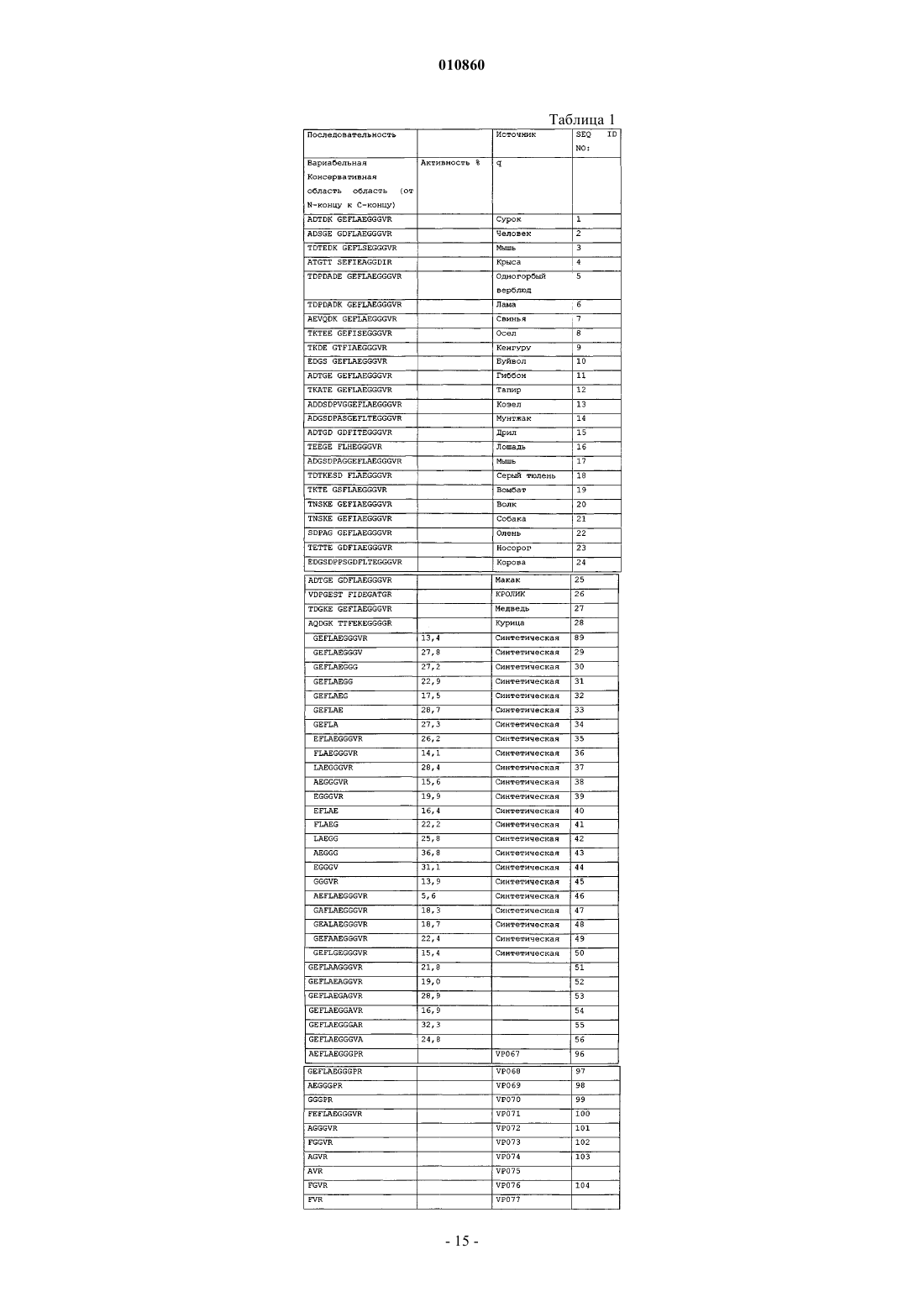
Антиинфарктные молекулы
Формула / Реферат
1. Фракция плазмы находящегося в состоянии гибернации животного, содержащая молекулу, где молекула обладает антиинфарктной активностью и где фракцию выделяют путем сбора крови животного через 1-25 дней после начала гибернации.
2. Фракция по п.1, где фракцию выделяют путем сбора крови животного через 10-20 дней после начала гибернации.
3. Фракция по п.1, где фракцию выделяют путем сбора крови животного через 14-16 дней после начала гибернации.
4. Фракция по п.1, где фракцию выделяют путем сбора крови животного через 15 дней после начала гибернации.
5. Фракция плазмы находящегося в состоянии гибернации животного, включающая молекулу, где молекула обладает антиинфарктной активностью, и где фракцию выделяют путем сбора крови первого животного, которое находится в ранней стадии гибернации, и где фракция не включает никакого количества крови второго животного, если второе животное находится в средней стадии гибернации.
6. Фракция плазмы находящегося в состоянии гибернации животного, включающая молекулу, где молекула обладает антиинфарктной активностью и где фракцию выделяют путем сбора крови животного за 1-25 дней до окончательного пробуждения животного.
7. Фракция по п.6, где фракцию выделяют путем сбора крови животного за 10-20 дней до окончательного пробуждения животного.
8. Фракция по п.6, где фракцию выделяют путем сбора крови животного за 14-16 дней до окончательного пробуждения животного.
9. Фракция по п.6, где фракцию выделяют путем сбора крови животного за 15 дней до окончательного пробуждения животного.
10. Фракция плазмы находящегося в состоянии гибернации животного, содержащая молекулу, где молекула обладает антиинфарктной активностью, и где фракцию выделяют путем сбора крови первого животного, которое находится в поздней стадии гибернации, и где фракция не включает никакого количества крови второго животного, если второе животное находится в средней стадии гибернации.
11. Способ по п.1, где антиинфарктная активность представляет собой церебральную антиинфарктную активность.
12. Способ по п.1, где антиинфарктная активность представляет собой кардиальную антиинфарктную активность.
13. Фракция плазмы находящегося в состоянии гибернации животного, содержащая молекулу, где молекула индуцирует рециркуляцию мочевины и где фракцию выделяют путем сбора крови животного через 1-25 дней после начала гибернации.
14. Фракция по п.13, где фракцию выделяют путем сбора крови животного через 10-20 дней после начала гибернации.
15. Фракция по п.13, где фракцию выделяют путем сбора крови животного через 14-16 дней после начала гибернации.
16. Фракция по п.13, где фракцию выделяют путем сбора крови животного через 15 дней после начала гибернации.
17. Фракция плазмы находящегося в состоянии гибернации животного, содержащая молекулу, где молекула индуцирует рециркуляцию мочевины, и где фракцию выделяют путем сбора крови первого животного, где первое животное находится в ранней стадии гибернации, и где фракция не включает никакого количества крови второго животного, если второе животное находится в средней стадии гибернации.
18. Фракция плазмы находящегося в состоянии гибернации животного, содержащая молекулу, где молекула индуцирует рециркуляцию мочевины и где фракцию выделяют путем сбора крови животного за 1-25 дней до окончательного пробуждения животного.
19. Фракция по п.18, где фракцию выделяют путем сбора крови животного за 10-20 дней до окончательного пробуждения животного.
20. Фракция по п.18, где фракцию выделяют путем сбора крови животного за 14-16 дней до окончательного пробуждения животного.
21. Фракция по п.18, где фракцию выделяют путем сбора крови животного за 15 дней до окончательного пробуждения животного.
22. Фракция плазмы находящегося в состоянии гибернации животного, содержащая молекулу, где молекула индуцирует рециркуляцию мочевины, и где фракцию выделяют путем сбора крови первого животного, где первое животное находится в поздней стадии гибернации, и где фракция не включает никакого количества крови второго животного, если второе животное находится в средней стадии гибернации.
23. Способ очистки молекулы, обладающей антиинфарктной активностью, включающий:
1) взятие образца у находящегося в состоянии гибернации животного,
2) взятие второго образца у находящегося в состоянии гибернации животного,
3) сравнение молекул образца со вторым образцом,
4) выделение молекулы образца, экспрессия которой отличается от экспрессии во втором образце,
5) исследование молекулы на антиинфарктную активность,
6) идентификацию молекулы с антиинфарктной активностью.
24. Способ очистки молекулы, обладающей антиинфарктной активностью, включающий:
1) взятие образца у находящегося в состоянии гибернации животного,
2) взятие второго образца у находящегося в состоянии гибернации животного в другом под-состоянии,
3) сравнение молекул образца со вторым образцом,
4) выделение молекулы образца, экспрессия которой отличается от экспрессии во втором образце,
5) исследование молекулы на антиинфарктную активность,
6) идентификацию молекулы с антиинфарктной активностью.
25. Способ очистки молекулы, обладающей антиинфарктной активностью, включающий:
1) взятие образца у находящегося в состоянии гибернации животного по состоянию на первое время,
2) взятие второго образца у находящегося в состоянии гибернации животного по состоянию на второе время, где первое время и второе время являются разными,
3) сравнение молекул образца со вторым образцом,
4) выделение молекулы образца, экспрессия которой отличается от экспрессии во втором образце,
5) исследование молекулы на антиинфарктную активность,
6) идентификацию молекулы с антиинфарктной активностью.
26. Способ очистки молекулы, обладающей антиинфарктной активностью, включающий:
1) взятие образца крови у находящегося в состоянии гибернации животного,
2) взятие второго образца крови у находящегося в состоянии гибернации животного,
3) сравнение молекул образца со вторым образцом,
4) выделение молекулы образца, экспрессия которой отличается от экспрессии во втором образце,
5) исследование молекулы на антиинфарктную активность,
6) идентификацию молекулы с антиинфарктной активностью.
27. Способ по пп.23-26, где стадия сравнения образца и второго образца включает анализ экспрессии генов в образце и втором образце.
28. Способ по пп.23-26, где стадия сравнения образца и второго образца включает анализ экспрессии белков в образце и втором образце.
29. Способ по пп.23-25, где образец и второй образец получают из крови, мочи, спинальной жидкости или цереброспинальной жидкости, тканей, органов, клеток.
30. Способ по п.26, где образец и второй образец получают из мочи, спинальной жидкости или цереброспинальной жидкости, тканей, органов, клеток.
31. Способ по пп.23-26, где животное представляет собой млекопитающее.
32. Способ по п.31, где млекопитающее является сусликом, медведем, сурком, скунсом или летучей мышью.
33. Способ по пп.23-26, где образец крови получают от животного, находящегося в ранней стадии гибернации или поздней стадии гибернации.
34. Способ по пп.23-26, где второй образец крови получают от животного, находящегося в средней стадии гибернации.
35. Способ по п.33, где второй образец крови получают от животного, находящегося в средней стадии гибернации.
36. Способ по пп.23-26, где образец крови получают от животного через 1-25 дней после начала гибернации.
37. Способ по пп.23-26, где второй образец крови получают от животного через 26-60 дней после начала гибернации.
38. Способ по п.36, где второй образец крови получают от животного через 26-60 дней после начала гибернации.
39. Способ по пп.23-26, где стадия сравнения включает идентификацию дифференциально регулируемых молекул, где дифференциально регулируемые молекулы присутствуют в образце в количестве, отличном от второго образца.
40. Способ по п.39, где идентификация дифференциально регулируемых молекул включает фракционирование образца и второго образца.
41. Способ по п.40, где фракционирование происходит путем отбора молекул с молекулярной массой 10 кДа или меньше.
42. Способ по п.40, где фракционирование включает стадию разделения молекул в образце крови и втором образце по заряду, гидрофобности, гидрофильности, липофильности, скрученности, молекулярной массе, по методу аффинной хроматографии белков, пептидов или углеводов или по растворимости.
43. Способ по п.42, где аффинное разделение включает использование affi-gel blue хроматографии.
44. Способ по п.39, где идентификация включает анализ образцов методами ГХ-масс-спектроскопии, гель-хроматографии, высокоэффективной жидкостной хроматографии, ГХ/MS/MS масс-спектроскопии.
45. Способ по п.44, где высокоэффективная жидкостная хроматография включает обращенно-фазовую хроматографию.
46. Способ по п.44, где гель-хроматография включает двумерный электрофорез на полиакриамидном геле.
47. Способ по п.39, где способ дополнительно включает очистку дифференциально регулируемых молекул с получением очищенной дифференциально регулируемой молекулы.
48. Способ по п.47, где способ дополнительно включает анализ антиинфарктной активности очищенной диференциально регулируемой молекулы.
49. Способ по п.48, где стадия анализа включает использование модели, вызванной MCAO церебральной ишемии у мыши.
50. Способ по п.48, где антиинфарктная активность представляет собой церебральную антиинфарктную активность.
51. Способ по п.48, где антиинфарктная активность представляет собой кардиальную антиинфарктную активность.
52. Способ уменьшения инфаркта у субъекта, включающий введение субъекту FPA.
53. Способ по п.52, где FPA включает структуру, имеющую по меньшей мере 20% идентичности с SEQ ID NO: 2, и где аминокислоты 8, 12 и 13 не изменяются.
54. Способ по п.53, где любое изменение по аминокислотам 7, 9 и 15 представляет собой консервативные замены.
55. Способ по п.52, где FPA включает структуру, имеющую по меньшей мере 70% идентичности с SEQ ID NO: 2.
56. Способ по п.55, где любое отклонение от SEQ ID NO: 2 представляет собой консервативную замену.
57. Способ по п.52, где FPA включает аминокислоты, имеющие по меньшей мере 40% идентичности с аминокислотами 6-16 SEQ ID NO: 2, и где аминокислоты 8, 12 и 13 не изменяются.
58. Способ по п.57, где любое отклонение от аминокислот 7, 9 и 15 представляет собой консервативные замены.
59. Способ по п.52, где FPA включает структуру, имеющую по меньшей мере 70% идентичности с аминокислотами 6-16 SEQ ID NO: 2.
60. Способ по п.59, где любое отклонение от SEQ ID NO: 2 представляет собой консервативную замену.
61. Способ по пп.52-60, где FPA уменьшает размер инфаркта, который присутствует в модели MCAO у мыши.
62. Способ по п.61, где инфаркт уменьшается по меньшей мере на 20%.
63. Способ по п.61, где инфаркт уменьшается по меньшей мере на 40%.
64. Способ по п.61, где инфаркт уменьшается по меньшей мере на 60%.
65. Способ по п.61, где инфаркт уменьшается по меньшей мере на 80%.
66. Способ по пп.52-60, где инфарктный коэффициент в модели MCAO у мыши составляет по меньшей мере 1,1.
67. Способ по пп.52-60, где инфарктный коэффициент в модели MCAO у мыши больше или равен 1,5.
68. Способ по пп.52-60, где инфарктный коэффициент в модели MCAO у мыши больше или равен 2.
69. Способ по п.68, где коэффициент определяют, используя средние объемы инфарктного поражения.
70. Способ по п.69, где средний объем инфаркта в модели MCAO у мыши меньше или равен 90%.
71. Способ по п.69, где средний объем инфаркта в модели MCAO у мыши меньше или равен 70%.
72. Способ по п.69, где средний объем инфаркта в модели MCAO у мыши меньше или равен 50%.
73. Способ по п.69, где средний объем инфаркта в модели MCAO у мыши меньше или равен 30%.
74. Способ уменьшения инфаркта у субъекта, включающий введение субъекту композиции, включающей пептидную последовательность, представленную в SEQ ID NO: 34, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 96-103, AVR или FVR.
75. Способ по п.52, где FPA имеет последовательность, представленную в SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51 или SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 89, SEQ ID NO: 96-103, AVR или FVR.
76. Способ по п.52, где FPA имеет последовательность, представленную в SEQ ID NO: 46, SEQ ID NO: 45, SEQ ID NO: 36, SEQ ID NO: 50, SEQ ID NO: 38, SEQ ID NO: 40 или SEQ ID NO: 54, SEQ ID NO: 32, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 52 или SEQ ID NO: 39.
77. Способ по п.52, где инфаркт представляет собой церебральный инфаркт.
78. Способ по п.52, где инфаркт представляет собой кардиальный инфаркт.
79. Способ уменьшения инфаркта у субъекта, включающий введение субъекту брадикинина.
80. Способ по п.79, где брадикинин включает структуру, имеющую по меньшей мере 60% идентичности с SEQ ID NO: 57.
81. Способ по п.80, где любое отклонение от SEQ ID NO: 57 представляет собой консервативные замены.
82. Способ по п.79, где брадикинин включает структуру, имеющую по меньшей мере 80% идентичности с SEQ ID NO: 83.
83. Способ по п.80, где любое отклонение от SEQ ID NO: 57 представляет собой консервативные замены.
84. Способ по п.79, где брадикинин не имеет основную аминокислоту на С-конце.
85. Способ по п.84, где основная аминокислота представляет собой Arg, Lys или His.
86. Способ по п.85, где брадикинин включает основную аминокислоту на N-конце.
87. Способ по п.86, где основная аминокислота представляет собой Arg, Lys или His.
88. Способ по п.79, где брадикинин включает основную аминокислоту на N-конце.
89. Способ по п.88, где основная аминокислота представляет собой Arg, Lys или His.
90. Способ по п.79, где брадикинин имеет последовательность, представленную в SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 75, SEQ ID NO: 77, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84 или SEQ ID NO: 85.
91. Способ по п.79, где брадикинин имеет последовательность, представленную в SEQ ID NO: 58, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 77 или SEQ ID NO: 81.
92. Способ по п.79, где брадикинин имеет последовательность, представленную в SEQ ID NO: 58.
93. Способ по п.79, где брадикинин имеет последовательность, представленную в SEQ ID NO: 61.
94. Способ по п.79, где инфаркт представляет собой церебральный инфаркт.
95. Способ по п.79, где инфаркт представляет собой кардиальный инфаркт.
96. Способ получения антиинфарктной молекулы, включающий синтезирование антиинфарктной молекулы или варианта антиинфарктной молекулы, где антиинфарктная молекула может быть очищена способом, включающим:
1) взятие образца крови у находящегося в состоянии гибернации животного,
2) взятие второго образца крови у находящегося в состоянии гибернации животного,
3) сравнение молекул образца со вторым образцом,
4) выделение молекулы образца, экспрессия которой отличается от экспрессии во втором образце,
5) исследование молекулы на антиинфарктную активность,
6) идентификацию молекулы с антиинфарктной активностью, где образец крови берут в период, составляющий меньше чем или равный 25 дней после начала гибернаци, а второй образец крови берут в период, составляющий больше чхь 25 дней после начала гибернации, и где антиинфарктная молекула присутствует в больших количествах в образце крови по сравнению со вторым образцом крови.
97. Способ получения антиинфарктной молекулы, включающий синтезирование антиинфарктной молекулы или варианта антиинфарктной молекулы, где антиинфарктная молекула может быть очищена способом, включающим:
1) взятие образца крови у находящегося в состоянии гибернации животного,
2) взятие второго образца крови у находящегося в состоянии гибернации животного,
3) сравнение молекул образца со вторым образцом,
4) выделение молекулы образца, экспрессия которой отличается от экспрессии во втором образце,
5) исследование молекулы на антиинфарктную активность,
6) идентификацию молекулы с антиинфарктной активностью, где образец крови берут в период, составляющий меньше чем или равный 25 дней до окончания гибернации, а второй образец крови берут в период, составляющий больше чем 25 дней после начала гибернации, но больше чем за 25 дней до окончания гибернации, и где антиинфарктная молекула присутствует в больших количествах в образце крови по сравнению со вторым образцом крови.
98. Способ идентификации антиинфарктной молекулы, включающий введение молекулы в модели MCAO у мыши, сравнение антиинфарктной активности молекулы с антиинфарктой активностью FPA в модели MCAO у мыши и отбор молекулы, если антиинфарктная активность молекулы составляет по меньшей мере 20% от активности FPA.
99. Способ уменьшения инфаркта у субъекта, нуждающегося в уменьшении инфаркта, включающий введение субъекту эффективного количества антагониста рецептора типа 2 ангиотензина II в фармацевтически приемлемой форме.
100. Способ по п.99, где инфаркт связан с инсультом.
101. Способ по п.99, где инфаркт связан с ишемией сердца.
102. Способ по п.99, где антагонист рецептора типа 2 ангиотензина II представляет собой брадикинин.
103. Способ по п.102, где брадикинин включает структуру, имеющую 60% идентичности с SEQ ID NO: 57.
104. Способ по п.103, где любое отклонение от SEQ ID NO: 57 представляет собой консервативные замены.
105. Способ по п.102, где брадикинин включает структуру, имеющую 80% идентичности с SEQ ID NO: 83.
106. Способ по п.105, где любое отклонение от SEQ ID NO: 57 представляет собой консервативные замены.
107. Способ по п.102, где брадикинин не имеет основную аминокислоту на С-конце.
108. Способ по п.107, где основная аминокислота представляет собой Arg, Lys или His.
109. Способ по п.108, где брадикинин включает основную аминокислоту на N-конце.
110. Способ по п.109, где основная аминокислота представляет собой Arg, Lys или His.
111. Способ по п.102, где брадикинин включает основную аминокислоту на N-конце.
112. Способ по п.111, где основная аминокислота представляет собой Arg, Lys или His.
113. Способ по п.102, где брадикинин имеет последовательность, представленную в SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 75, SEQ ID NO: 77, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84 или SEQ ID NO: 85.
114. Способ по п.102, где брадикинин имеет последовательность, представленную в SEQ ID NO: 58, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 77 или SEQ ID NO: 81.
115. Способ по п.102, где брадикинин имеет последовательность, представленную в SEQ ID NO: 58.
116. Способ по п.102, где брадикинин имеет последовательность, представленную в SEQ ID NO: 61.
117. Способ по п.102, где инфаркт связан с инсультом.
118. Способ идентификации ингибитора взаимодействия между брадикинином и рецептором типа 2 ангиотензина II, включающий контактирование клетки, экспрессирующей рецептор типа 2 ангиотензина II, с предполагаемым ингибитором в присутствии брадикинина; определение количества брадикинина, связавшегося с рецептором типа 2 ангиотензина II; где снижение связывания брадикинина с рецептором типа 2 ангиотензина II указывает на присутствие ингибитора.
119. Способ идентификации ингибитора взаимодействия между брадикинином и рецептором типа 2 ангиотензина II, включающий контактирование клетки, экспрессирующей рецептор типа 2 ангиотензина II, с предполагаемым ингибитором в присутствии брадикинина, где рецептор типа 2 ангиотензина II включает донор флуоресценции, где брадикинин включает акцептор флуоресценции; и измерение передачи энергии методом резонанса флуоресценции (FRET), где уменьшение FRET в сравнении с полученным значением FRET в клетке, которая не контактировала с предполагаемым ингибитором, указывает на присутствие ингибитора.
120. Способ идентификации ингибитора взаимодействия между брадикинином и рецептором типа 2 ангиотензина II, включающий контактирование клеточной системы с предполагаемым ингибитором, где клеточная система включает рецептор типа 2 ангиотензина II, где клеточная система включает брадикинин, где рецептор типа 2 ангиотензина II включает донор флуоресценции и где брадикинин включает акцептор флуоресценции; и измерение передачи энергии методом резонанса флуоресценции (FRET) до контактирования клеточной системы с предполагаемым ингибитором и после контактирования клеточной системы с предполагаемым ингибитором, где уменьшение FRET в клеточной системе, когда предполагаемый ингибитор находится в контакте с предполагаемым ингибитором, указывает на присутствие ингибитора.
121. Способ по пп.118-120, дополнительно включающий стадию испытания идентифицированного ингибитора в модели инфаркта in vivo и отбор молекул, которые уменьшают инфаркт в модели животного.
122. Способ по пп.118-120, где предполагаемый ингибитор обнаружен в библиотеке молекул.
Текст
010860 Настоящая заявка заявляет приоритет согласно предварительной заявке США 60/354,678, поданной 6 февраля 2002 года, предварительной заявке США 60/392,133, поданной 28 июня 2002 года, и предварительной заявке США 60/429,278, поданной 25 ноября 2002 года. Предварительные заявки 60/354,678, 60/392,133 и 60/429,278 все включены в настоящую заявку посредством ссылки во всей их полноте. Предпосылки изобретения Многие небольшие и среднего размера млекопитающие, обитающие в холодных регионах, вступают в длительное и контролируемое состояние спячки (гибернации) в течение зимних месяцев, когда пища становится менее доступной. Действительные гибернаторы, такие как суслики, лесные сурки и мыши,готовятся к зимней спячке, накапливая большие количества жира в организме. Некоторые, такие как лесные сурки, также откладывают запасы пищи в своих норах. Когда животные впадают в гибернацию, у них происходят физиологические изменения. Снижается частота сердечных сокращений, происходят изменения метаболизма, и изменяется их способность к пробуждению. В настоящей заявке раскрываются способы оценки состояния гибернации у млекопитающего в различное время в период гибернации. Настоящая заявка также раскрывает, что впадающие в зимнюю спячку животные могут пережить события пробуждения, скорее, в начале периода гибернации и в конце периода гибернации, чем в середине периода гибернации. Кроме того, раскрывается, что фракции плазмы,полученные от животных, находящихся в раннем состоянии гибернации, но не от животных, находящихся в среднем состоянии гибернации, содержат молекулы, оказывающие действие на ишемию в модели крыс и которые можно использовать для лечения ишемии. Кроме того, в данной заявке показано, что такие молекулы включают FPA и его производные, а также брадикинин и его производные. Краткое описание изобретения Раскрываются композиции и способы, которые в одном отношении относятся к зависящим от состояния способам определения интересующих молекул. Также раскрываются композиции и способы,которые в одном отношении относятся к молекулам, обладающим антиинфарктными и антиишемическими свойствами. Следует понимать, что как приведенное выше общее описание, так и следующее далее подробное описание приводятся только в качестве примера и иллюстрации и не являются ограничением настоящего изобретения в том виде, как оно заявлено. Краткое описание фигур Прилагаемые фигуры, которые включены в данное описание и являются его частью, иллюстрируют некоторые варианты воплощения изобретения и вместе с описанием изобретения служат для объяснения его принципов. Фиг. 1 показывает эффект пробуждения в ранний и поздний периоды гибернации на динамику сердечных сокращений и смертность у взрослых и молодых особей лесных сурков. Животных будили в середине декабря и в середине января путем вытягивания за лапы в течение 8 мин, пока животное не оказывалось на спине. Такой стимул в середине января приводил к сильной брадикардии и полному пробуждению, связанными с гибелью в течение 6-12 ч 4 из 4 особей. Стимул в середине декабря не приводил к пробуждению, брадикардии или гибели. На фиг. 2 представлена идентификация зависящих от состояния белков в D2- и NE2-фракциях, как было выявлено в 2-мерных SDS-гелях. Два верхних блока показывают белки в состоянии 1 (NE2) и в состоянии 2 (D2, 02) с наложением сверху состояния 1 (правый верхний блок). При наложении только очень светлый эпицентр показан для каждого пятна состояния 1, оставляя его окружение, как это видно на схеме, от серого до белого. Увеличение, показанное в нижнем левом блоке, показывает сравнение при наложении состояния 1 на состояние 2 в области 32 кДа (очерченной), а увеличение, представленное в нижнем правом блоке, показывает такое же сравнение в области 66 кДа (очерчено). Эти пятна состояния 2 без соответствующего наложенного пятна являются, таким образом, опосредованными состоянием 2(наклонные пунктирные маркеры). Один из эффектов таких зависящих от состояния белков можно видеть на моделях инсульта, представленных на фиг. 1. Диапазон pI составил 4-7. На фиг. 3 показана идентификация пятен методом ЖХ/MS/MS, при этом представляющие интерес пятна (обведены кружочком) являются специфическими либо для материала состояния 1 (NE2), либо для материала состояния 2 (D2). Представляющие интерес пятна расположены на 2-мерных BATSгелях. BATS-гели являются менее чувствительными и количественными, чем 2DSDS-гели (предыдущая фигура), поскольку только 9 зависящих от состояния пятен было обнаружено при диапазоне pI 4-7 (пара слева - 4, а пара справа - 7). Фиг. 4 показывает D2-специфическую молекулу, предотвращающую инсульт. Сравнения методомBATS полос D2 с полосами SA (контроль) и NE2 (его ближайший контроль) показывают три D2-специфические молекулы (обведены кружочком). Три верхних среза показывают объем инфаркта в модели МСАО у мыши. Только ткань с функционирующими митохондриями принимала красное (темное) окрашивание ТТС (2%). На фиг. 5 показано полученное при помощи компьютера сравнение 2D-гелей, представляющих разные состояния. D2-гель сравнивали с его ближайшим контролем NE2. Гели, содержащие CSF и мочу (ги-1 010860 бернация), сравнивали с их полученными летом контролями. Каждую из 3 пар гелей подвергали компьютерной обработке для пространственного выравнивания пятен. Плотность серебряных вкраплений каждого пятна нормализовали к его собственному гелю для компенсации разницы концентраций в объемах жидкости (т.е. общее количество белка в каждом геле считалось постоянным). Затем подсчитывали разницу между каждой парой пятен. Пятна, содержащие более чем двукратное увеличение состояния 2(гибернация), показаны в зеленом цвете. Те незначительные увеличения плотности пятен состояния 2,которые относили за счет разницы концентраций, не компенсированной процедурой нормализации, показаны сплошным темным цветом. Те пятна, которые показывают двукратное или более сильное уменьшение состояния 2, показаны как светлые пятна. Пятна, не претерпевшие изменения между этими двумя состояниями, очерчены темным. Фиг. 6 показывает эффект времени введения инъекции D2 на размер церебрального инфаркта в модели окклюзии среднемозговой артерии у мыши. В результате предварительной обработки D2 за 2 ч до 1-часовой окклюзии среднемозговой артерии получали минимальный размер инфаркта (вертикальные линии - SD). Прогрессивно более удаленное время инъекций приводило к прогрессивно увеличивающимся размерам инфаркта, но эффект был нелинейным. Обработка D2 методом диализа в 8 М-мочевине для вытеснения белка из альбуминового носителя и с мембранной отсечкой 10 кДа для удаления пептидов обеспечивала значительно более высокий эффект на размер инфаркта при инъекции через 1 ч. Фиг. 7 показывает фингерпринтинг ("отпечатки пальцев") полипептидов ниже 10 кДа, полученный методом ЖХ/MS/MS. Было обнаружено, что 8 молекул в ряду пептидов изменились в процессе ранней стадии гибернации (D2) по сравнению с поздней стадией гибернации (NE). Один из них был идентифицирован как фибринопептид А. Из восьми два пептида являются более распространенными в поздней стадии гибернации (1310 и 2011). Фиг. 8 показывает результаты для пептида: масса 1620,9 Да. Фиг. 9 показывает результаты для пептида: масса 904,4 Да. Фиг. 10 показывает результаты для пептида: масса 904,4 Да. Фиг. 11 показывает результаты для пептида: масса 904,4 Да - RPPGFSPF. Фиг. 12 показывает средние значения и стандартные отклонения для групп обработки FPA-h и другими молекулярными фракциями. Фиг. 13 показывает эффект скорости рециркуляции мочевины в крови у крыс, которая обеспечивается в/в инъекциями D2 или D01 (20 мг/кг) или альбуминового контроля (Xeno, 20 мг/кг). Каждому животному вводили во время ноль 1 мг мочевины с двойной меткой (меньше чем 1% от общего количества мочевины). Присутствие мочевины с одной меткой на уровне, превышающем естественный фон, можно объяснить только отщеплением 2 меченых атомов азота и их обратной рециркуляцией с образованием дополнительной однократно меченной мочевины. Ось у показывает для каждой крысы, в каком количестве однократно меченная мочевина относительно немеченой мочевины (% мольной фракции) в течение времени присутствует выше базовой линии естественной однократно меченной мочевины (избыток). На время 3-6 ч после инъекции средняя разница между группой D2 и D01 и группой альбумина была статистически значимой (Р 0,025). Никакая инъекция не вызывала какого-либо изменения среднего артериального давления. Фиг. 14 показывает эффект С-концевых фрагментов FPAw на объемы инфаркта у мыши после временной ишемии. Всех мышей подвергали 1-часовой церебральной ишемии с последующей 24-часовой реперфузией. Животным вводили следующие инъекции: ничего, носитель (физиологический раствор) или С-концевые фрагменты FPAw (в дозе 10 мг/кг) внутривенно по окончании ишемии. Животных умерщвляли на второй день и обрабатывали для определения объема инфаркта, р 0,02 для С-концевого фрагмента (I) и С-концевого фрагмента (L) по сравнению с отсутствием введения, р 0,004 для С-концевого фрагмента (I) по сравнению с физиологическим раствором и р 0,003 для С-концевого фрагмента (L) по сравнению с физиологическим раствором. Фиг. 15 показывает эффект С-концевых фрагментов FPAw на объемы инфаркта у мыши после временной ишемии. Всех мышей подвергали 1-часовой церебральной ишемии с последующей 24-часовой реперфузией. Животным вводили следующие инъекции: ничего, носитель (физиологический раствор) или С-концевые фрагменты FPAw (в дозе 10 мг/кг) внутривенно по окончании ишемии. Животных умерщвляли на второй день и обрабатывали для определения объема инфаркта. Объем инфаркта указан в мм 3. Фиг. 16 показывает эффект FPA на объемы инфаркта у мыши после временной ишемии. Всех мышей подвергали 1-часовой церебральной ишемии с последующей 24-часовой реперфузией. Животным вводили носитель (физиологический раствор) или FPA (0,625; 2,5 и 10 мг/кг) внутривенно по окончании ишемии. Животных умерщвляли на второй день и обрабатывали для определения объема инфаркта,р 0,0001 для всех значений по сравнению с контролем, за исключением FPA 10, р 0,0047. Фиг. 17 показывает эффект D2 на объемы инфаркта у мыши до и после временной ишемии. Всех мышей подвергали 1-часовой церебральной ишемии с последующей 24-часовой реперфузией. Животным вводили носитель (физиологический раствор) или D2 (в дозе 5 мг/кг) внутривенно до или по окончании ишемии. Животных умерщвляли на второй день и обрабатывали для определения объема инфаркта. Индивидуальные объемы инфаркта для каждого животного. Объемы инфаркта указаны в мм 3.-2 010860 Фиг. 18 показывает формулу для цикло[(N1-L-лизин, 6-глицин)брадикинина], циклического варианта брадикинина, где аргинин на N-концевом участке брадикинина замещен L-лизином, а серин в положении 6 брадикинина замещен глицином. Замыкание цикла осуществляется через пептидную связь,образованную карбонильной группой аргинина и -аминогруппой лизина. Подробное описание изобретения Перед тем, как приступить к описанию соединений, композиций, изделий, устройств и/или способов, которые раскрываются и описываются в настоящей заявке, следует указать, что композиции и способы не ограничиваются конкретными способами синтеза или конкретными рекомбинантными биотехнологическими способами, если не указано иное, или конкретными реагентами, если не указано иное, и,безусловно, могут меняться. Также следует понимать, что используемая в данном описании терминология предназначена только для целей описания конкретных вариантов воплощения изобретения и не предназначена для его ограничения.A. Определения. Аббревиатуры: МСАО - окклюзия среднемозговой артерии; ТТС - хлорид трифенилтетразолия; I.V. внутривенный (в/в); FPAw - последовательность фибринопептида А сурка; С-конец (I) - С-концевой фрагмент FPA, где в положении 4 находится изолейцин; и С-конец (L) - С-концевой фрагмент FPA, где в положении 4 находится лейцин. Как это используется в настоящем описании и прилагаемой формуле изобретения, формы единственного числа включают также и формы множественного числа, если только из контекста не следует иное. Так, например, термин "фармацевтический носитель" включает смеси двух или более таких носителей и т.п. Указанные в данном описании пределы могут быть выражены как от "приблизительно" одного конкретного значения и/или до "приблизительно" другого конкретного значения. Когда указаны такие пределы, другой вариант осуществления изобретения включает от одного конкретного значения и/или до другого конкретного значения. Подобным образом, когда значения указаны как приблизительные при помощи предшествующего значению слова "приблизительно", следует понимать, что конкретное значение представляет собой другой вариант воплощения изобретения. Также следует понимать, что конечные точки каждого из указанных пределов являются важными как по отношению к другой конечной точке,так и независимо от другой конечной точки. Следует также понимать, что в данном описании раскрывается большое количество значений и что каждое значение также раскрывается как "приблизительное" этого конкретного значения в дополнение к такому значению как таковому. Например, если раскрывается значение "10", тогда также раскрывается значение "приблизительно 10". Также специалистам должно быть понятно, что также раскрываются значения "меньше чем или равное", "больше чем или равное значению" и возможные пределы между значениями. Например, если раскрывается значение "10", также раскрываются значения "меньше чем или равно 10", а также "больше чем или равно 10". Также следует понимать, что повсеместно в материалах настоящей заявки представлены данные в различных форматах и что эти данные представляют конечные точки, и исходные точки, и пределы для любой комбинации указанных значений. Например, если раскрывается конкретное значение "10" и конкретное значение 15,должно быть понятно, что значения, большие чем, большие чем или равные, меньшие чем, меньшие чем или равные, и равные 10 и 15 должны также считаться как раскрытые между 10 и 15. Во всех разделах текста данной заявки имеются ссылки на различные публикации. Раскрытие этих публикаций во всей их полноте включено в настоящую заявку посредством ссылки для более полного описания известного уровня техники. Указанные в них ссылки также индивидуально и конкретно включены в настоящую заявку посредством ссылки для описания содержащегося в них материала, обсуждаемого в предложении, в котором есть указание на эту ссылку. Раскрываются компоненты, предназначенные для использования в получении раскрываемых композиций, а также сами композиции, предназначенные для использования в способах, раскрываемых в настоящей заявке. Эти и другие материалы раскрываются в настоящей заявке, и следует понимать, что когда раскрываются комбинации, подгруппы, взаимодействия, группы и т.д. этих веществ, то, хотя конкретная ссылка на каждое из различных отдельных таких соединений и их комбинаций и перестановок не может быть полно раскрыта, в данной заявке конкретно подразумевается и описывается каждое из вышеперечисленного. Например, если раскрывается и обсуждается конкретный FPA и обсуждаются различные модификации, которые могут осуществляться в применении к различным молекулам, включаяFPA, конкретно подразумеваются каждая комбинация и перестановка FPA, а также возможные модификации, если конкретно не указано иное. Так, если раскрывается класс молекул А, В и С, а также класс молекул D, Е и F и пример комбинации молекул A-D, тогда, даже если не указано отдельно, каждое из индивидуальных и совместно рассматриваемых значений комбинаций А-Е, A-F, B-D, B-E, B-F, С-D, С-Е и C-F считается как раскрытое в данной заявке. Подобным образом, также является раскрытым любой подвид этих комбинаций. Так, например, подгруппы А-Е, B-F и С-Е должны считаться раскрытыми. Это относится ко всем аспектам настоящей заявки, включая, но не ограничиваясь этим, стадии способов получения и применения раскрываемых композиций. Так, в случае различных дополнительных стадий, ко-3 010860 торые могут быть осуществлены, должно быть понятно, что каждую из таких дополнительных стадий можно осуществить любым из конкретных вариантов осуществления или комбинацией вариантов осуществления раскрываемых способов."Необязательный" или "необязательно" означает, что описываемое далее событие или обстоятельство может иметь, а может и не иметь место и что описание включает случаи, когда указанное событие или обстоятельство имеет место и когда оно не имеет места."Праймеры" представляют собой подвид зондов, способных поддерживать определенный тип ферментативной манипуляции и которые могут гибридизоваться с являющейся мишенью нуклеиновой кислотой таким образом, что может произойти ферментативная манипуляция. Праймер может быть получен из любой комбинации нуклеотидов, или производных нуклеотидов, или известных из уровня техники аналогов, не вмешивающихся в ферментативную манипуляцию."Зонды" представляют собой молекулы, способные взаимодействовать с являющейся мишенью нуклеиновой кислотой, как правило, последовательность-специфическим образом, например через гибридизацию. Гибридизация нуклеиновых кислот хорошо известна из уровня техники и обсуждается в данном описании. Обычно зонд может быть получен из любой комбинации нуклеотидов, или производных нуклеотидов, или известных из уровня техники аналогов.B. Композиции и способы. Раскрываются композиции и способы, имеющие отношение к ишемии, такой как ишемия сердца и церебральная ишемия. Раскрываются композиции и способы, уменьшающие инфаркт, который может произойти в результате ишемических событий. Каждый год происходит 600000 новых или повторных инсультов, в 1995 году это явилось причиной 157991 смерти (1 из каждых 14,6 смертей). В настоящее время 4000000 человек пережили инсульт, и это число продолжает увеличиваться. Начало инсультов в 80% случаев является ишемическим и в 20% случаев - геморрагическим. Инсульт является третьей наиболее распространенной причиной смертности и основной причиной потери трудоспособности в США. Последствия и размер инфаркта после очаговой церебральной ишемии определяют как по "некротической" (параптоз) гибели клеток, так и по более поздней потере нервных клеток в пограничной зоне ишемии (запрограммированная гибель клеток, или апоптоз). Недавно появились терапевтические методы лечения ишемического инсульта, однако, такие методы не являются достаточными. Раскрываются зависящие от состояния способы выделения желаемых соединений. Также раскрываются зависящие от состояния способы выделения соединений, обладающих антиинфарктными свойствами. Антиинфарктные молекулы были идентифицированы в крови находящихся в состоянии гибернации животных и были выделены и описаны в настоящей заявке. Из раскрываемого в данном описании должно быть понятно, что высокая смертность животных в первый год гибернации связана с молекулами, обладающими антиинфарктными свойствами. У животных первого года гибернации наблюдается высокая смертность, до 77%, по данным полевых исследований сурков (Noonan, R. Groundhog Mortality. Wildlife Control Technology. (Sept.): 1-2, 2000.www.wctech.com/hbt.htm, 2000). До 77% смертности у молодых особей, 30% у взрослых особей (данные,полученные в природе, путем мечения и повторной поимки). Согласно сообщениям показатель смертности у взрослых особей, определенный методами мечения и повторной поимки, составил около 30%. Более молодые животные залегают на зимовку позднее, пробуждаются позднее, и такие молодые особи с меньшим весом тела имеют меньше вероятности для выживания. Часто считают, что опосредующим фактором здесь являются недостаточные запасы бурого жира (голодание), но аутопсия постоянно показывает достаточное количество жира у этих молодых жертв. 1. Подсостояния гибернации. Когда млекопитающие впадают в зимнюю спячку, происходит ряд физиологических изменений, которые должны иметь место как в начале гибернации, как описано в данной заявке, так и постоянно в процессе гибернации. Например, частота сердечных сокращений в период гибернации у животных должна снижаться, а также многие другие функции обмена веществ, включая репликацию клеток. Кроме того, должен измениться цикл мочевины для предотвращения вызываемой мочевиной токсичности у животного. Так, существуют относительные различия между млекопитающими в состоянии гибернации по сравнению с млекопитающими, не находящимися в состоянии гибернации. В настоящей заявке раскрываются также различия в самом состоянии гибернации у млекопитающих в период гибернации. Раскрываются способы оценки молекулярного различия между состояниями гибернации, а не только между состоянием гибернации и состоянием негибернации. Например, существуют физиологические различия и молекулярные различия между млекопитающими, находящимися в ранней стадии гибернации, по сравнению с поздней стадией. Состояние (или подсостояния) гибернации может характеризоваться, например, физиологией, эндокринной секрецией или поведением. Примером физиологии является то, что частота сердечных сокращений ниже нормальных физиологических пределов; примером эндокринной секреции является относительное повышение фибринопептида-А в кровообращении; примером поведения является полная активизация при пробуждении из состояния спячки с или без неожиданной смерти. Можно определить, что начало гибернации происходит, когда имеет место снижение нормального сердечно-сосудистого состояния у животного. Такое снижение может представлять собой, например,-4 010860 точку, в которой частота сердечных сокращений животного составляет 80% или меньше от нормальной частоты сердечных сокращений в состоянии покоя. В некоторых вариантах воплощения изобретения гибернация начиналась, когда наблюдается статистически значимая разница между частотой сердечных сокращений в состоянии покоя и пониженной частотой, в сопоставлении со снижением, вызванным, например, сном. Значение р 0,05 считается значимым. При наступлении гибернации температура животного обычно также снижается и животное свертывается в клубок. Конечное пробуждение характеризуется как состояние, которое следует за гибернацией, когда животное остается пробужденным и не возвращается в позднюю стадию гибернации. Конечное пробуждение также можно определить как время, когда частота сердечных сокращений находящегося в гибернации животного увеличивается до нормальной для этого животного частоты сердечных сокращений после того, как животное находилось в состоянии гибернации. Обычно в природе животные начинают покидать свое убежище и начинают искать пищу в момент конечного пробуждения. Следует понимать, что наступление гибернации определяет точку, с которой различные животные могут быть нормализованы. Раскрывается, что существует различие между фракциями плазмы крови,взятой в различные периоды гибернации у животного, находящегося в состоянии гибернации. Раскрываются подсостояния, полученные на 1-100 дни после наступления гибернации. Раскрываются подсостояния, полученные на 1-100 дни до конечного пробуждения. Должно быть понятно, что 1 день после наступления гибернации можно считать подсостоянием гибернации, отличным от того, которое наблюдается через 5 дней после наступления гибернации, которое может быть подсостоянием, отличным от наблюдаемого, например, за 1 день до конечного пробуждения. Также должно быть понятно, что подсостояния, включающие ряд дней после наступления гибернации, также раскрываются в данном описании. Например, период с 1 по 5 день после гибернации может представлять собой подсостояние, отличное от наблюдаемого в период с 20 по 25 дни. Например, подсостояния с повышенным содержанием антиинфарктных молекул представляют собой подсостояния, включающие 1-30 дни, или 4-25 дни, или 10-20 дни,или 13-18 дни после наступления гибернации, и подсостояния с пониженным содержанием антиинфарктных молекул представляют собой подсостояния, включающие 30-60 дни, или 35-55 дни, или 40-50 дни, или 43-48 дни после наступления гибернации. Также раскрываются подсостояния, наблюдаемые через каждые 14 дней после наступления гибернации или через каждые 14 дней после взятия первого образца, например дни 1, 14, 28, 42, 56, 70, 84, 98, и/или 112, или дни 10, 24, 38, 52, 66, 80, 94, 108, и/или 122. Другие раскрываемые подсостояния представляют собой время 1 с, 1 мин, 1 ч, 1 день, 1 неделя, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после наступления гибернации. Раннюю стадию гибернации можно определить как время после наступления гибернации, но до средней стадии гибернации. Среднюю стадию гибернации можно определить как время после ранней стадии гибернации и до поздней стадии гибернации. Позднюю стадию гибернации можно определить как время после средней стадии гибернации до конечного пробуждения. Ранняя стадия гибернации может быть ассоциирована с состоянием, в котором у пробудившегося от гибернации животного наблюдается пониженное количество случаев брадикардии и смертей (типично, отсутствие смертей). Ранняя стадия гибернации также ассоциируется с повышенной секрецией FPA и брадикинина (по сравнению со средней стадией гибернации). Например, ранняя стадия гибернации обычно представляет собой время, когда сердечно-сосудистая динамика достигает низкой точки (например, частота сердечных сокращений снижается примерно до 4 с на одно биение) и температура тела снижается примерно до 35-40 С. Кроме того, в настоящем описании раскрывается, что на ранней стадии гибернации в кровотоке присутствуют молекулы, которые, помимо прочего, защищают животное от ишемии и индуцируют рециркуляцию мочевины. Средняя стадия гибернации может быть ассоциирована с состоянием, в котором у пробудившегося от гибернации животного наблюдается повышенное количество случаев брадикардии и смертей. Средняя стадия гибернации также ассоциируется с пониженной секрецией FPA и брадикинина (по сравнению с ранней стадией гибернации). Поскольку оба подсостояния соотносятся во времени и возникают относительно друг друга и относительно начала и завершения гибернации, дата также может ассоциироваться с общим термином "средняя стадия гибернации". Как показано в настоящей заявке, средняя стадия гибернации обычно ассоциируется с находящимся в гибернации животным, сохраняющим энергию путем снижения количества молекул в системе кровообращения, включая те молекулы, которые защищают животное от ишемии. Весьма вероятно, что существуют другие регуляторные молекулы, секреция которых также прекращается. Позднюю стадию гибернации можно наблюдать как состояние, при котором повышается количество антиинфарктных молекул, включая FPA и брадикинин, по отношению к количеству антиинфарктных молекул в течение средней стадии гибернации, и это количество сходно с количеством на ранней стадии гибернации. Должно быть понятно, что разные стадии гибернации, например ранняя, средняя и поздняя,не перекрываются в течение конкретного года или цикла гибернации конкретного животного, но они могут перекрываться в сопоставлении по годам. Например, в некоторые годы гибернация может быть очень короткой, например ранний период гибернации может завершиться в начале декабря, а в другие годы гибернация может быть долгой, например ранняя стадия гибернации может заканчиваться в конце-5 010860 декабря. Например, раннюю стадию гибернации можно рассматривать как 1515 дни после начала; среднюю стадию как 4515 дни после начала и позднюю стадию как 6030 дни после начала. Разные подсостояния также можно определить как количество дней до наступления гибернации. Раскрываются 1-75 дни до наступления гибернации. Например, обычно подавляется аппетит, и это начинается у некоторых животных в дикой природе даже с первой недели октября, но, в основном, наблюдается у всех диких животных в течение нескольких недель в середине-конце ноября до начала периода гибернации. Как было показано, это подсостояние не связано с повышением уровней фибринопептида-А или вызванной пробуждением брадикардией. Также рециркулярующие мочевину молекулы секретируются на ранней стадии гибернации, и они обычно присутствуют в течение 1-21 дня после наступления гибернации, но они не могут секретироваться при отключении метаболизма и при отсутствии образования мочевины. Таким образом, гибернацию рассматривают как набор различных физиологических, химических и поведенческих подсостояний, которые временно проявляются как перекрывающиеся и неперекрывающиеся подпериоды. В основном, рассматривая физиологические и поведенческие события, которые возникают либо самопроизвольно, либо вызваны экспериментальными средствами и которые имеют место в разное время в течение периода гибернации, например такие, как вызванная пробуждением смерть, в данной заявке раскрывают, что для молекул плазмы можно описать различные состояния, такие как секреторные состояния. После описания различных состояний, например, путем указания времени после наступления гибернации или, например, путем оценки физиологического состояния для каждого описанного состояния могут быть получены образцы плазмы или других тканей, таких как мышечная или нервная ткань, двух различных состояний, например ранней стадии гибернации и средней стадии гибернации. Эти образцы тканей затем можно сравнивать при помощи таких методов, как ГХ масс-спектрометрия, фракционирование или гель-хроматография. Различие молекулярного состава образцов тканей затем можно оценить на различную активность, связанную с гибернацией, или с другими физиологическими характеристиками. Молекула, представляющая собой отличие, может быть затем, например, дополнительно очищена или получена синтетическим путем или дополнительно охарактеризована. В данной заявке раскрывается, что животные, впадающие в зимнюю спячку, такие как сурки, претерпевают сильный сердечно-сосудистый стресс при пробуждении от спячки. Однако животные, впадающие в зимнюю спячку, способны лучше справиться с этим стрессом на ранней и поздней стадиях гибернации, например, соответственно, в 1-30 дни и 60-90 дни после наступления гибернации, чем на средней стадии гибернации, например в 31-59 дни после наступления гибернации. При помощи раскрываемых в данной заявке способов были обнаружены молекулы, которые присутствуют на ранней и поздней стадиях гибернации в плазме животных, таких как сурки, способные помогать впадающим в зимнюю спячку животным, таким как сурки, а также другим животным преодолеть стресс, вызванный пробуждением от состояния гибернации. Такие молекулы присутствуют в меньших количествах на средней стадии гибернации. Две такие молекулы представляют собой FPA и его производные, и брадикинин и его производные, и функциональные варианты каждой из таких молекул. Также раскрывается, что эти молекулы способны снижать инфаркт при введении животным, у которых произошла окклюзия артерии. Раскрываемые композиции, таким образом, можно вводить субъекту, перенесшему событие, которое влечет за собой инфаркт, такое как "инсульт" (удар) или "сердечный приступ". Раскрываются способы выделения белков и пептидов при сравнении "зависящих от состояния" фракций молекул, собранных у животных, находящихся в состоянии гибернации. Эти небольшие, зависящие от состояния отличия в физиологии используют для сбора отдельных фракций молекул, которые при исследовании методами, используемыми в протеомике (например, методом двумерного гель-электрофореза в SDS-ПААГ, объединенным методом масс-спектроскопии ЖХ/MS/MS и т.д.), привели как к выделению, так и к идентификации соответствующей молекулы, лежащей в основе главного эффекта в той или другой модели специфического биоанализа, которые можно соотнести с физиологией и моделями гибернации. Раскрываются модели, где модель представляет собой модель инсульта, такую как модель грызуна,в которой после окклюзии среднемозговой артерии в течение 1 ч восстанавливают кровоток и позже исследуют размер инфаркта с использованием окрашивания оставшейся жизнеспособной ткани хлоридом трифенилтетразолия (ТТС, 1%). Варианты такой модели инсульта включают частичную или долговременную окклюзию любой церебральной артерии и любой вид млекопитающих, хотя модели грызунов являются наиболее типичными для сохранения испытываемых материалов. В этой модели были испытаны многие соединения различного назначения (например, те или другие виды ингибиторов рецепторов глутамата, ингибиторов фактора некроза опухоли и т.д.). В настоящей заявке раскрывается, что гибернация аналогична сну в том, что состоит из трудноуловимых подсостояний. Например, сон можно подразделить на два состояния, синхронизированное и несинхронизированное ЭЭГ-состояния. Кроме того, исследование показывает, что существует значительная разница в физиологической основе этих дух основных подсостояний. В настоящей заявке раскрывается, что гибернация представляют собой аналог десинхронизированного сна как такового (т.е. REM-6 010860 сна), поскольку оба состояния ассоциируются с нейросекрецией, атонией и потерей автономного тонуса(как симпатической, так и парасимпатической ветвей). Это означает, что существуют также подсостояния этого подсостояния сна. В процессе состояния сна с быстрым движением глаз (REM-сон) наблюдается заметное благоприятное воздействие на вентрикулярную эктопию и чувствительность сердца к смертельной аритмии в модели ишемии миокарда у свиньи. Латентное состояние между началом REM-сна,определенном по ЭЭГ-критериям, и началом благоприятного воздействия на сердечно-сосудистую систему, определенном по ЭЭГ-критериям, составил 20-30 с, что свидетельствовало о нейрогуморальном механизме действия. Кроме того, исследования показали, что благоприятное воздействие на аритмогенез сообщалось сердцу через вегетативную нервную систему и исходило из невральной активности в лобных долях головного мозга (Skinner, J.E., Reduction of cardiac vulnerability during REM sleep in the pig. In: SleepDisorders, Basic and Clinical Research, edited by M. Chase and E.D. Weitzman. New York: Spectrum Publications,1983, pp. 49-63; Skinner, J.E., J. Amer. Coll. Cardiol., 5: 88B94B, (1985, той части головного мозга, которая инициирует ЭЭГ-синхронизацию и сон (Skinner, J.E., Douglis, F.M., and Harper, R.M. Higher cerebralM.H. Kryger, T. Roth, and W.C. Dement. W.B. Saunders Co., Chapter 27, pp. 276-293, (1989. Оказалось трудным отбирать образцы молекул из интерстициальной области головного мозга в процессе REM, поскольку этот период очень короткий. Так как REM является высоконейросекреторным состоянием головного мозга, сопровождаемым отключением обеих ветвей вегетативной нервной системы и мышечной атонией, искали аналогичное состояние головного мозга, и оно было обнаружено у млекопитающего в состоянии гибернации. Было сделано предположение, что такое состояние представляет собой длительное состояние, позволяющее осуществлять адекватный отбор образцов молекул, секретируемых не находящимися в состоянии гибернации животными в процессе REM-сна. Раскрываются: 1) вынужденное пробуждение, сопровождаемое сильной брадикардией, на средней стадии гибернации, неизбежно ведущее к смерти; и 2) вынужденное пробуждение и сопровождающая его брадикардия либо на ранней, либо на поздней стадии гибернации, результатом чего является успешное пробуждение. Раскрывается, что относительная ишемия, обусловленная метаболической потребностью, создаваемой поведением пробуждения, которая недостаточно поддерживается кровотоком (несоответствующая брадикардия), не может быть преодолена на средней стадии гибернации, поскольку присутствует недостаточное количество антиинфарктных молекул. Раскрывается, что молекулярные фракции, экстрагированные у животных на ранней и поздней стадиях гибернации, содержат молекулы, которые могут регулировать и обеспечивать успешное пробуждение, не приводя к смерти животного, но молекулы, полученные на средней стадии гибернации, не могут. В модели инсульта у грызунов было обнаружено, что только фракции, полученные на ранней и поздней стадии гибернации, содержали антиинфарктную молекулу. Дифференциальные сравнения с молекулярной фракцией, полученной на средней стадии гибернации,с использованием различных методов (2D-гели, ЖХ/MS/MS) привели к идентификации раскрываемых антиинфарктных молекул. Таким способом очистки, в зависимости от состояния, было получено 9 белков и 5 пептидов, которые активировались на ранней стадии гибернации по сравнению со средней стадией гибернации. Раскрывается, что гибернация имеет подсостояния. Также раскрывается, что нечетко различимое разграничение на независимые подсостояния связано с различными профилями нейросекреции. Также раскрывается, что такие связанные с гибернацией подсостояния обычно возникают в процессе бодрствования, до гибернации, если они связаны с ишемией. Также раскрываются зависящие от подсостояния гибернации профили нейросекреции, ведущие к потере аппетита. Раскрывается, что сравнение фракций плазмы, взятой до и после того, как впадающие в зимнюю спячку животные прекращают прием пищи, может в результате вывести на выделение и идентификацию специфической молекулы, которая подавляет аппетит в предшествующий гибернации период бодрствования. Данные, подтверждающие такое дифференциальное сравнение, представлены в табл. 15. Таблица 15. Пищевое поведение сурка. Наблюдения осуществляли на 6 сурках, которых отлавливали и изучали на протяжении всего периода гибернации. Ежедневная пища составляла 1 небольшую морковку, 1/2 яблока, 1 лист капусты и воду без ограничения. Потребление пищи отмечали 24 ч спустя; несъеденную пищу удаляли из клетки,перед тем как положить на блюдо для пищи свежую. Дата 1 сентября 1 октября 1 ноября 30 ноября 1 декабря Пищевое поведение животных, обобщенное на дату наблюдения 6 из 6 потребляли, в основном, всю пищу ежедневно. 6 из 6 потребляли почти всю пищу; 2 ели значительно меньше, но съели яблоки. 2 из 6 потребляли почти всю пищу; 4 ели значительно меньше, но съели яблоки. 2 из 6 съели некоторое количество пищи; 3 съели очень мало; 1 съел совсем мало пищи. Всю пищу убрали и животных больше не беспокоили; в течение 1 недели все 6 были спокойными (т.е. в состоянии гибернации), как было определено 24-часовым отслеживанием активности.-7 010860 Способ определения молекул в зависящих от состояния фракциях связанных с гибернацией образцов плазмы, цереброспинальной жидкости, мочи или других биологических скоплений молекул раскрывается как для состояний бодрствования, так и гибернации у впадающих в зимнюю спячку животных. Раскрываются применения зависящих от состояния способов захвата связанных с гибернацией молекул. Раскрываются молекулы или частично или, по существу, очищенные фракции молекул, которые содержат молекулы, связанные с: 1) предотвращением повреждения головного мозга при инсульте,2) предотвращением повреждения миокарда при сердечном приступе и 3) рециркуляцией мочевины в крови при почечной недостаточности или другом состоянии. Раскрываются FPA и связанные с FPA молекулы, такие как молекулы, имеющие идентичность сFPA, обладающие антиинфарктным действием. Раскрываются антиинфарктные молекулы. В случае возникновения случайного тромбоза в сосуде с интактным просветом для кровотока (т.е. в неразрезанном сосуде), тогда перед тем, как может начаться тромболиз для удаления закупорки, произойдет случайная ишемия в расположенных ниже по ходу потока тканях. Примеры такого случайного свертывания крови связаны с гематомами, низким перфузионным давлением, позиционной закупоркой сосуда и т.д. Ишемическое повреждение, вызванное образованием случайного сгустка, может быть устранено при помощи свободных FPA-фрагментов, или вариантов, или производных, которые были выделены. Если FPA вытекает из организма из-за разреза или разрыва сосуда, тогда с ишемией труднее бороться, но если кровоток остается неповрежденным, тогда выброс в кровоток нефосфорилированного FPA может иметь селективное преимущество антиинфарктной функции в процессе растворения сгустка и восстановления циркуляции крови. 2. Ишемия. а) Механизмы умеренной нейро- и кардиопротекции. Молекулы для защиты от ишемии искали давно, основываясь на наблюдениях, что нейроны могут разрушать сами себя посредством сверхактивного возбудительного процесса. Глутамат и его рецепторы,некоторые из которых вовлечены в процессы познавания и запоминания, по-видимому, являются основной причиной этого сверхвозбуждения (Michaelis E.K. Prog. Neurobiol. 1998, 54 (4): 369-15). L-Глутамат представляет собой наиболее распространенную систему передачи возбуждения в головном мозге позвоночных, и в дополнение к его действиям в качестве синаптического трансмиттера он производит долгосрочные изменения в метаболизме и жизнеспособности нейронов. Такие действия производятся через активацию двух основных классов рецепторов, тех, которые образуют ионные каналы, и тех, которые связываются с G-белками для контроля метаболизма. Фармакологическая и физиологическая характеристика этих различных форм рецепторов вывела на определение трех ионных каналов и трех (групп) метаболических рецепторов. На сегодняшний день идентифицировано более 25 генов для специфических субъединиц этих рецепторов, и еще 5 белков, по-видимому,функционируют как субъединицы рецептора или как ассоциированные с рецептором белки (такие последовательности для таких белков можно найти в Genbank, и они включены в настоящую заявку во всей их полноте посредством ссылки). Регуляция экспрессии таких белковых субъединиц, их локализация в нейронах и глиальных мембранах и их роль в определении физиологических свойств рецепторов глутамата представляет сегодня область научных исследований. Как ионотропные, так и метаботропные рецепторы связываются с множеством внутриклеточных мессенджеров, таких как Са 2+, циклический AMP, реактивные формы кислорода, и эти связи инициируют множество сигнальных каскадов, которые определяют рост, дифференциацию и выживание нейронов. Aarts et al. обнаружили два небольших пептида с некоторой антиинфарктной активностью, которые работают через рецептор NMDA. Aarts et al., Scence, 298: 846850 (2002), включенный в настоящую заявку посредством ссылки, по крайней мере, что касается материала, относящегося к антиинфарктным молекулам (Lys-Leu-Ser-Ser-Ile-Glu-Ser-Asp-Val SEQ ID NO: 104)(Tyr-Gly-Arg-Lys-Lys-Arg-Arg-Gln-Arg-Arg-Arg SEQ ID NO: 105). Такие находки, связанные с L-глутаматом, привели к предположению, что если один или несколько рецепторов глутамата или субклеточные связи блокированы, тогда, возможно, возбуждение-смерть, возникающие в результате глутаматного демпинга во время ишемического повреждения, можно предотвратить. Лубелузол представляет собой одну из таких молекул, которая, действительно, блокирует эффект стимуляции рецептора глутамата (Lesage A.S., et al., J. Pharmacol. Exp. Ther. 1996, 279: 759-66). Однако клинические испытания показали, что он не проявил себя как полезный с медицинской точки зрения для лечения пациентов, зарегистрированных в течение 8 ч после начала инсульта (Grotta J., Cerebrovasc. Dis. 2001, 12: 258-63). Существует несколько других линий доказательств, подтверждающих другие умеренно эффективные антиинсультные воздействия. Молекула эндотелиальной адгезии была предложена в качестве основного кандидата, вызывающего инсульт и некротическую гибель клеток, в которых она образуется. Молекула TNF-альфа (фактор некроза опухоли альфа) через второй мессенджер, керамид, приводит к активации ICAM-1 (молекула-1 межклеточной адгезии), молекулы, вызывающей связывание моноцитов и макрофагов с эндотелиальной выстилкой мелких кровеносных сосудов (Ginis I., et al., Am. J.Physiol. 1999, 276: 01171-83). Этот механизм также проявляет действие ишемического "предкондиционирования" в головном мозге (Chen Y., et al., J. Cereb. Blood Flow Metab. 2001, 21: 34-40), феномен, являющийся чрезвычайно востребованным, поскольку ведет к сохранению тканей как в моделях инфаркта го-8 010860 ловного мозга, так и сердца. Однако в небольшом клиническом испытании было обнаружено, что вмешательство в механизм TNF-ICAM-моноцит мышиного антитела против ICAM человека (Enlimomab) имеет негативный результат (Furuya K., et al., Stroke 2001 Nov.; 32 (11): 2665-74). Предкондиционирование сначала было исследовано в миокарде. Предыдущий опыт с ишемией (т.е."предкондиционирование"), как было обнаружено, ведет к меньшему объему инфаркта в более поздний период после восстановления, когда артерию освобождали. Первоначально было показано, что миокардиальный механизм включал ингибирующий g-белок, связанный с аденозиновым рецептором (HashimiM.W., et al., Mol. Cell Biochem. 186: 19-25). Co времени ранней аденозин-gi-циклазной гипотезы было обнаружено, что феномен предкондиционирования является более сложным. Предкондиционирование имеет две фазы (Bolli R. The late phase of preconditioning. Circ. Res. 2000,87 (11): 972-83). В отличие от ранней фазы предкондиционирования, которая длится 2-3 ч и защищает от инфаркта миокарда, но не от "образования поверхностных повреждений", существует поздняя фаза, которая длится 3-4 дня и, действительно, защищает от инфаркта и от поверхностного повреждения сердечной ткани. Этот более длительный эффект может, таким образом, иметь большее клиническое значение. Позднее предкондиционирование представляет собой полигенный феномен, который требует одновременной активации множества реагирующих на стресс генов. Химические сигналы, высвобождаемые сублетальным ишемическим стрессом (такие как NO, реактивные формы кислорода и аденозин), запускают комплексный каскад сигнальных событий. Эти события включают активацию протеинкиназы С, протеинтирозинкиназ Src и нуклеарного фактора каппа-В и завершаются повышенным синтезом индуцируемой синтазы NO, циклооксигеназы-2, альдозоредуктазы, супероксиддисмутазы Mn и, возможно, других кардиозащитных белков. Аналогичная последовательность может быть запущена разными стимулами,такими как сердечный стресс, физическая нагрузка и цитокины. Таким образом, оказалось, что позднее предкондиционирование является универсальным ответом сердца на стресс, в целом. Важно, что кардиозащитное действие позднего предкондиционирования можно воспроизвести фармакологически при помощи клинически релевантных средств (например, доноров NO, агонистов аденозинового рецептора,производных эндотоксина или агонистов опиоидных рецепторов). Однако и в мозге, и в сердце сохранение тканей в результате либо церебрального, либо сердечного предкондиционирования является незначительным, при этом большая часть инфаркта все же проявляется. Это незначительное количество сохраненных тканей составляет, например, от 25 до 35% (Furuya K.,et al., J. Cereb. Blood Flow Metab. 2001 3: 226-32; Dawson D.A., et al., J. Cereb. Blood Flow Metab. 1999, 6: 616-23; and Nawashiro H., et al., Brain Res. 1997, 778 (2): 265-71) для пути метаболизма TNF-ICAM в головном мозге при обеспечении предишемического лечения.b) "Поверхностно поврежденная" ткань: механизм 100% восстановления функции. Феномен восстановления неконтрактильной функции ишемической сердечной ткани был обнаружен в 1980-х годах после хирургического вмешательства, связанного с восстановлением сосудов у пациентов,страдающих тяжелым ишемическим заболеванием сердца (Cooper Н.А., Braunwald E., Coron. Artery Dis. 2001 12: 387-92). Миокард, который выдержал временное сублетальное повреждение, но имеет потенциал для полного восстановления со временем, называют "поверхностно поврежденным" миокардом. Кратковременное поверхностное повреждение миокарда обычно наблюдают после шунтирования коронарной артерии."Гибернационный" миокард аналогичен поверхностно поврежденному, но это хроническое состояние, которое может быть вызвано либо хроническим низким кровоснабжением, либо постоянно повторяющимся поверхностным повреждением. Например, когда у пациентов со стенокардией повышаются потребности в кислороде, возникают длительные периоды ишемии, которые приводят к многочисленным эпизодам поверхностных повреждений, и эта серия, в конечном итоге, приводит к гибернационному миокарду. Когда миоциты постоянно снабжаются при низкой скорости кровоснабжения, они просто теряют свою способность к сокращению, но они не гибнут, а происходит некротическое растворение. Наоборот, после восстановления кровообращения эти клетки, даже после нескольких лет дисфункции, восстанавливают свои сократительные свойства. Восстановление обычно более полное в поверхностно поврежденной ткани, чем в гибернационной ткани, при этом последняя обычно имеет небольшие островки некротического повреждения в своей массе. Взаимосвязь между поверхностно поврежденным, гибернационным и предкондиционированным миокардом еще полностью не выяснена (Futterman L.G., Lemberg L., Am. J. Crit. Care 2000 9: 430-6), но подобно эффектам ишемии в головном мозге, когда изменяются как ионные, так и метаболические пути,контролируемые глутаматом, в лежащей в основе этого молекулярной биологии, вероятно, прослеживаются полигенные пути. Эти пути молекулярной динамики, которая меняется, по-видимому, зависят от конкретных зависимостей от состояния, присутствующих в момент модификации, включая различие между видами (Kim S.J., et al., Circ. Res. 2001 Oct. 26; 89: 831-7). с) Модели ишемии.Co времени введения в медицину одобренного FDA тромболиза с использованием таких активаторов тканевого плазминогена, как tPA, модели инсульта и сердечного приступа изменились, вместо длительной окклюзии сосудов для получения инфаркта, используют кратковременную окклюзию. Для ими-9 010860 тации реального с медицинской точки зрения времени между началом окклюзии и инъекцией тромболитического средства и лекарственного средства-кандидата время окклюзии в большинстве моделей животных снизилось от 24 до 1-2 ч (т.е. окклюзию прекращают для имитации тромболиза и повреждение ткани определяют гистологически через 24 ч). Часто в случаях модели ишемии сердца исследуют контрольную группу, называемую группой"предкондиционирования", для сравнения нового лекарственного средства-кандидата с такой нелекарственной защитой. На моделях "сердечного предкондиционирования" ранее было установлено, что у каждого животного, у которого наблюдали кратковременные ишемические приступы, эти приступы не приводили к необратимому повреждению ткани. Существуют доказательства того, что этот физиологический защитный механизм связан в аденозиновым рецептором и опосредован g-белком. Полагают, что защиту ткани посредством такого "предкондиционирования" можно отнести к "поверхностному повреждению сердечной ткани" (реверсия не окращающейся ткани) или "сердечной гибернации" (частичная реверсия несокращающейся ткани), что происходит после повторного установления длительной ишемии, как происходит при шунтировании коронарной артерии. Разница между поверхностно поврежденными и гибернационными тканями заключается в наличии или отсутствии какойлибо невосстанавливаемой дисфункции ткани. Контрольные группы предкондиционирования обычно показывают сохранение ткани только до 3050%, что существенно меньше, чем ожидаемое для любого из новых лекарственных средств, которые могли бы оказывать действие по ограничению размера инфаркта. Полагают, что даже кратковременная окклюзия вызовет некоторое необратимое повреждение ткани. Например, 1-часовая окклюзия может привести к образованию некоторой отдаленной ткани в объеме ишемии, способной к реверсированию повреждения ткани, но некоторая центральная масса ткани уже станет неспособной к восстановлению и в результате омертвеет. Раскрываемые молекулы и фракции могут обеспечить 100% реверсирование инфаркта у некоторых животных, у которых была вызвана 1-часовая окклюзия (мышь-МСАО), в том числе реверсирование в центральной массе ткани, и, таким образом, очевидно, что должны быть решены проблемы повреждения центральной ткани по сравнению с периферийным повреждением. При предварительной обработке раскрываемыми в настоящей заявке молекулой(ами) и фракциями после 1-часовой окклюзии наблюдали 100% сохранение ткани спустя 24 ч у всех животных. Инъекция соответствующей(их) молекулы (молекул) оказалась эффективной, когда инъекцию вводили в течение времени вплоть до 8 ч после начала 1 часовой ишемии. Для мыши необходимо лишь 1/20 часть инъецируемого материала по сравнению с крысой, что делает мышь более эффективной для многочисленных исследований. Раскрываются способы, в которых стадия анализа включает использование мышиной модели вызванной МСАО церебральной ишемии или ишемии миокарда. Также раскрываются способы, в которых на стадии анализа для исследования ишемии миокарда или церебральной ишемии при окклюзии коронарной артерии используют модель крысы или модель любого другого животного, например модели млекопитающих. Также раскрываются способы, использующие животные модели ангиогенеза новых сосудов, ремоделирования старых сосудов, где коллатеральный анастомоз раскрывают шире для наполнения дистальных концов блокированных сосудов, реперфузионного повреждения, где большие количества аккумулированных побочных продуктов ишемии поступают в отдаленные ишемические ткани и/или в ишемических тканях происходит индуцированное осмосом повреждение органелл или мембран и где любой другой орган становится ишемическим или где все органы и ткани становятся ишемическими в результате ишемии всего организма, вызванной временной остановкой сердца (фибрилляция желудочков) или блокадой кровотока (например, зажим аорты). Существует множество других моделей, в дополнение к более традиционным моделям ишемии (окклюзия сосудов)/инфаркта (вызванного некроза). Например, инфаркт может быть вызван травмой от механического удара, коагулопатией от яда змеи и т.д. Таким же образом ишемия может медленно вызываться амероидными констрикторами, образуемыми в мелких отдаленных сосудах вводимыми инфузией микросферами, и т.д. Кроме того, эти модели могут включать глобальные варианты модуляции, такие как выключенный ген (например, делеция рецептора миокарда), биоповеденческие модификации (например, психосоциальный стресс) и т.д.C. Композиции. Раскрываются композиции, обладающие антиинфарктными свойствами. Раскрывается зависящий от состояния способ, в котором фракции альбумина (например, гелевая колонка affi-blue), выделенные из фракции средней стадии гибернации, экстрагированной, например, через 6 недель после наступления гибернации, и из фракции ранней стадии гибернации, экстрагированной, например, через 2 недели после наступления гибернации, показали 9 белков и 5 пептидов, которые были дифференциально экспрессированы в ранней и средней стадиях гибернации. Фракции фильтровали (отсечка 10 кДа) с получением субфракций белка и пептида, и после испытания на мышиной модели МСАО было показано, что обе фракции обеспечивали антиинфарктное действие. Два из полученных пептидов, как было показано, дифференциально активируются, а три были идентифицированы методом ЖХ/MS/MS как матричные артефакты. При помощи используемого в протеомике метода фингерпринтинга и секвенирования de novo пептиды были идентифицированы как фибринопептид-А (FPA) и брадикинин. Молекулу FPA систематически- 10010860 исследовали в модели МСАО у мыши, синтезируя различные фрагменты FPA. В данной заявке раскрывается, что фиксированная на С-конце область является активным фрагментом FPA, который обладает антиинфарктными свойствами. Было показано, что синтезированный брадикинин и Des-Arg-брадикинин также обладают антиинфарктными свойствами в мышиной модели МСАО. С использованием колонок с обращенной фазой были идентифицированы дополнительные пептиды (отсечка ниже 10 кДа, ЖХ/MS/MS) в дифференциальных фракциях D2 по сравнению с NE2. Раскрываемые композиции можно выделить с использованием зависящих от состояния способов,раскрываемых в настоящей заявке, или они относятся к молекулам, которые можно выделить с использованием зависящих от состояния способов, раскрываемых в настоящей заявке, или они представляют собой молекулы, которые имитируют функцию молекул, которые могут быть выделены с использованием зависящих от состояния свойств, раскрываемых в настоящей заявке. Раскрываются способы сравнения ранней и средней стадий гибернации, которые привели к идентификации 9 белков в дифференциальных состояниях. Также раскрываются зависящие от состояния способы, в которых сравнивают множество различных молекул в различных подсостояниях гибернации, как до, так и в период подсостояний гибернации. Такие модификации были осуществлены, и их можно осуществить при помощи молекулярных методов двумерного гель-электрофореза и используемого в протеомике объединенного метода ЖХ/MS/MS. Зависящие от состояния сравнения и идентификацию молекул можно осуществлять и различными другими молекулярными методами, в частности такими, как метод сравнения наборов генов и,в основном, метод любого другого сравнения, подходящий для идентификации специфических зависящих от состояния молекул. Должно быть понятно, что при использовании молекул, выделенных у животного с использованием зависящих от состояния способов, раскрываемых в настоящей заявке, такую молекулу можно использовать при разной степени чистоты. Например, зависящие от состояния способы могут обеспечить плазму,которую можно фракционировать на основе, например, размера, или заряда, или гидрофобности. Одну или все из таких процедур или другие процедуры можно использовать для повышения специфической активности образца. Фракции можно отслеживать на их активность, например отслеживать их антиинфарктные свойства, на модели крысы или мыши, как описано в настоящей заявке. Сырые биоматериалы,такие как кровь, сначала можно обработать с получением плазмы. Затем плазму можно очистить различными способами. Плазму можно очистить с использованием аффинной матрицы (например, affi-gel blue),которая отделяет фракцию альбумина от других материалов плазмы. Такую фракцию альбумина можно затем очистить с использованием любого из различных способов, в которых используют разницу, например, в размере пор, скрученности, заряде, молекулярной массе, гидрофобности и/или растворимости. Затем фракцию альбумина можно фракционировать на основе размера, например, используя молекулярные сита или мембраны, имеющие отсечку молекулярной массы, например, 3,5, 7, 10, 15, 20, 30, 50,75, 100, 150 и 200 кДа. 1. Фракции, полученные у животных в период гибернации. Раскрываются фракцииплазмы, выделенные в период гибернации у животных, таких как сурок, обладающие антиинфарктными свойствами, где фракцию получают от находящегося в состоянии гибернации животного в период вплоть до 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30 или 40 дней после начала гибернации или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30 или 40 дней до окончательного пробуждения от гибернации. Раскрываются фракции плазмы, выделенные у животного в состоянии гибернации, такого как сурок, обладающие антиинфарктными свойствами, где фракцию получают от находящегося в состоянии гибернации животного в период 1-25 дней, или 5-20 дней, или 10-18 дней, или 14 дней после начала гибернации или 2-6 недель, 3-6 недель, 4-6 недель или 5 недель до окончания гибернации животного или всей колонии. Раскрываются фракции плазмы, выделенные у животного в состоянии гибернации. Находящимся в состоянии гибернации животным может быть любое впадающее в зимнюю спячку животное. Например,находящееся в состоянии гибернации животное может представлять собой млекопитающее (например,суслик, медведь, лесной сурок, сурок, скунс, летучая мышь), насекомое (например, комар, оса, пчела),рыбу (например, даллия), рептилию (например, змея, черепаха), земноводное (например, лягушка) или птицу (например, козодой). Раскрываются фракции плазмы и молекулы, идентифицированные в таких фракциях, обладающие антиинфарктным действием в течение многих часов после начала ишемии. Например, результаты, представленные на фиг. 6, показывают положительные результаты через 6 ч после ишемии. ДиализованнаяD2-фракция при введении путем инъекции через 1 ч после начала ишемии обеспечивает отсутствие или минимальный объем инфаркта у большинства субъектов. Раскрываются молекулы, обладающие идентичностью с FPA сурка и FPA человека (фиг. 8). В настоящей заявке раскрывается, что соответствующие зависящие от состояния молекулы, обнаруженные у грызунов (сурок, крыса, мышь), проявляют эффективное действие по предотвращению инсульта у различных видов, таких как человек. Благодаря их первостепенной важности для выживания в период ишемии (например, врожденной ишемии, условной ишемии при сублетальной физической нагрузке, циркуляторной ишемии, ишемии при гибернации и т.д.) такие молекулы, вероятно, были функционально законсервированы среди видов млекопитающих в ходе эволюции.- 11010860 Раскрываются фракции плазмы находящегося в состоянии гибернации животного, включающие молекулу, где молекула обладает антиинфарктной активностью и где фракцию выделяют путем сбора крови животного через 1-25 дней после начала гибернации. Также раскрываются фракции, где фракции выделяют путем сбора крови животного через 10-19 дней после начала гибернации, или где фракцию выделяют путем сбора крови животного через 14, 15 или 16 дней после начала гибернации, или где фракцию выделяют путем сбора крови животного через 15 дней после начала гибернации. Раскрываются фракции плазмы находящегося в стадии гибернации животного, включающие молекулу, где молекула обладает антиинфарктной активностью, и где фракцию выделяют путем сбора крови животного, где первое животное находится в ранней стадии гибернации, и где фракция не включает никакого количества крови второго животного, если второе животное находится в средней стадии гибернации. Раскрываются фракции плазмы находящегося в состоянии гибернации животного, включающие молекулу, где молекула обладает антиинфарктной активностью и где фракцию выделяют путем сбора крови животного за 1-25 дней до окончательного пробуждения животного. Также раскрываются фракции, где фракции выделяют путем сбора крови животного за 10-20 дней до окончательного пробуждения животного, где фракции выделяют путем сбора крови животного за 14,15 или 16 дней до окончательного пробуждения животного и где фракции выделяют путем сбора крови животного за 15 дней до окончательного пробуждения животного. Также раскрываются фракции плазмы находящегося в состоянии гибернации животного, включающие молекулу, где молекула обладает антиинфарктной активностью, и где фракцию выделяют путем сбора крови первого животного, где первое животное находится в поздней стадии гибернации, и где фракция не включает никакого количества крови второго животного, если второе животное находится в средней стадии гибернации. Раскрываются фракции, где антиинфарктная активность представляет собой церебральную антиинфарктную активность, и фракции, где антиинфарктная активность представляет собой кардиальную антиинфарктную активность или обе активности. Раскрываются фракции плазмы находящегося в состоянии гибернации животного, включающие молекулу, где молекула индуцирует рециркуляцию мочевины и где фракцию выделяют путем сбора крови животного через 1-25 дней после начала гибернации. Также раскрываются фракции, обладающие активностью рециркуляции мочевины, где фракции выделяют путем сбора крови животного через 10-20 дней после начала гибернации, или где фракции выделяют путем сбора крови животного через 14, 15 или 16 дней после начала гибернации, или где фракцию выделяют путем сбора крови животного через 15 дней после начала гибернации. Раскрываются фракции плазмы находящегося в состоянии гибернации животного, включающие молекулу, где молекула индуцирует рециркуляцию мочевины, и где фракцию выделяют путем сбора крови первого животного, где первое животное находится в ранней стадии гибернации, и где фракция не включает никакого количества крови второго животного, если второе животное находится в средней стадии гибернации. Также раскрываются фракции плазмы находящегося в состоянии гибернации животного, включающие молекулу, где молекула индуцирует рециркулирование мочевины и где фракции выделяют путем сбора крови животного за 1-25 дней до окончательного пробуждения животного. Также раскрываются фракции, где фракции выделяют путем сбора крови животного за 10-20 дней до окончательного пробуждения животного, где фракции выделяют путем сбора крови животного за 14,15 или 16 дней до окончательного пробуждения животного и где фракции выделяют путем сбора крови животного за 15 дней до окончательного пробуждения животного. Также раскрываются фракции плазмы находящегося в состоянии гибернации животного, включающие молекулу, где молекула индуцирует рециркуляцию мочевины, и где фракции выделяют путем сбора крови первого животного, где первое животное находится в поздней стадии гибернации, и где фракция не включает никакого количества крови второго животного, если второе животное находится в средней стадии гибернации. 2. Способы очистки антиинфарктных молекул. Также раскрываются способы очистки молекулы, обладающей антиинфарктной активностью,включающие: 1) взятие образца у находящегося в состоянии гибернации животного, 2) взятие контрольного образца у находящегося в состоянии гибернации животного, 3) сравнение образца с контрольным образцом. Раскрываются способы очистки молекулы, обладающей антиинфарктной активностью, включающие: 1) взятие образца у находящегося в состоянии гибернации животного, 2) взятие второго образца у находящегося в состоянии гибернации животного, 3) сравнение образца со вторым образцом. Раскрываются способы очистки молекулы, обладающей антиинфарктной активностью, включающие: 1) взятие образца у находящегося в состоянии гибернации животного, 2) взятие второго образца у находящегося в состоянии гибернации животного в другом подсостоянии, 3) сравнение образца со вторым образцом.- 12010860 Раскрываются способы очистки молекулы, обладающей антиинфарктной активностью, включающие: 1) взятие образца у находящегося в состоянии гибернации животного по состоянию на первое время,2) взятие второго образца у находящегося в состоянии гибернации животного по состоянию на второе время, где первое время и второе время являются разными, 3) сравнение образца со вторым образцом. Раскрываются способы очистки молекулы, обладающей антиинфарктной активностью, включающие: 1) взятие образца крови у находящегося в состоянии гибернации животного, 2) взятие второго образца крови у находящегося в состоянии гибернации животного, 3) сравнение образца крови со вторым образцом крови. Также раскрываются способы, где стадия сравнения образца и второго образца включает анализ экспрессии генов в образце и втором образце, и способы, где стадия сравнения образца и второго образца включает анализ экспрессии белков в образце и втором образце. Раскрываются способы, где образец и второй образец получают из крови, мочи, спинальной жидкости или цереброспинальной жидкости, тканей, органов, клеток. Раскрываются способы, где животное представляет собой млекопитающего, такого как суслик, медведь, сурок, скунс или летучая мышь. Раскрываются способы, где образец крови получают у животного, находящегося в ранней или поздней стадии гибернации. Раскрываются способы, где второй образец крови получают у животного, находящегося в средней стадии гибернации. Раскрываются способы, где образец крови получают у животного через 1-25 дней после начала гибернации. Раскрываются способы, где второй образец крови получают у животного через 26-60 дней после начала гибернации. Раскрываются способы, где стадия сравнения включает идентификацию дифференциально регулируемых молекул, где дифференциально регулируемые молекулы присутствуют в образце в количестве,отличном от второго образца. Раскрываются способы, где идентификация дифференциально регулируемых молекул включает фракционирование образца и второго образца. Также раскрываются способы, где фракционирование происходит путем отбора молекул с М.м. 10 кДа или меньше. Раскрываются способы, где фракционирование включает стадию разделения молекул в образце крови и втором образце по заряду, гидрофобности, гидрофильности, липофильности, скрученности, молекулярной массе, методом аффинной хроматографии белков, пептидов или углеводов или по растворимости. Раскрываются способы, где аффинное разделение включает использование хроматографии affi-gel blue. Раскрываются способы, где идентификация включает анализ образцов методами ГХ-масс-спектроскопии, гель-хроматографии, высокоэффективной жидкостной хроматографии или ГХ/MS/MS массспектроскопию осуществляют с использованием стандартных процедур (жидкостная хроматография,объединенная с масс-спектрометрией). Раскрываются способы, где высокоэффективная жидкостная хроматография включает хроматографию с обращенной фазой, и способы, где гель-хроматография включает двумерный полиакриамидный гель-электрофорез. Раскрываются способы, где способ дополнительно включает очистку дифференциально регулируемых молекул с получением очищенных дифференциально регулируемых молекул. Раскрываются способы, где способ дополнительно включает анализ антиинфарктной активности очищенных диференциально регулируемых молекул. Раскрываются способы, где стадия анализа включает использование модели вызванной МСАО церебральной ишемии у мыши. Также раскрываются способы, использующие модели ангиогенеза новых сосудов, ремоделирования, реперфузионного повреждения и тесты для ишемии различных органов. Раскрываются способы, где антиинфарктная активность представляет собой церебральную антиинфарктную активность, и способы, где антиинфарктная активность представляет собой кардиальную антиинфарктную активность. 3. Фибриноген A (FPA). а) Структура молекулы FPA.FPA представляет собой фрагмент растворимого фибриногена, который высвобождается при расщеплении фибриногена тромбином. Катализируемое тромбином (IIa) расщепление растворимого фибриногена (Fbg) с образованием фибрина (Fbn) является конечным протеолитическим событием в каскаде коагуляции. Такие растворимые Fbn мономеры самопроизвольно полимеризуются с образованием нерастворимой сети Fbn, которая стабилизируется катализируемым фактором XIIIa перекрестным сшиванием остатков lys и glu цепей а и g. Такая сеть Fbn представляет собой основной белковый компонент гемостатической пробки. Плазменный фибриноген представляет собой гликопротеин массой примерно 340000 кДа, который синтезируется в печени. Он циркулирует у животных при концентрации 2,6 мг/мл. Он состоит из связан- 13010860 ного дисульфидными связями димера, состоящего из 3 пар связанных дисульфидными связями неидентичных полипептидных цепей (Аа, Bb и g).FPA представляет собой N-концевой фрагмент цепи Аа, который содержит участки перекрестной сшивки фактора XIIIa и 2 сайта фосфорилирования. Fbg обычно является полностью фосфорилированным после синтеза, но циркулирует только при 20-30% фосфорилирования. В результате высвобожденияFPA путем расщепления в R16-G17 образуется Fbn I, экспонирующий сайт полимеризации (17-20) на цепи Аа. Эти участки связываются с комплементарными участками на D домене Fbn с образованием протофибрил. Последующее IIa-расщепление FPB (R14-G15) из цепи Bb раскрывает дополнительные сайты полимеризации и активирует боковой рост сети Fbn. Таким образом, обычно FPA составлен из Nконцевых аминокислот вплоть до сайта расщепления тромбина, что обычно происходит в сайте расщепления R-G. Таким образом, один путь определения FPA представляет определение по сайту расщепления тромбина и, таким образом, является относительной системой. Как правило, должно быть 11-20 аминокислот, расположенных к N-концу от сайта расщепления. Таким образом, один путь обсуждения относительных положений FPA представляет собой обсуждение этого положения относительно сайта расщепления, например, 3 аминокислот к N-концу от сайта расщепления или 7 аминокислот к N-концу от сайта расщепления. Например, в FPA сурка последовательность AEG будет представлять, соответственно, 7, 6 и 5 аминокислот к концу от сайта расщепления. Структура фрагментов фибриногена, включая FPA, в настоящее время исследуется и моделируется,например, при помощи тромбина (Martin, P.D., et al., J. Biol. Chem. 267 pp. 7911 (1992); Stubbs, M.Т., et al.,Eur. J. Biochem. 206 pp. 187 (1992); Martin, P.D., et al., Biochemistry 35 pp. 13030 (1996); Malkowski, M.G.,et al., Biochem. J. 326 pp. 815 (1997. Такие структуры можно использовать для обнаружения структурных миметиков FPA и вариантов, сохраняющих функции FPA, такие как антиинфарктные свойства. Например, известны контакты тромбина с подобластью FPA (например, GEFLAEGGGV). Известно, что эта подобласть обладает антиинфарктными свойствами. Таким образом, миметики этой подобласти можно выделить путем моделирования с использованием тромбина и сравнения координат контактов тромбина с известной подобластью и подобластью, представляющей интерес. Молекулы, связывающиеся с тромбином аналогичным образом, как можно ожидать, должны обладать такими же свойствами FPA человека и фрагментов FPA человека, такими как антиинфарктные свойства, т.к. являются эквивалентными в известном анализе FPA - связывании с тромбином. Как раскрывается в настоящей заявке, эту информацию можно объединить с комбинаторными химическими методами и процедурами скрининга для выделения молекул, обладающих свойствами FPA. Например, в определенном типе анализа связывания молекулы могут связываться с тромбином, а затем для конкуренции этим молекулам можно использовать FPA или его фрагмент. Молекулы, отобранные в этом конкурентном анализе связывания, дадут молекулы, обладающие свойствами связывания, аналогичными FPA, что обеспечивает аналогичные функциональные свойства, такие как антиинфарктная активность. Из обсуждения, представленного в настоящем описании, должно быть понятно, что существуют самые разнообразные последовательности FPA. Например, существуют последовательности FPA, которые можно получить от самых разных животных. Также существуют последовательности, которые можно получить от находящихся в состоянии гибернации животных. Табл. 1 показывает примерный перечень последовательностей FPA, полученных от ряда различных животных. Последовательности можно сравнивать при помощи стандартных методов с получением процента идентичности для любой из последовательностей. Кроме того, при помощи обсуждаемых в данном описании способов можно получить консенсусную последовательность. Должно быть понятно, что любое сравнение раскрываемых в настоящем описании последовательностей, которое может быть выполнено для получения процента идентичности, конкретно раскрывается вместе с конкретной идентичностью. Например, последовательности человека и сурка отличаются по 4 из 15 положений. Это дает примерно 74% идентичность между FPA человека и сурка. Также должно быть понятно, что конкретные фрагменты также можно сравнивать на их идентичность. Например, фрагмент, включающий 10 аминокислот, наиболее близко расположенных от сайта расщепления (GEFLAEGGGV), отличается у человека и сурка только 1 аминокислотой, что указывает на 90% идентичность этого фрагмента у человека и сурка. Такой тип анализа можно осуществить для любой последовательности FPA. Как раскрывается в настоящем описании, FPA человека работает в модели крысы. FPA человека и крысы имеют 11 отличий из 15, что указывает на 13% идентичность. Однако следует отметить, что положения 3, 4 и 8 являются высококонсервативными и также сохраняются у крысы. Таким образом, раскрываются последовательности, сохраняющие G, G и F в положениях 3, 4 и 8 к N-концу от сайта расщепления, соответственно, но возможны и другие варианты. Ниже представлены конкретные FPA-производные, которые могут быть испытаны в модели МСАО мыши: Табл. 1 представляет ряд последовательностей FPA. Эти последовательности отличаются в положениях с 1 по 5, меньше отличаются в положениях с 6 по 10 и имеют 100% гомологию в положениях 11-16. Дозу можно определить, например, по эффективной дозе плазмы 5 мг/кг как составляющую 1/1000 от 5 мг/кг, плазмы, 0,005 мг/кг фармакофора. Доза 0,005 мг/кг des-arg-BK была эффективной.- 15010860 Аминокислотные остатки в субстрате, который подвергается расщеплению, обозначены как Р 1, Р 2,P3 или Р 4 и т.д. в направлении к N-концу от разорванной связи. Расщепление происходит между Р 1 и Р 1',при этом Р 1 состоит из аминокислоты аргинина в молекуле FPA, a P1' обозначает аминокислоту, расположенную к с-концу от аргинина в исходной молекуле фибриногена.FPA представляет собой молекулу, являющуюся побочным продуктом в реакции коагуляции, которая образуется, когда тромбин взаимодействует с фибриногеном с образованием нерастворимого фибрина(кровяной сгусток) плюс свободный FPA. Свободный FPA обычно рассматривают как хороший маркер образования фибрина (Ottani F., Galvani M., Clin. Chim. Acta 2001 Sep. 15; 311 (1): 33-9). FPA расположен на N-конце молекулы фибриногена, которая при расщеплении приводит к образованию кровяного сгустка. Реакция коагуляции происходит, когда тромбин прикрепляется к вариабельному участку FPA, тогда какFPA является связанным с фибриногеном. Такое прикрепление возникает при помощи фосфорилирования серина в положении 3 (Maurer M.C., et al., Biochemistry 1998 Apr. 28; 37 (17): 5888-902). После отщепленияFPA он экспонирует связи оставшегося фибриногена, которые подвергаются сшивке с другими экспонированными пептидными связями других молекул фибриногена с образованием длинных фибриновых цепей. Уровни FPA можно измерить и использовать в качестве маркера клинических состояний заболевания. FPA повышен у пациентов с острым инфарктом миокарда, и его уровни повышаются в связи с активацией факторов свертывания крови XI и IX, которые участвуют в активации фибриногена тромбином (Minnema M.C.,et al., Arterioscler. Thromb. Vasc. Biol. 2000 Nov.; 20 (11): 2489-93). Фактор XII приводит к коагуляции,способствуя отщеплению FPA от фибриногена (Zito F., et al., Circulation 2000 Oct. 24; 102 (17): 2058-62). Протромбиновый фрагмент (f1.2) увеличивается как в связи с FPA, так и ишемическими событиями как в области сердца, так и головного мозга (Cote R., et al., Stroke 2000 Aug.; 31 (8): 1856-62). Содержание FPA в моче повышается у пациентов с болью в груди, которым оказывают неотложную помощь, и это связано с повышенным риском смерти (Sonel A., et al., Circulation 2000 Sep. 5; 102 (10): 1107-13). В экспериментах с животными были исследованы FPA-корреляты. У кроликов эволюционная модификация конца вариабельного участка FPA в положении 7 (Thr) предотвращает действие хабутобина,тромбинподобного фермента из яда змеи, по отщеплению FPA и ускорению летальной коагулопатии(Nejime T., et al., Toxicon. 2000 Aug.; 38 (8): 1029-41). Тканевый фактор (TF), действующий выше протромбина в пути коагуляции, в целом, как оказалось, опосредует коагуляцию, которая образуется в моделях ишемии/реперфузионного повреждения в выделенном сердце кролика (Armaganian L., et al., Coron.FPA и тромболиз являются связанными (растворение сгустка). D-Димерная молекула получается в результате тромболитической конверсии нерастворимого фибрина (т.е. действие по растворению сгустка),и имеются доказательства, показывающие, что количество этой молекулы увеличивается у некоторых пациентов с острым и хроническим инсультом без существенного увеличения FPA (Ince В., et al., Thromb.Res. 1999 Nov. 1; 96 (3): 169-74). Однако тромболиз при инъекции активатора тканевого плазминогена,вызывающего преобразование плазминогена в плазмин и начало фибринолиза, образующего D-димер,приводит к заметному повышению FPA; такое повышение может происходить в процессе ингибирования тромбина гепарином (Fassbender K., et al., Stroke 1999 Oct.; 30 (10): 2101-4). Тем не менее, FPA может повышаться, не вызывая при этом коагуляцию, и тромболиз может происходить и без изменения уровнейFPA, хотя обычно это все же происходит при инъекции активаторов тканевого плазминогена (tPA's). Повышение уровня FPA в процессе тромболиза можно отнести за счет его состояния фосфорилирования. Высокомолекулярный фибриноген (т.е. в котором положение 3 Ser является фосфорилированным) является протромботическим, поскольку фосфорилирование способствует прикреплению тромбина к этой молекуле, как описано выше, способствуя отщеплению FPA (Maurer М.С., et al., Biochemistry 1998 Apr. 28; 37 (17): 5888-902). Высокомолекулярный фибриноген - это то, что больше всего связано с сопутствующими коронарными ишемическими событиями у пациентов с острым инфарктом миокарда (Reganon E.,et al., Thromb. Haemost. 1999 Nov.; 82 (5): 1403-5). Это имеет смысл, поскольку фосфорилирование фибриногена ведет к протромботическому состоянию. Тромбоз является прямо противоположным тромболизу, тем не менее, неожиданные результаты получают, когда оба эти состояния вызываются одновременно. Фибриноген в кровотоке является на 95% фосфорилированным в период 20-35 ч после обработки ТРА, что приводит к раскрытию закупоренного коронарного сосуда. Однако уровни и фосфорилированого фрагмента FPA и HMW-фибриногена повышены у пациентов, которые не демонстрируют раскрытия сосудов после лечения тромболиза (Reganon E.,et al., Thromb. Haemost. 1993 Dec. 20; 70 (6): 978-83). Это объясняется тем, что успешный тромболиз некоторым образом приводит к пониженному фосфорилированию Ser в положении 3 свободного FPA как в его свободном состоянии, так и в связанном с фибриногеном состоянии. Таким образом, по-видимому,существует негативная обратная связь между тромболизом и тромбозом, которая включает фосфорилирование FPA. Нефосфорилированный свободный FPA, по-видимому, должен быть антитромботическим. 4. Брадикинин. а) Структура брадикинина. Брадикинин представляет собой другой специфический активируемый пептид D2 по сравнению сNE2. Брадикинин представляет собой пептид, обнаруженный в 1909 г., и его описанные ранее известные действия включают: 1) сердечно-сосудистое действие (т.е. сосудосуживающее действие), 2) сенсорно-болевое восприятие (активатор рецептора) и 3) свертывание крови (т.е. путем активации выше путей протромбина (как указано выше. Брадикинин представляет собой провоспалительный пептид (RPPGFSPFR), который высвобождается из кининогена под действием фермента калликреина. Брадикинин также является сильным сосудорасширяющим средством, средством, сокращающим различные виды внесосудистой гладкой мускулатуры(например, бронхиальной), и активатором повышенной проницаемости сосудов. Он также вызывает боль, основной показатель воспаления. Из настоящего описания должно быть понятно, что существуют различные последовательности брадикинина, например последовательности брадикинина, которые могут быть получены от различных видов животных (см., например, табл. 2). Также существуют последовательности, которые могут быть получены от животных, находящихся в состоянии гибернации. Табл. 2 показывает примерный перечень последовательностей брадикинина от ряда различных животных и синтетических последовательностей. Эти последовательности можно сравнивать, и, как обсуждается в данном описании, можно получить процент идентичности для каждой из последовательностей с использованием стандартных методов. Кроме того, используя описываемые здесь способы, можно получить консенсусную последовательность. Должно быть понятно, что любое сравнение раскрываемых здесь последовательностей, которое можно осуществить для получения процента идентичности, конкретно раскрывается вместе с конкретной идентичностью. Например, радужная форель и сурок отличаются по 4 из 10 положений. Это дает приблизительно 60% идентичность между FPA радужной форели и сурка. Также должно быть понятно, что можно сравнивать и конкретные фрагменты на их идентичность. Например, фрагмент, включающий 10 аминокислот непосредственно у сайта расщепления (rppgfspf), отличается у радужной форели и сурка 2 аминокислотами, что указывает на 80% идентичность для этого фрагмента у человека и сурка. Такой тип анализа можно выполнить для каждой последовательности FPA. Как раскрывается в данном описании, раскрываемая антиинфарктная молекула, например С-концевой фрагмент FPA сурка, применима в модели крысы или мыши. В табл. 2 представлен ряд молекул брадикинина и вариантов и таблица (BK). Антиинфарктные свойства BK могут осуществляться молекулами, родственными BK, такими как В 9340, и другими производными BK, содержащими аналоги аминокислот или других химических заместителей, включенных в молекулу. Антиинфарктные свойства BK могут быть описаны, как указано ниже, с использованием, например, модели инфаркта мыши MCAO. Последовательности имеют идентичность, и эту идентичность можно определить, как описано ниже. Таблица 2 Брадикинин и типичные вариантыHyp=гидроксипролин Антиинфарктные свойства брадикинина могут осуществляться молекулами, родственными брадикинину, обладающими антиинфарктной активностью. Например, des-arg-BK обладает активностью, аналогичной или даже большей, чем сам BK. Des означает боковую цепь. Например, des-Arg9 относится кb) Функциональные аналоги брадикинина. Существуют различные варианты брадикинина, многие из которых представлены в табл. 2. Многие из этих вариантов включают нестандартные аминокислотные производные. Например, существуют аналоги Cereport (также известные как RMP-7 или лобрадамил) (Arg-Pro-Hyp-Gly-Thi-Ser-Pro-Tyr (Me)psi(CH2NH)-Arg, SEQ ID NO: 90), лизилбрадикинин (брадикинин с добавленным на N-конце лизином),брадикинин с добавленным на С-конце лизином, трифторацетатная соль 7-метоксикумарин-4-ацетил(des(Arg10, Leu9)каллидин H-Lys-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Leu, SEQ ID NO: 95). Циклические аналоги брадикинина обладают желаемыми свойствами, такими как улучшенная стабильность и повышенная активность и улучшенная специфическая активность. Циклические аналоги брадикинина раскрываются в патенте США 4187217, который включен в настоящую заявку посредством ссылки, по крайней мере, что касается материала, относящегося к вариантам брадикинина. Пример циклического варианта брадикинина показан на фиг. 18. Также существуют различные варианты брадикинина, которые содержат непептидные связи и неаминокислотные аналоги (например, патент США 5162497, который включен в настоящую заявку посредством ссылки), по крайней мере, что касается материала, относящегося к брадикинину и вариантам брадикинина. Также существует большое количество различных вариантов брадикинина и молекул, функционирующих подобно брадикинину, таких как функциональные аналоги брадикинина, которые можно найти, например,в Handbook of Experimental Pharmacology, vol. XXV. Bradikinin, Kallidin and Kallikrein. Ed. E. G. Erdos. SpringerVerlag, Berlin-Heidelberg, New York, 1970, pp. 1-768, который включен в настоящую заявку посредством ссылки, по крайней мере, что касается материала, относящегося к функциональным аналогам брадикинина. 5. Антиинфарктные свойства. Антиинфарктные свойства FPA или родственных FPA молекул (например, С-концевой фрагмент,11-мер), или брадикинина или родственных брадикинину молекул (например, DES-arg-брадикинин), или любых других антиинфарктных молекул, раскрываемых в настоящей заявке, можно оценить путем определения уменьшения объема инфаркта по сравнению с контролем. Используя модель мыши MCAO,можно определить количество инфарктной ткани после ишемического события. Объем инфаркта можно определить при помощи анализа, и, чем меньше объем инфаркта после ишемического события, тем более активной является испытываемая молекула в предотвращении и реверсировании инфаркта. Например,средний объем инфаркта можно определить как процент от общего объема ткани. Средний объем инфаркта для 11-мерного фрагмента FPA составил 18,5%, что было значительно ниже по сравнению с 54,7% для контролей (р 0,0001). Диапазон объемов инфаркта для ряда различных испытанных животных для производных FPA составил 0-44% по сравнению с 34-71% для контролей. Средний объем инфаркта для BK составил 33,2%, и 17,0% - для daBK, и 18,0% - для daBK в сочетании с С-концевым фрагментом. Средний объем инфаркта для объединенных групп BK и daBK (25,2%) был статистически значимым по сравнению с 54,7% для контрольных групп (р 0,003). Диапазон объемов инфаркта для более эффективного daBK составил 9-27% по сравнению с 34-71% для контрольных групп. Таким образом, один путь определения антиинфарктой эффективности определенной молекулы включает получение инфарктного коэффициента - отношения среднего объема инфаркта контрольной группы, например, без введения молекулы или носителя к среднему объему инфаркта, который имеет место при введении молекулы. Объем инфаркта в этом инфарктном коэффициенте сам по себе представляет отношение количества затронутой инфарктом ткани к общему объему ткани (% инфарктной ткани). Эти объемы можно определить, как раскрывается ниже. Так, антиинфарктная молекула, такая как FPA,или BK, или их производные, может представлять собой молекулу, имеющую инфарктный коэффициент больше чем 1, или больше чем или равный 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5,2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0,5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 25, 30, 35, 40, 45, 50, 60, 65, 70, 75, 80,85, 90, 100, 500, 1000, 2000, 5000, 10000, 100000, или больше. Это можно определить, рассмотрев средние объемы или абсолютные объемы для данного испытания. Другой путь определения, является ли молекула антиинфарктной молекулой, состоит просто в рассмотрении абсолютного количества затронутого инфарктом объема, обнаруженного в модели МСАО мыши после введения молекулы. Например, раскрываются антиинфарктные молекулы, такие как FPA, BK или их производные, которые обеспечивают затронутый инфарктом объем, меньше чем или равный 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 29,28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1%. Это можно определить либо как средние значения, либо как абсолютный объем из данных одного испытания. 6. Композиции, идентифицированные с использованием зависимости от состояния. В данном описании раскрываются способы идентификации молекул, которые связаны с определен- 20010860 ными физиологическими состояниями. Было определено, что раскрываемые способы функционируют,когда состояния являются очень близкими, например, по времени, физиологии и характеристикам. Один пример, который обсуждался в данном описании, представляет собой идентификацию молекул, связанных с антиинфарктной активностью, которые могут быть обнаружены у животных в состоянии гибернации. Этот способ идентификации включал сравнение фракций состояний, наиболее близко соседствующих с гибернацией, для определения разницы, а не сравнение фракций состояния гибернации с фракциями отличного от гибернации состояния. Такая концепция наиболее близкого соседства может быть применима к ряду различных физиологических состояний. Это обеспечивает определение в рамках подсостояния подсостояний и ближайших соседствующих подсостояний. Например, гибернация, пищевое поведение, сон, гипноз, качательные движения при беременности, сила притяжения, невесомость, секс,возникающая после приема пищи эйфория, психотические явления, такие как биполярное, солнечное воздействие, например, вызывающее эйфорию, темные круги в глазах, например, из-за возникающей депрессии, физические нагрузки, гипербаризм или состояния, связанные со стрессом, - все это состояния,которые могут иметь подсостояния и близко соседствующие состояния. Существуют различные физиологические проявления, которые можно отслеживать, такие как биение сердца, кровяное давление, частота дыхания, ЭЭГ или движение глаз. Это можно измерить любыми способами. Один способ обобщения и анализа таких состояний представляет собой использование нелинейного модифицированного алгоритма соотнесения размерных точек (PD2i). В течение многих лет было известно, что измерение изменения частоты сердечных сокращений (HRV) с использованием линейного стохастического алгоритма (стандартное отклонение, энергетические спектры и т.д.) можно использовать для прогнозирования возможности смерти от аритмии у госпитализированных пациентов с заболеваниями сердца. Прогнозирование (например, статистические данные, касающиеся чувствительности,специфичности и относительного риска), однако, не было очень успешным, таким образом, алгоритм не оказался клинически полезным для отдельных пациентов. Патенты США 5720924 и 5709214 показывают, что анализ HRV при помощи нелинейного детерминистического алгоритма PD2i обнаружил гораздо лучшее прогнозирование, чем линейный стохастический анализ (включены в настоящую заявку посредством ссылки, по крайней мере, что касается материала, относящегося к использованию алгоритма PD2i). Таким образом, аналитическое определение PD2i является детерминистическим и основано на причинном изменении данных. Для этого не требуется стационарности, и, на самом деле, в этом определении отслеживают непостоянные изменения данных; оно является чувствительным как к хаотическим, так и к нехаотическим линейным данным. Это аналитическое определение основано на предшествующих аналитических определениях, которые вместе являются алгоритмами для определения соотносимых размеров, и оно нечувствительно к непостоянству данных. В силу такой характеристики PD2i может прогнозировать клинический результат с большой чувствительностью и специфичностью, что недоступно для других определений. Такое прогнозирование можно улучшить при помощи алгоритма учета помех(заявка на патент США на имя Skinner, 2003). Такой нелинейный алгоритм считается полезным, поскольку способен отслеживать изменения состояния, которые со временем происходят в биологическом организме. Наиболее стохастические измерения требуют постоянства данных, что означает, что генератор данных не может изменить состояние в процессе продуцирования этих данных; т.е. его стохастические свойства не могут измениться (среднее значение, стандартное отклонение и другие параметры должны оставаться без изменения). Однако серии биологических данных постоянно меняют состояние. При решении проблемы нестационарности данных, присущей большей части, если не всем, биологических данных, прогнозирование при помощи алгоритма PD2i смерти от аритмии сегодня является клинически полезным. Раскрывается такое устройство, устройство, включающее алгоритм PD2i или аналогичный алгоритм, которое можно использовать для получения физиологических данных между состояними и подсостояниями. Такие устройства можно использовать для определения возникающих неуловимых изменений состояния (т.е. подсостояния), т.е. их можно использовать для определения физиологических отличий в рамках состояния, которые определяют два подсостояния. Такие подсостояния могут быть связаны с высвобождением целевой молекулы.a) Способ "ближайшего соседнего подсостояния". Способ ближайшего соседнего подсостояния характеризуется тем, что устанавливают присутствие двух различных состояний, т.е. подсостояний, содержащихся в рамках предыдущего состояния. Например, в состоянии гибернации, как раскрывается в данном описании, существуют, например, два разных подсостояния, возникающих в связи с брадикардией, которые использовали для идентификации молекул,защищающих от инфаркта. В процессе состояния гибернации существует подсостояние, когда внезапное пробуждение очень часто приводит к случаям смерти. Ближайшее соседнее состояние представляет собой точку в состоянии гибернации, когда пробуждение не приводит к частым случаям смерти. Сравнение подсостояния, приводящего к смерти, с ближайшим соседним подсостоянием, или контролем, не приводящим к смерти, может обеспечить очень специфические молекулярные сравнения, ассоциированные с физиологией. Таким образом, "состояние" можно рассматривать как бинарное состояние, такое как сон по сравнению с пробуждением, голод по сравнению с насыщением, болезнь по сравнению со здоровьем и т.д.- 21010860 Подсостояние можно охарактеризовать как определенное состояние в рамках состояния, которое определяется и которое дополнительно подразделяет состояние. При определении физиологии или поведения можно разграничивать одно подсостояние от другого в рамках общего состояния, являющегося контрольным. Когда такие подсостояния объединяют с методами, используемыми в протеомике и геномике,для определения молекулярных отличий, могут быть идентифицированы физиологически релевантные молекулы. Такой подход, как продемонстрировано в данном описании, позволяет определить многие молекулярные отличия, а в некоторых случаях - все отличия, связанные с физиологией.b) Различные типы состояний. Физиологические подсостояния, помимо тех, в которых присутствуют антиинфарктные молекулы,временно присутствуют для поддержания более значительного общего состояния, такого как гибернация. Например, у находящихся в состоянии гибернации беременных самок медведя, у которых отсутствует мочеиспускание, образуются комплексные молекулы во все больших и больших количествах для растущего плода, так что у них должна быть соответствующая физиология, чтобы справиться с накоплением мочевины в крови, и препятствующая, таким образом, и уремической токсичности в их собственном организме. В настоящем описании раскрываются физиологические данные, которые показывают, что мочевина с двойной меткой, инъецированная лабораторным крысам, находящимся в нормальном состоянии бодрствования (1, 2 или 3 мг/крыса), может быть стимулирована в/в инъекцией связанных с гибернацией фракций молекул (т.е. D2, D01 при дозе 20 мг/кг) с образованием мочевины с одной меткой (т.е. "рециркуляционной" мочевины). По состоянию на 3 ч после инъекции связанной с гибернацией фракции молекул, среднее значение, превышающее индивидуальное для каждого животного фоновое значение, составило примерно 50% по сравнению с контролем (в/в, ксеноальбумин, 20 мг/кг) (р 0,025) и становилось даже более значимым по состоянию на 6 ч после инъекции (р 0,01). По состоянию на 6 ч после инъекции, было обнаружено повышение скорости рециркуляции мочевины более чем в 13 раз. 7. Композиции, идентифицированные методом скрининга с использованием раскрываемых композиций/комбинаторной химии. Должно быть понятно, что то, что FPA и брадикинин обладают антиинфарктными свойствами,означает, что знание того, с чем взаимодействуют FPA и брадикинин, можно использовать для идентификации молекул, функционирующих подобно FPA и брадикинину в конкретном анализе, и затем эти молекулы могут быть испытаны в моделях инфаркта, которые были раскрыты, для определения их активности. Например, имеющуюся информацию о связывании FPA и тромбина можно использовать для выделения молекул, которые связываются с тромбином так же, как и FPA, и эти молекулы могут быть испытаны в известных моделях инфаркта. Например, раскрываются эксперименты по отбору, в которых выделяют конкурирующие ингибиторы связывания FPA и тромбина. Таким образом, существует множество путей получения антиинфарктных молекул, в том числе молекул, которые могут быть получены путем синтеза молекул, которые можно выделить методами скрининга. Также должно быть понятно, что можно выделить множество молекул, включающих, но не ограничивающихся этим, варианты белков, антитела, функциональные нуклеиновые кислоты и пептидные миметики. Далее следует обсуждение тех или других молекул, включая малые молекулы, которые могут быть определены как обладающие антиинфарктными свойствами подобно FPA и брадикинину. Должно быть понятно, что FPA и брадикинин относятся ко всем вариантам и производным FPA и брадикинина,соответственно, т.е. они обладают некоторой степенью идентичности с FPA и брадикинином. Молекулы,которые могут функционировать как FPA и/или брадикинин, но не имеют структуры на основе аминокислот, называют антиинфарктными молекулами, обладающими особыми свойствами, такими как активность FPA или активность брадикинина. Раскрываются способы получения антиинфарктной молекулы, включающие синтезирование антиинфарктной молекулы или варианта антиинфарктной молекулы, где антиинфарктная молекула может быть очищена способом, включающим: 1) взятие образца крови у находящегося в состоянии гибернации животного, 2) взятие второго образца крови у находящегося в состоянии гибернации животного, 3) сравнение образца крови со вторым образцом крови, где образец крови берут в период, составляющий меньше чем или равный 25 дней после начала гибернаци, а второй образец крови берут в период, составляющий больше чем 25 дней после начала гибернации, и где антиинфарктная молекула присутствует в больших количествах в образце крови по сравнению со вторым образцом крови. Раскрываются способы получения антиинфарктной молекулы, включающие синтезирование антиинфарктной молекулы или варианта антиинфарктной молекулы, где антиинфарктная молекула может быть очищена способом, включающим: 1) взятие образца крови у находящегося в состоянии гибернации животного, 2) взятие второго образца крови у находящегося в состоянии гибернации животного, 3) сравнение образца крови со вторым образцом крови, где образец крови берут в период, составляющий меньше чем или равный 25 дней до конца гибернации, а второй образец крови берут в период, составляющий больше чем 25 дней после начала гибернации, но больше чем за 25 дней до окончания гибернации, и где антиинфарктная молекула присутствует в больших количествах в образце крови по сравнению со вторым образцом крови.- 22010860 Также раскрываются способы идентификации антиинфарктной молекулы, включающие введение молекулы модели мыши с MCAO, сравнение антиинфарктной активности молекулы с антиинфарктой активностью FPA в модели мыши с MCAO и отбор молекулы, если антиинфарктная активность молекулы составляет по меньшей мере 20% от активности FPA. Раскрываются способы идентификации ингибитора взаимодействия между брадикинином и рецептором ангиотензина II, включающие контактирование клетки, экспрессирующей рецептор типа 2 ангиотензина II, с предполагаемым ингибитором в присутствии брадикинина; определение количества брадикинина, связавшегося с рецептора типа 2 ангиотензина II; где снижение связывания брадикинина с рецептором типа 2 ангиотензина II указывает на то, что это вещество является ингибитором. Раскрываются способы идентификации ингибитора взаимодействия между брадикинином и рецептором типа 2 ангиотензина II, включающие контактирование клетки, экспрессирующей рецептор типа 2 ангиотензина II, с предполагаемым ингибитором в присутствии брадикинина, где рецептор типа 2 ангиотензина II включает донор флуоресценции, где брадикинин включает акцептор флуоресценции; и измерение передачи энергии методом резонанса флуоресценции (FRET), где уменьшение FRET по сравнению с полученным значением FRET в клетке, которая не контактировала с предполагаемым ингибитором,указывает на присутствие ингибитора. Раскрываются способы идентификации ингибитора взаимодействия между брадикинином и рецептором типа 2 ангиотензина II, включающие контактирование клеточной системы с предполагаемым ингибитором, где клеточная система включает рецептора типа 2 ангиотензина II, где клеточная система включает брадикинин, где рецептор типа 2 ангиотензина II включает донор флуоресценции и где брадикинин включает акцептор флуоресценции; и измерение передачи энергии методом резонанса флуоресценции (FRET) до контактирования клеточной системы с предполагаемым ингибитором и после контактирования клеточной системы с предполагаемым ингибитором, где уменьшение FRET в клеточной системе, когда предполагаемый ингибитор контактировал с предполагаемым ингибитором, указывает на присутствие ингибитора. Клеточная система означает клетку, содержащую необходимые компоненты для функционирования и анализа, как раскрывается в настоящей заявке. Раскрываются способы, дополнительно включающие стадию испытания идентифицированного ингибитора в in vivo модели инфаркта и отбор молекул, уменьшающих инфаркт в моделях животных. Раскрываются способы, где предполагаемый ингибитор обнаружен в библиотеке молекул. Раскрываются способы скрининга антиинфарктной молекулы, модулирующей рецептор типа 2 ангиотензина II, включающие контактирование модели инфаркта животного, известной в качестве экспрессирующей рецептор ангиотензина II, с предполагаемой антиинфарктной молекулой в отсутствие экзогенного брадикинина; оценку на наличие инфаркта; и соотнесение отсутствия инфаркта с присутствием антиинфарктного миметика брадикинина, который модулирует рецептор ангиотензина II. Раскрываются способы скрининга антиинфарктной молекулы, которая модулирует рецептор типа 2 ангиотензина II, включающие контактирование модели инфаркта животного, известной в качестве экспрессирующей рецептор ангиотензина II, с предполагаемой антиинфарктной молекулой в отсутствие брадикинина; определение отсутствия или наличия; и соотнесение отсутствия инфаркта с присутствием антиинфарктной молекулы, которая модулирует рецептор ангиотензина II. Раскрываются способы, где предполагаемый антиинфарктный миметик представляет собой агонист или антагонист рецептора ангиотензина II. Раскрываются способы идентификации предполагаемой антиинфарктной молекулы, включающие контактирование клетки, экспрессирующей рецептор типа 2 ангиотензина II, с предполагаемой антиинфарктной молекулой в присутствии брадикинина; определение уменьшения связывания брадикинина с рецептором типа 2 ангиотензина II и соотнесение уменьшения связывания брадикинина с рецептором типа 2 ангиотензина II с присутствием антиинфарктной молекулы. Должно быть понятно, что эти способы можно использовать для обнаружения ингибиторов взаимодействия между брадикинином и рецептором типа 2 ангиотензина II. Раскрываются способы идентификации предполагаемой антиинфарктной молекулы, включающие контактирование клетки, экспрессирующей рецептор типа 2 ангиотензина II, функционально связанный с донором флуоресценции, с брадикинином, функционально связанным с акцептором флуоресценции, и предполагаемой антиинфарктной молекулой; и измерение передачи энергии методом резонанса флуоресценции (FRET), где уменьшение FRET по сравнению с величиной FRET, измеренной в клетке, которая не контактировала с предполагаемой антиинфарктной молекулой, указывает на присутствие антиинфарктной молекулы. Должно быть понятно, что раскрываемые способы могут дополнительно включать испытание выделенных соединений или композиций в модели животного, например ишемии. Например, размер инфаркта, который происходит в присутствии выделенных молекул, можно измерить и сравнить с размером инфаркта, который имеет место в отсутствие молекулы. Модели животных, как раскрывается в настоящей заявке, также можно использовать для de novo выделения антиинфарктных молекул, как раскрывается в настоящей заявке. В частности, модели животных можно использовать для конкурентного связывания предполагаемой антиинфарктной молекулы, например, с брадикинином, или FPA, или их- 23010860 вариантами или производными. Раскрываемые способы также можно использовать с библиотеками молекул для скрининга активных композиций или соединений. Обычно способы включают стадию отделения активных молекул от неактивных молекул при скрининге библиотеки, как раскрывается в настоящей заявке. Раскрываются способы лечения субъектов, нуждающихся в уменьшении инфаркта, включающие введение эффективного количества выделенных молекул с использованием раскрываемых способов. Должно быть понятно, что раскрываемые способы можно применить на практике для церебрального инфаркта, инфаркта миокарда или других типов инфаркта. Должно быть понятно, что инфаркты, представляющие собой области некротической ткани, могут возникать разными путями, но обычно инфаркт возникает в результате ишемии, или снижения количества кислорода в области ткани. Потеря кислорода и последующая реперфузия, если это происходит, могут вызвать образование некротической ткани. Раскрываемые способы разработаны для снижения эффектов ишемических событий, такие как инфаркты, вызванные реперфузией и/или кислородной недостаточностью. Такие типы событий возникают, например, во время инсульта, когда происходит блокада кровеносного сосуда в церебральной ткани, приводящая к ишемии или событиям, связанным с сердечной деятельностью, таким как сердечный приступ, где блокада коронарной артерии вызывает ишемию. Лечение ишемии обычно включает уменьшение блокады. Например, нитроглицерин лечит ишемию(раскрывает закупоренные коронарные сосуды несколько больше нормы и снимает стенокардическую боль от ишемии). Задержка кровотока вызывает ишемию. Модель MCAO у мыши воспроизводит ишемию и устанавливает стадию возникновения инфаркта, как правило, на момент 24 ч. Происходит именно предотвращение/лечение инфаркта, т.к. кровоток восстанавливается во время инъекции раскрываемых композиций, и поэтому ткань уже больше не является ишемической. Антиинфарктные молекулы иногда называют "нейропротекторными лекарственными средствами". Существует множество различных типов молекул, которые могут обладать антиинфарктной активностью, как у FPA или брадикинина. Примеры таких соединений обсуждаются ниже. а) Функциональные нуклеиновые кислоты. Функциональные нуклеиновые кислоты представляют собой молекулы нуклеиновых кислот, которые обладают специфической функцией, такой как связывание молекулы-мишени или катализ специфической реакции. Функциональные молекулы нуклеиновых кислот можно разделить на следующие категории, которые не должны рассматриваться как ограничивающие. Например, функциональные нуклеиновые кислоты включают антисмысловые молекулы, аптамеры, рибозимы, образующие триплекс молекулы и внешние направляющие последовательности. Функциональные молекулы нуклеиновых кислот могут действовать как аффекторы, ингибиторы, модуляторы и стимуляторы специфической активности,которой обладает молекула-мишень, или функциональные молекулы нуклеиновых кислот могут обладать de novo активностью, независимой от каких-либо других молекул. Функциональные молекулы нуклеиновых кислот могут взаимодействовать с любой макромолекулой, такой как ДНК, РНК, полипептиды или углеводные цепи. Таким образом, функциональные нуклеиновые кислоты могут взаимодействовать с мРНК FPA или брадикинина или молекулами, с которыми они взаимодействуют, такими как тромбин или его фрагменты, или геномной ДНК FPA или брадикинина или молекулами, с которыми они взаимодействуют, такими как тромбин или его фрагменты, или они могут взаимодействовать с полипептидом FPA или брадикинина или молекулами, с которыми они взаимодействуют, такими как тромбин или его фрагменты. Часто функциональные нуклеиновые кислоты разработаны для взаимодействия с другими нуклеиновыми кислотами на основе гомологии последовательностей между молекулой-мишенью и молекулой функциональной нуклеиновой кислоты. В других ситуациях специфическое распознавание между функциональной молекулой нуклеиновой кислоты и молекулоймишенью не основано на гомологии последовательностей между функциональной молекулой нуклеиновой кислоты и молекулой-мишенью, а, скорее, основано на образовании третичной структуры, которая позволяет осуществить специфическое распознавание. Антисмысловые молекулы предназначены для взаимодействия с являющейся мишенью молекулой нуклеиновой кислоты через происходящее по правилам либо не по правилам спаривание оснований. Взаимодействие антисмысловой молекулы и молекулы-мишени предназначено для инициации разрушения молекулы-мишени через, например, РНКазу и опосредованный распад гибрида РНК-ДНК. Альтернативно, антисмысловая молекула предназначена для прерывания функции процессинга, которая обычно должна осуществляться на молекуле-мишени, такой как транскрипция или репликация. Антисмысловые молекулы могут быть сконструированы на основе последовательности молекулы-мишени. Существуют различные способы оптимизации антисмысловой эффективности путем обнаружения наиболее доступных участков молекулы-мишени. Примеры способов включают in vitro эксперименты по отбору и исследованию модификаций ДНК с использованием DMS и DEPC. Предпочтительно, чтобы антисмысловые молекулы связывались с молекулой-мишенью с константой диссоциации (kd) меньше чем 10-6. Более предпочтительно, чтобы антисмысловые молекулы связывались с kd меньше чем 10-8. Еще более предпочтительно, чтобы антисмысловые молекулы связывались с молекулой-мишенью с kd меньше чем 10-10. Также еще более предпочтительно, чтобы антисмысловые молекулы связывались с молекулой-мишенью- 24010860 с kd меньше чем 10-12. Типичные примеры способов и процедур, которые могут быть полезными при конструировании и использовании антисмысловых молекул, можно найти в следующих патентах США (но этот перечень не является ограничивающим): 5135917, 5294533, 5627158, 5641754, 5691317, 5780607,5786138, 5849903, 5856103, 5919772, 5955590, 5990088, 5994320, 5998602, 6005095, 6007995, 6013522,6017898, 6018042, 6025198, 6033910, 6040296, 6046004, 6046319 и 6057437. Аптамеры представляют собой молекулы, которые взаимодействуют с молекулой-мишенью предпочтительно специфическим образом. Как правило, аптамеры представляют собой небольшие нуклеиновые кислоты длиной в пределах 15-50 оснований, которые складываются в определенные вторичные или третичные структуры, такие как стержнепетлевые или G-квартеты. Аптамеры могут связываться с небольшими молекулами, такими как АТР (патент США 5631146) и теофилин (патент США 5580737), а также с большими молекулами, такими как обратная транскриптаза (патент США 5786462) и тромбин(патент США 5543293). Аптамеры могут связываться с молекулой-мишенью очень прочно с kd менее чем 10-12 М. Предпочтительно, когда аптамеры связываются с молекулой-мишенью с kd меньше чем 10-6. Более предпочтительно, когда аптамеры связываются с молекулой-мишенью с kd меньше чем 10-8. Еще более предпочтительно, когда аптамеры связываются с молекулой-мишенью с kd меньше чем 10-10. Также предпочтительно, когда аптамеры связываются с молекулой-мишенью с kd меньше чем 10-12. Аптамеры могут связываться с молекулой-мишенью с высокой степенью специфичности. Например, были выделены аптамеры, которые имеют отличие более чем в 10000 раз в сродстве связывания между молекулоймишенью и другой молекулой, которая отличается только по одному положению в молекуле (патент США 5543293). Предпочтительно, когда аптамер имеет kd с молекулой-мишенью по меньшей мере в 10 раз меньше, чем kd с фоновой связывающейся молекулой. Более предпочтительно, когда аптамер имеет kd с молекулой-мишенью по меньшей мере в 100 раз меньше, чем kd с фоновой связывающейся молекулой. Еще более предпочтительно, когда аптамер имеет kd с молекулой-мишенью по меньшей мере в 1000 раз меньше, чем kd с фоновой связывающейся молекулой. Предпочтительно, когда аптамер имеет kd с молекулой-мишенью по меньшей мере в 10000 раз меньше, чем kd с фоновой связывающейся молекулой. Предпочтительно, когда осуществляют сравнение, например, полипептида, чтобы фоновая молекула представляла другой полипептид. Например, при определении специфичности аптамеров FPA или брадикинина или молекул, с которыми они взаимодействуют, таких как тромбин или его фрагменты, фоновый белок может быть сывороточным альбумином. Репрезентативные примеры получения и использования аптамеров для связывания ряда различных молекул-мишеней можно найти в следующих патентах США (но этот перечень не является ограничивающим): 5476766, 5503978, 5631146, 5731424, 5780228,5792613, 5795721, 5846713, 5858660, 5861254, 5864026, 5869641, 5958691, 6001988, 6011020, 6013443,6020130, 6028186, 6030776 и 6051698. Рибозимы представляют собой молекулы нуклеиновых кислот, способные катализировать химическую реакцию либо на внутримолекулярном, либо на межмолекулярном уровне. Таким образом, рибозимы представляют собой каталитические нуклеиновые кислоты. Предпочтительно, когда рибозимы катализируют межмолекулярные реакции. Существует много различных типов рибозимов, которые катализируют реакции нуклеазного типа или полимеразы нуклеиновых кислот, которые основаны на рибозимах, обнаруженных в природных системах, таких как рибозимы акулы-молота (например, но не ограничиваясь ими, следующие патенты США: 5334711, 5436330, 5616466, 5633133, 5646020, 5652094, 5712384,5770715, 5856463, 5861288, 5891683, 5891684, 5985621, 5989908, 5998193, 5998203, заявка WO 9858058 на изобретение Ludwig и Sproat, заявка WO 9858057 на изобретение Ludwig и Sproat, заявка WO 9718312 на изобретение Ludwig и Sproat), рибозимы в виде шпилек (например, но не ограничиваясь ими, следующие патенты США: 5631115, 5646031, 5683902, 5712384, 5856188, 5866701, 5869339 и 6022962) иtetrahymena-рибозимы (например, но не ограничиваясь ими, следующие патенты США: 5595873 и 5652107). Также существует множество рибозимов, которые не были обнаружены в природных системах,но которые были сконструированы для катализа специфических реакций de novo (например, но не ограничиваясь ими, следующие патенты США: 5580967, 5688670, 5807718 и 5910408). Предпочтительные рибозимы расщепляют РНК- или ДНК-субстраты и более предпочтительно расщепляют РНК-субстраты. Рибозимы обычно расщепляют нуклеиново-кислотные субстраты через распознавание и связывание с мишеневым субстратом с последующим расщеплением. Такое распознавание часто основано, большей частью, на происходящих по правилам и не по правилам взаимодействиях пар оснований. Такое свойство делает рибозимы особенно хорошими кандидатами для нацеливания специфического расщепления нуклеиновых кислот, поскольку распознавание являющегося мишенью субстрата основано на последовательности мишеневых субстратов. Репрезентативные примеры, как можно получить и использовать рибозимы для катализа ряда различных реакций, можно найти в следующих патентах США (но этот перечень не является ограничивающим): 5646042, 5693535, 5731295, 5811300, 5837855, 5869253, 5877021,5877022, 5972699, 5972704, 5989906 и 6017756. Образующие триплекс функциональные молекулы нуклеиновых кислот представляют собой молекулы, которые могут взаимодействовать либо с двухцепочечной, либо с одноцепочечной нуклеиновой кислотой. Когда молекулы триплекса взаимодействуют с мишеневым участком, образуется структура,называемая "триплексом", в которой присутствуют три цепи ДНК, образующие комплекс в зависимости- 25010860 от спаривания оснований как по Watson-Crick, так и по Hoogsteen. Молекулы триплекса являются предпочтительными, поскольку они могут связываться с мишеневыми участками с высоким сродством и специфичностью. Предпочтительно, чтобы образующие триплекс молекулы связывались с молекулой-мишенью с kd меньше чем 10-6. Более предпочтительно, чтобы образующие триплекс молекулы связывались с kd меньше чем 10-8. Еще более предпочтительно, чтобы образующие триплекс молекулы связывались с молекулой-мишенью с kd меньше чем 10-10. Также предпочтительно, чтобы образующие триплекс молекулы связывались с молекулой-мишенью с kd меньше чем 10-12. Репрезентативные примеры получения и использования образующих триплекс молекул для связывания ряда различных молекул-мишеней можно найти в следующих патентах США (но этот перечень не является ограничивающим): 5176996, 5645985,5650316, 5683874, 5693773, 5834185, 5869246, 5874566 и 5962426. Внешние направляющие последовательности (EGS) представляют собой молекулы, которые связываются с мишеневой молекулой нуклеиновой кислоты, образуя комплекс, и этот комплекс распознается РНКазой Р, которая расщепляет молекулу-мишень. EGS могут быть сконструированы для специфического нацеливания на выбранную молекулу РНК. РНКаза Р способствует процессингу транспортной РНК(tРНК) в клетке. Бактеримальная РНКаза Р может быть рекрутирована для расщепления, по существу,любой последовательности РНК с использованием EGS, являющегося причиной того, что мишеневый комплекс РНК:EGS имитирует природного субстрата tРНК (заявка WO 92/03566 на изобретение Yale иForster и Altman, Science 238: 407-409 (1990. Подобным образом, направляемое EGS/РНКазой Р расщепление РНК можно использовать для расщепления желаемых мишеней в эукариотических клетках (Yuan et al., Proc. Natl. Acad. Sci. USA 89: 80068010 (1992); заявка WO 93/22434 на изобретение Yale; заявка WO 95/24489 на изобретение Yale; Yuan иAltman, EMBO J. 14: 159-168 (1995), и Carrara et al., Proc. Natl. Acad. Sci. (USA) 92: 2627-2631 (1995. Репрезентативные примеры получения и использования молекул EGS для способствования расщеплению ряда различных молекул-мишеней можно найти в следующих патентах США (но этот перечень не является ограничивающим): 5168053, 5624824, 5683873, 5728521, 5869248 и 5877162.b) Комбинаторная химия. Раскрываемые композиции можно использовать в качестве мишеней для любого комбинаторного метода идентификации молекул или макромолекулярных молекул, которые взаимодействуют с раскрываемыми композициями, желаемым образом. Нуклеиновые кислоты, пептиды и родственные молекулы,раскрываемые в настоящей заявке, можно использовать в качестве мишеней для комбинаторных подходов. Также раскрываются композиции, идентифицированные при помощи комбинаторных методов или методов скрининга, в которых композиции, раскрытые в табл. 1 или 2, или их части используют в качестве мишени в комбинаторном или скрининговом протоколе или композиции, которые взаимодействуют с последовательностями, представленными в табл. 1 или 2, или их части используют в качестве мишени в комбинаторном или скрининговом протоколе. Должно быть понятно, что при использовании раскрываемых композиций в комбинаторных методах или методах скрининга можно идентифицировать молекулы, такие как макромолекулярные молекулы, которые обладают конкретными желаемыми свойствами, такими как ингибирование или стимулирование функции молекулы-мишени. Молекулы, идентифицированные и выделенные с использованием раскрываемых композиций, таких как композиции, раскрытые в табл. 1 или 2, или их части или композиции, которые взаимодействуют с последовательностями, представленными в табл. 1 или 2, или их части,также раскрываются в настоящей заявке. Таким образом, продукты, полученные с использованием комбинаторного или скринингового подхода, включающего использование раскрываемых композиций, таких как композиции, раскрытые в табл. 1 или 2, или их части или композиции, которые взаимодействуют с последовательностями, представленными в табл. 1 или 2, или их части, также считаются раскрытыми в настоящей заявке. Комбинаторная химия включает, но не ограничивается этим, все способы выделения небольших молекул или макромолекул, которые способны связываться либо с небольшой молекулой,либо с другой макромолекулой, типично, итеративным способом. Белки, олигонуклеотиды и сахара являются примерами макромолекул. Например, молекулы олигонуклеотидов с определенной функцией,каталитической или связывания лиганда, можно выделить из сложной смеси случайных олигонуклеотидов способом, который был назван "in vitro генетика" (Szostak, TIBS 19: 89, 1992). В этом способе синтезируют большую группу молекул, несущих случайные и определенные последовательности, и подвергают такую сложную смесь, например приблизительно 1015 отдельных последовательностей в 100 мкг 100 нуклеотидов РНК, некоторой селекции и обогащению. Посредством повторных циклов аффинной хроматографии и ПЦР амплификации молекул, связывающихся на колонке с лигандом, Ellington и Szostak (1990) установили, что 1 из 1010 молекул РНК образует такую структуру, которая связывается с небольшими молекулами красителя. Были также выделены молекулы ДНК, обладающие такими свойствами связывания с лигандом (Ellington and Szostak, 1992; Bock et al., 1992). Методы, направленные на выполнение аналогичных задач, существуют для небольших органических молекул, белков, антител и других макромолекул, которые известны специалистам в данной области. Набор молекул для скрининга на желаемую активность, основан ли он на небольших органических библиотеках, олигонуклеотидах или антителах, в широком смысле называют комбинаторной химией. Комбинаторные методы являются особенно подхо- 26010860 дящими для определения реакций связывания между молекулами и для выделения молекул, обладающих специфической активностью связывания, часто называемых аптамерами, когда макромолекулы представляют собой нуклеиновые кислоты. Существует множество способов выделения белков, которые обладают либо de novo активностью,либо модифицированной активностью. Например, библиотеки представления фагов использовались для выделения различных пептидов, которые взаимодействуют со специфической мишенью (см., например,патенты США 6031071; 5824520; 5596079 и 5565332, которые включены в настоящее описание посредством ссылки, по крайней мере, в том, что касается материала, относящегося к представлению фагов, и способов, относящихся к комбинаторной химии). Предпочтительный способ выделения белков, обладающих заданной функцией, описан Roberts иSzostak (Roberts R.W. and Szostak J.W. Proc. Natl. Acad. Sci. USA, 94 (23): 12997-302 (1997. Такой способ комбинаторной химии объединяет функциональную активность белков с генетической способностью нуклеиновых кислот. Образуется молекула РНК, где молекула пурамицина является ковалентно присоединенной к 3'-концу молекулы РНК. In vitro трансляция такой модифицированной молекулы РНК приводит к правильному белку, кодируемому РНК, которая подлежит трансляции. Кроме того, из-за присоединения пурамицина, пептидильного акцептора, который не может быть удлинен, растущая петидная цепь присоединяется к пурамицину, который присоединен к РНК. Таким образом, молекула белка связывается с генетическим материалом, который ее кодирует. Теперь можно осуществлять обычные процедуры отбора in vitro для выделения функциональных пептидов. По окончании процедур отбора по функции пептидов осуществляют традиционные манипуляции с нуклеиновыми кислотами для амплификации нуклеиновой кислоты, которая кодирует выбранные функциональные пептиды. После амплификации генетического материала новую РНК подвергают транскрипции с пурамицином по 3'-концу, транслируется новый пептид, и осуществляют следующий функциональный раунд отбора. Таким образом, отбор белков можно осуществлять итеративным способом, таким же, как и способ отбора нуклеиновых кислот. Транслируемый пептид регулируется последовательностью РНК, связанной с пурамицином. Эта последовательность может представлять собой любую из случайной последовательности, созданной для оптимальной трансляции (т.е. без стоп-кодонов и т.д.), или это может быть вырожденная последовательность известной молекулы РНК для поиска улучшенной или измененной функции известного пептида. Условия для амплификации нуклеиновых кислот и in vitro трансляции хорошо известны специалистам среднего уровня, и их предпочтительно осуществляют, как описано Roberts и Szostak (Roberts R.W. and Szostak J.W.Proc. Natl. Acad. Sci. USA, 94 (23): 12997-302 (1997. Следующий предпочтительный способ, относящийся к комбинаторным способам, разработанным для выделения пептидов, описан Cohen et al. (Cohen B.A., et al., Proc. Natl. Acad. Sci. USA 95 (24): 14272-7(1998. Этот способ использует и модифицирует двухгибридную технологию. Двухгибридные системы дрожжей являются полезными для определения и анализа взаимодействия белок:белок. Двухгибридная система, первоначально описанная в дрожжах Saccharomyces cerevisiae, является мощным молекулярногенетическим методом идентификации новых регуляторных молекул, специфических в отношении представляющего интерес белка (Fields and Song, Nature 340: 245-6 (1989. Cohen et al. модифицировали этот метод таким образом, чтобы можно было идентифицировать новые взаимодействия между синтетическими или полученными инженерными методами пептидными последовательностями, которые связываются с выбранной молекулой. Преимущество такой технологии в том, что выбор осуществляют во внутриклеточной среде. В этом способе используют библиотеку пептидных молекул, которые связываются с доменом кислотной активации. Выбранный пептид, например внеклеточная часть композиций, раскрытых в табл. 1 или 2, или их частей или композиций, которые взаимодействуют с последовательностями,представленными в табл. 1 или 2, или их частей, связывается с ДНК-связывающим доменом белка, активирующего транскрипцию, такого как Gal 4. Применяя двухгибридный метод к такого типа системе,можно идентифицировать молекулы, связывающиеся с FPA или брадикинином, или молекулы, с которыми они взаимодействуют, такие как тромбин, или их фрагменты. Используя методику, хорошо известную специалистам в данной области, в сочетании с различными комбинаторными библиотеками, можно выделить и охарактеризовать те небольшие молекулы или макромолекулы, которые связываются или взаимодействуют с желаемой мишенью. Можно сравнить относительное сродство связывания этих соединений и идентифицировать оптимальные соединения при помощи анализов конкурентного связывания, хорошо известных специалистам в данной области. Методы получения комбинаторных библиотек и скрининга комбинаторных библиотек для выделения молекул, которые связываются с желаемой мишенью, хорошо известны специалистам в данной области. Репрезентативные приемы и методы можно найти в следующих патентах США, но этот перечень не является ограничивающим: 5084824, 5288514, 5449754, 5506337, 5539083, 5545568, 5556762, 5565324,5565332, 5573905, 5618825, 5619680, 5627210, 5646285, 5663046, 5670326, 5677195, 5683899, 5688696,5688997, 5698685, 5712146, 5721099, 5723598, 5741713, 5792431, 5807683, 5807754, 5821130, 5831014,5834195, 5834318, 5834588, 5840500, 5847150, 5856107, 5856496, 5859190, 5864010, 5874443, 5877214,5880972, 5886126, 5886127, 5891737, 5916899, 5919955, 5925527, 5939268, 5942387, 5945070, 5948696,5958702, 5958792, 5962337, 5965719, 5972719, 5976894, 5980704, 5985356, 5999086, 6001579, 6004617,- 27010860 6008321, 6017768, 6025371, 6030917, 6040193, 6045671, 6045755, 6060596 и 6061636. Комбинаторные библиотеки могут быть получены из широкого ряда молекул при помощи различных приемов синтеза. Например, библиотеки, содержащие конденсированные 2,4-пиримидиндионы (патент США 6025371), дигидробензопираны (патенты США 60177 68 и 5821130), амидные спирты (патент США 5976894), амиды гидроксиаминокислот (патент США 5972719), углеводы (патент США 5965719),1,4-бензодиазепин-2,5-дионы (патент США 5962337), циклические соединения (патент США 5958792),амиды биариламинокислот (патент США 5948696), тиофены (патент США 5942387), трициклические тетрагидрохинолины (патент США 5925527), бензофураны (патент США 5919955), изохинолины (патент США 5916899), гидантоин и тиогидантоин (патент США 5859190), индолы (патент США 5856496), имидазолпиридоиндол и имидазолпиридобензотиофены (патент США 5856107), замещенные 2-метилен-2,3 дигидротиазолы (патент США 5847150), хинолины (патент США 5840500), РНК (патент США 5831014),содержащие метки соединения (патент США 5721099), поликетиды (патент США 5712146), субъединицы морфолино (патенты США 5698685 и 5506337), сульфамиды (патент США 5618825) и бензодиазепины (патент США 5288514). Скрининг молекул, аналогичных тромбину, для ингибирования связывания FPA представляет собой способ выделения желаемых соединений. Как используется в данном описании, комбинаторные способы и библиотеки включают традиционные методы скрининга и библиотеки, а также методы и библиотеки, используемые в повторяющихся процессах.c) Компьютерное моделирование лекарственных средств. Раскрываемые композиции можно использовать в качестве мишеней для способов молекулярного моделирования либо для идентификации структуры раскрываемых композиций, либо для идентификации потенциальных или реальных молекул, таких как небольшие молекулы, которые взаимодействуют желаемым образом с раскрываемыми композициями. Нуклеиновые кислоты, пептиды и родственные молекулы, раскрываемые в настоящей заявке, можно использовать в качестве мишеней в любой программе или способе молекулярного моделирования. Должно быть понятно, что при использовании раскрываемых композиций в способах моделирования обеспечивается возможность идентификации молекул, таких как макромолекулярные молекулы, которые обладают конкретными желаемыми свойствами, такими как ингибирование или стимулирование функции молекулы-мишени. Молекулы, идентифицированные и выделенные с использованием раскрываемых композиций, таких как композиции, раскрытые в табл. 1 или 2, или их части или композиции,которые взаимодействуют с последовательностями, представленными в табл. 1 или 2, или их части, также раскрываются в настоящей заявке. Таким образом, продукты, полученные при помощи подходов молекулярного моделирования, в которых используют раскрываемые в настоящей заявке композиции, такие как композиции, раскрытые в табл. 1 или 2, или их части или композиции, которые взаимодействуют с последовательностями, представленными в табл. 1 или 2, или их части, также считаются как раскрытые в настоящей заявке. Таким образом, один путь выделения молекул, которые связываются с выбранной молекулой, представляет собой путь через рациональный дизайн. Это достигается посредством информации о структурах и компьютерного моделирования. Методы компьютерного моделирования делают возможным визуализацию трехмерной атомной структуры выбранной молекулы и рациональный дизайн новых соединений,которые будут взаимодействовать с молекулой. Трехмерная конструкция, как правило, зависит от данных кристаллографического рентгеноструктурного анализа или данных ЯМР выбранной молекулы. Молекулярная динамика требует данных о силах, полученных в полевых исследованиях. Системы компьютерной графики позволяют прогнозировать, как новое соединение будет связываться с молекулой-мишенью, и делают возможным экспериментальное манипулирование со структурами соединения и молекулы-мишени для улучшения специфичности связывания. Для прогнозирования, каким будет взаимодействие молекула-соединение при внесении небольших изменений в одно или оба взаимодействующих вещества, необходимы программы молекулярной механики и сложные компьютерные вычислительные программы, обычно сочетаемые с предназначенными в помощь пользователю, запускаемыми при помощи меню интерфейсами между программой молекулярного конструирования и пользователем. Примерами систем молекулярного моделирования являются программы CHARMm и QUANTA, Polygen Corporation, Waltham, MA. CHARMm осуществляет функции минимизации энергии и молекулярной динамики. QUANTA осуществляет конструирование, графическое моделирование и анализ молекулярных структур. QUANTA позволяет осуществлять интерактивное конструирование, модификацию,визуализацию и анализ поведения молекул друг с другом. Многие статьи посвящены компьютерному моделированию лекарственных средств, взаимодействующих с конкретными белками, например Rotivinen, et al., 1988 Acta Pharmaceutica Fennica 97, 159-166;Ripka, New Scientist 54-57 (June 16, 1988); McKinaly and Rossmann, 1989 Annu. Rev. Pharmacol. Toxiciol. 29, 111-122; Perry and Davies, QSAR: Quantitative Structure-Активность Relationships in Drug Design pp. 189-193 (Alan R. Liss, Inc. 1989); Lewis and Dean, 1989 Proc. R. Soc. Lond. 236, 125-140 and 141-162; а также касающиеся модели фермента для компонентов нуклеиновых кислот, Askew, et al., 1989 J. Am. Chem.Soc. 111, 1082-1090. Другие компьютерные программы, которые отбирают и графически отображают химические вещества, доступны от таких фирм, как BioDesign, Inc., Pasadena, CA., Allelix, Inc, Mississauga,Ontario, Canada, и Hypercube, Inc., Cambridge, Ontario. Хотя эти программы, прежде всего, были разработаны для применения к лекарственным средствам, специфическим в отношении конкретных белков, их можно адаптировать для моделирования молекул, специфически взаимодействующих с конкретными участками ДНК или РНК после идентификации такого участка. Хотя описанное выше представлено со ссылкой на конструирование и получение соединений, которые могут влиять на связывание, можно также осуществлять скрининг библиотек известных соединений,включая натуральные продукты или синтетические химические вещества, и биологически активные вещества, включая белки, для выявления соединений, изменяющих связывание с субстратом или ферментную активность.(1) Общая характеристика антител. Термин "антитела" в данном описании используется в широком смысле и включает как поликлональные, так и моноклональные антитела. В дополнение к интактным молекулам иммуноглобулина, термин "антитела" также включает фрагменты или полимеры таких молекул иммуноглобулина и человеческие или гуманизированные варианты молекул иммуноглобулина или их фрагменты, выбранные за их способность имитировать FPA, или брадикинин, или их фрагменты, например антиинфарктные свойстваFPA, брадикинина или их фрагментов, раскрываемых в настоящей заявке. Антитела могут быть испытаны на их желаемую активность при помощи in vitro анализов, описанных в настоящей заявке, или аналогичными способами, после чего испытывают их in vivo терапевтическую и/или профилактическую активность в соответствии с известными методами клинических испытаний. Также раскрываются функциональные эквиваленты антител. Термин "моноклональное антитело", как он используется в настоящем описании, относится к антителу, полученному из, по существу, гомогенной популяции антител, т.е. отдельные антитела в пределах популяции являются идентичными, за исключением возможных естественных мутаций, которые могут присутствовать в небольшой субпопуляции молекул антител. Охватываемые настоящей заявкой моноклональные антитела конкретно включают "химерные" антитела, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям антител, которые были получены от конкретного вида или принадлежащих к конкретному классу или подклассу антител,тогда как остальная часть цепи(цепей) является идентичной или гомологичной соответствующим последовательностям антител, которые были получены от другого конкретного вида или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, если они проявляют желаемую антагонистическую активность (см. патент США 4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA,81: 6851-6855 (1984. Раскрываемые моноклональные антитела можно получить с использованием любой процедуры,обеспечивающей продуцирование антител. Например, моноклональные антитела можно получить с использованием гибридомных способов, таких как описанные Kohler and Milstein, Nature, 256: 495 (1975). В гибридомном способе мышь или другое подходящее животное-хозяин обычно иммунизируют агентом иммунизации для выработки лимфоцитов, которые продуцируют или способны продуцировать антитела,которые будут специфически связываться с агентом иммунизации. Моноклональные антитела также можно получить методами рекомбинантной ДНК, такими как описанные в патенте США 4816567 (Cabilly et al.). ДНК, кодирующую раскрываемые моноклональные антитела, можно легко выделить и секвенировать с использованием традиционных процедур (например,с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи мышиных антител). Можно также получить библиотеки антител или активных фрагментов антител и провести отбор с использованием метода представления фага, например,как описано в патенте США 5804440, Burton et al., и патенте США 6096441, Barbas et al.In vitro способы также являются подходящими для получения моновалентных антител. Расщепление антител для получения их фрагментов, в частности Fab-фрагментов, можно осуществлять с использованием рутинных процедур, известных из уровня техники. Например, расщепление можно осуществлять с использованием папаина. Примеры расщепления с использованием папаина описаны в WO 94/29348, опубликованной 22 декабря 1994, и патенте США 4342566. Папаиновое расщепление антител обычно дает два идентичных антигенсвязывающих фрагмента, называемых Fab-фрагментами, каждый включает один антигенсвязывающий сайт, и остаточный Fc-фрагмент. Обработка пепсином дает фрагмент, который включает два антигенсвязывающих сайта и который все еще способен к перекрестному связыванию с антигеном. Фрагменты, независимо от того, присоединены они к другим последовательностям или нет, также могут включать вставки, делеции, замены или другие избранные модификации конкретных областей или конкретных аминокислотных остатков, при условии, что активность антитела или фрагмента антитела существенно не меняется и не ухудшается по сравнению с немодифицированным антителом или фрагментом антитела. Такие модификации могут обеспечить некоторые дополнительные свойства, такие как- 29010860 удаление/добавление аминокислот, способных к дисульфидному связыванию, повышение биодолговечности, изменение секреторных характеристик и т.д. В любом случае, антитело или фрагмент антитела должны обладать биоактивными свойствами, такими как специфическое связывание с их родственным антигеном. Функциональные или активные участки антитела или фрагмента антитела можно определить путем мутагенеза специфического участка белка с последующей экспрессией и анализом экспрессированного полипептида. Такие способы хорошо знакомы специалистам в данной области и могут включать сайт-специфический мутагенез нуклеиновой кислоты, кодирующей антитело или фрагмент антитела(Zoller, M.J. Curr. Opin. Biotechnol. 3: 348-354, 1992). Как он использован в данном описании, термин "антитело" или "антитела" может также относиться к человеческому антителу и/или гуманизированному антителу. Многие нечеловеческие антитела (например, полученные от мышей, крыс и кроликов), естественно, являются антигенными у человека и, таким образом, могут вызвать нежелательные иммунные реакции при их введении человеку. Поэтому использование человеческих или гуманизированных антител в способах по настоящему изобретению уменьшает возможность того, что антитело, введенное человеку, вызовет нежелательную иммунную реакцию.(2) Человеческие антитела. Человеческие антитела можно получить любым методом. Примеры методов получения человеческих моноклональных антител включают методы, описанные Cole et al. (Monoclonal Antibodies and CancerTherapy, Alan R. Liss, p. 77, 1985), и Boerner et al. (J. Immunol., 147 (1): 86-95, 1991). Человеческие антитела (и их фрагменты) также можно получить при помощи библиотек представления фагов (Hoogenboom etal., J. Mol. Biol., 227: 381, 1991; Marks et al., J. Mol. Biol., 222: 581, 1991). Человеческие антитела также можно получить от трансгенных животных. Например, были описаны трансгенные мутантные мыши, способные продуцировать полный набор человеческих антител в ответ на иммунизацию (см., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90: 2551-255 (1993); Jakobovitset al., Nature, 362: 255-258 (1993); Bruggermann et al., Year in Immunol., 7: 33 (1993. Конкретно, гомозиготная делеция гена соединительной области тяжелой цепи антитела (J(H у таких мышей с мутацией в зародышевой линии приводит к полному ингибированию продукции эндогенных антител, а успешный перенос цепочки генов антител зародышевой линии человека в организм такой мутированной в зародышевой линии мыши обеспечивает продуцирование человеческих антител при введении антигена.(3) Гуманизированные антитела. Методы гуманизации антител обычно включают использование технологии рекомбинантной ДНК для манипуляции с ДНК последовательностью, кодирующей одну или несколько полипептидных цепей молекулы антитела. Следовательно, гуманизированная форма нечеловекого антитела (или его фрагмента) представляет собой химерное антитело или цепь антитела (или его фрагмент, такой как Fv, Fab, Fab' или другая антигенсвязывающая часть антитела), которое содержит часть антигенсвязывающего сайта от нечеловеческого (донорного) антитела, интегрированную в каркас человеческого (реципиентного) антитела. Для генерирования гуманизированных антител остатки одного или нескольких определяющих комплементарность участков (CDR) молекулы реципиентного (человеческого) антитела замещают остатками одного или нескольких CDR молекулы донорного (нечеловеческого) антитела, известного как обладающее желаемыми антигенсвязывающими свойствами (например, некоторой степенью специфичности и аффинности в отношении являющегося мишенью антигена). В некоторых случаях Fv-каркасные (FR) остатки человеческого антитела заменяют соответствующими остатками нечеловеческих антител. Гуманизированные антитела также могут содержать остатки, не обнаруженные ни в реципиентном антителе,ни в импортированной последовательности CDR, ни в каркасных последовательностях. Как правило,гуманизированное антитело включает один или несколько аминокислотных остатков, введенных в него из источника, не являющегося человеком. На практике гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые остатки CDR и, возможно, некоторые остатки FR замещены остатками из аналогичных сайтов в антителах грызунов. Гуманизированные антитела обычно содержат по меньшей мере часть константной области антитела (Fc), типично человеческого антитела (Jones et al., Nature, 321: 522-525 (1986), Reichmann et al., Nature, 332: 323-327 (1988), and Presta,Curr. Opin. Struct. Biol., 2: 593-596 (1992. Способы гуманизации нечеловеческих антител хорошо известны из уровня техники. Например, гуманизированные антитела могут быть генерированы в соответствии с методами Winter and co-workers(Jones et al., Nature, 321: 522-525 (1986), Riechmann et al., Nature, 332: 323-327 (1988), Verhoeyen et al.,Science, 239: 1534-1536 (1988, путем замещения соответствующих последовательностей человеческого антитела одной или несколькими последовательностями CDR грызунов. Способы, которые можно использовать для получения гуманизированных антител, также описаны в патенте США 4816567 (Cabilly et(4) Введение антител. Введение антител можно осуществить, как раскрывается ниже. Существуют также способы использования нуклеиновых кислот для доставки антител. Антитела-мимики против FPA или брадикинина ши- 30
МПК / Метки
МПК: C07K 14/00
Метки: антиинфарктные, молекулы
Код ссылки
<a href="https://eas.patents.su/30-10860-antiinfarktnye-molekuly.html" rel="bookmark" title="База патентов Евразийского Союза">Антиинфарктные молекулы</a>
Предыдущий патент: Гетероариламины-производные пиримидина и пиридазина в качестве ингибиторов гликогенсинтаза-киназы 3-бета (ингибиторов gskз)
Следующий патент: Способ коррекции функциональных расстройств организма человека
Случайный патент: Очистка грунтовых вод