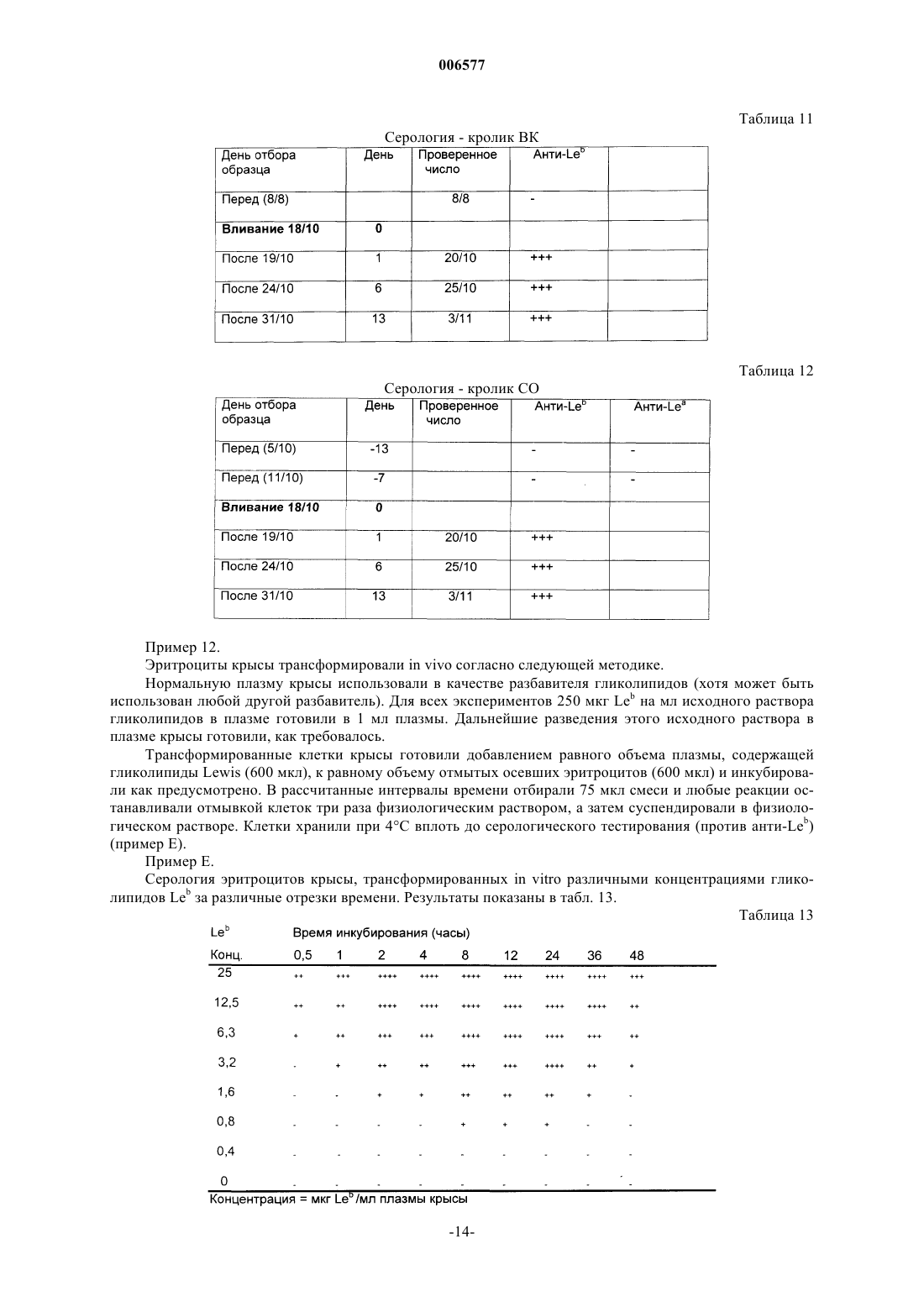
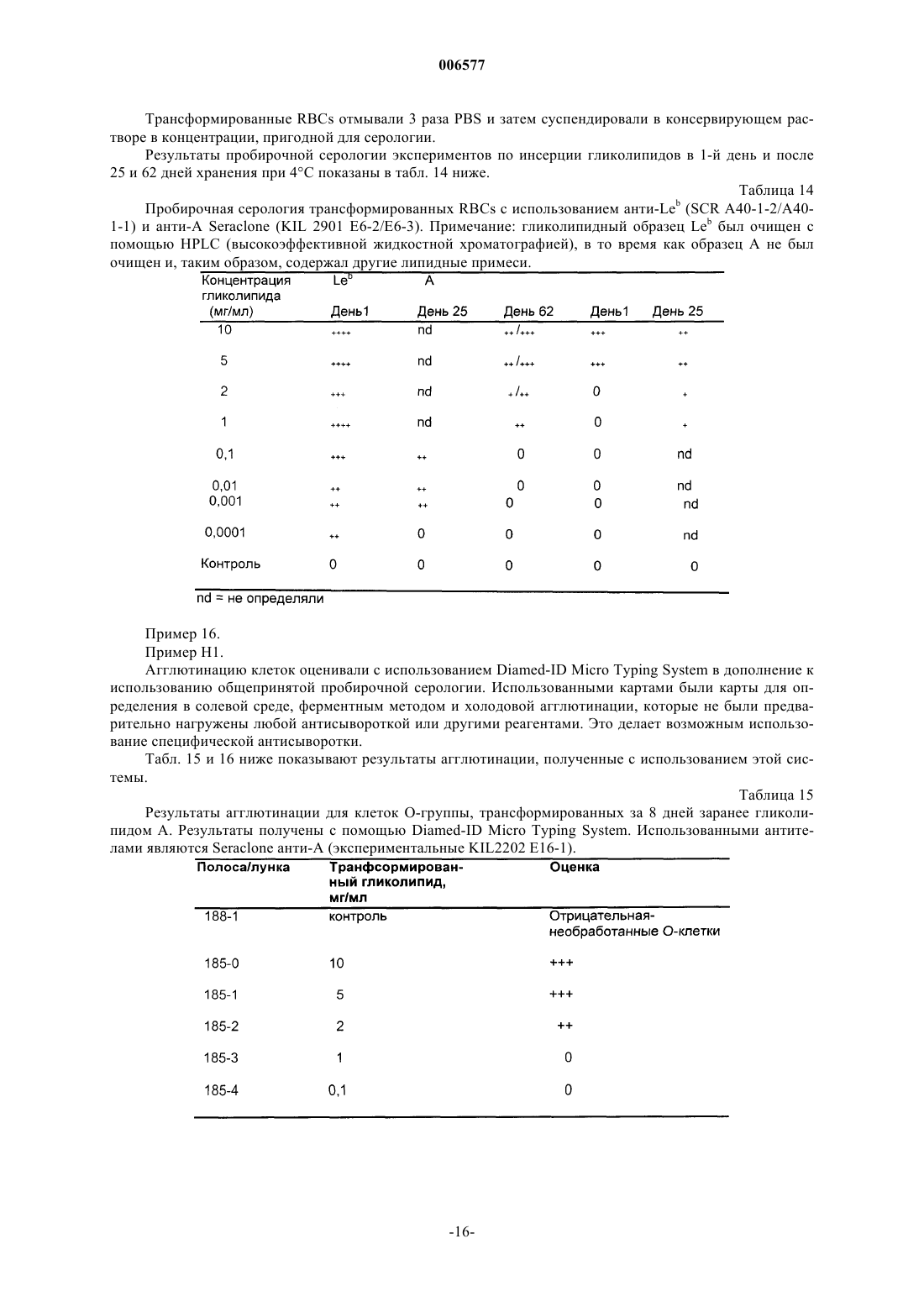
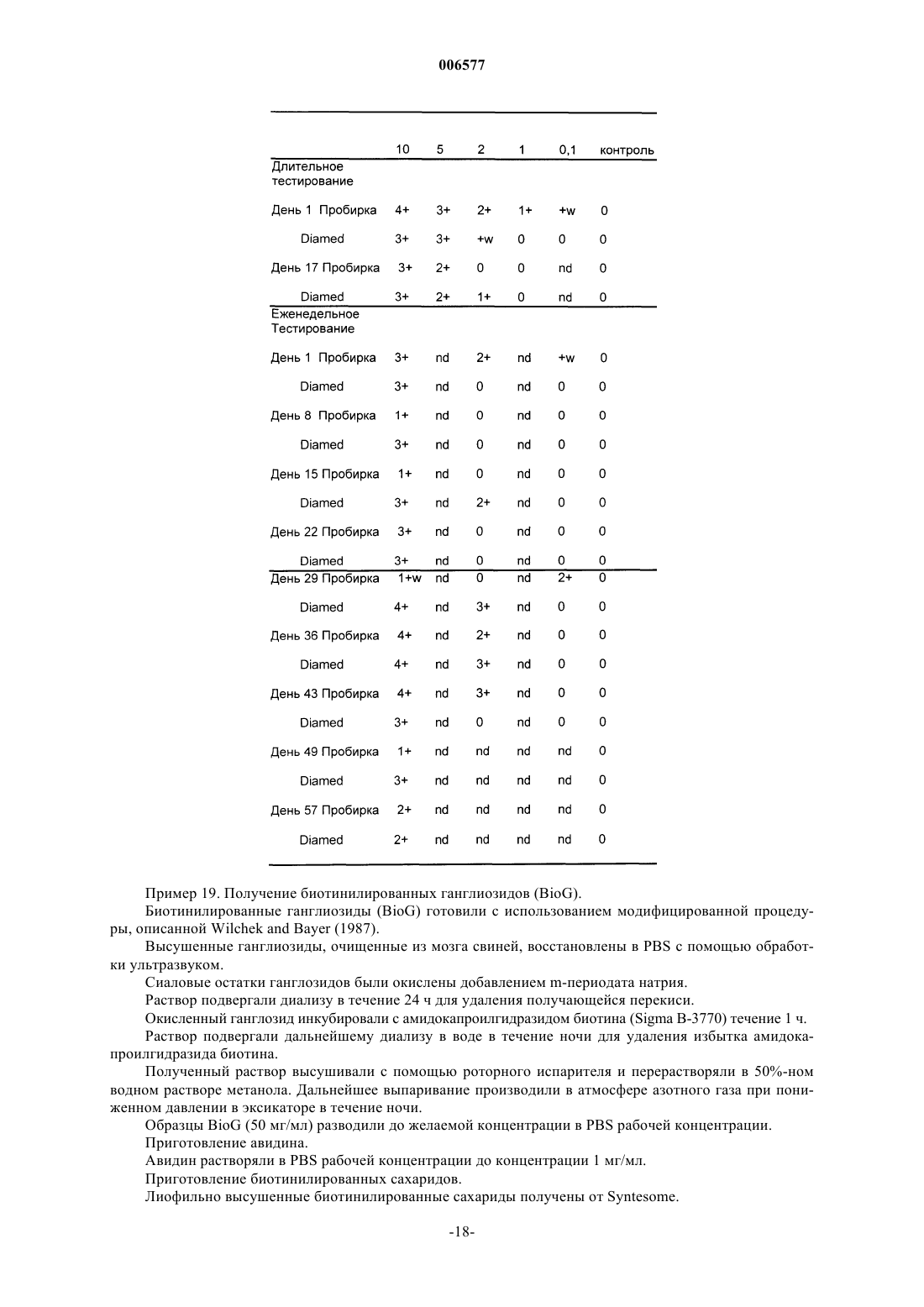
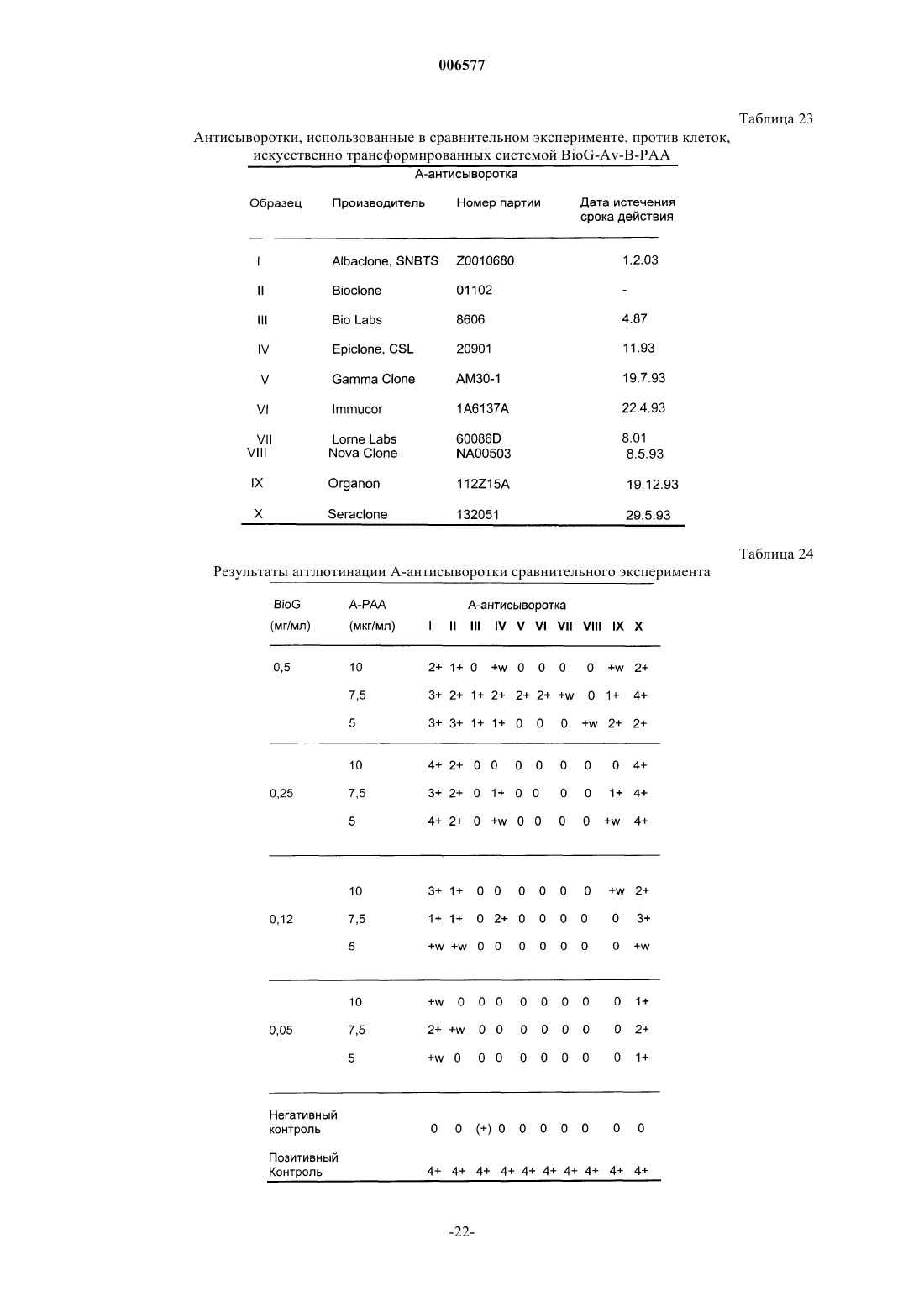
Контроли чувствительности для серологии крови, приготовленные из модифицированных клеток
Номер патента: 6577
Опубликовано: 24.02.2006
Авторы: Чен Джай, Гилливер Лисса Гуинет, Блейк Дебора Аделла, Генри Стивен Майкл
Формула / Реферат
1. Способ приготовления контроля чувствительности для определения группы крови, включающий
растворение количества антигена в воде, произвольно содержащей одну или несколько растворенных солей, для получения раствора антигена известной концентрации; и
контактирование раствора антигена с водным раствором известной концентрации клеток в течение времени и при температуре, достаточных для обеспечения встраивания (инсертирования) молекул антигена в мембраны клеток для получения трансформированных клеток; или
контактирование раствора антигена с водным раствором известной концентрации клеток, которые были модифицированы инсерцией линкерной молекулы в мембраны клеток в течение времени и при температуре, достаточных для обеспечения присоединения молекул антигена к линкерным молекулам для получения трансформированных клеток; и
отмывку трансформированных клеток отмывочным раствором и суспендирование отмытых трансформированных клеток в воде, произвольно содержащей одну или несколько растворенных солей, для получения раствора трансформированных клеток; и
определение концентрации раствора трансформированных клеток для предоставления раствору возможности быть использованным в качестве контроля чувствительности для определения группы крови.
2. Способ по п.1, где клетки водного раствора не являются модифицированными и где трансформированные клетки содержат молекулы антигена, инсертированные непосредственно в клеточные мембраны.
3. Способ по п.1, где клетки водного раствора модифицированы инсерцией линкерной молекулы и где трансформированные клетки содержат молекулы антигена, присоединенные к клеточным мембранам через линкерные молекулы.
4. Способ по п.3, где линкерная молекула включает в себя липидный хвост и "мостик", который соединяет липидный хвост с антигеном.
5. Способ по п.4, где "мостик" представляет собой биотин-авидиновый "мостик".
6. Способ по п.3, где линкерная молекула содержит биотинилированный гликолипид.
7. Способ по любому из предыдущих пунктов, где клетками являются клетки животных, растительные клетки, бактериальные клетки, или клетки, или везикулы, имеющие искусственную клеточную мембрану.
8. Способ по п.7, где клетками животных являются клетки человека.
9. Способ по п.8, где клетками человека являются эритроциты крови.
10. Способ по п.9, где эритроцитами являются эритроциты О-группы.
11. Способ по любому из пп.1-10, где антиген является гликолипидом или биотинилированным углеводом.
12. Способ по п.11, где гликолипид содержит в своем составе гликолипид, связанный с группой крови, такой как A, B, H, Lewis (Lea или Leb) или Gal(alpha) гликосфинголипид.
13. Способ по п.11, где биотинилированный углевод является биотинилированным углеводом, связанным с группой крови, таким как A, B, H, Lewis (Lea или Leb) или Gal(alpha).
14. Трансформированная клетка, полученная способом по любому из пп.1-13.
15. Трансформированная клетка по п.14 для использования в качестве контроля чувствительности реагентов или тест-систем, используемых при определении группы крови.
16. Способ для определения чувствительности реагента тестирования групп крови или тест-системы, включающий
контактирование количества контроля чувствительности, полученного способом по любому из пп.1-13, с реагентом тестирования групп крови или тест-системой для обеспечения реактивности комплекса антиген-антитело между трансформированными клетками и антителами, содержащимися в реагенте для тестирования или тест-системе,
оценку уровня реактивности комплекса антиген-антитело, и
определение чувствительности реагента для тестирования группы крови или тест-системы.
17. Способ по п.16, где уровень реактивности комплекса антиген-антитело оценивают прямой агглютинацией или индуцированной агглютинацией.
18. Способ по п.17, где агглютинацию индуцируют потенциированием, или использованием антиглобулиновых молекул, или использованием ферментов.
19. Способ по п.16, где оценку уровня реактивности комплекса антиген-антитело осуществляют использованием ферментативных меток, радиоактивных меток или флуоресцентных меток.
20. Использование контроля чувствительности, полученного способом по любому из пп.1-13, для определения эффективности одного или нескольких реагентов или тест-систем, используемых при определении группы крови.
21. Набор, содержащий подходящие компоненты для проведения определения группы крови, где набор включает в себя контроль чувствительности, полученный способом по любому из пп.1-13.
Текст
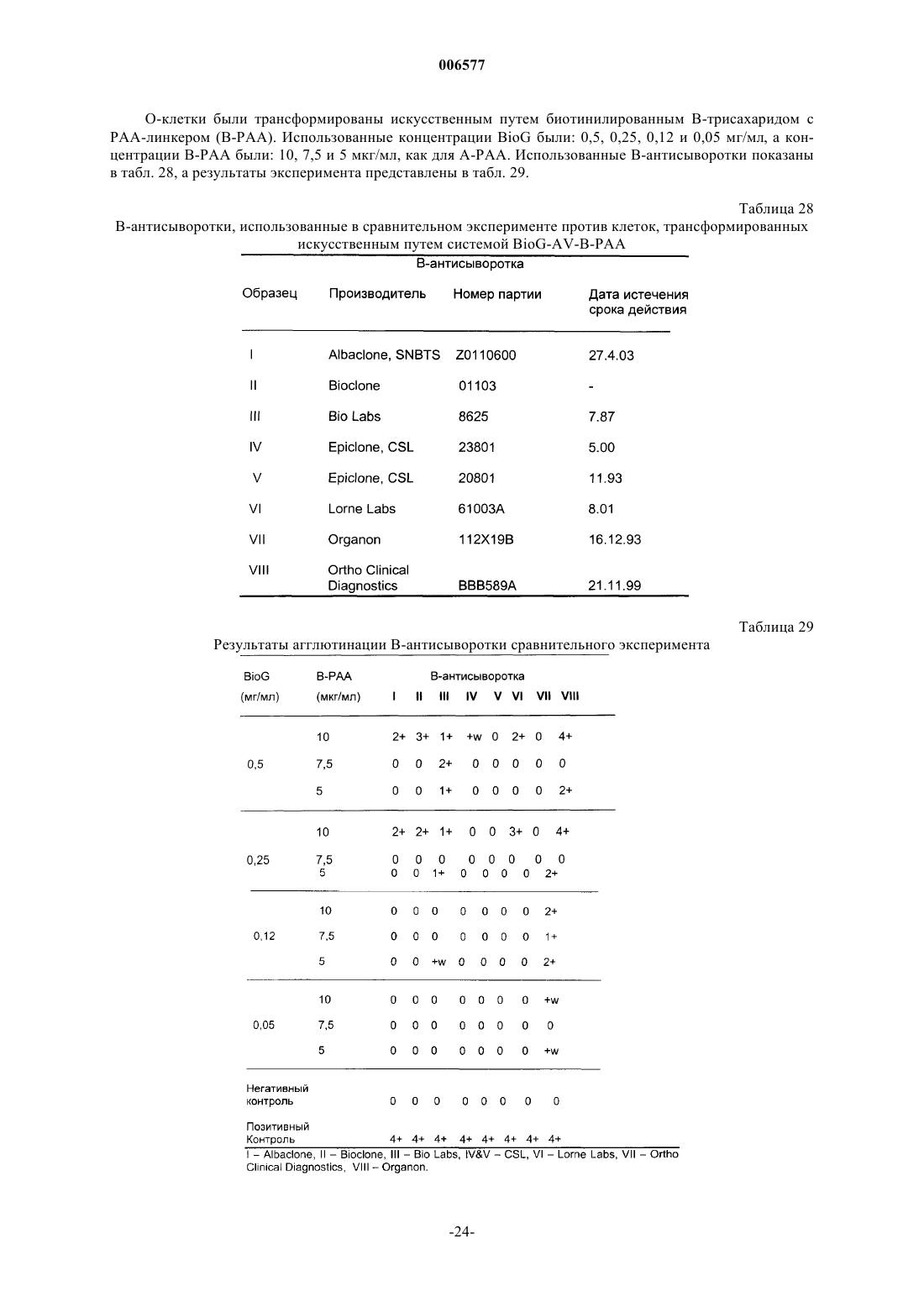
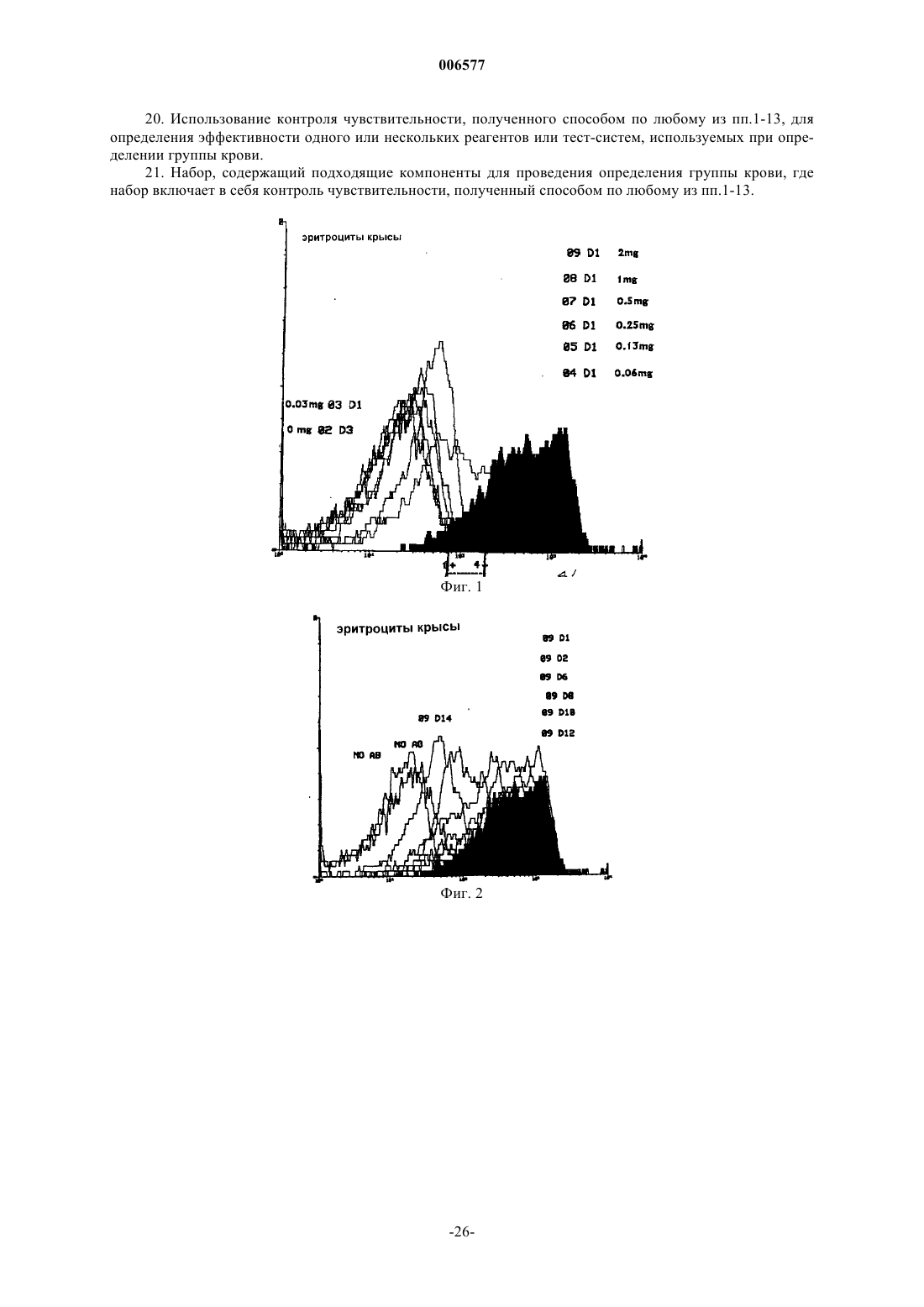
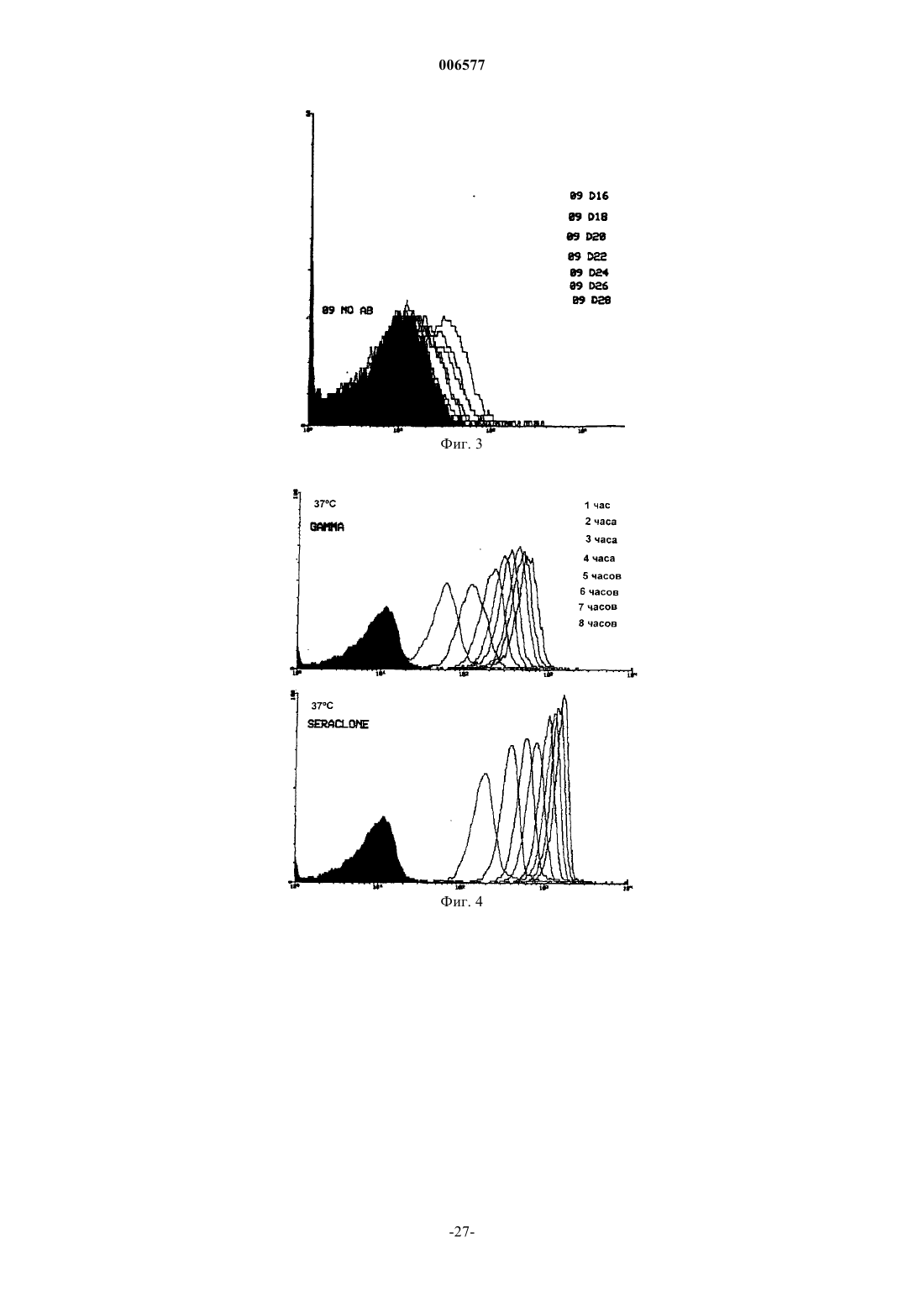
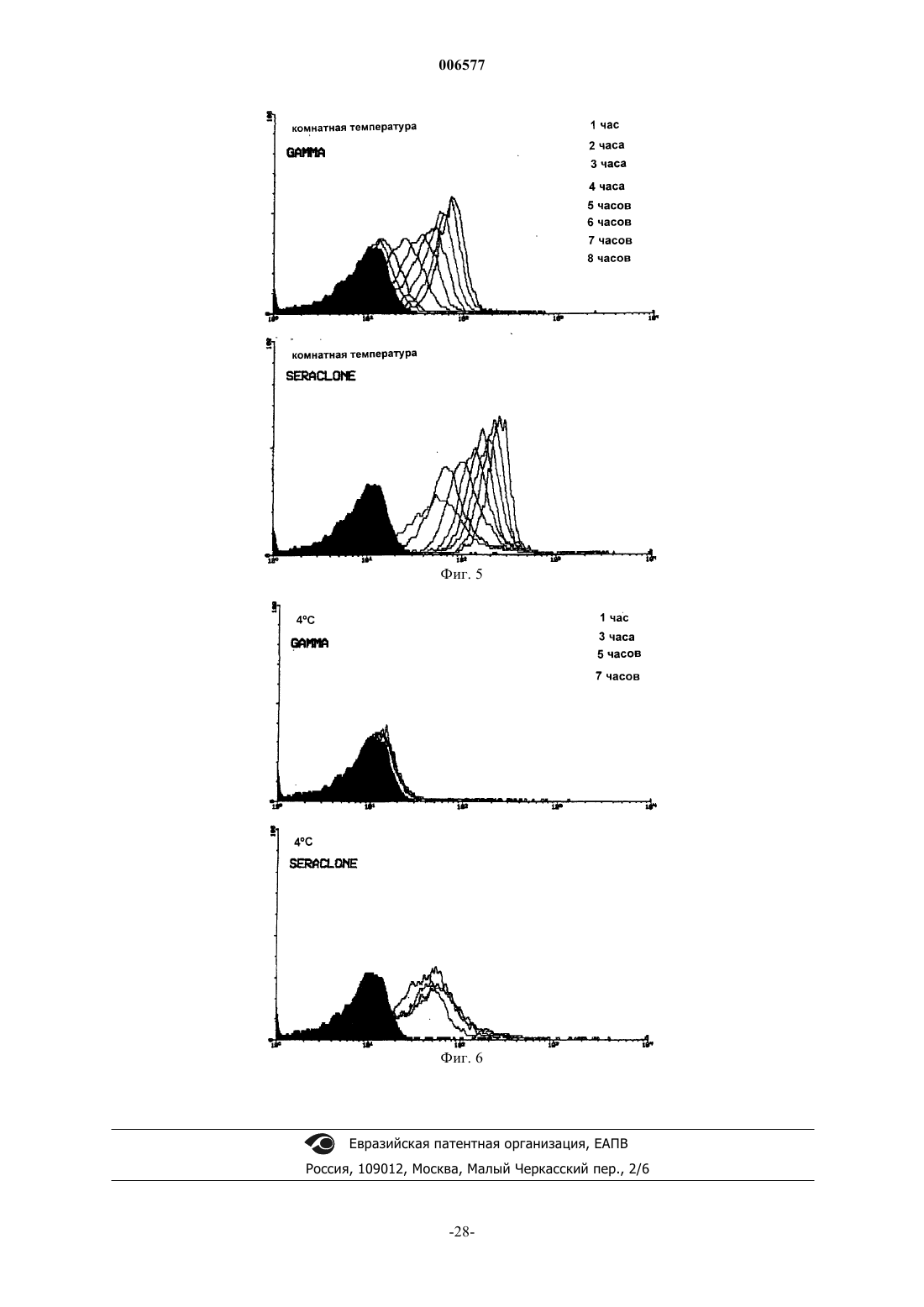
006577 Данное изобретение относится к использованию искусственно модифицированных клеток, которые экспрессируют антигены группы крови (или антигены, имеющие отношение к группе крови) для получения клеток, полезных в иммуногематологических, гематологических, иммунологических, серологических анализах в качестве контролей чувствительности. В частности, изобретение относится к контролям чувствительности для использования в медицине переливания крови, которые были приготовлены из клеток, в которые были инсертированы антигены А и/или В. Предпосылки изобретения Важной функцией центров крови является тестирование крови для точного определения типа группы крови индивидуума, от которого кровь (или другой продукт) были получены. Знание типа группы крови является существенным для разного рода терапий, включая переливание крови, пересадку органов и лечение гемолитических болезней новорожденных. В частности, тип группы крови индивидуума должен быть определен перед данным переливанием крови. Несоответствие типов групп крови может иметь пагубные последствия, потенциально сводящиеся к гибели индивидуума, которому перелили кровь. АВО-система групп крови представляет важнейшие антигены на эритроцитах (RBCs) человека для серологии переливания крови. Люди относятся к одной из четырех основных групп: А, В, АВ и О. RBCs(эритроциты) каждой группы соответственно несут А-антиген, В-антиген, оба антигена А- и В-антиген,или ни одного (нет ни А-, ни В-антигена). Естественные антитела присутствуют в крови против антигена группы крови, который отсутствует в RBCs. Таким образом, индивидуумы группы А имеют анти-В, таковые из группы В имеют анти-А, таковые из группы О имеют анти-А и анти-В и таковые из группы АВ не имеют ни одного. Перед трансфузией крови кровь должна быть проверена на перекрестную совместимость (или тестированием донорской крови против сыворотки реципиента, или проверкой крови на перекрестную совместимость электронным способом против записанных данных), чтобы быть уверенным, что RBCs одной группы не предоставляют индивидууму, обладающему антителами против них.RBCs тестируют против реагентов, содержащих известные антитела (известен как прямой метод определения группы крови), а сыворотку тестируют против RBCs, имеющими известные антигены (метод известен как обратный метод определения группы крови). Начиная с 1980-х в качестве реагентов для определения группы крови использовались моноклональные антитела (MAbs). При сравнении с традиционными поликлональными антисыворотками, реагенты, содержащие моноклональные антитела, обеспечивают повышенную специфичность, стойкую реактивность и в большинстве случаев повышенную эффективность. Обычный контроль качества систем определения групп крови (например, система гелевых карт) и реагентов является существенным в любой лаборатории банка крови. Реагенты и системы для определения групп крови могут претерпевать снижение специфичности или активности при транспортировке,хранении или в результате контаминации при хранении и использовании. Моноклональные реагенты являются необходимыми для идентифицирования всех встречающихся в природе разновидностей групп крови системы АВО, включая подгруппы А и В. Для обеспечения правильной идентификации моноклональные реагенты для определения групп крови и системы для определения групп крови в лабораториях банка крови тестируют против контрольных реагентов, содержащих эритроциты (RBC). Для этой цели в качестве контрольного реагента предпочтительными являются RBCs со слабой экспрессией антигена. Это происходит потому, что такие эритроциты могут обеспечивать лучшее показание активности антисыворотки для идентификации слабых фенотипов. В природе существуют различные формы подгрупп АВО со слабой или плохой экспрессией. Концентрации антигенов А/В внутри каждого из клеточных фенотипов являются изменчивыми и вообще неизвестны до тех пор, пока не производят исчерпывающие анализы. Использование RBCs слабых фенотипов в качестве контрольных реагентов является на практике трудным вследствие очень низкой частоты подгрупп фенотипов индивидуумов. Например, фенотип Ах определяют как 0,003% группы А, а другие подгруппы имеют даже более низкую частоту. Поэтому для этой цели могут быть пригодными искусственные эритроциты слабых фенотипов.RBCs О-группы, трансформированные в искусственные эритроциты (RBCs) А-группы, или в RBCs В-группы, или в RBCs группы АВ, по-видимому, имеют серологические сходство со слабыми фенотипами. Экспрессия этих антигенов может быть проконтролирована изменением условий инсертирования,таких как концентрация инсертированного антигена, и/или соотношением RBC к антигену для инсерции,или количеством добавленного искусственного антигена и так далее. Инсертированные антигены могут быть стабильными в мембране эритроцитов (RBC) при определенных условиях в течение по меньшей мере шести недель, а возможно и дольше. В настоящее время серологическая чувствительность моноклональных антител (антисыворотки),используемых для обнаружения клеток, которые плохо экспрессируют углеводные антигены, может определяться одним из нескольких способов: 1. Тестированием против естественно слабых подгрупп. Этот способ заключается в обнаружении редких подгрупп, приготовлении готовых к использованию клеток этой подгруппы, а затем использовании клеток в качестве контролей.-1 006577 2. Тестированием против нормальных клеток. Этот способ заключается в тестировании общих клеток и не дает никакого показателя чувствительности. 3. Разведением антисыворотки для определения активности. Оно заключается в разведении антител и тестировании против нормальных антигенов. Этот способ является наиболее распространенным в отсутствие достоверных контролей. Естественные клетки, вследствие их частоты, являются очень трудными для получения и поддержания их запаса. Кроме того, они варьируют между индивидуумами. Постоянное снабжение было бы трудным, если не невозможным. Кроме того, различные популяции имеют различные повторяемости слабых подгрупп. Нормальные клетки экспрессируют высокие уровни антигена, например, в области 500000 копий на эритроцит. При тестировании таких клеток реагенты обычно разводят, чтобы показать, что при низком разведении они все еще могут взаимодействовать с RBCs и давать серологически положительный результат. Такой способ чувствительности разведением является длительным. Кроме того, результаты экстраполируют для определения уровня выявления антигена при нормальном разведении. Такая некорректная методология, к сожалению, имеет место в большинстве мест. Обнаружение ухудшения реагентов было бы возможно только тогда, когда были бы предприняты регулярные трудоемкие исследования используемых разведений или были бы тестированы слабые подгруппы. Дополнительные проблемы могут происходить с разведением антисыворотки. Моноклональные реагенты зачастую являются биклональными и сформулированы таким образом, чтобы давать специфические рабочие характеристики. Хорошо известно, что при детектировании подгрупп АВО некоторые клоны являются лучше, чем другие. Как следствие, реагенты часто формулируют в виде смесей. Разведение таких реагентов сводит на нет их важные характерные качества, и таким образом не будет отражать истинную характеристику реагентов. Кроме того, в настоящее время многие моноклональные реагенты поступают сформулированными для тест-систем на картах и предварительно внесены внутрь тест-систем(например, гелевые карты) и таким образом не могут быть тестированы способами разведения. Многие лаборатории теперь не регулярно проводят контроль на чувствительность их реагентов для определения групп крови по системе АВО. Вместо этого они полагаются на производителя и прошлые характеристики реагентов. Альтернативно, лаборатории могут проводить серийное тестирование только на еженедельной или ежемесячной основе способом, описанным выше для способа 3. Кроме того, многие надеются на литературные результаты случайной трансфузии слабой подгруппы несовместимому реципиенту, которая показывает, что эти события являются обычно не фатальными. Предварительная проверка совместимости крови (тестирование крови донора против сыворотки реципиента) обнаружила бы несовместимость между неправильно определенной слабой подгруппой для переливания несовместимому реципиенту. Однако такие ежедневные проверки совместимости крови перед переливанием во многих центрах не проводятся, а взамен полагаются на правильное определение группы крови обоих донора и реципиента. Поэтому в настоящее время более важным является то, чтобы правильно была определена группа крови. Проблема невыполнения любого тестирования состоит в том, что реагенты для определения групп крови могут разрушаться, и клинически важная подгруппа может быть неправильно определена при типировании крови в отсутствии проверки крови на совместимость. Такая кровь может вызывать от слабой до сильной реакции трансфузии. Поэтому существует ясная потребность в реактивах контроля чувствительности, которые имеют известное предопределенное количество антигенной экспрессии и поэтому способны быть используемыми для калибровки тест-реагентов или систем тест-систем, чтобы давать аккуратные и стандартизованные определения типов групп крови. Это является предметом изобретения для обеспечения реагентов контроля чувствительности определения групп крови, или, по меньшей мере, обеспечения пригодной альтернативы. Сущность изобретения В одном аспекте изобретения предоставляют способ приготовления контроля чувствительности для определения группы крови, включающий растворение количества антигена в воде, произвольно содержащей одну или несколько растворенных солей, для получения раствора антигена известной концентрации; и контактирование раствора антигена с водным раствором известной концентрации клеток в течение времени и при температуре, достаточной для обеспечения возможности встраивания молекул антигена в клеточные мембраны для получения трансформированных клеток; или контактирование раствора антигена с водным раствором известной концентрации клеток, которые были модифицированы инсерцией линкерной молекулы в мембраны клеток в течение времени и при температуре, достаточной для обеспечения возможности присоединения молекул антигена к линкерным молекулам для получения трансформированных клеток; и отмывание трансформированных клеток водным раствором и суспендирование отмытых трансформированных клеток в воде, произвольно содержащей одну или несколько растворенных солей для получения раствора трансформированных клеток; и-2 006577 определение концентрации раствора трансформированных клеток, дающей возможность раствору быть использованным в качестве контроля чувствительности для определения группы крови. В одном варианте воплощения изобретения клетки водного раствора не являются модифицированными, а трансформированные клетки содержат антигенные молекулы, встроенные непосредственно в клеточные мембраны. В альтернативном варианте воплощения изобретения клетки водного раствора модифицируют инсерцией линкерной молекулы, а трансформированные клетки содержат антигенные молекулы, прикрепленные к клеточным мембранам через линкерные молекулы. Используемые клетки могут быть клетками любого типа, включая клетки животных, растительные клетки, бактериальные клетки, или могут быть везикулами, имеющими искусственную клеточную мембрану. Однако предпочтительным является то, что использованными клетками являются клетки животных. Далее предпочтительным является то, что клетки животных являются эритроцитами крови человека. Предпочтительным является то, что линкерная молекула включает в себя липидный хвост и мостик, который присоединяет липидный хвост к антигену. Линкерная молекула предпочтительно имеет в своем составе биотинилированный гликолипид. Один пример мостика представляет собой биотин-авидиновый мостик. Предпочтительно антиген означает гликолипид или биотинилированный углевод. Предпочтительно гликолипид означает гликолипид, связанный с группой крови, например, А, В, Н, группой Lewis, илиGаl(аlрhа)-гликосфинголипид. Предпочтительным является также то, что биотинилированный углевод является углеводом, связанным с группой крови, такой как А, В, Н, Lewis, или Gal(alpha). Во втором аспекте изобретения предоставляют трансформированную клетку, полученную способом первого аспекта данного изобретения. В другом аспекте данного изобретения предоставляют способ определения чувствительности реагента тестирования группы крови или тест-системы, включающий контактирование количества контроля чувствительности, полученного способом первого аспекта данного изобретения, с реагентом тестирования группы крови или тест-системой для обеспечения реактивности комплекса антиген-антитело между трансформированными клетками и антителами или пектинами, содержащимися в реагенте тестирования или в тест-системе; оценка уровня реактивности комплекса антиген-антитело; и определение чувствительности реагента тестирования группы крови или тест-системы. Оценка уровня реактивности комплекса антиген-антитело может быть определена прямой агглютинацией или индуцированной агглютинацией. Индуцированная агглютинация включает в себя потенцирование (усиление), или использование молекул антиглобулина, или с использованием ферментов. Предпочтительной является оценка при помощи использования ферментативных меток, радиоактивных меток или флуоресцентных меток. В дальнейшем аспекте изобретения предоставляют использование контроля чувствительности, полученного способом первого аспекта изобретения, для определения эффективности одного или нескольких реагентов или тест-систем, используемых при определениях групп крови. Другой аспект изобретения состоит в обеспечении набора, содержащего компоненты, пригодные для выполнения определения группы крови, где набор включает в себя контроль чувствительности, полученный способом первого аспекта изобретения. Краткое описание чертежей Фиг. 1 изображает результаты проточной цитометрии изменения количества гликолипида Leb при трансформации in vivo периферических эритроцитов крысы с использованием анти-Leb в качестве первичных антител; фиг. 2 изображает результаты проточной цитометрии изменения времени между 1-12 днями при трансформации in vivo периферических эритроцитов крысы с использованием анти-Lеb в качестве первичных антител; фиг. 3 изображает результаты проточной цитометрии изменения времени между 16-28 днями при трансформации in vivo периферических эритроцитов крысы с использованием анти-Leb в качестве первичных антител; фиг. 4 изображает результаты проточной цитометрии изменения времени трансформации in vitro эритроцитов крысы между 0 и 8 ч при 37 С с использованием двух различных реагентов первичных анти-Lеb; фиг. 5 изображает результаты проточной цитометрии изменения времени трансформации in vitro эритроцитов крысы между 0 и 8 ч при 22 С (при комнатной температуре) с использованием двух различных реагентов первичных анти-Lеb; фиг. 6 изображает результаты проточной цитометрии изменения времени трансформации in vitro эритроцитов крысы между 0 и 7 ч при 4 С с использованием двух различных реагентов первичных aнтиLeb.-3 006577 Подробное описание Хотя большая часть последующего описания относится к антигенам гликосфинголипидов, должно быть оценено то, что другие антигены, включающие в себя другие гликолипиды и искусственные антигены, также охвачены изобретением. Также должно быть оценено то, что термин антиген включает в себя модифицированные антигены, такие как антигены, имеющие прикрепленную молекулу, способствующую связыванию с линкерной молекулой. Например, в случае линкерной молекулы, оканчивающейся авидином, антиген будет биотинилированным антигеном. Линкерными молекулами могут быть любые молекулы, способные к связыванию антигена с липидом, который встроен в мембрану клетки. Линкерная молекула будет обычно иметь углеводный участок,объединенный с липидом мостиком, таким как биотин-авидиновый мостик. Однако могут быть использованы другие мостики, например, всякий мостик, основанный на хелатообразовании. Для предотвращения неопределенности, любая ссылка в этом описании на раствор клеток предназначена, чтобы включить в себя суспензию клеток. Гликолипиды в качестве антигенов групп крови могут быть удалены эритроцитами (RBCs) из плазмы. Это познание получено частично из исследований системы Lewis. Липиды плазмы заменяются липидами в мембране RBC, и состав фосфолипидов и жирных кислот в мембранах RBC совпадает с таковым в плазме. Следовательно, гликосфинголипиды плазмы, переносящие структуры Lewis или АВНструктуры, становятся внедренными в мембраны эритроцитов. Инсерционные технологии основаны на установившихся принципах, что гликолипидные антигены можно встроить в мембрану эритроцитов без повреждения клетки. Таким образом, количество встроенного антигена к экспрессированному антигену может быть проконтролировано созданием клеток со специфическими характерными особенностями. Такие клетки могут или иметь сходство с природными слабыми подгруппами, или с не встречающимися в природе экспрессирующими клетками группы крови. Количество экспрессированного на клетках антигена может быть установлено в соответствии с требованиями пользователей. Возможны различные уровни экспрессии, например, 5, 10, 20% или 1000, 5000 копий и так далее на эритроцит. Один контроль может быть установлен на клиническом пороге, при котором нарушение определения антигена может давать в результате клинически существенную реакцию трансфузии. Другие контроли могут быть установлены на уровнях, которые дадут уверенность в выявлении слабых подгрупп. Такие контроли могут подтверждать качества тестирования групп крови системы АВО, делая уровни чувствительности измеряемыми. Это может гарантировать обеспечение более надежной кровью, разделенной на группы по системе АВО. Контроль чувствительности по изобретению является полезным для определения чувствительности реагентов для определения групп крови и/или для тест-систем, включающих гелевые карты. Контроли чувствительности для определения слабых подгрупп для использования в медицине переливания крови готовили из клеток О-группы, в которые встраивали определенные количества антигенов А и/или В, для получения специфических оценок реакции в анализах выявления антигена. Анализы могут включать в себя способы с использованием пластинок, пробирок, гелевых карт, микропланшетов и любых,с ручным управлением или автоматических, платформ, которые используют агглютинацию, или любой другой способ обнаружения антигена (например, иммуноферментный анализ, проточная цитометрия и т.д.). Хотя предпочтительным для данного изобретения является использование эритроцитов человека,RBCs других животных могут быть использованы. Кроме того, в то время как следующее описание обращается преимущественно к RBCs, должно быть оценено то, что могут быть использованы другие клетки, например, тромбоциты, лейкоциты, растительные клетки, клетки культур клеток, бактериальные клетки и искусственные клеточные мембраны. Эритроциты, экспрессирующие встроенные антигены, могут быть созданы или in vitro, или in vivo с использованием клеток человека или клеток других животных. Создание клеток in vivo требует инъецирования специфических количеств антигена в систему кровообращения человека или животного, а затем получения крови, или немедленно, или через определенные периоды времени. Последнее продуцирует уменьшающиеся количества экспрессированного антигена (эффективно естественный титр). Этот способ может быть использован для создания клеток, экспрессирующих одни антигены, но не другие. Например, эритроциты животных могут быть использованы для создания RBCs ABO-системы, которые являются негативными для антигенов групп крови человека Kell, Duffy, Rhesus или Kidd. Агглютинация является одним критерием выявления антигенов. Агглютинация представляет собой склеивание эритроцитов, вызванное антителом или пектином, сшивающими антигены на различных клетках. Агглютинация может быть обнаружена без применения приспособлений (зрительно) или с помощью автоматических технических приемов анализаторами групп крови. Реакции агглютинации, совершаемые вручную, могут быть оценены в соответствии со следующей схемой: Оценка агглютинации Наблюдения Совсем нет скоплений Неопределенно Очень слабая реакция - видимая только с оптической помощью Слабая - очень, очень мелкие скопления Очень мелкие скопления Несколько мелких скоплений Одно большое скопление, окруженное мелкими скоплениями Одно отдельное большое скопление Чем выше концентрация раствора антигена группы А или группы В, используемого для инсерции,тем выше количество антигена, внедренного в эритроциты O-группы. Это замечено более сильной агглютинацией трансформированных RBCs с анти-А или анти-В реагентами. Более низкие концентрации антигенных растворов группы А или группы В приводят к инсерции меньшего количества А- или Вантигенов в эритроциты O-группы, выражающейся в более слабой агглютинации с анти-А-, или анти-Вреагентами. Количество встроенных антигенов является пропорциональным концентрации гликолипидов в растворе для инсерции и/или температуре и/или времени контакта.RBCs могут быть трансформированы короткими или длинноцепочечными гликолипидами. Однако кажется, нет существенного различия между этими двумя типами трансформированных RBCs в общей серологии крови при тестировании против реагентов для клеточного типирования. Похожую агглютинацию наблюдают с обоими типами при тестировании против специфической антисыворотки. ОднакоRBCs могут быть трансформированы специфическими компонентами АВО-системы. Например, могут быть созданы экспрессионные компоненты эритроцитов антигенов А (такие как Aleb или А тип 3). Такие клетки были бы важными для определения специфичности определенных антител и при скрининге панелей моноклональных антител. Эффект соотношения концентрации RBC к концентрации гликолипидов является соотношением между 1:1 и 3:1, который приводит к эффективной трансформации эритроцитов О-группы и сильной оценке агглютинации с анти-А или анти-В. Соотношение 4:1 или выше приводит к меньшей инсерции антигенов. При определенных условиях, соотношение 3:1 является наиболее экономичным соотношением для получения сильной серологической оценки. Однако, если желателен слабый фенотип, то может быть использовано более высокое соотношение RBCs. Концентрированные растворы гликолипидов могут эффективно инсертировать антигены в RBCs в течение 2 ч. Более длительное время инкубации приводит к лучшей инсерции, хотя после продолжительного времени (32 ч) серология ухудшается (см. пример 5). Считают, что это ухудшение происходит скорее из-за ухудшения RBCs после продолжительной инкубации при 37 С, чем из-за потери антигена. Время, взятое для инсерции молекул антигена в клеточные мембраны, зависит от удельных концентраций раствора антигена, и от раствора клеток, и от температуры. Однако является предпочтительным,что для раствора антигена с концентрацией приблизительно 10 мг/мл и соотношения осевших эритроцитов 3:1 при 25 С время инсерции составляет приблизительно 4 ч. Изменения в условиях инсерции могут позволить контролирование экспрессии антигена на RBCs. Если желательны слабые А-клетки или слабые В-клетки, то для инсерции может быть использована низкая концентрация гликолипидов, или высокие соотношения RВСs:гликолипид. Ели необходимы сильно агглютинирующие фенотипы, то высокие концентрации раствора гликолипидов или более низкие соотношения RВСs:гликолипид могут дать наиболее сильную серологию. Манипулированием гликолипидных концентраций могут быть созданы RBCs, которые экспрессируют в 20 раз большее количество антигена, чем в норме обнаруженное в мембране RBC. Основное преимущество изобретения состоит в том, что количество антигенной экспрессии может быть проконтролировано для соответствия требованиям специфической чувствительности. Например,одна клетка могла бы содержать количество антигенов, которое коррелирует с уровнем клинической значимости. Следовательно, если такая клетка продуцирует позитивный серологический результат, то пользователь может быть уверен, что они не потеряют ни один клинически важный подтип. Другая клетка могла быть установлена на пороге специфичности антигена, например, одна для каждого из различных подтипов, таким образом, обеспечивая поправку на известные уровни чувствительности. Такие клетки могли бы быть также использованы для калибровки высокочувствительных устройств, или даже могли бы быть использованы в проточно-цитометрических анализах для кривых количественного анализа антигена. Методология позволяет клеткам быть стандартизированными и быть унифицированными во всем мире. Это дало бы возможность сравнения качеств различных лабораторий различных методологий. Включение клеток в Программу проверки качества серологии переливания могло бы установить стандарт контроля качества тестирования групповых антигенов системы АВО. Существует неопровержимая потребность в производстве контролей чувствительности. Важность этого усилена, поскольку существует общее движение к патологии в лабораториях, укомплектованных мультиквалифицированными специалистами, у которых нет всестороннего опыта переливания крови. Контроль чувствительности согласно данному изобретению предпочтительно означает набор фенотипа группы А (слабый) и фенотипа группы В (слабый). Далее предпочтительным является то, что один также был бы Rh DCce (R1r), а другой Rh ce(rr). Это гарантировало бы то, что реагенты для определения группы крови как для системы АВО, так и для и системы RhD могли быть качественно проконтролиро-5 006577 ваны тем же набором клеток. Кроме того, другой набор с рядом слабых АВ-антигенов может быть полезным для более специализированных лабораторий. Альтернативно могут быть использованы клетки животных, в которых отсутствуют специфические антигены человека. Например, некоторые клетки животных были бы эквивалентны Rh-нулевым (т.е. Rh-антигены отсутствуют). Некоторые лаборатории эффективно производят контроль качества крови систем АВО и RhD, но другие этого не делают. Некоторые лаборатории производят клетки внутреннего контроля качества систем АВО и RhD (A2B R1r, О rr). Однако существует степень варьирования в этих продуктах вследствие гетерогенности фенотипов крови доноров. Контроли чувствительности по данному изобретению не обладают этими недостатками, поскольку ослабленная антигенная экспрессия является точно установленной, отсутствует вариабельность, и они являются легко доступными. Дополнительным преимуществом настоящего изобретения является то, что инсерционная жидкость, содержащая антиген, может быть высушена и может храниться без повреждения в течение длительного периода времени. Восстановление раствора для трансформации и его добавление к клеткам могло бы позволить создание малых требующихся объемов специализированных клеток, например, приобретенных В-клеток. Такая продукция в настоящее время не существует. Примеры Нижеследующие примеры предназначены просто, чтобы проиллюстрировать изобретение. Данное изобретение не должно рассматриваться как ограниченное любым из примеров. Пример 1. Гликолипидные инсерционные растворы готовили в соответствии со следующими способами. Высушенный гликолипид растворяли в смеси хлороформ:метанол (2:1) до концентрации 20 мг/мл. 200 мкл раствора гликолипидов разделяли на аликвоты в стеклянные пробирки и высушивали в атмосфере азотного газа. 300 мкл смеси метанол:вода (1:1) добавляли для растворения высушенного гликолипида. Пробирку нагревали до 37 С на водяной бане для облегчения растворения. На пробирке делали отметку на уровне 100 мкл и гликолипидный раствор высушивали при 60 С с азотным газом до уровня ниже отметки. На этом этапе выпаривали почти весь метанол в растворе и оставляли гликолипид растворенным в воде. 10 мкл 10-кратного фосфатного буферного раствора (PBS) добавляли в пробирку для установления концентрации соли. Деионизованную воду добавляли до уровня 100 мкл. Пример 2. Гликолипиды инсертировали (встраивали) в RBCs в соответствии со следующим способом. 5 мкл гликолипидного раствора для инсерции в концентрации 40 мг/мл добавляли в стеклянную культуральную пробирку. Добавляли 15 мкл раствора Celpresol и 40 мкл осевших эритроцитов О-группы. Пробирку инкубировали при 37 С в течение 2 ч с постоянным встряхиванием. Трансформированные RBCs отмывали 6 раз 0,9%-ным физиологическим раствором перед суспендированием в растворе Celpresol в концентрации 5%.Celpresol является консервирующим раствором для RBC (полученный от CSL Biosciences, Adelaide,Australia). Однако могут быть использованы солевые или другие изотонические растворы или растворы для хранения клеток. Пример 3. Следующий пример представляет собой один способ тестирования антисыворотки с использованием контроля изобретения. 1. Трансформированные RBCs промывали 3 раза 0,9% физиологическим раствором. Добавляли Celpresol в пробирки для получения суспензии эритроцитов 5%-ной концентрации. 2. Суспензию эритроцитов (25 мкл) добавляли в маленькие стеклянные пробирки. Затем добавляли антисыворотку (25 мкл). 3. Суспензию эритроцитов и антисыворотку хорошо перемешивали и крутили на иммунологической центрифуге в течение 15 с. 4. Количество агглютинации прочитывали и оценивали. Пример 4. Примеры имеющихся антител для серологического фенотипироваания, которые могут быть тестированы с использованием контролей настоящего изобретения, показаны ниже. Этот список примеров не является исчерпывающим, и другие антитела могут быть применимыми для этого изобретения. Некоторые из этих тестированных реагентов являются устаревшими и были использованы только для демонстративных целей. Пример 5. Время инкубации для инсертирования гликолипидов исследовали добавлением 180 мкл осевшихRBCs О-группы к 60 мкл растворов длинноцепочечных А или короткоцепочечных В гликолипидов с концентрациями 9,6, 4,8, 2,4, 1,2 и 0,6 мг/мл соответственно. Аликвоту 25 мкл отбирали после инкубации с гликолипидами в течение 1, 2, 4, 8, 24, 48 и 72 ч. Серологические тесты выполняли на клетках. Результаты суммированы в табл. 1 и 2.-7 006577 Таблица 1 Изучение времени инкубации на инсерцию: RBCs О-группы трансформированы нейтральными гликолипидами А и тестированы против Bioclone анти-А Таблица 2 Изучение времени инкубации на инсерцию: RBCs О-группы трансформированы нейтральными гликолипидами В и тестированы против XXX5 анти-В Пример 6. Различные объемы осевших RBCs О-группы трансформировали одним объемом раствора длинноцепочечных А или В гликолипидов соответственно в концентрации 9,6 мг/мл. Результаты суммированы в табл. 3. Соотношение эритроцитов (RBCs) к плазме (инсерционному раствору гликолипидов) 3:1 оказалось таким же эффективным, как и соотношение 1:1 для инсерции. При увеличении количества RBCs до 4:1, 5:1 и 6:1 количество инсерции на эритроцит (RBC) уменьшалось. Таблица 3 Изучение соотношения RBC к инсерционной жидкости гликолипидов (плазме). Различные объемы RBCs О-группы трансформировали гликолипидами группы А или группы В и тестировали против реагентов анти-А или анти-В-8 006577 Пример 7. Тестировали широкое разнообразие анти-А-, анти-В- и анти-АВ-реагентов на их эффективность против RBCs, трансформированных нейтральными А и В гликолипидами с использованием способа данного изобретения. Эритроциты тестировали на день инсерции. Эритроциты O-группы, инсертированные нейтральными гликолипидами А, тестировали против анти-А реагентов от различных производителей. Результаты представлены в табл. 4. Таблица 4RBCs О-группы, трансформированные гликолипидами группы А, тестированные против различных анти-А-реагентов (классифицированы путем оценки образцов) Реагенты от различных производителей (некоторые далеко до их даты окончания срока действия) давали огромные различия в оценке агглютинации. Как видно из табл. 4 (классифицированы путем оценки образцов), при инсерции гликолипида группы А в концентрации 9,6 мг/мл, несколько анти-Ареагентов давали оценку агглютинации с трансформированным RBC 4+ или 3+, в то время как другие давали оценку только 1+ или негативные реакции. При концентрации 0,6 мг/мл только экспериментальный реагент ХХХ 2 мог детектировать встроенные антигены. Эритроциты О-группы, трансформированные нейтральными гликолипидами А, также были протестированы против анти-АВ-реагентов от различных производителей. Результаты показаны в табл. 5. Анти-АВ-реагены также давали различные оценочные характеристики агглютинации с трансформированными RBCs.RBCs О-группы, трансформированные гликолипидами группы А,тестированные против различных анти-АВ-реагентовRBCs О-группы, трансформированные гликолипидами группы В, также тестировали против антиВ-реагентов от различных производителей. Результаты показаны в табл. 6. Таблица 6RBCs О-группы, трансформированные гликолипидами группы В, тестированные против различных анти-В-реагентов (классифицированы путем оценки образцов) Только очень немногие анти-В-реагенты могли выявлять встроенные группы В-антигенов. Среди тех реагентов, которые действовали, только Bioclone является коммерческим анти-В-реагентом. Другие являются экспериментальными реагентами.RBCs О-группы, трансформированные гликолипидами группы В, были также тестированы против анти-АВ от различных производителей. Результаты показаны в табл. 7.RBCs О-группы, трансформированные гликолипидами группы В, тестированные против различных анти-АВ-реагентов Только Biolab анти-АВ мог детектировать встроенные антигены группы В. Это человеческий поликлональный анти-АВ-реагент (который больше не является коммерчески доступным). Пример 8. Гликолипид Leb можно встроить в эритроциты (в RBCs) при суспендировании гликолипида Leb вLе(b-)плазме и смешивании с эритроцитами того же типа в различных соотношениях и инкубировании в течение 2 ч при 37 С. Результаты показаны в табл. 8. Таблица 8 Накопление Lеb-гликолипидов на поверхности Lе(b-)-клеток Пример 9. Этот пример описывает процедуру, использованную для анализа проточной цитометрией. Анализы проточной цитометрии проводили на оборудовании Facsort instrument (Becton Dickinson,San Jose, CA), действующем с программным обеспечением Lysis II. Промытые эритроциты крысы фиксировали добавлением одной части эритроцитов к 20 частям 10%-ного формалина и инкубированием в течение ночи при комнатной температуре. Фиксированные клетки отмывали 4 раза PBS и разводили в 0,5% БСА в буфере 1 (50 мМ NaCl в фосфатном буфере, рН 8,0) до конечной концентрации 5106 клеток/мл перед инкубацией с антителами Lewis. Использованные условия флуоресцентного мечения были-11 006577 основаны на работе Murai et al. (Clinica Chimica Acta, 1994, 226, 21-28). Для анализа инкубировали 100 мкл суспензии фиксированных эритроцитов при 4 С в течение 1 ч со 100 мкл анти-Lеb (Gamma 25-1,Gamma Biologicals Inc., Tx, разведенными 1:2 в буфере 1), отмывали дважды в 1 мл буфера 1 и инкубировали при 4 С в течение 1 ч со 100 мкл биотинилированных антимышиных IgM (E0465, Dako A/S, Denmark; разведенных в буфере 2, 1:400 в 0,5% БСА в 200 мМ NaCl в фосфатном буфере, рН 8,0). Затем меченные клетки дважды отмывали в 1 мл буфера 2 и инкубировали при 4 С в течение 10 мин со 100 мклRPE-Streptavidin (R0438 Dako A/S, разведенным 1:15 в буфере 3, 200 мМ NaCl в фосфатном буфере, рН 7,0), отмывали один раз в буфере 3, а затем суспендировали в 500 мкл буфера 3. Анализ проточной цитометрией проводили в течение 1 ч с подсчетом 5000 клеток для каждого образца. Пример 10. Трансформацию in vivo периферических клеток крови крысы производили с использованием следующего метода. Использовали крупные (250-300 г), инбредные, все мужские особи крыс Lewis. Такие крысы, вопреки своему названию, не экспрессируют гликолипиды Lea или Leb. Гликолипиды эмульгировали в Emulsan, липидная жидкость для парентерального введения, которая содержит 20% фракцию соевого масла, 1,2% лецитин/яичный белок и 22% глицерина, масса/объем. Серию разведений с концентрациями гликолипидов, изменяющимися от 0,03 до 2,0 мг/150 мкл, готовили из исходного раствора гликолипида в эмульсане (13,3 мкг/мкл). После анестезии (8%-ным хлоралгидратом в дозе 3,3 мл/кг) обнажали хирургическим путем яремную вену крыс и вводили 150 мкл раствора гликолипид/Emulsan. Затем место операции зашивали. Через 24 ч и после того получали приблизительно 50 мкл эритроцитов согреванием крыс под нагревательными лампами, наложением жгута на хвост и, делая небольшой прокол хвостовой вены микроланцетом, получали кровь. Эритроциты получали из цельной крови центрифугированием и отмыванием трижды. Другие клетки (например, тромбоциты, лейкоциты) могут быть получены соответствующими методами выделения. Предпринимали серологические анализы и проточную цитометрию, и их описывают ниже в примерах от А до С. Пример А. Серологические анализы с анти-Leb трансформации in vivo эритроцитов крысы. Крысы были инъецированы внутривенно различными дозами гликолипидов Leb-6. Образцы крови отбирали в дни, указанные в табл. 9. Прямую серологическую агглютинацию с анти-Lеb классифицировали от негативной (-) до очень сильно позитивной . Таблица 9 День отбора образцов крови (после введения) и проведение серологии анти-Lеb эритроцитов-12 006577 Пример В. Связь проточной цитометрии с гликолипидами in vivo с использованием анти-Lеb. Различных крыс инъецировали различными дозами гликолипидов Leb и через 1 день отбирали кровь. Результаты показаны на фиг. 1. Зона позитивной серологии показана 1+-4+. Наибольшее количество гликолипида, использованного для трансформации (2 мг), давало черную насыщенную кривую. Ненасыщенные кривые, убывающие к левой части 2-миллиграммовой кривой, представляют результаты, полученные от уменьшения количеств гликолипида. Дозы использованного гликолипида составляли 2, 1, 0,5, 0,25, 0,13, 0,06, 0,03 и 0 мг. Пример С. Проточно-цитометрический с использованием анти-Leb анализ эритроцитов крыс, трансформированных in vivo. Крыс инъецировали гликолипидами Leb в дозе 2 мг и отбирали кровь на 1, 2, 6, 8, 10, 12,16, 18, 20, 22, 24, 26, 28 день. Наивысший уровень трансформации может быть увиден в черной насыщенной кривой. Результаты представлены в последовательном порядке убывания экспрессии антигена,т.е. справа налево по дням 1, 2, 6, 8, 10, 12, 14, и отрицательные контроли фиг. 2, и дни 16, 18, 20, 22, 24,26, 28, и отрицательный контроль (черная насыщенная кривая) представлены на фиг. 3. Пример 11. Периферические клетки крови кролика трансформировали in vivo с использованием следующего метода. Гликолипиды готовили растворением 200 мг суммарных гликолипидов (группа Ale(a-b+ из тонкой кишки в 100 мкл теплого этанола. Добавляли теплый (37 С) интралипид (Pharmacia) (2 мл) с последующей короткой обработкой ультразвуком. Гликолипид вливали внутрь маргинальной ушной вены (медленное вливание). Кровь из кроликов (около 0,2-0,5 мл) отбирали до и после вливания и проводили серологическое тестирование с анти-Lеwis-реагентами (anti-Leb-Gamma Biological LBM26-1 и иногда anti-LeaGamma Biological LAM25-1) (см. пример D). Тестирование более поздних данных также заключалось в повторном тестировании более ранних образцов в качестве контролей стабильности хранящихся клеток. Клетки хранили при 4 С в консервирующем растворе для эритроцитов (Celpresol, CSL Australia). Пример D. Таблица 10 Серология - кролик МО Пример 12. Эритроциты крысы трансформировали in vivo согласно следующей методике. Нормальную плазму крысы использовали в качестве разбавителя гликолипидов (хотя может быть использован любой другой разбавитель). Для всех экспериментов 250 мкг Leb на мл исходного раствора гликолипидов в плазме готовили в 1 мл плазмы. Дальнейшие разведения этого исходного раствора в плазме крысы готовили, как требовалось. Трансформированные клетки крысы готовили добавлением равного объема плазмы, содержащей гликолипиды Lewis (600 мкл), к равному объему отмытых осевших эритроцитов (600 мкл) и инкубировали как предусмотрено. В рассчитанные интервалы времени отбирали 75 мкл смеси и любые реакции останавливали отмывкой клеток три раза физиологическим раствором, а затем суспендировали в физиологическом растворе. Клетки хранили при 4 С вплоть до серологического тестирования (против анти-Lеb)(пример Е). Пример Е. Серология эритроцитов крысы, трансформированных in vitro различными концентрациями гликолипидов Leb за различные отрезки времени. Результаты показаны в табл. 13. Таблица 13-14 006577 Пример 13. Температурную динамику определяли методом проточной цитометрии. Для этого эксперимента чувствительность метода проточной цитометрии оценивали сначала против клеток, активированных во время инкубации при 37 С в течение 3 ч с различными концентрациями Lеb-гликолипидов. Было обнаружено, что метод проточной цитометрии был наиболее достоверным для детектирования клеток, трансформированных высокими концентрациями гликолипидов, 100 мкг/мл, которые вызывают серологическую оценку 3+ или 4+ в пределах времени инкубации (результаты не представлены). В соответствии с этими результатами, эритроциты трансформировали плазмой, содержащей 250 мкг/мл (25 мкг/пробирку) в течение периодов времени, вплоть до 8 ч при трех различных температурах, 4, 22 и 37 С. Результаты оценивали методом проточной цитометрии (см. примеры F1 и F2). Пример F1. Трансформация in vitro эритроцитов Le(a-b-) человека гликолипидами Leb, в течение периода трансформации температура составляла 37 С. Реакционную способность определяли методом проточной цитометрии с использованием двух различных анти-Lеb-реагентов. Результаты показаны на фиг. 4. Черная насыщенная кривая представляет негативный контроль, т.е. нетрансформированные клетки. Незаполненные кривые слева представляют минимальное количество времени трансформации, в то время как незаполненные кривые справа представляют более длительное время. Результаты представлены в последовательном порядке, т.е. слева направо, существующие в 0, 1, 2, 3, 4, 5, 6, 7 и 8 ч. Пример F2. Трансформация in vitro эритроцитов Le(a-b-) человека гликолипидами Leb, в течение периода трансформации температура составляла 22 С (комнатная температура). Реакционную способность определяли методом проточной цитометрии с использованием двух различных анти-Lеb-реагентов. Черная насыщенная кривая представляет негативный контроль, т.е. нетрансформированные клетки. Результаты показаны на фиг. 5. Незаполненные кривые слева представляют минимальное количество времени трансформации, в то время как незаполненные кривые справа представляют более длительное время. Результаты представлены в последовательном порядке, т.е. слева направо, существующие в 0, 1, 2, 3, 4,5, 6, 7 и 8 ч. Трансформация in vitro эритроцитов Le(a-b-) человека гликолипидами Leb, в течение периода трансформации температура составляла 4 С. Реакционную способность определяли методом проточной цитометрии с использованием двух различных aнти-Leb-peaгeнтов. Результаты показаны на фиг. 6. Черная насыщенная кривая представляет негативный контроль, т.е. нетрансформированные клетки. Незаполненные кривые слева представляют минимальное количество времени трансформации, в то время как незаполненные кривые справа представляют более длительное время. Результаты представлены в последовательном порядке, т.е. слева направо, существующие в 0, 1, 3, 5 и 7 ч. Пример 14. Высушенные гликолипидные образцы с солями фосфатного буфера (PBS) готовили и восстанавливали с использованием следующих методов. Пример G1. Гликолипидные образцы готовили и высушивали, как следует ниже. Высушенный гликолипид растворяли в смеси хлороформ:метанол (2:1) до концентрации 50 мг/мл. Растворенный гликолипид (500 мкл) переносили в стеклянную пробирку. Затем добавляли рабочую концентрацию фосфатно-солевого буфера (PBS, 500 мкл или альтернативно 50 мкл 10-кратного PBS). Также добавляли небольшое количество метанола для облегчения образования однофазного раствора. Раствор высушивали в нагревательном блоке при 70 С в атмосфере азотного газа. Во время высушивания раствор периодически разделяли на две фазы и добавляли небольшое количество метанола для возвращения его в одну фазу для облегчения упаривания. Таким образом, гликолипидный раствор мог быть полностью высушен. Альтернативно, гликолипидный образец может быть заморожен при -85 С и лиофильно высушен. Пример G2. Высушенные гликолипидные образцы перерастворяли, как следует ниже. Деонизованную воду (500 мкл) добавляли к высушенным гликолипидным образцам для получения раствора гликолипидов в PBS в концентрации 50 мг/мл. Пробирку обрабатывали ультразвуком в течение 2 мин для уверенности, что образец полностью растворился. Образец мог быть затем дополнительно разведен до желаемой концентрации PBS рабочей концентрации. Пример 15. Этот способ является альтернативным и предпочтительным способом для инсерции гликолипидов вRBCs, в котором используется соотношение 3:1. Гликолипиды А-группы крови (20 мкл, 10 мг/мл) и отмытые осевшие RBCs О-группы (60 мкл) добавляли в пробирку Эппендорф. Пробирку инкубировали на водяной бане при 25 С в течение 4 ч, с перемешиванием каждый час(комнатная температура является менее стрессовой для этапа инсерции, как показано пренебрежимо малым гемолизом, сравниваемым с инкубацией при 37 С).-15 006577 Трансформированные RBCs отмывали 3 раза PBS и затем суспендировали в консервирующем растворе в концентрации, пригодной для серологии. Результаты пробирочной серологии экспериментов по инсерции гликолипидов в 1-й день и после 25 и 62 дней хранения при 4 С показаны в табл. 14 ниже. Таблица 14 Пробирочная серология трансформированных RBCs с использованием анти-Leb (SCR A40-1-2/A401-1) и анти-А Seraclone (KIL 2901 Е 6-2/Е 6-3). Примечание: гликолипидный образец Leb был очищен с помощью HPLC (высокоэффективной жидкостной хроматографией), в то время как образец А не был очищен и, таким образом, содержал другие липидные примеси. Пример 16. Пример Н 1. Агглютинацию клеток оценивали с использованием Diamed-ID Micro Typing System в дополнение к использованию общепринятой пробирочной серологии. Использованными картами были карты для определения в солевой среде, ферментным методом и холодовой агглютинации, которые не были предварительно нагружены любой антисывороткой или другими реагентами. Это делает возможным использование специфической антисыворотки. Табл. 15 и 16 ниже показывают результаты агглютинации, полученные с использованием этой системы. Таблица 15 Результаты агглютинации для клеток О-группы, трансформированных за 8 дней заранее гликолипидом А. Результаты получены с помощью Diamed-ID Micro Typing System. Использованными антителами являются Seraclone анти-А (экспериментальные KIL2202 Е 16-1).-16 006577 Таблица 16 Результаты агглютинации для клеток О-группы, трансформированных за 17 дней заранее гликолипидом А. Результаты получены с помощью Diamed-ID Micro Typing System. Использованными антителами являются анти-А Seraclone (экспериментальные KIL2202 Е 41-2). Пример Н 2. Сравнительный эксперимент проводили с использованием пробирочной серологии и системыDiamed для определения сравнительных характеристик обеих систем. Были использованы анти-А сыворотки Seraclone и Alba-clone для определения были ли эквивалентными сравнительные характеристики обеих систем. Результаты показаны в табл. 17 ниже. Таблица 17 Результаты агглютинации с использованием двух различных анти-А-сывороток - Seraclone и Albaclone. Клетки и антисыворотки тестировали в пробирках и в системе Diamed. Пример 17. Стабильность инсерции гликолипида исследовали в соответствии со следующим методом. Два набора клеток трансформировали различными концентрациями гликолипида А. Один набор тестировали на агглютинацию в 1 и 6 недели, а другой набор тестировали еженедельно. Результаты агглютинации пробирочной серологии и с системой Diamed показаны ниже в табл. 18. Клетки для еженедельного тестирования распределяли между двумя растворами для хранения клеток - CellStab и Celpresol как средство сравнения их характеристик. Все клетки хранили во флаконах с плоскими основаниями. Никаких существенных различий между двумя консервирующими растворами для клеток не было замечено, оцененных как различия в оценке агглютинации или гемолизе. В любое время клетки обнаруживали от минимального гемолиза до отсутствия гемолиза. Таблица 18 Результаты агглютинации клеток, трансформированных различными концентрациями гликолипида А. Результаты с 29-го дня и далее были получены с использованием анти-А Alba clone, все прочие результаты получены с использованием анти-А Seraclone (см. табл. 17 ниже для сравнения данных по этим двум антисывороткам). Пример 19. Получение биотинилированных ганглиозидов (BioG). Биотинилированные ганглиозиды (BioG) готовили с использованием модифицированной процедуры, описанной Wilchek and Bayer (1987). Высушенные ганглиозиды, очищенные из мозга свиней, восстановлены в PBS с помощью обработки ультразвуком. Сиаловые остатки ганглозидов были окислены добавлением m-периодата натрия. Раствор подвергали диализу в течение 24 ч для удаления получающейся перекиси. Окисленный ганглозид инкубировали с амидокапроилгидразидом биотина (Sigma B-3770) течение 1 ч. Раствор подвергали дальнейшему диализу в воде в течение ночи для удаления избытка амидокапроилгидразида биотина. Полученный раствор высушивали с помощью роторного испарителя и перерастворяли в 50%-ном водном растворе метанола. Дальнейшее выпаривание производили в атмосфере азотного газа при пониженном давлении в эксикаторе в течение ночи. Образцы BioG (50 мг/мл) разводили до желаемой концентрации в PBS рабочей концентрации. Приготовление авидина. Авидин растворяли в PBS рабочей концентрации до концентрации 1 мг/мл. Приготовление биотинилированных сахаридов. Лиофильно высушенные биотинилированные сахариды получены от Syntesome.B-PAA-biotin = Syntesome,по каталогу 186-ВР Их ресуспендировали деинизованной водой до концентрации 1 мг/мл и разводили до желаемой концентрации PBS. Метод трансформации. Метод искусственной трансформации совершали в три последовательных этапа. Сначала осуществляют инсерцию биотинилированных ганглозидов (BioG) в мембрану RBC с последующей конъюгированием авидина (Av) на биотин ганглозида и заканчивают конъюгированием биотинилированного сахарида(например, А-РАА или В-РАА) на молекулу авидина. Все начальные эксперименты проводили с А-РАА. Инсерция биотинилированного ганглозида.BioG (20 мкл, 0,01 мг/мл для клеток, предназначенных для А-РАА конъюгирования) и отмытые осевшие RBCs O-группы (60 мкл) добавляли в пробирку Эппендорф. Пробирку инкубировали на водяной бане при 25 С в течение 4 ч с перемешиванием каждый час(было обнаружено, что комнатная температура является менее стрессовой для этапа инсерции, как показано пренебрежимо малым гемолизом по сравнению с инкубацией при 37 С). Трансформированные RBCs промывали 3 раза PBS. Конъюгирование авидина. Авидин (40 мкл, 1 мг/мл) добавляли в пробирку Эппендорф, содержащую отмытые RBCs BioG(приблизительно 60 мкл эритроцитов). Пробирку инкубировали при комнатной температуре в течение 30 мин с перемешиванием, производимым через каждые 10 мин. Эритроциты Av-BioG отмывали 3 раза PBS. Конъюгирование биотинилированного сахарида. Биотинилированные сахариды (60 мкл, 0,001 мг/мл) добавляли в пробирку Эппендорф, содержащую отмытые RBCs Av-BioG (приблизительно 60 мкл эритроцитов). Пробирку инкубировали при комнатной температуре в течение 30 мин с перемешиванием, производимым через каждые 10 мин. Эритроциты BioG-Av-A-PAA отмывали 3 раза PBS и суспендировали в Celpresol до 5%-ной концентрации для серологического тестирования. Пример 20. Блочное титрование осуществляли для определения минимальных концентраций как BioG, так и АРАА, необходимых для производства RBCs, которые дают позитивную агглютинацию при тестировании против анти-А. Результаты показаны ниже в табл. 19 и 20. Таблица 19 Результаты блочного титрования для сахарида А-РАА с использованием анти-А Seraclone-19 006577 Таблица 20 Результаты блочного титрования для сахарида А-РАА с более высокими концентрациями BioG, показывающие отрицательные результаты для клеток, у которых отсутствует или BioG, или сахарид АРАА, или оба. Были использованы анти-А Seraclone. Пример 21. Стабильность концентраций BioG анализировали следующими способами. Клетки готовили с использованием BioG в концетрациях: 0,5 мг/мл, 0,25 мг/мл, 0,12 мг/мл и 0,05 мг/мл и с использованием концентраций сахарида А-РАА: 0,01 и 0,0025 мг/мл с использованием принятого метода. Затем 0,01 мг/мл клеток еженедельно тестировали для серологической оценки. Во время эксперимента не наблюдали гемолиз. Таблица 21 Результаты агглютинации клеток, трансформированных различными концентрациями BioG и АРАА. Результаты через 1 день были получены с использованием анти-А Albaclone, для всех остальных использовали анти-А Seraclone (см. табл. 6 ниже о результатах эквивалентности для этих двух антисывороток). Сравнительный эксперимент проводили с использованием пробирочной серологии, чтобы установить, являлись ли анти-А сыворотки Seraclone и Albaclone эвивалентными. Клетки трансформировали указанными концентрациями BioG и сахаридом А-РАА в концентрации 0,01 мг/мл. Таблица 22 Результаты агглютинации с использованием двух различных анти-А-сывороток - Seraclone и Albaclone. Клетки и антисыворотки тестировали только в пробирках. Пример 22. Испытание нескольких просроченных антисывороток провели на клетках, трансформированныхBioG в концентрациях 0,5, 0,25, 0,12 и 0,05 мг/мл в комбинации блочного титрования с А-РАА в концентрации 10, 7,5 и 5 мкг/мл. Использованная антисыворотка показана в табл. 23, а результаты приведены в табл. 24.I - Albaclone, II - Bioclone, III - Bio Labs, IV - CSL, V - Gamma Clone, VI - Immucor, VII - Lorne Labs,VIII - Nova Clone, IX - Organon, X - Seraclone. Некоторые из этих антисывороток тестировали в системе Diamed. Избранные результаты показаны ниже в табл. 25, 26 и 27. Таблица 25 Результаты агглютинации клеток О-группы, трансформированных отмеченными концентрациямиBioG и А-РАА. Результаты получены с помощью Diamed-ID Micro Typing System. Использованными антителами являются анти-А Albaclone (эксперимент KIL2403 Е 93-1-1). Таблица 26 Результаты агглютинации клеток О-группы, трансформированных отмеченными концентрациямиBioG и А-РАА. Результаты получены с помощью системы Diamed-ID Micro Typing System. Использованными антителами являются анти-А Albaclone (эксперимент KIL2403 Е 93-1-2). Таблица 27 Результаты агглютинации клеток О-группы, трансформированных отмеченными концентрациямиBioG и А-РАА. Результаты получены с помощью Diamed-ID Micro Typing System. Использованными антителами являются анти-А Seraclone (эксперимент KIL2403 Е 93-2-3).-23 006577 О-клетки были трансформированы искусственным путем биотинилированным В-трисахаридом с РАА-линкером (В-РАА). Использованные концентрации BioG были: 0,5, 0,25, 0,12 и 0,05 мг/мл, а концентрации В-РАА были: 10, 7,5 и 5 мкг/мл, как для А-РАА. Использованные В-антисыворотки показаны в табл. 28, а результаты эксперимента представлены в табл. 29. Таблица 28 В-антисыворотки, использованные в сравнительном эксперименте против клеток, трансформированных искусственным путем системой BioG-AV-B-РАА-24 006577 Хотя изобретение описано путем примеров, должно быть подчеркнуто, что изменения и модификации могут быть сделаны, не выходя за рамки формулы изобретения. Кроме того, поскольку известные эквиваленты существуют к определенным особенностям, то такие эквиваленты включены в эту спецификацию в виде специальных ссылок. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ приготовления контроля чувствительности для определения группы крови, включающий растворение количества антигена в воде, произвольно содержащей одну или несколько растворенных солей, для получения раствора антигена известной концентрации; и контактирование раствора антигена с водным раствором известной концентрации клеток в течение времени и при температуре, достаточных для обеспечения встраивания (инсертирования) молекул антигена в мембраны клеток для получения трансформированных клеток; или контактирование раствора антигена с водным раствором известной концентрации клеток, которые были модифицированы инсерцией линкерной молекулы в мембраны клеток в течение времени и при температуре, достаточных для обеспечения присоединения молекул антигена к линкерным молекулам для получения трансформированных клеток; и отмывку трансформированных клеток отмывочным раствором и суспендирование отмытых трансформированных клеток в воде, произвольно содержащей одну или несколько растворенных солей, для получения раствора трансформированных клеток; и определение концентрации раствора трансформированных клеток для предоставления раствору возможности быть использованным в качестве контроля чувствительности для определения группы крови. 2. Способ по п.1, где клетки водного раствора не являются модифицированными и где трансформированные клетки содержат молекулы антигена, инсертированные непосредственно в клеточные мембраны. 3. Способ по п.1, где клетки водного раствора модифицированы инсерцией линкерной молекулы и где трансформированные клетки содержат молекулы антигена, присоединенные к клеточным мембранам через линкерные молекулы. 4. Способ по п.3, где линкерная молекула включает в себя липидный хвост и мостик, который соединяет липидный хвост с антигеном. 5. Способ по п.4, где мостик представляет собой биотин-авидиновый мостик. 6. Способ по п.3, где линкерная молекула содержит биотинилированный гликолипид. 7. Способ по любому из предыдущих пунктов, где клетками являются клетки животных, растительные клетки, бактериальные клетки, или клетки, или везикулы, имеющие искусственную клеточную мембрану. 8. Способ по п.7, где клетками животных являются клетки человека. 9. Способ по п.8, где клетками человека являются эритроциты крови. 10. Способ по п.9, где эритроцитами являются эритроциты О-группы. 11. Способ по любому из пп.1-10, где антиген является гликолипидом или биотинилированным углеводом. 12. Способ по п.11, где гликолипид содержит в своем составе гликолипид, связанный с группой крови, такой как А, В, Н, Lewis (Leа или Leb) или Gal(alpha) гликосфинголипид. 13. Способ по п.11, где биотинилированный углевод является биотинилированным углеводом, связанным с группой крови, таким как А, В, Н, Lewis (Leа или Leb) или Gal(alpha). 14. Трансформированная клетка, полученная способом по любому из пп.1-13. 15. Трансформированная клетка по п.14 для использования в качестве контроля чувствительности реагентов или тест-систем, используемых при определении группы крови. 16. Способ для определения чувствительности реагента тестирования групп крови или тестсистемы, включающий контактирование количества контроля чувствительности, полученного способом по любому из пп.1-13, с реагентом тестирования групп крови или тест-системой для обеспечения реактивности комплекса антиген-антитело между трансформированными клетками и антителами, содержащимися в реагенте для тестирования или тест-системе,оценку уровня реактивности комплекса антиген-антитело, и определение чувствительности реагента для тестирования группы крови или тест-системы. 17. Способ по п.16, где уровень реактивности комплекса антиген-антитело оценивают прямой агглютинацией или индуцированной агглютинацией. 18. Способ по п.17, где агглютинацию индуцируют потенциированием, или использованием антиглобулиновых молекул, или использованием ферментов. 19. Способ по п.16, где оценку уровня реактивности комплекса антиген-антитело осуществляют использованием ферментативных меток, радиоактивных меток или флуоресцентных меток.-25 006577 20. Использование контроля чувствительности, полученного способом по любому из пп.1-13, для определения эффективности одного или нескольких реагентов или тест-систем, используемых при определении группы крови. 21. Набор, содержащий подходящие компоненты для проведения определения группы крови, где набор включает в себя контроль чувствительности, полученный способом по любому из пп.1-13.
МПК / Метки
МПК: G01N 33/96, G01N 33/80
Метки: модифицированных, контроли, клеток, чувствительности, приготовленные, серологии, крови
Код ссылки
<a href="https://eas.patents.su/29-6577-kontroli-chuvstvitelnosti-dlya-serologii-krovi-prigotovlennye-iz-modificirovannyh-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Контроли чувствительности для серологии крови, приготовленные из модифицированных клеток</a>
Предыдущий патент: Аппарат для дображивания, и/или хранения, и/или транспортировки, и/или розлива пива
Следующий патент: Гидрофобные агонисты допамина, введенные в дерму
Случайный патент: Жидкие составы, содержащие диалкилсульфосукцинат и ингибиторы гидроксифенилпируват-диоксигеназы