Лечение и диагностика рака
Формула / Реферат
1. Изолированное моноклональное антитело или его антигенсвязывающий участок, которые связываются с внеклеточным доменом простатспецифического мембранного антигена (PSMA), где антитело или его антигенсвязывающий участок связываются с живыми клетками.
2. Изолированное поликлональное антитело или его антигенсвязывающий участок, которые связываются с внеклеточным доменом простатспецифического мембранного антигена (PSMA), где антитело или его антигенсвязывающий участок связываются с живыми клетками.
3. Антитело или его антигенсвязывающий участок по п.1 или 2, которые позволяют использовать агенты, активные в клетке.
4. Изолированное антитело или его антигенсвязывающий участок по пп.1-3, где антитело или его антигенсвязывающий участок представляют собой IgG.
5. Изолированное антитело или его антигенсвязывающий участок по пп.1-4, выбранные из группы, состоящей из Fab-фрагмента, F(ab')2-фрагмента и Fv-фрагмента.
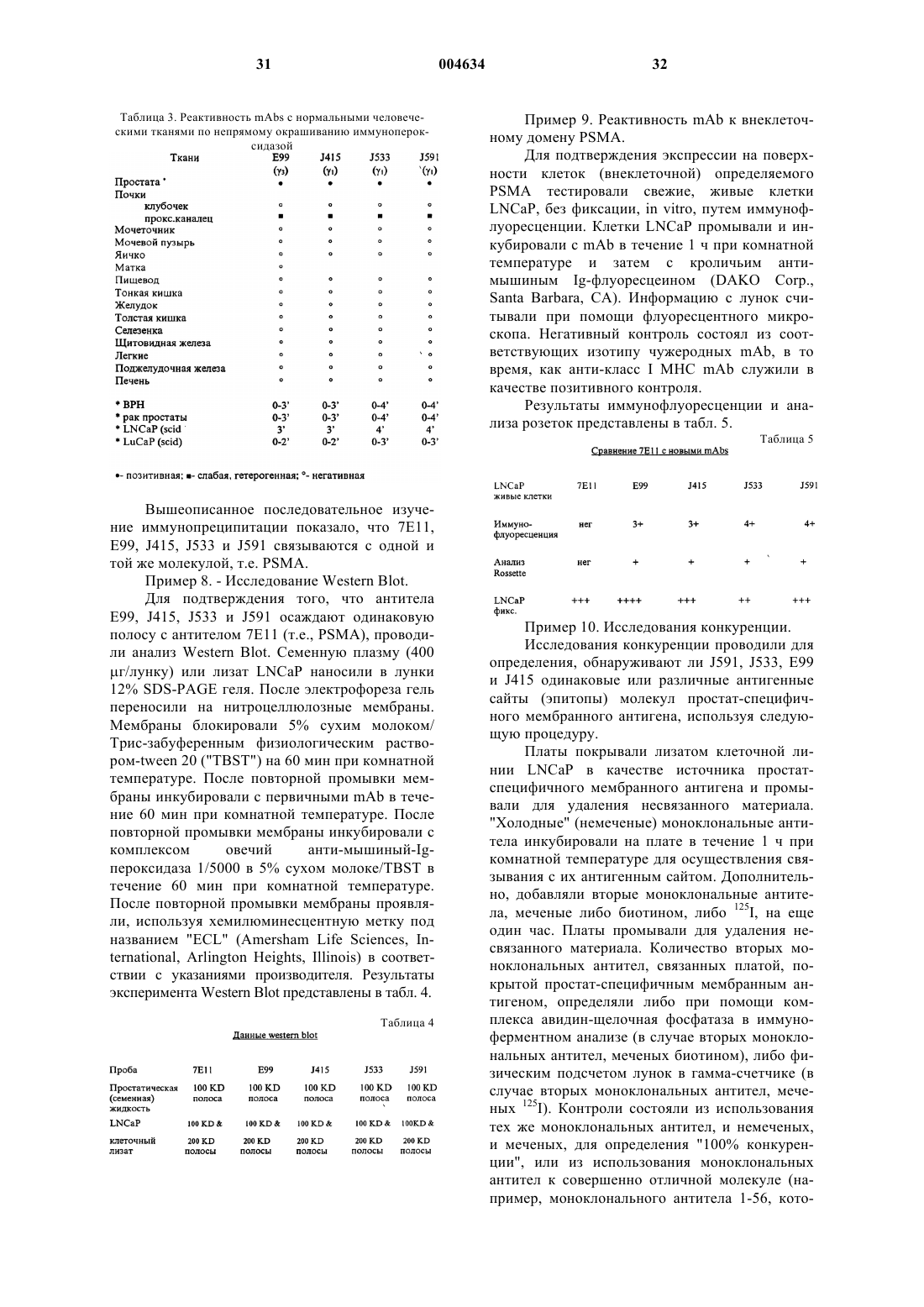
6. Изолированное антитело или его антигенсвязывающий участок по пп.1-5, которые конкурируют за связывание PSMA с антителом, выбранным из группы, состоящей из моноклональных антител E99, J533 и JS91.
7. Изолированное антитело или его антигенсвязывающий участок по п.6, которые конкурируют за связывание PSMA с моноклональным антителом J591.
8. Изолированное антитело или его антигенсвязывающий участок по пп.1-5, которые связываются с внеклеточным эпитопом PSMA, который также распознается антителом, выбранным из группы, состоящей из моноклональных антител E99, J533 и J591.
9. Изолированное антитело или его антигенсвязывающий участок по п.8, которые связываются с внеклеточным эпитопом PSMA, который также распознается моноклональным антителом J591.
10. Изолированное антитело или его антигенсвязывающий участок по пп.1-5, которые конкурируют за связывание PSMA с моноклональным антителом J415.
11. Изолированное антитело или его антигенсвязывающий участок по п.10, которые связываются с внеклеточным эпитопом PSMA, который также распознается моноклональным антителом J415.
12. Изолированное антитело или его антигенсвязывающий участок по пп.1 или 3-5, где антитело выбрано из группы, состоящей из моноклональных антител E99, J533, J415 и J591.
13. Изолированное антитело по пп.1 или 3-4, продуцируемое гибридомой, имеющей регистрационный номер ATCC, выбранный из группы, состоящей из HB-12101, HB-12109, HB-12127 и HB-12126.
14. Изолированное антитело или его антигенсвязывающий участок по пп.1-5, которые содержат антигенсвязывающий участок аминокислотной последовательности, выбранной из группы, состоящей из аминокислотной последовательности вариабельного участка тяжелой цепи SEQ ID NO:8 и аминокислотной последовательности вариабельного участка легкой цепи SEQ ID NO:19.
15. Изолированное антитело или его антигенсвязывающий участок по п.14, которые содержат антигенсвязывающий участок из аминокислотной последовательности вариабельного участка тяжелой цепи SEQ ID NO:8 и антигенсвязывающий участок из аминокислотной последовательности вариабельного участка легкой цепи SEQ ID NO:19.
16. Изолированное антитело или его антигенсвязывающий участок по пп.1-5, которые содержат антигенсвязывающий участок аминокислотной последовательности, кодируемой нуклеотидной последовательностью, выбранной из группы, состоящей из нуклеотидной последовательности вариабельного участка тяжелой цепи SEQ ID NO:6 и нуклеотидной последовательности вариабельного участка легкой цепи SEQ ID NO:17.
17. Изолированное антитело или его антигенсвязывающий участок по п.16, которые содержат антигенсвязывающий участок аминокислотной последовательности, кодируемой нуклеотидной последовательностью вариабельного участка тяжелой цепи SEQ ID NO:6, и антигенсвязывающий участок аминокислотной последовательности, кодируемой нуклеотидной последовательностью вариабельного участка легкой цепи SEQ ID NO:17.
18. Изолированное антитело или его антигенсвязывающий участок по пп.1-17, где антитело или его антигенсвязывающий участок связаны с цитотоксическим лекарством.
19. Изолированное антитело или его антигенсвязывающий участок по п.18, где цитотоксическое лекарство выбрано из группы, состоящей из терапевтического лекарства, вещества, испускающего излучение, молекул растительного, грибного или бактериального происхождения, белков и их смесей.
20. Изолированное антитело или его антигенсвязывающий участок по п.19, где цитотоксическое лекарство представляет собой вещество, испускающее излучение.
21. Изолированное антитело или его антигенсвязывающий участок по п.20, где вещество, испускающее излучение, представляет собой a -излучатель, b -излучатель или g -излучатель.
22. Изолированное антитело или его антигенсвязывающий участок по п.21, где вещество, испускающее излучение, выбрано из группы, состоящей из 212Bi, 213Bi, 211At, 186Re,90Y и 131I.
23. Изолированное антитело или его антигенсвязывающий участок по пп.1-22, где антитело или его антигенсвязывающий участок связаны с меткой.
24. Изолированное антитело или его антигенсвязывающий участок по п.23, где метка выбрана из группы, состоящей из флуоресцентной метки, биологически активной ферментной метки, радиоактивной метки, метки, активной в отношении ядерного магнитного резонанса, люминесцентной метки и хромофорной метки.
25. Изолированное антитело или его антигенсвязывающий участок по п.24, где радиоактивная метка выбрана из группы, состоящей из 32P, 125I, 3H, 14C, 188Rh, 131I, 99mTc и 111In.
26. Композиция, содержащая изолированное антитело или его антигенсвязывающий участок по любому из пп.1-25 и физиологически приемлемый носитель, наполнитель или стабилизатор, смешанные с изолированным антителом или его антигенсвязывающим участком.
27. Композиция, содержащая изолированное антитело или его антигенсвязывающий участок по любому из пп.1-25 и фармацевтически приемлемый носитель, наполнитель или стабилизатор, смешанные с изолированным антителом или его антигенсвязывающим участком.
28. Набор для определения PSMA-экспрессирующих клеток, содержащий изолированное антитело или его антигенсвязывающий участок по любому из пп.23-25 и средство для обнаружения метки.
29. Набор по п.28, где клетки представляют собой злокачественные клетки.
30. Набор для определения PSMA-экспрессирующих клеток, содержащий изолированное антитело или его антигенсвязывающий участок по любому из пп.1-22, метку, средство для присоединения метки к антителу или его антигенсвязывающему участку и средство для обнаружения метки.
31. Набор по п.30, где клетки представляют собой злокачественные клетки.
32. Набор по пп.28-31, дополнительно содержащий физиологически приемлемый носитель, наполнитель или стабилизатор.
33. Набор по пп.28-31, дополнительно содержащий фармацевтически приемлемый носитель, наполнитель или стабилизатор.
34. Набор по пп.28-31, где метка выбрана из группы, состоящей из флюоресцентной метки, биологически активной ферментной метки, радиоактивной метки, метки, активной в отношении ядерного магнитного резонанса, люминесцентной метки и хромофорной метки.
35. Набор по п.34, где радиоактивная метка выбрана из группы, состоящей из 32P, 125I, 3H, 14C, 188Rh, 131I, 99mTc и 111In.
36. Набор по пп.30-35, где рак представляет собой рак простаты.
37. Набор по пп.30-35, где рак выбран из группы, состоящей из рака почек, рака уротелия, рака толстой кишки, рака легких, рака молочной железы и метастазирующей в печень аденокарциномы.
38. Клеточная линия гибридомы, имеющая регистрационный номер ATCC HB-12101, которая продуцирует моноклональное антитело E99.
39. Клеточная линия гибридомы, имеющая регистрационный номер ATCC HB-12109, которая продуцирует моноклональное антитело J415.
40. Клеточная лиэшя гибридомы, имеющая регистрационный номер ATCC HB-12127, которая продуцирует моноклональное антитело J533.
41. Клеточная линия гибридомы, имеющая регистрационный номер ATCC HB-12126, которая продуцирует моноклональное антитело J591.
42. Способ лечения, предупреждения возникновения или замедления развития рака у субъекта, включающий получение антитела или его антигенсвязывающего участка по пп.1-25, и введение антитела или его антигенсвязывающего участка субъекту при условиях, эффективных для лечения, предупреждения возникновения или замедления развития рака.
43. Способ по п.42, где рак представляет собой рак простаты.
44. Способ по п.43, где рак простаты является метастазирующим.
45. Способ по п.44, где метастазирующий рак простаты включает метастазы в костный мозг или лимфатические узлы.
46. Способ по пп.43-45, где введение антитела или его антигенсвязывающего участка осуществляют после простатэктомии.
47. Способ по п.42, где рак представляет собой непростатический рак.
48. Способ по п.47, где непростатический рак выбран из группы, состоящей из рака почек, рака уротелия, рака толстой кишки, рака легких, рака молочной железы и метастазирующей в печень аденокарциномы.
49. Способ по п.47, где антитело или его антигенсвязывающий участок связываются с эндотелиальными клетками сосудов, находящихся рядом с непростатическими злокачественными клетками или внутри непростатической злокачественной опухоли.
50. Способ по пп.42-49, где введение осуществляют путем парентеральной, внутривенной, внутримышечной, ректальной или внутриполостной инсталляции.
51. Способ по пп.42-50, где антитело или его антигенсвязывающий участок интернализуются с PSMA.
52. Способ по пп.42-51, где введение антитела комбинируют с дополнительной терапией.
53. Способ по п.52, где дополнительная терапия выбрана из группы, состоящей из хирургической операции, радиоактивного облучения, химиотерапии, иммунотерапии и гормонального замещения.
54. Способ по п.53, где гормональное замещение включает обработку эстрогеном или антиандрогенным агентом.
55. Способ по п.54, где антиандрогенный агент представляет собой агент, который блокирует или ингибирует действие тестостерона.
56. Способ по пп.42-44, где антитело или его антигенсвязывающий участок эффективны для индукции эндогенной иммунной функции хозяина.
57. Способ по п.56, где эндогенная иммунная функция хозяина представляет собой комплементзависимую цитотоксичность или антителозависимую цитотоксичность.
58. Способ лечения, предупреждения возникновения или замедления развития рака у субъекта, включающий получение первого антитела или его антигенсвязывающего участка по пп.1-25, получение второго антитела или его антигенсвязывающего участка, которые связываются с внеклеточным доменом простатспецифического мембранного антигена, и введение и первого антитела или его антигенсвязывающего участка, и второго антитела или его антигенсвязывающего участка субъекту, нуждающемуся в лечении, при условиях, эффективных для лечения, предупреждения возникновения или замедления развития рака.
59. Способ по п.58, где рак представляет собой рак простаты.
60. Способ по п.59, где рак простаты является метастазирующим.
61. Способ по п.60, где метастазирующий рак простаты включает метастазы в костный мозг или лимфатические узлы.
62. Способ по пп.58-61, где введение осуществляют путем парентеральной, внутривенной, внутримышечной, ректальной или внутриполостной инсталляции.
63. Способ по пп.58-62, где введение антитела или его антигенсвязывающего участка осуществляют после простатэктомии.
64. Способ по п.58, где рак представляет собой непростатический рак.
65. Способ по п.64, где введение осуществляют путем парентеральной, внутривенной, внутримышечной, ректальной или внутриполостной инсталляции.
66. Способ определения PSMA-экспрессирующих клеток, включающий получение антитела или его антигенсвязывающего участка по пп.23-25, где антитело или его антигенсвязывающий участок связаны с меткой, обеспечение взаимодействия PSMA-экспрессирующих клеток с антителом или его антигенсвязывающим участком при условиях, эффективных для связывания, и определение PSMA-экспрессирующих клеток путем обнаружения метки.
67. Способ по п.66, где клетки представляют собой нормальные, доброкачественные гиперпластические или злокачественные клетки простаты.
68. Способ по п.66, где клетки представляют собой непростатические злокачественные клетки.
69. Способ по пп.66-68, где взаимодействие обеспечивают in vitro.
70. Способ по п.69, где взаимодействие обеспечивают в образце сыворотки или мочи.
71. Способ по п.69, где взаимодействие обеспечивают в биопсийном образце ткани.
72. Способ по п.70 или 71, где образец взят от человека.
73. Способ по п.66, где взаимодействие обеспечивают в живом млекопитающем, включающий введение антитела или его антигенсвязывающего участка млекопитающему при условиях, эффективных для связывания антитела или его антигенсвязывающего участка с PSMA-экспрессирующими клетками, присутствующими у млекопитающего.
74. Способ по п.67, где взаимодействие обеспечивают в живом млекопитающем, включающий введение антитела или его антигенсвязывающего участка млекопитающему при условиях, эффективных для связывания антитела или его антигенсвязывающего участка с эндотелиальными клетками сосудов, находящихся рядом или внутри нормальной, доброкачественной гиперпластической или злокачественной ткани простаты, присутствующей у млекопитающего.
75. Способ по п.68, где взаимодействие обеспечивают в живом млекопитающем, включающий введение антитела или его антигенсвязывающего участка млекопитающему при условиях, эффективных для связывания антитела или его антигенсвязывающего участка с эндотелиальными клетками сосудов, находящихся рядом или внутри непростатической злокачественной ткани, присутствующей у млекопитающего.
76. Способ по п.75, где непростатическая злокачественная ткань представляет собой злокачественную ткань почек, злокачественную ткань уротелия, злокачественную ткань толстой кишки, злокачественную ткань легких, злокачественную ткань молочной железы, злокачественную ткань метастазирующей в печень аденокарциномы, злокачественную ткань лимфатических узлов или злокачественную ткань метастазов в костный мозг.
77. Способ по пп. 75-76, где антитело или его антигенсвязывающий участок связываются с эндотелиальными клетками сосудов, находящихся рядом или внутри непростатической злокачественной ткани.
78. Способ по пп.75-77, где обнаружение метки определяет местоположение непростатической злокачественной ткани в теле субъекта.
79. Способ по п.74, где обнаружение метки определяет местоположение нормальной, доброкачественной гиперпластической или злокачественной ткани простаты в теле субъекта.
80. Способ по п.73, где обнаружение метки определяет местоположение PSMA-экспрессирующих клеток в теле субъекта.
81. Способ по пп.73-79, где субъектом является человек.
82. Способ по пп.73-81, где метку обнаруживают с помощью устройства для визуализации изображения.
83. Способ по пп.73-82, где метку обнаруживают с помощью трансректального зонда.
84. Способ по пп.42-80, где изолированное антитело или его антигенсвязывающий участок находятся в составе композиции, дополнительно включающей физиологически приемлемый носитель, наполнитель или стабилизатор.
85. Способ по пп.42-80, где изолированное антитело или его антигенсвязывающий участок находятся в составе композиции, дополнительно включающей фармацевтически приемлемый носитель, наполнитель или стабилизатор.
Текст
1 Настоящая заявка защищает преимущества предварительной заявки на патент США 60/022,125, поданной 18 июля 1996 года, и являющейся частичным продолжением заявки на патент США с порядковым номером 08/838,682,поданной 9 апреля 1997 года, в которой заявлены преимущества предварительной заявки на патент США с порядковым номером 60/016,976,поданной 6 мая 1996 года. Область техники Настоящее изобретение относится к лечению и диагностике рака при помощи биологических агентов. Предпосылки изобретения Несмотря на улучшенные способы лечения определенных форм рака, он продолжает оставаться ведущей причиной смертности в Соединенных Штатах. Поскольку шанс на полную ремиссию рака в большинстве случаев сильно увеличивается при ранней диагностике, то является крайне желательным, чтобы врачи имели возможность определять рак до значительного развития опухоли. Однако развитие способов,которые позволяют проводить быстрое и достоверное определение многих форм рака, продолжает являться проблемой для медицинского сообщества. Одной из таких иллюстративных форм рака является рак простаты. Рак простаты является наиболее частым типом рака у мужчин с оценкой 317 000 случаев до 1996 года в Соединенных Штатах. Это вторая причина смертности среди мужчин, умирающих от неоплазии, оцениваемая в 40 000 смертей в год. Своевременное определение и лечение необходимы для снижения смертности,вызванной раком простаты. Определение рака простаты Когда рак простаты дает метастазы, он отдает особое предпочтение кости и лимфатическим узлам. Saitoh et al., "Metastatic Patterns ofNumber Of Organs Involved," Cancer. 54:30783084 (1984). На момент клинической диагностики до 25% пациентов имеют метастазы в костях,подтвержденные радиоизотопным сканированием. Murphy, G.P., et al., "The National Survey ofAmerican College of Surgeons," J. Urol., 127:928939 (1982). Доказано, что точная клиническая оценка вовлечения узлов является затрудненной. Визуальные методы, такие как компьютерная томография ("СТ") или магнитный резонанс("MR"), не дают возможности отличить вовлечения лимфатических узлов при давшем метастазы раке простаты по другому критерию, кроме размера (т.е., 1 см). Поэтому, определенно,эти визуальные способы по своей природе нечувствительны при определении заболеваний малого объема (1 см), также как и неспецифичны при определении аденопатии большего объема. Недавними исследованиями была определена точность MR у пациентов с клиническиN. Engl. J. Med., 323:621-626 (1990). В этом исследовании MR подверглись 194 пациента, и у 185 из них проводили вскрытие лимфатических узлов. 23 (13%) пациента имели патологически измененные лимфатические узлы. Подозрение по MR было только у 1 из этих 23 случаев, т.е. чувствительность составляла 4%. Сходные результаты были отмечены и при использовании СТ сканирования. Gasser et al., "MRI And Ultrasonography In Staging Prostate Cancer." N. Engl.K. Med. (Correspondence), 324 (7):49-495 (1991). Повышение активности кислой фосфатазы в сыворотке пациентов, имеющих метастазирующую карциному простаты, было впервые описано Гутманом с соавторами (Gutman et al.,J. Clin. Invest 17:473 (1938). При раке простаты кислая фосфатаза простаты высвобождается из онкологической ткани в кровяное русло, приводя к тому, что общий уровень сывороточной кислой фосфатазы может быть значительно увеличен относительно нормальных количеств. С того времени были осуществлены многочисленные исследования этого фермента и его отношение к раку простаты, например, у Yam, Amer.J. Med. 56:604 (1974). Однако, количество сывороточной кислой фосфатазы повышено у, примерно, 65-90% пациентов, имеющих карциному простаты с метастазами в кости; у, примерно,30% пациентов без рентгенологического доказательства метастазирования в кости; и у только,примерно, 5-10% пациентов, не имеющих клинически достоверных метастазов. При предшествующих попытках разработать специфический тест на простатическую кислую фосфатазу исследования в этой области имели лишь ограниченный успех, так как методами, которые основаны на активности фермента или так называемом "специфическом" субстрате, невозможно принять во внимание другие биохимические и иммунохимические различия между многими кислыми фосфатазами, которые не имеют отношения к активности фермента простатического происхождения. В случае изоферментов, т.е. генетически обусловленных ферментов, имеющих одинаковую характерную ферментативную активность и сходную молекулярную структуру, но различающихся по аминокислотным последовательностям и/или по содержанию и, поэтому, иммунохимически различных, казалось бы невозможно по самой природе различить формы различных изоферментов просто путем выбора определенного субстрата. Поэтому неудивительно, что ни один из этих известных способов не является высокоспецифичным для прямого определения активности кислой фосфатазы простаты; например, смотрите Cancer 5:236 (1952); J. Lab. Clin. Med. 82:486 3 В дополнение к указанным проблемам неспецифичности, которые, оказываются присущими многим реагентам, используемым в известных аналогах для определения кислой фосфатазы простаты, имеются данные о повышении сывороточной кислой фосфатазы, связанном с другими заболеваниями, что еще более усложняет проблему получения достоверного клинического обнаружения рака простаты. Например,у Tuchman et al., Am. J. Med. 27:959 (1959) было отмечено, что уровни сывороточной кислой фосфатазы оказывается повышенным у пациентов с заболеванием Гоше. Из-за неизбежных сложностей в разработке "специфического" субстрата для кислой фосфатазы простаты некоторые исследователи разработали иммунохимические методы для определения кислой фосфатазы простаты. Однако ранее описанные иммунохимические методы обладают собственными недостатками, которые помешали их широкому распространению. Например, Шульман с соавторами (Shulman et al.,Immunology 93:474 (1964 описывали иммунодиффузионный тест для определения кислой фосфатазы простаты человека. Используя антисыворотку, приготовленную из антигена жидкости простаты, полученной у пациента с заболеванием простаты ректальным массажем, обнаружили отсутствие кросс-реактивной линии преципитина при использовании метода двойной диффузии против экстрактов нормальных почек, яичек, печени и легких. Однако этот способ имеет недостаток ограниченной чувствительности, даже при использовании больших количеств антигена и антисыворотки, которые могут иметь перекрестную реакцию с другими,не имеющими антигенного отношения к сыворотке, белковыми компонентами, присутствующими в простатической жидкости.WO 79/00475, выданный Chu et al., описывает способ для определения прототипов изоферментов кислой фосфатазы простаты, связанных с раком простаты, который лишен многих вышеперечисленных недостатков. Однако практические проблемы возникают вследствие необходимости получения онкологической ткани простаты, из которой экстрагируют диагностически необходимые прототипы изоферментов кислой фосфатазы простаты, связанные с раком простаты, для приготовления антител к ним. В последние годы были приложены значительные усилия для идентификации фермента или антигенных маркеров для различных типов злокачественных новообразований с целью развития специфических диагностических реагентов. Идеальный опухолевый маркер должен проявлять, помимо прочих характеристик, тканевую или клеточную специфичность. Предшествующие исследователи продемонстрировали наличие ткане-специфичных антигенов простаты человека. 4 Лечение рака простаты Как описано у W.J.Catalona, "Managementof Cancer of The Prostate," New Engl. J. Med.,331(15):996-]004 (1994), лечение рака простаты может быть достигнуто пристальным наблюдением, лекарственным лечением и временным облегчением боли. Для мужчин с ожидаемой длительностью жизни менее, чем 10 лет, пристальное наблюдение является допустимым, если рак простаты начальной стадии, низкого уровня обнаружен во время частичной простатэктомии при доброкачественной гиперплазии. Такие типы рака редко прогрессируют в течение первых пяти лет после обнаружения. С другой стороны, для более молодых мужчин лекарственное лечение зачастую является более подходящим. Если рак простаты локален и ожидаемая длительность жизни пациента составляет 10 лет или более, радикальная простатэктомия обеспечивает наилучший шанс для остановки заболевания. Исторически, препятствием этой процедуры является то, что большинство типов рака распространяется за пределами операции к тому времени, когда рак обнаружен. Однако использование теста на простат-специфичный антиген позволяет раннюю диагностику рака простаты. В результате, операция является менее интенсивной с меньшими осложнениями. Пациенты с большими, развитыми опухолями имеют меньше шансов быть удачно прооперированными радикальной простатэктомией. После операции в случае наличия детектируемых концентраций сывороточного простатспецифичного антигена имеется индикация продолжающегося рака. Во многих случаях концентрация простат-специфичного антигена может быть снижена радиационным лечением. Однако эта концентрация часто снова повышается в течение двух лет. Радиационная терапия также была широко распространена как альтернатива радикальной простатэктомии. Пациентами, которым обычно применяли радиационную терапию, являются пациенты более старшего возраста и менее здоровые, с развитыми, клинически более распространенными опухолями. Особенно распространенными процедурами являются внутрилучевая терапия, которая включает пространственную,конформационную терапию, при которой поле радиации создано, чтобы соответствовать объему обрабатываемой ткани; внутритканевая радиационная терапия, при которой лучи радиоактивных соединений вводят с использованием ультразвукового контроля; и комбинация внутрилучевой терапии и внутритканевой лучевой терапии. Для лечения пациентов с локально распространенным заболеванием используют гормональную терапию до или после радикальной простатэктомии или радиационной терапии. Гормональная терапия является основной фор 5 мой лечения мужчин с диссеминированным раком простаты. Удаление яичка снижает концентрации сывороточного тестостерона, в то время,как лечение эстрогеном является сходным по результату. Диэтилстилбестрол из эстрогена является другой используемой гормональной терапией, которая имеет недостаток, вызывая сердечно-сосудистую токсичность. Когда вводят агонисты гонадотропин-рилизинг гормона,концентрации тестостерона, в конечном счете,снижаются. Флутамид и другие нестероидные,антиандрогенные агенты блокируют связывание тестостерона с его внутриклеточными рецепторами. В результате это блокирует эффект тестостерона, увеличивая концентрации сывороточного тестостерона, и позволяет пациентам сохранять потенцию - значительная проблема после радикальной простатэктомии и радиационного лечения. Цитотоксическая химиотерапия является крайне неэффективной при лечении рака простаты. Ее токсичность делает эту терапию неподходящей для престарелых пациентов. В дополнение, рак простаты относительно устойчив к цитотоксическим агентам. Использование моноклональных антител в определении и лечении рака простаты Теоретически радиоактивно меченые моноклональные антитела ("mAbs") содержат потенциал для усиления и чувствительности, и специфичности при определении рака простаты внутри лимфатических узлов и в других органах. Поскольку много mAbs было ранее получено против антигенов, имеющих отношение к простате, ни одно из этих mAbs не было специально получено как объект для визуализации. Несмотря на это, клинические нужды требуют оценки некоторых из этих mAbs как возможных визуальных агентов. Vihko et al., "RadioimagingCarcinoma," The Prostate, 14:209-220 (1989). В некоторых случаях моноклональные антитела, полученные для определения и/или лечения рака простаты, распознают антитела, специфичные к злокачественным тканям простаты. Таким образом, такие антитела используются для распознания злокачественных тканей простаты (для лечения или определения) от доброкачественных тканей простаты. См. патент США 4,970,299, выданный Bazinet et al., иal. Другие моноклональные антитела реагируют с поверхностными антигенами на всех эпителиальных клетках простаты, являются ли они злокачественными или доброкачественными. См. патенты США 4,446,122 и Re 33,405,выданные Chu et al., патент США 4,863,851,выданный McEwan et al., и патент США 5,055,404, выданный Ueda et al. Однако антигены, определяемые этими моноклональными антителами, присутствуют в крови и, поэтому,конкурируют с антигенами в месте опухоли за моноклональные антитела. Это создает фоновый сигнал, что делает использование таких антител не отвечающими требованиям визуализации invivo. В терапии такие антитела, будучи связанными с цитотоксичным агентом, могли бы быть опасными для других органов.PSMA и демонстрирует, что PSMA является простат-специфичным и проявляет повышенные уровни экспрессии в местах метастазов и при гормонально стабильных состояниях. Другие исследования показали, что PSMA более высоко экспрессируется в клетках рака простаты, нежели в клетках из нормальной простаты или из простаты с доброкачественной гиперплазией. Дополнительно, PSMA не обнаруживается в сыворотке (Troyer et al., "Detection and Characterization of the Prostate-Specific Membrane Antigen (PSMA) in Tissue Extracts and Body Fluids,"Int. J. Cancer. 62:552-558 (1995. Эти характеристики делают PSMA привлекательной целью для опосредованной антителами мишени для визуализации и терапии рака простаты. Исследования по визуализации с использованием меченого индием 7 Е 11 показали, что антитело достаточно хорошо локализуется и на простате, и в местах метастазов. В дополнение, оказывается, 7 Е 11 имеет значительно лучшую чувствительность для определения повреждений по сравнению с другими доступными в настоящее время способами визуализации,такими, как СТ и MR изображения или сканирование костей. Bander, "Current Status of Monoclonal Antibodies for Imaging and Therapy of(1994). Однако использование 7E11 и других известных антител к PSMA для помощи в визуа 7 лизации и терапии имеет некоторые недостатки. Во-первых, PSMA является интегральным мембранным белком, о котором известно, что он имеет короткий внутриклеточный хвост и длинный внеклеточный домен. Биохимической характеристикой и картированием (Troyer et al.,"Biochemical Characterization and Mapping of the 7T11-C5.3 Epitope of the Prostate-specific Membrane Antigen," Urol. Oncol., 1:29-37 (1995 было показано, что эпитоп или антигенный сайт, с которыми 7 Е 11 антитело связывается, присутствует на внутриклеточной части молекулы. Поскольку молекулы антител, при нормальных обстоятельствах, не пересекают клеточную мембрану, если только они не связаны с внеклеточной частью молекулы и становятся транслоцироваными внутриклеточно, антитело 7 Е 11 не имеет доступа к своему антигенному сайтумишени в других здоровых живых клетках. Следовательно, визуализация с использованием 7 Е 11 ограничена до определения мертвых клеток внутри опухоли. Дополнительно,терапевтическое использование антитела 7 Е 11 ограничено, так как эффективной целью могут быть только клетки, которые уже мертвы, или ткани, содержащие большую часть мертвых клеток. Несмотря на то, что неудобства и проблемы в диагностике и лечении одного определенного типа рака являются предметом настоящей дискуссии, рак простаты является просто демонстрационной моделью. Диагностика и лечение других многочисленных типов рака имеют сходные проблемы. Настоящее изобретение направлено на преодоление недостатков, известных в области антител в диагностике и лечении рака простаты и других типов рака. Краткое изложение изобретения Один аспект настоящего изобретения относится к способу удаления или умерщвления онкологических клеток. Процесс включает обеспечение биологическим агентом, который,контактируя с внеклеточным доменом простатспецифичного мембранного антигена, распознает внеклеточный домен простат-специфичного мембранного антигена. Эти биологические агенты подвергают контакту с эндотелиальными клетками сосудов около онкологических клеток при условиях, эффективных для обеспечения и связывания биологического агента с эндотелиальными клетками сосудов около онкологических клеток, и умерщвления или удаления онкологических клеток. Биологический агент может быть использован единственно или может быть связан с веществом, эффективным для умерщвления или удаления онкологических клеток после связывания биологического агента с эндотелиальными клетками сосудов около онкологических клеток. В особенно предпочтительном воплощении способа удаления или умерщвления онко 004634 8 логических клеток в соответствии с настоящим изобретением биологический агент, контактируя с внеклеточным доменом простатспецифичного мембранного антигена, связывается и интернализуется простат-специфичным мембранным антигеном таких клеток. Предпочтительными биологическими агентами для использования в способе удаления или умерщвления онкологических клеток в соответствии с настоящим изобретением являются антитела или их связывающие части, зонды или лиганды. Способы настоящего изобретения особенно полезны для умерщвления или удаления онкологических клеток почек, уротелия, толстой кишки, прямой кишки, легких и молочных желез и онкологических клеток метастатической аденокарциномы в печени. Другой аспект настоящего изобретения относится к способу определения злокачественной ткани в биологической пробе. Этот способ включает обеспечение биологическим агентом,который, контактируя с внеклеточным доменом простат-специфичного мембранного антигена,связывается с внеклеточным доменом простатспецифичного мембранного антигена. Биологический агент связывают с меткой, эффективной для осуществления определения эндотелиальных клеток сосудов около или внутри онкологической ткани после связывания биологического агента с эндотелиальными клетками сосудов около или внутри онкологической ткани. Биологическую пробу подвергают контакту с биологическим агентом, имеющим метку, при условиях, эффективных для осуществления связывания биологического агента с эндотелиальными клетками сосудов около или внутри онкологической ткани в биологической пробе. Присутствие онкологической ткани в биологической пробе определяют путем обнаружения метки. В особенно предпочтительном воплощении способа определения онкологической ткани в соответствии с настоящим изобретением биологический агент является таковым, что контактируя с внеклеточным доменом простатспецифичного мембранного антигена, он связывается и интернализуется внеклеточным доменом простат-специфичного мембранного антигена. Предпочтительными биологическими агентами для использования в способе определения онкологической ткани в соответствии с настоящим изобретением являются антитела или их связывающие части, зонды или лиганды. Способ особенно полезен для определения онкологической ткани почек, уротелия, толстой кишки, прямой кишки, легких и молочных желез и онкологических клеток метастатической аденокарциномы в печени. Еще один аспект настоящего изобретения относится к способу удаления или умерщвления нормальных, доброкачественных гиперпластических и онкологических эпителиальных клеток простаты. Процесс включает обеспечение био 9 логическим агентом, который распознает внеклеточный домен простат-специфичного мембранного антигена. Биологический агент может быть использован единственно или может быть связан с веществом, эффективным для уничтожения клеток после связывания биологического агента с клетками. Эти биологические агенты дополнительно подвергают контакту с клетками при условиях, эффективных для обеспечения и связывания биологического агента с внеклеточным доменом простат-специфичного мембранного антигена, и уничтожения или удаления клеток. В особенно предпочтительном воплощении способа удаления или умерщвления нормальных, доброкачественных гиперпластических и онкологических эпителиальных клеток простаты в соответствии с настоящим изобретением биологический агент связывается и интернализуется простат-специфичным мембранным антигеном таких клеток. Предпочтительными биологическими агентами для использования в способе удаления или умерщвления нормальных, доброкачественных гиперпластических и онкологических эпителиальных клеток простаты в соответствии с настоящим изобретением являются антитела или их связывающие порции,зонды или лиганды. Другой аспект настоящего изобретения относится к способу определения нормальных,доброкачественных гиперпластических и онкологических эпителиальных клеток простаты или их частей в биологической пробе. Этот способ включает обеспечение биологическим агентом,который связывается с внеклеточным доменом простат-специфичного мембранного антигена. Биологический агент связывается с меткой, эффективной для осуществления определения клеток или их частей после связывания биологического агента с клетками или их частями. Биологическую пробу подвергают контакту с биологическим агентом, имеющим метку, при условиях, эффективных для осуществления связывания биологического агента с внеклеточным доменом простат-специфичного мембранного антигена любых клеток или их частей в биологической пробе. Присутствие любых клеток или их частей в биологической пробе определяют путем обнаружения метки. В особенно предпочтительном воплощении способа определения нормальных, доброкачественных гиперпластических и онкологических эпителиальных клеток простаты в соответствии с настоящим изобретением биологический агент связывается и интернализуется простат-специфичным мембранных антигеном таких клеток. Предпочтительными биологическими агентами для использования в способе определения нормальных, доброкачественных гиперпластических и онкологических эпителиальных клеток простаты в соответствии с настоя 004634 10 щим изобретением являются антитела или их связывающие части, зонды или лиганды. Другой аспект настоящего изобретения относится к биологическому агенту, который распознает внеклеточный домен простатспецифичного мембранного антигена. В предпочтительном воплощении изолированный биологический агент связывается и интернализуется простат-специфичным мембранным антигеном. Предпочтительными изолированными биологическими агентами, которые распознают внеклеточный домен простат-специфичного мембранного антигена, в соответствии с настоящим изобретением являются изолированные антитела или их связывающие части, зонды или лиганды. Раскрываются также клеточные линии гибридом, которые продуцируют моноклональные антитела этих типов. Биологические агенты настоящего изобретения распознают внеклеточный домен антигенов нормальных, доброкачественных гиперпластических и онкологических эпителиальных клеток простаты. В отличие от антитела 7 Е 11,которое распознает эпитоп простатассоциированных антигенов, которые экспонируются внеклеточно только после лизиса клеток, биологические агенты настоящего изобретения связываются с антигенными эпитопами,которые экспонированы внеклеточно в живых клетках простаты. Используя биологические агенты настоящего изобретения, клеткамимишенями могут быть живые, нефиксированные нормальные, доброкачественные гиперпластические и злокачественные эпителиальные клетки простаты, что делает лечение и диагностику более эффективными. В предпочтительном воплощении для лечения рака простаты биологические агенты настоящего изобретения также связываются и интернализуются простатспецифичным мембранным антигеном, что позволяет терапевтически использовать внутриклеточно действующие цитотоксические агенты. Краткое описание фигур Фиг. 1 является иммуноэлектронной микрофотографией меченого золотом моноклонального антитела J591 на поверхности клетокLNCaP после инкубирования при 4 С. Фиг. 2 является иммуноэлектронной микрофотографией клеток LNCaP, обработанных меченым золотом моноклональным антителомJ591 после 5 мин инкубирования при 37 С. Фиг.3 является иммуноэлектронной микрофотографией клеток LNCaP, обработанных меченым золотом моноклональным антителомJ591 после 10 мин инкубирования при 37 С. Фиг. 4 является иммуноэлектронной микрофотографией клеток LNCaP, обработанных меченым золотом моноклональным антителомJ59I после 15 мин инкубирования при 37 С. Фиг. 5 является иммуноэлектронной микрофотографией клеток LNCaP, обработанных 11 меченым золотом моноклональным антителомJ591 внутри эндосом. Фиг. 6 обобщает стратегию секвенирования тяжелой цепи моноклонального антителаJ591. Фиг. 7 показывает нуклеотидную последовательность тяжелой цепи моноклонального антитела J591 (обозначенную SEQ.ID.No.1),нуклеотидную последовательность, соответствующей обратной некодирующей нити (обозначенную SEQ.ID.No.2), и соответственно выведенные аминокислотные последовательности(обозначенные SEQ.ID.Nos.3, 4 и 5). Фиг. 8 является сравнением тяжелой цепи моноклонального антитела J591 со смысловой последовательностью для мышиных тяжелых цепей, подгруппы IIА. Фиг. 9 обобщает стратегию секвенирования каппа легкой цепи моноклонального антитела J591. Фиг. 10 показывает нуклеотидные последовательности каппа легкой цепи моноклонального антитела J591 (обозначенную SEQ.ID.No.9), нуклеотидную последовательность соответствующей обратной некодирующей нити(обозначенную SEQ.ID.No.10), и соответственно выведенные аминокислотные последовательности (обозначенную SEQ.ID.Nos.3, 4 и 5). Фиг. 11 является сравнением каппа легкой цепи моноклонального антитела J591 со смысловой последовательностью для мышиных тяжелых цепей, подгруппы V. Фиг. 12A-12F являются микрофотографиями (250 х увеличение), показывающими иммуногистохимическую реактивность mAb J591 к вновь образованным сосудам различных карцином. Подробное описание изобретения Один аспект настоящего изобретения относится к способу удаления или умерщвления нормальных, доброкачественных гиперпластических и злокачественных эпителиальных клеток простаты. Процесс включает обеспечение биологическим агентом, таким как антитело или его связывающая часть, зонд или лиганд, которые связываются с внеклеточным доменом простат-специфичного мембранного антигена (т.е.,частью простат-специфичного мембранного антигена, которая является наружной) таких клеток. Биологический агент может быть использован единственно или может быть связан с веществом, способным эффективно убивать клетки после связывания биологического агента с этими клетками. Эти биологические агенты дополнительно подвергают контакту с клетками при условиях, эффективных для осуществления и связывания биологического агента с внеклеточным доменом простат-специфичного мембранного антигена, и умерщвления или удаления клеток. В его предпочтительной форме, такой контакт проводят у живых млекопитающих 12 путем введения биологического агента млекопитающему при условиях, эффективных для осуществления и связывания биологического агента с внеклеточным доменом простатспецифичного мембранного антигена, и умерщвления или удаления клеток. Такое введение может быть осуществлено орально или парентерально. В особенно предпочтительном воплощении способа удаления или умерщвления нормальных, доброкачественных гиперпластических и злокачественных эпителиальных клеток простаты в соответствии с настоящим изобретением биологический агент связывается и интернализуется простат-специфичным мембранным антигеном таких клеток. Снова биологический агент может быть использован единственно. Альтернативно, биологический агент может быть связан с веществом, эффективным для умерщвления клеток после связывания биологического агента с простат-специфичным мембранным антигеном и после интернализации биологического агента простат-специфичным мембранным антигеном. Механизм, путем которого биологический агент представляется простат-специфичным мембранным антигеном, не является критическим для практики настоящего изобретения. Например, биологический агент может индуцировать интернализацию простат-специфичного мембранного антигена. Альтернативно, интернализация биологического агента может являться результатом обычной интернализации простат-специфичного мембранного антигена. Описанные выше биологические агенты(т.е., биологические агенты, такие как антитело или его связывающая часть, зонд или лиганд,которые, контактируя с внеклеточным доменом простат-специфичного мембранного антигена,распознают внеклеточный домен простатспецифичного мембранного антигена и, предпочтительно, интернализуются им) могут быть использованы для удаления или умерщвления онкологических клеток. В этом аспекте настоящего изобретения биологический агент может быть использован единственно или может быть связан с веществом, эффективным для умерщвления онкологических клеток после связывания биологического агента с эндотелиальными клетками сосудов, находящихся рядом с онкологическими. Эти биологические агенты подвергают контакту с эндотелиальными клетками сосудов, находящихся рядом с онкологическими. Контактирование проводят при условиях,которые эффективны для обеспечения связывания биологического агента с эндотелиальными клетками сосудов, находящихся рядом с онкологическими, и, в дополнение, которые способны эффективно обеспечивать умерщвление или удаление онкологических клеток. Механизм,при помощи которого происходит умерщвление или удаление онкологических клеток, не явля 13 ется принципиальным для практики настоящего изобретения. Например, онкологические клетки могут быть убиты или удалены напрямую биологическим агентом вследствие их близости к эндотелиальным клеткам сосудов, с которыми биологический агент связывается. Альтернативно, биологический агент может убивать, удалять или другим способом изменять свойства эндотелиальных клеток сосудов, с которыми он связался, таким образом, что кровоток по направлению к онкологическим клеткам, находящимся рядом, останавливается или иным способом снижается, обеспечивая таким образом умерщвление или удаление онкологических клеток. Таким образом, способ настоящего изобретения является особенно полезным для умерщвления или удаления эндотелиальных клеток сосудов в злокачественных тканях, как и в злокачественных клетках, контактирующих со злокачественными тканями. В особенно предпочтительном воплощении способа удаления или умерщвления онкологических клеток в соответствии с настоящим изобретением используемый биологический агент таков, что контактируя с внеклеточным доменом простат-специфичного мембранного антигена, он связывается и интернализуется внеклеточным доменом простат-специфичного мембранного антигена. Способы настоящего изобретения особенно полезны для умерщвления или удаления онкологических эпителиальных клеток простаты, как и других клеток, нежели онкологические эпителиальные клетки простаты. Примерами онкологических клеток,которые являются онкологическими не эпителиальными клетками простаты, являются злокачественные клетки почек, уротелия, толстой кишки, прямой кишки, легких и молочной железы, и злокачественные клетки метастатической аденокарциномы печени. Несмотря на то, что способ настоящего изобретения может быть использован для умерщвления или удаления любых клеток, которые экспрессируют внеклеточный домен простат-специфичного мембранного антигена или его часть, или чье существование зависит от клеток, которые экспрессируют внеклеточный домен простат-специфичного мембранного антигена или его часть, способ настоящего изобретения является особенно полезным для умерщвления или удаления онкологических клеток, так как эндотелиальные клетки сосудов, доставляющих кровь к злокачественным тканям (например, опухолям, объединениям онкологических клеток или другим злокачественным массам), экспрессируют внеклеточный домен простат-специфичного мембранного антигена вне зависимости от того, какой тип рака имеет место. В контрасте, эндотелиальные клетки сосудов, доставляющих кровь к нормальным тканям, не экспрессируют внеклеточный домен простат-специфичного мембранного антигена. 14 Другой аспект настоящего изобретения относится к способу определения нормальных,доброкачественных гиперпластических и злокачественных эпителиальных клеток или их частей в биологической пробе. Этот способ включает обеспечение биологическим агентом, таким, как антитело или его связывающая часть,зонд или лиганд, которые связываются с внеклеточным доменом простат-специфичного мембранного антигена таких клеток. Биологический агент связывают с меткой, способной эффективно обеспечить определение клеток или их частей (например, простат-специфичный мембранный антиген или его фрагмент, выделенный из таких нормальных, доброкачественных гиперпластических и злокачественных клеток) после связывания биологического агента с клетками или их частями. Биологическую пробу подвергают контакту с биологическим агентом,имеющим метку, при условиях, эффективных для осуществления связывания биологического агента с внеклеточным доменом простатспецифичного мембранного антигена любых клеток или их частей в биологической пробе. Присутствие любых клеток или их частей в биологической пробе определяют путем обнаружения метки. В его предпочтительной форме такое контактирование проводят у живых млекопитающих и оно включает введение биологического агента млекопитающему при условиях,эффективных для осуществления связывания биологического агента с простат-специфичным мембранным антигеном или с любой из клеток,или их частей в биологической пробе. Снова такое введение может быть осуществлено орально или парентерально. Способ настоящего изобретения может быть использован для обследования пациентов на предмет заболевания, связанного с присутствием нормальных, доброкачественных гиперпластических и злокачественных эпителиальных клеток или их частей. Альтернативно он может быть использован для идентификации возврата таких заболеваний, особенно, когда заболевание локализовано в определенном биологическом материале пациента. Например, возврат простатического заболевания в простатическую ямку может встречаться после радикальной простатэктомии. Используя способ настоящего изобретения, этот возврат может быть определен путем введения млекопитающему антитела с близкодействующей радиоактивной меткой и затем путем определения метки ректально, например, при помощи трансректального детекторного зонда. В качестве альтернативы шаг контактирования может быть осуществлен в пробе сыворотки или мочи, или других жидкостях организма, например, для определения присутствияPSMA в жидкости организма. Когда контактирование проводят в сыворотке или пробе мочи,предпочтительно, чтобы биологический агент 15 не распознавал других, нежели PSMA, антигенов, циркулирующих в крови. Поскольку целые клетки простаты не экскретируют или секретируют PSMA во внеклеточное окружение, определение PSMA в сыворотке, моче или других жидкостях организма, обычно, обозначает, что клетки простаты лизированы. Таким образом,биологические агенты или способы настоящего изобретения могут быть использованы для определения эффективности протокола лечения рака простаты путем анализа уровня PSMA в сыворотке, моче или других жидкостях организма. В особенно предпочтительном воплощении способа определения нормальных, доброкачественных гиперпластических и злокачественных эпителиальных клеток простаты в соответствии с настоящим изобретением, биологический агент, такой, как антитело или его связывающая часть, зонд или лиганд, связывается и интернализуется простат-специфичным мембранным антигеном таких клеток. Снова биологический агент связывают с меткой, способной эффективно обеспечить определение клеток или их частей после связывания биологического агента и интернализации биологического агента простат-специфичным мембранным антигеном. Другой аспект настоящего изобретения относится к способу определения злокачественной ткани в биологической пробе. Этот способ включает обеспечение вышеописанным биологическим агентом (например, таким биологическим агентом, как антитело или его связывающая часть, зонд или лиганд, которые, контактируя с внеклеточным доменом простатспецифичного мембранного антигена, распознают внеклеточный домен простатспецифичного мембранного антигена). Биологический агент связывают с меткой, которая способна обеспечить эффективное определение эндотелиальных клеток сосудов, находящихся около или внутри онкологической ткани, после связывания биологического агента с эндотелиальными клетками сосудов, находящихся около или внутри онкологической ткани. Биологическую пробу затем подвергают контакту с биологическим агентом, имеющим метку. Контактирование проводят при условиях, позволяющих эффективно провести связывание биологического агента с эндотелиальными клетками сосудов,находящихся около или внутри онкологической ткани, в биологической пробе. Присутствие злокачественных клеток или их частей в биологической пробе определяют путем обнаружения метки. Вместо того, чтобы подвергать контакту с биологическим агентом целую биологическую пробу, предполагается, что может быть использована часть биологической пробы. Например,проба из тканевой биопсии может быть подвергнута контакту с биологическим агентом для определения присутствия злокачественной тка 004634 16 ни в пробе тканевой биопсии, также как и в большей биологической пробе, из которой она взята. Альтернативно, биологический агент может быть подвергнут контакту с пробой сыворотки или мочи для того, чтобы удостовериться,присутствуют ли в ней какие-либо эндотелиальные клетки сосудов, экспрессирующие внеклеточный домен простат-специфичного антигена. Если эндотелиальные клетки сосудов, экспрессирующие внеклеточный домен простатспецифичного антигена, обнаруживаются в сосудистой сети злокачественных тканей, но не в сосудистой сети нормальных тканей, обнаружение метки в пробе сыворотки или мочи означает присутствие злокачественной ткани в большей биологической пробе, из которой она взята (т.е.,в пациенте). В особенно предпочтительном воплощении способа определения злокачественных тканей в соответствии с настоящим изобретением используемый биологический агент таков, что контактируя с внеклеточным доменом простатспецифичного мембранного антигена, он связывается и интернализуется простат-специфичным мембранным антигеном. Способ настоящего изобретения может быть использован для определения злокачественных эпителиальных клеток простаты, как и злокачественных тканей, содержащих другие онкологические клетки, нежели онкологические эпителиальные клетки простаты. Примеры злокачественных тканей, содержащих другие злокачественные клетки, нежели злокачественные эпителиальные клетки простаты, которые могут быть определены способами настоящего изобретения, включают онкологические клетки почек, уротелия, толстой кишки, прямой кишки, легких и молочной железы, и онкологическую ткань метастатической аденокарциномы печени. Как указано выше, биологические агенты,подходящие для либо умерщвления, удаления,либо определения злокачественных клеток и нормальных, доброкачественных гиперпластических и злокачественных эпителиальных клеток простаты, включают антитела, такие как моноклональные или поликлональные антитела. В дополнение, могут быть использованы фрагменты антител, половины антител, гибридные производные, зонды или лиганды, связанные с внеклеточным доменом простат-специфичных мембранных антигенов или их частей в нормальных, доброкачественных гиперпластических и злокачественных эпителиальных клетках простаты. В результате, при использовании способов настоящего изобретения для умерщвления, удаления или определения нормальных,доброкачественных гиперпластических и злокачественных эпителиальных клеток простаты,биологические агенты связываются со всеми такими клетками, не только с клетками, которые зафиксированы или с клетками, чьи внутриклеточные антигенные домены другим образом 17 экспонированы внеклеточному окружению. Следовательно, связывание биологических агентов сконцентрировано в областях, где существуют эпителиальные клетки простаты, вне зависимости от того, фиксированы или не фиксированы эти клетки, живые они или некротические. Дополнительно или альтернативно, эти биологические агенты, такие, как антитела, их связывающие части, зонды или лиганды, связываются и интернализуются простат-специфичными мембранными антигенами или их частями в нормальных, доброкачественных гиперпластических и злокачественных эпителиальных клеток простаты. Продукция моноклональных антител может быть обеспечена методами, которые являются хорошо известными в области. В основном, процесс сначала включает получение иммунных клеток (лимфоцитов) из селезенки млекопитающего (например, мыши), которое было предварительно иммунизировано интересующим антигеном либо in vivo, либо in vitro. Лимфоциты, секретирующие антитела, дополнительно сливают с клетками миеломы (мыши) или трансформированными клетками, которые способны длительно реплицироваться в клеточной культуре, продуцируя таким образом долгоживущую клеточную линию, секретирующую иммуноглобулин. Полученные слитые клетки,или гибридомы, культивируют и анализируют полученные колонии на продукцию желаемых моноклональных антител. Колонии, продуцирующие такие антитела, клонируют и выращивают либо in vivo, либо in vitro для получения больших количеств антител. Описание теоретической основы и практической методологии слияния таких клеток изложено у Kohler andMilstein, Nature 256:495 (1975), что внесено здесь в ссылки. Лимфоциты млекопитающих иммунизируют путем иммунизации in vivo животного(например, мыши) белком или полипептидом настоящего изобретения. Такие иммунизации повторяют, если необходимо, с интервалами до нескольких недель для получения достаточного титра антител. После последней иммунизации животных забивают и удаляют клетки селезенки. Слияние с клетками миеломы млекопитающих или другими партнерами слияния, способными к длительной репликации в клеточной культуре, обеспечивается стандартными и хорошо известными методами, например, путем использования полиэтиленгликоля ("PEG") или других агентов для слияния (см. Milstein andKohler, Eur. J. Immunol. 6:511 (1976), что внесено здесь в ссылки). Эту длительноживущую клеточную линию, которая является, предпочтительно, мышиной, но также может быть получена из клеток других видов млекопитающих,включая, но не ограничиваясь, крыс и человека,селектируют так, чтобы она имела дефицит в 18 ферменте, необходимом для утилизации определенных питательных веществ, была способна к быстрому росту и имела хорошую способность к слиянию. Профессионалам в области известны многие такие клеточные линии, другие линии регулярно описывают. Процедуры получения поликлональных антител также хорошо известны. Обычно такие антитела могут быть получены путем введения белка или полипептида настоящего изобретения подкожно новозеландским белым кроликам, у которых сначала отбирают кровь для получения пре-иммунной сыворотки. Антигены могут быть инъецированы в общем объеме 100 л на один укол в шесть разных мест укола. Каждый инъекционный материал будет содержать синтетический поверхностный адъювант плурониковых полиолов или порошкообразный акриламидный гель, содержащие белок или полипептид послеSDS-полиакриламидного гель-электрофореза. Дополнительно в течение двух недель после первой инъекции у кроликов забирают кровь и периодически иммунизируют тем же антигеном три раза каждые шесть недель. Пробу сыворотки дополнительно собирают 10 дней после каждой иммунизации. Поликлональные антитела затем удаляют из сыворотки аффинной хроматографией, используя соответствующий антиген для захвата антитела. В конце кроликов умерщвляют пентобарбиталом в дозе 150 мг/кг внутривенно. Эта и другие процедуры для получения поликлональных антител раскрыты вManual (1988), что внесено здесь в ссылки. В дополнение к использованию целых антител процессы настоящего изобретения включают использование связывающих частей таких антител. Такие связывающие части включаютFab фрагменты, F(ab') фрагменты и Fv фрагменты. Эти фрагменты антител могут быть получены подходящими процедурами, такими, как процедуры протеолитической фрагментации,как описано у J.Goding, Monoclonal Antibodies:Press 1983), что внесено здесь в ссылки. В качестве альтернативы, в процессах настоящего изобретения могут быть использованы зонды или лиганды, обнаруженные либо в природе, либо полученные синтетическими методами рекомбинантных ДНК, или другими биологическими или молекулярными методами. Подходящими зондами или лигандами являются молекулы, которые связываются с внеклеточными доменами простат-специфичных мембранных антигенов, идентифицированные моноклональными антителами настоящего изобретения. Другими подходящими зондами или лигандами являются молекулы, которые связываются и интернализуются простат-специфичными мембранными антигенами. Такими зондами или лигандами могут быть, например, бел 19 ки, пептиды, пектины или зонды нуклеиновых кислот. Особенно предпочтительно использовать моноклональные антитела, идентифицированные ниже в табл. 1. Название моноклонального антитела Е 99 Таблица 1 Номер АТСС для клеточной линии гибридомы НВ-12101 НВ-12109 НВ-12127 НВ-12126 Эти антитела могут быть использованы единственно или как компонент в смеси с другими антителами или другими биологическими агентами для лечения рака или визуализации онкологических тканей (особенно, эндотелиальных клеток сосудов в них) или эпителиальных клеток простаты с различающимися характеристиками поверхностных антигенов. Вне зависимости от того, используются ли биологические агенты для лечения или для диагностики, они могут быть введены орально,парентерально, подкожно, внутривенно, внутримышечно, внутрибрюшинно, введением в нос,внутриполостными или внутрипузырными омываниями, введением в глаз, введением в артерии, введением в места поражений или путем приложения к слизистым оболочкам, таким, как оболочки носа, горла и бронхиальных труб. Они могут быть введены единственно или с фармацевтически или физиологически приемлемыми носителями, наполнителями или стабилизаторами, и может находиться в твердой или жидкой формах, таких, как таблетки, капсулы, порошки,растворы, суспензии или эмульсии. Формы дозировок твердого вида могут быть традиционного типа. Твердая форма может быть капсулой, такой как обычного желатинового типа, содержащей биологический агент,такой как антитело или их связывающие порции, настоящего изобретения и носитель, например, увлажнители и инертные наполнители,такие как лактоза, сахароза или кукурузный крахмал. В другом воплощении, эти соединения таблетируют с подходящей основой для таблетирования, такой как лактоза, сахароза или кукурузный крахмал, или желатин, дезинтегрирующие агенты, такие как кукурузный крахмал,картофельный крахмал или алгиниковая кислота, и увлажнитель, такой как стеариновая кислота или стеарат магния. Биологический агент настоящего изобретения может также быть введен в инъекционной дозировке в растворе или суспензии этих материалов в физиологически приемлемом разбавителе с фармацевтическим носителем. Такие носители включают стерильные жидкости, такие как вода или масла, с или без добавления сурфактанта и другого фармацевтически и физиологически приемлемого носителя, включая адьюванты, наполнители или стабилизаторы. Ил 20 люстративными маслами являются нефтяные,животные, растительные или синтетического происхождения, например, арахисовое масло,соевое масло или минеральное масло. В основном, предпочтительными жидкими носителями,особенно для инъекционных растворов, являются вода, раствор хлорида натрия, водная Dглюкоза и соответствующий раствор сахара, и гликоли, такие как пропиленгликоль или полиэтиленгликоль. Для использования в качестве аэрозолей биологический агент настоящего изобретения в растворе или суспензии может быть упакован в аэрозольный контейнер под давлением совместно с подходящими пропеллентами, например,гидроуглеродными пропеллентами, такими, как пропан, бутан или изобутан с подходящими адьювантами. Материалы настоящего изобретения также могут быть введены в форме без давления, такой, как распылитель или аэрозольный ингалятор. Биологические агенты могут быть использованы для обнаружения онкологических тканей(особенно, в эндотелиальных клетках их сосудов) и нормальных, доброкачественных гиперпластических и злокачественных эпителиальных клеток простаты in vivo. Это достигается путем пометки биологического агента, введения меченого биологического агента млекопитающему и дополнительно визуализацией млекопитающего. Примерами меток, полезных для диагностической визуализации в соответствии с настоящим изобретением являются радиометки,как 131I, 111In, 123I, 99mTc, 32 Р, 125I, 3 Н, 14 С и l88Rh,флюоресцентные метки, как флуоресцеин и родамин, активные метки для ядерного магнитного резонанса, изотопы позитронной эмиссии,определяемые сканером позитрон-эмиссионной томографии ("PET"), хемолюминесцеры, как люциферин, и ферментативные маркеры, как пероксидаза или фосфатаза. Также могут быть радиоизотопные близкодействующие источники излучения, такие, как изотопы, определяемые короткодистанционными детекторными зондами, такими, как трансректальный зонд. Эти изотопы и трансректальные детекторные зонды,будучи использованными в комбинации, являются особенно полезными для определения возвратов простатической ямки и заболеваний узлов таза. Биологический агент может быть помечен такими реагентами с использованием методов, известных в области. Например, см.Mice", Meth. Enzymol. 121: 802-816 (1986), что внесено здесь в ссылки. Радиомеченый биологический агент этого изобретения может быть использован для диагностических тестов in vitro. Специфическая активность меченого биологического агента, такого как меченое антитело, его связывающая часть, зонд или лиганд, зависит от полужизни,изотопной чистоты радиоактивной метки и того,каким образом метку вносят в биологический агент. В табл. 2 перечислены некоторые широко используемые изотопы, их специфические активности и полужизни. В иммунологических тестах, чем выше специфическая активность,обычно, тем лучше чувствительность. Изотоп 14 Удельная активность чистого изотопа (Ки/моль) 6.25 х 101 2.01 х 104 1.50 х 106 2.18 х 106 3.16 х 106 1.62 х 107 Процедуры пометки биологических агентов радиоактивными изотопами, перечисленными в табл. 2, являются широко известными в области. Процедуры пометки тритием описаны в патенте США 4,302,438, что внесено здесь в ссылки. Процедуры йодирования, пометки тритием и пометки 35S, специально адаптированные для мышиных моноклональных антител, описаны у Goding, J.W. (supra, pp 124-126), и ссылка,процитированная там, что внесено здесь в ссылки. Другие процедуры йодирования биологических агентов, таких, как антитела, их связывающие части, зонды или лиганды, описаны уHunter and Greenwood, Nature 144:945 (1962),David et al., Biochemistry 13:1014-1021 (1974) и в Патентах США Nos. 3,867,517 и 4,376,110, что внесено здесь в ссылки. Элементы для радиоактивного мечения, которые полезны для визуализации, включают 123I, 131I, 111In и 99mТс, например. Процедуры йодирования биологических агентов описаны у Greenwood, F. et al., Biochem.J. 89:114-123 (1963); Marchalonis, J. Biochem.J. 113:299-305 (1969); и Morrison, M. et al., Immunochemistry. 289-297 (1971), что внесено здесь в ссылки. Процедуры 99mТс-мечения описаны уCancer. New York: Masson 111-123 (1982) и ссылки, процитированные там, что внесено здесь в ссылки. Процедуры, подходящие для 111Hnatowich, D.J. et al., J. Immul. Methods. 65:147157 (1983), Hnatowich, D. et al., J. Applied Radiation. 35:554-557 (1984) и Buckley, R.G. et al.,F.E.B.S. 166:202-204 (1984), что внесено здесь в ссылки. В случае, если биологический агент является радиомеченым, биологический агент вводят пациенту с локализацией в опухоли, несущей антиген, с которым биологический агентin vivo, используя известные методы, такие, как радиоядерное сканирование с использованием,например, гамма-камеры или эмиссионной томографии. См., например, A.R.Bradwell et al.,"Development in Antibody Imaging", MonoclonalPress 1985), что внесено здесь в ссылки. Альтернативно, может быть использован позитронный эмиссионный трансаксиальный томографический сканнер, как таковой, созданный Pet VI,находящийся в Brookhaven National Laboratory,если используют радиометку, высвобождающую позитроны (например, 11 С, 18F, 15O и 13N). Биологические агенты, меченые флуорофорами или хромофорами, могут быть получены из стандартных долей, известных в области. Поскольку антитела и другие белки адсорбируют свет, имеющий длину волны до, примерно,310 нм, флуоресцентные доли должны быть выбраны так, чтобы они имели основную адсорбцию при длинах волн выше 319 нм и, предпочтительно, выше 400 нм. Разнообразие подходящих флуоресцентных и хромофорных веществ описано у Stryer, Science. 162:526 (1968) иBrand, L. et al., Annual Review of Biochemistry. 41:843-868 (1972), что внесено здесь в ссылки. Биологические агенты могут быть помечены группами флуоресцентных хромофоров традиционными методами, такими, как раскрытые в патентах США . 3,940,475, 4,289,747 и 4,376,110, что внесено здесь в ссылки. Одной из групп флюоресцентных веществ,имеющих набор желаемых свойств, описанных выше, являются ксантиновые красители, которые включают флуоресцеины, полученные из 3,6-дигидрокси-9-фенилксантгидрола, и резамины и родамины, полученные из 3,6-диамино-9 фенилксантгидрола и лиззаним родамина В. Родаминовые и флуоресцеиновые производные 9-о-карбоксифенилксантгидрола имеют 9-окарбоксифенильную группу. Флуоресцеиновые соединения, имеющие реактивные спаренные группы, такие как аминогруппы, и изотиоцианатные группы, такие как флуоресцеин изотиоцианаты и флюорескамины, широко доступны. Другой группой флуоресцентных соединений являются нафтиламины, имеющие амино группу в позицияхили . Биологические агенты могут быть помечены флуорохромами или хромофорами процедурами, описанными у Goding, J. (supra, pp 208249). Биологические агенты могут быть помечены индикаторными группами, содержащими ЯМР-активный атом 19F или множеством таких атомов, так как (i) практически все природно богатые флуорином атомы являются изотопами 19F и, таким образом, практически все флуоринсодержащие соединения являются ЯМРактивными; (ii) многие химически активные полифлуоринированные соединения, такие, как 23 трифторуксусный ангидрид, являются коммерчески доступными по относительно низкой стоимости, и (iii) было обнаружено, что многие флуоринированные соединения являются с медицинской точки зрения приемлемыми для использования у человека, такие, как перфлуоринированные полиэфиры, используемые для переноса кислорода в качестве заменителя гемоглобина. После прошествия определенного времени для инкубации проводят ЯМР определение всего организма, используя прибор, такой, как один из описанных у Pykett, Scientific American. 246:78-88 (1982), что внесено здесь в ссылки,для локализации и визуализации злокачественных тканей (особенно, эндотелиальных клеток сосудов внутри них) и эпителиальных клеток простаты. В случаях, когда важно отделить районы,содержащие живые и мертвые эпителиальные клетки простаты, или разделить живые и мертвые эпителиальные клетки простаты, могут быть одновременно введены антитела настоящего изобретения (или другие биологические агенты настоящего изобретения), меченые как описано выше, совместно с антителом или другим биологическим агентом, которые распознают только живые или только мертвые эпителиальные клетки простаты, меченые меткой, которая может быть отделена от метки, использованной для пометки нужного антитела. Путем анализа концентрации двух меток в различных местах или во времени могут быть оценены вариации пространственной и временной концентраций живых и мертвых нормальных, доброкачественных гиперпластических и злокачественных эпителиальных клеток простаты. В особенности, этот способ может быть осуществлен,используя меченые антитела настоящего изобретения, которые распознают и живые, и мертвые эпителиальные клетки простаты, и меченые 7 Е 11 антитела, которые распознают только мертвые эпителиальные клетки простаты. Биологические агенты могут также быть использованы для умерщвления или удаления онкологических клеток и нормальных, доброкачественных гиперпластических и злокачественных эпителиальных клеток простаты in vivo. Это включает использование биологических агентов единственно или с цитотоксическим лекарством, с которым связаны биологические агенты настоящего изобретения (например,биологические агенты, распознающие нормальные, доброкачественные гиперпластические и злокачественные эпителиальные клетки простаты). Это включает введение биологических агентов, связанных с цитотоксическим лекарством, млекопитающему, нуждающемуся в таком лечении. В случае нормальных, доброкачественных гиперпластических и злокачественных эпителиальных клеток простаты, любые из этих клеток, с которыми биологические агенты связаны, уничтожаются, т.к. биологические агенты 24 распознают эпителиальные клетки простаты. Несмотря на то, что такое введение может разрушить нормальные эпителиальные клетки простаты, это не является проблемой, так как простата не является необходимостью для жизни или выживания. Хотя простата напрямую не относится к фертильности, это не является практическим соображением для пациентов,получающим лечение по настоящему изобретению. В случае онкологических тканей, поскольку биологические агенты распознают эндотелиальные клетки сосудов, которые находятся рядом с онкологическими клетками, связывание комплекса биологический агент/цитотоксическое лекарство с этими эндотелиальными клетками сосудов разрушает их, таким образом устраняя приток крови к соседним онкологическим клеткам и, таким образом, убивая или удаляя эти онкологические клетки. Альтернативно,биологические агенты, вследствие их связывания с эндотелиальными клетками сосудов, находящихся рядом с онкологическими клетками,локализованы рядом с онкологическими клетками. Таким образом, путем использования подходящих биологических агентов (включая таковые, содержащие вещества, эффективные для умерщвления клеток, не беспорядочно, но только на коротком расстоянии), клетки в онкологических тканях (включая злокачественные клетки) могут быть селективно убиты или удалены. Биологические агенты настоящего изобретения могут быть использованы для доставки разнообразных цитотоксических лекарств,включая терапевтические лекарства, соединения, испускающие излучение, молекулы растительного, грибкового или бактериального происхождения, биологические белки и их смеси. Цитотоксические лекарства могут быть внутриклеточно действующими цитотоксическими лекарствами, такими, как радиоизотопные близкодействующие источники излучения, включая,например, -излучатели высокой энергии. Ферментативно активные токсины и их фрагменты проиллюстрированы А фрагментом дифтерийного токсина, несвязывающими активными фрагментами дифтерийного токсина,экзотоксином А (из Pseudomonas aeruginosa), А цепью рицина, А цепью абрина, А цепью модеццина, -сакрином, определенными белкамиPAP-S), ингибитором Morodica charantia, курцином, кротином, ингибитором Saponaria officinalis, гелонином, митогиллином, рестриктоцином,феномицином и эномицином, например. Процедуры для получения ферментативно активных полипептидов иммунотоксинов описаны в WO 84/03508 и WO 85/03508, что внесено здесь в ссылки. Некоторые цитотоксические доли произведены из адриамицина, хлорамбуцила, дау 25 номицина, метотрексата, неокарциостатина и платины, например. Процедуры для конъюгирования биологических агентов с цитотоксическими агентами были описаны ранее. Процедуры для конъюгирования хлорамбуцила с антителами описаны у(1973); Ghose, T. et al., British Medical Journal. 3:495-499 (1972); и Szekerke, M., et al., Neoplasma. 19:211-215 (1972), что внесено здесь в ссылки. Процедуры для конъюгирования дауномицина и адриамицина с антителами описаны у Hurwitz, E. et al., Cancer Research, 35:11751181 (1975) и Arnon, R. et al., Cancer Surveys. 1:429-449 (1982), что внесено здесь в ссылки. Процедуры получения конъюгатов антителорицин описаны в Патенте США No.4,414,148 и уOsawa, Т., et al., Cancer Surveys, 1:373-388 (1982) и в ссылках, процитированных там, что внесено здесь в ссылки. Процедуры связывания также описаны в ЕР 86309516.2, что внесено здесь в ссылки. В особенно предпочтительном воплощении настоящего изобретения, которое особенно хорошо подходит для умерщвления или удаления нормальных, доброкачественных гиперпластических и онкологических эпителиальных клеток простаты, первый биологический агент конъюгируют с пролекарством, которое активируется только в непосредственной близи с активатором пролекарства. Активатор пролекарства конъюгируют со вторым биологическим агентом в соответствии с настоящим изобретением,предпочтительно, таким, который связывается с неконкурентным сайтом на молекуле простатспецифического мембранного антигена. Связываются ли два биологических агента с конкурентным или неконкурентным сайтами связывания может быть определено традиционными пробами связывания. Например, моноклональные антитела J591, J533 и Е 99 связываются с конкурентными сайтами связывания на молекуле простат-специфического мембранного антигена. Моноклональное антитело J415, с другой стороны, связывается с сайтом связывания, который является неконкурентным относительно сайта, с которым J591, J533 и Е 99 связываются. Так, например, первый биологический агент может быть одним из J591, J533 и Е 99, и второй биологический агент может быть J415. Альтернативно, первый биологический агент может быть J415 и второй биологический агент может быть одним из J591, J533 и Е 99. Пары лекарство-пролекарство, подходящие для использования в практике настоящего изобретения, описаны у Blakely et al., "ZD2767, an Improved SystemTumor Xenografts", Cancer Research, 56:32873292 (1996), что внесено здесь в ссылки. Альтернативно, биологический агент может быть связан с высокоэнергичными излу 004634Baldwin et al. (eds.), pp 303-316 (Academic Press 1985), что внесено здесь в ссылки. Другие подходящие радиоизотопы включают -эмиттеры,такие, как 212Bi, 213Bi и 2llAt, и -эмиттеры, такие, как l86Re и 90Y. Ожидается, что радиотерапия будет особенно эффективной, поскольку эпителиальные клетки простаты и эндотелиальные клетки сосудов внутри опухолей являются относительно радиочувствительными. Если биологические агенты используются единственно для умерщвления или удаления онкологических клеток или эпителиальных клеток простаты, такое умерщвление или удаление может быть выполнено путем инициации эндогенных иммунных функций хозяина, как опосредованная комплементом или антителозависимая клеточная цитотоксичность. Биологический агент настоящего изобретения может быть использован и продаваться вместе с оборудованием, таким, как набор для определения определенной метки. Биологические агенты настоящего изобретения могут быть использованы вместе с другими типами терапевтического лечения. Такие другие типы лечения включают хирургию, излучение, криохирургию, термотерапию, гормональную терапию, химиотерапию, вакцины и другие иимунотерапии. Также настоящее изобретение охватывает способ умерщвления или удаления, который включает использование биологических агентов для профилактики. Например, эти материалы могут быть использованы для предотвращения или задержки развития или прогрессирования рака простаты или других типов рака. Использование терапевтических способов настоящего изобретения для лечения рака простаты или других типов рака имеет набор преимуществ. Поскольку биологические агенты, в соответствии с настоящим изобретением, имеют в качестве мишени только онкологические клетки (такие, как клетки злокачественных тканей,содержащие эндотелиальные клетки сосудов) и эпителиальные клетки сосудов, другая ткань остается нетронутой. В результате, лечение такими биологическими агентами является более безопасным, особенно для пожилых пациентов. Ожидается, что лечение в соответствии с настоящим изобретением будет особенно эффективным, поскольку оно направляет высокие уровни биологических агентов, таких, как антитела или их связывающие части, зонды или лиганды, к костному мозгу и лимфатическим со 27 судам, где преимущественно доминируют метастазы рака простаты и метастазы многих других типов рака. Более того, способы настоящего изобретения являются особенно хорошо подходящими для лечения рака простаты, размер опухоли при раке простаты имеет тенденцию к небольшому размеру и, поэтому легко разрушается цитотоксическими агентами. Лечение в соответствии с настоящим изобретением может быть эффективно прослежено по клиническим параметрам, таким, как, в случае рака простаты,сывороточный простат-специфичный антиген и/или по патологическим характеристикам рака пациента, включая стадию, шкалу Глисона(Gleason), экстракапсулярную, семянную, везикулярную или периневральную инвазии, положительные края, вовлеченные лимфатические узлы, и т.д. Альтернативно, эти параметры могут быть использованы для определения, когда такое лечение должно быть использовано. Поскольку биологические агенты настоящего изобретения связываются с живыми клетками простаты, терапевтические способы лечения рака простаты с использованием этих биологических агентов являются гораздо более эффективными, чем те, которые нацелены на лизированные клетки простаты. По этим же причинам способы диагностики и визуализации,которые определяют локализацию живых нормальных, доброкачественных гиперпластических или злокачественных эпителиальных клеток простаты (как и эндотелиальных клеток сосудов внутри опухолей) являются гораздо более продвинутыми из-за использования биологических агентов настоящего изобретения. В дополнение, способность разделять между живыми и мертвыми клетками простаты может быть преимущественной, особенно, для мониторинга эффективности определенного протокола лечения. Гибридомы Е 99, J415, J533 и J591 были депонированы, соответствуя и удовлетворяя требованиям Будапештского договора по Международному Соответствию Депонирования Микроорганизмов для целей процедуры патентования Американской Коллекции Клеточных Культур ("А.Т.С.С.") по адресу 12301, ParklawnDrive, Rockville, Maryland 20852. Гибридома Е 99 была депонирована 2 мая 1996 года и получила указательный номер А.Т.С.С. НВ-12101. Гибридома J415 была депонирована 30 мая 1996 года и получила указательный номер А.Т.С.С. НВ-12109. Гибридомы J533 и J591 были депонированы 6 июня 1996 года и получили указательные номера А.Т.С.С. НВ-12127 и НВ-12126,соответственно. Настоящее изобретение дополнительно проиллюстрировано следующими примерами. Пример 1. Ткани человека. Свежие образцы доброкачественных и злокачественных тканей были получены из от 004634 28 деления патологии Медицинского Центра Корнельского Университета Нью-Йорка (New York("NYH-CUMC"). Пример 2. Культура ткани. Культуральные линии клеток рака человека были получены из Лаборатории урологической онкологии NYH-CUMC. Линии клеток рака простаты РС-3 (Mickey, D.D. et al., "Characterization of A Human Prostate AdenocarcinomaBiol. Res 37:67-84 (1980), что внесено здесь в ссылки, DU-145 (Mickey, D.D., et al., "Characterization of A Human Prostate Adenocarcinoma CellRes 37:67-84 (1980), что внесено здесь в ссылки, и LNCaP (Horoszewicz, J.S., et al.,"LNCaP Model Of Human Prostatic Carcinoma",Cancer Res 43:1809-1818 (1983), что внесено здесь в ссылки) были получены из AmericanType Culture Collection (Rockville, MD.). Сначала гибридомы клонировали в среде RPMI-1640,с добавками 10% FCS, 0,1 мМ неосновных аминокислот, 2 мМ L-глутамина, 100 ед/мл пенициллина, 100 ug/мл стрептомицина и средыHAT (GIBCO, Grand Island, NY). Субклоны культивировали в той же среде без аминоптерина. Пример 3. Получение мышиных моноклональных антител. Мыши BALB/c женского пола были иммунизированы внутриперитонеально LNCaP (6 х 106 клеток) три раза с интервалами в 2 недели. Последняя внутрибрюшинная повторная иммунизация была осуществлена с использованием свежих эпителиальных клеток простаты, которые были выращены in vitro. Три дня спустя клетки селезенки сливали с мышиными клетками миеломы SP-2, используя стандартные методики (Ueda, R. et al., "Cell Surface Antigens OfUSA. 78: 5122-5126 (1981), что внесено здесь в ссылки). Супернатанты полученных клонов были проанализированы методом розеток и пробами цитотоксичности комплемента против живых LNCaP. Клоны, которые были позитивны по этим анализам, были проанализированы иммунохимически против нормальных почек, толстой кишки и простаты. Клоны, которые былиLNCap+/NmlKid-/тoлcтaя кишка-простата+ селектировали и переклонировали 3 раза ограниченным разведением. Класс гемоглобина культурированного супернатанта из каждого клона определяли иммунодиффузией, используя специфичную кроличью антисыворотку (Calbiochem,San Diego, CA). mAbs очищали, используя набор MAPS-II (Bio-Rad, Richmond, CA). Пример 4. Биотинилирование mAbs.(Sigma) в диметилсульфоксиде (1 мг/мл) и перемешивали в течение 4 ч при комнатной температуре. Несвязанный биотин удаляли диализом против физиологического раствора, забуференного фосфатом ("PBS"). Пример 5. Иммуногистохимическое окрашивание тканей простаты. Замороженные срезы тканей простаты помещали внутрь колец крышек плат Falcon 3034(1988), что внесено здесь в ссылки. Платы хранили при -80 С. Замороженные срезы фиксировали 2% параформальдегидом в PBS в течение 10 минут при комнатной температуре и, после промывания с PBS, блокировали активность эндогенной пероксидазы обработкой 0,3% перекисью водорода в PBS в течение 10 мин при комнатной температуре. После инкубирования срезов с 2% BSA в PBS в течение 20 мин добавляли mAbs на 60 мин при комнатной температуре. Препараты интенсивно промывали PBS и инкубировали с кроличьим анти-мышиным Ig,конъюгированным с пероксидазой (DAKOCorp., Santa Barbara, CA), разведенным в пропорции 1:100 в 10% нормальной человеческой сыворотке в PBS, в течение 60 мин при комнатной температуре. После реакции с диаминобензидином проводили контрастирующее окрашивание срезов с гематоксилином. Пример 6. Серологический анализ. Гемоадсорбционный анализ в смеси с анти-мышиным иммуноглобулином проводили,как указано у Ueda, R., et al., "Cell Surface Antigens Of Human Renal Cancer Defined By MouseSci. USA. 78:5122-5126 (1981), что внесено здесь в ссылки. Для получения клеток-индикаторов анти-мышиный Ig (DAKO Corp.) конъюгировали с человеческим RBC типа 0, используя 0,01% хлорид хрома. Серологические исследования проводили на клетках, предварительно культивированных на планшетах Терасаки (Nunc,Denmark). Антитела инкубировали с клеткамимишенями при комнатной температуре в течение 1 ч. Клетки-мишени затем промывали и добавляли клетки-индикаторы на 1 ч. Пример 7. Иммунопреципитация. Клетки LNCaP (2 х 107) биотинилировали с биотином-NHSS (в конечной концентрации 5 мМ) в течение 30 мин на льду. После промывания биотинилированные клетки снова суспендировали в 1 мл лизирующего буфера (20 мМ 30 трис/HCl рН 8.0, 1 мМ EDTA, 1 мМ PMSF, 1% тритон Х-100) в течение 30 мин на льду. Суспензию центрифугировали при 1500 g х 100 мин при 4 С, и супернатант центрифугировали при 12,000 rpm x 15 мин при 4 С. Полученный лизат предварительно абсорбировали с пансорбином,покрытым кроличьим или козлиным антимышиным IgG, в течение 1 ч при 4 С. Предварительно адсорбированный лизат инкубировали с mAb в течение ночи при 4 С. На 2 ч при 4 С добавляли агарозные шарики, покрытые кроличьим или козлиным анти-мышиным IgG, и затем промывали. Шарики снова суспендировали в трис-основании/NaCl, добавляли к буферу для проб с 2-меркаптоэтанолом и кипятили в течение 5 мин. После центрифугирования супернатант наносили на 12% гель для SDS-PAGE(ДСН-электрофорез в полиакриламидном геле). Гель переносили на нитроцеллюлозную мембрану, которую блокировали и окрашивали со стрептавидин-пероксидазой. Мембрану проявляли с диаминобензидином ("DAB"). Следующая иммунопреципитация была сходной, за исключением того, что лизат сначала предварительно очищали с одними mAb в течение ночи при 4 С. Дополнительно использовали вторые mAb для иммунопреципитации предварительно очищенного лизата. Анализировали приблизительно 2000 клонов, из которых были отобраны четыре клона,как описано в примере 3, выше. После субклонирования были проанализированы супернатанты из 4 гибридом, Е 99, J415, J533 и J591 путем иммунофлуоресценции против живых (т.е., нефиксированных) LNCaP, иммунопреципитации и последующей иммунопреципитации для подтверждения реактивности к PSMA. Иммунофлуоресцентное исследование с использованием LNCaP клеток-мишеней (впервые описанных у Horoszewicz, что внесено здесь в ссылки, для получения антител 7 Е 11 и прототипной линии клеток для экспрессии PSMA) показывает, что антитела Е 99 связываются и оставляют живые клетки LNCaP иммунофлуоресцентными. Это отличается от антител 7 Е 11,которые, как впервые отмечено у Horoszewicz,что внесено здесь в ссылки, обеспечивают только слабое или не обеспечивают связывания с живыми клетками LNCaP, но проявляют сильное связывание так только клетки фиксируют(убивают). Реактивности четырех mAbs с нормальными человеческими тканями исследовали иммуногистохимически; эти результаты представлены в табл. 3. Таблица 3. Реактивность mAbs с нормальными человеческими тканями по непрямому окрашиванию иммунопероксидазой 32 Пример 9. Реактивность mAb к внеклеточному домену PSMA. Для подтверждения экспрессии на поверхности клеток (внеклеточной) определяемогоLNCaP, без фиксации, in vitro, путем иммунофлуоресценции. Клетки LNCaP промывали и инкубировали с mAb в течение 1 ч при комнатной температуре и затем с кроличьим антимышиным Ig-флуоресцеином (DAKO Corp.,Santa Barbara, СА). Информацию с лунок считывали при помощи флуоресцентного микроскопа. Негативный контроль состоял из соответствующих изотипу чужеродных mAb, в то время, как анти-класс I MHC mAb служили в качестве позитивного контроля. Результаты иммунофлуоресценции и анализа розеток представлены в табл. 5. Таблица 5 Вышеописанное последовательное изучение иммунопреципитации показало, что 7 Е 11,Е 99, J415, J533 и J591 связываются с одной и той же молекулой, т.е. PSMA. Пример 8. - Исследование Western Blot. Для подтверждения того, что антитела Е 99, J415, J533 и J591 осаждают одинаковую полосу с антителом 7 Е 11 (т.е., PSMA), проводили анализ Western Blot. Семенную плазму (400 г/лунку) или лизат LNCaP наносили в лунки 12% SDS-PAGE геля. После электрофореза гель переносили на нитроцеллюлозные мембраны. Мембраны блокировали 5% сухим молоком/ Трис-забуференным физиологическим раствором-tween 20 ("TBST") на 60 мин при комнатной температуре. После повторной промывки мембраны инкубировали с первичными mAb в течение 60 мин при комнатной температуре. После повторной промывки мембраны инкубировали с комплексом овечий анти-мышиный-Igпероксидаза 1/5000 в 5% сухом молоке/TBST в течение 60 мин при комнатной температуре. После повторной промывки мембраны проявляли, используя хемилюминесцентную метку под названием "ECL" (Amersham Life Sciences, International, Arlington Heights, Illinois) в соответствии с указаниями производителя. Результаты эксперимента Western Blot представлены в табл. 4. Таблица 4 Пример 10. Исследования конкуренции. Исследования конкуренции проводили для определения, обнаруживают ли J591, J533, Е 99 и J415 одинаковые или различные антигенные сайты (эпитопы) молекул простат-специфичного мембранного антигена, используя следующую процедуру. Платы покрывали лизатом клеточной линии LNCaP в качестве источника простатспецифичного мембранного антигена и промывали для удаления несвязанного материала."Холодные" (немеченые) моноклональные антитела инкубировали на плате в течение 1 ч при комнатной температуре для осуществления связывания с их антигенным сайтом. Дополнительно, добавляли вторые моноклональные антитела, меченые либо биотином, либо 125I, на еще один час. Платы промывали для удаления несвязанного материала. Количество вторых моноклональных антител, связанных платой, покрытой простат-специфичным мембранным антигеном, определяли либо при помощи комплекса авидин-щелочная фосфатаза в иммуноферментном анализе (в случае вторых моноклональных антител, меченых биотином), либо физическим подсчетом лунок в гамма-счетчике (в случае вторых моноклональных антител, меченых 125I). Контроли состояли из использования тех же моноклональных антител, и немеченых,и меченых, для определения "100% конкуренции", или из использования моноклональных антител к совершенно отличной молекуле (например, моноклонального антитела 1-56, кото 33 рое определяет ингибин, имеющий отношение к простате белок, отличный от простатспецифичного мембранного антигена) для определения "0% конкуренции". Результаты показывают, что каждый изJ591, J533 и Е 99 служит помехой, конкурирует или блокирует связывание друг друга, но не блокирует связывание J415, и наоборот. 7E11/CYT356, о котором известно, что он связывается с PSMA в другом (внутриклеточном) сайте,не блокировал ни один из J591, J533, Е 99 илиJ415. Наличие пар моноклональных антител, которые связываются с неконкурентными сайтами, позволяет создать метод анализа сэндвича(комплекса) антител для определения растворимых антигенов, таких, как растворимый простат-специфичный мембранный антиген или его фрагмент в, например, жидкостях организма. Например,антиген(например,простатспецифичный мембранный антиген или его фрагмент) может быть "захвачен" из жидкости организма при помощи J591 и, на другом этапе,определен при помощи меченого J415. В другом воплощении, т.е. лечении, можно увеличить связывание антител путем использования комбинации неконкурентных моноклональных антител. Например, предполагая, что каждый из неконкурентных сайтов один раз представлен на молекуле простат-специфичного мембранного антигена, добавление комбинацииJ591 плюс J415 могло бы связывать в два раза больше молекул моноклональных антител, нежели любое из моноклональных антител по отдельности. Связывание двух неконкурентных антигенных сайтов связывания также может приводить к большему перекрестному связыванию антигена и, возможно, повышенной интернализации. Дополнительно, поскольку две определяемых сайта физически локализованы на одной молекуле простат-специфичного мембранного антигена, связывание двух молекул моноклональных антител с этой единственной молекулой простат-специфичного мембранного антигена ставит две молекулы моноклональных антител в непосредственную близость одной к другой, ситуация, которая обеспечивает оптимальное взаимодействие лекарство - пролекарство. Например, моноклональное антитело J591 может быть конъюгировано с активатором пролекарства. Поскольку пролекарство и активатор могут быть связаны в непосредственной близи только в месте клеток, экспрессирующих простат-специфичный мембранный антиген (т.е.,клеток рака простаты) активация пролекарства в активную форму может происходить только в этих местах. Пример 11. Микроскопия. Софокусная микроскопия и иммуноэлектронная микроскопия продемонстрировали,что Е 99, J591, J533 и J415 связываются с клеточной мембраной в ямках, покрытых клатри 004634 34 ном, и затем быстро интернализуются в эндосомы (цитоплазматические везикулы). Фиг. 1-4 являются иммуно-электронными микрофотографиями, которые прослеживают взаимодействие моноклонального антитела J591, меченого золотом, с клеточной поверхностью как функцию времени. На этих фигурах местонахождение моноклонального антитела показано черными точками. Живые клетки LNCaP инкубировали с J591 в течение одного часа при 4 С. Клетки промывали и затем содержали при 37 С в течение 0, 5,10 или 15 мин, после чего их фиксировали и подвергали иммуно-электронной микроскопии. Фиг. 1 показывает клетки перед инкубации при 37 С. Можно видеть J591, связанным с клеткой вдоль наружной стороны клеточной мембраны. На этой фигуре "М" обозначает митохондрию клетки, и "N" обозначает ее ядро. Фиг. 2 показывает клетку после инкубации при 37 С в течение 5 мин. Стрелка показывает формирование ямки, покрытой клатрином. На фиг. 3, которая показывает клетку после 10 мин инкубации при 37 С, можно видеть захват или эндоцитоз покрытой клатрином ямки, как показано стрелкой. Фиг. 4 показывает, что после инкубации при 37 С в течение 15 мин моноклональное антитело J591 содержится в эндоцитозных везикулах внутри клетки, как показано стрелками. Как можно видеть на фиг. 5, после инкубации при 37 С в течение 15 мин. моноклональное антитело J591 также содержится внутри эндосом, как показано стрелками. Пример 12. Секвенирование вариабельного района моноклонального антитела J591. Общую РНК получали из 107 клеток мышиной гибридомы J591. Пробу культуральной среды этих клеток тестировали на связывание со специфическим антигеном J591 на клетках простаты. Культуральная среда была позитивна и по твердофазному иммуно-ферментному анализу, и по Western Blot на связывание с антигеном. кДНК VH и VK получали, используя обратную транскриптазу и мышиныйпостоянный район, и праймеры постоянного района мышиного IgG. кДНК первой цепи были амплифицированы ПЦР, используя разнообразные праймеры мышиных сигнальных последовательностей (6 для VH и 7 для VK). Амплифицированные ДНК очищали на геле и клонировали в вектор рТ 7 В 1uе. Полученные клоны VH и VK анализировали на правильную встройку путем ПЦР и определяли последовательность ДНК отобранных клонов методом дидеокситерминации цепи. Исключая район праймера (поскольку эта последовательность зависит от последовательности использованного праймера), все полученные клоны VH имели идентичную последовательность. Эта последовательность была получена из клонов, полученных с тремя различными 5' праймерами. Один клон имел изменение 35 одной пары оснований внутри сигнальной последовательности, и один клон содержал измененный продукт ПЦР. Используя стратегию секвенирования, показанную на фиг. 6, получали нуклеотидную последовательность тяжелой цепи. Она обозначена SEQ. ID. No. 1 и показана на фиг. 7 вместе с нуклеотидной последовательностью соответствующей обратной, некодирующей цепи (обозначенной SEQ. ID. No. 2). Эти последовательности включают часть сигнальной последовательности и часть постоянного района антитела. Соответствующие вычисленные аминокислотные последовательностиNo. 4 и SEQ. ID. No. 5, также показаны на фиг. 7. Кодирующая цепь вариабельного района тяжелой цепи J591 (исключая сигнальную последовательность и компоненты постоянного района) имеет следующую нуклеотидную последовательность (обозначенную SEQ. ID. No. 6): Обратная, некодирующая цепь вариабельного района тяжелой цепи J591 (исключая сигнальную последовательность и компоненты постоянного района) имеет следующую нуклеотидную последовательность (обозначенную Белковая последовательность, соответствующая вариабельному району тяжелой цепиJ591 (исключая сигнальную последовательность и компоненты постоянного района) имеет следующую нуклеотидную последовательностьJ591 VH содержится в подгруппе III мышиных тяжелых цепей (Kabat et al., Sequences ofProteins of Immunological Interest. U.S. Department of Health and Human Services (1991) ("Kabat"), что внесено здесь в ссылки). Последовательность J591 VH сравнивается со смысловой последовательностью для этой подгруппы на фиг. 8. В отличие от VH, было получено более одной последовательности VK. Из исследованных 15 клонов VK четыре имели последовательность измененного мышиного Ig из пары слияния (Carol et al., Molecular Immunology. 25:991-995 (1988), что внесено здесь в ссылки). Эти клоны происходили из двух специфичных 5' праймеров. Дальнейшей работы с этими клонами не проводили. Из оставшихся клонов десять 36 имели одинаковые нуклеотидные последовательности, и один клон, VK17, имел альтернативную VK последовательность. Десять идентичных клонов происходили из трех 5' праймеров (отличных от двух, которые имели измененные последовательности), один из которых также продуцировал VK17. Стратегия секвенирования, которая была использована, показана на фиг. 9. Нуклеотидная последовательность J591VK, соответствующая десяти идентичным клонам (обозначенная SEQ. ID. No. 9) представлена на фиг. 10 вместе с нуклеотидной последовательностью соответствующей обратной, некодирующей цепи (обозначенной SEQ. ID. No. 10) и вычисленными аминокислотными последовательностями, которые обозначены SEQ. ID. No. 11, SEQ. ID. No. 12 и SEQ. ID. No. 13. Эти последовательности включают часть сигнальной последовательности и часть постоянного района антитела. Кодирующая цепь вариабельного района легкой (каппа) цепи J591 (исключая сигнальную последовательность и компоненты постоянного района), соответствующая десяти идентичным клонам, имеет следующую нуклеотидную последовательность (обозначенную Обратная, некодирующая цепь вариабельного района легкой (каппа) цепи J591 (исключая сигнальную последовательность и компоненты постоянного района), соответствующая десяти идентичным клонам, имеет следующую нуклеотидную последовательность (обозначенную Белковая последовательность, соответствующая вариабельному району легкой (каппа) цепи J591 (исключая сигнальную последовательность и компоненты постоянного района),соответствующая десяти идентичным клонам,имеет следующую нуклеотидную последовательность (обозначенную SEQ. ID. No. 16): Кодирующая цепь вариабельного района легкой (каппа) цепи J591 (исключая сигнальную последовательность и компоненты постоянного района), соответствующая клону VK17, имеет следующую нуклеотидную последовательность Обратная, некодирующая цепь вариабельного района легкой (каппа) цепи J591 (исключая сигнальную последовательность и компоненты постоянного района), соответствующая клонуVK17, имеет следующую нуклеотидную последовательность (обозначенную SEQ. ID. No. 18): Белковая последовательность, соответствующая вариабельному району легкой (каппа) цепи J591 (исключая сигнальную последовательность и компоненты постоянного района),соответствующая клону VK17, имеет следующую нуклеотидную последовательность (обозначенную SEQ. ID. No.19):J591 VK относится к Подгруппе V мышиных каппа цепей (Kabat, что внесено здесь в ссылки). Последовательность J591 VK, соответствующая десяти идентичным клонам, сравнивается со смысловой последовательностью для подгруппы на фиг. 11. Предпочтительными J591 являются таковые, которые имеют кодирующие последовательности цепи ДНК вариабельного района, соответствующие SEQ. ID. No. 6 и последовательностям некодирующих цепей (обратных), соответствующих SEQ. ID. No. 7. Вариабельный район тяжелой цепи J591, предпочтительно,имеет аминокислотную последовательность,соответствующую SEQ. ID. No. 8. Вариабельный район легкой цепи J591, предпочтительно,имеет последовательность кодирующей цепи ДНК, соответствующую SEQ. ID. No. 17, последовательность некодирующей (обратной) цепи ДНК, соответствующую SEQ. ID. No. 18, и аминокислотную последовательность, соответствующую SEQ. ID. No. 19. Пример 13. Иммуногистохимическое окрашивание нормальных и злокачественных тканей. Онкологические ткани из 23 карцином предварительно охлаждали в жидком азоте, быстро замораживая в соединении ОСТ (Miles,Elkhart, Indiana) на сухом льду, и хранили при-80 С. Замороженные срезы тканей (5 м) фиксировали в холодном ацетоне (4 С) в течение 10 мин. mAbs (5 г/мл или супернатанты гибридом) инкубировали в течение 1 ч при комнатной температуре. Связывание антител определяли,используя кроличий анти-мышиный комплексIg-пероксидаза (DAKO, Caprinteria, California) в качестве вторых антител и DAB (Sigma, 004634St.Louis, Missouri) в качестве хромогена. Сходные по изотипу чужеродные антитела использовали как негативный контроль.mAbs J591, J533, J415 и Е 99 сильно реагировали с клеточным эндотелием во всех 23 исследованных карциномах, включая 9/9 почечных, 5/5 уротелия, 6/6 толстой кишки, 1/1 легких и 1/1 карцином молочной железы, и 1/1 метастатической аденокарциномы печени. Фиг. 2A-2F, соответственно, показывают иммуногистохимическую реактивность mAb J591 к вновь образованным сосудам карциномы почек, уротелия, толстой кишки, легких и молочной железы, и метастатической аденокарциномы печени. Несмотря на то, что изобретение было детально описано в целях иллюстрации, очевидно,что эти детали перечислены только по этой причине, и профессионалами в области могут быть сделаны варианты без отхода от идеи и рамок изобретения, которые определены следующей формулой изобретения. Перечисленние последовательностей ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Изолированное моноклональное антитело или его антигенсвязывающий участок, которые связываются с внеклеточным доменом простат-специфического мембранного антигена(PSMA), где антитело или его антигенсвязывающий участок связываются с живыми клетками. 2. Изолированное поликлональное антитело или его антигенсвязывающий участок, которые связываются с внеклеточным доменом простат-специфического мембранного антигена(PSMA), где антитело или его антигенсвязывающий участок связываются с живыми клетками. 3. Антитело или его антигенсвязывающий участок по п.1 или 2, которые позволяют использовать агенты, активные в клетке. 4. Изолированное антитело или его антигенсвязывающий участок по пп.1-3, где антитело или его антигенсвязывающий участок представляют собой IgG. 5. Изолированное антитело или его антигенсвязывающий участок по пп.1-4, выбранные из группы, состоящей из Fab-фрагмента, F(аb')2 фрагмента и Fv-фрагмента. 6. Изолированное антитело или его антигенсвязывающий участок по пп.1-5, которые конкурируют за связывание PSMA с антителом,выбранным из группы, состоящей из моноклональных антител Е 99, J533 и JS91. 7. Изолированное антитело или его антигенсвязывающий участок по п.6, которые конкурируют за связывание PSMA с моноклональным антителом J591. 8. Изолированное антитело или его антигенсвязывающий участок по пп.1-5, которые связываются с внеклеточным эпитопом PSMA,который также распознается антителом, выбранным из группы, состоящей из моноклональных антител Е 99, J533 и J591. 44 9. Изолированное антитело или его антигенсвязывающий участок по п.8, которые связываются с внеклеточным эпитопом PSMA, который также распознается моноклональным антителом J591. 10. Изолированное антитело или его антигенсвязывающий участок по пп.1-5, которые конкурируют за связывание PSMA с моноклональным антителом J415. 11. Изолированное антитело или его антигенсвязывающий участок по п.10, которые связываются с внеклеточным эпитопом PSMA, который также распознается моноклональным антителом J415. 12. Изолированное антитело или его антигенсвязывающий участок по пп.1 или 3-5, где антитело выбрано из группы, состоящей из моноклональных антител Е 99, J533, J415 и J591. 13. Изолированное антитело по пп.1 или 34, продуцируемое гибридомой, имеющей регистрационный номер АТСС, выбранный из группы, состоящей из НВ-12101, НВ-12109, НВ 12127 и НВ-12126. 14. Изолированное антитело или его антигенсвязывающий участок по пп.1-5, которые содержат антигенсвязывающий участок аминокислотной последовательности, выбранной из группы, состоящей из аминокислотной последовательности вариабельного участка тяжелой цепи SEQ ID NO:8 и аминокислотной последовательности вариабельного участка легкой цепиSEQ ID NO:19. 15. Изолированное антитело или его антигенсвязывающий участок по п.14, которые содержат антигенсвязывающий участок из аминокислотной последовательности вариабельного участка тяжелой цепи SEQ ID NO:8 и антигенсвязывающий участок из аминокислотной последовательности вариабельного участка легкой цепи SEQ ID NO:19. 16. Изолированное антитело или его антигенсвязывающий участок по пп.1-5, которые содержат антигенсвязывающий участок аминокислотной последовательности, кодируемой нуклеотидной последовательностью, выбранной из группы, состоящей из нуклеотидной последовательности вариабельного участка тяжелой цепи SEQ ID NO:6 и нуклеотидной последовательности вариабельного участка легкой цепиSEQ ID NO:17. 17. Изолированное антитело или его антигенсвязывающий участок по п.16, которые содержат антигенсвязывающий участок аминокислотной последовательности, кодируемой нуклеотидной последовательностью вариабельного участка тяжелой цепи SEQ ID NO:6, и антигенсвязывающий участок аминокислотной последовательности, кодируемой нуклеотидной последовательностью вариабельного участка легкой цепи SEQ ID NO:17. 18. Изолированное антитело или его антигенсвязывающий участок по пп.1-17, где анти 45 тело или его антигенсвязывающий участок связаны с цитотоксическим лекарством. 19. Изолированное антитело или его антигенсвязывающий участок по п.18, где цитотоксическое лекарство выбрано из группы, состоящей из терапевтического лекарства, вещества,испускающего излучение, молекул растительного, грибного или бактериального происхождения, белков и их смесей. 20. Изолированное антитело или его антигенсвязывающий участок по п.19, где цитотоксическое лекарство представляет собой вещество, испускающее излучение. 21. Изолированное антитело или его антигенсвязывающий участок по п.20, где вещество,испускающее излучение, представляет собой излучатель, -излучатель или -излучатель. 22. Изолированное антитело или его антигенсвязывающий участок по п.21, где вещество,испускающее излучение, выбрано из группы,состоящей из 212Bi, 213Bi, 211At, 186Re,90Y и 131I. 23. Изолированное антитело или его антигенсвязывающий участок по пп.1-22, где антитело или его антигенсвязывающий участок связаны с меткой. 24. Изолированное антитело или его антигенсвязывающий участок по п.23, где метка выбрана из группы, состоящей из флуоресцентной метки, биологически активной ферментной метки, радиоактивной метки, метки, активной в отношении ядерного магнитного резонанса,люминесцентной метки и хромофорной метки. 25. Изолированное антитело или его антигенсвязывающий участок по п.24, где радиоактивная метка выбрана из группы, состоящей из 32 Р, 125I, 3 Н, 14 С, 188Rh, 131I, 99mTc и 111In. 26. Композиция, содержащая изолированное антитело или его антигенсвязывающий участок по любому из пп.1-25 и физиологически приемлемый носитель, наполнитель или стабилизатор, смешанные с изолированным антителом или его антигенсвязывающим участком. 27. Композиция, содержащая изолированное антитело или его антигенсвязывающий участок по любому из пп.1-25 и фармацевтически приемлемый носитель, наполнитель или стабилизатор, смешанные с изолированным антителом или его антигенсвязывающим участком. 28. Набор для определения PSMAэкспрессирующих клеток, содержащий изолированное антитело или его антигенсвязывающий участок по любому из пп.23-25 и средство для обнаружения метки. 29. Набор по п.28, где клетки представляют собой злокачественные клетки. 30. Набор для определения PSMAэкспрессирующих клеток, содержащий изолированное антитело или его антигенсвязывающий участок по любому из пп.1-22, метку, средство для присоединения метки к антителу или 46 его антигенсвязывающему участку и средство для обнаружения метки. 31. Набор по п.30, где клетки представляют собой злокачественные клетки. 32. Набор по пп.28-31, дополнительно содержащий физиологически приемлемый носитель, наполнитель или стабилизатор. 33. Набор по пп.28-31, дополнительно содержащий фармацевтически приемлемый носитель, наполнитель или стабилизатор. 34. Набор по пп.28-31, где метка выбрана из группы, состоящей из флюоресцентной метки, биологически активной ферментной метки,радиоактивной метки, метки, активной в отношении ядерного магнитного резонанса, люминесцентной метки и хромофорной метки. 35. Набор по п.34, где радиоактивная метка выбрана из группы, состоящей из 32 Р, 125I, 3 Н,14 С, 188Rh, 131I, 99mTc и 111In. 36. Набор по пп.30-35, где рак представляет собой рак простаты. 37. Набор по пп.30-35, где рак выбран из группы, состоящей из рака почек, рака уротелия, рака толстой кишки, рака легких, рака молочной железы и метастазирующей в печень аденокарциномы. 38. Клеточная линия гибридомы, имеющая регистрационный номер АТСС НВ-12101, которая продуцирует моноклональное антитело Е 99. 39. Клеточная линия гибридомы, имеющая регистрационный номер АТСС НВ-12109, которая продуцирует моноклональное антителоJ415. 40. Клеточная линия гибридомы, имеющая регистрационный номер АТСС НВ-12127, которая продуцирует моноклональное антителоJ533. 41. Клеточная линия гибридомы, имеющая регистрационный номер АТСС НВ-12126, которая продуцирует моноклональное антителоJ591. 42. Способ лечения, предупреждения возникновения или замедления развития рака у субъекта, включающий получение антитела или его антигенсвязывающего участка по пп.1-25, и введение антитела или его антигенсвязывающего участка субъекту при условиях, эффективных для лечения, предупреждения возникновения или замедления развития рака. 43. Способ по п.42, где рак представляет собой рак простаты. 44. Способ по п.43, где рак простаты является метастазирующим. 45. Способ по п.44, где метастазирующий рак простаты включает метастазы в костный мозг или лимфатические узлы. 46. Способ по пп.43-45, где введение антитела или его антигенсвязывающего участка осуществляют после простатэктомии. 47. Способ по п.42, где рак представляет собой непростатический рак. 47 48. Способ по п.47, где непростатический рак выбран из группы, состоящей из рака почек,рака уротелия, рака толстой кишки, рака легких,рака молочной железы и метастазирующей в печень аденокарциномы. 49. Способ по п.47, где антитело или его антигенсвязывающий участок связываются с эндотелиальными клетками сосудов, находящихся рядом с непростатическими злокачественными клетками или внутри непростатической злокачественной опухоли. 50. Способ по пп.42-49, где введение осуществляют путем парентеральной, внутривенной, внутримышечной, ректальной или внутриполостной инсталляции. 51. Способ по пп.42-50, где антитело или его антигенсвязывающий участок интернализуются с PSMA. 52. Способ по пп.42-51, где введение антитела комбинируют с дополнительной терапией. 53. Способ по п.52, где дополнительная терапия выбрана из группы, состоящей из хирургической операции, радиоактивного облучения,химиотерапии, иммунотерапии и гормонального замещения. 54. Способ по п.53, где гормональное замещение включает обработку эстрогеном или антиандрогенным агентом. 55. Способ по п.54, где антиандрогенный агент представляет собой агент, который блокирует или ингибирует действие тестостерона. 56. Способ по пп.42-44, где антитело или его антигенсвязывающий участок эффективны для индукции эндогенной иммунной функции хозяина. 57. Способ по п.56, где эндогенная иммунная функция хозяина представляет собой комплемент-зависимую цитотоксичность или антитело-зависимую цитотоксичность. 58. Способ лечения, предупреждения возникновения или замедления развития рака у субъекта, включающий получение первого антитела или его антигенсвязывающего участка по пп.1-25, получение второго антитела или его антигенсвязывающего участка, которые связываются с внеклеточным доменом простатспецифического мембранного антигена, и введение и первого антитела или его антигенсвязывающего участка, и второго антитела или его антигенсвязывающего участка субъекту, нуждающемуся в лечении, при условиях, эффективных для лечения, предупреждения возникновения или замедления развития рака. 59. Способ по п.58, где рак представляет собой рак простаты. 60. Способ по п.59, где рак простаты является метастазирующим. 61. Способ по п.60, где метастазирующий рак простаты включает метастазы в костный мозг или лимфатические узлы. 62. Способ по пп.58-61, где введение осуществляют путем парентеральной, внутривен 004634 48 ной, внутримышечной, ректальной или внутриполостной инсталляции. 63. Способ по пп.58-62, где введение антитела или его антигенсвязывающего участка осуществляют после простатэктомии. 64. Способ по п.58, где рак представляет собой непростатический рак. 65. Способ по п.64, где введение осуществляют путем парентеральной, внутривенной,внутримышечной, ректальной или внутриполостной инсталляции. 66. Способ определенияPSMAэкспрессирующих клеток, включающий получение антитела или его антигенсвязывающего участка по пп.23-25, где антитело или его антигенсвязывающий участок связаны с меткой,обеспечение взаимодействияPSMAэкспрессирующих клеток с антителом или его антигенсвязывающим участком при условиях,эффективных для связывания, и определениеPSMA-экспрессирующих клеток путем обнаружения метки. 67. Способ по п.66, где клетки представляют собой нормальные, доброкачественные гиперпластические или злокачественные клетки простаты. 68. Способ по п.66, где клетки представляют собой непростатические злокачественные клетки. 69. Способ по пп.66-68, где взаимодействие обеспечивают in vitro. 70. Способ по п.69, где взаимодействие обеспечивают в образце сыворотки или мочи. 71. Способ по п.69, где взаимодействие обеспечивают в биопсийном образце ткани. 72. Способ по п.70 или 71, где образец взят от человека. 73. Способ по п.66, где взаимодействие обеспечивают в живом млекопитающем, включающий введение антитела или его антигенсвязывающего участка млекопитающему при условиях, эффективных для связывания антитела или его антигенсвязывающего участка с PSMAэкспрессирующими клетками, присутствующими у млекопитающего. 74. Способ по п.67, где взаимодействие обеспечивают в живом млекопитающем, включающий введение антитела или его антигенсвязывающего участка млекопитающему при условиях, эффективных для связывания антитела или его антигенсвязывающего участка с эндотелиальными клетками сосудов, находящихся рядом или внутри нормальной, доброкачественной гиперпластической или злокачественной ткани простаты, присутствующей у млекопитающего. 75. Способ по п.68, где взаимодействие обеспечивают в живом млекопитающем, включающий введение антитела или его антигенсвязывающего участка млекопитающему при условиях, эффективных для связывания антитела или его антигенсвязывающего участка с эндотелиальными клетками сосудов, находящихся ря 49 дом или внутри непростатической злокачественной ткани, присутствующей у млекопитающего. 76. Способ по п.75, где непростатическая злокачественная ткань представляет собой злокачественную ткань почек, злокачественную ткань уротелия, злокачественную ткань толстой кишки, злокачественную ткань легких, злокачественную ткань молочной железы, злокачественную ткань метастазирующей в печень аденокарциномы, злокачественную ткань лимфатических узлов или злокачественную ткань метастазов в костный мозг. 77. Способ по пп. 75-76, где антитело или его антигенсвязывающий участок связываются с эндотелиальными клетками сосудов, находящихся рядом или внутри непростатической злокачественной ткани. 78. Способ по пп.75-77, где обнаружение метки определяет местоположение непростатической злокачественной ткани в теле субъекта. 79. Способ по п.74, где обнаружение метки определяет местоположение нормальной, доб 004634 50 рокачественной гиперпластической или злокачественной ткани простаты в теле субъекта. 80. Способ по п.73, где обнаружение метки определяет местоположениеPSMAэкспрессирующих клеток в теле субъекта. 81. Способ по пп.73-79, где субъектом является человек. 82. Способ по пп.73-81, где метку обнаруживают с помощью устройства для визуализации изображения. 83. Способ по пп.73-82, где метку обнаруживают с помощью трансректального зонда. 84. Способ по пп.42-80, где изолированное антитело или его антигенсвязывающий участок находятся в составе композиции, дополнительно включающей физиологически приемлемый носитель, наполнитель или стабилизатор. 85. Способ по пп.42-80, где изолированное антитело или его антигенсвязывающий участок находятся в составе композиции, дополнительно включающей фармацевтически приемлемый носитель, наполнитель или стабилизатор.
МПК / Метки
МПК: G01N 33/574
Метки: диагностика, лечение, рака
Код ссылки
<a href="https://eas.patents.su/27-4634-lechenie-i-diagnostika-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Лечение и диагностика рака</a>
Предыдущий патент: Способ получения производного тетразола
Следующий патент: Рецептор baff (bcma), иммунорегуляторный агент
Случайный патент: Патрон (варианты)