Пестицидные соединения, составы и способ их получения.
Номер патента: 2064
Опубликовано: 24.12.2001
Авторы: Куруцне Р.Жужа, Пап Ласло, Секей Иштван, Баконьвари Ильдико, Арваи Геза, Чиз Ласло, Цудор Ирэн, Берток Бэла
Формула / Реферат
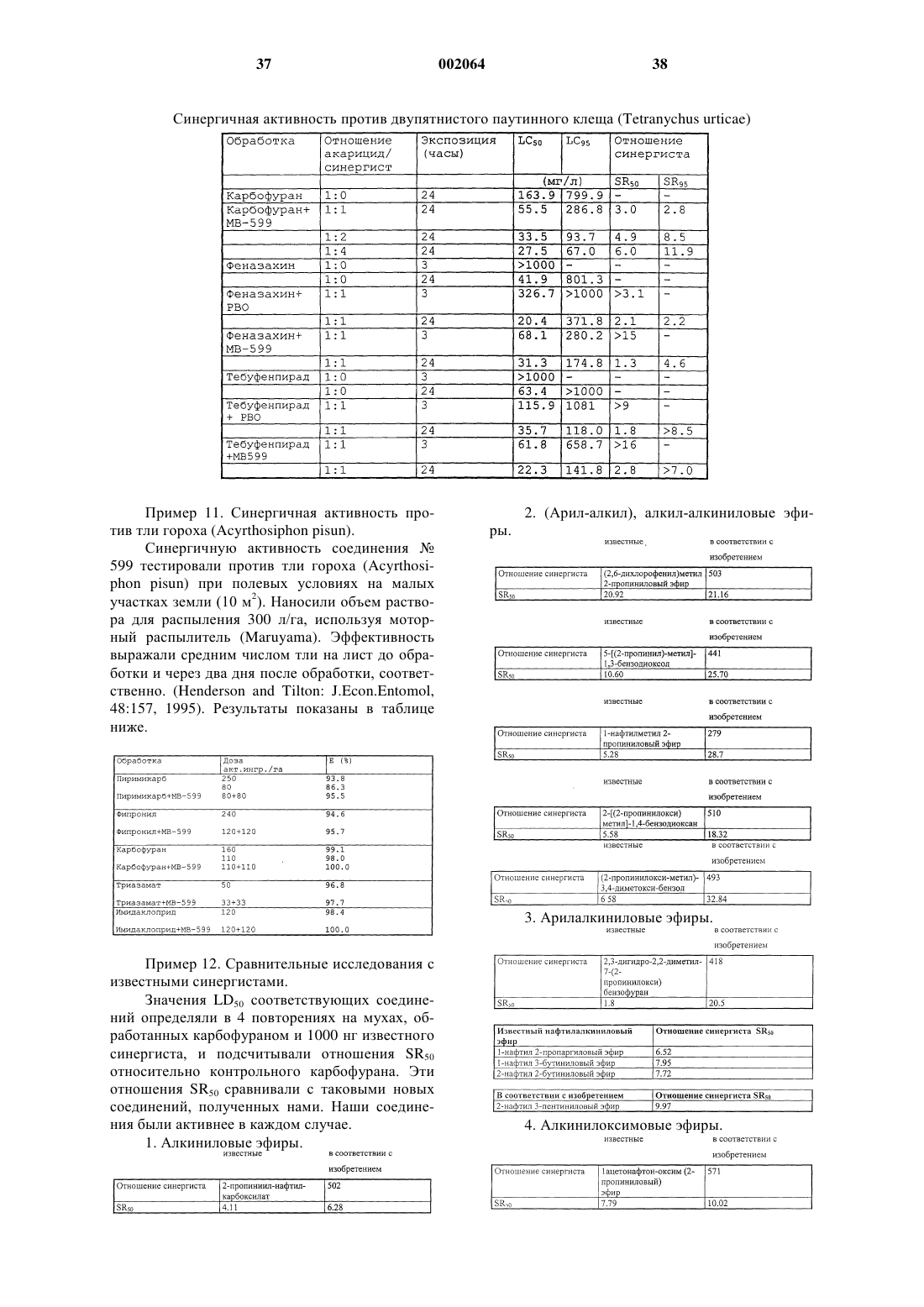
1. Соединения общей формулы I
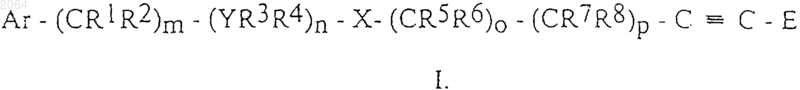
их оптически активные изомеры и соли, где
Аr является С3-С6 алициклической, ароматической или пяти- или шестичленной гетероциклической группой, содержащей один или два атома азота и/или один или два атома кислорода, которая может быть замещена одной или более C1-C4 алкокси-, метилендиокси-, C1-C6 алкильной, C1-C6 галогеналкильной, нитрогруппой или атомом галогена и/или конденсирована с бензольным кольцом;
R1, R2 являются, независимо друг от друга, Н, C1-C6 алкилом, C1-C6 галогеналкилом, C1-C6 алкенилом, фенилом, C3-C6 циклоалкилом,
R3, R4 являются, независимо друг от друга, Н, C1-C6 алкилом, C1-C6 галогеналкилом, C1-C6 алкенилом, фенилом, C3-C6 циклоалкилом, или
R3 и R4 являются совместно атомом кислорода,
Y=C или
YR3R4 вместе образуют 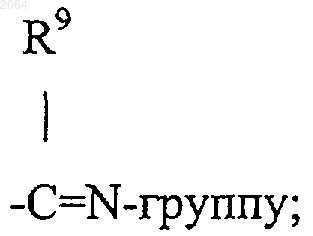
X = -О-; -NR10-;
R9 = H, C1-C6 алкилу, фенилу;
R10 = Н, C1-C6 алкилу;
R5, R6, R7, R8 являются, независимо друг от друга, Н, C1-C6 алкилом, C1-C6 галогеналкилом, C1-C6 алкенилом;
Е = Н, метилу, где метил условно считается одним атомом;
m = 0, 1, 2;
n = 0, 1;
o = 0, 1, 2;
p = 0, 1, 2,
с условием, что сумма атомов -(CR1R2)m-(YR3R4)n-X-(CR5R6)o-(CR7R8)p скелетного моста равна 3 и -Су С-Е скелет образует с атомами моста линейную цепь, состоящую из 6 атомов, заканчивающуюся предпочтительно метильной группой, с дополнительным условием, что,
если Аr является нафтильной группой, Y означает С-атом, Х означает O-атом, R3 и R4 совместно не могут означать =O, или
если Аr является фталимидной группой, R1 означает метил, m = 1, n = 0, о = 1, R5 и R6 являются атомами водорода, р = 0, Е не является водородом, или
если Аr является нафтильной группой, m = 0, n = 0, Х означает O-атом, R5, R6, R7 и R8 являются атомами водорода, Е не является водородом, или
если Аr является фенилом, который может быть замещен или нафтилом, m = 0, n = 1, Х означает O-атом, Y является атомом углерода, R3 и R4 являются атомами водорода или совместно означают атом кислорода, или YR3R4 вместе образуют R9-C=N-группy, где R9 = H или алкилу, Е не является водородом.
2. Соединения общей формулы IA
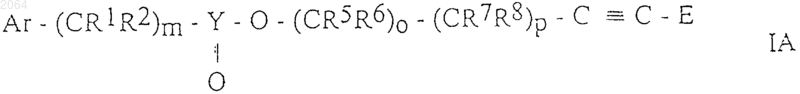
и их оптически активные изомеры, где Аr, R1, R2, R5, R6, R7, R8, Y, Е, m, о и р имеют те же значения, как определено в п.1.
3. Соединения общей формулы IB

и их оптически активные изомеры, где Аr, R1, R2, R5, R6, R7, R8, R10, Y, Е, m, о и р имеют те же значения, как определено в п.1.
4. Соединения общей формулы IC
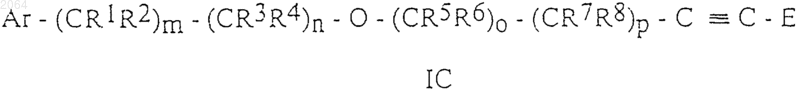
и их оптически активные изомеры, где Аr, R1, R2, R3, R4, R5, R6, R7, R8, Е, m, n, о и р имеют те же значения, как определено в п.1.
5. Соединения общей формулы ID
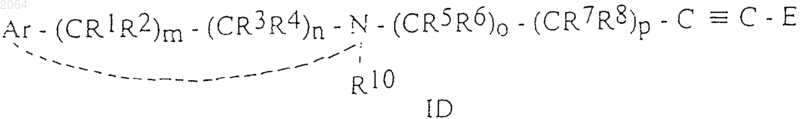
и их соли, и их оптически активные изомеры, где Ar, R1, R2, R3, R4, R5, R6, R7, R8, R10, Е, m, n, о и р имеют те же значения, как определено в п.1.
6. Соединения общей формулы IE
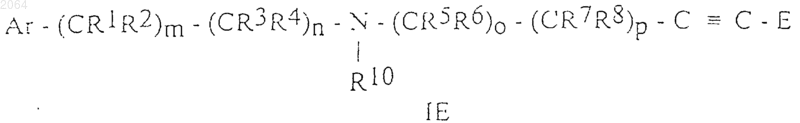
и их соли, и их оптически активные изомеры, где Ar, R1, R2, R3, R4, R5, R6, R7, R8, R10, E, m, n, о и р имеют те же значения, как определено в п.1.
7. Соединения общей формулы IF
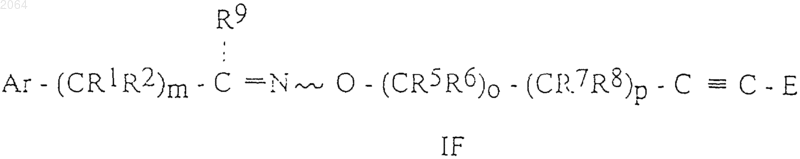
и их оптически активные изомеры, где Ar, R1, R2, R5, R6, R7, R8, R9, Е, m, о и р имеют те же значения, как определено в п.1.
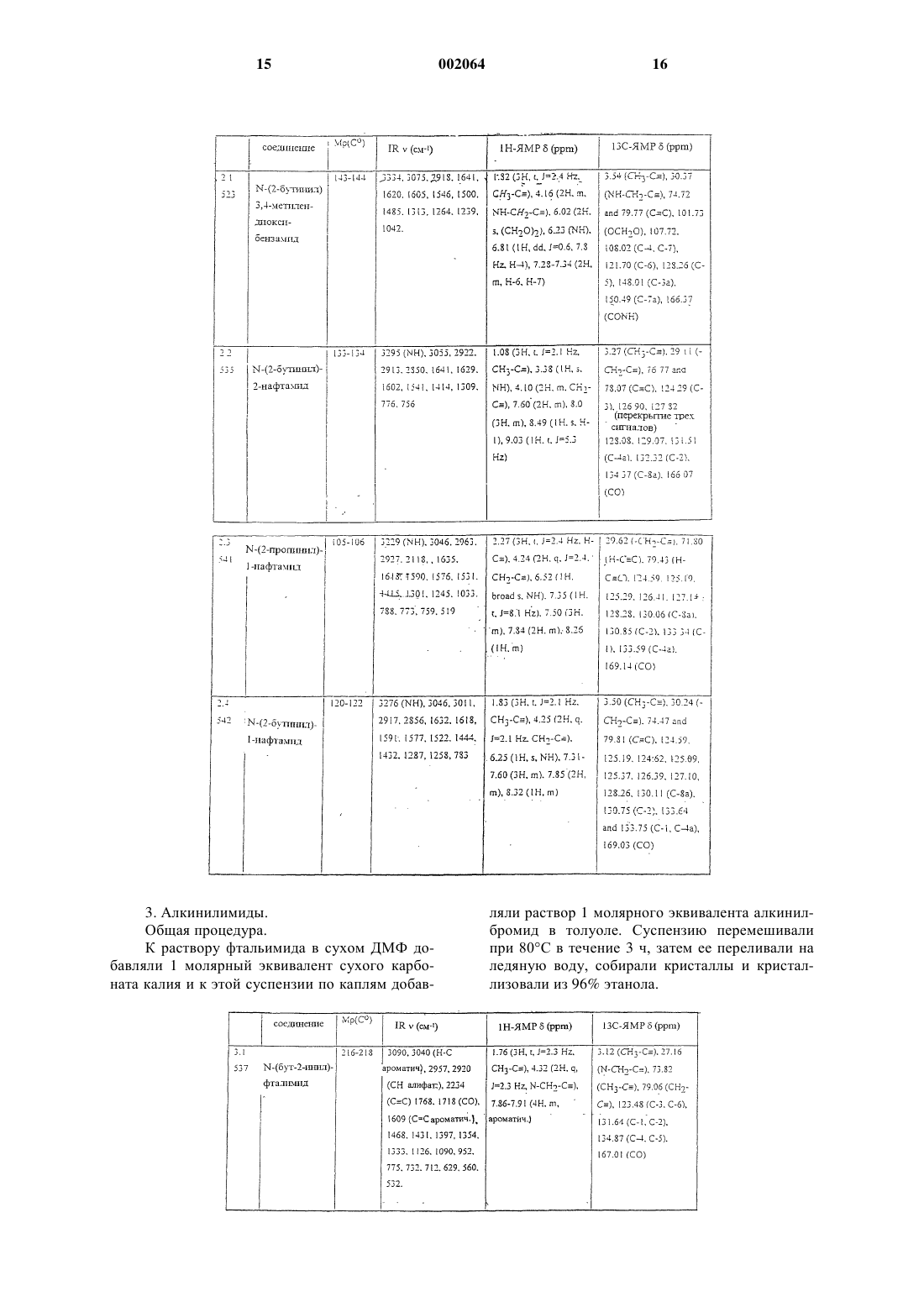
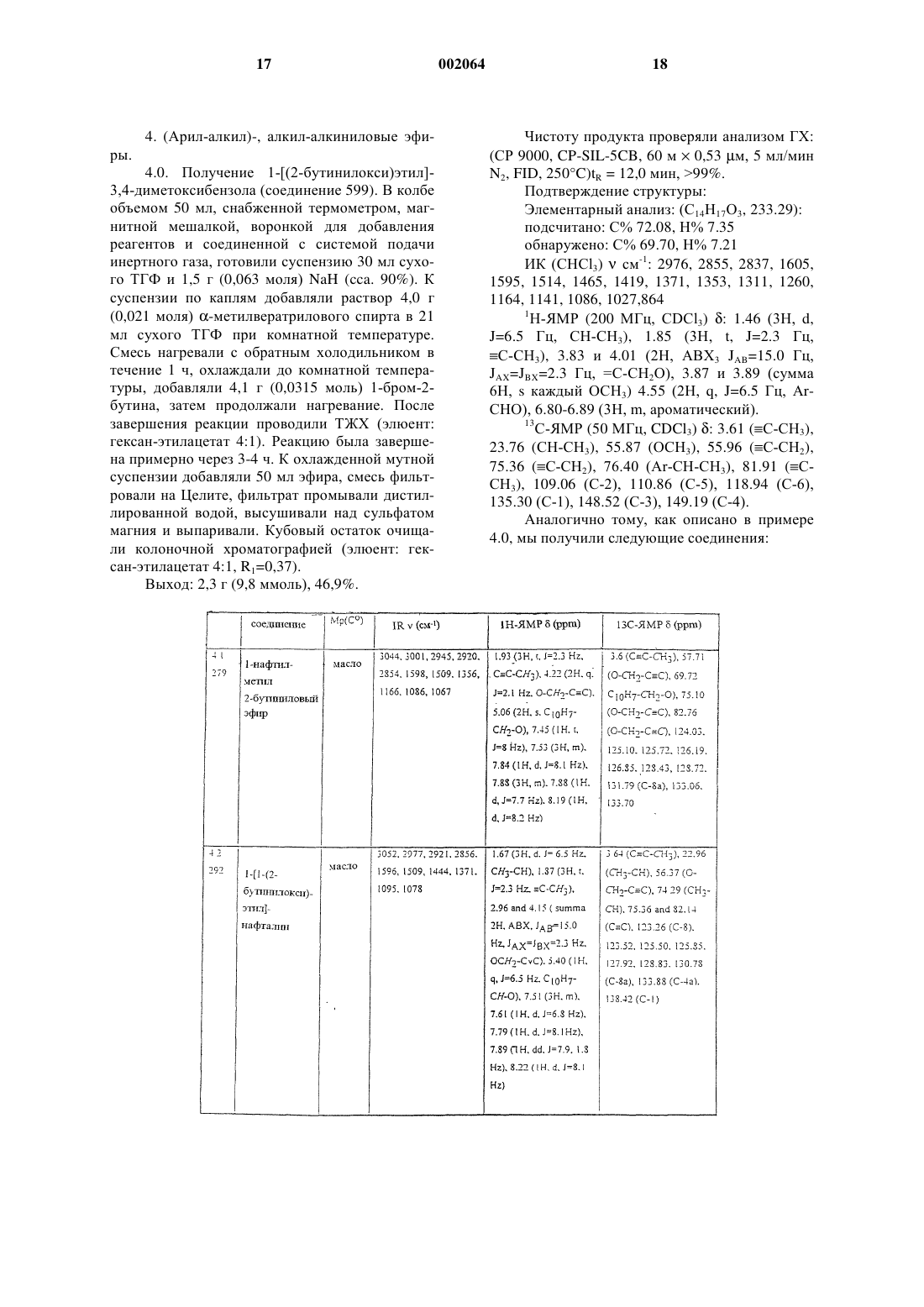
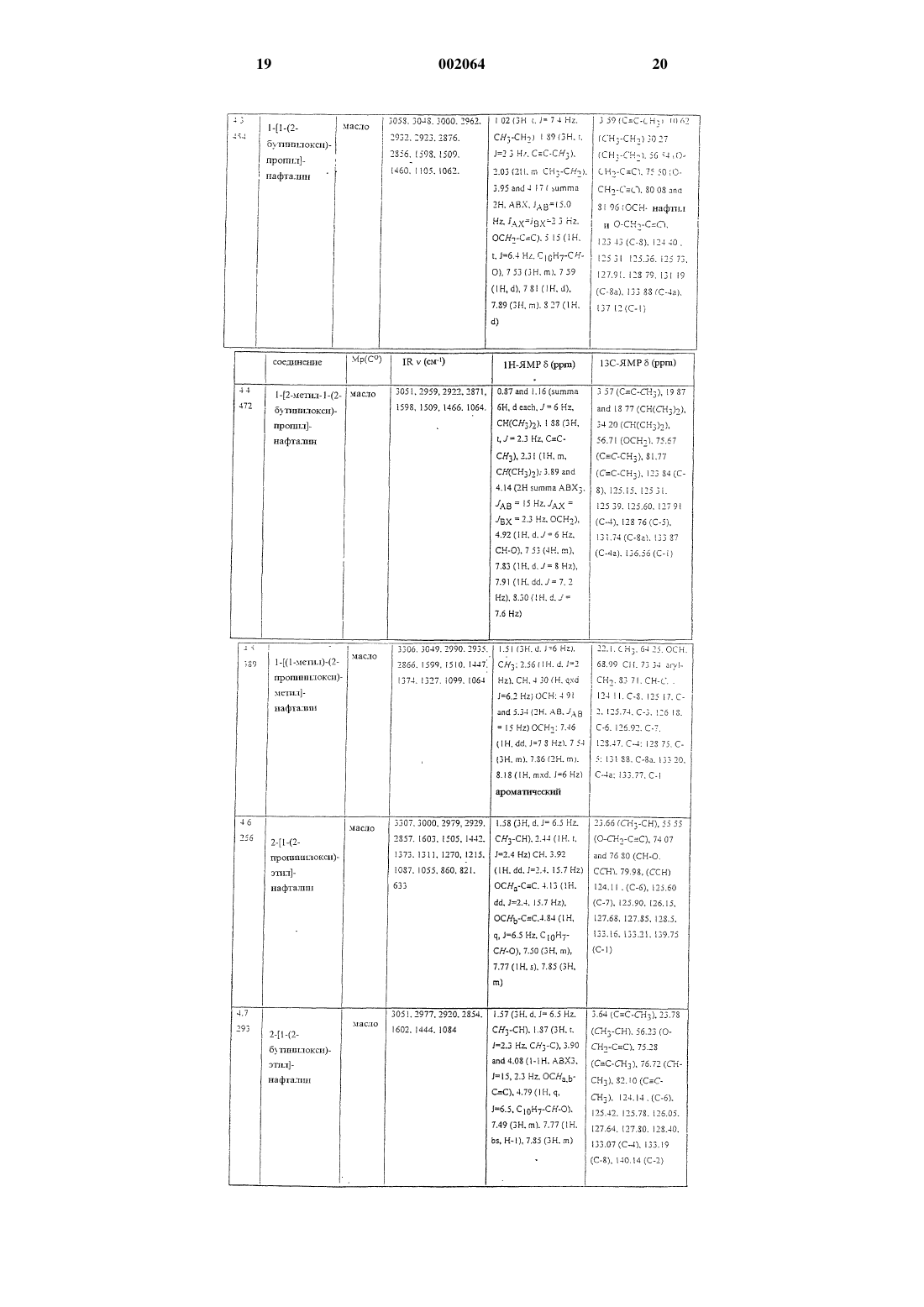
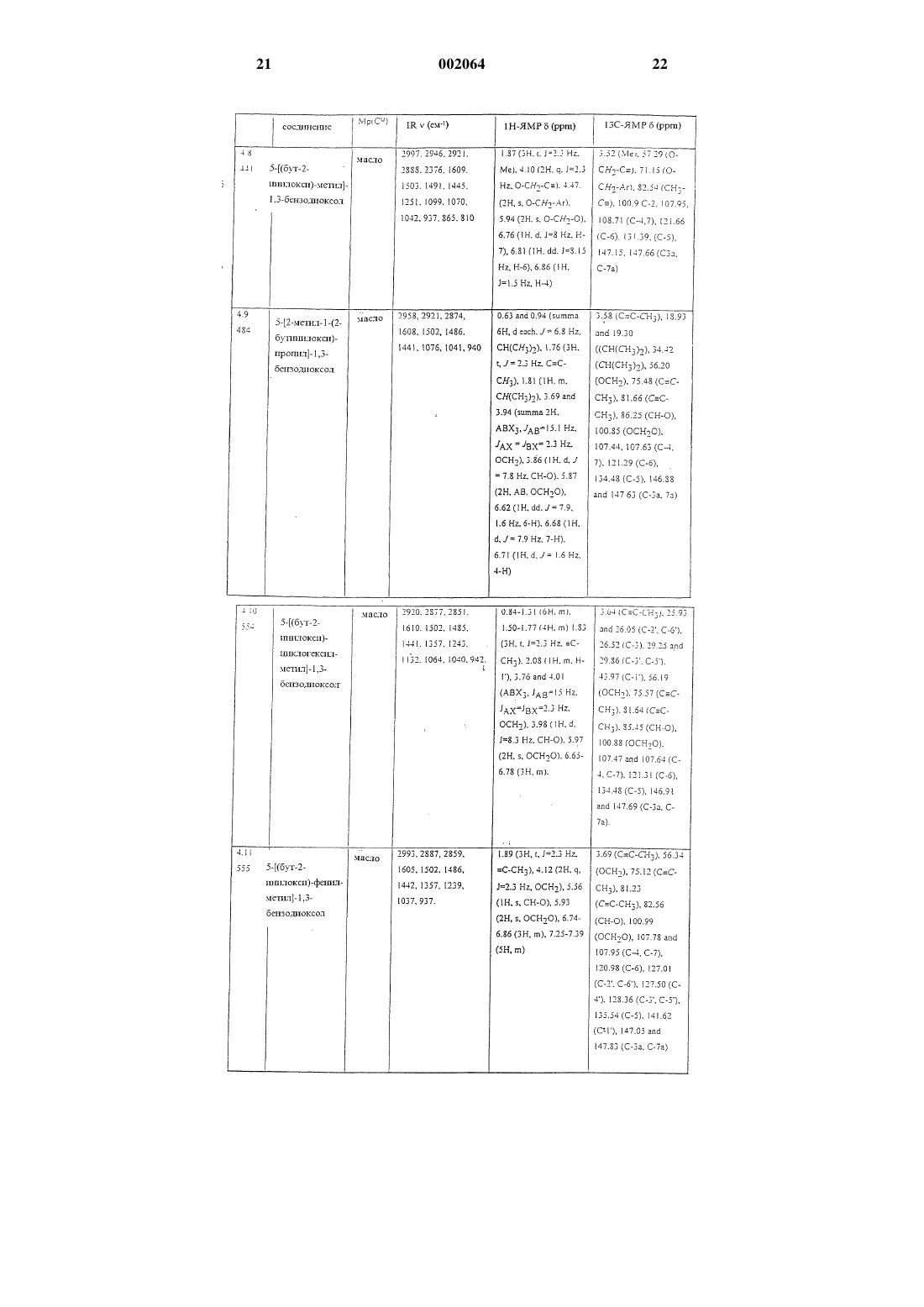
8. Соединения по п.1
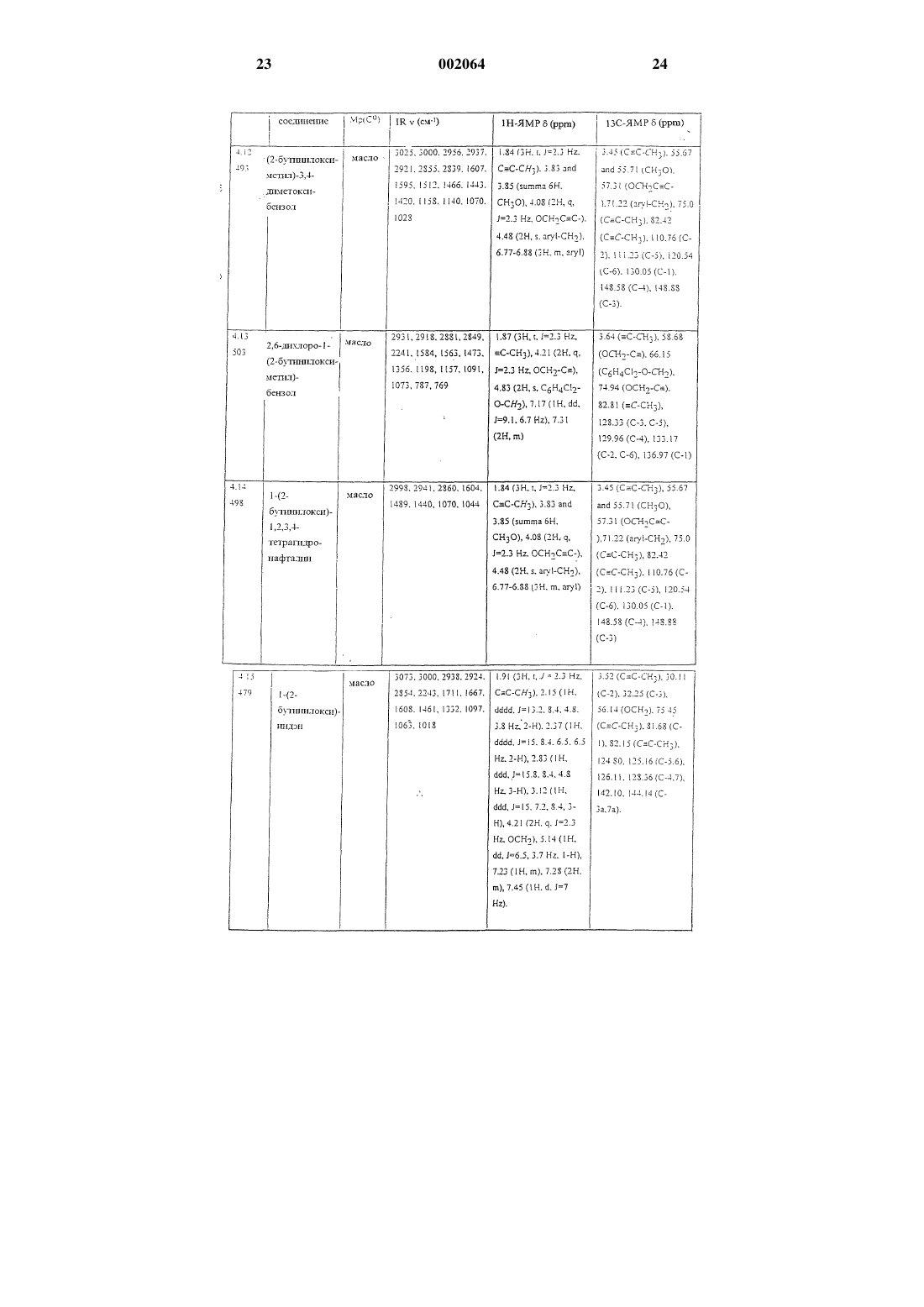
1-нафтилметил-2-бутиниловый эфир,
2-пропинил-1,3-бензодиоксол-5-карбоксилат,
1-[(2-бутинилокси)этил]-3,4-диметоксибензол,
2,6-дихлор-1-(2-бутинилоксиметил)бензол,
1-[1-(2-бутинилокси)пропил]нафталин,
R-(+)-2-[1-(2-бутинилокси)этил]нафталин,
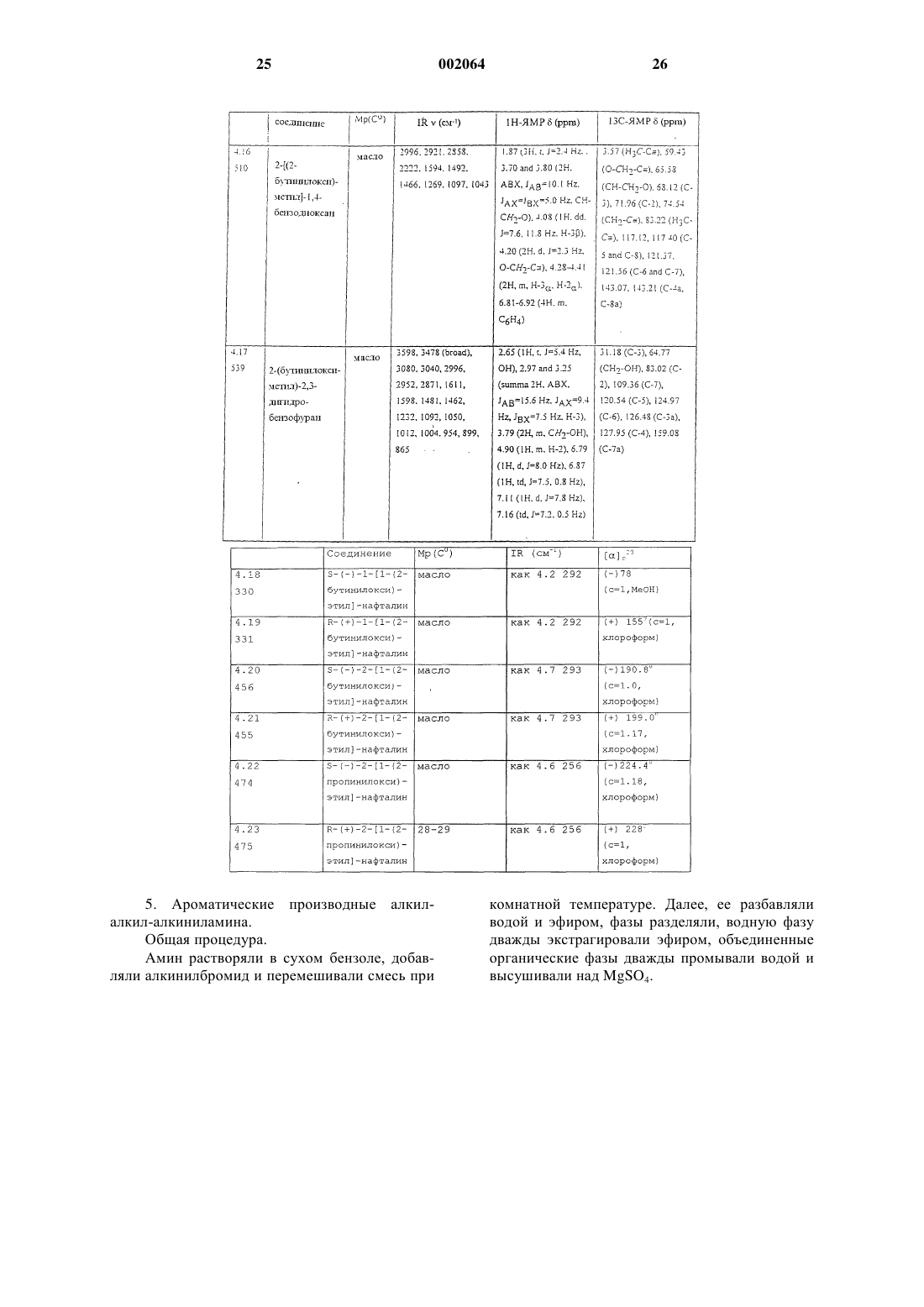
5-[(бут-2-инилокси)метил]-1,3-бензодиоксол,
5-[2-метил-1-(2-бутинилокси)пропил]-1,3-бензодиоксол,
5-[(бут-2-инилокси)фенилметил]-1,3-бензодиоксол,
2-[(2-бутинилокси)метил]-1,4-бензодиоксан,
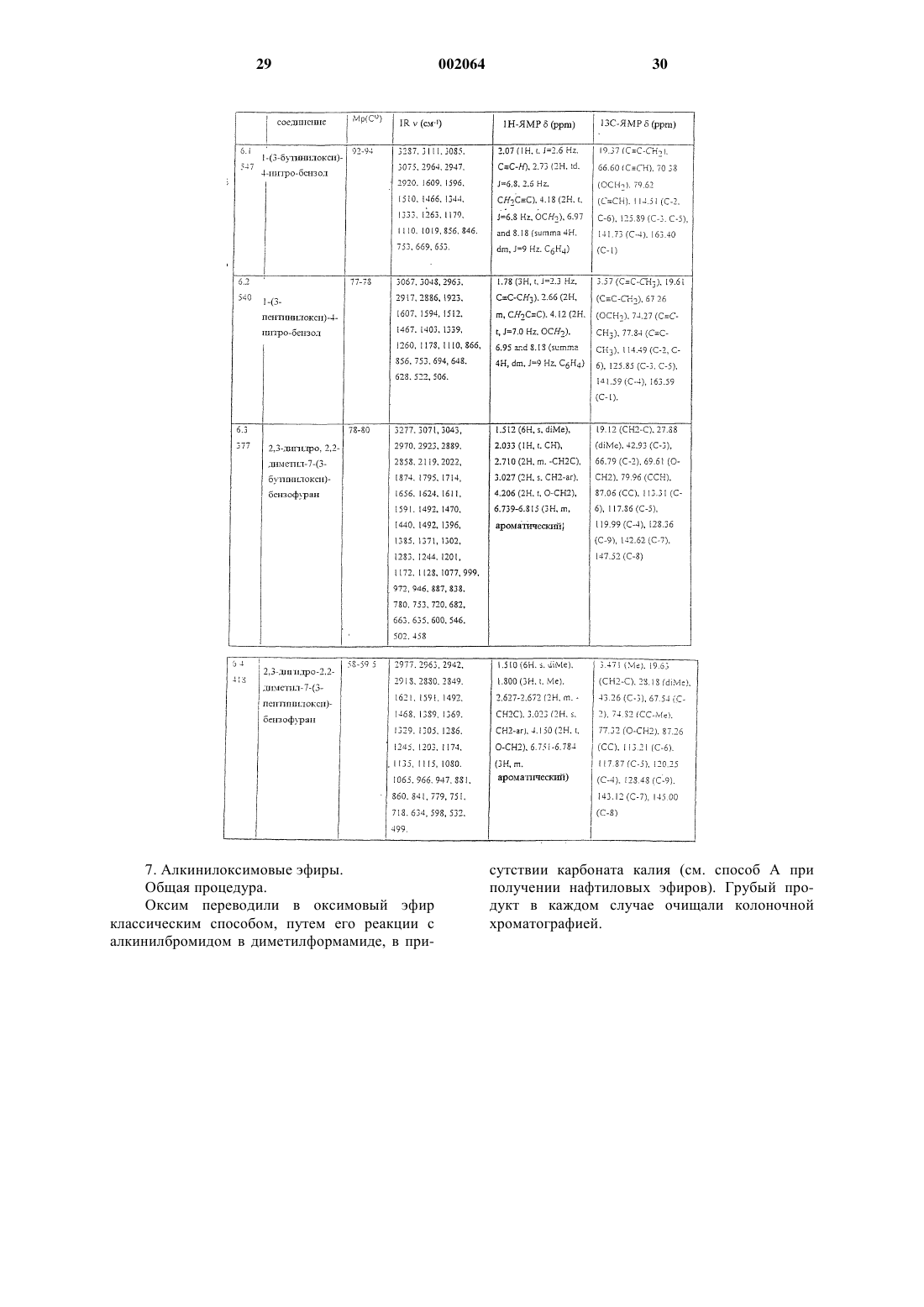
2,3-дигидро-2,2-диметил-7-(3-пентинилокси)бензофуран.
9. Способ получения соединений общей формулы I, где Ar, R1, R2, R3, R4, R5, R6, R7, R8, R10, X, Y, Е, m, n, о и р имеют те же значения, как определено в п.1, отличающийся тем, что
а) для получения соединений общей формулы IA, где Ar, R1, R2, R5, R6, R7, R8, Y, Е, m, о и р имеют те же значения, как определено в п.1, осуществляют взаимодействие между соединениями общих формул II и III
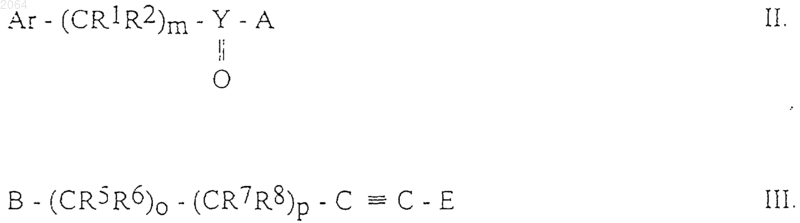
где Ar, R1, R2, R5, R6, R7, R8, Y, Е, m, о и р имеют те же значения, как определено в п.1, А и В являются группами, подходящими для образования эфирной связи;
б) для получения соединений общей формулы IB, где Ar, R1, R2, R5, R6, R7, R8, R10, Y, Е, m, о и р имеют те же значения, как определено в п.1, осуществляют взаимодействие между соединениями общих формул IV и V
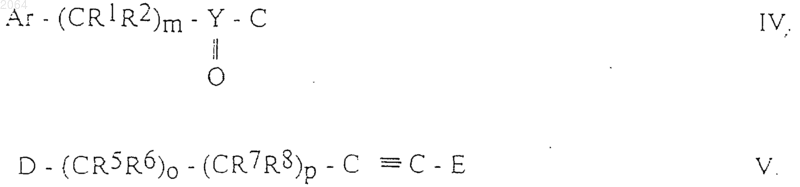
где Ar, R1, R2, R5, R6, R7, R8, Y, Е, m, о и р имеют те же значения, как определено в п.1, и С и D являются группами, подходящими для образования амидной связи;
в) для получения соединений общей формулы IC, где Ar, R1, R2, R5, R6, R7, R8, Е, m, n, о и р имеют те же значения, как определено в п.1, R3 и R4, независимо друг от друга, означают Н, алкил, алкенил, галогеноалкил, фенил, замещенный фенил, осуществляют взаимодействие между соединениями общих формул VI и VII
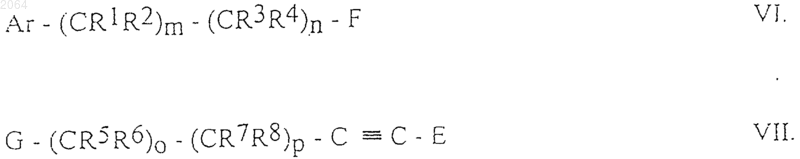
где Ar, R1, R2, R5, R6, R7, R8, Е, m, n, о и р имеют те же значения, как определено в п.1, R3 и R4, независимо друг от друга, означают Н, алкил, алкенил, галогеноалкил, фенил, замещенный фенил, F и G являются группами, подходящими для образования эфирной связи;
г) для получеэшя соединений общей формулы ID, где Ar-(CR1R2)m-(CR2R4)n-N является карбоксимидной группой, R5, R6, R7, R8, Е, о и р имеют те же значения, как определено в п.1, карбоксимид общей формулы VIII

подвергают реакции с соединением общей формулы IX
![]()
где R5, R6, R7, R8, E, o и p имеют те же значения, как определено в п.1, и Lg представляет собой отщепляемую группу;
д) для получения соединений общей формулы IE, где Ar, R1, R2, R3, R4, R5, R6, R7, R8, R10, Е, m, n, о и р имеют те же значения, как определено в п.1, осуществляют взаимодействие между соединениями общих формул Х и XI
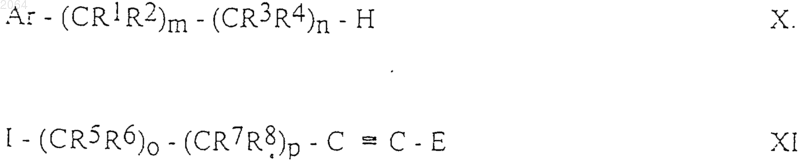
где Ar, R1, R2, R3, R4, R5, R6, R7, R8, E, m, n, о и р имеют те же значения, как определено в п.1, Н и I представляют собой группы, подходящие для образования группы
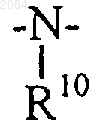
где R10 имеет значение, как указано выше;
е) для получения соединений общей формулы IF, где Ar, R1, R2, R5, R6, R7, R8, R9, E, m, о и р имеют те же значения, как определено в п.1, осуществляют взаимодействие между соединениями общих формул XII и IX
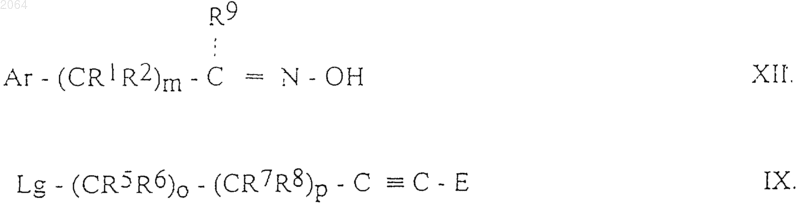
где Ar, R1, R2, R5, R6, R7, R8, R9, E, m, n, о и р имеют те же значения, как определено в п.1, и Lg представляет собой отщепляемую группу, и, если необходимо, полученное таким образом соединение общей формулы I превращают в его соли, или выделяют из его солей, и, если необходимо, разделяют его оптически активные изомеры.
10. Пестицидный состав, содержащий в качестве активного ингредиента 0,0001-99,9 мас.% соединения общей формулы I, где Ar, R1, R2, R3, R4, R5, R6, R7, R8, R10, m, n, о и р имеют те же значения, как определено в п.1, и, возможно, другие пестицидные активные ингредиент(ы), а также носители и другие дополнительные материалы.
11. Артроподицидный состав, содержащий в качестве активного ингредиента 0,0001-99,9 мас.% соединения общей формулы I, где Ar, R1, R2, R3, R4, R5, R6, R7, R8, R10, m, n, о и р имеют те же значения, как определено в п.1, и, возможно, другие артроподицидные активные ингредиент(ы), а также носители и другие дополнительные материалы.
12. Состав по п.11, отличающийся тем, что он содержит в качестве другого активного ингредиента
производные ацетамида: например оксамил;
соединения бензоилмочевины: например флуциклоксурон, гексафлумурон, тефлубензурон, трифлумурон;
бензоилмочевиноподобные IGR соединения;
соединения бициклогептадиена: например гептенофос;
дифенильные соединения, соединенные мостами: например этофенпрокс, бромопропилат, метоксихолор, темефос, тетрадифон;
карбаматы: например аминокарб, алдикарб, алдоксикарб, асулам, бендиокарб, бенфуракарб, карбарил, карбетамид, карбофуран, карбосульфан, диэтофенкарб, диоксакарб, этиофенкарб, фенобукарб, феноксикарб, фурантиокарб, изопрокарб, метомил, оксамил, пиримикарб (пиримор), пропоксур, тиодикарб, тиофанокс, ксиликарб;
производные карбамоилоксима: например аланикарб, бутокарбоксим;
циклодиены: например алдрин, хлордан, эндосульфан, гептахлор;
диазоли: фипронил;
гидразиды: RH 5992, RH 5849, CGA 215'944;
аналоги нереистоксина: например бенсултап;
нитроимидазолидиниленамины: например имидаклоприд;
фосфорорганические соединения, например хиналфос, диазинон, фосалон, диметоат, азинфос-метил,
соединения органотина, например азоциклотин, цигексатин, фенбутатин оксид SSI-121;
фенокси соединения: например диафентиурон;
пиразоли: например пиразофос;
пиретроиды: например аллетрин, биоаллетрин (эсбол), акринатрин, фенвалерат, эмпентрин, праллетрин, ресметрин, MTI-800, флуфенпрокс, перметрин, тетраметрин, циперметрин и их изомеры и комбинации изомеров;
пиридазиноны: например пиридабен;
производные пиридинов: например хлорпирифос;
производные пиримидинов: например пиримифос-этил, пиримифос-метил;
пирроли: например AC 303-t, 630;
хиназолины: например феназахин;
производные терпеноидов: например метопрен;
тетразины: например клофентезин, SzI-121 (флуфензин);
тиадиазины: например бупрофезин;
тиазолидин: например гекситиазокс;
триазоли: например исазофос, RH 7988;
хлорсодержащие углеводороды: линдан;
макроциклические лактоны;
тебуфенпирад;
фенпироксимат;
триазамат.
13. Составы по пп.11 и 12, содержащие в качестве активного ингредиента общей формулы I одно или более из следующих соединений:
1-нафтилметил-2-бутиниловый эфир,
2-пропинил-1,3-бензодиоксол-5-карбоксилат,
1-[(2-бутинилокси)этил]-3,4-диметоксибензол,
2,6-дихлоро-1-(2-бутинилоксиметил)бензол,
1-[1-(2-бутинилокси)пропил]нафталин,
R-(+)-2-[1-(2-бутинилокси)этил]нафталин,
5-[(бут-2-инилокси)метил]-1,3-бензодиоксол,
5-[2-метил-1-(2-бутинилокси)пропил]-1,3-бензодиоксол,
5-[(бут-2-инилокси)фенилметил]-1,3-бензодиоксол,
2-[(2-бутинилокси)метил]-1,4-бензодиоксан,
2,3-дигидро-2,2-диметил-7-(3-пентинилокси)бензофуран.
14. Состав по пп.11-13, содержащий в качестве активного ингредиента 0,0001-99,9 мас.% соединения общей формулы I, где Аr, R1, R2, R3, R4, R5, R6, R7, R8, R10, m, n, о и р имеют те же значения, как определено в п.1, и карбамат, подходящий для уничтожения артропода, предпочтительней карбофуран.
15. Состав по п.14, содержащий в качестве соединения общей формулы I (2-бутинилоксиметил)-3,4-диметоксибензол.
16. Состав по п.14, содержащий в качестве соединения общей формулы I 5-[(бут-2-инилокси)метил]-1,3-бензодиоксол.
17. Способ уничтожения паразитов, предпочтительней членистоногих, включающий обработку паразитов, предпочтительней членистоногих, подходящим количеством состава по п.10 или 11, если желательно, таким образом, что составы, содержащие соединения общей формулы I, где Аr, R1, R2, R3, R4, R5, R6, R7, R8, R10, m, n, о и р имеют те же значения, как определено в п.1, и составы, содержащие известные активные ингредиенты, используют в смеси или последовательно.
18. Соединения по п.1, отличающиеся тем, что Аr представляет собой тетрагидронафтил, нафтил, бензодиоксол, фенил, бензофуранил, тетрагидробензофуранил или инденил, который может быть замещен одной или более C1-C4 алкокси-, метилендиокси-, C1-С6 алкильной, C1-С6 галогеналкильной или нитрогруппой или галогеном.
Текст
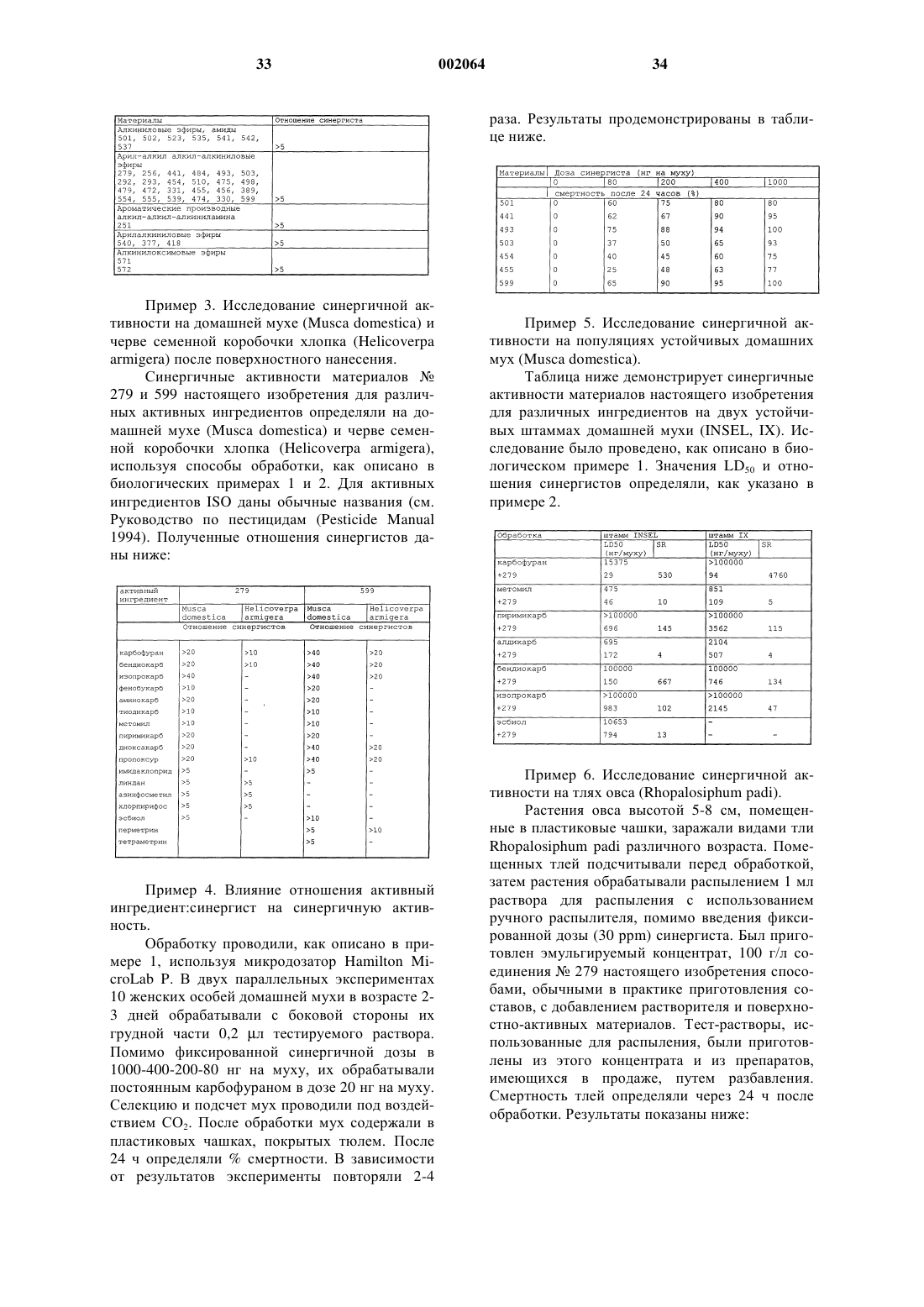
1 Данное изобретение относится к пестицидным соединениям общей формулы I, пестицидным составам, содержащим активные ингредиенты общей формулы I, а также пестицидным синергистам общей формулы I, усиленным пестицидным составам с известными пестицидными активными ингредиентами и способу их получения. В общей формуле I заместители имеют следующие значения: Аr является С 3-С 6 алициклической, ароматической или пяти- или шестичленной гетероциклической группой, содержащей один или два атома азота и/или один или два атома кислорода, которая может быть замещена одной или более С 1-С 4 алкокси-, метилендиокси-, С 1-С 6 алкильной, С 1-С 6 галогеналкильной, нитрогруппой или атомом галогена и/или конденсирована с бензольным кольцом;R1, R2 являются, независимо друг от друга,Н, С 1-С 6 алкилом, С 1-С 6 галогеналкилом, C1-С 6 алкенилом, фенилом, С 3-С 6 циклоалкилом;R3, R4 являются, независимо друг от друга,Н, С 1-С 6 алкилом, С 1-С 6 галогеналкилом, C1-С 6 алкенилом, фенилом, С 3-С 6 циклоалкилом; илиR3 и R4 являются совместно атомом кислорода;R5, R6, R7, R8 являются, независимо друг от друга, Н, С 1-С 6 алкилом, С 1-С 6 галогеналкилом,С 1-С 6 алкенилом; Е = Н, метилу, где метил условно считается одним атомом;-(CR1R2)m-(YR3R4)n-X-(CR5R6)o-(CR7R8)p скелетного моста равна 3 и -СС-Е скелет образует с атомами моста линейную цепь, состоящую из 6 атомов, заканчивающуюся предпочтительно метильной группой,с дополнительным условием, что,если Аr является нафтильной группой, Y означает С-атом, Х означает O-атом, R3 и R4 совместно не могут означать =O, или если Аr является фталимидной группой, R1 означает метил, m = 1, n = 0, o = 1, R5 и R6 являются атомами водорода, р = 0, Е не является водородом, или если Аr является нафтильной группой, m = 0, n = 0, Х означает O-атом, R5, R6, R7 и R8 являются атомами водорода, Е не является водородом, или 2 если Аr является фенилом, который может быть замещен, или нафтилом, m = 0, n = 1, Х означает O-атом, Y является атомом углерода,R3 и R4 являются атомами водорода или совместно означают атом кислорода, или YR3R4 вместе образуют R9-C=N-группy, где R9 = H или алкилу, Е не является водородом. Изобретение включает в себя также соли и оптически активные изомеры соединений общей формулы I. Более узкие группы соединений общей формулы I представлены соединениями общих формул IA, IB, IC, ID, IE, IF, их солями и оптически активными изомерами, где значения заместителей те же, что определены выше. Преимущественными представителями соединений общей формулы I являются 1-нафтилметил-2-бутиниловый эфир,2-пропинил-1,3-бензодиоксол-5-карбоксилат,1-[(2-бутинилокси)-этил]-3,4-диметоксибензол,2,6-дихлор-1-(2-бутинилоксиметил)бензол,1-[1-(2-бутинилокси)пропил]нафталин,R-(+)-2-[1-(2-бутинилокси)этил]нафталин,5-[(бут-2-инилокси)метил]-1,3-бензодиоксол,5-[2-метил-1-(2-бутинилокси)пропил]-1,3 бензодиоксол,5-[(бут-2-инилокси)фенилметил]-1,3 бензодиоксол,2-[(2-бутинилокси)метил]-1,4-бензодиоксан,2,3-дигидро-2,2-диметил-7-(3-пентинилокси)бензофуран. В термине Аr ароматической группой преимущественно является фенильная или нафтильная группа. Аr как гетероциклическая группа может содержать один или более О, S, N гетероатомов, Аr может преимущественно представлять бензодиоксол-, бензодиоксан-, 2 бензофуран-, 7-бензофурановую группы. Алициклическая группа преимущественно может быть конденсирована с бензольным кольцом и, например, может представлять индановую группу или 1,2,3,4-тетрагидронафтильную группу. Карбоксимидная группа может преимущественно представлять фталимидную группу. Ароматические, гетероциклические и алициклические Аr группы могут быть замещеныC1-4 алкокси-, метилендиокси-, C1-4 алкилом,галогеном, C1-4 галоалкилом или нитрогруппами. Соединения, которые не являются токсичными, или лишь слабо токсичны по отдельности, но взятые вместе с пестицидом, предпочтительно артроподицидным веществом, заметно увеличивают силу последнего, называются синергистами. Эти вещества могут, в принципе,действовать несколькими путями, однако, в основном, они оказывают сво действие посредст 3 вом блокирования метаболизма активной субстанции. Метаболизм может проходить через окислительные, гидролитические, конъюгативные и абсорбционные реакции и их вариации. В настоящее время не существует чткого примера синергистов, действующих на уровне рецептора, не играют они важной роли и в практике. Сила синергиста, например, в случае инсектицидов, характеризуется так называемой SR пропорцией синергиста, представленной следующим образом: Чем больше значение SR50 отличается от 1,тем выше сила синергиста. Использование синергистов в антроподицидных препаратах очень привлекательно, поскольку они дают возможность получения новых препаратов с практически всеми представителями данной сферы. Эти новые препараты, в сравнении с предшествующими, обещают быть менее дорогими, менее токсичными, более селективными, менее опасными для окружающей среды, подавляющими развитие устойчивости, и активными также на штаммах, которые уже выработали устойчивость. Вслед за открытием синергистов и выявлением механизма их действия последовали широкомасштабные исследования и разработки новых синергистов, продолжавшиеся с середины 60-х до конца 70-х годов. Результатом этих исследований явилось создание лишь нескольких молекул, которые действительно нашли применение (в настоящее время существует менее 10 зарегистрированных инсектицидных синергистов). Эти соединения имеют большое научное значение в исследованиях устойчивости (K.F. Raffa and T.M. Priester, J. Agric. Entomol., 2(1), 27-45, (1985, однако, лишь 2-3 молекулы приведены в качестве продуктов в Руководстве по пестицидам (Pesticide Manual), и лишь два вещества (РВО, MGK264) действительно находятся на рынке. Область применения ограничена несколькими факторами: непросто найти химический инструмент, который мог бы использоваться селективно и безопасно, и отношение стоимость/эффективность которого было бы конкурентоспособно в сравнении с таковым активного ингрeдиента. Для того чтобы синергист был экономически применим, оно должно обладать высокой силой, действовать при малых дозах (не превышающих исходной дозы активного ингрeдиента). На основе их химических структур известные в настоящее время артроподицидные синергисты могут быть разделены на следующие группы:- гомологи O-2-пропинила и пропинила и их производные (эфиры, оксим-эфиры, сложные эфиры),- производные N-алкила,- сложные эфиры фосфора,- другие производные, например, тиоцианаты, полигало эфиры и т.д. Соединения могут также быть разделены на группы на основе атакуемой ими мишени[K.F. Raffa and T.M. Priester, J. Agric. Entomol,2(1), 27-45, (1985)], но это разделение является скорее теоретическим, менее точным, прежде всего потому, что действительные метаболические процессы не известны полностью. Метаболизм большинства соединений проходит последовательно, но может проходить также одновременно, и может следовать различным механизмам, таким образом, разделение менее информативно, даже если мы сочтм первый шаг каскадной деградации за решающий. За метаболическую деградацию большинства артроподицидов отвечает, в первую очередь, оксигеназная система. В литературе считается, что соединения этой группы проявляют свою активность, в основном, посредством блокирования фермента цитохрома Р-450 окислительной системы микросом [John E. Cassida, J.Chem., 16(5), 779-786, (1968)]. Ферменты, формирующие структурно аналогичную группу так называемых изоферментов, составляют большую часть детоксификационной системы организмов [Ortiz de Montellano, P.R., Ed. CytochromYork, (1986)]. Они осуществляют детоксификацию через монооксигенирование субстрата, в результате чего получается более полярный продукт, который, возможно, после последующих трансформаций может быть элиминирован организмом. Система разрушает самые разные структуры одним и тем же путм. Поэтому они также обозначаются как оксигеназы смешанной функции (MFO) и полисубстратные монооксигеназы (PSMO). На основании этого можно ожидать, что поверхность фермента является неспецифичной также и для синергиста. В противоположность этому, мы обнаружили, что соединения могут быть оптимизированы. Для выделения и тестирования ферментов цитохрома Р-450 насекомых существуют доступные стандартные способы [J.G. Scott andS.S.T. Lee; Arch. Insect Biochem. and Phys., 24, 119, (1993)]. Ферменты различных видов могут показывать большие сходства, но они могут также значительно отличаться друг от друга. Синергисты, известные в литературе и исследованные нами, принадлежат к группе O-2 пропинила и гомологов пропинила и их производных (эфиров, оксим-эфиров, сложных эфиров). Как показано в литературе, они проявляют 5 различную силу у различных видов, это означает, что окислительная способность видов в некоторой степени варьирует. Это является причиной высокой селективности насекомое/млекопитающее и высокой селективности синергиста, что является характерной особенностью этой группы соединений. Эти селективности, которые не могут быть непосредственно объяснены образом действия, приведнным выше, являются основами разработки и безопасного применения. С другой стороны, это служит причиной того, что эти соединения не стали коммерчески доступными. Для всех полученных и оцененных соединений группы, пока что мы можем сказать, в основном, то, что их действие было связано исключительно с боковой пропиниловой цепью, эта цепь была замещена в аллельной позиции различными ариловыми кольцами, главным образом, через атом кислорода. Известные соединения, пока что,могут быть разделены на следующие группы:- пропаргиловые сложные эфиры нафтойной кислоты [Hoffman-La Roche, Belg. Patent,867 849 (1978)]- пропаргиловые сложные эфиры фенилфосфоновой кислоты [Niagara Chem. Div., FMCCorp., Technical Data Sheet on NIA 16824,(1968)]. Первые две группы подразделяются на добавочные группы по причине высокой изменчивости ароматической группы и заместителей. Так, известны нафтилпропаргиловые эфирыGeigy, Ger. Offen, 2 100 325 (1971)], 4 гидроксихинолинпропаргиловые эфиры [Alkaloida, HU 210 557, (1992)], метилендиоксибензилпропаргиловые эфиры [Sumitomo, JP, 03 01177, (1973)] и альфа-замещнные метилендиоксибензилпропаргиловые эфиры [Sumitomo,JP, 61 24585, 61 24586 (1986)]. В результате исследований нафтилпропиниловых эфиров был сделан вывод о том, что бутиниловые эфиры, в первую очередь, 3 бутиниловые эфиры, являются более сильными по сравнению с аналогичными пропаргиловыми и пентиниловыми эфирами [R.M. Sacher et al., J.Agr. Food Chem., 16, 779-786, (1968)]. Интересно, однако, что продолжение этой работы не последовало, открытие не было также и запатентовано. Детальный анализ имеющихся в литературе данных наводит на мысль о том, что пропиниловая боковая цепь не может быть замещена на гомологичные боковые цепи, поскольку публикации и патенты относятся далее 6 к производным пропаргила. Для того чтобы разрешить это противоречие, мы получили соединения, о которых идт речь, и обнаружили, что в противовес тому, что было описано в литературе, производное 2-бутинила (то, которое заканчивается метильной группой) является более сильным по сравнению с производным 3 бутинила; альфа-изомеры являются более сильными по сравнению с аналогичными бетаизомерами; и производное 3-пентинила сильнее,чем производное 2-бутинила. Эти данные хорошо согласуются с нашей теорией, и приведнные в литературе данные, вероятно, послужили причиной того, что это направление не было продолжено другими исследователями. Существует также противоречие и в отношении активности производных 4-пентинилфтальимида: хотя они и оказались сильными синергистами аллетрина, они проявляют антагонизм в отношении пиретрина [H. Jaffe, J.L. Neumeyer, J.Med. Chem., 13, 901, (1970)]. В этих структурах,к тому же, алкинильная цепь оканчивается тройной связью. Гибридные вариации этих структур,называемыеN-алкилокси-Oпропаргил-фтальимидами, тоже были получены,тройная связь здесь также находится в терминальной позиции [Sumitomo, NL, 6 600 916(1966)]. Можно сделать вывод, что, наиболее активные представители группы, несмотря на показанную в некоторых тестах высокую активность и являясь превосходными по их отношению синергист/активный ингредиент [D.J.Henessy, Biochemical Toxicology of Insecticides,Ed., R.D. O'BrianI. Yamamoto, Academic Press,105-114, (1970)], никогда не были применены в практике. Для этого есть несколько причин: их активность не достигала силы предшествующих, хорошо зарекомендовавших себя производных, они показывали активность лишь в узком диапазоне, их сила была высоко видозависимой, и внутри отдельных видов она сильно зависела от "сопротивления" индивида. Таким образом, их безопасное и широкое применение не было гарантировано. Все алкинильные соединения, перечисленные выше, являются производными общей оптимальной структуры, но авторы не представили детально взаимосвязи, и не получили наиболее активных представителей, понижающих и повышающих достоинства этих групп соединений. Мы экспериментально проверили, сравнили и проанализировали биологическое действие известных соединений, а также новых, полученных нами производных, и обнаружили структурный элемент, ответственный за действие этих соединений. На основании этого мы получили новые соединения, которые по активности значительно превосходят своих предшественников и сочетают в себе те свойства, которые гарантируют эффективность на большинстве видов и с большинством известных активных ингредиентов. Неотделимой частью данного изо 7 бретения является открытие того, что в оптимальных соединениях носителем активности служит тройная связь алкинильной структуры с насыщенным электронами Аr кольцом, которое соединятся с тройной связью через мобильный мост, состоящий из трх атомов. Атомы моста и кольца могут быть различными и могут содержать заместители. Для увеличения активности является предпочтительным вводить липофильные и насыщенные электронами атомы и заместители. Таким образом, атомами моста могут быть (помимо атомов углерода) гетероатомы кислорода, серы, азота и фосфора. Эти атомы могут быть соединены одинарными или кратными связями друг с другом и с дополнительными заместителями, содержащими вышеупомянутые гетероатомы, которые могут быть замещены дополнительными функциональными группами или производными. Атомы могут замещать друг друга. Первый элемент моста со своим заместителем может образовывать кольцо, которое может быть присоединено к ароматическому кольцу, и, таким образом, может представлять собой часть насыщенной электронами группы. В кольцо, соединнное с мостом,также могут быть введены перечисленные выше гетероатомы, и эффект может быть дополнительно усилен посредством введения алкокси-,галогена, алкил-, галоалкил- или нитрозаместителей. Кольцо может быть 5-, 6- или 7-членным и может быть связано с дополнительным кольцом, построенным в соответствии с вышеупомянутым принципом, и может включать в свой состав первый элемент моста. Соединения, в которых ацетиленовый водород алкинильной боковой цепи замещен метильной группой, показывают более высокую активность по сравнению с аналогами, имеющими тройную связь в конце цепи. Соблюдая эти правила, мы можем получить новые заместители, посредством которых можно модифицировать свойства соединений в соответствии с требованием (липофильность, трансламинарность, систематичность, и т.п.) области применения. Среди изомеров оптически активных соединений, например, -метилзамещнных производных бензила, R(+)энантиомеры сильнее,чем S(-)энантиомеры. Разница между активностями изомеров растт с увеличением активности рацемической смеси. Разработанные нами соединения являются новыми, они характеризуются неординарной селективностью млекопитающее/насекомое и высокой силой, проявляемой при низкой дозе относительно активного ингрeдиента. Это приписывается крайне высокому рецепторному сродству наших соединений. В сравнительных экспериментах индексы наших соединений значительно превосходили таковые ранее известных синергистов активных ингредиентов, чей метаболизм основан на микросомальном окислении. Эта высокая активность и селективность 8 были продемонстрированы на полевых исследованиях, проведенных на малых участках. Соединения не проявляли фитотоксичность, не отделялись от активных ингредиентов, их физико-химические параметры хорошо сочетались с параметрами активного ингредиента. Несмотря на вышеизложенное,соотношение доза/ эффективность/цена, которое ранее мешало применению, может быть изменено таким образом, и применение становится возможным. С использованием активных соединений общей формулы I действие следующих известных артроподицидных активных ингредиентов может быть усилено. Ацетамидные производные: например, оксамил. Соединения бензоилмочевины: например,флуциклоксурон, гексафлумурон, тефлубензурон, трифлумурон. Бензоилмочевиноподобные IGR соединения. Бициклогептадиеновые соединения: например, гептенофос. Дифенильные соединения с мостиковыми связями: например, этофенпрокс, бромопропилат, метоксихолор, темефос, тетрадифон. Карбаматы: например, аминокарб, алдикарб, алдоксикарб, асулам, бендиокарб, бенфуракарб, карбарил, карбетамид, карбофуран, карбосульфан, диэтофенкарб, диоксакарб, этиофенкарб, фенобукарб, феноксикарб, фуратиокарб,изопрокарб, метомил, оксамил, пиримикарб 9 Производные пиримидинов: например, пиримифосэтил, пиримифосметил. Пирроли: например, AC 303-t, 630. Хиназолины: например, феназахин. Производные терпеноидов: например, метопрен. Тетразины: например, хлофентезин, SzI121 (флуфензин). Тиадиазины: например, бупрофезин. Тиазолидин: например, гекситиазокс. Триазоли: например, исазофос, RH 7988. Хлоринированные углеводороды: линдан. Макроциклические лактоны. Тебуфенпирад. Фенпироксимат. Триазамат. Вышеупомянутые известные активные ингредиенты описаны в 8-м и 10-м изданиях Справочника по пестицидам (8th and 10th Edition ofNo. 0635499 (SZI-121), A.G.Chem. New Compound review vol. 11 (1993) и Symposium Series 504 p. 272, соответственно). Соединения общей формулы I могут быть наиболее предпочтительно использованы для усиления эффекта карбаматов, предпочтительно карбофурана. Мы обнаружили, что соединения имеют двойное действие, они являются превосходными веществами, усиливающими артроподицидные активные ингредиенты, и они препятствуют индивидуальному росту членистоногих путем повреждения биосинтеза экдисона, материала,играющего центральную роль в росте членистоногих. Таким образом, существует недвусмысленное взаимоотношение между синергичными и повреждающими индивидуальный рост активностями. Последний из названных эффектов,помимо выдающейся метаболизмблокирующей активности соединений, является также следствием факта, что эти материалы в контрасте с другими, ранее известными семействами соединений, практически не распадаются или распадаются только крайне медленно в организме членистоногих. Таким образом, при использовании этих соединений по одиночке в течение длительного периода, в зависимости от фаз эндокринной регуляции, они способны блокировать синтез гормонов и препятствовать деградации эндо- и экзобиотиков. Вследствие накопления токсинов в организме, насекомые становятся неспособными жить, они не питаются, продукция яиц понижается и репродукция останавливается. Кроме этих усиленных активностей, значения токсичности соединений на млекопитающих не увеличивались. Это может быть отнесено к различиям в значениях электронных потенциалов систем микросомального окисления у млекопитающих и у членистоногих. Тогда как значения окислительного потенциала высших организмов высоки, и поэтому они способны 10 пробивать электронный барьер находящихся в комплексе синергистов, окислительная система членистоногих с ее небольшим потенциалом не способна окислять и таким способом удалять комплексные молекулы с поверхности фермента, приводя к параличу системы. Это является причиной, почему соединения могут быть использованы безопасно и селективно. Быстрая,выше среднего, деградация и выведение соединений из млекопитающих, относящиеся к высокой активности их ферментов и быстрому связыванию ферментов, обеспечивает то, что в контрасте с членистоногими эти материалы не усиливают эффекты биотиков, обнаруженных или употребленных организмом млекопитающих, и поэтому они безопасны. Эффект был продемонстрирован нами на различных видах членистоногих. Будучи использованы по одиночке или в качестве синергиста, соединения были активны на насекомых,тлях и также на клещах. В свете вышесказанного этот факт снова относится к качественно отличной детоксификационной системе млекопитающих. Очень ценным преимуществом наших соединений является то, что при использовании их на видах, которые уже развили устойчивость,токсичная доза может быть снижена по отношению к первоначальной дозе известного активного ингредиента (измеренной на чувствительных штаммах). Этого не наблюдалось с другими синергистами. Это делает возможным безопасное и эффективное управление устойчивыми популяциями, удовлетворяющее современным правилам. Помимо преимуществ, упомянутых выше(соединения делают возможным развивать препараты, которые менее дороги, менее токсичны на млекопитающих, селективны и могут подавлять устойчивость), при помощи этих соединений могут быть обновлены хорошо известные активные ингредиенты, чей рынок упал в последние годы из-за развившейся к ним устойчивости (Карбофуран, Хиналфос, Картап, Метомил). Наши соединения создают новые направления и возможности рынка, так как они усиливают эффективность менее активных материалов (Ресметрин, Биоаллетрин, Пиримикарб и т.д.) до уровня наиболее активных соединений без увеличения их токсичности. РВО, который находится на рынке в больших количествах, и при снижении запасов которого его стоимость увеличивается, и который не является привлекательным вследствие приписываемого ему вызывающего опухоль эффекта, также может быть заменен нашими соединениями. Получение соединений общей формулы I отличается в зависимости от различных групп,входящих в состав этих соединений, и может быть проведено химическими способами, характерными для получения этих групп. 11 Так,а) для получения соединений общей формулы IA, где Ar, R1, R2, R5, R6, R7, R8, Y, Е, m, o и р имеют те же значения, как определено выше,подвергают реакции соединения общих формулII и III, где Ar, R1, R2, R5, R6, R7, R8, Y, Е, m, о и р имеют те же значения, как определено выше,А и В являются группами, подходящими для образования эфирной связи; б) для получения соединений общей формулы IB, где Аr, R1, R2, R5, R6, R7, R8, R10, Y, Е,m, о и р имеют те же значения, как определено выше, подвергают реакции соединения общих формул VI и VII, где Ar, R1, R2, R5, R6, R7, R8, Y,Е, m, о и р имеют те же значения, как определено выше, и С и D являются группами, подходящими для образования амидной связи; в) для получения соединений общей формулы IC, где Ar, R1, R2, R5, R6, R7, R8, Е, m, n, о и р имеют те же значения, как определено выше,R3 и R4 независимо означают Н, алкил, алкенил,галоалкил, фенил, замещенный фенил, подвергают реакции соединения общих формул VI иVII, где Аr, R1, R2, R5, R6, R7, R8, E, m, n, о и р имеют те же значения, как определено выше, R3 и R4 могут независимо означать Н, алкил, алкенил, галоалкил, фенил, замещенный фенил, F иG являются группами, подходящими для образования эфирной связи; г) для получения соединений общей формулы ID, где Ar-(CR1R2)m-(CR2R4)n-N являются карбоксимидной группой, R5, R6, R7, R8, E, o и p имеют те же значения, как определено выше,карбоксимид общей формулы VIII подвергают реакции с соединением общей формулы IX, гдеR5, R6, R7, R8, E, o и p имеют те же значения, как определено выше, и Lg представляет собой отщепляемую группу; д) для получения соединений общей формулы IE, где Ar, R1, R2, R3, R4, R5, R6, R7, R8, R10,Е, m, n, о и р имеют те же значения, как определено выше, подвергают реакции соединения общих формул Х и XI, где Ar, R1, R2, R3, R4, R5,R6, R7, R8, Е, m, n, о и р имеют те же значения,как определено выше, Н и I представляют собой группы, подходящие для образования группы, где R10 имеет то же значение, как определено выше; е) для получения соединений общей формулы IF, где Ar, R1, R2, R5, R6, R7, R8, R9, Е, m, о и р имеют те же значения, как определено выше,подвергают реакции соединения общих формул XII и IX, где Ar, R1, R2, R5, R6, R7, R8, R9,Е, m, n, о и р имеют те же значения, как определено выше, и Lg представляет собой отщепляемую группу, и, если желательно, полученное таким образом соединение может быть трансформировано в его соли, или может быть высвобождено из его солей, и, если желательно, 002064 12 могут быть разделены оптически активные изомеры. Для получения соединений общей формулы I предпочтительно а) галогенангидрид общей формулы II подвергают реакции с алкинолом общей формулы III, или карбоновую кислоту общей формулыII подвергают реакции с алкинилгалогенидом общей формулы III в присутствии кислотосвязывающего агента, или карбоновую кислоту общей формулы II подвергают реакции с алкинолом общей формулы III в присутствии активатора, предпочтительно диэтилазодикарбоксилата и трифенилфосфина или дициклогексилкарбодиимида и кислотного катализатора,б) галогенангидрид общей формулы II подвергают реакции с первичным или вторичным алкиниламином общей формулы V, или карбоксамид общей формулы IV подвергают реакции с алкинилгалогенидом общей формулыV, возможно, в присутствии кислотосвязывающего агента,в) спирт общей формулы VI подвергают реакции с алкинилгалогенидом общей формулыVII, или галогенид общей формулы VI подвергают реакции с алкинолом общей формулы VII в присутствии основания, или спирт общей формулы VI и алкинол общей формулы VII подвергают реакции в присутствии активатора,предпочтительно диэтилазодикарбоксилата и трифенилфосфина или дициклогексилкарбодиимида и кислотного катализатора,г) карбоксимид общей формулы VIII подвергают реакции в присутствии основания с алкинилгалогенидом или -мезилатом, -тозилатом, -трифтороацетатом общей формулы IX,или д) вторичный амин общей формулы Х подвергают реакции с алкинилгалогенидом общей формулы XI, или галогенид общей формулы Х подвергают реакции с вторичным амином общей формулы XI в присутствии основания, или е) альдоксим или кетоксим общей формулы XII подвергают реакции в присутствии основания с алкинилгалогенидом или -мезилатом,-тозилатом, -трифтороацетатом общей формулыIX. Соединения, полученные и заявленные нами, являются новыми, они не раскрыты в литературе. Их структуры были исследованы после очистки, очистка проверена методами ТЖХ и ГХ. Молекулярная формула соединений подтверждена элементарным анализом, и структуры были определенно подтверждены исследованиями IR, 1H- и 13 С-ЯМР. Материалы могут быть формулированы как независимые составы или в смеси с другими известными артроподицидными активными ингредиентами, и в соответствии с целью заявки,могут быть использованы известные носители и другие дополнительные материалы. Таким об 13 разом, известными способами могут быть получены концентраты эмульсий, микроэмульсии,пыли, аэрозоли, пары и дымы. [Phone PoulencGeronazzo: Surfactant and Specialities for PlantProtection, Application Manual (1994), ICI: Surfactants, Application Manual (1992)]. В рамках заявки препарат, содержащий соединение общей формулы I, и препарат, содержащий известные активные ингредиент(ы), могут использоваться один после другого, или может использоваться их смесь. Для демонстрации нашего изобретения мы представляем следующие примеры, которые не следует рассматривать как ограничивающие объем охраны данного изобретения. Примеры получения Чистоту соединений проверяли методами ТЖХ и ГХ: (СР 9000, CP-SIL-5CB, 60 м 0,53 м, 5 мл/мин N2, FID, 220C). Как показано, с использованием этих методов все соединения имели чистоту более 95%. Структуру материалов подтверждали исследованиями IR, 1H и С 13-ЯМР, молекулярные формулы были подтверждены элементарным анализом. 14 1. Алкиниловые эфиры. Общая процедура. А) Подходящий алкиниловый спирт растворяли в сухом бензоле, добавляли пиридин и охлаждали смесь до 0-5 С. К этой смеси добавляли хлористый ацил с такой скоростью, что температура реакционной смеси не превышала 5 С. Реакционную смесь перемешивали при комнатной температуре в течение ночи, отфильтровывали выпавший в осадок хлоргидрат пиридина. Фильтрат нейтрализовали раствором соляной кислоты, затем промывали последовательно водой и насыщенным раствором хлорида натрия, высушивали над MgSO4 и выпаривали. Грубый материал очищали хроматографией. Б) 6 ммоль кислоты растворяли в 20 мл сухого ТГФ и добавляли 1,0 г (6 ммоль) диэтилазодикарбоксилата (DEAD). Смесь охлаждали на ледяной водяной бане и добавляли раствор 10 ммолей алкинола и 1,6 г (6 ммоль) трифенилфосфина в 10 мл ТГФ. Характерный оранжевый цвет DEAD постепенно исчезал. Раствор перемешивали при комнатной температуре в течение ночи, затем его разбавляли 50 мл этилацетата,промывали насыщенным раствором хлорида натрия, высушивали и выпаривали. Из остатка кристаллизовался оксид трифенилфосфина при добавлении смеси гексан-этилацетат. Фильтрат очищали колоночной хроматографией. ррт - означает здесь и далее по тексту - частей на миллион 2. Алкиниламиды. Общая процедура. Раствор хлористого ацила подвергали реакции с раствором алкиниламина в присутствии пиридина при комнатной температуре. Суспен зию разбавляли, промывали последовательно водой, разбавленным раствором соляной кислоты и раствором гидрокарбоната натрия, высушивали, выпаривали и очищали хроматографией и кристаллизацией. 3. Алкинилимиды. Общая процедура. К раствору фтальимида в сухом ДМФ добавляли 1 молярный эквивалент сухого карбоната калия и к этой суспензии по каплям добав 002064 ляли раствор 1 молярного эквивалента алкинилбромид в толуоле. Суспензию перемешивали при 80 С в течение 3 ч, затем ее переливали на ледяную воду, собирали кристаллы и кристаллизовали из 96% этанола. 4. (Арил-алкил)-, алкил-алкиниловые эфиры. 4.0. Получение 1-[(2-бутинилокси)этил]3,4-диметоксибензола (соединение 599). В колбе объемом 50 мл, снабженной термометром, магнитной мешалкой, воронкой для добавления реагентов и соединенной с системой подачи инертного газа, готовили суспензию 30 мл сухого ТГФ и 1,5 г (0,063 моля) NaH (cca. 90%). К суспензии по каплям добавляли раствор 4,0 г(0,021 моля) -метилвератрилового спирта в 21 мл сухого ТГФ при комнатной температуре. Смесь нагревали с обратным холодильником в течение 1 ч, охлаждали до комнатной температуры, добавляли 4,1 г (0,0315 моль) 1-бром-2 бутина, затем продолжали нагревание. После завершения реакции проводили ТЖХ (элюент: гексан-этилацетат 4:1). Реакцию была завершена примерно через 3-4 ч. К охлажденной мутной суспензии добавляли 50 мл эфира, смесь фильтровали на Целите, фильтрат промывали дистиллированной водой, высушивали над сульфатом магния и выпаривали. Кубовый остаток очищали колоночной хроматографией (элюент: гексан-этилацетат 4:1, R1=0,37). Выход: 2,3 г (9,8 ммоль), 46,9%. Чистоту продукта проверяли анализом ГХ:N2, FID, 250C)tR = 12,0 мин, 99%. Подтверждение структуры: Элементарный анализ: (С 14 Н 17 О 3, 233.29): подсчитано: С% 72.08, Н% 7.35 обнаружено: С% 69.70, Н% 7.21 ИК (СНСl3)см-1: 2976, 2855, 2837, 1605,1595, 1514, 1465, 1419, 1371, 1353, 1311, 1260,1164, 1141, 1086, 1027,864 1 Н-ЯМР (200 МГц, СDСl3) : 1.46 (3 Н, d,J=6.5 Гц, СН-СH3), 1.85 (3 Н, t, J=2.3 Гц,С-СН 3), 3.83 и 4.01 (2 Н, АВХ 3 JAB=15.0 Гц,JAX=JBX=2.3 Гц, =С-СН 2 О), 3.87 и 3.89 (сумма 6 Н, s каждый ОСН 3) 4.55 (2 Н, q, J=6.5 Гц, АrСНО), 6.80-6.89 (3 Н, m, ароматический). 13 С-ЯМР (50 МГц, CDCl3) : 3.61 (С-СН 3),23.76 (СН-СН 3), 55.87 (ОСН 3), 55.96 (С-СН 2),75.36 (С-СН 2), 76.40 (Ar-CH-СН 3), 81.91 (ССН 3), 109.06 (С-2), 110.86 (С-5), 118.94 (С-6),135.30 (С-1), 148.52 (С-3), 149.19 (С-4). Аналогично тому, как описано в примере 4.0, мы получили следующие соединения: комнатной температуре. Далее, ее разбавляли водой и эфиром, фазы разделяли, водную фазу дважды экстрагировали эфиром, объединенные органические фазы дважды промывали водой и высушивали над MgSO4. 6. Арилалкиниловые эфиры. Общая процедура. А) Подходящий фенол растворяли в сухом ДМФ и добавляли к раствору сухой К 2 СО 3 и подходящий алкинилгалогенид. Реакционную смесь нагревали до 60 С и перемешивали при этой температуре в течение 3-6 ч. ДМФ далее отгоняли в вакууме, остаток суспендировали в смеси хлороформа и дистиллированной воды. Фазы разделяли, водную фазу дважды экстрагировали хлороформом, объединенные органические фазы промывали последовательно водой и насыщенным раствором хлорида натрия, высушивали над MgSO4 и выпаривали. Грубый продукт очищали хроматографией. Б) Рh3 Р растворяли в сухом бензоле в инертной атмосфере и добавляли к раствору подходящий спирт и затем фенол. Смесь охлаждали до 0-10 С и медленно, малыми порциями добавляли DEAD (диэтилазодикарбоксилат),поддерживая температуру ниже 10 С. Реакционную смесь перемешивали в течение 10-24 ч. Результат: осажденный Рh3 РО отфильтровывали, фильтрат промывали водой, высушивали и выпаривали. Остаток хроматографировали. В) 0,01 моля фенола растворяли в 7 мл сухого ацетонитрила и охлаждали до -4 С в атмосфере аргона. Далее к раствору добавляли 1,968 г (0,0129 моля) DBU, поддерживая температуру ниже -4 С. К полученному раствору добавляли 1,8 г меди (II) и параллельно готовили трифторацетат другого реагента. 0,0115 Моля алкинилового спирта растворяли в 7 мл ацетонитрила и охлаждали раствор до -5 С в атмосфере аргона. К раствору добавляли 1,968 г (0,0129 моля)DBU, при температуре ниже -5 С. К смеси по каплям добавляли 1,6 г (0,0115 моля) ангидрида трифторуксусной кислоты, поддерживая температуру ниже 2 С. Полученную смесь перемешивали при 0 С в течение 30 мин. Полученный таким образом раствор трифторацетата по каплям добавляли к первому раствору, поддерживая температуру ниже 0 С и перемешивали смесь при 0 С в течение 5 ч. После реакции следовала ТЖХ. В конце реакции ацетонитрил отгоняли в вакууме. Остаток перемешивали со смесью 150 мл бензола и 50 мл воды. Органическую фазу промывали последовательно 1N соляной кислотой, 1N гидроксидом натрия, водой и насыщенным раствором хлорида натрия, затем высушивали и выпаривали. Продукт очищали хроматографией. 7. Алкинилоксимовые эфиры. Общая процедура. Оксим переводили в оксимовый эфир классическим способом, путем его реакции с алкинилбромидом в диметилформамиде, в при 002064 сутствии карбоната калия (см. способ А при получении нафтиловых эфиров). Грубый продукт в каждом случае очищали колоночной хроматографией. Результаты активности Пример 1. Исследование синергичной активности на домашней мухе (Musca domestica) после поверхностного нанесения. В двух параллельных экспериментах 10 женских особей домашней мухи, в возрасте 2-4 дней, обрабатывали с боковой стороны их грудной части 0,2 л тестируемого раствора, при помощи микропипетки Hamilton MicroLab P. Помимо фиксированной синергичной дозы в 1000 нг на муху, животных обрабатывали карбофураном в дозе 20 нг на муху. В качестве растворителя был использован целлозольв. Селекцию и подсчет мух проводили под воздействием СО 2. После обработки мух содержали в пластиковых чашках, покрытых тюлем. Смертность после 24 ч выражали в %. Результаты продемонстрированы в таблице ниже: Пример 2. Исследование синергичной активности на черве семенной коробочки хлопка(Helicoverpa armigera) после поверхностного нанесения. Обработку проводили сходным образом,как описано в примере 1, но в качестве тестируемых животных были обработаны личинки стадии L2 червя семянной коробочки хлопка(Helicoverpa armigera). Значения данных дозасмертность LD50 (нг на личинку) после 24 ч определяли пробит-анализом. Ни один из синергистов не действовал в использованной дозе 1000 нг на личинку. Отношение синергиста было подсчитано как частное от деления значенийLD50 карбофурана, введенного отдельно и с синергистом. Эксперименты были повторены 2-4 раза. Отношение синергистов продемонстрировано в таблице ниже: Пример 3. Исследование синергичной активности на домашней мухе (Musca domestica) и черве семенной коробочки хлопка (Helicoverpaarmigera) после поверхностного нанесения. Синергичные активности материалов 279 и 599 настоящего изобретения для различных активных ингредиентов определяли на домашней мухе (Musca domestica) и черве семенной коробочки хлопка (Helicoverpa armigera),используя способы обработки, как описано в биологических примерах 1 и 2. Для активных ингредиентов ISO даны обычные названия (см. Руководство по пестицидам (Pesticide Manual 1994). Полученные отношения синергистов даны ниже: Пример 4. Влияние отношения активный ингредиент:синергист на синергичную активность. Обработку проводили, как описано в примере 1, используя микродозатор Hamilton MicroLab P. В двух параллельных экспериментах 10 женских особей домашней мухи в возрасте 23 дней обрабатывали с боковой стороны их грудной части 0,2 л тестируемого раствора. Помимо фиксированной синергичной дозы в 1000-400-200-80 нг на муху, их обрабатывали постоянным карбофураном в дозе 20 нг на муху. Селекцию и подсчет мух проводили под воздействием СО 2. После обработки мух содержали в пластиковых чашках, покрытых тюлем. После 24 ч определяли % смертности. В зависимости от результатов эксперименты повторяли 2-4 Пример 5. Исследование синергичной активности на популяциях устойчивых домашних мух (Musca domestica). Таблица ниже демонстрирует синергичные активности материалов настоящего изобретения для различных ингредиентов на двух устойчивых штаммах домашней мухи (INSEL, IX). Исследование было проведено, как описано в биологическом примере 1. Значения LD50 и отношения синергистов определяли, как указано в примере 2. Пример 6. Исследование синергичной активности на тлях овса (Rhopalosiphum padi). Растения овса высотой 5-8 см, помещенные в пластиковые чашки, заражали видами тлиRhopalosiphum padi различного возраста. Помещенных тлей подсчитывали перед обработкой,затем растения обрабатывали распылением 1 мл раствора для распыления с использованием ручного распылителя, помимо введения фиксированной дозы (30 ррm) синергиста. Был приготовлен эмульгируемый концентрат, 100 г/л соединения 279 настоящего изобретения способами, обычными в практике приготовления составов, с добавлением растворителя и поверхностно-активных материалов. Тест-растворы, использованные для распыления, были приготовлены из этого концентрата и из препаратов,имеющихся в продаже, путем разбавления. Смертность тлей определяли через 24 ч после обработки. Результаты показаны ниже: Пример 7. Исследование влияния на плодовитость домашней мухи (Musca domestica). Группы, состоящие из вновь выведенных 50 мужских и 50 женских мух, кормили в течение 48 ч гранулированным сахаром, содержавшим 500 ppm материала 441 и 484 настоящего изобретения, соответственно, выращивали яйца, отложенные в течение следующих 10 дней. Эффект снижения плодовитости выражали как отношение количеств вылупившихся мух в обработанной и необработанной группах. Эксперименты повторяли 4 раза. Пример 8. Синергия акарицидного эффекта, исследованная на двупятнистых паутинных клещах (Tetranychus urticae). С первой пары листьев однонедельного растения боба вырезали диски листьев диаметром 225 мм, которые были обработаны путем их погружения (5 мин) в тест-раствор, состоящий из активного ингредиента и синергиста в определенных концентрациях. Для приготовления концентрированных растворов необходимой концентрации добавляли 10% ацетона в качестве сорастворителя и 0,1% Tween-80 в качестве детергента. Высушенные диски листьев укладывали на влажную поверхность и инфицировали 10 подрастающими женскими клещами на лист. После 48 ч подсчитывали смертность, используя микроскоп и щетку. Эксперимент проводили 4 раза. Средние результаты показаны в таблице ниже. Пример 9. Эффективность полевых испытаний против колорадского жука (Leptinotarsadecemlineata). Готовили эмульгируемый концентрат соединения 279 настоящего изобретения с концентрацией 100 г/л способами, используемыми в практике приготовления составов, добавляя растворитель и поверхностно-активные материалы. Добавляли состав Чинуфур (Chinufur) 40FW, содержащий 400 г/л карбофурана, совместно с фиксированной дозой в 2 л/га соединения 279 при исследовании на поле малого размера против колорадского жука (Leptinotarsa decemlineata). Распыление проводили распылителем с мотором (Maruyama), распыляя 300 л/га раствора для распыления. Обработку повторяли 4 раза, на участке земли 25 м 2. Влияние обработок оценивали на второй день путем подсчета выживших жуков на растениях. Результаты показаны в таблице ниже: Пример 10. Синергичная активность соединения 599. Синергичную активность соединения 599 с различными специфичными акарицидами исследовали против двупятнистого паутинного клеща (Tetranychus urticae) способами, описанными в примере 8. Значения LC50 и LC95, подсчитанные из отношения концентрациясмертность, показаны в таблице ниже. Синергичная активность против двупятнистого паутинного клеща (Tetranychus urticae) Пример 11. Синергичная активность против тли гороха (Acyrthosiphon pisun). Синергичную активность соединения 599 тестировали против тли гороха (Acyrthosiphon pisun) при полевых условиях на малых участках земли (10 м 2). Наносили объем раствора для распыления 300 л/га, используя моторный распылитель (Maruyama). Эффективность выражали средним числом тли на лист до обработки и через два дня после обработки, соответственно. (Henderson and Tilton: J.Econ.Entomol,48:157, 1995). Результаты показаны в таблице ниже. 3. Арилалкиниловые эфиры. Пример 12. Сравнительные исследования с известными синергистами. Значения LD50 соответствующих соединений определяли в 4 повторениях на мухах, обработанных карбофураном и 1000 нг известного синергиста, и подсчитывали отношения SR50 относительно контрольного карбофурана. Эти отношения SR50 сравнивали с таковыми новых соединений, полученных нами. Наши соединения были активнее в каждом случае. 1. Алкиниловые эфиры. 39 Примеры для приготовления составов. Торговые названия вспомогательных материалов даны в кавычках, после чего следуют названия производителей. 1. Получение порошков. А) 158 г сильно размельченного перлита,20 г карбофурана и 20 г соединения 279 смешивали в гомогенизаторе, к этой смеси добавляли 2 г эфира жирного спирта и полигликоля("G-3920" ICI) и гомогенизировали смесь. Порошковую смесь размельчали в эжекторной мельнице и добавляли к ней 5 г октилфенолполигликолевого эфира (ЕO=20) ("Triton X-165"("Aerosol-13" Цианамид). Полученный продукт является способной к увлажнению порошковой смесью (WP). Б) 10 г соединения 279 и 10 г карбофурана разбавляли 2 г этанола. Раствор смешивали с 5 г лигнинсульфоната кальция ("Borrespeseca", Borregard), 5 г нонилфенолполигликолевого эфира("Arkopal N-200" Hoechst) и 70 г карбоната кальция в порошковом гомогенизаторе. Полученный продукт размельчали в мельнице alpine100 typ. Средний размер частиц составил 1-2 м. Этот состав может быть использован для получения микросуспензий. В) Смесь 3 г диазинона, 3 г соединения 441 и 0.3 г эфира жирного спирта и полигликоля("G-3920" ICI) помещали в аппарат для гомогенизирования в смесь 1,0 г синтетической кремниевой кислоты (Aerosil 200) и 191 г талька(dmax=15-30 м), рН последнего был предварительно доведен до рН=7.0 при помощи калий- и натрийфосфатного буферов. При дальнейшем перемешивании добавляли 1 г диоктилсульфосукцината ("Aerosol OTB" Cyanamid) и 1 г сульфоната эфира жирного спирта и полигликоля("Genapol LRD" Hoechst) и, наконец, смесь размельчали до среднего размера частиц 20 м. Полученный продукт является легко летучим порошковым препаратом. 2. Получение концентратов эмульсий.A) Смесь 5 г пиримикарба и 5 г соединения 493 растворяли в смеси 20 г ксилола и 40 г пропанола. К этому раствору добавляли смесь 4 г этоксилированного алкилфенола и соли линейный-алкил-арил-сульфонат кальция ("Geronol FF/U" Geronazzo) и 6 г смеси этоксилированного амина, жирной кислоты и соли линейный-алкил-арил-сульфонат щелочного металла("Geronol MS" Geronazzo). После полного растворения добавляли 20 г воды. Получали прозрачный раствор, для которого характерно то,что при разбавлении водой он образует эмульсию с диаметром капель 0,8-1.5 м. Б) Смесь из 5 г хиналфоса, 10 г соединения 484 и смеси 7 г этоксилированного (ЕO=13) пропоксилированного (РO=21) нонилфенола, 2 г кальциевой соли линейный-додецил-бензолсульфоновой кислоты и 12 г РОЕ-(20)-сорбитан 002064 40 моноолеата растворяли в смеси 28,6-28,6 мл пропиленгликоля и сосновой жирной кислоты и 23,8 мл подсолнечного масла, 9,5 мл этанола и 95 мл алифатического углеводорода и нафталиновой константой 45%. Полученный таким образом материал может быть предпочтительно использован для получения микроэмульсий.B) Смесь 0,02-0,02 мас. ч. активного ингредиента и синергиста растворяли в 10 мас. ч. пропанола, к полученному раствору добавляли 99,96 мас. ч. лишенной запаха нефти и перемешивали смесь по получения гомогенного раствора. Полученный таким образом диспергируемый препарат может прямо быть использован в применении к ULV. Г) Следуют способу, описанному в примере А), с разницей, что в качестве синергиста активного ингредиента используют 10 г соединения 279. 3. Получение гранулятов. В механическом грануляторе смешивали 300 г карбофурана, 300 г соединения 418, 1500 г соли поликарбоксилата щелочного металла("Sorphol", Toho), 500 г додецилбензолсульфоновой кислоты ("Маrlоn ТР 370" Huls), 500 г свекольного сахара и 7200 г каолинита. Полученную таким образом смесь смешивали с 8300 мл воды, используя миксер с высокой силой резки (v=10 м/с). В конце смесь высушивали распылением. Распределение размера частиц продукта составляет 0,1-0,4 мм. 4. Получение аэрозолей. В аппарате 100 1, снабженном мешалкой,смешивали 1 кг биоаллетрина, 0.5 кг соединения 441, 0,1 кг aerosil-air 972, 0,1 кг этиленгликольмоносалицилата, 15 кг лишенной запаха нефти и 50 кг пропанола. После растворения полученной смесью заполняли цилиндры с 33,3 кг жидкого газа пропан-бутан (25-75). 5. Получение паров. В 60 мл этанола растворяли 5 г Sбиоаллетрина, 5 г соединения 279 и 1 г лимонного ароматизатора. Раствором заполняют испаритель при температуре 50 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы IR5, R6, R7, R8 являются, независимо друг от друга, Н, C1-C6 алкилом, C1-C6 галогеналкилом,C1-C6 алкенилом; Е = Н, метилу, где метил условно считается одним атомом;p = 0, 1, 2,с условием, что сумма атомов -(CR1R2)m(YR3R4)n-X-(CR5R6)o-(CR7R8)p скелетного моста равна 3 и -СС-Е скелет образует с атомами моста линейную цепь, состоящую из 6 атомов,заканчивающуюся предпочтительно метильной группой, с дополнительным условием, что,если Аr является нафтильной группой, Y означает С-атом, Х означает O-атом, R3 и R4 совместно не могут означать =O, или если Аr является фталимидной группой, R1 означает метил, m = 1, n = 0, о = 1, R5 и R6 являются атомами водорода, р = 0, Е не является водородом, или если Аr является нафтильной группой, m = 0, n = 0, Х означает O-атом, R5, R6, R7 и R8 являются атомами водорода, Е не является водородом, или если Аr является фенилом, который может быть замещен или нафтилом, m = 0, n = 1, Х означает O-атом, Y является атомом углерода,R3 и R4 являются атомами водорода или совместно означают атом кислорода, или YR3R4 вместе образуют R9-C=N-группy, где R9 = H или алкилу, Е не является водородом. 2. Соединения общей формулы IA их оптически активные изомеры и соли,где Аr является С 3-С 6 алициклической, ароматической или пяти- или шестичленной гетероциклической группой, содержащей один или два атома азота и/или один или два атома кислорода, которая может быть замещена одной или более C1-C4 алкокси-, метилендиокси-, C1-C6 алкильной, C1-C6 галогеналкильной, нитрогруппой или атомом галогена и/или конденсирована с бензольным кольцом;R1, R2 являются, независимо друг от друга,Н, C1-C6 алкилом, C1-C6 галогеналкилом, C1-C6 алкенилом, фенилом, C3-C6 циклоалкилом,R3, R4 являются, независимо друг от друга,Н, C1-C6 алкилом, C1-C6 галогеналкилом, C1-C6 алкенилом, фенилом, C3-C6 циклоалкилом, илиR3 и R4 являются совместно атомом кислорода,Y=C или и их оптически активные изомеры, где Аr,R1, R2, R5, R6, R7, R8, Y, Е, m, о и р имеют те же значения, как определено в п.1. 3. Соединения общей формулы IB и их оптически активные изомеры, где Аr,R1, R2, R5, R6, R7, R8, R10, Y, Е, m, о и р имеют те же значения, как определено в п.1. 4. Соединения общей формулы IC и их оптически активные изомеры, где Аr,R1, R2, R3, R4, R5, R6, R7, R8, Е, m, n, о и р имеют те же значения, как определено в п.1. 5. Соединения общей формулы ID 43 и их соли, и их оптически активные изомеры, где Ar, R1, R2, R3, R4, R5, R6, R7, R8, R10, Е, m,n, о и р имеют те же значения, как определено в п.1. 6. Соединения общей формулы IE и их соли, и их оптически активные изомеры, где Ar, R1, R2, R3, R4, R5, R6, R7, R8, R10, E, m,n, о и р имеют те же значения, как определено в п.1. 7. Соединения общей формулы IF и их оптически активные изомеры, где Ar,R1, R2, R5, R6, R7, R8, R9, Е, m, о и р имеют те же значения, как определено в п.1. 8. Соединения по п.1 1-нафтилметил-2-бутиниловый эфир,2-пропинил-1,3-бензодиоксол-5-карбоксилат,1-[(2-бутинилокси)этил]-3,4-диметоксибензол,2,6-дихлор-1-(2-бутинилоксиметил)бензол,1-[1-(2-бутинилокси)пропил]нафталин,R-(+)-2-[1-(2-бутинилокси)этил]нафталин,5-[(бут-2-инилокси)метил]-1,3-бензодиоксол,5-[2-метил-1-(2-бутинилокси)пропил]-1,3 бензодиоксол,5-[(бут-2-инилокси)фенилметил]-1,3-бензодиоксол,2-[(2-бутинилокси)метил]-1,4-бензодиоксан,2,3-дигидро-2,2-диметил-7-(3-пентинилокси)бензофуран. 9. Способ получения соединений общей формулы I, где Ar, R1, R2, R3, R4, R5, R6, R7, R8,R10, X, Y, Е, m, n, о и р имеют те же значения,как определено в п.1, отличающийся тем, что а) для получения соединений общей формулы IA, где Ar, R1, R2, R5, R6, R7, R8, Y, Е, m, о и р имеют те же значения, как определено в п.1,осуществляют взаимодействие между соединениями общих формул II и III где Ar, R1, R2, R5, R6, R7, R8, Y, Е, m, о и р имеют те же значения, как определено в п.1, А и В являются группами, подходящими для образования эфирной связи; б) для получения соединений общей формулы IB, где Ar, R1, R2, R5, R6, R7, R8, R10, Y, Е,m, о и р имеют те же значения, как определено в п.1, осуществляют взаимодействие между соединениями общих формул IV и V где Ar, R1, R2, R5, R6, R7, R8, Y, Е, m, о и р имеют те же значения, как определено в п.1, и С и D являются группами, подходящими для образования амидной связи; в) для получения соединений общей формулы IC, где Ar, R1, R2, R5, R6, R7, R8, Е, m, n, о и р имеют те же значения, как определено в п.1,R3 и R4, независимо друг от друга, означают Н,алкил, алкенил, галогеноалкил, фенил, замещенный фенил, осуществляют взаимодействие между соединениями общих формул VI и VII где Ar, R1, R2, R5, R6, R7, R8, Е, m, n, о и р имеют те же значения, как определено в п.1, R3 и R4,независимо друг от друга, означают Н, алкил,алкенил, галогеноалкил, фенил, замещенный фенил, F и G являются группами, подходящими для образования эфирной связи; г) для получения соединений общей формулы ID, где Ar-(CR1R2)m-(CR2R4)n-N является карбоксимидной группой, R5, R6, R7, R8, Е, о и р имеют те же значения, как определено в п.1,карбоксимид общей формулы VIII подвергают реакции с соединением общей формулы IX где R5, R6, R7, R8, E, o и p имеют те же значения,как определено в п.1, и Lg представляет собой отщепляемую группу; д) для получения соединений общей формулы IE, где Ar, R1, R2, R3, R4, R5, R6, R7, R8, R10,Е, m, n, о и р имеют те же значения, как определено в п.1, осуществляют взаимодействие между соединениями общих формул Х и XI где Ar, R1, R2, R3, R4, R5, R6, R7, R8, E, m, n, о и р имеют те же значения, как определено в п.1, Н иI представляют собой группы, подходящие для образования группы где R10 имеет значение, как указано выше; е) для получения соединений общей формулы IF, где Ar, R1, R2, R5, R6, R7, R8, R9, E, m, о и р имеют те же значения, как определено в п.1,осуществляют взаимодействие между соединениями общих формул XII и IX где Ar, R1, R2, R5, R6, R7, R8, R9, E, m, n, о и р имеют те же значения, как определено в п.1, иLg представляет собой отщепляемую группу, и,если необходимо, полученное таким образом соединение общей формулы I превращают в его соли, или выделяют из его солей, и, если необходимо, разделяют его оптически активные изомеры. 10. Пестицидный состав, содержащий в качестве активного ингредиента 0,0001-99,9 мас.% соединения общей формулы I, где Ar, R1,R2, R3, R4, R5, R6, R7, R8, R10, m, n, о и р имеют те же значения, как определено в п.1, и, возможно,другие пестицидные активные ингредиент(ы), а также носители и другие дополнительные материалы. 11. Артроподицидный состав, содержащий в качестве активного ингредиента 0,0001-99,9 мас.% соединения общей формулы I, где Ar, R1,R2, R3, R4, R5, R6, R7, R8, R10, m, n, о и р имеют те же значения, как определено в п.1, и, возможно,другие артроподицидные активные ингредиент(ы), а также носители и другие дополнительные материалы. 12. Состав по п.11, отличающийся тем, что он содержит в качестве другого активного ингредиента производные ацетамида: например оксамил; соединения бензоилмочевины: например флуциклоксурон, гексафлумурон, тефлубензурон, трифлумурон; бензоилмочевиноподобные IGR соединения; соединения бициклогептадиена: например гептенофос; дифенильные соединения, соединенные мостами: например этофенпрокс, бромопропилат, метоксихолор, темефос, тетрадифон; карбаматы: например аминокарб, алдикарб, алдоксикарб, асулам, бендиокарб, бенфуракарб, карбарил, карбетамид, карбофуран, карбосульфан, диэтофенкарб, диоксакарб, этиофенкарб, фенобукарб, феноксикарб, фурантиокарб,изопрокарб, метомил, оксамил, пиримикарб(флуфензин); тиадиазины: например бупрофезин; тиазолидин: например гекситиазокс; триазоли: например исазофос, RH 7988; хлорсодержащие углеводороды: линдан; макроциклические лактоны; тебуфенпирад; фенпироксимат; триазамат. 13. Составы по пп.11 и 12, содержащие в качестве активного ингредиента общей формулы I одно или более из следующих соединений: 1-нафтилметил-2-бутиниловый эфир,2-пропинил-1,3-бензодиоксол-5-карбоксилат,1-[(2-бутинилокси)этил]-3,4-диметоксибензол,2,6-дихлоро-1-(2-бутинилоксиметил)бензол,1-[1-(2-бутинилокси)пропил]нафталин,R-(+)-2-[1-(2-бутинилокси)этил]нафталин,5-[(бут-2-инилокси)метил]-1,3-бензодиоксол,5-[2-метил-1-(2-бутинилокси)пропил]-1,3 бензодиоксол,5-[(бут-2-инилокси)фенилметил]-1,3 бензодиоксол,2-[(2-бутинилокси)метил]-1,4-бензодиоксан,2,3-дигидро-2,2-диметил-7-(3-пентинилокси)бензофуран. 14. Состав по пп.11-13, содержащий в качестве активного ингредиента 0,0001-99,9 мас.% соединения общей формулы I, где Аr, R1, R2, R3,R4, R5, R6, R7, R8, R10, m, n, о и р имеют те же значения, как определено в п.1, и карбамат, 47 подходящий для уничтожения артропода, предпочтительней карбофуран. 15. Состав по п.14, содержащий в качестве соединения общей формулы I (2-бутинилоксиметил)-3,4-диметоксибензол. 16. Состав по п.14, содержащий в качестве соединения общей формулы I 5-[(бут-2 инилокси)метил]-1,3-бензодиоксол. 17. Способ уничтожения паразитов, предпочтительней членистоногих, включающий обработку паразитов, предпочтительней членистоногих, подходящим количеством состава по п.10 или 11, если желательно, таким образом,что составы, содержащие соединения общей 48 формулы I, где Аr, R1, R2, R3, R4, R5, R6, R7, R8,R10, m, n, о и р имеют те же значения, как определено в п.1, и составы, содержащие известные активные ингредиенты, используют в смеси или последовательно. 18. Соединения по п.1, отличающиеся тем,что Аr представляет собой тетрагидронафтил,нафтил, бензодиоксол, фенил, бензофуранил,тетрагидробензофуранил или инденил, который может быть замещен одной или более C1-C4 алкокси-, метилендиокси-, C1-С 6 алкильной, C1-С 6 галогеналкильной или нитрогруппой или галогеном.
МПК / Метки
МПК: A01N 31/04, C07D 317/48, C07C 43/166
Метки: пестицидные, получения, способ, составы, соединения
Код ссылки
<a href="https://eas.patents.su/26-2064-pesticidnye-soedineniya-sostavy-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Пестицидные соединения, составы и способ их получения.</a>
Предыдущий патент: Каротажная система, спускаемая в колонну бурильных труб и способ бурения скважины с проведением в ней исследований с использованием такой системы
Следующий патент: Цветной магнитный тонер и способ его изготовления
Случайный патент: Устройство для определения и регулирования расхода потока текучей среды