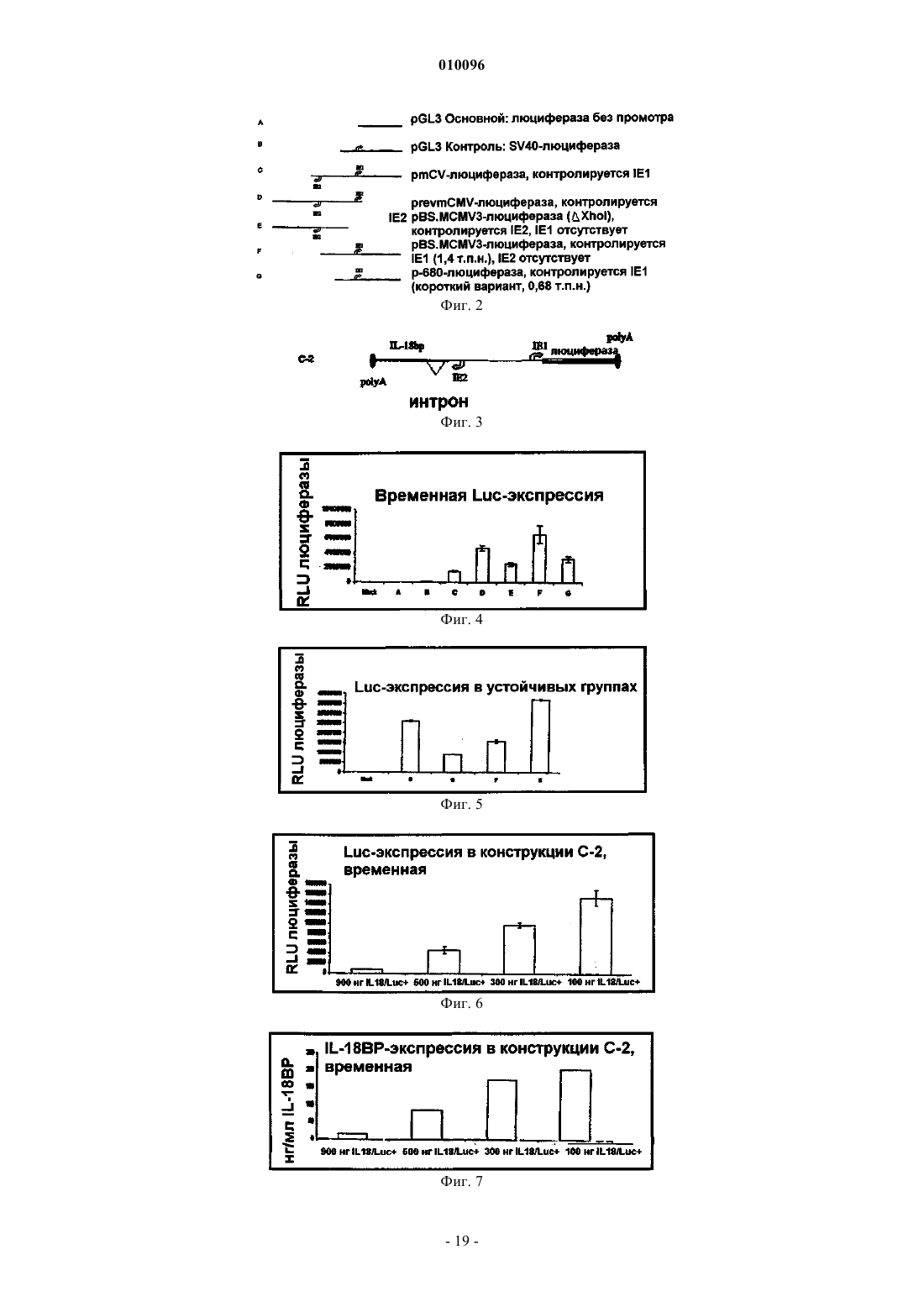
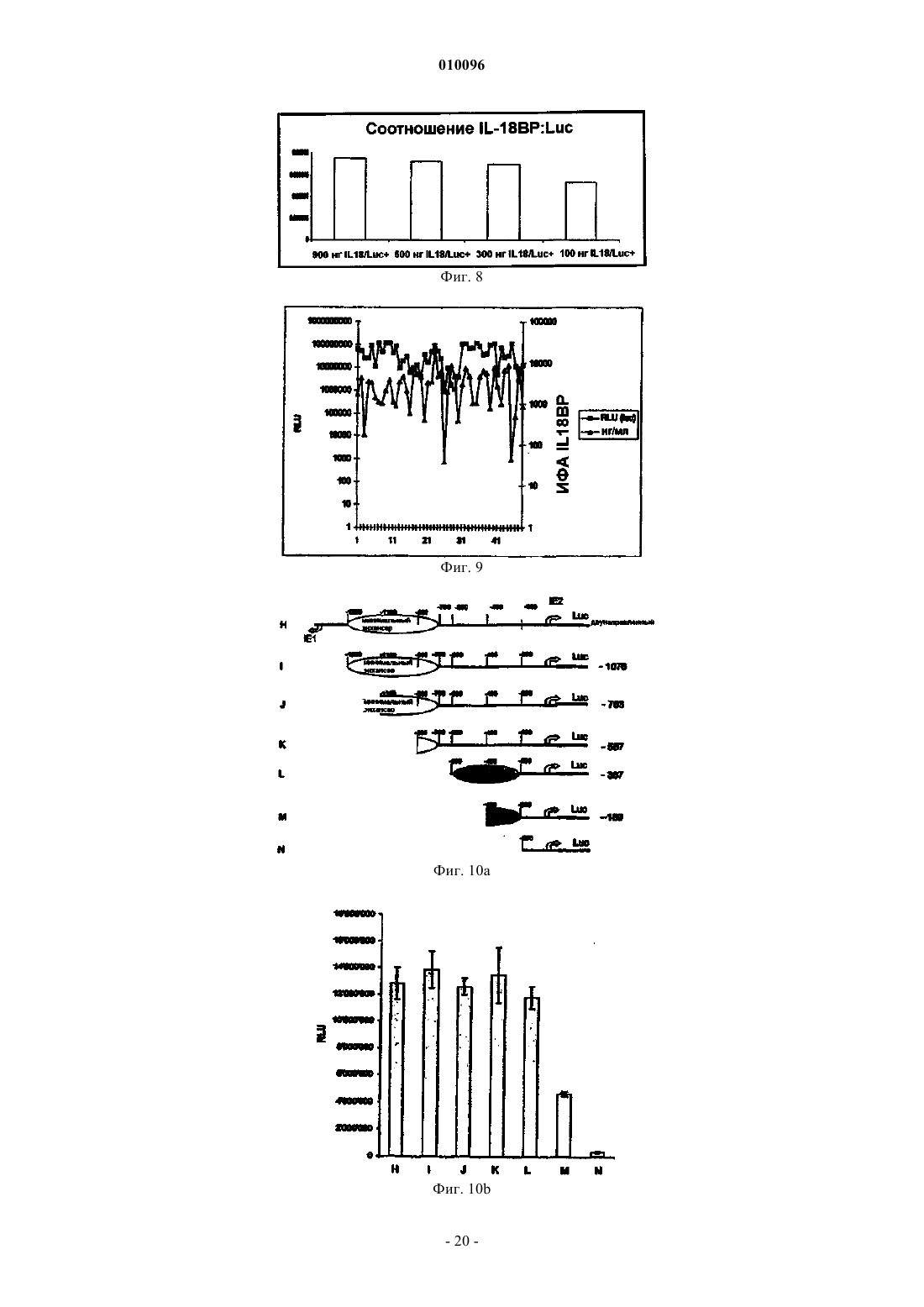
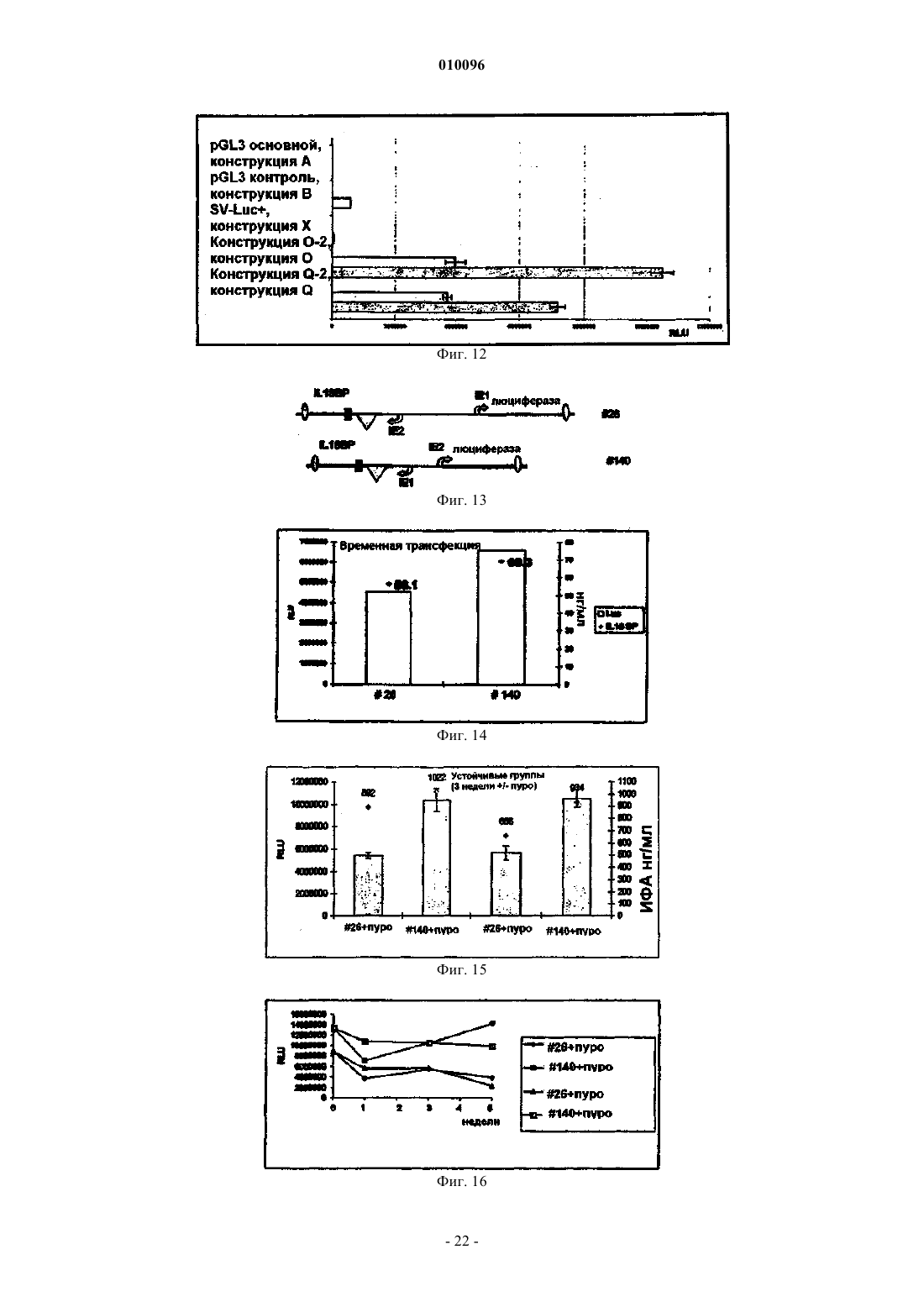
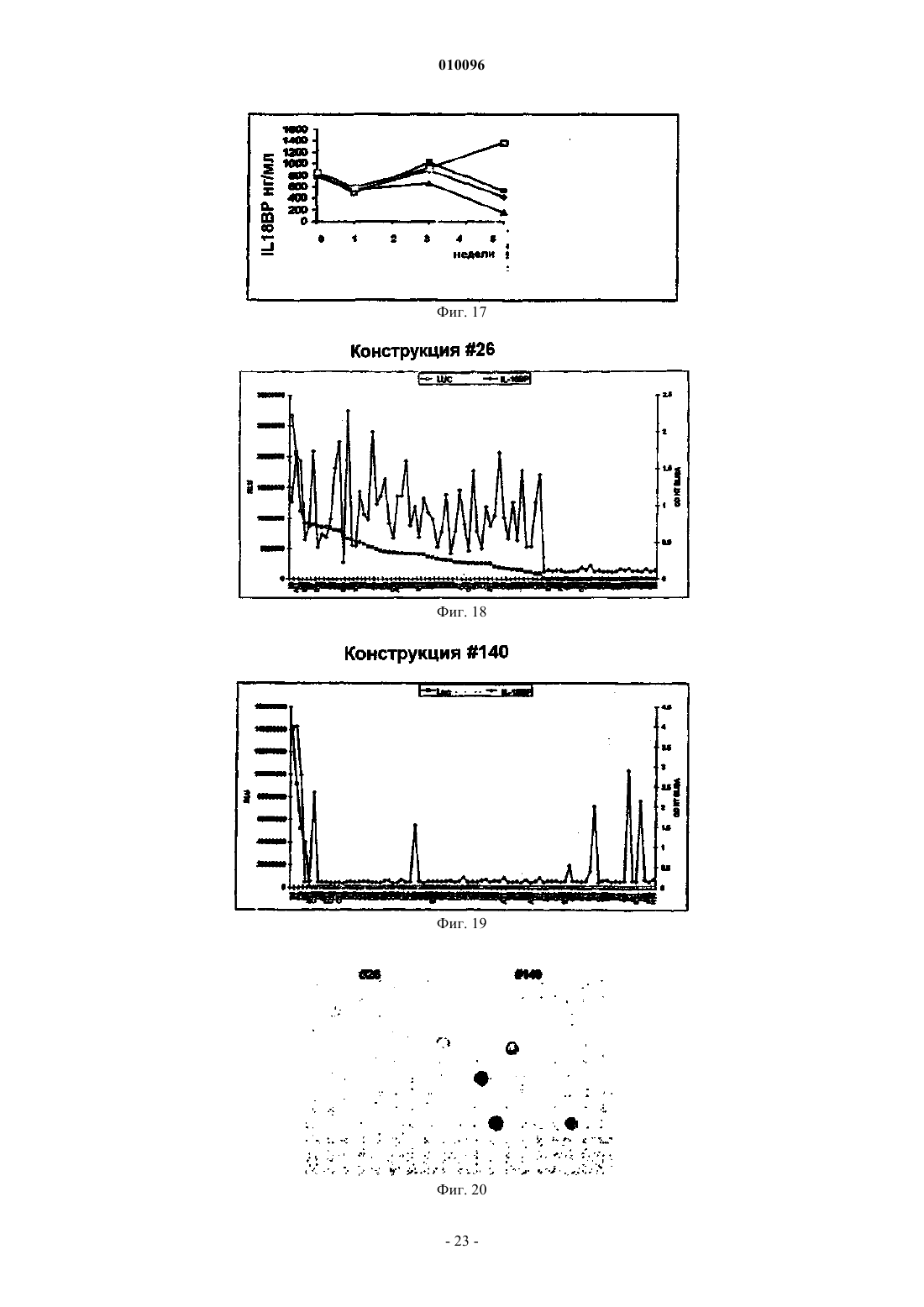
Экспрессирующие векторы, содержащие ie2-промотор мсмv
Формула / Реферат
1. Экспрессирующий вектор, содержащий коровый промотор mCMV-IE2-гена, простирающийся от нуклеотида 1 до нуклеотида 39 в последовательности SEQ ID No: 1, где:
(i) экспрессирующий вектор не содержит никакого полного гена mCMV и
(ii) указанный промотор mCMV-IE2-гена оперативно связан с ДНК-последовательностью, кодирующей полипептид.
2. Вектор по п.1, дополнительно содержащий промотор, отличающийся от указанного mCMV-IE2-промотора.
3. Вектор по п.1 или 2, включающий в себя первый и второй промоторы вирусного, клеточного или искусственного происхождения.
4. Вектор по п.3, в котором первый промотор представляет собой mCMV-IE2-промотор, а второй промотор представляет собой mCMV-IE1-промотор.
5. Вектор по любому из предшествующих пунктов, содержащий ДНК-последовательность SEQ ID No: 1.
6. Вектор по любому из предшествующих пунктов, содержащий фрагмент, содержащий нуклеотиды от -587 до -189 слева от области mCMV-IE2, где нумерация нуклеотидов осуществляется относительно +1 IE2-гена.
7. Вектор по любому из предшествующих пунктов, включающий в себя фрагмент, содержащий нуклеотиды от -587 до -189 слева от области mCMV-IE2, где нумерация нуклеотидов осуществляется относительно +1 IE2-гена.
8. Вектор по любому из пп.3-7, где первый и второй промоторы оперативно связаны с ДНК-последовательностями, кодирующими по меньшей мере один полипептид.
9. Экспрессирующий вектор, содержащий энхансер mCMV-IE2-гена, простирающийся от нуклеотида -387 до нуклеотида -189 выше области mCMV-IE2, где нумерация нуклеотидов осуществляется относительно +1 IE2-гена, где указанный экспрессирующий вектор:
(i) не содержит никакого полного гена mCMV и
(ii) содержит первый и второй промоторы вирусной, клеточной или искусственной природы, где указанные первый и второй промоторы оперативно связаны с ДНК-последовательностями, кодирующими по меньшей мере один полипептид.
10. Вектор по п.8 или 9, где ДНК-последовательности кодируют по меньшей мере один представляющий интерес белок.
11. Вектор по п.10, где ДНК-последовательности кодируют по меньшей мере один маркерный белок.
12. Вектор по п.10, где ДНК-последовательности кодируют по меньшей мере один репортерный белок.
13. Вектор по любому из пп.3-11, где первый промотор, а также второй промотор располагают таким образом, чтобы они были двунаправленными.
14. Вектор по любому из предшествующих пунктов, дополнительно включающий в себя один или более регуляторных элементов, выбранных из 5'UTR, интронов, 3'UTR, 3'-концевых процессирующих мРНК-последовательностей, сайтов полиаденилирования и последовательностей внутреннего связывания рибосом (IRES).
15. Вектор по п.14, где регуляторный элемент представляет собой IRES, дополнительно содержащий ДНК-последовательность, кодирующую по меньшей мере одну полицистронную мРНК.
16. Вектор по любому из предшествующих пунктов, дополнительно включающий в себя один или более ДНК-элементов, выбранных из инсуляторов, пограничных элементов, районов контроля локуса (LCR), областей прикрепления к матриксу (MAR) и элементов для рекомбинации и кассетного обмена.
17. Вектор по любому из пп.8-16, где ДНК-последовательность, кодирующая полипептид, оперативно связанная с первым промотором, и ДНК-последовательность, кодирующая полипептид, оперативно связанная со вторым промотором, кодирует тот же самый полипептид.
18. Вектор по любому из пп.8-16, где ДНК-последовательность, кодирующая полипептид, оперативно связанная с первым промотором, и ДНК-последовательность, кодирующая полипептид, оперативно связанная со вторым промотором, кодирует разные полипептиды.
19. Вектор по п.18, где ДНК-последовательность, кодирующая полипептид, оперативно связанная с первым промотором, кодирует первую субъединицу димерного или мультимерного белка, и ДНК-последовательность, кодирующая полипептид, оперативно связанная со вторым промотором, кодирует вторую субъединицу димерного или мультимерного белка.
20. Вектор по п.19, где одна субъединица представляет собой альфа-цепь, а другая субъединица представляет собой бета-цепь гормона, выбранного из FSH человека, LH человека, TSH человека и CG человека.
21. Вектор по п.19, где одна субъединица представляет собой тяжелую цепь, а другая субъединица представляет собой легкую цепь иммуноглобулина.
22. Вектор по любому из пп.10-21, где представляющий интерес белок выбран из FSH, LH, CG, TSH, гормона роста, интерферона, белка I, связывающего TNF, белка II, связывающего TNF, RaptivaТ, IL-18BP или их мутеинов, фрагментов, функциональных производных и слитых белков.
23. Вектор по любому из пп.11-22, где маркерный белок выбран из аденозиндезаминазы (ADA), аминогликозидфосфотрансферазы (neo), дигидрофолатредуктазы (DHFR), гигромицин-В-фосфотрансферазы (НРН), тимидинкиназы (tk), ксантин-гуанинфосфорибозилтрансферазы (gpt), гена множественной лекарственной устойчивости (MDR), орнитиндекарбоксилазы (ODC) и устойчивости к N-(фосфоноацетил)-L-аспартату (CAD), пуромицинацетилтрансферазы (РАС), галактокиназы, человеческих рецепторов фолата или восстановленных носителей фолата.
24. Вектор по пп.12-23, где репортерный белок выбран из люциферазы, зеленого флуоресцирующего белка, щелочных фосфатаз и пероксидазы хрена или их сочетаний.
25. Экспрессирующий вектор, содержащий промотор mCMV-IE2-гена, где указанный промотор состоит из последовательности, выбранной из группы, состоящей из:
(i) корового IE2-промотора, простирающегося от нуклеотида 1 до нуклеотида 39 в последовательности SEQ ID No: 1;
(ii) последовательности, содержащей коровый IE2-промотор, простирающийся от нуклеотида 1 до нуклеотида 39 в последовательности SEQ ID No: 1, и последовательности от 100 до 200 нуклеотидов слева от указанного корового промотора и
(iii) последовательности SEQ ID No: 1.
26. Вектор по п.25, где указанный промотор оперативно связан с ДНК-последовательностью, кодирующей полипептид.
27. Вектор по п.26, где указанный полипептид выбран из FSH, LH, CG, TSH, гормона роста, интерферона, белка I, связывающего TNF, белка II, связывающего TNF, RaptivaТ, IL-18ВР или их мутеинов, фрагментов, функциональных производных и слитых белков.
28. Хозяйская клетка, трансфицированная вектором по любому из предшествующих пунктов.
29. Хозяйская клетка по п.28, являющаяся клеткой СНО.
30. Способ получения полипептида, включающий в себя стадию трансфекции хозяйской клетки по меньшей мере одним вектором по любому из пп.1-27.
31. Способ по п.30, где трансфекция представляет собой устойчивую трансфекцию.
32. Способ получения полипептида, включающий в себя стадию культивирования хозяйской клетки по п.28 или 29 в условиях, обеспечивающих возможность экспрессии полипептида.
33. Способ по п.30 или 31, дополнительно включающий в себя стадию выделения полипептида из хозяйской клетки или из супернатанта клеточной культуры.
34. Применение вектора по любому из пп.1-27 для экспрессии представляющего интерес гена.
35. Применение вектора по любому из пп.1-27 для селекции клонов, которые экспрессируют высокие количества представляющего интерес гена.
36. Применение вектора по любому из пп.4-24 для одновременной экспрессии представляющих интерес двух и более генов или ДНК.
37. Применение вектора по любому из предшествующих пунктов для производства лекарственного средства, предназначенного для ДНК-терапии.
38. Применение хозяйской клетки по п.28 или 29 для производства лекарственного средства для клеточной терапии.

Текст
010096 Область техники, к которой относится изобретение Настоящее изобретение относится к экспрессирующим векторам, содержащим IE2-промоторmCMV-гена либо его фрагмент, стимулирующий функциональную экспрессию, а также и/или IE2-энхансер гена mCMV либо его фрагмент, усиливающий функциональную экспрессию, где указанный экспрессирующий вектор не содержит какого-либо целого гена mCMV, к хозяйским клеткам, содержащим такие векторы, к способам получения требуемых полипептидов с использованием данных экспрессирующих векторов, а также к использованию указанных экспрессирующих векторов. В соответствии с настоящим изобретением экспрессирующие векторы, содержащие промоторmCMV IE2 и промотор mCMV IE1, необязательно вместе с новым энхансером mCMV IE2, являются предпочтительными, особенно если оба промотора составляют элементы одной структуры и являются разнонаправленными. Сущность изобретения В последние десятилетия экспрессирующие векторы используют в качестве носителей для экспрессии генов или кДНК, кодирующих полипептиды или белки в интересующих хозяйских клетках. Сильные вирусные или клеточные промоторы и энхансеры используют для высокоуровневой экспрессии представляющего интерес гена с помощью временной или постоянной (устойчивой) трансфекции рекомбинантной ДНК в соответствующие хозяйские клетки. Показано, что в этом отношении особенно пригодна предранняя (IE) область цитомегаловируса человека (hCMV), a экспрессирующие векторы, содержащие генные элементы, полученные из данной области, известны, например, из ЕР 0323997 В 1. До последнего времени генные регуляторные последовательности из мышиного цитомегаловируса(mCMV) используют редко, несмотря на то, что, как было показано, полученные из mCMV регуляторные элементы являются очень мощными, даже сильнее аналогичных копий вируса человека (Kim et al., 2002). В патенте США 4963481 (de Villiers) описаны экспрессирующие векторы, содержащие ДНК, которая кодирует гетерологичный белок под транскрипционным контролем ДНК-фрагментов, полученных из IR-генной области mCMV, содержащей фрагмент размером около 2270 пар оснований (п.н.), выделенный рестрикционной эндонуклеазой Pstl из данного вирусного генома. Неполный вариант данного фрагмента из 1387 п.н. существенно улучшает эффективность указанного ДНК-фрагмента в качестве промотора для экспрессии вышеупомянутого гетерологичного белка. В патенте США 4968615 (Kozinowski) описаны молекулы рекомбинантной ДНК, содержащей транскрипционные энхансеры из мышиного цитомегаловируса (MCMV), которые можно использовать для усиления транскрипции структурных генов эукариотических клеток. Показано, что данный mCMVэнхансер расположен в рамках 2,27 т.п.н. Pstl-фрагмента, идентифицированного de Villers (патент США 4963481).Manning and Mocarski (1988) проанализировали функциональную значимость IE2-области mCMV для репликации мышиного цитомегаловируса. С этой целью сконструировали рекомбинантный вирус,который содержал репортерный ген lacZ под транскрипционным контролем IE-энхансера/промотораmCMV, разрывающего, тем самым, этот IE2-ген. Действительно, экспрессия IE2-гена не наблюдалась, а вирус реплицировался нормально. Поэтому эти авторы сделали вывод, что данный IE2-ген, который не сохраняется у таких цитомегаловирусов, как mCMV и hCMV, не являлся существенным для репликации вируса. Manning and Mocarski не смогли определить или подтвердить особую пользу в наличии энхансер/промоторной IE2-области. В последних публикациях показано дополнительное отличие между IE-областью CMV мыши и человека. Мышиный локус экспрессирует вторую основную мРНК в противоположном направлении от мРНК первого IE2-гена. Этот второй предранний ген назвали IE2, а его промоторную последовательность обозначили как IE2-промотор (Messerle et al., 1991). Указанная IE2-область из mCMV до сих пор не использовалась в векторах для экспрессии гетерологичных белков. Сущность изобретения Настоящее изобретение основано на данных, в соответствии с которыми вектор, обладающий ДНКэлементом, содержащим IE2-промоторную область из mCMV, может эффективно запускать экспрессию представляющего интерес гена в трансфицированных хозяйских клетках. Кроме того, настоящее изобретение основано на данных по идентификации нового энхансера в IE2 области mCMV, который в настоящем описании называют IE2-энхансер mCMV. Данный энхансер удовлетворяет критерию, предъявляемому к определению энхансера, то есть усиливает экспрессию, независимо от (1) размещения (2) ориентации и от (3) усиления экспрессии с гетерологичного промотора. Поэтому первый аспект настоящего изобретения относится к экспрессирующему вектору, содержащему IE2-промотор mCMV-гена, либо к его фрагменту, усиливающему функциональную экспрессию,а также/или к IE2-энхансеру mCMV-гена либо к его фрагменту, усиливающему функциональную экспрессию, где указанный экспрессирующий вектор не содержит никакого целого гена mCMV. Второй аспект настоящего изобретения относится к хозяйской клетке, содержащей вектор в соответствии с настоящим изобретением. Третий аспект настоящего изобретения относится к способу получения представляющего интерес-1 010096 полипептида, включающему в себя стадию трансфекции хозяйской клетки вектором в соответствии с настоящим изобретением. Четвертый аспект настоящего изобретения относится к способу получения представляющего интерес полипептида, включающему в себя стадию культивирования хозяйской клетки согласно изобретению. Пятый аспект настоящего изобретения относится к использованию вектора в соответствии с настоящим изобретением для экспрессии представляющих интерес одного или нескольких генов либо кДНК. Шестой аспект настоящего изобретения относится к использованию вектора согласно изобретению для селекции клонов, которые экспрессируют большие количества представляющего интерес гена. Седьмой аспект относится к использованию вектора в соответствии с настоящим изобретением для ДНК-терапии. Краткое описание чертежей На фиг. 1 представлена последовательность двунаправленного ДНК-элемента, полученного из IEобласти mCMV, для использования в экспрессирующих конструкциях. Указаны, соответственно, +1 сайты и ТАТА-боксы промоторов IE2 и IE1. Коровые промоторы обоих генов выделены в четырехугольнике. Сайты рестрикции HpaI и XhoI выделены жирным шрифтом. Положение -682 указано относительно +1 IE1. На фиг. 2 представлены репортерные конструкции A-G. Люциферазный репортерный ген представлен в виде жирной линии, а промоторы указаны в виде светлых стрелок. А: негативный беспромоторный контроль (pGL3 Основной). В: SV40-промотор/энхансерный запуск люциферазного репортерного вектора (pGL3 Контроль). С: экспрессия люциферазы, управляемая IE1-промотором (pmCMV-люцифераза, управляемая IE1).G: сокращенный вариант запуска экспрессии люциферазы под IE1-промотором (р-680-люцифераза,управляемая IE1 (сокращенный вариант, 0,68 т.п.н На фиг. 3 представлена двунаправленная конструкция, подобная конструкции С на фиг. 2 (конструкция С-2), с последовательностью, кодирующей IL-18BP (жирная линия), присоединенной к IE2-промотору. Таким образом, в данной конструкции IE1-промотор запускает экспрессию mCMV-люциферазы и одновременно IE2-промотор mCMV запускает экспрессию IL-18BP. Треугольник: интрон. Зачерненные овалы: polyA. На фиг. 4 показана экспрессия люциферазного репортерного гена в разных репортерных конструкциях, которые изображены на фиг. 2, конструкции A-G. Клетки CHO-S, выращенные на бессывороточной среде (SFM), были случайным образом трансфицированы конструкциями A-G или ложнотрансфицированы. Активность люциферазы выражена в относительных световых единицах (RLU). На фиг. 5 представлена экспрессия люциферазы, измеренная в RLU в стабильных группах CHO-Sклеток. Данные клетки выращивают в SFM после трансфекции конструкциями D, С, F и E, как изображено на фиг. 2. Экспрессию люциферазы определяют после 21 дня селекции. На фиг. 6 показаны результаты измерения в RLU после временной трансфекции с помощью 900,500, 300 и 100 нг двунаправленной конструкции С-2, представленной на фиг. 3. На фиг. 7 показаны количества IL-18BP в нг/л в супернатантах культуры клеток, полученные в эксперименте с временной трансфекцией, в соответствии с фиг. 6 (конструкция С-2). На фиг. 8 представлено соотношение количества IL-18BP и люциферазы, измеренной в соответствии с экспериментами на фиг. 6 и 7. На фиг. 9 представлены количества люциферазы в RLU (на левой у-оси) и IL-18 ВР в нг/мл (на правой у-оси), экспрессируемые в 48 индивидуальных клонах, которые были отобраны через 8 дней после трансфекции двунаправленной конструкцией С-2 (как показано на фиг. 3). Предел для обнаружения люциферазы составил около 500 RLU, и 2,5 нг/мл - для IL-18BP. Каждый шаг на оси X соответствует одному единичному клону. На фиг. 10 а показаны репортерные конструкции H-N. Люциферазный репортерный ген (Luc) выделен жирной линией, а соответствующие промоторы IE1 и IE2 указаны светлыми стрелками. Энхансеры представлены в виде серых овалов: светло-серый овал использован для известного IE1-энхансера, а темно-серый овал использован для нового IE2-энхансера. Н: двунаправленная конструкция с IE2-промотором управляет экспрессией люциферазы;I: экспрессией люциферазы управляет IE2-промотор, a IE1-промотор удален;J, K, L, M, N: конструкции, содержащие укороченные mCMV-промоторы, цифрами даны положения, соответствующие числу пар оснований для mCMVp относительно +1 IE2:M: начиная от - 387,N: начиная от - 189. На фиг. 10b показана экспрессия в RLU для репортерных конструкций H-N в соответствии с фиг. 10 а после временной трансфекции клеток CHO-S, которые выращивают в бессывороточной среде. На фиг. 11 а представлены дополнительные конструкции O-Y, в которых объединены новый IE2 энхансер (серый овал) с SV40-промотором. Указанный серый овал соответствует IE2-энхансеру от -587 до -189, половина серого овала соответствует IE2-энхансеру от -387 до -189. Стрелки выше данного IE2 энхансера указывают направление энхансерной последовательности. Люциферазный репортерный ген представлен в виде жирной линии, SV40-промотор указан светлой стрелкой. Черный овал: polyA. О: длинную IE2-энхансерную последовательность (-587/-189) клонируют по 5'-концу SV40-промотора. Р: короткую IE2-энхансерную последовательность (-387/-189) клонируют по 5'-концу SV-промотора.Y: негативный контроль, везде без промотора. На фиг. 11b представлена экспрессия люциферазы с репортерными конструкциями O-Y, как показано на фиг. 11 а. Клетки CHO-S, выращенные в бессывороточной среде (SFM), трансфицируют случайным образом с помощью конструкций O-Y. Люциферазную активность изображают в виде сложенной ленты, длина которой определена по отношению к контролю X (значение 1), т.е. по отношению к экспрессии, управляемой SV40-промотором без какого-либо энхансера. Светлые четырехугольники: длинный IE2-энхансер (-587/-189), заштрихованные прямоугольники: короткий IE2-энхансер (-387/-189). Хось представляет собой логарифмическую шкалу. На фиг. 12 представлен эксперимент по сравнению нового IE2-энхансера с известным hCMV-энхансером. Клетки трансфицируют с помощью контрольной конструкции A (pGL3 основная, см. фиг. 2, с отсутствием промотора), контрольной конструкции В (pGL3 контрольная, см. фиг. 2, SV40-промотор сID No: 2). Люциферазу измеряют в RLU (х-ось). Заштрихованные прямоугольники: с известным hCMVэнхансером. Прямоугольники серого цвета: с новым IE2-энхансером. На фиг. 13 показан двунаправленный вектор, используемый для одновременной экспрессии IL18BP и люциферазы. Промоторы IE1 и IE2 указаны светлыми стрелками. Треугольник представляет собой интрон А из IE-области hCMV, а овал серого цвета - сигнал полиаденилирования. Зачерненный квадрат соответствует сигнальному пептиду. Конструкция 26: люцифераза экспрессируется под IE1-промотором, a IL-18BP экспрессируется под IE2-промотором. Последовательность между обоими промоторами как в конструкции Н на фиг. 10 а. Конструкция 140: люцифераза экспрессируется под IE2-промотором, a IL-18BP экспрессируется сIE1-промотора. Между этими двумя промоторами располагается IE2-энхансер (от -587 до -189). На фиг. 14 представлены данные о количествах экспрессируемой люциферазы (RLU, левая у-ось) иIL-18BP (нг/мл, правая Y-ось) после временной трансфекции СНО-клеток, выращиваемых в бессывороточной среде, с помощью любой конструкции, 26 или 140, в соответствии с фиг. 13. Прямоугольники: экспрессия люциферазы; зачерненные ромбы: экспрессия IL-18BP. На фиг. 15 представлены данные по экспрессии люциферазы (RLU, левая у-ось) и IL-18BP (нг/мл,правая y-ось) в устойчивых группах, трансфицированных с помощью любой конструкции, 26 или 140,в соответствии с фиг. 13. Экспрессию измеряют через 7 дней после трансфекции. Клетки отбирают в присутствии пуромицина (+puro) или же отбирают в течение 3 недель без пуромицина (-puro). Прямоугольники: экспрессия люциферазы, зачерненные ромбы: экспрессия IL-18BP. На фиг. 16 показана продолжительность экспрессии люциферазы, как в эксперименте на фиг. 15. На оси х отложено время в неделях. Данные, представленные на фиг. 15, соответствуют 3-недельным данным на фиг. 16. Зачерненный ромб: 26 + puro, маленький квадрат: 140 + puro, зачерненный треуголь-3 010096 ник: 26 - puro, большой квадрат: 140 - puro. На фиг. 17 показана продолжительность экспрессии IL-18BP в соответствии с экспериментами фиг. 16. Обозначения - как на фиг. 16. На фиг. 18 представлены результаты анализа протоклонов в отношении экспрессии люциферазы(квадраты) в RLU (левая y-ось) и экспрессии IL-18BP (ромбы) в нг/мл (правая y-ось). Каждый шаг на оси х соответствует индивидуальному протоклону. Протоклоны создаются СНО-клетками, устойчиво трансфицированными конструкцией 26, и отбираются в присутствии пуромицина. На фиг. 19: то же, что и на фиг. 18, но протоклоны создаются клетками, трансфицированными конструкцией 140. Фиг. 20: протоклоны, трансфицированные любой конструкцией, 26 или 140, анализируют на предмет экспрессии люциферазы в 96-луночном планшете, инвертированном с помощью устройстваChemiDoc. Подробное описание изобретения В соответствии с настоящим изобретением неожиданно обнаружилось, что промотор предраннего второго (IE2) гена мышиного цитомегаловируса (mCMV) оказался эффективен для стимуляции экспрессии полипептида, представляющего интерес, который, собственно, не является IE2-белком mCMV, т.е. гетерологичным полипептидом или белком. Данный экспрессирующий вектор предположительно не является собственно мышиным цитомегаловирусом или же содержащим какие-либо полные гены вирусаmCMV, но представляет собой вектор для экспрессии рекомбинантного белка. Вследствие этого настоящее изобретение относится к экспрессирующему вектору, содержащемуIE2-промотор mCMV-гена, или к его фрагменту, стимулирующему функциональную экспрессию, где данный экспрессирующий вектор не содержит какого-либо полного гена mCMV. Кроме этого, в IE2-области mCMV был идентифицирован новый энхансер, который именуется здесь IE2-энхансер mCMV, или IE2-энхансер. Данный энхансер усиливает экспрессию независимо от его локализации или ориентации по отношению к данному гену, а также усиливает экспрессию с гетерологичных промоторов, соответствуя, таким образом, основному критерию энхансера. В этой связи настоящее изобретение относится также к экспрессирующему вектору, содержащему указанный IE2-энхансер mCMV-гена, или к его фрагменту, усиливающему функциональную экспрессию,где экспрессирующий вектор не содержит какого-либо полного гена mCMV. Специалистам в данной области техники очевидно, что вектор согласно изобретению может содержать лишь один только IE2-промотор mCMV либо IE2-промотор в сочетании с любым подходящим известным энхансером. Специалистам в данной области также очевидно, что вектор согласно изобретению может содержать лишь один только IE2-энхансер mCMV либо IE2-энхансер в сочетании с любым подходящим промотором. Кроме того, вектор согласно изобретению может содержать IE2-промотор mCMV в сочетании с IE2-энхансером mCMV. Сам IE2-ген mCMV известен, например, из публикации Messerie et al., 1991 г. Используемый здесь термин "промотор" относится к участку ДНК, функции которого заключаются в контроле транскрипции одной или нескольких ДНК-последовательностей и который структурно идентифицируется по наличию сайта связывания ДНК-зависимой РНК-полимеразы и по наличию других ДНК-последовательностей, влияющих на регуляцию промоторной функции. Функционально экспрессирующий усиливающий фрагмент промотора представляет неполную или усеченную промоторную последовательность, сохраняющую активность в качестве промотора. Промоторную активность можно измерить любым методом, известным в данной области, например репортерным методом с использованием люциферазы в качестве репортерного гена (Wood, 1991; Seliger and McElroy, 1960; de Wet et al., 1985 или коммерчески пригодной люциферазы от Promega). В соответствии с настоящим изобретением IE2-промотор может, к примеру, включать в себя последовательность от положения +1 до ТАТА-бокса, как указано на фиг. 1. IE2-промотор может также включать в себя последовательность, именуемую здесь "коровый промотор", простирающуюся от нуклеотида 1 до нуклеотида 39 в последовательности, изображенной на фиг. 1 (четырехугольник). Специалистам в данной области известно, что последовательность IE2-промотора mCMV может быть длиннее или короче данного корового промотора до тех пор, пока он запускает транскрипцию ДНК-последовательности,оперативно с ним связанной. Например, IE2-промотор может также включать в себя 100-200 пар оснований слева от данного корового промотора. Такая промоторная область именуется также "проксимальным промотором". Специалистам в данной области должно быть также очевидно, что термины "промотор" и"энхансер" (см. ниже) точно не определяются и что поэтому данный промотор может включать в себя энхансерные области либо энхансерные области могут включать в себя промоторные области, в зависимости от терминологии и контекста. Термин "вектор" относится к любому носителю экзогенной ДНК или РНК, который пригоден для перемещения экзогенной ДНК в хозяйскую клетку для репликации и/или для соответствующей экспрессии экзогенной ДНК с помощью данной хозяйской клетки. Используемый здесь термин "оперативно связанный" подразумевает функциональное слияние промотора со структурным геном, или кДНК, или с другой последовательностью ДНК, которая находится-4 010096 под контролем данного промотора. Поэтому используемый здесь термин "оперативно связанный" не ограничивается прямым слиянием ДНК-последовательностей. Термин "полный ген mCMV" относится к вирусному гену мышиного цитомегаловируса, который обладает своими собственными (эндогенными, вирусными) 5'- и 3'-регуляторными элементами."Энхансерная область" относится к участку ДНК, функция которого заключается в повышении уровня транскрипции одного или нескольких генов. В частности, используемый здесь термин "энхансер" подразумевает регуляторный ДНК-элемент, который усиливает, увеличивает, улучшает или повышает качество экспрессии гена вне зависимости от его местоположения и ориентации по отношению к экспрессирующему гену и который может быть усиливающим, увеличивающим, улучшающим, повышающим качество или превышающим экспрессию более чем одного промотора. Предпочтительно, если данный энхансер усиливает экспрессию одновременно более чем с одного промотора. Фрагмент энхансера, усиливающий функциональную экспрессию, представляет собой неполную или усеченную энхансерную последовательность, сохраняющую данную усиливающую способность. Вектор согласно изобретению предпочтительно состоит из фрагмента, включающего в себя нуклеотиды от -387 до -189 из левой IE2-области mCMV, и нумерация нуклеотидов осуществляется относительно положения +1 IE2-гена. Данный фрагмент обладает энхансерной функцией и именуется здесь коротким вариантом энхансера IE2. Еще в одном предпочтительном варианте осуществления настоящего изобретения данный вектор состоит из фрагмента, содержащего нуклеотиды от -587 до -189 левой IE2-области mCMV, и нумерация нуклеотидов осуществляется относительно +1 IE2-гена. Данный фрагмент обладает энхансерной функцией и именуется здесь длинным вариантом IE2-энхансера. Вектор согласно изобретению может также включать в себя еще и дополнительный IE-энхансерmCMV". Такой IE1-энхансер mCMV известен в данной области, например, из патента США 4968615. Он,к примеру, может простираться в последовательности, представленной на фиг. 1, от положения -587 до-147 или от положения -682 до -147, нумерация которых осуществляется относительно положения +1IE1-гена. IE1-энхансер mCMV, который может быть использован в соответствии с настоящим изобретением, может дополнительно включать в себя последовательность, простирающуюся от пары оснований-1330 до -488 относительно положения +1 в IE1 на фиг. 1. Данная энхансерная область может также включать в себя весь промотор или его часть. Благодаря использованию mCMV-энхансера в дополнение к IE2-промотору можно еще больше повысить экспрессию представляющего интерес полипептида. В соответствии с настоящим изобретением указанный вектор дополнительно содержит промотор,который отличается от IE2-промотора mCMV, или его фрагмент, усиливающий функциональную экспрессию. В предпочтительном варианте осуществления настоящего изобретения вектор согласно изобретению включает в себя первый и второй промотор вирусного, клеточного или искусственного происхождения или его фрагмент, усиливающий функциональную экспрессию. Поэтому в предпочтительном варианте осуществления настоящего изобретения данный вектор включает в себя IE2-промотор mCMV в сочетании со вторым промотором или его фрагментом, усиливающим функциональную экспрессию. Примеры дополнительных подходящих промоторов включают в себя hCMV-промотор, металлотионеиновый промотор (МТ), SV40-промотор либо искусственный промотор. Предпочтительно второй промотор представляет собой дополнительную копию IE2-промотораmCMV. Такие дополнительные промоторы могут усилить конститутивную или регуляторную экспрессию. Регулируемая экспрессия может быть индуцируемой, или репрессируемой, либо и той, и другой. Предпочтительно, когда такой второй промотор представляет собой промотор IE1-гена mCMV или его фрагмент, усиливающий функциональную экспрессию. Поэтому особенно предпочтительно, чтобы первый промотор представлял собой IE2-промотор mCMV или его фрагмент, усиливающий функциональную экспрессию, а второй промотор представлял собой IE1-промотор mCMV или его фрагмент, усиливающий функциональную экспрессию.IE1-промотор mCMV известен, к примеру, из WO 87/03905. Он может включать в себя коровый промотор, содержащий последние 47 п.н. из последовательности на фиг. 1 (в рамке) или дополнительные 100-200 п.н. слева от последовательности (т.е. проксимальный промотор), либо он может включать в себя целую межгенную область вплоть до положения -1330 (относительно положения +1 в IE1, см. фиг. 1). В предпочтительном варианте осуществления настоящего изобретения вектор состоит из ДНК-последовательности SEQ ID No: 1, включающей в себя и IE1-, и IE2-промотор, а также IE1-энхансер и новый IE2-энхансер или любой его фрагмент, усиливающий функциональную экспрессию. В наиболее предпочтительном варианте осуществления настоящего изобретения в используемом векторе в соответствии с настоящим изобретением промотор или его фрагмент, усиливающий функциональную экспрессию, оперативно связан с ДНК-последовательностью, кодирующей по меньшей мере один полипептид. В дополнительном варианте осуществления настоящего изобретения энхансер соглас-5 010096 но изобретению присутствует в экспрессирующем векторе вместе с ДНК-последовательностью, кодирующей по меньшей мере один полипептид. Предпочтительно, чтобы указанная ДНК-последовательность кодировала представляющий интерес белок. Весьма предпочтительно, если ДНК-последовательность кодирует маркерный белок или она представляет собой амплифицируемый ген. Предпочтительно также, если указанная ДНК-последовательность кодирует репортерный белок. Если вектор согласно изобретению содержит более одного промотора, то любое сочетание или часть сочетания представляющего интерес белка, маркера, репортера, амлифицируемого гена и пр. может экспрессироваться с одной и той же плазмиды. В соответствии с настоящим изобретением представляющий интерес полипептид может представлять собой любой полипептид, который отличается от собственно IE2-полипептида, может быть внеклеточным белком, таким как пептидные гормоны, или трансмембранным белком, таким как рецепторы фактора роста или гормональные рецепторы, либо внутриклеточным белком, таким как киназы, фосфатазы или ДНК-связывающие белки, в зависимости от предполагаемого использования интересующего полипептида или от хозяйской клетки, в которой он экспрессируется. В соответствии с настоящим изобретением подходящие маркерные белки представляют собой, например, негативные или позитивные селективные маркеры либо амплифицируемые гены. Примеры включают в себя белки, выбранные из аденозиндезаминазы (ADA), аминогликозидфосфотрансферазы(neo), дигидрофолатредуктазы (DHFR), гигромицин-В-фосфотрансферазы (HPH), тимидинкиназы (tk),ксантингуанинфосфорибозилтрансферазы (gpt), фактора множественной лекарственной устойчивости(MDR), орнитиндекарбоксилазы (ODC) и фактора N-(фосфоноацетил)-L-аспартатрезистентности (CAD) или пуромицинацетилтрансферазы (РАС). Дополнительные примеры включают в себя гены, используемые для селекции при использовании отдельных метаболических путей, такие как галактокиназа(Schumperli et al., 1982), рецептор фолиевой кислоты (Zhu et al., 2001) или носитель восстановленного фолата (Assaraf et al., 1992). Еще в одном предпочтительном варианте осуществления настоящего изобретения представляющий интерес полипептид представляет собой продукт репортерного гена. Используемый здесь термин "репортерный ген" или "репортерный белок" подразумевает ген, кодирующий генный продукт, который можно идентифицировать с использованием простых, недорогостоящих способов или реактивов и который можно оперативно связать с областью промотора согласно изобретению или к его активному фрагменту. Репортерный ген можно использовать для определения транскрипционной активности в скринирующих анализах (см., например, Goeddel (ред.) Methods Enzymol.,Vol. 185, San Diego. Academic Press, Inc. (1990, например, с использованием люциферазы в качестве репортерного гена (Wood, 1991; Seliger and McErloy, 1960; de Wet et al., 1985 или коммерчески доступного от Promega). Примеры выбраны из люциферазы, зеленого флуоресцирующего белка, щелочных фосфатаз, О-галактозидазы, или пероксидазы хрена, или из внутримолекулярных сочетаний с другими белками, такими,например, как зеленый флуоресцирующий белок (GFP) или улучшенный GFP (EGFP) с пуромициновым ацетилтрансферазным геном (Abbate et al., 2001), или из их сочетаний. Экспериментальные данные согласно изобретению основаны на том, что эффективную одновременную экспрессию интересующих полипептидов можно осуществить с IE2- и IE1-промотора, оба из которых представлены в одной и той же плазмиде. В этой связи в дополнительном предпочтительном варианте осуществления настоящего изобретения оба промотора, IE2-промотор mCMV и IE1-промоторmCMV, или их фрагменты, усиливающие функциональную экспрессию, соответственно, оперативно связывают с полипептидом. Высокие уровни экспрессии могут быть осуществлены, если оба промотора представлены в двунаправленной структуре. Поэтому IE2-промотор mCMV или его фрагмент, усиливающий функциональную экспрессию, и промотор, в частности IE1-промотор mCMV, или его фрагмент, усиливающий функциональную экспрессию, располагают в двух направлениях. Используемый здесь термин "расположенный в двух направлениях" подразумевает, что данные промоторы запускают транскрипцию в противоположных направлениях. Данная схема расположения плазмидной ДНК называется также "двунаправленной структурой" данного вектора. Промоторы IE1 или IE2 mCMV-гена, или их фрагменты, усиливающие функциональную экспрессию, или любой новый промотор, который можно использовать в сочетании с IE2-промотором mCMV либо в сочетании с IE2-энхансером, может также включать в себя сигнал инициации трансляции. В другом предпочтительном варианте осуществления настоящего изобретения IE2-промоторmCMV-гена, или его фрагмент, усиливающий функциональную экспрессию, либо IE2-энхансер mCMV соединяются с другими элементами, регулирующими или влияющими на транскрипцию. Такие элементы могут влиять на процессинг, стабильность или трансляционную эффективность РНК. Примеры подходящих элементов выбраны из группы, состоящей из 5'-UTR, интронов, 3'-UTR (см., например, Mazumderet al., 2003), 3'-концевых процессирующих последовательностей мРНК (например, сайты полиаденили-6 010096 рования) и IRES-последовательностей для экспрессии полицистронной мРНК (см., например, Mountfordand Smith, 1995). Предпочтительно использовать IRES-элемент для экспрессии полицистронных мРНК, в которых кодирующие последовательности отделены с помощью IRES. В этом случае преимуществом является то,что некоторые представляющие интерес полипептиды могут экспрессироваться с одной и той же мРНК и, следовательно, с одного и того же промотора. Еще в одном предпочтительном варианте осуществления настоящего изобретения лишь один IE2 промотор mCMV-гена или в сочетании с IE1-промотором mCMV-гена или любой другой естественный или искусственный промотор или IE2-энхансер могут быть присоединены к дополнительным последовательностям, усиливающим экспрессию, таким как инсуляторы, пограничные элементы, LCR (описанные,например, у Blackwood and Kadonga (1998 или области, связанные с матриксом/клеточным каркасом(описанные, к примеру, у Li et al., 1999). Специалисты в данной области примут во внимание и то, что вектор согласно изобретению может также содержать дополнительные энхансеры, такие, например, как хорошо известный SV40-энхансер или hCMV-энхансер. В соответствии с настоящим изобретением полипептид, оперативно связанный с первым промотором, предпочтительно с IE2-промотором mCMV, и полипептид, оперативно связанный со вторым промотором, предпочтительно с IE1-промотором mCMV-, может быть одним и тем же. В этом случае две копии одного и того же гена представлены в одном и том же векторе, но под контролем двух разных промоторов. Именно поэтому представляется возможным достичь скорости экспрессии, которая превосходит экспрессию единственной копии гена, кодирующего представляющий интерес полипептид. В альтернативном варианте осуществления настоящего изобретения полипептид, оперативно связанный с первым промотором, предпочтительно IE2-промотором mCMV, и полипептид, оперативно связанный со вторым промотором, предпочтительно IE1-промотором mCMV, отличаются. Поэтому настоящее изобретение содержит эффективный вектор для коэкспрессии двух разных полипептидов, таких как селективные маркеры или представляющие интерес белки, коэкспрессии двух или более субъединиц одного и того же белка или даже разных доменов одного и того же белка, необходимых для их раздельной экспрессии, но при этом в одной и той же хозяйской клетке. Специалистам в данной области техники следует иметь в виду, что в соответствии с настоящим изобретением одну и ту же клетку можно одновременно трансфицировать несколькими экспрессирующими векторами, которые служат для экспрессии множества белков и/или субъединиц всего комплекса мультимерных белков. Предпочтительно, чтобы указанный полипептид, оперативно связанный с первым промотором, например с IE2-промотором mCMV, представлял собой первую субъединицу димерного или мультимерного белка, а полипептид, оперативно связанный со вторым промотором, предпочтительно с IE1-промотором mCMV, представлял собой вторую субъединицу димерного или мультимерного белка. В соответствии с настоящим изобретением коэкспрессия двух субъединиц димерного белка является предпочтительной. Коэкспрессия двух субъединиц одного и того же белка является особенно предпочтительной,так как экспрессия с обоих промоторов может привести к образованию сходных количеств субъединиц или заданных соотношений обоих полипептидов, в зависимости от силы используемых промоторов. Затем эти субъединицы можно собрать в одной и той же клетке для создания зрелого белка. Предпочтительные примеры димерных белков, подходящих для экспрессии с использованием вектора согласно изобретению, представляют собой альфа-цепь и бета-цепь пептидного гормона, такого какFSH человека, LH человека, TSH человека и CG человека. В соответствии с настоящим изобретением любую из двух субъединиц можно присоединить к промотору, предпочтительно к IE2-промоторуmCMV. Специалистам в данной области следует иметь в виду, что в соответствии с настоящим изобретением в равной степени можно использовать гормоны других видов животных, таких как лошадь или свинья, а также бычьи гормоны, в зависимости от цели использования данного рекомбинантного полипептида. В другом варианте осуществления настоящего изобретения первая субъединица представляет собой тяжелую цепь, а вторая субъединица представляет собой легкую цепь иммуноглобулина, или наоборот. Предпочтительным примером подходящего иммуноглобулина является IgG. Для терапевтического использования такие иммуноглобулины могут, например, представлять собой гуманизированные антитела или человеческие антитела. Наиболее предпочтительным примером такого гуманизированного антитела является гуманизированное анти-СВ 11-антитело с торговым названием Raptiva. Многие представляющие интерес полипептиды могут экспрессироваться с использованием вектора согласно изобретению. В предпочтительных вариантах осуществления настоящего изобретения полипептид выбирают из группы, состоящей из хорионического гонадотропина, фолликулостимулирующего гормона, лютеинизирующего хорионического гонадотропного гормона, тиреотропина, человеческого соматотропина, интерферона (например, интерферона бета-1a, интерферона бета-1b), рецепторов интерферона (например, рецептора гамма-интерферона), TNF-рецепторов р 55 и р 65, интерлейкинов (например, интерлейкина-2, интерлейкина-11), белков, связывающих интерлейкин (например, белка, связы-7 010096 вающего интерлейкин-18), анти-CD11 а-антител, а также мутеинов, фрагментов, растворимых форм,функциональных производных, их слитых белков. Другие представляющие интерес предпочтительные полипептиды включают в себя, например, эритропоэтин, гранулоцитарный колониестимулирующий фактор, гранулоцитарно-макрофагальный колониестимулирующий фактор, гипофизарные пептидные гормоны, менопаузный гонадотропин, инсулиноподобные ростовые факторы (например, соматомедин-С), фактор роста кератиноцитов, выделенный из глиальных клеток нейротропный фактор, тромбомодулин, основной фактор роста фибробластов, инсулин, фактор VIII, соматотропин, морфогенетический белок кости типа 2, тромбоцитарный фактор роста,гирудин, эритропоэтин, рекомбинантный слитый белок LFA-3/IgG1, глюкоцереброзидазу, а также мутеины, фрагменты, растворимые формы, функциональные производные, их слитые белки. Второй аспект настоящего изобретения относится к хозяйской клетке, трансфицированной по меньшей мере одним вектором, описанным выше. Специалистам в данной области следует иметь в виду,что в соответствии с настоящим изобретением хозяйскую клетку можно в равной степени одновременно трансфицировать двумя или несколькими векторами. Подходящими клетками в соответствии с настоящим изобретением являются многие хозяйские клетки, такие как первичные или устойчивые клеточные линии от самых разнообразных эукариот, включая растительные и животные клетки, а также клетки млекопитающих или человека. Например, подходящие хозяйские клетки включают в себя СНО-клетки, COS-клетки, CV1-клетки, мышиные L-клетки,НТ 1080-клетки, BHK-21-клетки, HEK293-клетки, NIH-3 Т 3-клетки, LM-клетки, YI-клетки, мышиныеNSO и SP2/0 гибридомные клетки и им подобные, Namalwa-клетки, RPMI-8226-клетки, Vero-клетки, WI38-клетки, MRC-5-клетки или иные иммортализованные и/или трансформированные клетки. Предпочтительно, если хозяйские клетки представляют собой СНО-клетки, и более предпочтительно, если они представляют собой CHO-S-клетки, описанные, например, Shotwell et al. (1982, J. Biol.Chem. 257: 2974-2980). СНО-клетки впервые были получены Puck (J. Exp. Med. 108, 945, 1958) из биоптата яичника самки китайского хомячка. Из данных исходных клеток был получен ряд сублиний с различными характеристиками. Одна из этих СНО-клеточных линий, СНО-K1, является пролинзависимой и диплоидной по гену дигидрофолатредуктазы (DHFR). Другая линия, полученная из данной клеточной линии, представляет собой дефицитную по DHFR СНО-клеточную линию (СНО DUK B11) (PNAS 77,1980, 4216-4220), которая характеризуется утратой DHFR-функции в результате мутации одного изDFRH-генов и последующей утратой другого гена. Все эти клетки можно трансфицировать с помощью векторов согласно изобретению либо временно,либо частично устойчиво (например, если вектор является эписомным), либо устойчивым (например,интегрированным в данный геном) способом. Устойчивая трансфекция является предпочтительной для определения клонов, которые непрерывно экспрессируют представляющий интерес полипептид.IE2-промотор согласно изобретению или IE2-энхансер можно использовать в качестве регуляторных элементов в рамках способа, называемого "эндогенная активация гена". Вектор согласно изобретению может содержать введенный геномный локус, который, как считают, активируется в результате гомологической рекомбинации, оперативно связывая, таким образом, данную регуляторную последовательность (IE2-промотор и/или энхансер) с интересующим геном, экспрессия которого нуждается в индукции или в усилении. Данный способ описан, например, в WO 91/09955. Третий аспект настоящего изобретения относится к способу получения интересующего полипептида,включающему в себя стадию трансфекции хозяйской клетки с помощью вектора согласно изобретению. В зависимости от природы интересующего полипептида, использование способа в соответствии с настоящим изобретением приводит к секретированию белка или полипептида, который можно собрать из супернатанта данной клеточной культуры, либо к получению белка клеточной мембраны или внутриклеточного белка, который можно выделить из имеющихся клеток с помощью известных способов. Соответствующий полипептид, производимый в соответствии с настоящим изобретением, может служить любой цели, но предпочтительно он представляет собой терапевтический белок, предполагаемый для введения человеку или животным. В зависимости от предполагаемого использования, сама клетка, обладающая интегрированным полипептидом, может быть продуктом предлагаемого способа. Такая клетка может, например, использоваться в клеточной терапии. Четвертый аспект настоящего изобретение относится к способу получения интересующего полипептида, включающему в себя стадию культивирования хозяйских клеток в соответствии с настоящим изобретением. В предпочтительном варианте осуществления настоящего изобретения данный способ дополнительно включает в себя стадию выделения интересующего полипептида из хозяйских клеток или культурального супернатанта. Данная стадия дает особое преимущество и облегчает осуществление секреции белков, которые можно просто выделить из клеточного супернатанта. Вместе с тем, данная стадия также применима для выделения полипептидов из клеточных мембран или из внутриклеточных структур, которые можно выделить из хозяйских клеток. Данный способ можно использовать во временной, устойчивой, эписомной или в вирусной экс-8 010096 прессирующей системах. Как показано ниже в примерах, вектор согласно изобретению, полученный в устойчивой экспрессирующей системе, дает в результате особенно сильную экспрессию требуемого белка. Поэтому в предпочтительном варианте осуществления настоящего изобретения используемая трансфекция представляет собой устойчивую трансфекцию. В пятом аспекте настоящего изобретения вектор в соответствии с настоящим изобретением используют для экспрессии представляющего интерес гена. Такими генами могут быть, например, гены, кодирующие любой из вышеуказанных полипептидов. Вектор согласно изобретению можно также использовать для экспрессии маркерных генов, репортерных генов, амплифицируемых генов и пр. Предпочтительно данный вектор используют для одновременной экспрессии представляющих интерес двух или более генов либо кДНК. Его можно также использовать для совместной экспрессии одного представляющего интерес гена и одного маркерного гена или репортерного гена, или амплифицируемого гена, или других подобных генов. В рамках настоящего изобретения неожиданно было показано, что вектор согласно изобретению, в частности вектор, содержащий IE2-промотор, IE2-энхансер и IE1-промотор, получен при идентификации клонов, которые весьма эффективно экспрессируют репортерный ген и ген, представляющий интерес. В этой связи, шестой аспект настоящего изобретения относится к использованию вектора в соответствии с настоящим изобретением для селекции клонов, которые экспрессируют большие количества представляющего интерес гена. В седьмом аспекте настоящее изобретение относится к использованию вектора согласно изобретению в производстве лекарственного средства, используемого для плазмидной или ДНК-терапии, или генотерапии. В восьмом аспекте хозяйскую клетку согласно изобретению используют для производства лекарственного средства для клеточной терапии. Если данная клеточная терапия предполагается для лечения человека, предпочтительно, чтобы хозяйская клетка представляла собой клетку человека или клеточную линию,более предпочтительно, чтобы клетка или клеточная линия была получена от пациента, которого лечат. Теперь, располагая полным описанием настоящего изобретения, специалистам в данной области следует иметь в виду, что это же можно осуществить в широких пределах эквивалентных параметров,концентраций и условий, не выходящих за рамки существа и содержания настоящего изобретения и без излишнего экспериментирования. Хотя данное изобретение описано в связи с конкретными вариантами его осуществления, очевидно,что оно поддается дополнительным модификациям. Настоящая заявка подразумевает внесение любых изменений, назначений или переделок настоящего изобретения, которые в общем плане следуют принципам настоящего изобретения, и в том числе таких отклонений от существа настоящего изобретения,которые находятся в рамках известной или обычной практики в пределах области, к которой относится настоящее изобретение, и которые могут быть применены к сформулированным выше существенным признакам, так же, как и в рамках нижеследующей формулы изобретения. Все цитируемые здесь ссылки, в том числе журнальные статьи и рефераты, опубликованные или неопубликованные патентные заявки США или иностранные, изданные патенты США или иностранные патенты, или любые иные ссылки полностью включены здесь путем ссылки, включая все данные, таблицы, рисунки и текст, представленные в цитируемых ссылках. Кроме того, полное содержание цитируемых ссылок, в рамках цитируемых здесь ссылок, также полностью включено путем ссылки. Ссылка на известные стадии способа, традиционные стадии способа, известные способы или традиционные способы никоим образом не должна расцениваться таким образом, что какой бы то ни было аспект, описание или вариант осуществления настоящего изобретения уже раскрыт, известен или предложен в данной области. Предшествующее описание конкретных вариантов осуществления настоящего изобретения должно столь полно выявлять основную природу настоящего изобретения, что другие, применяя знания в рамках данной области (в том числе содержимое цитируемых здесь ссылок), легко смогут модифицировать и/или адаптировать для различных применений такие конкретные варианты осуществления настоящего изобретения без излишнего экспериментирования, не выходя за рамки общего замысла настоящего изобретения. Поэтому такие переделки и модификации подразумеваются в рамках смысла и диапазона равноценных раскрываемых вариантов осуществления настоящего изобретения, базирующихся на указаниях и следующих указаниям, представленным здесь. Очевидно, следует иметь в виду, что фразеология или терминология данного документа предназначены для описания, но не ограничиваются им, так что терминология или фразеология описания настоящего изобретения предназначаются для интерпретации специалистами в данной области в свете изложенных здесь указаний, наряду с общими сведениями специалистов в данной области. Примеры Пример 1. Оценка пригодности экспрессирующих векторов для временной трансфекции. Материалы и методы Материалы. Клетки: CHO-S, источник Gibco/Invitrogen (Cat. No 11619). Плазмидные ДНК, сконструированные, как указано на фиг. 2 и 3, выделяют из стандартно выращива-9 010096 емых ночных культур с помощью набора Nucleobond PC 500 в соответствии с протоколом производителя. Трансфекция. Липофектамин (Invitrogen, Cat. No 18324-012). Посуда: 24-луночные планшеты. Клетки: СНО-S клетки в экспоненциальной фазе роста пассируют 24 ч перед трансфекцией. Чтобы исключить стационарную фазу при низкой плотности клеток, клетки разбавляют до концентрации 0,75106 клеток/мл. Суммарное количество для трансфекции составило 1,5105 клеток, ресуспендированных в 100 мкл бессывороточной среды SFM II (Invitrogen, Cat. No 12052-114) на лунку, для 24-луночного планшета. Трансфекционные смеси были следующими.SFM 11-среда: 48 мкл. Общий объем равен 50 мкл.B) Аликвоты ДНК: 1 мкг (50 нг экспрессирующего вектора + 950 нг плазмиды-носителя, pBluescriptSFM II-среда: дополнять до 50 мкл. Растворы А и В смешивают и инкубируют в течение 30 мин при комнатной температуре. Данную смесь приливают к 100 мкл SFM II-среды, содержащей 1,5105 клеток. Данные клетки вновь ставят в инкубатор и инкубируют при 37 С 5% СО 2 в течение 3 ч. Затем добавляют 400 мкл SFM II-среды для разбавления липофектамина. В течение последующих 48 ч клетки повторно инкубируют перед отбором проб для анализа. Каждую трансфекцию осуществляют трижды. Измерение люциферазы. Аналитическую систему Bright-Glo Luciferase от Promega, Cat. No E2610, используют для измерения люциферазы в соответствии с указаниями производителя. Вкратце, суспензию клеток гомогенизируют, пипетируя несколько раз, отбирают аликвоту в 50 мкл и вносят ее в белый 96-луночный планшет (Nunc, Cat. No 236108). Затем добавляют перерастворенныйBright-Glo-реагент и инкубируют в течение 5 мин при комнатной температуре. Световое излучение измеряют с помощью люминометра Centro LB 960 (Berthold Technologies) в течение 5 с. Результаты Конструкции экспрессирующих векторов, используемые во временной экспрессирующей системе на основе CHO-S-клеток, изображены на фиг. 2. В данной серии экспериментов люциферазу используют в качестве репортерного гена для оценки генной экспрессии. Векторы, не обладающие каким-либо промотором вообще (конструкция А) или SV40-промотор/энхансер (конструкция В), которая не является очень активной в CHO-S-клетках, используют в качестве контроля. Результаты экспериментов по временной трансфекции с векторами A-G представлены на фиг. 4. В конструкциях С и F экспрессия люциферазы управляется промотором IE1. Обе конструкции обеспечивают экспрессию люциферазы. Конструкция С, дополнительно содержащая IE2-промотор, располагается в двух противоположных направлениях по отношению к IE1-промотору. Данное двунаправленное расположение уменьшает эффективность экспрессии с IE1-промотора (конструкция С) по сравнению с использованием одного лишь IE1-промотора (конструкция F). Короткий вариант в 0,68 п.н. IE1-промотора(конструкция G) был менее эффективным, чем его длинный вариант (конструкция F). Независимо от присутствия или отсутствия второго промотора в одной и той же конструкции, IE2 промотор эффективно запускает экспрессию люциферазы (конструкции D и Е) и поэтому может использоваться в качестве промоторного элемента в экспрессирующих векторах для экспрессии интересующего полипептида. В противоположность IE1-промотору, IE2-промотор, взятый отдельно (конструкция Е), менее эффективен, чем при его использовании в двунаправленной структуре (конструкция D). Поэтому он особенно подходит для использования в двунаправленных экспрессирующих векторах. Пример 2. Оценка пригодности экспрессирующих векторов в устойчивой трансфекции. Материалы и методы Методы. Клетки: CHO-S, от Gibco/Invitrogen (Cat. No 11619). Плазмидные ДНК (в соответствии с фиг. 2) выделяют из стандартно выращиваемых ночных культур с помощью набора Nucleobond PC 500 (Macherey-Nagel Cat. No 740574) в соответствии с протоколом производителя. Трансфекция. Липофектамин (Invitrogen, Cat. No 18324-012). Для осуществления устойчивой трансфекции используют колбы Т 75. Клетки CHO-S, находящиеся в экспоненциальной фазе роста, пассируют за 24 ч до трансфекции. Чтобы исключить стационарную фазу при низкой плотности клеток, последние разбавляют до концентрации 0,75106 клеток/мл. Суммарное количество трансфицируемых клеток, равное 5106, ресуспендируют в 7 мл среды SFM II (Invitrogen Cat.No 12052-114) в колбе Т 75. Использовали следующие смеси для трансфекции.A) Липофектамин: 52,1 мкл. Среда SFM II: 517,9 мкл. Общий объем составляет 570 мкл.B) Аликвоты ДНК: 10 мг линеаризованной плазмидной ДНК (9 мкг Luc-экспрессирующего вектора+ 1 мкг плазмиды для селекции: SV40-промотор, управляющий геном устойчивости к пуромицину. Все плазмиды линеаризуют с помощью PvuI). Объем доводят до 570 мкл средой SFM II. Растворы А и В смешивают и инкубируют в течение 30 мин при комнатной температуре. Приливают 7 мл, содержащих 5106 клеток, и затем вновь помещают в инкубатор при 37 С и 5% СО 2 на 3 ч. Затем инкубированную культуру центрифугируют при 800 g в течение 3 мин и клеточный осадок ресуспендируют в 5 мл EX-CELL 325 (JRH, Cat. No 14335-1000M) с добавлением 1X НТ и 4,5 мМ L-глутамина(100 Х НТ, Invitrogen, Cat. No 11067-030, 200 мМ L-глутамина, Sigma, G-7513). 5 мл EX-CELL 325 добавляют непосредственно в колбу Т 75 для того, чтобы ресуспендировать прилипшие клетки, которые добавляются к имеющейся суспензии. В итоге, в 10 мл среды EX-CELL 325 находится 5106 клеток. Методика отбора. Через 48 ч после трансфекции осуществляют селекцию, меняя среду и разбавляя клетки до концентрации 110 клеток/мл в среде EX-CELL 325, содержащей 10 мкг/мл пуромицина (Sigma, P-8833). Каждые 2 дня клетки подсчитывают, центрифугируют и ресуспендируют в свежей селективной среде до концентрации 1108 живых клеток/мл. В эти же дни осуществляют контроль жизнеспособности. После 21-35 дней селекцию завершают, и жизнеспособность клеток превышает 80%. Измерение люциферазы. За 2 ч до отбора культуральных проб клетки подсчитывают и данную культуру разбавляют до концентрации 0,2108 живых клеток/мл. Измерение люциферазы осуществляют с помощью аналитической системы Bright-Glo Luciferase отPromega, Cat. No E2610 в соответствии с указаниями производителя. Вкратце, клетки суспендируют путем неоднократного их пипетирования, после чего берут аликвоту в 50 мкл и помещают ее в белый 96-луночный планшет (Nunc, Cat. No 236108). Приливают 50 мкл перерастворенного Bright-Glo-реагента и инкубируют в течение 5 мин при комнатной температуре. Люминометром Centro LB 960 (Berthold Technologies) в течение 5 с в опыте измеряют световое излучение. Затем активность люциферазы стандартизуют путем подсчета живых клеток в испытываемом образце, т.е., как правило, 1104 клеток. Результаты Конструкции С, D, Е и F (см. фиг. 2) тестируют в устойчивой экспрессирующей системе. Полученные результаты изображены на фиг. 5. Конструкция Е, содержащая только IE2-промотор, приводит к сильнейшей экспрессии люциферазы в данной системе. При совместном присутствии IE1-промотора иIE2-промотора, размещенных в двух противоположных направлениях (конструкция D), IE2-промотор все еще обеспечивает экспрессию люциферазы, превышающую экспрессию под промотором IE1, либо при отдельном его присутствии (конструкция F), или в двунаправленном положении с IE2-промотором (конструкция С). Пример 3. Коэкспрессия двух полипептидов, представляющих интерес, в двунаправленных экспрессирующих векторах. Материалы и методы Трансфекцию осуществляют так, как описано в примерах 1 и 2. Вкратце, CHO-S-клетки (в суспензии, Gibco SFMII) были временно трансфицированы с помощью 900, 500, 300 и 100 нг векторной ДНК(конструкция С-2, см. фиг. 3) в 24-луночных планшетах (трижды для каждой обработки). Через 2 дня после трансфекции осуществляют анализ люциферазы с клеточными экстрактами в трех повторах, который выражают с помощью RLU (относительные единицы света). Перед лизисом клеток были взяты супернатанты из одних и тех же лунок, объединены и проанализированы на IL18BP с помощью ИФА (см. ниже). ИФА IL-18BP. Количество рекомбинантного человеческого IL-18BP (rhIL-18 ВР) в супернатанте измеряют с помощью стандартного ИФА с использованием выделенных очисткой белком G моноклопальных анти-rhIL-18 ВР-антител, конъюгированных с биотином. Экстравидин-HRP (Sigma) используют в качестве детектирующего реагента. На фиг. 9 показаны количества IL-18BP в нг/мл и люциферазы в RLU, экспрессируемые в 48 клонах на 90-й день после устойчивой трансфекции с помощью двунаправленной mCMV-промоторной конструкции (см. фиг. 3). Предел обнаружения для люциферазы составляет около 500 RLU и 2,5 нг/мл - дляIL-18BP. Результаты В данной серии экспериментов проанализирована экспрессия двух генов, находящихся в конструк- 11010096 ции С-2, изображенной на фиг. 3. Маркерный ген (люцифераза) экспрессируется с IE2-промотора, а представляющий интерес ген, ген IL-18BP, экспрессируется с промотора IE2. IL-18BP представляет собой секретируемый белок. Промоторы выстроены в двунаправленную структуру, т.е. оба промотора одновременно запускают экспрессию в противоположных направлениях. Результаты данного исследования изображены на фиг. 6-9. На фиг. 6 показана величина люциферазной экспрессии, которая измерена в RLU во временной экспрессирующей системе. В той же временной экспрессирующей системе с помощью ИФА измеряют IL-18 ВР в супернатантах клеточных культур. На фиг. 7 показаны результаты секреции белка IL-18BP в нг/мл. На фиг. 8 показано соотношение IL18BP и люциферазы в каждом эксперименте. Как показано на фиг. 6-8, для трансфекции используют разные количества плазмидной ДНК. Все использованные количества ДНК приводят к экспрессии как люциферазы, так и IL-18BP. Поразительно, но самые лучшие результаты получены при трансфекции наименьшим количеством ДНК, а именно 100 нг векторной ДНК, и этот результат одинаков и для IL-18BP, и для люциферазы. Более того, этот стабильный показатель (фиг. 8) свидетельствует о константном соотношении потенциальной экспрессии обоих промоторов. Наконец, эти данные демонстрируют, что оба гена экспрессируются одновременно с двух промоторных единиц, показывая также, что обе экспрессирующие единицы полностью функциональны в двунаправленной промоторной структуре. Далее, устойчиво трансфицируют конструкцию С-2, а экспрессию люциферазы и IL-18BP анализируют в 48 независимых клонах. Устойчивую трансфекцию осуществляют в соответствии с протоколом, описанным в примере 2, за тем исключением, что используемая после трансфекции среда представляет собой ProCho5 (Cambrex, cat. 12766Q). Что касается клонирования одиночной клетки, данный пул упорядочивают в 384-луночной планшете (Nunc, cat. 164688) с плотностью 0,5 клеток на лунку (70 мкл/лунку) с использованием диспенсераMultidrop (ThermoLabsysterns, cat. 5840150). Спустя 8 дней случайным образом отбирают 192 клона и анализируют люциферазную экспрессию. Отбирают 48 клонов с наивысшей Luc-экспрессией, которые перепроверяют на экспрессию люциферазы (люминометром) и на IL-18BP (неавтоматизированный ИФА,см. выше). На фиг. 9 представлены результаты данного эксперимента. Все 48 клонов экспрессируют люциферазу и IL-18BP, хотя и в разном количестве. Пример 4. Определение минимальной энхансерной последовательности. Материалы и методы Плазмидные ДНК. Набор векторов, содержащих укороченные mCMV-промоторы, создан с использованием ПЦР (полимеразная цепная реакция) и специфичных для mCMVp праймеров (таблица ниже). Условия ПЦР были следующими. Смесь. 10 нг плазмидной ДНК (prevmCMV-Luciferase (XhoI), конструкция Е на фиг. 2). 50 пкмоль смыслового и антисмыслового праймера (см. ниже таблицу, обычный антисмысловой праймер для всех). 200 мкМ каждого dNTP (dATP, dTTP, dGTP, dCTP). 1x Dynazyme-буфер, содержащий 1,5 мМ MgCl2. 4 единицы ДНК-полимеразы Dynazyme II (Finnzymes, cat. F-501S). Характеристика циклов: 95 С, 5' 2 цикла: 95 С, 30" 52 С, 30" 72 С, 1'30 2 цикла: 95 С, 30" 54 С, 30" 72 С, 1'30 10 циклов: 95 С, 30" 58 С, 30" 72 С, 1'30 15 циклов: 95 С, 30" 60 С, 30" 72 С, 1'30- 12010096 5 мкл амплификата из каждой ПЦР-реакции помещают в 1%-ный агарозный гель. Перед клонированием вырезают полосы, обладающие нужной длиной, и подвергают выделению очисткой с использованием набора Qiagen Minilute Gel Extraction, cat. 28606.IE2 в качестве начала отсчета, представляют собой -1076, -783, -587, -387 и -189. Метод клонирования для любого промоторного фрагмента был одним и тем же, ПЦР выполняют в полную длину mCMVp (prevmCMV-Luciferase (XhoI), т.е. конструкция Е на фиг. 2). Затем данные фрагменты обрабатывают с помощью XhoI/ExoRI, добавляют два сайта рестрикции по краям специфической праймерной последовательности. Затем из конструкции Е удаляют промоторную последовательность путем обработки ее с помощью XhoI/EcoRI и укороченные варианты встраивают в тот же локус. Оценку конструкций осуществляют с помощью временной трансфекции липофектамином с последующим измерением люциферазы. Дополнительные материалы и методы описаны в примере 1. SFMсреда, используемая в данном примере, представляет собой ProCho5, Cambrex, B-12766Q. Результаты Векторы H-N (фиг. 10 а), содержащие IE2-промотор mCMV, приводящие в действие люциферазный ген, были сконструированы для того, чтобы определить минимальные последовательности, необходимые для высокого экспрессирующего уровня с IE2-промотора. Семь конструкций H-N экспрессирующих векторов используют для временной экспрессирующей системы, основанной на CHO-S-клетках. Полученные результаты изображены на фиг. 10b. КонструкцияL представляет собой самую короткую конструкцию, сохраняющую сильную экспрессию люциферазы в данной системе. Конструкция М все еще приводит к экспрессии люциферазы на уровне, соответствующем 30% уровня экспрессии, достигаемого с помощью конструкций H-L. Экспрессия люциферазы, получаемая с помощью конструкции N, оказывается очень низкой, но все же существенной, свидетельствуя о базальной промсторной активности, что и следовало ожидать для продуктивного сайта инициации транскрипции, содержащего ТАТА-бокс и инициатор. Наконец, данные эксперименты определяют новый энхансер, расположенный слева от IE2 mCMV,именуемый здесь IE2-энхансер mCMV. В вышеуказанных экспериментах IE2-энхансер увеличивает транскрипцию с минимального IE2-промотора, сохраняемого в конструкции N. Минимальная последовательность, необходимая для высокой экспрессии репортерного гена, находится в пределах фрагмента от-587 до -189 п.н. (конструкция L) и в пределах конструкции, содержащей фрагмент от -387 до -189, все еще усиливающей экспрессию люциферазы (конструкция М). Пример 5. Новый IE2-энхансер активирует минимальный SV40-промотор. Дополнительные эксперименты осуществляют для того, чтобы выяснить, действительно ли новыйIE2-энхансер в самом деле удовлетворяет всем критериям, необходимым для энхансерной активности,т.е. усиливает экспрессию, независимо от (1) местоположения, (2) ориентации и (3) промоторной идентичности. Для этого были сконструированы конструкции O-V с целью выяснить, может ли новый IE2-энхансер усиливать экспрессию гетерологичного промотора, SV40-промотора, независимо от ориентации,расстояния и положения (5' или 3') относительно SV40-промотора. Конструкции W, X и Y служат контролем, W содержит SV40-энхансер, X содержит SV40-промотор и не содержит какого-либо энхансера, aY не содержит ни энхансера, ни промотора. Конструкция вектора Вектор, именуемый pSV-Luc (конструкция X на фиг. 11 а), который содержит лишь SV40-промотор,был сконструирован из pGL3-CtrI (Promega, E 1741), содержащего SV40-промотор, приводящий в действие люциферазный ген, а также SV40-энхансер, локализованный на 3'-конце данного гена (конструкцияW), и pGL3-Basic (Promega, E1751), не содержащего ни промотора, ни энхансера (конструкция Y). Вкратце, pGL3-ctrI разрезают с помощью NotI/XbaI, чтобы выделить фрагмент, содержащий SV40 промотор с последующим люциферазным геном. Аналогичным способом разрезают pGL3-basic с помощью NotI/XbaI и выделяют векторный остов без энхансера, но содержащий poly А-область. В результате объединения двух фрагментов получают pSV-Luc (конструкция X). 5'-Область SV40-промотора данного вектора создана путем клонирования IE2-энхансерной после- 13010096 довательности (от -587 до -189) в обеих ориентациях, названной р 5'enh-SV-Luc (конструкция О), и р 5'обратноориентированной последовательности enh-SV-Luc (конструкция Q). Кроме того, данную IE2-энхансерную последовательность (от -587 до -189) также клонируют в обеих ориентациях в 3'-область люциферазного гена. Полученные векторы были названы р 3'enh-SV-Luc+ (конструкция S) и р 3'-обратноориентированный enh-SV.Luc. (конструкция U). Такую же процедуру осуществляют с коротким вариантом IE2-энхансера, а именно занимающего позицию от -387 до -189, вместо положения от -587 до -189, и получают конструкции Р, R, Т и V, см. фиг. 11 а. Конструирование О, Р. Реципиентный вектор представляет собой pSV-Luc+ (конструкция X из фиг. 11 а), линеаризованный с помощью обработки NheI/SmaI. Полноразмерный энхансер выделяют путем обработки NdeI и последующей реакцией затупления по концам с использованием полимеразы Кленова с последующей очисткой и обработкой NheI. Такой же подход применяют для создания короткой энхансерной конструкции. Конструирование Q, R. Реципиентный вектор представляет собой pSV-Luc+ (конструкция X из фиг. 11 а), линеаризованный обработкой с помощью XhoI/SmaI. Полноразмерный энхансер выделяют путем обработки с помощьюNdeI и последующей реакцией затупления концов с использованием полимеразы Кленова, очисткой и обработкой с помощью XhoI. Такой же подход применяют для создания короткой энхансерной конструкции. Конструирование S, T, U и V. Реципиентный вектор представляет собой pSV-Luc+ (конструкция X из фиг. 11 а), раскрываемый обработкой с помощью BamHI и последующим туплением концов с использованием полимеразы Кленова. Полноразмерный энхансер выделяют обработкой с помощью NdeI/NheI и последующей реакцией затупления концов с использованием полимеразы Кленова. Клонирование осуществляют в обеих ориентациях, которые идентифицируют с помощью рестрикционного анализа. Обе конструкции с разными ориентациями оставляют для анализа. Такой же подход применяют для создания короткой энхансерной конструкции. Конструирование pGL3-Basic (конструкция Y) служит в качестве контроля отсутствия экспрессии.pGL3ctrI (конструкция W) служит в качестве SV40-промотор/энхансерного вектора. PSV-Luc является контролем, обладающим только SV40-промотором (конструкция X). Измерения трансфекции и люциферазы осуществляют в качестве предварительных примеров. Результаты Результаты, полученные для конструкций O-Y из фиг. 11 а, изображены на фиг. 11b. Конструкция,содержащая SV40-промотора с отсутствием энхансерной активности, взята в качестве исходного уровня добавляемой энхансерной активности, а активность, измеряемая с помощью конструкции X, задается в виде 1. Все конструкции, обладающие либо длинным, либо коротким IE2-энхансером, обеспечивают экспрессию репортерного гена. Длинный вариант конструкции устойчиво обеспечивает высокую экспрессию репортерного гена с SV40-промотора, которая оказывается гораздо выше той, которую получают при объединении SV40-промотора и SV40-энхансера (конструкция О). Вследствие этого данный эксперимент четко определяет последовательность от -587 до -189 и последовательность от -387 до 189 в качестве настоящих энхансеров, активирующих гетерологичный промотор в независимости от положения и ориентации. Пример 6. Сравнение длинного IE2-энхансерного варианта (от -587 до -189) и hCMV-энхансера. Протоколы экспериментов по трансфекции липофектамином с последующим измерением люциферазы, описаны в примере 1. Результаты В данном эксперименте конструкции О и Q, обладающие длинным вариантом нового IE2-энхансера в обоих направлениях в 5'SV40-промоторе, используют для сравнения с известным сильным энхансером,hCMV (человеческий цитомегаловирус)-энхансером. На этом конце IE2-последовательность mCMV замещают hCMV-энхансерной последовательностью (SEQ ID No: 2) в конструкции О, получая таким образом конструкцию O-2. То же самое проделали с конструкцией Q, превращая ее в конструкцию Q-2. Использованная для клонирования последовательность hCMV-энхансера, обладающая фланкирующими MluI-сайтами (MluI=acgcgt), имеет следующий вид:SV-Luc+ расщепляют с помощью MluI и обрабатывают щелочной фосфатазой из кишечника теленка для предотвращения самолигирования. Последовательность hCMV-промотора клонируют в MluI-сайт. Оба разноориентированных клона сохраняют для сравнения с эквивалентными IE2-конструкциями. Результаты по экспрессии люциферазы представлены на фиг. 12. Уровень экспрессии люциферазы,полученный с новым IE2-энхансером (длинный вариант), оказывается по меньшей мере в 2 раза выше уровня экспрессии люциферазы, полученного с помощью классического hCMV-энхансера. Пример 7. Характеристика IE2-энхансера в двунаправленной конструкции. Созданы две дополнительные конструкции для тестирования нового энхансера в двунаправленной структуре, названные конструкциями 26 и 140, которые изображены на фиг. 13. 26: основу данного вектора составляет последовательность mCMV-Luc+ (конструкция С, фиг. 3). Она была создана с помощью SacII/EcoRI. 1L-18 ВР-кассета взята из phCMV-IL18BP2. Путем разрезания данного вектора с помощью SacII/EcoRI выделяют фрагмент, содержащий интрон А, за которым следуют открытая рамка считывания IL-18BP и SV40polyA-область. 140: основу данного вектора составляет конструкция L из фиг. 10 а. Он создан с помощьюXhoI/NheI, открывающих данный вектор 5' IE2-энхансером. Вектор, экспрессирующий IL-18BP с IE1 промотора, названный pBS.I IL18BP(IE1).I, используют для встраивания в качестве донорного. Обрабатывая данный вектор с помощью XhoI/SpeI, выделяют XhoI-фрагмент, содержащий IE1-промотор (см. фиг. 1), за которыми следует кассета интрон А-IL18BP-SV40polyA. В полученной конструкции недостает последовательности между -589 и XhoI-сайтом исходной mCMV-промоторной последовательности. Устойчивую трансфекцию и измерение люциферазы осуществляют, как описано в примере 2, а ИФА IL18BP осуществляют, как описано в примере 3. Однако конструкция 140 не является точным отображением конструкции 26 в отношении того,что промоторы IE1 и IE2 находятся в противоположной ориентации. Так, экспрессия люциферазы запускается в конструкции 26 под промотором IE1, а в конструкции 140 под промотором IE2, экспрессияIL18BP запускается под промотором IE2 в конструкции 26 и под промотором IE1 в конструкции 140. Результаты, полученные с обеими конструкциями, представлены ниже, так как они существенны для одновременного действия нового IE2-энхансера двух разных промоторов в двунаправленном экспрессирующем векторе (конструкция 140). На фиг. 14 изображены объединенные результаты по устойчивой трансфекции клеток с помощью конструкции 26 и 140 на примере экспрессии люциферазы и IL-18BP. Конструкция 140 обеспечивает более высокую экспрессию и маркерного гена (люцифераза) и представляющего интерес гена (IL-18BP). Для того, чтобы определить стабильность экспрессии люциферазы и IL-18BP, совокупности клеток выдерживают в селективных условиях, а именно либо обрабатывают пуромицином, либо выдерживают в течение 3 недель без селективного давления (без пуромицина). Полученные результаты представлены на фиг. 15-17. Уровни экспрессии репортерного гена люциферазы и IL-18BP существенно не изменяются во времени, см. фиг. 16 и 17. Таким образом, было продемонстрировано, что обе конструкции, 26 и 140, показывают аналогичные уровни экспрессии во времени, в присутствии или в отсутствие селективного давления. Поэтому конструкции, обладающие новым IE2-энхансером, пригодны для устойчивой и одновременной экспрессии двух генов. Поскольку вышеприведенные результаты были получены для совокупностей, клоны были получены путем лимитирующего разведения в концентрации 0,5 клеток на лунку из обеих совокупностей. Чтобы оценить уровни клональной экспрессии, клоны культивируют при пуромициновом отборе. Затем выделенные клоны разделяют в присутствии и в отсутствие пуромицина, чтобы со временем контролировать их устойчивость. Результаты, представленные на фиг. 18 и 19, взяты до разделения клонов на среде с отсутствием/присутствием пуромицина. Результаты, полученные через 2 недели после удаления пуромицина, свидетельствуют о незначительной разнице между обеими конструкциями, подтверждая тем самым их устойчивость. Данное исследование было продолжено в течение последующих 10-12 недель. Чтобы оценить экспрессию обоих генов, используют посуду с высокой пропускной способностью, а именно 96-луночные планшеты. День 1. Разведение 1/2 анализируемых клеток, 100 мкл культуральной среды (бессывороточной) ProCho5 + 100 мкл свежей ProCho5, содержащей 5% околоплодной сыворотки теленка. В конечной концентрации 2,5% FBS клетки были способны прикрепляться. Был сделан еженедельный пассаж поддерживающего планшета для фактора разведения 1/20, каждый в ProCho5-среде. День 2. Удаляют среду, однократно промывают 200 мкл 1x PBS (Invitrogen, 10010-015), после чего добавляют 75 мкл свежей ProCho5, содержащей 5% FBS, и инкубируют в течение 24 ч. День 3. Из каждого супернатанта отбирают 50 мкл и приливают 200 мкл ИФА-буфера (1x PBS, 0,1% мас./об. BSA, 0,2% Твина 20). Аликвоту в 100 мкл анализируют с помощью ИФА на IL-18 ВР. Лунки промывают 200 мкл 1x PBS (отбросить) и приливают 100 мкл Glo-лизирующего буфера(Promega, Е 266 а). Данные лунки инкубируют в течение 30 мин при комнатной температуре, чтобы обеспечить лизис клеток. Измерение люциферазы осуществляют с использованием 30 мкл лизированных клеток, перенесенных в белый 96-луночный планшет + 30 мкл перерастворенного Bright-Glo-реагента. Световое излучение замеряют люминометром Centro LB960 в течение 5 с экспонирования. Анализ клонов, полученный при устойчивой трансфекции с помощью конструкции 26, изображен на фиг. 18, а анализ клонов при устойчивой трансфекции с помощью конструкции 140 изображен на фиг. 19. Клоны, представленные на фиг. 18 и 19, оценивают по их люциферазному показателю нисходящим способом. Экспрессию IL18BP выражают ОП-величиной. Так как ИФА осуществляют в посуде с высокой пропускной способностью, получение реальной количественной оценки уровней IL-18BP невозможно. Однако контроли с 2500 и 250 нг/мл, а также холостой контроль включены в данную планшету для контроля изменчивости. На фиг. 20 показана экспрессия люциферазы, полученная с помощью устройства ChemiDoc. Данное изображение дает CCD-камера (Biorad), позволяющая получать сигналы хемилюминисцентного происхождения (как на фиг. 20). Программное обеспечение под названием Quantity One 4.2.3 позволяет управлять изображением инвертирования сигналов, которые были использованы здесь. Как следует из результатов, представленных на фиг. 18-20, конструкция 140 дает группу неэкспрессируемых клонов. Однако удивительно, что небольшая часть позитивных клонов экспрессируется обоими генами чрезвычайно сильно. Поэтому конструкция 140 дает возможность осуществлять скрининг при очень высокой экспрессии на очень ранних стадиях клонирования и тем самым исключает необходимость тестирования и доведения до конца большого числа клонов, обычно используемых для идентификации небольшого числа клонов с высокой экспрессией двух интересующих генов. Список литературы 1. Abbate et al., Biotechniques 2001 Aug.; 31 (2): 336-40. 2. Assaraf et al., J. Biol. Chem. 1992, Mar. 25; 267 (9): 5776-84. 3. Blackwood, E.M., Kadonaga, J.T. Science 1998, Jul. 3; 281 (5373): 61-3. 4. De Wet et al. (1985) Proc. Natl. Acad. Sci. USA 82, 7870. 5. Dorsch-Haesler, K. et al. (1985). Proc. Natl. Acad. Sci. USA 82: 8325-8329. 6. Goeddel Methods Enzymol., Vol. 185, San Diego. 7. Li, Q., Harju, S., Peterson, K.R. Trends Genet. 1999 Oct.; 15 (10): 403-8. 8. Manning, W.C. and Mocarski, E.S., Virology 167, 477-484 (1988). 9. Mazumder, B., Seshadri, V., Fox, P.L. Trends Biochem. Sci. 2003 Feb.; 28 (2): 91-8. 10. Messerle, M. et al. (1991). J. Virol. 65: 1638-1643. 11. Kim, S.-Y. et al. (2002). J. Biotech. 93: 183-187. 12. Mountford, P.S., Smith, A.G. Trends Genet. 1995 May; 11 (5): 179-84. 13. Sandford and Burns, Virology 222, 310-317 (1996). 14. Schumperli et al., Proc. Natl. Acad. Sci. USA, 1982 Jan.; 79 (2): 257-61. 15. Seliger and McElroy (1960) Arch. Biochem. Biophys. 88, 136. 16. Shotwell et al., 1982, J. В. C. 257 (6), 2974-80. 17. Wood et al., (1991) Biochem. Biophys. Res. Comm. 124, 592. 18. Патент США 4963481. 19. Патент США 4968615. 20. Zhu et al., J. Cell Biochem. 2001, Mar. 26; 81 (2): 205-19. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Экспрессирующий вектор, содержащий коровый промотор mCMV-IE2-гена, простирающийся от нуклеотида 1 до нуклеотида 39 в последовательности SEQ ID No: 1, где:(i) экспрессирующий вектор не содержит никакого полного гена mCMV и(ii) указанный промотор mCMV-IE2-гена оперативно связан с ДНК-последовательностью, кодирующей полипептид. 2. Вектор по п.1, дополнительно содержащий промотор, отличающийся от указанного mCMV-IE2 промотора. 3. Вектор по п.1 или 2, включающий в себя первый и второй промоторы вирусного, клеточного или искусственного происхождения. 4. Вектор по п.3, в котором первый промотор представляет собой mCMV-IE2-промотор, а второй промотор представляет собой mCMV-IE1-промотор. 5. Вектор по любому из предшествующих пунктов, содержащий ДНК-последовательность SEQ ID No: 1. 6. Вектор по любому из предшествующих пунктов, содержащий фрагмент, содержащий нуклеотиды от -587 до -189 слева от области mCMV-IE2, где нумерация нуклеотидов осуществляется относительно +1 IE2-гена.- 16010096 7. Вектор по любому из предшествующих пунктов, включающий в себя фрагмент, содержащий нуклеотиды от -587 до -189 слева от области mCMV-IE2, где нумерация нуклеотидов осуществляется относительно +1 IE2-гена. 8. Вектор по любому из пп.3-7, где первый и второй промоторы оперативно связаны с ДНК-последовательностями, кодирующими по меньшей мере один полипептид. 9. Экспрессирующий вектор, содержащий энхансер mCMV-IE2-гена, простирающийся от нуклеотида -387 до нуклеотида -189 выше области mCMV-IE2, где нумерация нуклеотидов осуществляется относительно +1 IE2-гена, где указанный экспрессирующий вектор:(i) не содержит никакого полного гена mCMV и(ii) содержит первый и второй промоторы вирусной, клеточной или искусственной природы, где указанные первый и второй промоторы оперативно связаны с ДНК-последовательностями, кодирующими по меньшей мере один полипептид. 10. Вектор по п.8 или 9, где ДНК-последовательности кодируют по меньшей мере один представляющий интерес белок. 11. Вектор по п.10, где ДНК-последовательности кодируют по меньшей мере один маркерный белок. 12. Вектор по п.10, где ДНК-последовательности кодируют по меньшей мере один репортерный белок. 13. Вектор по любому из пп.3-11, где первый промотор, а также второй промотор располагают таким образом, чтобы они были двунаправленными. 14. Вектор по любому из предшествующих пунктов, дополнительно включающий в себя один или более регуляторных элементов, выбранных из 5'UTR, интронов, 3'UTR, 3'-концевых процессирующих мРНК-последовательностей, сайтов полиаденилирования и последовательностей внутреннего связывания рибосом (IRES). 15. Вектор по п.14, где регуляторный элемент представляет собой IRES, дополнительно содержащий ДНК-последовательность, кодирующую по меньшей мере одну полицистронную мРНК. 16. Вектор по любому из предшествующих пунктов, дополнительно включающий в себя один или более ДНК-элементов, выбранных из инсуляторов, пограничных элементов, районов контроля локуса(LCR), областей прикрепления к матриксу (MAR) и элементов для рекомбинации и кассетного обмена. 17. Вектор по любому из пп.8-16, где ДНК-последовательность, кодирующая полипептид, оперативно связанная с первым промотором, и ДНК-последовательность, кодирующая полипептид, оперативно связанная со вторым промотором, кодирует тот же самый полипептид. 18. Вектор по любому из пп.8-16, где ДНК-последовательность, кодирующая полипептид, оперативно связанная с первым промотором, и ДНК-последовательность, кодирующая полипептид, оперативно связанная со вторым промотором, кодирует разные полипептиды. 19. Вектор по п.18, где ДНК-последовательность, кодирующая полипептид, оперативно связанная с первым промотором, кодирует первую субъединицу димерного или мультимерного белка, и ДНК-последовательность, кодирующая полипептид, оперативно связанная со вторым промотором, кодирует вторую субъединицу димерного или мультимерного белка. 20. Вектор по п.19, где одна субъединица представляет собой альфа-цепь, а другая субъединица представляет собой бета-цепь гормона, выбранного из FSH человека, LH человека, TSH человека и CG человека. 21. Вектор по п.19, где одна субъединица представляет собой тяжелую цепь, а другая субъединица представляет собой легкую цепь иммуноглобулина. 22. Вектор по любому из пп.10-21, где представляющий интерес белок выбран из FSH, LH, CG,TSH, гормона роста, интерферона, белка I, связывающего TNF, белка II, связывающего TNF, Raptiva,IL-18BP или их мутеинов, фрагментов, функциональных производных и слитых белков. 23. Вектор по любому из пп.11-22, где маркерный белок выбран из аденозиндезаминазы (ADA),аминогликозидфосфотрансферазы (neo), дигидрофолатредуктазы (DHFR), гигромицин-В-фосфотрансферазы (НРН), тимидинкиназы (tk), ксантин-гуанинфосфорибозилтрансферазы (gpt), гена множественной лекарственной устойчивости (MDR), орнитиндекарбоксилазы (ODC) и устойчивости к N-(фосфоноацетил)-L-аспартату (CAD), пуромицинацетилтрансферазы (РАС), галактокиназы, человеческих рецепторов фолата или восстановленных носителей фолата. 24. Вектор по пп.12-23, где репортерный белок выбран из люциферазы, зеленого флуоресцирующего белка, щелочных фосфатаз и пероксидазы хрена или их сочетаний. 25. Экспрессирующий вектор, содержащий промотор mCMV-IE2-гена, где указанный промотор состоит из последовательности, выбранной из группы, состоящей из:(i) корового IE2-промотора, простирающегося от нуклеотида 1 до нуклеотида 39 в последовательности SEQ ID No: 1;(ii) последовательности, содержащей коровый IE2-промотор, простирающийся от нуклеотида 1 до нуклеотида 39 в последовательности SEQ ID No: 1, и последовательности от 100 до 200 нуклеотидов слева от указанного корового промотора и(iii) последовательности SEQ ID No: 1. 26. Вектор по п.25, где указанный промотор оперативно связан с ДНК-последовательностью, кодирующей полипептид.- 17010096 27. Вектор по п.26, где указанный полипептид выбран из FSH, LH, CG, TSH, гормона роста, интерферона, белка I, связывающего TNF, белка II, связывающего TNF, Raptiva, IL-18 ВР или их мутеинов,фрагментов, функциональных производных и слитых белков. 28. Хозяйская клетка, трансфицированная вектором по любому из предшествующих пунктов. 29. Хозяйская клетка по п.28, являющаяся клеткой СНО. 30. Способ получения полипептида, включающий в себя стадию трансфекции хозяйской клетки по меньшей мере одним вектором по любому из пп.1-27. 31. Способ по п.30, где трансфекция представляет собой устойчивую трансфекцию. 32. Способ получения полипептида, включающий в себя стадию культивирования хозяйской клетки по п.28 или 29 в условиях, обеспечивающих возможность экспрессии полипептида. 33. Способ по п.30 или 31, дополнительно включающий в себя стадию выделения полипептида из хозяйской клетки или из супернатанта клеточной культуры. 34. Применение вектора по любому из пп.1-27 для экспрессии представляющего интерес гена. 35. Применение вектора по любому из пп.1-27 для селекции клонов, которые экспрессируют высокие количества представляющего интерес гена. 36. Применение вектора по любому из пп.4-24 для одновременной экспрессии представляющих интерес двух и более генов или ДНК. 37. Применение вектора по любому из предшествующих пунктов для производства лекарственного средства, предназначенного для ДНК-терапии. 38. Применение хозяйской клетки по п.28 или 29 для производства лекарственного средства для клеточной терапии.
МПК / Метки
МПК: C07K 14/045, C12N 5/10, C12N 15/86
Метки: ie2-промотор, мсмv, векторы, содержащие, экспрессирующие
Код ссылки
<a href="https://eas.patents.su/26-10096-ekspressiruyushhie-vektory-soderzhashhie-ie2-promotor-msmv.html" rel="bookmark" title="База патентов Евразийского Союза">Экспрессирующие векторы, содержащие ie2-промотор мсмv</a>
Предыдущий патент: Новые пептиды, которые связываются с рецептором эритропоэтина
Следующий патент: Способ получения напитка, обработанного никотином или его производным
Случайный патент: Аэрозольный генератор с изогнутой капиллярной трубкой