Способ диагностики или выявления конформационного заболевания или его маркера и набор для использования в способе
Формула / Реферат
1. Способ диагностики или выявления конформационного заболевания, которое характеризуется конформационным превращением лежащего в его основе белка из непатогенного в патогенный конформер, путем анализа образца на предмет выявления маркера указанного заболевания, предусматривающий:
(i) обеспечение контактирования указанного образца с некоторым количеством непатогенного конформера;
(ii) дезагрегацию любых агрегатов, образующихся во время стадии (i); и
(iii) определение наличия и/или количества в образце указанного патогенного конформера, который является маркером указанного заболевания;
причем стадия (i) включает в себя стадию (ia) инкубации указанного образца с непатогенным конформером, а стадии (ia) и (ii) образуют цикл, который повторяют по меньшей мере дважды перед осуществлением стадии (iii).
2. Способ по п.1, где цикл повторяют от 5 до 40 раз до выполнения стадии (iii).
3. Способ по любому из пп.1-2, где стадию (i) осуществляют в физиологических условиях.
4. Способ по любому из пп.1-3, где количество непатогенного конформера на стадии (i) является избыточным.
5. Способ по любому из пп.1-4, где конформационное заболевание представляет собой трансмиссивное конформационное заболевание.
6. Способ по любому из пп.1-5, где анализируемый образец подвергают предварительной обработке для избирательного концентрирования патогенного конформера в образце.
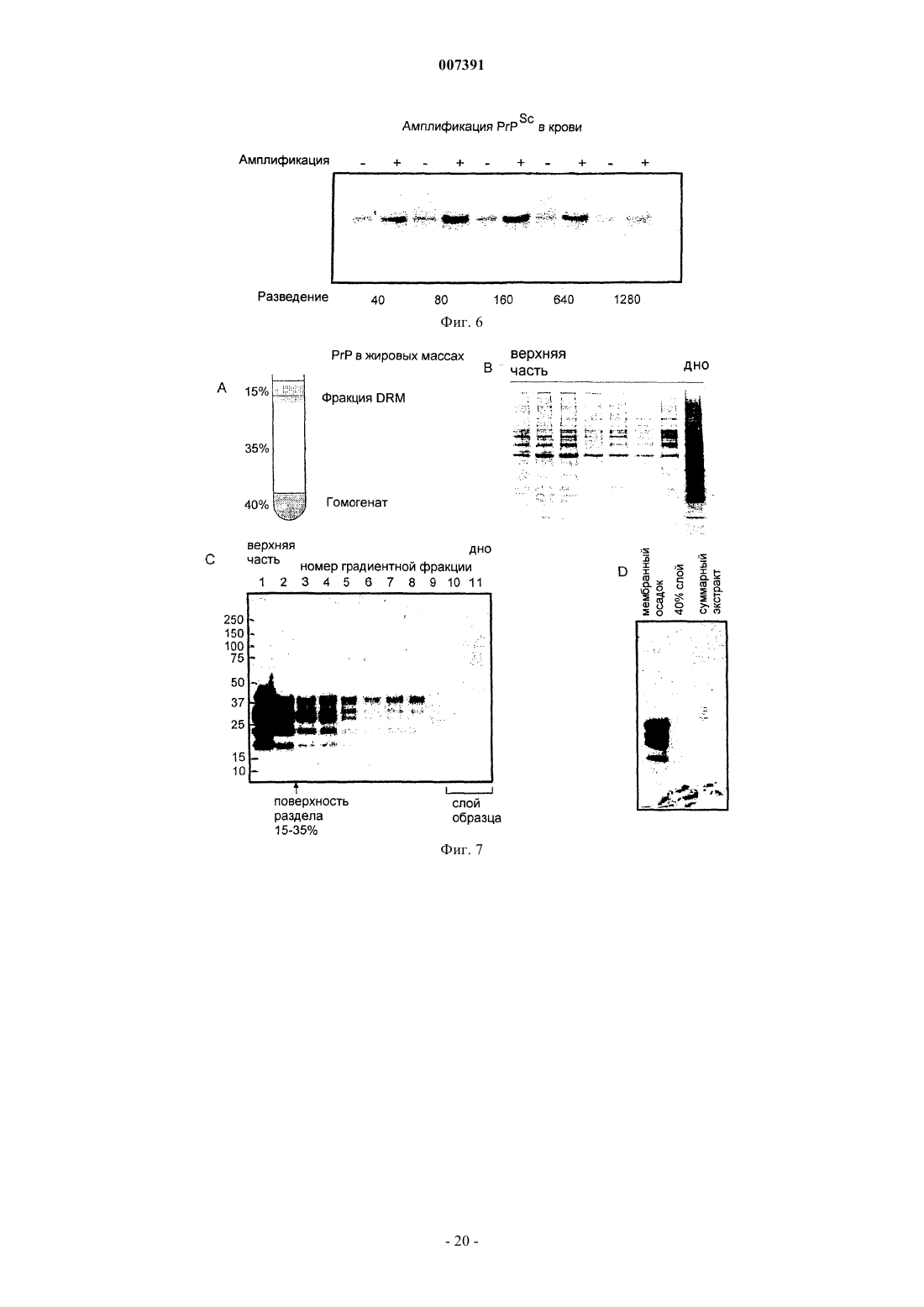
7. Способ по п.6, где патогенным конформером является PrPSc, а предварительная обработка представляет собой экстрагирование из образца фракции, которая нерастворима в мягких детергентах.
8. Способ выявления маркера конформационного заболевания, которое характеризуется конформационным превращением лежащего в его основе белка из непатогенного в патогенный конформер в образце, причем указанный анализ включает в себя следующие стадии:
(i) обеспечение контактирования указанного образца с некоторым количеством непатогенного конформера;
(ii) дезагрегацию любых агрегатов, возможно образующихся во время стадии (i); и
(iii) определение наличия и/или количества в образце указанного патогенного конформера, который является маркером указанного заболевания;
причем стадия (i) включает в себя стадию (ia) инкубации указанного образца с непатогенным конформером, а стадии (ia) и (ii) образуют цикл, который повторют по меньшей мере дважды перед осуществлением стадии (iii).
9. Способ идентификации соединения, которое модулирует конформационное превращение белка из непатогенного в патогенный конформер, которое характеризует конформационное заболевание, предусматривающий:
(i) обеспечение контактирования некоторого количества непатогенного конформера с некоторым количеством патогенного конформера в присутствии указанного соединения (а) и в отсутствие указанного соединения (b);
(ii) дезагрегацию любых агрегатов, образующихся во время стадии (i), и
(iii) определение количества патогенного конформера в присутствии указанного соединения (а) и в отсутствие указанного соединения (b);
причем стадия (i) включает в себя стадию (ia) инкубации указанного образца с непатогенным конформером, а стадии (ia) и (ii) образуют цикл, который повторяют по меньшей мере дважды перед осуществлением стадии (iii), и
(iv) отбор соединения, которое модулирует количество патогенного конформера, измеренного в отсутствие соединения.
10. Способ по любому из пп.1-7, 8 или 9, где патогенным конформером является PrPSc, непатогенным конформером является PrPC, а лежащим в основе заболевания белком является прионный белок.
11. Способ выявления патогенной формы прионного белка в образце, предусматривающий:
(i) обеспечение контактирования указанного образца с некоторым количеством непатогенного прионного белка;
(ia) инкубирование образца с непатогенным прионным белком;
(ii) дезагрегацию любых агрегатов, образующихся во время стадии (ia);
повторение стадий (ia)-(ii) два или более раз и далее
(iii) определение наличия и/или количества в образце патогенного прионного белка.
12. Способ выявления патогенной формы b -амилоидного белка в образце, предусматривающий:
(i) обеспечение контактирования указанного образца с некоторым количеством непатогенного b -амилоидного белка;
(ia) инкубирование образца с непатогенным b-амилоидным белком;
(ii) дезагрегацию любых агрегатов, образующихся во время стадии (ia);
повторение стадий (ia)-(ii) два или более раз и далее
(iii) определение наличия и/или количества в образце патогенного b-амилоидного белка.
13. Набор для применения в способе по любому из пп.1-7, 8 или 9, включающий в себя планшет для микротитрования, многолуночное ультразвуковое устройство и известное количество непатогенного конформера.
Текст
007391 Настоящее изобретение относится к способу диагностики или выявления конформационных заболеваний путем анализа образца на наличие маркера (т.е. патогенного конформера) указанных заболеваний; указанный способ включает в себя использование циклической амплификационной системы для повышения уровней патогенного конформера. В частности, указанные конформационные заболевания могут представлять собой прионные энцефалопатии. Предпосылки к созданию изобретения Конформационные заболевания представляют собой группу расстройств, не имеющих очевидной связи друг с другом, но имеющих выраженное сходство в клинических проявлениях, которое отражает их общие молекулярные механизмы стимуляции и самоассоциации, с последующим депонированием и повреждением тканей. Интерес к структуре возникает благодаря тому факту, что указанные различные заболевания вызываются конформационным превращением лежащего в их основе белка, что обычно приводит к его агрегации и депонированию в тканях. С медицинской точки зрения, проявление указанных конформационных заболеваний отражает данный молекулярный механизм, обычно с медленным и незаметно наступающим началом, когда превращение наблюдается в нормальном белке, но с более внезапным началом,когда оно наблюдается в нестабильном варианте белка. Двумя примерами особой важности указанных конформационных заболеваний являются трансмиссивные спонгиформные энцефалопатии и деменция Альцгеймера - заболевание, которое грозит стать разорительным для систем здравоохранения в развитых странах (см. обзор Carrell et al., 1997). Трансмиссивные спонгиформные энцефалопатии (TSE), известные также как прионные заболевания, представляют собой группу нейродегенеративных заболеваний, которые поражают человека и животных. Болезнь Крейтцфельда-Якоба (CJD), куру, болезнь Герстманна-Штраусслера-Шейкера (GSS) и фатальная семейная бессонница (FFI) у человека, а также scrapie (почесуха) и спонгиформная энцефалопатия крупного рогатого скота (BSE) у животных представляют собой некоторые из заболеваний TSE(Prusiner, 1991). Несмотря на то, что данные заболевания человека являются относительно редкими, риск возможной передачи BSE человеку по пищевой цепочке принимается во внимание органами управления здравоохранением и научным сообществом (Cousens et al., 1997, Bruce et al., 1997). Данные заболевания отличаются крайне продолжительным инкубационным периодом, за которым следует короткая и неизбежно смертельная клиническая стадия болезни (Roos et al., 1973). В настоящее время лечение не разработано. Ключевой характеристикой данного заболевания является образование белка патологической конфигурации, названного PrPSc, который представляет собой посттрансляционно модифицированную версию нормального белка, называемого PrPC (Cohen and Prusiner, 1998). Для различения изоформ PrP не было выявлено химических различий (Stahl et al., 1993), и конверсия, как представляется, представляет собой конформационное изменение, в то время как -спиральное содержание нормального белка уменьшается, а количество -складчатой структуры увеличивается (Pan et al., 1993). За структурными изменениями следуют изменения биохимических свойств: PrPC является растворимым в неденатурирующих детергентах, PrPSc является нерастворимым; PrPC легко расщепляется протеазами, в то время как PrPSc является частично резистентным, что приводит к образованию N-терминально усеченного фрагмента,известного как форма "PrPres" (Baldwin et al., 1995; Cohen and Prusiner, 1998), "Prp 27-30" (27-30 кДа) или"РК-резистентная" (резистентная к протеиназе К). В настоящее время точной диагностики TSE не существует (доклад ВОЗ, 1998 г., Budka et al., 1995,Weber et al., 1997). Попытки разработать диагностический тест для выявления прионных заболеваний затрудняются очевидным отсутствием иммунного ответа на PrPSc. Клинический диагноз CJD в настоящее время основывается на сочетании подострой прогрессирующей деменции (менее чем за 2 года), миоклонуса и мультифокальной неврологической дисфункции, связанных с характерной периодической электроэнцефалограммой (ЭЭГ) (доклад ВОЗ, 1998 г., Weber et al., 1997). Однако вариант CJD (vCJD), большинство ятрогенных форм CJD и до 40% спорадических случаев не показывают отклонений ЭЭГ (Steinhoff et al., 1996). В среднем точность клинической диагностики составляет около 60% для CJD и является в высокой степени изменчивой для других связанных с прионами заболеваний. Клиническая диагностика является более точной только на поздних стадиях заболевания, когда развиваются четкие симптомы(Weber et al., 1997). Генетический анализ является пригодным для диагностики наследственных прионных заболеваний,но последние представляют только 15% всех случаев. Методики визуализации ЦНС являются пригодными только для исключения других состояний быстро прогрессирующей деменции, благодаря структурным повреждениям головного мозга (Weber et al., 1997). Находки, сделанные с помощью визуализирующих головной мозг методик посредством компьютерной томографии (КТ) и методики ядерного магнитного резонанса (ЯМР), зависят, главным образом, от стадии заболевания. КТ является значительно менее чувствительной методикой, и на ранней стадии в 80% случаев атрофия не выявляется (Galvez andCartier, 1983). Помимо атрофии выявляются сверхинтенсивные сигналы ЯМР на базальных ганглиях(Onofrji et al., 1993). Как и изменения, наблюдаемые с помощью КТ, данные изменения никоим образом не являются специфичными. Недавние исследования дали возможность идентифицировать несколько белков нейронов, астроцитов и глии, содержание которых повышается при CJD (Jimi et al., 1992). Уровни белка S-100, нейронспецифичного изофермента и убиквитина значительно повышаются в цереброспинальной жидкости(CSF) на ранней стадии заболевания, с повышением концентраций в ходе заболевания (Jimi et al., 1992). Маркер гибели нейронов, белок 14-3-3, был предложен в качестве специфичного и чувствительного теста на спорадическую CJD (Hsich et al., 1996). Однако он не подходит для диагностики vCJD и является значительно менее специфичным при генетических формах. Поскольку белок 14-3-3 может присутствовать в CSF пациентов с другими состояниями, данный тест не рекомендуется ВОЗ в качестве общего скрининга на CJD и остается в резерве для подтверждения клинического диагноза (доклад ВОЗ, 1998 г.). Более успешная диагностика достигается с помощью комбинации клинических данных с биохимическими маркерами. Однако в соответствии с оперативной диагностикой, принятой в настоящее время в Европейской системе наблюдения за CJD, окончательный диагноз устанавливается только по результатам нейропатологических исследований и выявлению PrPSc с помощью иммуногистохимических методик, гистоблоттинга или вестерн-блоттинга (Weber et al., 1997, Budka et al., 1995). Образование PrPSc представляет собой не только наиболее вероятную причину заболевания, но также и наиболее хорошо известный маркер. Выявление PrPSc в тканях и клетках широко коррелирует с заболеванием и с наличием инфективности TSE, а способы лечения, которые инактивируют или элиминируют инфективность TSE, также элиминируют PrPSc (Prusiner, 1991). Идентификация PrPSc в тканях человека или животного считается ключевой для диагностики TSE (доклад ВОЗ, 1998 г.). Важным ограничением данного подхода является чувствительность, поскольку количества PrPSc являются высокими (достаточными для выявления обычными способами) только в ЦНС на поздних стадиях заболевания. Однако было показано, что на ранних стадиях заболевания имеет место генерализованное распределение PrPSc (в низких количествах), особенно в лимфоретикулярной системе (Aguzzi, 1997). Действительно, сообщается о наличии PrPSc в ткани небных миндалин и аппендиксе, полученных у пациентов с vCJD (Hill et al.,1997). Несмотря на то, что неизвестно, насколько рано в ходе заболевания можно использовать биопсию миндалин или аппендикса для диагностики vCJD, было показано, что у овец, генетически предрасположенных к заболеванию scrapie (почесуха), PrPSc можно выявить в тонзиллярной ткани еще до появления симптомов и на ранних стадиях инкубационного периода. Однако до настоящего времени PrPSc не был обнаружен в указанных тканях ни в одном случае спорадической CJD или GSS (Kawashima et al., 1997). Нормальный белок экспрессируется белыми кровяными клетками и тромбоцитами, и, следовательно, возможно, что у пораженных болезнью индивидуумов некоторые клетки крови могут содержать PrPSc(Aguzzi, 1997). Это дает возможность разработки анализа крови на CJD, но потребует исследования с гораздо более высокой чувствительностью, чем чувствительность имеющихся в настоящее время методов исследования. Предполагают, что репликация прионов наблюдается, когда PrPSc в инфектирующем инокулюме специфичным образом взаимодействует с PrPC хозяина, катализируя его превращение в патогенную форму белка (Cohen et al., 1994). Для того чтобы достигнуть концентрации PrPSc, достаточной для появления клинических симптомов, указанный процесс продолжается в течение периода времени от многих месяцев до многих лет. Инфективная единица PrPSc, как полагают, представляет собой олигомерную структуру с высоким содержанием -складчатой структуры, которая конвертирует нормальный белок путем включения его в растущий агрегат (фиг. 1). Данную конверсию имитируют in vitro посредством смешивания очищенногоPrPC с 50-кратным молярным избытком предварительно денатурированного PrPSc (Kocisko et al., 1994). Описанные до настоящего времени системы конверсии in vitro имеют низкую эффективность, поскольку они требуют избытка PrPSc и, следовательно, не пригодны для диагностических целей, поскольку они не могут обнаружить невыявляемые количества маркера. Причиной низкой эффективности является то, что количество олигомеров PrPSc (конвертирующих единиц) остается фиксированным в ходе исследования. Конвертирующие единицы растут последовательно по концам, и в результате они становятся больше, но количество их не увеличивается (фиг. 1). Подробное описание изобретения Заявители разработали способ диагностики или выявления конформационного заболевания, при котором заболевание характеризуется конформационным превращением лежащего в его основе белка между непатогенным и патогенным конформером, путем анализа образца на наличие маркера указанного заболевания; указанный способ включает в себя(i) контактирование указанного образца с некоторым количеством непатогенного конформера;(ii) дезагрегацию любых агрегатов, образующихся в конечном итоге во время стадии (i), и(iii) определение наличия и/или количества в образце указанного патогенного конформера. В общем, патогенный конформер будет маркером наличия указанного заболевания. Предпочтительно стадия (i) включает в себя стадию (ia) инкубирования указанного образца/непатогенного конформера.-2 007391 Согласно предпочтительному варианту осуществления настоящего изобретения, стадии (ia) и (ii) образуют цикл, который повторяется по меньшей мере дважды до выполнения стадии (iii). Более предпочтительно циклы повторяются от 5 до 40 раз и наиболее предпочтительно 5-20 раз. Конформационные заболевания, подлежащие выявлению или диагностике, представляют собой такие заболевания, которые характеризуются конформационным превращением лежащего в их основе белка. Данный "лежащий в основе белок" представляет собой белок, который способен воспринять непатогенное превращение и патогенное превращение. Примером подобного белка является прионный белок,PrP. Еще одним примером подобного белка является белок, имеющий отношение к болезни Альцгеймера, т.е. -амилоидный белок. Конформационные заболевания, подлежащие диагностике или выявлению, представляют собой предпочтительно трансмиссивные конформационные заболевания, такие как TSE (как определено в разделе "Предпосылки"). В случае диагностики TSE и согласно предпочтительному варианту осуществления настоящего изобретения маркером данного заболевания, а также патогенным конформером является PrPSc, в то время как непатогенным конформером белка, представляющего интерес, является PrPC. Количество непатогенного конформера, которое используется на стадии (i) (и, необязательно, на стадии (ib, это обычно известное количество, хотя это и необязательно в случае, если нужно просто установить наличие или отсутствие патогенного конформера. Предпочтительно, чтобы количество непатогенного конформера, которое используется на стадии (i)(и, необязательно, на стадии (ib, было избыточным количеством. В общем, исходное соотношение непатогенного конформера и патогенного конформера (если он присутствует в образце) будет более 100:1,предпочтительно более 1000:1 и наиболее предпочтительно более 1000000:1. Еще в одном предпочтительном варианте осуществления настоящего изобретения непатогенный конформер на стадии (i) присутствует в гомогенате головного мозга здорового субъекта и/или может быть добавлен к нему, перед осуществлением стадии (i); в данном случае, следовательно, гомогенат головного мозга, содержащий (предпочтительно, известный) избыток непатогенного конформера, добавляют на стадии (i). Предпочтительно, чтобы гомогенат головного мозга здорового субъекта имел такое же видовое происхождение, как и у анализируемого образца (например, гомогенат головного мозга человека для человеческого образца, гомогенат головного мозга крысы для крысиного образца, который подлежит анализу). Более предпочтительно, чтобы непатогенный конформер присутствовал в конкретной фракции гомогената головного мозга, например, в жировых массах из гомогената головного мозга. Получение данных фракций можно осуществлять, например, как описано у Sargiacomo M. et al., 1993. Таким образом, настоящее изобретение относится также к способу или анализу, как описано в настоящем документе, при котором ткань или фракцию ткани добавляют к непатогенному конформеру на стадии (i). Предпочтительно, чтобы ткань представляла собой ткань головного мозга или полученный из него гомогенат или фракцию от здорового субъекта (т.е. от такого субъекта, у которого нет патогенного конформера). Сообщается (Kocisko et al., 1994), что менее гликозилированные формы PrPC преимущественно превращаются в форму PrPSc. В частности, PrPC, на который воздействовали специфичной фосфатидилинозитол-фосфолипазой С, обычно более эффективно превращался в патогенную форму, чем полный, более интенсивно гликозилированный, PrPC. Таким образом, еще один вариант осуществления настоящего изобретения относится к способу или анализу, как описано в настоящем документе, при котором непатогенным конформером является PrPC, который имеет пониженный уровень гликозилирования (в частности,N-связанного гликозилирования) по сравнению с PrPC дикого типа. Предпочтительно, PrPC обрабатывают, чтобы удалить некоторое, все или значительное количество гликозилирования перед его использованием в качестве непатогенного конформера в способах и анализах, описанных в настоящем документе; и более предпочтительно, непатогенный конформер представляет собой PrPC, который практически негликозилирован. В случае диагностики TSE, если в образце присутствуют агрегаты патогенной формы, во время стадии (i) они будут индуцировать конверсию PrPCPrPSc, а во время стадии (ii) указанные агрегаты будут распадаться на более маленькие, но инфективные единицы, каждая из которых все еще способна индуцировать конверсию другого PrPC. Данная методика в настоящем документе названа "циклической амплификацией" и представлена на фиг. 2. Данная система обеспечивает экспоненциальное увеличение количества PrPSc, в конечном итоге присутствующего в образце, которое можно легко обнаружить. Согласно еще одному предпочтительному варианту осуществления настоящего изобретения возможным является, следовательно, рассчитать количество PrPSc, исходно имеющееся в образце, исходя из известного количества PrPC, определяя количество PrPSc, имеющееся в образце к концу анализа и учитывая количество выполненных циклов. Напротив, если в образце нет PrPSc (как такового или в форме 9 агрегатов), молекула PrPC не превратится в PrPSc и к концу анализа маркер будет отсутствовать (в образце не будет выявлен патогенный конформер).-3 007391 Было показано, что инфективной единицей PrPSc является олигомер с высоким содержанием структуры, который может превращаться в нормальный белок путем интеграции его в растущий агрегат,где он приобретает свойства, присущие патологической форме (резистентность к протеазам и нерастворимость) (Jarrett and Lansbury, Jr., 1993, Caughey et al., 1997). После инкубирования двух форм PrP, олигомерные виды увеличивают свой размер за счет привлечения и трансформирования молекул PrPC. Данный процесс имеет низкую эффективность, поскольку он зависит от фиксированного количества олигомеров, растущих по концам. Количество конвертирующих единиц не возрастает в ходе реакции, в течение которой они только становятся больше по размеру. Предполагают, что данный процесс представляет собой то, что происходит в организме животного или человека после инфицирования; процесс, который,как известно, занимает месяцы или даже несколько лет. В данном изобретении заявители описывают процедуру разрушения олигомеров на более мелкие молекулы, каждая из которых затем способна конвертировать РrPC. Таким образом, данную систему непосредственно используют для диагностики конформационных заболеваний и, в частности, трансмиссивных конформационных заболеваний, таких как TSE, путем амплификации не выявляемых другими методами количеств PrPSc в различных тканях или биологических жидкостях. Данная система может позволить раннее выявление людей, входящих в группу риска развития TSE, и могла бы быть также весьма полезной для биохимического контролирования эффективности лекарственных средств для лечения TSE в ходе клинических испытаний. Согласно предпочтительному варианту осуществления настоящего изобретения, образец, подлежащий анализу, проходит стадию "предварительной обработки", целью которой является "избирательное концентрирование" в образце патогенного конформера, который необходимо обнаружить. В случае TSE,как сообщается, и PrPC, и PrPSc располагаются в особом участке плазматической мембраны, которая является резистентной к обработке мягкими детергентами (такими как ледяной тритон X-100), благодаря относительно высокому содержанию холестерина и гликосфинголипидов (М. Vey et al., 1996). Указанные мембранные домены называют жировыми массами или устойчивыми к детергентам мембранами(DRM) или кавеолаподобными доменами (CLD), и они имеют высокое содержание сигнальных белков,рецепторов и GPI-якорных белков. Заявители подтвердили, что 100% PrPC в головном мозге находятся в данной фракции, которая содержит 2% всех белков (см. пример 6 и фиг. 7). Таким образом, простая стадия выделения жировых масс из образца позволяет осуществить выраженное обогащение содержанияPrPC. Сходные результаты были получены заявителем в отношении выделения жировых масс из гомогената головного мозга при scrapie, из которых был получен PrPSc. Таким образом, один вариант осуществления настоящего изобретения включает в себя стадию, во время которой образец, подлежащий анализу, проходит стадию предварительной обработки для избирательного концентрирования в образце патогенного конформера. Предпочтительно, чтобы патогенным конформером являлся PrPSc, предварительная обработка представляет собой экстрагирование из образца фракции, которая является нерастворимой в мягких детергентах. Стадии (i) и (ia) предпочтительно выполняют в физиологических условиях (рН, температура и концентрация ионов) и более предпочтительно, чтобы к раствору также добавлялись ингибиторы протеаз и детергенты. Условия следует выбирать таким образом, чтобы позволить любому патогенному конформеру, если он имеется в образце, конвертировать непатогенный конформер в патогенный конформер, образуя, таким образом, агрегат или олигомер патогенных конформеров. Подходящие физиологические условия легко определит специалист. Продолжительность инкубации во времени будет такой, чтобы позволить некоторому количеству,суммарному количеству или значительной части непатогенного конформера превратиться в патогенный конформер, если предположить, что в образце имеется некоторое количество патогенного конформера. Специалисту легко определить указанное время. Предпочтительно, чтобы каждая инкубация составляла от 1 мин до 4 ч, наиболее предпочтительно от 30 мин до 1 ч и особенно предпочтительно приблизительно 60 мин. Стадия инкубации (ia) может также включать в себя дополнительную стадию (ib), которая включает в себя добавление дополнительного количества непатогенного конформера. Для дезагрегирования агрегатов во время стадии (ii) способа согласно изобретению можно использовать различные способы. Они включают в себя следующее: обработку растворителями (такими как додецилсульфат натрия, диметилсульфоксид, ацетонитрил, гуанидин, мочевина, трифторэтанол, разбавленная трифторуксусная кислота, разбавленная муравьиная кислота и т.п.), модификацию физикохимических свойств раствора, таких как рН, температура, концентрация ионов, диэлектрическая постоянная, и физические методы, такие как обработка ультразвуком, облучение лазером, замораживание/оттаивание, французский пресс, автоклавирование, высокое давление, перемешивание, мягкая гомогенизация, другие виды облучения и т.п. Согласно настоящему изобретению обработка ультразвуком является предпочтительным способом. Дезагрегацию можно осуществлять в течение такого времени, за которое происходит дезагрегация некоторого количества, всего количества или значительной части агрегатов, которые образовались в течение стадии (ii). Нет необходимости в дезагрегации всех агрегатов на любой стадии дезагрегации. При-4 007391 таком способе количество конвертирующих единиц увеличивается на каждой стадии дезагрегации. Время дезагрегации легко определит специалист, и оно может зависеть от используемого способа дезагрегации. Предпочтительно дезагрегацию осуществляют в течение периода времени от 1 с до 60 мин,наиболее предпочтительно от 5 с до 30 мин и особенно предпочтительно от 5 с до 10 мин. Если дезагрегацию осуществляют посредством ультразвуковой обработки, то она продолжается предпочтительно от 5 с до 5 мин и наиболее предпочтительно от 5 до 30 с. Обработку ультразвуком применяли ранее как часть некоторых способов очистки PrP с целью повышения растворимости больших агрегатов, но ее никогда не описывали как способ амплификации конверсии PrP in vitro. Применение традиционного ультразвукового устройства с одним зондом сталкивается с проблемой обработки множества образцов одновременно, как это потребует диагностический тест. В продаже имеются ультразвуковые устройства с форматом 96-луночных микротитрационных планшетов, которые обеспечивают ультразвуковую обработку всех лунок в одно и то же время и могут программироваться на автоматическую работу. Указанные ультразвуковые устройства можно легко адаптировать для использования в диагностическом способе согласно изобретению. Таким образом, один вариант осуществления настоящего изобретения относится к применению на стадии (ii) многолуночного ультразвукового устройства. Выявление вновь конвертированного патогенного конформера, например PrPSc, (iii) после процедуры циклической амплификации, описанной на стадиях (i)-(ii), можно осуществлять согласно любому из известных способов. Специфическое выявление PrPSc обычно (но не всегда, см. ниже) происходит на первой стадии разделения двух изоформ PrP (нормального белка и патогенного белка). Разделение осуществляют на основе своеобразных биохимических свойств PrPSc, которые отличают его от большинства нормальных белков организма, а именно PrPSc является частично устойчивым к обработке протеазами, и он не растворяется даже в присутствии неденатурирующих детергентов. Следовательно, первой стадией после процедуры амплификации обычно является удаление или отделение PrPC из образца посредством обработки протеазами или посредством ценитрифугирования для отделения растворимого белка (PrPC) от нерастворимого (PrPSc). После этого выявление PrPSc можно осуществлять, помимо прочих, любым из следующих способов: А). Иммуноблоттингом после SDS-PAGE. Это осуществляют посредством обычной процедуры, хорошо известной специалистам, и с использованием некоторых из многих коммерчески доступных антиPrP-антител.B). Анализом ELISA. Твердофазное выявление можно осуществлять как с помощью простого анализа, при котором образцы помещают на планшет, после чего выявляют количество PrPSc с использованием анти-PrP-антител или более предпочтительно с помощью сандвича ELISA, при котором планшет сначала покрывают анти-PrP-антителом, которое специфичным образом захватывает PrP из образца, который затем выявляют, используя второе анти-PrP-антитело. Обе формы ELISA можно также использовать с меченными (радиоактивность, флуоресценция, биотин и т.п.) анти-PrP-антителами, для дальнейшего повышения чувствительности выявления.C). Радиоактивными исследованиями. Нормальный PrPC, используемый в качестве субстрата для процедуры амплификации, можно пометить радиоактивными изотопами (3 Н, 14 С, 35S, 125I и т.п.) перед началом процедуры, и после удаления неконвертированного PrPC можно количественно определить радиоактивность вновь конвертированного PrPSc. Данная процедура является более количественной и не рассчитана на использование антител.D). Флуоресцентными анализами. Нормальный PrPC, используемый в качестве субстрата для процедуры амплификации, можно пометить флуоресцентными зондами перед началом процедуры и после удаления неконвертированного PrPC можно количественно определить флуоресценцию вновь конвертированного PrPSc. Возможно, что флуоресцентный анализ может не потребовать удаления неконвертированного PrPC, поскольку флуоресцентные свойства PrPC и PrPSc могут быть различными в силу отчетливой конформации двух указанных изоформ.E). Агрегационными анализами. Хорошо известно, что PrPSc (но не PrPC) способен агрегировать,образуя амилоидные волокна или структуры типа палочек. Следовательно, выявление PrPSc можно было бы осуществить с помощью способов, используемых для количественного определения образования данных типов агрегатов, включая электронную микроскопию, окрашивание специфичными красителями(Конго красным, тиофлавином S и Т и т.п.) и нефелометрическими анализами. Агрегационные анализы не требуют стадии разделения двух изоформ, поскольку нормальный PrPC не агрегирует.F). Структурными анализами. Наиболее важным различием между нормальным и патогенным PrP является их вторичная и третичная структуры. Следовательно, можно использовать способы, которые позволяют оценить структуру белков, включая ЯМР, циркулярный дихроизм, трансформированную по Фурье инфракрасную спектроскопию, спектроскопию комбинационного рассеяния, внутреннюю флуоресценцию, УФ-поглощение и т.п. Наиболее часто используемым моноклональным антителом против PrP является "3F4" (Kascsak etal., 1987), которое получено у мышей, иммунизированных 262 К PrPres хомяка (резистентным к протеа-5 007391 зам конформером). Указанное антитело также способно распознавать непатогенный конформер из головного мозга хомяка и человека, но не крупного рогатого скота, мыши, крысы, овцы или кролика; оно также способно связываться с патогенным конформером человека, но только после денатурации указанного белка. Подобные антитела можно пометить, чтобы обеспечить легкое выявление маркера. Например, некоторые ученые используют временные измерения флуоресценции с использованием меченного европием антитела 3F4 (Safar et al., 1998). Описанные выше способы выявления можно использовать для выявления других патогенных конформеров, например патогенных форм -амилоидного белка, и наоборот. В альтернативном варианте осуществления настоящего изобретения добавленный в избыточном количестве непатогенный конформер может быть помечен и может поддаваться выявлению, таким образом, что количество неагрегированного конформера к концу исследования позволит определить количество патогенного конформера, который исходно присутствовал в образце. Согласно еще одному альтернативному варианту осуществления настоящего изобретения, патогенный конформер (маркер) можно было бы выявлять с помощью антитела, направленного против него. В более широком аспекте можно добавлять метку или метящий фрагмент к патогенному конформеру, непатогенному конформеру или к антителу против одного из конформеров в зависимости от рода выполняемого анализа. Другой целью настоящего изобретения является анализ на наличие маркера конформационного заболевания, которое характеризуется конформационным превращением лежащего в его основе белка из непатогенного в патогенный конформер, в образце; указанный анализ включает в себя следующие стадии: (i) контактирование указанного образца с некоторым количеством непатогенного конформера; (ii) дезагрегацию любых агрегатов, образующихся в конечном итоге во время стадии (i), и (iii) определение наличия и/или количества в образце указанного патогенного конформера. В общем, патогенный конформер будет представлять собой маркер наличия указанного заболевания. Предпочтительно, чтобы стадия (i) включала в себя стадию (ia), во время которой происходит инкубирование указанного образца/непатогенного конформера. Согласно предпочтительному варианту осуществления настоящего изобретения стадии (ia) и (ii) образуют цикл, который повторяется по меньшей мере дважды до выполнения стадии (iii). Более предпочтительно, если циклы повторяются от 5 до 40 раз и наиболее предпочтительно 5-20 раз. Еще одной целью настоящего изобретения является диагностический набор для применения в описанном анализе, который включает в себя определенное количество непатогенного конформера и, необязательно, дополнительно микротитрационный планшет и многолуночное ультразвуковое устройство. С использованием способа согласно изобретению возможно выявление от 1 до 10 фг патогенного конформера, исходно присутствующего в образце, что эквивалентно от 3 до 3010-20 моль. Образец обычно будет представлять собой биологический образец или ткань, и любой указанный биологический образец или ткань можно исследовать с помощью способа согласно изобретению. В случае ткани анализ и способ согласно изобретению можно выполнять на гомогенатах или непосредственно на образцах ех vivo. Указанные способы и анализы обычно будут выполняться на образцах ex vivo или invitro. Предпочтительно, когда образец представляет собой биологическую жидкость, такую как кровь,лимфа, моча или молоко; ткань головного мозга, спинной мозг, тонзиллярную ткань или ткань аппендикса; образец, полученный из крови, такой как гемолизированные эритроциты или препараты лейкоцитарной пленки; или препарат плазматических мембран, такой как жировая масса, устойчивые к детергентам мембраны или кавеолаподобные домены. Альтернативно, образец может представлять собой композицию, включающую в себя соединение (особенно белок), полученное у человека или животного, такое как гормон роста или тканевый экстракт, такой как экстракт гипофиза. Такая композиция образца может быть контаминирована патогенным конформером. Образец также может включать в себя пищевой продукт или напиток или часть пищевого продукта или напитка (предназначенных для потребления человеком или животными) с целью установления наличия или отсутствия патогенного конформера в данном продукте или напитке. Предпочтительно, чтобы непатогенный конформер, добавленный на стадии (i), был того же вида,что и сам образец. Он может быть получен, например, из здоровой (т.е. непатогенной) формы (например,ткани) биологического образца, подлежащего анализу. Альтернативно, непатогенный конформер может быть получен синтетическим или рекомбинантным путем с использованием средств, известных специалистам. Следует понимать, однако, что непатогенный конформер необязательно должен быть в чистой или даже практически чистой форме. В большинстве случаев непатогенный конформер будет в форме гомогената ткани или его фракции, которые содержат указанный непатогенный конформер. Предпочтительные примеры включают в себя гомогенаты головного мозга и полученные из него фракции, например жировые массы. Предпочтительно образец и/или непатогенный конформер будут происходить от человека или до-6 007391 машнего животного, например коровы, овцы, козы или кошки. Другой целью настоящего изобретения является создание способа идентификации соединения, которое модулирует конформационное превращение лежащего в основе заболевания белка, из непатогенного в патогенный конформер, включающего в себя:(i) контактирование некоторого количества непатогенного конформера с некоторым количеством патогенного конформера в присутствии или в отсутствие указанного соединения,(ii) дезагрегацию любых агрегатов, образующихся в конечном итоге во время стадии (i),(iii) определение количества патогенного конформера в присутствии или в отсутствие указанного соединения. Если желательно, стадия (i) может включать в себя стадию (ia), во время которой происходит инкубирование указанного образца/непатогенного конформера, и цикл, который осуществляют между стадиями (ia) и (ii), как описано выше для способов и анализов согласно изобретению, и наоборот. Если количество патогенного конфомера, измеренное в присутствии указанного соединения, больше, чем количество, измеренное в его отсутствии, это означает, что данное соединение представляет собой фактор, который "катализирует" конформационное превращение; если указанное количество меньше, это означает, что данное соединение представляет собой фактор, который ингибирует указанное превращение. Согласно описанному выше способу "идентификацию" следует также интерпретировать как "скрининг" ряда соединений."Метка" или "метящая часть" может представлять собой любое соединение, применяемое в качестве средства выявления белка. Метка или метящая часть может быть присоединена к белку посредством ионных или ковалентных взаимодействий, водородной связи, электростатических взаимодействий или интеркаляции. Примеры меток или метящих частей включают в себя - без ограничения - конъюгаты с флуоресцентными красками, биотин, дигоксигенин, радионуклеотиды, хемилюминесцентные вещества,ферменты и рецепторы таким образом, что выявление меченого белка происходит путем флуоресценции,конъюгации со стрептавидином и/или авидином, количественного определения радиоактивности или хемилюминесценции, каталитических и/или лиганд-рецепторных взаимодействий. Предпочтительной меткой является флуоресцентная или фосфоресцентная метка. Термин "конформационные заболевания" относится к группе заболеваний, возникающих вследствие распространения аберрантного конформационного превращения лежащего в их основе белка, что приводит к агрегации белка и его депонированию в тканях. Указанные заболевания могут также передаваться посредством индуцированного конформационного изменения, распространяться от патогенного конформера к его нормальному или непатогенному конформеру, и в этом случае их в настоящем документе называют "трансмиссивными конформационными заболеваниями". Примерами указанных видов заболеваний являются прионные энцефалопатии, включая спонгиформную энцефалопатию крупного рогатого скота (BSE) и ее человеческий эквивалент, болезнь Крейтцфельда-Якоба (CJD), при которых лежащим в их основе белком является PrP. Термин "спорадическая CJD", сокращенно "sCJD", относится к наиболее распространенному проявлению болезни Крейтцфельда-Якоба (CJD). Данное заболевание наблюдается спонтанно у индивидуумов среднего возраста приблизительно 60 лет, с частотой 1 случай на миллион человек в год во всем мире. Термин "ятрогенная CJD", сокращенно "iCJD", относится к заболеванию, вызываемому случайным инфицированием людей человеческими прионами. Наиболее заметным примером такого заболевания является случайное инфицирование детей человеческими прионами из контаминированных препаратов человеческого гормона роста. Термин "семейная CJD" относится к CJD, которая редко наблюдается в семьях и неизбежно вызывается мутациями гена человеческого прионного белка. Заболевание происходит вследствие аутосомнодоминантного нарушения. Члены семьи, которые унаследовали указанные мутации, умирают от CJD. Термин "болезнь Гертсманна-Штрасслера-Шейнкера", сокращенно "GSS", относится к форме наследственного прионного заболевания человека. Указанное заболевание наблюдается вследствие аутосомно-доминантного нарушения. Члены семьи, которые унаследовали мутантный ген, умирают от GSS. Термин "прион" будет означать трансмиссивную частицу, которая, как известно, вызывает группу указанных трансмиссивных конформационных заболеваний (спонгиформные энцефалопатии) у людей и животных. Термин "прион" представляет собой сокращение слов "белок" и "инфекция", а частицы составлены преимущественно, если не исключительно, из молекул PrPSc. Прионы отличаются от бактерий, вирусов и вироидов. Известные прионы включают в себя такие прионы, которые инфицируют животных, вызывая scrapie (почесуху), трансмиссивное дегенеративное заболевание нервной системы овец и коз, а также спонгиформную энцефалопатию крупного рогатого скота (BSE) или коровье бешенство и спонгиформные энцефалопатии кошек. Известны следующие четыре прионные заболевания, поражающие человека: (1) куру, (2) болезнь Крейтцфельда-Якоба (CJD), (3) болезнь Гертсманна-Штрасслера-Шейнкера (GSS) и (4) фатальная семейная бессонница (FFI). Используемый в настоящем документе термин прион включает в себя все формы прионов, вызывающие все или любое из указанных заболеваний или другие заболевания у любых животных и, в частности, у людей-7 007391 и сельскохозяйственных животных. Термины "ген PrP" и "ген прионного белка" используются в настоящем документе взаимозаменяемым образом для описания генетического материала, который экспрессирует прионные белки и полиморфизмы, а также мутации, такие, которые перечислены в настоящем документе под подзаголовком"Патогенные мутации и полиморфизмы". Ген PrP может быть от любого животного, включая "хозяина" и"экспериментальных" животных, описанных в настоящем документе, и представлять собой любые и все его полиморфизмы и мутации; признано, что указанные термины включают в себя гены, не являющиеся геном PrP, которые еще предстоит открыть. Термин "ген PrP" относится, главным образом, к любому гену любого вида, который кодирует любую форму аминокислотных последовательностей PrP, включая любой прионный белок. Некоторые общеизвестные последовательности PrP описаны в работе Gabriel et al., 1992, включенной в настоящий документ в качестве ссылки для раскрытия и описания указанных последовательностей. Аббревиатуры, используемые в настоящем документе, включают в себя следующие: ЦНС (CNS) - центральная нервная система;BSE - спонгиформная энцефалопатия крупного рогатого скота;PrPС - нормальный непатогенный конформер PrP;PrPSc - патогенная или "scrapie" - изоформа PrP (которая также является маркером прионных заболеваний). Патогенные мутации и полиморфизмы Существует ряд известных патогенных мутаций в гене человеческого PrP. Кроме того, существуют известные полиморфизмы в генах PrP человека, овцы и крупного рогатого скота. Следующее представляет собой неограничивающий перечень указанных мутаций и полиморфизмов. Таблица мутаций Патогенные человеческие Человеческие Полиморфизмы Полиморфизмы крупмутации полиморфизмы овцы ного рогатого скота Вставка 2 октаповтора Кодон 129 Кодон 171 5 или 6 Вставка 4 октаповторовAla/Val Вставка 7 октаповторов Вставка 8 октаповторов Вставка 9 октаповторов Кодон 102 Pro-Leu Кодон 105 Pro-Leu Кодон 117 Ala-Val Кодон 145 стоп Кодон 178 Asp-Asn Кодон 180 Val-Ile Кодон 198 Phe-Ser Кодон 200 Glu-Lys Кодон 210 Val-Ile Кодон 217 Asn-Arg Кодон 232 Met-Ala Нормальную аминокислотную последовательность, которая наблюдается у подавляющего большинства индивидуумов, называют последовательностью PrP дикого типа. Указанная последовательность дикого типа подвергается определенным характерным полиморфным изменениям. В случае человеческого PrP, две полиморфные аминокислоты наблюдаются по остаткам 129 (Met/Val) и 219 (Glu/Lys). PrP овцы имеет два аминокислотных полиморфизма по остаткам 171 и 136, в то время как PrP крупного рогатого скота имеет пять или шесть повторов последовательности из восьми аминокислот в аминоконцевом участке зрелого прионного белка. Несмотря на то, что сами по себе данные полиморфизмы не являются патогенными, они, как представляется, влияют на прионные заболевания. Были идентифицированы определенные мутации гена человеческого PrP, отличающиеся от указанных нормальных вариаций прионных белков дикого типа, которые изменяют специфичные аминокислотные остатки PrP или количество октаповторов, и которые отличаются от наследственных человеческих прионных заболеваний. С целью дальнейшего осмысления приведенной выше карты, демонстрирующей мутации и поли-8 007391 морфизмы, можно обратиться к опубликованным последовательностям генов PrP. Например, раскрыты и опубликованы у Gabriel et al., 1992, гены PrP курицы, крупного рогатого скота, овцы, крысы и мыши. Последовательность гена PrP сирийского хомячка опубликована Goldmann et al., 1990. Последовательность гена PrP у крупного рогатого скота опубликована Goldmann et al., 1991. Последовательность генаPrP курицы опубликована Harris et al., 1991. Последовательность гена PrP норки опубликована Kretzschmar et al., 1992. Последовательность гена PrP человека опубликована Kretzschmar et al., 1986. Последовательность гена PrP мыши опубликована Locht et al., 1986. Последовательность гена PrP овцы опубликована Westaway et al., 1994. Данные публикации включены в настоящий документ в качестве ссылки для раскрытия и описания гена PrP и аминокислотной последовательности PrP. Настоящее изобретение относится также к способу выявления наличия патогенной формы прионного белка в образце (предпочтительно в образце крови или головного мозга), включающему в себя:(i) контактирование образца с некоторым количеством непатогенного прионного белка;(ii) дезагрегация любых агрегатов, образующихся во время стадии (ia); повторение стадий (ia)-(ii) два или более раз; а затем(iii) определение наличия и/или количества в образце патогенного прионного белка. Еще один вариант осуществления настоящего изобретения относится к способу диагностики CJD у пациента, включающему в себя: взятие образца (предпочтительно образца крови или головного мозга) у пациента;(i) контактирование образца с некоторым количеством белка PrPС;(ii) дезагрегацию любых агрегатов, образующихся во время стадии (ia); повторение стадий (ia)-(ii) два или более раз; а затем(iii) определение наличия и/или количества PrPSc в образце. Настоящее изобретение относится также к способу выявления наличия патогенной формы амилоидного белка в образце (предпочтительно в образце крови или головного мозга), включающему в себя:(i) контактирование образца с некоторым количеством непатогенного -амилоидного белка;(ii) дезагрегацию любых агрегатов, образующихся во время стадии (ia); повторение стадий (ia)-(ii) два или более раз; а затем(iii) определение наличия и/или количества в образце патогенного -амилоидного белка. Еще один вариант осуществления настоящего изобретения относится к способу диагностики болезни Альцгеймера у пациента, включающему в себя: взятие образца (предпочтительно образца крови или головного мозга) у пациента;(i) контактирование образца с некоторым количеством непатогенного -амилоидного белка;(ii) дезагрегацию любых агрегатов, образующихся во время стадии (ia); повторение стадий (ia)-(ii) два или более раз; а затем(iii) определение наличия и/или количества в образце патогенного -амилоидного белка. Настоящее изобретение относится также к аппарату для применения в способах, описанных выше,особенно к аппарату, включающему в себя микротитрационный планшет, многолуночное ультразвуковое устройство и некоторое количество непатогенного конформера. Еще один вариант осуществления настоящего изобретения относится к способу диагностического выявления конформационного заболевания, которое характеризуется конформационным превращением лежащего в его основе белка из непатогенного в патогенный конформер, путем анализа образца на наличие маркера указанного заболевания; указанный способ включает в себя:(i) контактирование указанного образца с известным количеством непатогенного конформера;(ii) дезагрегацию любых агрегатов, образующихся в конечном итоге во время стадии (i), и(iii) определение наличия и/или количества в образце указанного патогенного конформера. Предпочтительно, если стадии (i) и (ii) образуют цикл, который повторяется по меньшей мере дважды до выполнения стадии (iii), наиболее предпочтительно, если стадии (i) и (ii) образуют цикл, который повторяется от 5 до 40 раз до выполнения стадии (iii). Настоящее изобретение относится также к анализу на наличие маркера конформационного заболевания, которое характеризуется конформационным превращением лежащего в его основе белка из непатогенного и патогенный конформер в образце, при этом указанный анализ включает в себя следующие стадии:(i) контактирование указанного образца с известным количеством непатогенного конформера;(ii) дезагрегацию любых агрегатов, образующихся в конечном итоге во время стадии (i), и(iii) определение наличия и/или количества в образце указанного патогенного конформера. Пред-9 007391 почтительно, чтобы стадии (i) и (ii) образовали цикл, который повторяется по меньшей мере дважды до выполнения стадии (iii). Настоящее изобретение относится также к способу идентификации соединения, которое модулирует конформационное превращение лежащего в основе заболевания белка из непатогенного в патогенный конформер, включающему в себя:(i) контактирование известного количества непатогенного конформера с известным количеством патогенного конформера в присутствии или в отсутствие указанного соединения,(ii) дезагрегацию любых агрегатов, образующихся в конечном итоге во время стадии (i),(iii) определение количества патогенного конформера в присутствии или в отсутствие указанного соединения. Настоящее изобретение описано со ссылками на конкретные варианты осуществления настоящего изобретения, но содержание описания включает в себя все модификации и замены, которые могут быть сделаны специалистом, без отступления от смысла и цели формулы изобретения. Настоящее изобретение далее будет описано с использованием следующих примеров, которые не должны истолковываться как ограничивающие каким бы то ни было образом настоящее изобретения. В примерах будут встречаться ссылки на фигуры, описанные ниже в настоящем документе. Описание фигур Фиг. 1. Схематическое изображение превращения PrPCPrPSc. Инфективной единицей PrPSc является олигомер с высоким содержанием -складчатой структуры, который конвертирует PrPC путем включения его в растущий агрегат, где он приобретает свойства, связанные с PrPSc. Фиг. 2. Диаграмма, изображающая процедуру циклической амплификации. Система основана на циклах инкубирования PrPSc в присутствии избытка PrPC, с последующими циклами ультразвукового воздействия. Во время периодов инкубирования олигомерный PrPSc увеличивается в размерах за счет включения PrPC в растущий агрегат, а во время ультразвукового воздействия агрегаты разрушают, чтобы увеличить количество конвертирующих единиц. На представленной фигуре показано два цикла ультразвукового воздействия/инкубирования. Фиг 3. Амплификация PrPSc посредством циклов ультразвукового воздействия. Небольшое количество гомогената пораженного scrapie головного мозга, содержавшего PrPSc, инкубировали с гомогенатом головного мозга здоровой крысы (полоса 1, контрольный опыт) или с гомогенатом головного мозга здорового хомячка (полоса 2 и 3). Последний образец разделяли на две группы, одну из которых подвергали пяти циклам инкубирования/ультразвукового воздействия (полоса 3). Половину указанных образцов загружали непосредственно в гель и окрашивали на общий белок красителем кумасси (панель А). Другую половину обрабатывали РК и подвергали иммуноблоттингу с использованием анти-PrP-антитела 3F4(панель В). Панель С показывает некоторые контроли, в которых гомогенат здорового головного мозга инкубировали отдельно (полосы 1 и 2) или в присутствии разбавленного гомогената пораженного scrapie головного мозга (полосы 3 и 4). Половину образцов (полосы 2 и 4) подвергали 5 циклам ультразвукового воздействия/инкубирования. Полосы 2, 3 и 4 обрабатывали протеиназой К. Фиг 4. Чувствительность системы циклической амплификации. Изучали минимальную концентрацию PrPSc, которая может быть выявлена после амплификации, посредством серийных разведений гомогената пораженного scrapie головного мозга, и инкубирования его с гомогенатом головного мозга здорового хомячка с циклами ультразвуковой обработки или без них. Панель А показывает контрольный опыт,в котором пораженный scrapie головной мозг хомячка подвергали серийным разведениям в гомогенате головного мозга крысы. Панель В соответствует эксперименту, в котором серийные разведения пораженного scrapie головного мозга хомячка инкубировали с головным мозгом здорового хомячка и подвергали 5 циклам инкубирования/ультразвукового воздействия. Денситометрическая оценка иммуноблоттов в А и В показана на панели С. Разведения, которые производили, считая исходным материалом головной мозг, были следующими: 100 (полоса 1), 200 (полоса 2), 400 (полоса 3), 800 (полоса 4), 1600 (полоса 5) и 3200 (полоса 6). Фиг 5. Зависимость сигнала PrPres от количества циклов амплификации. Разбавленный гомогенат пораженного scrapie головного мозга инкубировали с избытком гомогената головного мозга здорового хомячка. Образцы подвергали 0, 5, 10, 20 или 40 циклам, и оценивали сигнал PrPres посредством иммуноблоттинга. Фиг 6. Амплификация PrPSc в образцах крови. В гепаринизированную кровь крысы помещали гомогенат пораженного scrapie головного мозга хомячка до достижения конечного разведения 10:1. Указанную смесь инкубировали в течение 15 мин при комнатной температуре. Данный материал подвергали 10 кратным серийным разведениям, используя гепаринизированную кровь крысы. Образцы подвергали 11 циклам инкубирования-ультразвукового воздействия, и оценивали сигнал PrPres посредством иммуноблоттинга. Фиг. 7. Прионный белок присутствует в жировых массах. Жировые массы (также называемые устойчивой к детергентам мембранной фракцией или DRM) выделяли, используя ранее описанные протоколы. 100 мг ткани головного мозга гомогенизировали в 1 мл PBS, содержавшего 1% тритона Х-100 и 1 х- 10007391 полного коктейля ингибиторов протеаз (Boehringer). Ткань гомогенизировали посредством 10 пассажей через иглу для шприца 22G и инкубировали в течение 30 мин при 4 С на ротационной мешалке. Образец разбавляли 1:2 в 60% сахарозе и помещали на дно центрифужной пробирки. Поверх образца осторожно наслаивали 7 мл 35% сахарозы. Поверх градиента наслаивали 1,5 мл 15% сахарозы. Пробирку центрифугировали при 150 000 g в течение 18 ч при 4 С. Жировые массы всплывали на поверхности раздела 1535% сахарозы (панель А). Различные фракции собирали и анализировали на общий белок с окрашиванием нитратом серебра (панель В) и подвергали иммуноблоттингу для выявления PrP (панель С). Для удаления сахарозы из образца фракцию жировых масс выделяли, промывали в PBS и центрифугировали при 28000 об./мин в течение 1 ч при 4 С. Центрифужный осадок промывали и ресуспендировали в PBS, содержавшем 0,5% тритона Х-100, 0,5% SDS и ингибиторы протеаз. Весь PrPС локализовался в данной фракции (панель D). Фиг. 8. Факторы, необходимые для амплификации, присутствуют в жировых массах. Жировые массы выделяли из головного мозга здорового хомячка, как описано на фиг. 2, и смешивали с разбавленным в 700 раз PrPSc высокой очистки из пораженного scrapie головного мозга хомячка. Образцы замораживали (полоса 3) или амплифицировали в течение 20 ч (полоса 4). Полосы 1 и 2 представляют те же процедуры, но с использованием для амплификации тотального гомогената головного мозга. Фиг. 9. Пресимптоматическое выявление PrPSc в головном мозге хомячка. Хомячкам интрацеребрально (и/ц) инокулировали физиологический раствор (контрольная группа) или разбавленный в 100 раз гомогенат пораженного scrapie головного мозга. Еженедельно по 4 хомячка из каждой группы умерщвляли, а головной мозг извлекали и гомогенизировали. Половину образцов немедленно замораживали (белые столбики), а другую половину подвергали 20 циклам инкубирования/ультразвукового воздействия(черные столбики). Все образцы обрабатывали РК и подвергали 28 иммуноблоттингу. Интенсивность полос оценивали посредством денситометрии. Каждый столбик представляет среднюю величину для образцов от 4 животных. В контрольных образцах головного мозга выявления не было, как без амплификации, так и с амплификацией, и данные результаты не показаны на фигуре. Фиг. 10. Амплификация человеческого PrPSc. Проводились исследования с использованием образцов головного мозга от 11 различных подтвержденных случаев спорадической CJD, а также от 5 случаев семейной CJD и 4 подобранных по возрасту контролей, которые включали в себя пациентов, страдавших другими неврологическими расстройствами. Головной мозг гомогенизировали и подвергали 20 циклам амплификации. Репрезентативные результаты контроля (А) и трех различных случаев спорадическойCJD (В) (1, 2, 3) представлены на фигуре. Фиг. 11. Выявление PrPSc в крови после получения гемолизированных эритроцитов. Гемолизированные эритроциты из 0,5 мл гепаринизированной крови здоровых (С) и пораженных scrapie хомячков(Sc) получали, как описано в данном тексте. Половину образцов не подвергали амплификации, а другую половину смешивали с гомогенатом нормального головного мозга хомячка и подвергали 20 циклам амплификации. Все образцы затем обрабатывали РК и анализировали посредством иммуноблоттинга. Один репрезентативный эксперимент показан на фигуре. Фиг. 12. Выявление PrPSc в крови после экстракции саркозилом. 0,5 мл гепаринизированной крови здоровых (С) и пораженных scrapie хомячков (Sc) подвергали экстракции саркозилом, как описано в данном тексте. Половину образцов не подвергали амплификации, а другую половину смешивали с гомогенатом нормального головного мозга хомячка и подвергали 20 циклам амплификации. Все образцы затем обрабатывали РК и анализировали посредством иммуноблоттинга. Один репрезентативный образец от контрольных животных и два от пораженных scrapie животных показаны на фигуре. Фиг. 13. Выявление PrPSc в крови после выделения жировых масс. Жировые массы экстрагировали,как описано в тексте, из 0,5 мл гепаринизированной крови здоровых (С) и пораженных 29 scrapie хомячков (Sc). Половину образцов не подвергали амплификации, а другую половину смешивали с гомогенатом нормального головного мозга хомячка и подвергали 20 циклам амплификации. Все образцы затем обрабатывали РК и анализировали посредством иммуноблоттинга. Один репрезентативный образец от контрольных животных и два от пораженных scrapie животных показаны на фигуре. Фиг. 14. Выявление PrPSc в крови после получения лейкоцитных пленок. Фракцию лейкоцитной пленки крови отделяли центрифугированием из 0,5 мл гепаринизированной крови здоровых (С) и пораженных scrapie хомячков (Sc). Половину образцов не подвергали амплификации, а другую половину смешивали с гомогенатом нормального головного мозга хомячка и подвергали 20 циклам амплификации. Все образцы затем обрабатывали РK и анализировали посредством иммуноблоттинга. Один репрезентативный эксперимент показан на фигуре. Примеры Пример 1. Амплификация резистентного к РK PrP посредством циклической конверсии in vitro. Гомогенат головного мозга хомяка, извлеченный из пораженных scrapie животных, разбавляли до тех пор, пока сигнал PrPSc едва выявлялся иммуноблоттингом после обработки протеиназой K (РК) (фиг. 3 В, полоса 1). Обработка РК производилась обычным способом для различения нормальных и патологических форм PrP, которые отличаются по своей чувствительности к расщеплению под действием протеаз(PrPSc является частично резистентным, а PrPC расщепляется) (Prusiner, 1991). Форма PrP, которая являет- 11007391 ся резистентной к воздействию РК, будет далее называться PrPres. Инкубирование образца разбавленного гомогената пораженного scrapie головного мозга с гомогенатом головного мозга здорового хомячка,содержавшим избыток PrPC, приводило к возрастанию сигнала PrPres (фиг. 3 В, полоса 2). Это позволяет предположить, что инкубирование двух гомогенатов головного мозга приводит к конверсии PrPC в PrPSc. Когда образцы инкубировали в тех же условиях, но подвергали пяти циклам инкубирования/ультразвукового воздействия, количество PrPres резко увеличивалось (фиг. 3 В, полоса 3). Денситометрический анализ иммуноблотта показывает, что сигнал PrPres возрастал в 84 раза в результате циклической амплификации по сравнению с сигналом PrPres, присутствующим в разбавленном гомогенате пораженного scrapie головного мозга (полоса 1). Конверсия зависит от наличия PrPSc, поскольку PrPres не наблюдался, когда нормальные гомогенаты головного мозга инкубировали в отдельности в тех же условиях как с ультразвуковым воздействием,так и без него (фиг. 3 С, полоса 2). Для устранения артефактов превращения количество общего белка,загруженного в гель, поддерживали на постоянном уровне (фиг. 3 А) добавлением гомогената головного мозга крысы к разбавленному образцу пораженного scrapie головного мозга, пользуясь тем, что PrP крысы не выявляется антителом, используемым для иммуноблоттинга. Пример 2. Чувствительность, выявления посредством циклической амплификации. Для оценки минимальной концентрации PrPSc, которая может быть выявлена после амплификации,гомогенат пораженного scrapie головного мозга подвергали серийному разведению непосредственно в гомогенате головного мозга здорового хомячка. Без инкубирования сигнал PrPres прогрессивно уменьшался до тех пор, пока не становился абсолютно невыявляемым при 800-кратном разведении (фиг. 4 А,С). Напротив, когда то же разведение инкубировали с гомогенатом головного мозга здорового хомячка и подвергали 5 циклам инкубирования/ультразвукового воздействия, предел выявления PrPres резко снижался. Действительно, четкий сигнал легко выявлялся даже при 3200-кратном разведении (фиг. 4 В, С). Пример 3. Экспоненциальное возрастание PrPres с увеличением количества циклов. Для того чтобы выяснить, зависит ли интенсивность сигнала PrPres после циклической амплификации от количества выполненных циклов инкубирования/ультразвукового воздействия, разбавленный гомогенат пораженного scrapie головного мозга инкубировали с избытком гомогената головного мозга здорового хомячка. Образцы подвергали 0, 5, 10, 20 или 40 циклам, а сигнал PrPres оценивали посредством иммуноблоттинга. Уровни PrPres возрастали по экспоненте в зависимости от количества циклов инкубирования/ультразвукового воздействия (фиг. 5). Данный результат наводит на мысль о том, что увеличение количества циклов могло бы дополнительно уменьшить пределы выявления. Пример 4. Эксперименты с ультразвуковым воздействием на образцы крови с нагрузкой PrPSc. Гепаринизированную кровь крысы нагружали гомогенатом пораженного scrapie головного мозга хомячка до достижения конечного разведения 10:1. Данную смесь инкубировали при комнатной температуре в течение 15 мин. Из данного материала делали 10-кратные серийные разведения с использованием гепаринизированной крови крысы. 50 мкл каждого разведения центрифугировали при 3000 об./мин в течение 10 мин. Плазму отделяли от центрифужного осадка. 10 мкл плазмы смешивали с 50 мкл гомогената головного мозга здорового хомячка, содержавшего субстрат PrPC для реакции конверсии. Образцы подвергали 11 циклам инкубирования-ультразвукового воздействия. В качестве контроля те же образцы смешивали с 50 мкл гомогената головного мозга здорового хомячка и хранили при -20 С вплоть до использования. 15 мкл обработанных ультразвуком и контрольных образцов расщепляли протеиназой К, отделяли с помощью SDS-PAGE и анализировали посредством вестерн-блоттинга, a PrPSc выявляли, как описано в разделе "Методы". Результаты представлены на фиг. 6. Данные результаты показывают четкое повышение выявления белка после процедуры амплификации, что особенно очевидно при низкой концентрации PrPSc (например, в разведении 1280). Если сравнить данные результаты с результатами, полученными на тканях инфицированного головного мозга, то можно получить подтверждение того, что процесс амплификации сходным образом работает в случае крови. Пример 5. Циклическая амплификация с высокой пропускной способностью. Применение традиционного ультразвукового устройства с одним зондом сталкивается с проблемой обработки множества образцов одновременно, как того потребует диагностический тест. Заявители адаптировали систему циклической амплификации к ультразвуковому устройству с форматом 96-луночного микротитрационного планшета (Misonix 431 МР - 20 кГц), который обеспечивает ультразвуковую обработку всех лунок в одно и то же время и может программироваться на автоматическую работу. Данное улучшение не только сокращает время обработки, но также предотвращает потерю материала по сравнению с использованием одного зонда. Перекрестная контаминация устраняется, поскольку нет прямого погружения зонда в образец. Последнее обстоятельство является существенным при анализе инфицированных образцов и сводит к минимуму ложноположительные результаты. Двадцать циклов 1 ч инкубирования с последующим ультразвуковым импульсным воздействием от 15 до 30 с приводили к достоверной амплификации сигнала PrPres, сходным с полученным ранее при использовании традиционного ультразвукового устройства.- 12007391 Пример 6. Факторы, необходимые для амплификации, находятся в резистентной к детергентам мембранной фракции. Субклеточная локализация конверсии PrP в патогенезе заболевания еще не выяснена. Однако сообщалось, что как PrPC, так и PrPSc располагаются в особом участке плазматической мембраны, который является резистентным к воздействию мягкими детергентами в силу относительно высокого содержания холестерина и гликосфинголипидов (Vey et al., 1996; Harmey et al., 1995). Указанные мембранные домены называют жировыми массами или устойчивыми к детергентам мембранами (DRM), и они содержат большое количество сигнальных белков, рецепторов и GPI-якорных белков. Заявители подтвердили, что 100% PrPС в головном мозге привязаны к данной фракции, которая содержит 2% общего белка (фиг. 7). Таким образом, простая стадия выделения жировых масс позволяет резко увеличить содержание PrPC. Сходные результаты были получены при выделении жировых масс из гомогената пораженного scrapie головного мозга, в котором PrPSc выделяли из жировых масс. Для того чтобы оценить, содержатся ли факторы, необходимые для амплификации PrP, в жировых массах, заявители выделяли их из головного мозга здоровых животных и добавляли ничтожные количества PrPSc высокой чистоты, экстрагированного из головного мозга больных животных. Амплификация в жировых массах была эквивалентна амплификации, полученной с тотальным экстрактом головного мозга (фиг. 8), поскольку количество PrPres, образовавшегося после амплификации, было сходным при обоих условиях. Данный результат указывает, что все элементы, которые требуются для конверсии и амплификации PrP (включая так называемый "фактор X" (Telling et al., 1995, содержатся в этом специализированном мембранном домене. Следовательно, идентификация и выделение факторов, необходимых для конверсии PrP, должна быть возможной посредством дальнейшего отделения белков от жировых масс и мониторинга их активности посредством циклической амплификации. Помимо этого, жировые массы представляют собой возможную замену для применения тотального гомогената головного мозга в процедуре циклической амплификации, в качестве источника субстрата PrPC и других эндогенных факторов, участвующих в конверсии. Пример 7. Пресимптоматическая диагностика у экспериментальных животных. Для изучения пресимптоматической диагностики у хомячков, экспериментально инфицированныхscrapie, заявители произвели скрининг 88 образцов головного мозга на различных стадиях доклинической фазы, половину из которых составляли неинфицированные контроли. Головной мозг отбирали каждую неделю (по 4 из каждой группы) и повергали 20 циклам амплификации. Результаты показали, что данный способ способен выявлять патологический белок в головном мозге даже на второй неделе после инокуляции, задолго до того, как у животных появляются какие бы то ни было симптомы (фиг. 9). Без циклической амплификации PrPSc выявляли в головном мозге на шестой неделе после заражения, только за 4 недели до появления клинической картины заболевания. Ни у одного из контрольных животных,которые не были заражены scrapie, амплификации не обнаружили. Пример 8. Применение циклической амплификации к образцам головного мозга человека. Для анализа возможности применения процедуры циклической амплификации к образцам головного мозга человека (трупов), пораженного болезнью Крейтцфельда-Якоба (CJD), заявители инкубировали гомогенаты головного мозга от нескольких пациентов с CJD (или от нормальных контролей) с гомогенатом головного мозга здорового человека и осуществляли процедуру циклической амплификации. Результаты показывают, что происходит достоверная амплификация в анализируемых образцах головного мозга при спорадической CJD, но ни в одном из 4 контрольных образцов амплификации не происходит (фиг. 10). Интересно, что амплификация была получена только в образцах, которые, как было показано, были заражены и, таким образом, способны конвертировать немутированный PrPC, в то время как это не происходило, когда мутантный белок был не способен конвертировать белок дикого типа. Эти данные подтверждают заключение о том, что данный метод работает в образцах, полученных у человека, так же, как это было показано ранее для образцов животного происхождения. Пример 9. Диагностика по крови посредством циклической амплификации. Исследования инфективности предполагают, что, по крайней мере, у экспериментальных животныхPrPSc присутствует в крови у животных на поздней стадии заболевания (Brown et al., 2001). С целью осуществить выявление PrPSc в крови посредством циклической амплификации, заявители предпочли сначала избирательно сконцентрировать образец по белку, подлежащему выявлению, и устранить массу в изобилии имеющихся белков крови, таких как альбумин или гемоглобин. Следующие четыре различных протокола, как было показано, были эффективными для достижения указанной цели. 1. Получение теней эритроцитов. Гепаринизированную кровь хомяка центрифугировали при 2500 об./мин при 4 С. Плазму и клеточную фракцию разделяли и замораживали и хранили при -80 С до использования. 0,5 мл фракции клеток крови промывали 3 раза в 12-15 объемах свежего холодного PBS, рН 7,6. Клетки ресуспендировали в 1215 объемах 20 мОСМ буфера фосфата натрия, рН 7,6 и слегка перемешивали в течение 20 мин на льду,затем центрифугировали при 30000 об./мин в течение 10 мин при 4 С. Надосадок удаляли, осадок промывали 3 раза 20 мОСМ буфером фосфата натрия. Конечный осадок ресуспендировали в PBS, содержавшем 0,5% тритона Х-100, 0,5% SDS и ингибиторы протеаз. 15 мкл полученной суспензии перемеши- 13007391 вали об./об. с 10% гомогенатом головного мозга здорового хомяка и подвергали 20 циклам инкубирования-ультразвукового воздействия. По 20 мкл обработанных ультразвуком и контрольных образцов расщепляли протеиназой K, разделяли посредством SDS-PAGE и анализировали с помощью вестернблоттинга, a PrPSc выявляли, как описано в разделе "Методы". Результаты показывают выявление PrPSc после процедуры амплификации в образцах крови инфицированных животных (фиг. 11). В образцах крови неинфицированных животных после амплификации сигнала не наблюдалось. Без амплификации невозможно выявить присутствие PrPSc (фиг. 11). 2. Экстракция саркозилом. Гепаринизированную кровь хомяка центрифугировали при 2500 об./мин при 4 С. 0,5 мл фракции клеток крови разбавляли (об./об.) 20% саркозилом и инкубировали в течение 30 мин. Образец центрифугировали на ультрацентрифуге Beckman TL100 при 85000 об./мин в течение 2 ч при 4 С. Осадок промывали и ресуспендировали в PBS, содержавшем 0,5% тритона Х-100, 0,5% SDS и ингибиторы протеаз. 15 мкл полученной суспензии перемешивали об./об. с 10% гомогенатом головного мозга здорового хомяка и подвергали 20 циклам инкубирования-ультразвукового воздействия. По 20 мкл обработанных ультразвуком и контрольных образцов расщепляли протеиназой K, разделяли посредством SDS-PAGE и анализировали с помощью вестерн-блоттинга, a PrPSc выявляли, как описано в разделе "Методы". Результаты показывают выявление PrPSc после процедуры амплификации в образцах крови от инфицированных животных (фиг. 12). В образцах крови от неинфицированных животных после амплификации сигнала не наблюдалось. Без амплификации невозможно выявить присутствие PrPSc (фиг. 12). 3. Эстракция жировых масс. Гепаринизированную кровь хомяка центрифугировали при 2500 об./мин при 4 С. 0,5 мл фракции клеток крови разбавляли (об./об.) PBS с 1% тритоном Х-100 и инкубировали в течение 30 мин при 4 С. Образец разбавляли 1:2 60% сахарозой и помещали на дно центрифужной пробирки. Поверх образца осторожно наслаивали 7 мл 35% сахарозы. Поверх градиента наслаивали 1,5 мл 15% сахарозы. Пробирку центрифугировали при 150000 об./мин в течение 18 ч при 4 С. Жировые массы выделяли, промывали вPBS и центрифугировали при 28000 об./мин в течение 1 ч при 4 С. Осадок промывали и ресуспендировали в PBS, содержавшем 0,5% тритона Х-100, 0,5% SDS и ингибиторы протеаз. 15 мкл полученной суспензии перемешивали об./об. с 10% гомогенатом головного мозга здорового хомяка и подвергали 20 циклам инкубирования-ультразвукового воздействия. По 20 мкл обработанных ультразвуком и контрольных образцов расщепляли протеиназой K, разделяли посредством SDS-PAGE и анализировали с помощью вестерн-блоттинга, a PrPSc выявляли, как описано в разделе "Методы". Результаты показывают выявление PrPSc после процедуры амплификации в образцах крови от инфицированных животных (фиг. 13). В образцах крови от неинфицированных животных после амплификации сигнала не наблюдалось. Без амплификации невозможно выявить присутствие PrPSc (фиг. 13). 4. Получение лейкоцитарной пленки. Гепаринизированную кровь хомяка центрифугировали при 1500 об./мин при 4 С в течение 10 мин. Лейкоцитарную пленку осторожно выделяли с помощью стандартных процедур и хранили при -80 С до использования. Замороженную лейкоцитарную пленку ресуспендировали в PBS, содержавшем 0,5% тритона Х-100, 0,5% SDS и ингибиторы протеаз. 15 мкл полученной суспензии перемешивали об./об. с 10% гомогенатом головного мозга здорового хомяка и подвергали 20 циклам инкубирования-ультразвукового воздействия. По 20 мкл обработанных ультразвуком и контрольных образцов расщепляли протеиназой К, разделяли посредством SDS-PAGE и анализировали с помощью вестерн-блоттинга, a PrPSc выявляли,как описано в разделе "Методы". Результаты показывают выявление PrPSc после процедуры амплификации в образцах крови инфицированных животных (фиг. 14). В образцах крови неинфицированных животных после амплификации сигнала не наблюдалось. Без амплификации невозможно выявить присутствие PrPSc (фиг. 14). Методы Получение гомогенатов головного мозга. Головной мозг сирийских золотистых хомячков, здоровых или инфицированных адаптированным штаммом scrapie 263K, получали после декапитации и немедленно замораживали в сухом льду и хранили при -80 С до использования. Головной мозг гомогенизировали в PBS с 10% ингибиторов протеаз(мас./об.). Добавляли детергенты (0,5% тритона Х-100, 0,05% SDS и осветляли центрифугированием на малых скоростях (10000 об./мин) в течение 1 мин. Получение образцов и циклическая амплификация. Непосредственно в гомогенате здорового головного мозга производили серийные разведения гомогената пораженного scrapie головного мозга. По 30 мкл полученных разведений инкубировали при 37 С при перемешивании. Каждый час осуществляли цикл ультразвукового воздействия (5 импульсов по 1 с каждый) с использованием ультразвукового микроустройства с иглой, погруженной в образец. Указанные циклы повторяли несколько раз (5-20). Выявление PrPSc. Образцы расщепляли с помощью РК в концентрации 100 мкг/мл в течение 90 мин при 37 С. Реакцию останавливали 50 мМ PMSF. Образцы разделяли с помощью SDS-PAGE (в денатурирующих усло- 14007391 виях) и подвергали электроблоттингу через нитроцеллюлозную мембрану в CAPS или трис-глициновом трансферном буфере с 10% метанолом в течение 45 мин при 400 мА. Обратимое окрашивание общего белка осуществляли перед блокированием мембраны 5% обезжиренным молоком. После этого мембрану инкубировали в течение 2 ч с моноклональным антителом 3F4 (1:50000). Промывали четыре раза по 5 мин PBS, 0,3% твина 20, перед инкубированием со вторичным антимышиным антителом, меченным пероксидазой хрена (1:5000) в течение 1 ч. После промывания реактивность в мембране разрабатывали с помощью набора для хемолюминесценции ECL (Amersham), согласно инструкциям производителя. Список литературыEncephalopathies: Report of a WHO Consultation, Geneva, Switzerland 9-11 February 1998, WHO. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ диагностики или выявления конформационного заболевания, которое характеризуется конформационным превращением лежащего в его основе белка из непатогенного в патогенный конформер, путем анализа образца на предмет выявления маркера указанного заболевания, предусматривающий:(i) обеспечение контактирования указанного образца с некоторым количеством непатогенного конформера;(ii) дезагрегацию любых агрегатов, образующихся во время стадии (i); и(iii) определение наличия и/или количества в образце указанного патогенного конформера, который является маркером указанного заболевания; причем стадия (i) включает в себя стадию (ia) инкубации указанного образца с непатогенным конформером, а стадии (ia) и (ii) образуют цикл, который повторяют по меньшей мере дважды перед осуществлением стадии (iii). 2. Способ по п.1, где цикл повторяют от 5 до 40 раз до выполнения стадии (iii). 3. Способ по любому из пп.1-2, где стадию (i) осуществляют в физиологических условиях. 4. Способ по любому из пп.1-3, где количество непатогенного конформера на стадии (i) является избыточным. 5. Способ по любому из пп.1-4, где конформационное заболевание представляет собой трансмиссивное конформационное заболевание. 6. Способ по любому из пп.1-5, где анализируемый образец подвергают предварительной обработке для избирательного концентрирования патогенного конформера в образце. 7. Способ по п.6, где патогенным конформером является PrPSc, а предварительная обработка представляет собой экстрагирование из образца фракции, которая нерастворима в мягких детергентах. 8. Способ выявления маркера конформационного заболевания, которое характеризуется конформационным превращением лежащего в его основе белка из непатогенного в патогенный конформер в образце, причем указанный анализ включает в себя следующие стадии:(i) обеспечение контактирования указанного образца с некоторым количеством непатогенного конформера;(ii) дезагрегацию любых агрегатов, возможно образующихся во время стадии (i); и(iii) определение наличия и/или количества в образце указанного патогенного конформера, который является маркером указанного заболевания; причем стадия (i) включает в себя стадию (ia) инкубации указанного образца с непатогенным конформе- 16007391 ром, а стадии (ia) и (ii) образуют цикл, который повторют по меньшей мере дважды перед осуществлением стадии (iii). 9. Способ идентификации соединения, которое модулирует конформационное превращение белка из непатогенного в патогенный конформер, которое характеризует конформационное заболевание, предусматривающий:(i) обеспечение контактирования некоторого количества непатогенного конформера с некоторым количеством патогенного конформера в присутствии указанного соединения (а) и в отсутствие указанного соединения (b);(ii) дезагрегацию любых агрегатов, образующихся во время стадии (i), и(iii) определение количества патогенного конформера в присутствии указанного соединения (а) и в отсутствие указанного соединения (b); причем стадия (i) включает в себя стадию (ia) инкубации указанного образца с непатогенным конформером, а стадии (ia) и (ii) образуют цикл, который повторяют по меньшей мере дважды перед осуществлением стадии (iii), и(iv) отбор соединения, которое модулирует количество патогенного конформера, измеренного в отсутствие соединения. 10. Способ по любому из пп.1-7, 8 или 9, где патогенным конформером является PrPSc, непатогенным конформером является PrPC, а лежащим в основе заболевания белком является прионный белок. 11. Способ выявления патогенной формы прионного белка в образце, предусматривающий:(i) обеспечение контактирования указанного образца с некоторым количеством непатогенного прионного белка;(ii) дезагрегацию любых агрегатов, образующихся во время стадии (ia); повторение стадий (ia)-(ii) два или более раз и далее(iii) определение наличия и/или количества в образце патогенного прионного белка. 12. Способ выявления патогенной формы -амилоидного белка в образце, предусматривающий:(i) обеспечение контактирования указанного образца с некоторым количеством непатогенного амилоидного белка;(ii) дезагрегацию любых агрегатов, образующихся во время стадии (ia); повторение стадий (ia)-(ii) два или более раз и далее(iii) определение наличия и/или количества в образце патогенного -амилоидного белка. 13. Набор для применения в способе по любому из пп.1-7, 8 или 9, включающий в себя планшет для микротитрования, многолуночное ультразвуковое устройство и известное количество непатогенного конформера.
МПК / Метки
МПК: A61P 43/00, G01N 33/68
Метки: диагностики, набор, маркера, заболевания, способе, способ, выявления, использования, конформационного
Код ссылки
<a href="https://eas.patents.su/25-7391-sposob-diagnostiki-ili-vyyavleniya-konformacionnogo-zabolevaniya-ili-ego-markera-i-nabor-dlya-ispolzovaniya-v-sposobe.html" rel="bookmark" title="База патентов Евразийского Союза">Способ диагностики или выявления конформационного заболевания или его маркера и набор для использования в способе</a>
Предыдущий патент: Фунгицидные смеси на базе производных бензамидоксима, бензофенонов и азола
Следующий патент: Фенилацетамидотиазольные производные, способ их получения и их использования в качестве противоопухолевых средств
Случайный патент: Производные арилметилкарбониламинотиазола и их применение в качестве противоопухолевых средств