Способ и набор для лечения рака
Номер патента: 25069
Опубликовано: 30.11.2016
Авторы: Нгуйен Бинь, Лимон Кристофер Пол, Редди Джозеф Ананд
Формула / Реферат
1. Способ лечения немелкоклеточного рака легких, где способ включает стадии введения соединения ЕС145 формулы
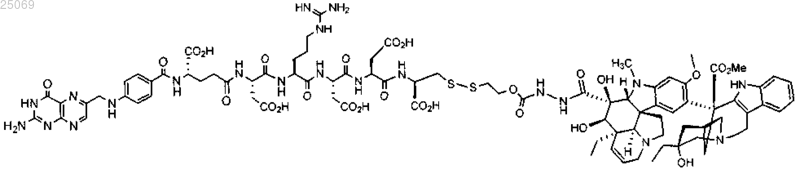
или его фармацевтически приемлемой соли пациенту и введения пациенту таксана.
2. Способ по п.1, где таксан выбран из группы, состоящей из доцетаксела и паклитаксела.
3. Способ по п.2, где таксан представляет собой доцетаксел.
4. Способ по п.2, где таксан представляет собой паклитаксел.
5. Способ по п.1, где указанное соединение или его фармацевтически приемлемую соль и указанный таксан вводят в терапевтически эффективных количествах.
6. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 1 мкг/м2 до приблизительно 500 мг/м2 площади поверхности тела.
7. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 1 мкг/м2 до приблизительно 300 мг/м2 площади поверхности тела.
8. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 10 до приблизительно 100 мкг/кг масса тела пациента.
9. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 90 мас.%.
10. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль находится в форме восстанавливаемого лиофилизата.
11. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных, не содержащих пирогены водных растворах.
12. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан вводят в дозах меньших, чем их максимальные переносимые дозы.
13. Набор, содержащий соединение ЕС145 формулы
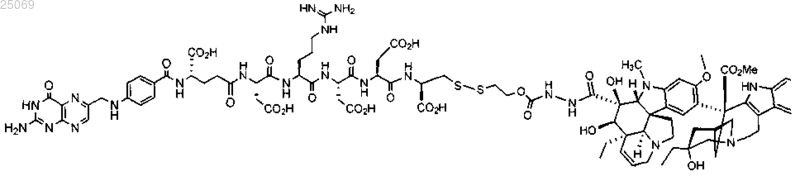
или его фармацевтически приемлемую соль и таксан для применения в способе по п.1.
14. Набор по п.13, где таксан выбран из группы, состоящей из доцетаксела и паклитаксела.
15. Набор по п.14, где таксан представляет собой доцетаксел.
16. Набор по п.14, где таксан представляет собой паклитаксел.
17. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в терапевтически эффективных количествах.
18. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных контейнерах или упаковках.
19. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 90 мас.%.
20. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 95 мас.%.
21. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль находится в форме восстанавливаемого лиофилизата.
22. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных, не содержащих пирогены водных растворах.
23. Способ лечения немелкоклеточного рака легких, где способ включает стадии введения пациенту дозы соединения ЕС145 формулы
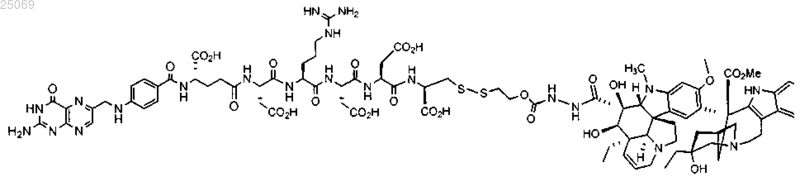
или его фармацевтически приемлемой соли посредством внутривенной болюсной инъекции дважды в неделю в течение первой и второй недель из трехнедельного цикла лечения и введения пациенту дозы доцетаксела в течение 1 ч в первые сутки трехнедельного цикла терапии.
24. Способ по п.23, где доза указанного соединения или его фармацевтически приемлемой соли составляет 2,5 мг.
25. Способ по п.23, где доза доцетаксела составляет 75 мг/м2 площади поверхности тела.
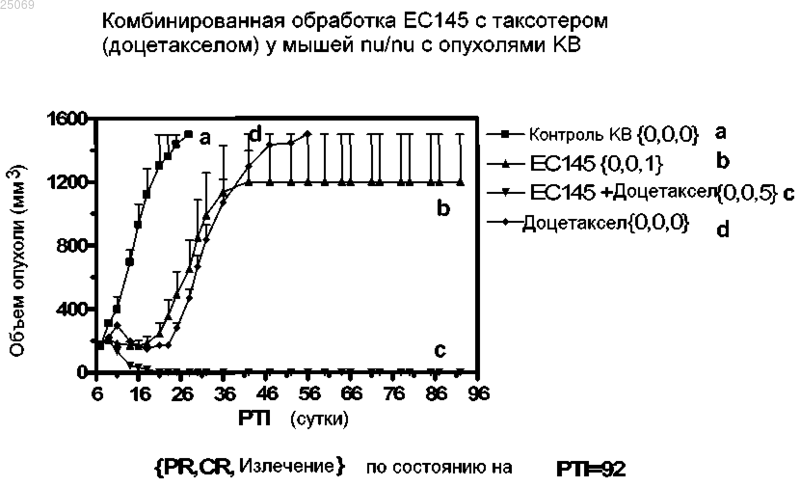
Текст
СПОСОБ И НАБОР ДЛЯ ЛЕЧЕНИЯ РАКА Изобретение относится к способам и набору для лечения немелкоклеточного рака легких с помощью конъюгата фолата-барвинка, представляющего собой соединение ЕС 145, в комбинации по меньшей мере с одним таксаном. Перекрестная ссылка на связанные заявки По настоящей заявке испрашивается приоритет в соответствии с 35 U.S.С.119(е) предварительной патентной заявки США с серийным 61/413275, полностью включенной в настоящий документ в качестве ссылки. Область техники Изобретение относится к способам и набору для лечения немелкоклеточного рака легких с помощью конъюгата фолата-барвинка, представляющего собой соединение ЕС 145, в комбинации по меньшей мере с одним таксаном. Предшествующий уровень техники и сущность изобретения Несмотря на факт значительного развития технологий против рака, таких как лучевая терапия, химиотерапия и гормональная терапия, рак все еще остается второй основной причиной смертности в Соединенных Штатах Америки после заболеваний сердца. Чаще всего злокачественную опухоль лечат посредством химиотерапии с использованием очень сильнодействующих лекарственных средств, таких как митомицин, паклитаксел и камптотецин. Во многих случаях эти химиотерапевтические средства демонстрируют зависимое от дозы действие, и уничтожение клеток пропорционально дозе лекарственного средства. Таким образом, для устранения неоплазий необходим высокоагрессивный способ дозирования. Однако помехой химиотерапии с высокими дозами является плохая селективность в отношении злокачественных клеток и высокая токсичность для нормальных клеток. Это отсутствие опухолеспецифичного лечения является одним из многих препятствий, которые необходимо преодолеть современной химиотерапии. Одним из средств преодоления ограничений современной химиотерапии могло бы стать получение биологически эффективных концентраций средств против злокачественных опухолей в опухолевых тканях с очень высокой специфичностью. Для достижения этой цели предпринимались большие усилия для разработки опухолеспецифических лекарственных средств посредством конъюгации лекарственных средств против злокачественных опухолей с такими лигандами, как гормоны, антитела или витамины. Например, в качестве опухоленаправленного средства пригодно низкомолекулярное витаминное соединение фолат. Другим подходом для преодоления ограничений современной химиотерапии могла бы стать доставка комбинации опухоленаправленного лекарственного средства с одним или несколькими химиотерапевтическими средствами, когда профили токсичности опухоленаправленного лекарственного средства и химиотерапевтического средства являются различными. Дальнейшей модификацией этого подхода является использование опухоленаправленного лекарственного средства и химиотерапевтического средства в комбинированном лечении в количествах каждого, меньших чем, как правило, используют при применении опухоленаправленного лекарственного средства или химиотерапевтического средства для лечения отдельно. Фолат является представителем витаминов группы В и играет важную роль в выживании клеток,принимая участие в биосинтезе нуклеиновых кислот и аминокислот. Этот жизненно необходимый витамин также является высокоаффинным лигандом, который увеличивает специфичность конъюгированных лекарственных средств против злокачественных опухолей, вследствие направленности к несущим фолатный рецептор (FR) злокачественным клеткам. FR, ассоциированный с опухолями связанный с гликозилфосфатидилинозитолом белок, может активно интернализовать связанные фолаты и конъюгированные с фолатами соединения посредством опосредованного рецептором эндоцитоза. Выявлено, что экспрессия FR повышена более чем в 90% неслизистых карциномах яичника. Также выявлены от высоких до умеренных уровней FR в карциномах почки, головного мозга, легкого и молочной железы, тогда как в большинстве нормальных тканей он присутствует на низких уровнях. Также полагают, что плотность FR возрастает на более поздней стадии злокачественной опухоли. Направляемые фолатом лекарственные средства разработаны и их тестировали в клинических испытаниях в качестве лекарственных средств против злокачественных опухолей. ЕС 145 содержит очень сильнодействующее цитотоксическое химиотерапевтическое средство из алкалоида барвинка, дезацетилвинбластингидразид (DAVLBH), конъюгированное с фолатом. Молекула ЕС 145 направлена к фолатному рецептору, на высоких уровнях находящемуся на поверхности эпителиальных опухолей, включая немелкоклеточные карциномы легких (NSCLC), злокачественные опухли яичника, эндометрия и почек и другие, включая карциному фаллопиевых труб и первичную перитонеальную карциному. Без связи с теорией полагают, что ЕС 145 связывается с опухолями, экспрессирующими фолатный рецептор, доставляя группу барвинка непосредственно в злокачественные клетки, избегая нормальную ткань. После связывания ЕС 145 проникает в злокачественную клетку посредством эндоцитоза, высвобождает DAVLBH и вызывает гибель клеток вследствие ингибирования формирования митотического комплекса, необходимого для деления клетки. ЕС 145 имеет номер Chemical Abstracts Registry Number 742092-03-1 и следующую формулу: В рамках изобретения в отношении способа лечения или набора термин ЕС 145 означает химиотерапевтическое средство, как указано выше, или его фармацевтически приемлемую соль, и химиотерапевтическое средство может находиться в растворе или суспензии в ионизированной форме, включая протонированную форму. ЕС 145 можно синтезировать, например, способом, описанным в PCT/US11/037134,включенной в настоящий документ в качестве ссылки. ЕС 145 в настоящем документе используют взаимозаменяемо с термином "конъюгат". В одном из вариантов осуществления предоставлен способ лечения немелкоклеточного рака легких. Способ включает введение ЕС 145 в комбинации с химиотерапевтическим средством, представляющим собой таксан, с механизмом действия, выбранным из группы, состоящей из ингибирования разборки микротрубочек и ингибирования митоза. В другом варианте осуществления описан указанный выше способ, где одно или несколько химиотерапевтических средств выбраны из группы, состоящей из доцетаксела (например, таксотер (TAXOTERE и паклитаксела (например, таксол (TAXOL) или абраксан (ABRAXANE. В приведенных ниже пунктах описаны независимые варианты осуществления изобретения. 1. Способ лечения немелкоклеточного рака легких, где способ включает стадии введения соединения ЕС 145 формулы или его фармацевтически приемлемой соли пациенту и введения пациенту таксана. 2. Способ по п.1, где таксан выбран из группы, состоящей из доцетаксела и паклитаксела. 3. Способ по п.2, где таксан представляет собой доцетаксел. 4. Способ по п.2, где таксан представляет собой паклитаксел. 5. Способ по п.1, где указанное соединение или его фармацевтически приемлемую соль и указанный таксан вводят в терапевтически эффективных количествах. 6. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 1 мкг/м 2 до приблизительно 500 мг/м 2 площади поверхности тела. 7. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 1 мкг/м 2 до приблизительно 300 мг/м 2 площади поверхности тела. 8. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 10 до приблизительно 100 мкг/кг масса тела пациента. 9. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 90 мас.%. 10. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль находится в форме восстанавливаемого лиофилизата. 11. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных, не содержащих пирогены водных растворах. 12. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан вводят в дозах меньших, чем их максимальные переносимые дозы. 13. Набор, содержащий соединение ЕС 145 формулы или его фармацевтически приемлемую соль и таксан для применения в способе по п.1. 14. Набор по п.13, где таксан выбран из группы, состоящей из доцетаксела и паклитаксела. 15. Набор по п.14, где таксан представляет собой доцетаксел. 16. Набор по п.14, где таксан представляет собой паклитаксел. 17. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в терапевтически эффективных количествах. 18. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных контейнерах или упаковках. 19. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 90 мас.%. 20. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 95 мас.%. 21. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль находится в форме восстанавливаемого лиофилизата. 22. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных, не содержащих пирогены водных растворах. 23. Способ лечения немелкоклеточного рака легких, где способ включает стадии введения пациенту дозы соединения ЕС 145 формулы или его фармацевтически приемлемой соли посредством внутривенной болюсной инъекции дважды в неделю в течение первой и второй недель из трехнедельного цикла лечения и введения пациенту дозы доцетаксела в течение 1 ч в первые сутки трехнедельного цикла терапии. 24. Способ по п.23, где доза указанного соединения или его фармацевтически приемлемой соли составляет 2,5 мг. 25. Способ по п.23, где доза доцетаксела составляет 75 мг/м 2 площади поверхности тела. Краткое описание чертежей Фиг. 1. Объем опухоли (среднее для пяти животных в каждой обрабатываемой группе), измеряемый у мышей nu/nu с опухолями KB (в диапазоне 144-212 мм 3), которых (а) не обрабатывали или обрабатывали: (b) EC145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; или (d) доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели; или (с) ЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели. Обработка только ЕС 145 приводила к 0 случаев частичного ответа, 0 случаев полного ответа и 1 случаю излечения. Обработка только доцетакселом приводила к отсутствию частичных ответов, полных ответов или излечения. Обработка комбинацией приводила к 5 случаям излечения. Фиг. 2. Процентное изменение массы (среднее для пяти животных в каждой обрабатываемой группе), измеряемый у мышей nu/nu с опухолями KB (в диапазоне 144-212 мм 3), которых (а) не обрабатывали или обрабатывали: (b) EC145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; или (d) доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели; или (с) ЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели. Фиг. 3. Объем опухоли (среднее для пяти животных в каждой обрабатываемой группе), измеряемый у мышей nu/nu с опухолями KB (в диапазоне 103-173 мм 3), которыхне обрабатывали или обрабатывали:ЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; илиабраксаном(т.е. связанной с альбумином формой паклитаксела) при 20 мг/кг трижды в неделю в течение 1 недели; илиЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + абраксаном (эквивалентом паклитаксела) при 20 мг/кг трижды в неделю в течение 1 недели. Обработка только ЕС 145 приводила к 0 случаев частичного ответа, 0 случаев полного ответа и 0 случаев излечения. Обработка только абраксаном приводила к 1 случаю частичного ответа, 2 случаям полного ответа и 2 случаям излечение. Обработка комбинацией приводила к 2 случаям полного ответа и 3 случаям излечения. Фиг. 4. Процентное изменение массы (среднее для пяти животных в каждой обрабатываемой группе), измеряемое у мышей nu/nu с опухолями KB (в диапазоне 92-185 мм 3), которыхне обрабатывали или обрабатывали:ЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; илиабраксаном (эквивалентом паклитаксела) при 20 мг/кг трижды в неделю в течение 1 недели; илиЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + абраксаном (эквивалентом паклитаксела) при 20 мг/кг дважды в неделю в течение 1 недели. Фиг. 5. Объем опухоли (среднее для пяти животных в каждой обрабатываемой группе), измеряемый у мышей nu/nu с опухолями KB (в диапазоне 111-173 мм 3), которыхне обрабатывали или обрабатывали:ЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; илипаклитакселом при 20 мг/кг трижды в неделю в кремофоре/этаноле в течение 1 недели; илиЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + паклитакселом в кремофоре/этаноле при 20 мг/кг трижды в неделю в течение 1 недели; илитолько носителем кремофором/этанолом. Обработка только ЕС 145 приводила к 0 случаев частичного ответа, 0 случаев полного ответа и 0 случаям излечения. Обработка только паклитакселом приводила к 2 случаям полного ответа и 3 случаям излечения. Обработка комбинацией приводила к 1 случаю полного ответа и 4 случаям излечения. Фиг. 6. Процентное изменение массы (среднее для пяти животных в каждой обрабатываемой группе), измеряемое у мышей nu/nu с опухолями KB (в диапазоне 52-185 мм 3), которыхне обрабатывали или обрабатывали:ЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; илипаклитакселом при 20 мг/кг трижды в неделю в кремофоре/этаноле в течение 1 недели; илиЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + паклитакселом в кремофоре/этаноле при 20 мг/кг трижды в неделю в течение 1 недели; илитолько носителем кремофором/этанолом. Фиг. 7. Объем опухоли (среднее), измеряемый у мышей с опухолями IGR-OV1 (яичника человека),которыхне обрабатывали или обрабатывали:ЕС 145 при 2 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; илидоцетакселом при 10 мг/кг трижды в неделю в течение 1 недели; илиЕС 145 при 2 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели. Фиг. 8. Процентное изменение массы (среднее) мышей с опухолями IGR-OV1 (яичника человека),которыхне обрабатывали или обрабатывали:ЕС 145 при 2 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; илидоцетакселом при 10 мг/кг трижды в неделю в течение 1 недели; илиЕС 145 при 2 ммоль/кг/инъекцию трижды в неделю в течение 2 недель + доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели. Фиг. 9. Объем опухоли у мышей с опухолями М 109, которых (а) не обрабатывали или обрабатывали: (b) EC145 при 2 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; или (d) доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели; или (с) ЕС 145 при 2 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели. Фиг. 10. Процентное изменение массы у мышей с опухолями М 109, которых (а) не обрабатывали или обрабатывали: (b) EC145 при 2 ммоль/кг/инъекцию трижды в неделю в течение 2 недель; или (d) доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели; или (с) ЕС 145 при 2 ммоль/кг/инъекцию трижды в неделю в течение 2 недель + доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели. Определения В рамках изобретения термин "ингибирование роста опухоли" означает уменьшение размера опухоли, полное исчезновение опухоли или рост опухоли пациента менее 30% в течение курса лечения ЕС 145 и дополнительным химиотерапевтическим лекарственным средством. В рамках изобретения в отношении способа лечения или набора термин доцетаксел (например, таксотер (TAXOTERE означает композицию, содержащую химиотерапевтическое средство, определяемое номером Chemical Abstracts Registry Number 114 977-28-5, или его фармацевтически приемлемую соль. Химиотерапевтическое средство (т.е. доцетаксел) может находиться в растворе или суспензии. В рамках изобретения в отношении способа лечения или набора термин паклитаксел (например,таксол (TAXOL) или абраксан (ABRAXANE означает композицию, содержащую химиотерапевтическое средство, определяемое номером Chemical Abstracts Registry Number 33069-62-4, или его фармацевтически приемлемую соль. Химиотерапевтическое средство (т.е. паклитаксел) может находиться в растворе или суспензии. Подробное описание иллюстративных вариантов осуществления В приведенных ниже пронумерованных пунктах описаны независимые варианты осуществления изобретения, и каждый из вариантов осуществления, описанных в этом разделе подробного описания настоящей заявки, относится к каждому из приведенных ниже вариантов осуществления: 1. Способ лечения немелкоклеточного рака легких, где способ включает стадии введения соединения ЕС 145 формулы или его фармацевтически приемлемой соли пациенту и введения пациенту таксана. 2. Способ по п.1, где таксан выбран из группы, состоящей из доцетаксела и паклитаксела. 3. Способ по п.2, где таксан представляет собой доцетаксел. 4. Способ по п.2, где таксан представляет собой паклитаксел. 5. Способ по п.1, где указанное соединение или его фармацевтически приемлемую соль и указанный таксан вводят в терапевтически эффективных количествах. 6. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 1 мкг/м 2 до приблизительно 500 мг/м 2 площади поверхности тела. 7. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 1 мкг/м 2 до приблизительно 300 мг/м 2 площади поверхности тела. 8. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 10 до приблизительно 100 мкг/кг масса тела пациента. 9. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 90 мас.%. 10. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль находится в форме восстанавливаемого лиофилизата. 11. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных, не содержащих пирогены водных растворах. 12. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан вводят в дозах меньших, чем их максимальные переносимые дозы. 13. Набор, содержащий соединение ЕС 145 формулы или его фармацевтически приемлемую соль и таксан для применения в способе по п.1. 14. Набор по п.13, где таксан выбран из группы, состоящей из доцетаксела и паклитаксела. 15. Набор по п.14, где таксан представляет собой доцетаксел. 16. Набор по п.14, где таксан представляет собой паклитаксел. 17. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в терапевтически эффективных количествах. 18. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных контейнерах или упаковках. 19. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 90 мас.%. 20. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 95 мас.%. 21. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль находится в форме восстанавливаемого лиофилизата. 22. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных, не содержащих пирогены водных растворах. 23. Способ лечения немелкоклеточного рака легких, где способ включает стадии введения пациенту дозы соединения ЕС 145 формулы или его фармацевтически приемлемой соли посредством внутривенной болюсной инъекции дважды в неделю в течение первой и второй недель из трехнедельного цикла лечения; и введения пациенту дозы доцетаксела в течение 1 ч в первые сутки трехнедельного цикла терапии. 24. Способ по п.23, где доза указанного соединения или его фармацевтически приемлемой соли составляет 2,5 мг. 25. Способ по п.23, где доза доцетаксела составляет 75 мг/м 2 площади поверхности тела. В любом из различных вариантов осуществления, описываемых в настоящем документе, когда применимо, могут быть представлены приведенные ниже свойства, обеспечивая дополнительные варианты осуществления изобретения. Для всех вариантов осуществления также предусмотрена любая подходящая комбинация вариантов осуществления. Любую подходящую комбинацию описанных выше вариантов осуществления считают соответствующей изобретению. В различных вариантах осуществления способов или наборов, описываемых в настоящем докумен-5 025069 те, ЕС 145 можно вводить отдельно или в комбинации с одним или несколькими из таксанов (или с любой комбинацией таксанов). В различных вариантах осуществления, описываемых в настоящем документе, другие химиотерапевтические средства можно выбирать из лекарственных средств представляют собой ингибитор разборки микротрубочек и/или ингибитор митоза. Следует понимать, что другое лекарственное средство может иметь более одного механизма действия. В одном из иллюстративных вариантов осуществления ЕС 145 можно вводить в комбинации по меньшей мере с одним химиотерапевтическим средством, выбранным из группы, состоящей из доцетаксела и паклитаксела. В других вариантах осуществления способов или наборов, описываемых в настоящем документе,описаны фармацевтически приемлемые соли конъюгатов, описываемых в настоящем документе. Фармацевтически приемлемые соли конъюгатов, описываемых в настоящем документе, включают их соли присоединения кислоты и основания. Подходящие соли присоединения кислот формируются из кислот, которые образуют нетоксические соли. Иллюстративные примеры включают ацетатные, аспартатные, бензоатные, безилатные, бикарбонатные/карбонатные, бисульфатные/сульфатные, боратные, камзилатные, цитратные, эдизилатные, эзилатные, формиатные, фумаратные, глюцептатные, глюконатные, глюкуронатные, гексафторфосфатные,гибензатные, гидрохлоридные/хлоридные, гидробромидные/бромидные, йодогидратные/йодидные, изетионатные, лактатные, малатные, малеатные, малонатные, мезилатные, метилсульфатные, нафтилатные,2-напсилатные, никотинатные, нитратные, оротатные, оксалатные, пальмитатные, памоатные, фосфатные/гидрофосфатные/дигидрофосфатные, сахаратные, стеаратные, сукцинатные, тартратные, тозилатные и трифторацетатные соли. Подходящие основные соли конъюгатов, описываемых в настоящем документе, формируются из оснований, которые образуют нетоксические соли. Иллюстративные примеры включают соли аргинина,бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Также можно формировать гемисоли кислот и оснований, например гемисульфатные и гемикальциевые соли. В одном из вариантов осуществления конъюгаты или дополнительные химиотерапевтические средства, описываемые в настоящем документе, можно вводить в виде состава в ассоциации с одним или несколькими фармацевтически приемлемыми носителями. Носители могут представлять собой эксципиенты. Выбор носителя в большой степени зависит от таких факторов, как конкретный способ введения,влияние носителя на растворимость и стабильность и характер лекарственной формы. Фармацевтические композиции, подходящие для доставки конъюгатов или дополнительных химиотерапевтических средств,описываемых в настоящем документе, и способы их получения легко понятны специалистам в данной области. Такие композиции и способы их получения можно найти, например, в Remington: The SciencePractice of Pharmacy, 21st Edition (Lippincott WilliamsWilkins, 2005), включенном в настоящий документ в качестве ссылки. В одном из иллюстративных аспектов фармацевтически приемлемый носитель включает любой и все растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые средства,средства придания изотоничности и задерживающие всасывание средства и т.п. и их сочетания, которые физиологически совместимы. В некоторых вариантах осуществления носитель подходит для парентерального введения. Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для получения стерильных инъецируемых растворов или дисперсий для немедленного приема. В композиции по изобретению также можно вводить дополнительные активные соединения. В различных вариантах осуществления жидкие составы могут включать суспензии и растворы. Такие составы могут включать носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль,метилцеллюлозу или подходящее масло, и один или несколько эмульгаторов и/или суспендирующих средств. Жидкие составы также можно получать посредством восстановления твердых веществ, например, из саше. В одном из вариантов осуществления водная суспензия может включать активные материалы в смеси с подходящими эксципиентами. Такие эксципиенты представляют собой суспендирующие средства, например карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу натрия, альгинат натрия, поливинилпирролидон, трагакантовую камедь и гуммиарабик; диспергирующие средства или средства для смачивания, которые могут представлять собой природный фосфолипид, например лецитин; продукт конденсации алкиленоксида с жирной кислотой, например полиоксиэтиленстеарат; продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом, например гептадекаэтиленоксицетанол; продукт конденсации этиленоксида с частичным сложным эфиром, получаемым из жирных кислот и гексита, такой как моноолеат полиоксиэтиленсорбита; или продукт конденсации этиленоксида с частичным сложным эфиром, получаемым из жирных кислот и ангидридов гекситом, например моноолеат полиоксиэтиленсорбитана. Водные суспензии также могут содержать один или несколько консервантов, например аскорбиновую кислоту, этил-, н-пропил- или п-гидроксибензоат; или один или несколько красителей. В одном из иллюстративных вариантов осуществления диспергируемые порошки и гранулы, под-6 025069 ходящие для получения водной суспензии при добавлении воды обеспечивают активный ингредиент в смеси с диспергирующим средством или средством для смачивания, суспендирующим средством и одним или несколькими консервантами. Также могут присутствовать дополнительные эксципиенты, например красители. Подходящие эмульгаторы могут представлять собой природные камеди, например гуммиарабик или трагакантовая камедь; природные фосфолипиды, например соевый лецитин; и сложные эфиры,включая частичные сложные эфиры, получаемые из жирных кислот и ангидридов гекситов, например моноолеат сорбитана, и продукты конденсации указанных частичных сложных эфиров с этиленоксидом,например моноолеат полиоксиэтиленсорбитана. В других вариантах осуществления в композицию можно включать средства придания изотоничности, например сахара, полиспирты, такие как маннит, сорбит, или хлорид натрия. Пролонгированного всасывания инъецируемых композиций добиваться посредством включения в композицию средства, замедляющего всасывание, например моностеаратных солей и желатина. Как описано в настоящем документе, в одном из аспектов конъюгат или дополнительное химиотерапевтическое средство можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие маршруты для такого парентерального введение включают внутривенную, внутриартериальную, интраперитонеальную, интратекальную, эпидуральную, интрацеребровентрикулярную, интрауретральную, интрастернальную, интракраниальную, внутриопухолевую, внутримышечную и подкожную доставку. Подходящие средства для парентерального введения включают игольные (включая микроигольные) инжекторы, безыгольные инжекторы и инфузионные способы. В одном из иллюстративных аспектов парентеральные составы, как правило, представляют собой водные растворы, которые могут содержать носители или эксципиенты, такие как соли, углеводы и буферные средства (предпочтительно при рН от 3 до 9), но для некоторых применений их можно более удобно формулировать в качестве стерильного неводного раствора или в качестве сухой формы для использования в сочетании с подходящим носителем, таким как стерильная, не содержащая пирогенов вода. В других вариантах осуществления для парентерального введения конъюгатов или дополнительных химиотерапевтических средств, описываемых в настоящем документе, можно адаптировать любой из жидких составов, описываемых в настоящем документе. Получение парентеральных составов в стерильных условиях, например посредством лиофилизации в стерильных условиях, можно легко проводить с использованием стандартных фармацевтических способов, хорошо известные специалистам в данной области. Например, ЕС 145 можно лиофилизировать способом, описанным в заявке США с серийным 61/474428, включенной в настоящий документ в качестве ссылки. В одном из вариантов осуществления ЕС 145 может присутствовать в форме восстанавливаемого лиофилизата. В одном из вариантов осуществления можно увеличивать растворимость конъюгата или дополнительного химиотерапевтического средства, используемых для получения парентерального состава, посредством применения подходящих способов формулирования, таких как введение усиливающих растворимость средств. Составы с ЕС 145 описаны в заявке США с серийным 61/474428, PCT/US11/037134 и WO 2011/014821, каждый из которых полностью включен в настоящий документ в качестве ссылки. В различных вариантах осуществления составы для парентерального введения можно формулировать для немедленного и/или модифицированного высвобождения. В одном из иллюстративных аспектов активные средства по изобретению можно вводить в составе с замедленным высвобождением, например в композиции, которое включает полимер с замедленным высвобождением. Активные соединения можно получать с носителями, которые защищают соединение от быстрого высвобождения, например в виде составов с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Можно использовать биологически разлагаемые биологически совместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры,полимолочная кислота и сополимеры молочной и гликолевой кислот (PGLA). Как правило, способы получение таких составов известны специалистам в данной области. В другом варианте осуществления конъюгаты или дополнительные химиотерапевтические средства, описываемые в настоящем документе,или композиции, содержащие конъюгаты или дополнительные химиотерапевтические средства, при необходимости можно вводить в непрерывном режиме. В одном из вариантов осуществления предоставлен набор. Если необходимо вводить комбинацию активных соединений, две или более фармацевтических композиций можно комбинировать в форме набора, подходящего для последовательного введения или совместного введения композиций. Такой набор содержит две или более отдельных фармацевтических композиций, по меньшей мере одна из которых содержит конъюгат, описываемый в настоящем документе, и предназначен для раздельного хранения композиций, например, в виде контейнера, порционной бутылки или порционного пакета из фольги. В другом варианте осуществления предоставлены композиции, содержащие конъюгат или дополнительное химиотерапевтическое средство, описываемые в настоящем документе, в контейнере с этикеткой в которой предоставлены инструкции для применения лечения конъюгатом. Также предоставлены инструкции по применению дополнительного химиотерапевтического средства для введения (например, таксана). В одном из вариантов осуществления стерильные инъецируемые растворы можно получать, добав-7 025069 ляя требуемое количество активного средства в подходящий растворитель с одним или комбинацией ингредиентов, описанных выше, как необходимо, с последующей стерилизацией фильтрованием. Как правило, дисперсии получают, добавляя активное соединение в стерильный носитель, содержащий диспергирующую среду и любые дополнительные ингредиенты из описанных выше ингредиентов. В случае стерильных порошков для получения стерильных инъецируемых растворов предпочтительные способы получения представляют собой вакуумную сушку и лиофилизацию, которыми получают порошок активного ингредиента с любым желаемым дополнительным ингредиентом из его заранее простерилизованного раствора, или ингредиенты можно стерилизовать фильтрованием совместно. Композицию можно формулировать в виде раствора, микроэмульсии, липосомы или другой упорядоченной структуры, подходящей для получения высокой концентрации лекарственного средства. Носитель может представлять собой растворитель или диспергирующую среду, содержащую, например, воду,этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. В одном из вариантов осуществления можно поддерживать надлежащую текучесть, например, посредством применения такого покрытия, как лецитин, посредством поддержания требуемого размера частиц в случае дисперсии и посредством применения поверхностно-активных веществ. Для введения ЕС 145 и дополнительного химиотерапевтического средства можно использовать любую эффективную схему лечения. Например, ЕС 145 и дополнительное химиотерапевтическое средство(т.е. лекарственное средство) можно вводить в качестве однократной дозы или их можно разделять и вводить в виде схемы лечения с несколькими ежедневными дозами. Кроме того, в качестве альтернативы ежедневному введению можно использовать ступенчатую схему лечения, например, от одних до пяти суток в неделю, и считают, что для цели способов, описываемых в настоящем документе, такая периодическая или ступенчатая суточная схема лечения является эквивалентной ежедневному лечению, и она предусмотрена. В одном из иллюстративных вариантов осуществления для устранения опухоли пациента подвергают лечению несколькими инъекциями ЕС 145 и дополнительного химиотерапевтического средства. В одном из вариантов осуществления пациенту несколько раз инъецируют (предпочтительно приблизительно от 2 до приблизительно 50 раз) ЕС 145 и дополнительное химиотерапевтическое средство,например, с интервалами 12-72 ч или с интервалами 48-72 ч. После начальной инъекции(й) пациенту можно проводить дополнительные инъекции ЕС 145 и дополнительного лекарственного средства с интервалом от нескольких суток или месяцев и дополнительные инъекции могут предотвращать рецидив злокачественной опухоли. В другом варианте осуществления схема лечения для дополнительного химиотерапевтического средства отлична от ЕС 145. В одном из вариантов осуществления ЕС 145 вводят в виде внутривенной болюсной инъекции 2,5 мг, дважды в неделю в течение недель 1 и 2 трехнедельного цикла. В другом варианте осуществления вводят таксан (например, доцетаксел) при 75 мг/м 2 в течение 1 ч на сутки 1 трехнедельного цикла. В другом варианте осуществления можно комбинировать варианты осуществления, описанные в этом абзаце. Дозы в мг/м 2 основаны на 1 м 2 площади поверхности тела. Одноразовое суточное дозирование ЕС 145 и дополнительного химиотерапевтического средства может значительно варьировать в зависимости от состояния пациента, состояния подвергаемой лечению болезни, чистоты соединений и маршрута их введения и распределения в тканях и возможности совместного использования других видов терапевтического лечения, таких как лучевая терапия. Эффективное количество для введения пациенту основано на площади поверхности тела, массе и оценки врачом состояния пациента. Эффективные дозы могут находиться в диапазоне, например, приблизительно от 1 нг/кг до приблизительно 1 мг/кг, приблизительно от 1 до приблизительно 500 мкг/кг и приблизительно от 1 до приблизительно 100 мкг/кг. Эти дозы основаны на средней массе пациента приблизительно 70 кг и кг представляют собой кг массы тела пациента. Каждое из ЕС 145 и дополнительных химиотерапевтических средств можно вводить в дозе приблизительно от 1,0 нг/кг до приблизительно 1000 мкг/кг, приблизительно от 10 нг/кг до приблизительно 1000 мкг/кг, приблизительно от 50 нг/кг до приблизительно 1000 мкг/кг, приблизительно от 100 нг/кг до приблизительно 1000 мкг/кг, приблизительно от 500 нг/кг до приблизительно 1000 мкг/кг, приблизительно от 1 нг/кг до приблизительно 500 мкг/кг, приблизительно от 1 нг/кг до приблизительно 100 мкг/кг, приблизительно от 1 до приблизительно 50 мкг/кг, приблизительно от 1 до приблизительно 10 мкг/кг, приблизительно от 5 до приблизительно 500 мкг/кг, приблизительно от 10 до приблизительно 100 мкг/кг, приблизительно от 20 до приблизительно 200 мкг/кг, приблизительно от 10 до приблизительно 500 мкг/кг или приблизительно от 50 до приблизительно 500 мкг/кг. Суммарную дозу можно вводить одной или дробными дозами, и она по решению врача может выходить из типичных диапазонов, приводимых в настоящем документе. Эти дозы основаны на средней массе пациента приблизительно 70 кг и"кг" представляют собой килограммы масса тела пациента. Врач легко может определить дозы для индивидуумов, чья масса выходит из этого диапазона, таких как дети и пожилые индивидуумы. В другом варианте осуществления каждое из ЕС 145 и дополнительных химиотерапевтических средств можно вводить в дозе приблизительно от 1 мкг/м 2 до приблизительно 500 мг/м 2, приблизительно от 1 мкг/м 2 до приблизительно 300 мг/м 2 или приблизительно от 100 мкг/м 2 до приблизительно 200 мг/м 2. В других вариантах осуществления каждое из ЕС 145 и дополнительных лекарственных средств можно-8 025069 вводить в дозе приблизительно от 1 до приблизительно 500 мг/м 2, приблизительно от 1 до приблизительно 300 мг/м 2, приблизительно от 1 до приблизительно 200 мг/м 2, приблизительно от 1 до приблизительно 100 мг/м 2, приблизительно от 1 до приблизительно 50 мг/м 2 или приблизительно от 1 до приблизительно 600 мг/м 2. Суммарную дозу можно вводить одной или дробной дозами, и она по решению врача может выходить из типичных диапазонов, приводимых в настоящем документе. Эти дозы основаны на 1 м 2 площади поверхности тела. Конъюгаты и химиотерапевтические средства, описываемые в настоящем документе, могут содержать один или несколько хиральных центров или могут иным образом иметь способность существовать в виде нескольких стереоизомеров. Таким образом, следует понимать, что настоящее изобретение относится к чистым стереоизомерам, а также к смесям стереоизомеров, таким как энантиомеры, диастереомеры и обогащенных энантиомерами или диастереомерами смеси. Конъюгаты и химиотерапевтические средства, описываемые в настоящем документе, могут обладать способностью существовать в виде геометрических изомеров. Таким образом, следует понимать, что настоящее изобретение относится к чистым геометрическим изомерам или смесям геометрических изомеров. Следует понимать, что конъюгаты и химиотерапевтические средства, описываемые в настоящем документе, могут существовать в несольватированных формах, а также сольватированных формах,включая гидратированные формы. В основном, сольватированные формы эквивалентны несольватированным формам и включены в объем настоящего изобретения. Конъюгаты и химиотерапевтические средства, описываемые в настоящем документе, могут существовать в нескольких кристаллических или аморфных формах. В основном, все физические формы эквивалентны для применений, предусматриваемых настоящим изобретением, и их следует включать в объем настоящего изобретения. В другом варианте осуществления композиции и/или лекарственные формы для введения ЕС 145 или дополнительного химиотерапевтического средства получают из соединений с чистотой по меньшей мере приблизительно 90, или приблизительно 95, или приблизительно 96, или приблизительно 97, или приблизительно 98, или приблизительно 99, или приблизительно 99,5%. В другом варианте осуществления композиции и или лекарственные формы для введения ЕС 145 или дополнительного лекарственного средства получают из соединений с чистотой по меньшей мере 90, или 95, или 96, или 97, или 98, или 99,или 99,5%. В рамках изобретения определения частоты можно производить на основе массовой доли, молярной концентрации и т.п. Кроме того, определения чистоты может основываться на отсутствии или по существу отсутствии определенных предопределенных компонентов, в качестве неограничивающих примеров, таких как, фолиевая кислота, содержащие дисульфиды компоненты, не содержащие лекарственное средство из барвинка, продукты окисления, дисульфидные компоненты, не содержащие фолат, и т.п. Также следует понимать, что определения чистоты применимы к растворам соединений и композиций, очищаемых способами, описываемыми в настоящем документе. В этих случаях, измерения чистоты,включая измерения массовой доли и молярной концентрации, зависят от компонентов раствора за исключением растворителя. В другом варианте осуществления ЕС 145 предоставлен в стерильном контейнере или упаковке. Чистоту ЕС 145 или дополнительного лекарственного средства можно измерять любым общепринятым способом, включая различные способы хроматографии или спектроскопии, такие как жидкостная хроматография высокого давления или высокоэффективная жидкостная хроматография (ВЭЖХ), спектроскопия ядерного магнитного резонанса, TLC, УФ-спектроскопия оптической плотности, флуоресцентная спектроскопия и т.п. На злокачественных клетках сверхэкспрессированы экспрессируемые на поверхности рецепторы витаминов, такие как высокоаффинный фолатный рецептор. Опубликовано, что все эпителиальные злокачественные опухоли яичника, молочной железы, кишечника, легкого, носовой полости, гортани и головного мозга экспрессируют повышенные уровни фолатного рецептора. Известно, что фактически более чем 90% всех опухолей яичника человек экспрессируют большие количества этого рецептора. Таким образом, комбинированное лечение, описываемое в настоящем документе, можно использовать для лечения множества типов опухолевых клеток. Лечение, описываемое в настоящем документе, можно использовать для клинической медицины человека и ветеринарных применений. Таким образом, животное-хозяин, несущее популяцию патогенных клеток и подвергаемое комбинированному лечению, может представлять собой человека (т.е. пациента) или, в случае ветеринарных применений, может представлять собой лабораторное, сельскохозяйственное, домашнее или дикое животное. Способы, описываемые в настоящем документе, можно применять для людей, лабораторных животных, таких как грызуны (например, мыши, крысы, хомяки и т.д.),кролики, обезьяны, шимпанзе, домашних животных, таких как собаки, кошки и кролики, сельскохозяйственных животных, таких как коровы, лошади, свиньи, овцы, козы, и диких животных в неволе, таких как медведи, панды, львы, тигры, леопарды, слоны, зебры, жирафы, гориллы, дельфины и киты. В одном из аспектов ответ на лечение характеризуют с использованием критериев Response Evaluation Criteria in Solid Tumors (RECIST). Иллюстративно критерии адаптированы из исходной WHO Handbook (3), учитывая измерение наибольшего диаметра для всех заданных очагов поражения: полный от-9 025069 вет, (CR) исчезновение всех намеченных очагов поражения; частичный ответ (PR) - по меньшей мере 30% уменьшение суммы наибольших диаметров намеченных очагов поражения, принимая в качестве контрольной величины исходную сумму наибольших диаметров; стабильное заболевание (SD) - ни достаточного уменьшения до качества PR, ни значительного увеличения до качества PD, принимая в качестве контрольной величины наименьшую сумму наибольших диаметров с начала лечения; прогрессирующее заболевание (PD) - по меньшей мере 20% увеличение суммы наибольших диаметров намеченных очагов поражения, принимая в качестве контрольной величины наименьшую сумму наибольших диаметров, зафиксированную с начала лечение или возникновение одного или нескольких новых очагов поражения. Другие критерии включают общую частоту ответа опухоли (ORR=CR+PR), частоту контроля заболевания (DCR=CR+PR+SD) и общую выживаемость (OS) -время до гибели данного пациента, определяемое как количество суток от первых суток, когда пациент получил лечение по протоколу, до даты гибели пациента. В одном из вариантов осуществления предоставлен способ лечения экспрессирующей фолатный рецептор эпителиальной опухоли у нуждающегося в этом пациента, включающий введение терапевтически эффективного количества ЕС 145 в комбинации с терапевтически эффективным количеством дополнительного химиотерапевтического средства. ЕС 145 и дополнительное химиотерапевтическое средство можно вводить одномоментно в одной или нескольких композициях или последовательно. Другой вариант осуществления представляет собой применение ЕС 145 в комбинации с дополнительным химиотерапевтическим средством для лечения у пациента экспрессирующей фолатный рецептор эпителиальной опухоли. Дополнительный вариант осуществления представляет собой применение ЕС 145 для получения лекарственного средства для лечения у пациента экспрессирующей фолатный рецептор эпителиальной опухоли в комбинации с дополнительным химиотерапевтическим средством. Для любого из способов, применений, композиций, фармацевтических композиций, комбинаций или наборов, описываемых в настоящем документе, вариант экспрессирующей фолатный рецептор эпителиальной опухоли представляет собой опухоль яичника, эндометрия или немелкоклеточную опухоль легкого (NSCLC). Лечение NSCLC можно проводить на любой стадии, включая стадии 0, I, II, IIIA, IIIB или IV. Для любого из указанных выше способов, применений, композиций, фармацевтических композиций, комбинаций или наборов другой вариант экспрессирующей фолатный рецептор эпителиальной опухоли представляет собой опухоль яичника. Опухоль яичника может быть устойчива к платине или чувствительна к платине. В другом варианте осуществления для любого из способа, применения, композиции, фармацевтической композиции, комбинации или набора ЕС 145 представляет собой соединение формулы или его фармацевтически приемлемую соль. В рамках изобретения ЕС 145 может находиться в растворе или суспензии в ионизированной форме,включая протонированную форму. В одном из вариантов осуществления предоставлен способ лечения устойчивого к платине рака яичника у нуждающегося в этом пациента, включающий введение терапевтического количества ЕС 145 в комбинации с терапевтическим количеством дополнительного химиотерапевтического средства. В другом варианте осуществления предоставлено применение ЕС 145 в комбинации с дополнительным химиотерапевтическим средством для лечения у пациента устойчивого к платине рака яичника. В другом варианте осуществления предоставлено применение ЕС 145 для получения лекарственного средства для лечения у пациента устойчивого к платине рака яичника в комбинации с дополнительным химиотерапевтическим средством. Для любого из способа, применения, фармацевтической композиции, композиции, комбинации или набора, описанных выше в отношении лечения устойчивого к платине рака яичника с использованием ЕС 145 в комбинации с дополнительным химиотерапевтическим средством, один из вариантов осуществления представляет собой вариант осуществления, где чистота ЕС 145 или дополнительного лекарственного средство составляет по меньшей мере 90%. Другой вариант осуществления представляет собой вариант осуществления, где ЕС 145 или дополнительное химиотерапевтическое средство предоставлены в водном стерильном жидком составе. В другом варианте осуществления описан способ отбора пациента для лечения, где способ включает стадию введения пациенту композиции, содержащей ЕС 20, комбинированный с изотопом технеция,как описано в PCT/US2010/043992 (структура ЕС 20 описана в PCT/US2010/043992, в настоящее время опубликованной как WO 2011/014821), описание которой полностью включено в настоящий документ в качестве ссылки, где пациентов отбирают для лечения, если у них экспрессирован фолатный рецептор на уровнях, по меньшей мере, FR+ (т.е. по меньшей мере один очаг поражения экспрессирует фолатный рецептор) или FR (т.е. все очаги поражения экспрессируют фолатный рецептор). В одном из вариантов осуществления этой процедуры визуализации пациенту инъецируют 0,5 мг фолиевой кислоты с последующей инъекцией в пределах от 1 до 3 мин 1 до 2 мл 0,1 мг ЕС 20, меченного от 20 до 25 мКи 99mTc и после периода от 1 до 2 ч проводят визуализацию. В одном из вариантов осуществления способы визуализации выбраны из группы, состоящей из планарной визуализации, SPECT и SPECT/CT. В другом варианте осуществления способы, композиции, фармацевтические композиции, комбинации или наборы и применения, описываемые в настоящем документе, включают приведенные ниже примеры. Примеры дополнительно иллюстрируют дополнительные характеристики различных вариантов осуществления изобретения, описываемых в настоящем документе. Однако следует понимать, что примеры являются иллюстративными, и их не следует рассматривать как ограничивающие другие варианты осуществления изобретения, описываемые в настоящем документе. Кроме того, следует понимать, что в различных вариантах осуществления изобретения, описываемых в настоящем документе, включены другие варианты примеров. Примеры Материалы.N10-трифторацетилптероевую кислоту приобретали в Eprova AG, Schaffhausen, Switzerland. Реагенты для пептидного синтеза приобретали в NovaBiochem и Bachem. Целлюлозные планшеты и DEAE планшеты для ионного обмена приобретали в J.T. Baker. Паклитаксел приобретали в А.K. Scientific(Mountain View, СА). Таксотер и абраксан приобретали в Purdue Pharmacy (West Lafayette, IN) Способы. Эксперименты по противоопухолевому действию in vivo. Самок мышей nu/nu в возрасте от четырех до шести недель (Charles River, Wilmington, MA) или самок мышей Balb/c в возрасте от шести до семи недель (Harlan Sprague Dawley, Inc., Indianapolis, IN) в течение эксперимента содержали со стандартным 12-часовым циклом смена света-темноты и кормили без ограничений кормом, обедненном фолатами (Harlan diet TD00434, Harlan Teklad, Madison, WI). FRпозитивные назофарингеальные клетки KB человека и клетки яичника IGROV человека выращивали в непрерывном режиме в виде монослоя, с использованием не содержащей фолатов среды RPMI(FFRPMI), содержащей 10% инактивированную нагреванием эмбриональную телячью сыворотку(HIFCS) при 37 С в увлажненной атмосфере 5% СО 2/95% воздуха без антибиотиков. Сингенные FRположительные клетки карциномы легкого Madison 109 (М 109) получали из опухолей М 109 и культивировали в течение нескольких суток перед имплантацией мышам в FFRPMI, содержащей 10% HIFCS. Клетки KB (1106 на мышь nu/nu), М 109 клетки (1106 на мышь Balb/c), клетки IGROV (4106 на мышьnu/nu) в 100 мкл инъецировали в подкожный слой средней области спины. Мышей разделяли на пять групп и свежеполученные тестируемые препараты инъецировали через латеральную хвостовую вену в стерильных условиях в объеме фосфатно-солевого буфера (PBS) 200 мкл. Как правило, внутривенное(в/в) введение начинали, когда объем опухолей составлял приблизительно 100-200 мм 3. Мышам в контрольных группах обработку не проводили. Рост каждой п./к. опухоли сопровождали трехкратным измерением опухоли три в неделю в течение обработки и дважды в неделю после нее до достижения объема 1500 мм 3. Опухоли измеряли в двух перпендикулярных направлениях с использованием штангенциркуля нониусом и их объемы рассчитывали как 0,5LW2, where L = измерение по длиннейшей оси в мм, и W = измерение по оси, перпендикулярной L в мм. В качестве основной меры токсичности определяли изменения массы тела по той же схеме, как и измерения объема опухоли. Ежедневно контролировали выживание животных. Умирающих животных (или неспособных дотянуться до пищи или воды) подвергали эвтаназии посредством асфиксии СО 2. Все исследования in vivo проводили в соответствии с руководствами American Accreditation Association of Laboratory Animal Care. Для отдельных опухолей частичный ответ (PR) определяли как уменьшение объема 50%, но с остающейся во все моменты времени измеряемой опухолью (2 мм 3). Полный ответ (CR) определяли как исчезновение измеряемой опухолевой массы (2 мм 3) в любой временной точке до конца исследования. Излечение определяли как CR без повторного роста опухоли во временных рамках исследования. Пример. Комбинированная обработка ЕС 145 с доцетакселом. Случайно распределенных мышей nu/nu с опухолями KB (в диапазоне 144-212 мм 3) (а) не обрабатывали или обрабатывали: (b) EC145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; или (d) доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели; или (с) ЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели. Для обзора ответа опухолей в течение периода обработки см. фиг. 1, а для обзора изменения массы в течение периода обработки см. фиг. 2. Обработка только доцетакселом приводила к отсутствию частичных ответов, полных ответов или излечения. Обработка комбинацией приводила к 5 случаям излечения. Пример. Комбинированная обработка ЕС 145 с абраксаном. Случайно распределенных мышей nu/nu с опухолями KB (в диапазоне 103-173 мм 3)не обрабатывали или обрабатывали:ЕС 145 при 1 ммоль/кг/инъекцию трижды в неделю в течение 2 недель; илиEC145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + абраксаном (эквивалентом паклитаксела) при 20 мг/кг трижды в неделю в течение 1 недели. Для обзора ответа опухолей в течение периода обработки см. фиг. 3, а для обзора изменения массы в течение периода обработки см. фиг. 4. Пример. Комбинированная обработка ЕС 145 с паклитакселом в кремофоре/этаноле. Случайно распределенных мышей nu/nu с опухолями KB (в диапазоне 111-173 мм 3)не обрабатывали или обрабатывали:ЕС 145 при 1 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; илипаклитакселом при 20 мг/кг трижды в неделю в кремофоре/этаноле в течение 1 недели; илиЕС 145 при 1 ммоль/кг/инъекцию трижды в неделю в течение 2 недель + паклитакселом в кремофоре/этаноле при 20 мг/кг трижды в неделю в течение 1 недели; илитолько носителем кремофором/этанолом. Для обзора ответа опухолей в течение периода обработки см. фиг. 5, а для обзора изменения массы в течение периода обработки см. фиг. 6. Пример. Мышей nu/nu с опухолями IGR-OV1 (яичника человека)не обрабатывали или обрабатывали:ЕС 145 при 2 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; илидоцетакселом при 10 мг/кг трижды в неделю в течение 1 недели; илиЕС 145 при 2 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели. Для обзора ответа опухолей в течение периода обработки см. фиг. 7, а для обзора изменения массы в течение периода обработки см. фиг. 8. Пример. Мышей с опухолями M109 (а) не обрабатывали или обрабатывали: (b) EC145 при 2 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель; или (d) доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели; или (с) ЕС 145 при 2 мкмоль/кг/инъекцию трижды в неделю в течение 2 недель + доцетакселом при 10 мг/кг трижды в неделю в течение 1 недели. Для обзора ответа опухолей в течение периода обработки см. фиг. 9, а для обзора изменения массы в течение периода обработки см. фиг. 10. Примеры соединений. Материалы.API (активный лекарственный продукт) ЕС 145 получают в соответствии с описанием в US 7601332 или WO 2011/014821 или как описано ниже (PCT/US2011/037134). Другие материалы, устройства и оборудование получают из коммерческих источников, включая следующее: вода для инъекции (WFI); дигидрат трицитрата натрия, EMD 1,06432,0500; лимонная кислота, JT Baker 0122-01; маннит, JT Baker 2553-01; аргон; азот; фильтр, Pall 12122; трубки; флаконы, Wheaton223685/WO08230, 5 мл, 20 мм, трубки типа I, стекло; пробки, (West Pharmaceutical19700021 или 19700022) 20 мм, S-10-F451, 4432/50 Gray w/покрытие B2-40 (пробка для сыворотки); зажимы, Blue (с пробкой для сыворотки); пробки, West 20 мм 4432/50, S-87-J, Gray w/покрытие В 2-44 (пробка с разрезной юбкой для лиофилизации); зажимы, Helvoet Pharma 110009704, Brown 6028 (пробка с разрезной юбкой для лиофилизации); вода Milli-Q, Millipore Direct Q 3 UV System; моногидрат одноосновного фосфата натрия, Mallinckrodt 7868; дигидрат двухосновного фосфата натрия, Fisher S472-500; хлорид натрия, Mallinckrodt 7581; хлорид калия, Fisher P330-500; дигидрат цитрата натрия, Aldrich 39,807-1; сахароза, SigmaS3929-1KG; гидроксид натрия, JT Baker 3278-01; соляная кислота, EMD HX0603P-S; ледяная уксусная кислота, EMD AX0074-6; триэтиламинацетат, Fisher, 04885-1; 5 Н гидроксид аммония, Acros,AC612570010; ацетонитрил, Sigma-Aldrich 34851-4L; колонка для ВЭЖХ Waters Symmetry C18, 3,5 мкм,4,675 мм, P/N WAT066224; предохранительная колонка Waters Symmetry C18,5 мкм, 3,920 мм, P/NWAT054225. Устройства и оборудование. ВЭЖХ: Waters Alliance 2695 с детектором оптической плотности Waters 2487 Dual A AbsorbanceRepeater Plus, с 50 мл комбинированными наконечниками; лиофилизатор: FTS LyoStar II с устройством сбора данных LyoManager II Data Collection; укупорочное устройство, Westcapper NPW-500, 5A-018. В настоящем документе используют общепринятые сокращения, например, для растворителей, реагентов и защитных групп. Для обозначения карбамоилдисульфидного промежуточного соединения используют CDSI (4). Способы ВЭЖХ, используемые для фракционирования и оценки образца в примерах, включают следующие.EC145-CMC-IP-0001. Получение образца: разбавление материала приблизительно до 0,5 мг/мл 8 М гуанидином HCl. Колонка: Waters XBridge ВЕН С 18, 3,5 мкм, 2,1100 мм. Подвижные фазы: А) 500 мМ бикарбонат аммония, рН 9,2; В) 75:25 ацетонитрил-метанол. ЕС 145-СМС-АМ-0001 (версия 2.3). Получение образца: разбавить материал приблизительно до 1 мг/мл фосфатно-солевым буфером или 1:1 ацетонитрилом-водой (об./об.). Колонка: Waters Symmetry C18, 3,5 мкм, 4,675 мм. Подвижные фазы: А) 10 мМ триэтилацетат аммония, рН 7,5; В) ацетонитрил. Объем впрыска: 10 мкл. УФ-детекция: 280 нм. Температура колонки: 25 С. Температура образца 5 С.EC119 синтезируют с использованием твердофазной химии на основе Fmoc следующим образом. 1 связывание. Добавление 2-хлортритилхлоридной смолы в емкость для пептидного синтеза. Набухание в DMFDMF. Добавление 6% пиперазина в 0,1 M HOBt в DMF и перемешивание в течение 10-20 мин. Добавление 6% пиперазина в 0,1 М HOBt в DMF и перемешивание в течение 10-20 мин. 3 промывки DMF. 3 промывки МТВЕ. Проведение теста Кайзера для подтверждения завершения связывания. 2 связывание. 3 промывки DMF (10 мл/г смолы). Добавление 2 экв. Fmoc-Asp(OtBu)-ОН в DMF. Добавление 2 экв. HOBt в DMF. Добавление 2 экв. DIC. Перемешивание в течение 1,5-3 ч. Подтверждение связывания тестом Кайзера. 2 промывки МТВЕ. 2 промывки DMF. Добавление 6% пиперазина в 0, 1 М HOBt в DMF и перемешивание в течение 10-20 мин. Добавление 6% пиперазина в 0,1 М HOBt в DMF и перемешивание в течение 10-20 мин. 3 промывки DMF. 3 промывки МТВЕ. Проведение теста Кайзера. 3 связывание. 3 промывки DMF. Добавление 2 экв. Fmoc-Asp(OtBu)-ОН в DMF. Добавление 2 экв. HOBt в DMF. Добавление 2 экв. DIC. Перемешивание в течение 1,5-3 ч. Подтверждение связывания тестом Кайзера. 2 промывки МТВЕ. 2 промывки DMF. Добавление 6% пиперазина в 0, 1 М HOBt в DMF и перемешивание в течение 10-20 мин. Добавление 6% пиперазина в 0,1 М HOBt в DMF и перемешивание в течение 10-20 мин. 3 промывки DMF. 3 промывки МТВЕ. Проведение теста Кайзера. 4 связывание. Промывка DMF. Добавление 2 экв. Fmoc-Arg(Pbf)-ОН в DMF. Добавление 2 экв. HOBt в DMF. Добавление 2 экв. DIC. Перемешивание в течение 1,5-3 ч. Подтверждение связывания тестом Кайзера. 2 промывки МТВЕ. 2 промывки DMF. Добавление 6% пиперазина в 0, 1 М HOBt в DMF и перемешивание в течение 10-20 мин. Добавление 6% пиперазина в 0,1 М HOBt в DMF и перемешивание в течение 10-20 мин. 3 промывки DMF. 3 промывки МТВЕ. Проведение теста Кайзера. 5 связывание. 3 промывки DMF. Добавление 2 экв. Fmoc-Asp(OtBu)-ОН в DMF. Добавление 2 экв. HOBt в DMF. Добавление 2 экв. DIC. Перемешивание в течение 1,5-3 ч. Подтверждение связывания тестом Кайзера. 2 промывки МТВЕ. 2 промывки DMF. Добавление 6% пиперазина в 0,1 М HOBt в DMF и перемешивание в течение 10-20 мин. Добавление 6% пиперазина в 0,1 М HOBt в DMF и перемешивание в течение 10-20 мин. 3 промывки DMF. 3 промывки МТВЕ. Проведение теста Кайзера. 6 связывание. 3 промывки DMF. Добавление 2 экв. Fmoc-Glu-OtBu в DMF. Добавление 2 экв. HOBt в DMF. Добавление 2 экв. DIC. Подтверждение связывания тестом Кайзера. 2 промывки МТВЕ. 2 промывки DMF. Добавление 6% пиперазина в 0,1 М HOBt в DMF и перемешивание в течение 10-20 мин. Добавление 6% пиперазина в 0,1 М HOBt в DMF и перемешивание в течение 10-20 мин. 3 промывки DMF. 3 промывки МТВЕ. Проведение теста Кайзера. 7 связывание. 3 промывки DMF. Добавление 1,2 экв. N10-TFA-Pte-OH в минимальном количестве DMSO. Добавление 1,2 экв. HOBt в DMF. Добавление 1,2 экв. of PyBOP в DMF. Добавление 2,4 эквивалентов of DIPEA. Перемешивание в течение 3-5 ч. Подтверждение связывания тестом Кайзера. 2 промывки DMF. 2 промывки МТВЕ. Снятие защиты - удаление трифторацетильной группы 2 промывки DMF. Добавление 2% гидразина в DMF и перемешивание в течение 5 мин. Добавление 2% гидразина в DMF и перемешивание в течение 5 мин. Добавление 2% гидразина в DMF и перемешивание в течение 5 мин. 3 промывки DMF. 3 промывки МТВЕ. Сушка смолы в вакууме при комнатной температуре. Отщепление от смолы. Добавление в колбу расщепляющего реагента (10 мл/г смолы), содержащего 85% TFA, 2,5% триизопропилсилана, 2,5% воды и 10% этандитиола. Охлаждение смеси в ледяной бане. Добавление смолы и реакция в течение 2-3 ч при комнатной температуре. Фильтрование и сбор фильтрата. Добавление фильтрата в холодный МТВЕ (10 мл МТВЕ на 1 мл фильтрата). Перемешивание при 0-5 С в течение 3010 мин. Фильтрование осажденного продукта через стеклянный фильтр средней пористости. 3 раза промывки осадка холодным МТВЕ. Сушка продукта в вакууме при комнатной температуре. Хранение в атмосфере азота при -20 С. Очистка. Неочищенный EC119 очищают посредством препаративной ВЭЖХ с использованием колонки С 18 с обращенной фазой (6-дюймовая колонка, 2,8 кг, 10 мкм, 100 А). Подвижные фазы представляют собой 0,5% NH4OAc (А) и 0,5% NH4OAc/ACN (1:4) (В). 40 г неочищенного EC119 растворяют в 1-5% TFA,фильтруют через 1 мкм стекловолоконный фильтр и загружают в 6-дюймовую колонку. Фракции собирают и берут образец для анализа ВЭЖХ. Непосредственно после сбора рН каждой фракции доводят до 3-4 с использованием 50% АсОН в атмосфере азота для осаждения продукта. Осажденный продукт центрифугируют, промывают 0,1% АсОН и хранят при 2-8 С до дальнейшей обработки. Контейнеры при проведении центрифугирования прочищают азотом для снижения возможности окисления. Общими критериями является чистота 98%, изомеры D-Arg4, D-Glu2 и D-Asp30,25%, другие примеси 0,5%. Изомеры D-Asp5, D-Asp6 и D-Cys препаративной ВЭЖХ удалить нельзя и их следует предотвращать в процессе синтеза. Материалы, удовлетворяющие общим критериям максимально быстро лиофилизируют(раствор EC119 и влажный осадок нестабильны). Чистота конечного продукта составляет более 98%. Общий выход чистого ЕС 119, включая твердофазный синтез и очистку, составляет приблизительно 40%. Продукт упаковывают в бутылку из янтарного стекла в атмосфере азота и хранят при -20 С. Пример. А. Типичное преобразование сульфата винбластина в дезацетилвинбластингидразид Материалы. Сульфат винбластина: USP; FW=909,05 г/моль; метанол: безводный; гидразин: безводный; FW=32 г/моль; деионизованная вода; этилацетат: степени LC/GC; толуол: степени LC/GC; одноосновный фосфат натрия: 99,0%; FW=120 г/моль; двухосновный фосфат натрия: 99,0%; FW=142 г/моль; хлорид натрия: химически чистый; FW=58,4 г/моль; сульфат натрия: безводный; 5-норборнен-2-карбоновая кислота. Процедура. Реакцию, экстрактивную обработку и выделение проводят в атмосфере азота или в атмосфере аргона. Для удаления сульфата натрия и захвата продукта используют нагнетательные фильтры. Растворы хлорида натрия, используемые для гашения и промывки, барботируют азотом или аргоном до тех пор,пока уровень растворенного кислорода не станет более 0,9 м.д. Сульфат винбластина и безводный метанол помещают в реактор, который продули аргоном. В реактор добавляют 5-норборнен-2-карбоновую кислоту и безводный гидразин. Смесь перемешивают и после растворения твердых веществ смесь нагревают приблизительно до 60 С. После завершения реакции при анализе ВЭЖХ реакционную смесь охлаждают, гасят и экстрагируют в этилацетат. После сушки продукт кристаллизуют из этилацетата и толуола. Твердые вещества сушат в вакууме в течение ночи при комнатной температуре. Буферизованный NaCl содержит 10,0 г NaCl, 7,10-7,30 г NaH2PO4, 4,40-4,60 г Na2HPO4 и 90 мл воды. Раствор барботируют аргоном или азотом (содержание растворенного кислорода 0,9 м.д.). Типичный выход после выделения составляет 50-60% от теоретического максимума. В. Стадии 2 и 3 процесса обработки ЕС 145 Обработка на стадии 2 и стадии 3. Материалы. Дезацетилвинбластингидразид: FW=768,9 г/моль; 20,5 г, 26,7 ммоль; смешанный карбонат (3):FW=384,9 г/моль; 10,7 г, 27,8 ммоль; ацетонитрил: в достаточном количестве: триэтиламина: FW=101,2 г/моль; 2,67 г, 26,4 ммоль; Na2PO47H2O: 47,84 г; ЕС 119: 29,9 г 28,6 ммоль; 0,5 Н HCl: в достаточном количестве; WFI: в достаточном количестве. Процедура. Следует заметить, что вся вода, используемая в этом способе, представляет собой воду для инъекций (WFI). Очистка подходящей емкости аргоном. Загрузка 20,50,3 г дезацетилвинбластингидразида; эта загрузка корректируется на активность, т.е. если активность составляла 90,0%, загружали 22,8 г. Загрузка 10,70,2 г смешанного карбоната (корректировка на активность). Загрузка 80030 мл ацетонитрила и 2,670,11 г триэтиламина. Смешивание в атмосфере аргона при 10-14 С в течение 20-28 ч. Отбор образца для ВЭЖХ (ЕС 145-СМС-АМ-0001, версия 2.3). Ожидаемым результатом является отношение CDSI к гидразиду 25:1. Если нет, продолжение смешивания в атмосфере аргона при 10-14 С в течение 2-4 ч и новый отбор образца. Барботирование 780-820 мл воды аргоном до достижения уровня растворенного кислорода менее 0,9 м.д.; регистрация уровня растворенного кислорода. Растворение 47,80,5 г гептагидрата двухосновного фосфата натрия в дезоксигенированной воде. Добавление в подходящий контейнер 29,80,5 г ЕС 119; (загрузка корректируется на активность). Добавление к ECU 9 раствора фосфата натрия и перемешивание в атмосфере аргона. Измерение рН раствора и доведение до рН 5,8-6,2 0,5 Н HCl, если необходимо. Добавление к реакционной смеси забуференного раствора ЕС 119. Перемешивание в атмосфере аргона при 20-25 С в течение 60-75 мин. Отбор образца для ВЭЖХ (ЕС 145-СМС-АМ-0001, версия 2.3). Если отношение ЕС 145 к CDSI25:1, переходить к следующей стадии. Если нет, продолжать перемешивание в атмосфере аргона при 20-25 С и снова получить образец. Если отношение ЕС 145 к CDSI25:1,переходить к следующей стадии. Если нет, добавить дополнительный 1 г EC119 и перемешивать в атмосфере аргона при 20-25 С в течение 30 мин и снова получить образец. Получение 6,9-7,1 л 25 мМ фосфатного буфера, 185-195 мМ NaCl, рН 7,2-7,5 получаемых из воды,барботированной аргоном до достижения уровня растворенного кислорода менее 0,9 м.д. Разбавление реакционной смеси этим буфером. Если в смеси образуется более чем легкое помутнение, необходима фильтрация раствора продуктов (Whatman Polycap TC75 или ТС 150, 0,45 или 1,0 мкм); эту фильтрацию можно проводить при загрузке продукта на колонку Biotage. Очистка с применением жидкостной хроматографии. Использование картриджа Biotage 150M, С 18. Картридж этого размера может вместить реакционную смесь в два раза большего объема, чем описанная в настоящем документе смесь. Подготовка колонки. а. Промывка колонки:i) 12-13 л ацетонитрила,ii) 12-13 л 80% ацетонитрила и 20% воды (об./об.),iii) 12-13 л 50% ацетонитрила и 50% воды (об./об.),iv) 12-13 л 10% ацетонитрила и 90% воды (об./об.). Очистка. Получение 25 мМ фосфатного буфера, (185-195 ммоль) NaCl, рН 7,3-7,5. Барботирование буфера аргоном до достижения содержания растворенного кислорода 0,9 м.д. Получение: 41 л 10% ацетонитрила в забуференном физиологическом растворе (об./об.); 13 л 16% ацетонитрила в забуференном физиологическом растворе (об./об.), 52 л 27% ацетонитрила в забуференном физиологическом растворе (об./об.). Проверка содержания растворенного кислорода в растворах подвижной фазы. Если содержание растворенного кислорода составляет более 0,9 м.д., барботирование подвижной фазы аргоном или азотом до достижения уровня растворенного кислорода 0,9 м.д. Промывка колонки 26-27 л подвижной фазы 10% ацетонитрила. Загрузка раствора продукта на колонку. Элюция продукта с использованием следующей последовательности подвижных фаз:i) 13-14 л подвижной фазы 10% ацетонитрила,ii) 13 л подвижной фазы 16% ацетонитрила,iii) 51-52 л подвижной фазы 27% ацетонитрила. Примечания. Полезным является встроенный УФ-детектор; продукт должен выходить, начиная от 15-19 л подвижной фазы 27% ацетонитрила с полосой пропускания 8-13 л. Оценка фракций:i) способ ВЭЖХ EC145-CMC-IP-0001,ii) проходящая фракция = 97,0% ЕС 145 и отсутствие примесей 0,8%. Обработка колонки после запуска. Колонку можно один раз использовать повторно. Если колонку используют для второго запуска,проводят стадии ii)-iv).i) Промывка колонки 12-13 л ацетонитрилом-водой 1:1,ii) промывка колонки 20-22 л ацетонитрила,iii) повторение стадий получения на колонке ii)-iv). Ультрафильтрация. Барботирование достаточного количества воды аргоном или азотом до достижения уровня растворенного кислорода менее 0,9 м.д. Прошедшие хроматографические фракции комбинируют и разводят равным объемом барботированной воды. Собирают устройство ультрафильтрации с использованием регенерированной целлюлозной мембраны Millipore с номинальным порогом Mw 1000 (кат.CDUF002LA) и промывают 9 л дезоксигенированной воды. Начинают ультрафильтрацию раствора про- 16025069 дуктов. Поддерживают обратное давление 206,8-344,7 кПа. Продолжают ультрафильтрацию до достижения объема концентрата от 2 до 3 л. Добавляют от 11 до 12 л дезоксигенированной воды. Продолжают ультрафильтрацию до достижения объема концентрата от 2 до 3 л. Добавляют от 11 до 12 л дезоксигенированной воды. Продолжают ультрафильтрацию до достижения объема концентрата от 2 до 3 л. Добавление от 8 до 10 л дезоксигенированной воды. Продолжают ультрафильтрацию до достижения объема концентрата 2 л. Конечную точку ультрафильтрации необходимо определять посредством анализа образца концентрата посредством GC и концентрации. Характеристика составляет 50 мкг ацетонитрила на 1 мг ЕС 145. Если это не достигается, проводят еще один цикл ультрафильтрации. Концентрацию API в растворе необходимо доводить до такой, чтобы упакованный материал составлял от 6 до 12 мг/мл. При завершении ультрафильтрации устройство промывают 1 литром воды. Таким образом, продолжают ультрафильтрацию или добавляют воду при необходимости. После прохождения раствором продукта устройства для ультрафильтрации, устройство для ультрафильтрации промывают 1 л дезоксигенированной воды и комбинируют с раствором продукта. После комбинирования смыва с раствором продукта, этот раствор необходимо профильтровать через 0,2-микронный высокоэффективный фильтр и этот фильтрат упаковывают (проводят в инертной атмосфере). Типичный выход выделенного продукта составляет 50-60% от теоретического максимума. Пример. Лиофилизированное ЕС 145. Размораживали два флакона водного раствора ЕС 145 с общим объемом 22 мл при температуре окружающей среды и переносили в четыре 20 мл флакона для лиофилизации. Флаконы переносили в испаритель на период приблизительно 1,5 ч. Лиофилизацию проводили с использованием устройства для лиофильной сушки LABCONCO, которое перед загрузкой образцов предварительно охлаждали до -72 С(температура оболочки). Образцы лиофилизировали в течение 3 0 мин при -20 С с последующими дополнительными 38,5 ч при 20 С. Полученное рыхлое бледно-желтое твердое вещество объединяли в один флакон для дальнейшей характеристики. Составы. Водные составы. Ниже предоставлены составы, которые можно использовать для предоставления ЕС 145 с концентрацией ЕС 145 1,4 мг/мл. Для обеспечения болюсной дозы ЕС 145 2,5 мг используют отдельные флаконы. Пример. Состав ЕС 145 в фосфатно-солевом буфере с рН 7,4. В приведенном ниже составе предоставлен лекарственный продукт (DP) EC145 для внутривенного(в/в) введения в виде 2,0 мл водного стерильного жидкого состава с рН 7,4, в одноразовых флаконах из прозрачного стекла с покрытыми Flurotech резиновыми пробками, которые хранят замороженными в атмосфере инертного газа. Каждый флакон содержит 1,4 мг/мл ЕС 145. Количественный состав лекарственного продукта представлен в таблице ниже. Для обеспечения болюсной дозы ЕС 145 2,5 мг используют отдельные флаконы. Этот состав предусматривает 10 мМ фосфатный буфер, рН 7,4; 138 мМ хлорид натрия, и 2,7 мМ хлорид калия. Компоненты лекарственного продукта ЕС 145 Пример. Состав ЕС 145 в цитратном буфере с рН 6,2. Приведенный ниже состав предоставляет раствор, который представляет собой 50-мМ раствор ЕС 145 в цитратном буфере с рН 6,2. Компоненты лекарственного продукта ЕС 145 Составы для лиофилизации. Пример. Состав ЕС 145 в цитратном буфере с рН 6,2 с 3% маннитом. В приведенном ниже составе предоставлен раствор, который представляет собой раствор ЕС 145 в цитратном буфере с рН 6,2, содержащий в качестве наполнителя 3% маннит, пригодный для лиофилизации и восстановления. Компоненты лекарственного продукта ЕС 145 Пример. Состав ЕС 145 в цитратном буфере с рН 6,2 с 4% маннитом/1% сахарозой. Такой же состав как для 3% маннита выше, но с 80 мг маннита и 20 мг сахарозы. Пример. Состав плацебо в цитратном буфере с рН 6,2 с 3% маннитом. Приведенный ниже состав предоставляет раствор плацебо, который представляет собой раствор цитратного буфера с рН 6,2, содержащий 3% маннит в качестве наполнителя, пригодный для лиофилизации и восстановления. Компоненты продукта плацебо Пример. Получение лиофилизированных фармацевтических композиций ЕС 145 и плацебо. Циклы лиофилизации проводили с флаконами с ЕС 145, содержащими 3% маннит, флаконами с ЕС 145, содержащими 4% маннит/1% сахарозу, и флаконами с плацебо (без API EC145). Во флаконы с раствором ЕС 145 и флаконы с плацебо помещали зонды для регистрации температуры раствора в течение цикла. Перед помещением конечного продукта на воздух все циклы заполняли аргоном с флаконами закрытыми в лиофилизаторе. Непосредственно после закрывания флаконы обживали и на них помещали этикетку. В ряде циклов лиофилизации с различными параметрами наблюдать видимые различия между флаконами, содержащими 3% маннит, и флаконами, содержащими 4% маннит/1% сахарозу, было невозможно. Пример. Описание способа составления. В большую колбу помещают избыток WFI и барботируют инертным газом в течение 30 мин с уменьшением содержания кислорода до 1,0 м.д. Для подтверждения содержания кислорода до начала составления используют тестирование по ходу процесса. На протяжении всего способа составления в растворе состава поддерживали постоянный слой инертного газа с положительным давлением. Замороженный раствор лекарственного вещества (API) EC145 вынимают из холодильника и размораживают в водяной бане с циркуляцией с контролируемой температурой при 20-25 С. Размороженный раствор API добавляют в тарированную, очищенную инертным газом емкость для определения количества раствора API для формулирования. На основе плотности и концентрации ЕС 145 в растворе, массу раствора, добавляемого в тарированную емкость, используют для определения общего конечного раствора, доступного для заполнения при 1,4 мг ЕС 145/мл. Емкость с магнитной мешалкой взвешивают и на 62,5% общего объема от конечного заполняемого объема заполняют WFI. Добавляют маннит для обеспечения конечной концентрации 3% маннита. В емкость добавляют цитрат натрия с последующей промывкой барботированной WFI. В емкость добавляют лимонную кислоту с последующей промывкой барботированной WFI. Барботируемый раствор перемешивают до растворения всей лимонной кислоты. Для измерения рН раствора рН-метр стандартизуют со стандартами буферов при рН 4 и 7. Если рН не находится в диапазоне 6,0-6,2, рН доводят 1,0 М лимонной кислотой или 1,0 М цитратом натрия. Емкость оборачивают в фольгу для защиты ЕС 145 от света. Раствор лекарственного вещества ЕС 145 добавляют в емкость для составления с перемешиванием и барботированием инертным газом. Содержащую лекарственное вещество емкость дважды промывают раствором WFI. Смесь перемешивают с барботированием до получения визуально гомогенной смеси. Определят массу конечного намеченного состава и в раствор добавляют WFI до намеченной массы. Раствор фильтруют через 0,22-мкм стерильный фильтр, предварительно увлажняют и тестируют точку кипения с использованием перистальтического насоса. На всем протяжении процесса фильтрации поддерживают продувание приемной емкости инертным газом. После фильтрации повторяют тест точки кипения дляподтверждения поддержания эффективной фильтрации на протяжении всего процесса. Головку наполнителя калибруют для доставки в каждый флакон 2,03 г (2,0 мл, 2,8 мг ЕС 145) раствора состава ЕС 145. В течение процесса заполнения заполняемое количество регулярно проверяют. В процессе заполнения во флаконы на половину длины вставляют пробки. В соответствующие флаконы в лотках для лиофилизации помещают термопары и лотки подвергают лиофилизации в соответствии с определенным циклом. Пример. Цикл лиофилизации. Приводимый ниже цикл лиофилизации с использованием раствора ЕС 145 в цитратном буфере с рН 6,2, содержащего 3% маннит, описанного выше (2 мл в 5 мл флаконе) обеспечивает лиофилизированный состав ЕС 145 с удовлетворительным внешним видом осадка, который легко восстанавливается в воде и который сохраняет высокую чистоту API (95%). Флаконы барботируют аргоном, заполняют 2 мл состава ЕС 145, закрывают пробкой с разрезной юбкой для лиофилизации в положении на половину длины. Как только лоток заполняют и закрывают,его помещают в лиофилизатор при 5 С. 1. Предварительное охлаждение полок лиофилизатора до 5 С. 2. Загрузка заполненных лотков на предварительно охлажденные полки. 3. Начало цикла лиофилизации после завершения загрузки. 4. Удержание температуры полок при 5 С в течение 30-60 мин. Альтернативно, предварительное охлаждение полок до температур от -50 до 5 С обеспечивает укороченный период времени до предварительного охлаждения заполненных лотков; и стадия 4 может не требоваться. 5. Мгновенное изменение температуры полок до -50 С. 6. Поддержание температуры полок при -50 С в течение периода от 60 до 360 мин. 7. Уменьшение давления в камере до величины от 6,67 до 20 Па. 8. Поддержание температуры полок при -50 С в течение периода от 180 до 1740 мин. 9. Изменение температуры полок до -37 С в течение 73 мин (0,20 С/мин). 10. Поддержание температуры полок при -37 С в течение периода от 60 до 720 мин. 11. Изменение температуры полок до -20 С в течение 150 мин ( 0,11 С/мин). 12. Поддержание температуры полок при -20 С в течение периода от 60 до 360 мин. 13. Изменение температуры полок до температур от 20 до 30 С в течение периода от 60 до 360 мин. 14. Поддержание температуры полок при температурах от 20 до 30 С в течение периода от 60 до 600 мин. 15. Заполнение камеры аргоном или азотом до 87 кПа. 16. Сжимание полок (полностью закрытые пробками флаконы). 17. Заполнение до атмосферного давления фильтрованным воздухом. 18. Разгрузка лиофилизатора. Конкретный пример указанного выше цикла лиофилизации с начальным охлаждением в течение 30 мин при 5 С можно в обобщенной форме представить следующим образом: Затем флакон закрывают колпачком с получением конечного продукта в виде удовлетворительного осадка в каждом флаконе. Эксперименты по противоопухолевому действию. Ранее в фазе II исследования ЕС 145 в качестве единственного средства у тяжелых предварительно подвергнутых лечению пациентов с NSCLC (среднее из 6 схем лечения предшествующей химиотерапии) выявлено, что в подгруппе, все очаги поражения у которой экспрессировали фолатный рецептор (FR),наблюдали многообещающе увеличенную выживаемость без прогрессирования в течение 7,1 месяцев и общую выживаемость в течение 10,8 месяцев. Исследования in vitro и in vivo в модели заболевания наKB продемонстрировали хороший синергизм между ЕС 145 и таксотером (TAXOTERE). Измеряют активность ЕС 145 в качестве единственного средства в сравнении с текущим стандартом таксотером (TAXOTERE) у пациентов с NSCLC 2 линии, все очаги поражения у которых экспрессируют фолатный рецептор (FR). Пациентов в двух подгруппах пациентов с NSCLC (немелкоклеточный рак легких) 2 линии пациенты обрабатывают комбинацией ЕС 145 и таксотера (TAXOTERE): (1) пациенты, все очаги поражения которых экспрессируют фолатный рецептор (FR) и (2) пациенты по меньшей мере с одним, но не всеми очагами повреждения, которые экспрессируют фолатный рецептор (FR+). В течение обработки проводят следующие измерения: выживаемость без прогрессирования (PFS); общая частота ответа опухоли (ORR=CR+PR); длительность ответа опухоли (DOR); частота контроля заболевания (DCR=CR+PR+SD); длительность DCR и общую выживаемость (OS). Другие тесты представляют собой безопасность и переносимость лечения ЕС 145, ЕС 145+таксотером (TAXOTERE) и таксотером (TAXOTERE) в качестве единственного средства и безопасность и переносимость лечения 99mTc-ЕС 20. Пациентов подвергали скринингу на включение в исследование посредством визуализации плоскостной томографии и однофотонной эмиссионной компьютерной томографии (SPECT) с использованием 99mTc-ЕС 20. Подходящих пациентов, удовлетворяющих критериям пригодности, случайным образом распределяли (1:2:2) по одной из трех схем лечения: лечение только ЕС 145 (группа А), лечение комбинацией ЕС 145+таксотер (TAXOTERE) (группа В) или лечение только таксотером (TAXOTERE) (группа С). Случайное распределение пациентов стратифицируют по времени после последней химиотерапии(3 по сравнению с 3 месяцами), лучшему ответу на последнюю химиотерапию (объективный ответ опухоли/стабильное заболевание в отличие от прогрессирующего заболевания/неизвестного), стадии(IIIB в отличие от IV) и предшествующему лечению ингибитором EGFR (да в отличие от нет), FR+ в отличие от FR для исследуемой группы с таксотером (TAXOTERE) и для исследуемой группы с таксотером (TAXOTERE) + EC145. Введение 99mTc-ЕС 20. Перед процедурой визуализации ЕС 20, пациентам проводили одну внутривенную (IV) инъекцию 0,5 мг фолиевой кислоты с последующей инъекцией в пределах от 1 до 3 мин от 1 до 2 мл 0,1 мг ЕС 20,меченного от 20 до 25 мКи 99mTc. Пациентам проводили плоскостную визуализацию (от середины бедра до головы, вид сзади и спереди) через период от 1 до 2 ч после инъекции 99mTc-ЕС 20. непосредственно после получения плоскостных изображений проводят визуализацию SPECT области(ей), для которых известно, что они содержат заданный очаг(и) поражения. Если анатомическую область, содержащую опухоль, до визуализации SPECT идентифицировать невозможно, получают изображения SPECT (илиSPECT/компьютерной томографии [СТ]) грудной клетки/брюшной полости и брюшной полости/таза. Введение ЕС 145 (группа А и В). ЕС 145 вводят в качестве в/в болюсной инъекции 2,5 мг в понедельник и среду в течение недель 1 и 2, 3-недельного цикла. Введение таксотера (TAXOTERE) (группа В и С). Таксотер вводят при 75 мг/м 2 в/в в течение 1 ч на сутки 1, 3-недельного цикла. Первых 3 пациентов в группе В с комбинацией тщательно наблюдали в отношении безопасности. Пациентов оценивают с использованием СТ в конце каждого из 2 циклов. Группа А: ЕС 145 (n=60 FR): 2,5 мг в/в; понедельник, среда в течение недель 1, 2, 3-недельного цикла. Группа В: ЕС 145+таксотер (TAXOTERE) (n=60 FR, 60 FR+) как для схем группы А и группы С. Группа С: таксотер (TAXOTERE) (n=60 FR, 60 FR+). В подвергаемых лечению группах определяют выживаемость без прогрессирования (PFS). Основной интерес представляют сравнения: ЕС 145 + таксотер (TAXOTERE) в сравнении с таксотером(только FR). Статистический анализ. Уровень значимости представляет собой одностороннюю альфа = 0,10 без поправок на множественное сравнение. Для каждого из указанных выше сравнений 94 событий PFS у 120 пациентов обеспечивают мощность приблизительно 75% с определением отношения рисков, равного 0,67. Принимая среднюю PFS для таксотера (TAXOTERE) 3 месяца, эти отношения рисков соответствуют 4,5 месяцы в тестируемых группах, т.е. 50% улучшение средней PFS. Хотя выше описаны и/или приведены в качестве примеров определенные варианты осуществления настоящего изобретения, предусмотрено, что возможны их значительные вариации и модификации. Таким образом, настоящее изобретение не ограничено конкретными вариантами осуществления, описанными и/или приведенными в качестве примеров в настоящем документе. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения немелкоклеточного рака легких, где способ включает стадии введения соединения ЕС 145 формулы или его фармацевтически приемлемой соли пациенту и введения пациенту таксана. 2. Способ по п.1, где таксан выбран из группы, состоящей из доцетаксела и паклитаксела. 3. Способ по п.2, где таксан представляет собой доцетаксел. 4. Способ по п.2, где таксан представляет собой паклитаксел. 5. Способ по п.1, где указанное соединение или его фармацевтически приемлемую соль и указанный таксан вводят в терапевтически эффективных количествах. 6. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 1 мкг/м 2 до приблизительно 500 мг/м 2 площади поверхности тела. 7. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 1 мкг/м 2 до приблизительно 300 мг/м 2 площади поверхности тела. 8. Способ по п.5, где терапевтически эффективные количества указанного соединения или его фармацевтически приемлемой соли и указанного таксана находятся в диапазонах от приблизительно 10 до приблизительно 100 мкг/кг масса тела пациента. 9. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 90 мас.%. 10. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль находится в форме восстанавливаемого лиофилизата. 11. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных, не содержащих пирогены водных растворах. 12. Способ по п.1, где указанное соединение или его фармацевтически приемлемая соль и таксан вводят в дозах меньших, чем их максимальные переносимые дозы. 13. Набор, содержащий соединение ЕС 145 формулы или его фармацевтически приемлемую соль и таксан для применения в способе по п.1. 14. Набор по п.13, где таксан выбран из группы, состоящей из доцетаксела и паклитаксела. 15. Набор по п.14, где таксан представляет собой доцетаксел. 16. Набор по п.14, где таксан представляет собой паклитаксел. 17. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в терапевтически эффективных количествах. 18. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных контейнерах или упаковках. 19. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 90 мас.%. 20. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан имеют чистоту по меньшей мере 95 мас.%. 21. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль находится в форме восстанавливаемого лиофилизата. 22. Набор по п.13, где указанное соединение или его фармацевтически приемлемая соль и таксан находятся в стерильных, не содержащих пирогены водных растворах. 23. Способ лечения немелкоклеточного рака легких, где способ включает стадии введения пациенту дозы соединения ЕС 145 формулы или его фармацевтически приемлемой соли посредством внутривенной болюсной инъекции дважды в неделю в течение первой и второй недель из трехнедельного цикла лечения и введения пациенту дозы доцетаксела в течение 1 ч в первые сутки трехнедельного цикла терапии. 24. Способ по п.23, где доза указанного соединения или его фармацевтически приемлемой соли составляет 2,5 мг. 25. Способ по п.23, где доза доцетаксела составляет 75 мг/м 2 площади поверхности тела.
МПК / Метки
МПК: G01N 33/574
Метки: рака, лечения, набор, способ
Код ссылки
<a href="https://eas.patents.su/25-25069-sposob-i-nabor-dlya-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Способ и набор для лечения рака</a>
Предыдущий патент: Чистящие средства для твердых поверхностей на основе смесей, полученных в результате метатезиса натуральных масел
Следующий патент: Способ получения фармацевтической композиции, содержащей ипн
Случайный патент: Транспортная система юницкого ( варианты ) и способ построения транспортной системы












