Способы крупномасштабного производства выведенных из рекомбинантной днк молекул tpa или k2s
Номер патента: 5163
Опубликовано: 30.12.2004
Авторы: Гётц Фридрих, Маносрои Араня, Маносрои Йирадей, Вернер Рольф-Гюнтер, Таяпиватана Чатчай
Формула / Реферат
1. Способ получения тканевого активатора плазминогена (tPA), варианта tPA, молекулы несущей домен kringle 2 и серинпротеазу (K2S) или варианта K2S в прокариотических клетках, где tPA, вариант tPA, молекула K2S или вариант K2S секретируется внеклеточно в виде активного протеина с правильной складчатостью, отличающийся тем, что прокариотическая клетка содержит и экспрессирует вектор, включающий ДНК, которая кодирует tPA, вариант tPA, молекулу K2S или вариант K2S, функционально связанную с ДНК, которая кодирует сигнальный пептид OmpA.
2. Способ по п.1, отличающийся тем, что прокариотическая клетка содержит и экспрессирует вектор, который включает ДНК, кодирующую tPA, вариант tPA, молекулу K2S или вариант K2S, функционально связанную с ДНК, которая кодирует сигнальный пептид OmpA, функционально связанный с молекулой нуклеиновой кислоты, имеющей последовательность TCTGAGGGAAACAGTGAC (SEQ ID NO:1), или ее функционально активным производным.
3. Способ по п.1 или 2, отличающийся тем, что прокариотическая клетка представляет собой E. coli.
4. Способ по любому из пп.1-3, отличающийся тем, что осуществляют следующие стадии:
а) амплифицируют с помощью ПЦР ДНК, кодирующую tPA, вариант tPA, молекулу K2S или вариант K2S;
б) очищают ПЦР-продукт;
в) встраивают указанный ПЦР-продукт в вектор, включающий ДНК, которая кодирует сигнальный пептид OmpA, и ДНК, которая кодирует gpIII, таким образом, чтобы ПЦР-продукт в этом векторе был функционально связан против хода транскрипции с ДНК, кодирующей сигнальную последовательность OmpA, и связан по ходу транскриции с ДНК, кодирующей gpIII;
г) встраивают стоп-кодон между tPA, вариантом tPA, молекулой K2S или вариантом K2S и gpIII;
д) экспрессируют вектор с помощью прокариотической клетки;
е) очищают tPA, вариант tPA, молекулу K2S или вариант K2S.
5. Способ по любому из пп.1-4, отличающийся тем, что вектор представляет собой фагмидный вектор, включающий ДНК, которая кодирует сигнальный пептид OmpA, и ДНК, которая кодирует gpIII.
6. Способ по любому из пп.1-5, отличающийся тем, что вектор представляет собой фагмидный вектор pCombS3HSS.
7. Способ по любому из пп.1-6, отличающийся тем, что последовательность ДНК OmpA, связанная против хода транскрипции с K2S, включает следующую последовательность или ее вариант, полученный вследствие вырожденности нуклеотидного кода:
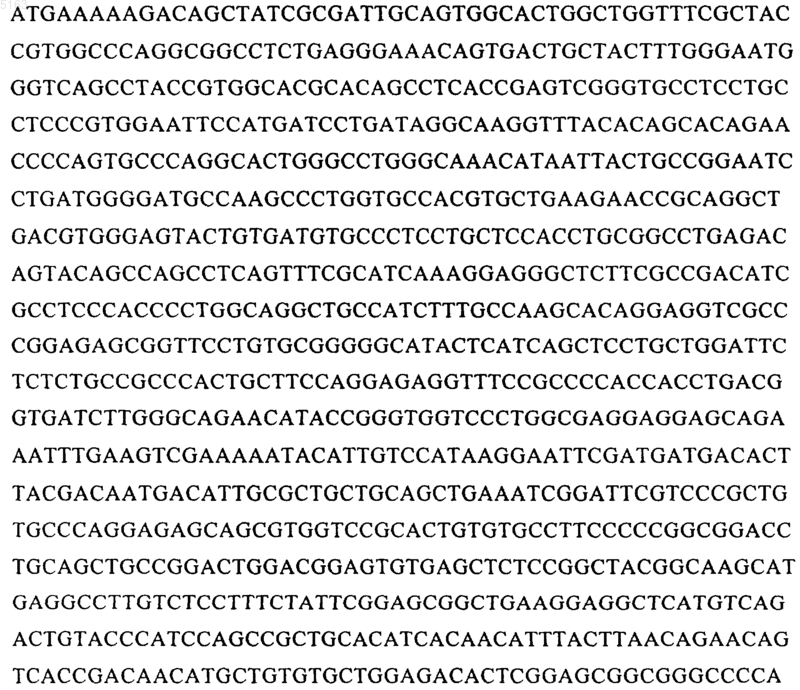
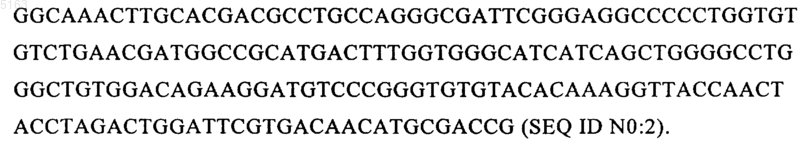
8. Способ по любому из пп.1-7, отличающийся тем, что последовательность ДНК OmpA включает следующую последовательность:

9. Способ по любому из пп.1-8, отличающийся тем, что последовательность ДНК OmpA имеет следующую последовательность:

10. Способ по любому из пп.1-9, отличающийся тем, что перед ДНК, кодирующей tPA, вариант tPA, молекулу K2S или вариант K2S, расположен промотор lac и/или сайт связывания рибосомы.
11. Способ по любому из пп.1-10, отличающийся тем, что ДНК, кодирующую tPA, вариант tPA, молекулу K2S или вариант K2S, выбирают из группы, включающей молекулы ДНК, кодирующие по меньшей мере 90% аминокислот 87 - 527, 174 - 527, 180 - 527 или 220 - 527 протеина человеческого тканевого активатора плазминогена.
12. Способ по любому из пп.5-11, отличающийся тем, что последовательность ДНК K2S включает следующую последовательность или ее вариант, полученный вследствие вырожденности нуклеотидного кода:
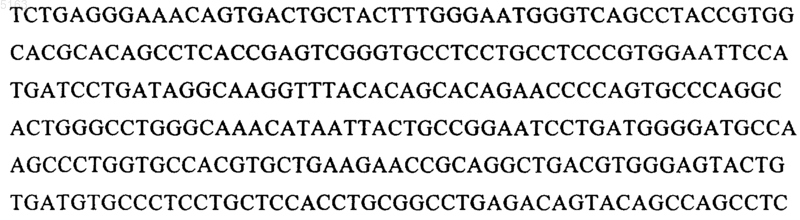

13. Способ по любому из пп.5-12, отличающийся тем, что последовательность ДНК K2S содержит следующую последовательность:


14. Молекула ДНК, отличающаяся тем, что она кодирует
а) протеин OmpA, функционально связанный с
б) молекулой ДНК, кодирующей полипептид, который содержит домен kringle 2 и серинпротеазу протеина тканевого активатора плазминогена.
15. Молекула ДНК по п.14, отличающаяся тем, что последовательность ДНК включает следующую последовательность или ее вариант, полученный вследствие вырожденности нуклеотидного кода:
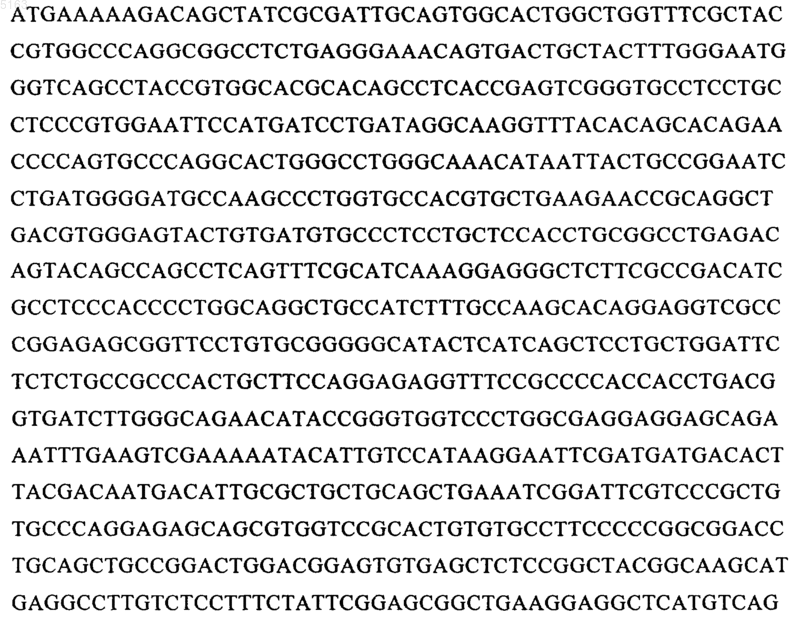
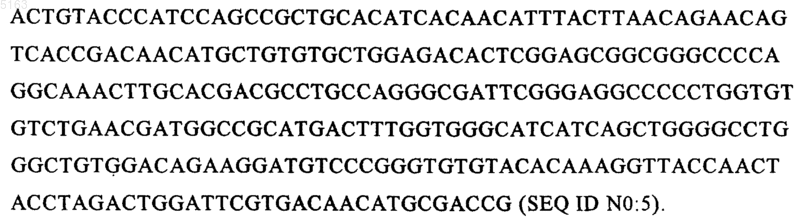
16. Молекула ДНК по любому из пп.14 или 15, отличающийся тем, что последовательность ДНК содержит следующую последовательность:
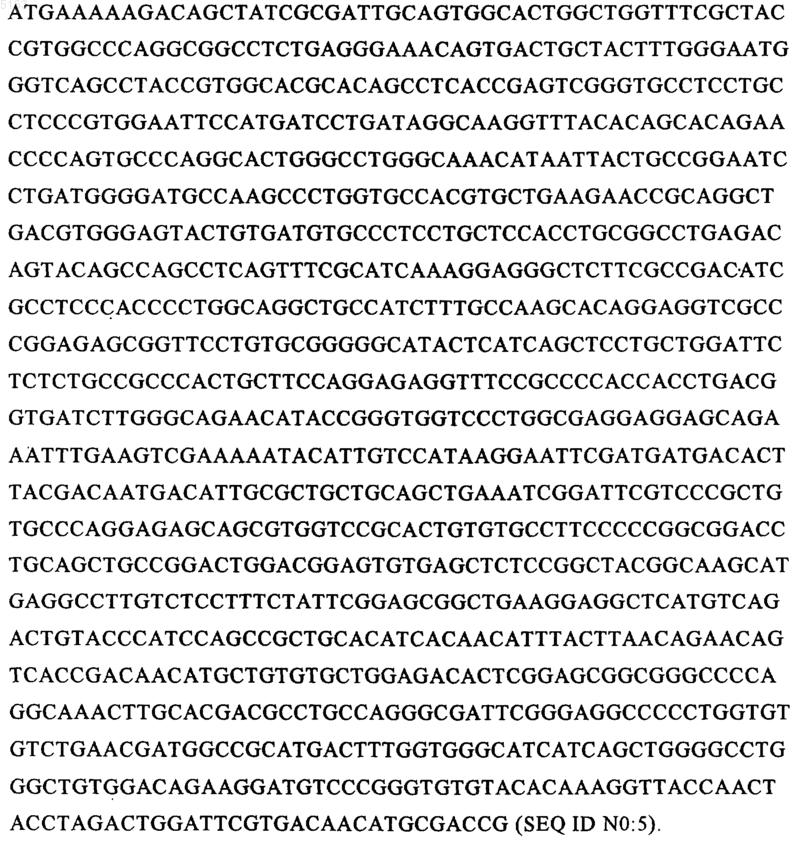
17. Молекула ДНК по любому из пп.14-16, отличающаяся тем, что последовательность ДНК, указанная в б), кодирует по меньшей мере 90% аминокислот 87-527 протеина человеческого тканевого активатора плазминогена.
18. Молекула ДНК по любому из пп.14-17, отличающаяся тем, что последовательность ДНК, указанная в б), кодирует по меньшей мере 90% аминокислот 174-527 протеина человеческого тканевого активатора плазминогена.
19. Молекула ДНК по любому из пп.14-18, отличающаяся тем, что последовательность ДНК, указанная в б), кодирует по меньшей мере 90% аминокислот 180-527 протеина человеческого тканевого активатора плазминогена.
20. Молекула ДНК по любому из пп.14-19, отличающаяся тем, что последовательность ДНК, указанная в б), кодирует по меньшей мере 90% аминокислот 220-527 протеина человеческого тканевого активатора плазминогена.
21. Молекула ДНК по любому из пп.14-20, отличающаяся тем, что последовательность ДНК, указанная в б), гибридизуется в строгих условиях со следующей последовательностью:


22. Молекула ДНК по любому из пп.14-21, отличающаяся тем, что последовательность ДНК, указанная в б), содержит следующую последовательность:
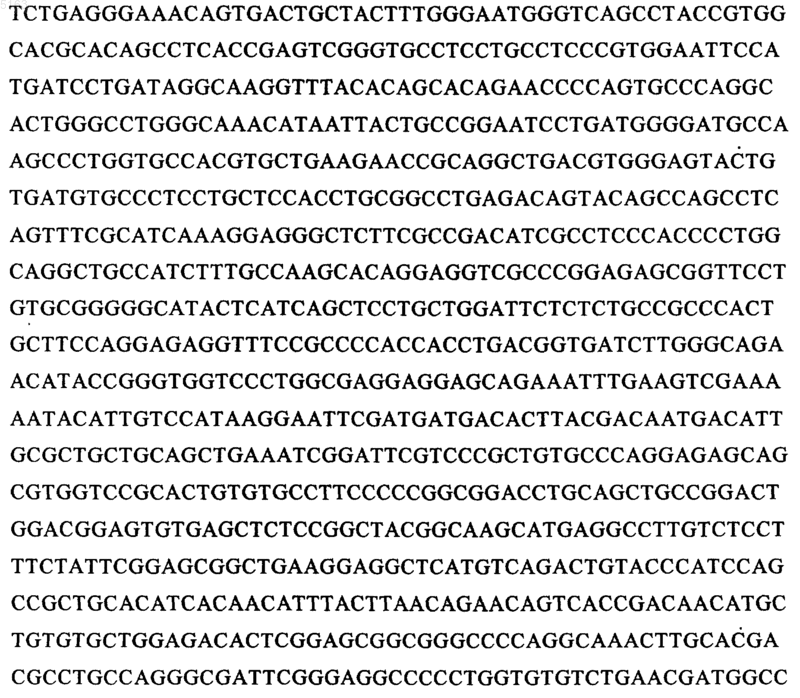

23. Слитый протеин OmpA и K2S, отличающийся тем, что он включает протеин, имеющий следующую аминокислотную последовательность:

24. Слитый протеин OmpA и K2S по п.23, отличающийся тем, что, включает протеин, имеющий следующую аминокислотную последовательность:

25. Протеин K2S, отличающийся тем, что он имеет следующую аминокислотную последовательность:

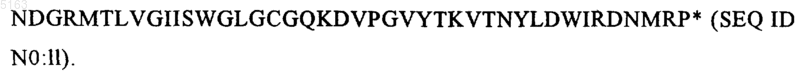
26. Вектор, содержащий последовательность ДНК по любому из пп.14-22.
27. Вектор по п.26, где перед последовательностью ДНК расположен промотор lac и сайт связывания рибосомы.
28. Вектор pComb3HSS, включающий ДНК по любому из пп.14-22, где экспрессию протеина gpIII подавляют или ингибируют с помощью делеции молекулы ДНК, кодирующей протеин gpIII, или с помощью стоп-кодона, расположенного между геном, кодирующим полипептид, который включает домен kringle 2 и серинпротеазу протеина тканевого активатора плазминогена, и геном протеина III.
29. Прокариотическая клетка-хозяин, содержащая молекулу ДНК по любому из пп.14-22.
30. Прокариотическая клетка-хозяин, содержащая вектор по любому из пп.26-28.
31. Клетка-хозяин E. coli, содержащая молекулу ДНК по любому из пп.14-22.
32. Клетка-хозяин E. coli, содержащая вектор по любому из пп.26-28.
33. Применение молекулы ДНК по любому из пп.14-22 или вектора по любому из пп.26-28 или клетки-хозяина по любому из пп.29-32 в способе получения полипептида, обладающего активностью тканевого активатюЁр плазминогена.
34. Применение по п.33, где указанный способ представляет собой способ по любому из пп.1-13.
Текст
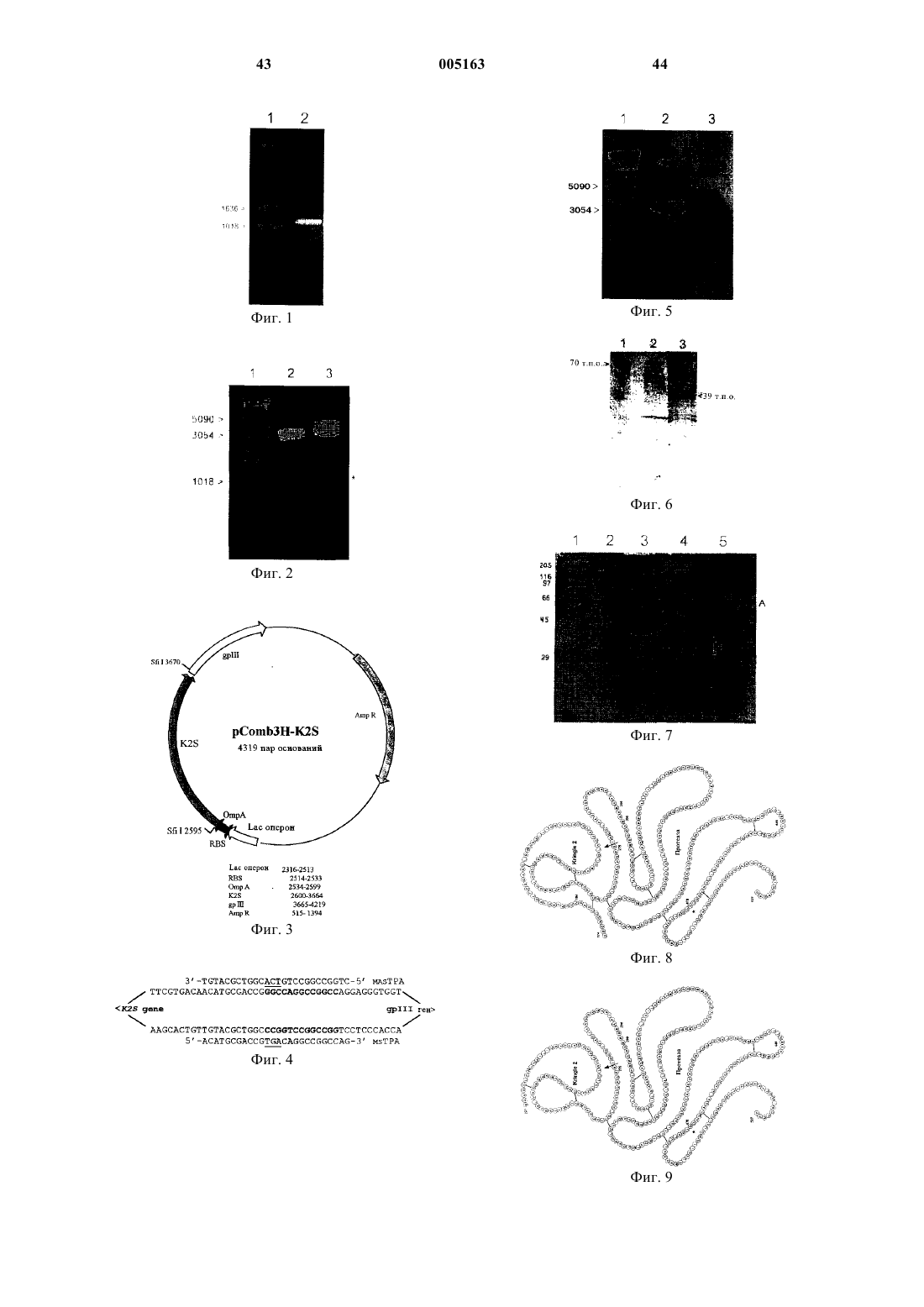
1 Изобретение относится к тромболизу и получению производного тканевого активатора плазминогена (tPA) в прокариотических клетках. Изобретение относится к способам получения выведенных из рекомбинантной ДНК тканевого активатора плазминогена (tPA), его варианта, молекулы K2S (несущей кренделеобразный домен 2 и сериновый домен) (K2S) или ее варианта в прокариотических клетках,где tPA или K2S или вариант секретируются внеклеточно в виде активного протеина с правильной складчатостью, и прокариотическая клетка содержит и экспрессирует вектор, который несет ДНК, кодирующую tPA или K2S или вариант, которая функционально связана с ДНК,кодирующей сигнальный пептид ОmpА. Изобретение относится также к специфическим производным K2S, которые можно получать указанным способом. Кроме того, изобретение относится к молекулам ДНК и к применению этих молекул ДНК согласно указанным способам. Предпосылки создания изобретения Тканевый активатор плазминогена (tPA) представляет собой полипептид, содержащий 527 аминокислотных остатков (27), молекулярная масса которого составляет 72 кДа. Молекула содержит 5 структурных доменов. Вблизи Nконцевой области расположен образующий петлю пальцеобразный (finger) домен, за которым расположен домен фактора роста. За ними находятся два аналогичных домена кренделеобразный домен 1(kringle 1) и кренделеобразный домен 2 (kringle 2). Как пальцеобразный домен, так и кренделеобразный домен 2, специфично связываются с фибриновыми сгустками, усиливая тем самым активацию связанного плазминогена протеином tPA. Далее по ходу транскрипции относительно кренделеобразного домена 2 расположена сериновая протеаза, каталитический сайт которой локализован на С-конце. Сериновая протеаза ответственна за превращение плазминогена в плазмин, т.е. за реакцию, играющую важную роль в гомеостазе образования фибрина и рассасывания сгустка. Для правильной складчатости tPA необходимо правильное спаривание 17 дисульфидных мостиков в молекуле (1). В клинических условиях tPA используют в качестве тромболитического агента для лечения острого инфаркта миокарда, легочной эмболии,удара, периферических артериальных окклюзии и других тромбоэмболических заболеваний. Его преимуществом является отсутствие побочных воздействий, связанных с системным кровотечением и истощением фибриногена (7). Первоначально для получения tPA в терапевтических целях использовали клетки бычьей меланомы (12). Поскольку для клинических целей необходимо иметь стабильный процесс,обеспечивающий эффективное получение высо 005163 2 коочищенного протеина с достаточным выходом, была создана полноразмерная рекомбинантная молекула tPA (r-tPA), экспрессирующаяся в клетках млекопитающих. Клетки яичника китайского хомячка трансфектировали геном tPA для 8 синтеза r-tPA (8, 22). Выведенный из рекомбинантной ДНК продукт, полученный с помощью ферментационной системы с использованием культур клеток млекопитающих, собирали и очищали от культуральной среды. Принимая во внимание простоту и экономичность производства, были предприняты многочисленные попытки получения r-tPA из микроорганизмов, прежде всего из бактерий, и более предпочтительно из Escherichia coli (10,13, 30). Для решения проблем, связанных с низким выходом и образованием внутриклеточных телец, что приводило к неправильной складчатости и инактивации фермента, был предложен целый ряд стратегий. Было предложено несколько вариантов делеционных мутантов, содержащих кренделеобразный домен 2 и сериновую протеазу (K2S). Однако проявление ферментативной активности рекомбинантной молекулы K2S (r-K2S) достигалось только после процессов повторного образования складчатости выделенных из цитоплазматического компартмента внутриклеточных телец (16, 29). Для того, чтобы избежать сложности процессов повторного образования складчатости, загрязненности протеинами с неправильной складчатостью и переноса протеинов в периплазму, применяли специальные бактериальные системы экспрессии (6, 31). Несмотря на периплазматическую экспрессию tPA,сверхэкспрессия приводила к получению неактивных агрегатов даже в условиях относительно высокого окисления в периплазме. Из прототипов известно несколько описаний методов получения рекомбинантной молекулы K2S в Е. coli. Однако отсутствует описание метода, обеспечивающего эффективное с точки зрения стоимости крупномасштабное производство биологически активной молекулыK2S. У Obukowicz с соавторами (25) предложен метод экспрессии и очистки r-K2S из периплазматического пространства. Очевидным недостатком этого метода является дополнительная стадия экстракции из периплазмы, непригодная для крупномасштабного производства. У Saito с соавторами (29) описана экспрессия r-K2S в цитоплазме. Для экспрессии молекулы r-K2S, которую выделяли из цитоплазматического пространства Е. coli в виде внутриклеточного тельца, авторы использовали процессы ренатурации in vivo. Исследователи фирмы Boehringer Mannheim применяли аналогичный сложный процесс денатурации/повторного образования складчатости, включающий стадии расщепления клеток, солюбилизации в денатурирующих и восстанавливающих условиях и 3 реактивации в окислительных условиях в присутствии GSH/GSSG (восстановленный глутатион/окисленный глутатион), который является не эффективным с точки зрения стоимости (24) и для которого необходима мутация аминокислотной последовательности, что может сопровождаться появлением антигенных свойств. В 1991 г. Waldenstrom с соавторами (34) сконструировали вектор (pEZZK2P) для секреции конструкции кренделеобразный домен 2 плюс домен сериновой протеазы в супернатант культуры Е.coli. Для удаления слитого протеинаZZ из очищенной с помощью IgG-Сефарозы фракции использовали гидроксиламин. Для расщепляющего агента гидрокисламина необходима модификация сайтов расщепления конструкции кренделеобразный домен 2 плюс сериновая протеаза (Asn177- Ser и Asn184- Gin),обеспечивающая защиту ее от расщепления гидроксиламином. Однако полученную в результате этого не встречающуюся в естественных условиях молекулу K2S с неправильной складчатостью нельзя применять для терапевтических целей. Она не обладает ферментативной активностью в отношении связывания фибрина/протеазной активностью. Не встречающаяся в естественных условиях последовательность может даже активировать человеческую иммунную систему. Таким образом, в основу настоящего изобретения была положена задача разработать приемлемый с коммерческой точки зрения способ крупномасштабного производства молекулtPA и их производных, например, K2S, который предусматривает секрецию молекулы K2S в биологически активной форме в супернатант культуры. Подробное описание изобретения Пути решения поставленной задачи представлены в формуле и описании настоящего изобретения. Изобретение не ограничено применением одного или нескольких пунктов формулы изобретения или описания, а включает также их модификации. Изобретение относится к способу получения выведенных из рекомбинантной ДНК тканевого активатора плазминогена (tPA), варианта tPA, молекулы, содержащей кренделеобразный домен 2 и домен сериновой протеазы(K2S), или варианта K2S в прокариотических клетках, где tPA, вариант tPA, молекула K2S или вариант K2S секретируются внеклеточно в виде активного протеина с правильной складчатостью, и прокариотическая клетка содержит и экспрессирует вектор, который несет ДНК, кодирующую tPA вариант tPA, молекулу K2S или вариант K2S, функционально связанную с ДНК,которая кодирует сигнальный пептид ОmpА или его функционально активное производное. При создании изобретения неожиданно было установлено, что сигнальный пептид ОmрА индивидуально и/или в сочетании с N 005163NO:9)/ SEGNSD (SEQ ID NO: 10) переносит выведенные из рекомбинантной ДНК tPA, вариант tPA, молекулу K2S или вариант K2S к внешней поверхности и облегчает высвобождение функциональной и активной молекулы в культуральную среду в большей степени, чем это достигается при использовании любого другого известного из существующего уровня техники метода. Согласно способу по изобретению перед пересечением наружной мембраны выведенный из рекомбинантной ДНК протеин приобретает правильную складчатость. Сигнальный пептид отщепляется, образуя зрелую молекулу. Неожиданно было установлено, что эффективность удаления сигнального пептида является очень высокой и приводит к правильной складчатости выведенного из рекомбинантной ДНК протеина. Сигнальный пептид ОmpА взаимодействует с SecE и его перенос через внутреннюю мембрану осуществляется с помощью энергии, которая генерируется SecA при связывании с компонентами Sec (SecE-SecY).SecY образует поры для секреции, предназначенные для переноса выведенного из рекомбинантной ДНК протеина по изобретению. Пространство между наружной мембраной и внутренней мембраной грамотрицательных бактерий, т.е. периплазма, обладает более высокими окислительными условиями по сравнению с цитоплазматическим пространством. Это способствует образованию дисульфидных мостиков и правильной складчатости выведенного из рекомбинантной ДНК протеина (например, K2S) в периплазме, что приводит к получению активной молекулы. Согласно настоящему изобретению сигнальный пептид должен отщепляться с образованием зрелой молекулы. Комплекс, включающий секретин GspD и липопротеин GspS на наружной мембране служит в качестве воротного механизма ионного канала для секреции выведенного из рекомбинантной ДНК протеина по изобретению во внеклеточную среду. Для этого процесса секреции требуется энергия которая образуется в цитоплазме с помощью связывающего нуклеотид GspE протеина, и затем переносится на протеин внутренней мембраны (Gsp G-J, F и K-N). GspC переносит энергию на GspD путем образования поперечной связи между рядом протеинов внутренней мембраны (Gsp G-J, F и K-N) и GspD. Перед успешным пересечением наружной мембраны выведенный из рекомбинантной ДНК протеин приобретает правильную складчатость. Согласно изобретению понятие функционально связанный обозначает, что ДНК, кодирующую tPA, вариант tPA, молекулу K2S или вариант K2S (предпочтительно содержащую нуклеиновую кислоту, которая кодирует SEGN или SEGNSD на N-конце), клонируют в векторе в непосредственной близости с ДНК ОmpА для достижения экспрессии слитого протеина ОmpА 5 и tPA, варианта tPA, молекулы K2S или варианта K2Sn и для направления секреции наружу из прокариотической клетки-хозяина. Как правило,секретируется большая часть tPA, вариантовtPA, молекул K2S или вариантов K2S, и их можно затем очищать с помощью приемлемых методов, таких как осаждение сульфатом аммония и/или аффинная хроматография, и с помощью дополнительных стадий очистки. Под объем изобретения подпадает также применение индукторов, таких как ИПТГ (изопропилтиогалактозид) или ИПТГ в сочетании с глицерином,улучшение условий инкубации и периода сбора с целью максимального повышения количества активного протеина. Согласно предпочтительному варианту осуществления изобретения ДНК, кодирующую сигнальный пептид ОmpА, можно сливать с коротким пептидом, который отличается наличием аминокислотной последовательностиSEGN или SEGNSD кодирующей нуклеотидной последовательности TCTGAGGGAAAC(SEQ IDID NO:1), и локализован в N-концевой области или вблизи N-концевой области tPA, вариантаtPA, молекулы K2S или варианта K2S. Так,предпочтительно этот слитый протеин содержитOmpA-SEGNSD-tPA,-tPA-вариант,-K2SMoneKyna или -K2S-BapnaHT. Еще более предпочтительно эти аминокислотные последовательности, характеризующиеся наличием SEGN или SEGNSD, могут иметь точковую мутацию или могут быть заменены на не встречающиеся в естественных условиях аминокислоты. И еще более предпочтительно между ОтрА и SEGN или SEGNSD и tPA, вариантом tPA, молекулой K2S или вариантом K2S может находиться аминокислотный или неаминокислотный спейсер. Таким образом, согласно предпочтительному способу по изобретению прокариотическая клетка содержит и экспрессирует вектор,содержащий ДНК, которая кодирует tPA, вариант tPA, молекулу K2S или вариант K2S, функционально связанный с ДНК, которая кодирует сигнальный пептид OmpA, функционально связанный с молекулой нуклеиновой кислоты, которая имеет последовательностьTCTGAGGGAAACAGTGAC, или с ее функционально активным производным. Способ по изобретение предусматривает применение прокариотических клеток-хозяев,таких как (но не ограничиваясь ими) Escherichiamirabilis, Saccharomyces, Pichia или Staphylococcus, например, Staphylococcus carnosus. Предпочтительно клетка-хозяин по изобретению представляет собой грамотрицательную бактерию. Предпочтительно способ по изобретению отличается также тем, что прокариотическая 6 клетка представляет собой E. coli. Пригодные штаммы включают (но не ограничиваясь ими) штаммы E. coli XL-1 blue, BL21(DE3), JM109,DH-серии, ТОРЮ и НВ 101. Предпочтительно способ по изобретению отличается также тем, что осуществляют следующие стадии: а) амплифицируют с помощью ПЦР ДНК,кодирующую tPA, вариант tPA, молекулу K2S или вариант K2S; б) очищают ПЦР-продукт; в) встраивают указанный ПЦР-продукт в вектор, содержащий ДНК, которая кодирует сигнальный пептид OmpA, и ДНК, которая кодирует gpIII, таким образом, чтобы ПЦРпродукт в этом векторе был функционально связан против хода транскрипции с ДНК, кодирующей сигнальную последовательность OmpA,и связан по ходу транскриции с ДНК, кодирующей gpIII; г) встраивают стоп-кодон между tPA, вариантом tPA, молекулой K2S или вариантомK2S или вариант K2S. При осуществлении стадии а) способа по изобретению выбор/создание праймеров является важным для клонирования в экспрессионном векторе ДНК в правильной локализации и направлении (см. пример 1). Так,праймеры, которые приведены в качестве примера в примере 1 и на фиг. 4, являются важным объектом настоящего изобретения. Указанный на стадии в) gp III, т.е. ген протеина III, представляет собой ген, который присутствует главным образом в фагмидных векторах. Стопкодон встраивают для того, чтобы избежать транскрипции gp III, что в конце концов приводит к секреции представляющего интерес tPA,варианта tPA, молекулы K2S или варианта K2S. Для встраивания стоп-кодона можно применять любой пригодный метод, такой как сайтнаправленный мутагенез (см., например, у Weiner MP,Costa GL (1994) PCR Methods Appi 4(3):S131136; Weiner MP, Costa GL, Schoettlin W, Cline J,Mathur E, BauerJC (1994) Gene 151(1-2): 119123; см. также пример 1). Согласно изобретению можно применять любой вектор, предпочтительно вектор представляет собой фагмидный вектор (см. ниже). Предпочтительно способ по изобретению отличается также тем, что tPA, вариант tPA,молекулу K2S или вариант K2S выбирают из ряда, включающего человеческий тканевый активатор плазминогена (tPA, фиг. 16) или его фрагмент, функционально активный вариант,аллельный вариант, субъединицу, химическое производное, слитый протеин или их гликозилированные варианты. Такие фрагменты, аллельные варианты, функционально активные варианты, варианты, полученные благодаря вы 7 рожденности нуклеотидного кода, слитые протеины с протеином tPA по изобретению, химические производные или гликозилированный вариант протеинов tPA по изобретению могут содержать один, несколько или все перечисленные ниже домены или субъединицы или варианты: 1. Пальцеобразный домен (4-50). 2. Домен фактора роста (50-87). 3. Кренделеобразный домен 1 (87-176). 4. Кренделеобразный домен 2 (176-262). 5. Протеазный домен (276-527). Нумерация/название доменов соответствует нумерации/названию, приведенным для протеина, имеющего регистрационный номер Genbank GI 137119, или они описаны в Nature 301(5897), 214-221 (1983). Более предпочтительно способ по изобретению отличается также тем, что 5 tPA, вариантtPA, молекулу K2S или вариант K2S выбирают из ряда, включающего Кренделеобразный домен 2 (4.) плюс домен сериновой протеазы(5.), вариант K2S человеческого тканевого активатора плазминогена или его фрагмент, функционально активный вариант, аллельный вариант, субъединицу, химическое производное,слитый протеин или их гликозилированные варианты. Более предпочтительно способ по изобретению отличается также тем, что вектор представляет собой фагмидный вектор, содержащий ДНК, которая кодирует сигнальный пептидOmpA, и ДНК, которая кодирует gpIII. Более предпочтительно способ по изобретению отличается также тем, что вектор представляет собой фагмидный вектор pComb3HSS(см. также пример 1). Более предпочтительно способ по изобретению отличается также тем, что последовательность ДНК содержит или представляет собой приведенную ниже последовательность ДНК, которая кодирует OmpA и K2S или ее функционально активный вариант или вариант,полученный благодаря вырожденности нуклеотидного кода: Более предпочтительно способ по изобретению отличается также тем, что последова 005163 8 тельность ДНК OmpA содержит или представляет собой приведенную ниже последовательность или ее функционально активный вариант или вариант, полученный благодаря вырожденности нуклеотидного кода:GGCGGCC (SEQ ID NO:3). Указанная ДНК кодирует приведенную ниже аминокислотную последовательностьOmpA. Таким образом, OmpA содержит или представляет собой протеин, который отличается тем, что приведенная ниже аминокислотная последовательность MKKTAIAIAVALAGFATVAQAA (SEQ ID NO:21) или ее фрагмент,функционально активный вариант, аллельный вариант, субъединица, химическое производное или гликозилированный вариант подпадают под объем изобретения. Нетранслируемая область может содержать регуляторный элемент, такой, например,как инициатор транскрипции (промотор) или энхансер. Промотор может, например, представлять собой конститутивный, индуцибельный или контролируемый стадией развития промотор. Предпочтительно (но не исключая другие известные промоторы) используют конститутивные промоторы человеческого цитомегаловируса (ЦМВ) и вируса саркомы Рауса(РСВ), а также обезьянего вируса 40 (ОВ-40) и промотор вируса герпеса простого. Согласно изобретению индуцибельные промоторы представляют собой промоторы, обеспечивающие устойчивость к антибиотикам, промоторы, индуцируемые тепловым шоком, индуцируемый гормонами промотор вируса рака молочной железы и промотор металлотионеина. Предпочтительные промоторы включают промотор фага Т 3, промотор фагаТ 7, Lac/aral и LtetO-1. Более предпочтительно способ по изобретению отличается также тем, что ДНК, кодирующую tPA, вариант tPA, молекулу K2S или вариант K2S, помещают под контроль промотора lac и/или сайта связывания рибосомы, такого как последовательность Шайна-Дальгарно (см. также пример). Более предпочтительно способ по изобретению отличается также тем, что ДНК, кодирующую tPA, вариант tPA, молекулу K2S или вариант K2S, выбирают из группы молекул ДНК, кодирующих по меньшей мере 90% аминокислот 87-527, 174 - 527, 180 - 527 или 220 527 протеина человеческого тканевого активатора плазминогена. Более предпочтительно способ по изобретению отличается также тем, что последовательность ДНК K2S содержит или представляет собой следующую последовательность: Настоящее изобретение относится также к вариантам описанных выше молекул нуклеиновых кислот, полученным благодаря вырожденности нуклеотидного кода, или их фрагментам,к нуклеиновым кислотам, которые гибридизуются с указанными нуклеиновыми кислотами в строгих условиях, к их аллельным и функционально активным вариантам. Изобретение относится также к нуклеиновым кислотам, которые содержат нуклеиновую кислоту K2S, слитую с нуклеиновой кислотой, кодирующей молекулу другого протеина. Строгие условия, как должно быть очевидно специалистам в данной области, представляют собой условия, которые позволяют отбирать нуклеиновые кислоты, гомологичные более чем на 85%, предпочтительно более чем на 90%Laboratory Press, Cold Spring Harbor, New York). Гибридизацию следует осуществлять, например, в смеси: 6 х SSC/5x раствор Денхардта/0,1% ДСН (ДСН обозначает додецилсульфат натрия) при 65 С. Степень строгости определяется на стадии отмывки. Так, например, для отбора последовательностей ДНК, гомология которых составляет примерно 85% или более, пригодны следующие условия: 0,2 х SSC/0,01% ДСН/65 С, а для отбора последовательностей ДНК, гомология которых составляет примерно 90% или более, пригодны следующие условия: 0,lx SSC/ 0,01% ДСН/ 65 С. Состав указанных реагентов описан у Sambrook и др. (1989, выше). Другим важным объектом настоящего изобретения является вариант человеческого тканевого активатора плазминогена, содержащий или представляющий собой протеин: кренделеобразный домен 2 (4.) плюс сериновая протеаза(5.) (сокращенно K2S) или его вариант или фрагмент, функционально активный вариант,аллельный вариант, субъединица, химическое производное или их гликозилированные варианты. Нумерация/название доменов соответствует нумерации/названию, приведенным для протеина, имеющего регистрационный номер Gen 005163bank GI 137119, или они описаны в Nature 301(5897), 214-221 (1983), причем кренделеобразный домен 2 простирается от аминокислоты 176 до 262, а протеазный домен от аминокислоты 276 до 527. Таким образом, согласно изобретению предпочтительная молекула K2S может содержать аминокислоты 176-527, включая аминокислоты между кренделеобразным доменом 2 и доменом протеазы (аминокислоты 263 - 275; см. пример, приведенный на чертеже(структура А. Молекула K2S по изобретению содержит минимальный фрагмент кренделеобразного домена 2 и домен протеазы, еще сохраняющий протеазную активность и активность в отношении связывания с фибрином(указанные активности оценивали, например,согласно методам, приведенным в описании/примерах). Молекула K2S по изобретению содержит аминокислоты SEGN или SEGNSD наN-конце (см. выше).Предпочтительная молекула А не содержит аминокислоты 1-3 или 1-5 молекулы tPA. Предпочтительно молекула K2S по изобретению содержит аминокислоту Asn в положениях 177 и 184, т.е. для не требуются описанные у Waldenstrom модификации для улучшения продуктивности согласно способу по изобретению. Таким образом, предпочтительная молекула K2S по изобретению имеет нативную аминокислотную последовательность (без мутации) в отличие от известных из прототипов молекул. Наиболее предпочтительная молекулаK2S по изобретению представляет собой молекулу, которая отличается наличием нативной аминокислотной последовательности или ее фрагмента, не содержит ни аминокислот 1-3, ни 1-5 tPA и содержит N-концевые аминокислотыSEGN или SEGNSD для улучшения продуктивности и/или правильной складчатости молекулы. Важно, что протеин K2S по изобретению содержит на N-конце пептид, имеющий аминокислотную последовательность SEGN, что позволяет осуществлять промышленное производство с помощью описанного выше способа секретируемого протеина K2S с правильной складчатостью. Указанные 4 аминокислоты, обозначенные как SEGN, могут содержать на N-конце еще одну или несколько аминокислот, однако указанные аминокислоты должны быть локализованы в N-концевой области, а не в С-концевой области. Более предпочтительно указанные аминокислоты локализованы в N-концевой области. Предпочтительно аминокислоты, обозначенные как SEGN, могут нести точковую мутацию или могут иметь замены на не встречающуюся в естественных условиях аминокислоты. Таким образом, еще одним важным объектом изобретения является протеин K2S, отличающийся тем, что он содержит аминокислоты,последовательность которых обозначена какSEGN, или его вариант или фрагмент, функционально активный вариант, аллельный вариант, 11 субъединица, химическое производное, слитый протеин или их гликозилированные варианты. Примеры таких фрагментов, простирающихся от аминокислоты 193 до аминокислоты 527 приведены, например, на фиг. 10 (структура Б-1) и на фиг. 11 (структура Б-2). В структуре Б 1 присутствует нативная аминокислота Cys в положении 261, а в структуре Б-2 эта аминокислота заменена Ser. Другие фрагменты по изобретению, включающие аминокислоты 220-527(фиг. 14, структура В) или аминокислоты 260527 (фиг. 15, структура Г), можно модифицировать согласно изобретению путем добавления аминокислот SEGN и/или замены Cys-261 наSer. Специалист в данной области может определить минимальную длину молекулы K2S по изобретению, необходимую для сохранения ее биологической функции, и получить молекулуK2S, обладающую повышенной продуктивностью и/или правильной складчатостью, путем добавления аминокислот SEGN в N-концевую область. Таким образом, еще одним предпочтительным вариантом осуществления изобретения является указанная минимальная по размеру молекула K2S, несущая SEGN в N-концевой области. Следующим важным объектом изобретения является протеин K2S, отличающийся тем,что он содержит аминокислоты, последовательность которых обозначена как SEGNSD, или его вариант или фрагмент, функционально активный вариант, аллельный вариант, субъединицу,химическое производное, слитый протеин или их гликозилированные варианты. Примеры таких фрагментов, простирающихся от аминокислоты 191 до аминокислоты 527 приведены, например, на фиг. 12 (структура Б-3) и на фиг. 13(структура Б-4). В структуре Б-3 присутствует нативная аминокислота Cys в положении 261, а в структуре Б-4 эта аминокислота заменена Ser. Другие фрагменты по изобретению, включающие аминокислоты 220-527 (фиг. 14, структура В) или аминокислоты 260-527 (фиг. 15, структура Г), можно модифицировать согласно изобретению путем добавления аминокислот SEGNSD и/или замены Cys-261 на Ser. Специалист в данной области может определить минимальную длину молекулы K2S по изобретению, необходимую для сохранения ее биологической функции, и получить молекулу K2S, обладающую повышенной продуктивностью и/или правильной складчатостью, путем добавления аминокислот SEGNSD в N-концевую область. Таким образом, еще одним предпочтительным вариантом осуществления изобретения является указанная минимальная по размеру молекула K2S,несущая SEGNSD в N-концевой области. Еще одним предпочтительным вариантом осуществления настоящего изобретения является протеин K2S, который содержит протеин,отличающийся наличием следующей аминокислотной последовательности или ее варианта или 12 фрагмента, функционально активного варианта,аллельного варианта, субъединицы, химического производного или гликозилированного варианта: В настоящем описании звездочкойобозначен STOP (т.е. кодируемая стоп-кодоном аминокислота). Пример этой молекулы K2S приведен на фиг. 8. Одним из вариантов молекулы K2S по изобретению является слитый протеин K2S,который слит с молекулой другого протеина. Следующим предпочтительным вариантом осуществления настоящего изобретения является протеин K2S, представляющий собой протеин, который имеет следующую аминокислотную последовательность: Указанные молекулы K2S могут кодироваться описанной выше молекулой ДНК. Еще одним важным объектом изобретения является молекула ДНК, отличающаяся тем, что она кодирует: а) протеин OmpA или его функционально активное производное, функционально связанные с б) молекулой ДНК, которая кодирует полипептид, содержащий кренделеобразный домен 2 и домен сериновой протеазы протеина тканевого активатора плазминогена. Более предпочтительно молекула ДНК по изобретению отличается также тем, что последовательность ДНК содержит или представляет собой приведенную ниже последовательность ДНК, кодирующую OmpA и K2S, или ее функционально активный вариант или вариант, полученный вследствие вырожденности нуклеотидного кода: 13 Указанная молекула ДНК кодирует следующий слитый протеин OmpA и K2S. Этот слитый протеин OmpA и K2S, отличающийся тем, что он содержит или представляет собой протеин, который имеет приведенную ниже аминокислотную последовательность или его фрагмент, функционально активный вариант,аллельный вариант, субъединицу, химическое производное или их гликозилированные варианты, является важным объектом настоящего изобретения: Следующим предпочтительным объектом изобретения является молекула ДНК по изобретению, отличающаяся тем, что указанная в разделе б) последовательность ДНК кодирует по меньшей мере 90% аминокислот 87-527 протеина человеческого тканевого активатора плазминогена (в настоящем описании использована нумерация, предложенная для GI 137119 или описанная в Nature 301 (5897), 214-221 (1983. Еще одним предпочтительным объектом изобретения является молекула ДНК по изобретению, отличающаяся тем, что указанная в разделе б) последовательность ДНК кодирует по меньшей мере 90% аминокислот 174-527 протеина человеческого тканевого активатора плазминогена. Следующим предпочтительным объектом изобретения является молекула ДНК по изобретению, отличающаяся тем, что указанная в разделе б) последовательность ДНК кодирует по меньшей мере 90% аминокислот 180 - 527 протеина человеческого тканевого активатора плазминогена. Еще одним предпочтительным объектом изобретения является молекула ДНК по изобретению, отличающаяся тем, что указанная в разделе б) последовательность ДНК кодирует по меньшей мере 90% аминокислот 220 - 527 протеина человеческого тканевого активатора плазминогена. Следующим предпочтительным объектом изобретения является молекула ДНК по изобретению, отличающаяся тем, что указанная в разделе а) последовательность ДНК гибридизуется в строгих условиях со следующей последовательностью: Еще одним предпочтительным объектом изобретения является молекула ДНК по изобретению, отличающаяся тем, что указанная в разделе а) последовательность ДНК имеет следующую последовательность: 14 Следующим предпочтительным объектом изобретения является молекула ДНК по изобретению, отличающаяся тем, что указанная в разделе б) последовательность ДНК гибридизуется в строгих условиях со следующей последовательностью: Следующим предпочтительным объектом изобретения является молекула ДНК по изобретению, отличающаяся тем, что указанная в разделе б) последовательность ДНК имеет следующую последовательность: Еще одним предпочтительным вариантом осуществления изобретения является вектор,содержащий последовательность ДНК по изобретению. Следующим предпочтительным вариантом осуществления изобретения является вектор по изобретению, где указанная последовательность ДНК находится под контролем промотора lac и сайта связывания рибосомы. Приемлемые векторы по изобретению включают (но не ограничиваясь ими) вирусные векторы, такие, например, как вирус коровьей оспы, вирус СемликиФореста (Semliki-Forest) и аденовируса, фагмидные векторы и т.п. Предпочтительными являются векторы, которые целесообразно использовать в Е. coli, а также в другом прокарио 15 тическом хозяине, такие как pPROTet.E, pPROLar.A, представители семейства pBAD, семейства pSE, семейства pQE и pCAL. Еще одним предпочтительным вариантом осуществления изобретения является векторpComb3HSS, который содержит ДНК по изобретению, где экспрессию протеина gp III подавляют или ингибируют путем делении молекулы ДНК, кодирующей протеин gp III, или с помощью стоп-кодона, расположенного между геном, который кодирует полипептид, содержащий кренделеобразный домен 2 и домен сериновой протеазы протеина тканевого активатора плазминогена, и геном протеина III. Следующим важным объектом настоящего изобретения является прокариотическая клеткахозяин, содержащая молекулу ДНК по изобретению. Еще одним важным объектом настоящего изобретения является прокариотическая клеткахозяин, содержащая вектор по изобретению. Следующим важным объектом настоящего изобретения является клетка-хозяин Е. coli, содержащая молекулу ДНК по изобретению. Еще одним важным объектом настоящего изобретения является клетка-хозяин Е. coli, содержащая вектор по изобретению. И еще одним важным объектом настоящего изобретения является применение молекулы ДНК по изобретению или вектора по изобретению или клетки-хозяина по изобретению согласно методу получения полипептида, обладающего активностью тканевого активатора плазминогена. И еще одним важным объектом настоящего изобретения является применение по изобретению, как описано выше, где указанный способ представляет собой способ по изобретению. Еще одним очень важным объектом является фармацевтическая композиция, содержащая субстанцию, получаемую с помощью способа по изобретению, и фармацевтически приемлемые эксципиенты и носители. Примером такой субстанции является описанная выше молекула K2S. Понятие фармацевтически приемлемый носитель в контексте настоящего описания относится к общепринятым фармацевтическим эксципиентам или добавкам, применяемым в области приготовления фармацевтических препаратов. Такие физиологически приемлемые соединения включают, например, углеводы, такие как глюкоза, сахароза или декстраны, антиоксиданты, такие как аскорбиновая кислота или глутатион, хелатирующие агенты,низкомолекулярные протеины или другие стабилизаторы или эксципиенты (см., например,также Remington's Pharmaceutical Sciences (1990,18-ое изд., изд-во Mack Publ., Easton Указанную фармацевтическую композицию по изобретению целесообразно вводить внутривенно в виде болюса, например, в виде однократного 16 быстрого внутривенного введения больших объемов жидкости в течение 5-10 с. Изобретение относится также к применению субстанций, получаемых способом по изобретению, для приготовления лекарственного средства, предназначенного для лечения удара, инфаркта сердца, острого инфаркта миокарда, легочной эмболии, любой артериальной окклюзии, такой как окклюзия коронарной артерии, окклюзия внутричерепной артерии (например, артерий головного мозга), окклюзия периферических артерий, глубокий тромбоз вен,или родственных заболеваний, связанных с нежелательным коагулированием крови. Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем. Пример 1. Материалы и методы. Конструирование праймеров. Для амплификации определенного фрагмента гена tPA синтезировали пару праймеров SK2/174 [5(фирма Life Technologies, Гранд Айленд,штат Нью-Йорк). Эти праймеры конструировали на основе гена человеческого tPA, полученного из базы данных 30 NCBI (gl37119). Их синтезировали с помощью концевых сайтов клонирования Sfll (подчеркнуты) таким образом, чтобы рамка считывания, начинающаяся с кодонаpComb3HSS. Конструировали другой набор праймеров для сайтнаправленного мутагеназа, предназначенный для отжига последовательности, расположенной между геном K2S и геном III вpComb3H-K2S. Последовательности праймеров с замененными в результате мутации основаниями (подчеркнуты) с целью получения нового стоп-кодона представляют собой MSTPA Амплификация гена K2S с помощью ПЦР. 1 мкг праймеров SK2/174 и ASSP вместе с 50 нг матрицы р 51-3 (полученной от Др. Hiroshi Sasaki, фирма Fujisawa Pharmaceutical, Япония) суспендировали в 100 мкл смеси для ПЦР. Затем к раствору добавляли 2,5 ед. полимеразыTaq (фирма Roche Molecular Biochemicals, Индианаполис, штат Индиана). Осуществление амплификации в заданных условиях инициировали резким началом при 85 С в течение 4 мин,с последующей денатурацией при 95 С в течение 50 с, отжигом при 42 С в течение 50 с, удлинением при 72 С в течение 1,5 мин. Реакцию осуществляли с использованием 35 повторяющихся циклов. Смесь дополнительно инкубировали при 72 С в течение 10 мин. Амлифицированный продукт длиной 1110 пар оснований затем очищали с помощью набора QIAquickPCR Purification (фирма QIAGEN, Гильден, 17 Германия). Правильность очищенного продукта подтверждали с помощью рестриктаз. Конструкция для экспрессии K2S в фагмидном векторе. Очищенный ПЦР-продукт K2S и фагмидный вектор pComb3HSS (любезно предоставленный Др. Carlos F. Barbas, Scripps Institute, США) расщепляли с помощью Sfil (фирмаBiochemicals,Индианаполис, штат Индиана), получая специфические липкие сайты клонирования. 4 мкг очищенного ПЦР-продукта расщепляли с помощью 60 ед. Sfil при 50 С в течение 18 ч. Для расщепления pComb3HSS 20 мкг фагмидных векторов обрабатывали 100 ед. Sfil. Затем расщепленные продукты очищенного ПЦРпродукта K2S и pComb3HSS (-3300 пар оснований), очищали на геле с помощью набора QIAquick Gel Extraction (фирма QIAGEN, Гильден,Германия). В смесь, содержащую 0,7 мкг очищенного расщепленного с помощью SfilpComb3HSS и 0,9 мкг очищенного, расщепленного с помощью Sfil ПЦР-продукта, интродуцировали 5 ед. лигазы фага Т 4 (фирма Roche Molecular Biochemicals, Индианаполис, штат Индиана). Реакционную смесь для лигирования инкубировали при 30 С в течение 18 ч. Вновь сконструированный фагмидный вектор обозначили как pComb3H-K2S. Трансформация штамма Е. coil XL-1 Blue. 200 мкл СаСЧз-компетентного штамма Е. coliXL-1 Blue (фирма Stratagene, Ла Джолла, штат Калифорния) трансформировали с использованием 70 нг лигированного или мутантного продукта. Трансформированные клетки размножали, распределяя на LB-агаре, содержащем 100 мкг/мл ампициллина и 10 мкг/мл тетрациклина(фирма Sigma, Сент Луис, штат Миссури). После культивирования при 37 С в течение 18 ч отбирали с использованием метода щелочного лизиса несколько устойчивых к антибиотикам колоний для получения минипрепаратов плазмид. Каждую очищенную плазмиду подвергали анализу в отношении сайтов рестрикции Sfil. Затем несущую трансформант плазмиду с правильным(ими) сайтом(ами) рестрикции Sfil размножали в течение 18 ч при 37 С в 100 мл LBбульона, дополненного ампициллином (100 мкг/мл) и тетрациклином (10 мкг/мл). Максипрепараты плазмид получали с помощью набора QIAGEN Plasmid Maxi (фирмаQIAGEN, Гильден, Германия). Очищенную плазмиду повторно оценивали в отношении специфичных сайтов рестрикции с помощью(фирма Stratagene, Ла Джолла, штат Калифорния) для осуществления циклической амплификации. Реакцию начинали с одного цикла при 95 С в течение 30 с. Затем осуществляли 16 циклов, включающих: 95 С в течение 30 с, 55 С в течение 1 мин и 68 С в течение 9 мин. Затем реакционную пробирку помещали на лед на 2 мин. Для расщепления цепей матрицы в реакционную смесь для амплификации добавляли 10 ед. рестриктазы Dpnl (фирма Stratagene, Ла Джолла, штат Калифорния) и инкубировали в течение 1 ч при 37 С. Этот синтезированный продукт (MpComb3H-K2S) затем применяли для трансформации штамма Е. coli XL-1 Blue. Получение выявляемой с помощью фага рекомбинантной молекулы K2S. После трансформации штамма XL-1 Blue с помощьюpComb3H-K2S использовали методику выявления с помощью фага. Клон pComb3H-K2S, которым трансформировали штамм Е. coli XL-1Blue, размножали в 10 мл "супер"-бульона, содержащего ампициллин (100 мкг/мл) и тетрациклин (10 мкг/мл), при 37 С до достижения оптической плотности (ОП) [при 600 нм], равной 1,5. Затем бактериальную культуру размножали в 100 мл такой же среды и культивировали в течение 2 ч. Для заражения трансформированного штамма Е. coli XL-1 Blue использовали 10 БОЕ (бляшкообразующих единиц) фага- хелпера VCSM13 (фирма Stratagene, Ла Джолла, штат Калифорния). После инкубации в течение 3 ч в культуру добавляли канамицин в конечной концентрации 70 мкг/мл. Культуру выдерживали при встряхивании (200 об/мин) в течение 18 ч при 37 С. Затем собирали бактериофаги, несущие K2S на gp3 (K2S-(, добавляя 4% (мас./об.) ПЭГ с молекулярной массой 8000 (фирма Sigma,Сент Луис, штат Миссури) и 3% (мас./об.) NaCl. И, наконец, собранный фаг ресуспендировали в 2 мл ЗФР, рН 7,4. Количество фага определяли,заражая штамм Е. coli XL-1 Blue. Количество колониеобразующих единиц на один миллилитр(КОЕ/мл) расчитывали согласно описанному ранее методу (21). Экспрессия полученной рекомбинантным путем молекулы K2S во встряхиваемых колбах. Трансформированный MpComb3H-K2S штамм Е. coli XL-1 Blue культивировали в 100 мл супер-бульона (3% (мас./об.) триптон, 2%[600 нм], равной 0,8. Затем синтез протеина индуцировали с помощью 1 мМ ИПТГ (фирма Promega, Мэдисон, штат Висконсин). Затем бактерии культивировали при встряхивании (200 об/мин) в течение 6 ч при 30 С. Супернатант культуры собирали и осаждали 55%-ным насыщенным раствором сульфата аммония (32). Осадок восстанав 19 ливали с помощью ЗФР, рН 7,2 и подвергали диализу в противотоке такого же буферного раствора при 4 С в течение 18 ч. Периплазматические протеины из бактериальных клеток экстрагировали, используя хлороформный шок согласно описанному ранее методу (Ames и др.)(2). Количественный иммуноанализ полученной рекомбинантным путем молекулы K2S. Для обнаружения r-K2S твердую фазу сенсибилизировали моноклональным антителом к кренделеобразному домену 2 (16/В) (любезно предоставленным Др. Ute Zacharias, Central Institute of Molecular Biology, Берлин-Бух, Германия). Осуществляли отмывку и блокирование согласно стандартному методу ELISA. В каждую лунку, сенсибилизированную антителом к кренделеобразному домену 2, добавляли по 50 мкл 10 КОЕ/мл К 28-ф или секреторного rK2S. Оценку комплекса антиген-антитело осуществляли согласно описанному ниже процессу. В каждую реакционную лунку после стадии отмывки добавляли либо овечье антитело к М 13, конъюгированное с пероксидазой из хрена(HRP) (фирма Pharmacia Biotech, Уппсала,Швеция), или овечье антитело к tPA, конъюгированное с HRP (фирма Cedarlane, Онтарио,Канада). В каждую лунку вносили субстрат ТМБ (тетраметилбензидин) и, наконец, после инкубации в течение 30 мин реакцию прекращали, добавляя раствор H2SО 4. В качестве позитивного контроля использовали стандартный полученный из меланомы tPA 86/670 (NationalInstitute for Biological Standards и Control, Хертфордшин, Великобритания). Анализ амидолитической активности. Для оценки амидолитической активностиChromogenix (Молндал, Швеция). Для определения ферментативной активности сериновой протеазы в качестве субстрата использовали смесь, содержащую плазминоген и S-2251. Активность каждого осажденного аммонием и разбавленного в 100 раз образца оценивали с добавлением в качестве стимулятора фрагментов человеческого фибриногена или без стимулятора. Анализ выполняли согласно руководствуCOASET t-PA. ДСН-ПААГ и иммуноблоттинг. Подвергнутый диализу осажденный из супернатанта культуры продукт дополнительно концентрировали в 10 раз с помощью центрикона 10 (фирмаAMICON, Беверли, штат Миннесота). Протеины сконцентрированного образца разделяли с помощью ДСН-ПААГ, используя 15%-ный фильтрующий гель в восстанавливающем буфере, с последующим электроблоттингом на нитроцеллюлозу. Затем нитроцелюлозу блокировали с помощью 4%-ного снятого молока в течение 2 ч. Для обнаружения r-K2S нитроцеллюлозу обрабатывали соответствующим образом разведенным овечьим антителом к tPA, конъюгиро 005163 20 ванным с HRP. Иммунореактивную полосу визуализировали с помощью чувствительной системы обнаружения, набора Amplified Opti-4CN(фирма BIORAD, Геркулес, штат Калифорния). Электрофорез в сополимеризированном с плазминогеном полиакриламидном геле. 11%ный фильтрующий полиакриламидный гель подвергали сополимеризации с плазминогеном и желатином согласно описанному ранее методу(Heussen и др.) (14). 4%-ный концентрирующий гель готовили без плазминогена и желатина. Электрофорез осуществляли при 4 С при постоянной силе тока 8 мА. Оставшийся в полосе геля ДСН удаляли послеосторожного встряхивания при комнатной температуре в течение 1 ч в 2,5%-ном Triton Х-100. Затем полосу геля инкубировали в 0,1 М глицине-NaOH, рН 8,3 в течение 5 ч при 37 С. И, наконец, полосу геля окрашивали и обесцвечивали с помощью стандартной системы для окраски гелей на основе кумасси бриллиантового голубого (R-250). Область, в которой была локализована присущая пептиду ферментативная активность, не окрашивалась красителем в противоположность окрашенному в голубой цвет фону. Результаты Конструирование вектора, несущего генK2S. Из вектора р 51-3 амплифицировали кренделеобразный домен 2 плюс домен сериновой протеазы tPA (от Ser174 в кренделеобразном домене 2 до Pro527 в сериновой протеазе) с помощью праймеров SK.2/174 и ASSP. Полученный в результате амплификации продукт длиной 1110 пар оснований выявляли с помощью электрофореза в агарозном геле (фиг. 1, полоса 2) и встраивали в фагмидный векторpComb3HSS с использованием двух сайтов расщепления Sfil на 5'- и 3'-концах в правильной рамке считывания. Таким образом получали новый вектор pComb3H-K2S, несущий K2S. В этом векторе ген K2S фланкирован против хода транскрипции сигнальной последовательностьюOmpA и по ходу транскрипции - геном gp3. Правильность вставки K2S подтверждали рестрикционным анализом с использованием SfilpComb3H-K2S штамма Е. coli XL-1 Blue,X[K2S] использовали нитчатый фаг VCSM13.VCSM13 размножали и встраивали в него слитый протеин K2S-gp3 во время процесса упаковки вируса. Собранный рекомбинантный фаг(К 28-ф) имел концентрацию 5,4 х 10 КОЕ/мл,которую определяли путем повторного заражения штамма Е. coli XL-1 Blue осажденным с помощью ПЭГ фагами. В этих рекомбинантных фаговых частицах с помощью сэндвич- ELISA 21 подтверждали наличие экспрессии r-K2S. Связанный с фагом гетерологичный протеин K2S выявляли с помощью моноклонального антитела к кренделеобразному домену 2 (16/В), используя в качестве системы для обнаружения овечье антитело к tPA, конъюгированное с HRP. В этом анализе коэффициент абсорбции составил 1,120,03 (табл. 1). Количество K2S, обнаруженного на 10 в 12 степени фаговых частицах, соответствовало 336 нг протеина в пересчете на стандартный полученный из меланомыtPA. Для подтверждения того, что слитый протеин K2S-gp3 связан с фаговыми частицами,овечье антитело к tPA, конъюгированное с HRP,заменяли овечьим антителом к М 13, конъюгированным с HRP. Для этой иммуннологической реакции коэффициент абсорбции составлял 1,890,07 (табл. 1). В отличие от этого, если иммобилизованное антитело представляло собой овечье антитело к M13, то был выявлен очень низкий уровень K2S при использовании овечьего антитела к tPA, коъюгированного с HRP; коэффициент абсорбции составлял только 0,170,01(таблица 1). Этот позволяет предположить наличие лишь небольшого количества очищенных фаговых частиц, несущих слитый протеин K2Sgp3. В качестве негативного контроля использовали VCSM13, полученный из нетрансформированного штамма XL-1 Blue. Конструкция MpComb3H-K2S. Стоп-кодон помещали между K2S и gp3 в pComb3H-K2S с помощью мутагенных праймеров (MSTPA иMASTPA) (фиг. 4). Для повышения количества вновь синтезированного и мутантногоMpComb3H-K2S, смесь для циклической амплификации преднамеренно расщепляли с помощью Dpnl с целью расщепления старой damметилированной матрицы pComb3H-K2S (Dpnl обладает специфичностью в отношении damметилированной ДНК). После трансформации штамма Е. coli XL-1 Blue с помощьюMpComb3H-K2S для дальнейших исследований был выбран трансформант XM[K2S]. В результате замены пар оснований один из сайтов расщепления Sfil, прилегающий к 3'-концу генаK2S, был удален после сайтнаправленного мутагенеза. Была выявлена линейная версия длиной 4319 пар оснований расщепленного с помощью Sfil MpComb3H-K2S, в которой не обнаружен встроенный фрагмент гена K2S (фиг. 5,полоса 3). Таким образом, ген K2S, кодируемыйK2S в XM[K2S]индyциpoвaли с помощью ИПТГ. С помощью ELISA r-K2S был выявлен как в периплазматическом пространстве, так и в супернатанте культуры. Количество гетерологичного протеина определяли в каждом препарате с помощью сэндвич-ELISA и сопоставляли со стандартным tPA. Из 100 мл бактериальной культуры во встряхиваемых колбах при ОП [600 22 нм], равном 50, в периплазматической фракции обнаружено 1,38 мкг r-K2S (примерно 32%), в то время как в осажденном аммонием супернатанте культуры обнаружено 2,96 мкг r-K2S(примерно 68%). Метод сэндвич-ELISA применяли для оценки осажденного ПЭГ фага из зараженного VCSM13 XM[K2S]. Никакого r-K2S,иммобилизованного с помощью моноклонального антитела к кренделеобразному домену 2,не было обнаружено при выявлении с помощью антитела к М 13, конъюгированного с HRP, эти результаты свидетельствуют о том, что K2S не присутствовал на фаговых частицах, в том случае, если отсутствовал gp3. Оценка амидолитической активности. Если в образце присутствует домен сериновой протеазы, то плазминоген превращается в плазмин. Полученный плазмин далее расщепляет субстрат S-2251 с образованием окрашенного продукта, пара-нитроанилина, который имеет максимум абсорбции при 405 нм. Удельная активность рекомбинантного продукта кореллирует с коэффициентом абсорбции. Оценивали и сравнивали зависящую от фибриногена ферментативную активность каждого образца, т.е. K2S-ф,периплазматического r-K2S или выделенного из супернатанта культуры r-K2S. Для обоих таких образцов, как K2S-ф и перипоазматический rK2S, выявлен очень низкий уровень ферментативной активности, который оказался ниже уровня чувствительности метода (0,25 ед./мл). Выделенный из супернатанта культуры г-K2S обладал зависящей от фибриногена ферментативной активностью, составляющей 7 ед./мл. Таким образом, из 100 мл культуры получали всего 700 ед. ферментативной активности. Без фибриногена никакой ферментативной активности r-K2S, очищенного из супернатанта культуры, не было обнаружено, в то время как стандартный полученный из меланомы tPA обладал некоторой активностью. Демонстрация наличия рекомбинантного протеина с помощью иммуноблоттинга. С использованием овечьих антител к tPA установлено, что молекулярная масса частично очищенного K2S, полученного из супернатантаXM[K2S], составляет 39 кДа (фиг. 6). Негативный контроль, т.е. частично очищенный супернатант культуры не трансформированного штамма XL I-Blue, не имел никакой реактивной полосы, соответствующей указанному размеру. Локализация активного фермента с помощью ПААГ. Плазминоген подвергали сополимеризации и иммобилизовали с помощью желатина в полиакриламидном геле до осуществления электрофореза. Анализировали осажденные аммонием супернатанты культур штамма Е. coliXL-1 Blue, штамма Е. coli XL-1 Blue, трансформированного pComb3HSS и XM[K2S] (фиг. 7). Все образцы разгоняли в невосстанавливающих условиях для сохранения правильной конформации и активности домена сериновой протеа 23 зы. Прозрачные области, полученные в результате расщепления плазминогена сериновой протеазой, были обнаружены только в осажденных аммонием супернатантах культуры XM[K2S] в положениях, соответствующих 34 и 37 кДа. При использовании других образцов не выявлено очищенных зон. На соответствующей позитивному контролю полосе стандартного полученного из меланомы tPA также продемонстрирована ферментативная активность в положениях,соответствующих 66 и 72 кДа. Ссылки 1. Alien S., H. Y. Nairn и N. J. Bulleid. 1995.lysine. Thromb. Haemost. 67:88-94. Описание чертежей На чертежах показано: на фиг. 1 - подтверждение характеристик продукта ПЦР-амплификации гена K2S из вектора р 51-3 с помощью праймеров SK2/174 иASSP. Ряд 1 соответствует маркеру размером 1 т.п.н. (фирма Roche Molecular Biochemicals, Индианаполис, штат Иллинойс). Ряд 2 соответствует продукту амплификации, внесенному в количестве 1 мкл. Обозначена индивидуальная полоса, соответствующая 1110 парам оснований. Электрофорез осуществляли в 1%-ном агарозном геле; на фиг. 2 - ряд 1 соответствует встроенному гену K2S на полосе, соответствующей 1110 пар оснований , после расщепления с помощью Sfil вектора pComb3H-K2S. Ряд 1 соответствует маркеру размером 1 т.п.н. Ряд 2 соответствует нерасщепленному вектору pComb3HK2S. Электрофорез осуществляли в 1%-ном агарозном геле; на фиг 3. - схематичное изображениеpComb3H-K2S с указанием двух сайтов клонирования Sfil, в которые встраивали ген K2S. Также обозначены сигнальная последовательность (OmpA), сайт связывания рибосомы(RIBS), промотор lac и ген gpIII; на фиг. 4. - схематичная диаграмма сайта мутации в стыке между генами K2S и gpIII в вектореpComb3H-K2S связывали с набором праймеров для мутации (MSTPA и MASTPA), которые содержали модифицированные олигонуклеозиды(подчеркнуто). После осуществления цикла амплификации сайт 1 Sfll (выделен жирным шрифтом) модифицировали и удаляли из вновь синтезированной цепи; на фиг. 5. - характеризация вновь синтезированного вектора МрСоmb3 Н-K2S с помощью рестриктазы Sfi I. Ряд 3 соответствует полосе размером 4319 пар оснований, которая соответствует одному сайту расщепления MpComb3HK2S. В области, соответствующей 1110 парам оснований, не удалось визуализировать встроенный ген K2S. Ряд 1 соответствует маркеру размером 1 т.п.н. Ряд 2 соответствует нерасщепленному вектору MpComb3H-K2S. Электрофорез осуществляли в 1%-ном агарозном геле; на фиг. 6 - идентификация иммунологически реактивной полосы, соответствующей вы 27 веденному из рекомбинантной ДНК протеину,полученному из супернатанта культурыXM[K2S], с помощью овечьего антитела к tPA,конъюгированного с HRP. В ряд 1 вносили 40 нг стандартного полученного из меланомы tPA(86/670), для которого обнаружена реактивная полоса, соответствующая 70 кДа. В ряд 2 и 3 соответственно вносили очищенные и сконцентрированные супернатанты культур нетрансформированных штаммов Е. coil XL1- Blue иXM[K2S]. Индивидуальная реактивная полоса,соответствующая 39 кДа, особенно хорошо видна в ряду 3; на фиг. 7 - определение молекулярной массы внеклеточного r-K2S, несущего активный домен сериновой протеазы, путем электрофореза в полиакриламидном геле сополимеризованного плазминогена. В ряд 1 внесены стандарты молекулярной масс (510'), ДСН-6 Н (фирмаSigma, Сент Луис, штат Миссури). В ряды 2, 3 и 4 соответственно вносили по 50 мкг осажденного насыщенным 55%-ным раствором сульфата аммония супернатанта культуры XL-1 Blue, XI1 Blue, трансформированного pComb3HSS, иXM[K2S]. В полосу 5 вносили 5 мед. стандартного полученного из миеломы tPA (86/670). Прозрачные зоны расщепленного плазминогена в полиакриламидном геле обнаружены только в ряду 4 в областях, соответствующих молекулярным массам 34 и 37 кДа (Б) и в ряду 5 в области, соответствующей молекулярным массам 66 и 72 кДа (А); на фиг. 8 - структура A (SEQ ID NO: 11) Нативная молекула K2S от аминокислоты 174 до 527 без модификации; на фиг. 9 - структура В-0 (SEQ ID NO: 12) Нативная молекула K2S от аминокислоты 197 до 527 без модификации; на фиг. 10 - структура Б-1 (SEQ ID NO: 13) Молекула K2S от аминокислоты 193 до 527, где к структуре В-0, приведенной на фиг. 9,к N-концевой области добавлены аминокислотыSEGNSD; на фиг. 13 - структура Б-4 (SEQ ID NO: 16) Молекула K2S от аминокислоты 191 до 527, соответствующая молекуле, приведенной на фиг. 12, где Cys-261 заменен на Ser; на фиг. 14 - структура В (SEQ ID NO: 17) Нативная молекула K2S от аминокислоты 220 до 527 без модификации. Эту молекулу можно дополнительно модифицировать аналогично тому, как описано для структуры Б на фиг. 10-13; 28 на фиг. 15 - структура D (SEQ ID NO: 18) Нативная молекула K2S от аминокислоты 260 до 527 без модификации. Эту молекулу можно дополнительно модифицировать аналогично тому, как описано для структуры Б на фиг. 10-13; на фиг. 16 - молекула tPA (SEQ ID NO: 19). Таблица 1. Обнаружение молекулы r-K2S в препарате фага с помощью сэнвич- ELISAVCSM13 получали из штамма XL-1 Blue,трансформированного pComb3HSS. б Применяли мышиное моноклональное антитело к кренделеобразному домену 2(16/В). Другие антитела получали из овечьего иммуноглобулина. в Данные являются средними величинами абсорбции каждого образца, полученными по трем повторностям. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения тканевого активатора плазминогена (tPA), варианта tPA, молекулы несущей домен kringle 2 и серинпротеазу (K2S) или варианта K2S в прокариотических клетках,где tPA, вариант tPA, молекула K2S или вариантK2S секретируется внеклеточно в виде активного протеина с правильной складчатостью, отличающийся тем, что прокариотическая клетка содержит и экспрессирует вектор, включающий ДНК, которая кодирует tPA, вариант tPA, молекулу K2S или вариант K2S, функционально связанную с ДНК, которая кодирует сигнальный пептид OmpA. 2. Способ по п.1, отличающийся тем, что прокариотическая клетка содержит и экспрессирует вектор, который включает ДНК, кодирующую tPA, вариант tPA, молекулу K2S или вариант K2S, функционально связанную с ДНК,которая кодирует сигнальный пептид OmpA,функционально связанный с молекулой нуклеиновой кислоты, имеющей последовательностьTCTGAGGGAAACAGTGAC (SEQ ID NO:1),или ее функционально активным производным. 3. Способ по п.1 или 2, отличающийся тем,что прокариотическая клетка представляет собой Е. coli. 4. Способ по любому из пп.1-3, отличающийся тем, что осуществляют следующие стадии: а) амплифицируют с помощью ПЦР ДНК,кодирующую tPA, вариант tPA, молекулу K2S или вариант K2S; б) очищают ПЦР-продукт; в) встраивают указанный ПЦР-продукт в вектор, включающий ДНК, которая кодирует сигнальный пептид OmpA, и ДНК, которая кодирует gpIII, таким образом, чтобы ПЦРпродукт в этом векторе был функционально связан против хода транскрипции с ДНК, кодирующей сигнальную последовательность OmpA,и связан по ходу транскриции с ДНК, кодирующей gpIII; г) встраивают стоп-кодон между tPA, вариантом tPA, молекулой K2S или вариантомK2S или вариант K2S. 5. Способ по любому из пп.1-4, отличающийся тем, что вектор представляет собой фаг 005163 38 мидный вектор, включающий ДНК, которая кодирует сигнальный пептид OmpA, и ДНК,которая кодирует gpIII. 6. Способ по любому из пп.1-5, отличающийся тем, что вектор представляет собой фагмидный вектор pCombS3HSS. 7. Способ по любому из пп.1-6, отличающийся тем, что последовательность ДНК OmpA,связанная против хода транскрипции с K2S,включает следующую последовательность или ее вариант, полученный вследствие вырожденности нуклеотидного кода: 8. Способ по любому из пп.1-7, отличающийся тем, что последовательность ДНК OmpA включает следующую последовательность: 9. Способ по любому из пп.1-8, отличающийся тем, что последовательность ДНК OmpA имеет следующую последовательность: 10. Способ по любому из пп.1-9, отличающийся тем, что перед ДНК, кодирующей tPA,вариант tPA, молекулу K2S или вариант K2S,расположен промотор lac и/или сайт связывания рибосомы. 11. Способ по любому из пп.1-10, отличающийся тем, что ДНК, кодирующую tPA, вариант tPA, молекулу K2S или вариант K2S, выбирают из группы, включающей молекулы ДНК, кодирующие по меньшей мере 90% аминокислот 87 - 527, 174 - 527, 180 - 527 или 220 527 протеина человеческого тканевого активатора плазминогена. 12. Способ по любому из пп.5-11, отличающийся тем, что последовательность ДНКK2S включает следующую последовательность или ее вариант, полученный вследствие вырожденности нуклеотидного кода: 13. Способ по любому из пп.5-12, отличающийся тем, что последовательность ДНК 14. Молекула ДНК, отличающаяся тем, что она кодирует а) протеин OmpA, функционально связанный с б) молекулой ДНК, кодирующей полипептид, который содержит домен kringle 2 и серинпротеазу протеина тканевого активатора плазминогена. 15. Молекула ДНК по п.14, отличающаяся тем, что последовательность ДНК включает следующую последовательность или ее вариант,полученный вследствие вырожденности нуклеотидного кода: 16. Молекула ДНК по любому из пп.14 или 15, отличающийся тем, что последовательность ДНК содержит следующую последовательность: 17. Молекула ДНК по любому из пп.14-16,отличающаяся тем, что последовательность ДНК, указанная в б), кодирует по меньшей мере 90% аминокислот 87-527 протеина человеческого тканевого активатора плазминогена. 18. Молекула ДНК по любому из пп.14-17,отличающаяся тем, что последовательность ДНК, указанная в б), кодирует по меньшей мере 90% аминокислот 174-527 протеина человеческого тканевого активатора плазминогена. 19. Молекула ДНК по любому из пп.14-18,отличающаяся тем, что последовательность ДНК, указанная в б), кодирует по меньшей мере 90% аминокислот 180-527 протеина человеческого тканевого активатора плазминогена. 20. Молекула ДНК по любому из пп.14-19,отличающаяся тем, что последовательность ДНК, указанная в б), кодирует по меньшей мере 90% аминокислот 220-527 протеина человеческого тканевого активатора плазминогена. 21. Молекула ДНК по любому из пп.14-20,отличающаяся тем, что последовательность 41 ДНК, указанная в б), гибридизуется в строгих условиях со следующей последовательностью: 25. Протеин K2S, отличающийся тем, что он имеет следующую аминокислотную последовательность: 22. Молекула ДНК по любому из пп.14-21,отличающаяся тем, что последовательность ДНК, указанная в б), содержит следующую последовательность: 23. Слитый протеин OmpA и K2S, отличающийся тем, что он включает протеин,имеющий следующую аминокислотную последовательность: 26. Вектор, содержащий последовательность ДНК по любому из пп.14-22. 27. Вектор по п.26, где перед последовательностью ДНК расположен промотор lac и сайт связывания рибосомы. 28. Вектор pComb3HSS, включающий ДНК по любому из пп.14-22, где экспрессию протеина gpIII подавляют или ингибируют с помощью делеции молекулы ДНК, кодирующей протеинgpIII, или с помощью стоп-кодона, расположенного между геном, кодирующим полипептид,который включает домен kringle 2 и серинпротеазу протеина тканевого активатора плазминогена, и геном протеина III. 29. Прокариотическая клетка-хозяин, содержащая молекулу ДНК по любому из пп.14-22. 30. Прокариотическая клетка-хозяин, содержащая вектор по любому из пп.26-28. 31. Клетка-хозяин E. coli, содержащая молекулу ДНК по любому из пп.14-22. 32. Клетка-хозяин Е. coli, содержащая вектор по любому из пп.26-28. 33. Применение молекулы ДНК по любому из пп.14-22 или вектора по любому из пп.26-28 или клетки-хозяина по любому из пп.29-32 в способе получения полипептида, обладающего активностью тканевого активатора плазминогена. 34. Применение по п.33, где указанный способ представляет собой способ по любому из пп.1-13.
МПК / Метки
МПК: C12N 9/00
Метки: способы, крупномасштабного, днк, выведенных, рекомбинантной, молекул, производства
Код ссылки
<a href="https://eas.patents.su/24-5163-sposoby-krupnomasshtabnogo-proizvodstva-vyvedennyh-iz-rekombinantnojj-dnk-molekul-tpa-ili-k2s.html" rel="bookmark" title="База патентов Евразийского Союза">Способы крупномасштабного производства выведенных из рекомбинантной днк молекул tpa или k2s</a>