Способ улавливания металлов
Номер патента: 24285
Опубликовано: 30.09.2016
Авторы: Вепсяляйнен Йоуко, Турханен Петри, Перяниеми Сирпа
Формула / Реферат
1. Способ улавливания металлов из раствора, согласно которому бисфосфонат формулы I
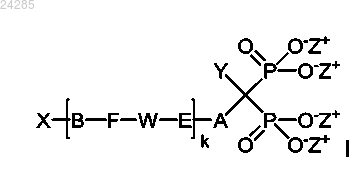
в котором A представляет собой (CR1R2)m-(CR3R4)n-(CR5R6)o-цепь;
B представляет собой (CR1R2)m-(CR3R4)n-(CR5R6)o-цепь;
k равен 0, 1 или 2;
m равен 0, 1, 2, 3, 4, 5 или 6;
n равен 0, 1, 2, 3, 4, 5 или 6;
о равен 0, 1, 2, 3, 4, 5 или 6;
R1, R2, R3, R4, R5 и R6, каждый независимо, представляют собой Н, C1-C6-алкил, C3-C6-алкенил, C3-C6-алкинил или C3-C6-циклоалкенил;
Е и F независимо представляют собой связь, О, S, NR7, C=O, NR7C=O или CONR7;
W представляет собой связь, О, S, NR7, замещенную или незамещенную этиленовую группу, этиниленовую группу, C3-C6-циклоалкил или предпочтительно фенил, нафтил, пиридил, тиенил, фуранил, пирролил, бензофуранил, индолил, хинолинил, изохинолинил или неароматическое гетероциклическое кольцо, состоящее из 4-6 атомов, такое как пиперидинил, морфолинил, пиперазинил, дигидрофуранил, пирролидинил, азедидинил или оксазетидинил;
X представляет собой Н, NR7R8, N+R7R7R8, OH, CO2H или SH, где R7 и R8 независимо представляют собой Н, C1-C6-алкил, C3-C6-алкенил, C3-C6-алкинил или C3-C6-циклоалкенил или R7 и R8 вместе образуют 4-8-членное кольцо, необязательно содержащее двойные или тройные связи;
Y представляет собой Н, OH, NH2, SH, CH2OH, CH2NH2, CH2CO2H или O-CO-A-G-B, где А и В такие, как определены выше, a G представляет собой связь, замещенную этиленовую или этиниленовую группу;
Z представляет собой Н+, Li+, Na+, K+, NH4+ или моно-, ди-, три- или тетраалкиламмониевую группу,
при этом заместители выбирают таким образом, что соединение I является твердым и нерастворимым либо труднорастворимым в жидкости, из которой улавливают металл, причем соединение формулы I, является нерастворимым, если его растворимость в этой жидкости меньше 0,1 г/100 мл, и труднорастворимым, если его растворимость больше 0,1 г/100 мл, но меньше 1 г/100 мл;
смешивают с раствором, в результате чего положительно заряженные катионы металлов, возможно присутствующие в растворе, реагируют с бисфосфонатом, посредством чего образуется твердый нерастворимый комплекс, и комплекс отделяют от раствора.
2. Способ по п.1, в котором количество атомов углерода в группе -[B-F-W-Е]-А- составляет от 5 до 21 атомов в виде цепи, разветвленной цепи или циклической структуры, либо в виде комбинации этих структурных единиц.
3. Способ по п.2, в котором группа -[B-F-W-E]-A- представляет собой алкильную или алкенильную группу, либо арилалкильную или арилалкенильную группу, либо алкильную или алкенилкарбоксильную группу.
4. Способ по п.3, в котором группа -[B-F-W-E]-A- представляет собой алкильную или алкенильную группу.
5. Способ по любому из пп.1-4, в котором X представляет собой NR7R8, N+R7R7R8, Н, OH или COOH.
6. Способ по п.5, в котором X представляет собой NH2.
7. Способ по любому из пп.1-6, в котором Y представляет собой OH, NH2 или Н.
8. Способ по п.7, в котором X представляет собой OH.
9. Способ по любому из пп.1-8, в котором бисфосфонат вместе с металлами, прореагировавшими с ним, отделяют от раствора с помощью фильтрации.
10. Способ по любому из пп.1-9, в котором металл представляет собой Са, Mg, Pb, Hg, Cd, V, Cr, Ni, As, Zn, Al, Ba, Fe, Sn, Sr, Bi, Mn, Mo, Ga, Nb, Та, Ag, Cu, Pt, Au, Ru, Rh, Ir, Nd, Sc, La, Y, Eu, Zr или U.
11. Способ по любому из пп.1-10, в котором в жидкость добавляют целлюлозу или активированный уголь.
12. Способ по любому из пп.1-11, в котором жидкость представляет собой сточные воды или воду для бытового потребления.
13. Применение нерастворимого или труднорастворимого бисфосфоната формулы I для улавливания металлов из раствора.
Текст
Изобретение относится к способу улавливания металлов из раствора, согласно которому твердый нерастворимый или труднорастворимый бисфосфонат формулы I смешивают с раствором, в результате чего металлы, возможно присутствующие в растворе,реагируют с бисфосфонатом, после чего бисфосфонат вместе с металлами, прореагировавшими с ним, отделяют от раствора. Способ может быть использован для улавливания металлов, например,из сточных вод или из воды для бытового потребления.(71)(73) Заявитель и патентовладелец: ХЕМЕК ОЙ АБ (FI) Область техники Настоящее изобретение в целом относится к области химического синтеза, аналитической химии,"зеленой" (экологически безопасной) химии и теории разделения. В частности, изобретение относится к улавливанию металлов из жидкостей, в особенности, из водных растворов. Предшествующий уровень техники Для улавливания ионов металлов из растворов используют различные способы разделения. Как правило, процедура разделения должна быть простой, относительно быстрой, количественной и не очень дорогой. Такая процедура также должна подразумевать минимальную предварительную обработку образца. Для подобной процедуры могут использоваться хелатирующие осадители. Как правило, такие хелатирующие осадители содержат группы с замещаемыми атомами водорода, такие как карбоксильные(-COOH), гидроксильные (-OH), меркапто- (-SH) или сульфогруппы (-SO3H), вместе с функциональными группами основного характера, такими как амино- (-NH2), аминоцикло- (-NH-), иминогруппы (=N-), карбонильные (СО) или тиокетогруппы (CS), с которыми реагирующий металл координируется с образованием 4-, 5- или 6-членного кольца (Perniemi, S. Preconcentration of phosphorus, chromium, arsenic, selenium, mercury and gold onto activated charcoal before determination by EDXRF (Предварительное концентрирование фосфора, хрома, мышьяка, селена, ртути и золота на поверхности активированного угля перед определением РФСРЭ (рентгено-флуоресцентной спектрометрией с рассеиванием энергии)(EDXRF, Yliopistopaino, Helsinki, 1995). Наиболее популярными хелатирующими агентами для осаждения являются дитиокарбаматы благодаря низкой растворимости в воде их металлохелатов. Дитиокарбаматы обладают высоким сродством к переходным металлам и низким сродством к щелочным и щелочноземельным металлам. Осаждение проводят для одного элемента либо группы элементов. В случае достаточно низких концентраций металлов количественное осаждение и накопление осадка могут достигаться за счет добавления соосадителя (носителя) или связывания хелатирующих агентов со смолой. Метилен-бис-фосфонаты (МБФ, англ. аббревиатура - MBP от methylenebisphosphonates), отличающиеся наличием каркаса Р-С-Р, используют для различных целей на протяжении 50 лет их существования. Изначально бисфосфонаты (БФ, англ. аббревиатура - BP от bisphosphonates) выполняли функции умягчителей воды за счет ингибирования кристаллизации солей кальция, однако основанием для их основного использования в настоящее время является высокое сродство к минералу костной ткани гидроксиапатиту (Fleisch, H. Bisphosphonates in Bone Disease: From the Laboratory to the Patient (Бисфосфонаты в остеопатии: От лаборатории до пациента), The Parthenon Publishing Group Inc.: New York, 1995). В качестве эффективных ингибиторов костной резорбции БФ (BP) используются в остеопатии и при расстройствах кальциевого метаболизма, например при остеопорозе (Yates, A.J.; Rodan, G.A. DDT, 3 (1998) 69). БФ (BP) также используются в качестве агентов для остеосцинтиграфии (сканирования костей) при соединении их с гамма-излучающим изотопом технеция, в качестве предназначенных для костей прокомпонентов, например для противовоспалительных препаратов (Hirabayashi, H.; Sawamoto, Т.; Fujisaki,J.; Tokunaga, Y.; Kimura, S.; Hata, T. Pharm. Res., 18 (2001) 646), в качестве реагентов для экстракции селективными растворителями ионов актинидов (Reddy, G.V.; Jacobs, H.K.; Gopalan, A.S.; Barrans Jr.; R.E.;Dietz, M.L.; Stepinski, D.C.; Herlinger, A.W. Synt. Commun., 34 (2004) 331), а также в качестве нового класса гербицидов (Chuiko, A.L., Lozinsky, M.O., Jasicka-Misiak, I. and Kafarski, P. J. Plant. Growth Regul. 18 (1999) 171). С недавних пор МБФ (MBP) используют в качестве ингибиторов роста паразитарных заболеваний типа малярии (Ghosh, S.; Chan, J.M.W.; Lea, C.R.; Meints, G.A.; Lewis, J.C.; Tovian, Z.S.;Wu, X. Crystal. Crowth. Des. 7 (2007) 1134). БФ (BP) как таковые не используются для улавливания ионов металлов без дополнительной смолы. Коммерчески доступные БФ-полистирольные ионообменные смолы (Diphonix) используются для захвата актинидов (Horwitz, E.P., Chiarizia, R., Diamond, H., Gatrone,R.C., Alexandratos, S.D., Trochimczuk, A.Q. and Crick D.W. Solvent Extr. Ion Exch. 11 (1993) 943) и переходных металлов (Chiarizia, R., Horwitz, E.P., Gatrone, R.C., Alexandratos, S.D., Trochimczuk, A.Q. andCrick D.W. Solvent Extr. Ion Exch. 11 (1993) 967). Нежелательные катионы металлов, как правило, присутствуют не только в промышленных сточных водах, в водах, стекающих через места свалок, золу из мест сжигания отходов и в водах пробуренных скважин, но также в химических реагентах, используемых, например, при очистке воды или на заводах по производству бумаги. Как правило, катионы металлов присутствуют в стабильной растворенной, водной форме и не могут образовывать твердых осадков. Обычно целью любого способа улавливания является адсорбция таких катионов на твердые материалы (например, смолы) либо осаждение их в виде комплексов. Ионообменные смолы могут адсорбировать как отрицательные, так и положительные ионы в зависимости от структуры смолы. Кроме того, при очистке широко используется активированный уголь благодаря его развитой нейтральной поверхности, способной эффективно адсорбировать также и нейтральные органические соединения, бактерии, хлорид, аммоний и до определенной степени также некоторые металлы, такие как хром, кобальт и ртуть. Однако с заряженными частицами возникают сложности. Как только металлы затвердевают, их удаляют, например, фильтрацией. Промышленность и разработка полезных ископаемых поставляют в окружающую среду значительную часть загрязнений тяжелыми металлами, несмотря на широкое использование закрытых оборотных систем водоснабжения. Стандартные способы извлечения токсичных тяжелых металлов включают в себя химическое осаждение, химическое окисление или восстановление, фильтрацию, ионный обмен, электрохимическую обработку и выпаривание. Чаще всего сточные воды обрабатывают добавлением химических реагентов, повышающих величину pH и осаждающих тяжелые металлы. Донные отложения, содержащие металлы, затем удаляют. Такой способ является в некоторой степени эффективным для осаждения, например, меди и никеля, но в случае серебра, свинца и цинка возникают проблемы. Ограниченность таких способов приводит к неполному извлечению металлов и к использованию дорогостоящего оборудования и систем контроля. Кроме того, такие способы становятся неэффективными и неэкономичными в случаях, когда требуется извлечение тяжелых металлов при очень низких концентрациях. В частности, хром представляет серьезную опасность в плане вредного воздействия на окружающую среду, поскольку его широко используют в качестве агента для поверхностного покрытия (гальванизации) и в кожевенной промышленности. Сточные воды, содержащие хром, как правило, являются достаточно кислыми, так как токсичный Cr(VI) восстанавливают до Cr(III) с помощью NaHSO3 илиFeSO4 в кислой среде (pH3). Разработаны различные способы извлечения Cr(III) из растворов. Способы основаны, например, на активированном угле, однако их использование является ограниченным из-за высокой стоимости и сложности регенерации. В настоящее время существует также общая потребность в более экологически благоприятном промышленном использовании, так называемом принципе "зеленой химии". Идея зеленой химии заключается в создании продуктов и процессов, снижающих либо исключающих использование и образование вредных веществ. Зеленая химия заключается не только в рециклинге (повторном использовании ценных металлов, таких как благородные металлы (например, Au, Ag, Pt, Pd) или металлы электронной промышленности (например, Ga, Nb, Ta), но также и в том, что материалы, используемые для процессов рециклинга, должны быть экологически благоприятными. Например, обычная ионообменная смола содержит комплексообразующий агент, связанный, к примеру, со стирольным полимером. Материал является "более зеленым", если его ионообменные свойства обеспечиваются без использования смолы и если его легко регенерировать. Краткое описание сущности изобретения Далее изобретение будет описано в соответствии с формулой изобретения. Настоящее изобретение предусматривает новый способ улавливания металлов из растворов за счет комплексообразования с твердым и нерастворимым или труднорастворимым бисфосфонатом формулы IR1, R2, R3, R4, R5 и R6, каждый независимо, представляют собой Н, C1-C6-алкил, C3-C6-алкенил,C3-C6-алкинил или C3-C6-циклоалкенил; Е и F независимо представляют собой связь, О, S, NR7, C=O, NR7C=O или CONR7;W представляет собой связь, О, S, NR7, замещенную или незамещенную этиленовую группу, этиниленовую группу, C3-C6-циклоалкил либо моно- или бициклическое ароматическое или гетероароматическое кольцо, состоящее из от 5 до 12 атомов;R7 и R8 независимо представляют собой Н, C1-C6-алкил, C3-C6-алкенил, C3-C6-алкинил илиC3-C6-циклоалкенил либо R7 и R8 вместе образуют 4-8-членное кольцо, необязательно содержащее двойные или тройные связи;Y представляет собой Н, OH, NH2, SH, CH2OH, CH2NH2, СН 2 СО 2 Н или О-СО-A-G-B, где А и В такие, как определены выше, a G представляет собой связь, замещенную этиленовую или этиниленовую группу;Z представляет собой Н+, Li+, Na+, K+, NH4+ или моно-, ди-, три- или тетраалкильную аммониевую группу. Количество атомов углерода в группе -[B-F-W-E]-A- предпочтительно составляет от 5 до 21 атомов в виде цепи, разветвленной цепи или циклической структуры либо в виде комбинации этих структурных единиц. Более предпочтительно группа -[B-F-W-E]-A- представляет собой алкильную или алкенильную группу, либо арилалкильную или арилалкенильную группу, либо алкил- или алкенилкарбоксильную группу. Наиболее предпочтительно группа -[B-F-W-E]-A- представляет собой алкильную или алкенильную группу. Количество атомов углерода между А и X предпочтительно составляет от 7 до 16 атомов в виде цепи, разветвленной цепи или циклической структуры или в виде комбинации этих структурных единиц.X предпочтительно представляет собой NR7R8, N+R7R7R8, H или OH, более предпочтительно NH2.Y предпочтительно представляет собой OH, NH2 или Н, более предпочтительно OH.W предпочтительно представляет собой фенил, нафтил, пиридил, тиенил, фуранил, пирролил, бензофуранил, индолил, хинолинил, изохинолинил или неароматическое гетероциклическое кольцо, состоящее из 4-6 атомов, такое как пиперидинил, морфолинил, пиперазинил, дигидрофуранил, пирролидинил, азедидинил или оксазетидинил. Наиболее предпочтительно W представляет собой фенил или нафтил. Бисфосфонат реагирует с катионом металла, подлежащим улавливанию, и образует комплексное соединение, которое затем отделяют от жидкости. Процесс улавливания осуществляется в одной жидкой фазе, т.е. он не является процессом экстракции. Заместители в формуле I выбирают таким образом, чтобы бисфосфонат был нерастворим или труднорастворим в жидкости в реакционных условиях и образующееся комплексное соединение было нерастворимым либо труднорастворимым. Улавливание металлов из жидкостей зависит, например, от металла, его степени окисления, бисфосфоната I, pH, температуры, времени контакта и дополнительных материалов, используемых во время процедуры улавливания. Как правило, могут улавливаться все положительно заряженные металлические элементы, за исключением щелочных металлов. Каждый из металлов имеет также свой собственный диапазон pH для улавливания и оптимальную величину pH для максимального улавливания. Бисфосфонат вместе с присоединенными к нему металлами может быть удален из жидкости фильтрацией. Учитывая упомянутые выше разные параметры улавливания для каждого металла, можно выделять один металл или группу металлов из смеси катионов. Согласно одному из вариантов осуществления положительно заряженные ионы отделяют от отрицательно заряженных ионов, например Cr3+ от Cr6+, существующего в водном растворе в виде бихромат-иона (Cr2O72-). Кроме того, несложным является отделение щелочных металлов от других металлических катионов. В случае бисфосфоната отсутствует необходимость в использовании ионообменной смолы. В качестве вспомогательных веществ для повышения эффективности улавливания на стадии отделения комплексов металл-бисфосфонат могут быть использованы целлюлоза или активированный уголь. Изобретение может использоваться для улавливания, в частности, следующих металлов: Са, Mg, Pb,Hg, Cd, V, Cr, Ni, As, Zn, Al, Ba, Fe, Sn, Sr, Bi, Mn, Mo, Ga, Nb, Ta, Ag, Cu, Pt, Au, Ru, Rh, Ir, Nd, Sc, La, Y,Eu, Zr и U. Настоящее изобретение может быть использовано во многих областях, относящихся к очистке водных растворов от нежелательных катионов металлов. К стандартным областям применения относятся смягчение и очистка хозяйственно-бытовых вод от Са 2+, Mg2+ и других нежелательных ионов металлов,очистка сточных вод из различных источников (например, дренажной воды со свалок), отделение одного металла или группы металлов от смеси катионов, предварительное концентрирование разбавленных жидкостей для аналитических целей, а также улавливание и концентрирование радиоактивного материала до компактного размера. Изобретение особенно полезно для улавливания тяжелых металлов, таких как Pb2+, Hg+, Hg2+ или Cd2+, из смесей, содержащих различные количества анионов и других катионов. Время реакции, требующееся согласно способу, является относительно коротким. Концентрация металла, подлежащего улавливанию, может быть достаточно низкой, например приблизительно до 10-500 м.д. (миллионных долей) или даже ниже. Это является существенным преимуществом при удалении вредных металлов или при извлечении благородных металлов. Выходы в соответствии со способом являются высокими. Подробное описание изобретения Настоящее изобретение направлено на бисфосфонаты I, определенные выше. Их структура характеризуется наличием Р-С-Р каркаса с рядом заместителей при мостиковом атоме углерода. Изобретение,в частности, направлено на способность таких соединений улавливать металлы. Частные варианты осуществления, описанные в данном контексте, предназначены во всех отношениях для иллюстрации и не являются ограничительными. Альтернативные варианты осуществления будут очевидными для специалистов в области техники, к которой относится настоящее изобретение, без отклонения от его объема. Для Al3+, Ga3+, Cr3+, Fe3+, Cu2+, Ag+, Zn2+, Cd2+, Sn2+, Sn4+, Pb2+, Sb3+, Nd3+, Sc3+, Nb5+ и Bi3+ может быть получено практически количественное улавливание (95%), а процент улавливания для остальных исследованных катионов металлов лежит в диапазоне от 49 до 94%. Настоящее изобретение также направлено на отделение Al3+, V4+, Ag+, Ru2+, Rh2+, Ir2+, Pt2+, Au3+,+Hg , Hg2+, Pb2+, Sb3+, Nd3+, Sc3+, Nb5+, La3+, Eu3+, Zr4+, Y3+ или Bi3+ от других положительно заряженных катионов металлов (Са 2+, Mg2+, Sr2+, ). Согласно данному способу металлы улавливают при разных величинах pH, например улавливание Ag+ начинают от pH 1,5, тогда как, например, Ni2+ улавливают, начиная с pH 4. Общие методики синтеза Соединения согласно изобретению могут быть приготовлены из легкодоступных исходных материалов с помощью следующих общих способов и методик. Специалистам в данной области будет очевидно, что все аспекты настоящего изобретения могут быть получены с помощью способов, описанных в данном контексте, либо с помощью других известных способов, реагентов и исходных материалов. Также следует отметить, что, если приведены стандартные или предпочтительные параметры процесса (т.е. время реакции, молярные соотношения при реакции, температура, растворители и т.д.), другие параметры процесса также могут быть использованы, если не указано иное. Оптимальные условия реакции могут варьироваться в зависимости от конкретных используемых реагентов или растворителей. Может потребоваться введение стандартных защитных групп для защиты некоторых функциональных групп от протекания нежелательных реакций. Выбор подходящих защитных групп для конкретной функциональной группы, а также подходящего способа введения защиты и снятия защиты, хорошо известен в данной области. Некоторые примеры многочисленных защитных групп и способы их введения и удаления описаны в работе Greene, T.W., Wuts, G.M., Protection Groups in Organic Synthesis (Защитные группы в органическом синтезе), Fifth Edition, Wiley, New York, 1999, и материалах, использованных в ней. Целевое соединение I может быть получено несколькими способами в зависимости от используемых исходных материалов или требуемых заместителей. Некоторое время назад был опубликован комплексный обзор методов синтеза для получения различных бисфосфонатов (Abdou, W.M. andShaddy, A.A. ARKIVOC 2009 (ix) 143). Наиболее общие способы синтеза бисфосфонатов представлены на схемах A-D. Самый легкодоступный способ получения бисфосфоновых кислот, как показано на схеме А, исходит из соединения трехвалентного фосфора, содержащего нуклеофильную электронную пару, которое присоединяется к карбонильной группе, содержащей Х-[B-F-W-E]k-А-цепь и приемлемую уходящую группу L. Согласно этому способу в Х-[B-F-W-E]k-А-цепи допустимы различные функциональные группы, такие как алкильные, алкенильные или алкинильные цепи, циклические структуры, ароматические кольца и функциональные группы с гетероатомами (например, NH2 или OH). Как правило, уходящая группа L представляет собой -OH, -Cl или -OCOR (ангидрид) функциональную группу. Целевую бисфосфоновую кислоту получают после обработки кипящей водой. Схема А Другой способ получения бисфосфоновых кислот задействует соответствующие эфиры, как показано на схеме В. Согласно этому способу остальные исходные вещества используются такие, как описаны выше, а в качестве источника фосфора берут эфиры трехвалентного фосфора. Как правило, условия реакции в данном случае являются более мягкими по сравнению с описанным выше способом, и это обеспечивает большую маневренность при выборе функциональных групп в Х-[B-F-W-E]k-А-цепи. На последней стадии эфирные группы гидролизуют либо до смешанных эфиров кислот (частично гидролизованных), либо до тетракислот (Turhanen, P.A. and Vepslinen, J.J. Synthesis, 2004, 992). Схема В(Deesterification - Деэтерификация) Третий общий способ получения бисфосфоновых кислот исходит из тетраалкилметиленбисфосфонатов, содержащих по меньшей мере один атом водорода при мостиковом атоме углерода, как показано на схеме С. На первой стадии этот атом водорода замещают атомом металла в щелочной среде с последующим добавлением в реакционную смесь Х-[B-F-W-E]k-А-галогенида. На последней стадии эфирные группы гидролизуют водой либо силильным реагентом до соответствующего тетракислого бисфосфоната. Этот способ позволяет также получать бисфосфонаты, в которых эфирные группы частично гидролизованы до смешанных эфиров кислот, если в качестве дезалкилирующего агента используют LiI, NaI или KI (Turhanen, P.A., Vepslinen, J.J. Synthesis, 2001, 633). Схема С В литературе упоминается и о других способах получения бисфосфоновых соединений, таких как реакции Арбузова и Михаэлиса-Беккера. Кроме того, массовым является изменение возможных исходных материалов для получения конкретного замещения в целевом бисфосфонате. Пример редко используемых исходных материалов представлен на схеме D. Согласно этому способу в качестве исходной точки для получения целевых бисфосфонатов используют X-[B-F-W-E]k-А-цианид. В частности, этот способ позволяет напрямую получать бисфосфонаты I, в которых заместитель Y является группой NH2 Схемы A-D описывают некоторые стандартные способы получения Р-С-Р-каркаса, содержащего заместители X-[B-F-W-E]k-A и Y. Однако фосфорсодержащие окончания в форме кислот или эфиров являются достаточно стабильными для различных реагентов и реакционных условий, которые большей частью обеспечивают модификации функциональных групп. Несколько примеров различных возможных превращений существующих функциональных групп в Х-[В-F-W-E]k-A и Y описаны в работе Larock,R.C., Comprehensive Organic Transformations (Комплексные органические превращения), 2nd ed., Wiley,JohnSons, 1999 и в использованных ссылочных материалах. Улавливание ионов металлов. Согласно настоящему изобретению раскрыты эффективные способы улавливания растворимых катионов металлов из различных водных растворов с помощью соединений, определяемых формулой I. Способ имеет множество применений в различных областях, для которых требуется улавливание, концентрирование или удаление по меньшей мере части растворимых катионов металлов из жидкостей. К характерным примерам относятся улавливание одного металла или группы металлов из жидкостей, очистка сточных вод, дренажных вод свалочных мест или буровых вод от нежелательных металлов, например, тяжелых металлов, смягчение воды для бытового потребления, отделение положительно и отрицательно заряженных ионов металлов друг от друга, обогащение или рециклинг (повторное использование) дорогостоящих металлов, например висмута, серебра и золота, от менее ценных металлов. Это всего лишь некоторые характерные примеры возможных областей применения данного изобретения. В целом, согласно данному изобретению положительно заряженные катионы металлов, по меньшей мере частично, извлекают из жидкости с помощью твердых бисфосфонатов, определенных в формуле I,нерастворимых или труднорастворимых в жидкости, из которой улавливают металлы. Соединение считается нерастворимым, если его растворимость меньше 0,1 г/100 мл, и труднорастворимым, если его растворимость больше 0,1 г/100 мл, но меньше 1 г/100 мл. Бисфосфонат I действует в жидкостях как ионообменная смола, при этом катионы металлов присоединяются к фосфорсодержащим концам. По сравнению с существующими методиками (например, Diphonix) отсутствует необходимость в дополнительных твердых материалах, поскольку бисфосфонат I действует одновременно как ионообменная смола и как твердая подложка. Низкая растворимость достигается за счет использования в структуре бисфосфоната I длинной углеродной цепи (цепей) или ароматического кольца (колец). Предпочтительно соединение I содержит от 7 до 16 атомов углерода в виде цепной, разветвленной цепной или циклической структуры либо в виде комбинации этих структурных единиц между А и X и предпочтительно в цепи, начинающейся с Р-С-Р-мостикового атома углерода, при этом количество гетероатомных функциональных групп, за исключением фосфорсодержащих функциональных групп, ограничено двумя или тремя группами. Растворимость еще больше уменьшается, если соединение I содержит функциональные группы, способные образовывать твиттерные ионы друг с другом. Характерными примерами твиттерных ионов являются кислоты (например, -CO2H или -PO3H2) и основания (амины) в одной молекуле. Растворимости выбранных бисфосфонатов I определяли с помощью спектрофотометра в УФ и видимой областях спектра при длине волны 880 нм, используя метод молибденовой сини (Finnish Standard Association SFS 3026: Determinationof phosphate in water. Finnish Standard Association SFS, Helsinki Finland, 1986 (Финская ассоциация стандартов SFS 3026: Определение фосфата в воде. Финская ассоциация стандартов SFS, Хельсинки, Финляндия, 1986. Как правило, существующие системы для улавливания металлов эффективны при нейтральных или щелочных величинах pH, но менее эффективны в кислой среде. Как будет показано далее на примерах,бисфосфонат I может эффективно улавливать ионы металлов также и в кислой среде. Некоторые металлы улавливаются даже в сильно кислых условиях, к ним относятся ванадий (V4+) и алюминий (Al3+), для улавливания которых оптимальными диапазонами pH являются 0-0,5 и 1-2 соответственно. В некоторых случаях положительно заряженные металлические элементы улавливают в широком диапазоне pH, как,например, Fe3+ (pH 1-11) и Hg2+ (pH 2-11). Некоторые элементы, такие как литий (Li+), натрий (Na+), калий (K+) и цезий (Cs+), а также отрицательно заряженные элементы в водных растворах, такие как Cr(VI),-5 024285As(III), As(V), Se(IV) и Se(VI), не удаляются из жидкостей с помощью бисфосфоната I. Упомянутая выше pH-селективность является преимуществом в случаях, когда ионы металлов отделяют друг от друга. Простейшим примером является разделение хрома(III) и хрома(VI), так как положительно заряженный Cr3+ извлекается с помощью бисфосфоната I, тогда как Cr6+, существующий в водном растворе в виде бихромат-аниона (Cr2O72-), не связывается бисфосфонатом. Более сложным примером является, например, отделение серебра (Ag+) от катионов меди (Cu2+) и никеля (Ni2+), основанное на различающихся свойствах связывания с соединениями I при разных величинах pH. В этом случае оптимальный диапазон pH для улавливания Ag+ начинается с 1,5, тогда как Cu2+ и Ni2+ улавливают, начиная сpH 3 и 4 соответственно. Вообще говоря, положительно заряженные металлические элементы, улавливаемые в кислой среде, отделяют от катионов, улавливаемых при большей величине pH, или наоборот. Аналогичное разделение предполагается в случае Al3+, V4+, Ru2+, Rh2+, Ir2+, Pt2+, Au3+, Hg+, Hg2+, Pb2+,Sb3+, Nd3+, Sc3+, Nb5+, La3+, Eu3+, Zr4+, Y3+ или Bi3+ при отделении их от других положительно заряженных катионов металлов (например, Са 2+, Mg2+, Sr2+), для которых оптимальный диапазон улавливания начинается с более высоких pH. Эффективность улавливания зависит не только от величины pH, но также и от концентрации металла в растворе и количества используемого бисфосфоната I. Как правило, результаты лучше в случае, когда концентрации катионов металлов соответствуют миллионным долям (м.д.) или уровню чувствительности в 1 миллиардную часть, а количество бисфосфоната приблизительно в 10-300 превышает количество катионов металлов, которые извлекают. В таких условиях для некоторых металлических элементов,таких как Al3+, Ga3+, Cr3+, Fe3+, Cu2+, Ag+, Zn2+, Cd2+, Sn2+, Sn4+, Pb2+, Sb3+, Nd3+, Sc3+, Nb5+ и Bi3+, получают количественное (95%) улавливание. Процент улавливания для остальных исследованных катионов металлов лежит в диапазоне 49-94%. Эти результаты также позволяют судить о порядке сродства (константе равновесия K) исследуемых металлов к твердому бисфосфонатному комплексообразующему агенту I. В этом случае численные значения K (константы связывания) достаточно сложно измерить с помощью традиционных методов титрования, поскольку и бисфосфонатный комплексообразующий агент, и образующийся комплекс являются твердыми соединениями. Кроме того, эффективность улавливания увеличивается при использовании целлюлозы или активированного угля в качестве вспомогательных веществ на стадиях выделения комплексов металлбисфосфонат из растворов. В частности, если количества твердых комплексов металл-бисфосфонат малы по сравнению с объемом, вспомогательные вещества улучшают фильтрацию и делают ее более эффективной. С другой стороны, активированный уголь эффективно связывает также растворимые комплексы металл-бисфосфонат или фракции из растворов и позволяет осуществлять разделение и улавливание таких комплексов и фракций из раствора. Проценты улавливания для меди (Cu2+), никеля (Ni2+) и железа(Fe2+) значительно увеличиваются при использовании в качестве вспомогательного вещества активированного угля. Улавливание ионов металлов из растворов также зависит от времени контакта комплексообразующего агента с жидкостью и от температуры улавливания. В случае единственного катиона металла в растворе, например Mg2+, комплексы образуются в течение нескольких минут, тогда как в более сложных растворах наблюдается селективное связывание металлов. Если время контакта составляет 30 мин или меньше, ионы Pb2+ и Hg2+ связываются с комплексообразующим агентом приблизительно в 10 раз лучше,чем другие изучаемые катионы в том же растворе. Кроме того, при более длительном времени контакта эти ионы обладают большим сродством к комплексообразующему агенту. Ионы Hg2+ связываются в течение нескольких минут, ионы Pb2+ - в течение нескольких часов (практически количественное связывание через 6,5 ч), тогда как для Cd2+ и других ионов требуется более длительное время контакта. Еще большая селективность связывания металлов наблюдается при изменении температуры от 4 до 50C. При более низких температурах (30C) только свинец связывался количественно, при этом селективность при температуре 4C по сравнению с Cd2+, Zn2+, Al3+ и Mn2+ была в 6, 11, 16 и 21 раз выше соответственно. Кроме того, связывание Cd2+ проявляет некоторую селективность при более низких температурах по сравнению с другими изучаемыми металлами, но при температуре 50C все изучаемые катионы, за исключением Са 2+, связываются количественно. Применение улавливания металлов из жидкостей. В этой части текста рассматриваются некоторые области применения, в которых возможно использование комплексообразующего агента I. Большинство из применений относятся к очистке сточных вод из различных источников, таких как места свалки или токсичные отходы с утилизационной установки. Предпочтительно предлагаемый комплексообразующий агент I может эффективно связывать тяжелые металлы, такие как Pb2+, Hg2+ и Cd2+, из жидкостей, содержащих варьируемые количества различных элементов. Кроме того, возможно смягчение воды для бытового потребления, поскольку предполагается,что бисфосфонаты с низкой растворимостью в воде нетоксичны. Изобретение также может быть использовано для аналитических целей, причем не только для количественного отделения катионов и анионов друг от друга, как показано выше, но также и для предварительного концентрирования разбавленных растворов. Изобретение также может быть использовано в горнодобывающей промышленности, где дорогостоящие или редкие металлы отделяют от менее ценных металлов. К другим возможным областям применения относятся улавливание радиоактивного материала и токсичных металлов, например урана,из биологических систем. Это лишь некоторые примеры, при этом использование комплексообразующих агентов I не ограничивается приведенными выше примерами. Качество воды для бытового потребления в населенных пунктах обычно достаточно высокое благодаря использованию водоочистительных станций. Однако в сельской местности не единичны скважины для индивидуального пользования, при этом качество воды в них зависит от жилой площади и типа скважины. Характерными нежелательными металлами, присутствующими в индивидуальных скважинах,являются кальций и магний, влияющие на жесткость воды наряду с другими катионами металлов, такими как железо (предел 400 мкг/л) и марганец (100 мкг/л) (http://www.pori.fi/porilab/rajaarvot.htm). В частности, в пробуренных скважинах качество воды может быть низким из-за присутствия большого количества других катионов металлов, таких как алюминий (200 мкг/л), стронций, медь (2 мг/л) и цинк. Изобретение было исследовано применительно к двум образцам буровой воды из Тампере (DW 1) и Турку(DW 2). Оба образца содержали высокую концентрацию кальция и магния, заметные количества стронция и цинка. DW1 содержал также марганец, a DW2 - катионы алюминия и меди. После обработки образцов комплексообразующим агентом концентрации всех металлов заметно снижались, за исключением натрия, который оставался в растворах. Качество воды при этом существенно улучшалось. Изобретение также обладает преимуществами при использовании для очистки сточных вод из различных источников. В настоящее время не только бытовые и промышленные сточные воды накапливают в свалочных местах, но также, например, и загрязненная почва имеет свое собственное хранение. В таких местах возникают проблемы из-за дождя, касающиеся стока жидкости через места свалки. В зависимости от места свалки стекающая вода, проходящая через эту площадь, может быть загрязнена различными количествами разных элементов. Элементы, в большом количестве присутствующие в окружающей среде, такие как кальций, магний, алюминий и железо, являются не такими вредными, как тяжелые металлы,например, свинец, кадмий и ртуть. Изобретение было проверено на двух образцах дренажной воды TS1 и TS2, полученных с места свалки загрязненной почвы и токсичных отходов соответственно. Образец TS1 содержал различные концентрации катионов Al3+, Ва 2+, Са 2+, Mg2+, Mn2+, Mo6+, Ni2+ и Zn2+, а образец TS2 - в основном Са 2+ и катионы тяжелых металлов As3/5+, Cd2+, Cr3+, Pb2+, Sr2+, Zn2+ и Hg2+. TS1 обрабатывали биисфосфонатным комплексообразующим агентом I, при этом наблюдалось извлечение 32-89% упомянутых выше катионов. Поскольку концентрации тяжелых металлов в образце TS1 были очень низкими, в образец добавляли известные количества мышьяка, кадмия и свинца. Результат после обработки комплексообразующим агентом соответствовал ожидаемому, поскольку наблюдалось практически количественное удаление кадмия и свинца, мышьяк оставался в растворе, а эффективность удаления остальных металлов была практически неизменной. В образце TS2 ртуть и/или катионы ртути удалялись количественно, стронций,цинк, свинец, кадмий и мышьяк - очень эффективно, при этом наблюдалось удаление лишь 23% хрома и железа. В случае мышьяка, кадмия и свинца полученные проценты удаления являются минимальными величинами, так как количества этих ионов после обработки были ниже пределов обнаружения. Удаление мышьяка из TS2 объясняется как совместное осаждение с некоторыми другими катионами в образцеTS2. Третий опытный образец с места свалки (TS3) готовили из золы, полученной из токсичных отходов с утилизационной установки. Этот образец содержал значительные количества Са 2+, K+ и Na+, что приводило к проблемам с удалением остальных катионов. Однако было возможно весьма эффективное, 66%,удаление свинца из такого раствора, хотя концентрации других катионов, имеющихся в избытке, приблизительно в 100-400 раз превышали концентрацию Pb2+. Разбавление водой в соотношении 1:10 (TS3a) и 1:100 (TS3b) значительно улучшало улавливание ионов алюминия, кальция, стронция и цинка. Кроме того, из образцов TS3a и TS3b готовили образцы с добавками кадмия, свинца и цинка, так как из-за разбавления концентрации этих катионов после обработки были близки или ниже предела обнаружения. Результаты, полученные из этих опытов, были хорошими, поскольку наблюдалось количественное удаление и удалялось 92% добавленного цинка. Четвертый приготовленный опытный образец (TS4) содержал много натрия (6 г/л), приблизительно 300 мг/л хрома и варьирующиеся количества некоторых других распространенных катионов металлов,таких как алюминий, кальций, магний и цинк. Такие достаточно кислые (pH 3,7) сточные воды характерны, например, для кожевенной промышленности. На основании приведенных выше примеров хром(III) улавливают в широком диапазоне pH, при этом оптимальное извлечение получают при величине pH 3,1,однако улавливание не настолько эффективно по сравнению с другими металлами из-за низкой связующей способности. Это можно легко преодолеть, если раствор отходов обработать большим избытком комплексообразующего агента, при этом обработку повторяют несколько раз либо раствор разбавляют до значительного объема. Все эти способы испытывали применительно к образцу TS4, при этом наилучшие результаты были получены в случае, когда раствор отходов разбавляли и обработку повторяли по меньшей мере дважды. Хотя такой вид кислых растворов сложно очистить с помощью других способов,способ, разработанный здесь, приводил приблизительно к 83-100% удалению хрома. Как следует из описанных выше опытов, твердые бисфосфонаты I являются достаточно хорошими комплексообразующими агентами для улавливания различных металлических элементов из растворов,содержащих варьирующиеся количества различных элементов. Особенно хорошие результаты получают при удалении тяжелых металлов, таких как катионы кадмия, свинца и ртути, из раствора, содержащего другие мешающие элементы. Другие тяжелые металлы, такие как хром, цинк, стронций и молибден,также хорошо улавливаются из различных растворов. Кроме того, эффективно удаляются другие вредные катионы, такие как алюминий, кальций и магний, в частности, содержащиеся в водах для бытового потребления. Изобретение также может быть использовано в горнодобывающей промышленности, когда ценные и/или редкие металлы улавливают из разбавленных жидкостей. В настоящее время эффективные способы, основанные на осаждении, например в виде сульфидов, разработаны для известных металлов, таких как железо, никель, медь и марганец, однако проблемы возникают при выделении редких металлов, таких как иридий, галлий или рутений, из руды, содержащей множество других более распространенных металлов. Как показано выше, имеются различные способы удаления металла, подлежащего улавливанию, основанные на выборе pH, температуры, времени контакта и улавливающей емкости. Металлы,улавливаемые при более низких величинах pH (Al3+, V4+, Ru2+, Rh2+, Ir2+, Pt2+, Au3+, Hg+, Hg2+, Pb2+, Sb3+,Nd3+, Sc3+, Nb5+, La3+, Eu3+, Zr4+, Y3+ или Bi3+), легко отделяются от металлов, например Са 2+, Mg2+ и Sr2+,связывающихся при более высоких величинах pH. Кроме того, в то же время возможно концентрирование в плотную твердую форму таких элементов, например, 10000 мл до 1 г или 10 м 3 до 1 кг. При изменении температуры или времени контакта возможно селективное улавливание, например, Pb2+, Hg2+, Hg+,Cd2+ и Zn2+ по сравнению с другими металлами, такими как Са 2+, Mg2+ Ni2+. Особенно полезным является улавливание катионов Au3+ из растворов TS5, содержащих варьируемые количества некоторых других металлов. Изобретение не ограничивается улавливанием определенных металлов из растворов, содержащих смеси катионов металлов в различных количествах, также может одновременно улавливаться несколько металлов. В приведенных выше примерах количество комплексообразующего агента I было ограниченным по сравнению с общим количеством разных катионов металлов в жидкости, либо улавливания регулировали с помощью других критериев выбора. Несколько металлов можно улавливать одновременно,если количество комплексообразующего агента достаточно по сравнению с количеством металлов, подлежащих улавливанию, и если улавливание не ограничено каким-либо другим критерием выбора, например величиной pH. Как правило, можно осуществлять одновременное улавливание металлов, имеющих достаточное сродство к комплексообразующему агенту. Катионы Zn2+, Eu3+, La3+, Nd3+, Y3+, UO22+,Nb5+ и Zr4+ улавливались с количественными выходами из образца TS5, поскольку предполагается, что эти металлы имеют также самое высокое сродство к комплексообразующему агенту, при этом и остальные из присутствующих в большом количестве металлов в образце Mg2+ и Ni2+ с более низким сродством также улавливаются с хорошими выходами. Все металлы с высоким или средним сродством к комплексообразующему агенту могут улавливаться и концентрироваться одновременно. Изобретение также обладает преимуществами при улавливании конкретных групп металлов. Выбор металлов основан, например, на pH, температуре, времени контакта или емкости. Предпочтительно металлы выбирают, основываясь на величине pH. Очень хорошие результаты были получены при добавлении в образец TS5 катионов алюминия, галлия и ванадия. Улавливание происходило при очень низкой величине pH, при которой ожидалось, что лишь добавленные металлы и Fe3+ будут иметь сродство к комплексообразующему агенту. TS5 обрабатывали комплексообразующим агентом при pH 0,5. Результат был ожидаемым, так как добавленные Al3+ и V4+ улавливались с количественными выходами, Ga3+ - с выходом 93% и лишь Fe3+ отделялся от других металлов, в большом количестве присутствующих в образце TS5. Ожидается, что при низкой величине pH катионы Al3+, V4+, Ru2+, Rh2+, Ir2+, Pt2+, Au3+, Hg+,Hg2+, Pb2+, Sb3+, Nd3+, Sc3+, Nb5+, La3+, Eu3+, Zr4+, Y3+ и/или Bi3+ будут отделяться от остальных исследуемых катионов, или наоборот. Также могут быть использованы другие способы выбора группы металлов,например Pb2+, Hg2+ и Hg+ отделяют от других металлов, когда время контакта комплексообразующего агента с раствором является коротким (например, 30 мин). Изобретение также может широко использоваться для аналитических целей, при которых твердые бисфосфонатные комплексообразующие агенты используют для предварительного концентрирования требуемых катионов металлов из разбавленных растворов и/или растворов, содержащих различные мешающие элементы. Области применения не ограничиваются отделением ионов с противоположным зарядом друг от друга или улавливанием выбранных катионов из смеси элементов на основе регулируемого выбора величины pH. Предпочтительно комплексообразующие агенты являются очень эффективными при уровнях концентрации в мг/л (м.д.) и мкг/л (миллиардных частях), при этом количественное улавливание в оптимальных условиях получают для катионов Al3+, Ga3+, Cr3+, Fe3+, Cu2+, Ag+, Zn2+, Cd2+, Sn2+,Sn4+, Pb2+, Sb3+, Nd3+, Sc3+, Nb5+ и Bi3+. Другие изученные катионы металлов также улавливаются с выходами 49-94%. Как правило, с помощью комплексообразующего агента легко достигалось концентрирование от 1000-10000 до 1 (например, 10000 мл на 1 г комплексообразующего агента). Предпочтительно количества металлов измеряют либо непосредственно из твердого материала, например с помощью РФСРЭ (EDXRF) (Energy Dispersive X-ray Fluorescence Spectrometry - рентгено-флуоресцентной спектроскопии с рассеиванием энергии), либо после разложения твердых веществ с помощью микроволнового гидролиза. Изобретение также обладает преимуществами при улавливании радиоактивного материала и концентрировании до меньшего объема. Однако с радиоактивными материалами запрещено работать в обычных лабораториях, но согласно общим правилам химические свойства, например реакции и комплексообразование, будут одинаковыми для всех различных изотопов элемента. Предпочтительно изобретение использовали для улавливания урана (UO22+), при этом ожидается, что также и другие положительно заряженные актиниды, например Pu3+, PuO22+, Am3+ и AmO22+, могут улавливаться аналогичным образом. Кроме того, наглядным является улавливание и концентрирование ядерных отходов, так как типичные долгоживущие, такие как 126Sn или 107Pd, и среднеживущие, такие как 113mCd, 90Sr, осколочные изотопы удаляются из растворов в виде соответствующих нерадиоактивных изотопов. Изобретение также удовлетворяет критериям "зеленой химии", поскольку во время комплексообразования не требуется использования какого-либо дополнительного твердого материала, а регенерация бисфосфонатного комплексообразующего агента легко осуществляется с помощью концентрированной кислоты. Рециклинг и регенерацию раствора изучали с помощью раствора Cu2+, который пропускали через комплексообразующий агент на микропористом диске. Емкость улавливания катионов Cu2+ снижалась от 2300 до 860 м.д. (приблизительно 37% от исходного) между 1- и 10-м циклами рециклинга, однако между 10- и 20-й стадиями рециклинга величина уменьшалась лишь на 17%. Множество модификаций и другие варианты осуществления изобретений, излагаемые в данном документе, будут очевидны специалистам в области техники, к которой принадлежат эти изобретения, обладающие преимуществом идей, представленных в приведенном выше описании и сопутствующих примерах. Таким образом, следует понимать, что изобретение не ограничено конкретными примерами описанных вариантов осуществления, при этом модификации и другие варианты осуществления предназначены для включения в объем прилагаемой формулы изобретения. Хотя в данном контексте использованы специальные термины, они использованы исключительно в общем и описательном смысле, а не в целях ограничения. Описание примеров осуществления изобретения Экспериментальная часть Следующие синтетические и аналитические примеры предложены для иллюстрации изобретения, и их ни в коем случае не следует истолковывать, как ограничивающие объем изобретения. В приведенных ниже примерах использованы следующие сокращения. Сокращения, не определенные ниже, имеют их общепринятые значения.AAC (AAS) = атомно-абсорбционная спектроскопия (atomic absorption spectroscopy),ХПААС (CVAAS) = атомно-абсорбционная спектроскопия с использованием низкотемпературного пара (cold vapor atomic absorption spectroscopy),ИСП-ЭС (ICP-AES) = эмиссионная спектроскопия с индуктивно-связанной плазмой (inductivelycoupled plasma emission spectroscopy). Общая методика определения процента извлечения в примерах 7-20. Водный раствор (110 мл), содержащий известное количество одного катионного элемента или элементов, обычно 0,5-200 м.д., готовили из стандартного раствора Merch Titrisol. После доведения величины pH с помощью кислоты (например, HCl или HNO3) или основания (например, NaOH) до требуемой исходной величины отбирали образец А (10 мл), после чего добавляли 100 мг выбранного твердого комплексообразующего агента. Смесь перемешивали при комнатной температуре в течение 24 ч и отбирали образец В (10 мл). Образцы А и В фильтровали по отдельности через шприцевой фильтр 0,2 мкм и с помощью атомно-абсорбционного спектрофотометра определяли концентрацию изучаемого элемента или элементов в обоих растворах. На основании разности концентраций между растворами образцов А и В определяли извлечение в процентах. Анализируемый раствор, использованный в примерах 12-23. Опытный образец 1 (TS1). Образец дренажной воды отбирали на месте свалки, содержащей загрязненную почву: приблизительно 200 мг/л Са 2+ и Mg2+; 0,05 - 0,3 мг/л Al3+, Ba2+, Mn2+, Mo6+, Ni2+ и Zn2+; 0,05 мг/л As3+ (или As5+),Cd2+ и Pb2+; pH 3,53. Опытный образец 2 (TS2). Образец сточной воды с места свалки, содержащей тяжелые металлы: приблизительно 2 г/л Са 2+; 0,1-13 мг/л As3+ (или As5+), Cr3+, Fe2/3+, Pb2+, Sr2+, Zn2+ и Hg2+; pH 3,56. Опытный образец 3 (TS3). Образец золы (200 г), полученной из токсичных отходов с утилизационной установки, суспендировали в воде (2,0 л), перемешивали в течение 24 ч и фильтровали. Приблизительные концентрации металлов (pH 3,62): 1-4 г/л Са 2+, K+ и Na+, 0,1-0,2 г/л Al3+, Mg2+ и Zn2+; 0,02 г/л Cd2+, Mn2+, Pb2+ и Sr2+. Опытный образец 4 (TS4). Готовили анализируемый раствор, содержащий 24000 мг/л Na+; 50-2000 мг/л Са 2+, Cr3+, K+ и Mg2+ и следовое количество катионов Al3+, Fe2/3+, Mn2+, Ni2+, Sr2+, V4+ и Zn2+. Опытный образец 5 (TS5). Готовили анализируемый раствор, содержащий 1-15 мг/л Al3+, Fe2/3+, Mg2+, Mn2+, Ni2+ и Zn2+; 0,1-0,9 мг/л Са 2+ и Na+ и следовое количество других катионов Cr3+, Co2+, Cu2+, Eu3+, La3+, Nd3+, Y3+, UO22+ и Nb5+. Названия приготовленных соединений в примерах 1-5 взяты из ChemBioDrawUltra 11,0. Пример 1. 11-Амино-1-гидроксиундекан-1,1-диилдифосфоновая кислота (1 а): Смесь 11-аминоундециловой кислоты (157 г), фосфорной кислоты (64 г) и метансульфоновой кислоты (375 мл) нагревали до температуры 65C с последующим добавлением PCl3 (140 мл) в течение 20 мин. Затем смесь выдерживали при температуре 65C в течение 48 ч и в сильно охлажденный раствор добавляли при интенсивном перемешивании холодную воду (1 л). После нагревания при кипении с обратным холодильником в течение ночи реакционную смесь охлаждали до 0C и твердый продукт отделяли фильтрацией, получая 1 а (270 г) в виде твердого вещества белого цвета. 1 Н ЯМР (D2O, 500 МГц):2,52 (т, 2 Н, 3JHH=7,0 Гц), 1,81 (м, 2 Н), 1,49 (м, 2 Н), 1,36 (м, 2 Н), 1,29-1,18(м, 14 Н). 31 Р ЯМР (D2O, 202 МГц):20,4. Для примера аналогичным образом были получены следующие бисфосфонаты. 8-Амино-1-гидроксиоктан-1,1-диилдифосфоновая кислота (1b): 1 Н ЯМР (D2O):2,62 (2 Н, т, J=7,0 Гц), 1,93-1,81 (2 Н, м), 1,61-1,52 (2 Н, м), 1,50-1,41 (2 Н, м), 1,391,24 (6 Н, м); 31 Р ЯМР (D2O):19,05 (с). 9-Амино-1-гидроксинонан-1,1-диилдифосфоновая кислота (1 с): 1 Н ЯМР (D2O):2,59 (2 Н, т, J=7,0 Гц), 1,93-1,79 (2 Н, м), 1,59-1,50 (2 Н, м), 1,50-1,38 (2 Н, м), 1,371,21 (8 Н, м); 31 Р ЯМР (D2O):19,30 (с). 10-Амино-1-гидроксидекан-1,1-диилдифосфоновая кислота (1d): 1 Октан-1,1-диилдифосфоновая кислота (6 а). Тетраизопропил-метилен-бисфосфонат (8,0 г, 23,2 ммоль) добавляли по каплям в NaH (0,8 г, 60% в масле) в сухом ТГФ (тетрагидрофуране) (40 мл), и смесь перемешивали при комнатной температуре в течение 1,5 ч с последующим постепенным добавлением 1-бромгептана. Смесь нагревали при кипении с обратным холодильником в течение 23 ч, в охлажденную смесь добавляли воду (160 мл) и продукт экстрагировали с помощью CH2Cl2 (3150 мл). После сушки растворители упаривали, и остаток очищали с помощью колоночной хроматографии на силикагеле (Rf=0,68 EtOAc/ацетон, 1:2) и получали тетраизопропиловый промежуточный продукт, который обрабатывали HCl (4 M). После нагревания при кипении с обратным холодильником в течение 17 ч смесь упаривали досуха и получали 6 а (4,4 г, 69%) в виде твердого вещества белого цвета. 1 Н ЯМР (D2O):2,23 (1 Н, tt, 2JHP=23,2 Гц, 3JHH=6,0 Гц), 1,93-1,79 (2 Н, м), 1,59-1,50 (2 Н, м), 1,36-1,22(8 Н, м), 0,89-0,81 (3H, м); 31 Р ЯМР (D2O):22,73 (с). В качестве примера аналогичным образом получали следующие бисфосфонаты. Ундекан-1,1-диилдифосфоновая кислота (6b): 1 Н ЯМР (CD3OD):2,16 (1 Н, tt, 2JHP=23,5 Гц, 3JHH=6,0 Гц), 1,99-1,84 (2 Н, м), 1,66-1,55 (2 Н, м), 1,391,22 (14 Н, м), 0,94-0,85 (3H, м); Пример 3. 1-Аминононан-1,1-диилдифосфоновая кислота (7 а). Смесь октилцианида (1,4 г, 10 ммоль), фосфорной кислоты (1,6 г), и безводной бензолсульфокислоты (10 г) нагревали до температуры 65C в атмосфере аргона с последующим добавлением PCl3 (0,9 мл). Смесь перемешивали при температуре 90C в течение 17 ч, добавляли воду (40 мл), после чего реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Твердый продукт отделяли фильтрацией и получали 7 а (0,9 г, 30%) в виде твердого вещества белого цвета. 1 Н ЯМР (D2O):2,11-2,00 (2 Н, м), 1,61-1,52 (2 Н, м), 1,38-1,23 (10H, м), 0,90-0,82 (3H, м); 31 Р ЯМР (D2O):12,71 (с). В качестве примера аналогичным образом получали следующие бисфосфонаты. 1-Аминодекан-1,1-диилдифосфоновая кислота (7b): 1 Н ЯМР (D2O):2,06-1,96 (2 Н, м), 1,58-1,48 (2 Н, м), 1,33-1,18 (12 Н, м), 0,85-0,78 (3H, м); 31 Р ЯМР (D2O):12,57 (с). Пример 4 Другие способы получения бисфосфонатов. Мононатриевая соль 11-гидрокси-11,11-бис-(гидрокси(метокси)фосфорил)-N,N,Nтриметилундекан-1-аммонийиодида (8 а). Тринатриевую соль 1 а (2,0 г, 4,8 ммоль) растворяли в воде (10 мл) и добавляли йодистый метил(4 мл), после чего смесь перемешивали в течение 2 дней при температуре 40C. Смесь упаривали досуха и дважды повторяли обработку MeI. Остаток растворяли в ацетоне, удаляли твердые вещества, фильтрат упаривали досуха и получали 8 а (2,6 г, 95%) в виде твердого вещества светло-коричневого цвета. 1 Н ЯМР (D2O, 500 МГц):3,71-3,68 (м, 6 Н), 3,36 (м, 2 Н), 3,16 (9 Н, с), 1,95 (м, 2 Н), 1,84 (м, 2 Н), 1,61 11-Гидрокси-N,N.N-триметил-11,11-дифосфоноундекан-1-аммонийхлорид (8b). Соединение 6 а (1,3 г, 2,3 ммоль) нагревали при кипении с обратным холодильником с 6 М HCl(10 мл) в течение 6 ч. Смесь упаривали досуха и остаток растворяли в сухом MeOH (8 мл), твердые вещества удаляли и фильтрат упаривали досуха. Осадок промывали ацетоном (10 мл), сушили в вакууме и получали 8b (0,88 г, 90%) в виде твердого вещества желтого цвета. 1 Н ЯМР (D2O, 500 МГц):3,36 (м, 2 Н), 3,15 (с, 9 Н), 1,95 (м, 2 Н), 1,84 (м, 2 Н), 1,61 (м, 2 Н), 1,45-1,33 11-Ацетамидо-1-гидроксиундекан-1,1-диилдифосфоновая кислота (8 с). Получали из тринатриевой соли 1 а (1,0 г, 4,8 ммоль) и уксусного ангидрида (5 мл) с помощью известного метода (Turhanen, P. A.; Vepslinen, J. J. Beilstein J. Org. Chem. 2006, 2, No. 2. doi:10,1186/18605397-2-2). После обработки катионообменной смолой Dowex H+ (50W8-200) получали 6 с (0,78 г, 83%) в виде твердого вещества белого цвета.(м, 2 Н), 1,38-1,28 (м, 12 Н); 31 Р ЯМР (CD3OD, 202 МГц):21,9. 11-2,2-Дифосфоноэтил)тио)ундекановая кислота (8d). Тетраизопропиловый эфир этен-1,1-диилдифосфоновой кислоты (2 г) и 11-меркаптоундекановую кислоту (1,23 г) в метаноле (50 мл) нагревали при температуре 40C в течение ночи с последующим добавлением 4 М HCl (50 мл). Смесь нагревали при кипении с обратным холодильником в течение ночи и упаривали досуха с получением 8d (2,28 г, 99%) в виде твердого вещества белого цвета. 1 Н ЯМР (CD3OD, 500 МГц):3,03 (тд, 2 Н, 3JPH=15,8 Гц, 3JHH=6,1 Гц), 2,58 (т, 2 Н, 3JHH=7,3 Гц), 2,45(тт, 1 Н, 3JPH=23,4 Гц, 3JHH=6,1 Гц), 2,30 (т, 2 Н, 3JHH=7,4 Гц) 1,60 (м, 4 Н), 1,42 (м, 2 Н), 1,36-1,27 (м, 8 Н); 31 Р ЯМР (CD3OD, 202 МГц):19,9. 6-2,2-Дифосфоноэтил)амино)гексановая кислота (8 е). Синтезировали аналогично 8d из 6-аминокапроновой кислоты (810 мг) и получали 8 е (1,96 г, 99%) в виде твердого вещества белого цвета. 31 Р ЯМР (CD3OD, 202 МГц):19,5 (шир.с). Пример 5.(Z)-1-(Гептадек-8-еноилокси)этан-1,1-диилдифосфоновая кислота (9 а). В раствор тетраметилового эфира этидроната (3,9 г, 15 ммоль), полученного из диметилфосфата и диметилацетилфосфоната с помощью известного метода (Turhanen, P.A., Ahlgren, M.J., Jrvinen, Т. иVepslinen J.J. Phosphorus, Sulfur Silicon 170 (2001) 115), в ацетонитриле (65 мл) добавляли олеоилхлорид (5,5 мл, 20 ммоль) и смесь перемешивали при температуре 55C в течение 72 ч. Растворители удаляли и остаток очищали с помощью колоночной хроматографии, используя смесь EtOAc-MeOH (9:1) в качестве элюента. Фракции, содержащие требуемый промежуточный продукт, упаривали досуха и растворяли в сухом ацетонитриле с последующим добавлением триметилсилилбромида (4,4 экв.). После перемешивания в течение 3 ч при температуре 20C летучие жидкости отгоняли, а остаток растворяли в метаноле. Смесь перемешивали в течение 2 ч при температуре 20C, растворители отгоняли и остаток промывали н-гексаном и получали 9 а (1,7 г) в виде порошка белого цвета. 1 Н ЯМР (CD3OD, 500 МГц):5,37-5,30 (2 Н, м), 2,35 (2 Н, т, 3JHH=7,5 Гц), 2,03-1,98 (4 Н, м), 1,93 (3H,3 т, JHP=15,8 Гц), 1,65-1,58 (2 Н, м), 1,37-1,20 (20 Н, м), 0,88 (3H, т, 3JHH=6,9 Гц); 31 Р ЯМР (CD3OD, 202 МГц):17,9. В качестве примера аналогичным образом получали следующие бисфосфонаты. 1-(Додеканоилокси)этан-1,1-диилдифосфоновая кислота (9b): 1 Н ЯМР (CD3OD, 500 МГц):2,38 (2 Н, т, 3JHH=7,5 Гц), 1,88 (3H, т, 3JHP=15,3 Гц), 1,67-1,60 (2 Н, м),1,39-1,23 (16 Н, м), 0,90 (3H, т, 3JHH=6,9 Гц); 31 Р ЯМР (CD3OD, 202 МГц):17,8. 1-(Стеароилокси)этан-1,1-диилдифосфоновая кислота (9 с). 1 Н ЯМР (CD3OD, 500 МГц):2,38 (2 Н, т, 3JHH=7,5 Гц), 1,88 (3H, т, 3JHP=15,3 Гц), 1,67-1,60 (2 Н, м),1,39-1,23 (28 Н, м), 0,90 (3H, т, 3JHH=6,9 Гц); 31 Р ЯМР (CD3OD, 202 МГц):17,8. Пример 6. Растворимость соединений. Растворимости выбранных соединений определяли с помощью спектрофотометра в УФ и видимой областях спектра на длине волны 880 нм, используя метод молибденовой сини, из насыщенных водных растворов образцов (Finnish Standard Association SFS 3026: Determination of phosphate in water (Финская ассоциация стандартов SFS 3026: Определение фосфата в воде). Finnish Standard Association SFS, HelsinkiFinland, 1986). Полученные результаты представлены в табл. 1. Таблица 1 Найденные растворимости выбранных комплексообразующих агентов 1) В пересчете на моногидрат. 2) Растворимость в пересчете на элементарный фосфор. 3) Растворимость, рассчитанная для всей молекулы; мононатриевая соль. Пример 7. pH и извлечение в %. Используя указанную выше общую методику, определяли оптимальные диапазоны pH для извлечения каждого металла с помощью комплексообразующего агента 1 а. Для каждого элемента извлечение в% определяли при разных величинах pH в диапазоне 5-14. Полученные результаты показаны в приведенной ниже таблице с минимальным извлечением в % внутри оптимального диапазона pH. Таблица 2 Определенные диапазоны pH с минимальным извлечением в % для выбранных элементов при использовании в качестве комплексообразующего агента 1 а Пример 8. Улавливание отдельных катионов металлов из водного раствора. Максимальное извлечение в % и величину pH, при которой оно достигается, определяли для каждого отдельного катионного элемента, используя общую методику, приведенную выше. Результаты для соединения 1 а представлены в табл. 3. Таблица 3 Определение величины pH для максимального извлечения в % выбранных элементов при использовании в качестве комплексообразующего агента 1 а Пример 9. Улавливание отдельных катионов металлов из водных растворов без использования и с использованием активированного угля. Используя описанную выше общую методику, определяли в % извлечение катионов Cu2+, Ni2+ и 3+Fe при pH 3 при использовании в качестве комплексообразующих агентов соединений 2 а, 2b, 5b, 6b и 6 с. Опыты повторяли, добавляя в раствор одновременно с использованием комплексообразующего агента также активированный уголь (100 мг). Результаты обоих опытов представлены в табл. 4. Таблица 4 Определение извлечения катионов Cu2+, Ni2+ и Fe3+ в % для выбранных комплексообразующих агентов без добавления и с добавлением активированного угля (АУ) Пример 10. Улавливающая емкость. Способность соединения 1 а улавливать выбранные металлы определяли в соответствии с общей методикой, описанной выше, используя в каждом эксперименте концентрацию исходного металла 100 м.д. и 1 а (100 мг) при выбранной величине pH. Количества металлов, извлеченных из смеси, определяли с помощью AAC (AAS). Результаты представлены в табл. 5 и приведены в мг металла, связанного с 1 г 1 а. Пример 11. Влияние количества комплексообразующего агента на извлечение в %. Влияние количества комплексообразующего агента 1 а на извлечение в % изучали на примере раствора кальция (Са 2+) с концентрацией 2,0 м.д. Раствор (100 мл), содержащий 2,0 м.д. кальция, перемешивали в течение 24 ч с требуемым количеством комплексообразующего агента 1 а (от 25 до 301 мг) при pH 2,9. Извлечение в % определяли для каждого раствора, используя общую методику, результаты представлены в табл. 6. Таблица 6 Извлечение в % Са 2+ в зависимости от количества комплексообразующего агента 1 а на примере раствора 2 м.д. кальция Пример 12. Влияние температуры на извлечение в %. Влияние температуры на извлечение выбранного металла в % изучали, используя TS5 с комплексообразующим агентом 1 а. TS5 (100 мл) с добавкой известных количеств катионов свинца (Pb2+) перемешивали с 1 а (1,0 г) при выбранной температуре в течение 24 ч, после чего отделяли 1 а фильтрацией через шприцевой фильтр 0,2 мкм. Концентрации металла при температурах 4, 7, 22, 30, 40 и 50C определяли с помощью анализа ИСП-ЭС (ICP-AES). Извлечение в % вычисляли, сравнивая эти результаты с исходными концентрациями металла в TS5, результаты приведены в табл. 7. Таблица 7 Влияние температуры на извлечение в % на примере образца 1) Минимальное извлечение [%], так как количество элемента после обработки 1 а ниже предела обнаружения. Пример 13. Влияние времени контакта на извлечение в %. Влияние времени контакта на извлечение выбранного металла в % изучали, используя TS5 с комплексообразующим агентом 1 а. TS5 (100 мл) с добавкой известных количеств катионов свинца (Pb2+) и ртути (Hg2+) перемешивали с 1 а (100 мг) в течение выбранных периодов времени, после чего отделяли 1 а фильтрацией через шприцевой фильтр 0,2 мкм. Определяли концентрации металла спустя 5, 15, 30 мин,1, 2, 3,5, 6,5 и 29,5 ч с помощью анализа ИСП-ЭС (ICP-AES). Извлечение в % вычисляли, сравнивая эти результаты с исходными концентрациями металла в TS5. Результаты показаны в табл. 8. Таблица 8 Улавливание выбранных металлов из образца TS5 с добавкой Pb2+ и Hg2 при изменении времени контакта с комплексообразующим агентом 1 а Пример 14. Отделение Cr(III) от Cr(VI). Водный раствор (100 мл), содержащий 1,72 м.д. Cr(III) и 1,89 м.д. Cr(VI), готовили из стандартного раствора Merch Titrisol и доводили величину pH до 4,0. В соответствии с общей методикой, описанной выше, смесь обрабатывали 1 а (100 мг) и вычисляли извлечение Cr(III) и Cr(VI), составившие 97 и 0% соответственно. Пример 15. Очистка и смягчение воды из пробуренных скважин. Образец 1 из пробуренной скважины (DW 1) отбирали вблизи Тампере, а образец 2 (DW 2) - вблизи Турку. Образцы (по 100 мл каждый) перемешивали с 1 а (1,0 г) в течение 24 ч. Начальные и конечные концентрации металлов в растворах выбранных металлов определяли с помощью анализа ИСП-ЭС (ICPAES) после фильтрации, результаты показаны в табл. 9. Таблица 9 Смягчение и очистка от выбранных металлов воды из пробуренной скважины с помощью комплексообразующего агента 1 а 1) DW 1 (pH 7,04) отбирали из пробуренной скважины вблизи Тампере. 2) Образец обрабатывали 1 а. 3) DW2 (pH 6,97) отбирали из пробуренной скважины вблизи Турку. 4) Количество элемента ниже предела обнаружения. 5) Минимальное извлечение [%]. Пример 16. Очистка воды, стекающей через место свалки. Опытный образец 1 (TS1, 100 мл), в котором исходные концентрации катионов металлов определяли с помощью метода ИСП-ЭС (ICP-AES), обрабатывали 1 а (1,0 г) при перемешивании в течение 24 ч После фильтрации через шприцевой фильтр в растворе определяли концентрации металлов 0,2 мкм и рассчитывали удаление в процентах. Поскольку в TS1 содержались лишь небольшие количества As, Cd иPb, в него добавляли известные количества этих катионов металлов. Образец с добавкой (100 мл) обрабатывали 1 а (1 г) как и исходный образец TS1. Результаты обоих опытов приведены в табл. 10. Таблица 10 Очистка дренажной воды из загрязненной почвы. Образец D был таким же, как С, но с добавкой As, Cd и Pb 1) Количество элемента ниже предела обнаружения. 2) Минимальное извлечение [%], так как количество элемента после обработки 1 а ниже предела обнаружения. 3) Образец с добавкой As2+ (начальная концентрация 1,06 мг/л и конечная -1,06 мг/л), Cd2+ (1,030 и 0,038 мг/л) и Pb2+ (2,780 и 0,166 мг/л).TS2 (100 мл), в котором исходные концентрации катионов металлов определяли с помощью методов AAC (AAS) и ИСП-ЭС (ICP-AES), обрабатывали 1 а (1,0 г) при перемешивании в течение 24 ч. После фильтрации через шприцевой фильтр 0,2 мкм в растворе определяли концентрации металлов. Вычисленное извлечение в % приведено в табл. 11. Таблица 11 Очистка образца TS2 от тяжелых металлов с помощью комплексообразующего агента 1 а 1) Количество Hg определяли с помощью метода ХПААС (CVAAS). 2) Минимальное извлечение [%], так как количество элемента после обработки 1 а ниже предела обнаружения. Пример 18. Очистка зольной воды, полученной из токсичных отходов с утилизационной установки. Образец TS3, образец TS3, разбавленный в соотношении 1:10 (TS3a) и в соотношении 1:100 (TS3b),и образцы TS3a и TS3b с добавками Cd2+, Pb2+ и Zn2+.обрабатывали, каждый, 1 а (1,0 г) при перемешивании в течение 24 ч. Эти пять образцов по отдельности фильтровали через шприцевой фильтр 0,2 мкм и определяли концентрации металла в каждом растворе с помощью метода ИСП-ЭС (ICP-AES) до и после обработки 1 а. Вычисленные значения извлечения в % показаны в табл. 12. Таблица 12 Очистка сточных вод, полученных из золы, содержащей токсичные металлы,с использованием 1 а в качестве комплексообразующего агента(1,12 и 0,10 мг/мл). 5) Минимальное извлечение [%], так как количество элемента после обработки 1 а ниже предела обнаружения. 6) н/обн. = не обнаружено, поскольку количество элемента ниже предела обнаружения. Пример 19. Удаление Cr3+ из кислого раствора. Образец TS4 разбавляли водой в соотношении 1:100, определяли величину pH (3,67) раствора и отбирали образец А. Часть (50 мл) разбавленного раствора обрабатывали 1 а, 6d или 7 а (1,0 г) в течение 24 ч при перемешивании при комнатной температуре. После фильтрации через шприцевой фильтр 0,2 мкм определяли извлечение Cr(III) по сравнению с исходным раствором А. Результаты извлечения в % Cr3+ и некоторых других элементов приведены в табл. 13. Таблица 13 Удаление Cr3+ из образца TS4 с помощью 1 а 1) Минимальное извлечение [%], так как количество элемента ниже предела обнаружения. 2) Не определено. Пример 20. Отделение серебра с помощью комплексообразующего агента с помощью использования элюирования HCl. Смесь Cu(NO3)23H2O (20 мл, 0,1 М), AgNO3 (20 мл, 0,1 М), Fe(NO3)3 (20 мл, 0,1 М), воды (40 мл) и 1 а (10 г) перемешивали в течение 48 ч при комнатной температуре. Твердые вещества собирали в микропористый диск (пористость G-4), промывали водой (60 мл) и элюировали 0,01 М (60 мл), 0,1 М (60 мл) и 1 М (60 мл) растворами HCl. Количество каждого из металлов в элюированных растворах HCl определяли с помощью AAC (AAS), используя стандартные методики. На основании этих результатов рассчитывали конечную концентрацию каждого металла в твердом комплексообразующем агенте 1 а, результаты приведены в табл. 14. Таблица 14 Улавливание серебра с помощью 1 а из раствора,содержащего смесь ионов Ag+, Cu2+ и Fe3+ Пример 21. Улавливание золота из образца TS5 с помощью соединения 1 а.TS5 (100 мл) представлял собой стандартный раствор Merch Titrisol с добавкой Au3+ (87,7 мг/мл). После доведения величины pH смеси до 3,0 с помощью HNO3 отбирали образец А, после чего добавляли 1 а (5 г). Смесь перемешивали при комнатной температуре в течение 24 ч и отбирали образец В. Образцы А и В фильтровали по отдельности через шприцевой фильтр 0,2 мкм и определяли концентрацию выбранного элемента в обоих растворах с помощью метода ИСП-ЭС (ICP-AES). Величины извлечения в % для выбранных элементов вычисляли, исходя из разницы концентраций между образцами А и В. Результаты извлечения золота из TS5 представлены в табл. 15. Таблица 15 Извлечение золота из TS5 при использовании 1 а в качестве комплексообразующего агента 1) Конечная концентрация золота была 30,7 мг/мл. 2) Минимальное извлечение [%], так как количество элемента после обработки 1 а было ниже предела обнаружения.TS5 (100 мл) перемешивали с 1 а (1 г) при комнатной температуре в течение 24 ч. После фильтрации через шприцевой фильтр 0,2 мкм концентрацию металлов Ni2+, Zn2+, Eu3+, La3+, Nd3+, Y3+, UO22+, Nb5+ иZr4+ определяли с помощью методов ИСП-ЭС (ICP-AES) и ИСП-МС (ICP-MS - масс-спектроскопия с индуктивно связанной плазмой). Величину извлечения в % вычисляли для каждого элемента, исходя из разницы концентраций между начальным и конечным растворами, результаты опытов представлены в табл. 16. Таблица 16 Одновременное улавливание Ni2+, Zn2+, Eu3+, La3+, Nd3+, Y3+, UO22+, Nb5+ и Zr4+ из TS5 при использовании в качестве комплексообразующего агента 1 аTS5 (100 мл) представлял собой стандартные растворы Merch Titrisol с добавкой известных количеств Al3+, Ga3+ и V4+. После доведения величины pH смеси до 0,5 с помощью HNO3 отбирали образец А,затем добавляли 1 а (10 г). Смесь перемешивали при комнатной температуре в течение 24 ч и отбирали образец В. Образцы А и В фильтровали по отдельности через шприцевой фильтр 0,2 мкм и концентрации исследуемых элементов в обоих растворах определяли с помощью метода ИСП-ЭС (ICP-AES). Величины извлечения в % для каждого элемента вычисляли исходя из разницы концентраций между образцами А и В. Результаты опытов представлены в табл. 17. Таблица 17 Одновременное улавливание Al3+, Ga3+ и V4+ изTS5 при использовании в качестве комплексообразующих агентов 1 а 1) Al3+: начальная 105,0 мг/мл, конечная 0,2 мг/мл. 2) Ga2+: начальная 109,2 мг/мл, конечная 7,4 мг/мл. 3) V4+: начальная 104,0 мг/мл, конечная 0,3 мг/мл. 4) Минимальное извлечение [%], так как количество элемента после обработки 1 а было ниже предела обнаружения. Пример 24. Концентрация разбавленных образцов. Водный раствор (100 мл), содержащий 100 ч./млрд требуемого металлического элемента, приготовленный из стандартного раствора Merch Titrisol, разбавляли водой до 10 л, регулировали величину pH и обрабатывали 1 е (1 г) в течение 24 ч. при перемешивании. После фильтрации через микропористый диск(пористость G-4) твердые вещества разлагали с помощью микроволнового гидролиза, остаток разбавляли до заданного объема водой (10 мл) и определяли концентрации металлов с помощью метода AAC (AAS). Результаты улавливания приведены в табл. 18. Таблица 18 Улавливание выбранных металлов с помощью 1 е после разбавления 1:10000 Пример 25. Улавливание Sc3+ из силикатной почвы. Силикатная почва (1000 г) была с добавкой S2O3 (767 мг). Образец (200 мг) взвешивали в таре из тефлона (Teflon), после чего добавляли концентрированные растворы HCl (9 мл) и HNO3 (3 мл). Смесь нагревали под действием микроволн в течение 50 мин с последующим добавлением HF (3 мл) и нагрев микроволнами продолжали до полного растворения твердых веществ. Полученный раствор обрабатывали 4% раствором Н 3 ВО 3 (10 мл) при нагревании и отбирали образец А (5 мл). Остальной раствор (20 мл) обрабатывали с помощью 1 а (100 мг) при комнатной температуре в течение 24 ч. После фильтрации через шприцевой фильтр 0,2 мкм определяли концентрацию Sc3+ до и после обработки с помощью метода ААС (AAS) и получали улавливание Sc3+ 87%. Пример 26. Улавливание ионов Cu2+ из раствора с помощью приготовленных бисфосфонатов. Готовили раствор, содержащий 1,00 м.д. катионов Cu2+ при pH 3 и 50 мл такого раствора обрабатывали требуемым твердым бисфосфонатом (50 мг), используя методику, описанную в общей методике. Улавливание в % определяли для следующих соединений (Cu2+, в скобках - улавливание в %): 3 а (16%),3b (88%), 3 с (93%), 4 (95%), 5 а (20%), 5b (18%), 5 с (85%), 6b (48%), 6 с (100%), 6d (100%), 7 а (88%), 7b Пример 27. Рециклинг и регенерация твердого бисфосфонатного материала. Соединение 1 а (700 мг) взвешивали на микропористом диске (пористость G-4) и через порошок в вакууме медленно подавали водный раствор CuCl22H2O (20 мл), содержащий приблизительно 47700 м.д. меди. Во время этого процесса фильтрации цвет 1 а изменялся от белого до голубого, указывая на то, что медь присоединяется к твердому порошкообразному бисфосфонату. После сушки микропористого диска водный раствор HCl (25 мл, 2 М) медленно подавали через микропористый диск. Во время этого процесса регенерации твердый бисфосфонатный материал на микропористом диске возвращал свой цвет от голубого к белому, а отфильтрованный раствор был светло голубым. Эту процедуру, используя исходный порошкообразный 1 а на микропористом диске и свежий раствор CuCl22H2O (20 мл), повторяли 20 раз. Концентрация меди, измеренная с помощью AAC (AAS), отфильтрованного раствора HCl, составляла 2294, 859 и 713 м.д. после 1-, 10- и 20-го циклов регенерации соответственно. Количество 1 а после последней стадии регенерации составляло 630 мг (90% от исходного количества). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ улавливания металлов из раствора, согласно которому бисфосфонат формулы IR1, R2, R3, R4, R5 и R6, каждый независимо, представляют собой Н, C1-C6-алкил, C3-C6-алкенил,C3-C6-алкинил или C3-C6-циклоалкенил; Е и F независимо представляют собой связь, О, S, NR7, C=O, NR7C=O или CONR7;W представляет собой связь, О, S, NR7, замещенную или незамещенную этиленовую группу, этиниленовую группу, C3-C6-циклоалкил или предпочтительно фенил, нафтил, пиридил, тиенил, фуранил,пирролил, бензофуранил, индолил, хинолинил, изохинолинил или неароматическое гетероциклическое кольцо, состоящее из 4-6 атомов, такое как пиперидинил, морфолинил, пиперазинил, дигидрофуранил,пирролидинил, азедидинил или оксазетидинил;X представляет собой Н, NR7R8, N+R7R7R8, OH, CO2H или SH, где R7 и R8 независимо представляют собой Н, C1-C6-алкил, C3-C6-алкенил, C3-C6-алкинил или C3-C6-циклоалкенил или R7 и R8 вместе образуют 4-8-членное кольцо, необязательно содержащее двойные или тройные связи;Y представляет собой Н, OH, NH2, SH, CH2OH, CH2NH2, CH2CO2H или O-CO-A-G-B, где А и В такие, как определены выше, a G представляет собой связь, замещенную этиленовую или этиниленовую группу;Z представляет собой Н+, Li+, Na+, K+, NH4+ или моно-, ди-, три- или тетраалкиламмониевую группу,при этом заместители выбирают таким образом, что соединение I является твердым и нерастворимым либо труднорастворимым в жидкости, из которой улавливают металл, причем соединение формулыI, является нерастворимым, если его растворимость в этой жидкости меньше 0,1 г/100 мл, и труднорастворимым, если его растворимость больше 0,1 г/100 мл, но меньше 1 г/100 мл; смешивают с раствором, в результате чего положительно заряженные катионы металлов, возможно присутствующие в растворе, реагируют с бисфосфонатом, посредством чего образуется твердый нерастворимый комплекс, и комплекс отделяют от раствора. 2. Способ по п.1, в котором количество атомов углерода в группе -[B-F-W-Е]-А- составляет от 5 до 21 атомов в виде цепи, разветвленной цепи или циклической структуры, либо в виде комбинации этих структурных единиц. 3. Способ по п.2, в котором группа -[B-F-W-E]-A- представляет собой алкильную или алкенильную группу, либо арилалкильную или арилалкенильную группу, либо алкильную или алкенилкарбоксильную группу. 4. Способ по п.3, в котором группа -[B-F-W-E]-A- представляет собой алкильную или алкенильную группу. 5. Способ по любому из пп.1-4, в котором X представляет собой NR7R8, N+R7R7R8, Н, OH илиCOOH. 6. Способ по п.5, в котором X представляет собой NH2. 7. Способ по любому из пп.1-6, в котором Y представляет собой OH, NH2 или Н. 8. Способ по п.7, в котором X представляет собой OH. 9. Способ по любому из пп.1-8, в котором бисфосфонат вместе с металлами, прореагировавшими с ним, отделяют от раствора с помощью фильтрации. 10. Способ по любому из пп.1-9, в котором металл представляет собой Са, Mg, Pb, Hg, Cd, V, Cr, Ni,As, Zn, Al, Ba, Fe, Sn, Sr, Bi, Mn, Mo, Ga, Nb, Та, Ag, Cu, Pt, Au, Ru, Rh, Ir, Nd, Sc, La, Y, Eu, Zr или U. 11. Способ по любому из пп.1-10, в котором в жидкость добавляют целлюлозу или активированный уголь. 12. Способ по любому из пп.1-11, в котором жидкость представляет собой сточные воды или воду для бытового потребления. 13. Применение нерастворимого или труднорастворимого бисфосфоната формулы I для улавливания металлов из раствора.
МПК / Метки
МПК: C07F 9/38, C02F 5/14, C22B 3/00, C02F 1/58
Метки: способ, металлов, улавливания
Код ссылки
<a href="https://eas.patents.su/24-24285-sposob-ulavlivaniya-metallov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ улавливания металлов</a>
Предыдущий патент: Способ производства пропилена
Следующий патент: Спиро[1,3]оксазины и спиро[1,4]оксазепины в качестве ингибиторов bace1 и(или) bace2
Случайный патент: Припой на основе серебра












