Способы создания и скрининга библиотек, кодируемых днк
Формула / Реферат
1. Способ маркировки кодируемых ДНК химических библиотек, включающий связывание первой функциональной группы бифункционального линкера с инициирующим олигонуклеотидом по 5'-концу упомянутого инициирующего олигонуклеотида, связывание второй функциональной группы упомянутого бифункционального линкера с компонентом упомянутой химической библиотеки и связывание первой идентификационной области на 3'-конце упомянутого инициирующего олигонуклеотида, при этом упомянутый бифункциональный линкер или инициирующий олигонуклеотид модифицируют для повышения растворимости члена химической библиотеки, кодируемой ДНК в органических условиях.
2. Способ по п.1, где упомянутый инициирующий олигонуклеотид, связанный с упомянутым бифункциональным линкером, образует шпилечную структуру.
3. Способ по п.1, в котором упомянутый инициирующий олигонуклеотид включает вторую идентификационную область.
4. Способ по п.3, в котором упомянутая вторая идентификационная область гибридизуется с упомянутой первой идентификационной областью упомянутого инициирующего олигонуклеотида.
5. Способ по п.1, в котором упомянутый бифункциональный линкер модифицируют для повышения растворимости члена упомянутой кодируемой ДНК химической библиотеки в органических условиях.
6. Способ по п.5, в котором модифицированный бифункциональный линкер содержит один или более из следующих элементов: алкильная цепь, полиэтиленгликольное звено, разветвленная молекула с положительными зарядами, гидрофобная кольцевая структура.
7. Способ по п.1, в котором упомянутый инициирующий олигонуклеотид модифицируют для повышения растворимости члена упомянутой кодируемой ДНК химической библиотеки в органических условиях.
8. Способ по п.7, в котором упомянутый инициирующий олигонуклеотид включает первую идентификационную область и вторую идентификационную область и в котором упомянутые первую идентификационную область или вторую идентификационную область модифицируют для повышения растворимости члена упомянутой кодируемой ДНК химической библиотеки в органических условиях.
9. Способ по п.7, в котором модифицированный инициирующий олигонуклеотид содержит один или более нуклеотидов, имеющих гидрофобную группировку или вставку, имеющую гидрофобную группировку.
10. Способ по п.9, в котором упомянутый модифицированный инициирующий олигонуклеотид включает упомянутый нуклеотид, имеющий гидрофобную группировку, и упомянутая гидрофобная группировка представляет собой алифатическую цепь в положении С5.
11. Способ по п.9, в котором упомянутый модифицированный инициирующий олигонуклеотид включает упомянутую вставку, имеющую гидрофобную группировку, и упомянутая гидрофобная группировка представляет собой азобензол.
12. Способ по п.1, в котором упомянутый член указанной кодируемой ДНК химической библиотеки имеет коэффициент распределения октанол:вода от 1,0 до 2,5.
13. Способ маркировки кодируемых ДНК химических библиотек, включающий связывание первой функциональной группы бифункционального линкера с инициирующим олигонуклеотидом по 5'-концу упомянутого инициирующего олигонуклеотида, где упомянутый инициирующий олигонуклеотид, связанный с упомянутым бифункциональным линкером, образует шпилечную структуру, связывание второй функциональной группы упомянутого бифункционального линкера с компонентом упомянутой химической библиотеки и связывание первой идентификационной области на 3'-конце упомянутого инициирующего олигонуклеотида.
14. Способ по п.13, в котором упомянутый инициирующий олигонуклеотид включает вторую идентификационную область.
15. Способ по п.14, в котором упомянутая вторая идентификационная область гибридизуется с упомянутой первой идентификационной областью упомянутого инициирующего олигонуклеотида.
16. Способ по п.15, в котором упомянутая вторая идентификационная область включает флюоресцентную метку или биотиновую метку.
17. Способ по п.16, в котором упомянутую вторую идентификационную область не амплифицируют перед анализом после стадии отбора.
18. Способ по п.15, в котором упомянутые бифункциональный линкер, инициирующий олигонуклеотид, первую идентификационную область или вторую идентификационную область модифицируют для повышения растворимости члена упомянутой кодируемой ДНК химической библиотеки в органических условиях.
19. Способ создания кодируемых ДНК библиотек, включающий:
(a) связывание первой функциональной группы бифункционального линкера с инициирующим олигонуклеотидом на 5'-конце упомянутого инициирующего олигонуклеотида;
(b) создание первого узла разнообразия, где упомянутое создание включает связывание второй функциональной группы упомянутого бифункционального линкера с остовом;
(c) кодирование первого узла разнообразия в отдельных сосудах, где упомянутое кодирование включает связывание первой идентификационной области на 3'-конце упомянутого инициирующего олигонуклеотида;
(d) объединение упомянутого первого узла разнообразия в пул;
(e) распределение упомянутого объединенного в пул первого узла разнообразия во второй набор отдельных сосудов, где упомянутый первый узел разнообразия вступает в реакцию с образованием второго узла разнообразия.
20. Способ по п.19, в котором второй узел разнообразия не является кодированным и его не объединяют в пул.
Текст
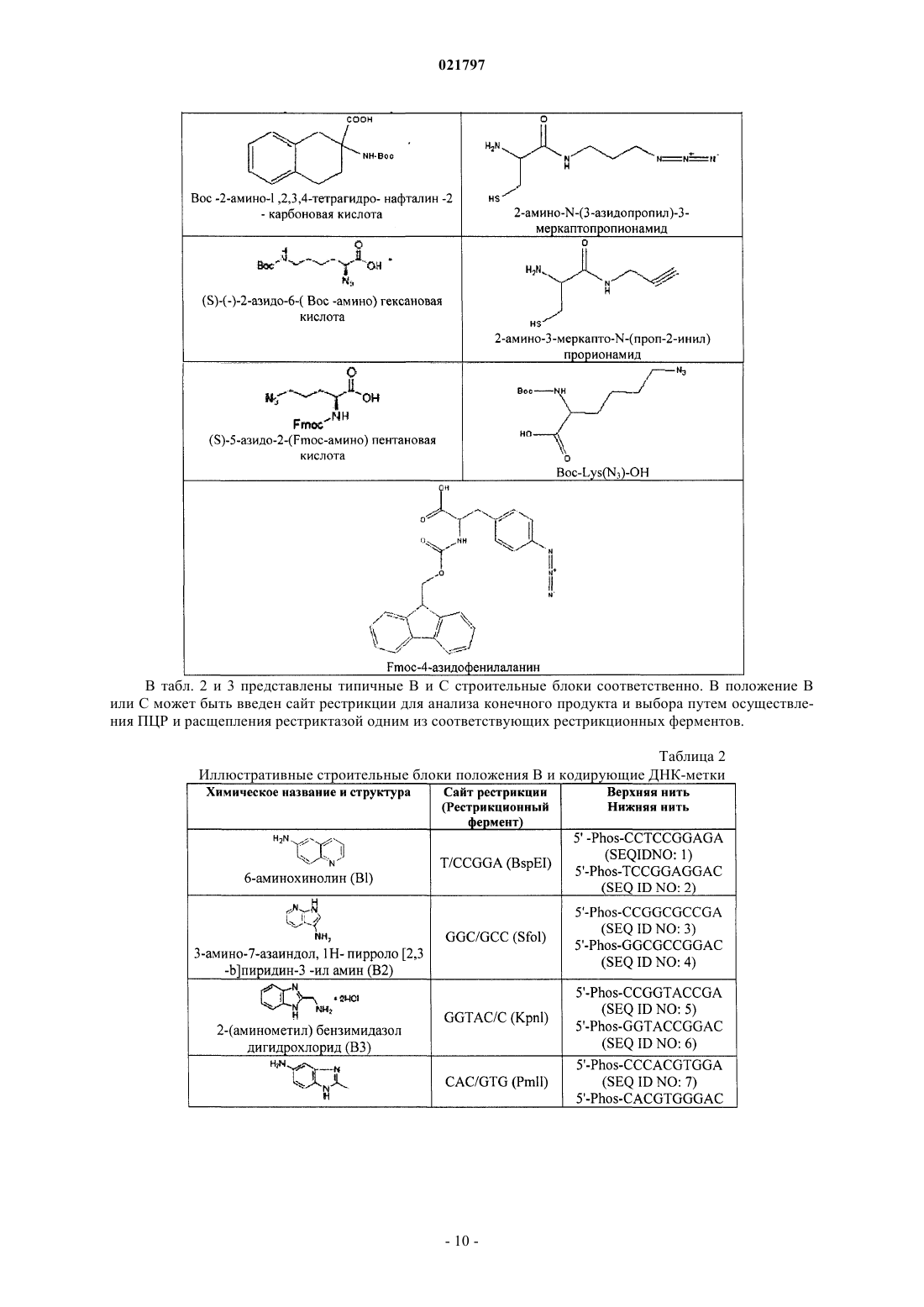
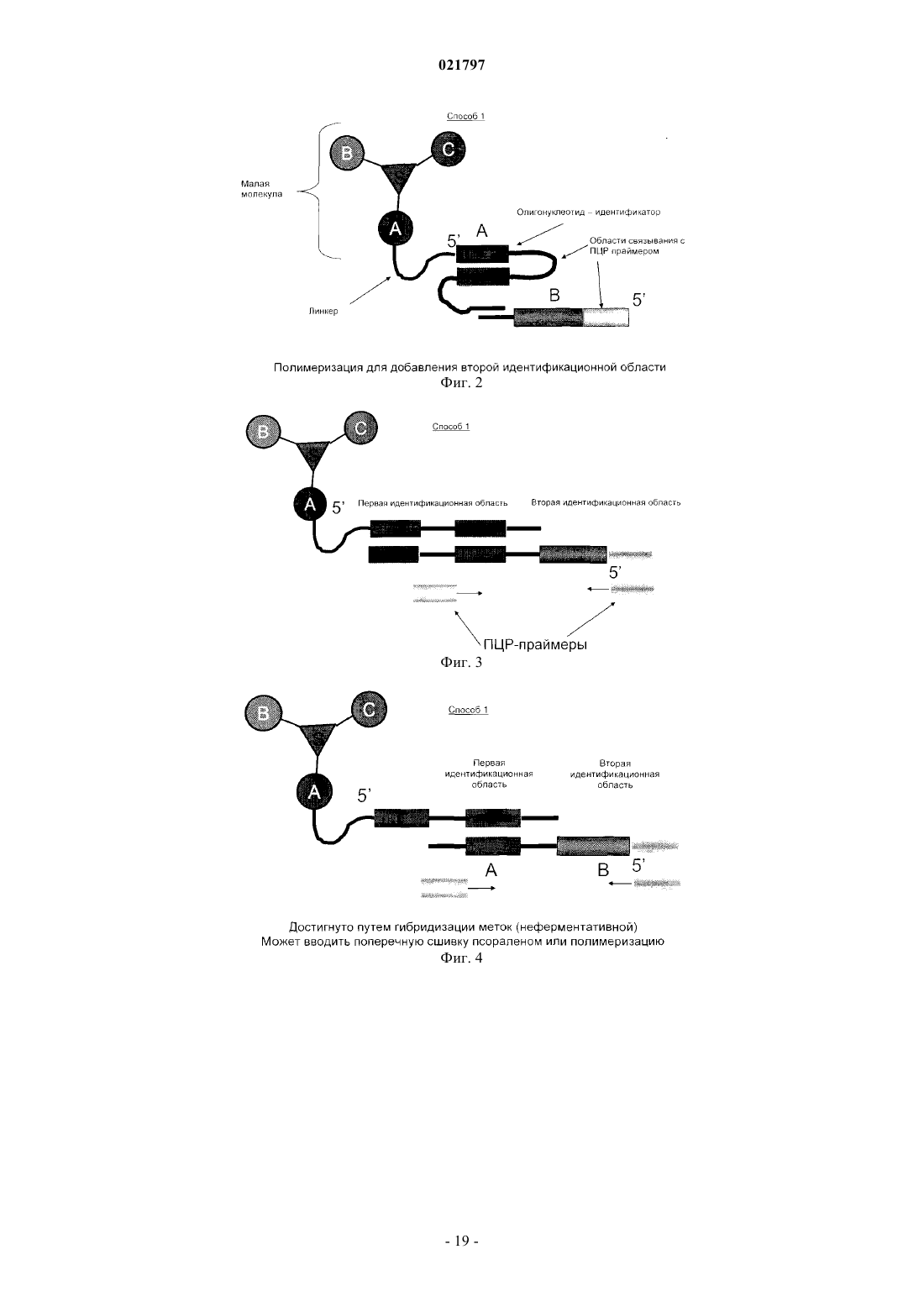
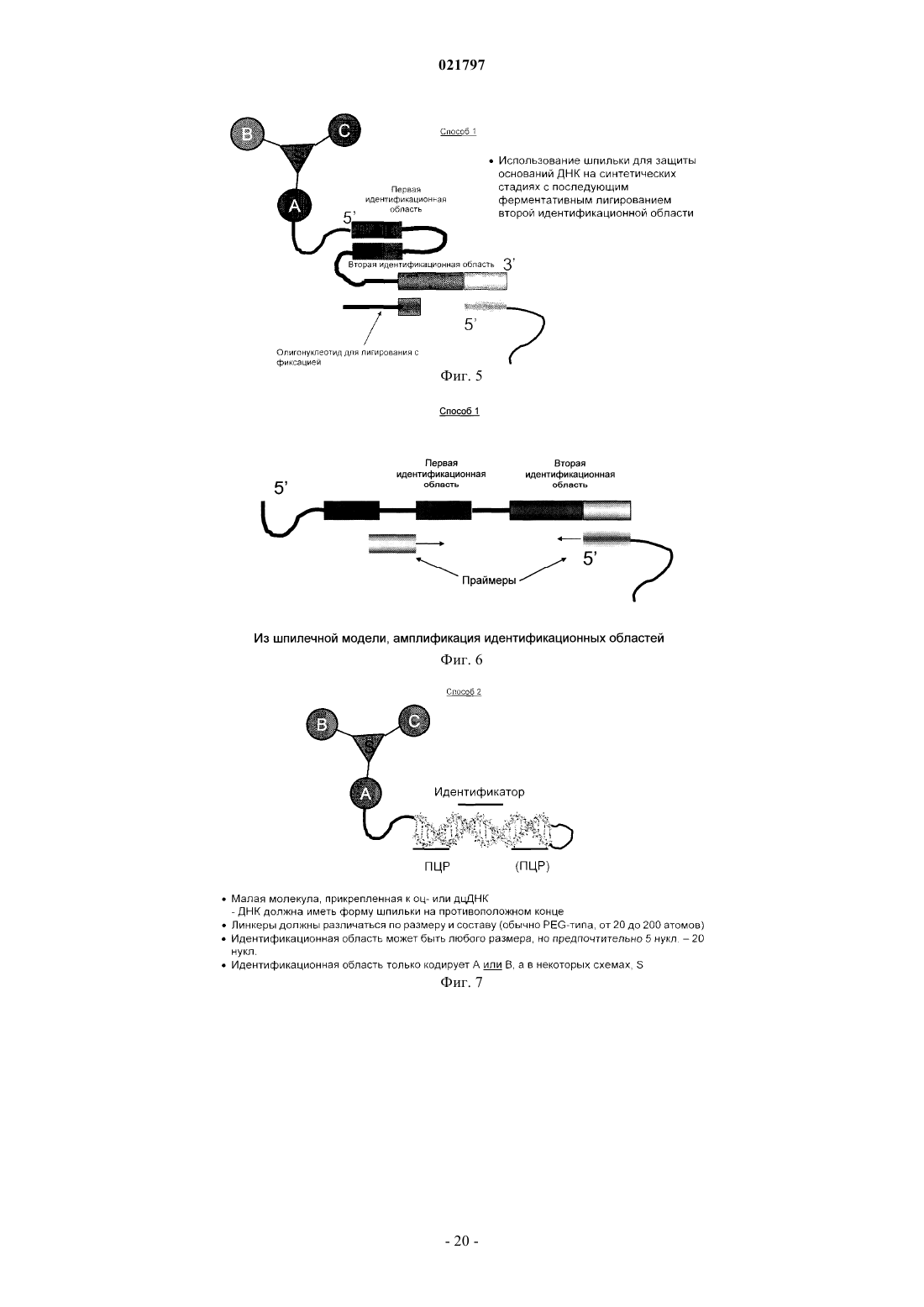
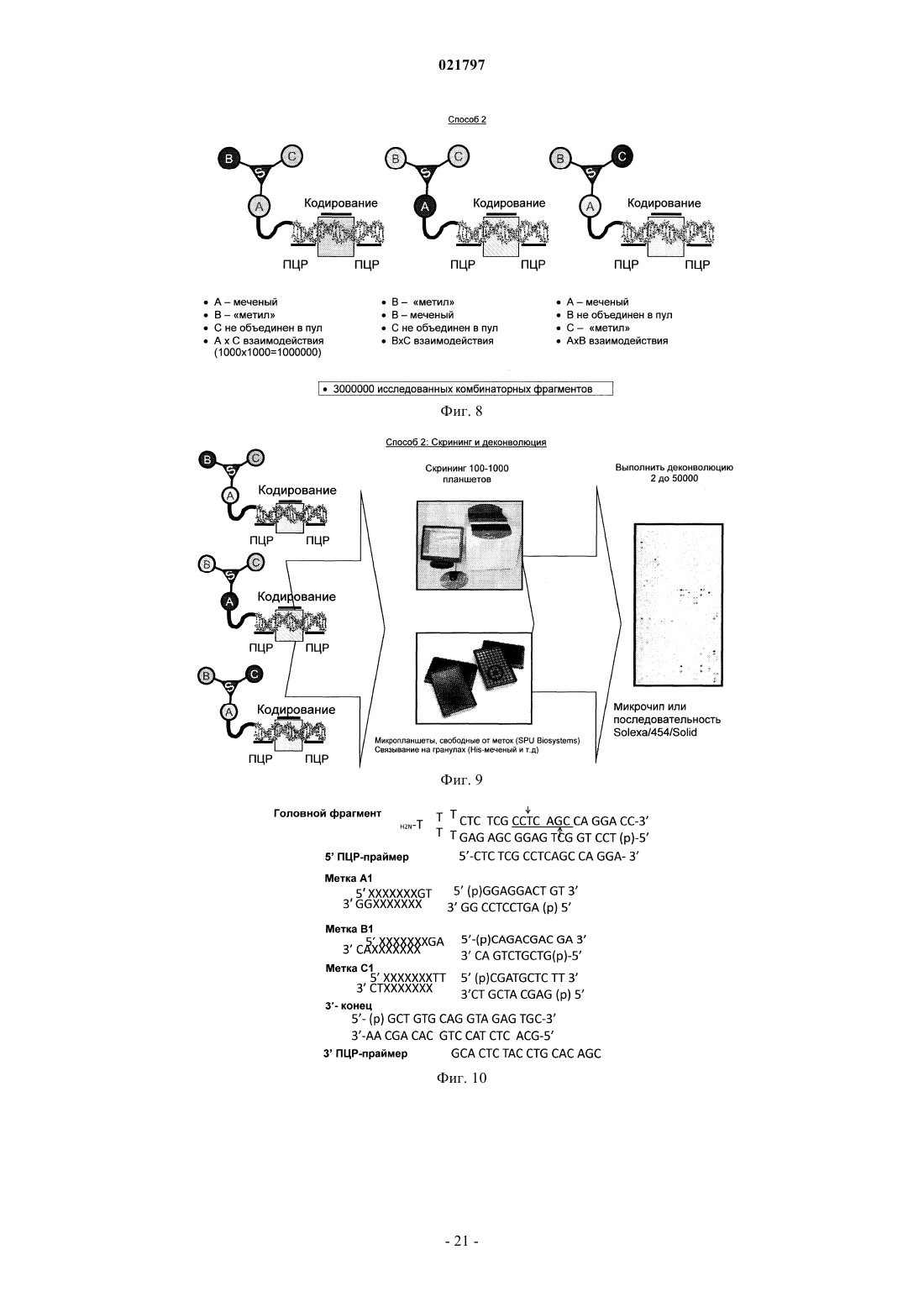
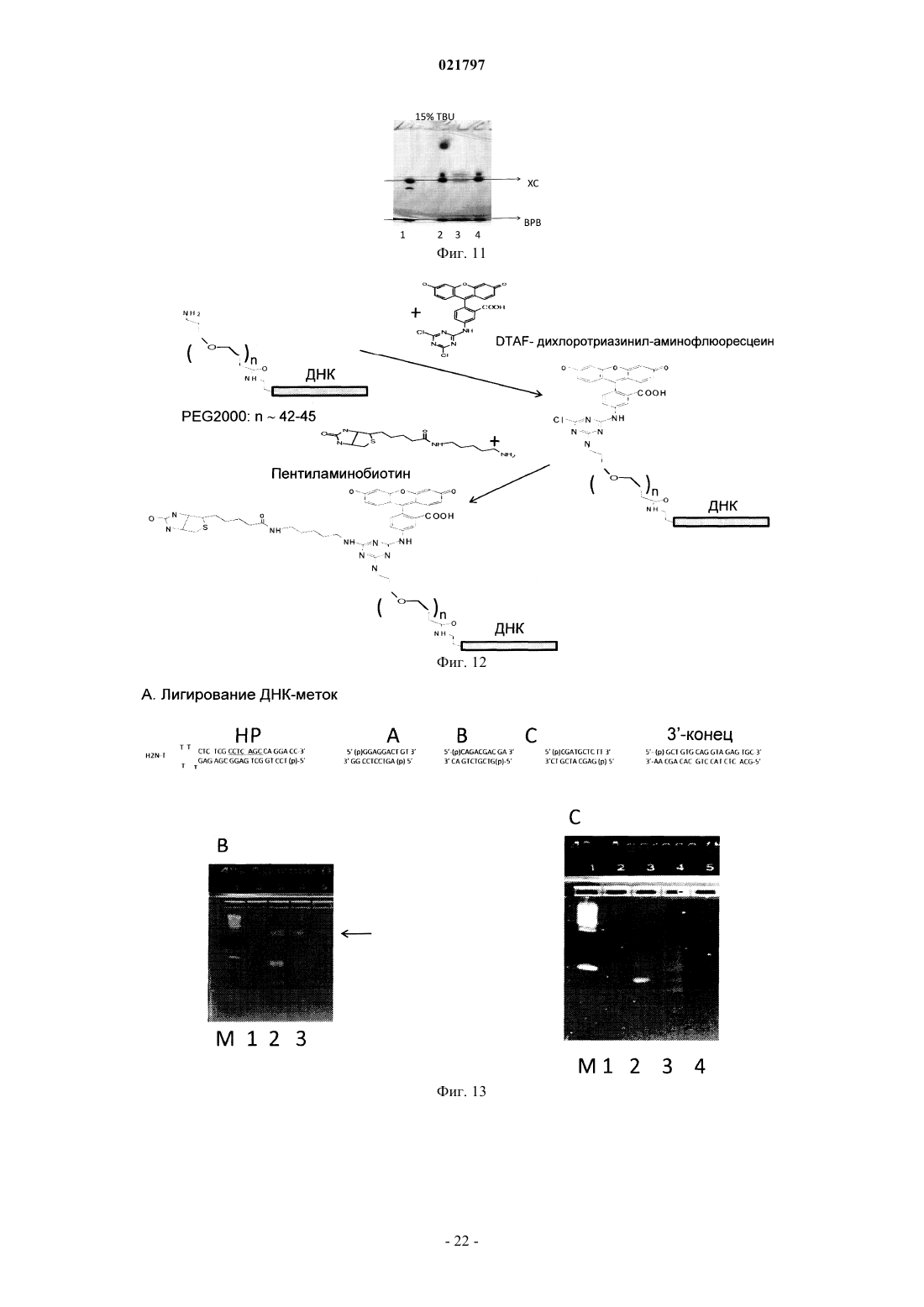
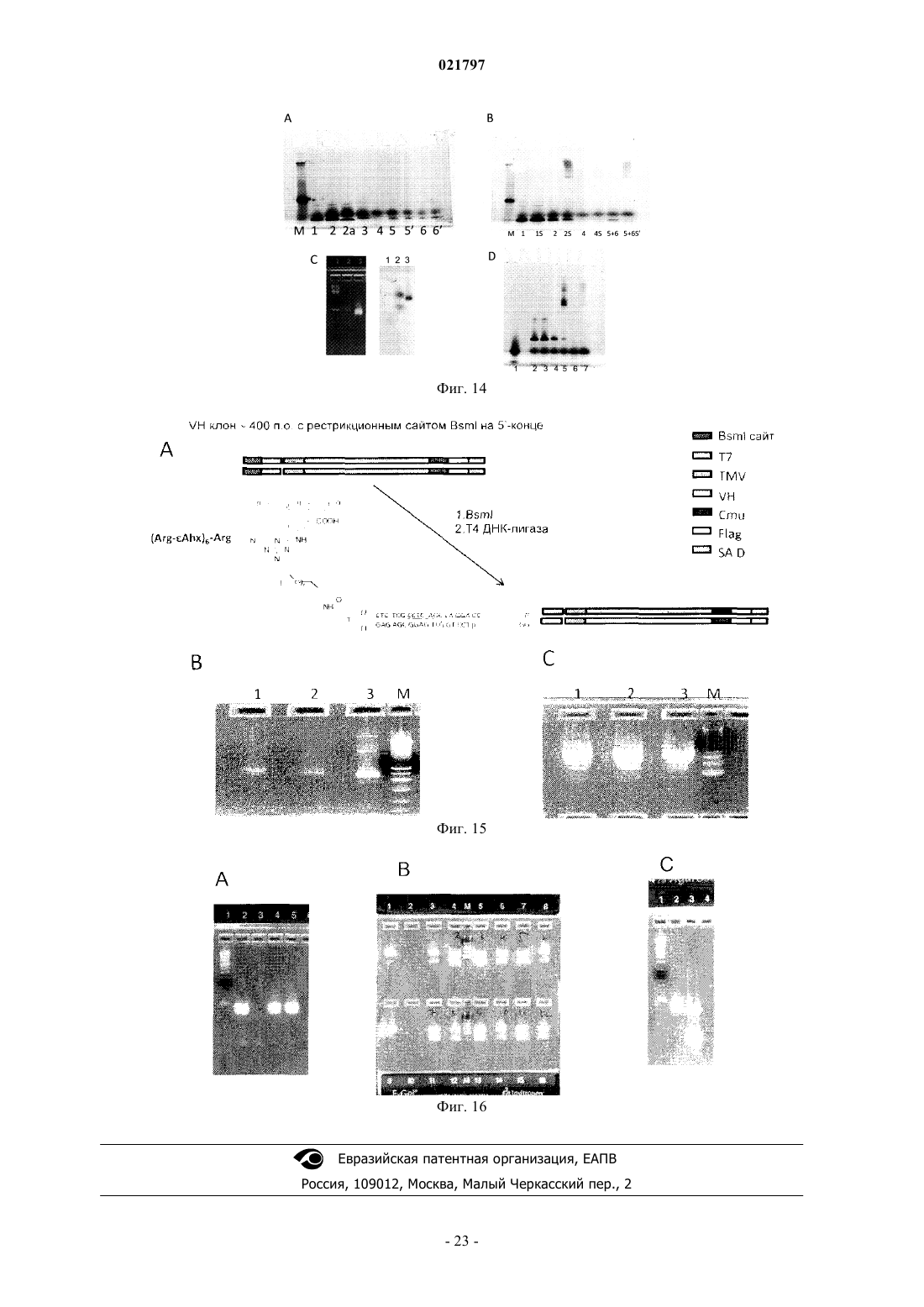
Настоящее изобретение включает ряд способов для идентификации одного или более соединений,которые связываются с биологической мишенью. Способы включают синтез библиотеки соединений, где соединения содержат функциональную группировку, имеющую одно или более положений разнообразия. Функциональная группировка соединений функционально связана с инициирующим олигонуклеотидом, который идентифицирует структуру функциональной группировки. Сведения о предшествующем уровне техники Растущие затраты на разработку лекарственных средств заставляют постоянно искать новые методы исследования все большего химического пространства, насколько возможно недорогого, в поисках молекул большей эффективности и практически нетоксичных. Подходы комбинаторной химии в 1980-е годы первоначально были объявлены методами, превосходящими парадигму разработки лекарственных средств, но большей частью они потерпели неудачу из-за недостаточных размеров библиотек и неэффективных методов деконволюции. В последнее время использование комбинаторных библиотек малых молекул с отображенной ДНК вызвало новый сдвиг парадигмы в сторону скрининга терапевтических соединений-прототипов. Морган и др. (публикация заявки на патент США 2007/0224607, включенной в настоящее описание посредством отсылки) идентифицируют основные проблемы использования комбинаторных методик с отображенной ДНК при разработке лекарственных средств: (1) синтез библиотек достаточной сложности и (2) идентификация молекул, активных в используемых схемах отбора. Кроме того, Морган и др. заявляют, что чем выше степень сложности библиотеки, т.е. количество различных структур, присутствующих в библиотеке, тем больше вероятность, что библиотека содержит молекулы с представляющей интерес активностью. Таким образом, химия, применяемая при синтезе библиотеки, должна быть способна продуцировать очень большие количества соединений за соответствующий период времени. Этот подход в основном результативен при идентификации молекул разных хемотипов и с высокой аффинностью. Однако появилось много проблем в отношении создания библиотек огромной сложности и оценки производительности секвенирования в описанном масштабе. Например, очистка библиотеки после многократных химических превращений (например, обычно 3 или 4 стадии) и биологических превращений(например, ферментативное сшивание ДНК меток) трудоемка и приводит к значительному объему "шума" в библиотеке либо из-за неполного синтеза молекул, либо из-за неправильной маркировки на стадии лигирования. Кроме того, объем секвенирования, необходимый для запроса отобранных популяций, является впечатляющим, что обычно требует методов секвенирования "следующего поколения". Последнее вызвано тем фактом, что необходимы сложные генетические схемы маркировки, внедренные в ДНКчасть библиотеки, вместе с алгоритмами биоинформатики для анализа производительности секвенирования "следующего поколения", для отсеивания шума и идентификации результативных попаданий в библиотеке. В результате даже с такими методологиями секвенирование все еще не достаточно продвинуто,чтобы полностью охватить разнообразие последовательностей (представляющих как реальные попадания, так и "шум") из данной схемы отбора. ДНК-дисплей комбинаторных библиотек малых молекул основывается на многоступенчатом"сплит-пул" синтезе библиотеки в сочетании с ферментативным добавлением меток ДНК, которые кодируют и синтетическую стадию, и используемый строительный блок. Обычно выполняются и кодируются несколько (например, 3 или 4) синтетических стадий; они включают положения разнообразия (обозначенные в настоящем описании как А, В и С (фиг. 1, например, образованные соединением строительных блоков, например, с аминовыми или карбоксилатными функциональными группами на химическом остове, который отображает прикрепленные строительные блоки в заданных ориентациях. Одним примером такого остова (S), который часто используется в комбинаторных библиотеках, является триазиновый компонент, который может быть ортогонально дериватизирован в трех положениях относительно своей кольцевой структуры. Процесс формирования библиотеки может быть трудоемким, продукты часто очищаются неэффективно и в результате появляются неизвестные реакции, которые создают нежелательные и(или) неизвестные молекулы, присоединенные к ДНК. Кроме того, неполная очистка библиотеки может вызвать взаимное загрязнение меток на стадиях сшивания, что приводит к неправильной маркировке. Конечным результатом отбора и секвенирования попаданий из библиотеки является тот факт, что необходимо выполнять массово-параллельное секвенирование, вызванное собственным "шумом" обеих ДНК, присоединенных к молекулам, не предусмотренных (например, непрореагировавшие или побочные продукты) или неправильно маркированных. Таким образом, эффективность секвенирования не сохраняется. В некоторых случаях инициирующий олигонуклеотид, из которого построена библиотека малых молекул, содержит праймерсвязывающую область для полимеразной амплификации (например, ПЦР) в форме ковалентно замкнутого, двунитевого олигонуклеотида. Эта конструкция очень проблематична для выполнения полимеразных реакций из-за трудности плавления двойной спирали и возможности инициирующего олигонуклеотида связываться и инициировать полимеризацию, которая приводит к неэффективной реакции, снижающей производительность в 10-1000 раз или больше. Существует потребность в более последовательном подходе к скринингу и идентификации малых молекул, обладающих большей эффективностью и практически нетоксичных. Сущность изобретения В настоящем изобретении представлен способ создания и скрининга упрощенных библиотек, кодируемых ДНК, благодаря меньшему количеству синтетических стадий (например, отсутствие ферментативного сшивания или ковалентно замкнутых инициирующих двунитевых олигонуклеотидов) и, следовательно, с существенно меньшим "шумом" во время анализа кодированных олигомеров (именуемых в данном описании "идентификационными областями"). Таким образом, секвенирование становится намного эффективнее, или альтернативно, становится возможным анализ на микрочипах с учетом собственных смещений, которые могут спутать интерпретацию данных, которые могут вводиться амплификацией кодирующей области. Кроме того, были идентифицированы способы создания большего разнообразия химических реакций, а не просто ограниченных водными условиями, чтобы повысить гидрофобность и растворимость библиотеки, кодируемой ДНК, в органических растворителях для последующих стадий синтеза библиотеки. Таким образом, химические реакции можно выполнять с потенциально более высокой производительностью, большим разнообразием строительных блоков, а также с повышенной надежностью химических реакций. Соответственно, в настоящем изобретении представлен способ маркировки химических библиотек,кодируемых ДНК, путем связывания первой функциональной группы бифункционального линкера с инициирующим олигонуклеотидом на 5'-конце инициирующего олигонуклеотид, в котором инициирующий олигонуклеотид образует шпилечную структуру, и путем связывания второй функциональной группы бифункционального линкера с компонентом химической библиотеки. Инициирующий олигонуклеотид может включать первую идентифицирующую область и вторую идентифицирующую область таким образом, что вторая идентифицирующая область гибридизируется с первой идентифицирующей областью олигонуклеотида. Вторая идентифицирующая область может включать флуоресцентную метку(например, флуорофор или GFP-зеленый флуоресцентный белок) или биотиновую метку. Кроме того,вторая идентифицирующая область не амплифицируется перед анализом после стадии отбора. В другом примере осуществления изобретения представлен способ создания библиотек, кодируемых ДНК путем (а) создания первого узла разнообразия, (b) кодирования первого узла разнообразия в отдельных сосудах, (с) объединения в пул первого узла разнообразия и (d) распределения объединенного в пул первого узла разнообразия во второй набор отдельных сосудов, в котором первый узел разнообразия вступает в реакцию для формирования второго узла разнообразия. В некоторых примерах осуществления изобретения второй узел разнообразия не кодируется и не объединяется в пул. В другом примере осуществления изобретения представлен способ создания библиотеки с использованием полу- или неводных (например, органических) химических реакций с более высокой производительностью, более высоким разнообразием строительных блоков, а также увеличенным количеством химических реакций, которые можно использовать для создания большего количества ДНКмаркированных комбинаторных библиотек, чем было возможно до сих пор. В общем, способы настоящего изобретения предусматривают набор библиотек, содержащих, например, одно или два положения разнообразия на химическом остове, который можно эффективно выработать с высокой производительностью, подвергать скринингу для идентификации предпочтительных отдельных строительных блоков или комбинаций строительных блоков, принадлежащих, например, одному или двум положениям разнообразия, а также итерационно модифицировать, например, во втором,третьем и(или) четвертом положении разнообразия для создания молекул с улучшенными свойствами. Кроме того, описанные способы предусматривают экспансивный и экстенсивный анализ отобранных соединений с требуемым биологическим свойством, которое, в свою очередь, дает возможность идентифицировать родственные соединения с семейными структурными отношениями (например, связь "структура-активность"). Термин "остов" значит химический компонент, который отображает узел(ы) разнообразия в конкретной специальной геометрии. Узел(ы) разнообразия обычно присоединяется(ются) к остову во время синтеза библиотеки, но в некоторых случаях один узел разнообразия может присоединяться к остову перед синтезом библиотеки (например, добавление идентификационных областей). В некоторых примерах осуществления изобретения остов дериватизируется таким образом, что он может быть ортогонально лишаться защитных свойств во время синтеза библиотеки и впоследствии может вступать в реакцию с различными узлами разнообразия (например, при помощи идентификационной маркировки на каждой стадии). Под термином "идентифицирующая область" понимают участок ДНК-метки библиотеки, который кодирует добавление строительного блока к библиотеке. Термин "инициирующий олигонуклеотид" означает исходный олигонуклеотид для синтеза библиотеки, который также содержит ковалентно присоединенный линкер и функциональный компонент для добавления узла разнообразия или остова. Олигонуклеотид может быть однонитевым или двунитевым. Термин "функциональный компонент" означает химический компонент, включающий один или несколько строительных блоков, которые можно выбрать из любой малой молекулы или создать, и построенный на основании требуемых характеристик, например растворимость, наличие доноров и акцепторов водородных связей, ротационных степеней свободы связей, положительного заряда, отрицательного за-2 021797 ряда, и т.п. Функциональный компонент должен быть совместимым с химической модификацией таким образом, чтобы он вступал в реакцию с головным фрагментом. В некоторых примерах осуществления изобретения функциональный компонент может далее вступать в реакцию как бифункциональный или трехфункциональный (или выше) элемент. Функциональные компоненты могут также включать строительные блоки, которые используются в любом из узлов или положений разнообразия. Примеры строительных блоков и кодирующих ДНК-меток можно найти в табл. 1 и 2. См., например, публикацию заявки на патент США 2007/0224607, включенную в настоящее описание посредством отсылки. Термин "строительный блок" означает химическую структурную единицу, которая связывается с другими химическими структурными элементами или может быть связана с другими такими единицами. Если функциональный компонент является полимерным или олигомерным, строительные блоки представляют собой мономерные звенья полимера или олигомера. Строительные блоки могут также включать структуру остова (например, строительный блок остова), к которому присоединена или может быть присоединена одна или несколько дополнительных структур (например, периферические строительные блоки). Строительные блоки могут быть любыми химическими соединениями, являющимися комплементарными (т.е. строительные блоки должны обладать способностью вступать в реакцию совместно для образования структуры, включающей два или несколько строительных блоков). Как правило, у всех используемых строительных блоков будет как минимум две реактивные группы, хотя некоторые из используемых строительных блоков будут иметь только одну реактивную группу каждый. Реактивные группы на двух различных строительных блоках должны быть комплементарными, т.е. обладать способностью к совместной реакции для формирования ковалентной связи. Термин "линкер" означает молекулу, которая связывает нуклеиново-кислотный участок библиотеки с функциональными отображенными образцами. Такие линкеры известны в данной области; и линкеры,которые можно использовать при синтезе библиотеки, включают, помимо прочего, 5'-Oдиметокситритил-1',2'-дидезоксирибоза-3'-[(2-цианоэтил)-(N,N-диизопропил)]фосфорамидит; 9-Oдиметокситритил-триэтиленгликоль,1-[(2-цианоэтил)-(N,N-диизопропил)]фосфорамидит; 3-(4,4'диметокситритилокси)пропил-1-[(2-цианоэтил)-(N,N-диизопропил)]фосфорамидит и 18-Oдиметокситритилгексаэтиленгликоль, 1-[(2-цианоэтил)-(N,N-диизопропил)]фосфорамидит. Такие линкеры можно добавлять один за другим в различных комбинациях для создания линкеров различной требуемой длины. "Разветвленный линкер" означает молекулу, которая связывает позицию нуклеиновой кислоты библиотеки с двумя или более идентичными функциональными образцами библиотеки. Разветвленные линкеры известны, их примеры могут включать симметричные или асимметричные удвоители (1) и (2) или симметричный утроитель (3). См., например, Newcome et al., Dendritic Molecules: Concepts, Synthesis, Perspectives, VCH Publishers (1996); Boussif et al., Proc. Natl. Acad. Sci. USA 92: 7297-7301(1995); и Jansen et al., Science 266: 1226(1994). В соответствии с использованием в настоящем описании термин "олигонуклеотид" относится к полимеру нуклеотидов. Олигонуклеотид может содержать ДНК или ее любую известную производную,которая может синтезироваться и использоваться для распознавания пары оснований. Олигонуклеотид не должен иметь смежных оснований, но может включать рассеянные фрагменты линкера. Олигонуклеотидный полимер может включать природные нуклеозиды (например, аденозин, тимидин, гуанозин, цитидин, уридин, деоксиаденозин, деокситимидин, дезоксигуанозин и дезоксицитидин), аналоги нуклеозида (например, 2-аминоаденозин, 2-тиотимидин, инозин, пирроло-пиримидин, 3-метил аденозин, С 5 пропинилцитидин, С 5-пропинилуридин, С 5-бромуридин, С 5-фторуридин, С 5-йодуридин, С 5 метилцитидин, 7-деазааденозин, 7-деазагуанозин, 8-оксоаденозин, 8-оксогуанозин, O(6)-метилгуанин и 2-тиоцитидин), химически модифицированные основания, биологически модифицированные основания(например, метилированные основания), интеркалированные основания, модифицированные сахара (например, 2'-фторорибоза, рибоза, 2'-дезоксирибоза, арабиноза и гексоза) и(или) модифицированные фосфатные группы (например, фосфортиоаты и 5'-N-фосфорамидитные связи). Термин "функционально связанный" означает, что две химические структуры соединены таким образом, чтобы они оставались связанными после различных манипуляций, которым они, как предполагается, должны подвергаться. Как правило, функциональный компонент и кодирующий олигонуклеотид связаны ковалентно посредством соответствующей связывающей группы. Например, связывающая группа может представлять собой бифункциональный компонент с участком прикрепления для кодирующего олигонуклеотида и участком прикрепления для функционального компонента. Термин "малая молекула" означает молекулу с молекулярным весом ниже приблизительно 1000 дальтон (Да). Малые молекулы могут быть органическими или неорганическими и могут быть выделены,например, из библиотеки соединений или из естественных источников или могут быть получены путем дериватизации известных соединений. Другие особенности и преимущества изобретения будут очевидны из следующего детального описания, рисунков, примеров и патентной формулы. Перечень фигур Фиг. 1 - схема, иллюстрирующая положения разнообразия А, В и С. Фиг. 2 - схема члена химической библиотеки, кодируемой ДНК способа 1, демонстрирующая частично инициирующий олигонуклеотид, включающий шпилечную структуру, комплементарную в идентификационной области, которая вступила в реакцию с узлами разнообразия А и В. Добавляется идентификационная область для В. На этой фигуре узел разнообразия "С" является потенциальным положением для дополнительного положения разнообразия, добавляемого после добавления идентификационной области В. Фиг. 3 - схема члена химической библиотеки, кодируемой ДНК способа 1, демонстрирующая частично инициирующий олигонуклеотид, включающий последовательность в петлевой области шпилечной структуры, которая может служить областью связывания праймера для амплификации. Фиг. 4 - схема члена химической библиотеки, кодируемой ДНК способа 1, демонстрирующая частично инициирующий олигонуклеотид, включающий некомплементарную последовательность на 3'конце молекулы, которая может служить для связывания второй идентификационной области либо для полимеризации, либо для ферментативного сшивания. Фиг. 5 - схема члена химической библиотеки, кодируемой ДНК способа 1, демонстрирующая частично инициирующий олигонуклеотид, в котором петлевая область инициирующего олигонуклеотида, и,как минимум, идентификационная область на 3'-стороне петлевой области могут служить для гибридизации с комплементарным олигонуклеотидом, который, кроме того, содержит вторую идентификационную область. Фиг. 6 - схема ПЦР-амплификации шпилечной модели, представленной на фиг. 5. Фиг. 7 - схема члена химической библиотеки, кодируемой ДНК способа 2, демонстрирующая шпилечный олигонуклеотид, ковалентно замкнутый (например, с помощью шпильки или химически) на дальнем конце линкера. Фиг. 8 - схема члена химической библиотеки, кодируемой ДНК способа 2, демонстрирующая включение дополнительных узлов разнообразия. Фиг. 9 - схема члена химической библиотеки, кодируемой ДНК способа 2, демонстрирующая стадии скрининга библиотек и способов выполнения деконволюции идентификационных областей. Фиг. 10 - схема, демонстрирующая олигонуклеотиды, используемые при синтезе библиотеки. Головной фрагмент (HP) был синтезирован с помощью IDT DNA и очищен с помощью ВЭЖХ. Стрелки указывают на сайт для рестрикции BbvCI (подчеркнут) или Nb. BbvCI или Nt.BbvCI расщепления с внесением однонитевого разрыва. Последовательности меток Al, Bl и CI ДНК (верхняя и нижняя нити), 5'- и 3'-ПЦР праймеры и 3'-конца HP также показаны. Фиг. 11 - электрофоретический гель (ТВЕ-мочевина (15%) электрофорез в геле; УФ-подсветка на пластинке для ТСХ головного фрагмента на различных стадиях его синтеза. Головной фрагмент HP (IDTDNA) был ацилирован с помощью Fmoc-амино-PEG2000-NHS (JenKem Technology, США). Дорожка 1 представляет собой олигонуклеотид HP (IDT DNA) (42 nts). Дорожка 2 - это HP, ацилированный с помощью Fmoc-амино-PEG2000-NHS. После добавления Трис-HCl наблюдается некоторое снятие защитыFmoc. Дорожка 3 представляет собой неочищенную реакцию с пиперидином, демонстрирующую полное снятие защиты Fmoc. Дорожка 4 такая же, как и дорожка 3, после обессоливания на колонке NAP-5 и лиофилизации. ХС: ксилен цианол (мигрирует как ДНК длиной 60 нукл.); ВРВ: бромфеноловый синий(мигрирует как ДНК длиной 15 нукл.). Фиг. 12 - схема, демонстрирующая стадии синтеза модельной библиотеки. DTAF конъюгирован с амино-ПЭГ модифицированным головным фрагментом (НР-1) на первой стадии. После этой стадии часть HP-l-DTAF была дополнительно ацилирована пентиламино-биотином. Фиг. 13 А - схема лигирования ДНК-меток. На фиг. 13 В иллюстрируется 4% агарозный гель библиотеки HP-l-DTAF-биотина на различных стадиях лигирования ДНК-метки. М: маркер; дорожка 1: HPl-DTAF-биотин; дорожка 2: 1 + только метка А; дорожка 3:1 + метки А, В и С, а также 3'-концевой лигированный олигонуклеотид. Стрелка указывает на яркую зеленую флюоресценцию (DTAF). Значительного разделения на геле не наблюдается. На фиг. 13 С иллюстрируется ПЦР амплификация (24 цикла) реакций сшивания. М: маркер (самая нижняя полоса - 100); дорожка 1: ПЦР амплификация зеленой флуоресцентной полосы из дорожки 1, фиг. 14 В (HP-l-DTAF-биотин + Метка А); дорожка 2: ПЦР-амплификация зеленой флуоресцентной полосы из дорожки 2, фиг. 13 В (HP-l-DTAF-биотин + все 3 метки и 3'-концевой олигонуклеотид); дорожка 3: ПЦР-амплификация неочищенной реакции сшивания HP-l-DTAF-биотин + все 3 метки; дорожка 4: шаблон отсутствует. Фиг. 14 - набор электрофоретических гелей, демонстрирующих очистку модельного соединенияXChem и модельный выбор (путем взаимодействия связывания между биотиновым компонентом модельного соединения XChem и стрептавидином). Гели представляют собой 4-12% SDS NuPage гели с рабочим буфером MES. Гели сканировали на зеленую флюоресценцию с помощью 450-нм лазера. Фиг. 14 А - гель, демонстрирующий стадии синтеза и очистки. Пробы смешали с буфером для нанесения на гель и прокипятили. М: маркер; дорожка 1: НР-l + 25 DTAF; дорожки 2 и 2 а: НР-l-DTAF + биотин (две независимых реакции); дорожки 3-6 (стадии очистки/отбора модели с помощью Dynal гранул стрептави-4 021797 дина): дорожка 3: непрерывный поток; дорожка 4: последняя промывка (промывание водой при 80 С в течение 10 мин); дорожки 5- и 5'-: элюция с помощью 25 ммоль ЭДТА при 90 С (1-й и 2-й); дорожки 6 и 6': элюция с помощью 25 ммоль ЭДТА и 5 ммоль NaOH при 90 С (1-й и 2-й). Фиг. 14 В - гель, демонстрирующий связывание HP-l-DTAF-биотина ("библиотека из 1") со стрептавидином. Пробы смешали с буфером для нанесения на гель и непосредственно перенесли на гель без кипячения. Пробы, как в геле на фиг. 14 А, инкубировали с избытком стрептавидина в 50 ммоль NaCl/10 ммоль Триса HCl, рН 7,0, в течение 10 мин. "S" обозначает добавление стрептавидина. Пробы 5 и 6 объединили в пул. Дорожка 1: HP-lDTAF; дорожка: HP-l-DTAF + стрептавидин; дорожка 2: HP-l-DTAF-биотин (обессолен); дорожка 2S:HP-l-DTAF-биотин + стрептавидин; дорожка 4: последняя промывка (промывание водой при 80 С в течение 10 мин); дорожка 4S: проба последней промывки + стрептавидин; дорожка 5+6: объединенные пробы 5, 5'-, 6 и 6' (элюция фракций из гранул стрептавидина, очищенный и отобранный HP-l-DTAFбиотин; дорожка 5+6S': очищенный и отобранный HP-l-DTAF-биотин + стрептавидин. Следует заметить,что нет никакого значимого различия в миграции между различными стадиями синтеза "библиотеки из 1". Фиг. 14 С - 4% агарозный гель головного фрагмента (Trilink) HP-T, вступивший в реакцию с DTAF. Дорожка 1: маркер; дорожка 2: DTAF; дорожка 3 HP-T-DTAF. Левая панель: УФ-визуализация геля (окрашивание бромидом этидия). Правая панель: тот же гель, сканированный на флюоресценцию при длине волны возбуждения 450 нм (зеленый, флюоресцеин). Фиг. 14D - 4-12% SDS NuPage гель с рабочим буфером MES, демонстрирующий связывание HP-T-DTAF- биотина со стрептавидином. Пробы смешали с буфером для нанесения на гель и непосредственно перенесли на гель без кипячения. Пробы, как в геле на фиг. 14 А, инкубировали с избытком стрептавидина в 50 ммоль NaCl/10 ммоль Триса HCl, рН 7,0, в течение 10 мин. Дорожка 1: DTAF; дорожка 2: HP-T-DTAF; дорожка 3: HP-T-DTAF + стрептавидин; дорожка 4: HP-T-DTAF-биотин (обессолен); дорожка 5: HP-T-DTAF-биотин + стрептавидин; дорожка 6: объединенные пробы 5, 5'-, 6 и 6' (фракции элюции из гранул стрептавидина, очищенный и отобранный HP-lDTAF-биотин; дорожка 7: очищенный и отобранный HP-l-DTAF- биотин + стрептавидин. Фиг. 15 А - схема синтеза конструкции для эксперимента внутриклеточной доставки Т 7 RNAP. КлонVH дцДНК был ПЦР амплифицированным для прикрепления BsmI сайта на 5'-конце вверх по потоку от промотора Т 7. После расщепления рестриктазой и очистки конструкция была сшита с HP-l-DTAF-R7(головной фрагмент, модифицированный с помощью DTAF и (-Arg-sAhx)6-Arg пептид). Фиг. 15 В - электрофоретический гель реакции сшивания. Дорожки 1 и 2 демонстрируют различные пробы НР-1, лигированные с VH; на дорожке 3 показан несшитый VH ПЦР продукт; М является маркером. Фиг. 15 С - электрофоретический гель, демонстрирующий оценку активности Т 7 промотора. Гель демонстрирует реакцию с Т 7 Megascript (Ambion, Inc) с использованием проб из дорожек 1-3, фиг. 15 В. Фиг. 16 - электрофорез агарозного геля стадий синтеза 1010 библиотеки Фиг. 16 А - 4% агарозный гель головного фрагмента (Trilink) HP-T, лигированного с меткой А. Дорожка 1: маркер; дорожка 2: НРТ; дорожка 3: метка А отожжнная; дорожка 4: НР-Т, лигированный с меткой А; дорожка 5: НР-Т, лигированный с меткой А и обессоленный на колонке Zeba. Фиг. 16 В - 2% агарозный гель сшивания НР-Т-А с 12 различными метками В. Дорожка М: маркер, дорожки 1 и 9: НР-Т-А; дорожки 3, 4, 5, 6, 7, 8, 11, 12,13, 14, 15 и 16: сшивание НР-Т-А с метками В 1 -В 12. Фиг. 16 С - 4% агарозный гель объединенной в пул библиотеки (библиотека В), лигированный с метками А и сшитыми В 1-В 12, после реакции с цианурхлоридом и аминами В 1-В 12. Дорожка 1: маркер; дорожка 2: НР-Т-А; дорожка 3: библиотека-В, объединенная в пул и обессоленная на колонках Zeba. Сведения, подтверждающие возможность осуществления В настоящем изобретении предложен целый ряд способов идентификации одного или нескольких соединений, которые связываются с биологической мишенью. Способы включают синтезирование библиотеки соединений, в которых соединения содержат функциональный компонент, имеющий одно или несколько положений разнообразия. Функциональный компонент соединений функционально соединен с инициирующим олигонуклеотидом, который идентифицирует структуру функционального компонента. Суммируя вышесказанное, в способе 1 предложен ряд способов сохранения двунитевого характера дцДНК во время синтеза библиотеки, что важно на стадии химической реакции, которые могут использоваться (как показано на фиг. 2-6) для создания до двух узлов разнообразия. Способ 2 (фиг. 7-9) предполагает один узел разнообразия и использует шпилечный олигонуклеотид, который является ковалентно замкнутым (например, с помощью шпильки или химическим образом) на удаленном конце линкера. В способе 3 предложены способы создания библиотек с одним, двумя, тремя или больше узлами разнообразия. Подробное описание способов 1, 2 и 3 приводится ниже. Способ 1. В настоящем изобретении представлен способ идентификации одного или нескольких соединений,которые связываются с биологической мишенью. Способ включает синтезирование библиотеки соединений, в котором соединения содержат функциональный компонент, имеющий не более двух положений разнообразия. Функциональный компонент соединений функционально соединен с инициирующим олигонуклеотидом, который идентифицирует структуру функционального компонента за счет обеспечения раствора, содержащего А инициирующие соединения. Инициирующий олигонуклеотид включает линкер L (например, полиэтиленгликоль) с целым чис-5 021797 лом, равным единице или больше, в котором инициирующие олигонуклеотиды содержат функциональный компонент, включающий строительные блоки А, присоединенные к L и распределенных в реакционные сосуды А, где А - целое число, равное двум или больше, который функционально соединен с инициирующим олигонуклеотидом, идентифицирующим строительные блоки. В некоторых примерах осуществления изобретения строительные блоки А могут быть дополнительно дериватизированы с помощью общего узла S. В других примерах осуществления изобретения А впоследствии преобразуется с помощью S, причем S - это молекула остова, которая обеспечивает введение дополнительных узлов разнообразия. В некоторых примерах осуществления изобретения A-S может подвергаться скринингу непосредственно, с представлением одного узла разнообразия. В других примерах осуществления изобретения реакционные сосуды A-S (например, которые могут сначала включать очистку A-S от исходных материалов) смешиваются вместе и распределяются аликвотно в реакционные сосуды В, где В - целое число, равное единице или больше, и вступают в реакцию с одним из В строительных блоков. A-S-B, все еще в реакционных сосудах В, в некоторых случаях вступают в реакцию со строительным блоком С, где С - целое число, равное единице, очищаются и подвергаются реакции полимеризации или сшивания с помощью праймеров В, в которых праймеры В отличаются последовательностью и идентифицируют строительные блоки В. В некоторых примерах осуществления изобретения A-S может быть целым числом, равным единице. В одном примере осуществления изобретения A-S может соединяться непосредственно с инициирующими олигонуклеотидами В, а после реакции со строительными блоками В, реакции В смешиваются. В других примерах осуществления изобретения смесь A-S-B, в которой В представляет единственный узел разнообразия, подвергается скринингу непосредственно с представлением одного узла разнообразия. В других примерах осуществления изобретения смесь A-S-B, где В представляет единственный узел разнообразия, в дальнейшем разделяются аликвотно в реакционные сосуды С, вступают в реакцию со строительными блоками С и подвергаются второй реакции полимеризации нити или сшивания с помощью праймеров С, в которых праймеры С отличаются последовательностью и идентифицируют строительные блоки С. В некоторых примерах осуществления изобретения В может быть целым числом, равным единице,a A-S числом больше единицы, в этом случае A-S, теперь дериватизированная с помощью В, распределяется аликвотно в реакционные сосуды С, вступает в реакцию со строительными блоками С и подвергается полимеризации второй нити с помощью праймеров С; при этом праймеры С отличаются последовательностью и идентифицируют строительные блоки С. Такую общую стратегию можно расширить включением дополнительных узлов разнообразия (например, D, E, F и т.д.) таким образом, что первый узел разнообразия вступает в реакцию со строительными блоками и(или) S и кодируется исходным олигонуклеотидом, смешивается, повторно распределяется аликвотно в сосуды, а затем последующий узел разнообразия дериватизируется строительными блоками, который кодируется праймером, используемым для реакции полимеризации или сшивания. В некоторых примерах осуществления изобретения А может быть целым числом, равным единице,В может быть целым числом, равным единице, и используются инициирующие олигонуклеотиды С. A-SB, присоединенные к инициирующим олигонуклеотидам С, образуются в реакционном сосуде С, вступают в реакцию со строительными блоками С и подвергаются скринингу непосредственно. В некоторых примерах осуществления изобретения S вступает в реакцию с инициирующим олигонуклеотидом, а А, В и(или) С (например, или D, E, F и т.д) вступают в дальнейшем в реакцию. В некоторых примерах осуществления изобретения А, В или С (например, или D, Е, F, и т.д.) может содержать участки для дополнительных узлов разнообразия. В этом случае S может использоваться или может не использоваться или необходимо вводить дополнительные узлы разнообразия. В одном примере осуществления изобретения инициирующий олигонуклеотид включает шпилечную структуру, комплементарную в идентификационной области (фиг. 2). Идентификационная область может иметь длину, например, от 2 до 100 пар оснований, предпочтительно длину 5-20 пар оснований, и наиболее предпочтительно длину 6-12 пар оснований. Инициирующий олигонуклеотид, кроме того,включает последовательность в петлевой области шпилечной структуры, которая может служить областью связывания праймера для амплификации (фиг. 3) таким образом, что температура плавления в области связывания праймера более высокая для ее комплементарного праймера (например, включающего прилегающие сбоку идентификационные области), чем в одиночной идентификационной области. В одном примере осуществления изобретения петлевая область может включать модифицированные пары оснований, которые могут образовывать дуплексные образования с более высокой аффинностью, чем немодифицированные основания; такие модифицированные основания известны в данной области (фиг. 3). Инициирующий олигонуклеотид может, кроме того, включать некомплементарную последовательность на 3'-конце молекулы, которая может служить для связывания второй идентификационной области либо для полимеризации, либо для ферментативного лигирования (фиг. 4). В одном примере осуществления изобретения нити можно затем сшивать, например, с помощью псоралена. В другом примере осуществления изобретения петлевая область и, как минимум, идентификационная область на 3'-стороне петлевой области, могут способствовать гибридизации с комплементарным олигонуклеотидом, который также содержит вторую идентификационную область (фиг. 5). В случаях,когда используется много строительных блоков и соответствующих меток (например, 100 меток), на стадии синтеза олигонуклеотида для создания необходимого количества меток может применяться стратегия "смешивания-разбиения". Такие стратегии смешивания-разбиения для синтеза ДНК известны в данной области. В одном примере осуществления изобретения нити можно впоследствии сшивать, например, с помощью псоралена. Получаемые в результате члены библиотеки могут амплифицироваться с помощью ПЦР после выбора для связывания компонентов против мишени (ей), представляющей интерес(фиг. 6). Например, головной фрагмент, который включает инициирующий олигонуклеотид, может вступать в реакцию с линкером и А, который включает, например, 1000 различных вариантов. Для каждого строительного блока А ДНК-метка А может лигироваться с головным фрагментом или достраиваться с праймера до головного фрагмента. Эти реакции могут выполняться, например, на 1000-луночном планшете или 10100-луночном планшете. Все реакции могут быть объединены, факультативно очищены и распределены во второй набор планшетов. Затем эту же процедуру можно выполнить со строительными блоками В, которые также включают, например, 1000 различных вариантов. ДНК-метка В может быть лигирована с головным фрагментом, и все реакции могут быть объединены. Библиотека из 10001000 комбинаций от А до В (т.е. 1000000 соединений), маркированы 1000000 различных комбинаций меток. Этот подход можно расширить добавлением вариантов С, D, Е и т.д. Созданную библиотеку можно затем использовать для идентификации соединений, которые связываются с мишенью. Композиция соединений, которые связываются с библиотекой, можно оценить с помощью ПЦР и секвенированием ДНКметок, чтобы идентифицировать пополненные соединения. Способ 2. В другом примере осуществления изобретения (фиг. 7) способ включает синтезирование библиотеки соединений, в котором соединения содержат функциональный компонент, имеющий не более двух положений разнообразия. Функциональный компонент соединений функционально соединяется с инициирующим олигонуклеотидом, который содержит уникальную генетическую последовательность,идентифицирующую структуру функционального компонента за счет обеспечения раствора, содержащего инициирующие соединения А, в котором L - целое число, равное единице или больше, где инициирующие соединения включают функциональный компонент, имеющий строительные блоки А, распределенные в реакционные сосуды А, где, например, А - целое число, равное двум или больше, который функционально соединяется с исходным олигонуклеотидом, который идентифицирует строительные блоки А. В некоторых примерах осуществления изобретения строительные блоки А предварительно дериватизируются с помощью общего S. В других примерах осуществления изобретения А впоследствии преобразуется с помощью S, причем S - это молекула остова, которая обеспечивает введение дополнительных узлов разнообразия. Далее, реакционные сосуды A-S (которые могут сначала включать очисткуA-S от исходных материалов) смешиваются вместе и распределяются аликвотно в реакционные сосуды В, где В - целое число, равное единице или больше, и вступают в реакцию с одним из строительных блоков В. A-S-B, все еще в реакционных сосудах В, в некоторых примерах осуществления изобретения вступают в реакцию с строительным блоком С, где С - целое число, равное единице, очищаются и хранятся отдельно в сосудах В для скрининга. В некоторых примерах осуществления изобретения A-S - это целое число, равное единице. В одном примере осуществления изобретения A-S может быть связан непосредственно с инициирующими олигонуклеотидами В и после реакции строительных блоков В, реакции В смешиваются и распределяются аликвотно в реакционные сосуды С, вступают в реакцию со строительными блоками С и хранятся отдельно в сосуде С для скрининга. В других примерах осуществления изобретения В может быть целым числом, равным единице, a A-S числом больше единицы, в этом случае A-S, теперь дериватизированная с помощью В, распределяется аликвотно в реакционные сосуды С, вступает в реакцию со строительными блоками С и хранится отдельно в сосудах С для скрининга. Такую общую стратегию можно расширить включением дополнительных узлов разнообразия (например,D, E, F и т.д.) таким образом, что первый узел разнообразия вступает в реакцию со строительными блоками и(или) S и кодируется исходным олигонуклеотидом, смешивается, повторно распределяется аликвотно в сосуды, а затем последующий узел разнообразия дериватизируется строительными блоками и хранится в своих соответствующих сосудах для скрининга (фиг. 8). Например, как описано в способе 1, головной фрагмент, который включает инициирующий олигонуклеотид, может вступать в реакцию с линкером и строительными блоками А, которые включают, например, 1000 различных вариантов. Для каждого строительного блока А ДНК-метка А может сшиваться с головным фрагментом или достраиваться с праймера до головного фрагмента. Реакции могут объединяться в пул. Затем эту же процедуру можно выполнить со строительными блоками В, но в отношении В ДНК-метка не добавляется. Поскольку В не кодируется, все "В" реакции могут объединяться в пул (например, 1000 реакций) и может выполняться стадия отбора для идентификации всех строительных блоков А, которые дают требуемый эффект связывания с неизвестными строительными блоками В. Библиотека строительных блоков А, идентифицированных на стадии отбора (например, 10 строительных блоков А), может затем вступать в реакцию с теми же 1000 строительными блоками В, что приводит к отбору 10000 соединений или меньше. На этом этапе могут быть добавлены ДНК-метки для В и могут быть идентифицированы строительные блоки В, дающие требуемый эффект связывания в комбинации, например, с 10 строительными блоками А, приводя к пошаговой свертке исходной библиотеки, например,1000000 соединений. Набор таких конечных соединений может тестироваться индивидуально для идентификации оптимальных, например, связующих веществ, активаторов или ингибиторов. Чтобы избежать объединения всех реакций после синтеза В, можно использовать, например, прибор BIND Reader (SRU Biosystems) для мониторинга связывания на поверхности датчика в формате высокой пропускной способности (например, 384-луночные планшеты и 1536-луночные планшеты). Например, строительные блоки А могут кодироваться ДНК-метками, а строительные блоки В могут кодироваться по положению. Связующие вещества можно затем идентифицировать с помощью BIND датчика, секвенирования и анализа на микрочипах или анализа расщепления рестриктазой меток А. Этот анализ предусматривает идентификацию комбинаций строительных блоков А и В, которые продуцируют требуемые молекулы. Можно использовать другие методы для мониторинга связывания, известные специалистам в данной области, включая, например, твердофазный иммуноферментный анализ (ELISA). Способы 1 и 2. Инициирующий олигонуклеотид способов 1 и 2 может содержать шпилечную структуру, комплементарную в идентификационной области. Инициирующий олигонуклеотид, кроме того, содержит последовательность в петлевой области шпилечной структуры, которая может служить в качестве праймерсвязывающей области для амплификации таким образом, что температура плавления связывающей праймер области более высокая для ее комплементарного праймера (который может включать примыкающие по бокам идентификационные области), чем у одиночной идентификационной области. В одном примере осуществления изобретения инициирующий олигонуклеотид включает молекулу линкера, способную функционально вступать в реакцию со строительными блоками. Молекула линкера может прикрепляться непосредственно к 5'-концу олигонуклеотида известными в данной области методами или может быть встроена в молекулу, например, вне дериватизированного основания (например,положение С 5 уридина), или линкер может быть размещен в центре олигонуклеотида с помощью известных стандартных методик. Инициирующий олигонуклеотид может быть однонитевым или двунитевым. Двунитевый олигонуклеотид можно получить с помощью шпилечного образования олигонуклеотида или путем перекрестного сшивания с использованием, например, псораленового компонента, известного в данной области. Инициирующий олигонуклеотид может содержать две праймерсвязывающие области (например,для обеспечения реакции ПЦР) с обеих сторон идентификационной области, которая кодирует строительный блок. Альтернативно, инициирующий олигонуклеотид может содержать один праймерсвязывающий сайт на 5'-конце. В других примерах осуществления изобретения инициирующий олигонуклеотид представляет собой шпильку, а петлевая область образует праймерсвязывающий сайт или праймерсвязывающий сайт вводится путем скрещивания олигонуклеотида с идентификационной областью на 3'стороне петли. Праймер-олигонуклеотид, содержащий область, гомологичную 3'-концу инициирующего олигонуклеотида, и несущий праймерсвязывающую область на ее 5'-конце (например, для обеспечения реакции ПЦР) может гибридизироваться с олигонуклеотидом и может содержать идентификационную область, которая кодирует строительные блоки, используемые в одном из положений разнообразия. Праймер-олигонуклеотид может содержать дополнительную информацию, например, область рандомизированных нуклеотидов, например, длиной 2-16 нуклеотидов, которые включены для биоинформативного анализа. В одном примере осуществления изобретения инициирующий олигонуклеотид не содержит ПЦР праймерсвязывающий сайт. В другом примере осуществления изобретения библиотека соединений, или ее часть, контактирует с биологической мишенью в условиях, пригодных, как минимум, для связывания одного члена библиотеки соединений с мишенью, с последующим удалением не связывающихся с мишенью членов библиотеки и анализом идентификационной области или областей. Примеры биологических мишеней включают, например, ферменты (например, киназы, фосфатазы, метилазы, деметилазы, протеазы и ферменты репарации ДНК), белки, вовлеченные в белок-белковые взаимодействия (например, лиганды для рецепторов), рецепторные мишени (например, GPCR-рецепторы, сопряженные с G-белком и RTK), ионные каналы, бактерии, вирусы, паразиты, ДНК, РНК, прионы или карбогидраты). В одном примере осуществления изобретения библиотека соединений, или ее часть, контактирует с биологической мишенью в условиях, пригодных, как минимум, для связывания одного члена библиотеки соединений с мишенью, с последующим удалением не связывающихся с мишенью членов библиотеки, с последующей амплификацией идентификационной области известными способами и дальнейшим анализом идентификационной области или областей известными способами. В одном примере осуществления изобретения метод амплификации идентификационной области может включать, например, полимеразную цепную реакцию (ПЦР), лигандную цепную реакцию (LCR),амплификацию по типу катящегося кольца (RCA) или любой другой известный способ для амплифика-8 021797 ции последовательности нуклеиновой кислоты. В следующем примере осуществления изобретения библиотека соединений не объединяется в пул после окончательной стадии добавления строительного блока, а пулы подвергаются скринингу индивидуально для идентификации соединения(ий), которое(ые) связывается(ются) с мишенью. В другом примере осуществления изобретения молекулы, которые связываются с мишенью, не подвергаются амплификации, а анализируются непосредственно. Методы анализа включают, например,анализ на микрочипах или основанные на гранулах методы деконволюции идентификационных областей(фиг. 9). Молекулы, которые связываются на стадии скрининга, можно также обнаружить с помощью фотонно-кристаллического биодатчика в отсутствие метки. В одном примере осуществления изобретения инициирующий олигонуклеотид и(или) праймеролигонуклеотид содержат функциональный компонент, который обеспечивает его обнаружение, например, с помощью флуоресцентных меток, Q точек или биотина. В одном примере осуществления изобретения в анализе на микрочипах используется повышенная возможность обнаружения, например, фотонные кристаллы непостоянного резонанса. В одном примере осуществления изобретения метод амплификации включает формирование водномасляной эмульсии для создания множества водных микрореакторов, в котором как минимум один из микрореакторов содержит по крайней мере один член библиотеки соединений, который связывается с мишенью, одну гранулу, способную связываться с кодирующим олигонуклеотидом как минимум одного члена библиотеки соединений, который связывается с мишенью, и раствор реакции амплификации, содержащий реагенты, необходимые для выполнения нуклеиново-кислотной амплификации, амплифицирующий кодирующий олигонуклеотид в микрореакторах для образования амплифицированных копий кодирующего олигонуклеотида, и связывающий амплифицированные копии кодирующего олигонуклеотида с гранулами в микрореакторах. После идентификации строительных блоков из первой библиотеки, которые связываются с мишенью, представляющей интерес, можно приготовить вторую библиотеку итерационным способом, когда добавляют один или два дополнительных узла разнообразия, а библиотека создается и разнообразие отбирается в соответствии с приведенным описанием. Этот процесс можно воспроизводить столько раз,сколько необходимо для создания молекулы с требуемыми молекулярными и фармацевтическими свойствами. Иллюстративные строительные блоки А включают, например, аминокислоты (не ограниченные альфа-аминокислотами), реагенты клик-химии (например, азидные или алкиновые цепи) с амином или тиоловые реагенты. Выбор строительного блока А зависит, например, от природы реактивной группы,используемой в линкере, природы компонента остова, а также растворителя, используемого для химического синтеза. См., например, табл. 1. Таблица 1 Иллюстративные строительные блоки положения А В табл. 2 и 3 представлены типичные В и С строительные блоки соответственно. В положение В или С может быть введен сайт рестрикции для анализа конечного продукта и выбора путем осуществления ПЦР и расщепления рестриктазой одним из соответствующих рестрикционных ферментов. Таблица 2 Иллюстративные строительные блоки положения В и кодирующие ДНК-метки Таблица 3 Иллюстративные строительные блоки положения С и кодирующие ДНК-метки Способ 3. В любом из описанных здесь способов (например, способы 1 и 2) олигонуклеотид головного фрагмента можно модифицировать для поддержания растворимости в полу- или неводных (например, органических) условиях. В некоторых примерах осуществления изобретения головной фрагмент включает идентификационную область. В других примерах осуществления изобретения головной фрагмент с линкером может сначала дериватизироваться строительным блоком (например, функциональным компонентом) или остовом, затем добавляется идентификационная последовательность. У нуклеотидных оснований головного фрагмента можно повысить гидрофобность путем модификации, например, положения С 5 оснований Т или С с алифатическими цепями, без существенного нарушения их способности к образованию водородной связи со своими комплементарными основаниями. См., например, примеры модифицированных оснований в табл. 4. Кроме того, олигонуклеотид головного фрагмента может иметь разбросанные модификации, которые повышают растворимость в органических растворителях. Например, азобензол фосфорамидит может вводить гидрофобный компонент в конструкцию головного фрагмента. Такие вставки гидрофобных амидитов в головной фрагмент могут встречаться где угодно в молекуле. Однако вставка не может помешать последующей маркировке с помощью дополнительных ДНК-меток во время синтеза библиотеки или течению реакций ПЦР после завершения отбора или анализа на микрочипах, если используется для деконволюции метки. Такие добавления к конструкции головного фрагмента, описанной здесь, обеспечили бы растворимость головного фрагмента, например, в 15, 25, 30, 50, 75, 90, 95, 98, 99 или 100% органическом растворителе. Таким образом, добавление гидрофобных остатков в конструкцию головного фрагмента позволяют повысить растворимость в полуили неводных (например, органических) условиях, что делает головной фрагмент компетентным в отно- 12021797 шении маркировки нуклеиновой кислоты. Кроме того, ДНК-метки, которые впоследствии вводятся в библиотеку, можно также модифицировать в положении С 5 оснований Т или С таким образом, что они также повышают гидрофобность и растворимость библиотеки в органических растворителях для последующих стадий синтеза библиотеки. Таблица 4 Иллюстративные модифицированные нуклеотидные основания Молекула линкера между библиотекой головного фрагмента и малых молекул может изменяться для повышения растворимости головного фрагмента в органическом растворителе. В продаже имеется широкий ассортимент линкеров, который может соединять головной фрагмент с библиотекой малых молекул. Линкеры отбирают эмпирически для данной конструкции библиотеки малых молекул (остовы и строительные блоки) таким образом, что библиотека может синтезироваться в органическом растворителе, например 15, 25, 30, 50, 75, 90, 95, 98, 99 или 100% органическом растворителе. Линкер можно изменять с помощью модельных реакций перед синтезом библиотеки, чтобы выбрать адекватную длину цепи,которая растворяет головной фрагмент в органическом растворителе. Среди таких линкеров могут быть линкеры, например, с увеличенной длиной алкильной цепи, увеличенные звенья полиэтиленгликоля,ответвленные разновидности с положительными зарядами (для нейтрализации отрицательных фосфатных зарядов на головном фрагменте) или увеличенные объемы гидрофобности (например, добавление структур бензольного кольца). Молекула линкера может обеспечивать адекватный спейсер между ДНК головного фрагмента и членом химической библиотеки. Например, можно использовать бифункциональные линкеры. В некоторых примерах осуществления изобретения бифункциональные линкеры могут включать, например, три части. Часть 1 может быть реактивной группой, которая формирует ковалентную связь с ДНК, например,карбоксиловая кислота, предпочтительно активизированная N-гидроксисукцинимид (NHS) сложным эфиром для вступления в реакцию с аминогруппой на ДНК (например, амино-модифицированный dT),амидитом для модификации 5'- или 3'-конца головного фрагмента однонитевой ДНК (достигаемый с помощью олигонуклеотида стандартной химии), пар клик-химии (азид алкин циклоприсоединение в присутствии Cu(I) катализатора) или тиоловые реактивные группы. Часть 2 может также быть реактивной группой, которая образует ковалентную связь с химической библиотекой, либо строительным блоком в положении А, либо компонентом остова. Такая реактивная группа может представлять собой, например,амин, тиол, азид или алкин для реакций на водной основе или многие другие реактивные группы для реакций на органической основе. Часть 3 может быть химически инертным спейсером переменной длины,который вводится между частью 1 и 2. Такой спейсер может представлять собой цепь звеньев этиленгликоля (например, полиэтиленгликоли различной длины), алкан, алкен, полиеновая цепь или пептидная цепь. Линкер может содержать ветви или вставки с гидрофобными компонентами (например, бензольные кольца) для повышения растворимости головного фрагмента в органических растворителях, например,- 13021797 флуоресцентные компоненты (например, флюоресцеин или Су-3), используемые для целей обнаружения библиотеки. Примеры коммерчески доступных линкеров включают, например, аминокарбоксиловые линкеры(например, пептиды (например, Z-Gly-Gly-Gly-Osu или Z-Gly-Gly-Gly-Gly-Gly-Gly-Osu), ПЭГ (например,Fmoc-амино-PEG2000-NHS или амино-PEG)-NHS) или цепи алкановой кислоты (например, Boc-аминокапроновая кислота-Osu), линкеры клик-химии (например, пептиды (например, азидогомаланинGly-Gly-Gly-OSu или пропаргилглицин-Gly-Gly-Gly-OSu), ПЭГ (например, азидо-PEG-NHS) или цепи алкановой кислоты (например, 5-азидопентановая кислота, (S)-2-(азидометил-1-Вос-пирролидин или 4 азидо-бутано-1-вая кислота N-гидроксисукцинимид сложный эфир, тиол-реактивные линкеры (например, ПЭГ (например, SM(PEG)nNHS-PEG-малеимид), алкановые цепи (например, 3-(пиридин-2-илдисульфанил)пропионовая кислота-Osu или сульфосукцинимидил 6-(3'-[2 пиридилдитио]пропионамидо)гексаноат, амидиты для олигонуклеотидного синтеза (например, аминовые модификаторы(например,6-(трифторацетиламино)-гексил-(2-цианоэтил)-(N,Nдиизопропил)фосфорамидит), тиоловые модификаторы (например, S-тритил-6-меркаптогексил-1-[(2 цианоэтил)-(N,N-диизопропил)]фосфорамидит или модификаторы клик-химии (например, 6-гексин-1-ил(2-цианоэтил)-(N,N-диизопропил)фосфорамидит,3-диметокситритилокси-2-(3-(3 пропаргилоксипропанамидо)пропанамидо)пропил-1-O-сукциноил, длинноцепочечный алкиламино CPG или 4-азидо-бутан-1-овая кислота N-гидроксисукцинимид сложный эфир. Для упрощения синтеза библиотеки в органических растворителях гидрофобные остатки в конструкции головного фрагмента можно изменять с помощью конструкции линкера. Например, разработана комбинация головного фрагмента и линкера для получения соответствующих остатков, в которой коэффициент октанол:вода (Poct) составляет, например, от 1,0 до 2,5. Примеры Ниже приведены примеры, иллюстрирующие изобретение. Они ни в коей мере не ограничивают настоящее изобретение. Пример 1. Получение головного фрагмента (вариант 1). Фосфорилированный олигонуклеотидный головной HP (олиго HP), имеющий следующую последовательность, был синтезирован и очищен с помощью ВЭЖХ с использованием IDT DNA.(CCTCAGC) для рестрикционного фермента BbvCI или версии этого фермента Nb. BbvCI или Nt. BbvCI со способностью к внесению ников, который может расщеплять либо верхнюю, либо нижнюю нить (BioLabs, Новая Англия). В середине шпилечной петли вставлена боковая цепь С 5-аминомодифицированный dT (dT-C6-NH; "С 6" относится к карбон 6 линкеру), который использовали для соединения амино-ПЭГ линкера (PEG2000, приблизительно 45 звеньев этиленгликоля). Верхние и нижние нити меток ДНК А, В и С были синтезированы и очищены с помощью IDT DNA и очищены стандартным обессоливанием. Более длинные олигонуклеотиды, например 3'-концевые праймеры и ПЦР праймеры, были синтезированы с помощью IDT DNA и очищены с помощью ВЭЖХ. 10 наномоль олиго HP растворили в 50 мкл воды. 20-кратный молярный избыток Fmoc-аминоPEG2000-карбоксил-NHS сложного эфира (JenKem Technology, США) растворили в 50 мкл диметилформамида (ДМФА) и добавили к раствору олигонуклеотида двумя частями в течение 2 ч при комнатной температуре (конечный состав растворителя 50% ДМФА/50% воды). Затем для быстрого охлаждения избытка NHS сложных эфиров добавили 60 мкл 1 М Триса HCl, рН 7,0 (конечная концентрация 200 ммоль) и раствор инкубировали в течение еще 30 мин при комнатной температуре. Получившуюся реакционную смесь разбавили до 500 мкл водой и обессолили, пропустив через NAP-5 колонку (Sephadex-25,GE Healthcare). Полученный материал лиофилизировали и растворили в 100 мкл воды. Добавили 20 мкл пиперидина (до конечной концентрации 20%) и инкубировали в течение 2 ч при комнатной температуре. Образовался мутный осадок из-за снятия защиты амина и высвобождения нерастворимой в воде Fmoc группы. Реакционную смесь затем профильтровали через 0,2-мкм центрифужные фильтры (Millipore) и осадили с помощью 300 ммоль ацетата натрия с добавлением 3 объемов этанола. Было установлено, что Fmocзащищенная форма модифицированного олигонуклеотида растворима в этаноле и изопропаноле. Благодаря высокой эффективности сочетания, полученный головной фрагмент (НР-1) использовали без дальнейшей очистки (фиг. 11). Пример 2. Получение головного фрагмента (вариант 2). Полный головной фрагмент (НР-1) со следующей последовательностью был получен компанией Пример 3. Синтез модельного члена библиотеки. Стадия 1. Присоединение DTAF. Чтобы приготовить "библиотеку из 1", модельное соединение, 5-(4,6-дихлоротриазиниламинофлюоресцеин) (DTAF; Anaspec) (фиг. 12) присоединили к аминогруппе НР-1. DTAF структурно представляет собой трихлоротриазиновый остов с одним присоединенным аминосоединением. Для формирования библиотеки трихлоротриазиновые остовы можно дериватизировать целым рядом строительных блоков в каждом из трех положений хлора. DTAF также обеспечивает флуоресцентную метку для модельной библиотеки. Реакция (10 мкл) была организована следующим образом. В 5 мкл растворенных в воде 400 мкмоль НР-1 добавили 2 мкл 750 ммоль боратного буфера, рН 9,5, и 1 мкл DMF. DTAF растворили в DMF до 50 ммоль и добавили 2 мкл в реакцию. Конечные концентрации НР-1 и DTAF составили 200 мкмоль и 10 ммоль соответственно, таким образом образовался 50-кратный избыток DTAF. Конечная концентрация DMF составила 30%. Было установлено, что НР-1 оставался растворимым вDMF с процентным содержанием вплоть до 90%, что доказывает, что он растворим в органическом растворителе, например, DMF. Реакция продолжалась при 4 С в течение 16-20 ч. Реакционную смесь затем разбавили водой до 30-50 мкл и обессолили на центрифужной колонке Zeba (Pierce). Дальнейшая очистка на этой стадии не производилась. Стадия 2. Присоединение аминобиотина. После присоединения DTAF к НР-1 остается еще одна реактивная группа на молекуле остова, доступная для модификации. Для создания модельного связывающего соединения был выбран аналог аминобиотина EZ-Link Pentylamine-Biotin (Pierce) для присоединения в этом положении (фиг. 12). Реакция была организована следующим образом. 20 мкл реакционной смеси, содержащей приблизительно 200 пмоль НР-l-DTAF (стадия 1), растворили в 150 ммоль боратного буфера, рН 9,5, и 10 нмоль пентиламинбиотина. Реакция продолжалась в течение 4-12 ч при 75 С. Реакцию затем очистили обессоливанием на центрифужной колонке Zeba, как описано выше. Стадия 3. Сшивание ДНК меток с HP-l-DTAF-биотином. Фосфорилированные ДНК-метки (область 3'-концевого праймера и ПЦР 5'- и 3'-концевые праймеры) были синтезированы с помощью IDT DNA. Олигонуклеотидные последовательности (фиг. 13) следующие. Эквивалентные количества верхних и нижних пар меток и 3'-концевых олигонуклеотидов растворили в воде и подвергли отжигу путем нагрева до 85 С и постепенного понижения температуры до 4 С в буфере, состоящем из 200 ммоль NaCl, 50 ммоль Трис HCl, рН 7,0. Сначала двунитевую метку А 1 лигировали с головным фрагментом. Реакция лигирования (20 мкл) содержала 2,5 мкмоль HP-l-DTAF-биотина и 2,5 мкмоль двунитевой метки А 1 в 1 Т 4 ДНК-лигазном буфере и 60 единиц Вейсса Т 4 ДНК-лигазы (BioLabs, Новая Англия). Реакцию инкубировали при 16 С в течение 16 ч. Получившийся продукт не растворялся ни на одном из тестированных гелей, включая различные процентные содержания ТВЕ-мочевины, NativePage, SDS-PAGE или 2% и 4% агарозный Е-гель(Invitrogen, Inc). Подвижность олигонуклеотида, модифицированного ПЭГ линкером и 20 DTAFбиотином, главным образом определялась наличием этих групп, а не собственно ДНК (данные не показаны). Чтобы проверить эффективность лигирования, были лигированы все метки и 3'-концевые олигонуклеотиды, выполнены ПЦР-анализы получившейся конструкции для подтверждения эффективности сшивания. Реакция сшивания (70 мкл) содержала 2,5 мкмоль HP-l-DTAF-биотина; 2,5 мкмоль каждого из отожженных двунитевых ДНК-меток (А 1, В 1 и С 1), а также 3'-концевая метка; 1 Т 4 ДНК-лигазный бу- 15021797 фер; и 210 единиц Вейсса Т 4 ДНК-лигазы. Реакцию инкубировали при 16 С в течение 20 ч. Реакционную смесь загрузили на 4% агарозный гель и из геля экстрагировали флуоресцентную полосу. Этот материал использовали для тестовой 24-цикловой ПЦР-амплификации при использовании праймеров 5'- и 3'- согласно вышеприведенному описанию. Полученные результаты показаны на фиг. 13. Стадия 4. Очистка HP-l-DTAF-биотаж на гранулах стрептавидина и реакция со стрептавидином. Очистка HP-l-DTAF-биотина на стрептавидиновых (SA) Dynal магнитных гранулах М-280 (Invitrogen) служит в качестве модели для выбора аффинности для химической ДНК- меченной библиотеки. Гранулы SA были предварительно уравновешены в 2 PBS буфере, содержащем 0,05% Тритон Х-100. 50 пмоль HP-l-DTAF-биотина загрузили на 25 мкл предварительно промытых гранул SA в течение 15 мин при комнатной температуре при перемешивании. Пропущенный поток собрали, а гранулы промыли 3 раза в течение 30 мин в 1 мл того же буфера. Окончательную промывку выполнили при 80 С в течение 10 мин с помощью 30 мкл воды (собранной). Гранулы элюировали с помощью 30 мкл 25 ммоль ЭДТА и 5 ммоль NaOH в течение 10 мин при 90 С, и элюент сразу же нейтрализовали, добавив 3 мкл 1 ммоль Триса HCl, рН 7,0. Для эксперимента связывания со стрептавидином 5 мкл проб элюции инкубировали с избытком стрептавидина в 50 ммоль NaCl/10 ммоль Триса HCl, рН 7,0, в течение 10 мин. Пробы смешали с буфером для нанесения на гель без кипячения и растворили в 4-12% SDS NuPage геле (Invitrogen) с помощью рабочего буфера MES. Полученные результаты показаны на фиг. 14. Пример 4. Присоединение H(-Arg-sAhx)6-Arg-OH пептида к HP-l-DTAF. Для использования в качестве другой модификации для последней реактивной группы на триазиновом остове был выбран обогащенный аргинином пептид R7, H(-Arg-sAhx)6-Arg-OH (Bachem). Это проникающий через клеточную мембрану пептид аргинин-аминогексановой кислоты, используемый для внутриклеточной доставки соединения. Условия реакции были аналогичны условиям реакции, описанным выше: 20 мкл реакции содержали приблизительно 200 пмоль НР-25 l-DTAF (стадия 1), растворенного в 150 ммоль боратного буфера, рН 9,5, и 10 нмоль пептида R7. В таких условиях боковая цепь аргинина не вступает в реакцию, а только реактивный амин в пептиде является N-концом. Реакция продолжалась в течение 12 ч при 75 С и затем была очищена обессоливанием на центрифужных колонках Zeba. Пример 5. Конструкция ДНК для эксперимента по детекции внутриклеточной доставки Т 7 РНКП[RNAP]. Конструкция ДНК, используемая для эксперимента по внутриклеточной доставке химической"библиотеки из 1", была получена из ПЦР продукта одного клона VH ДНК приблизительно 400 п.о., характеризующегося Т 7-промоторной областью на 5'-конце и константной областью Cmu короткого антитела рядом с 3'-концом молекулы. Чтобы лигировать конструкцию ДНК с модифицированным головным фрагментом модельной химической библиотеки, присоединили рестрикционный сайт BsmI против хода транскрипции от Т 7-промоторной области с помощью ПЦР-амплификации клона. При рестрикционного расщеплении BsmI образовался GG 3'-выступ, который сделал возможным лигирование с головным фрагментом (СС 3'-выступ). 5'-праймер с BsmI сайтом (подчеркнут) был синтезирован IDT DNA, Inc. После ПЦР-амплификации конструкцию ДНК очистили с помощью набора для ПЦР-очистки (Invitrogen), а полученную в результате ДНК расщепили с помощью 250 единиц BsmI (BioLabs, Новая Англия) при 65 С в NEB буфере 4 в течение 2 ч. ДНК очистили на 2% агарозном геле. Реакция лигирования(пептид аргинин-аминогексановой кислоты) в 1 Т 4 ДНК-лигазном буфере и 60 единицах Вейсса Т 4 ДНК-лигазы (BioLabs, Новая Англия). Реакцию инкубировали при 16 С в течение 20 ч. Благодаря высокой эффективности лигирования, материал далее использовали для эксперимента по внутриклеточной доставке/Т 7 RNAP без дальнейшей очистки. Полученные результаты показаны на фиг. 15. Пример 6. Синтез 1010 библиотеки. Стадия 1. Лигирование метки А с головным фрагментом НР-Т В этой иллюстративной библиотеке используются только положения В и С. Одна метка А лигируется с НР-Т. Метка имеет следующую последовательность: 30 нмоль НР-Т смешали с 45 нмоль каждого из верхних и нижних олигонуклеотидов метки А 1 в 1T4 ДНК-лигазном буфере и подвергли отжигу путем нагрева до 95 С в течение 1 мин с последующим охлаждением до 4 С со скоростью 0,2 С/с. Затем пробу довели до 16 С. Добавили 300 единиц Вейсса Т 4 ДНК-лигазы, инкубировали пробы в течение 16-20 ч при 16 С. После лигирования НР-Т-А обессолили с помощью колонки Zeba (Pierce). См., например, фиг. 16 А. Стадия 2. Лигирование меток В 1-В 12 и С меток. Двенадцать реакций лигирования были составлены подобно реакциям лигирования, описанным выше. В каждую из 12 пробирок по 5 нмоль пар верхних и нижних олигонуклеотидов В 1-В 12 добавили в 1 T4 ДНК-лигазный буфер и подвергли отжигу согласно вышеприведенному описанию. НР-Т-А растворили в 1 T4 ДНК-лигазном буфере. 2,5 нмоль НР-Т-А распределили аликвотно в эти 12 пробирках. 30 единиц Вейсса Т 4 ДНК-лигазы добавили в каждую пробирку, реакции протекали в течение 20 ч при 16 С. После инкубации каждую реакционную смесь отдельно обессолили на 0,5-мл центрифужной колонке Zeba, уравновесили 150 ммоль боратным буфером, рН 9,0. В каждую пробирку добавили 20 избытка цианурхлорида (50 нмоль), растворили в ацетонитриле и инкубировали в течение 1,5 ч при 4 С. После такой инкубации 100 избыток (250 нмоль, т.е. 5 избыток относительно цианурхлорида) аминов В 1-В 12, растворенных в ацетонитриле или DMF, добавили в соответствии с лигированными метками В 1 В 12. Реакцию с аминами выполняли в течение 20 ч при 4 С. После этой реакции библиотеку объединили в пул, дважды обессолили на 2-мл колонках Zeba и лиофилизировали. См., например, фиг. 16 В и 16 С. Подобно вышеприведенным реакциям, метки С и амины были добавлены в условиях реакции, аналогичных вышеописанным. Другие примеры осуществления изобретения. Все публикации, патенты и заявки на патенты, упомянутые в вышеприведенной спецификации,включены в настоящее описание посредством отсылки. Различные модификации и изменения описанного метода и системы в соответствии с настоящим изобретением очевидны специалистам в данной области без отступления от объема и сущности изобретения. Хотя изобретение описано применительно к определенным примерам осуществления изобретения, подразумевается, что заявленное изобретение не должно ограничиваться этими примерами осуществления. Безусловно, подразумевается, что различные модификации описанных способов реализации изобретения, очевидные для специалистов, входят в объем изобретения. Другие примеры осуществления изобретения включены в формулу изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ маркировки кодируемых ДНК химических библиотек, включающий связывание первой функциональной группы бифункционального линкера с инициирующим олигонуклеотидом по 5'-концу упомянутого инициирующего олигонуклеотида, связывание второй функциональной группы упомянутого бифункционального линкера с компонентом упомянутой химической библиотеки и связывание первой идентификационной области на 3'-конце упомянутого инициирующего олигонуклеотида, при этом упомянутый бифункциональный линкер или инициирующий олигонуклеотид модифицируют для повышения растворимости члена химической библиотеки, кодируемой ДНК в органических условиях. 2. Способ по п.1, где упомянутый инициирующий олигонуклеотид, связанный с упомянутым бифункциональным линкером, образует шпилечную структуру. 3. Способ по п.1, в котором упомянутый инициирующий олигонуклеотид включает вторую идентификационную область. 4. Способ по п.3, в котором упомянутая вторая идентификационная область гибридизуется с упомянутой первой идентификационной областью упомянутого инициирующего олигонуклеотида. 5. Способ по п.1, в котором упомянутый бифункциональный линкер модифицируют для повышения растворимости члена упомянутой кодируемой ДНК химической библиотеки в органических условиях. 6. Способ по п.5, в котором модифицированный бифункциональный линкер содержит один или более из следующих элементов: алкильная цепь, полиэтиленгликольное звено, разветвленная молекула с положительными зарядами, гидрофобная кольцевая структура. 7. Способ по п.1, в котором упомянутый инициирующий олигонуклеотид модифицируют для повышения растворимости члена упомянутой кодируемой ДНК химической библиотеки в органических условиях. 8. Способ по п.7, в котором упомянутый инициирующий олигонуклеотид включает первую идентификационную область и вторую идентификационную область и в котором упомянутые первую идентификационную область или вторую идентификационную область модифицируют для повышения растворимости члена упомянутой кодируемой ДНК химической библиотеки в органических условиях. 9. Способ по п.7, в котором модифицированный инициирующий олигонуклеотид содержит один или более нуклеотидов, имеющих гидрофобную группировку или вставку, имеющую гидрофобную группировку. 10. Способ по п.9, в котором упомянутый модифицированный инициирующий олигонуклеотид включает упомянутый нуклеотид, имеющий гидрофобную группировку, и упомянутая гидрофобная группировка представляет собой алифатическую цепь в положении С 5. 11. Способ по п.9, в котором упомянутый модифицированный инициирующий олигонуклеотид включает упомянутую вставку, имеющую гидрофобную группировку, и упомянутая гидрофобная группировка представляет собой азобензол. 12. Способ по п.1, в котором упомянутый член указанной кодируемой ДНК химической библиотеки имеет коэффициент распределения октанол:вода от 1,0 до 2,5. 13. Способ маркировки кодируемых ДНК химических библиотек, включающий связывание первой функциональной группы бифункционального линкера с инициирующим олигонуклеотидом по 5'-концу упомянутого инициирующего олигонуклеотида, где упомянутый инициирующий олигонуклеотид, связанный с упомянутым бифункциональным линкером, образует шпилечную структуру, связывание второй функциональной группы упомянутого бифункционального линкера с компонентом упомянутой химической библиотеки и связывание первой идентификационной области на 3'-конце упомянутого инициирующего олигонуклеотида. 14. Способ по п.13, в котором упомянутый инициирующий олигонуклеотид включает вторую идентификационную область. 15. Способ по п.14, в котором упомянутая вторая идентификационная область гибридизуется с упомянутой первой идентификационной областью упомянутого инициирующего олигонуклеотида. 16. Способ по п.15, в котором упомянутая вторая идентификационная область включает флюоресцентную метку или биотиновую метку. 17. Способ по п.16, в котором упомянутую вторую идентификационную область не амплифицируют перед анализом после стадии отбора. 18. Способ по п.15, в котором упомянутые бифункциональный линкер, инициирующий олигонуклеотид, первую идентификационную область или вторую идентификационную область модифицируют для повышения растворимости члена упомянутой кодируемой ДНК химической библиотеки в органических условиях. 19. Способ создания кодируемых ДНК библиотек, включающий:(a) связывание первой функциональной группы бифункционального линкера с инициирующим олигонуклеотидом на 5'-конце упомянутого инициирующего олигонуклеотида;(b) создание первого узла разнообразия, где упомянутое создание включает связывание второй функциональной группы упомянутого бифункционального линкера с остовом;(c) кодирование первого узла разнообразия в отдельных сосудах, где упомянутое кодирование включает связывание первой идентификационной области на 3'-конце упомянутого инициирующего олигонуклеотида;(d) объединение упомянутого первого узла разнообразия в пул;(e) распределение упомянутого объединенного в пул первого узла разнообразия во второй набор отдельных сосудов, где упомянутый первый узел разнообразия вступает в реакцию с образованием второго узла разнообразия. 20. Способ по п.19, в котором второй узел разнообразия не является кодированным и его не объединяют в пул.
МПК / Метки
МПК: C40B 70/00, C40B 40/08
Метки: способы, днк, скрининга, создания, кодируемых, библиотек
Код ссылки
<a href="https://eas.patents.su/24-21797-sposoby-sozdaniya-i-skrininga-bibliotek-kodiruemyh-dnk.html" rel="bookmark" title="База патентов Евразийского Союза">Способы создания и скрининга библиотек, кодируемых днк</a>
Следующий патент: Бензоксазины, бензотиазины и родственные соединения, обладающие ингибирующей nos активностью
Случайный патент: Способ лечения послеоперационной боли