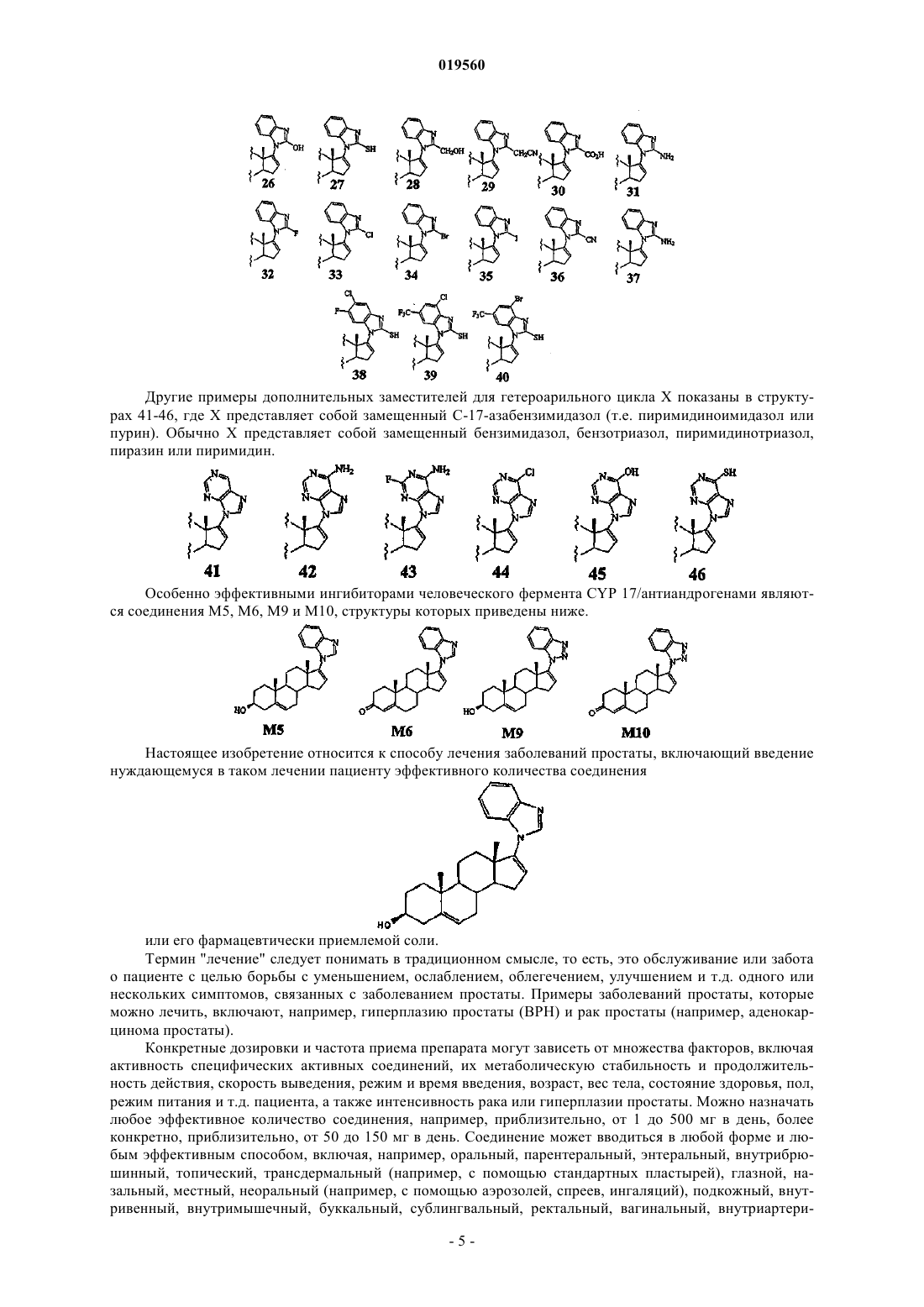
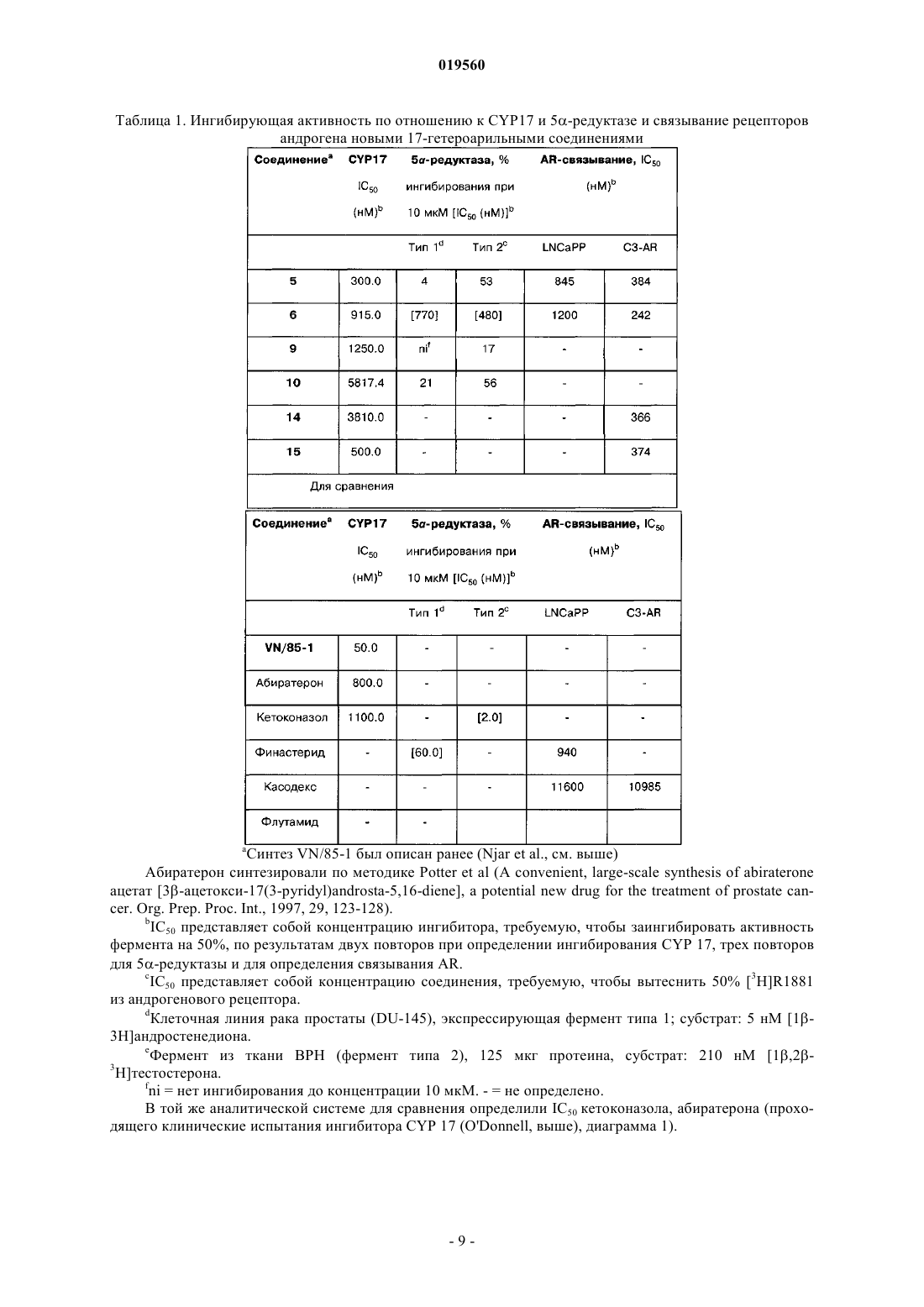
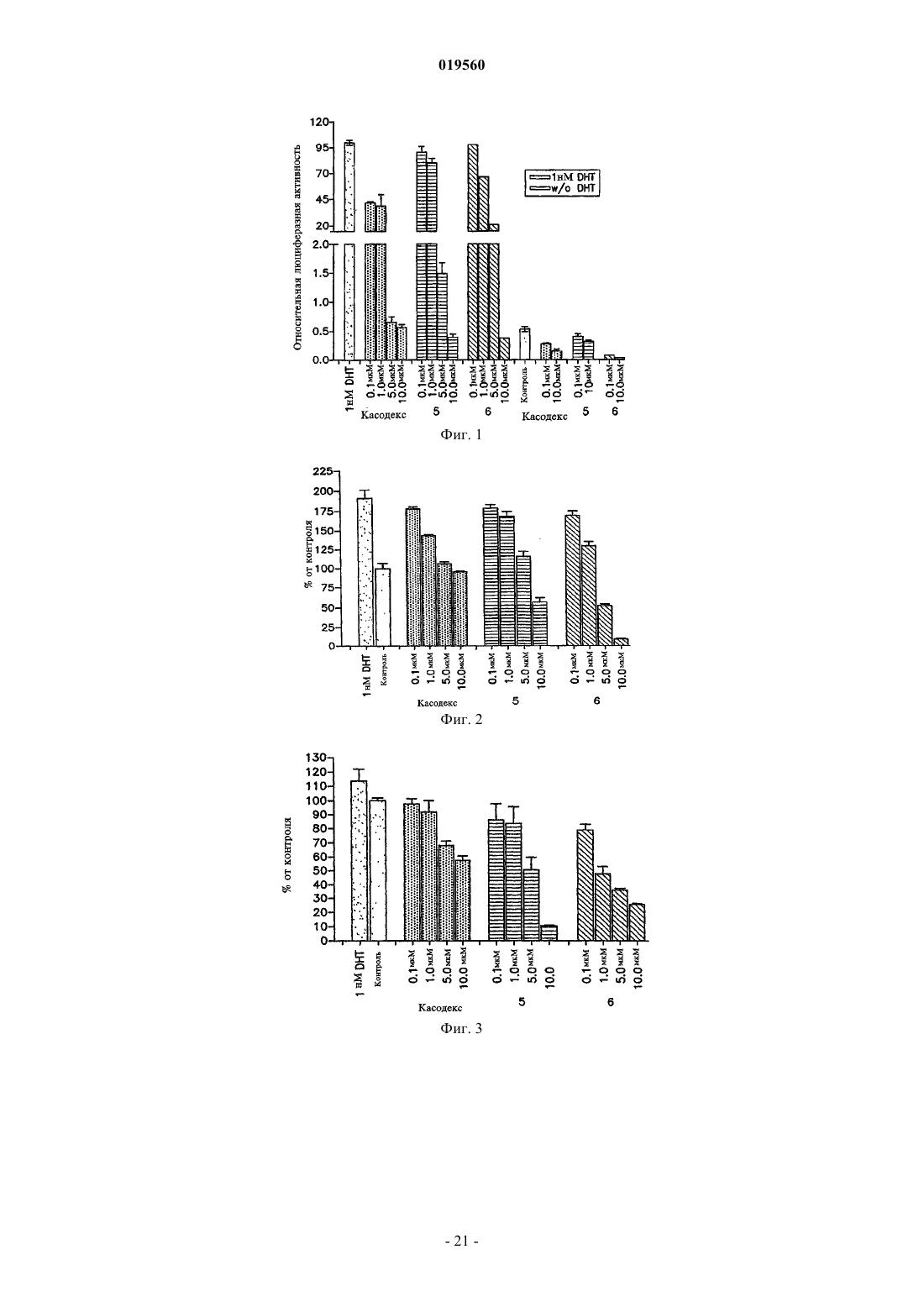
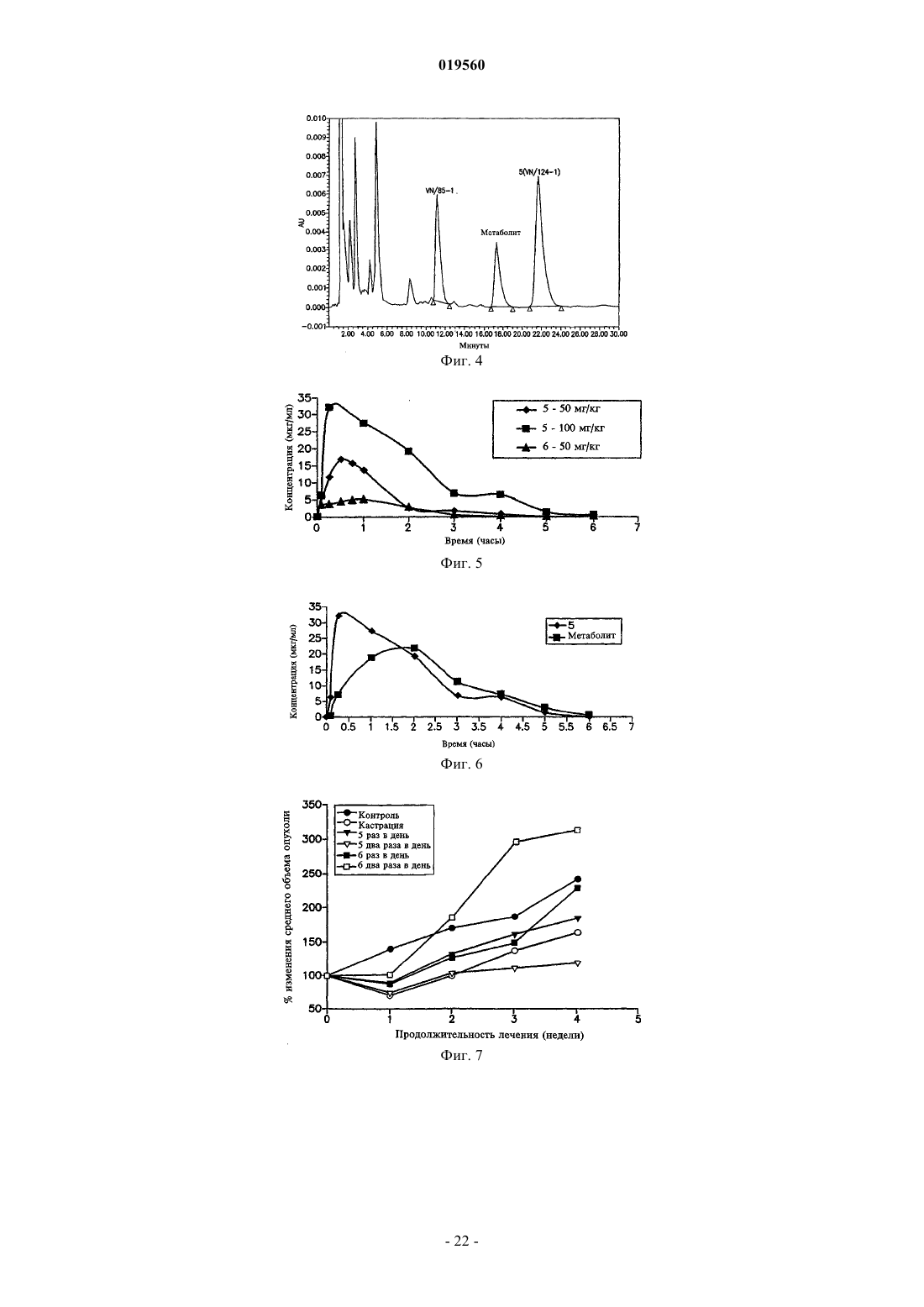
Способ лечения простаты (варианты)
Формула / Реферат
1. Способ лечения заболевания простаты, включающий введение нуждающемуся в лечении субъекту эффективного количества соединения

или его фармацевтически приемлемой соли.
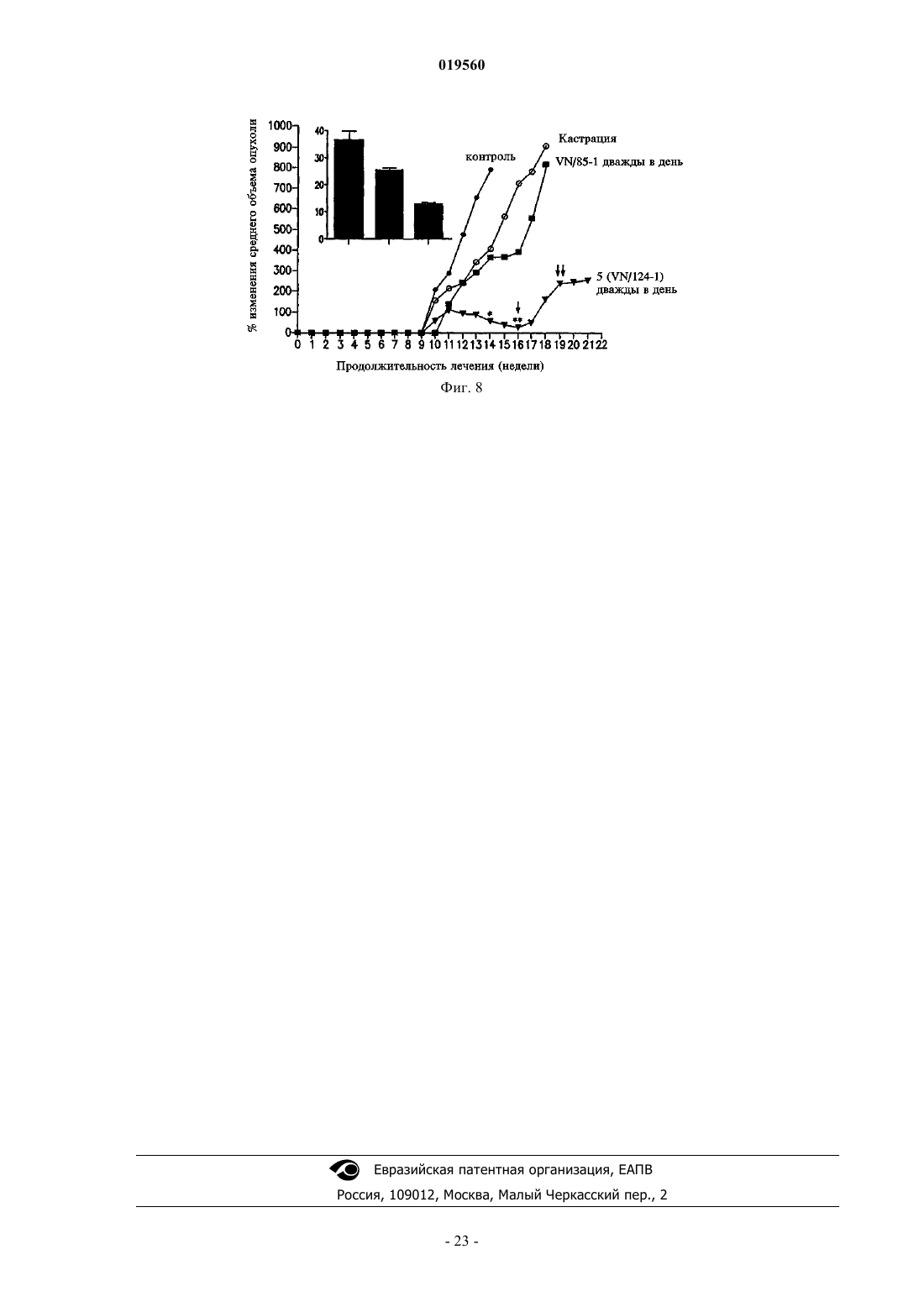
2. Способ по п.1, в котором указанным заболеванием простаты является рак простаты или гиперплазия простаты.
3. Способ лечения заболевания простаты, включающий введение нуждающемуся в лечении субъекту композиции, содержащей эффективное количество соединения со структурной формулой
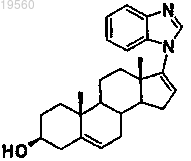
или его фармацевтически приемлемой соли и физиологически приемлемый наполнитель.
4. Способ по п.3, в котором указанным заболеванием простаты является рак простаты или гиперплазия простаты.
5. Способ по п.3, в котором композицию вводят перорально.
6. Способ по п.3, в котором композицию вводят пероральным введением или введением, отличным от перорального, выбранным из группы, включающей парэнтеральное, энтеральное, внутрибрюшинное, наружное, чрескожное, конъюнктивное, назальное, местное, аэрозольное, ингаляционное, внутривенное, внутримышечное, защечное, подъязычное, ректальное, внутриартериальное и интратекальное введение.
Текст
СПОСОБ ЛЕЧЕНИЯ ПРОСТАТЫ (ВАРИАНТЫ) Настоящее изобретение относится к способу лечения заболеваний простаты, в том числе рака простаты и гиперплазии простаты. В одном из вариантов настоящего изобретения способ лечения включает введение нуждающемуся субъекту эффективного количества соединения или его фармацевтически приемлемой соли. В еще одном варианте настоящего изобретения способ лечения заболеваний простаты включает введение нуждающемуся субъекту композиции,которая содержит эффективное количество вышеуказанного соединения или его фармацевтически приемлемой соли и физиологически приемлемый наполнитель. Область техники к которой относится изобретение Настоящее изобретение относится к способу лечения заболеваний простаты, в том числе рака и гиперплазии простаты, посредством стероидных С-17 гетероарильных ингибиторов человеческого фермента CYP 17 и антагонистов природных (дикого типа) и мутантных андрогеновых рецепторов (AR). Предшествующий уровень техники Рак простаты (РСА) является наиболее распространенной злокачественной опухолью и причиной смертности от рака в пожилом возрасте в мире. Если не считать рака легких, РСА является наиболее распространенной формой рака у мужчин и находится на втором месте среди причин смертности среди мужчин в Америке. Предполагается, что в Соединенных Штатах в этом году (2004) будет диагностировано 230000 новых случаев рака простаты и около 23000 мужчин умрут от этого заболевания (Jemal et al.,Cancer Statistics, 2004. CA Cancer J. Clin., 2004, 54, 8-29). За период с 1992 по 1999 г. среднее количество случаев РСА среди афроамериканцев было на 59% выше, чем среди европейцев (American Cancer Society- Cancer Facts and Figures 2003), а средная доля смертности - более чем в два раза выше, чем у европейцев. Андрогены играют важную роль в развитии, росте и прогрессировании РСА (McConnell, J. D., "Physiological basis of endocrine therapy for prostatic cancer", Urol. Clin. North Am., 1991, 18: 1-13). Наиболее важная роль при этом принадлежит тестостерону (Т) и дигидротестостерону (DHT). Около 90% тестостерона синтезируется в яичках, а остальной тестостерон (10%) - в надпочечниках. Далее Т превращается в более эффективный андроген DHT с помощью фермента стероидной 5-редуктазы, локализованной главным образом в простате (Bruchovsky et al., "The conversion of testosterone to 5-androstan-17-ol-3-oneby rat prostate in vivo и in vitro", J. Biol. Chem., 1968, 243, 2012-2021). Huggins с соавторами предложили андрогеновую депривацию в качестве терапии при развивающемся и метастазирующем РСА в 1941 г.gland.", Arch. Surg., 1941, 43, 209-212). Впоследствии было показано, что наилучшие результаты на множественных выборках больных РСА демонстрирует терапия, направленная на удаление андрогенов."GnRH антагонистов остается стандартным способом лечения большинства пациентов с раком простаты. Хирургическая или медикаментозная орхидектомия снижает или полностью подавляет продукцию андрогена яичками, но не действует на синтез андрогена надпочечниками. В нескольких исследованиях сообщалось, что комбинация орхидектомии с лечением антиандрогенами, чтобы подавить действие андрогенов надпочечников, существенно увеличивает выживаемость пациентов с РСА (Crawford, et al., "Aandrogen blockade in advanced prostate cancer", Prostate, 1994, 5 (SuppL), 17s-22s). В недавней статье Mohler с соавторами (Mohler et al., "The androgen axis in recurrent prostate cancer", CHn. Cancer Res., 2004, 10,440-448) было четко продемонстрировано, что Т и DHT обнаруживаются в тканях с рецидивирующим РСА в концентрациях, достаточных для активации андрогеновых рецепторов. Кроме того, Sawyer с соавторами (Chen et al., "Molecular determinants of resistance to antiandrogen therapy." Nat. Med., 2004, 10, 3339) способом microarray-based profiling на модели изогенных ксенотрасплантантов с РСА обнаружили,что умеренное увеличение уровня mRNA андрогеновых рецепторов было единственным изменением связанным с развитием резистентности к антиандрогенной терапии. Специфичные соединения, сильно ингибирующие синтез андрогена в яичках, надпочечниках и других тканях, могут быть более эффективными при лечении РСА (Njar, V.C.O.; Brodie, A. M. H., "Inhibitors of 17-hydroxylase-C17,20-lyase (CYP17):Potential agents for the treatment of prostate cancer", Current Pharm. Design, 1999, 5: 163-180). В яичках и надпочечниках последняя стадия биосинтеза Т включает две ключевые реакции, которые происходят последовательно и катализируются одним ферментом - цитохром Р 450 монооксигеназой 17-гидроксилазой/17,20-лиазой (CYP 17) (Hall P. F., "Cytochrome P-450 C21scc: one enzyme with twoactions: Hydroxylase и lyase", J Steroid Biochem. Molec. Biol, 1991, 40, 527-532). Кетоконазол - противогрибковый агент и хорошо действующий ингибитор ферментов Р 450 является также умеренным ингибитором CYP 17 и используется в клинике при лечении РСА (Trachtenberg et al., "Ketoconazole: A novel andrapid treatment for advanced prostatic cancer", J Urol. 1983, 130, 152-153). Сообщается, что тщательное планирование лечения может приводить к пролонгированным ответам у пациентов, в других случаях устойчивых к гормональной терапии (Muscato et al., "Optimal dosing of ketoconazole and hydrocotisone leads tolong responses in hormone refractory prostate cancer", Proc. Am. Assoc. Cancer Res., 1994, 13: 22 (Abstract. Кроме того, показано, что кетоконазол сохраняет активность у пациентов с РСА на поздней стадии, даже в случае прерывания приема флутамида. (Small et al., "Ketoconazole retains activity in advanced prostatecancer patients with progression despite flutamide withdrawal", J Urol, 1997, 157, 1204-1207). Хотя кетоконазол сейчас изъят из использования из-за его гепатотоксичности и других побочных эффектов, перечисленные факты позволяют предположить, что более эффективные и селективные ингибиторы CYP 17 могли бы стать полезными агентами для лечения этого заболевания, в том числе прогрессирующего и у пациентов, которые могут быть гормонорезистентными.-1 019560 Известно множество стероидных и нестероидных ингибиторов CYP 17 и показано, что некоторые являются эффективными ингибиторами продукции тестостерона на модели грызунов (Njar and Brodie,см. выше). Jarman и соавторы описали гормональное воздействие своего наиболее эффективного ингибитора CYP 17 абиратерона (abiraterone) у пациентов с раком простаты (О' Donnell et al.," Hormonal impactof the 17-hydroxylase/C 17,20-lyase inhibitors abiraterone acetate (CB7630) in patients with prostate cancer",Br. J. Cancer, 2004, 90: 2317-2325). Показано, что некоторые из эффективных ингибиторов CYP17 также ингибируют 5-редуктазу и/или являются эффективными антиандрогенами с мощной противоопухолевой активностью. (Njar и Brodie, см. выше, и Long et al., "Antiandrogenic effects of novel androgen synthesisinhibitors on hormone- dependent prostate cancer." Cancer Res., 2000, 60, 6630-6640). Другие аналоги ингибиторов человеческого фермента CYP 17 и антагонистов природных (дикого типа) и мутантных андрогеновых рецепторов (AR) приведены в патентах U.S. Patent Nos. 5994335; 6200965 и 6444683. Сущность изобретения Стероидные С-17 бензоазолы, пиримидиноазолы (азабензоазолы) и диазины являются эффективными ингибиторами человеческого фермента CYP 17, а также эффективными антагонистами природных(дикого типа) и мутантных андрогеновых рецепторов (AR). Способы синтеза стероидных С-17 бензоазолов и пиримидиноазолов включают этап нуклеофильного винилового замещения по типу "присоединения-элиминирования" с участием 3-ацетокси-17-хлоро 16-формиландроста-5,16-диена или его аналогов и бензоазольных или пиримидиноазольных нуклеофилов. Способы синтеза стероидных С-17 диазинов включают этап катализируемой палладием реакции кросс-сочетания с участием 17-иодоандроста-5,16-диен-3-ола или его аналогов и трибутилстаннилдиазинов. Наиболее эффективными ингибиторами CYP 17 были: 3-гидрокси-17-(1 Н-бензимидазол-1 ил)андроста-5,16-диен (5, кодовое название VN/124-1), 3-гидрокси-17-(51-пиримидил)андроста-5,16 диен (15) и 17-(1 Н-бензимидазол-1-ил)андроста-4,16-диен-3-он (6), для которых значения IC50 были 300,500 и 915 нМ соответственно. Соединения 5, 6, 14 и 15 эффективно предотвращали связывание 3H-R1881(метилтриенолон, стабильный синтетический андроген) как с мутантными и LNCaP AR, так и с AR дикого типа, причем в последнем случае эффективность связывания была в 2.2 - 5 раз выше. Было показано также, что соединения 5 и 6 являлись эффективными полными антагонистами AR. Исследования на клетках показали, что соединения 5 и 6 ингибировали рост стимулированных DHT клеток рака простатыLNCaP и LAPC4, при этом значения IC50 находились в низком микромолярном диапазоне (т.е.10 мкМ). Их эффективность в качестве ингибиторов была сравнима с касодексом, но заметно выше флутамида. Фармакокинетика соединений 5 и 6 была исследована на мышах. Через 30 и 60 мин после введения соединений 5 и 6 подкожно из расчета 50 мг/кг, их содержание в плазме составляло соответственно 16,82 и 5,15 нг/мл. Оба соединения быстро выводились из плазмы (время полужизни соответственно 44,17 и 39,93 м) и через 8 ч там не обнаруживались. Следует отметить, что соединение 5 быстро превращалось в метаболит, предположительно идентифицированный как 17-(1H-бензимидазол-1-ил)андроста-3-он. В тестах in vivo соединение 5 оказалось очень эффективным ингибитором роста андрогензависимых человеческих ксенотрансплантатов опухоли простаты LAPC4, в то время как соединение 6 в этих же условиях было неэффективным. Соединение 5 (50 мг/кг, дважды в день) вызывало 93,8% уменьшение (Р = 0,00065) среднего конечного объема опухоли по сравнению с контролем и было значительно эффективнее, чем кастрация. Согласно нашим данным, это первый пример анти-гормонального агента (ингибитора синтеза андрогенов (ингибитор CYP 17)/антиандроген), который подавлял андроген-зависимый рост опухоли простаты значительно эффективнее, чем кастрация. Учитывая эти впечатляющие противораковые свойства, соединение 5 и другие могут быть использованы при лечении рака простаты. Впервые раскрываются эффективные ингибиторы CYP 17/антиандрогенов - это 17-бензоазолы, 17 пиримидиноазолы и 17-диазины (см., например, схемы 1 и 2, где приведены примеры получения соединений и которые могут быть по аналогии применены к другим структурам, как описано ниже). Побудительным мотивом для получения этих С-17 гетероарильных стероидов было стремление включить структурные фрагменты бензимидазола, бензотриазола, пиримидиноазола и диазина, также называемые "привелигированными субструктурами" (Nicolaou et al., "Natural product-like combinatorial libraries based onEvans et al. (J Med. Chem., 1988, 31, 2235-2246), чтобы описать структурные мотивы, способные взаимодействовать с рядом непохожих мишеней. Эти темплаты, особенно темплат бензимидазола, продолжают привлекать широкое внимание в медицинской химии из-за многообразия их биологической активности и их присутствия в большинстве используемых лекарств (Nicolaou et al., above). Различные стероидные С-17 бензоазолы, пиримидиноазолы (азабензоазолы) и диазины, которые являются эффективными ингибиторами человеческого фермента CYP 17/антиандрогенами предтавлены общей формулой I где циклическая структура ABC состоит из фрагментов А, В и С стероида или его аналогов, которые могут содержать заместители; является двойной связью или, если соединение представляет собой 17-(1H-бензимидазол-1 ил)андрост-3-он, одинарной связью; иX - необязательно содержащий заместители бензимидазол, бензотриазол, пиримидиноимидазол(пурин), пиримидинотриазол или диазин, при этом структурные фрагменты бензимидазола, бензотриазола и пиримидиноимидазола связаны со стероидным остатком через атом азота пятичленного цикла, а диазиновые группы связаны со стероидным остатком через атом углерода диазинового цикла. Фармацевтически приемлемые соли стероидных С-17 бензоазолов, пиримидиноазолов (азабензоазолов) и диазинов, представленных общей формулой I, также являются эффективными ингибиторами человеческого фермента CYP 17/антиандрогенами. Дополнительные заместители циклической структуры ABC включают один или больше следующих групп: алкил и галогенированный алкил (предпочтительно C1-6); алкенил и галогенированный алкенил(предпочтительно С 1-6), включая и такие остатки, когда двойная связь непосредственно соединена с циклической структурой; галоген; амино; аминоалкилен; гидроксиимино и гидрокси. Кроме того, атомы водорода на соседних атомах углерода циклической структуры ABC могут быть удалены и заменены на дополнительную связь между соседними атомами углерода с образованием двойной связи между этими атомами в циклической структуре. Предпочтительными дополнительными заместителями в циклической структуре ABC являются метильные группы в 10 и/или 13 положениях структуры. Дополнительные заместители остатков бензимидазола, бензотриазола, пиримидиноимидазола, пиримидинотриазола или диазина включают галоген, амино, аминоалкилен, гидрокси, -SH, -S-алкил, алкил и галогенированный алкил (предпочтительно C1-6). Эти дополнительные заместители будут прикрепляться к атомам углерода, принадлежащим структурным единицам бензимидазола, бензотриазола, пиримидиноимидазола, пиримидинотриазола или диазина. Далее показаны структурные формулы бензимидазола, бензотриазола, пиримидиноимидазола, пиримидинотриазола и диазина гдеозначает точку присоединения стероидного остатка. В циклической структуре ABC цикл С обычно не содержит заместителей за исключением, предпочтительно, алкила, в особенности метила, связанного с углеродом, общим для колец С и D и расположенным рядом с гетероарильным заместителем С-17, т.е. в позиции 13. Кольца А, В и С циклической группы ABC имеют традиционную структуру, основанную на 3 гидроксиандроста-5,16-диене или 3-оксоандроста-5,16-диене. Циклы А и В характеризуются одной из следующих структур 1-25: Далее приведены химические названия соединений, структура циклов АВ которых соответствует 1-25, а циклы С и D являются традиционными, где X - это бензамидазол. В вышеописанных соединениях X может также представлять собой бензотриазол, пиримидиноимидазол, пиримидинотриазол, пиразин или пиримидин. Соединение 1: 3-Гидрокси-3-метил-17-(1 Н-бензимидазол-1-ил)андроста-5,16-диен Соединение 2: 3-Фторо-17-(1 Н-бензимидазол-1-ил)андроста-5,16-диен Соединение 3: 3-Хлоро-17-(1 Н-бензимидазол-1-ил)андроста-5,16-диен Соединение 4: 3-Бромо-17-(1 Н-бензимидазол-1-ил)андроста-5,16-диен Соединение 5: 3-Иодо-17-(1H-бензимидазол-1-ил)андроста-5,16-диен Соединение 6: 3-Амино-17-(1 Н-бензимидазол-1-ил)андроста-5,16-диен Соединение 7: 17-(1 Н-бензимидазол-1-ил)андроста-3,5,16-триен Соединение 8: 17-(1 Н-бензимидазол-1-ил)андроста-2,4,16-триен Соединение 9: 17-(1 Н-бензимидазол-1-ил)-3-метиленандроста-5,16-триен Соединение 10:17-(1 Н-бензимидазол-1-ил)-3-метиленандроста-4,16-триен Соединение 11: 3,3-Дифторо-17-(1 Н-бензимидазол-1-ил)андроста-5,16-диен Соединение 12: 3,3-Дифторо-17-(1 Н-бензимидазол-1-ил)андроста-4,16-диен Соединение 13: 17-(1 Н-бензимидазол-1-ил)-3-метиленандроста-2,4,16-триен Соединение 14: 17-(1 Н-бензимидазол-1-ил)-3-метиленандроста-2,4,6,16-тетраен Соединение 15: 3,3-Дифторо-17-(1 Н-бензимидазол-1-ил)андроста-2,4,16-триен Соединение 16: 3,3-Дифторо-17-(1 Н-бензимидазол-1-ил)андроста-2,4,6,16-тетраен Соединение 17: 3-Гидроксиимино-17-(1 Н-бензимидазол-1-ил)андроста-5,16-диен Соединение 18: 3-Гидроксиимино-17-(1 Н-бензимидазол-1-ил)андроста-4,16-диен Соединение 19: 3-Гидроксиимино-17-(1 Н-бензимидазол-1-ил)андроста-2,4,16-триен Соединение 20: 3-Гидроксиимино-17-(1 Н-бензимидазол-1-ил)андроста-2,4,6,16-диен Соединение 21: 3-Гидрокси-17-(1 Н-бензимидазол-1-ил)эстра-1,3,5(10),16-тетраен Соединение 22: 3-Фторо-17-(1 Н-бензимидазол-1-ил)эстра-1,3,5(10),16-тетраен Соединение 23: 3-Хлоро-17-(1H-бензимидазол-1-ил)эстра-1,3,5(10),16-тетраен Соединение 24: 3-Бромо-17-(1H-бензимидазол-1-ил)эстра-1,3,5(10),16-тетраен Соединение 25: 3-Иодо-17-(1H-бензимидазол-1-ил)эстра-1,3,5(10),16-тетраен Примеры дополнительных заместителей гетероарильного цикла X, показаны на следующих далее структурах 26-40, где X - это бензимидазол. Кроме того, X может представлять собой замещенный бензотриазол, пиримидиноимидазол, пиримидинотриазол, пиразин или пиримидин. Другие примеры дополнительных заместителей для гетероарильного цикла X показаны в структурах 41-46, где X представляет собой замещенный С-17-азабензимидазол (т.е. пиримидиноимидазол или пурин). Обычно X представляет собой замещенный бензимидазол, бензотриазол, пиримидинотриазол,пиразин или пиримидин. Особенно эффективными ингибиторами человеческого фермента CYP 17/антиандрогенами являются соединения М 5, М 6, М 9 и M10, структуры которых приведены ниже. Настоящее изобретение относится к способу лечения заболеваний простаты, включающий введение нуждающемуся в таком лечении пациенту эффективного количества соединения или его фармацевтически приемлемой соли. Термин "лечение" следует понимать в традиционном смысле, то есть, это обслуживание или забота о пациенте с целью борьбы с уменьшением, ослаблением, облегечением, улучшением и т.д. одного или нескольких симптомов, связанных с заболеванием простаты. Примеры заболеваний простаты, которые можно лечить, включают, например, гиперплазию простаты (ВРН) и рак простаты (например, аденокарцинома простаты). Конкретные дозировки и частота приема препарата могут зависеть от множества факторов, включая активность специфических активных соединений, их метаболическую стабильность и продолжительность действия, скорость выведения, режим и время введения, возраст, вес тела, состояние здоровья, пол,режим питания и т.д. пациента, а также интенсивность рака или гиперплазии простаты. Можно назначать любое эффективное количество соединения, например, приблизительно, от 1 до 500 мг в день, более конкретно, приблизительно, от 50 до 150 мг в день. Соединение может вводиться в любой форме и любым эффективным способом, включая, например, оральный, парентеральный, энтеральный, внутрибрюшинный, топический, трансдермальный (например, с помощью стандартных пластырей), глазной, назальный, местный, неоральный (например, с помощью аэрозолей, спреев, ингаляций), подкожный, внутривенный, внутримышечный, буккальный, сублингвальный, ректальный, вагинальный, внутриартери-5 019560 альный, интратекальный и т.д. маршруты введения. Соединение формулы может вводиться по одиночке или совместно с любыми другими ингредиентами, активными или неактивными, например с физиологически приемлемыми носителями, используемыми для приготовления фармацевтических композиций. В еще одном варианте настоящего изобретения способ лечения заболеваний простаты включает введение нуждающемуся субъекту композиции, которая содержит эффективное количество соединения формулы или его фармацевтически приемлемой соли и физиологически приемлемый наполнитель. Краткое описание чертежей Фиг. 1. Показывает влияние соединений 5, 6 и касодекса на транскрипциональную активность люциферазы, опосредуемую LNCaP-AR, на примере клеток рака простаты LNCaP-ARR2-Iu. Находящиеся в культуральной среде без стероидов клетки обработали либо только средой, либо возрастающими концентрациями соединения 5 или касодекса совместно с 1 нМ DHT или без него в течение 18 ч. Клетки протестировали на люциферазную активность, как будет описано ниже. Столбики соответствуют среднему значению световых единиц (отсчет за одну секунду/единицу протеина, то есть, относительная люциферазная активность) по результату из трех ячеек трех различных экспериментов. Фиг. 2 и 3. Показывают эффекты соединения 5, 6 и касодекса на рост клеток рака простаты (a)LNCaP и (b) LAPC-4. Клетки были выращены в среде без стероидов, после чего помещены в платы. Ячейки (по три на каждое измерение) обработали возрастающими концентрациями соединения 5, 6 или касодекса и DHT, как будет описано ниже. Процент ингибирования роста через 7 дней обработки (по сравнению с контролем) определяли с помощью опыта WST-1. Результаты представляют собой средние значения и стандартные отклонения для трех экспериментов, выполненных в трех повторах. Фиг. 4. Показывает типичную хроматограмму HPLC для соединений 5, 16 (внутренний стандарт) и метаболита из мышиной плазмы. Времена удержания для соединения 16, метаболита и соединения 5 составляли 11,5, 17,3 и 21,6 мин соответственно. Фиг. 5. Показывает фармакокинетические профили соединений 5 и 6 после введения подкожно одной болюсной дозы самцам мышей SCID. Каждая точка соответствует среднему значению концентрации в плазме, полученной для трех мышей. Стандартные отклонения (не показано) соответствуют 5-8% от средних значений. Фиг. 6. Показывает фармакокинетические профили соединения 5 и метаболита после введения подкожно одной болюсной дозы (100 мг/кг.bw) соединения 5 самцам мышей. Фиг. 7. Показывает противораковую активность in vivo соединений 5, 6 и орхидектомии на рост опухолей простаты LAPC-4 у самцов мышей SCID. Группы по пять мышей с опухолями LAPC-4 принимали соединение 5 (0,15 или 0,30 ммоль/кг/день). Объемы опухолей измеряли еженедельно, процент изменения объема опухоли был определен через 28 дней после начала лечения. Стандартные отклонения объема опухолей (не показано) составляли 10-12% от средних значений. Фиг. 8. Показывает эффекты соединения 5, 16 и орхидектомии на образование и рост опухолей простаты LAPC4 у самцов мышей SCID. 3107 клеток LAPC-4 ввели подкожно в дорсальный бок мышамSCID. Одну группу мышей кастрировали. Другая группа получала либо только среду, либо соединения 5(0,15 ммоль/кг дважды в день) или 16 (0,15 м моль/кг дважды в день). Ежедневное лечение соединениями 5 или 16 начали в первый день после инокуляции клеток. Объемы опухолей измеряли еженедельно, через 16 недель лечения определили процент изменения объема опухолей.на фиг. 8 означает значимое отличие соединения 5 от контроля, кастрации и соединения 16 на 14-й неделе (Р = 0,00065, 0,05 и 0,0097, соответственно).означает значимое отличие соединения 5 от кастрации и соединения 16 на 16-й неделе(Р = 0,047 и 0,0047, соответственно), - : Стрелками показаны периоды уменьшения вводимой дозы соединения 5. Сведения, подтверждающие возможность осуществления изобретения Были исследованы следующие параметры вышепредставленных соединений: ингибиторная активность по сравнению с CYP 17 и стероидной 5-редуктазами; связывание с андрогеновыми рецепторами и трансактивация андрогеновых рецепторов; антипролиферативный эффект в опытах с двумя линиями клеток рака простаты LNCaP и LAPC-4. Исследование фармакокинетики соединений 5 и 6 было проведено на мышах, исследование противоопухолевой активности против клеток карциномы простатыLAPC-4 in vivo было также проведено на мышах. Все описанные здесь соединения, за исключением соединения 15, относятся к группам соединений, описанным в работах Haidar et al., "Novel steroidal pyrimidil ингибиторов of P450 17 (17-hydroxylase/C17-20-lyase", Arch. Pharm. Med Chem., 2001, 334, 373-374;and Haidar et al., и "Effects of novel 17-hydroxylase/C17,20-lyase (P45017, CYP17) ингибиторов биосинтеза андрогенов in vitro и in vivo", J Steroid Biochem. Molec. Biol, 2003, 84, 555-562. Способы получения 17-бензоазолов и 17-диазинов приведены на схемах 1 и 2 соответственно. Эти способы могут быть применены и к другим описанным здесь аналогам. Схема 1.(i) POCl3-DMF, CHCl3, Ar, кипячение; (ii) бензимидазол, K2CO3, DMF, Ar, 80C; (iii) 10% Pd на активированном древесном угле, PhCN, кипячение; (iv) 10% метанольного KOH, Ar, rt.; (v) Al(i-PrO)3,1-метил-4-пиперидон, толуол, кипячение; (vi) бензо-1H-1,2,3-триазол, K2CO3, DMF, Ar, 80C; (vii) ксилен, Ar, кипячение.iv) (5-трибутилстаннил)пиримидин/Pd(PPh3)4 Ключевой интермедиат для синтеза 17-бензазолов, а именно 3-ацетокси-17-хлоро-16 формиландроста-5,16-диена (2) был получен из соединения (1) с помощию стандартной процедуры, описанной ранее в статьях Njar et al., "Nucleophilic vinylic "addition-elimination" substitution reaction of 3acetoaxy-17-chloro-16-formylandrosta-5,16-diene: A novel и general route to 17-substituted-16-steroids. Part 1.Med. Chem. Lett., 1996, 6, 2777 - 2782; и "Novel 17-azolyl steroids; potent ингибиторов of cytochrome P450 17-hydroxylase/17,20-lyase (P45017): Potential agents for the treatment of prostate cancer", J Med. Chem.,1998, 41, 902 - 912). Обработка соединения 2 бензимидазолом в присутствии K2CO3 в DMF при температуре около 80 С позволила получить ожидаемый 3-ацетокси-17-1H-бензимидазол 3 с практически ко-7 019560 личественным выходом. Соединение 3 хорошо деформилируется в присутствии 10% палладия на активированном угле в кипящем бензонитриле, давая соединение 4 с 93% выходом. Гидролиз полученного соединения позволяет получить требуемый 3-гидрокси-17-бензимидазол 5. Модифицированное окисление соединения 5 по реакции Опеннауэра позволяет получить соответствующий 4-3-оксоаналог, 6. Реакция соединения 2 с бензотриазолом в присутствии K2CO3 в DMF при температуре около 80 С позволила получить ожидаемый 3-ацетокси-17-бензо-1H-1,2,3-триазол 7b с очень хорошим выходом,побочным продуктом был региостереомер 7 а 2 Н-1,2,3-триазол, его выход примерно 5%. Эти два региостереомера были легко разделены с помощью флэш-хроматографии (flash column chromatography (FCC на силикагеле и легко идентифицированы с помощью спектров NMR. Так, четыре ароматических протона симметричного 2 Н-1,2,3-триазола 7 а дают сигнал в виде двух пар дублетов при 7.43, 7.45, 7.88 и 7.90, в то время как четыре ароматических протона несимметричного 1 Н-1,2,3-триазола 7b дают мультиплет при 7.46 (2 Н) и дублеты при 7.57 (1 Н) и 8.15 (1 Н), соответственно. Кроме того, сигнал протона 16-СНО в соединении 7 а значительно сдвинут "вниз" по сравнению с сигналом этого протона в соединении 7b [ 10,66 и 9,59 соответственно). Деформилирование соединения 7b с генерацией катализатораRh(1,3-бис(дифенилфосфино)пропан)2+Cl- [Rh(dppp)2+Cl-] in situ в кипящем ксилене дает соединение 8,последующий гидролиз 3-ацетоксигруппы позволяет получить целевое соединение 3-гидрокси-17(бензо-1 Н-1,2,3-триазол-1-ил)андроста-5,16-диен (9) с 90% выходом. Окисление 9 дает соединение 10 с хорошим выходом. Синтез 17-диазинов, (17-диазина 14 and 17-пиримидина 15) был начат с легко доступного дегидроэпиандростерона (11, схема 2). Его превратили в соответствующий 17 гидразон 12 обработкой гидразин гидратом и гидразин сульфатом, как было ранее описанов статье Potter с соавторами " А convenient,large-scale synthesis of abiraterone acetate [3-acetoxy-17(3-pyridyl)androsta-5,16-dien], a potential new drugfor the treatment of prostate cancer. Org. Prep. Proc. Int., 1997, 29, 123-128. Обработка соединения 12 иодом в присутствии 1,1,3,3-тетраметилгуанидина позволила получить винил 17-иодид 13 с очень хорошим выходом. Катализируемые палладием реакции кросс-сочетания (Choshi et al., "Total synthesis of Grossularines-1 и -2." J Org. Chem., 1995, 60, 5899-5904) соединения 13 с (2-трибутилстаннил)пиразином или (5 трибутилстаннил)пиримидином шли с образованием 3-гидрокси-17-(2-пиразил)андроста-5,16-диена (14,15%), и 3-гидрокси-17-(5-пиримидил)андроста-5,16-диена (15, 10%), соответственно. Низкие выходы этих двух кросс-реакций вероятнее всего связаны с нестабильностью станнилдиазиновых реагентов в условиях происходящей реакции. Структуры целевых соединений 14 и 15 легко идентифицировать методом NMR: три неэквивалентных протона 17-пиразина в соединении 14 дают сигнал в виде трех синглетов при 8,35, 8,48 и 8,70, в то время как эти же протоны 17-пиримидина в соединении 15 дают следующие сигналы: два неэквивалентных протона выглядят как синглет 8,73, и один протон дает сигнал при 9,07. Более того, влияние 17-диазиновых групп в соединениях 14 и 15 является причиной различий в химических сдвигах соответствующих 16-олефиновых протонов по сравнению с 16-ым протоном в исходном А 16-17-иодиде 13: сигнал 16-Н в соединении 14 выглядит как синглет при 6,77, который значительно менее экранирован по сравнению с 16-Н в соединении 13 ( 6,14); 16-Н в соединении 15 обнаруживается при 6,11, также как в соединении 13. Как указано выше, о соединении 15 ранее было указано в вышеупомянутой работе Haidar и соавторы, однако его способ синтеза отличается от описанного здесь. Репрезентативные образцы новых соединений были затем подвергнуты расширенному тестированию in vitro и in vivo, как подробно описано в следующих далее разделах. Без дополнительных разъяснений предполагается, что компетентный специалист сможет с помощью представленного описания реализовать настоящее изобретение в максимальной степени. Следующие далее предпочтительные конкретные примеры реализации изобретения, таким образом, приведены исключительно для иллюстративных целей и ни коим образом не ограничивают остальную часть описания. Далее и во всех примерах все температуры выражены в градусах по Цельсию, все доли и проценты по весу, если не указано иначе. Примеры Биологические эксперименты Изучение ингибирования CYP 17: Анализ ингибирования CYP 17 проводился в соответствии с ранее описанной методикой, согласно которой в качестве источника фермента использовали Е. coli, экспрессирующие интактный цитохром Р 450 с 17(Grigoryev et al., "Cytochrome P450c17-expressing Escherichia coli as a first-step screening system for 17hydroxylase-C17,20-lyase inhibitors", Anal. Biochem.; 1999, 267, 319-330; и "Effects of new 17hydroxylase/C17,20-lyase inhibitors on LNCaP prostate cancer cell growth in vitro and in vivo", Br. J. Cancer, 1999,81, 622-630). Значения IC50 соединений были определены из кривых доза-ответ и представлены в табл. 1.-8 019560 Таблица 1. Ингибирующая активность по отношению к CYP17 и 5-редуктазе и связывание рецепторов андрогена новыми 17-гетероарильными соединениями Синтез VN/85-1 был описан ранее (Njar et al., см. выше) Абиратерон синтезировали по методике Potter et al (A convenient, large-scale synthesis of abiraterone ацетат [3-ацетокси-17(3-pyridyl)androsta-5,16-diene], a potential new drug for the treatment of prostate cancer. Org. Prep. Proc. Int., 1997, 29, 123-128).IC50 представляет собой концентрацию ингибитора, требуемую, чтобы заингибировать активность фермента на 50%, по результатам двух повторов при определении ингибирования CYP 17, трех повторов для 5-редуктазы и для определения связывания AR.IC50 представляет собой концентрацию соединения, требуемую, чтобы вытеснить 50% [3H]R1881 из андрогенового рецептора.d Клеточная линия рака простаты (DU-145), экспрессирующая фермент типа 1; субстрат: 5 нМ [13 Н]андростенедиона. е Фермент из ткани ВРН (фермент типа 2), 125 мкг протеина, субстрат: 210 нМ [1,23 Н]тестостерона.ni = нет ингибирования до концентрации 10 мкМ. - = не определено. В той же аналитической системе для сравнения определили IC50 кетоконазола, абиратерона (проходящего клинические испытания ингибитора CYP 17 (O'Donnell, выше), диаграмма 1). Диаграмма 1. Структуры абиратерона и VN/85-1 и 3-гидрокси-17-(1 Н-имидазол-1-ил)андроста 5,16-диена (VN/85-1, соединение 16, диаграмма 1, считается наиболее сильным ингибитором CYP 17(Njar et al., Current Pharm. Design, 1999, 5: 163-180; и J. Med. Chem., 1998, 41, 902-912, выше. Некоторые новые 17-гетероциклические соединения демонстрируют мощное ингибирование CYP 17 с IC50 300-915 нМ. Бензимидазолы 5 и 6 ингибируют фермент в 4-6 раз сильнее, чем бензотриазолы 9 и 10. Результат позволяет предположить, что на ингибиторную активность влияет электронная структура 17 гетероциклов. Более того, соединения с 5-3-ольной функциональностью, 5 и 9, являются по меньшей мере в три раза более сильными ингибиторами, чем соответствующие аналоги с функциональной группой 4-3-она, то есть, соединения 6 и 10 соответственно. Эти результаты противоречат нашим предыдущим данным по простым 17-азольным ингибиторам CYP 17. В той серии экспериментов не было обнаружено заметного различия в ингибирующей способности между 5-3-ольными азолами и соответствующими 4-3-оновыми аналогами (Njar et al., J. Med. Chem., 1998, 41, 902 - 912, выше). Возможное объяснение этого связано с тем, что более объемные бензоазолы по-другому связываются с активным сайтом фермента, так что становится важным эффект (эффекты) группы в третьем положении. Связывание субстрата или ингибитора с гемовым компонентом некоторых цитохромов Р 450 изучено методом UV-vis дифференциальной спектроскопии (Jefcoat С. R., "Measurement of substrate and inhibitor binding to microsomal cytochrome P450 by optical difference spectroscopy", Methods Enzymol, 1978, 52, 258-279). Данный метод был расширен с помощью стандартной процедуры, ранее описанной авторами изобретения (Njar etal., Bioorg. Med. Chem. Lett., 1996, 6, 2777-2782; и J Med. Chem., 1998, 41, 902-912). Соединения 5 и 9 индуцируют дифференциальный спектр типа II, что означает координацию стероидного азота (N-3 бензоимидазолового или бензотриазолового цикла) к гемовому железу CYP 17 с образованием низкоспинового железа. Пиковые положения максимума Соре комплекса фермента с 5 и 9 (426 нм) соответствуют имеющейся информации по связыванию азот-содержащих лигандов с системами CYP, а также соответствуют данным авторов изобретения для других 17-азолильных ингибиторов CYP 17 (Njar et al., Bioorg. Med.Chem. Lett., 1996, 6, 2777-2782; и J Med. Chem., 1998, 41, 902-912). Взаимодействие бензоазольного азота с гемовым железом CYP17 позволяет предположить объемную толерантность по 17 положению, так как сродство связывания 5 и 9 идентично сродству для менее стерически требовательного соединения 16,содержащего 17-имидазольную группу. Из двух изученных 17-диазинов, 17-пиримидин 15 (IC50 = 500 нМ), приблизительно, в 8 раз сильнее 17-пиразина 14 (IC50 = 3810 нМ). Что касается бензоазолов, настоящий результат показывает, что электронная природа 17-гетероциклов влияет на ингибирующую активность. Наконец, получены значенияIC50 для кетоконазола и абиратерона в той же системе (табл. 1). Самое сильное соединение изученной серии, 17-бензимидазол 5, показывает, приблизительно, в 4 и в 3 раза более сильное ингибирование, по сравнению с указанными соединениями, соответственно, хотя оно и слабее, чем 16. Ингибирование изозимов 5-редуктазы человека типа 1 и 2 in vitro На основании предыдущих данных, что некоторые ингибиторы CYP17 способны ингибировать ферменты 5-редуктазу человека, авторы изобретения кратко изучили эту способность рассматриваемой новой серии ингибиторов CYP17. Ингибирующую активность соединений 5, 6, 9, 10 и финастерида (для контроля) определяли на клеточной линии DU-145 (человеческий фермент типа 1) и гомогенатах ткани ВРН человека (человеческий фермент типа 2), как описано в работе Hartmann et al., "Synthesis and evaluation of 2 '-substituted 4-(4'-carboxy- or 4'-carboxymethylbenzylidene)-N-acylpiperidines: Highly potent and invivo active steroid 5-reductase type 2 inhibitors", J. Med. Chem., 2002, 45, 3406-3417. Значения IC50 и процента ингибирования в концентрации 10 мкМ для некоторых соединений представлены в табл. 1. Сильное ингибирование ферментов типа 1 и 2 демонстрирует только соединение 6 (IC50 = 770 и 480 нМ, соответственно), хотя оно и в несколько раз слабее финастерида (IC50 = 60 и 2 нМ, соответственно). Анализы связывания с LNCaP и PC-3AR андрогеновыми рецепторами Ранее авторы изобретения уже показали, что некоторые из ингибиторов CYP17 являются сильными антиандрогенами для мутантных AR и AR дикого типа (Long et al., Gregoriyev et al. and Njar et al., J. Med.Chem., 1998, 41, 902-912, выше). В связи с этим интересно было оценить способность серии вышеописанных ингибиторов CYP17 связываться с указанными рецепторами. Конкуренция с AR определялась с использованием меченого R1881 ([3H]-R1881) в андроген-чувствительных клетках LNCaP, экспрессирующих мутантные AR, и андроген-нечувствительных клетках РС-3, стабильно трансфецированных AR дикого типа (называются РС-3 AR). Соединения 5, 6, 14 и 15 в наномолярном диапазоне концентраций эффективно конкурируют с меченым R1881 за связывание с AR обоих типов, причем это связывание доза-зависимо (фигуры не показаны). Соединения 5, 6, 14 и 15 демонстрируют значения IC50 384, 242, 336 и- 10019560 374 нМ, соответственно (табл. 1) с AR дикого типа, они от 29 до 45 раз более эффективны в этом отношении, чем клинически используемый антиандроген флутамид (IC50= 10,985 нМ). Как видно из табл. 1,сродство связывания соединений 5 и 6 с мутантными AR сравнимо с касодексом, используемым в настоящее время антиандрогеном, но снова превосходит данные для флутамида. Однако известно, что биологическая активность флутамида вызвана, в основном, его метаболитом, гидроксифлутамидом, который является значительной более эффективным антагонистом AR. Влияние агентов на опосредуемую AR транскрипцию мутанта LNCaP Далее авторы изобретения попытались выяснить, могут ли соединения 5 и 6 функционировать как агонисты или антагонисты AR. Исследуемое регулируемой андрогенами активации транскрипции выполняли на клетках LNCaP, временно трансфецированных репортерным конструктом пробазин люциферазы AARZ-Luc (анализ активности люциферазы) (Kim et al., "Synergism of cytoplasmic kinases in IL6induced ligand-independent activation of androgen receptor in prostate cancer cells", Oncogene, 2004, 25:18381844; и Zhang etal., "A Small composite probasin promoter confers high levels of prostate-specific gene expression through regulation by androgens and glucocorticoids in Vitro и in Vivo", Endocrinology, 2000, 141: 46984710). Соединения 5, 6 или касодекс в концентрациях 0,1 и 10 мкМ каждое не влияли на люциферазную активность, однако экспрессия люциферазы увеличивалась, приблизительно в 99,6 раза после обработки 1.0 нМ DHT в течение 18 ч (фиг. 1). Более того, экспрессия люциферазы, индуцированная экспозицией 1.0 нМ DHT, снижалась концентрационно-зависимым образом и приблизительно одинаково под действием 5, 6 и касодекса, причем это снижение проходило приблизительно одинаково (фиг. 1). Совместно приведенные результаты позволяют предположить, что соединения 5 и 6, как и касодекс, не явлются полными или частичными агонистами AR и могут считаться сильными и чистыми андрогеновыми антагонистами. Хотя авторы изобретения не тестировали соединения на клетках РС-3 AR/LU, экспрессирующих AR дикого типа, они с большой вероятностью будут вести себя там сходным образом. Ранее авторы изобретения показали, что некоторые ингибиторы CYP17 более сопоставимы с касодексом, чем флутамид (Long et al., выше), и это, судя по всему, относится к рассматриваемым здесь новым соединениям. В целом, вышепредставленные соединения сильно взаимодействуют с AR обоих типов. Это может быть полезно при лечении пациентов с опухолями, экспрессирующими AR дикого или мутантного типа,или пациентов с усиленной экспрессией AR. Эффекты бензоазолов на рост клеток рака простаты LNCaP и LAPC-4 in vitro Исследована способность соединений 5 и 6 ингибировать пролиферацию мутантных клеток LNCaP,стимулированных 1 нМ DHT. Интенсивность пролиферации DHT-стимулированных клеток LNCaP, приблизительно, в 2 раза превосходит контроль без DHT (фиг. 2). Как видно из фиг. 2, соединения 5 и 6 ингибируют DHT-индуцированную пролиферацию клеток LNCaP доза-зависимым образом, значения IC50 составляют 6.0 и 1.8 мкМ, соответственно. В качестве положительного контроля использовали касодекс,он показывает похожее ингибирование DHT-индуцированной пролиферации клеток LNCaP (фиг. 2, IC50= 8,6 мкМ). Обработка андроген-чувствительной линии клеток простаты LAPC4 10 нМ DHT не привела к значимой индукции пролиферации клеток (фиг. 3). Другие исследователи также сообщают, что ответ клеток LAPC4 на андрогены выражен не в такой степени, как ответ клеток LNCaP (Thompson et al., "Androgen antagonist activity by the antioxidant moiety of vitamine E, 2,2,5,7,8-pentamethyl-6-chromanol in humanprostate carcinoma cells", MoUc. Carter Them., 2003, 2, 797-803). Однако соединения 5, 6 и касодекс демонстрируют доза-зависимое ингибирование на этой клеточной линии (фиг. 3), как и в случае клетокLNCaP. По своей способности ингибировать пролиферацию клеток LAPC4 соединения образуют следующий ряд: 65 касодекс, значения IC50 составляют 1,0, 3,2 и 10 мкМ, соответственно. Совместно полученные данные позволяют предположить, что соединения 5 и 6 могут блокировать способность DHT стимулировать пролиферацию клеток, что коррелирует с описанным выше связыванием с андрогеновыми рецепторами и их активацией. Соединения 5 и 6 относятся к числу наиболее эффективных антиандрогенов, известных в настоящее время. Фармакокинетика соединений 5 и 6 и метаболизм соединения 5 Фармакокинетика двух ведущих соединений 5 и 6 была изучена на самцах мышей линии SCID в соответствии с ранее описанной нами процедурой для других ингибиторов CYP 17 (Nnane et al., "Pharmacokinetic profile of 3-hydroxy-17-(1H-123-triazol-1-yl)androsta-5,16-diene (VN/87-1), a potent androgen synthesis inhibitor in mice", J. Steroid Biochem. Molec. Biol, 2001, 71, 145-152; и Handratta et al., "Potent CYP 17 Значения представляют собой среднееS.E., n = 5. При исследовании методом HPLC в обращенной фазе соединения 5 (время удержания (rt) = 21,6 мин) хорошо разрешалось от внутреннего стандарта (16, rt = 11,5 мин), метаболита (rt = 17,3 мин) и других эндогенных соединений из мышиной плазмы (фиг. 4). Полученные для соединения 5 кривые калибровки линейны и репродуцибельны (данные не показаны), вариабельность в одном анализе и между анализами составляет менее 10%, и предел детекции - 100 нг/мл. Метод HPLC был валидирован и использовался для мониторинга соединения 5 в мышиной плазме. Сразу после введения подкожно концентрация соединения 5 в плазме экспоненциально начинала уменьшаться, период полужизни составлял около 44.17 минут, скорость элиминирования достигала 56,5 мин-1. Клиренс соединения 5 из системной циркуляции составлял 1986.14 мл/ч/кг, оно не обнаруживалось спустя 6 ч после введения. В табл. 2 показаны расчетные параметры фармакокинетики для бесчастевой модели после подкожного введения соединения 5, основанные на концентрации вещества в плазме. На фиг. 5 показана кривая зависимости концентрации соединения 5 от времени после введения подкожно(50 и 100 мг/кг). Наблюдаемая плазматическая концентрация соединения 5 у мышей достигала пика через 30.0 минут после введения. Соединение 5 хорошо абсорбировалось из подкожной области, площадь под кривой зависимости его плазматической концентрации от времени после введения подкожно возрастала пропорционально дозе в интервале доз от 50 до 100 мг/кг. Более того, период полужизни элиминации и среднее время резидентности оставалось относительно постоянным при увеличении дозы от 50 до 100 мг/кг (табл. 1). Результаты показывают, что фармакокинетический профиль соединения 5 не зависит от дозы. Как показано на фиг. 6, из соединения 5 образуется значительное количество полярного метаболита(время удержания 17,3 мин, см. фиг. 4), он присутствовал в плазме на протяжении всех фармакокинетических исследований. Максимальное количество метаболита составляло 67,72%, оно достигалось через 2 ч после введения. Время удержания этого метаболита идентично соединению 6. Предварительно его идентифицировали методом LC-MS; его молекулярная масса (m/z 391 = М + Н+) соответствовала структуре 3-оксо-5,16 тетрагидросоединения 5 (то есть, 17-(1H-бензимидазол-1-ил)андрост-3-ону). Метаболит образовывался из соединения 5 путем окисления 3-ОН - 3-оксо с последующим восстановлением (под действием редуктаз) обоих двойных связей 5 и 16. Похожий метаболит ранее был идентифицирован у самцов мышей и образовывался из близко-родственного стероидного 17-имидазола (в результате окисления 3-ОН- 3-оксо с последующей изомеризацией двойной связи 5, Handratta et al., выше). Основной метаболит соединения 5, то есть 17-(1H-бензимидиазол-1-ил)андрост-3-он, может быть синтезирован из транс-андростерона; см. Схему 3. Ожидается, что у него будет также и аналогичная активность. Фармакокинетика соединения 6 in vivo у мышей не похожа на соединение 5 из-за относительно низкой Cmax и относительно более высокой скорости элиминирования (фиг. 5 и табл. 2). Кроме того, авторы изобретения не обнаружили метаболизма соединения 6 в плазме, что также отличает его от соединения 5. Эффекты соединений 5 и 6 на ксенотрансплантанты, выращенные в мышах SCID На основании впечатляющих результатов многочисленных биологических экспериментов in vitro,то есть, сильного ингибирования CYP 17, сильной антипролиферативной активности на клетках рака простаты и антиандрогенной активности, соединения 5 и 6 были отобраны для исследования противораковой эффективности in vivo на модели ксенотрансплантантов рака простаты человека LAPC4. В первом эксперименте определяли эффекты соединений 5 и 6 на рост хорошо установленных опухолей рака простаты LAPC4 у мышей SCID. В качестве эксперимента сравнения использовали кастрацию. Мыши с опухолями получали (n = 5/группа) одну или две дозы 5 или 6 (0,15 ммоль/кг раз в день или 0,15 ммоль/кг дважды в день). Объем опухолей измеряли еженедельно и сравнивали с контролем,получавшим "только среду", или кастрированными мышами. Кастрация привела к 55% снижению финального объема опухоли, по сравнению с контролем (фиг. 7). Введение вещества 5 по 0,15 ммоль/кг раз в день и 0,15 ммоль/кг два раза в день привело к снижению среднего финального объема опухоли на 41 и 86,5%, соответственно, по сравнению с опухолями у контрольных животных, получавших "среду" (фиг. 7). В отличие от превосходного эффекта соединения 5 на ингибирование роста опухоли у мышей соединение 6 было либо неэффективно в низких дозах, либо даже стимулировало рост опухоли, по сравнению с контролем (фиг. 7). Неспособность соединения 5 ингибировать рост опухоли LAPC4 in vivo особенно огорчает, так как это соединение очень эффективно ингибирует рост клеток РСА in vitro и является высоко эффективным полным антиандрогеном (см. фиг. 1). Значимое различие противораковой эффективности соединения 5 и 6 in vivo нельзя объяснить просто различием фармакокинетических свойств двух соединений. В настоящее время причины столь драматических различий противораковой активности соединений неизвестны. Однако можно предположить, что соединение 6 превращается в организме животных в метаболит(ы), являющиеся сильными агонистами андрогеновых рецепторов, вызывающими сильную стимуляцию роста опухоли. В ходе эксперимента мышей раз в неделю взвешивали. Вес тела животных всех групп слегка увеличился, что совпадает с увеличением для контрольной группы. Все мыши выглядели здоровыми, побочных эффектов не наблюдалось, что позволяет предположить отсутствие у соединений значимой токсичности. Во втором эксперименте in vivo исследовалась способность соединений 5 ингибировать рост клеток рака простаты LAPC4 в мышах SCID, в качестве контроля использовали соединение 16 (Диаграмма 1),ранее идентифицированный сильный ингибитор CYP 17/антиадроген (Gregoriyev et al. и Njar et al., J.Med. Chem., 1998, 41, 902-912, выше) и кастрация. Лечение в этом эксперименте начиналось в день, когда мышей подкожно инокулировали гормон-зависимыми клетками LAPC4. Их в ходе лечения кастрировали или им вводили подкожно два раза в день соединения 5 или 16. Фиг. 8 показывает эффекты различных видов лечения на возникновение и размер опухолей в течение 21 недели терапии.- 13019560 Пальпируемая измеряемая опухоль развилась на 10-й неделе терапии у всех групп, кроме той, которую лечили веществом 16 (0.15 ммоль/кг дважды в день), у них пальпируемая измеряемая опухоль возникла на 11-й неделе. У контрольных мышей за 14 недель лечения общий объем опухолей увеличился в 8 раз, после чего мышей пришлось забить из-за слишком больших опухолей. Таким образом, объемы опухолей у всех остальных групп сравнивали с объемами опухоли у мышей контрольной группы на 14 неделе лечения. У кастрированных мышей объем опухоли увеличился только в 4,1 раза (приблизительно, на 50% меньше, по сравнению с контролем), что похоже на 3,7-кратное увеличение (на 53,8% меньше, по сравнению с контролем) у мышей, принимавших соединение 16. У мышей, принимавших соединение 5(0,15 ммоль/кг дважды в день), объем опухоли увеличился только в полтора раза, что соответствует 93,8% уменьшению, по сравнению с контрольными мышами (Р = 0,00065). На 16-й неделе средний объем опухоли у мышей, принимавших соединение 5, оказался меньше (почти незаметная опухоль в латентном состоянии), чем на 10-й неделе, когда измеряемая опухоль только возникла. Более того, соединение 5 оказывало значимое ингибирующее действие на опухоли, по сравнению с 16 или кастрацией, Р = 0,005 и 0,05, соответственно. В общем случае, опухоли у контрольных, кастрированных мышей и мышей, принимавших соединение 16, росли быстро, а у мышей, принимавших соединение 5, росли медленно, причем их рост носил двухфазный характер (фиг. 8). Соединение 5 является наиболее эффективным агентом,и оно ингибирует рост опухолей значительно эффективнее кастрации. Интересно отметить, что, хотя соединение 16 в 6 раз сильнее ингибирует CYP 17, чем соединение 5, последнее соединение демонстрирует более высокую противораковую активность in vivo. Причины этого в настоящее время неизвестны,однако они могут быть частично обусловлены лучшими фармакокинетическими и фармакодинамическими характеристиками соединения 5. Чтобы определить, способна ли "латентная" опухоль простаты, образовавшаяся после лечения мышей соединением 5 (см. фиг. 8, неделя 16) расти при более низкой дозе соединения 5, эту дозу уменьшили до 0,15 ммоль/кг три раза в неделю (снижение дозы на 78,6%). Такое лечение проводили на неделях 16-19, объемы опухолей измеряли еженедельно. В этот период лечения при уменьшенной дозировке соединения опухоли восстановили свой рост (фиг. 8). По окончании указанного трехнедельного интервала стали снова давать обычную дозу препарата, и рост опухолей замедлился и вышел на плато. Приведенные данные позволяют сделать вывод о цитостатической природе лечения и приводят к необходимости непрерывно вводить лекарство для достижения противоракового эффекта. В конце эксперимента определили содержание соединения 5 в опухоли и органах мышей. МетодомHPLC определяли содержание соединения 5 в опухоли, яичках и печени через 1 ч после введения заключительной дозы (вставка в фиг. 8). Интересно, что небольшое количество метаболита (приблизительно 15% по сравнению с содержанием соединения 5) обнаружено только в тканях печени. Этот метаболит характеризуется тем же временем удержания, что и метаболит, обнаруженный в плазме (см. выше). Наибольшая концентрация соединения 5 (39,08,4 мкг/мг) определена в подкожных опухолях. Содержание в печени и яичках ниже, но регистрируется. Содержание соединения 5 в опухоли значительно выше, чем в плазме, что может быть результатом накопления соединения за период эксперимента. Таким образом,ингибирование роста опухоли соединением 5 может отчасти объясняться более высоким его содержанием в ксенотрансплантантах, где оно может оказывать прямой цитотоксический/цитостатический эффект на клетки рака простаты. Следует упомянуть, что существует свидетельство возможного прямого цитотоксического эффекта кетоконазола (умеренного ингибитора CYP 17) на клетки рака простаты. Кроме того, накопление соединения 5 в яичках должно активизировать ингибирование синтеза тестостерона у животных. Хотя хорошо известно, что LAPC4 андроген-зависима, эти клетки могут стать андрогеннезависимыми. В таком случае они могут представлять удобную модель, имитирующую развитие рака простаты у пациентов (Chen et al., выше, и Kline et al., "Progression of metastatic human prostate cancer toandrogen independence in immunodeficient SCID mice." Nat. Med, 1997, 3, 402-408). Как видно из фиг. 8,авторы изобретения смогли воспроизвести это явление. Кроме того, результаты показывают, что лечение соединением 16 или кастрация эффективно подавляет рост опухоли на некоторое время (андргензависимая фаза), но неэффективно затем (это может являться результатам начала андроген-независимой фазы), так как опухоль начинает расти так же быстро, как и у интактных контрольных животных. Рост опухоли у мышей, принимавших соединение 5, сильно подавлялся на протяжении всего периода лечения. Это позволяет предположить, что соединение 5 влияет также и на андроген-независимый рак простаты. Однако возможно, что лечение этим соединением заставляет опухоли LAPC4 оставаться андроген-зависимыми на протяжении более длительного периода и тем самым они дольше реагируют на терапию антиандрогенами. Последние исследования показывают, что активизация AR и его участие в прогрессирующей и рецидивной РСА (Mohler et al., и Chen et al., выше) снова вызвало повышенный интерес к андрогеновым рецепторам как мишени для новых лекарств, позволяющих лечить РСА (Tindall et al., "Symposium on androgen action in prostate cancer", Cancer Res., 2004, 64, 7178-7180). Из-за своих противораковых свойств,соединение 5 может стать прекрасным кандидатом на эту роль. Заключение Полученные данные усиливают разработанную авторами изобретения ранее концепцию о том, что модификация С 17-заместителя А 16 стероидов позволяет получить сильные ингибиторы CYP 17 и мощные антагонисты AR. Показано, что 17-бензимидазолы 5 и 6 координируют гемовое железо CYP 17, это свойство может частично обуславливать их ингибиторную активность. Соединения 5 и 6 демонстрируют почти эквипотенциальную активность in vitro как ингибиторов CYP 17, антагонистов AR и ингибиторов роста клеток рака простаты. Удивительно, что эти соединения чрезвычайно различаются по своей противораковой активности. Соединение 5 вызывает заметное подавление роста ксенотрансплантантов опухоли LAPC4, а соединение 6 (0,15 ммоль/кг дважды в день) усиливает рост опухоли. Полученные в настоящем исследовании результаты четко показывают, что соединение 5 является мощным ингибитором роста опухоли простаты человека, причем он заметно эффективнее кастрации. Это первый пример ингибитора CYP 17/антиандрогена, демонстрирующего in vivo противораковую активность против опухоли рака простаты, превосходящую эффективность кастрации. Полученные впечатляющие биологические данные делают соединение 5 кандидатом для дальнейшей разработки как потенциального лекарства против рака простаты у людей. Прекрасная противораковая активность соединения 5, содержащего бензимидазольную группу, делает бензимидазолы предпочтительной группой. Однако ожидается, что описанные выше аналоги соединения 5 проявляют схожую активность и, тем самым, также включены в изобретение. Экспериментальная часть Химия: Общие процедуры и методы идентичны описанным ранее в статье Njar et al., J Med. Chem., 1998, 41,902 - 912). Инфракрасные спектры получены на спектрометре Perkin Elmer 1600 FTIR с использованием растворов в CHCl3. Масс-спектры высокого разрешения (HRMS) получены на масс-спектрометре 3-TeslaFinnigan FTMS-2000 FT, режим ESI (Ohio State University, Department of Chemistry). Для подтверждения чистоты ключевых целевых соединений приводятся масс-спектры высокого разрешения, а также данныеHPLC, подтверждающие гомогенность соединений. Масс-спектры низкого разрешения (LRMS) получены на спектрометре Finnegan LCR-MS. Температуры плавления (mp) определяли с помощью прибораFischer Johns и не скорректированы. Дегидроэпиандростерон и ацетат дегидроэпиандростерона были куплены у фирмы Aldrich, Milwaukee, WI. 5-Трибутилстаннилпиримидин и 2-трибутилстаннилпиразин приобрели у фирмы Frontier Scientific, Inc., Logan, UT. 3-Ацетокси-17-хлоро-16-формиландроста-5,16-диен (2): Это соединение получено из 3-ацетоксиандрост-5-ен-17-она (1), как описано ранее, его спектральные и аналитические данные соответствуют описанным в статье Njar et al., J. Med. Chem., 1998, 41, 902912. 3-Ацетокси-17-(1 Н-бензимидазол-1-ил)-16-формиландроста-5,16-диен (3): Смесь 3-ацетокси-17-хлоро-16-формиландроста-5,16-диена (2, 2,5 г, 6,65 ммоль), бензимидазола(2.35 г, 19,9 ммоль), и K2CO3 (2.76 г, 23,9 ммоль) в сухом DMF (20 мл) перемешивали при 80 С в инертной атмосфере аргона в течение 1,5 ч. После охлаждения до комнатной температуры реакционную смесь вылили в ледяную воду (250 мл), полученный осадок отфильтровали, промыли водой и высушили, получив сырой продукт в виде твердого вещества грязно-белого цвета (приблизительно 2,9 г). Очистка методом FCC [петролейный эфир/EtOAc/Et3N (6:4:0.3)] позволила получить 2,7 г (88,7%) чистого вещества 3:H NMR (300 MHz, CDCl3)1.07 (s, 6H, 18- и 19-СН 3), 2.04 (s, 3 Н, 3-ОСН 3), 4.60 (m, 1H, 3-Н),5.43 (br s, 1H, 6-Н), 7.35 (br. s, 2H, ароматические-Hs), 7.85 (s, 1H, ароматический-Н), 7.98 (s, 1H, ароматический-Н), 7.98 (s, 1H, 21-Н) и 9.59 (s, 1H, 16-СНО). HRMS расчетный 481.2462 (C29H34O3N2.Na+), экспериментальный 481.2454. 3-Ацетокси-17-(1H-бензимидазол-1-ил)андроста-5,16-диен (4): Раствор 3-ацетокси-17-(1 Н-бензимидазол-1-ил)-16-формиландроста-5,16-диена (соединение 3, 2,04 г,4,45 ммоль) в сухом бензонитриле (10 мл) кипятили в присутствии 10% палладия на активированном угле(1.02 г, т.е, 50 вес.% соединения 3) в течение 5 ч. После охлаждения до комнатной температуры катализатор удалили фильтрацией через слой целита. Фильтрат упарили, остаток очистили с помощью FCCH NMR (300 MHz, CDCl3)1.02 (s, 3H, 18-СН 3), 1.07 (s, 3H, 19-СН 3), 2.04 (s, 3 Н, 3-ОСН 3), 4.62 (m,1H, 3-Н), 5.43 (br s, 1H, 6-Н), 5.98 (s, 1H, 16-Н), 7.30 (m, 2 Н, ароматические-Hs), 7.49 (s, 1H, ароматический-Н), 7.81 (s, 1H, ароматический-Н), и 7.95 (s, 1H, 21-Н). HRMS расчетный 453.2512 (C28H34O2N2.Na+),экспериментальный 453.2511. 3-Гидрокси-17-(1H-бензимидазол-1-ил)андроста-5,16-диен (5): Ацетат 4 (1,3 g 3,02 ммоль) растворили в метаноле (20 мл) в атмосфере аргона. К полученному рас- 15019560 твору добавили 10% раствор KOH в метаноле (8 мл). Смесь перемешивали при комнатной температуре в течение 1.5 ч и сконцентрировали при пониженном давлении при температуре примерно 40 С до объема 10 мл. Этот раствор вылили в ледяную воду (300 мл), полученный белый осадок отфильтровали, промыли водой и высушили. Кристаллизация из EtOAc/МеОН позволила получить соединение 5 (1.10 г, 94%),mp 189-190 С; IR (CHCl3) 2934, 2339, 1609, 1490, 1453, 1291, 1040, 837, 808, 705, 663, 608, 578, 550, 517H NMR (300 MHz, CDCl3)1.02 (s, 3 Н, 18-СН 3), 1.07 (s,3H, 19-СН 3), 3.55(m, 1 Н, 3-Н), 5.41 (br s,1 Н, 6-Н), 5.99 (s, 1H, 16-Н), 7.30 (m, 2 Н, ароматические-Hs), 7.54 (s, 1H, ароматический -Н), 7.80 (s, 1H,ароматический -Н), и 7.96 (s, 1H, 21-Н). HRMS расчетный 411.2407 (C26H32ON2.Na+), экспериментальный 411.2396. 17-(1 Н-бензимидазол-1-ил)андроста-4,16-диен-3-он (6): Из смеси соединения 5 (660 мг, 1.70 ммоль), 1-метил-4-пиперидона (2,5 мл), и толуола (40 мл) отогнали приблизительно 10 мл. Затем добавили изопропоксид алюминия (521 мг, 2,55 ммоль) и кипятили смесь в атмосфере аргона в течение 4 ч. После охлаждения смесь перегнали с EtOAc (50 мл), последовательно промыли 5% водным раствором NaHCO3 (3) и соляным раствором (2), а затем высушили(Na2SO4). Растворитель упарили, и сырой продукт очистили с помощью FCC [CH2Cl2/EtOH (25:1)] получив заявленное соединение 6 (544 мг, 82%): mp 201-204C; IR (CHCl3) 2946, 2858, 1622, 1611, 1490, 1453,1376, 1291, 1270, 1228, 1189, 893, 850, 837, 722, 662, 615, 568, 553,537, 519 cm-1; 1HNMR (300 MHz, CDCl3)1.04 (s, 3H, 18-CH3), 1.24 (s, 3H, 19-CH3), 5.78 (s, 1H, 4-H), 5.99 (s, 1H,16-H), 7.31 (m, 2H, ароматические-Hs), 7.48 (m, 1H, ароматический -H), 7.81 (s, 1H, ароматический-Н), и 7.95 (s, 1H, 21-H). HRMS расчетный 409.2250 (C26H30ON2.Na+), экспериментальный 409.2250. Реакция 3-ацетокси-17-хлоро-16-формиландроста-5,16-диена (2) с бензо-1 Н-1,2,3-триазолом и K2 СО 3: 3-Ацетокси-17-(бензо-2 Н-1,2,3-триазол-2-ил)-16-формиландроста-5,16-диен (7 а) и 3-ацетокси-17(бензо-1 Н-1,2,3-триазол-1-ил)-16-формиландроста-5,16-диен (7b): Смесь соединения 2 (2,5 г, 6,65 ммоль), бензотриазола (2,35 г, 19,9 ммоль), и K2CO3 (2,76 г, 23,9 ммоль) в сухом DMF (20 мл) перемешивали при температуре приблизительно 80 С в атмосфере аргона в течение 45 мин. После охлаждения до комнатной температуры реакционную смесь вылили в ледяную воду (250 мл), полученный осадок отфильтровали, промыли водой и высушили, получив сырой продукт в виде грязно-белого твердого вещества. Очистка с помощью FCC [петролейный эфир/EtOAc, (4:1)] в начале в качестве дополнительного продукта позволила получить 3-ацетокси-17-(бензо-2 Н-1,2,3 триазол-2-ил)-16-формиландроста-5,16-диен (7 а, 0,3 г, 9,8%); mp 248-250C; IR (CHCl3) 3023, 2945, 2358,1725, 1657, 1600, 1375, 1257, 1032, 728, 656, 584, 564, 540, 526, 506, 498 cm-1; 1H NMR (300 MHz, CDCl3)1.11 (s, 3 Н, 18-СН 3), 1.37 (s, 3 Н, 19-СН 3), 2.04 (s, 3 Н, 3-ОСН 3), 4.62 (m, 1H, 3-Н), 5.43 (br s, 1H, 6-Н),7.43 (d, 1H, J= 2.4 Hz, ароматические-Hs), 7.45 (d, 1H, J= 2.7 Hz, ароматический-Н), 7.88 (d, 1H, J= 2.7 Hz,ароматический-Н), 7.90 (d, 1H, J= 2.4 Hz, ароматический-Н) и 10.66 (s, 1H, 16-CHO). HRMS расчетный 482.2414(C28H33O3N3.Na+), экспериментальный 482.2413. Дальнейшее элюирование тем же растворителем позволила получить в качестве основного продукта 3-ацетокси-17-(бензо-1H-1,2,3-триазол-1-ил)16-формиландроста-5,16-диен (7b, 2.3 г, 75.4%); mp: 186-188C; IR (CHCl3) 3023, 2948, 1725, 1670, 1604,1488, 1450, 1374, 1253, 1196, 1032, 846, 824, 720, 658, 619, 548, 527, 504, 497 cm-1; 1H NMR (300 MHz, CDCl3)1.07 (s, 6H, 18- и 19-СН 3), 2.04 (s, 3 Н, 3-ОСН 3), 4.60 (m, 1 Н, 3-Н),5.43 (br s, 1H, 6-Н), 7.46 (m, 2 Н, ароматические-Hs), 7.57 (d, 1H, J = 6.9 Hz, ароматический-Н), 8.15 (d, 1H,J = 8.4 Hz), ароматический-Н), и 9,59 (s, 1 Н, 16-CHO). HRMS расчетный 482.2414 (C28H33O3N3.Na+), экспериментальный 482.2416. 3-Ацетокси-17-(бензо-1 Н-1,2,3-триазол-1-ил)андроста-5,16-диен (8) Смесь бис(трифенилфосфин)родий(I) карбонил хлорида (303 мг, 0,438 ммоль) и 1,3-бис(дифенилфосфино)пропана (394 мг, 0,954 ммоль) в сухом ксилене (40 мл) перемешивали при 80 С в атмосфере аргона в течение 15 мин, при этом образовался мелкодисперсный желтый осадок. Затем добавили соединение 7b (1,71 г, 3,72 ммоль) и смесь кипятили в атмосфере аргона в течение 18 ч, после чего сконцентрировали при пониженном давлении. Сырой продукт очистили с помощью FCC [петролейный эфир/EtOAc/Et3N, (8.9:1 :0.1)], получив 1.2 г (74.7 %) чистого вещества 8; mp 184-186 С. IR (CHCl3) 3063,2918, 2389, 2358, 1725, 1458, 1373, 1254, 1069, 1031, 843, 809, 786, 692, 646, 560, 535, 528, 512, 494 cm-1; 1Hz, ароматический-Н), 7.67 (d, 1H, J= 8.1 Hz, ароматический-Н), и 8.10 (d, 1H, J = 8.1 Hz, ароматическийН). HRMS расчетный 454.2465 (C27H33O2N3.Na+), экспериментальный 454.2469. 3-Гидрокси-17-(бензо-1 Н-1,2,3-триазол-1-ил)андроста-5,16-диен (9): Указанное соединение получили по методике, описанной для соединения 5, используя в качестве исходного соединения 3-ацетокси-17-(бензо-1H-1,2,3-триазол-1-ил)андроста-5,16-диен (8; 700 мг, 1.62 ммоль). Перекристаллизация из EtOAc/MeOH позволила получить заявленное соединение 9 (600 мг,95%); mp 241-244C; IR (CHCl3) 3603, 2937, 2859, 1609, 1488, 1451, 1373, 1287, 1243, 1069, 1040, 1007,953, 845, 805, 715, 665, 618, 570, 553, 517 cm-1; 1H NMR (300 MHz, CDCl3)1.09 (s, 3H, 18-CH3), 1.24 (s,- 16019560 3H, 19-CH3), 3.55 (m, 1H, 3-H), 5.41 (br s, 1H, 6-H), 6.06 (s, 1H, 16-H), 7.40 (t, 1H, J = 7.8 Hz, ароматический-Н), 7.52 (t, 1H, J = 7.8 Hz, ароматический-Н), 7.67 (d, 1H, J= 8.1 Hz, ароматический-Н), и 8.10 (d, 1H,J = 8.1 Hz, ароматический-Н). HRMS расчетный 412.2359 (C25H31ON3.Na+), экспериментальный 412.2365. 17-(Бензо-1 Н-1,2,3-триазол-1-ил)андроста-4,16-диен-3-он (10): Указанное соединение получали по методике, описанной для соединения 6, используя в качестве исходного соединения -гидрокси-17-(бензо-1HT-1,2,3-триазол-1-ил)андроста-5,16-диен (9; 500 мг, 1.28 ммоль). Очистка сырого продукта методом FCC [CH2Cl2/EtOH, (50:1)] позволила получить заявленное соединение 10 (420 мг, 84.4%); mp: 280-283 С; IR (CHCl3) 2944,1658, 1450, 1070, 8444, 825, 721, 624, 589,564, 554, 541, 521 cm-1; 1 Н NMR (300 MHz, CDCl3)1.26 (s, 3 Н, 18-СН 3), 1.27 (s, 3 Н, 19-СН 3), 5.77 (s, 1H, 4-Н), 6.01 (s, 1H,16-Н), 7.40 (t, 1H, J = 7.8 Hz, ароматический-Н), 7.52 (t, 1 Н, J = 7.8 Hz, ароматический-Н), 7.67 (d, 1H, J = 7.8 Hz, ароматический-Н) и 8.10 (d, 1H, J = 8.1 Hz, ароматический-Н). HRMS расчетный 410.2203(C25H29ON3.Na+), экспериментальный 410.2185. Дегидроэпиандростерон-17 гидрозон (12): Дегидроэпиандростерон (11, 3.5 г, 12.2 ммоль) растворили в этаноле (60 мл) и полученный раствор обработали гидразин гидратом (2.37 мл, 0.049 моль), а затем раствором гидразин сульфата (7,9 мг, 0,061 ммоль) в 0,25 мл воды. Смесь перемешивали при комнатной температуре в течение 12 ч и затем вылили в ледяную воду. Полученный осадок отфильтровали, промыли водой и высушили, получив белые кристаллы заявленного соединения 12; mp: 242-244 С (лит. 204-206 С);22 1 Н NMR (300 MHz, CDCl3):0.76 (s, 3 Н, 18-СН 3), 1.05 (s, 3H, 19-СН 3), 3.74 (br s, 1H, 3-Н) и 5.35 (s,1H, 6-Н). 17-Йодоандроста-5,16-диен-3-ол (13): Раствор йода (12,16 г, 0,0203 моль) в сухом THF(144 мл) и сухом Et2O (72 мл) при перемешивании охладили на ледяной бане до 0 С и затем обработали 1,1,3,3-тетраметилгуанидином (6,72 мл, 6,24 г,0,054 моль). Затем по каплям добавили раствор соединения 12 (3,0 г, 9,9 ммоль) в THF (81 мл), в течение 2 ч поддерживая температуру реакционной смеси около 0 С. Реакционную смесь затем сконцентрировали в вакууме, охладили в ледяной бане и высушили в вакууме при комнатной температуре, получив твердое вещество желтого цвета (13, 3,65 г, 92,4%). mp: 169-171 С. (лит. 175-176 С);22 IR (CHCl3) 2935,1371, 1039, 862, 843, 799, 715, 665, 582, и 566 cm-1; 1H NMR (300 MHz, CDCl3):0,76 (s, 3 Н, 18-СН 3), 1,05(s, 3 Н, 19-СН 3), 3.50 (br s, 1H, 3-Н), 5,35 (s, 1H, 6-Н) и 6,14 (s, 1H, 16-Н). 3-Гидрокси-17-(2-пиразил)андроста-5,16-диен (14): Смесь 17-иодоандроста-5,16-диен-3-ола (13; 0,5 г, 1,257 ммоль) в растворе сухого диметилформамида (DMF, 10 мл) с тетракис(трифенилфосфатом) палладия (Pd(PPh3)4) (71,6 мг, 0,062 ммоль) и (2 трибутилстаннил) пиразином (774,6 мг, 2,099 ммоль) нагревали при 120 С в течение 20 ч. После охлаждения смесь перегнали с холодной водой (50 мл) и проэкстрагировали EtOAc (30 мл 3). Объединенные экстракты промыли соляным раствором и водой, высушили над Na2SO4 и затем сконцентрировали, получив коричневатое твердое вещество. Этот сырой продукт очистили с помощью флэш-хроматографииHRMS расчетный 350.2358 (C23H30ON2), экспериментальный 350.2354. 3-Гидрокси-17-(5-пиримидил)андроста-5,16-диен (15): Вещество получали, используя в качестве исходного соединение 13 (0,645 г, 1,623 ммоль), согласно процедуре, описанной для соединения 14, но используя (5-трибутилстаннил)пиримидин (1,0 г, 2,710 ммоль), растворенный в 10 мл сухого DMF, содержащего (Pd(PPh3)4) (92,88 мг, 0,0804 ммоль) и (5 трибутилстаннил)пиримидин (1,0 г, 2,710 ммоль). Очистка с помощью FCC [петролейный эфир/EtOAc/Et3N (3:2:0,15)] позволила получить 3-гидрокси-17-(5-пиримидил)андроста-5,16-диен 15(44 мг, 10%); mp: 231-233 С (лит. 240-242 С);19 1 Н NMR (300 MHz, CDCl3):1,05 (s, 3 Н, 18-СН 3), 1,08 (s,3 Н, 19-СН 3), 3,83 (br s, 1H, 3-Н), 5,39 (s, 1H, 6-Н), 7,26 (s, 1H, 16-Н), 8,73 (s, 2H, 41-Н и 61-Н) и 9,07 (s,1H, 21-Н). HRMS расчетный 350,2358 (C23H30ON2), экспериментальный 350,2348. Анализ ингибиторной активности CYP17 in vitro Активность соединений как ингибиторов CYP 17 in vitro определялась с помощью разработанного авторами изобретения быстрого опыта по высвобождению уксусной кислоты (AARA), в качестве источника фермента использовались интактные Е. coli, экспрессирующие P450cl7 (Grigoryev, выше). В качестве субстрата использовали [21-3 Н]-17-гидроксипрегненолон, и активность по отношению к CYP 17 определялась по количеству тритиированной уксусной кислоты, формирующейся при расщеплении боковой цепи субстрата в положении С-21. Утверждается, что данный метод по точности и надежности сопоставим с процедурой анализа HPLC, используемой другими исследователями в этой области (Grigoryev, выше). Значения IC50 были получены непосредственно из графиков процента ингибирования как функции от концентрации ингибитора в соответствующем интервале. Каждое соединение тестировалось,как минимум, в пяти различных концентрациях. Опыты выполнялись в трех повторах, приводимые здесь- 17019560 значения IC50 представляют собой среднее по результатам трех экспериментов. Стандартные отклонения составляли 5% от средних значений. Анализ активности по отношению к 5-редуктазе типа 1 и 2 Ингибиторная активность соединений и финастерида (как контроль) определялась с использованием клеточной линии DU 145 (для человеческого фермента 1 типа) и гомогената простаты человека (ткань ВРН для фермента 2 типа) по способу, описанному в работе Hartmann и коллег (Picard et al., "Synthesisand in vivo active steroid 5-reductase type 2 inhibitors", J Med. Chem., 2002, 45, 3406-3417). Значения процента ингибирования определялись для концентрации 10 мкМ, а в случае более активных соединений,определялись IC50. Анализ конкурентного связывания с андрогеновыми рецепторами и люциферазный опыт Анализ конкурентного связывания с AR Ячейки 24-луночных планшет 5 мин обрабатывали раствором поли-1-лизина (0.05 мг/мл), затем высушили, промыли стерилизованной дистиллированной водой и сушили 2 ч. Чтобы определить кинетику связывания R1881 с LNCaP AR и AR дикого типа, клетки LNCaP и PC3AR перенесли в 24-луночные планшеты (2-3105) в среде, не содержащей стероиды, и позволили им прикрепиться. На следующий день среду заменили на не содержащий сыворотку и стероиды раствор RPMI с 0.1% BSA, содержащий[3H]R1881 (0.01-10 nM) в присутствии или отсутствии 200-кратного избытка холодного DHT для определения неспецифического связывания, а также 1 мкМ триамцинолон ацетонида для насыщения рецепторов прогестерона и глюкокортикоидов. Ячейки 2 ч ингибировали при 37 С, а затем дважды промыли ледяным DPBS и солюбилизировали в DPBS с 0,5% SDS и 20% глицерина. Экстракты удалили и ассоциированную с ячейками радиоактивность измерили в сцинтилляционном счетчике. Данные проанализировали, включая определение Kd и Bmax, методом нелинейной регрессии с помощью программного обеспечения Graphpad Prism. Когда удалось определить концентрацию, требующуюся, чтобы почти полностью насытить AR в клетках обеих линий, описанным выше методом определили способность тестируемых соединений (0.1 нМ - 10 мкМ) вытеснять из рецепторов [3H]R1881 (5.0 нМ). Значения IC50 каждого соединения определялось методом нелинейной регрессии с использованием программного обеспечения Graphpad Prism (GraphPad Software, Inc, San Diego, CA). Анализ трансактивации люциферазы Анализ транскрипционной активации выполнили, как описано в работе Kim et al., выше, с незначительными изменениями. Пробазин люциферазный репортерный конструкт ARR2-Luc генерировали включением минимального пробазинового промотера ARR2, любезно предоставленного доктором R.Matusik из Университетского медицинского центра в Вандербилте (Endocrinology, 2000, 141: 4698-4710),в поликлональную линкерную область вектора PGL3-enhancer (Promega). В качестве внутреннего контроля использовали pRL-null (Promega). Кратко, клетки LNCaP, выращенные в 24-луночных планшетах,которые были предварительно покрыты поли-L-лизином, трансфецировали ARR2-Luc в среде RPMI 1640 без фенолового красного, содержащей 5% FBS (charcoal-stripped FBS) (Hyclone). Через 24 ч после трансфекции клетки в течение 18 ч инкубировали со свежей средой RPMI 1640 без сыворотки и без фенолового красного, содержащей или не содержащей DHT и ингибиторы. Люциферазную активность измеряли в трех повторах с использованием двойной системы люциферазного анализа в соответствии с инструкциями производителя (Promega). Результаты представлены в виде индукции складки, то есть, относительной люциферазной активности обработанных клеток, деленной на активность контроля. Анализ роста и жизнеспособности культуры клеток Клетки LNCaP вырастили в среде RPMI 1640 с 10% FBS и 1% раствора пенициллина/стрептомицина. Чтобы определить эффект новых соединений на пролиферацию клеток, последние перенесли в свободную от стероидов среду за три дня до начала экспериментов. Свободная от стероидов среда представляла собой RPMI без фенолового красного, содержащая 5% сыворотки, обработанной декстраном и древесным углем и 1% раствор пенициллина/стрептомицина. Для определения роста клеток последние поместили (3104) в 24-луночные планшеты (Corning, Inc. Corning, NY). Через 24 ч, отведенные на прикрепление клеток, среду удалили и заменили на другую среду без стероидов, содержащую негативный контроль или указанную концентрацию DHT (1 нМ) и соединения (0,1-10 мкМ). Контрольные ячейки обрабатывали этанолом. Эту среду заменяли каждые три дня, количество живых клеток определяли и сравнивали методом анализа WST-1 [4-[3-(4-иодофенил)-2-(4-нитрофенил)-2 Н-5-тетразолио]1,3-бензолдисульфонат] на седьмой день. После инкубации клеток в течение указанного времени 10% раствор WST-1 добавили в каждую лунку и три часа инкубировали при температуре 37 С. После инкубации планшеты слегка встряхнули и сразу же определили поглощение при длине волны 450 нм с помощью сканирующего планшетного спектрофотометра. Все представленные результаты представляют собой средние значения как минимум для трех лунок. Дополнительный контроль представлял собой одну среду без клеток. Фармакокинетические исследования Все эксперименты на животных выполняли в соответствии с требованиями и с одобрения комитета заботы о животных (Animal Care Committee) Университа школы медицины в Мэриленде, Балтимор. Самцы мышей SCID весом 20-22 г (8-10 недельные) были получены из Национального института рака, Фридрих, MD, США, их держали в контролируемой среде при температуре, приблизительно, 25 С, 50% относительной влажности, цикле 12 ч света/12 ч темноты и при свободном доступе к пище и воде. Соединения 5 и 6 смешивали с 40% -циклодекстрином в воде и мыши делали одну подкожную инъекцию. Животных затем убивали в разное время вплоть до 6 ч после введения препарата, кровь получали из сердца под легкой галотановым анестезией (Ayerst, Нью Йорк, NY, США). Анализ HPLC Хроматографическое разделение и количественный анализ стероидов и соответствующих внутренних стандартов определяли методом HPLC в обращенной фазе на колонке Waters(r) Novapak C18 column (3.9150 мм), защищенной защитным картриджем Waters и набитой пленочным С 18 (pellicle С 18), как описано ранее. Кратко, использовавшаяся в этом эксперименте система HPLC состояла из системы доставки растворителя Waters, контроллера Waters (Милфорд, МА), подключенного к автосэмплеру Waters 717plus, и детектора из массива фотодиодов Waters 996, работающего при длине волны 242.7 нм. Состав мобильной фазы был следующим: вода/MeOH/CH3CN (35:35:30, v/v/v + 200 мкл Et3N и 0.77 г NH4OAc на 1000 мл мобильной фазы), скорость потока 1 мл/мин. Анализ HPLC проводили при температуре окружающей среды, обработку и получение данных осуществляли с помощью обработчикаWaters millennium chromatography manager. Пробоподготовка Тестовые пробирки, содержащие мышиную плазму (200 мкл), вещества 5 или 6 и VN/85-1 (внутренний стандарт, 10 мкл раствора концентрации 100 мкг/мл), проэкстрагировали диэтиловым эфиром(22 мл) каждый раз в течение 3 мин на миксере vortex и центрифугировали 5 мин при 3000 g. Органические слои упарили досуха в слабом потоке воздуха. Остаток реконституировали в аликвоту мобильной фазы (100 мкл) и профильтровали с использованием 0,2 мкм тефлоновых фильтров, после чего провели анализ HPLC. Кривые калибровки и валидация анализа HPLC Кривые калибровки соединения 5 в плазме и ткани и соединения 6 в плазме получены путем добавления различных количество соединения в экстракционные пробирки (в двух повторах), содержащие плазму (200 мкл) и тканевые препараты (200 мкл) от нелеченных животных, финальная концентрация составляла 0.1-100.0 мкг/мл. Были приготовлены также соответствующие бланки (пустые экстракционные пробирки), и в каждую пробирку добавили аликвоту внутреннего стандарта, финальная концентрация 5 мкг/мл. Калибровочные образцы прошли такую же процедуру пробоподготовки, которая была описана выше. Аликвоту реконституированного субстрата (50 мкл) ввели в систему HPLC и построили график отношений площадей пиков для каждого аналита к соответствующим площадям для внутреннего стандарта как функции от концентраций соединений 5 или 6. Точность и воспроизводимость анализов определена в диапазоне известных концентраций ингибиторов в чистой плазме и использовалась на протяжении всей процедуры HPLC. Это измерение повторили в трех отдельных экспериментах. Анализ данных Фармакокинетические расчеты выполняли, как описано ранее. Расчеты для бесчастевой (некомпартментальной) модели выполняли с использованием программы WinNOnlin (Scientific Consulting Inc.). Для сравнения различных групп с 95% доверительным интервалом выполнили односторонний дисперсионный анализ (ANOVA) на программном обеспечении SigmaStat for Windows version 1,0. Значимость определяли с помощью апостериального теста Бонферрони. Статистически значимыми считались значения Р 0,05. Противораковые эксперименты in vivo (ксенотрансплантанты рака простаты LAPC-4) Все эксперименты на животных выполнялись в соответствии с руководством и с одобрения Комитета заботы о животных Университета школы медицины в Мэриленде, Балтимор. Самцы мышей с тяжелым комбинированным иммунодефицитом (severe combined immunodeficient (SCID в возрасте 4-6 недель были приобретены в центре раковых исследований и разработок Национального института рака во Фридрихе (MD) и содержались в свободной от патогенов среде в контролируемых условиях по свету и влажности; им обеспечивали свободный доступ к пище и воде. Опухоли из клеток LAPC4 инокулировали мышам подкожно, в основном, так, как было описано ранее (21). Клетки LAPC4 вырастили в средеIMEM с 15% FBS + 1% BS и 10 нМ DHT до конфлюенции 80%. Затем клетки счистили в среду DPBS,собрали там центрифугированием и ресуспендировали в среде Matrigel (10 мг/мл) в концентрации 3107 клеток/мл. Мышам подкожно вводили по 100 мкл суспензии клеток с каждого бока. Опухоли еженедельно измеряли штангенциркулем, объем опухолей вычисляли по формуле 4/3r12r2 (r1r2). В первом эксперименте опухоли LAPC4 росли 8-10 недель после инокуляции. Группы по 5 мышей со сравнимыми общими объемами опухолей либо кастрировали, либо лечили соединениями 5 и 6 (0,15 ммоль/кг раз в день и 0,15 ммоль/кг дважды в день, 9 ч утра и 5 ч вечера). Кастрировали мышей под ме- 19019560 токсифторановой анестезией. Соединения 5 и 6 растворили в концентрации 17,2 мг/мл в физиологическом растворе, содержащем 0,3% гидроксипропилцеллюлозы, этот раствор ежедневно вводили мышам подкожно. Контрольные и кастрированные мыши получали только пустую среду. Опухоли измеряли еженедельно в течение 4 недель лечения, вычисляли объемы опухолей. В конце периода лечения животных забили под галотановой анестезией, опухоли вырезали, взвесили и заморозили при температуре -80 С. Животных также еженедельно взвешивали и в ходе эксперимента отслеживали их общее состояние здоровья и признаки возможной токсичности, вызванной лечением. Во втором эксперименте животных инокулировани клетками LAPC4 и разделили на четыре группы по пять мышей в каждой. Контрольная группа и группа кастрированных мышей получала только среду,остальные две группы получали либо VN/85-1 (0,15 ммоль/кг дважды в день, 9 ч утра и 5 ч вечера) либо 5 (0.15 ммоль/кг дважды в день, 9 ч утра и 5 ч вечера). Лечение начинали в день после инокуляцииLAPC4 и продолжали 14 недель для контрольной группы, 19 недель для групп VN/85-1 и кастрированной и 21 неделю для группы, принимавшей соединение 5. Опухоли измеряли и обрабатывали, как описано выше. Измерение содержания соединения 5 (VN/124-1) в опухоли, печени и яичках Животных из группы, принимавшей VN/124-1, забили через час после последнего введения препарата, выделили у них опухоли, печень и яички и заморозили их в жидком азоте. Образцы тканей гомогенизировали в фосфатном буфере (рН = 7,4, 0,5 мл/мг ткани). Гомогенизированную ткань (200 мкл) смешали с внутренним стандартом, VN/85-1 (10 мкл 100 мкг/мл маточного раствора) и проэкстрагировалиEt2O (22 мл), перемешивая на мешалке vortex по 3 мин и затем центрифугируя по 5 мин при 3000 g. Экстракты Et2O выделили и упарили досуха в слабом потоке воздуха. Остаток реконституировали в 100 мкл мобильной фазы HPLC, профильтровали через 0,2 мкм тефлоновые фильтры и проанализировали методом HPLC, как описано выше. Предыдущие примеры можно повторить с тем же успехом, заменив общие или специфические реагенты и/или операционные условия настоящего изобретения на те, которые были использованы в предыдущих примерах. Исходя из приведенного выше описания, опытный специалист может легко определить существенные характеристики настоящего изобретения и, не отступая от его духа и области, может внести в него различные изменения и модификации, чтобы адаптировать его к разнообразным условиям и возможностям применения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения заболевания простаты, включающий введение нуждающемуся в лечении субъекту эффективного количества соединения или его фармацевтически приемлемой соли. 2. Способ по п.1, в котором указанным заболеванием простаты является рак простаты или гиперплазия простаты. 3. Способ лечения заболевания простаты, включающий введение нуждающемуся в лечении субъекту композиции, содержащей эффективное количество соединения со структурной формулой или его фармацевтически приемлемой соли и физиологически приемлемый наполнитель. 4. Способ по п.3, в котором указанным заболеванием простаты является рак простаты или гиперплазия простаты. 5. Способ по п.3, в котором композицию вводят перорально. 6. Способ по п.3, в котором композицию вводят пероральным введением или введением, отличным от перорального, выбранным из группы, включающей парэнтеральное, энтеральное, внутрибрюшинное,наружное, чрескожное, конъюнктивное, назальное, местное, аэрозольное, ингаляционное, внутривенное,внутримышечное, защечное, подъязычное, ректальное, внутриартериальное и интратекальное введение.
МПК / Метки
МПК: A61K 31/58, C07J 43/00
Метки: варианты, способ, лечения, простаты
Код ссылки
<a href="https://eas.patents.su/24-19560-sposob-lecheniya-prostaty-varianty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения простаты (варианты)</a>
Предыдущий патент: Антивирусное соединение, в частности ингибирующее вич, фармацевтическая композиция на его основе и способ ингибирования с его помощью
Следующий патент: Способ нетепловой обработки молока
Случайный патент: Модуляторы рецепторов эстрогена и их применение