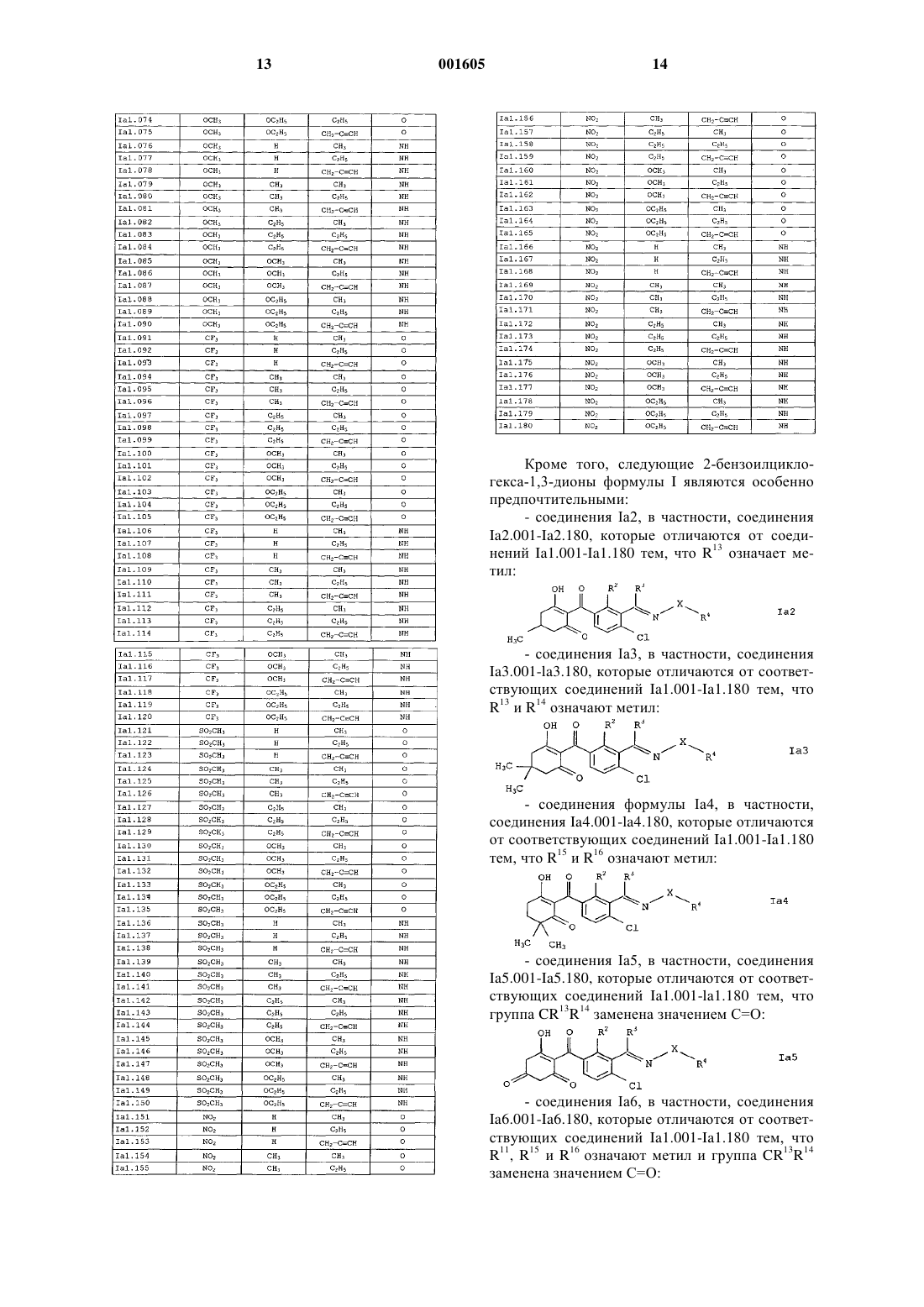
Замещенные 2-бензоилциклогексан-1,3-дионы
Номер патента: 1605
Опубликовано: 25.06.2001
Авторы: Бауманн Эрнст, Вестфален Карл-Отто, Ракк Михаель, Мисслитц Ульф, Оттен Мартина, Фон Дейн Вольфганг, Кардорфф Увэ, Майер Гуидо, Энгель Штефан, Витшель Маттиас, Райнхаймер Иоахим, Хилл Регина Луизе, Вальтер Хельмут
Формула / Реферат
1. 2-бензоилциклогексан-1,3-дионы формулы I, а также их применимые в сельском хозяйстве соли,

причем заместители в формуле I имеют следующие значения:
R1, R2 означает водород, нитро, галоген, циано, родано, C1-C6-алкил, C1-C6-галогеналкил, C1-C6-алкокси-C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, группы -OR5, -OCOR6, -OSО2R6, -SH, -S(О)nR7, -SО2ОR5, -SО2NR5R8, -NR8SО2R6 или -NR8СOR6;
R3 означает водород, циано, C1-C6-алкил, C1-C6-галогеналкил, группы -OR7, -SR7 или -NR7R10;
R4 означает водород, C1-C6-алкил, C3-C6-циклоалкил, C3-C6-алкенил,
C4-C6-циклоалкенил, C3-C6-алкинил, группы -COR9, -CO2R9, -COSR9 или -CONR8R9, причем приведенные алкильный, циклоалкильный, алкенильный, циклоалкенильный и алкинильный радикалы, а также радикал R9 групп -COR9, -CO2R9, -COSR9 и -CONR8R9 могут быть частично или полностью галогенированы и/или могут нести от одной до трех следующих групп: гидрокси, меркапто, амино, циано, R10, -OR10, -SR10, -NR8R10, =NOR10, -OCOR10, -SCOR10, -NR8COR10, -CO2R10, -COSR10, -CONR8R10, С1-С4-алкилиминоокси, С1-С4-алкоксиамино, C1-С4-алкилкарбонил, С1-С4-алкокси-C2-C6-алкоксикарбонил, C1-C4-алкилсульфонил, гетероциклил, гетероциклилокси, фенил, бензил, гетарил, фенокси, бензилокси и гетарилокси, причем восемь названных последними групп могут быть со своей стороны замещены;
Х означает кислород или группу NR8:
n имеет значение 0, 1 или 2;
R5 означает водород, C1-C6-алкил, C1-C6-галогеналкил, C1-C6-алкокси-C2-C6-алкил, C3-C6-алкенил или C3-C6-алкинил;
R6 C1-C6-алкил или C1-C6-галогеналкил;
R7 C1-C6-алкил, C1-C6-галогеналкил, C1-C6-алкокси-C2-C6-алкил, C3-C6-алкенил или C3-C6-алкинил;
R8 водород или C1-C6-алкил;
R9 C1-C6-алкил, C3-C6-алкенил, C3-C6-алкинил, фенил или бензил;
R10 C1-C6-алкил, C1-C6-галогеналкил, C3-C6-алкенил или C3-C6-алкинил;
Q означает необязательно замещенное, связанное в положении 2 циклогексан-1,3-дионовое кольцо.
2. 2-Бензоилциклогексан-1,3-дионы формулы I по п.1, в которой Q является связанным в положении 2 циклогексан-1,3-дионовым кольцом формулы II
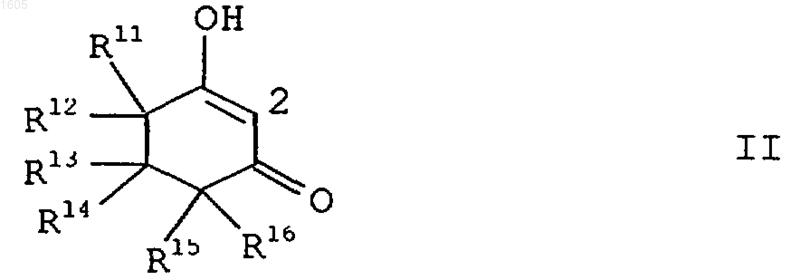
в которой R11, R12, R14 и R16 означают водород или C1-C4-алкил;
R13 означает водород, C1-C4-алкил или C3-C4-циклоалкил, причем обе приведенные последними группы могут нести от одного до трех следующих заместителей: галоген, С1-С4-алкилтио или C1-С4-алкокси; или
он означает тетрагидропиран-2-ил, тетрагидропиран-3-ил, тетрагидропиран-4-ил, тетрагидротиопиран-2-ил, тетрагидротиопиран-3-ил, тетрагидротиопиран-4-ил, 1,3-диоксолан-2-ил, 1,3-диоксан-2-ил, 1,3-оксатиолан-2-ил, 1,3-оксатиан-2-ил, 1,3-дитиолан-2-ил или 1,3-дитиан-2-ил, причем 6 приведенных последними радикалов могут быть замещены одним, максимально тремя C1-C4-алкильными радикалами;
R15 означает водород, С1-С4-алкил или C1-C6-алкоксикарбонил; или
R13 и R16 образуют вместе p-связь или карбоциклическое кольцо, имеющее от одного до шести звеньев;
или группа CR13R14 может быть заменена посредством С=O.
3. 2-Бензоилциклогексан-1,3-дионы формулы I по пп.1 или 2, в которой R1 означает нитро, галоген, циано, родано, C1-C6-алкил, C1-C6-галогеналкил, C1-C6-алкокси-C1-C6-алкил, C2-C6-алкенил, С2-С6-алкинил, -OR5 или -S(О)nR7;
R2 означает водород или приведенные выше для радикала R1 значения.
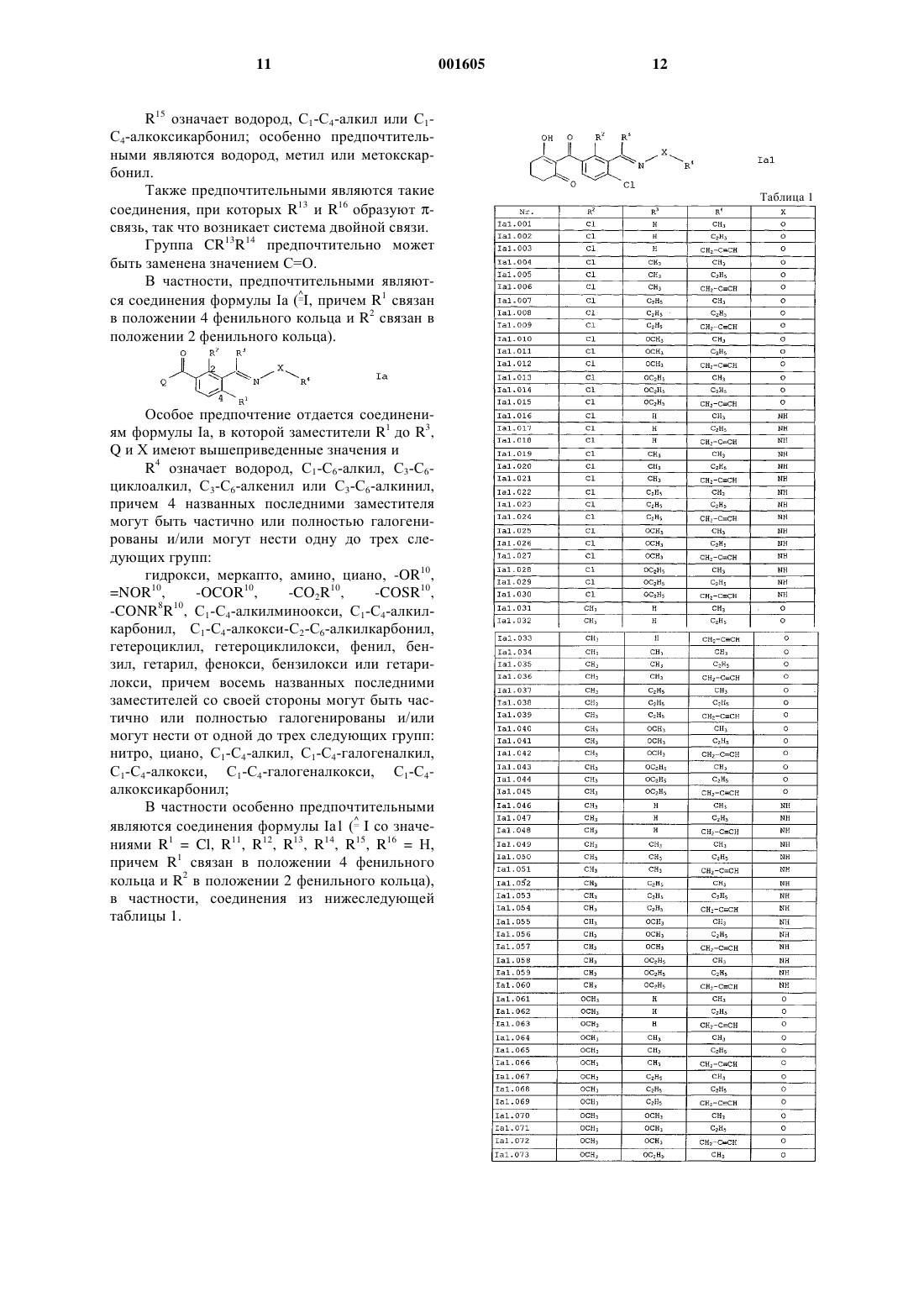
4. 2-Бензоилциклогексан-1,3-дионы формулы Iа
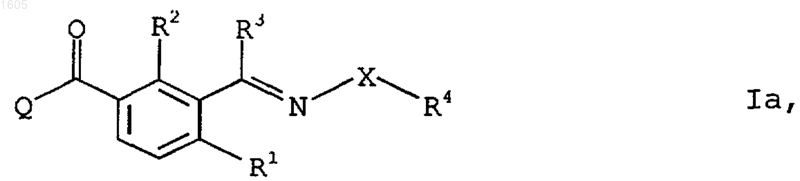
в которой заместители R1 до R4, Х и Q имеют приведенные в п.п.1-3 значения.
5. Способ получения 2-бензоилциклогексан-1,3-дионов формулы I по пп.1-4, отличающийся тем, что необязательно замещенный циклогексан-1,3-дион Q ацилируют активированной карбоновой кислотой IIIa или карбоновой кислотой IIIb
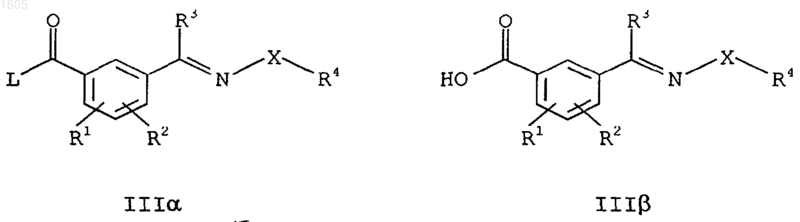
причем заместитель от R1 до R4 и Х имеют приведенные в п.1 значения и L означает нуклеофильно вытесняемую уходящую группу, и продукт ацилирования перегруппировывают в соединения I, в случае необходимости, -в присутствии катализатора.
6. Производные бензойной кислоты формулы IIIа
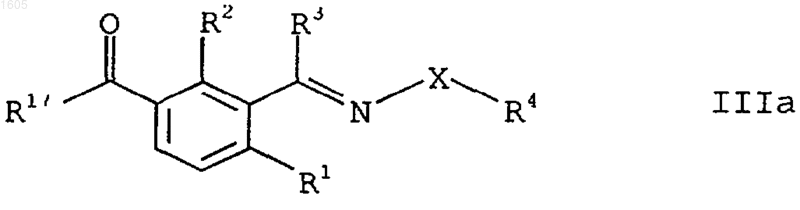
в которой
R1 означает нитро, галоген, циано, родано, C1-C6-алкил, C1-C6-галогеналкил, C1-C6-алкокси-C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил или группу -S(O)nR7;
R2 означает нитро, галоген, циано, родано, C1-C6-алкил, C1-C6-галогеналкил, C1-C6-алкокси-C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, группу -OR5 или -S(O)nR7;
R4 означает C1-C6-алкил, C3-C6-циклоалкил, C3-C6-алкенил, C4-C6-циклоалкенил, C3-C6-алкинил, группы -COR9, -CO2R9, -COSR9 или -CONR8R9, причем приведенные алкильный, циклоалкильный, алкенильный. Циклоалкенильный или алкинильный радикалы, а также радикал R9 групп -COR9, -CO2R9, -COSR9 и -СОNR8R9 могут быть частично или полностью галогенированы и/или могут нести от одной до трех следующих групп: гидрокси, меркапто, амино, циано, R10, -OR10, -SR10, -NR8R10, =NOR10, -OCOR10, -SCOR10, -NR8COR10, -CO2R10, -COSR10, -CONR8R10, C1-C4-алкилиминоокси, С1-С4-алкоксиамино, С1-С4-алкилкарбонил, C1-C4-алкокси-C2-C6-алкоксикарбонил, С1-С4-алкилсульфонил, гетероциклил, гетероциклилокси, фенил, бензил, гетарил, фенокси, бензилокси и гетарилокси, причем восемь последних радикалов могут быть со своей стороны замещены;
R17 означает гидрокси или гидролизируемый радикал и заместители R3, R5 и R7-R10, Х и n имеют приведенные в п.1 значения.
7. Производные бензойной кислоты формулы IIIа по п.6, причем R17 означает галоген, гидрокси или C1-C6-алкокси.
8. Средство, содержащее гербицидно эффективное количество, по крайней мере, одного соединения формулы I или применимой в сельском хозяйстве соли соединения I по пп.1-4 и вспомогательные средства, обычные для препаративной формы средств защиты растений.
9. Способ изготовления гербицидно эффективных средств по п.8, отличающийся тем, что смешивают гербицидно эффективное количество, по крайней мере, одного соединения формулы I или применимой в сельском хозяйстве соли соединения I по пп.1-4 и вспомогательные средства, обычные для препаративной формы средств защиты растений.
10. Способ борьбы с нежелательным ростом растений, отличающийся тем, что гербицидно эффективным количеством, по крайней мере, одного соединения формулы I или применимой в сельском хозяйстве соли соединения I по пп.1-4 воздействуют на растения, на их жизненное пространство и/или на семена.
11. Применение соединений формулы I и их применимых в сельском хозяйстве солей по пп.1-4 в качестве гербицидов.
Текст
1 Настоящее изобретение относится к замещенным 2-бeнзoилциклoгeкcaн-1,3-дионам формулы I, а также к их применимым в сельском хозяйстве солям, причем заместители формулы I имеют следующия значения:R4 означает водород, С 1-С 6-алкил, С 3-С 6 циклоалкил, С 3-С 6-алкенил, С 4-С 6-циклоалкенил, С 3-С 6-алкинил, группы -COR9, -CO2R9,-COSR9 или -CONR8R9, причем приведенные алкильный, циклоалкильный, алкенильный,циклоалкенильный и алкинильный радикалы, а также радикал R9 групп -COR9, -CO2R9, -COSR9 и -CONR8R9 могут быть частично или полностью галогенированы и/или могут нести от одной до трех следующих групп: гидрокси, меркапто, амино, циано, R10,10-CONR R ,С 1-С 4-алкилиминоокси,С 1-С 4 алкоксиамино, С 1-С 4-алкилкарбонил, С 1-С 4 алкокси-С 2-С 6-алкоксикарбонил, С 1-С 4-алкилсульфонил, гетероциклил, гетероциклилокси,фенил, бензил, гетарил, фенокси, бензилокси и гетарилокси, причем восемь названных последними групп могут быть со своей стороны замещены; Х означает кислород или группу NR8:Q означает необязательно замещенное,связанное в положении 2 циклогексан-1,3 дионовое кольцо. Кроме того, изобретение относится к способам и к промежуточным продуктам для получения соединений формулы I, к средствам, содержащим эти соединения, а также к примене 001605 2 нию соединений формулы I и содержащих их средств для борьбы с сорными растениями. Из публикаций, например, из европейских заявок ЕР-А 278 742, ЕР-А 298 680, ЕР-А 320 864 и международной заявки WO 96/14285 известны 2-бензоил-циклогексан-1,3-дионы. Гербицидные свойства известных до сих пор соединений, а также переносимость культурными растениями могут удовлетворять только условно. Поэтому задачей изобретения является создание новых, в частности, гербицидно действующих соединений с улучшенными свойствами. В соответствии с этим были найдены 2 бензоилциклогексан-1,3-дионы формулы I, a также их гербицидное действие. Далее были найдены гербицидные средства, содержащие соединения формулы I и обладающие очень хорошим гербицидным действием. Кроме того, были найдены способы получения этих средств и способы борьбы с нежелательным ростом растений соединениями формулы I. Предметом изобретения также являются стереоизомеры соединений формулы I. Они включают как чистые стереоизомеры, так и их смеси. Соединения формулы I содержат двойную связь углерод - азот и поэтому могут быть в форме Е-изомеров или Z-изомеров или смесейE/Z-изомеров. Соединения формулы I могут иметь другие двойные связи углерод-углерод,соответственно, углерод-азот. Предметом изобретения являются как чистые геометрические изомеры, так и их смеси. Соединения формулы I могут содержать в зависимости от рода заместителей один или несколько центров хиральности и могут находиться в форме смесей энантиомеров или диастереомеров. Предметом изобретения являются как чистые энантиомеры, или диастереомеры, так и их смеси. Соединения формулы I могут находиться также и в форме их применимых в сельском хозяйстве солей, причем вид соли как правило не играет роли. В общем применяются соли тех катионов или аддитивные соли таких кислот,катионы, соответственно, анионы которых не оказывают отрицательного влияния на гербицидное действие соединений формулы I. В качестве катионов пригодны в частности ионы щелочных металлов, предпочтительно таких как литий, натрий или калий, щелочноземельных металлов, предпочтительно кальция или магния и переходных металлов, предпочтительно марганца, меди, цинка и железа, а также аммония, причем здесь при необходимости от одного до четырех атомов водорода могут быть замещены С 1-С 4-алкилом или гидрокси-С 1-С 4 алкилом и/или фенилом или бензилом, предпочтительно диизопропиламмоний, тетраметиламмоний, тетрабутиламмоний, триэтилбензилам 3 моний, далее ионы форсония, сульфония, предпочтительно три(С 1-С 4-алкил)сульфоний и ионы сульфоксония, предпочтительно три(С 1-С 4 алкил)сульфоксоний. Анионами применяемых кислотноаддитивных солей являются в первую очередь хлорид, бромид, фторид, гидросульфат, сульфат, дигидрофосфат, гидрофосфат, нитрат, гидрокарбонат, карбонат, гексафторосиликат, гексафторофосфат, бензоат, а также анионы С 1-С 4 алкановых солей, предпочтительно формиат,ацетат, пропионат и бутират. Особенно предпочтительными являются соединения формулы I согласно изобретению,при которых заместитель Q представляет собой связанное в положении 2 циклогексан-1,3 дионовое кольцо формулы II, причем соединения формулы II также включают соединения формул II' und II" в их таутомерной форме, при этом R11, R12, R14 и R16 означают водород или С 1-С 4-алкил;R13 означает водород, С 1-С 4-алкил или С 3 С 4-циклоалкил, причем обе названные последними группы могут нести от одного до трех следующих заместителей: галоген, С 1-С 4 алкилтио или С 1-С 4-алкокси; или означает тетрагидропиран-2-ил, тетрагидропиран-3-ил, тетрагидропиран -4-ил, тетрагидротиопиран-2-ил, тетрагидротиопиран -3-ил,тетрагидротиопиран-4-ил, 1,3-диоксолан-2-ил,1,3-диоксан-2-ил, 1,3-оксатиолан-2-ил, 1,3-оксатиан-2-ил, 1,3-дитиолан-2-ил или 1,3-дитиан-2-ил, причем 6 названных последними радикалов могут быть замещены посредством от одного до трех С 1-С 4-алкильных радикалов;R13 и R16 вместе образуют -связь или карбоциклическое кольцо, имеющее от трех до шести звеньев или группа CR13R14 может быть заменена посредством С=O. Также предпочтительны соединения согласно изобретению формулы I, в которой 4 и -CONR8R9 могут быть частично или полностью галогенированы и/или могут нести от одной до трех следующих групп: гидрокси, меркапто, амино, циано, R10,10-CONR R ,С 1-С 4-алкилиминоокси,С 1-С 4 алкоксиамино, С 1-С 4-алкилкарбонил, С 1-С 4 алкокси-С 2-С 6-алкоксикарбонил, С 1-С 4-алкилсульфонил, гетероциклил, гетероциклилокси,фенил, бензил, гетарил, фенокси, бензилокси и гетарилокси, причем восемь названных последними заместителей могут быть с их стороны частично или полностью галогенированы и/или могут нести от одного до трех радикалов из следующих групп: нитро, циано, C1-С 4-алкил, С 1 С 4-галогеналкил, С 1-С 4-алкокси, С 1-С 4-галогеналкокси, C1-С 4-алкоксикарбонил. Названные для заместителей R1-R16 или в качестве остатков на фенильном, гетарильном и гетероцилильном кольцах органические части мoлекулы представляют собой сборные понятия для индивидуального перечисления отдельных звеньев групп. Все углеводородные цепи, т.е. алкил, галогеналкил, циклоалкил, алкоксиалкил,алкокси, галогеналкокси, алкилиминоокси, алкоксиамино, алкилтио, алкилсульфонил, алкилкарбонил, алкоксикарбонил, алкоксиалкоксикарбонил, алкенил, циклоалкенил, алкинил могут быть линейными или разветвленными. Если не было указано по-другому, галогенированные заместители несут предпочтительно от одного до трех одинаковых или различных атомов галогена. Галоген означает при этом фтор, хлор,бром или йод. Согласно изобретению для углеводородных цепей имеются, например, следующие значения:- С 1-С 4-алкил, а также алкильные радикалы С 1-С 4-алкилкарбонила означают: С 2-С 4-алкил,как указано выше, а также метил;- С 2-С 6-алкил, а также алкильные радикалы С 1-С 6-алкокси-С 2-С 6-алкила означают: С 2-С 4 алкил, как указано выше, а также фенил, 1 метилбутил, 2-метилбутил, 3-метилбутил, 2,2 диметилпропил, 1-этилпропил, гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил,2-метилпентил, 3-метилпентил, 4-метилпентил,1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил диметилбутил, 2,2-диметилбутил, 2,3 диметилбутил, 3,3-диметилбутил 1,1-этилбутил,2-этилбутил, 1,1,2-триметилпропил, 1-этил-1 метилпропил и 1-этил-3-метилпропил;-С 1-С 6-алкил, а также алкиловые радикалы С 1-С 6-алкокси-С 1-С 6-алкила означают: С 2-С 6 алкил, как указано выше, а также метил;-С 1-С 4-галогеналкил означает: С 1-С 4-алкил как указано выше, который частично или полностью замещен фтором, хлором, бромом и/или- С 1-С 6-алкокси, а также алкоксильные части групп С 1-С 6-алкокси-С 1-С 6-алкил, С 1-С 4 алкокси-С 2-С 6-алкоксикарбонил и С 1-С 6-алкоксикарбонил означают: С 1-С 4-алкокси, как указано выше, а также пентокси, 1-метилбутокси,2-метилбутокси, 3-метилбутокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 2,2-диметилпропокси, 1-этилпропокси, гексокси, 1 метилпентокси, 2-метилпентокси, 3-метилпентокси,4-метилпентокси,1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,2-диметилбутокси, 2,3-диметилбутокси, 3,3-диметилбутокси, 1-этилбутокси, 2 этилбутокси, 1,1,2-триметилпропокси, 1,2,2 триметилпропокси, 1-этил-1-метилпропокси и 1-этил-2-метилпропокси;- С 1-С 4-галогеналкокси означает: радикал С 1-С 4-алкокси, как названо выше, который частично или полностью замещен фтором, хлором,бромом и/или йодом, например, посредством следующих заместителей: фторметокси, дифторметокси, трифторметокси, хлордифторметокси, бромдифторметокси, 2-фторэтокси, 2 хлорэтокси, 2-бромэтокси, 2-йодэтокси, 2,2 дифторэтокси, 2,2,2-трифторэтокси, 2-хлор-2 фторэтокси,2-хлор-2,2-дифторэтокси,2,2 дихлор-2-фторэтокси, 2,2,2-трихлорэтокси, пентафторэтокси, 2-фторпропокси, 3-фторпропокси, 2-хлорпропокси, 3-хлорпропокси, 2 бромпропокси, 3-бромпропокси, 2,2-дифторпропокси, 2,3-дифторпропокси, 2,3-дихлорпропокси,3,3,3-трифторпропокси,3,3,3 001605- гетероциклил, а также радикалы гетероциклила в гетероциклилокси означают: трех- до семизвенные, насыщенные или парциально ненасыщенные моно- или полициклические гетероциклы, которые содержат от одного до трех гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы,такие как оксиранил, оксетан-3-ил, тиэтан-3-ил,2-тетрагидрофуранил, 3-тетрагидрофуранил, 2 тетрагидротиенил, 3-тетрагидротиэнил, 2-пирролидинил, 3-пирролидинил, 3-изоксазолидинил, 4-изоксазолидинил, 5-изоксазолидинил, 3 изотиазолидинил, 4-изотиазолидинил, 5-изотиазолидинил,3-пиразолидинил,4-пиразолидинил , 5-пиразолидинил , 2-оксазолидинил,4-оксазолидинил, 5-оксазолидинил, 2-тиазолидинил, 4-тиазолидинил, 5-тиазолидинил, 2 имидазолидинил, 4-имидазолидинил, 1,2,4 оксадиазолидинин-3-ил,1,2,4-оксадиазолидинин-5-ил, 1,2,4-тиадиазолидинин-3-ил, 1,2,4 тиадиазолидинин-5-ил, 1,2,4-триазолидинин-3 ил, 1,3,4-оксадиазолидинин-2-ил, 1,3,4-тиадиазолидинин-2-ил, 1,3,4-триазолидинин-2-ил, 2,3 дигидрофуран-2-ил, 2,3-дигидрофуран-3-ил, 2,3 дигидрофуран-4-ил, 2,3-дигидрофуран-5-ил, 2,5 дигидрофуран-2-ил, 2,5-дигидрофуран-3-ил, 2,3 дигидротиен-2-ил, 2,3-дигидротиен-3-ил, 2,3 дигидротиен-4-ил, 2,3-дигидротиен-5-ил, 2,5 дигидротиен-2-ил, 2,5-дигидротиен-3-ил, 2,3 дигидропиррол-2-ил, 2,3-дигидропиррол-3-ил,2,3-дигидропиррол-4-ил, 2,3-дигидропиррол-5 ил, 2,5-дигидропиррол-2-ил, 2,5-дигидропиррол 3-ил, 2,3-дигидроизоксазол-3-ил, 2,3-дигидроизоксазол-4-ил, 2,3-дигидроизоксазол-5-ил, 4,5 дигидроизоксазол-3-ил, 4,5-дигидроизоксазол-4 ил, 4,5-дигидроизоксазол-5-ил, 2,5-дигидроизоксазол-3-ил, 2,5-дигидроизоксазол-4-ил, 2,5 дигидроизоксазол-5-ил, 2,3-дигидроизо-тиазол 3-ил, 2,3-дигидроизотиазол-4-ил, 2,3-дигидроизотиазол-5-ил, 4,5-дигидроизотиазол-3-ил, 4,5 дигидроизотиазол-4-ил, 4,5-дигидроизо-тиазол 5-ил, 2,5-дигидроизотиазол-3-ил, 2,5-дигидроизотиазол-4-ил, 2,5-дигидроизотиазол-5-ил, 2,3 001605 8 дигидропиразол-3-ил, 2,3-дигидропиразол-4-ил,2,3-дигидропиразол-5-ил, 4,5-дигидропиразол-3 ил, 4,5- дигидропиразол-4-ил, 4,5-дигидропиразол-5-ил, 2,5-дигидропиразол-3-ил, 2,5 дигидропиразол-4-ил, 2,5-дигидропиразол-5-ил,2,3-дигидрооксазол-2-ил, 2,3-дигидрооксазол-4 ил, 2,3-дигидрооксазол-5-ил, 4,5-дигидрооксазол-2-ил, 4,5-дигидрооксазол-4-ил, 4,5-дигидрооксазол-5-ил, 2,5-дигидрооксазол-2-ил, 2,5 дигидрооксазол-4-ил, 2,5-дигидрооксазол-5-ил,2,3-дигидротиазол-2-ил,2,3-дигидротиазол-4 ил, 2,3-дигидротиазол-5-ил, 4,5-дигидротиазол 2-ил,4,5-дигидротиазол-4-ил,4,5-дигидротиазол-5-ил,2,5-дигидротиазол-2-ил,2,5 дигидротиазол-4-ил,2,5-дигидротиазол-5-ил,2,3-дигидроимидазол-2-ил, 2,3-дигидроимидазол-4-ил, 2,3-дигидроимидазол-5-ил, 4,5-дигидроимидазол-2-ил, 4,5-дигидроимидазол-4-ил,4,5-дигидроимидазол-5-ил, 2,5-дигидроимидазол-2-ил,2,5-дигидроимидазол-4-ил,2,5 дигидроимидазол-5-ил,2-морфолинил,3 морфолинил, 2-пиперидинил, 3-пиперидинил, 4 пиперидинил, 3-тетрагидропиридазинил, 4 тетрагидропиридазинил, 2-тетрагидропиримидинил, 4-тетрагидропиримидинил, 5-тетрагидропиримидинил,2-тетрагидропиразинил,1,3,5-тетрагидротриазин-2-ил, 1,2,4-тетрагидротриазин-3-ил, 1,3-дигидрооксазин-2-ил, 1,3 диоксан-2-ил, 1,3-дитиан-2-ил, 2-тетрагидропиранил, 3-тетрагидропиранил, 4-тетрагидропиранил,2-тетрагидротиопиранил,3-тетрагидротиопиранил, 4-тетрагидротиопиранил, 1,3 диоксолан-2-ил, 1,3-дитиолан-2-ил, 3,4,5,6 тетрагидропиридин-2-ил,4 Н-1,3-тиазин-2-ил,4 Н-3,1-бензотиазин-2-ил,1,1-диоксо-2,3,4,5 тетрагидротиен-2-ил, 2 Н-1,4-бензотиазин-3-ил,2 Н-1,4-бензоксазин-3-ил, 1,3-дигидрооксазин-2 ил,- гетарил, а также радикалы гетарила в гетарилокси означают: ароматические моно- или полициклические радикалы, которые наряду с углеводородными кольцевыми звеньями дополнительно могут содержать от одного-до четырех атомов азота или от одного до трех атомов азота и один атом кислорода или один атом серы или один атом кислорода или один атом серы, например,2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2 пирролил, 3-пирролил, 3-изоксазолил 4 изоксазолил, 5-изоксазолил, 3-изотиазолил, 4 изотиазолил, 5-изотиазолил, 3-пиразолил, 4 пиразолил, 5-пиразолил, 2-оксазолил,4 оксазолил, 5-окспзолил, 2-тиазолил, 4-тиазолил,5-тиазолил, 2-имидазолил, 4-имидазолил, 1,2,4 оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 1,2,4 тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,2,4 тиазол-3-ил,1,3,4-оксадиазол-2-ил,1,3,4 тиадиазол-2-ил, 1,3,4-тиазол-2-ил, 2-пиридинил,3-пиридинил, 4-пиридинил, 3-пиридазинил, 4 пиридазинил, 2-пиримидинил, 4-пиримидинил,5-пиримидинил, 2-пиразинил, 1,3,5-триазин-2 ил, 1,2,4-триазин-3-ил, 1,2,4,5-тетразин-3-ил, а 9 также соответствующие бензоконденсированные производные. Все фенильные и гетарильные кольца являются предпочтительно незамещенными или несут от одного до трех атомов галогена и/или от одного до двух радикалов из следующих групп: нитро, циано, метил, трифторметил, метокси, трифторметокси или метокси карбонил. В связи с применением соединений формулы I согласно изобретению в качестве гербицидов заместители имеют предпочтительно следующие значения, а именно отдельно или в комбинации:R1 означает нитро, галоген, циано, родано,С 1-С 6-алкил, С 1-С 6-галогеналкил, C1-С 6-алкоксиС 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил,группу -OR5 или -S(О)nR7; особенно предпочтительными являются нитро, галогены, как, например, фтор, хлор или бром, С 1-С 6-галогеналкил, группа -OR5 или SO2R7, как, например, метилсульфонил, этилсульфонил или дифторметилсульфонил; в частности, предпочтение отдается таким заместителям, как нитро, фтор, хлор, бром,трифторметил, метокси, зтокси, метилсульфонил, этилсульфонил или дифторметилсульфонил;R2 означает водород, нитро, галоген, циано, родано, С 1-С 6-алкил, С 1-С 6-галогеналкил, С 1 С 6-алкокси-С 1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6 алкинил, группу -OR5 или -S(O)nR7; особенно предпочтительными являются водород, нитро, галоген, например, фтор, хлор или бром, С 1-С 6-алкил, например, метил или этил, С 1-С 6-галогеналкил, группа -OR5 или SО 2R7, например, метилсульфонил, этилсульфонил или дифторметилсульфонил; в частности предпочтительными являются нитро, фтор,хлор, бром, метил, этил, трифторметил, метокси, этокси, метилсульфонил, этилсульфонил или дифторметилсульфонил;R4 означает водород, С 1-С 6-алкил, С 3-С 6 циклоалкил, С 3-С 6-алкенил или С 3-С 6-алкинил,причем 4 последних заместителя могут быть частично или полностью галогенированы и/или могут нести до трех следующих групп: гидрокси, меркапто, амино, циано, -OR10, =NOR10,-OCOR10, -CO2R10, -COSR10, -CONR8R10, С 1-С 4 алкилиминоокси, С 1-С 4-алкилкарбонил, С 1-С 4 алкокси-С 2-С 6-алкоксикарбонил, гетероциклил,гетероциклилокси, фенил, бензил, гетарил, фенокси, бкезилокси или гетарилокси, причем восемь названных последними радикалов, со своей стороны, могут быть частично или полностью галогенированы и/или могут нести от одного до трех радикалов из следующих групп: нитро, циано, С 1-С 4-алкил, С 1-С 4-галогеналкил,С 1-С 4-алкокси, С 1-С 4-галогеналкокси, С 1-С 4 алкоксикарбонил; 10 особенно предпочтительными являются С 1-С 6-алкил, С 3-С 6-циклоалкил, С 3-С 6-алкенил или С 3-С 6-алкинил, причем 4 названные последними заместители могут быть частично или полностью галогенированы и/или могут нести от одной до трех следующих групп: гидрокси,меркапто, амино, циано, -OR10, =NOR10,-OCOR10, -CO2R10, -COSR10, -CONR8R10, С 1-С 4 алкилиминоокси, С 1-С 4-алкилкарбонил, С 1-С 4 алкокси-С 2-С 6-алкоксикарбонил, гетероциклил,гетероциклилокси, фенил, бензил, гетарил, фенокси, бензилокси или гетарилокси, причем восемь названных последними заместителей могут быть частично или полностью галогенированы и/или могут нести от одной до трех следующих групп: нитро, циано, С 1-С 4-алкил, С 1-С 4-галогеналкил, С 1-С 4-алкокси, С 1-С 4-галогеналкокси, С 1 С 4-алкоксикарбонил; Х означает кислород или NH;R5 означает водород, С 1-С 6-алкил, С 1-С 6 галогеналкил, С 1-С 6-алкокси-С 2-С 6-алкил, С 3-С 6 алкенил или С 3-С 6-алкинил; особенно предпочтительными являются метил, этил, трифторметил, дифторметил, метоксиэтил, аллил или пропаргил;R8 означает водород или С 1-С 6-алкил;R11, R12, R14, R16 означают водород или С 1 С 4-алкил; особенно предпочтительными являются водород, метил или этил;R13 означает водород, С 1-С 4-алкил, С 3-С 4 циклоалкил, причем обе названные последними группы могут быть необязательно нести от одного до трех следующих заместителей: галоген,С 1-С 4-алкокси или С 1-С 4-алкилтио; тетрагидропиран-2-ил, тетрагидропиран-3-ил, тетрагидропиран-4-ил, тетрагидротиопиран-2-ил, тетрагидротиопиран-3-ил,тетрагидротиопиран-4-ил,1,3-диоксолан-2-ил,1,3-диоксан-2-ил,1,3 оксатиолан-2-ил, 1,3-оксатиан-2-ил, 1,3-дитиан 2-ил или 1,3-дитиолан-2-ил, причем шесть названных последними групп могут нести каждая от одно до трех радикалов С 1-С 4-алкил; особенно предпочтительными являются водород, метил, этил, циклопропил, ди(метокси)метил,ди(этокси)метил, 2-этилтиопропил, тетрагидропиран-2-ил, тетрагидропиран-3-ил, тетрагидропиран-4-ил, тетрагидротиопиран-2-ил, тетрагидротиопиран-3-ил, тетрагидротиопиран-4-ил,1,3-диоксолан-2-ил, 1,3-диоксан-2-ил, 5,5-диметил-1,3-диоксан-2-ил, 1,3-оксатиолан-2-ил, 1,3 оксатиан-2-ил, 1,3-дитиолан-2-ил, 5,5-диметил 1,3-дитиан-2-ил или 1-метилтиоциклопропил;R15 означает водород, С 1-С 4-алкил или С 1 С 4-алкоксикарбонил; особенно предпочтительными являются водород, метил или метокскарбонил. Также предпочтительными являются такие соединения, при которых R13 и R16 образуют связь, так что возникает система двойной связи. Группа CR13R14 предпочтительно может быть заменена значением С=O. В частности, предпочтительными являют ся соединения формулы Iа ( I, причем R1 связан в положении 4 фенильного кольца и R2 связан в положении 2 фенильного кольца). Особое предпочтение отдается соединениям формулы Iа, в которой заместители R1 до R3,Q и Х имеют вышеприведенные значения иR4 означает водород, С 1-С 6-алкил, С 3-С 6 циклоалкил, С 3-С 6-алкенил или С 3-С 6-алкинил,причем 4 названных последними заместителя могут быть частично или полностью галогенированы и/или могут нести одну до трех следующих групп: гидрокси, меркапто, амино, циано, -OR10,=NOR10,-OCOR10,-CO2R10,-COSR10,8 10-CONR R , С 1-С 4-алкилминоокси, С 1-С 4-алкилкарбонил, С 1-С 4-алкокси-С 2-С 6-алкилкарбонил,гетероциклил, гетероциклилокси, фенил, бензил, гетарил, фенокси, бензилокси или гетарилокси, причем восемь названных последними заместителей со своей стороны могут быть частично или полностью галогенированы и/или могут нести от одной до трех следующих групп: нитро, циано, С 1-С 4-алкил, С 1-С 4-галогеналкил,С 1-С 4-алкокси, С 1-С 4-галогеналкокси, С 1-С 4 алкоксикарбонил; В частности особенно предпочтительными являются соединения формулы Iа 1 ( I со значе 1 11 12 13 14 ниями R = Cl, R , R , R , R , R15, R16 = Н,причем R1 связан в положении 4 фенильного кольца и R2 в положении 2 фенильного кольца),в частности, соединения из нижеследующей таблицы 1.Ia2.001-Ia2.180, которые отличаются от соединений Ia1.001-Ia1.180 тем, что R13 означает метил:Ia3.001-la3.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем, что- соединения формулы Iа 4, в частности,соединения Ia4.001-la4.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем, что R15 и R16 означают метил:Ia5.001-Ia5.180, которые отличаются от соответствующих соединений Ia1.001-la1.180 тем, что группа CR13R14 заменена значением С=O:Ia6.001-Ia6.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем, чтоIa7.001-Ia7.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем, что заместители R11, R12, R15 и R16 означают метил и группа CR13R14 заменена значением С=O:Ia8.001-Ia8.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем, чтоIa9.001-Ia9.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем, чтоIa10.001-Ia10.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает нитро и R13 и R14 означают метил:Ia11.001-Ia11.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает нитро и R15 и R16 означают метил:Ia12.001-la12.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает нитро группа CR13R14 заменена значением С=O:Ia13.001-Ia13.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает нитро, R11, R15 и R16 означаютIa14.001-Ia14.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает нитро, R11, R12, R15 и R16 означают метил и группа CR13R14 заменена значением С=O:Ia15.001-Ia15.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает метилсульфонил:Ia16.001-Ia16.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает метилсульфонил и R13 означает метил:Ia17.001-Ia17.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает метилсульфонил и R13 и R14 означают метил:Ia18.001-Ia18.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает метилсульфонил и R15 и R16 означают метил:Ia19.001-Ia19.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает метилсульфонил и группаIa20.001-Ia20.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает метилсульфонил, R11, R15 и R16 означают метил игруппа CR13R14 заменена значением С=O:Ia21.001-Ia21.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает метилсульфонил, R11, R12, R15 иIa22.001-Ia22.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает трифторметил:Ia23.001-Ia23.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает трифторметил и R13 означает метил:Ia24.001-Ia24.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает трифторметил и R13 и R14 означают метил:Ia25.001-Ia25.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает трифторметил и R15 и R16 означают метил:Ia26.001-Ia26.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем, 001605Ia27.001-Ia27.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает трифторметил, R11, R15 и R16 означают метил и группа CR13R14 заменена значением С=O:Ia28.001-Ia28.180, которые отличаются от соответствующих соединений Ia1.001-Ia1.180 тем,что R1 означает трифторметил, R11, R12, R15 и R16 означают метил и группа CR13R14 заменена значением С=O: Чрезвычайно предпочтительными являются соединения формулы Iа ( I, причем R1 связан в положении 4 фенильного кольца и R2 связан в положении 2 фенильного кольца), при которой заместители имеют следующие значения:R4 С 1-С 6-алкил, С 3-С 6-алкинил, причем эти два заместителя могут быть частично или полностью галогенированы и/или могут нести от одной до трех следующих групп: фенил или гетарил, причем они могут быть со своей стороны частично или полностью галогенированы; Х кислород;R11, R12, R13, R14, R15, R16 означают водород или С 1-С 4-алкил; 2-бензоилциклогексан-1,3 дионы формулы I получают различным образом,например следующим способом: взаимодействием циклогександионов формулы II с активированной карбоновой кислотойIIIа или карбоновой кислотой III, которая активируется предпочтительно in situ, с получением продукта ацилирования IV и последующей перегруппировки. При этом L означает нуклеофильно вытесняемую уходящую группу, такую как галоген,например, бром, хлор, гетарил, например, имидазолил, пиридил, и карбоксилат, например,ацетат, трифторацетат и т.п. Активированная карбоновая кислота может применяться непосредственно, как в случае галогенидов карбоновой кислоты или производиться in situ, например, дициклогексилкарбодиимидом, сложным эфиром трифенилфосфин/азодикарбоновой кислоты, 2-пиридиндисульфит/трифенилфосфином, карбонилдиимидазолом и т.п. В случае необходимости преимуществом может быть проведение реакции ацилирования в присутствии основания. Реагенты и вспомогательное основание применяются при этом целесообразным образом в эквимолярном количестве. Небольшой избыток вспомогательного основания , например, 1,2 до 1,5 молярного эквивалента по отношению к II, может при условиях давать преимущества. В качестве вспомогательного основания пригодны третичные алкиламины, пиридин или карбонаты щелочных металлов. В качестве растворителя могут применяться, например, хлорированные углеводороды, такие как метиленхлорид, 1,2-дихлорэтан, ароматические углеводороды, такие как толуол, ксилол, хлорбензол,эфир, такое как диэтиловый эфир, метил-трет.бутиловый эфир, тетрагидрофуран, дтоксан,полярные апротонные растворители, такие как ацетонитрил, диметилформамид, диметилсульфоксид или сложный эфир, такой как сложный этиловый эфир уксусной кислоты или их смеси. Если в качестве активированных компонентов карбоновой кислоты применяются галогениды карбоновой кислоты, то целесообразным является охлаждение реакционной смеси на 010 С. при подаче этого реактива. Далее производят перемешивание при 20-100 С, предпочтительно при 25-50 С, до полной конверсии. Разделение реакционной смеси производится 20 обычным образом, например, реакционную смесь выливают на воду и целевой продукт экстрагируют. В качестве растворителя для этого пригодны, в частности, метиленхлорид, диэтилэфир и сложный эфир уксусной кислоты. После сушки органической фазы и удаления растворителя сырой сложный энольный эфир формулы IV подвергают очистке предпочтительно хроматографической чистке. Однако имеется возможность подачи сырого энольного эфира формулы IV на перегруппировку без дальнейшей очистки. Перегруппировка сложного энольного эфира формулы IV в соединения формулы I осуществляется целесообразным образом при температуре 20 до 40 С в растворителе и в присутствии вспомогательного основания, а также,в случае необходимости, с помощью циановых соединений в качестве катализатора. Растворителями могут быть, например,ацетонитрил, метиленхлорид, 1,2-дихлорэтан,сложный эфир уксусной кислоты, толуол или их смеси. Предпочтительно в качестве растворителя применяется ацетонитрил. Подходящими вспомогательными основаниями могут быть третичные амины, такие как триэтиламин, пиридин или карбонаты щелочных металлов, такие как карбонат натрия, карбонат кальция, карбонат калия, которые применяются предпочтительно в эквимолярном количестве или количестве, соответствующем максимально четырехкратному избыточному количеству по отношению к энольному эфиру. В качестве катализаторов перегруппировки пригодны неорганические цианиды, такие как цианид натрия, цианид кальция и органические циановые соединения, -такие как ацетонциангидрин, триметилсилилцианид. Они применяются обычно в количестве от 1 до 50 мол.% по отношению к энольному эфиру. Предпочтительно применяют ацетонциангидрин или триметилсилилцианид, например, в количестве от 5 до 15, предпочтительно 10 мол. по отношению к энольному эфиру. Разделение реакционной смеси может осуществляться известным образом. Реакционную смесь подкисляют, например, разбавленной минеральной кислотой, например, 5%-ой соляной или серной кислотой и экстрагируют органическим растворителем, например, метиленхпоридом или сложным этиловым эфиром уксусной кислоты. Органический экстракт можно экстрагировать 5-10%-ым раствором карбоната щелочного металла, например, раствором карбоната натрия или карбоната калия. Водную фазу подкисляют и образовавшийся осадок отсасывают, и/или экстрагируют метиленхпоридом или сложным этиловым эфиром уксусной кислоты, сушат и концентрируют. (примеры получения энольных эфиров циклогексан-1,3 дионов и каталической перегруппировки на цианидах сложного энольного эфира описаны, 21 например, в европейской заявке ЕР-А 186 118 и патенте США US 4 780 127). Применяемые в качестве исходного продукта циклогексан-1,3-дионы формулы II известны или могут получаться известными способами (например, как описано в европейских заявках ЕР-А 71 707, ЕР-А 142 741, ЕР-А 243 313, в патенте США US 4 249 937; в международной заявке WO 92/13821). Производные бензойной кислоты формулы причем заместители здесь имеют следующие значения:R4 означает водород, С 1-С 6-алкил, С 3-С 6 циклоалкил, С 3-С 6-алкенил, С 4-С 6-циклоалкенил, С 3-С 6-алкинил, группы -COR9, -CО 2R9,-COSR9 или-СОNR8R9, причем названные алкильные, циклоалкильные, алкенильные и алкинильные радикалы, а также радикал R9 группCOR9, -CO2R9, -COSR9 и -CONR8R9 могут быть частично или полностью галогенированы и/или могут нести от одной до трех следующих групп: гидрокси, меркапто, амино, циано, R10, -OR10,-SR10, -NR8R10, =NOR10, -OCOR10, -SCOR10,-NR8COR10, -CO2R10, -COSR10, -CONR8R10, С 1 С 4-алкилиминоокси, С 1-С 4-алкоксиамино, С 1-С 4 алкилкарбонил, С 1-С 4-алкокси-С 2-С 6-алкоксикарбонил, С 1-С 4-алкилсульфонил, гетероциклил,гетероциклилокси, фенил, бензил, гетарил, фенокси, бензилокси и гетарилокси, причем восемь названных последними групп, со своей стороны, могут быть также замещены; Х означает кислород или группу NR8;R17 означает гидрокси или гидролизируемый радикал. 22 Примерами для гидролизируемого радикала являются радикалы алкокси, фенокси, алкилтио, фенилтио, которые при необходимости могут быть замещены, галогениды, радикалы гетарила, которые связаны кислородом, радикалы амино, имино, которые могут быть при необходимости замещены, и т.п. Предпочтительными являются галогениды бензойной кислоты формулы III, с L означает галоген ( III с R17, который означает галоген), в которой заместители R1 до R4 и Х имеют приведенные выше для формулы III значения и L означает галоген, в частности хлорид или бромид. Также предпочтительными являются бен зойные кислоты формулы III ( III с R17 = гидрокси), в которой заместители R1 дo R4 и Х имеют приведенные выше для формулы III значения. Также предпочтительными являются сложные эфиры бензойной кислоты формулыIII ( III с М = С 1-С 6-алкокси), в которой заместители R1 до R4 и Х имеют приведенные выше для формулы III значения и М означает С 1-С 6-алкокси. Относительно предпочтительных соединений формулы III действительны те же значения для радикалов R1 до R4 и X, что и для соединений формулы I. Соединения формулы IIIа (с L = галоген) могут аналогично известным из публикаций методам (см. L.G. Fieser, M. Fieser "Reagents for Organic Synthesis", Bd. I, S. 767-769(1967 получаться взаимодействием бензойных кислот формулы III с реагентами галогенирования, такими как тионилхлорид, тионилбромид, фосген, дифосген, трифосген, оксалилхлорид, оксалилбромид. Бензойные кислоты формулы III могут получаться по аналогии известных в публикациях методов например посредством омыления сложных эфиров бензойной кислоты формулыIII (с М = С 1-С 6-алкокси). Сложные эфиры бензойной кислоты формулы III получают различными способами. Например, следующим: Путем окисления альдегидов формулы V можно получать известным самим по себе методом производные изофталевой кислоты формулы VI (см. публикацию J. March, "Advanced Organic Chemistry", 3-е издание, стр. 629 ff, Wileylnterscience Publication, 1985). Аналогично известным из публикаций способам соединения формулы VI могут переводиться сначала в соответствующие активированные карбоновые кислоты формулы VII, причем L1 означает нуклеофильно вытесняемые уходящие группы, такие как галоген, например,бром, хлор, гетарил, например, имидазолил,пиридил, карбоксилат, например, ацетат, трифторацетат и т.п., и после этого в соответствующие производные гидразидов гидроксамовой,соответственно карбоновой кислот формулы(1974), 27, cтр. 1341-1349). Алкилирование соединений формулы VIII приводит к образованию соединений формулы(со значением для R3 = OR7) известным образом (см. европейскую заявку ЕР-А 463 989; публикацию Synthesis (1983), 220-222; патент США US 4 931 088; публикации J. Org. Chem. Взаимодействием альдегидов/кетонов формулы IX с алкоксаминами, соответственно,алкилгидразинами, получают с помощью известных методов соединения формулы III. Аналогично известному из публикаций способу имеется возможность взаимодействия альдегидов/кетонов формулы IX с гадроксиламином,соответственно, гидразином и последующего алкилирования (см. J. March, "Advanced Organic Нитрилы формулы Х могут известным образом переводиться путем алкоголиза (R7OH) в иминоэфиры, которые на следующей стадии могут подвергаться взаимодействию с гидроксиламинами, соответственно, гидразинами с образованием соединений формулы III (см. J.March, "Advanced Organic Chemistry", 3-й выпуск, стр. 792-793, Wiley-lnterscience Publication,1985; патент США US 4 965 390). Нитрилы формулы X могут аналогично известному из литературных источников способу получаться из соответствующих альдегидов V(см. J. March, "Advanced Organic Chemistry", 3-й выпуск, стр. 806-807, Wiley-lnterscience Publication, 1985). Также возможно получение нитрилов формулы Х из анилинов формулы XI с помощью реакции Зандмейера или с помощью реакции Роземунд/фон Браун из арилгалогенидов формулы XII взаимодействием с цианидами металлов, в частности, с CuCN (см. J. March,"Advanced Organic Chemistry", 3-й выпуск, стр. 594, стр. 648, Wiley-lnterscience Publication,1985). Альдегиды формулы V можно получать аналогично известным из литературных источником способам из соответствующих толуолов формулы ХIII, причем их преобразуют сначала в -галогентолуол формулы XIV и после этого окисляют (см. Synth. Commun. 22, стр. 19671971 (1992. Примеры получения 2-(2,4-дихлор-3 пропаргилоксииминометилбензоил)-5,5-диметил-1,3-циклогаксандион (соединение 2.12) К раствору из 2,50 г (0,0092 моль) 2,4 дихлор-3-пропаргилоксииминометил-бензойной кислоты в 120 мл сухого ацетонитрила подают 1,20 г (0,0086 моль) димедона и 1,80 г (0,0086 моль) дициклогексилкарбодиимида. Через 12 ч при комнатной температуре реакционную смесь отфильтровывают над силикагелем (элюент: толуол), после этого растворитель удаляют, остаток загружают в 100 мл сухого ацетонитрила и примешивают 0,40 г (0,0047 моль) ацетонциангидрина и 3,10 г (0,031 моль) триэтиламина. Реакционную смесь перемешивают в течение 3 часов при комнатной температуре и потом подают ее в смесь из 200 мл воды и 100 мл 5%-ого раствора карбоната калия. Водную фазу промывают три раза сложным этиловым эфиром уксусной кислоты, потом устанавливают 10%-ой соляной кислотой на значение рН = 2 и три раза экстрагируют сложным этиловым эфиром уксусной кислоты. Объединенные органические фазы промывают до нейтрализaции водой, сушат и концентрируют. Получают 0,7 г 2-(2,4 дихлор-3-пропаргилоксииминометилбензоил)5,5-диметил-циклогександиона. (1 Н-ЯМР-спектр(1 Н); 2,66 (2 Н); 4,81 (2 Н); 7,12 (1 Н); 7,43 (1 Н); 8,31 (1 Н); 16,48 (1 Н).) 2-(2-хлор-3-этоксииминометил-4-метилсульфонилбензоил)-5,5-диметил-1,3-циклогександион (соединение 2.07) К раствору из 2,95 г (0,009 моль) 2-хлор-3 этоксииминометил-4-метилсульфонилбензойной кислоты в 130 мл безводного ацетонитрила подают 1,26 г (0,009 моль) димедона и 1,90 г(0,009 моль) дихлоргексилкарбодиимида. Через 12 часов подают по каплям при комнатной температуре 0,42 г (0,005 моль) ацетоциангидрина и 3,27 г (0,032 моль) триэтиламина в 10 мл абсолютного ацетонитрила. После этого все перемешивают в течение 2 ч при комнатной температуре. После смешения реакционной смеси с 200 мл воды отсасывают осадок и фильтрат подают к 100 мл 5%-го раствора карбоната калия,После промывки водной фазы сложным этиловым эфиром уксусной кислоты устанавливают 10%-ой соляной кислотой значение рН в 2 и экстрагируют этиловым эфиром уксусной кислоты. Объединенные органические фазы про 001605 26 мывают водой, сушат и концентрируют под вакуумом. Получают 2,52 г сырого продукта, который был перекристаллизован из толуола. (Тпл: 156-157 С) 2-[2,4-дихлор-3-(1'-метоксиимино-1'-(метокси)метил)бензоил]-1,3-циклогександион(соединение 2.10) К раствору из 0,46 г (0,0045 моль) триэтиламина и 0,5 г (0,0045 моль) 1,3 циклогександиона в 50 мл метиленхлорида подают 1,125 г (0,0038 моль) 2,4-дихлор-3-(1 метоксиимино-1'-(метокси)метил)бензоилхлорида. После перемешивания реакционного раствора в течение 2 ч при комнатной температуре под вакуумом удаляют растворитель. Остаток подвергают хроматографической очистке на силикагеле (элюент:толуол/этиловый эфир уксусной кислоты в соотношении 1/1). Полученный таким образом энольный эфир загружают в 50 мл ацетонитрила и примешивают 0,80 г (0,008 моль) триэтиламина и 0,15 г (0,0015 моль) триметилсилилцианида. Через 12 ч перемешивания при комнатной температуре удаляют растворитель и остаток загружают в метиленхлорид, органическую фазу промывают разбавленной фосфорной кислотой, сушат и концентрируют. Получают 0,90 г 2-[2,4-дихлор-3-(1'-метоксиимино-1'(метокси)метил)бензоил]-1,3-циклогександиона,который вымешивают из диэтилового эфира.(Тпл: 180-182 С) В нижеследующей таблице 2 приведены наряду с вышеописанными соединениями формулы I другие соединения, полученные и получаемые аналогичным образом. Таблица 2 Ниже приводится синтез некоторых исходных веществ: 2-хлор-3-этоксииминометил-4-метилсульфонилбензойная кислота (соединение 3.04). Стадия а) 2-хлор-3-метил-4-метилтиоацетофенон. 27 К суспензии из 286 г (2,14 моля) трихлорида алюминия в 420 мл 1,2-дихлорэтана подают по каплям при 15-20 С раствор из 157 г (2 моль) ацетилхлорида в 420 мл 1,2-дихлорэтана. После этого добавляют по каплям раствор из 346 г (2 моля) 2-хлор-6-метилтиотолуола в 1 л 1,2-дихлорэтана. Через 12 ч перемешивания реакционную смесь выливают в смесь из 3 л льда и 1 л концентрированного HCl. Все экстрагируют метиленхлоридом, органическую фазу промывают водой, сушат сульфатом натрия и концентрируют. Остаток отгоняют под вакуумом. Получают 256 г (60 % от теории) 2-хлор-3 метил-4-метилтио-ацетофенона. (Тпл: 46 С) Стадия б) 2-хлор-3-метил-4-метилсульфонилацетофенон. 163,0 г (0,76 моль) 2-хлор-3-метил-4 метилтиоацетофенона растворяют в 1,5 л ледяной уксусной кислоты, примешивают 18,6 г вольфрамата натрия и при охлаждении подают по каплям 173,3 г 30%-ого раствора перикиси водорода. Перемешивают еще в течение 2 дней и после этого разбавляют водой. Выпавшее твердое вещество отсасывают, промывают водой и сушат. Получают 164,0 г (88% от теории) 2-хлор-3-метил-4-метилсульфонилацетофенона.(Тпл: 110-111 С). Стадия в) 2-хлор-3-метил-4-метилсульфонилбензойная кислота. 82 г (0,33 моль) 2-хлор-3-метил-4 метилсульфонилацетофенона растворяют в 700 мл диоксана и при комнатной температуре примешивают 1 л 12,5-го раствора гипохлорита натрия. После этого 1 ч перемешивают при 80 С. После охлаждения образуются две фазы, нижнюю из которых разбавляют водой и слабо подкисляют. Выпавшее твердое вещество отсасывают, промывают водой и сушат. Получают 60 г(73 % от теории) 2-хлор-3-метил-4-метилсульфонил-бензойной кислоты. (Тпл: 230-231 С). Стадия г) сложный метиловый эфир 2 хлор-3-метил-4-метилсульфонилбензойной кислоты. 100 г (0,4 моля) 2-хлор-3-метил-4 метилсульфонилбензойной кислоты растворяют в 1 л метанола и в течение 5 ч при температуре с обратным холодильником обрабатывают хлористым водородом. После этого производят концентрирование реакционной смеси. Получают 88,5 г (84% от теории) сложного метилового эфира 2-хлор-3-метил-4-метилсульфонилбензойной кислоты. (Тпл:107-108 С). Стадия д) сложный метиловый эфир 3 бромметил-2-хлор-4-метилсульфонилбензойной кислоты. 82 г (0,31 моля) сложного метилового эфира 2-хлор-3-метил-4-метилсульфонилбензойной кислоты растворяют в 2 л тетрахлорметана и примешивают порциями под облучением 56 г 28 бутилового эфира. К раствору примешивают петролейный эфир, выпавшее твердое вещество отсасывают и сушат. Получают 74,5 г (70% от теории) сложного метилового эфира 3 бромметил-2-хпор-4-метилсульфонилбензойной кислоты. (Тпл: 74-75 С). Стадия e) сложный метиловый эфир 2 хлор-3-формил-4-метилсульфонилбензойной кислоты. Раствор из 41,0 г (0,12 моль) сложного метилового эфира 3-бромметил-2-хлор-4-метилсульфонилбензойной кислоты в 250 мл ацетонитрила смешивают с 42,1 г (0,36 моль) Nметилморфолин-N-оксида. Смесь перемешивают в течение 12 ч при комнатной температуре,после этого концентрируют и остаток подают в сложный этиловый эфир уксусной кислоты. Раствор экстрагируют водой, сушат сульфатом натрия и концентрируют. Получают 31,2 г (94% от теории) сложного метилового эфира 2-хлор 3-формил-4-метилсульфонилбензойной кислоты. (Тпл: 98-105 С). Стадия ж) 2-хлор-3-формил-4-метилсульфонилбензойная кислота. К раствору из 9,60 г (0,072 моль) йодида лития и 70 мл сухого пиридина медленно подают по каплям при температуре обратного холодильника раствор из 5,00 г (0,018 моль) сложного метилового эфира 2-хлор-3-формил-4 метилсульфонилбензойной кислоты. После перемешивания в течение 2 ч реакционную смесь охлаждают с обратным холодильником и удаляют под вакуумом растворитель. Остаток подают в воду и разбавленной соляной кислотой устанавливают на значение рН порядка 1-2. После экстрагирования водной фазы сложным этиловым эфиром уксусной кислоты собранную органическую фазу промывают водой для нейтрализации, сушат и концентрируют. Получают 4,00 г 2-хлор-3-формилметилсульфонил-бензойной кислоты (выход 85%). (1 Н-ЯМР-спектр(d6-DMSO,в част./мил): 3,41 (s, 3 Н); 8,05 (d,1H); 8,11 (d, 1H); 10,49 (s, 1H); 14,21 (s, br., 1H).) Стадия з) 2-хлор-3-этоксииминометил-4 метилсульфонилбензойная кислота. 1,63 г (0,017 моль) этоксиамингидрохлорида и 1,15 г (0,0085 моль) тонко распыленного карбоната калия смешивают с 60 мл сухого метанола в течение 1 ч. После этого подают 4,00 г(0,015 моль) 2-хлор-3-формил-4-метилсульфонилбензойной кислоты в 40 мл метанола. После перемешивания в течение 12 ч при комнатной температуре удаляют растворитель, остаток подают в сложный этиловый эфир уксусной кислоты и органическую фазу четыре раза промывают водой. После сушки и отгонки растворителя получают 3,60 г 2-хлор-3-этоксииминометил-4-метилсульфонилбензойной кислоты (выход 78%). (Тпл: 155-160 С). Альтернативно к этому: 29 стадия ж') сложный метиловый эфир 2 хлор-3-зтоксииминометил-4-метилсульфонилбензойной кислоты (соединение 3.01). 1,90 г (0,0195 моль) этоксиамингидрохлорида и 1,35 г (0,0097 моль) тонко распыленного карбоната калия перемешивают в течение 1 ч в 60 мл сухого метанола при комнатной температуре и после этого добавляют 4,90 г (0,0177 моль) сложного метилового эфира 2-хлор-3 формил-4-метилсульфонилбензойной кислоты. После восьмичасового перемешивания при комнатной температуре удаляют растворитель, остаток загружают в сложный этиловый эфир уксусной кислоты. Органическую фазу промывают для нейтрализации водой , сушат и концентрируют под вакуумом. Получают 5,00 г метилового эфира 2-хлор-3-этоксииминометил-4 метилсульфонилбензойной кислоты (выход 88%). (1 Н-ЯМР-спектр (CDCl3,в част./мил): 1,34 (t, 3 Н); 3,29 (s, 3 Н); 3,98 (s, 3 Н); 4,26 (q,2H); 7,91 (d, 1H); 8,10 (d, 1H); 8,38 (s, 1H. Стадия з') 2-хлор-3-этоксииминометил-4 метилсульфонилбензойная кислота. К 7,29 г (0,055 моль) йодида лития в 50 мл сухого пиридина подают медленно по каплям раствор из 4,37 г (0,0137 моль) сложного метилового эфира 2-хлор-3-этоксииминометил-4 метилсульфонил-бензойной кислоты. После перемешивания в течение 2 ч реакционную смесь охлаждают с обратным холодильником и удаляют растворитель под вакуумом. Остаток загружают в воду и устанавливают разбавленной соляной кислотой на значение рН порядка 1-2. После экстрагирования водной фазы этиловым эфиром уксусной кислоты собранную органическую фазу промывают водой, сушат и концентрируют под вакуумом. Получают 3,70 г 2 хлор-3-этоксииминометил-4-метилсульфонилбензойной кислоты. (Выход продукта 89%).(Тпл: 155-160 С). Метиловый эфир 2-хлор-3-хлоркарбонил 4-метилсульфонилбензойной кислоты. Стадия а) метиловый эфир 2-хлор-3 гидроксикарбонил-4-метилсульфонилбензойной кислоты К раствору из 115,3 г (0,42 моль) сложного метилового эфира 2-хлор-3-формил-4-метилсульфонилбензойной кислоты и 2000 мл ацетонитрила последовательно добавляют при 5 С 13,8 г (0,11 моль) моногидрата динатрийфосфата в 170 мл воды, 49,3 г (0,43 моль) 30%-го раствора перикиси водорода и 66,2 г (0,59 моль) 80%-го раствора хлорита натрия. После этого реакционную смесь перемешивают в течение 1 часа при 5 С и в течение 12 ч при комнатной температуре. Затем смесь устанавливают 10%ой соляной кислотой на значение рН порядка 1 и добавляют 1500 мл водного 40%-го раствора бисульфита натрия. После одночасового перемешивания при комнатной температуре водную фазу экстрагируют три раза этиловым эфиром уксусной кислоты. Собранную органическую 30 фазу промывают раствором бисульфита натрия и сушат. После отгонки растворителя получают 102,0 г метилового эфира 2-хлор-3-гидроксикарбонил-4-метилсульфонилбензойной кислоты.(s, 3 Н); 3,93 (s, 3 Н); 8,08 (s, 2H); 14,50 (s, br.,1H).) Стадия б) метиловый эфир 2-хлор-3 хлоркарбонил-4-метилсульфонилбензойной кислоты К раствору 6,0 г (0,021 моль) метилового эфира 2-хлор-3-гидроксикарбонил-4-метилсульфонилбензойной кислоты и 50 мл сухого толуола подают 2 капли диметилформамида и 11,9 г(0,1 моль) тионилхлорида. Раствор нагревают с обратным холодильником в течение 4 ч. После удаления растворителя под вакуумом получают 6,2 г метилового эфира 2-хлор-3-хлоркарбонил 4-метилсульфонил-бензойной кислоты (1 НЯМР-спектр (CDCl3;в част./мил.): 3,21 (s, 3 Н); 4,02 (s, 3 Н); 8,02 (d, 1H);8,07(d, 1H).) 2,4-дихлор-3-(1'-метоксиимино-1'-(метокси)метил)4 бензоилхлорид (соединениe 3.14). Стадия а) 2,4-дихлор-3-метилацетофенон. К раствору из 502,0 г (3,12 моль) 2,6 дихлортолуола и 408,0 г (3,06 моль) трихлорида алюминия добавляют по каплям при 100 С при перемешивании 235,0 г (3,0 моль) ацетилхлорида в течение 2 ч. После 2 ч перемешивания при 100-105 С смесь охлаждают и выливают на 3 л льда и 1 л воды. Выпавшее при этом твердое вещество отсасывают и промывают для нейтрализации d 800 мл воды. После сушки при 40 С получают 500,0 г 2,4-дихлор-3-метилацетофенона в качестве сырого продукта, который после этого отгоняют под высоким вакуумом. (Ткип: 121-128 С (4 мбар. Стадия б) 2,4-дихлор-3-метилбензойная кислота. В раствор 520,0 г (13 моль) гидроокиси натрия в 2600 мл воды подают по каплям при 010 С сначала 655,2 г (4,1 моль) брома и потом 203,0 г (1,0 моль) 2,4-дихлор-3-метилацетофенона в 1300 мл 1,4-диоксан. После перемешивания в течение 12 ч органическую фазу отделяют, водную фазу смешивают с 30%-ым раствором, полученным из пиросульфита натрия и воды, и смесь устанавливают на значение рН порядка 1. Выпавший осадок отсасывают, промывают водой и сушат под вакуумом при 60 С. Получают 197,0 г 2,4-дихлор-3-метил-бензойной кислоты. (Тпл: 173-175 С). Стадия в) сложный метиловый эфир 2,4 дихлор-3-метилбензойной кислоты. К раствору из 424,0 г (2 моля) 2,4-дихлор 3-метилбензойной кислоты и 1500 мл метанола подают по каплям 60 мл концентрированной серной кислоты. После нагрева с обратным холодильником в течение 5 ч реакционную смесь охлаждают, концентрируют под вакуумом и после этого загружают в 1000 мл метиленхло 31 рида. Органическую фазу промывают водой,потом 5%-ым раствором бикарбоната натрия и потом снова водой, сушат и концентрируют под вакуумом. Получают 401,0 г метилового эфира 2,4-дихлор-3-метилбензойной кислоты.(Ткип:103-107 С (1-1,5 мбар. Стадия г) сложный метиловый эфир 3 бромметил-2,4-дихлорбензойная кислота. К раствору из 84,0 г (0,38 моль) сложного метилового эфира 2,4-дихлор-3-метилбензойной кислоты и 67,6 г (0,38 моль) N-бромсукцинимида в 380 мл тетрахлорметана подают 1,0 г азобисизобутиронитрила. После нагревания с обратным холодильником в течение 3,5 ч реакционную смесь охлаждают и образовавшийся осадок отсасывают. Фильтрат концентрируют под вакуумом и полученный осадок вымешивают из метил-трет.-бутилового эфира. Получают 108,0 г сложного метилового эфира 3 бромметил-2,4-дихлорбензойной кислоты. (Тпл: 51-54 С). Стадия д) сложный метиловый эфир 2,4 дихлор-3-формилбензойной кислоты. К раствору из 312,0 г (0,99 моль) сложного метилового эфира 3-бромметил-2,4-дихлорбензойной кислоты в 2 л ацетонитрила подают по каплям с обратным холодильником 696,2 г (2,97 моль) водного 50%-го раствора N-метилморфолин-N-оксида. После перемешивания в течение 48 ч при комнатной температуре реакционную смесь смешивают с 6 л воды, выпавший остаток отсасывают, промывают водой и сушат под вакуумом. Получают 141,3 г сложного метилового эфира 2,4-дихлор-3-формилбензойной кислоты. (1 Н-ЯМР-спектр (CDCl3,в част./мил): 3,98 (s, 3 Н); 7,47 (d, 1H); 7,84 (d,1H); 10,48 (s, 1H).) Стадия e) метиловый эфир 2,4-дихлор-3 гидроксикарбонилбензойной кислоты. К раствору из 40,0 г (0,172 моль) метилового эфира 2,4-дихлор-3-формилбензойной кислоты и 500 мл ацетонитрила подают при 5 С последовательно 5,9 г (0,043 моль) моногидрата динатрийфосфата в 70 мл воды, 20,5 г (0,181 моль) 30%-го раствора перекиси водорода и 27,3 г (0,241 моль) 80%-го раствора хлорита натрия. Реакционный раствор перемешивают в течение 1 ч при 5 С и в течение 12 ч при комнатной температуре. После этого устанавливают 10%ой соляной кислотой значение рН на величину 1 и добавляют 500 мл 40%-го раствора бисульфита натрия. После перемешивания в течение 1 часа при комнатной температуре водную фазу три раза экстрагируют сложным этиловым эфиром уксусной кислоты (метилацетатом), собранную органическую фазу промывают 1,0 л 10%-го раствора дисульфита натрия и после этого сушат. После отгонки растворителя получают 40,0 г сложного этилового эфира 2,4 дихлор-3-гидроксикарбонилбензойной кислоты.(s, 3 Н); 7,69 (d, 1H); 7,89 (d,1H).) Стадия ж) сложный метиловый эфир 3 хлоркарбонил-2,4-дихлорбензойной кислоты. К раствору из 5,00 г (0,02 моль) сложного метилового эфира 2,4-дихлор-3-гидроксикарбонилбензойной кислоты и 50 мл сухого толуола подают 2 капли диметилформамида и 11,90 г(0,1 моль) тионилхлорида. Раствор нагревают 4 ч с обратным холодильником. После отгонки растворителя получают 5,35 г сложного метилового эфира 3-хлоркарбонил-2,4-дихлорбензойной кислоты. Стадия з) сложный метиловый эфир 2,4 дихлор-3-метоксиаминокарбонил-бензойной кислоты. К раствору из 5,35 г (0,02 моль) сложного метилового эфира 3-хлоркарбонил-2,4-дихлорбензойной кислоты и 100 мл дихлорметана подают 4,60 г (0,045 моль) триэтиламина и 3,75 г(0,045 моль) метоксиамингидрохлорида. После перемешивания в течение 12 ч при комнатной температуре реакционную смесь промывают разбавленной фосфорной кислотой, сушат и концентрируют. Полученный остаток вымешивают в диэтиловом эфире. Получают 4,80 г сложного метилового эфира 2,4-дихлор-3 метоксиаминокарбонил-бензойной кислоты(Тпл: 162-164 С) Стадия и) сложный метиловый эфир 2,4-дихлор-3-(1'-метоксиимино-1'-(метокси)метил)бензойной кислоты (соединение 3.09). Смесь из 16,0 г (0,058 моль) сложного метилового эфира 2,4-дихлор-3-метоксиаминокарбонилбензойной кислоты и 10,1 г (0,073 моль) карбоната калия в 300 мл диметилформамида перемешивают 30 мин при комнатной температуре. После этого подают по каплям 11,0 г(0,087 моль) диметилсульфата, перемешивают 12 ч при комнатной температуре и снова подают 11,0 г (0,087 моль) диметилсульфата. После нагревания в течение 6 ч на 60 С реакционную смесь охлаждают и смешивают с 2 л ледяной воды. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты, собранную органическую фазу сушат и растворитель отгоняют под вакуумом. После хроматографической очистки остатка на силикагеле (элюент:толуол/ этиловый эфир уксусной кислоты в соотношении 9/1) получают 2,0 г сложного метилового эфира 2,4-дихлор-3-(1'-метоксиимино-1'-(метокси)метил)бензойной кислоты. 33 моль) гидрохлорида натрия в 50 мл воды перемешивают 2 ч при 80 С. После охлаждения реакционную смесь смешивают с 200 мл ледяной воды и устанавливают концентрированной соляной кислотой значение рН на 1. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты, собранную органическую фазу сушат и концентрируют под вакуумом. Получают 2,10 г 2,4-дихлор-3-(1'-метоксиимино-1'(метокси)метил)бензойной кислоты (1H-ЯМРспектр (d6-ДМСО,в част./мил.): 3,53 (s, 3 Н); 3,72 (s, 3 Н); 7,74 (d,1H); 7,95 (d,1H).) Стадия л) 2,4-дихлор-3-(1-метоксиимино 1'-(метокси)метил)бензоилхлорид (соединение 3.14). Раствор из 2,10 г (0,0076 моль) 2,4-дихлор 3-(1'-(метокси)имино-1'-метоксиметил)бензойной кислоты и 20,00 г тионилхлорида в 50 мл сухого толуола перемешивают в течение 2 ч при 80 С. После удаления растворителя под вакуумом получают 2,25 г 2,4-дихлор-3-(1'метоксиимино-1'-(метокси)метил)бензоилхлорида Сложный метиловый эфир 2,4-дихлор-3 пропоксиаминокарбонилбензойной кислоты К раствору из 4,50 г (0,04 моль) пропоксиамингидрохлорида и 4.05 г (0,04 моль) триэтиламина в 200 мл метиленхлорида медленно добавляют по каплям при 30 С 10,7 г (0,04 моль) сложного метилового эфира 3-хлоркарбонил-2,4-дихлорбензойной кислоты в 100 мл метиленхлорида. После перемешивания в течение 2 ч при комнатной температуре реакционную смесь промывают разбавленной фосфорной кислотой, сушат и концентрируют. Полученный остаток хроматографически очищают на силикагеле (элюент: толуол/этиловый эфир уксусной кислоты в соотношении 9/1). Получают 11,50 г сложного метилового эфира 2,4-дихлор-3 пропоксиаминокарбонилбензойной кислоты(Тпл: 80-81 С). Сложный метиловый эфир 3-(4 хпорбензилоксиаминокарбонил)-2,4-дихлорбензойной кислоты. К смеси из 7,76 г (0,04 моль) 4 хлорбензилоксиамингидрохлорида и 4,05 г (0,04 моль) триэтиламина в 200 мл метиленхлорида медленно по каплям подают при 30 С 10,70 г(0,04 моль) сложного метилового эфира 3 хлоркарбонил-2,4-дихлорбензойной кислоты в 50 мл метиленхлорида. После перемешивания в течение 12 ч при комнатной температуре реакционную смесь промывают разбавленной фосфорной кислотой, сушат и концентрируют. После выделения остатка диметилэфиром получают 19,00 г сложного метилового эфира 3-(4 хлорбензилоксиаминокарбонил)-2,4-дихлорбензойной кислоты. (Тпл: 120-121 С). 3-(1'-метоксииминоэт-1-ил)-2-метил-4 метилсульфонилбензойная кислота (соединение 3.22). Стадия а) 3-(1'-метоксииминоэт-1'-ил)-2 метиланилин.(0,503 моль) O-метилгидроксиламингидрохлорида перемешивают с 400 мл этанола при комнатной температуре. После удаления растворителя остаток загружают в метиленхлорид и промывают водой, сушат и концентрируют. Получают 54 г (91% от теории) 3-(1 метоксииминоэт-1-ил)-2-метиланилина. Стадия б) 3-(1'-метоксииминоэт-1-ил)-2 метил-4-роданоанилин. К 54,0 г (0,303 моль) 3-(1'-метоксиминоэт 1'-ил)-2-метиланилин, 49,3 г (0,479 моль) бромида натрия и 77,5 г (0,956 моль) роданида натрия в 300 мл метанола подают по каплям при-20 до -15 С 50,9 г (0,319 моль) брома. Через 30 мин перемешивания при этой температуре нерастворимые составные части отсасывают,фильтрат смешивают со сложным этиловым эфиром уксусной кислоты и водным раствором бикарбоната натрия устанавливают рН на значение 8. Органическую фазу отделяют и оставшуюся водную фазу несколько раз экстрагируют сложным этиловым эфиромуксусной кислоты. Собранную органическую фазу промывают водой, сушат и концентрируют. Получают 67,3 г(95% от теории) 3-(1'-метоксииминоэт-1'-ил)-2 метил-4-роданоанилина. Стадия в) 3-(1'-метоксииминоэт-1'-ил)-2 метил-4-метилтиоанилин. К 40,4 г (0,315 моль) сульфида натрия в 200 мл воды подают по каплям при 20 до 30 С 67,3 г (0,286 моль) 3-(1'-метоксииминоэт-1'-ил)2-метил-4-роданоанилина в 600 мл метанола. После перемешивания в течение 3 ч при комнатной температуре добавляют 45,1 г (0,318 моль) метилйодида в 200 мл метаноа, также при 20 до 30 С. После этого перемешивают 12 ч при комнатной температуре, удаляют растворитель,остаток загружают в воду и несколько раз экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу промывают водой,сушат, концентрируют и полученный таким образом остаток дигерируют н-гексан/метил-трет.бетиловым эфиром. Получают 43,2 г (67% от теории) 3-(1'-метоксииминоэт-1'-ил)-2-метил-4 метилтио-анилина, (Тпл: 83-89 С). Стадия г) 6-бром-2-(1'-метоксииминоэт-1'ил)-3-метилтиотолуол. К 3,00 г (13,4 ммоль) 3-(1'-метоксииминоэт-1'-ил)-2-метил-4-метилтиоанилина в 13,40 г ледяной уксусной кислоты подают по каплям при комнатной температуре 9,23 г 47%ной бромистоводородной кислоты. После этого добавляют 9,23 г воды, 10 мин перемешивают при комнатной температуре и при -5 до 0 С подают 0,92 г (13,4 ммоль) нитрита натрия в 1,9 мл воды. Полученную реакционную смесь подают по каплям при 0 С к 1,92 г (13,4 ммоль) бромиду меди (I) в 6 мл 47%-ой бромистоводородной кислоты. После перемешивания в течение 12 часов при комнатной температуре смесь выли 35 вают на ледяную воду и экстрагируют метиленхлоридом. Органическую фазу промывают потом раствором сульфита натрия и воды, сушат и удаляют растворитель. Получают 2,50 г (65% от теории) 6-бром-2-(1'-метоксииминоэт-1'-ил)-3 метилтиотолуола. Стадия д) 6-бром-2-(1'-метоксииминоэт-1 ил)-3-метилсульфонилтолуол. К 2,5 г (8,71 ммоль) 6-бром-2-(1-метоксиимино-1'-ил)-3-метилтиотолуол в 50 мл метиленхлорида подают в течение 96 часов по порциям в общем 7,0 г (34,80 ммоль) м-хлорбензойной кислоты. После удаления растворителя реакционную смесь загружают в органический растворитель, раствор карбоната натрия, раствор сульфита натрия и воды промывают, сушат и концентрируют. Остаток хроматографически очищают на силикагеле (элюент:толуол/ сложный этиловый эфир уксусной кислоты). Получают 0,8 г (29 % от теории) 6-бром-2-(1'метоксииминоэт-1'-ил)-3-метилсульфонилтолуола. Стадия e) 3-(1'-метоксииминоэт-1'-ил)-2 метил-4-метилсульфонил-бензойная кислота. 0,77 г (2,41 ммоль) 6-бром-2-(1'-метоксииминоэт-1'-ил)-3-метилсульфонилтолуола, 0,03 г (0,1 ммоль) ацетата палладия, 0,14 г (0,49 ммоль) трихлоргексилфосфина, 0,10 г (2,4 ммоль) хлорида лития и 0,49 г (4,81 ммоль) триэтиламина суспендируют в 37,5 мл толуола и 17,5 мо воды и при 140 С, при давлении в 20 бар 36 ч пропускают газ. После охлаждения отделяют нерастворимую составную часть, органическую фазу экстрагируют водой (которую смешивают с 1 мл триэтиламина). Полученную водную фазу устанавливают соляной кислотой на значение рН порядка 1 и экстрагируют метиленхлоридом. Эту органическую фазу сушат и концентрируют. Получают 0,62 г (90% от теории) 3-(1'-метоксииминоэт-1'-ил)-2-метил-4 метилсульфонилбензойной кислоты. В нижеследующей таблице 3 приведены наряду с описанными выше соединениями другие производные бензойной кислоты формулыIIIа, которые были получены или могут быть получены аналогичным образом.I и их применимые в сельском хозяйстве соли пригодны в качестве гербицидов как смеси изомеров, так и как чистые изомеры. Содержащие соединения формулы I гербицидные средства хорошо пригодны для борьбы с ростом растений на площадях, занятых некультурными растениями, в частности, при высоких количествах внесения. На таких культурах, как пшеница,рис, кукуруза, соя и хлопок они действуют против сорняков и сорных злаковых растений, без достойного упоминания повреждения культурных растений. Этот эффект имеет место прежде всего при низких количествах внесения. В зависимости от соответствующего метода применения соединения формулы I, соответственно содержащие их средства, могут применяться еще на целом ряде культурных растений для устранения нежелательных растений. При этом следует назвать следующие культуры:vulgaris, Picea abies, Pinus spec., Pisum sativum,Prunus avium, Prunus persica, Pyrus communis,Ribes sylestre, Ricinus communis, Saccharum officinarum, Secale cereale, Solanum tuberosum, Sorghum bicolor (см. vulgare), Theobroma cacao, Trifolium pratense, Triticum aestivum, Triticum durum, Vicia faba, Vitis vinifera, Zea mays. Кроме того, соединения формулы I могут применяться на культурах, которые терпимы к действию гербицидов на основе растениеводства, включая генетические методы. Соединения формулы I, соответственно содержащие эти соединения гербицидные средства могут применяться, например, в форме непосредственно разбрызгиваемых водных растворов, порошков, суспензий, также и высокопроцентных водных, масляных или прочих суспензий или дисперсий, эмульсий, масляных дисперсий, паст, опыливающих средств, разбрасываемых средств или гранулята, причем они наносятся разбрызгиванием, распыления, опыливания, разбрасывания или полива. Формы применения ориентируются на цель применения, они в любом случае должны обеспечивать по возможности тонкое распределение веществ согласно изобретению. Гербицидные средства содержат обладающее гербицидным действием количество по крайней мере одного соединения формулы I или одной сельскохозяйственно применимой соли формулы I и обычные для получения препаративных форм средств защиты растений вспомогательные средства. В качестве инертных дополнительных средств пригодны в основном фракции минеральных масел от средней до высокой точками кипения, такие как керосин или дизельное масло, далее масло из каменноугольной смолы, а также масла растительного или животного происхождения, алифатические, циклические или ароматические углеводороды, например, парафин, тетрагидронафталин, алкилированные нафталины или их производные, алкилированные бензолы или их производные, спирты, такие как метанол, этанол, пропанол, бутанол, циклогексанол, кетоны, такие как циклогексанон или сильно полярные растворители, например, амины, такие как N-метилпирролидон или вода. Водные формы применения могут быть приготовлены из концентратов эмульсий, суспензий, паст, смачиваемых порошков или диспергируемого в воде гранулята путем добавки воды. Для изготовления эмульсий, паст или 38 масляных дисперсий субстраты могут гомогенизироваться в воде как сами, так и растворенные в масле или в растворителе, с помощью смачивающих, прилипательных, диспергирующих или эмульгирующих добавок. Также могут изготавливаться состоящие из действующего вещества,из смачивающего, прилипательного или эмульгирующего средства и, при необходимости, растворителя или масла концентраты, которые пригодны для разбавления в воде. В качестве поверхностно-активных веществ могут применяться соли щелочных, щелочноземельных металлов, аммониевые соли ароматических сульфокислот, например, лигнин-, фенол-, нафталин- и дибутилнафталинсульфокислоты, а также соли жирных кислот,алкил- и алкиларилсульфонаты, алкилсульфаты,лаурилсульфоэфиры, сульфаты жирных спиртов, а также соли сульфатированных гексанолов, гептанолов и октадеканолов, а также гликолевого эфира жирных спиртов, продукты конденсации сульфонированного нафталина и его производных с формальдегидом, продукты конденсации нафталина, соответственно, нафталинсульфокислот с фенолом и формальдегидом,эфир полиоксиэтиленоктилфенола, этоксилированный изооктилфенол, октилфенол или нонилфенол, алкилфенилполигликолевый эфир, трибутилфенилполигликолевый эфир, алкиларилполиэфирные спирты, изотридециловый спирт,конденсаты этиленоксидов жирных спиртов,этоксилированное касторовое масло, простой полиоксиэтиленалкиловый эфир или полигликолэфирный ацетат лауриновых спиртов, эфир сорбита, отработанны лигнин-сульфатный щелок или метилцеллюлоза. Порошковые, разбрасываемые и распыливаемые средства могут изготавливаться путем смешения или промеливания активных веществ вместе с твердыми наполнителями. Гранулят, например, пропитанный, оболочковый и гомогенный гранулят может изготавливаться путем связывания активных веществ с твердыми наполнителями. Твердыми наполнителями являются минеральные земли,например, кремниевые кислоты, силикаты,тальк, каолин, известняк, известь, мел, болус,лесс, глина, доломит, диатомовая земля, сульфат кальция и сульфат магния, окись магния,измельченная пластмасса, удобрения, такие как сульфат аммония, фосфат аммония, нитрат аммония, мочевина и растительные продукты, такие как зерновая мука, мука древесной коры,древесная мука и мука ореховой скорлупы, порошок целлюлозы и другие наполнители. Концентрация соединений формулы I в препаративных формах может вариироваться в широких пределах. Препаративные формы содержат в общем 0,001 до 98 вес.%, предпочтительно, 0,01 до 95 вес.% по крайней мере одного активного вещества. Активные вещества применяются при этом с чистотой от 90 до 100%, 39 предпочтительно от 95% до 100 % (по спектру ЯМР). Препаративные формы соединений формулы I согласно изобретению можно изготавливать, например, следующим образом:I. 20 весовых долей соединения Nr. 2.01 растворяют в смеси, состоящей из 80 весовых долей алкилированного бензола, 10 весовых долей продукта присоединения 8 до 10 молей этиленоксида к 1 молю моноэтаноламида Nолеиновой кислоты, 5 весовых долей соли кальция додецилбензол-сульфокислоты и 5 весовых долей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. Путем выливания и тонкого распределения раствора в 100 000 вес, долей воды получают водную дисперсию, которая содержит 0,02 вес.% активного вещества.II. 20 весовых долей соединения Nr. 2.03 растворяют в смеси, состоящей из 40 весовых долей циклогексанона, 30 весовых долей изобутанола, 20 весовых долей продукта присоединения 7 молей этиленоксида к 1 молю изооктифенола и 10 весовых долей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. Путем вливания и тонкого распределения в 100 000 весовых долей воды получают водную суспензию, содержащую 0,02 вес.% активного вещества.III. 20 весовых долей активного веществаNr. 2.05 растворяют в смеси, состоящей из 25 весовых долей циклогексанона, 65 весовых долей фракции минерального масла с точкой кипения от 210 до 280 С и 10 весовых долей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. Путем вливания и тонкого распределения в 100 000 весовых долей воды получают водную суспензию, содержащую 0,02 вес.% активного вещества.IV. 20 весовых долей активного веществаNr. 2.07 хорошо перемешивают с 3 весовыми долями нитриевой сили диизобутилнафталинсульфокислоты, 17 весовых долей натриевой соли лигнинсульфокислоты из отработанного сульфит-щелока и 60 весовых долей порошкообразного силикагеля и все промеливают в молотковой мельнице Благодаря тонкому распределению смеси в 20 000 весовых долях воды получают отвар для опрыскивания, который содержит 0,1 вес.% активного вещества.V. 3 весовых долей активного вещества Nr. 2.10 смешивают с 97 весовыми долями тонкого каолина. Таким образом получают средство распыления, содержащее 3 вес.% активного вещества.VI. 20 весовых долей активного веществаNr. 2.14 хорошо перемешивают с 2 весовыми долями соли кальция додецилбензолсульфокислоты, 8 весовыми долями полигликолевого эфира жирных спиртов, 2 весовыми долями натриевой соли конденсата фенол-мочевинаформальдегид и 68 весовыми долями парафино 001605 40 вого минерального масла. Получают стабильную масляную дисперсию.VII. 1 весовую долю соединения 2.06 растворяют в смеси, состоящей из 70 весовых долей циклогексанона, 20 весовых долей этоксилированного изооктилфенола и 10 весовых долей этоксилированного касторового масла. Получают стабильный концентрат эмульсии.VIII. 1 весовую долю соединения 2.09 растворяют в смеси, состоящей из 80 весовых долей циклогексанона и 20 весовых долей продукта WettolT ЕМ 31 (неионный эмульгатор на базе этоксилированного касторового масла). Получают стабильный концентрат эмульсии. Применение активных веществ формулы I,соответственно гербицидных средств, может осуществляться довсходовым или послевсходовым методом. Если активные вещества менее переносимы определенными культурными растениями, можно применять технику внесения,при которой гербицидные средства распрыскивают с помощью опрыскивающих приспособлений таким образом, что они по возможности не попадают на листья чувствительных культур, в то время как попадают на листья рaстущих внизу нежелательных растений или попадают в незащищенный грунт (методы post-directed, layby). Для расширения спектра активных веществ и для получения синергитического эффекта соединения формулы I могут примешиваться к многочисленным другим гербицидным или регулирующим рост группам активных веществ и вносятся совместно. Например, в качествe партнеров в смеси пригодны: 1,2,4 тиадиазолы, 1,3,4-тиадиазолы, амиды, аминофосфорная кислота и ее производные, аминотриазолы, анилиды, (гет)-арилалкоксиалкенкарбоновая кислота и ее производные, бензойная кислота и ее производные, бензотиадиазиноны,2-ароил-1,3-циклогександионы, гетарил-арилкетоны, бензилизоксазолидиноны, производные мета-СF3-фенила, карбаматы, хинолинкарбоновая кислота и ее производные, хлорацетанилиды, производные циклогексанон-оксимэфира,диазины, дихлорпропионовая кислота и ее производные, дигидробензофураны, дигидрофуран 3-оны, динитроанилины, динитрофенолы, дифенилэфир, дипиридилы, галогекарбоновые кислоты и их производные, мочевина, 3 фенилурацилы, имидазолы, имидазолиноны, Nфенил-3,4,5,6-тетрагидрофталимиды, оксадиазолы, оксираны, фeнолы, сложный эфир арилокси- или гетероарилоксифеноксипропионовой кислоты, фенилуксусная кислота и ее производные, фенилпропионовая кислота и ее производные, пиразола, фенилпиразолы, пиридазины,пиридинкарбоновая кислота и ее производные,пиримидиловый эфир, сульфонамиды, сельфонмочевина, триазины, триазиноны, триазолиноны, триазолкарбоксамиды, урацилы. 41 Кроме того, полезным является смешение соединений формулы I одних или в комбинации с другими гербицидами с другими средствами защиты растений и их совместное внесение,например, со средствами борьбы с вредителями или питофатогенными грибами или бактериями. Интерес представляет также смешиваемость этих соединений с растворами минеральных солей, которые применяются для устранения дефицитов в питательных веществах и микроэлементах. Могут добавляться непитотоксические масла и концентраты. Дозы внесения активного вещества составляют в зависимости от цели применения, времени года, целевых растений и стадии роста от 0,001 до 3,0, предпочтительно 0,01 до 1,0 кг/га активного вещества (a. S.) Примеры применения Гербицидное действие средств согласно изобретению можно показать с помощью испытаний в теплице. В качестве парниковых емкостей служили пластмассовые горшки с глинистым песком с прибл. 3,0% гумуса в качестве субстрата. Семена испытательных растений сеяли с разделением по сорту. При предвсходовой обработке суспендированное в воде средство наносили непосредственно после посева с помощью тонко распределяющих сопел. Емкости слегка орошали, чтобы способствовать прорастанию и росту и после этого покрывали прозрачной пластмассовой пленкой до тех пор, пока растения не подросли. Это покрытие приводит к равномерному прорастанию испытательных растений, если это не ограничивается активным веществом. Для послевсходовой обработки испытательные растения выращивали до размера от 15 до 30 см в зависимости от формы роста и после этого обрабатывали суспен-дированным в воде активным веществом. Для этого испытательные растения высевали и выращивали в тех же емкостях или же сначала давали им прорасти и за несколько дней до обработки сажали в испытательные емкости. Для обработки суспендированные в воде средства распыляли с помощью тонкораспределяющих сопел. Доза внесения для послевсходовой обработки составляла 0,125,соответcтвенно, 0,0625 кг/га. Растения держали в зависимости от вида при температуре в 10-25 С, соответственно в 20-35 С. Период испытаний длился от 2 до 4 недель В течение этого времени за растениями ухаживали и наблюдали их реакцию на различные виды обработки. Оценку проводили по шкале от 0 до 100. При этом 100 означает отсутствие всхожести растений, соотвественно полную гибель по крайней мере надземной части и 0 означает отсутствие повреждений или нормальный рост. Применяемые в теплицах растения выбраны из следующих видов: Русское назв. марь белая петушье просо белая горчица кукуруза При дозах внесения в 0,125, соответственно 0,0625 кг/га (a. S.) соединения 2.07 (таблица 2) при послевсходовой обработке показали очень хорошее действие против названных однодольных и двудольных сорных рaстений и хорошую переносимость на кукурузе. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 2-бензоилциклогексан-1,3-дионы формулы I, а также их применимые в сельском хозяйстве соли, причем заместители в формуле I имеют следующие значения:R4 означает водород, C1-C6-алкил, C3-C6 циклоалкил, C3-C6-алкенил,C4-C6-циклоалкенил, C3-C6-алкинил, группы -COR9, -CO2R9, -COSR9 или -CONR8R9, причем приведенные алкильный, циклоалкильный,алкенильный, циклоалкенильный и алкинильный радикалы, а также радикал R9 групп -COR9,-CO2R9, -COSR9 и -CONR8R9 могут быть частично или полностью галогенированы и/или могут нести от одной до трех следующих групп: гидрокси, меркапто, амино, циано, R10, -OR10,-SR10, -NR8R10, =NOR10, -OCOR10, -SCOR10,-NR8COR10, -CO2R10, -COSR10, -CONR8R10, С 1 С 4-алкилиминоокси, С 1-С 4-алкоксиамино, C1-С 4 алкилкарбонил, С 1-С 4-алкокси-C2-C6-алкоксикарбонил, C1-C4-алкилсульфонил, гетероциклил,гетероциклилокси, фенил, бензил, гетарил, фенокси, бензилокси и гетарилокси, причем восемь названных последними групп могут быть со своей стороны замещены; Х означает кислород или группу NR8: в которой R11, R12, R14 и R16 означают водород или C1-C4-алкил;R13 означает водород, C1-C4-алкил или C3C4-циклоалкил, причем обе приведенные последними группы могут нести от одного до трех следующих заместителей: галоген, С 1-С 4 алкилтио или C1-С 4-алкокси; или он означает тетрагидропиран-2-ил, тетрагидропиран-3-ил, тетрагидропиран-4-ил, тетрагидротиопиран-2-ил, тетрагидротиопиран-3-ил,тетрагидротиопиран-4-ил, 1,3-диоксолан-2-ил,1,3-диоксан-2-ил, 1,3-оксатиолан-2-ил, 1,3 оксатиан-2-ил, 1,3-дитиолан-2-ил или 1,3 дитиан-2-ил, причем 6 приведенных последними радикалов могут быть замещены одним,максимально тремя C1-C4-алкильными радикалами;R13 и R16 образуют вместе -связь или карбоциклическое кольцо, имеющее от одного до шести звеньев; или группа CR13R14 может быть заменена посредством С=O. 3. 2-Бензоилциклогексан-1,3-дионы формулы I по пп.1 или 2, в которой R1 означает нитро, галоген, циано, родано, C1-C6-алкил, C1C6-галогеналкил, C1-C6-алкокси-C1-C6-алкил, C2C6-алкенил, С 2-С 6-алкинил, -OR5 или -S(О)nR7;R2 означает водород или приведенные выше для радикала R1 значения. 4. 2-Бензоилциклогексан-1,3-дионы формулы Iа в которой заместители R1 до R4, Х и Q имеют приведенные в пп.1-3 значения. 5. Способ получения 2-бензоилциклогексан-1,3-дионов формулы I по пп.1-4, отличающийся тем, что необязательно замещенный циклогексан-1,3-дион Q ацилируют активированной карбоновой кислотой III или карбоновой кислотой III причем заместитель от R1 до R4 и Х имеют приведенные в п.1 значения и L означает нуклеофильно вытесняемую уходящую группу, и продукт ацилирования перегруппировывают в соединения I, в случае необходимости, - в присутствии катализатора. 6. Производные бензойной кислоты формулы IIIа-CONR8R9, причем приведенные алкильный,циклоалкильный, алкенильный. Циклоалкенильный или алкинильный радикалы, а также радикал R9 групп -COR9, -CO2R9, -COSR9 и-СОNR8R9 могут быть частично или полностью галогенированы и/или могут нести от одной до трех следующих групп: гидрокси, меркапто,амино, циано, R10, -OR10, -SR10, -NR8R10,=NOR10,-OCOR10,-SCOR10,-NR8COR10,10 10 8 10-CO2R , -COSR , -CONR R , C1-C4-алкилиминоокси, С 1-С 4-алкоксиамино, С 1-С 4-алкилкарбонил, C1-C4-алкокси-C2-C6-алкоксикарбонил,С 1-С 4-алкилсульфонил, гетероциклил, гетероциклилокси, фенил, бензил, гетарил, фенокси,бензилокси и гетарилокси, причем восемь последних радикалов могут быть со своей стороны замещены;R17 означает гидрокси или гидролизируемый радикал и заместители R3, R5 и R7-R10, Х иn имеют приведенные в п.1 значения. 7. Производные бензойной кислоты формулы IIIа по п.6, причем R17 означает галоген,гидрокси или C1-C6-алкокси. 8. Средство, содержащее гербицидно эффективное количество, по крайней мере, одного соединения формулы I или применимой в сельском хозяйстве соли соединения I по пп.1-4 и вспомогательные средства, обычные для препаративной формы средств защиты растений. 9. Способ изготовления гербицидно эффективных средств по п.8, отличающийся тем,что смешивают гербицидно эффективное количество, по крайней мере, одного соединения формулы I или применимой в сельском хозяйстве соли соединения I по пп.1-4 и вспомогательные средства, обычные для препаративной формы средств защиты растений. 10. Способ борьбы с нежелательным ростом растений, отличающийся тем, что гербицидно эффективным количеством, по крайней 46 мере, одного соединения формулы I или применимой в сельском хозяйстве соли соединения I по пп.1-4 воздействуют на растения, на их жизненное пространство и/или на семена. 11. Применение соединений формулы I и их применимых в сельском хозяйстве солей по пп.1-4 в качестве гербицидов.
МПК / Метки
МПК: C07C 251/60, A01N 33/24
Метки: замещенные, 2-бензоилциклогексан-1,3-дионы
Код ссылки
<a href="https://eas.patents.su/24-1605-zameshhennye-2-benzoilciklogeksan-13-diony.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 2-бензоилциклогексан-1,3-дионы</a>
Предыдущий патент: Применение аминоизотиазолов в качестве микробицидов
Следующий патент: Электрохимическая обработка материалов
Случайный патент: Способ повторного использования отходов