Способ получения обогащённого поликлонального антитела, высокоспецифичного к антигену поверхностного полисахарида липоарабиноманнана микобактерий, и способы его применения
Номер патента: 13228
Опубликовано: 30.04.2010
Авторы: Кульчин Владимир А., Керрик Джиль Л., Молокова Елена В.
Формула / Реферат
1. Способ получения обогащенного поликлонального антитела, высокоспецифичного к антигену поверхностного полисахарида липоарабиноманнана (LAM) микобактерии, включающий
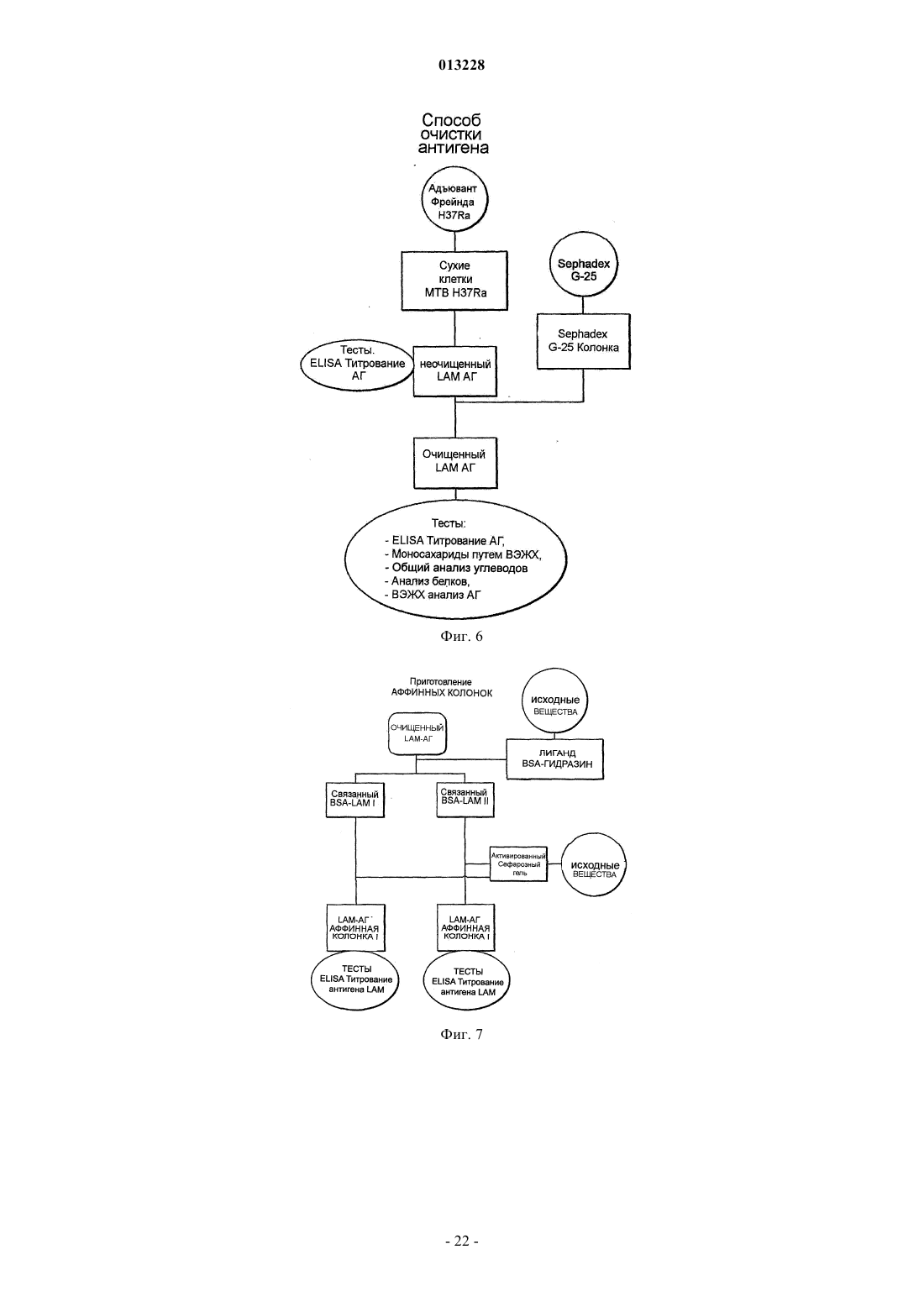
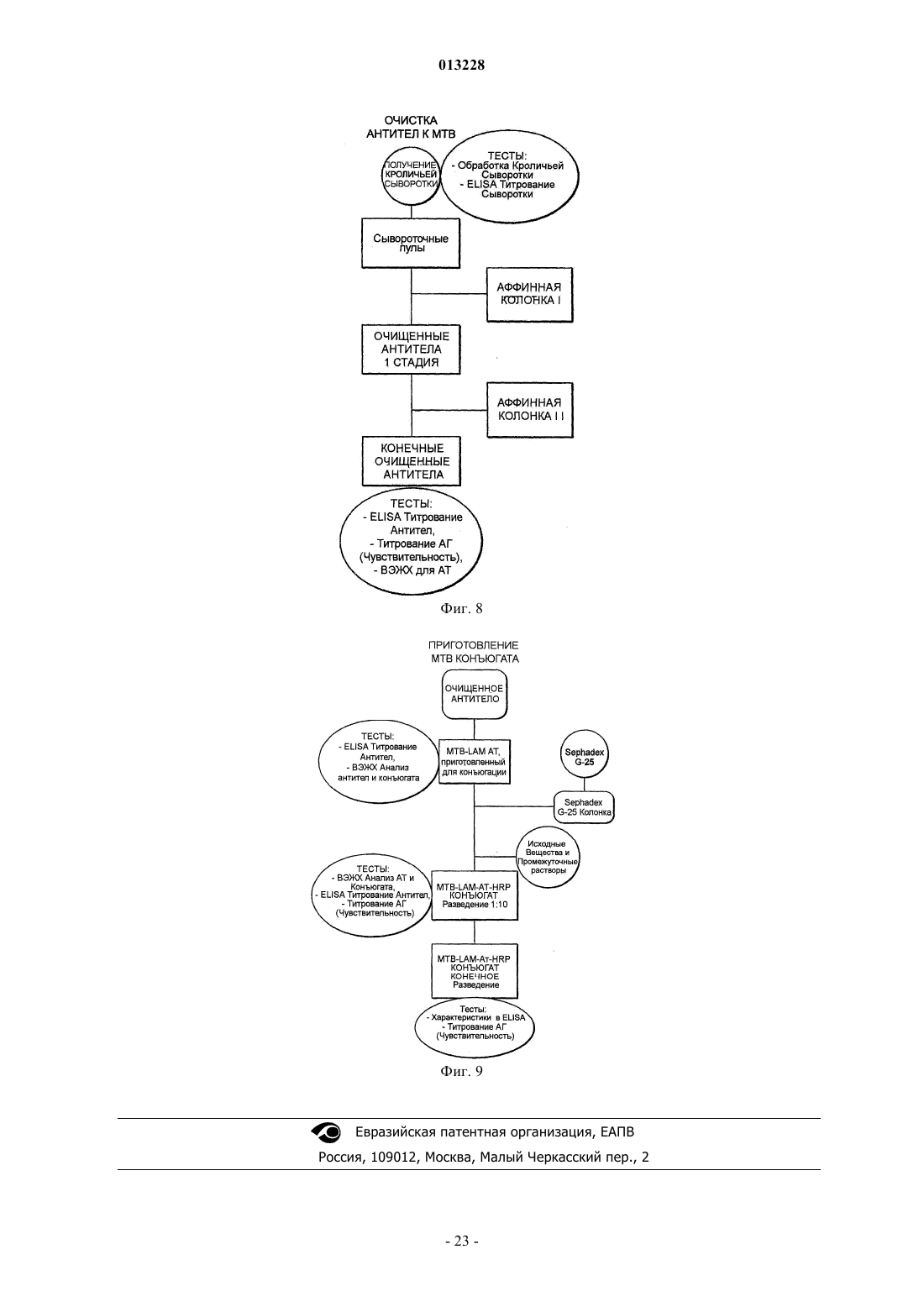
нанесение сыворотки из млекопитающего, зараженного микобактериями, на первый аффинный матрикс, приготовленный с выделенным антигеном LAM микобактерии, так что поликлональное антитело, специфичное к выделенному антигену LAM, удерживается первым аффинным матриксом;
выделение поликлонального антитела, специфичного к выделенному антигену LAM, из первого аффинного матрикса;
модификацию выделенного антигена LAM с целью его инактивации путем окисления при помощи NaIO4с получением модифицированного антигена LAM;
нанесение выделенного поликлонального антитела на второй аффинный матрикс, приготовленный с модифицированным антигеном LAM, так что поликлональное антитело, специфичное к модифицированному антигену LAM, удерживается вторым аффинным матриксом;
выделение обогащенного поликлонального антитела, специфичного к выделенному антигену LAM, путем сбора эффлюента со второго аффинного матрикса с получением обогащенного поликлонального антитела, высокоспецифичного к LAM за счет исключения антител, которые узнают модифицированный антиген LAM и удерживаются вторым аффинным матриксом,
причем обогащенное поликлональное антитело является более высокоспецифичным и проявляет большую чувствительность к микобактериальному антигену LAM, чем необогащенное антитело.
2. Способ по п.1, в котором микобактерией является Mycobacterium tuberculosis.
3. Способ по любому из пп.1, 2, в котором LAM выделен из адъюванта Фрейнда.
4. Популяция обогащенных поликлональных антител, высокоспецифичных к антигену LAM, полученная способом по любому из пп.1-3.
5. Способ обнаружения микобактериальной инфекции в образце, взятом у представляющего интерес субъекта, путем детекции антигена LAM в образце, включающий проведение иммунологического анализа на антиген LAM с использованием обогащенного поликлонального антитела, высокоспецифичного к антигену поверхностного полисахарида липоарабиноманнана (LAM) микобактерии, причем поликлональное антитело обогащают путем исключения антител, которые узнают антиген, модифицированный окислением при помощи NaIO4; причем результат иммунологического анализа, полученный на образце от представляющего интерес субъекта, который является повышенным по сравнению с результатом, полученным с отрицательным контролем, считается положительным в отношении микобактериальной инфекции.
6. Способ по п.5, в котором микобактериальной инфекцией является М. tuberculosis.
7. Способ по п.5, в котором иммунологический анализ представляет собой твердофазный иммуно-ферментный анализ.
8. Способ по п.5, в котором микобактериальная инфекция представляет собой болезнь Джона.
9. Способ по п.5, в котором микобактериальной инфекцией является легочная форма инфекции Mycobacterium tuberculosis.
10. Способ по п.5, в котором микобактериальной инфекцией является внелегочная форма инфекции Mycobacterium tuberculosis.
11. Способ по п.5, в котором образцом является любой из следующих: мокрота, кровь, моча, ткань или другой пригодный образец.
12. Способ по п.5, в котором образцом является необработанная неконцентрированная моча.
13. Набор для иммуноаналитического обнаружения микобактериальной инфекции в образце, отличающийся тем, что набор включает обогащенное антитело, полученное способом по любому из пп.1-3.
14. Набор по п.13, где иммунологический анализ представляет собой твердофазный иммуноферментный анализ.
15. Набор по п.13, где иммунологический анализ представляет собой иммунохроматографический стрип-тест.
16. Набор по п.13, где микобактериальной инфекцией является Mycobacterium tuberculosis.
Текст
013228 Область техники, к которой относится изобретение Настоящее изобретение касается диагностических тестов для выявления микробных заболеваний и состояний, в частности диагностических тестов и способов для выявления туберкулеза. Уровень техники На протяжении последних десятилетий туберкулез (ТБ) превратился из преимущественно легочной инфекции в комплексную патологию с увеличивающимся числом внелегочных форм. До настоящего времени программы по эффективной профилактике ТБ затруднены из-за отсутствия быстрого и работающего в полевых условиях массового проверочного анализа. В странах с высоким уровнем доходов культивирование микобактерий остается диагностическим стандартом, но является трудоемким и относительно дорогостоящим. Идеально, микроскопия мокроты, основанная на трех мазках мокроты, позволяет выявить до 67% культурально положительных случаев. Сообщалось, что сопутствующая ВИЧ инфекция ухудшает выявление Mycobacterium tuberculosis в мокроте, хотя некоторые исследователи не сообщали о каком-либо влиянии серостатуса по ВИЧ на диагностику кислотоустойчивых бацилл (AFB). Высокий процент внелегочного ТБ у ВИЧ-положительных ТБ пациентов дополнительно увеличивает число AFB-отрицательных случаев ТБ. Это делает диагностику туберкулеза все более сложной и подчеркивает срочную необходимость усовершенствования лабораторных методов для его диагностики. Существующие подходы для выявления ТБ не достаточны. Тест мокроты для диагностики легочного ТБ не всегда эффективен, в особенности, если в мокроте нет определяемой бактерии, или образец мокроты не может быть получен. Кроме того, данный диагностический тест требует микроскопии и/или культивирования бактерий для подтверждения диагноза, ни один из этих способов не является особенно подходящим для диагностики в полевых условиях. Использование спинно-мозговой жидкости для диагностики туберкулезного менингита также является проблематичным, особенно в полевых условиях, поскольку, в очередной раз, для подтверждения диагноза обычно требуются микроскопия и/или культивирование бактерий и/или ELISA анализ. Исследования крови для диагностики ТБ также известны, но имеют низкую эффективность, будучи сложными и недостоверными. Исследования мочи проще и более достоверны, но существующие способы требуют обработки мочи перед осуществлением диагностического анализа - такая обработка обычно включает концентрирование мочи. Среди вновь разработанных методов предложены тесты с использованием антител против ряда антигенов микобактерий, но ни один из этих тестов до сих пор не достиг необходимой специфичности для рутинной диагностики. Снижение чувствительности при ВИЧ-положительных случаях также является основным ограничением. Существует другой подход для оценки иммунного ответа на специфические антигены Mycobacterium tuberculosis, такие как ESAT-6, но до сих пор дифференцировка между латентной формой ТБ инфекции и заболеванием ТБ не представляется возможной. Туберкулез является исключительно сложной патологией, существующей во множественных формах, но всегда начинается как воздушно-капельная инфекция. Легочный туберкулез возникает немедленно при попадании микроорганизма и внелегочный туберкулез является результатом дальнейшего проникновения в организм пациента с наиболее распространенными примерами туберкулезного менингита и костного туберкулеза. Сложность патологии определяет большое количество различных способов диагностики, испытанных на протяжении этого столетия современной медициной. Кроме того, клинические и рентгенологические проявления легочного туберкулеза при сопутствующей ВИЧ-инфекции резко меняются из-за иммунодефицита. Данные факторы существенно ограничивают возможность ранней симптоматической диагностики туберкулеза у пациентов с ВИЧ/ТБ и также увеличивают опасность передачи ТБ родственникам и субъектам, ухаживающим за таким пациентом. Микобактерии потенциально могут быть извлечены из разных видов клинических образцов, включая пробы из верхних дыхательных путей (мокрота, бронхиальные смывы, бронхоальвеолярный лаваж,бронхиальные биопсии и др.); мочи, кала, крови, спинно-мозговой жидкости (ЦСЖ), биопсии тканей, и глубоких пункционных биопсий практически любых тканей и органов. Бактериальное культивирование остается золотым стандартом для диагностики туберкулеза, но оно может занять более 6-8 недель для вынесения заключительного диагноза. Существует три основных способа, применяющихся для быстрой(более быстрого, чем бактериальное культивирование) диагностики микобактериальных инфекций: прямая микроскопия мазков мокроты; анализы, основанные на ПЦР; иммунодиагностические способы. Прямая микроскопия мазков мокроты. Более столетия назад Роберт Кох идентифицировал этиологический агент туберкулеза путем его окрашивания и культивирования из клинических образцов. На сегодняшний день диагноз туберкулеза обычно устанавливается при использовании методов окрашивания и культивирования, которые, по существу, не отличаются от тех, которые применял Кох. Прямая микроскопия мокроты в настоящее время является стандартом для диагностики туберкулеза в развивающихся странах и является эталонным тестом, относительно которого должна быть определена эффективность любого нового теста. Это применимо для легочного туберкулеза, но не очень эффективно для детей или пациентов с начальными стадиями-1 013228 легочного туберкулеза. Анализы, основанные на полимеразной цепной реакции (ПЦР). Сравнительное изучение эффективности ПЦР тестов в семи лабораториях показало высокий уровень ложно-положительных результатов ПЦР, колеблющийся от 3 до 20% (с наибольшим 77% в одной лаборатории). Такая относительно низкая продуктивность является результатом недостаточного контролирования каждой стадии способа и недооценки необходимости более тщательного качественного контроля во время проведения всех стадий анализа. Иммунодиагностические способы. Кожный тест на туберкулез. Данный тест является, вероятно, наиболее старым иммунологическим тестом на туберкулез. Небольшое количество вещества, называемого ППД Туберкулин, вводится прямо под верхний слой кожи на предплечье посредством маленькой иглы. Тест оценивают через 48-72 ч после введения вещества. Как правило, набухание в 10 мм или более и считают положительным результатом. Многие развивающиеся страны применяют противотуберкулезную прививку (БЦЖ) для защиты против ТБ. После вакцинации БЦЖ кожный тест с ППД обычно становится положительным. Результаты кожного теста колеблются в зависимости от качества антигена ППД, реактивности иммунной системы и возможно даже от расы человека. Данный тест также не предоставляет определенных критериев относительно стадии и локализации инфекционного процесса. Серологические тесты на М. tuberculosis. Данный способ, основанный на обнаружении иммунного ответа антител на микобактериальные антигены, является одним из широкоиспользуемых в исследовательской и клинической средах. Все серологические тесты имеют приблизительно одинаковые чувствительность и специфичность в том случае,если используются очищенные антигены. Чувствительность самых лучших тестов находится в пределах 80% для образцов, положительных по мазку, и 60-70% для образцов, отрицательных по мазку. Сообщаемая чувствительность, как правило, выше и составляет 95-100%. Существующие в настоящее время способы имеют следующие недостатки. Для проведения весьма широко распространенного быстрого микроскопического теста требуется несколько часов, опытный лаборант и клиническое лабораторное помещение. Интерпретация данных исследования является слишком трудной процедурой по сравнению с действующими стандартами быстрой диагностики на месте (Point of Care, РОС) для района инфекционных заболеваний. Реальная стоимость одного анализа на одного пациента колеблется в диапазоне 100-150 долларов в больницах США. Клиническая специфичность теста является очень хорошей, но любые улучшения специфичности будут более чем желательными. Кожный тест имеет достаточную чувствительность, но занимает много времени и не предоставляет информацию относительно стадии патологического процесса и не достаточно дифференцирует инфицированных и вакцинированных субъектов. Серологические тесты обычно не имеют достаточной чувствительности. Результаты теста изменяются в зависимости от изменений индивидуальной иммунной реактивности на антигены ТБ. Данные тесты практически не применимы для ВИЧ пациентов, инфицированных М. tuberculosis. Данный фактор существенно ограничивает их применимость в африканских и многих азиатских странах. Кроме того, в США данная группа пациентов составляет большинство пациентов, инфицированных ТБ. Тесты ПЦР широко применяются в развитых странах, но являются сложными, дорогостоящими и не достаточно чувствительными для оправдания их применения в качестве проверочных тестов в развивающихся странах. Предпочтительный способ для быстрой диагностики инфекционных заболеваний основан на обнаружении бактериального антигена в образце пациента, что дает однозначное доказательство активного инфекционного процесса, вызванного специфическим патогеном. Концепция применения прямого антигенного теста для обнаружения микобактериальных инфекций была описана в некоторых публикациях. Например, о разработке одного из первых прямых антигенных анализов для М. tuberculosis сообщалось в 1982 - радиоиммуноанализ для обнаружения антигенов М. tuberculosis в мокроте пациентов с активным легочным туберкулезом с использованием кроличьих антител, специфичных к цельным клеткам М. bovis (вакцина БЦЖ). Автоклавированная и обработанная ультразвуком мокрота использовалась в качестве образца. Анализ выявлял антиген в 38 из 39 образцов мокроты от пациентов с активным легочным туберкулезом. В более поздних исследованиях описана разработка системы ELISA для обнаружения микобактериальных антигенов в спинно-мозговой жидкости пациентов с туберкулезным менингитом, также с использованием антител, специфичных для цельных клеток М. bovis. Обе системы демонстрировали поразительно высокую специфичность. Несмотря на то, что LAM являлся основным антигеном, отвечающим за обнаружение, сообщалось, что М. kansasii продемонстрировал перекрестную реактивность в 5% случаев,и М. intracellulare, M. avium, M. fortitum и М. vaccae перекрестно отвечали только в 2% случаев. Другими описывалось обнаружение способом ELISA микобактериального антигена в ЦСЖ у девяти из 12 пациентов с туберкулезным менингитом, соответствующая чувствительность 81,25%. Специфичность теста со-2 013228 ставляла 95%. Практически все предыдущие попытки разработки теста для диагностики туберкулеза были направлены на выявление легочной формы заболевания. Внелегочные формы, которые общеизвестно являются трудными для диагностирования, привлекали относительно небольшое внимание вследствие низкой распространенности по сравнению с легочной формой. До 1950-х и 1960-х, внелегочные случаи ТБ составляли только около 10% всех случаев туберкулеза. Начало пандемии ВИЧ/СПИД полностью изменило данную ситуацию. Эти два заболевания в конечном итоге соединились в новую комплексную проблему общественного здравоохранения. На сегодняшний день по меньшей мере у 60% нелеченых ВИЧ пациентов обнаруживается активный ТБ в течение их жизни и до 70% пациентов с ТБ являются ВИЧинфицированными в Черной Африке и Азии. Совмещение ВИЧ и ТБ изменило не только эпидемиологию туберкулеза, но и течение самого заболевания. В течение последних десятилетий ТБ развился из преимущественно легочной инфекции в многостороннюю патологию с постоянно растущим преобладанием внелегочных форм. Эти данные показывают, что внелегочные случаи ТБ в настоящее время включают до 30% всех случаев туберкулеза; данная цифра может быть даже занижена из-за недостатка методов для быстрого скрининга и диагностирования внелегочных форм туберкулеза. Кроме того, даже легочный туберкулез у ВИЧ инфицированных пациентов часто проявляется атипическими симптомами. Например,у таких пациентов мокрота обычно не вырабатывается. Данные факторы значительно ограничивают возможность раннего симптоматического выявления туберкулеза для пациентов с сочетанной инфекцией ВИЧ/ТБ и также увеличивают опасность переноса ТБ родственникам и лицам, ухаживающим за такими пациентами. Срочно необходим простой в применении скрининговый тест, способный обнаружить широкий спектр патологий, обусловленных инфекцией М. tuberculosis, включая тест для внелегочных форм ТБ. Такая необходимость обсуждалась в течение долгого периода времени без успехов в достижении поставленной цели. На сегодняшний день необходимость такого теста для общественного здравоохранения стала чрезвычайной. В других случаях легочных бактериальных инфекций, современный скрининговый способ выбора основан на обнаружении полисахаридных антигенов, секретируемых в мочу пациента. Бактериальные полисахариды состоят из моносахаридов, необычных для людей и, следовательно, устойчивых к расщеплению ферментами человека. Это делает возможным их секрецию в мочу в иммунохимически интактных формах, пригодных для обнаружения путем полисахаридспецифического иммуноанализа. Чрезвычайно низкие концентрации бактериальных полисахаридов, секретируемых в мочу, требуют очень высокой чувствительности иммуноанализа для применения его в качестве скринингового способа. Сотрудничающие группы исследователей из Швеции и Норвегии попытались разработать LAMспецифичную систему ELISA, способную обнаруживать антиген LAM в моче пациента. В системе использовался принцип антигенной ловушки для обнаружения туберкулеза в моче, который основан на липоарабиноманнане, полисахариде, присутствующем на поверхности Mycobacterium tuberculosis, микроба, ответственного за развитие туберкулеза у людей, что раскрыто в заявке РСТ WO 97/34149, Svenson. Раскрытая диагностическая система обнаруживала наличие LAM в моче пациента в 81,3% у AFBположительных пациентов и в 57,4% AFB-отрицательных пациентов и демонстрировала применимость выявления микобактериального антигена LAM для диагностики микобактериальных инфекций. В то же время раскрытая система оказалась неудачной для скрининговых целей. Несмотря на применение аффинноочищенного кроличьего поликлонального антитела, специфичного к антигену LAM, система не имела достаточной чувствительности при использовании необработанных неконцентрированных образцов мочи. Диагностическая процедура занимала приблизительно 24-48 ч сложных манипуляций в биохимической лаборатории, связанных концентрированием мочи пациентов и подготовкой ее для анализа тестом ELISA. В целом, чувствительность анализа по Svenson не достаточна для практического применения данного способа. Сложность и длительность иммуноанализа также препятствуют его практическому использованию в качестве скринингового теста для обнаружения микобактериальных инфекций,поскольку он оказался слишком трудным для применения в клинических условиях, где скорость, легкость использования и высокая чувствительность являются чрезвычайно важными для диагностических тестов, применяемых для выявления болезненных состояний. Раскрытие изобретения В первом воплощении изобретение предоставляет антигенно-активную изоформу липоарабиноманнана из Mycobacterium tuberculosis, полученную путем окисления LAM с использованием способов мягкого окисления, как, например, обработка низкими концентрациями NaIO4. В других воплощениях антигенно-активная изоформа LAM, полученная методами умеренного окисления, применяется для приготовления высокоспецифичных, высокоочищенных антител против инактивированной микобактерии, в частности против поверхностных полисахаридов, таких как LAM, для обнаружения полисахаридов (например, LAM) в моче, мокроте, крови, ткани или других образцах от исследуемого пациента. Другие воплощения показывают применение высокоспецифичного, высокоочищенного антитела, выработанного против антигенно-активной формы LAM, для диагностики туберкулеза у исследуемого пациента. В другом конкретном воплощении предоставляется популяция обогащенных антител, высокоспецифичных к антигену поверхностного полисахарида микобактерии. В данном воплощении популяция-3 013228 обогащенных антител может быть обогащена путем выработки их в окружении, содержащей антигенноактивный антиген. Альтернативно или дополнительно, антитело обогащают путем удаления антител,распознающих относительно неактивный антиген. В некоторых воплощениях микобактерией может быть Mycobacterium tuberculosis. Также поверхностным полисахаридом может быть липоарабиноманнан(LAM). В другом воплощении изобретения предоставлен способ получения обогащенного антитела, высокоспецифичного к антигену микобактерии. В данном воплощении способ включает выработку и выделение антитела против антигена микобактерий и отделение от выделенных антител той популяции антител,которая является специфичной к относительно неактивному антигену, для приготовления выделенного обогащенного антитела. В другом воплощении предоставлен способ получения обогащенного антитела, высокоспецифичного к антигену микобактерии. В данном воплощении способ включает выделение антигена из микобактерии в условиях сохранения его антигенной активности и выработку антител против изолированного антигена, пока его антигенная активность сохранена. В еще другом воплощении предоставлен способ получения обогащенного антитела, высокоспецифичного к антигену микобактерии. В данном воплощении способ включает нанесение сыворотки крови млекопитающих, зараженных микобактериями, на первый аффинный матрикс, приготовленный с изолированным антигеном из микобактерии, при этом антитело, специфическое к выделенному антигену,удерживается первым аффинным матриксом; выделение антитела, специфичного к выделенному антигену с первого аффинного матрикса; нанесение выделенного антитела на второй аффинный матрикс, приготовленный с модифицированным антигеном из микобактерии, при этом такое антитело, специфичное к модифицированному антигену, удерживается вторым аффинным матриксом, в которой модифицированный антиген обработан веществом для его деактивации относительно изолированного антигена; выделение обогащенного антитела, специфичного к изолированному антигену путем сбора эффлюента со второго аффинного матрикса, вследствие чего обогащенное антитело является более высокоспецифичным и проявляет более высокую чувствительность к антигену микобактерии, чем необогащенное антитело. В следующих близких воплощениях микобактерия может быть Mycobacterium tuberculosis, и поверхностный полисахарид может быть липоарабиноманнаном (LAM). В других воплощениях веществом для модифицирования антигена из микобактерии является периодат натрия. В других близких воплощениях поверхностный полисахарид может быть выделен из адъюванта Фрейнда. Другое воплощение предоставляет способ обнаружения микобактериальной инфекции в образце,взятом из субъекта. В данном воплощении способ включает обеспечение иммунореактивного окружения,такого как окружение, которое образована на основе обогащенного антитела, как описано выше; и проведение реакции образца в иммунореактивном окружении для выявления микобактериальной инфекции. Не обязательно микобактериальной инфекцией может являться М. tuberculosis или болезнь Джона. Также поверхностным полисахаридом может быть липоарабиноманнан (LAM). В следующих близких воплощениях иммунореактивное окружение представляет собой ELISA и может быть выполнено в виде индикаторной полоски (стрип-теста). В близких воплощениях микобактериальная инфекция может быть легочной формой инфекции Mycobacterium tuberculosis или внелегочной формой инфекции Mycobacterium tuberculosis, и образец может быть любым из мокроты, крови, мочи, ткани или другим подходящим образцом. В близком конкретном воплощении образцом может являться необработанная неконцентрированная моча. Другие воплощения предоставляют набор для диагностики микобактериальной инфекции в образце, набор, включающий иммунореактивное окружение для проведения анализа, где окружение содержит обогащенное антитело, как описано выше. В близких воплощениях иммунореактивное окружение включает ELISA, и может быть выполнено в виде стрип-теста. В следующих близких воплощениях, микобактериальной инфекцией может быть Mycobacterium tuberculosis и поверхностным полисахаридом может быть липоарабиноманнан (LAM). Краткое описание фигур Для лучшего понимания изложенных выше отличительных признаков изобретения ниже приводятся примеры осуществления изобретения со ссылками на прилагаемые фигуры, на которых Фиг. 1 демонстрирует структурную модель микобактериальных ManLAM, PILAM и AraLAM; фиг. 2 показывает сравнение серологической активности для экспериментов с LAM; фиг. 3 показывает эффективность препаратов LAM-специфичного AT в связывании при ELISA; фиг. 4 А - чувствительность LAM ELISA при разных концентрациях LAM в моче, где темные кружки обозначают результаты ELISA при использовании LAM из М. tuberculosis и светлые кружки обозначают контрольные результаты ELISA. Границей отсечения являлась оптическая плотность отрицательного контроля + 0,1, что обеспечивало минимальный предел чувствительности в 0,25 нг/мл; фиг. 4 В - связывание LAM-специфичных антител в ELISA с немикобактериальными антигенами было исключено для следующих бактериальных видов: Klebsiella pneumoniae, Streptococcus agalactiae,Streptococcus pneumoniae 14/12F, Pseudomonas aeruginosa, Staphylococcus aureus 25923/43300, Proteus vul-4 013228garis, E. coli 8739, Neisseria meningitidis A/B/13102, Haemophilus influenzae A/B/D, как можно видеть при сравнении результатов ELISA для М. tuberculosis (светлые треугольники) с результатами ELISA для других тестируемых бактериальных видов (темные треугольники, светлые и темные ромбы, светлые и темные кружки), изображенными на фиг. 4 В; фиг. 4 С - чувствительность LAM ELISA для разнообразных микобактериальных штаммов. LAM M.bovis и М. tuberculosis обнаруживались с наибольшей чувствительностью; фиг. 5 - корреляция между микроскопической плотностью микобактерий AFB положительных пациентов и концентрацией их антигена, измеренной LAM ELISA в необработанной моче.AFB(10/поле) 20 случаев. Столбчатая диаграмма показывает процентиль 10, 25, 50, 75, 90 и среднюю концентрацию антигена; фиг. 6 - схема способа очистки антигена в соответствии с конкретными воплощениями заявленного изобретения; фиг. 7 - схема для приготовления аффинных колонок в соответствии с конкретными воплощениями заявленного изобретения; фиг. 8 - схема способа очистки антител в соответствии с конкретными воплощениями настоящего изобретения; фиг. 9 - схема приготовления конъюгата в соответствии с конкретными воплощениями настоящего изобретения. Осуществление изобретения Определения. Следующие термины будут иметь указанные значения, если только иное не требуется по контексту. Термин "иммунореактивное окружение" в используемом здесь значении обозначает окружение,предназначенное для иммунологических анализов, иммунных реакций, иммунохимии и любого другого способа, метода, методики или системы, которые включают, относятся к или основываются на иммунологической реакции для достижения желаемого результата. Примерами иммунореактивных окружений являются те, которые подробно описаны Swanson et al. в патенте США 5073484; и Guire et al. в патентах США 5654162 и 6020147, раскрывающих способ и устройство для количественного определения исследуемого вещества в растворе, где конкретные воплощения используют иммунохимические реакции, в которых исследуемое вещество и действующее вещество представляют различные части специфически связанной пары лиганд (антиген) - антитело (антилиганд). Эти патенты относятся к технологии, которая реализована в виде, как мы называем в описании и формуле изобретения, "стрип-тест"."Адъювант Фрейнда" фирмы Sigma, США. Нами разработан высокочувствительный способ для обнаружения антигенов микобактерий, в частности антигенов М. tuberculosis, таких как поверхностные полисахариды липоарабиноманнан (LAM) и родственные виды, в биологических жидкостях, которые включают, но ею не ограничиваются, мочу. До настоящего времени тесты такого рода проявляли недостаточную чувствительность и были непригодны для необработанных образцов мочи или для обнаружения внелегочных форм ТБ инфекции. В частности,мы разработали обогащенные антитела, которые вырабатываются против антигенов микобактерий, где антитело обогащается путем индуцирования в окружении, которое содержит антигенно-активный антиген. Мы называем способ получения данного первого класса обогащенного антитела прямой способ,который более подробно описан далее. Мы также разработали антитело, которое обогащают путем удаления тех антител, которые распознают относительно неактивный антиген. Способ получения этого класса антител начинается с "прямого способа" для получения обогащенных антител, но затем также проводится исключение антител, которые узнают относительно неактивный антиген. Мы называем способ получения этого второго класса обогащенных антител "способ обогащения", который также подробно описывается ниже. Фиг. 8 представляет собой схематическое изображение, демонстрирующее стадии, для практического воплощения способа обогащения. Поскольку способ обогащения основывается на прямом способе,то фиг. 8 также иллюстрирует прямой способ, если остановиться после первой колонки для аффинной хроматографии. Далее мы показываем, как данные обогащенные антитела, каждое по отдельности или оба вместе,могут применяться для выявления легочной и внелегочной форм туберкулезной инфекции в разнообразных образцах, включая, но ими не ограничиваясь, необработанные (т.е. неконцентрированные) образцы мочи. (Другие возможные источники образцов включают мокроту, спинно-мозговую жидкость, кровь,ткань, смывы). В примерах, которые следуют далее, обогащенные антитела вырабатываются против эпитопа липоарабиноманнана (LAM) в окружении, которое сохраняет его антигенную активность. Предыдущие способы обнаружения поверхностных полисахаридов (LAM), использующие различные биологические жидкости, такие как сыворотка крови, моча или мокрота, проработаны, но имеют сомнительное подтверждение. В сыворотке крови обнаружение LAM вероятно затруднено из-за образо-5 013228 вания иммунных комплексов. Обнаружение LAM в мокроте возможно только в образцах, взятых у пациентов с легочной формой ТБ, поскольку внелегочные формы инфекции часто не сопровождаются образованием мокроты, содержащей антигены микобактерий. Предыдущие исследования с мочой требовали значительных предварительных обработок и действий, ограничивая такие процедуры в полевых условиях. Ни один из них не был эффективным для диагностирования внелегочных форм микобактериальных инфекций, как, например, таких, которые возникают у ВИЧ-инфицированных. Воплощения настоящего изобретения преодолевают трудности известных способов путем предоставления обогащенных антител, которые могут применяться для обнаружения антигенов микобактерий в широком спектре разновидностей образцов из субъекта. Данные разновидности образцов включают сыворотку крови, кровь, мокроту, смывы, ткань и необработанную, неконцентрированную мочу наряду с прочими. Липоарабиноманнан (LAM) является липополисахаридом с молекулярной массой 17500, специфичным для рода микобактерий. Липоарабиноманнан является комплексным полисахаридным антигеном,который состоит из маннозного и арабинозного остатков, формирующих сильно разветвленную и сложную структуру. Несмотря на более чем сорокалетние исследования полисахаридных антигенов микобактерий, в данных исследованиях упоминается только о фрагментах этих структур или структурных доменах и общих моделях. Новейшая общая модель структуры LAM представлена ниже на фиг. 1. Как часть внешней клеточной стенки, LAM секретируется из метаболически активных или дегенерирующих бактериальных клеток. Считается, что в активной фазе ТБ инфекции LAM поступает в циркуляцию, проходя через почки и, таким образом, может быть обнаружен в моче, отражая уровень микобактериальной обсемененности. Поскольку LAM является углеводным антигеном с гликозидными связями,для которых у человека не существует разрушающих гликозидаз, то антиген присутствует в моче в интактной форме. Антиген LAM микобактерии состоит из трех основных структурных доменов: маннозилфосфатидил-мио-инозитол (МЕР) якорного домена, содержащего различное количество жирных кислот с разной длиной цепи, маннанового корового полисахарида с различным количеством маннозных остатков; и разветвленных цепочек арабинанового полисахарида, связанного с маннановым ядром. Несмотря на многочисленные исследования, связывание участка(ков) арабинановых цепочек с маннановым ядром остается неизвестным. Цепочки арабинаннового полисахарида покрывают маннозные олигосахариды,состоящие из моно-(1-2)-ди- и (1-2)-триманнозильных единиц, различных по длине (кэппирующие мотивы). Уровень кэппирования меняется от штамма к штамму и, возможно, также зависит от условий роста. Чрезвычайно высокая структурная сложность и вариабельность микобактериального LAM влечет за собой такую же сложность спектра антигенных эпитопов. Сложность выбранного диагностического антигена подтолкнула нас к применению аффинно-очищенного поликлонального антитела в качестве основного реагента для иммуноанализа. Только применение поликлонального антитела позволяет разом охватить весь спектр антигенных специфичностей, потенциально связанных с LAM, присутствующим в клинических образцах. Чтобы добиться максимально высокой возможности для аналитической чувствительности сэндвич-анализа, мы используем высокую концентрацию антитела, специфичного к антигену,в зоне связывания и, кроме того, меченое антитело. Антигенспецифичная аффинная очистка известна для приготовления такого антитела. Для приготовления колонки для аффинной хроматографии, основанной на антигене, мы разработали способ выделения антигена и его пришивку на твердофазную подложку. Способ выделения антигенаLAM основан, с некоторыми незначительными модификациями, на способах выделения других бактериальных полисахаридов, описанных в литературе и хорошо известных из уровня техники, и описывается ниже. Предыдущий прямой антигенный иммуноанализ, основанный на определении LAM, описанный в литературе, заключался в использовании поликлонального антитела, очищенного путем антигенспецифичной аффинной хроматографии при использовании LAM-сефарозной колонки. Известный из уровня техники подход к синтезу аффинного матрикса был основан на частичном NaIO4-окислении полисахарида LAM с последующим присоединением к NH2-сефарозе. К нашему удивлению, наши исследования показали, что NaIO4-окисление уменьшает антигенную активность полисахарида LAM, как можно увидеть из фиг. 2. Поскольку эффективность связывания окисленного полисахарида с NH2-твердой подложкой находится в пропорциональной зависимости от степени окисления, мы присоединяли к сефарозной подложке посредством функционального BSA-спейсера молекулу антигена LAM, окисленной в 50 мМ NaIO4. При такой степени окисления полисахарид LAM еще сохраняет некоторую антигенную активность, как показано ниже, но обеспечивает высокую эффективность связывания. Нанесение иммунной сыворотки на такой аффинный матрикс приводит к выделению фракции кроличьего антитела с высоким выходом. Тестирование такого антитела в стандартных планшетах для твердофазного иммуноферментного анализа(ELISA) с иммобилизованными антителами показало определенную функциональную активность, но не на уровне, достаточном для применения в высокочувствительном иммунохимическом анализе, необхо-6 013228 димом для скрининга образцов в случае использования неконцентрированных образцов мочи. Эти данные объясняют результаты, полученные ранее в литературе, где использовалось LAM-специфичное аффинно-очищенное антитело, но было необходимо концентрировать образцы мочи для обнаруженияLAM, присутствующего в образцах. Неожиданно изменение химического способа связывания LAM на более мягкий недеструктивный способ, основанный на активации полисахарида бромистым цианом (CNBr), привело к очистке LAMспецифического антитела гораздо лучшего качества, что можно увидеть на фиг. 3. Кроме того, неожиданно пропускание антитела, очищенного на колонке с интактным LAM (CNBrактивирование), через колонку с антигеном LAM после глубокого, интенсивного окисления NaIO4 (см. ниже) приводило к получению относительно небольшой доли антитела, приблизительно 7-10% от используемого количества, с очень высокой активностью в LAM-специфичном прямом антигенном иммуноанализе. Фиг. 3 демонстрирует эффективность такого антитела при иммобилизации антитела. Когда такое антитело было помечено пероксидазой хрена (HRP) и применено в качестве меченого антитела, то также была продемонстрирована более высокая активность, чем у любого другого антитела, тестируемого или известного. Способ ELISA, основанный на таком антителе, показал очень высокую чувствительность и доказал пригодность для тестирования неконцентрированных образцов мочи. Это позволило нам создать скрининговый LAM-специфичный иммуноанализ с техническими характеристиками, пригодными для быстрого тестирования в полевых условиях для обоих случаев легочного и внелегочного ТБ, что ранее было неосуществимо. Таким образом, несмотря на то, что сообщалось о выявлении LAM в замороженной моче ТБ пациентов, анализ в описанных случаях нуждается в обширной пробоподготовке и,следовательно, не является адаптированным для полевых условий. Протоколы. В данном разделе мы описываем протоколы, пригодные для осуществления "прямого способа" и"способа обогащения", описанных выше. Данное обсуждение не разбирает строго по существу прямой способ и способ обогащения, но описывает специфические способы приготовления колонок, пригодных для применения в любом из двух способов или в обоих вместе, в зависимости от ситуации. Фиг. 8 показывает схему прямого способа и способа обогащения. Выделение сухих клеток М. tuberculosis из адъюванта Фрейнда. Сначала флаконы с адъювантом Фрейнда выдерживают для оседания клеток в течение минимум 1 недели при комнатной температуре до начала использования. Убрав крышку с флакона с адъювантом и не нарушая слоя клеток, осевших на дне флакона, удаляют все количество минерального масла. Небольшое количество минерального масла может быть оставлено во флаконе, как мера предосторожности для избежания удаления клеточного осадка. Убирают минеральное масло, затем смешивают 6,0 л этанола и 6,0 л диэтилового эфира и добавляют 5 мл смеси этанол:диэтиловый эфир в каждый флакон. Затем закрывают флакон, перемешивают на вортексе и быстро переносят суспензию в 1 л колбу Эрленмейера. На этом этапе следует избегать повторного оседания клеток во флаконах. Когда 1 л колба Эрленмейера заполнена до линии 1 л, дают клеткам осесть в течение 1-1,5 ч. Затем осторожно декантируют раствор из колбы Эрленмейера в чистый 1 л сосуд. Следует избегать взмучивания осевших клеток и удаления их вместе с раствором. Если раствор, перелитый в сосуд, прозрачный, его можно вылить. Если значительное количество клеток было перелито с раствором, возвращают вылитый раствор в колбу Эрленмейера и повторяют этап осаждения. Используя 20-30 мл аликвоты смеси этанол:диэтиловый эфир,переносят клетки на фильтр из пористого стекла. Промывают клетки 500 мл смеси этанол-диэтиловый эфир, затем промывают 200 мл диэтилового эфира. Затем клетки на фильтре высушивают на воздухе при использовании вакуума при 100 мм рт.ст.10 (низкий вакуум). Периодически перемешивают и гомогенизируют клеточную массу, затем покрывают фильтр пористым материалом (например, таким как безворсовые салфетки) и оставляют на фильтре до высыхания (приблизительно на 15 ч, т.е. на всю ночь). Взвешивают и записывают общую массу и рассчитывают массу сухих клеток. Затем плотно закрывают резиновой пробкой и хранят при температуре 15-30 С. Фенольная экстракция неочищенного LAM антигена. Помещают сухие клетки М. tuberculosis в 250-мл флаконы из пирексного стекла и добавляют к клеткам теплую деионизированную воду. Перемешивают и обрабатывают суспензию импульсами ультразвука (импульсы по 20 с) в ультразвуковой водяной бане до получения гомогенной суспензии. Клетки экстрагируют фенолом, затем осаждают этанолом и осажденные клетки помещают в холодильник (2-8 С) на ночь ( 16 ч) для выпадения осадка. Будучи очень внимательными, не нарушая осадок, аккуратно удаляют супернатант до тех пор, пока не останется около 100 мл супернатанта, покрывающего осадок. Осторожно перемешивают и переносят оставшуюся суспензию в тефлоновые центрифужные пробирки и центрифугируют при 12000 об./мин в течение 20 мин. Удаляют как можно больше супернатанта из всех пробирок без нарушения осадка, добавляют 5 мл деионизированной воды в каждую пробирку и, используя перемешивание и пульсовое ультразвуковое воздействие, растворяют осадок в воде. Объединяют все фракции с растворенным осадком и помещают в 500-мл флакон (примечание: не превышать 1/10 объемной емкости флакона). Выпаривают на роторном испарителе до минимального-7 013228 объема, но избегают затвердевания образца. Повторно растворяют пленку в приблизительно 50 мл воды и повторяют высушивание и повторное растворение до того, как образец высохнет, 3 раза. Повторно растворяют в 50 мл воды и высушивают. Очистка антигена LAM с помощью хроматографии на Sephadex G-25. Растворяют 800 мг неочищенного антигена (АГ) LAM в 15 мл 0,25% раствора уксусной кислоты. Перемешивают и обрабатывают ультразвуком в ультразвуковой бане для полного растворения. Центрифугируют в микроцентрифуге при 5000 об./мин в течение 5 мин. Собирают супернатант в 20-мл стеклянный флакон, разделяют супернатант на 3 экв.ч. для отдельных хроматографических анализов и затем осторожно наносят 1/3 АГ LAM супернатанта, собранного ранее, на хроматографическую колонку. После того как через колонку пройдет 100 мл, начинают сбор фракций. Продолжают сбор фракций до тех пор, пока с начала хроматографии не пройдет 350 мл подвижной фазы. Закрывают все пробирки с фракциями и хранят при 2-8 С. Выпаривают на роторном испарителе в 250-мл флаконе для выпаривания(объем не более 25 мл). Выпаривают до минимального объема, но избегают затвердевания образца. Разбавляют выпаренный материал 20 мл воды, обрабатывают ультразвуком, перемешивают до полного растворения и затем лиофилизируют (приблизительно 8 ч). Собирают высушенный материал с помощью шпателя в предварительно взвешенную стеклянную пробирку и взвешивают. Вышеизложенные стадии схематично изображены на фиг. 6. Связывание антигена LAM с BSA-спейсером путем активации CNBr. Сначала готовят растворы 0,5 М бикарбоната натрия и 1 М карбоната калия. Затем растворяют 30,0 мг очищенного АГ LAM в 1,5 мл деионизированной воды. Используют обработку ультразвуком (импульсы по 10-20 с) и перемешивают до полного растворения LAM АГ. Растворяют 300 мг BSA-гидразинового лиганда в 15 мл деионизированной воды. Обрабатывают импульсами ультразвука (импульсы по 10-20 с) и перемешивают на Вортексе до полного растворения,затем переносят в центрифужные пробирки и центрифугируют в течение 10 мин при 10000 об./мин. С помощью Пастеровской пипетки аккуратно собирают прозрачный супернатант из каждой пробирки и объединяют все супернатанты в 20 мл флаконе. Избегают взмучивания осадка, который может образоваться. Во флакон добавляют 1 мл 0,5 М бикарбоната натрия и хорошо перемешивают встряхиванием. К раствору LAM добавляют 150 мкл охлажденного 1 М карбоната калия и хорошо перемешивают коротким встряхиванием на Вортексе. Помещают полученный раствор в ледяную баню (лед/вода). Готовят 5 мг/мл CNBr в ацетонитриле для немедленного использования и добавляют 180 мкл раствора бромистого циана в раствор LAM. Перемешивают на Вортексе и помещают в лед примерно на 15 мин. Добавляют этот раствор в раствор BSA-гидразинового лиганда (см. выше) с помощью Пастеровской пипетки. Хорошо перемешивают и инкубируют в течение ночи (16-24 ч) при 2-8 С в плотно закрытом сосуде. Связывание антигена LAM с BSA-спейсером путем активации NaIO4. Растворяют антиген LAM в 1,25 мл деионизированной воды в 3-4 мл флаконе. Обрабатывают импульсами ультразвука и встряхивают на Вортексе до полного растворения. Готовят 0,1 М раствор периодата натрия (в NaOAc буфере, рН 4,0). Добавляют 1,25 мл 0,1 М раствора NaIO4 к 1,25 мл раствора LAM. Перемешивают на Вортексе. Накрывают флакон алюминиевой фольгой, помещают его на платформу шейкера для перемешивания в течение 1 ч + 5 мин при комнатной температуре. Растворяют 250 мг BSAгидразинового лиганда в 12,5 мл деионизированной воды в 25-40 мл стеклянном флаконе для сыворотки. Используют импульсы ультразвука и перемешивание на Вортексе для полного растворения, затем центрифугируют примерно 10 мин при 10000 об./мин. С помощью Пастеровской пипетки аккуратно собирают прозрачный супернатант из каждой пробирки и объединяют все супернатанты в 25-40 мл стеклянном флаконе. Избегают взмучивания осадка. Добавляют во флакон 12,5 мл 0,1 М фосфата натрия (рН 6,8) и хорошо перемешивают коротким встряхиванием на Вортексе. Способ связывания. К BSA-гидразиновому раствору добавляют окисленный раствор LAM и перемешивают. Добавляют 100 мг цианоборогидрида натрия и закрывают. Отбирают 10 мкл конечного раствора и разбавляют 90 мкл 1x PBS буфера (QC раствор) и сохраняют для дальнейших анализов (концентрация LAM будет составлять приблизительно 0,75 мг/мл). Активация сефарозы при помощи NaIO4. Отмеряют аликвоту суспензии сефарозы 4B-CL, соответствующую 80 мл осевшего геля, и переносят на фильтр из пористого стекла. Промывают 500 мл воды и высушивают, используя низкий вакуум(прибл. 300 мм рт.ст.), до тех пор, пока не проявится зернистая структура гелевой поверхности. Избегают образования воздушных трещин на гелевом слое. Готовят 0,1 М буферный раствор ацетата натрия, рН 4,0 и используют его для приготовления 30 мМ раствора NaIO4 в 0,1 М NaOAc. Добавляют к гелю 250 мл 30 мМ NaIO4 и тщательно перемешивают. Покрывают смесь алюминиевой фольгой и помещают на шейкерную платформу с углом 45 при средней скорости на 1,5 ч 10 мин при температуре окружающей среды. Переносят на фильтр из пористого стекла и отмывают 1 л воды с использованием низкого вакуума (прибл. 300 мм рт.ст.). Активированный гель должен быть приготовлен максимум за 4 ч до использования.-8 013228 Связывание BSA-LAM лиганда с активированной сефарозой (для синтеза первой и второй аффинных колонок). Приготовление матрикса. Готовят 0,1% раствор азида натрия в 1X PBS (фосфатно-буферный солевой раствор). Отмеряют объем суспензии активированной сефарозы, соответствующий 60 мл осевшего геля (или иного подходящего матрикса), и переносят на фильтр из пористого стекла. Высушивают гель, используя низкий вакуум(300 мм рт.ст.), до тех пор, пока гель не уплотнится и не станет видна его зернистая структура, но избегают образования трещин на поверхности геля. Раствор лиганда BSA-LAM. Приблизительно 17-20 мл раствора лиганда BSA-LAM разбавляют натрий-фосфатным буфером (рН 6,8) в 250-мл средней колбе до 90 мл. Добавляют к раствору 90 мг кристаллического цианоборогидрида натрия. Плотно закрывают колбу, используя для этого соответствующую пластмассовую пробку. Хорошо смешивают путем короткого перемешивания на вортексе. Раствор может опалесцировать, однако, он не должен содержать осадок. Могут быть заметны микроскопические пузырьки газа, образованные цианоборогидридом натрия. Стадия связывания. К раствору LAM, приготовленному, как описано выше, добавляют подсушенный активированный гель сефарозы. Плотно закрывают и тщательно смешивают суспензию, используя мягкое перемешивание. Инкубируют приблизительно 4 ч при температуре 372 С, перемешивают (путем переворачивания) реакционную смесь каждый час. Добавляют 4,5 мл 1,5 М Tris буфера и снова плотно закрывают пробку. Продолжают инкубацию при 372 С в течение около 16 ч (всю ночь). Переносят реакционную смесь на фильтр из пористого стекла и собирают жидкую фазу в чистую 100-200 мл колбу Бунзена при использовании низкого вакуума (300 мм рт.ст.). Промывают LAMсефарозный гель 400 мл деионизированной воды на фильтре и продолжают промывание 600 мл 1x PBS. Заполнение и хранение колонки. К приготовленному гелю в 250 мл лабораторный стакан добавляют 100 мл 1x PBS. Перемешивают вручную до образования суспензии. Гель вносят в колонку в соответствии со стандартными способами,используя 1x PBS. Уравновешивают колонку 1x PBS, содержащим 0,1% азид натрия. Общая схема связывания лиганда LAM с активированной сефарозой (для приготовления I и II аффинных колонок). Отмеряют объем суспензии активированной сефарозы, соответствующий 100 мл осевшего геля, и переносят на фильтр из пористого стекла. Высушивают гель при использовании низкого вакуума (300 мм рт.ст.) до того, как гель уплотнится и зернистая структура геля не станет видна, но избегают образования трещин на поверхности геля. Оставляют подсушенный гель для последующего применения. Раствор BSA-LAM лиганда. Натрий-фосфатным буфером (рН 6,8) разводят до 100 мл примерно 27,5 мл раствора лиганда BSALAM в 250 мл флаконе из пирекса. К раствору добавляют 100 мг кристаллического цианоборогидрид натрия. Плотно закрывают флакон, используя подходящую пластмассовую пробку. Хорошо перемешивают путем короткого встряхивания при использовании вортекса. Раствор может опалесцировать, однако, он не должен содержать осадок. Могут быть заметны микроскопические пузырьки газа, образованные цианоборогидридом натрия. Стадия связывания. К раствору LAM, приготовленному, как описано выше, добавляют подсушенный активированный гель сефарозы. Плотно закрывают снабженной пластмассовой пробкой. Тщательно смешивают суспензию, используя мягкое перемешивание (средняя скорость), и инкубируют приблизительно 4 ч при температуре 372 С, перемешивают реакционную смесь (путем переворачивания) каждый час. Добавляют 7,5 мл 1,5 М Tris буфера и плотно закрывают. Продолжают инкубацию при 372 С в течение около 16 ч (всю ночь). Переносят реакционную смесь на фильтр из пористого стекла и собирают жидкую фазу в чистую 100-200 мл колбу Бунзена при использовании низкого вакуума (300 мм рт.ст.). Промывают LAM - сефарозовый гель на фильтре примерно 800 мл деионизированной воды. Продолжают промывание примерно 1,2 л 1x PBS. Заполнение и хранение колонки. К приготовленному гелю в 250 мл лабораторном стакане добавляют приблизительно 160 мл 1x PBS. Перемешивают вручную (шпателем/стеклянной палочкой) до образования суспензии. Заполняют колонку в соответствии со стандартными способами, используя 1xPBS. Уравновешивают колонку 1x PBS, содержащим 0,1% азид натрия. Вышеизложенные стадии, включающие применение очищенного LAM и приготовление аффинных колонок I и II, схематично изображены на фиг. 7. Выделение антитела с помощью аффинной хроматографии - I ("прямой способ"). Готовят следующие маточные растворы: 1 л 0,1 М глицинового буфера и доводят рН до 2,5 с помощью 1 М HCl.-9 013228 1 л 3 х PBS раствора (разбавляют 10 х PBS исходный раствор деионизированной водой) и проверяют рН и, при необходимости, повторно доводят до 7,2-7,4 при помощи 1M HCl или 1M NaOH. 200 мл 1x PBS, содержащий 0,1% раствор азида натрия. 100 мл 0,5 М раствора динатрийфосфата (Na2HPO4). Приготовление сыворотки. Медленно размораживают замороженную сыворотку в холодильнике (приблизительно 16 ч/всю ночь) до полного размораживания. Измеряют объем сыворотки и взвешивают 2,9 г хлорида натрия на каждые 100 мл сыворотки и добавляют к ней. Аккуратно перемешивают вращательными движениями до полного растворения: конечная концентрация должна составлять 0,5 М NaCl. Центрифугируют (4-8 С) при 8000 g в течение 20 мин. Пастеровской пипеткой удаляют супернатант из всех центрифужных пробирок. Не нарушают осадок. Фильтруют супернатант через воронку, закрытую ватной пробкой, и собирают фильтрат. Собранный фильтрат должен быть слегка опалесцирующим, но не должен содержать какие-либо осадочные частицы. Помещают профильтрованную сыворотку в холодильник до использования. Нанесение сыворотки на колонку. Готовят колонку I (не модифицированный LAM, присоединенный к материалу колонки) для нанесения сыворотки путем уравновешивания с 1x PBS. Устанавливают скорость потока 2,0 мл/мин и продолжают промывку 1x PBS до тех пор, пока нулевая базовая линия не будет оставаться на постоянном уровне в течение по меньшей мере 1 ч. Устанавливают нулевую отметку для самописца и детектора, как необходимо. Как только нулевая линия стала постоянной, устанавливают скорость потока до 0,5-0,6 мл/мин и затем наносят сыворотку, приготовленную ранее, в LAM-аффинную колонку I при скорости потока 0,5-0,6 мл/мин. Собирают свободный объем элюента (который должен составлять приблизительно 30% объема колонки). Осуществляют контроль фракций при помощи УФ детектирования при длине волны 260-280 нм и, когда сигнал увеличивается, начинают сбор сыворотки, пропуская через колонку 500-1000 мл сыворотки. После того как весь объем сыворотки нанесен на колонку, кратковременно останавливают проток через колонку, вводят 3 х PBS буфер и затем возобновляют течение жидкости. Продолжают промывать колонку 3 х PBS до уменьшения сигнала приблизительно на 50% от нулевой линии. В этот момент прекращают сбор сыворотки и сохраняют все собранные фракции. Изменяют скорость потока до 2,0 мл/мин и продолжают промывать колонку PBS до тех пор, пока нулевая линия станет приблизительно 10-15%. Элюат выбрасывают. Заменяют 3 х PBS буфер на 1x PBS буфер и промывают примерно 2-2,5 объемами колонки при скорости потока 2,0 мл/мин. Элюат выбрасывают. Стадия элюирования антител. Устанавливают скорость потока 1,0 мл/мин. Заменяют 1x PBS на охлажденный 0,1 М Gly-HCl буфер, приготовленный ранее, и начинают элюирование связавшихся антител. Когда сигнал быстро увеличится и достигнет около 10-15% полной шкалы, начинают сбор элюата в 15 мл конические пробирки,помещенные в ледяную баню (0 С). Собирают по фракции 5-мл. Продолжают сбор антител в Gly-HCl буфере до тех пор, пока сигнал не начнет быстро уменьшаться. Прекращают сбор фракций в тот момент, когда сигнал упадет до уровня сигнала в начале сбора (1015% полной шкалы). Нейтрализуют собранный раствор антител путем добавления к каждой 5-мл фракции 0,5 мл 0,5 М Na2HPO4 с шагом по 0,1-мл. Общий добавленный объем должен составлять 10% объема фракций до нейтрализации. В процессе добавления Na2HPO4 буфера раствор аккуратно перемешивают и объединяют нейтрализованные фракции. Измеряют оптическую плотность (OD) антител при длине волны 280 нм относительно контрольной пробы, содержащей только ОДМ Gly-HCl буфер, и рассчитывают концентрацию антител. Оставляют антитела, собранные при 2-8 С, минимум на 3 дня для оседания поврежденных антител. Уход за колонкой. Уравновешивают колонку 1x PBS до нейтрального рН (рН 7). Во время хранения уравновешивают колонку 1x PBS с 0,1% раствором азида натрия и хранят колонку при температуре 4-8 С до следующего использования. Диализ. Центрифугируют приготовленные антитела при 10000 g в течение минимум 5 мин. Переносят супернатант в диализную трубку с порогом отсечения по моль.вес. 12-14 кДа и проводят диализ против 1xPBS в течение 2-3 дней с 4-разовой заменой буфера, при этом соотношение раствора антител к общему объему составляет 1:20. Удаляют антитела из диализной трубки. Измеряют объем раствора антител с помощью стеклянного мерного цилиндра. В случае, если там присутствуют какие-либо дополнительные разрушенные/нарушенные (в виде осадка), раствор антител снова центрифугируют при 10000 g в течение минимум 5 мин. Измеряют оптическую плотность (OD) антител при 280 нм после установки нуля спектрофотометра по 1x PBS буферу. Рассчитывают концентрацию в мг/мл и помещают на хранение при 48 С. Выделение антитела путем аффинной хроматографии - II ("способ обогащения"). Очистка высокоспецифичных антител. Пропускают 1x PBS через LAM-аффинную колонну 2, приготовленную ранее (LAM, модифициро- 10013228 ванный путем сильного окисления, соединенный с материалом колонки при использовании NaIO4), при скорости потока 2,0 мл/мин до того, как нулевая линия станет постоянной в течение по меньшей мере 15 мин. Устанавливают самописец и детектор на нулевой отметке, как это необходимо. Продолжают контролировать нулевую линию в течение следующих 30 мин и, как только она станет постоянной, наносят антитела на колонку. Устанавливают скорость потока 0,5-0,6 мл/мин и наносят объем антитела, который приготовили ранее, соответствующий 100-150 мг AT на LAM аффинную колонку 2, применяя перистальтический насос Econo или аналогичное устройство. Собирают свободный объем элюата (который будет составлять приблизительно 30 об.% колонки), контролируя OD при 280 нм. Начинают сбор антител в тот момент, когда сигнал увеличится на 10-15% выше нулевой линии, в чистый флакон для сыворотки. Когда весь объем антител будет нанесен, кратковременно останавливают поток жидкости, наносят 1x PBS буфер и возобновляют поток жидкости при 0,5-0,6 мл/мин. Продолжают собирать материал, проходящий через колонку, контролируя OD при 280 нм. Когда сигнал дойдет до 10-15% выше начала сбора(30-50% выше нулевой линии), останавливают сбор раствора. Измеряют OD высокоспецифичных антител при 280 нм и рассчитывают концентрацию антител. Незамедлительно помещают раствор антител для временного хранения при 4-8 С. Промывка колонки. Продолжают промывку колонки 1x PBS при скорости потока 2,0-2,5 мл/мин. Пропускают как минимум 3 объема колонки 1x PBS. Элюируют материал, адсорбированный на колонке, с охлажденным 0,1 М Gly-HCl буфером, приготовленным выше. Собирают элюированный материал в стеклянные флаконы. Когда контрольный сигнал снизиться до 10-15% от нулевой линии, останавливают сбор. Нейтрализуют собранный раствор антител путем добавления 10% от общего объема 0,5 М фосфата натрия, приготовленного ранее, добавляя по 0,5 мл. Измеряют OD антител при 280 нм и рассчитывают концентрацию антител. Сразу же помещают собранный раствор антител при 4-8 С и оставляют до тех пор, пока будет завершен анализ антител, собранных на вышеуказанной стадии. Если концентрация вышеуказанных антител составляет менее 0,3 мг/мл, концентрируют. Промывают колонку 1x PBS, минимум 3 объемами колонки, при скорости потока 2,0-2,5 мл/мин. Колонку промывают снова 1x PBS с 0,1% азидом натрия, 1 объемом колонки, и хранят при 4-8 С до последующего использования. Вышеизложенные стадии, демонстрирующие выделение обогащенных антител на аффинных колонках I и II с помощью применения прямого способа и способа обогащения, схематически представлены на фиг. 8. Способ сенсибилизации планшетов для ELISA. Устройство системы Moduline 300 System. Сенсибилизация антителами должна быть завершена не позднее 8 ч с момента окончания приготовления сенсибилизирующего раствора М 815. Сенсибилизирующий раствор антител должен храниться во льду (0 С) в течение процесса иммобилизации. Первая стадия. Предварительно сравнивают и тщательно осматривают пустые планшеты и убирают любые испорченные планшеты. Разливают по 100 мкл MTB-LAM специфического сенсибилизирующего раствора AT в каждую лунку каждого ряда планшета, применяя Moduline 300 System. Визуально проверяют все 96 лунок в каждом планшете для обеспечения равномерности заполнения лунок во время процесса иммобилизации. Сохраняют неиспользованный раствор AT и хранят при 2-8 С до тех пор, пока не обработают и не израсходуют весь набор планшетов. Укладывают планшеты с разлитыми AT в стопки по 10 планшетов каждая и накрывают верхний планшет пустым планшетом, использующимся в качестве крышки. Подписывают каждый планшет, накрывающий набор, цифрами от 1 до 18. Охлаждают наборы планшетов при 2-8 С и инкубируют всю ночь (14-18 ч). Вторая стадия. Устанавливают Moduline 300 System на проведение 3 циклов промывки с последующим немедленным проведением остановочного цикла 312 мкл блок-раствора. Блок-раствор должен быть применен в течение максимум 24 ч с момента завершения приготовления. Убирают планшеты из холодильника и убирают накрывающие планшеты из наборов в том порядке,как они были помещены на Moduline и откладывают их в сторону. Устанавливают таймер на 6 ч. Устанавливают блокированные планшеты, поступившие с конвейера, на последовательные пронумерованные подставки и блокируют в течение 5-6 ч при температуре окружающей среды (20-28 С). Помещают планшеты на подставках в сушильную камеру и инкубируют при 20-23 С и относительной влажности воздуха 20-22% в течение 24-72 ч. Вынимают сухие планшеты из сушильной камеры. Приготовление МТВ-АТ для конъюгации с пероксидазой хрена (HRP). Приготовление раствора МТВ-АТ должно быть осуществлено по меньшей мере за 7 дней до процедуры конъюгации. Диализ. Проводят диализ необходимого количества раствора MTB-LAM-AT против 1x PBS в течение, минимум, 48 ч, минимум, с 4 заменами, при 2-8 С. Используют диализные трубки с отсечением по молеку- 11013228 лярному весу 12-14000. После диализа центрифугируют раствор AT при 12000 об./мин в течение 10 мин и аккуратно переносят супернатант в 15 мл градуированные центрифужные пробирки. Измеряют OD раствора AT после диализа при 280 нм и рассчитывают концентрацию AT после диализа. Если раствор AT после диализа имеет OD280nm2,8, разбавляют раствор AT 1x PBS в соотношении 1:7. Концентрирование. Промывают устройство фильтра для центрифугирования Amicon Ultrafree-15 1x PBS. Помещают примерно 15 мл раствора 1xPBS в устройство и центрифугируют при 3500 об./мин в течение приблизительно 5 мин. Удаляют весь раствор из элементов устройства. Концентрируют вышеуказанный растворAT после диализа при помощи устройства фильтра для центрифугирования Ultrafree-15 до 4,5-5,5 мг/мл путем центрифугирования на настольной центрифуге (бакет-ротор) при 3500 об./мин в течение приблизительно 5 мин, трижды. Аккуратно удаляют концентрированный раствор AT из фильтрующего элемента устройства Amicon в 15 мл пробирку. Для максимального сбора удаляют концентрированный образец сразу же после центрифугирования и ресуспендируют концентрированный объем несколько раз с помощью пипетки для обеспечения оптимального перемешивания и удаления AT. Центрифугируют концентрированный раствор AT при 10000 об./мин в течение приблизительно 15 мин и переносят супернатант с AT в 15 мл пробирку. Измеряют OD280 раствора AT в разведении 1:20 1xPBS и рассчитывают концентрацию AT. Отбирают 0,1 мл раствора AT для анализа методом ELISA. Хранят при 2-8 С. Приготовление конъюгата MTB-LAM-AT-HRP. Промывают все стеклянные пробирки и магнитные мешалки для стадии конъюгации и стеклянные пробирки для хранения конъюгата раствором H2SO4 и тщательно прополаскивают их водопроводной водой и деионизированной Н 2 О. Приготовление колонки Sephadex G-25 для хроматографии. Берут колонку (1,530 см) с приблизительным V=50 мл, заполненную Sephadex G-25 (Fine). Заполняют колонку так же, как описано выше. Устанавливают следующие условия хроматографии для уравновешивания колонки 1 мМ ацетатом натрия: ацетатный буфер, рН 4,4,УФ проточный спектрофотометр с длиной волны 280 нм,чувствительность спектрофотометра: 0,2 OD,скорость регистрирующего записывающего устройства: 2 мм/мин,скорость подачи жидкости для промывки колонки: 60 мл/ч. Промывают колонку примерно 100-150 мл 1 мМ ацетата натрия, рН 4,4 и устанавливают базовую линию УФ-спектрофотометра на нулевую позицию. Следят за тем, чтобы установленная базовая линия оставалась неизменной в течение приблизительно 30 мин. Рассчитывают количество раствора MTBLAM-AT, необходимого для конъюгации, и центрифугируют AT при 12000 об./мин в течение примерно 10 мин. Аккуратно собирают супернатант AT в чистую стеклянную пробирку. Измеряют OD280nm раствора AT в разведении 1:20 1x PBS и рассчитывают концентрацию неразведенного раствора AT. Хранят раствор AT при 2-8 С до использования. Окисление HRP (пероксидазы хрена) с использованием NaIO4. Взвешивают 8 мг HRP в V-образной стеклянной пробирке. Добавляют 2,0 мл деионизированнойH2O. Осторожно перемешивают раствор в течение приблизительно 2-3 мин для того, чтобы HRP растворилась. Следят за тем, чтобы не оставалось нерастворенных частиц HRP на стенках стеклянной пробирки. Готовят свежий раствор 0,1 М NaIO4, рН 4,4 для использования в течение 5 мин и предохраняют от попадания света. Добавляют 0,4 мл 0,1 М NaIO4 к раствору HRP, приготовленному ранее, при перемешивании. Закрывают пробирку алюминиевой фольгой для защиты смеси от попадания света. Инкубируют смесь в течение 20 мин при перемешивании при температуре окружающей среды. К реакционной смеси добавляют 4 капли этиленгликоля и перемешивают примерно 2 мин. Хроматография и концентрирование окисленной HRP. Немедленно после завершения вышеуказанной стадии очищают окисленную HRP путем гельфильтрации на колонке Sephadex G-25 (Fine). Устанавливают скорость потока жидкости для элюции образца приблизительно 50 мл/ч. Тщательно переносят общий объем окисленной HRP, приготовленной ранее, на слой подсушенного геля, но при этом следят за тем, чтобы слой геля не нарушался. Не допускают высыхания геля. Собирают весь окисленный раствор HRP (окрашенный раствор) в одну 15 мл пробирку - первый пик на хроматографической диаграмме (OD280 нм 0,05). После завершения хроматографии, очищают колонку Sephadex G-25, выбрасывают гель и записывают объем раствора HRP после хроматографии. Концентрирование окисленной HRP. Предварительно промывают устройство фильтра для центрифугирования Ultrafree-15 1 мМ ацетата натрия, рН 4,4, приблизительно 15 мл 1 мМ ацетата натрия, рН 4,4 и центрифугируют фильтрующий элемент в течение приблизительно 5 мин при 3500 об./мин с помощью настольной центрифуги (бакет- 12013228 ротор). Затем удаляют все растворы из фильтрующего элемента. Немедленно после хроматографии концентрируют окисленный раствор HRP (вышеуказанный) до приблизительно 20,2 мл с помощью фильтра для центрифугирования Ultrafree-15 (Biomax-10K мембранный фильтр) путем центрифугирования при 3500 об./мин в течение приблизительно 5 мин. Тщательно собирают концентрированный раствор HRP из фильтрующего элемента устройства в чистую стеклянную пробирку, измеряют и записывают объем и хранят при 2-8 С. Конъюгация HRP с MTB-LAM-AT. Рассчитывают объем раствора MTB-LAM-AT, необходимый для конъюгации с HRP. ПомещаютMTB-LAM-AT (вышеуказанный) в V-образную стеклянную пробирку с треугольной магнитной мешалкой, не оставляя раствор AT на стенках пробирки. Добавляют 1/2 объема окисленного раствора HRP(вышеуказанного) к раствору MTB-LAM-AT, закрывают пробирку алюминиевой фольгой для защиты реакционной смеси от света и перемешивают реакционную смесь в стеклянной пробирке в течение 30 мин при комнатной температуре. Избегают образования пены. Добавляют 1 М карбонат-HCl для доведения до рН 9,5 и перемешивают при комнатной температуре в течение 2 ч. Защищают от света и избегают образования пены. Готовят 4 мг/мл борогидрида натрия (NaBH4) непосредственно перед использованием и защищают от света при помощи алюминиевой фольги. Незамедлительно добавляют рассчитанное количествоNaBH4, требуемое для раствора MTB-LAM-AT, приготовленного ранее, и инкубируют реакционную смесь при примерно 2-8 С в течение 2 ч. Проводят диализ реакционной смеси против 1x PBS в течение минимум 48 ч при 2-8 С минимум с 4 заменами буфера с 8-16 часовыми интервалами. Для диализа используют диализную трубку с отсечением по молекулярному весу 12-14 кДа. Хранение и анализ конъюгата. После диализа центрифугируют раствор конъюгата при 4000 об./мин в течение примерно 4 мин. Аккуратно извлекают супернатант и помещают раствор конъюгата в чистую 6 мл стеклянную пробирку. Отмеряют 18 мл стабилизатора конъюгата пероксидазы/разбавителя Gardian в 50 мл стеклянную колбу с магнитной мешалкой. Добавляют 2 мл конъюгата MTB-LAM-AT-HRP и перемешивают реакционную смесь в течение примерно 10 мин. Хранят при 2-8 С и защищают от света. Вышеуказанные стадии, касающиеся приготовления конъюгата МТВ, схематично представлены на фиг. 9. Результаты. Далее мы представляем результаты исследования непосредственно антигена методом ELISA, который позволяет обнаруживать LAM в необработанной, неконцентрированной моче с помощью "прямого способа", применяющегося для приготовления обогащенного антитела. (Полагаем, что даже лучший результат будет достигнут при применении обогащенных антител, приготовленных с помощью способа обогащения, описанного выше). Исследования, представляющие данные результаты, были проведены в области Мбея, которая находится на Юго-Западном нагорье Танзании, совместно с региональной программой по ТБ и проказе и медицинским исследовательским проектом Мбея (MMRP). В области Мбея ежегодно диагностируется приблизительно 3500 новых случаев ТБ и лечение проводится в соответствии с национальной стратегией DOTS. Начало каждого лечения начинается в центральном отделении Мбейского лечебно-диагностического центра. Показатель эффективности лечения ТБ составлял 72,3% в 2002. Цель исследования заключалась в определении эффективности коммерчески доступного анализа ELISA с иммобилизованным LAM в клинической практике и сравнении результатов с золотым стандартом диагностики ТБ: микроскопия мокроты, ТБ-культивирование, рентгенограмма легких и клиническое исследование. Материалы и методы. Описание LAM-ELISA.Portland, ME, США) является сходным с методом LAM-ELISA, разработанным другими. Иммунная сыворотка была получена из белых новозеландских кроликов, которых иммунизировали инактивированными цельными клетками М. tuberculosis линии H37Rv. Поликлональные LAM-специфические антитела были выделены путем аффинной хроматографии при использовании иммобилизованного LAM в качестве лиганда. Тест-набор состоит из 96-луночного планшета для ELISA, на который предварительно иммобилизовали LAM-специфичное антитело, блокированного и закрытого в пластиковом мешочке с осушителем; флакон с LAM-специфичным HRP-конъюгированным LAM-специфичным поликлональным антителом; флакон с однокомпонентным хромогенным веществом ТМВ (3,3',5,5'-тетраметилбензидин); флакон с отрицательным контрольным раствором и три флакона с калибровочными маркерами, соответствующими 0,5, 1,5 и 4,5 нг/мл LAM в образцах мочи. Образцы мочи считались положительными при анализе ELISA, когда полученная оптическая плотность при 450 нм была по меньшей мере на 0,1 выше сигнала отрицательного контроля (2SD). Пробы мочи пациента объемом 0,1 мл помещают в планшет для ELISA в двух повторах, инкубируют в течение 1 ч и отмывают 0,05% раствором Tween-20/PBS (PBST). Добавляют 0,1 мл LAMспецифичного HRP-конъюгата. После 1 ч инкубации планшет промывают раствором PBST и добавляют- 13013228 0,1 мл субстрата ТМВ. После 10 мин инкубации останавливают реакцию субстрата добавлением 0,1 мл 1 М H2SO4 и окраску регистрируют при 450 нм. В других воплощениях специфическую изоформу липоарабиноманнана (LAM), определяемую по уровню антигенной активности, применяют для приготовления высокоспецифичных поликлональных антител, которые применяют для обнаружения липоарабиноманнана микобактерии в моче пациентов,обследованных на наличие активной формы туберкулеза, при применении протоколов, которые сходны с описанными выше. Антигенно-активная изоформа LAM была обнаружена при применении селективного окисления LAM, где две изоформы были полностью идентифицированы и различимы (данные не представлены). Одна изоформа содержала участки чувствительные к высоким концентрациям периодата натрия (NaIO4), так что при высоких концентрациях периодата натрия серологическая активность LAM сводилась к нулю. Другая изоформа сохраняла серологическую активность, даже тогда, когда подвергалась воздействию высоких концентраций периодата натрия. Сравнение двух способов окисления LAM с применением любых мягких окислителей или низких концентраций NaIO4, показано, что антигенная активность LAM сохраняется. Окисление высокими концентрациями NaIO4, однако, приводит к потере антигенной активности LAM. Таким образом, только LAM, активированный CNBr, или окисленный мягкими окислителями или низкими концентрациями NaIO4, может использоваться для создания высоко антигенного LAM для применения в приготовлении высокоспецифичных, высокоочищенных поликлональных антител для применения в обнаружении LAM в образцах мочи для диагностирования ТБ у обследуемых пациентов. Данные результаты являются совершенно неожиданными при их сравнении со способами обнаружения, раскрытыми Svenson et al. (см., например, WO 97/34149), в которых применяли только высокие концентрации NaIO4 для окисления микобактериального LAM, и соответственно нарушалась антигенная активность LAM, использованного для создания антител. Не зная о том, что существует более чем одна изоформа LAM, было невозможно в более раннем раскрытии получить высокоспецифичные антитела к антигенно-активной форме LAM, поскольку никто ранее до данных исследований даже не предполагал существования особой изоформы, которая проявляла антигенную активность, или такая активность теряется во время проведения стандартных способов окисления, а именно обработки высокими концентрациями NaIO4. Описание клинических условий. В течение восьми недель 242 пациента с подозрениями на ТБ были приняты в амбулаторных отделениях 5 клинических центров в Мбеи, Танзания. Стандартные протоколы обследования включали клиническую оценку, рентгенограмму лгких, СОЭ, количество лейкоцитов и тест на ВИЧ, 3-кратное AFBокрашивание мокроты (Циль-Нильсен) на 1, 2 и 3 дни, культивирование 2 образцов мокроты на среде Левенштейна-Йенсена и анализ мочи и сыворотки методом LAM-ELISA. Все пациенты имели клинические симптомы ТБ (кашель 4 недель, ночная потливость, потеря веса,потеря аппетита). 137 из них имели лабораторно подтвержденную легочную форму ТБ (ЛТБ), 9 имели сильное подозрение на ЛТБ по результатам рентгенографии (плевральные выпоты или увеличенные прикорневые лимфатические узлы), и у 8 обнаружились клинические и рентгенологические признаки военного ТБ. Пациенты, давшие согласие, были протестированы на ВИЧ статус и 70% были подтверждены как ВИЧ-положительные. С результатами обращались конфиденциально. Исследование было одобрено местным институтским наблюдательным советом и национальным комитетом по этике Республики Танзания. Все лабораторные процедуры осуществлялись в лабораторном отделении Мбейского медицинского исследовательского Центра. Микроскопия и культивирование образцов мокроты. Окрашивание по методу Циль-Нильсена и микроскопия осуществлялись опытным и хорошо подготовленным техником-лаборантом. После специальной обработки образцы мокроты культивировали в среде Левенштейна-Иенсена в двух повторах. Культуры проверяли еженедельно на рост в течение 8 недель. Образцы мочи. От каждого пациента собирали 30 мл мочи в стерильный пластиковый контейнер, который помечали кодовым номером, соответствующим карте данных пациента. 100 мкл свежей и необработанной мочи добавляли в лунки планшета для ELISA в двух повторах. Отрицательные контроли, низко-, средне- и высокоположительные контроли также добавляли к каждому планшету в двух повторах. Образцы обрабатывались в течение 24 ч и затем хранились при -20 С для последующего тестирования в Германии. Группы контроля из Танзании и США. Образцы мочи 23 сотрудников Мбейского лечебно-диагностического центра, 20 сотрудников Chemogen, Inc. и 200 пациентов из 2 клиник в Нью-Йорке были протестированы способом LAM ELISA. Все они казались здоровыми в процессе клинического исследования и не имели каких-либо симптомов респираторных инфекций. Результаты. Доклиническая апробация способа ELISA.- 14013228 Фиг. 4 А демонстрирует кривую концентрационной зависимости при использовании различных концентраций LAM в моче, где темные кружки обозначают результаты ELISA при использовании LAM из М. tuberculosis, и светлые кружки обозначают контрольные результаты ELISA. Оптимальная точка отсечения определяется, согласно данной кривой, как концентрация LAM, обеспечивающая оптическую плотность (OD), превышающую OD отрицательного контроля на 0,1 OD, что соответствует более чем 2 стандартным отклонениям выше сигнала образца отрицательного контроля. Все образцы с оптической плотностью выше данного отсечения считались как ELISA-положительные. Отсечение соответствовало приблизительно 0,25 нг/мл LAM в необработанной свежей моче.MTB-ELISA оценивали на перекрестную реактивность с другими видами и родами грамположительных и грамотрицательных бактерий, типичных для инфекций мочевой системы и бактериальной пневмонии. Ни один из тестируемых образцов не показал какой-либо реактивности в оцениваемом способе LAM-ELISA, даже при высоких тестируемых концентрациях (фиг. 4 В), как можно видеть при сравнении результатов ELISA для М. tuberculosis (светлые треугольники) с результатами ELISA для других тестируемых бактериальных видов (темные треугольники, светлые и темные ромбы, светлые и темные кружки), изображенными на фиг. 4 В. Анализ цельных клеток разных видов микобактерий способомLAM-ELISA показывает перекрестную реактивность всех тестируемых видов микобактерий (М.) (фиг. 4 С), однако, М. tuberculosis H37Rv и М. bovis обнаруживаются с большей чувствительностью. Оба вида очень близки с иммунохимической точки зрения, только М. bovis редко является причиной микобактериальной инфекции у человека. Данные участников исследования. Согласно табл. 1, 242 исследуемых с подозрением на ТБ были разделены на 3 основных категории:(1) больные легочной формой ТБ с подтвержденным диагнозом по результатам микроскопии и/или культивирования, (2) больные с типичными клиническими и рентгенологическими признаками и (3) больные с клиническими симптомами ТБ, которые не являлись предполагаемыми ТБ больными, т.к. результаты всех общедоступных диагностических методов (рентгенография, микроскопия и культивирование мокроты) являлись отрицательными. Первая группа включала 137 пациентов, которые имели лабораторно подтвержденный легочный ТБ. У 132 было подтверждение по культивированию на среде Левенштейна-Йенсена и пятеро имели отрицательный результат по культивированию и AFB-положительный. Из 132 положительных случаев по культивированию 62,12% были AFB-положительные. Вторая группа содержала 17 других пациентов, которые были включены в терапевтическую программу DOTS, на основании рентгенографических и клинических данных (табл. 1). 88 пациентов третьей группы имели отрицательные результаты мокроты и у них не обнаруживалось специфических рентгенологических признаков легочного ТБ, и они не были, следовательно, включены в программу DOTS. Средний возраст участников исследования составлял 34 года. Соотношение женщин к мужчинам составляло 41:59. Общий уровень распространенности ВИЧ среди 223 пациентов, которые согласились быть протестированными на ВИЧ, составлял 69,1% (см. табл. 2). Уровень распространенности ВИЧ составлял 73,2% среди пациентов с подтвержденным ТБ и 60,8% среди пациентов без подтвержденного ТБ. Клиническая оценка ELISA. Из 137 пациентов с подтвержденным легочным ТБ (культивирование или AFB-положительное окрашивание) 111 являлись LAM-ELISA-положительными (чувствительность 81,02%) по предварительно определенному отсечению (оптическая плотность (OD) отрицательного контроля + 0,1). Среднее превышение OD (= среднее арифметическое OD - OD отрицательного контроля) для группы (82), положительной по микроскопии мазка и культивированию, составляло 0,604. Для отрицательных по мазку и положительных по культивированию случаев (50) среднее OD приращение равнялось 0,293 и для положительных по мазку, но отрицательных по культивированию случаев (5) - 0,249. Из 17 пациентов второй группы, которые были отрицательными по результатам культивирования иAFB-окрашивания, но имели рентгенологические и клинические признаки ТБ, 13 (76,47%) имели положительный результат теста LAM-ELISA со средним превышением OD 0,183. Из них 13 (76,47%) были ВИЧ-положительными. Остальные 88 пациентов, которые попали в специализированную ТБ клинику с клиническими симптомами, напоминающими легочную форму ТБ, были отрицательными по культивированию и AFBокрашиванию и не имели специфических рентгенологических признаков ТБ. Из них 13 (14,77%) имели положительные результаты LAM-ELISA теста (среднее OD превышение 0,184). Основываясь на известной концентрации в низко-, средне- и высокоположительном контроле, который был включен в каждый планшет, можно определить приблизительную концентрацию LAM в каждой пробе мочи, основываясь на величине OD ELISA. Коррелирует ли концентрация LAM с индивидуальным содержанием бактерий туберкулеза, было определено у AFB-положительных пациентов. В то время, как у пациентов с низкой плотностью бактерий туберкулеза по данным микроскопии (AFB +) средняя концентрация антигена LAM в моче составляла 0,93 нг/мл, у пациентов со средней плотностью кислотоустойчивых бацилл (AFB ) средняя концентрация антигена в моче составляла 1,74 нг/мл и уAFBпациентов - 2,02 нг/мл (фиг. 5). Последняя величина ниже, чем реальная концентрация LAM в- 15013228 моче AFB пациентов, поскольку прибор для чтения ELISA, использованный в Танзанской лаборатории, не был способен считывать сигналы выше двух единиц OD, соответствующих около 4 нг/мл. ВИЧ-серостатус не оказывал влияние на чувствительность LAM-ELISA у пациентов с подтвержденным легочным ТБ. Из 124 пациентов с известным ВИЧ-серостатусом и положительным ТБ по результатам культивирования и/или AFB-окрашивания, 73 из 89 ВИЧ-инфицированных пациентов (82,0%) имели положительный результат в LAM-ELISA в сравнении с 26 из 35 неинфицированных индивидуумов(74,3%). Подобным образом чувствительность AFB не зависела от ВИЧ серостатуса. Чувствительность составляла 61,2% и 58,8% у ВИЧ-инфицированных и отрицательных индивидуумов соответственно. Специфичность анализа оценивали при использовании мочи здоровых танзанийских и американских добровольцев. Исследовали мочу 23 здоровых танзанийских работников госпиталя. Ни один из тестируемых образцов не был положительным по LAM-ELISA (-0,047 средняя относительная OD, специфичность 100%). Образцы мочи 220 здоровых добровольцев из США были собраны и исследованы. У всех, за исключением 4, оптическая плотность была ниже линии отсечения в 0,1 OD (специфичность 98,18%). Обсуждение. Классические способы для диагностики ТБ, культивирование мокроты и микроскопия мазков, имеют очевидные ограничения. Оба способа обнаруживают только случаи открытой формы легочного ТБ,что значительно уменьшает возможность обнаружения всех случаев активного ТБ независимо от органного проявления. Следовательно, в прошлом было разработано множество новых методов, которые могли бы дополнять классические способы, особенно при имеющихся бедных технических средствах. Критериями, которые были установлены для таких новых методов, являются а) более высокая чувствительность, чем в микроскопии, b) сравнимая специфичность, с) незначительная дополнительная работа, d) возможность диагностики ТБ при отрицательном анализе мокроты и е) чувствительность, которая не ослабляется при наличии коинфекции ВИЧ. В первом приближении чувствительность LAM-ELISA (81% положительных по культивированию) превосходила AFB-окрашивание (69%). Чувствительность может быть в дальнейшем повышена за счет концентрирования свежей мочи, что, однако, повлечет за собой дополнительный объем работ для техника лаборанта. Вероятность обнаружения способом LAM-ELISA для случаев с рентгенологически подтвержденным военным ТБ (87,5%), также и для случаев с отрицательными результатами по мокроте с типичными рентгенологическими признаками легочного ТБ (67%), была обнадеживающей, хотя число всех случаев не достаточно велико для окончательного вывода. Для здоровых индивидуумов чувствительность ELISA была высокой (98,18% в США и 100% в Танзании). Коинфекция ВИЧ в случаях ТБ по положительным результатам культивирования не оказывает влияния на чувствительность LAM-ELISA. По сравнению с предыдущими опубликованными результатами LAM-ELISA, новый тест обнаруживает LAM при более низких концентрациях (0,2 нг/мл), чем имеющиеся тесты. Чувствительность нового теста составляла 82,9% (для AFB +) для неконцентрированной и свежей мочи по сравнению с чувствительностью 81,3% предыдущих тестов, в которых использовалась обработанная и замороженная моча. Специфичность теста составляла 98,36% в данном исследовании, по сравнению с 86,9% в предыдущем исследовании. Ограничение такого единовременного ТБ обследования заключалось в том, что для определенного количества пациентов с предполагаемым ТБ, оставались сомнения в плане их ТБ-статуса (группа 2 и 3). Для решения этого вопроса мы выделили три основные категории для анализа: группа 1: лабораторно подтвержденный ТБ, группа 2: клинически и рентгенологически определенный ТБ, группа 3: нет лабораторного или рентгенологического доказательства ТБ. Хотя мы были уверены, что у участников из категории 1 имеется истинный ТБ, мы не могли исключить, что категории 2 и 3 включают ряд пациентов,неправильно распределенных по группам. В связи с этим мы исключили их из нашего расчета чувствительности и специфичности. При диагнозе ТБ часто требуется продолжительное врачебное наблюдение за пациентами. Особенно пациенты с отрицательными результатами мокроты, но с необычными рентгенологическими признаками, будут нуждаться в нескольких дополнительных консультациях для того,чтобы вторично исследовать их ТБ-статус. При длительном исследовании повторные клинические, так же, как и диагностические, осмотры и результаты лечения ТБ могут дать важную дополнительную информацию для классификации групп 2 и 3 на больных ТБ и не больных ТБ пациентов. Представляющим исключительный интерес является вопрос, существует ли количественная корреляция между бактериальной обсемененностью М. tuberculosis и количеством LAM, обнаруженным в моче. Единственный способ для ответа на этот вопрос при комплексном исследовании заключался в установлении корреляции величины AFB-окрашивания мокроты и концентрации LAM в моче. Как показано на фиг. 5, существовала очевидная положительная корреляция концентрации антигена в моче и плотности туберкулезных бактерий в мокроте. Такая корреляция раскрывает некоторые дополнительные возможности применения LAM-анализа. Контроль за успешным лечением и раннее распознавание обострений после завершения лечения представляют прямую практическую значимость. Сочетание чувствительного анализа мочи со способностью обнаруживать внелегочную форму ТБ и ТБ при AFBотрицательных результатах позволяет считать LAM-анализ мощным инструментом в условиях возрас- 16013228 тающего распространения внелегочных форм ТБ и легочных форм с нетипичными клиническими симптомами. LAM-ELISA может быть применен не только для диагностирования пациентов с клиническими симптомами, но также для обследования ВИЧ-положительных пациентов и других групп с высокой степенью риска. Выявление ТБ в начальной стадии заболевания и эффективное лечение являются двумя опорами в успешной борьбе против ТБ. Для дальнейшего изучения роли LAM-анализа в данной борьбе мы в настоящее время запланировали некоторые перспективные и многоцентровые исследования. Таким образом, LAM-ELISA может быть с легкостью включен в рутинные диагностические процедуры лабораторий, как развитых, так и развивающихся стран. Это легкий в использовании и надежный метод. Выполнение анализа ELISA требует всего 2 1/2 ч, и большое количество образцов может быть проанализировано одновременно. Поскольку антиген липоарабиноманнан является стабильным, можно было хранить мочу в холодильнике в течение 3 дней без значительного уменьшения оптической плотности. Вновь разработанный MTB-ELISA для обнаружения LAM в необработанной моче имеет потенциал скрининг-теста для применения также в полевых условиях в развивающихся странах. Таблица 1 Анализ экскреции LAM в моче среди 242 пациентов, поступивших в амбулаторное отделение с клиническими подозрениями на ТБ, и контрольной группы из 243 клинически здоровых людей. Пределом отсечения для положительности по LAM-ELISA является 0,1 выше средней оптической плотности отрицательного контроля на планшете.+ = положительный. Таблица 2 Соотношение ВИЧ-положительных пациентов в разных группах. 223 из 242 дали согласие на ВИЧ-тестирование ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения обогащенного поликлонального антитела, высокоспецифичного к антигену поверхностного полисахарида липоарабиноманнана (LAM) микобактерии, включающий нанесение сыворотки из млекопитающего, зараженного микобактериями, на первый аффинный матрикс, приготовленный с выделенным антигеном LAM микобактерии, так что поликлональное антите- 17013228 ло, специфичное к выделенному антигену LAM, удерживается первым аффинным матриксом; выделение поликлонального антитела, специфичного к выделенному антигену LAM, из первого аффинного матрикса; модификацию выделенного антигена LAM с целью его инактивации путем окисления при помощиNaIO4 с получением модифицированного антигена LAM; нанесение выделенного поликлонального антитела на второй аффинный матрикс, приготовленный с модифицированным антигеном LAM, так что поликлональное антитело, специфичное к модифицированному антигену LAM, удерживается вторым аффинным матриксом; выделение обогащенного поликлонального антитела, специфичного к выделенному антигену LAM,путем сбора эффлюента со второго аффинного матрикса с получением обогащенного поликлонального антитела, высокоспецифичного к LAM за счет исключения антител, которые узнают модифицированный антиген LAM и удерживаются вторым аффинным матриксом,причем обогащенное поликлональное антитело является более высокоспецифичным и проявляет большую чувствительность к микобактериальному антигену LAM, чем необогащенное антитело. 2. Способ по п.1, в котором микобактерией является Mycobacterium tuberculosis. 3. Способ по любому из пп.1, 2, в котором LAM выделен из адъюванта Фрейнда. 4. Популяция обогащенных поликлональных антител, высокоспецифичных к антигену LAM, полученная способом по любому из пп.1-3. 5. Способ обнаружения микобактериальной инфекции в образце, взятом у представляющего интерес субъекта, путем детекции антигена LAM в образце, включающий проведение иммунологического анализа на антиген LAM с использованием обогащенного поликлонального антитела, высокоспецифичного к антигену поверхностного полисахарида липоарабиноманнана (LAM) микобактерии, причем поликлональное антитело обогащают путем исключения антител, которые узнают антиген, модифицированный окислением при помощи NaIO4; причем результат иммунологического анализа, полученный на образце от представляющего интерес субъекта, который является повышенным по сравнению с результатом, полученным с отрицательным контролем, считается положительным в отношении микобактериальной инфекции. 6. Способ по п.5, в котором микобактериальной инфекцией является М. tuberculosis. 7. Способ по п.5, в котором иммунологический анализ представляет собой твердофазный иммуноферментный анализ. 8. Способ по п.5, в котором микобактериальная инфекция представляет собой болезнь Джона. 9. Способ по п.5, в котором микобактериальной инфекцией является легочная форма инфекции Mycobacterium tuberculosis. 10. Способ по п.5, в котором микобактериальной инфекцией является внелегочная форма инфекцииMycobacterium tuberculosis. 11. Способ по п.5, в котором образцом является любой из следующих: мокрота, кровь, моча, ткань или другой пригодный образец. 12. Способ по п.5, в котором образцом является необработанная неконцентрированная моча. 13. Набор для иммуноаналитического обнаружения микобактериальной инфекции в образце, отличающийся тем, что набор включает обогащенное антитело, полученное способом по любому из пп.1-3. 14. Набор по п.13, где иммунологический анализ представляет собой твердофазный иммуноферментный анализ. 15. Набор по п.13, где иммунологический анализ представляет собой иммунохроматографический стрип-тест. 16. Набор по п.13, где микобактериальной инфекцией является Mycobacterium tuberculosis.
МПК / Метки
МПК: G01N 33/569, C07K 16/12
Метки: способы, поликлонального, применения, полисахарида, получения, способ, микобактерий, липоарабиноманнана, поверхностного, обогащённого, высокоспецифичного, антитела, антигену
Код ссылки
<a href="https://eas.patents.su/24-13228-sposob-polucheniya-obogashhyonnogo-poliklonalnogo-antitela-vysokospecifichnogo-k-antigenu-poverhnostnogo-polisaharida-lipoarabinomannana-mikobakterijj-i-sposoby-ego-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения обогащённого поликлонального антитела, высокоспецифичного к антигену поверхностного полисахарида липоарабиноманнана микобактерий, и способы его применения</a>
Предыдущий патент: Тирозиновые производные в качестве модуляторов pparγ
Следующий патент: Выделенный промотор из палочковидного тунгро-вируса риса и способы его применения
Случайный патент: Пониженная интерференция между маслосодержащими адъювантами и антигенами, содержащими поверхностно-активные вещества