Способ регулируемого окисления раствора, содержащего двухвалентное железо
Формула / Реферат
1. Способ получения раствора, содержащего трехвалентное железо, путем регулируемого окисления раствора, содержащего двухвалентное железо, включающий выполнение двух реакций, включая первую реакцию окисления двухвалентного железа в трехвалентное железо с помощью диоксида серы и кислорода и вторую реакцию получения серной кислоты из диоксида серы и кислорода, где указанная первая реакция имеет максимальную скорость окисления, при этом способ включает:
(a) обработку раствора, содержащего двухвалентное железо, в реакторе с одним или более вводимыми газами, содержащими диоксид серы и кислород;
(b) регулирование скорости подачи газообразного диоксида серы до скорости подачи газообразного диоксида серы, которая является равной или ниже максимальной скорости окисления двухвалентного железа в трехвалентное железо; и
(c) измерение и регулирование количества растворенного кислорода в указанном растворе, содержащем двухвалентное железо, на величину, при которой:
i) предотвращается восстановление трехвалентного железа в двухвалентное и
ii) избирательность получения трехвалентного железа с помощью первой реакции по сравнению с получением серной кислоты с помощью второй реакции устанавливается в соответствии с требованиями процесса по кислоте; и
(d) регулирование количества растворенного кислорода на указанную величину при поддержании скорости подачи газообразного диоксида серы.
2. Способ по п.1, в котором указанный раствор, содержащий двухвалентное железо, перемешивают во время окисления.
3. Способ по п.2, в котором раствор, содержащий двухвалентное железо, перемешивают при помощи реактора с подъемом жидкости при помощи сжатого воздуха или перемешивающего устройства, имеющего массивную крыльчатку, обеспечивающую нагнетание вниз, или крыльчатку радиального типа.
4. Способ по п.1, в котором оптимальный уровень концентрации растворенного кислорода поддерживают путем регулирования одного или более из следующего:
расход кислородсодержащего газа, вводимого в указанный раствор;
парциальное давление кислорода в кислородсодержащем газе и
степень перемешивания указанного раствора.
5. Способ по п.1, в котором указанный раствор, содержащий двухвалентное железо, представляет собой щелок, полученный при гидрометаллургической обработке металлсодержащего материала, выбранного из руды, рудного концентрата или отходов, указанный щелок предпочтительно включает обедненный выщелачивающий раствор, насыщенный выщелачивающий раствор, очищенный продукт, верхний продукт отстойника, либо комбинацию из двух или более перечисленных материалов.
6. Способ по п.1, в котором указанный раствор, содержащий двухвалентное железо, входит в состав суспензии.
7. Способ по п.1, в котором указанный диоксид серы и кислород вводят в указанный раствор в виде газообразной смеси или отдельных газовых потоков.
8. Способ по п.2, в котором указанные диоксид серы и кислород вводят в указанный раствор ниже перемешивающего устройства, предпочтительно путем барботирования через устройство для выпуска газа, такого как газовый диффузор.
9. Способ по п.1, в котором скорость подачи диоксида серы выбирают таким образом, чтобы обеспечить максимальную скорость окисления двухвалентного железа в диапазоне 0,1-27 г/л в час.
10. Способ по п.1, в котором температура процесса окисления составляет от 40 до 80°С, предпочтительно от 50 до 70°С.
11. Способ по п.1, в котором оптимальная величина растворенного кислорода составляет максимум 10 ч/млн и минимум 0,5 ч/млн.
12. Способ по п.1, в котором оптимальная величина растворенного кислорода предпочтительно находится в диапазоне от 3 до 7 ч/млн.
13. Способ извлечения целевого металла из материала, содержащего, по меньшей мере, этот целевой металл, включающий выполнение двух реакций, включая первую реакцию окисления двухвалентного железа в трехвалентное железо с помощью диоксида серы и кислорода и вторую реакцию получения серной кислоты из диоксида серы и кислорода, где указанная первая реакция имеет максимальную скорость окисления, при этом способ включает этапы, на которых:
(а) получают окисляющий раствор, содержащий трехвалентное железо, путем:
(i) обработки в реакторе кислого раствора, содержащего, по меньшей мере, ионы двухвалентного железа, одним или более газами, содержащими диоксид серы и кислород, чтобы окислить ионы двухвалентного железа до ионов трехвалентного железа;
(ii) регулирования скорости подачи газообразного диоксида серы до скорости подачи газообразного диоксида серы, которая является равной или ниже максимальной скорости окисления двухвалентного железа в трехвалентное железо в первой реакции; и
(iii) измерения и регулирования концентрации растворенного кислорода в указанном кислом растворе на величине, при которой:
(iii.а) предотвращается восстановление трехвалентного железа в двухвалентное и
(iii.b) избирательность получения трехвалентного железа с помощью первой реакции по сравнению с получением серной кислоты с помощью второй реакции устанавливается в соответствии с требованиями процесса по кислоте; и
(iv) регулирования количества растворенного кислорода на указанную величину при поддержании скорости подачи газообразного диоксида серы;
(b) выщелачивают упомянутый материал при помощи выщелачивателя, включающего упомянутый раствор, содержащий трехвалентное железо; и
(с) извлекают целевой металл из полученного в результате продукта выщелачивания.
14. Способ по п.13, в котором упомянутый материал представляет собой одно или более из следующего: руду, рудный концентрат или отходы, и предпочтительно одно или более из урановой руды, сульфидной руды или рудного концентрата.
15. Способ по п.13, в котором целевой металл выбирают из одного или более из следующего: урана, меди, никеля, кобальта, молибдена и цинка, предпочтительно урана и/или меди.
16. Способ по п.13, в котором кислый раствор, содержащий двухвалентное железо, представляет собой повторно используемый щелок, имеющийся на предприятии.
17. Способ извлечения целевого металла из материала, содержащего, по меньшей мере, этот целевой металл, включающий выполнение двух реакций, включая первую реакцию окисления двухвалентного железа в трехвалентное железо с помощью диоксида серы и кислорода и вторую реакцию получения серной кислоты из диоксида серы и кислорода, где указанная первая реакция имеет максимальную скорость окисления, при этом способ включает этапы, на которых:
(a) получают суспензию материала;
(b) выщелачивают суспензию с использованием кислого выщелачивателя, включающего раствор, содержащий трехвалентное железо, который получен путем:
i) обработки кислого раствора двухвалентного железа в реакторе одним или более газами, содержащими диоксид серы и кислород, для окисления ионов двухвалентного железа до ионов трехвалентного железа;
ii) регулирования скорости подачи газообразного диоксида серы до скорости подачи газообразного диоксида серы, которая является равной или ниже максимальной скорости окисления двухвалентного железа в трехвалентное железо в первой реакции;
iii) измерения и регулирования концентрации растворенного кислорода в указанном растворе на величине, при которой:
(iii.а) предотвращается восстановление трехвалентного железа в двухвалентное и
(iii.b) избирательность получения трехвалентного железа с помощью первой реакции по сравнению с получением серной кислоты с помощью второй реакции устанавливается в соответствии с требованиями процесса по кислоте; и
iv) регулирования количества растворенного кислорода на указанную величину при поддержании скорости подачи газообразного диоксида серы; и
(с) извлекают целевой металл из полученного в результате продукта выщелачивания.
18. Способ по п.17, в котором указанный раствор, содержащий трехвалентное железо, получают (i) по меньшей мере, частично перед смешиванием с суспензией и/или (ii) по меньшей мере, частично "на месте", после смешивания с суспензией.
19. Способ по п.17, в котором процентное содержание твердых веществ в суспензии такое, что позволяет обеспечить достаточно высокую скорость переноса газа внутри суспензии, в предпочтительном случае содержание твердых веществ не превышает 50%, более предпочтительно составляет менее 40% и еще более предпочтительно составляет от 10 до 30%.
20. Способ по п.13 или 17, в котором этап (b) выщелачивания приводит к восстановлению ионов трехвалентного железа до ионов двухвалентного железа и обработку диоксидом серы и кислородом продолжают на этапе (b) выщелачивания для повторного окисления ионов двухвалентного железа в ионы трехвалентного железа.
21. Способ переноса способа извлечения металла по п.13 или 17 из первого реактора во второй реактор, включающий этапы, на которых:
(a) определяют величину количества растворенного кислорода в первом реакторе, при которой
предотвращается восстановление трехвалентного железа в двухвалентное и
избирательность получения трехвалентного железа по сравнению с получением серной кислоты устанавливается в соответствии с требованиями процесса по кислоте;
(b) определяют концентрацию растворенного кислорода в растворе, находящемся во втором реакторе; и
(с) если необходимо, регулируют концентрацию растворенного кислорода во втором реакторе до достижения упомянутой оптимальной величины.
Текст
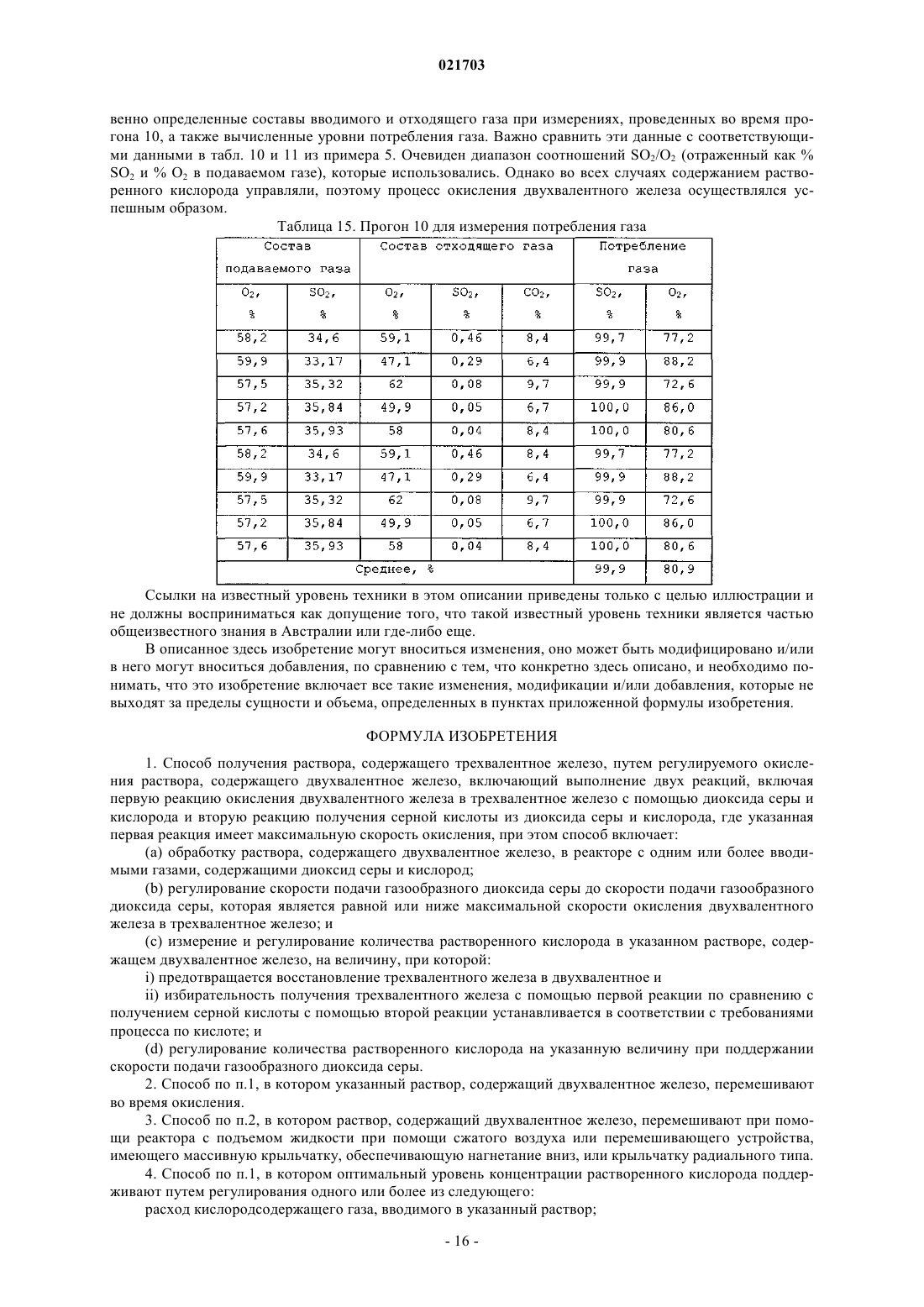
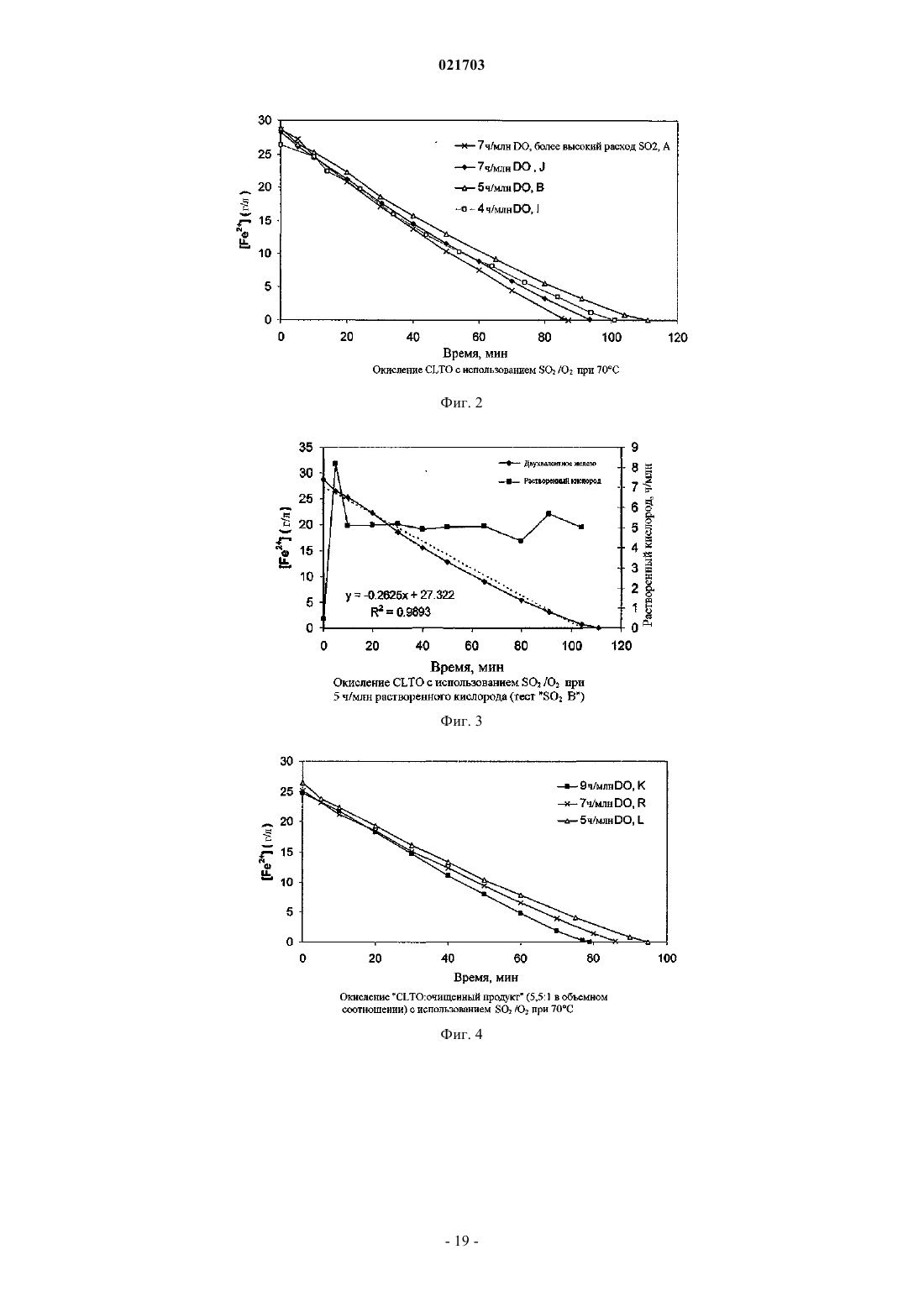
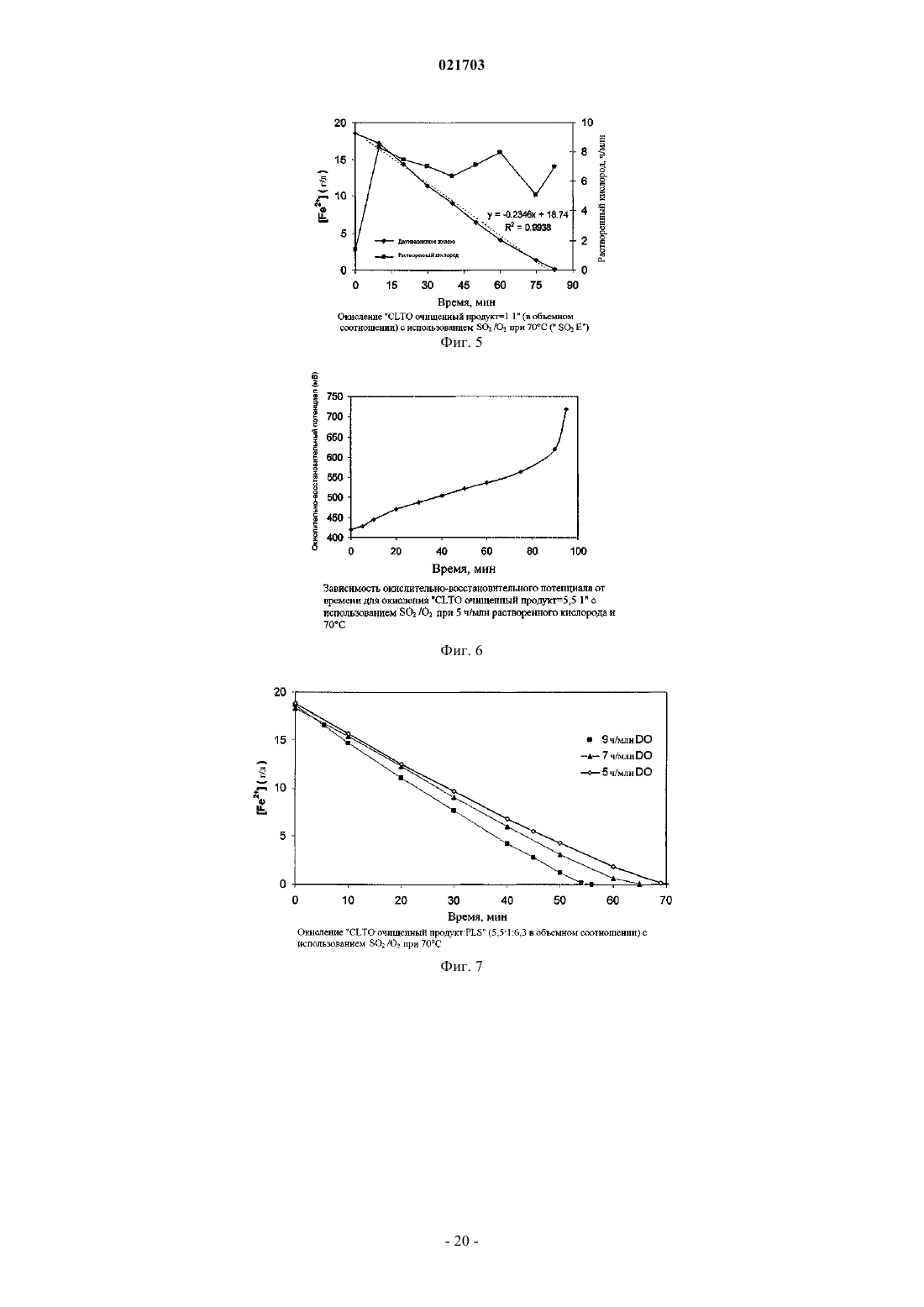
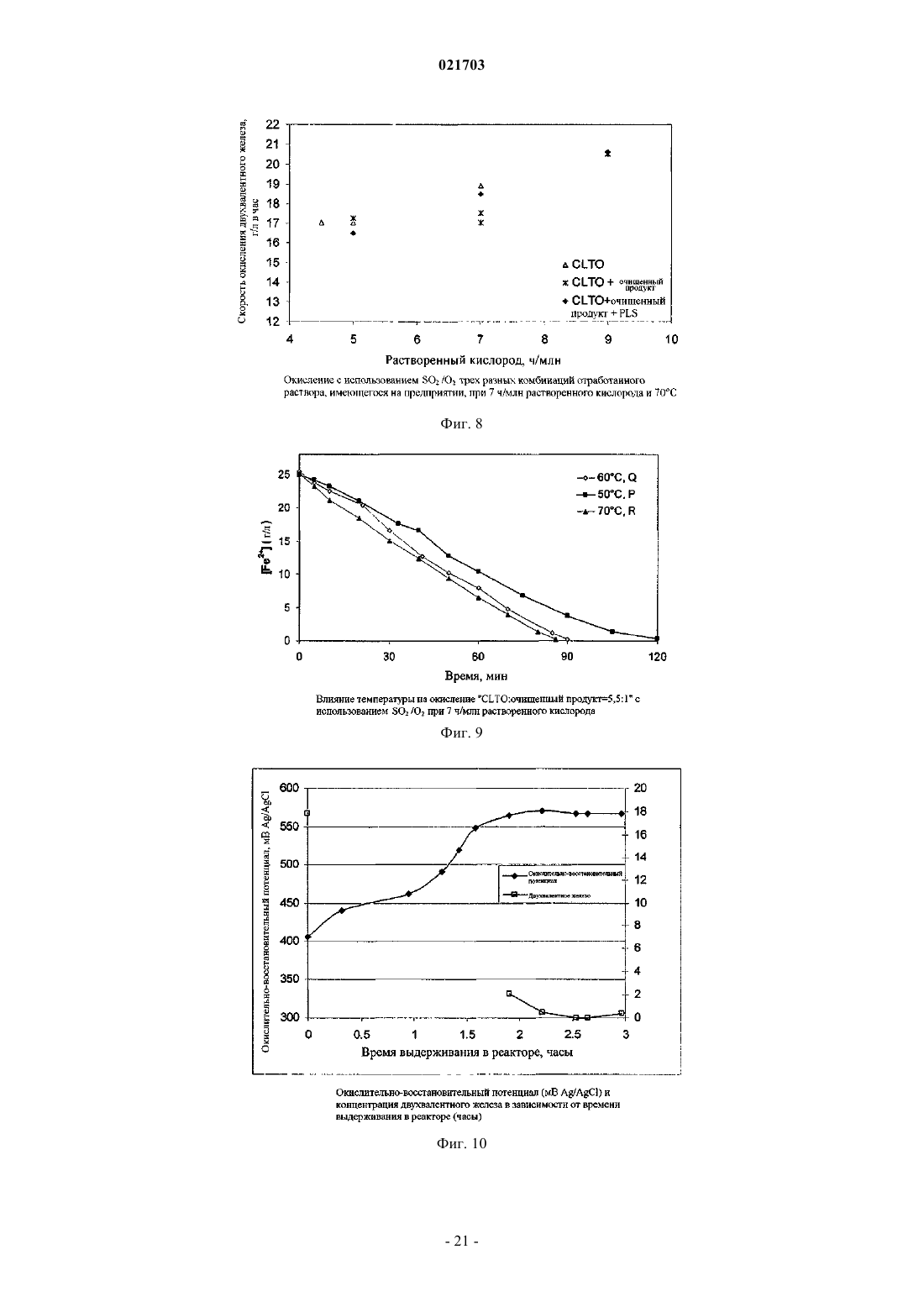
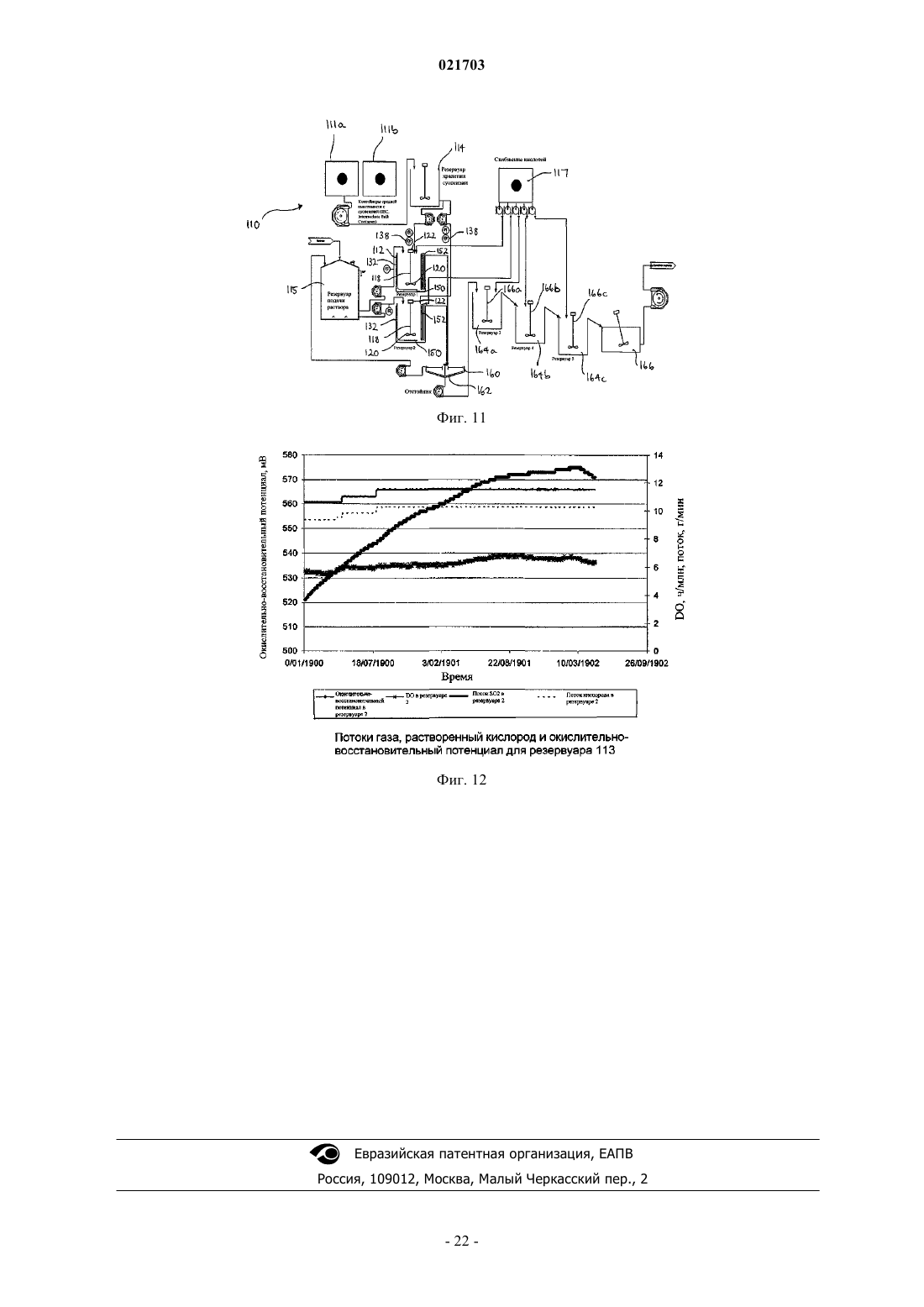
СПОСОБ РЕГУЛИРУЕМОГО ОКИСЛЕНИЯ РАСТВОРА, СОДЕРЖАЩЕГО ДВУХВАЛЕНТНОЕ ЖЕЛЕЗО Способ получения раствора, содержащего трехвалентное железо, путем регулируемого окисления раствора, содержащего двухвалентное железо, и этот способ включает получение раствора,содержащего, по меньшей мере, ионы двухвалентного железа, обработку этого раствора одним или более вводимых газов, содержащих диоксид серы и кислород, чтобы путем окисления превратить ионы двухвалентного железа в ионы трехвалентного железа, причем скорость подачи газообразного диоксида серы является ограничением скорости окисления; и поддержание концентрации растворенного кислорода в упомянутом растворе на оптимальном уровне. Рорке Гари Вернон (AU) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: БиЭйчПи БИЛЛИТОН ОЛИМПИК ДЭМ КОРПОРЕЙШН ПТИ ЛТД. (AU) Область техники Данное изобретение относится к способу регулируемого окисления раствора, содержащего ионы двухвалентного железа, путем обработки диоксидом серы и кислородом. В особенно предпочтительном варианте его реализации изобретение относится к способу выщелачивания материала, содержащего большое количество металла, который включает этап регулируемого окисления двухвалентного железа. Уровень техники При выполнении различных гидрометаллургических процессов возникают большие количества побочного щелока, содержащего двухвалентное железо. Примеры таких процессов включают извлечение урана, меди, никеля, кобальта, цинка из их руд, рудных концентратов или "хвостов". Ионы двухвалентного железа представляют собой потенциальный и недорогой источник окислителя, который может быть окислен до получения ионов трехвалентного железа и возвращен для использования в качестве окислителя на один или более этапов процесса. Одной из промышленных технологий окисления ионов двухвалентного железа является обработка раствора, содержащего двухвалентное железо, газообразными кислородом и диоксидом серы, которые имеются на некоторых предприятиях по обработке сернистых руд. Реакция окисления двухвалентного железа может быть записана следующим образом: Однако, если количество SO2 является слишком большим относительно O2, реакция окисления двухвалентного железа нежелательным образом меняется на обратную, и ионы трехвалентного железа восстанавливаются в ионы двухвалентного железа. Реакция восстановления трехвалентного железа может быть записана следующим образом: Ранее предпринимались попытки найти граничное соотношение газообразных кислорода и диоксида серы, выше которого происходит реакция превращения двухвалентного железа в трехвалентное железо, а ниже которого трехвалентное железо восстанавливается в двухвалентное железо, и выполнять процесс окисления двухвалентного железа выше этого граничного соотношения. Автор настоящего изобретения понял, что такой подход является проблематичным из-за того, что реакции происходят в фазе водного раствора, и скорость диффузии введенных газов в щелок зависит от ряда факторов, таких как парциальное давление кислорода в газе; конструкция реактора, в котором происходит процесс окисления, в частности, его высота (то есть,гидростатическое давление внутри реактора); степень перемешивания раствора, содержащего двухвалентное железо внутри реактора, в частности тип используемого перемешивающего устройства и его мощность и степень потребления растворенного кислорода, находящегося в реакторе, в химической реакции. Автор также понял, что, несмотря на возможность определить оптимальное соотношение газообразных диоксида серы и кислорода для конкретных параметров процесса и/или конкретного реактора,маловероятно, что это соотношение будет применимо при других параметрах процесса и/или реактора,например, когда работу переводят из лаборатории или с опытной установки на коммерческий уровень,увеличивая масштабы. Таким образом, задачей настоящего изобретения является предложить способ регулируемого окисления раствора, содержащего ионы двухвалентного железа, при использовании которого можно преодолеть или, по меньшей мере, уменьшить рассмотренные выше недостатки, свойственные известному уровню техники. Сущность изобретения Настоящее изобретение основано на понимании того, что реакцией окисления двухвалентного железа можно управлять таким образом, чтобы снизить до минимума или, по существу, исключить прохождение нежелательной реакции восстановления трехвалентного железа путем управления скоростью подачи газообразного SO2 таким образом, чтобы она ограничивала скорость окисления, что позволяет сохранить концентрацию SO2, растворенного в растворе, на относительно низком уровне; и поддерживания концентрации растворенного кислорода (DO) на оптимальном уровне, при котором процесс остается окислительным, что позволяет обеспечить избыток кислорода, растворенного в растворе. Согласно первому аспекту настоящего изобретения предлагается способ получения раствора, содержащего трехвалентное железо путем регулируемого окисления раствора, содержащего двухвалентное железо, включающие этапы, на которых получают раствор, содержащий, по меньшей мере, ионы двухвалентного железа; обрабатывают раствор одним или более вводимыми газами, содержащими диоксид серы и кислород для окисления ионов двухвалентного железа до ионов трехвалентного железа, причем скорость подачи газообразного диоксида серы является ограничением скорости окисления; и поддерживают концентрацию растворенного кислорода в растворе на оптимальном уровне. Соответственно, реакция окисления двухвалентного железа имеет заранее определенную скорость,заданную скоростью подачи газообразного диоксида серы. В дополнение к этому, концентрация растворенного кислорода сохраняется на оптимальном уровне при одновременном поддержании заранее определенной скорости реакции окисления двухвалентного железа. При управлении процессом таким образом автор изобретения обнаружил, что окислением двухвалентного железа можно управлять эффективным образом независимо от конфигурации реактора и других параметров процесса. При фиксации скорости подачи диоксида таким образом, чтобы она ограничивала скорость реакции окисления, и поддержания концентрации растворенного кислорода в растворе на оптимальном требуемом уровне процесс можно воспроизводить при различных параметрах этого процесса и/или реактора путем разработки и выполнения процесса с обеспечением того же самого значенияDO. Как правило, значение DO можно будет регулировать путем регулирования скорости подачи кислорода. В одном из вариантов реализации настоящего изобретения раствор, содержащий двухвалентное железо, перемешивают во время процесса окисления. Как правило, перемешивание выполняют при помощи перемешивающего устройства с приводом от двигателя, которое установлено внутри реактора. Примеры подходящих перемешивающих устройств включают устройства с массивной крыльчаткой, обеспечивающей нагнетание вниз, или крыльчаткой радиального типа. В одном из вариантов реализации настоящего изобретения, оптимальный уровень концентрации растворенного кислорода поддерживают путем изменения расхода кислородсодержащего газа, вводимого в раствор. Однако возможны и альтернативные приемы поддержания значения DO, включая регулирование парциального давления кислорода в кислородсодержащем газе или регулирование степени перемешивания раствора, в частности, количества энергии, передаваемой в раствор перемешивающим устройством с приводом от двигателя. Раствор, содержащий двухвалентное железо, может представлять собой щелок, получаемый в результате гидрометаллургической обработки руд, концентратов, отходов, таких как хвосты, либо их комбинации. Щелок может состоять из или быть частью обедненного выщелачивающего раствора, насыщенного выщелачивающего раствора, суспензии, очищенного продукта, верхнего продукта отстойника,раствора, получаемого после растворения минералов пустой породы, раствора, получаемого в результате восстановления ионов трехвалентного железа, либо любого другого подходящего щелока, получаемого на гидрометаллургическом предприятии. Газообразные диоксид серы и кислород можно вводить в раствор в виде газообразной смеси. Однако в одном из вариантов реализации настоящего изобретения газообразные диоксид серы и кислород вводят в отдельных газовых потоках. Как отмечено ранее, скорость переноса кислорода зависит, кроме прочего, от парциального давления кислорода в газе. Газообразный кислород может вводиться в виде воздуха, обогащенного кислородом воздуха или, по существу, чистого газообразного кислорода. Выбираемый состав газа будет в большой степени зависеть от требуемой скорости окисления и рабочей температуры, так как температура влияет на растворимость кислорода. Если кислород и диоксид серы вводятся как газообразная смесь, чистота диоксида серы также будет влиять на парциальное давление кислорода и, таким образом, является важным фактором, влияющим на скорость переноса кислорода. При высоких скоростях окисления и температурах выше 60 С (например,при необходимости расхода химически активного кислорода в диапазоне от 500 до 6000 г на м 3 реактора в час) будут предпочтительны одновременно диоксид серы высокой чистоты (80% и выше) и промышленно производимый кислород (93% чистоты и выше). При достаточно низких скоростях окисления двухвалентного железа и/или при более низких температурах (например, при необходимости расхода химически активного кислорода менее 500 г на м 3 реактора в час) может оказаться предпочтительным использование диоксида серы, произведенного при помощи плавильной печи или путем сжигания диоксида серы в воздухе (12-20% в объемном соотношении) в комбинации с промышленно производимым кислородом (93% чистоты и выше). При очень низкой потребности в химически активном кислороде можно использовать диоксид серы низкой чистоты в комбинации с воздухом. Оптимальные значения для любого конкретного процесса необходимо будет определять с учетом рабочей температуры и объема реактора в сопоставлении со стоимостью получения более чистых газов. В предпочтительном случае диоксид серы и кислород вводят в раствор путем барботирования через устройство для выпуска газа, например барботажное кольцо, либо другое устройство для распределения газа или диффузор. Если раствор перемешивают при помощи перемешивающего устройства с приводом от двигателя, в предпочтительном случае диоксид серы и кислород вводят в раствор ниже перемешивающего устройства, чтобы улучшить распределение газов в щелоке. Чтобы обеспечить низкую концентрацию диоксида серы в щелоке и, следовательно, гарантировать,что процесс остается окислительным, скорость подачи диоксида серы выбирают таким образом, чтобы она ограничивала скорость реакции окисления двухвалентного железа. Соответственно, скорость подачи диоксида серы, как правило, ниже требующейся для обеспечения максимальной скорости окисления двухвалентного железа, которая может быть достигнута для преобладающих параметров процесса и/или реактора. В общем случае скорость, которой управляют за счет расхода диоксида серы, ограничивают таким образом, чтобы перенос кислорода из газообразной фазы в водную фазу, требующийся для проведения реакции с диоксидом серы и сохранения необходимого количества растворенного кислорода, находился в пределах диапазона, приемлемого для оборудования, используемого при промышленном производстве. В одном из вариантов реализации настоящего изобретения максимальная скорость окисления двухвалентного железа не превышает 27 г на литр в час. В другом варианте реализации настоящего изобретения скорость окисления двухвалентного железа составляет не менее 0,1 г на литр в час. Температура в процессе окисления, как правило, повышается и может доходить до приблизительно 80 С. Обычно температура превышает 40 С. Максимальная температура может составлять 70 С. Оптимальный уровень концентрации растворенного кислорода в растворе может составлять, максимум, 20 ч/млн (ppm). В одном из вариантов реализации настоящего изобретения оптимальное значениеDO составляет, максимум, 10 ч/млн. Оптимальный уровень концентрации растворенного кислорода может составлять, минимум, 0,5 части на миллион. Оптимальный уровень концентрации растворенного кислорода может находиться в диапазоне от приблизительно 3 до 7 ч/млн. Способ, соответствующий настоящему изобретению, особенно пригоден для применения в процессе извлечения целевого металла из материала, содержащего, по меньшей мере, этот целевой металл. Таким образом, согласно второму аспекту настоящего изобретения, предлагается способ извлечения целевого металла из материала, содержащего, по меньшей мере, этот целевой металл, и этот способ включает этапы на которых:(i) обработки кислого раствора, содержащего, по меньшей мере, ионы двухвалентного железа, одним или более газами, содержащими диоксид серы и кислород, для окисления ионов двухвалентного железа до ионов трехвалентного железа, причем скорость подачи газообразного диоксида является ограничением скорости окисления; и(ii) поддерживают концентрацию растворенного кислорода в упомянутом растворе на оптимальном уровне;(b) выщелачивают упомянутый материал при помощи выщелачивателя, включающего упомянутый раствор, содержащий трехвалентное железо; и(c) извлекают целевой металл из полученного в результате продукта выщелачивания. Материал, содержащий целевой металл, может представлять собой одно или более из следующего: руду, рудный концентрат или отходы, например рудные хвосты, шлак или пыль. В предпочтительном варианте реализации настоящего изобретения этот материал содержит руду, рудный концентрат, хвосты,шлак или пыль, в состав которых входит уран. Используемое далее сокращение SIL обозначает "диоксид серы и кислород в щелоке" и относится к способу, соответствующему настоящему изобретению, при его использовании в процессе выщелачивания с целью извлечения целевого металла из материала, содержащего целевой металл. Целевым металлом, не ограничиваясь перечисленным, могут быть такие металлы, как уран, медь,никель, цинк, молибден или кобальт. В предпочтительном случае целевой металл выбирают из одного или более из следующего: урана и меди. В случае извлечения урана из уранинита соответствующей окислительно-восстановительной реакцией, которая имеет место во время выщелачивания, является Как видно из уравнения (3), окисление уранинита в ион уранила UO22+ приводит к восстановлению трехвалентного железа в двухвалентное. Например, ионы двухвалентного железа могут быть получены при растворении минералов пустой породы, содержащей двухвалентное железо, например, сидерита или хлорита. Двухвалентное железо также образуется при реакции ионов трехвалентного железа с минералами, содержащими сульфид основного металла, например, халькоцитом, борнитом, ковеллином, халькопиритом, пентландитом и сфалеритом. Ионы двухвалентного железа могут затем путем окисления быть повторно превращены в ионы трехвалентного железа при помощи процесса регулируемого окисления,соответствующего настоящему изобретению. В предпочтительном случае это осуществляется "на месте" путем добавления газообразных SO2 и О 2 к части щелока на основе кислого щелока двухвалентного железа, которая после декантации повторно направляется в реактор для выщелачивания, либо имеющемуся на предприятии кислому щелоку, содержащему двухвалентное железо, который получен на другом этапе комплексной гидрометаллургической обработки материала. В более предпочтительном случае повторное окисление двухвалентного железа до трехвалентного железа осуществляют непрерывно или полунепрерывно путем обработки диоксидом серы и кислородом в соответствии со способом регулируемого окисления, соответствующим настоящему изобретению. Извлечение урана из его руд часто выполняют при помощи процесса, который включает выщелачи-3 021703 вание руды или ее концентрата, как правило, с использованием выщелачивателя, включающего серную кислоту и окисляющий агент (окислитель). Растворенный уран обычно выделяют из выщелачивающих растворов при помощи процесса ионного обмена или удаления растворителя. При этом получают очищенный урансодержащий раствор, из которого уран извлекают путем осаждения, часто путем обработки аммиаком, чтобы вывести в осадок концентрат U3O8. Способ извлечения, соответствующий настоящему изобретению, может быть использован в обработке хвостов урансодержащей руды, которые получены путем обработки добытой руды на флотационной установке. В частности, способ может быть использован для выщелачивания урансодержащих хвостов, например, хвостов после флотации с целью концентрирования медной руды. В качестве примера добытая руда может представлять собой руду, содержащую медь, уран и золото, с принадлежащего заявителю рудника Olympic Dam в Южной Австралии. Способ, соответствующий настоящему изобретению, выгодным образом позволяет производить окисляющие растворы (для использования при выщелачивании рудных хвостов) путем проведения реакции имеющегося на предприятии щелока, содержащего двухвалентное железо, с диоксидом серы и кислородом, чтобы получить окисляющие растворы, содержащие трехвалентное железо. Диоксид серы удобно получать при окислении сульфидов меди в имеющейся на предприятии печи для обжига во взвешенном состоянии, а кислород можно удобным образом обеспечивать за счет воздуха. Такие окисляющие растворы затем можно добавлять к щелоку с хвостами в качестве альтернативы привычному окислителю, возможно, вместе с дополнительной кислотой. В предпочтительном варианте реализации настоящего изобретения диоксид серы и кислород вводят непрерывно или полунепрерывно во время упомянутого этапа выщелачивания, чтобы путем повторного окисления превратить ионы двухвалентного железа в ионы трехвалентного железа. Согласно третьему аспекту настоящего изобретения, дополнительно предлагается способ извлечения целевого металла из материала, содержащего, по меньшей мере, этот целевой металл, и этот способ включает этапы на которых:(i) обработки кислого раствора двухвалентного железа одним или более газами, содержащими диоксид серы и кислород, для окисления ионов двухвалентного железа до ионов трехвалентного железа,причем скорость подачи газообразного диоксида серы является ограничением скорости окисления; и(ii) поддерживают концентрацию растворенного кислорода в суспензии на оптимальном уровне; и(c) извлекают целевой металл из полученного в результате продукта выщелачивания. Таким образом, раствор, содержащий трехвалентное железо, может быть получен перед смешиванием с суспензией и/или он может быть создан "на месте" после смешивания раствора, содержащего двухвалентное железо, с суспензией. В одном из вариантов, соответствующих третьему аспекту настоящего изобретения, газообразные диоксид серы и кислород вводят в реактор, содержащий суспензию и кислый раствор двухвалентного железа, в результате чего ионы трехвалентного железа образуются в реакторе ("на месте"). В другом варианте, соответствующем третьему аспекту настоящего изобретения,кислый раствор двухвалентного железа, по меньшей мере, частично окисляют путем обработки диоксидом серы и кислородом, затем добавляют в суспензию, находящуюся в реакторе, куда продолжают вводить диоксид серы и кислород, чтобы продолжить окисление двухвалентного железа "на месте". В предпочтительном случае реактор включает перемешивающее устройство с приводом от двигателя, предназначенное для смешивания и распределения газообразных диоксида серы и кислорода по суспензии. В этом варианте реализации настоящего изобретения превращение ионов двухвалентного железа путем окисления в ионы трехвалентного железа, соответственно, происходит "на месте", в реакторе для выщелачивания. В общем случае раствор двухвалентного железа может быть получен из одного или более различных щелоков, имеющихся на предприятии, включая обедненные или насыщенные щелоки, либо очищенный продукт после удаления растворителя или ионного обмена. Ионы двухвалентного железа, находящиеся в растворе, могут быть получены из растворов, направляемых в реактор для выщелачивания, например, получаемых при выщелачивании рудных минералов. Ионы двухвалентного железа также получают в результате реакции кислоты с другими минералами, находящимися внутри руды, концентрата, пыли, шлака или хвостов. Например, ионы двухвалентного железа могут быть получены при растворении минералов пустой породы, содержащей двухвалентное железо, например сидерита или хлорита. Двухвалентное железо также возникает в результате реакции ионов трехвалентного железа с одним или более минералов, содержащих сульфид основного металла, например, халькоцита, борнита, ковеллина, халькопирита, пентландита и сфалерита. В предпочтительном варианте, соответствующем третьему аспекту настоящего изобретения, прошедшую выщелачивание суспензию направляют в отстойник, и верхний продукт отстойника повторно используют в реакторе для выщелачивания в качестве разбавляющего вещества. При повторном использовании верхнего продукта таким образом можно поддерживать плотность твердых веществ в реакторе для выщелачивания на оптимальном уровне, чтобы обеспечить удовлетворительную диффузию кислорода в суспензии. Это связано с тем, что диффузия кислорода может ухудшиться при высокой плотности твердых веществ в суспензии. Краткое описание чертежей Изобретение станет более понятным при рассмотрении приведенных далее примеров и сопровождающих чертежей, из которых фиг. 1 - структурная схема устройства, подходящего для использования вместе со способом, соответствующим настоящему изобретению; фиг. 2 - график зависимости концентрации двухвалентного железа от времени в CLTO при 70 С для концентраций растворенного кислорода, составляющих 4, 5 и 7 ч/млн; фиг. 3 - график зависимости концентрации двухвалентного железа и растворенного кислорода вCLTO от времени; фиг. 4 - график зависимости концентрации двухвалентного железа от времени в "CLTO + очищенный продукт" (5,5:1 в объемном соотношении) при 70 С для концентраций растворенного кислорода,составляющих 5, 7 и 9 ч/млн; фиг. 5 - график зависимости концентрации двухвалентного железа и растворенного кислорода от времени в "CLTO + очищенный продукт" (1:1 в объемном соотношении) при 70 С; фиг. 6 - график зависимости окислительно-восстановительного потенциала (ORP, Oxidation - Reduction Potential) от времени в "CLTO + очищенный продукт" (5,5:1) при концентрации растворенного кислорода, составляющей 5 ч/млн, и 70 С; фиг. 7 - график окисления "CLTO + очищенный продукт + PLS" (5,5:1:6,3 в объемном соотношении) с использованием SO2/O2 при 70 С; фиг. 8 - график зависимости скорости окисления двухвалентного железа от концентрации растворенного кислорода для окисления с использованием SO2/O2 трех различных комбинаций щелоков, имеющихся на предприятии, при концентрации растворенного кислорода, составляющей 7 ч/млн, и 70 С; фиг. 9 - график зависимости концентрации двухвалентного железа от времени в "CLTO + очищенный продукт" (5,5:1 в объемном соотношении) при концентрации растворенного кислорода, составляющей 7 ч/млн, и температуре, составляющей 50, 60 и 70 С; фиг. 10 - график зависимости окислительно-восстановительного потенциала и концентрации двухвалентного железа (г/л) от времени работы, выраженного временем выдерживания в реакторе (часы); фиг. 11 - структурная схема опытной установки для выполнения способа, соответствующего настоящему изобретению, "на месте", в суспензии урановой руды; и фиг. 12 - примерный график важных параметров управления, используемых в способе, соответствующем настоящему изобретению. Подробное описание предпочтительных вариантов реализации Примеры 1-4. На фиг. 1 приведена структурная схема установки 10 для использования вместе со способом, соответствующим настоящему изобретению, который рассмотрен в примерах 1-4. Установка 10 включает реактор 12, в который по каналу 16 подают исходный раствор или суспензию 14, содержащую двухвалентное железо. Реактор 12 включает датчик 38 растворенного кислорода, датчик 46 окислительновосстановительного потенциала и перемешивающее устройство 18, включающее крыльчатку 20, приводимую в действие двигателем 22. Источники 24 и 26, соответственно, диоксида серы и кислорода имеют гидравлическую связь с реактором 12 через канал 32 впуска газа. От источника кислорода идет канал 28 подачи кислорода, и от источника диоксида серы идет канал 30 подачи диоксида серы. Эти два канала соединены с каналом 32 впуска. Канал 28 подачи кислорода имеет датчики 34 и 36 давления кислорода, а также средство 40 регулирования потока кислорода по каналу 28 в зависимости от показаний датчика 38 концентрации растворенного кислорода. Канал 30 подачи диоксида серы имеет датчики 40 и 42 давления диоксида серы, а также средство 44 регулирования потока диоксида серы по каналу 30 в зависимости от показаний датчика 46 окислительно-восстановительного потенциала. Газообразные диоксид серы и кислород смешиваются в канале 32, и смесь газов подается в реактор через впускной клапан 48. Затем газообразная смесь подается в газовый диффузор 50, который обеспечивает диффузию газа в раствор ниже крыльчатки 20, что позволяет эффективным образом распределять газ по щелоку или суспензии, находящимся в реакторе. Температурой в реакторе управляют при помощи теплообменника 52 и измеряют ее термометром 54. После выполнения способа, соответствующего настоящему изобретению, прореагировавшие щелок или суспензию выгружают из реактора из выпуска 56. В примерах 1-4 щелоки, содержащие двухвалентное железо, поступившие с предприятия по обработке руды на руднике Olympic Dam, обрабатывались с использованием газообразных смесей SO2 и О 2,чтобы получить окислители на основе трехвалентного железа для их применения при выщелачивании урансодержащей руды. Окисление ионов двухвалентного железа при помощи SO2/O2 выполняли с использованием 3,5 л щелока в титановых резервуарах с отражательными перегородками объемом 5 л и перемешиванием при помощи титановых крыльчаток в виде турбины с шестилопастным рабочим колесом при скорости 500 об/мин. Резервуары имели внутренний диаметр 18,1 см и высоту 20 см, а диаметр крыльчатки составлял 7 см. Газообразная смесь добавлялась через металлокерамические барботеры, расположенные под крыльчаткой, чтобы улучшить массоперенос кислорода. Температуру раствора контролировали путем помещения резервуаров в водяную ванну с контролем температуры 1 С. Резервуары были снабжены крышкой, чтобы снизить до минимума испарение. Используемым газом был кислород с чистотой 99,5%,и значения расхода кислорода, которые приведены в примерах, относятся к газообразному О 2 с чистотой 99,5%. Зонд для измерения количеств растворенного кислорода (DO) состоял из датчика концентрации растворенного кислорода с титановыми омываемыми элементами. Датчик кислорода был откалиброван в водопроводной воде, которая была хорошо перемешана, при температуре, как можно более близкой (в пределах 3 С) к температуре эксперимента в день его проведения. Окислительно-восстановительный потенциал раствора отслеживался с использованием эталонного электрода Ag/AgCl/3M KCl, и все потенциалы приведены относительно этого эталона. Все количества образцов щелока были подкислены и кипятились в азотной среде в течение приблизительно 5 мин, чтобы удалить лишний SO2. Концентрация двухвалентного железа в прокипяченном образце затем определялась путем титрования с использованием стандартного раствора сульфата церия(IV). Непрокипяченые образцы щелока были отфильтрованы через фильтры 0,45 мкм и разбавлены перед анализом методом ICP-OES (атомно-эмиссионная спектрометрия с индуктивно-связанной плазмой). Для определения скоростей окисления двухвалентного железа были протестированы четыре разных щелока, имеющихся на предприятии, которые содержат двухвалентное железо: 1. Верхний продукт из отстойника концентрированного щелока (CLTO), полученный из системы циркуляции концентрированного щелока. 2. "CLTO + очищенный продукт", полученный в результате удаления растворителя урана, в объемном соотношении CLTO:очищенный продукт = 5,5:1. 3. "CLTO + очищенный продукт + насыщенный раствор щелока (PLS)" в объемном соотношении 5,5:1:6,3. 4. "CLTO + очищенный продукт" в объемном соотношении 1:1. Эти комбинации щелоков были выбраны для использования в различных щелоках. Составы щелоков, имеющихся на предприятии, и комбинации щелоков для тестов с SO2/O2 приведены в табл. 1 и 2 соответственно. Для трех тестов растворенный кислород барботировался через раствор в течение 5 мин перед добавлением SO2, чтобы определить концентрацию кислорода в растворе при достижении насыщения. Таблица 1. Состав щелоков, имеющихся на предприятии Таблица 2. Составы щелока для тестов с SO2/O2O2 был барботирован через раствор при 70 С в течение 5 мин перед добавлением SO2 Для большинства тестов с SO2/O2 расход SO2 был выбран таким, чтобы максимальная скорость окисления двухвалентного железа составляла 22 г/л в час (исходя из уравнения 1 и 100% потребленияSO2 для окисления двухвалентного железа). Массоперенос кислорода, требующийся для скорости окисления двухвалентного железа 22 г/л в час, приближается к пределу для существующего оборудования предприятия, используемого при промышленном производстве. Для 3,5 л щелока, имеющегося на предприятии, расход SO2 был задан равным 280 мл/мин, если не указано иное. Было обнаружено, что рН тестового щелока снижалось со временем, поэтому некоторая часть SO2 реагировала с образованием серной кислоты, вероятно, в соответствии с уравнением 4: Концентрация кислоты не поддерживалась на постоянном уровне во время тестов, чтобы смоделировать правдоподобную заводскую практику. Пример 1. Раствор 1: CLTO В табл. 3 указаны условия каждого из тестов на окисление. Таблица 3. Окисление CLTO с использованием SO2/O2 при 70 С Снижение концентрации двухвалентного железа в результате окисления CLTO с использованиемSO2/O2 при 70 С и для концентраций растворенного кислорода, равных 4-7 ч/млн, показано на фиг. 2. Расход SO2 был эквивалентным максимальной скорости окисления Fe2+, составляющей 22-24 г/л в час, за исключением теста "SO2 А", где расход SO2 был эквивалентным максимальной скорости окисления Fe2+, составляющей 27 г/л в час. Тест при концентрации растворенного кислорода (DO) 4,5 ч/млн характеризовался чуть более низкой первоначальной концентрацией двухвалентного железа, так как кислород барботировался через щелок в течение 5 мин перед добавлением SO2. Можно видеть, что сохранение оптимального уровня концентрации растворенного кислорода в растворе во всех тестах привело к тому, что процесс оставался окислительным. Из табл. 3 также можно видеть, что избирательность протекания реакции окисления двухвалентного железа (уравнение 1) по сравнению с превращением в кислоту в ходе побочной реакции (уравнение 3) увеличивалась с увеличением концентрации растворенного кислорода в растворе. Соответственно, это указывает на то, что значение DO задает избирательность протекания реакции окисления двухвалентного железа по сравнению с реакцией получения кислоты, и что более высокие значения DO в общем случае способствуют окислению двухвалентного железа, а не получению кислоты. Скорость окисления двухвалентного железа в течение всего времени теста (средняя скорость окисления двухвалентного железа) была вычислена, исходя из наклона линии на фиг. 3. При одной и той же концентрации растворенного кислорода скорость окисления двухвалентного железа увеличивалась при увеличении расхода SO2 (например, сравните тесты "SO2 А" и "SO2 J"). Тест"SO2 С" проводился при более низком расходе SO2, составлявшем 180-220 мл/мин (максимальная скорость окисления Fe2+ 14-17 г/л в час), по сравнению с тестом "SO2 В", который проводился при 290 мл/мин SO2, при концентрации растворенного кислорода, составлявшей 5 ч/млн. Скорость окисления двухвалентного железа в случае "SO2 С" составила 12 г/л в час по сравнению с 16 г/л в час в случае "SO2 В". Вычисленные уровни потребления SO2 при окислении двухвалентного железа для общей длительности теста приведены в табл. 4. Эти уровни потребления были вычислены с использованием уравнения 1. Таблица 4. Потребление SO2 и О 2 - окисление CLTO с использованием SO2/O2 при 70 С Расчеты по SO2 приведены для общей длительности теста, расчет по О 2 приведен только для стабильной скорости окисления и является оценочным, так как расходы O2 были разными для образцов. При концентрации растворенного кислорода на уровне 5-7 ч/млн для окисления двухвалентного железа было использовано приблизительно 70-80% SO2. Было обнаружено, что существенная доля также реагировала с образованием серной кислоты. В табл. 3 также показано потребление кислорода для окисления Fe2+. Потребление кислорода является только приблизительным, так как реальный расход кислорода менялся в течение теста. Использование барботера с порами 10 мкм вместо барботера с порами 2 мкм снизило эффективность использования кислорода с 30-35% до приблизительно 20%. Это, вероятно, обусловлено более высокой диффузией кислорода в водную фазу, когда используются поры меньшего размера. Пример 2. Раствор 2: CLTO + очищенный продукт Снижение концентрации двухвалентного железа в результате окисления с использованием SO2/O2 для "CLTO + очищенный продукт" (166 мл: 30 мл или 5,5:1 в объемном соотношении) при 70 С показано на фиг. 4. Расход SO2 был эквивалентным максимальной скорости окисления Fe2+, составляющей 22-23 г/л в час. Избирательность протекания реакции (1) окисления двухвалентного железа по сравнению с реакцией (3) образования кислоты снижалась по мере снижения концентрации растворенного кислорода с 9 до 5 ч/млн. Аналогично окислению CLTO, скорость окисления двухвалентного железа снижалась, как только запасы двухвалентного железа истощались. Один тест проводился для CLTO:очищенный продукт=1:1 (в объемном соотношении), и его результаты показаны на фиг. 5. Расход SO2 был эквивалентным максимальной скорости окисления Fe2+, составляющей 17-24 г/л в час. Скорости окисления двухвалентного железа приведены в табл. 5. При одной и той же концентрации растворенного кислорода скорости окисления двухвалентного железа в случаях CLTO и "CLTO + очищенный продукт" (5,5:1 в объемном соотношении) были схожими,что ожидалось, так как были схожими составы раствора. Кислотность щелока увеличивалась на приблизительно 10 г/л. Приблизительно 70-86% SO2 прореагировало, чтобы окислить двухвалентное железо в трехвалентное железо при концентрации растворенного кислорода на уровне 5-9 ч/млн, и приблизительно 20% кислорода было использовано для окисления двухвалентного железа, когда использовался барботер с порами 10 мкм (табл. 5). Таблица 6. Потребление SO2 и О 2 - окисление "CLTO + очищенный продукт" с использованием SO2/O2 при 70 С CLTO:очищенный продукт=5,5:1 (в объемном соотношении), если не указано иное Расчеты по SO2 приведены для общей длительности теста, расчет по О 2 приведен только для стабильной скорости окисления и является оценочным, так как расходы О 2 были разными для образцов. Окислительно-восстановительный потенциал во всех тестах, как правило, изменялся скачкообразно, когда концентрация двухвалентного железа была очень низкой, что можно было ожидать в этой системе, где окислительно-восстановительный потенциал определялся парой Fe3+/Fe2+, и в этом случае можно предположить, что этот потенциал пропорционален логарифму от этого отношения (т.е., отношениеFe3+/Fe2+ было очень высоким). Типичный график для окисления с использованием SO2/O2 при концентрации растворенного кислорода на уровне 5 ч/млн показан на фиг. 6. Первоначальная величина окислительно-восстановительного потенциала составляла 420 мВ, причем медленно поднималась до приблизительно 620 мВ, перед быстрым увеличением до 720 мВ при 70 С. При этом значении тест был прекращен, так как запасы двухвалентного железа практически полностью исчерпались бы. Пример 3. Раствор 3: CLTO + очищенный продукт + PLS На фиг. 7 показано изменение концентрации двухвалентного железа в результате окисления "CLTO+ очищенный продукт + PLS" (166 мл:30 мл:189 мл или 5,5:1:6,3) при 70 С. Расход SO2 был эквивалентным максимальной скорости окисления Fe2+, составляющей 23 г/л в час. Как и ожидалось, скорость окисления двухвалентного железа увеличивалась при увеличении концентрации растворенного кислорода в растворе с 5 до 9 ч/млн. Скорости окисления двухвалентного железа представлены в табл. 6. Повторимся еще раз, совершенно очевидно, что при снижении заданного значения концентрации растворенного кислорода образование кислоты (увеличение содержания кислоты) превалировало над окислением двухвалентного железа. Скорость окисления двухвалентного железа была схожа со скоростями для щелоков, содержащих CLTO и "CLTO:очищенный продукт = 5,5:1" (фиг. 8). Величины потребления SO2 и приближенного потребления О 2, которые схожи с предыдущими тестами для других щелоков, приведены в табл. 7. Таблица 7. Скорости окисления двухвалентного железа при окислении "CLTO:очищенный продукт:PLS" с использованием SO2/O2 при 70 С Пример 4. Влияние температуры Влияние температуры в диапазоне 50-70 С на окисление "CLTO:очищенный продукт=5,5:1" с использованием SO2/O2 приведено на фиг. 9 и в табл. 9. Скорости окисления двухвалентного железа и доляSO2, использованного для окисления двухвалентного железа при 60 и 70 С, были одинаковыми в пределах ошибки эксперимента. Однако при 50 С скорость окисления снижалась, в частности, когда концентрация двухвалентного железа была низкой в конце теста. Среднее потребление SO2 для окисления двухвалентного железа снизилось с 76% при 60-70 С до 59% при 50 С. Аналогично предыдущим тестам потребление О 2 для окисления двухвалентного железа составляло приблизительно 21-23% для устойчиво протекающей части реакции. Таблица 9. Влияние температуры на скорость окисления двухвалентного железа и потребление SO2 для"CLTO:очищенный продукт=5,5:1" при концентрации растворенного кислорода 7 ч/млн Потребление SO2 приведено для общей длительности теста Выводы для примеров 1-4 Таким образом, из примеров 1-4 можно увидеть, что окисление двухвалентного железа можно обеспечить в разных щелоках путем добавления диоксида серы с заранее определенной скоростью, которая ниже максимально достижимой, при одновременном управлении скоростью добавления кислорода,чтобы обеспечить заданное содержание растворенного кислорода в щелоке. В результате это можно воспроизвести при любом масштабе производства путем разработки процесса таким образом, чтобы он мог выполняться при том же заданном содержании растворенного кислорода. Расход SO2 выбирался таким образом, чтобы обеспечить максимальную скорость окисления двухвалентного железа для конкретных условий этих примеров, составляющую 22 г/л в час (предполагая 100% потребление SO2 при окислении двухвалентного железа). Однако в других физико-химических условиях либо при применении другого оборудования может оказаться подходящей другая максимальная скорость окисления двухвалентного железа, что потребует другого расхода SO2. Примеры также показывают, что со снижением концентрации растворенного кислорода снижается избирательность окисления двухвалентного железа по сравнению с конкурирующей реакцией образования кислоты. Следовательно, оптимальный уровень концентрации растворенного кислорода можно выбирать в зависимости от требований процесса по кислоте. Степени избирательности окисления двухвалентного железа были схожими для трех основных комбинаций щелоков, протестированных при одной и той же концентрации растворенного кислорода. Снижение температуры до 50 С привело к снижению итоговой скорости окисления двухвалентного железа при 7 ч/млн растворенного кислорода на приблизительно 17% для устойчиво протекающей части реакции, и происходило существенное снижение скорости реакции в конце теста. Значительная доля SO2 реагировала с образованием кислоты, и концентрация H2SO4 в растворе увеличивалась на приблизительно 10 г/л. Это было выгодным, если для последующего выщелачивания уранового концентрата требовалась дополнительная кислота. Пример 5. В примере 5 способ, соответствующий настоящему изобретению, был протестирован на опытной установке, расположенной на принадлежащем заявителю урановом руднике Olympic Dam. Опытная установка включала 5 реакторов для выщелачивания, объемом по 0,2 м 3 каждый, из которых первые два реактора использовались для выполнения способа, соответствующего настоящему изобретению. Каждый реактор был снабжен элементами, обеспечивающими нагрев и охлаждение, для поддержания температуры на желаемом уровне. Каждый реактор имел независимую подачу диоксида серы, воздуха и кислорода, и расходом каждого газа можно было управлять независимо. Целью подачи воздуха было сделать возможным имитацию подачи диоксида серы из разных источников. Например, предполагается, что диоксид серы, полученный путем сжигания серы в воздухе, будет содержать приблизительно 12% диоксида серы (в объемном соотношении), а все остальное будет составлять азот с небольшим количеством остаточного кислорода. Диоксид серы, полученный в результате плавки, как предполагается, будет содержать больший процент диоксида серы, и, наконец, диоксид серы, очищенный путем ожижения или полученный путем сжигания серы в кислороде, будет представлять собой чистый или, по существу, чистый SO2. Газы подавались локально расположенным барботером под массивные перемешивающие устройства, расположенные в каждом резервуаре. Каждый реактор имел датчик концентрации растворенного кислорода и датчик для измерения окислительно-восстановительного потенциала раствора. Каждый резервуар имел независимую подачу технологического щелока, содержащего двухвалентное железо. Два тестируемых щелока представляли собой CLTO и очищенный продукт. Целью этой опытной установки была демонстрация работы настоящего изобретения в условиях непрерывного процесса, а также определение потребления диоксида серы как функции от типа газа, концентрации растворенного кислорода, используемого в процессе раствора и скорости реакции. На фиг. 10 показан типичный характер изменения концентрации двухвалентного железа и окислительно-восстановительного потенциала для непрерывного теста в одном из резервуаров. Установка работала при фиксированном значении DO, которое поддерживали за счет скорости подачи кислорода. Скорость подачи диоксида серы была заранее заданной для желаемой скорости окисления. Эта скорость окисления определялась скоростью подачи ионов двухвалентного железа в реактор. Данные указывают на снижение содержания двухвалентного железа и являющееся результатом увеличение окислительновосстановительного потенциала до тех пор, пока не будет достигнут устойчивый режим работы. Таблица 10. Итоговые результаты непрерывных испытаний на опытной установке с использованием верхнего продукта из отстойника концентрированного щелока (CLTO) Таблица 11. Итоговые результаты для очищенного продукта В табл. 10 и 11 приведены средние значения для данных от множества операций. Основной вывод из этих данных заключается в том, что независимо от типа газа (количества азота), типа раствора, мощности перемешивающего устройства или температуры, пока в щелоке поддерживалось положительное количество (избыток) растворенного кислорода, процесс оставался окислительным, и можно было избежать смены реакции окисления двухвалентного железа на обратную. Дополнительные выводы являются следующими: во время этого испытания было достигнуто потребление диоксида серы свыше 97%, и было обнаружено, что на него не влияет скорость окисления. Однако на уровни потребления влияла свободная кислота в растворе, в частности, ввиду низкой чистоты газов SO2. Чтобы обеспечить неизменно высокое потребление SO2 для растворов с высокой кислотностью (5080 г/л), требуется SO2 высокой чистоты. Мощность перемешивающего устройства не оказывала заметного влияния на потребление SO2 в протестированных диапазонах. Чтобы обеспечить оптимальную избирательность окисления двухвалентного железа по сравнению с образованием кислоты, требуется минимальная концентрация растворенного кислорода (DO), составляющая 5 ч/млн. В протестированном диапазоне температур (50-70 С) рабочая температура не влияла на потребление диоксида серы или избирательность протекания реакции окисления двухвалентного железа. Стратегия работы, заключающаяся в ограничении скорости путем ограничения добавления SO2 уровнем ниже максимальных скоростей окисления двухвалентного железа и поддержания избыточного содержания кислорода в растворе, оказалась успешной на практике. На избирательность окисления двухвалентного железа по сравнению с образованием кислоты влияет кислотность раствора. По мере снижения рН и возрастания кислотности соответствующим образом снижается избирательность. Тесты проводились для того, чтобы посмотреть, будет ли меняться реакция окисления двухвалентного железа на обратную после того, как полученный в результате щелок вышел из реактора. Этого можно было бы ожидать, так как количество остаточного кислорода всегда будет оставаться низким из-за его низкой растворимости. Таким образом, если имелась значительная концентрация остаточного диоксида серы, это привело бы к восстановлению трехвалентного железа обратно в двухвалентное. Было обнаружено, что после выдерживания в течение 10 дней смены реакции окисления двухвалентного железа на обратную не отмечалось, что указывает на поддержание концентрации SO2 в растворе на низком уровне,благодаря способу, соответствующему настоящему изобретению. Пример 6. В примере 6 способ, соответствующий настоящему изобретению, был проведен "на месте", в суспензии урановой руды, источником которой стали хвосты с уранового рудника Olympic Dam, принадле- 13021703 жащего заявителю. На фиг. 11 схематично показано оборудование, входящее в состав опытной установки, в общем обозначенной номером 110, которая предназначена для выполнения способа, соответствующего настоящему изобретению, в примере 6. Опытная установка 110 включает два реакторных резервуара 112, 113 по 0,2 м 3, установленных параллельно, в которые под давлением подается суспензия со скоростью от приблизительно 50 до 100 л/ч из соответствующих резервуаров 111 а и 111b снабжения суспензией через резервуар 114 хранения суспензии, поток щелока, содержащего двухвалентное железо, из резервуара 115 подачи раствора и поток серной кислоты из резервуара 117 снабжения серной кислотой. Каждый из резервуаров 112, 113 также включает датчик 138 концентрации растворенного кислорода,датчик 146 окислительно-восстановительного потенциала и перемешивающее устройство 118, содержащее крыльчатку 120, приводимую в действие двигателем 122. Процентное содержание твердых веществ в каждом реакторе, как правило, составляет около 20% (в весовом соотношении). Смесь газообразных диоксида серы и кислорода подается в смесь из суспензии, кислоты и щелока с двухвалентным железом в каждый из резервуаров 112, 113 по соответствующему каналу 132 и через газовый диффузор 150, который рассеивает газообразную смесь по раствору ниже крыльчаток 120, за счет чего газ может быть эффективным образом распределен по смеси, содержащей суспензию. Температуру внутри каждого реактора 112, 113 контролируют при помощи соответствующих теплообменников 152 и измеряют соответствующими термометрами 154. Источником железа в окисляемом щелоке по большей части являются минералы пустой породы,такие как остаточные сульфиды, сидерит и хлорит, которые залегают вместе с урановой рудой. Верхний продукт из каждого реактора 112, 113 направляется в отстойник 160. Нижний продукт отстойника, при плотности твердых веществ, приемлемой для размера выпуска 162 отстойника, которая составляла 45%, использовался для опытной установки, хотя предполагается, что плотность твердых веществ будет выше (например, около 55%) для промышленной установки. Нижний продукт отстойника, содержащий упомянутые, по меньшей мере, частично выщелоченные твердые вещества, направляется в ряд дополнительных резервуаров для выщелачивания, в данном случае три резервуара 164 а, 164b, 164 с для выщелачивания с перемешиванием, имеющих объем 0,2 м 3, для завершения выщелачивания. Каждый из резервуаров для выщелачивания включает перемешивающее устройство 166 а, 166b, 166 с и независимо снабжается серной кислотой из резервуара 117 снабжения кислотой, а также имеет независимый контроль температуры. Верхний продукт отстойника направляется обратно в резервуар 115 подачи раствора. Уровень окисляемого щелока в резервуаре подачи раствора поддерживался, по существу, постоянным за счет добавления щелоков с других установок, например, очищенного продукта, полученного из цепи замены растворителя урана. Окисляемый щелок направляется обратно для использования в резервуарах 112, 113 реактора, чтобы поддержать оптимальный уровень процентного содержания твердых веществ в реакторе(например, 20 вес.%). При выполнении способа, соответствующего настоящему изобретению, поблизости от границы раздела "воздух/щелок" в отстойнике держали ручной детектор SO2, позволяющий обнаружить низкую концентрацию SO2, до 1 ч/млн. В случае наличия значительного остаточного количества SO2 в растворе,можно ожидать, что газообразный SO2 будет выделяться выше поверхности щелока. Никаких следов SO2 обнаружено не было. Условия, измеренные рабочие параметры и расходы реагентов, при которых работала каждая из опытных установок, представлены в табл. 12, 13 и 14, соответственно. Таблица 12. Условия прогонов опытной установки и назначение В табл. 12 прогон 9 представляет собой сравнительный пример, который может быть сравнен со способом, соответствующим настоящему изобретению. На фиг. 12 приведены примерные важные параметры управления, относящиеся к способу, соответствующему настоящему изобретению, а именно, расходы газообразных диоксида серы и кислорода, содержание растворенного кислорода и окислительно- 14021703 восстановительный потенциал в резервуаре 112. Данные показывают развитие процесса по наклонной вверх, от запуска до устойчивого режима. Таблица 13. Прогоны опытной установки с SIL и рабочие параметры В табл. 13 приведены параметры процесса для резервуаров с барботированием SO2/O2. Как видно,процессом можно было управлять с точки зрения окисления двухвалентного железа таким образом, чтобы достигались требуемые значения окислительно-восстановительного потенциала. Прогон 9 демонстрирует значение окислительно-восстановительного потенциала, равное 475 мВ, когда способ, соответствующий настоящему изобретению, не использовался, по сравнению с контролируемыми потенциалами в других прогонах. Значение в прогоне 9 обычно будет ниже, но в данном случае имелось значительное количество ионов двухвалентного железа в очищенном продукте, используемом в качестве разбавителя щелока. Таблица 14. Расход реагентов при прогонах опытной установки с SIL В табл. 14 приведены уровни добавления кислоты, SO2 и O2, вычисленные путем: деления реального расхода кислоты, SO2 и O2 на скорость подачи суспензии. Кроме того, в таблице приведены реальные расходы газа и соотношение кислорода и диоксида серы. Как можно видеть, постоянного соотношения не было. Требования по кислороду менялись в зависимости от условий. В табл. 15 приведены количест- 15021703 венно определенные составы вводимого и отходящего газа при измерениях, проведенных во время прогона 10, а также вычисленные уровни потребления газа. Важно сравнить эти данные с соответствующими данными в табл. 10 и 11 из примера 5. Очевиден диапазон соотношений SO2/O2 (отраженный как %SO2 и % О 2 в подаваемом газе), которые использовались. Однако во всех случаях содержанием растворенного кислорода управляли, поэтому процесс окисления двухвалентного железа осуществлялся успешным образом. Таблица 15. Прогон 10 для измерения потребления газа Ссылки на известный уровень техники в этом описании приведены только с целью иллюстрации и не должны восприниматься как допущение того, что такой известный уровень техники является частью общеизвестного знания в Австралии или где-либо еще. В описанное здесь изобретение могут вноситься изменения, оно может быть модифицировано и/или в него могут вноситься добавления, по сравнению с тем, что конкретно здесь описано, и необходимо понимать, что это изобретение включает все такие изменения, модификации и/или добавления, которые не выходят за пределы сущности и объема, определенных в пунктах приложенной формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения раствора, содержащего трехвалентное железо, путем регулируемого окисления раствора, содержащего двухвалентное железо, включающий выполнение двух реакций, включая первую реакцию окисления двухвалентного железа в трехвалентное железо с помощью диоксида серы и кислорода и вторую реакцию получения серной кислоты из диоксида серы и кислорода, где указанная первая реакция имеет максимальную скорость окисления, при этом способ включает:(a) обработку раствора, содержащего двухвалентное железо, в реакторе с одним или более вводимыми газами, содержащими диоксид серы и кислород;(b) регулирование скорости подачи газообразного диоксида серы до скорости подачи газообразного диоксида серы, которая является равной или ниже максимальной скорости окисления двухвалентного железа в трехвалентное железо; и(c) измерение и регулирование количества растворенного кислорода в указанном растворе, содержащем двухвалентное железо, на величину, при которой:i) предотвращается восстановление трехвалентного железа в двухвалентное иii) избирательность получения трехвалентного железа с помощью первой реакции по сравнению с получением серной кислоты с помощью второй реакции устанавливается в соответствии с требованиями процесса по кислоте; и(d) регулирование количества растворенного кислорода на указанную величину при поддержании скорости подачи газообразного диоксида серы. 2. Способ по п.1, в котором указанный раствор, содержащий двухвалентное железо, перемешивают во время окисления. 3. Способ по п.2, в котором раствор, содержащий двухвалентное железо, перемешивают при помощи реактора с подъемом жидкости при помощи сжатого воздуха или перемешивающего устройства,имеющего массивную крыльчатку, обеспечивающую нагнетание вниз, или крыльчатку радиального типа. 4. Способ по п.1, в котором оптимальный уровень концентрации растворенного кислорода поддерживают путем регулирования одного или более из следующего: расход кислородсодержащего газа, вводимого в указанный раствор; парциальное давление кислорода в кислородсодержащем газе и степень перемешивания указанного раствора. 5. Способ по п.1, в котором указанный раствор, содержащий двухвалентное железо, представляет собой щелок, полученный при гидрометаллургической обработке металлсодержащего материала, выбранного из руды, рудного концентрата или отходов, указанный щелок предпочтительно включает обедненный выщелачивающий раствор, насыщенный выщелачивающий раствор, очищенный продукт, верхний продукт отстойника, либо комбинацию из двух или более перечисленных материалов. 6. Способ по п.1, в котором указанный раствор, содержащий двухвалентное железо, входит в состав суспензии. 7. Способ по п.1, в котором указанный диоксид серы и кислород вводят в указанный раствор в виде газообразной смеси или отдельных газовых потоков. 8. Способ по п.2, в котором указанные диоксид серы и кислород вводят в указанный раствор ниже перемешивающего устройства, предпочтительно путем барботирования через устройство для выпуска газа, такого как газовый диффузор. 9. Способ по п.1, в котором скорость подачи диоксида серы выбирают таким образом, чтобы обеспечить максимальную скорость окисления двухвалентного железа в диапазоне 0,1-27 г/л в час. 10. Способ по п.1, в котором температура процесса окисления составляет от 40 до 80 С, предпочтительно от 50 до 70 С. 11. Способ по п.1, в котором оптимальная величина растворенного кислорода составляет максимум 10 ч/млн и минимум 0,5 ч/млн. 12. Способ по п.1, в котором оптимальная величина растворенного кислорода предпочтительно находится в диапазоне от 3 до 7 ч/млн. 13. Способ извлечения целевого металла из материала, содержащего, по меньшей мере, этот целевой металл, включающий выполнение двух реакций, включая первую реакцию окисления двухвалентного железа в трехвалентное железо с помощью диоксида серы и кислорода и вторую реакцию получения серной кислоты из диоксида серы и кислорода, где указанная первая реакция имеет максимальную скорость окисления, при этом способ включает этапы, на которых:(i) обработки в реакторе кислого раствора, содержащего, по меньшей мере, ионы двухвалентного железа, одним или более газами, содержащими диоксид серы и кислород, чтобы окислить ионы двухвалентного железа до ионов трехвалентного железа;(ii) регулирования скорости подачи газообразного диоксида серы до скорости подачи газообразного диоксида серы, которая является равной или ниже максимальной скорости окисления двухвалентного железа в трехвалентное железо в первой реакции; и(iii) измерения и регулирования концентрации растворенного кислорода в указанном кислом растворе на величине, при которой:(iii.а) предотвращается восстановление трехвалентного железа в двухвалентное и(iii.b) избирательность получения трехвалентного железа с помощью первой реакции по сравнению с получением серной кислоты с помощью второй реакции устанавливается в соответствии с требованиями процесса по кислоте; и(iv) регулирования количества растворенного кислорода на указанную величину при поддержании скорости подачи газообразного диоксида серы;(b) выщелачивают упомянутый материал при помощи выщелачивателя, включающего упомянутый раствор, содержащий трехвалентное железо; и(с) извлекают целевой металл из полученного в результате продукта выщелачивания. 14. Способ по п.13, в котором упомянутый материал представляет собой одно или более из следующего: руду, рудный концентрат или отходы, и предпочтительно одно или более из урановой руды,сульфидной руды или рудного концентрата. 15. Способ по п.13, в котором целевой металл выбирают из одного или более из следующего: урана,меди, никеля, кобальта, молибдена и цинка, предпочтительно урана и/или меди. 16. Способ по п.13, в котором кислый раствор, содержащий двухвалентное железо, представляет собой повторно используемый щелок, имеющийся на предприятии. 17. Способ извлечения целевого металла из материала, содержащего, по меньшей мере, этот целевой металл, включающий выполнение двух реакций, включая первую реакцию окисления двухвалентного железа в трехвалентное железо с помощью диоксида серы и кислорода и вторую реакцию получения серной кислоты из диоксида серы и кислорода, где указанная первая реакция имеет максимальную скорость окисления, при этом способ включает этапы, на которых:i) обработки кислого раствора двухвалентного железа в реакторе одним или более газами, содержащими диоксид серы и кислород, для окисления ионов двухвалентного железа до ионов трехвалентногоii) регулирования скорости подачи газообразного диоксида серы до скорости подачи газообразного диоксида серы, которая является равной или ниже максимальной скорости окисления двухвалентного железа в трехвалентное железо в первой реакции;iii) измерения и регулирования концентрации растворенного кислорода в указанном растворе на величине, при которой:(iii.а) предотвращается восстановление трехвалентного железа в двухвалентное и(iii.b) избирательность получения трехвалентного железа с помощью первой реакции по сравнению с получением серной кислоты с помощью второй реакции устанавливается в соответствии с требованиями процесса по кислоте; иiv) регулирования количества растворенного кислорода на указанную величину при поддержании скорости подачи газообразного диоксида серы; и(с) извлекают целевой металл из полученного в результате продукта выщелачивания. 18. Способ по п.17, в котором указанный раствор, содержащий трехвалентное железо, получают (i) по меньшей мере, частично перед смешиванием с суспензией и/или (ii) по меньшей мере, частично "на месте", после смешивания с суспензией. 19. Способ по п.17, в котором процентное содержание твердых веществ в суспензии такое, что позволяет обеспечить достаточно высокую скорость переноса газа внутри суспензии, в предпочтительном случае содержание твердых веществ не превышает 50%, более предпочтительно составляет менее 40% и еще более предпочтительно составляет от 10 до 30%. 20. Способ по п.13 или 17, в котором этап (b) выщелачивания приводит к восстановлению ионов трехвалентного железа до ионов двухвалентного железа и обработку диоксидом серы и кислородом продолжают на этапе (b) выщелачивания для повторного окисления ионов двухвалентного железа в ионы трехвалентного железа. 21. Способ переноса способа извлечения металла по п.13 или 17 из первого реактора во второй реактор, включающий этапы, на которых:(a) определяют величину количества растворенного кислорода в первом реакторе, при которой предотвращается восстановление трехвалентного железа в двухвалентное и избирательность получения трехвалентного железа по сравнению с получением серной кислоты устанавливается в соответствии с требованиями процесса по кислоте;(b) определяют концентрацию растворенного кислорода в растворе, находящемся во втором реакторе; и(с) если необходимо, регулируют концентрацию растворенного кислорода во втором реакторе до достижения упомянутой оптимальной величины.
МПК / Метки
Метки: окисления, двухвалентное, железо, раствора, содержащего, способ, регулируемого
Код ссылки
<a href="https://eas.patents.su/23-21703-sposob-reguliruemogo-okisleniya-rastvora-soderzhashhego-dvuhvalentnoe-zhelezo.html" rel="bookmark" title="База патентов Евразийского Союза">Способ регулируемого окисления раствора, содержащего двухвалентное железо</a>
Предыдущий патент: Система связи в режиме ведущий-ведомый
Следующий патент: Горелочное устройство щелевого типа алюминиевого электролизера с самообжигающимся анодом
Случайный патент: Модуляторы tgr5 и способы их применения