Способ лечения воспаления роговицы
Формула / Реферат
1. Способ лечения у субъекта воспаления роговицы, включающий введение субъекту терапевтически эффективного количества TLR4-антагониста для лечения у субъекта воспаления роговицы, где TLR4-антагонист является соединением формулы (II)
или его фармацевтически приемлемой солью или эфиром фосфорной кислоты.
2. Способ по п.1, где соединение TLR4-антагонист формулы (II) имеет структуру
или его фармацевтически приемлемая соль или эфир фосфорной кислоты.
3. Способ по п.1, где соединение TLR4-антагонист формулы (II) имеет структуру
4. Способ по п.1, где воспаление роговицы является ЛПС-индуцированным воспалением роговицы.
5. Способ по п.1, где субъект не имеет воспаления роговицы, но подвержен риску развития воспаления роговицы.
6. Способ по п.1, где субъект имеет воспаление роговицы.
7. Способ по п.1, где TLR4-антагонист вводится субъекту местно.
8. Способ по п.1, где TLR4-антагонист вводится субъекту в офтальмологическом препарате.
9. Способ по п.1, где воспаление роговицы связано с кератитом.
10. Способ по п.1, где воспаление роговицы связано со стерильным воспалением роговицы.
11. Способ по п.1, где воспаление роговицы связано с ношением контактных линз.
Текст
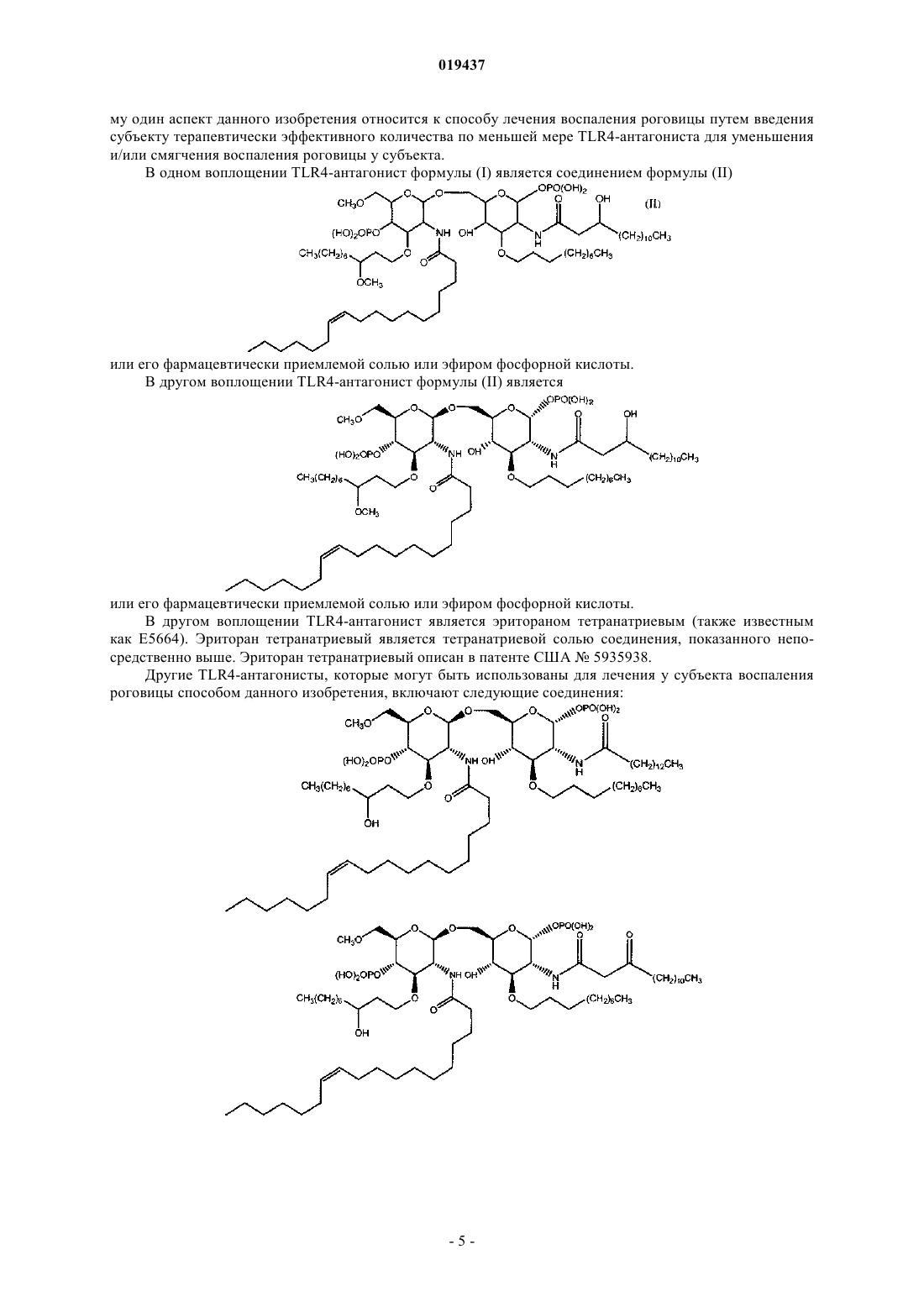
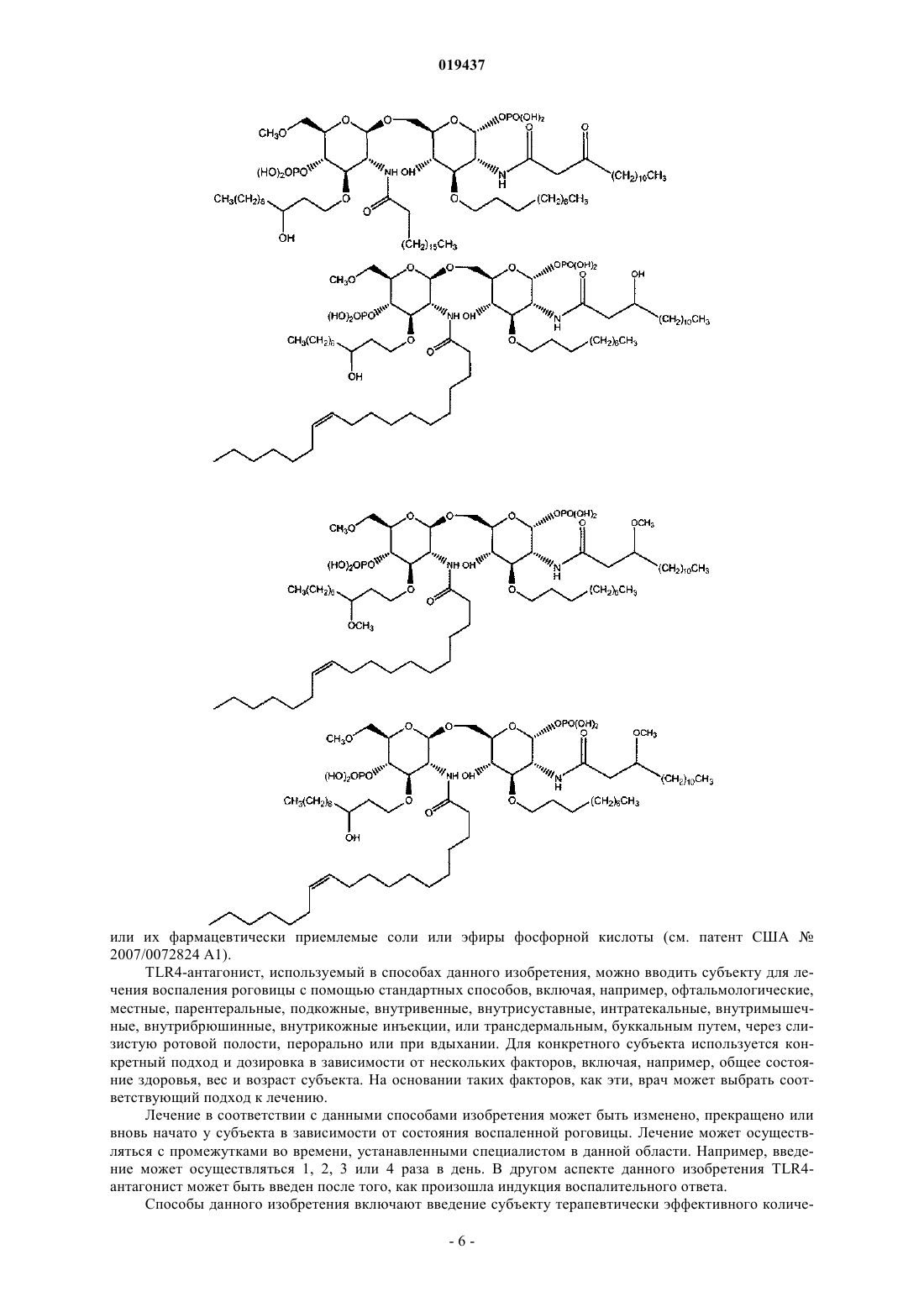
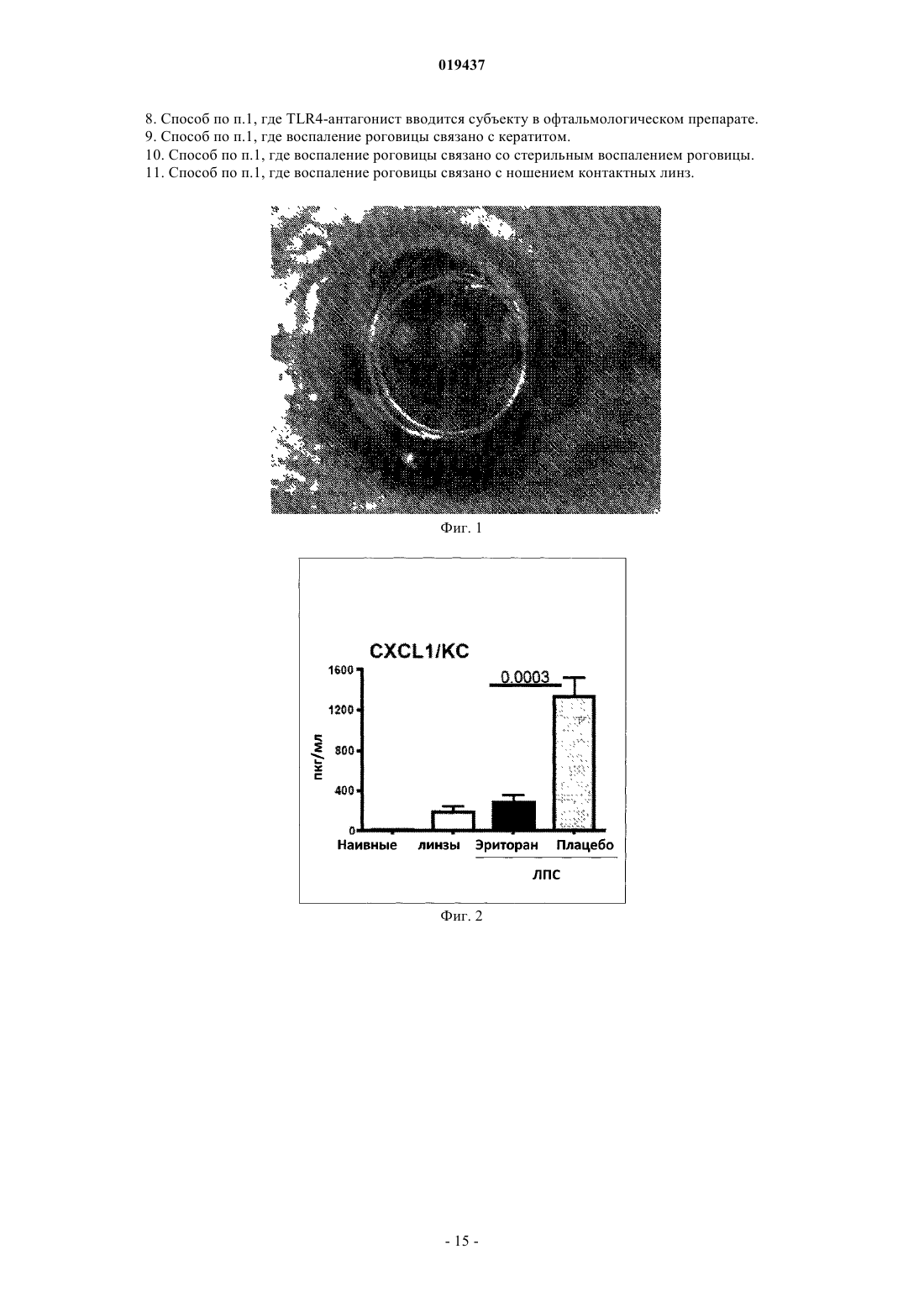
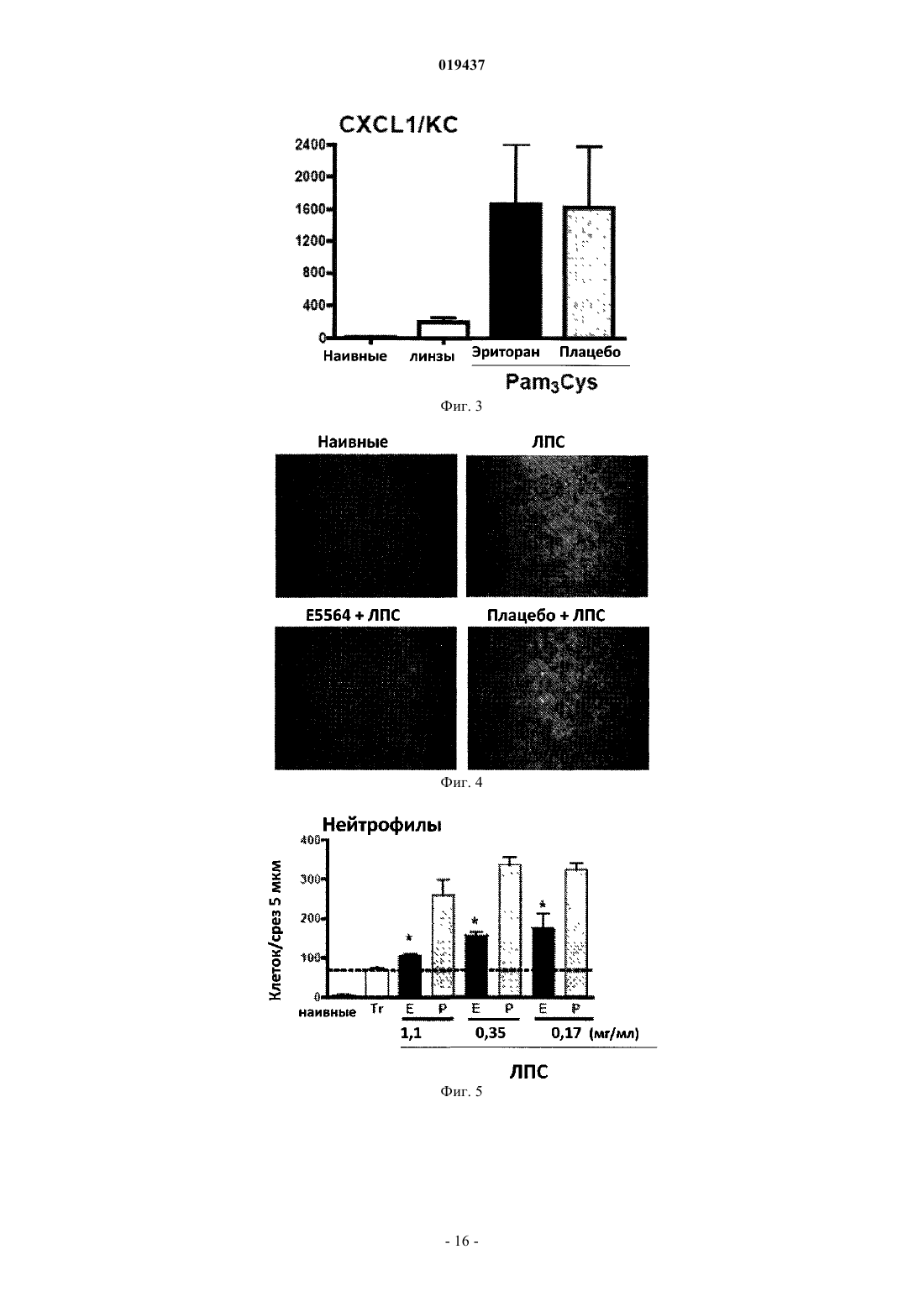
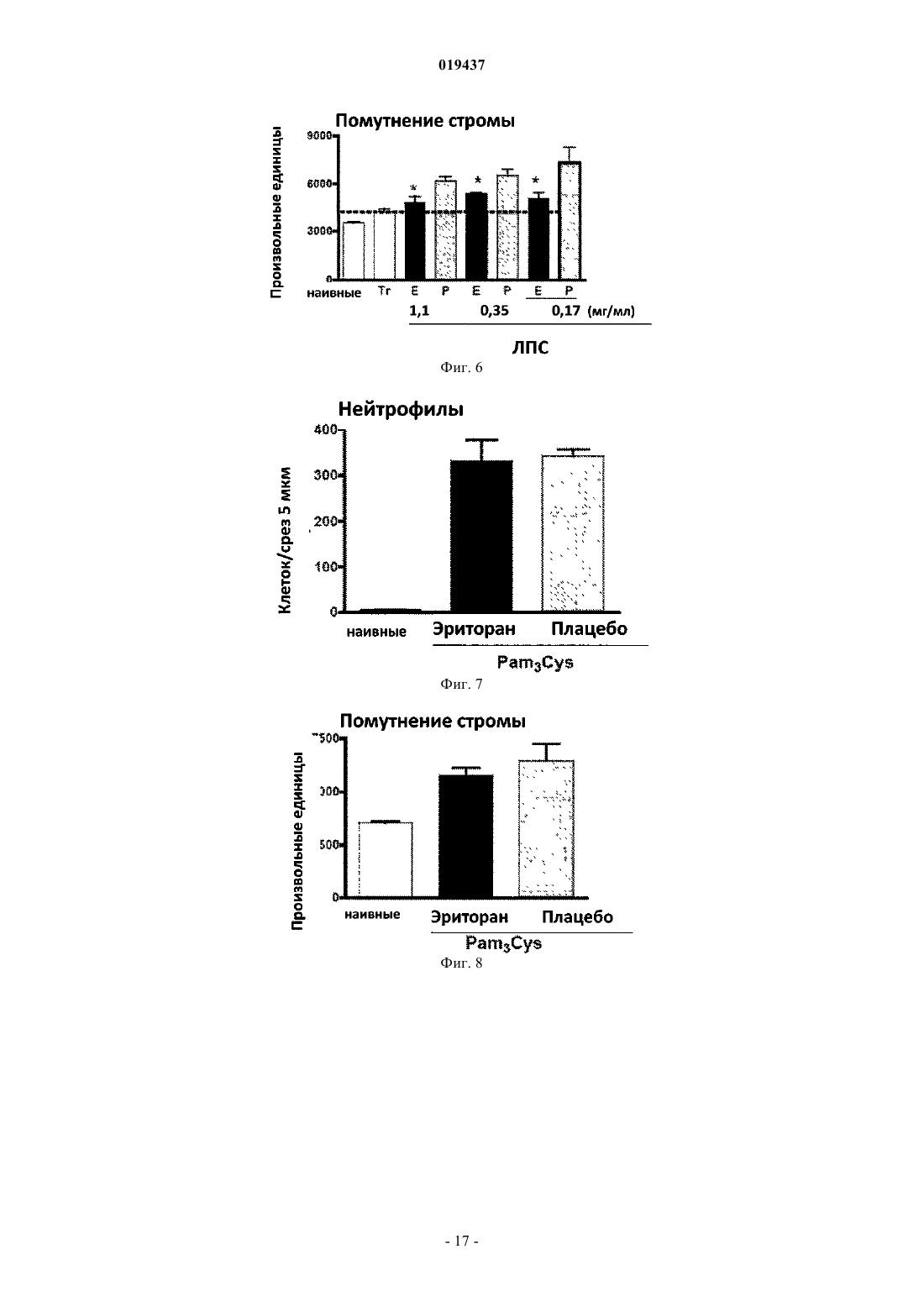
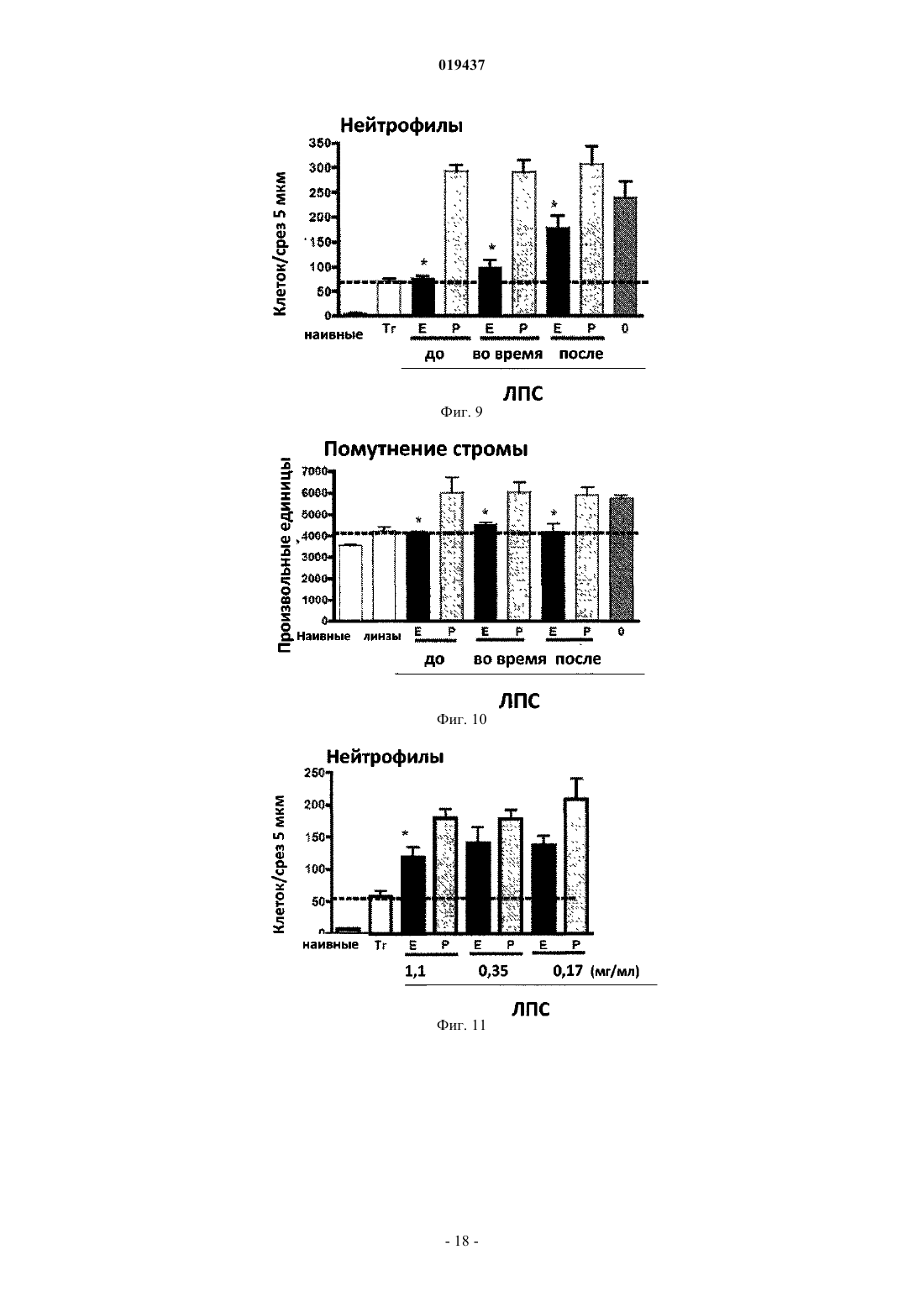
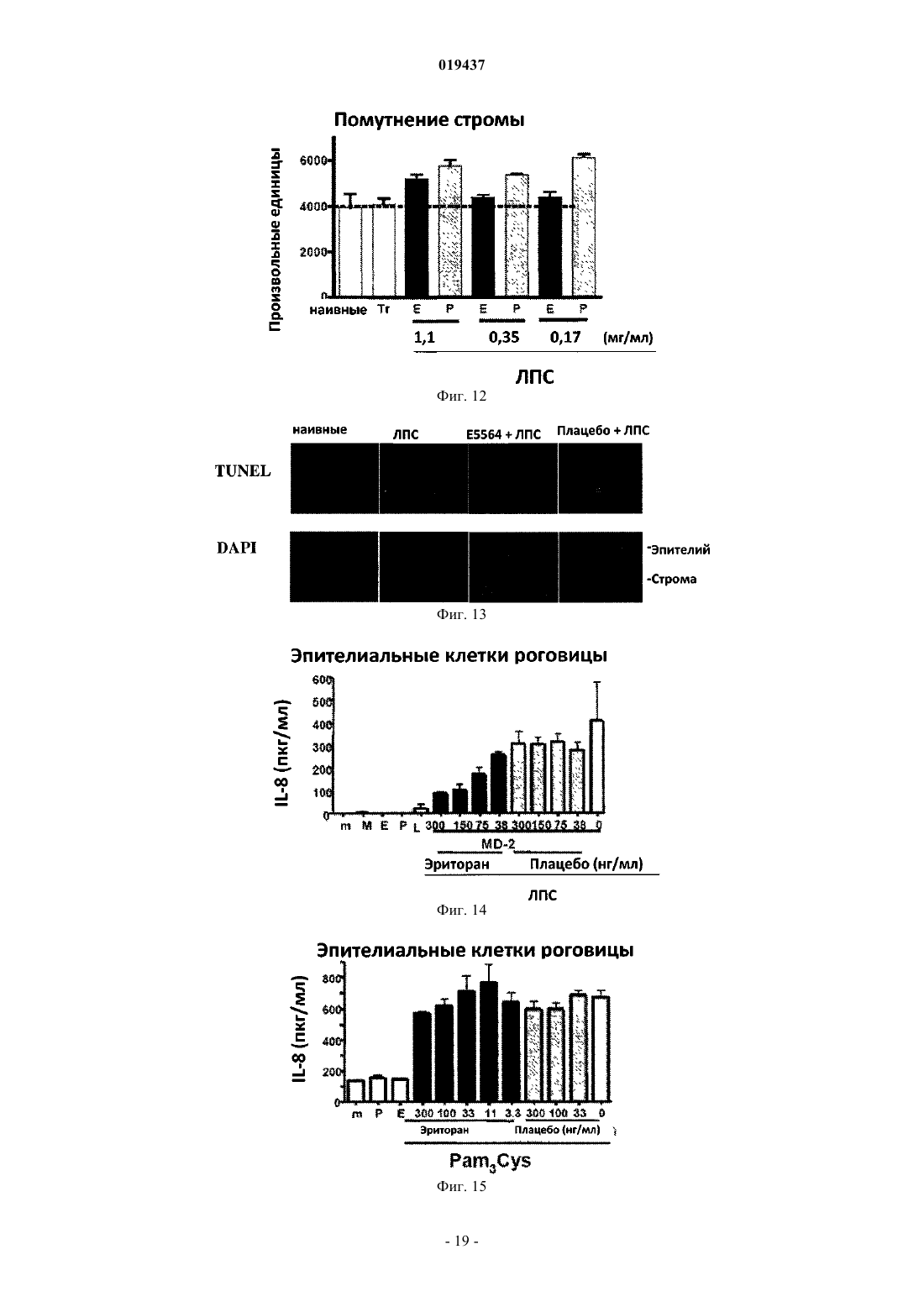
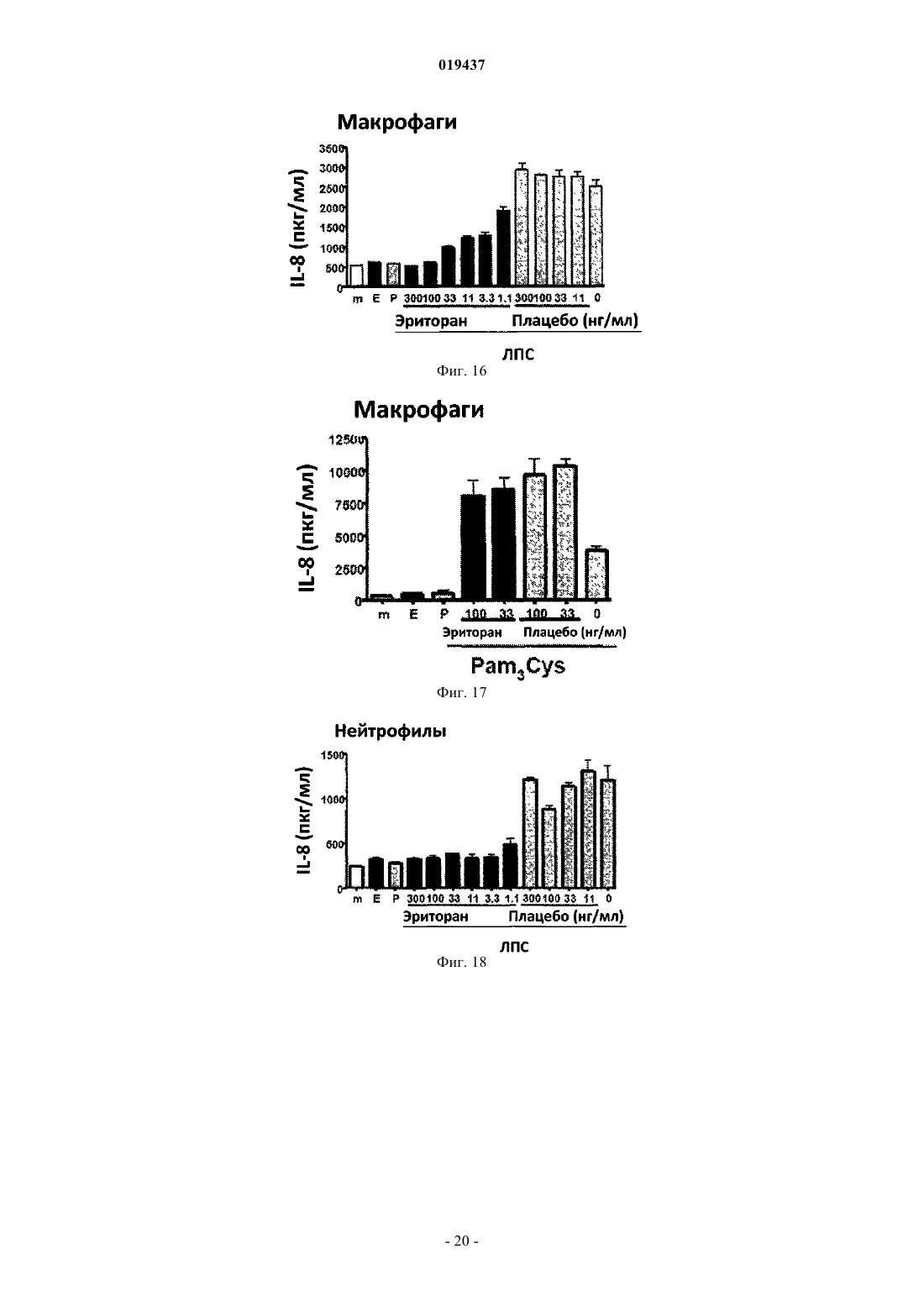
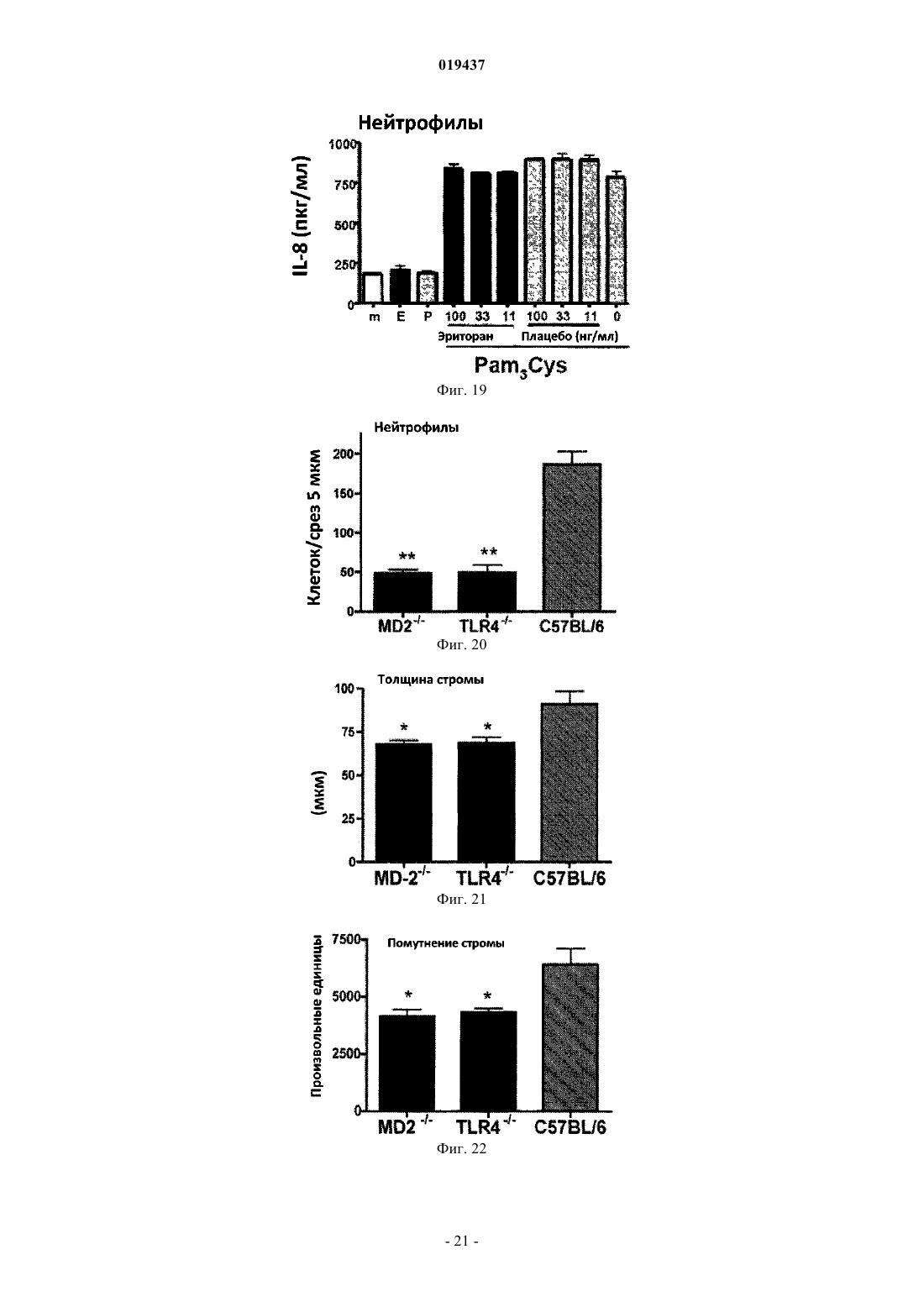
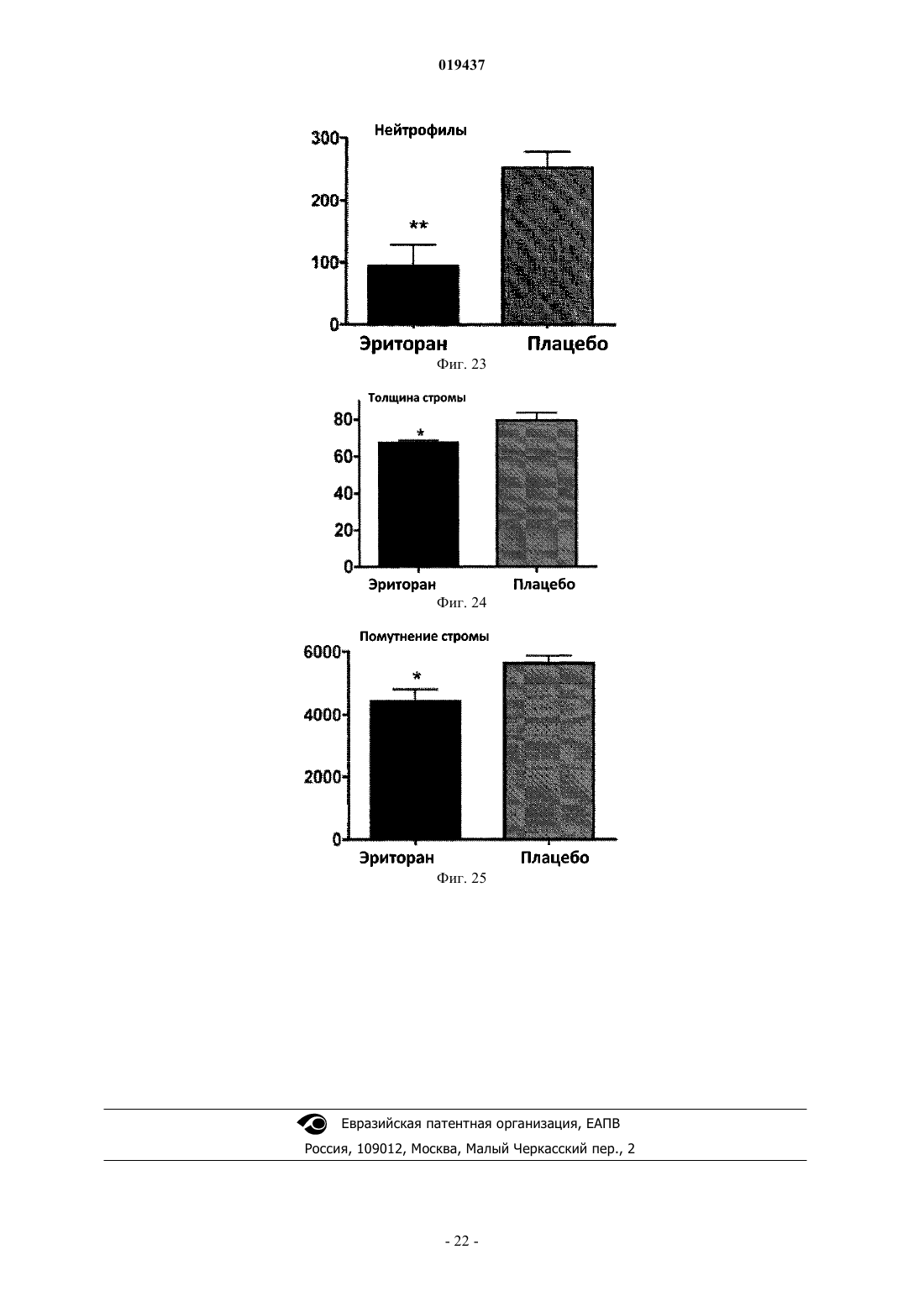
СПОСОБ ЛЕЧЕНИЯ ВОСПАЛЕНИЯ РОГОВИЦЫ Способ лечения у субъекта воспаления роговицы, включающий введение субъекту терапевтически эффективного количества TLR4-антагониста формулы (II) или его фармацевтически приемлемой соли или эфира фосфорной кислоты.(71)(73) Заявитель и патентовладелец: КЕЙС ВЕСТЕРН РЕСЕРВ ЮНИВЕРСИТИ (US) Отсылка к родственным заявкам Данная патентная заявка претендует на привилегии, предоставляемые в связи с подачей предварительных заявок США 61/101493, поданной 30 сентября 2008 г., и 61/061291, поданной 13 июня 2008 г., которые включены в данную заявку посредством ссылки. Область изобретения Данное изобретение относится к композициям и способам, которые используются в лечении и профилактике воспаления роговицы и/или условий, связанных с воспалением роговицы. Уровень изобретения После поражения роговицы иммунная и воспалительная системы отвечают за защиту целостности глаза. Этот защитный механизм может иметь клинические проявления от клеточной инфильтрации до формирования язвы. Хотя эти процессы являются защитными, они часто подвергают риску основную функцию глаза, вызывая васкуляризацию, рубцевание и/или перфорацию роговицы. Например, было показано, что нанесение на поверхность роговицы царапин и воздействие липополисахаридом (ЛПС) или другими бактериальными продуктами индуцирует воспаление роговицы, вызывая появление богатых нейтрофилами инфильтратов в строме роговицы (Johnson et al., Invest. OphthalmolImmunity 2006; 74:5325-5332). Когда имеет место поражение поверхности роговицы, воспалительные и/или иммунные клетки направляются на репарацию повреждения. Эти клетки могут агрегировать в области роговицы и становятся видимыми как клинически идентифицируемые инфильтраты. Это образование инфильтрата и возникшее в результате воспаление роговицы может возникнуть либо в инфекционных, либо в неинфекционных условиях. Одним из инфекционных состояний, которые могут отрицательно подействовать на роговицу,является бактериальный кератит. Основные причины бактериального кератита в США и во всем мире включают инфекцию Pseudomonas aeruginosa, Staphylococcus aureus, S. epidermidis и Streptococcus spp. В развивающихся странах бактериальный кератит прежде всего связан с травмой, связанной с сельскохозяйственным трудом, тогда как в промышленно развитых странах бактериальный кератит связан с ношением контактных линз. В дополнение к инфекционным кератитам ношение контактных линз также связано со стерильными, имеющими отрицательные результаты культурального исследования, клиническими проявлениями,включая связанное с контактными линзами острое покраснение глаза (CLARE), связанные с контактными линзами периферические язвы (CLPU) и связанные с контактными линзами инфильтраты роговицы(CLACI) (Stapleton et al., Optom. Vis. Sci. 2007; 84:257-272). Хотя симптомы этих проявлений менее тяжелые, чем симптомы, связанные с инфекционным кератитом, пострадавшие люди испытывают боль, покраснение, ухудшение зрения и сильный дискомфорт. Учитывая, что число людей, которые носят контактные линзы, превышает 34 млн в США и 140 млн во всем мире, относительно небольшой процент людей, которые носят контактные линзы, с этими клиническими проявлениями становится большим общим числом пострадавших (Stapleton et al., Optom. Vis. Sci. 2007; 84:257-272). В настоящее время стероиды применяют только для лечения инфильтратов роговицы. Побочные эффекты применения стероидов являются значительными. При инфекционных кератитах стероиды дают только после разрешения инфекции, в противном случае они могут неблагоприятно воздействовать на инфекцию. Кроме того, применение стероидов может вызвать повышение глазного давления, тем самым увеличивая риск глаукомы, и часто они назначаются вместе с препаратами против глаукомы. Сущность изобретения Данное изобретение относится к способу лечения у субъекта воспаления роговицы, включающему введение субъекту терапевтически эффективного количества TLR4-антагониста для лечения у субъекта воспаления роговицы, где TLR4-антагонист является соединением формулы (II) или его фармацевтически приемлемой солью или эфиром фосфорной кислоты. Данное изобретение также относится к способу лечения у субъекта воспаления роговицы, вклю-1 019437 чающему введение субъекту терапевтически эффективного количества TLR4-антагониста для лечения у субъекта воспаления роговицы, где TLR4-антагонист формулы (II) имеет структуру или его фармацевтически приемлемой соли или эфира фосфорной кислоты. Данное изобретение также относится к способу лечения у субъекта воспаления роговицы, включающему введение субъекту терапевтически эффективного количества TLR4-антагониста для лечения у субъекта воспаления роговицы, где соединение TLR4-антагонист формулы (II) имеет структуру В одном из вариантов настоящего изобретения воспаление роговицы является ЛПСиндуцированным воспалением роговицы. В другом варианте настоящего изобретения субъект не имеет воспаления роговицы, но подвержен риску развития воспаления роговицы. В одном из вариантов настоящего изобретения субъект имеет воспаление роговицы. В ещ одном из вариантов настоящего изобретения TLR4-антагонист вводится субъекту местно. В другом варианте настоящего изобретения TLR4-антагонист вводится субъекту в офтальмологическом препарате. В одном из вариантов настоящего изобретения воспаление роговицы связано с кератитом. В ещ одном из вариантов настоящего изобретения воспаление роговицы связано со стерильным воспалением роговицы. В другом варианте настоящего изобретения воспаление роговицы связано с ношением контактных линз. Краткое описание графических материалов Фиг. 1 иллюстрирует фотографию контактной линзы, приложенной к поверхности роговицы, обработанной эритораном тетранатриевым в соответствии с аспектом терапевтического способа данного изобретения. Фиг. 2 иллюстрирует график, сравнивающий продукцию хемокинов ЛПС-стимулированными роговицами, обработанными эритораном тетранатриевым (Е) (Е 5564) или плацебо (Р). Фиг. 3 иллюстрирует график, сравнивающий продукцию хемокинов Pam3Cys-стимулированными роговицами, обработанными эритораном (Е) и плацебо (Р). Фиг. 4 иллюстрирует полученное с помощью конфокальной микроскопии изображение центральной части роговицы, стимулированной ЛПС, эритораном тетранатриевым (Е) с ЛПС, и плацебо с ЛПС. Фиг. 5 иллюстрирует график, сравнивающий нейтрофильный инфильтрат в ЛПС-стимулированных роговицах при различных доза-ответах у мышей, обработанных эритораном тетранатриевым (Е) или плацебо (Р). Фиг. 6 иллюстрирует график, сравнивающий стромальное помутнение в ЛПС-стимулированных роговицах при различных доза-ответах у мышей, обработанных эритораном тетранатриевым (Е) или плацебо (Р). Фиг. 7 иллюстрирует график, сравнивающий нейтрофильный инфильтрат в Pam3Cysстимулированных роговицах при различных доза-ответах у мышей, обработанных эритораном тетранатриевым (Е) или плацебо (Р). Фиг. 8 иллюстрирует график, сравнивающий стромальное помутнение в Pam3Cys-стимулированных роговицах при различных доза-ответах у мышей, обработанных эритораном тетранатриевым (Е) или плацебо (Р). Фиг. 9 иллюстрирует график, сравнивающий нейтрофильный инфильтрат в роговицах при различных доза-ответах у мышей, обработанных эритораном тетранатриевым (Е) или плацебо (Р) до и после стимуляции ЛПС. Фиг. 10 иллюстрирует график, сравнивающий стромальное помутнение в роговицах при различных доза-ответах у мышей, обработанных эритораном тетранатриевым (Е) или плацебо (Р) до и после стимуляции ЛПС. Фиг. 11 иллюстрирует график, сравнивающий доза-ответы при обработке нейтрофильного инфильтрата в роговицах эритораном тетранатриевым после стимуляции ЛПС. Фиг. 12 иллюстрирует график, сравнивающий доза-ответы при обработке стромального помутнения в роговицах эритораном тетранатриевым после стимуляции ЛПС. Фиг. 13 иллюстрирует срезы обработанных эритораном тетранатриевым (Е) или плацебо (Р) ЛПСстимулированных роговиц мышей, меченых с помощью дезоксинуклеотидилтрансферазы в анализеTUNEL (флуоресцентное мечение с помощью dUTP высвобождающихся при деградации ДНК множественных 3'ОН-концов) и контрастно меченых с помощью 4',6-диамидино-2-фенилиндола (DAPI) для идентификации отдельных клеток. Фиг. 14 иллюстрирует график, показывающий уровни IL-8 в культуральном супернатанте человеческих эпителиальных клеток роговицы (НСЕ-Т), стимулированных ЛПС в присутствии эриторана тетранатриевого (Е) по сравнению с плацебо (Р) через 24 ч. Фиг. 15 иллюстрирует график, показывающий уровни IL-8 в культуральном супернатанте человеческих эпителиальных клеток роговицы (НСЕ-Т), стимулированных Pam3Cys в присутствии эриторана тетранатриевого (Е) по сравнению с плацебо (Р) через 24 ч. Фиг. 16 иллюстрирует график, показывающий уровни IL-8 в культуральном супернатанте макрофагов (U937), стимулированных ЛПС в присутствии эриторана тетранатриевого (Е) по сравнению с плацебо (Р) через 3 ч. Фиг. 17 иллюстрирует график, показывающий уровни IL-8 в культуральном супернатанте макрофагов (U937), стимулированных Pam3Cys в присутствии эриторана тетранатриевого (Е) по сравнению с плацебо (Р) через 3 ч. Фиг. 18 иллюстрирует график, показывающий уровни IL-8 в культуральном супернатанте нейтрофилов (HL60), стимулированных ЛПС в присутствии эриторана тетранатриевого (Е) по сравнению с плацебо (Р) через 3 ч. Фиг. 19 иллюстрирует график, показывающий уровни IL-8 в культуральном супернатанте нейтрофилов (HL60), стимулированных Pam3Cys в присутствии эриторана тетранатриевого (Е) по сравнению с плацебо (Р) через 3 ч. Фиг. 20 иллюстрирует график, сравнивающий нейтрофильный инфильтрат в Р.aeruginosaстимулированных роговицах мышей C57BL/6, TLR4-/- и MD-2-/- через 24 ч. Фиг. 21 иллюстрирует график, сравнивающий толщину стромы в Р. aeruginosa-стимулированных роговицах мышей C57BL/6, TLR4-/- и MD-2-/- через 24 ч. Фиг. 22 иллюстрирует график, сравнивающий стромальное помутнение в Р. aeruginosaстимулированных роговицах мышей C57BL/6, TLR4-/- и MD-2-/- через 24 ч. Фиг. 23 иллюстрирует график, сравнивающий нейтрофильный инфильтрат в Р.aeruginosaстимулированных роговицах мышей C57BL/6, обработанных эритораном тетранатриевым или плацебо через 24 ч. Фиг. 24 иллюстрирует график, сравнивающий толщину стромы в Р. aeruginosa-стимулированных роговицах мышей C57BL/6, обработанных эритораном тетранатриевым или плацебо через 24 ч. Фиг. 25 иллюстрирует график, сравнивающий стромальное помутнение в Р. aeruginosaстимулированных роговицах мышей C57BL/6, обработанных эритораном тетранатриевым или плацебо через 24 ч. Подробное описание изобретения Для удобства здесь собраны некоторые термины, используемые в данном описании, примеры и прилагаемая формула изобретения. Если не указано иное, то все технические и научные термины, используемые в данном документе, имеют тот же смысл, который под ними обычно понимает специалист в области, к которой принадлежит данное изобретение. Используемый в данном документе термин "антагонист Toll-подобного рецептора 4" или "TLR4 антагонист" относится к агенту, такому как малая молекула, полипептид, полинуклеотид, который способен существенно уменьшить, ингибировать, блокировать и/или смягчить активацию TLR4 клеток. Используемый в данном документе термин "субъект" относится к любому теплокровному организму, включая, но не ограничиваясь ими, людей, свиней, крыс, мышей, собак, коз, овец, лошадей, обезьян,человекообразных обезьян, кроликов, крупный рогатый скот и т.д. Используемые в данном документе термины "лечение" или "лечить" относятся к любому частному способу или процедуре, используемой для излечения, торможения, сокращения, устранения или исправ-3 019437 ления болезни или патологического состояния (например, воспаления роговицы), включая, например,предотвращение воспаления роговицы из развивающегося, подавление развития воспаления роговицы,задержку развития клинических симптомов, связанных с воспалением роговицы, и/или облегчение симптомов, связанных с воспалением роговицы. Используемый в данном документе термин "эффективное количество" относится к дозировкеTLR4-антагониста, вводимого отдельно или в сочетании с любыми дополнительными терапевтическими агентами, которая является эффективной и/или достаточной для лечения воспаления роговицы и/или болезни или расстройства, связанного с воспалением роговицы. Эффективное количество может варьироваться в зависимости от субъекта, от болезни, от которой лечат, и от осуществляемого лечения. Используемый в данном документе термин "терапевтически эффективное количество" относится к этому количеству TLR4-антагониста, вводимого отдельно или в сочетании с любыми дополнительными терапевтическими агентами, что приводит к облегчению симптомов, связанных с воспалением роговицы,и/или заболевания или расстройства, связанного с воспалением роговицы, и/или приводит к терапевтически соответствующему эффекту. К примеру, "терапевтически эффективное количество" можно понимать как количество TLR4-антагониста, необходимое для уменьшения воспаления роговицы у субъекта. Используемые в данном документе термины "парентеральное введение" и "введение парентерально" относятся к режиму введения, отличающемуся от энтерального и местного введения, обычно путем инъекций и включают, не ограничиваясь ими, внутривенные, внутримышечные, внутриартериальные,подоболочечные, внутрижелудочковые, интракапсулярные, интраорбитальные, внутрисердечные, внутрикожные, внутрибрюшинные, транстрахеальные, подкожные, субкутикулярные, внутрисуставные, субкапсулярные, субарахноидальные, интраспинальные и внутригрудинные инъекции и инфузии. Используемые в данном документе термины "фармацевтически или фармакологически приемлемый" относятся к молекулярным субстанциям и композициям, которые не вызывают вредную, аллергическую или другую неблагоприятную реакцию при введении животному или человеку в случае необходимости. Ветеринарные применения в равной степени включены в изобретение, и "фармацевтически приемлемые" составы включают составы для клинического и/или ветеринарного применения. Упоминаемый в данном документе "фармацевтически приемлемый носитель" включает в себя любые и все растворители, дисперсные среды, покрытия, антибактериальные и противогрибковые агенты,изотонические и задерживающие абсорбцию агенты и т.п. Применение таких сред и агентов для активных фармацевтических веществ хорошо известно в данной области. За исключением тех случаев, когда любые обычные среды или агенты несовместимы с активным ингредиентом, предполагается их применение в терапевтических композициях. Для введения человеку препараты должны соответствовать стандартам стерильности, пирогенности, общей безопасности и чистоты в соответствии с требованиями Отделения биологических стандартов FDA (Управления по контролю за пищевыми продуктами и лекарственными препаратами США). Дополнительные активные ингредиенты также могут быть включены в композиции. Упоминаемые в данном документе составы "единичной дозы" представляют собой составы, содержащие дозу или субдозу вводимого ингредиента, адаптированную для конкретной, рассчитанной по времени доставки. Например, составы "единичной дозы" представляют собой составы, содержащие суточную дозу или единицу, или ежедневную субдозу, или еженедельную дозу или единицу, или еженедельную субдозу и т.п. Используемый в данном документе термин "алкил" относится к алифатическим органическим группам, которые могут быть разветвленными или прямыми и которые возможно могут быть замещены одним или более атомом галогена в любом положении алкильной цепи. Используемый в данном документе термин "фармацевтически приемлемая соль" включает соли соединений, полученные из сочетания соединения и органической или неорганической кислоты или основания. Данное изобретение в общем относится к способам лечения у субъекта воспаления роговицы, а также к способам уменьшения непрозрачности роговицы (например, помутнения роговицы, помутнения стромы, утолщения стромы), связанной с воспалением роговицы. В одном примере воспаление роговицы может быть вызвано и/или связано с ношением контактных линз. В других примерах воспаление роговицы может быть связано с увеитом, склеритом, эписклеритом, кератитом, глазным или офтальмологическим хирургическим вмешательством (например, хирургическим вмешательством на роговице), эндофтальмитом, иритом, атрофической дегенерацией желтого пятна, пигментным ретинитом, ятрогенной ретинопатией, разрывами и дырами в сетчатке, цистоидным макулярным отеком, диабетическим макулярным отеком, диабетической ретинопатией, ретинопатией при серповидно-клеточной анемии, окклюзией вены и артерии сетчатки, оптической невропатией, экссудативной дегенерацией желтого пятна, неоваскулярной глаукомой, неоваскуляризацией роговицы, циклитом, ретинопатией при серповидноклеточной анемии и птеригиумом. В соответствии с воплощением способа данного изобретения воспаление роговицы у субъекта можно существенно уменьшить и/или смягчить путем введения TLR4-антагониста на роговицу субъекта в количестве, эффективном для блокирования, ингибирования и/или смягчения активации TLR4. Поэто-4 019437 му один аспект данного изобретения относится к способу лечения воспаления роговицы путем введения субъекту терапевтически эффективного количества по меньшей мере TLR4-антагониста для уменьшения и/или смягчения воспаления роговицы у субъекта. В одном воплощении TLR4-антагонист формулы (I) является соединением формулы (II) или его фармацевтически приемлемой солью или эфиром фосфорной кислоты. В другом воплощении TLR4-антагонист формулы (II) является или его фармацевтически приемлемой солью или эфиром фосфорной кислоты. В другом воплощении TLR4-антагонист является эритораном тетранатриевым (также известным как Е 5664). Эриторан тетранатриевый является тетранатриевой солью соединения, показанного непосредственно выше. Эриторан тетранатриевый описан в патенте США 5935938. Другие TLR4-антагонисты, которые могут быть использованы для лечения у субъекта воспаления роговицы способом данного изобретения, включают следующие соединения: или их фармацевтически приемлемые соли или эфиры фосфорной кислоты (см. патент США 2007/0072824 А 1).TLR4-антагонист, используемый в способах данного изобретения, можно вводить субъекту для лечения воспаления роговицы с помощью стандартных способов, включая, например, офтальмологические,местные, парентеральные, подкожные, внутривенные, внутрисуставные, интратекальные, внутримышечные, внутрибрюшинные, внутрикожные инъекции, или трансдермальным, буккальным путем, через слизистую ротовой полости, перорально или при вдыхании. Для конкретного субъекта используется конкретный подход и дозировка в зависимости от нескольких факторов, включая, например, общее состояние здоровья, вес и возраст субъекта. На основании таких факторов, как эти, врач может выбрать соответствующий подход к лечению. Лечение в соответствии с данными способами изобретения может быть изменено, прекращено или вновь начато у субъекта в зависимости от состояния воспаленной роговицы. Лечение может осуществляться с промежутками во времени, устанавленными специалистом в данной области. Например, введение может осуществляться 1, 2, 3 или 4 раза в день. В другом аспекте данного изобретения TLR4 антагонист может быть введен после того, как произошла индукция воспалительного ответа. Способы данного изобретения включают введение субъекту терапевтически эффективного количе-6 019437 ства TLR4-антагониста. Терапевтически эффективное количество способен определить специалист в данной области. Точный состав, путь введения и доза могут быть выбраны частным врачом в зависимости от состояния субъекта. Состав фармацевтических препаратов для применения в режимах введения, отмеченных выше (и других), описан, например, в Remington's Pharmaceutical Sciences (18th edition), ed. A. Gennaro, 1990, MackSciences Series, Marcel Dekker, Inc., N.Y. U.S.A., 1999). В одном примере TLR4-антагонист может поставляться в офтальмологическом препарате, который может быть введен в глаз субъекта. Офтальмологический препарат может содержать TLR4-антагонист в фармацевтически приемлемом растворе, суспензии или мази. Могут происходить некоторые изменения концентрации в зависимости от конкретного используемого TLR4-антагониста, состояния субъекта, которого лечат, и т.п., и лицо, ответственное за лечение, может определить наиболее подходящую концентрацию для конкретного субъекта. Офтальмологический препарат может быть в форме стерильного водного раствора, содержащего, по желанию, дополнительные ингредиенты, например консерванты, буферы, тонические агенты, антиоксиданты, стабилизаторы, неионные смачивающие или осветляющие агенты, а также агенты, увеличивающие вязкость. Примеры консервантов для применения в таких растворах включают хлорид бензалкония, хлорид бензетония, хлорбутанол, тимеросал и т.п. Примеры буферов включают борную кислоту, бикарбонаты натрия и калия, бораты натрия и калия, карбонаты натрия и калия, ацетат натрия и дифосфат натрия в количествах, достаточных для поддержания рН между примерно рН 6 и примерно рН 8 и, например, между примерно рН 7 и примерно рН 7,5. Примерами тонических агентов являются декстран 40, декстран 70, декстроза, глицерин, хлорид калия, пропиленгликоль и хлорид натрия. Примеры антиоксидантов и стабилизаторов включают бисульфит натрия, метабисульфит натрия,тиосульфит натрия и тиомочевину. Примеры смачивающих и осветляющих агентов включают полисорбат 80, полисорбат 20, полоксамер 282 и тилоксапол. Примеры агентов, увеличивающих вязкость, включают желатин, глицерин, гидроксиэтилцеллюлозу, гидроксиметилпропилцеллюлозу, ланолин, метилцеллюлозу, вазелин, полиэтиленгликоль, поливиниловый спирт, поливинилпирролидон и карбоксиметилцеллюлозу. Офтальмологические препараты будут вводиться местно в глаз субъекта, нуждающегося в лечении, с помощью традиционных способов, например, в форме капель или ванночек для глаза с офтальмологическим раствором.TLR4-антагонисты также могут быть составлены для местного введения через кожу. "Местные системы доставки" также включают трансдермальные пластыри, содержащие ингредиент для введения. Доставка через кожу также при желании может быть достигнута путем ионофореза или электротранспорта. Составы для местного введения на кожу включают, например, мази, кремы, гели и пасты, содержащие TLR4-антагонист в фармацевтически приемлемом носителе. Состав TLR4-антагонистов для местного применения включает препараты маслянистых или водорастворимых мазевых основ, хорошо известных специалистам в данной области. Например, эти составы могут включать растительные масла, животные жиры и, например, полутвердые углеводороды, полученные из нефти. Конкретные используемые компоненты могут включать белую мазь, желтую мазь, воск цетиловых эфиров, олеиновую кислоту,оливковое масло, парафин, вазелин, белый вазелин, спермацет, смесь крахмала с глицерином, белый воск, желтый воск, ланолин, безводный ланолин и глицерилмоностеарат. Также могут быть использованы различные водорастворимые мазевые основы, в том числе простые эфиры гликолей и их производные, полиэтиленгликоли, полиоксил 40 стеарат и полисорбаты. Субъекты, страдающие воспалением роговицы (или с риском воспаления роговицы), которые не являются легко доступными или не подходят для офтальмологического (например, с помощью глазных капель) и/или местного введения, можно лечить с помощью системного подхода, например, путем внутривенных инфузий. Например, TLR4-антагонист может быть введен в низкой дозе путем непрерывной внутривенной инфузии. В другом примере, в котором пациенту требуется более длительное лечение,TLR4-антагонист можно вводить с перерывами (например, каждые 12-24 ч). В вариантах этого подхода за начальной или нагрузочной дозой могут следовать поддерживающие дозы, которые меньше (например, в два раза) нагрузочной дозы, или может следовать непрерывная инфузия. Длительность такого лечения может быть определена специалистом в данной области на основании таких факторов, как, например, тяжесть состояния и наблюдающиеся улучшения. При введении субъекту TLR4-антагониста путем внутривенной инфузии можно использовать устройства и оборудование (например, катетеры, такие как центральные или периферические венозные катетеры, трубки, капельницы, камеры, препятствующие обратному току крови, Y-образные инъекционные системы, задвижки и инфузионные мешки), которое совместимо с TLR4-антагонистом. Субъекты, которым вводят TLR4-антагонисты, могут включать млекопитающих, экспрессирующихTLR на мембранах эпителиальных клеток роговицы, макрофагов и нейтрофилов. Субъекты, которых лечат в соответствии со способами данного изобретения, включают тех, которые имеют воспаление роговицы. Кроме того, субъекты, которые его не имеют, но которые подвержены риску развития воспаления роговицы, могут лечиться в соответствии со способами данного изобретения. В последней группе субъектов лечение может ингибировать или предотвращать развитие воспаления роговицы у субъекта. В одном аспекте данного изобретения воспаление роговицы, которое лечат с помощью способов,описанных в данном документе, связано с глазной болезнью или офтальмологическим расстройством,таким как увеит, склерит, эписклерит, кератит, глазное или офтальмологическое хирургическое вмешательство (например, хирургическое вмешательство на роговице), эндофтальмит, ирит, атрофическая дегенерация желтого пятна, пигментный ретинит, ятрогенная ретинопатия, разрывы и дыры в сетчатке,цистоидный макулярный отек, диабетический макулярный отек, диабетическая ретинопатия, ретинопатия при серповидно-клеточной анемии, окклюзия вены и артерии сетчатки, оптическая невропатия, экссудативная дегенерация желтого пятна, неоваскулярная глаукома, неоваскуляризация роговицы, циклит,ретинопатия при серповидно-клеточной анемии, птеригиум и условия, индуцированные ношением контактных линз, такие как периферическая язва. В частном аспекте данного изобретения способы могут быть использованы для лечения воспаления роговицы, связанного с микробной инфекцией. В одном частном примере кератит может быть вызван различными микробными инфекциями, такими как грамотрицательные бактерии Pseudomonas aeruginous и Serratia marcesans, грам-положительные бактерии,включая S. aureus, S. epidermidis и Corynebacterium species (P. acnes). Таким образом, в одном аспекте данного изобретения воспаление роговицы, задерживаемое у субъекта, является воспалением роговицы,связанным с бактериальным кератитом. В другом аспекте изобретения способы, описанные в данном документе, могут быть использованы для лечения воспаления роговицы, связанного с грибковым кератитом. В частности, способы данного изобретения могут быть использованы для лечения воспаления роговицы, связанного с родами грибов,включающими, например, Fusarium, Penicillium, Aspergillus, Cephalosporium (Acremonium), Trichophyton,Microsporum, Epidermophyton, Scopulariopsis и Candida. В другом аспекте изобретения описанные в данном документе способы могут быть использованы для лечения стерильного воспаления роговицы, при котором ни на контактных линзах, ни на поверхности роговицы не выявляются живые организмы. В частности, способы данного изобретения могут быть использованы у субъектов для лечения воспаления роговицы, связанного с ношением контактных линз. Эти синдромы могут включать, но не ограничиваясь ими, связанные с контактными линзами инфильтраты роговицы (CLACI), связанное с контактными линзами покраснение глаза (CLARE), связанную с контактными линзами периферическую язву (CLPU). Стерильные и инфекционные инфильтраты, как правило, но не всегда, отличаются при осмотре с помощью щелевой лампы, имеющейся у специалистов в данной области. Данное изобретение также относится к способу лечения TLR-индуцированного воспалительного ответа в роговице субъекта. Способ включает введение субъекту терапевтически эффективного количества TLR4-антагониста. В одном аспекте данного изобретения лечение TLR-индуцированного воспалительного ответа может включать торможение клеточной инфильтрации роговицы субъекта. В частности,лечение TLR-индуцированного воспалительного ответа может включать торможение нейтрофильной инфильтрации стромы роговицы субъекта. В другом аспекте данного изобретения лечение TLR-индуцированного воспалительного ответа может включать торможение секреции СХС-хемокинов, например торможение интерлейкина-8 (IL-8). IL-8 является СХС-хемокином, который может индуцировать выход нейтрофилов из кровотока и вход в окружающие ткани. Другие СХС-хемокины, которые продуцируются в роговице и обладают нейтрофильной активностью, включают CXCL1, CXCL2, CXCL5, которые также могут быть целевыми в способах данного изобретения. Данное изобретение также относится к контактным линзам для лечения воспаления роговицы у субъекта. Контактные линзы включают субстрат контактной линзы и покрытие, находящееся по меньшей мере на части субстрата. Покрытие может содержать TLR4-антагонист в количестве, эффективном для лечения у субъекта воспаления роговицы при установке субъекту контактных линз. Покрытие, содержащее TLR4-антагонист, может быть применено к количеству материала субстрата контактных линз, известному в данной области. Практически любой субстрат, известный в данной области, который может приобрести форму контактной линзы, может быть использован в данном изобретении, если он является оптически прозрачным. В аспекте изобретения субстрат может включать оптически прозрачные материалы, которые позволяют кислороду достичь роговицы в количестве, достаточном для длительного здоровья роговицы. Примеры субстратов включают полимеры из гидрофобных материалов, такие как силиконовые сополимеры,сополимеры, олигомеры и макромеры. Типичными субстратами являются полидиметилсилоксан, полидиметилковинилметилсилоксан. Другие силиконы включают силиконовые смолы, описанные в патенте США 3228741 от Becker; такие смеси, как описанные в патенте США 3341490 от Burdick et al., и такие силиконовые композиции, как описанные в патенте США 3518324 от Polmanteer. Субстраты,описанные в патентах США 4136250; 5387623; 5760100; 5789461; 5776999; 5849811; 5314960 и 5244981, также могут быть использованы в изобретении. Сшитые полимеры пропоксилата метилглюкозы и окисипропилена и гидрогели на основе НЕМА также могут быть использованы в качестве субстрата контактных линз. Силиконовые композиции, которые могут быть использованы для формирования контактных линз данного изобретения, являются сшитыми полисилоксанами, полученными путем сшивания силоксановых преполимеров с помощью гидросилилирования, соконденсации и таких свободно-радикальных механизмов, как описанные Chen в патенте США 4143949, который включен в данный документ посредством ссылки. Дополнительными субстратами на силиконовой основе являются сшитые полимеры ,диаминопропилполидиметилсилоксана и глицидилметакрилата. Силиконовые композиции, также предусмотренные данным изобретением, сделаны путем сочетания метакрилата с одним или более силиконовым мономером в присутствии катализатора полимеризации с переносом группы (GTP, group transferpolymerization) для формирования макромера, который впоследствии полимеризуется с другими мономерами для образования конечного субстрата. Инициаторы, условия реакции, мономеры и катализаторы,которые могут быть использованы для получения полимеров с переносом группы (GTP), описаны вWileySons) p. 580, 1987. Субстраты, описанные в патенте США 6951894, также подходят для использования в данном изобретении. Покрытие можно изготовить и применять в виде водного раствора, суспензии или коллоида, а затем нанести на субстрат для контактных линз в соответствии с любым процессом, который может обеспечить покрытие в контакте с субстратом. Например, процесс нанесения покрытия на субстрат включает погружение, распыление, соскабливание и покрытие путем центрифугирования. После того как субстрат линзы становится покрытым, он может быть подвергнут любому количеству дополнительных этапов, которые проводятся при производстве контактных линз. Они могут включать, например, этапы набухания и промывки, введение добавок, таких как поверхностно-активные вещества, этапы экстракции и т.п. Покрытие, содержащее TLR4-антагонист, можно присоединить к контактной линзе, например, путем химического связывания, такого как ковалентное или ионное связывание, или физического связывания. В некоторых аспектах покрытие может оставаться прикрепленными к субстрату линзы на протяжении срока ее использования (например, времени хранения плюс времени, в течение которого она будет находиться в контакте с глазом пользователя). Контактные линзы также могут содержать более одного слоя покрытия. Это может быть желательным, когда слой покрытия обеспечивает необходимые свойства поверхности (например, лечение воспаления роговицы), но не очень совместим с самим субстратом линзы. Например, для прикрепления покрытия к субстрату может быть использован связующий слой или связующий агент. Выбор совместимых материалов для субстрата линз, покрытия с TLR4-антагонистом и связующего слоя (при необходимости) способен осуществить специалист в данной области. В аспекте изобретения контактные линзы являются нетоксичными для роговицы и других тканей субъекта, обеспечивая лечение воспаления роговицы у субъекта. Данное изобретение также относится к офтальмологическому раствору для лечения у субъекта воспаления роговицы. Раствор может быть водным и включает TLR4-антагонист, как описано выше. Примеры используемых растворов, которые могут быть использованы в лечении воспаления роговицы,включают растворы, которые контактируют с веками и/или глазами, такие как многоцелевые растворы для линз, офтальмологические растворы для промывания, хирургические скрабы для использования на глазах, глазные капли, растворы для промывания глаз, растворы для контактных линз, местные продаваемые без рецепта глазные и периокулярные растворы (т.е. искусственные слезы), глазные и периокулярные очищающие растворы, растворы для увлажнения глаз и/или антибактериальные растворы для хирургических скрабов или для местного применения. В некоторых аспектах TLR4-антагонист может быть добавлен в коммерчески доступный раствор для контактных линз или в многоцелевой раствор для контактных линз для лечения воспаления роговицы. В других аспектах TLR4-антагонист может быть добавлен в водный раствор, приготовленный для использования в качестве раствора для контактных линз или многоцелевого раствора для линз, который не является коммерчески доступным, для лечения воспаления роговицы. В некоторых аспектах, когда офтальмологический раствор включает очищающий раствор, этот очищающий раствор может содержать очищающие агенты, чтобы эффективно очищать линзы от налета в виде пленки и от поверхностного мусора. Примеры очищающих агентов, которые могут быть использованы, включают полоксамеры и тетроновые поверхностно-активные вещества, содержащие полиоксиэтиленгидрофильные единицы. Во всех воплощениях очищающие агенты являются нетоксичными и не искажают зрение субъекта, у которого лечат воспаление роговицы. В других аспектах TLR4-антагонисты могут быть добавлены к тоническим агентам и буферам, которые имеются в обычных офтальмологических растворах. Примеры тонических агентов включают дек-9 019437 строзу, хлорид калия и/или хлорид натрия. Примеры буферов включают борную кислоту, борат натрия,цитрат натрия или калия, бикарбонат натрия, фосфат натрия и фосфат калия. Кроме того, могут быть добавлены антибактериальные агенты, имеющиеся в обычных офтальмологических растворах, таких как многоцелевые растворы для линз. Антибактериальные агенты для использования в растворах включают, например, полиаминопропилбигуанид, гидрохлорид алексидина, поликватерниум-1, поликватерниум-42, миристамидопропилдиметиламин или другие агенты, известные специалистам в данной области. В некоторых аспектах раствор также может включать агенты для комфорта или увлажнения, которые обеспечивают увлажнение и смазку контактных линз субъекта. Такие агенты включают, например,поликватерниум-10, полоксамер, пропиленгликоль, гидроксипропилметилцеллюлозу (НРМС) или другие агенты, известные специалистам в данной области. Так, в некоторых аспектах раствор предназначен для местного введения на веки и/или глаза, что предполагает, что раствор свободен от патогенных организмов и/или стерилен. Преимущество стерильного раствора заключается в том, что это уменьшает возможность введения загрязняющих веществ на веко и/или глаз субъекта. Стерильность или адекватная антимикробная сохранность может быть предоставлена в рамках данных растворов данного изобретения. В некоторых аспектах растворы производятся в стерильных условиях. В дополнение или вместо стерилизации водные растворы TLR4-антагониста могут содержать физиологически приемлемый консервант для минимизации возможности микробного загрязнения. В растворах данного изобретения могут быть использованы физиологически приемлемые консерванты для повышения стабильности растворов. Консерванты включают, например, полиаминопропилбигуанид,полигексаметиленбигуанид (РНМВ), поликватерниум-1, миристамидопропил и сорбиновую кислоту. Изобретение также проиллюстрировано следующими примерами, которые не предназначены для ограничения сферы формулы изобретения. Примеры В следующих примерах на роговицы мышей C57BL/6 наносили царапины и обрабатывали их эритораном тетранатриевым или плацебо до или после стимуляции ЛПС или TLR2-лигандом Pam3Cys. 2 мм круги, вырезанные из мягких контактных линз, использовали для покрытия поверхности роговицы на протяжении всего периода ингибирования и стимуляции. Инфильтраты роговицы выявляли in vivo с помощью конфокальной микроскопии (CONFOSCAN) и иммуногистохимии на нейтрофилы. Также оценивали влияние эриторана тетранатриевого на продукцию ИЛ-8 ЛПС- и Pam3Cys-стимулированными человеческими эпителиальными клетками роговицы (НСЕС), макрофагами и нейтрофилами. Как видно из приведенных ниже примеров, мы обнаружили, что эриторан тетранатриевый значительно ингибирует продукцию хемокинов СХС в роговице и развитие инфильтратов роговицы, в частности нейтрофильных, в ответ на стимуляцию ЛПС (TLR4), но не Pam3Cys (TLR2). Когда эриторан тетранатриевый применяли после стимуляции ЛПС, нейтрофильная инфильтрация была значительно ингибирована, хотя требовалась более высокая концентрация. Кроме того, продукция ИЛ-8 TLR4-, но не TLR2 стимулированными клеточными линиями НСЕС, макрофагов и нейтрофилов, также была значительно сокращена. Мы также отметили, что эриторан тетранатриевый является весьма эффективным антагонистом ЛПСиндуцированных инфильтратов роговицы, связанных с контактными линзами, даже если его давали после индукции воспалительного ответа. Хотя эриторан тетранатриевый специфичен по отношению к TLR4,здесь показано, что он ингибирует ЛПС-индуцированную продукцию IL8 в нескольких типах клеток. Пример 1. Приготовление эриторана тетранатриевого. Эриторан тетранатриевый и плацебо получали из научно-исследовательского института Eisai Research Institute, Андовер, Массачусетс и ресуспендировали в концентрации 1,1 мг/мл в воде, свободной от эндотоксина (Sigma; Великобритания). Этот стоковый реагент аликвотировали и хранили при -80 С. Образцы подвергали действию ультразвука перед разбавлением до концентрации, отмеченной для каждого эксперимента. Пример 2. Клеточные линии и стимуляция in vitro. Эпителиальную клеточную линию человеческой роговицы, трансфицированную SV-40 (НСЕ-Т),получали из АТСС. До стимуляции НСЕ-клетки помещали в 48-луночные планшеты и подвергали недостаточности эпидермального фактора роста в течение одной ночи. Т.к. НСЕ-клетки требуют экзогенногоMD-2 для ответа на ЛПС, то клетки инкубировали в течение 1 ч с 200 нг/мл рекомбинантного человеческого MD-2 (RD Systems, Миннеаполис, Миннесота) до стимуляции сверхчистым ЛПС (TLR4 специфичным, Escherichia coli K12, Invivogen; Сан-Диего, Калифорния). НСЕ-клетки также инкубировали с Pam3CysK4 (EMC Microcollections, Германия) в отсутствие MD-2. Макрофагальную клеточную линию U937 культивировали в среде RPMI (GIBCO) с 10% FBS и вносили по 5104 клеток/лунка в 96-луночные планшеты. Человеческую нейтрофилподобную клеточную линию (HL-60) поддерживали в RPMI с 10% FBS и инкубировали в течение пяти дней в 1,2% ДМСО для создания фенотипа нейтрофилов. Все клетки инкубировали с эритораном или плацебо после стимуляции ЛПС или Pam3CysK4 в оп- 10019437 тимальной концентрации для каждой клеточной линии (отмечено в результатах). Через 3 ч собирали бесклеточные супернатанты и измеряли CXCL8/IL-8 с помощью ИФА (RD Systems). Результаты приведены на фиг. 2, 3 и 14-19. Пример 3. Мышиная модель воспаления роговицы, связанного с контактными линзами. Мышей C57BL/6 (в возрасте 6-8 недель) получали из The Jackson Laboratory (Бар Харбор, Мэн). Мышей анестезировали путем внутрибрюшинного введения 0,4 мл 2,2,2-трибромэтанола (ТВЕ). Для получения трех параллельных царапин на эпителии роговицы использовали иглу 26 размера, как описано в наших предыдущих исследованиях. Местно применяли эриторан тетранатриевый или плацебо в концентрациях, указанных для каждого эксперимента, и на поверхность роговицы помещали круг диаметром 2 мм, вырезанный из обычной контактной линзы (LOTRAFILCON; CIBA VISION) (см. фиг. 1). Через 1 ч линзу на короткое время удаляли и на поверхность роговицы наносили 2 мкл ЛПС (20 мг/мл) илиPam3Cys (5 мг/мл). Затем круг, вырезанный из контактной линзы, возвращали, а через 1 ч линзу удаляли и мышей выводили из анестезии. В некоторых экспериментах порядок введения агониста и антагониста меняли или вводили одновременно оба агента. Пример 4. Воспаление роговицы, индуцированное Pseudomonas aeruginosa. Штамм Pseudomonas aeruginosa ATCC 19660 получали непосредственно из АТСС и сохраняли в стоке при -80 С. Бактерии выращивали в течение ночи (18 ч) в триптонно-соевом бульоне (TSB), а аликвоты из этих стационарных культур разводили 1:100 и выращивали в TSB до OD650=0,2 (1108 KOE/мл). Бактерии центрифугировали, промывали в PBS и ресуспендировали в количестве 2109 бактерий/мл в 0,3% растворе тобрамицина в PBS (Sigma-Aldrich). Уничтожение бактерий подтверждали отсутствием роста на чашках с TSB-агаром. На роговицу наносили три параллельные царапины, на поверхность роговицы помещали 5 мкл бактериальной суспензии, содержащей 1107 организмов, и покрывали 2 мм кругом, вырезанным из силикон-гидрогелевой контактной линзы (Lotrafilcon; Ciba Vision), как только что было описано. Пример 5. Анализ толщины и помутнения роговицы с помощью конфокальной микроскопии invivo. Анализ клеточной инфильтрации in vivo выполняли с использованием NIDEK CONFOSCAN. Мышей анестезировали и иммобилизовали и рассматривали роговицу с помощью 40 объектива с прозрачным гелем (Genteal, Novartis Ophthalmics, Дулут, Джорджия) в качестве среды. С помощью программного обеспечения NAVIS регистрировали серию изображений всей роговицы и измеряли непосредственно толщину стромы (область между базальным эпителием и эндотелием роговицы). Для измерения общего инфильтрата (называемого помутнением роговицы) считанное показание интенсивности света от каждого 1-2 мкм изображения стромы роговицы экспортировали в Prism (Graph Pad Software, Сан-Диего, Калифорния), а общую площадь под кривой затем рассчитывали, как описано выше. (Sun Y. et al. Infectionand immunity 2006; 74:5325-5332; Johnson A.C. et al. Invest. Ophthalmol. Vis. Sci. 2005; 46:589-595). Пример 6. Иммуногистохимия. Глаза быстро замораживали в жидком азоте и в течение 2 ч срезы толщиной 5 мкм инкубировали с антинейтрофильными антителами NIMP-R14, разведенными до концентрации 2 мкг/мл в 1% эмбриональной телячьей сыворотке/TBS (1% FCS/TBS). После промывания срезы роговицы инкубировали сFITC-конъюгированными кроличьими антикрысиными антителами (Vector Laboratories, Бурлингейм,Калифорния), разведенными 1:200 из стока в 1% FCS/TBS. Срезы помещали в среду Vectashield с красителем DAPI (Vector Laboratories) и определяли число нейтрофилов в каждом срезе с помощью флуоресцентной микроскопии и путем прямого подсчета. Пример 7. Анализ апоптоза. Жизнеспособность клеток in vitro измеряли с помощью трипанового синего. Срезы роговицы инкубировали с реагентами для мечения конца однонитевого разрыва dUTP, опосредованного терминальной дезоксинуклеотидилтрансферазой (TUNEL) в соответствии с инструкциями производителя (Roche, Пенцберг, Германия), и число TUNEL-положительных клеток в роговице количественно оценивали с помощью флуоресцентной микроскопии. Пример 8. Статистика. Статистический анализ проводили с использованием непарного t-теста (Prism; Graph Pad Software,Сан-Диего, Калифорния). Значение р менее 0,05 считали значимым. Пример 9. Влияние эриторана тетранатриевого на ЛПС-индуцированную продукцию хемокина СХС в роговице. Роль эриторана тетранатриевого в ЛПС-индуцированном воспалении роговицы определяли с помощью модели воспаления роговицы, связанного с контактными линзами, описанной в примере 3. Говоря кратко, на роговицы мышей C57BL/6 наносили три параллельные поверхностные царапины. Местно наносили 2 мкл 350 мг/мл раствора эриторана или плацебо и на поверхность роговицы помещали 2 мм круг, вырезанный из мягкой контактной линзы, как показано на фиг. 1. Через 1 ч линзу удаляли, местно наносили 2 мкл ЛПС (20 мг/мл) или Pam3Cys (5 мг/мл) и линзу возвращали. Через 1 ч линзу удаляли, а 3 ч спустя (через 4 ч после стимуляции) роговицы иссекали, гомогенизировали и измеряли CXCL1/KC с помощью ИФА. Фиг. 2 показывает, что CXCL1/KC в ЛПС-стимулированной роговице был значительно ингибирован эритораном по сравнению с плацебо (р=0,003). Однако в присутствии ЛПС (и плацебо) CXCL1/KC значительно повышался. Тем не менее, в случаях, когда роговицу предварительно обрабатывали эритораном тетранатриевым до ЛПС, продукция хемокинов устранялась, что показывает антагонистическое влияние эриторана тетранатриевого на этой модели. Мы обрабатывали роговицу эритораном тетранатриевым до стимуляции Pam3Cys, чтобы определить специфичность эриторана тетранатриевого. Фиг. 3 показывает, что в Pam3Cys-стимулированных роговицах не было разницы в CXCL1/KC между эритораном и плацебо. Этот эксперимент представляет два повторных исследования с пятью мышами в каждой группе. Пример 10. Влияние эриторана тетранатриевого на клеточную инфильтрацию стромы роговицы. Эриторан тетранатриевый не влияет на Pam3Cys/TLR2-индуцированное воспаление роговицы (фиг. 2, нижняя панель), что демонстрирует избирательное действие этого антагониста. Пример 11. Влияние эриторана тетранатриевого на клеточный инфильтрат в строме центральной части роговицы. Для определения влияния эриторана тетранатриевого на клеточную инфильтрацию на роговицы наносили царапины и обрабатывали их эритораном тетранатриевым или плацебо с контактными линзами,как описано в примере 3 выше. Через 2 ч контактные линзы удаляли и через 24 ч, когда наблюдается пик нейтрофильной инфильтрации, роговицу рассматривали путем конфокальной микроскопии in vivo(CONFOSCAN) и регистрировали изображения центральной части роговицы. Изображения, полученные путем конфокальной микроскопии in vivo, приведены на фиг. 4. Изображения на фиг. 4 показывают, что в роговицах наивных мышей не было инфильтрирующих клеток, в то время как в ЛПС-обработанной роговице наблюдался интенсивный клеточный инфильтрат в строме ее центральной части (опредяемый как небольшие, отражающие свет клетки) через 24 ч после связанного с контактными линзами воздействия ЛПС в одиночку, либо в присутствие плацебо. В отмеченном контрасте мы обнаружили, что роговицы, обработанные эритораном тетранатриевым до ЛПС, демонстрируют минимальный клеточный инфильтрат в строме центральной части роговицы, что свидетельствует о том, что предварительная обработка эритораном тетранатриевым ингибирует клеточную инфильтрацию в строме роговицы на этой модели воспаления роговицы. Пример 12. Влияние предварительной обработки эритораном тетранатриевым на ЛПСиндуцированное связанное с контактными линзами привлечение нейтрофилов и развитие помутнения роговицы. Роговицы обрабатывали с использованием модели воспаления роговицы, связанного с контактными линзами, как описано в примере 3 выше и как показано на фиг. 1. Затем мы количественно оценивали ингибирующее действие эриторана тетранатриевого на клеточные инфильтраты в роговице через 24 ч путем измерения коэффициента отражения в строме роговицы в соответствии с примером 4. Каждый срез стромы толщиной 1 мкм от переднего к заднему был оценен с точки зрения отражения света. Эти измерения использовали для построения кривой. Площадь под кривой представляет общий инфильтрат. Затем непосредственно подсчитывали число нейтрофилов на срез роговицы. Фиг. 5 и 6 показывают, что роговицы, на которые наносили царапины и которые инкубировали только с контактными линзами, имели примерно 50 нейтрофилов в срезе, в то время как ЛПСобработанные роговицы имели более 300 нейтрофилов в срезе роговицы. Мыши, у которых местно применяли эриторан тетранатриевый перед ЛПС, имели дозозависимое снижение числа нейтрофилов, при котором 0,35 мг/мл необходимо для снижения количества нейтрофилов на 50%. В группе контроля травматичности (Tr) на роговицы, на которые наносили царапины, воздействовали только физиологическим раствором и инкубировали 2 ч с контактными линзами. Значимые различия (р 0,05) между эритораном и плацебо помечены звездочкой. Повторные эксперименты показали, что концентрация 0,35 мг/мл является минимальной ингибирующей концентрацией. Фиг. 7 и 8 показывают нейтрофильную инфильтрацию и коэффициент отражения в роговицах, стимулированных Pam3Cys. TLR2-активация индуцировала нейтрофильную инфильтрацию и развитие помутнения роговицы. Предварительная обработка эритораном тетранатриевым в высокой концентрации не влияет ни на нейтрофильную инфильтрацию, ни на общий коэффициент отражения. Взятые вместе,эти данные показывают, что эриторан тетранатриевый оказывает дозозависимый антагонистический эффект на TLR4- и не TLR2-индуцированное воспаление роговицы. Пример 13. Эффект эриторана тетранатриевого, применяемого после ЛПС-индуцированного воспаления роговицы. Чтобы определить, может ли эриторан тетранатриевый ингибировать воспаление роговицы после того, как ответ был инициирован, на роговицы наносили царапины и стимулировали ЛПС, как описано выше. Мы добавляли эриторан тетранатриевый через 1 ч после стимуляции ЛПС. Этот протокол осуществляли параллельно с мышами, предварительно обработанными эритораном тетранатриевым, и с мышами, получавшими одновременно эриторан тетранатриевый и ЛПС. Нейтрофильную инфильтрацию и помутнение роговицы оценивали, как и прежде, результаты представлены на фиг. 9-12. Фиг. 9 и 10 показывают, что ЛПС-индуцированная нейтрофильная инфильтрация и помутнение роговицы значительно сократились во всех группах с эритораном тетранатриевым по сравнению с плацебо,и это показывает, что антагонизм остается эффективным даже после начала воспалительного ответа. В некоторых экспериментах эриторан тетранатриевый применяли снова через 3 ч (когда контактных линз уже не было), но никакого существенного различия между этой и однократной обработкой эритораном тетранатриевым не было. Фиг. 11 и 12 показывают доза-ответ при обработке эритораном тетранатриевым после стимуляции ЛПС. Значимые различия (р 0,05) между эритораном и плацебо помечены звездочками. Отмечено, что количество нейтрофилов в каждом протоколе было значительно ниже, в то время как концентрации ниже 1,1 мг/мл не оказывали существенного влияния. Эти эксперименты были повторены трехкратно с аналогичными результатами. Пример 14. Влияние эриторана тетранатриевого на апоптоз в эпителии роговицы. Эксперимент в примере 7 проводили с целью определения, оказывает ли эриторан тетранатриевый проапоптотический эффект на эпителий роговицы. Мышей предварительно обрабатывали 2,2 мкг эриторана тетранатриевого до ЛПС, как описано выше, и глаза быстро замораживали. Мы использовали анализ TUNEL на срезах роговицы толщиной 5 мкм для выявления апоптотических клеток. Все клетки идентифицировали с помощью DAPI. Как показано на фиг. 13, мы не наблюдали TUNEL-положительных клеток в эпителии роговицы, на которой был применен эриторан тетранатриевый, в присутствии или в отсутствие ЛПС. Мы обнаружили TUNEL-положительные клетки в строме роговицы, обработанной ЛПС либо в одиночку, либо с плацебо, что соответствует присутствию нейтрофилов (не показано). Эти наблюдения показывают, что на этой модели эриторан тетранатриевый не оказывает проапоптотический эффект. Пример 15. Влияние эриторана тетранатриевого на ЛПС-индуцированную продукцию IL-8 человеческими эпителиальными клетками роговицы, макрофагами и нейтрофилами. Так как пример 10 указывает, что эриторан тетранатриевый играет ингибиторную роль in vivo, мы затем исследовали влияние эриторана тетранатриевого на ЛПС-индуцированную продукцию СХСхемокина IL-8 специфическими типами клеток в роговице. Нормальный эпителий роговицы млекопитающего включает внешний многослойный эпителий роговицы, который может отвечать на TLRлиганды, резидентные макрофаги и дендритные клетки, которые экспрессируют TLR, и нейтрофилы. Мы использовали типичные клеточные линии. Клеточные линии, полученные из человеческих эпителиальных клеток роговицы (НСЕ-Т), макрофагов (U937) и нейтрофилов (HL-60), стимулировали ЛПС или Pam3Cys в присутствии эриторана тетранатриевого или плацебо. Через 3 ч (клетки U937 и HL-60) или 24 ч (клетки НСЕ-Т) в культуральных супернатантах количественно оценивали уровни IL8 с помощью ИФА. Фиг. 14 показывает НСЕ-Т-клетки,инкубированные с 900 нг/мл ЛПС в присутствии 0,2 мкг/мл экзогенного MD-2 (необходимого для ответа НСЕ на ЛПС) и указанных концентраций эриторана или плацебо. Контроли, которые не прореагировали,включают MD-2 в одиночку (М), плацебо в одиночку (Р), эриторан в одиночку (Е), ЛПС в отсутствиеMD-2 (L). Фиг. 15 показывает эпителиальные клетки роговицы, инкубированные с 500 нг/мл Pam3Cys в аналогичных условиях. Фиг. 16 и 17 показывают макрофаги, стимулированные 10 нг/мл ЛПС или 500 нг/мл Pam3Cys в присутствии эриторана или плацебо. Фиг. 18 и 19 показывают нейтрофилы, стимулированные 1 нг/мл ЛПС или 500 нг/мл Pam3Cys и эритораном или плацебо. Концентрации ЛПС были основаны на предварительных данных, показывающих оптимальную продукцию IL-8. Отмечено дозозависимое ингибирование эритораном для каждого типа клеток для ЛПС-, но не Pam3Cys-стимулированных клеток. Графики представляют собой среднее значение +/- стандартное отклонение среднего из трех лунок на каждый образец. Эксперименты были повторены трехкратно с аналогичными результатами. Фиг. 14-19 показывают каждый тип клеток, продуцирующий IL-8 в ответ на ЛПС. Кроме того, эриторан тетранатриевый ингибировал ЛПС-индуцированную продукцию IL-8 дозозависимым образом, в то время как не имел никакого влияния на Pam3Cys-индуцированные ответы. Клеточные линии макрофагов и нейтрофилов производили высокие уровни IL-8, которые ингибировались 1 нг/мл эриторана тетранатриевого. Напротив, человеческие эпителиальные клетки роговицы, которые отвечали на ЛПС только в присутствии экзогенного MD-2, производили меньше IL-8 и требовали более высоких доз эриторана тетранатриевого для ингибирования. Пример 16. Воспаление роговицы, индуцированное убитой антибиотиком Р. Aeruginosa, являетсяTLR/4MD-2-зависимым и ингибируется эритораном тетранатриевым. Так как P. aeruginosa является основной причиной бактериального кератита, связанного с контактными линзами, мы также оценили влияние эриторана тетранатриевого на модель Р. aeruginosaиндуцированного воспаления роговицы. Мы не обнаружили никакой разницы в воспалении роговицы,индуцированном Р. aeruginosa, убитой либо воздействием тепла, либо короткой инкубацией с тобрамицином (данные не приведены). Для определения роли TLR4 и MD-2 в Р. aeruginosa-индуцированном воспалении роговицы мы инкубировали P. aeruginosa в тобрамицине в течение 30 мин, чтобы убить бактерии (подтверждено путем посева), и вносили 2 мкл бактериальной суспензии, содержащей 1107 организмов (в присутствии антибиотика), на поверхность роговицы мышей C57BL/6, TLR4-/- и MD-2-/-, на которую были нанесены царапины. Бактерии покрывали кругом с диаметром 2 мм, вырезанным из сили- 13019437 кон-гидрогелевой контактной линзы, на 2 ч. Через 24 ч оценивали воспаление роговицы. Фиг. 20-22 показывают, что Р. aeruginosa-обработанные роговицы от мышей C57BL/6 имели выраженную нейтрофильную инфильтрацию в строме роговицы; тем не менее, нейтрофильная инфильтрация, толщина роговицы и помутнение роговицы были значительно ниже в роговицах мышей TLR4-/- и MD-2-/- по сравнению с роговицами мышей C57BL/6. Аналогичные результаты были получены для ЛПС (не показаны). Фиг. 23-25 показывают, что когда убитые тобрамицином P. aeruginosa наносили на роговицу в присутствии эриторана тетранатриевого (2,2 мкг эриторана тетранатриевого в 2 мкл H2O), каждый из этих маркеров воспаления роговицы был значительно ингибирован по сравнению с плацебо. Эти данные показывают, что воспаление роговицы, индуцированное убитыми антибиотиками P. aeruginosa, являетсяTLR4/MD-2-зависимым и может быть ингибировано эритораном тетранатриевым. Из приведенного выше описания изобретения специалисты в данной области смогут понять улучшения, изменения и модификации. Такие улучшения, изменения и модификации в рамках данной области охвачены прилагаемой формулой изобретения. Все ссылки, публикации и патенты, упомянутые в данной заявке, включены в нее в полном объеме посредством ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения у субъекта воспаления роговицы, включающий введение субъекту терапевтически эффективного количества TLR4-антагониста для лечения у субъекта воспаления роговицы, гдеTLR4-антагонист является соединением формулы (II) или его фармацевтически приемлемой солью или эфиром фосфорной кислоты. 2. Способ по п.1, где соединение TLR4-антагонист формулы (II) имеет структуру или его фармацевтически приемлемая соль или эфир фосфорной кислоты. 3. Способ по п.1, где соединение TLR4-антагонист формулы (II) имеет структуру 4. Способ по п.1, где воспаление роговицы является ЛПС-индуцированным воспалением роговицы. 5. Способ по п.1, где субъект не имеет воспаления роговицы, но подвержен риску развития воспаления роговицы. 6. Способ по п.1, где субъект имеет воспаление роговицы. 7. Способ по п.1, где TLR4-антагонист вводится субъекту местно. 8. Способ по п.1, где TLR4-антагонист вводится субъекту в офтальмологическом препарате. 9. Способ по п.1, где воспаление роговицы связано с кератитом. 10. Способ по п.1, где воспаление роговицы связано со стерильным воспалением роговицы. 11. Способ по п.1, где воспаление роговицы связано с ношением контактных линз.
МПК / Метки
МПК: G01N 33/554
Метки: роговицы, воспаления, способ, лечения
Код ссылки
<a href="https://eas.patents.su/23-19437-sposob-lecheniya-vospaleniya-rogovicy.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения воспаления роговицы</a>
Предыдущий патент: Устройство для измельчения в слое материала
Следующий патент: Упаковочная машина
Случайный патент: Способ хранения сперматозоидов и продукт для искусственного оплодотворения (варианты)