Водная адъювантная композиция, содержащая неионный агент, обеспечивающий изотоничность, иммуногенная композиция и набор на ее основе и способ приготовления иммуногенной композиции
Формула / Реферат
1. Водная адъювантная композиция, содержащая:
(а) агонист TLR-4 (Toll-подобного рецептора 4) и сапонин в составе липосом;
(б) неионный агент, обеспечивающий изотоничность,
где ионная сила адъювантной композиции составляет менее 100 мМ.
2. Водная адъювантная композиция по п.1, где неионный агент, обеспечивающий изотоничность, представляет собой полиол.
3. Водная адъювантная композиция по п.2, где полиол представляет собой сорбит или сахарозу.
4. Водная адъювантная композиция по любому из пп.1-3, где указанный агонист TLR-4 представляет собой 3D-MPL (3-деацилированный монофосфориллипид А).
5. Водная адъювантная композиция по любому из пп.1-4, где указанный сапонин представляет собой QuilA или его производное.
6. Водная адъювантная композиция по п.5, где производное QuilA представляет собой QS21.
7. Иммуногенная композиция, содержащая антиген или антигенный препарат и водную адъювантную композицию по любому из пп.1-6.
8. Способ приготовления иммуногенной композиции по п.7, включающий стадию разведения лиофилизированной композиции, содержащей по меньшей мере один антиген или антигенный препарат вместе с водной адъювантной композицией по любому из пп.1-6.
9. Набор для использования в способе приготовления иммуногенной композиции по п.8, содержащий (1) лиофилизированную композицию, содержащую антиген или антигенный препарат; и (2) водную адъювантную композицию по любому из пп.1-6.
Текст
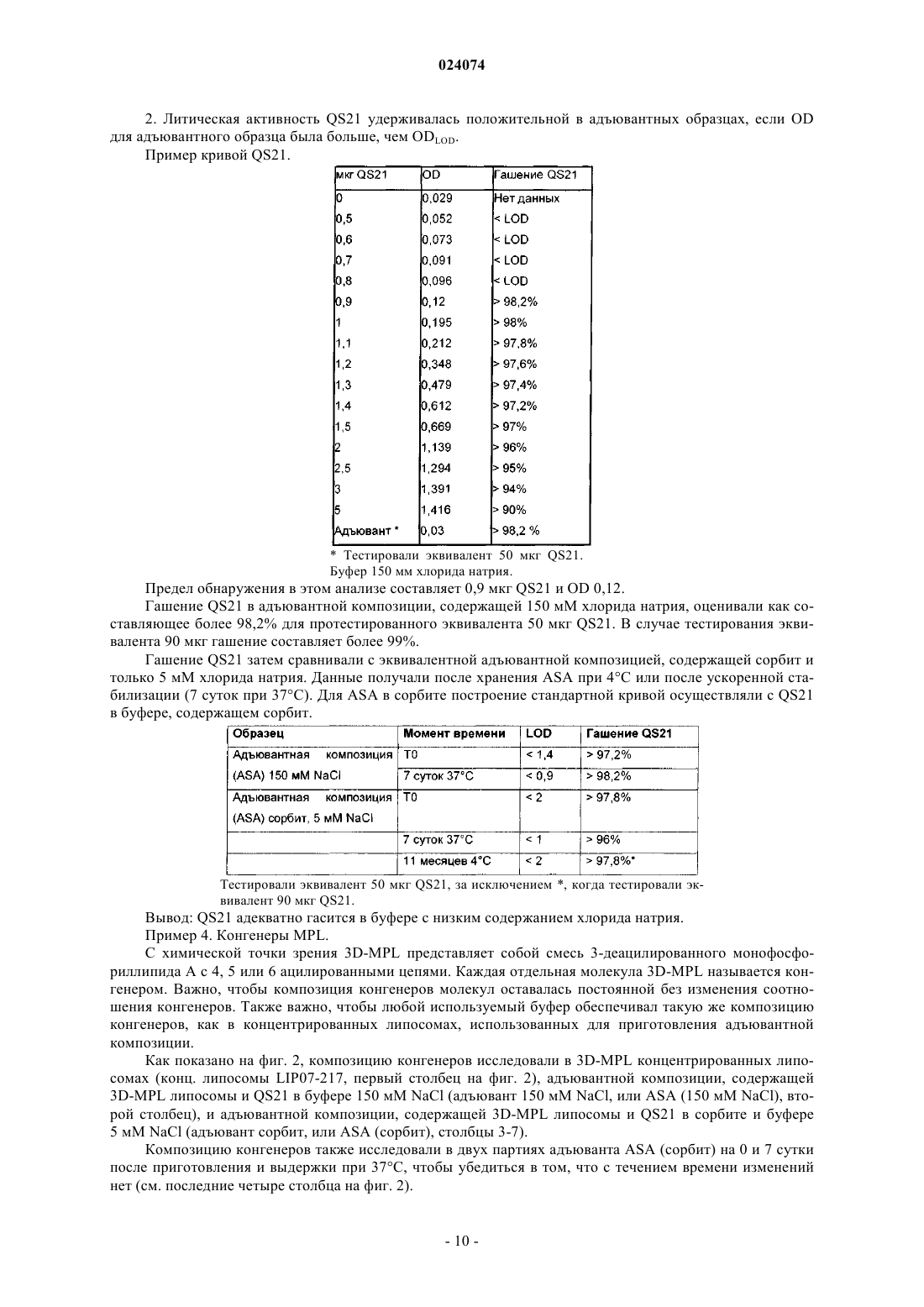
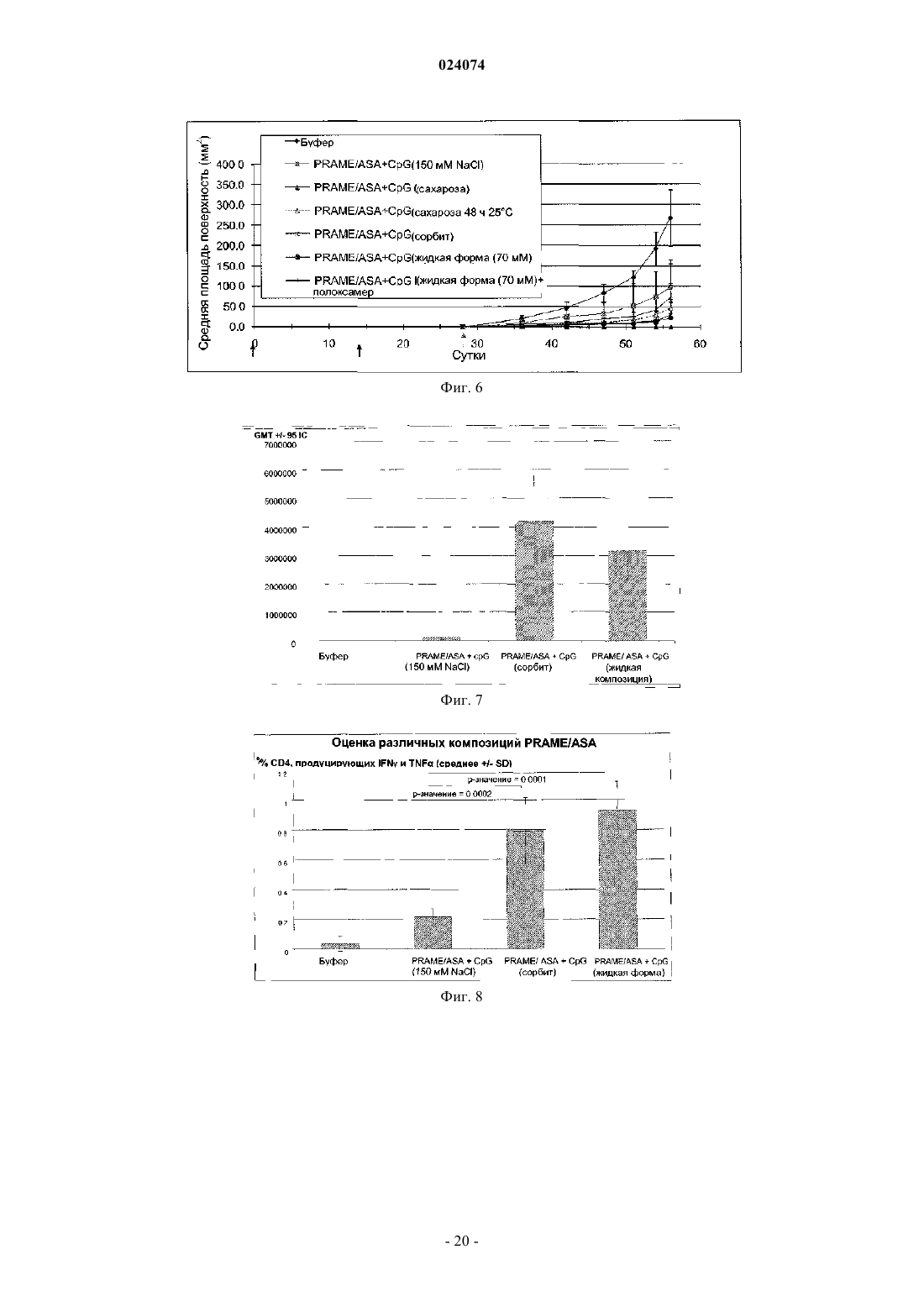
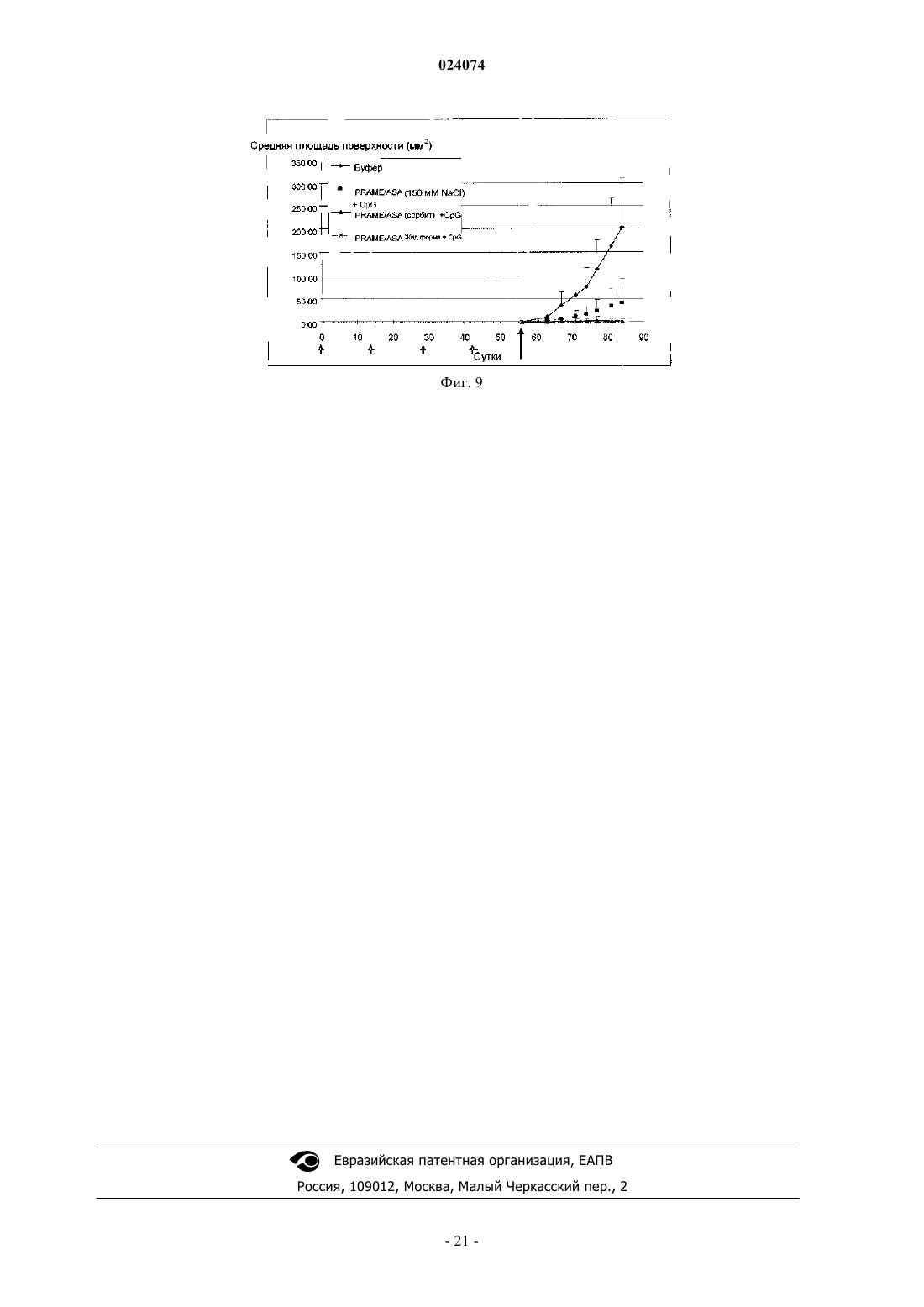
ВОДНАЯ АДЪЮВАНТНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ НЕИОННЫЙ АГЕНТ,ОБЕСПЕЧИВАЮЩИЙ ИЗОТОНИЧНОСТЬ, ИММУНОГЕННАЯ КОМПОЗИЦИЯ И НАБОР НА Е ОСНОВЕ И СПОСОБ ПРИГОТОВЛЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ Предложены водная адъювантная и иммуногенная композиции, содержащие агонист TLR-4 (Tollподобного рецептора 4) и сапонин в составе липосом, и неионный агент, обеспечивающий изотоничность, где ионная сила адъювантной композиции составляет менее 100 мМ. Также предложен способ приготовления иммуногенной композиции и набор для использования в таком способе, содержащий адъювантную композицию по изобретению. Эндерикс Вероник, Лемуан Доминик Ингрид (BE) Поликарпов А.В. (RU) Область изобретения Настоящее изобретение относится к водным адъювантным композициям, содержащим неионный агент, обеспечивающий изотоничность и имеющим низкие концентрации соли, в частности имеющим концентрацию хлорида натрия 100 мМ или менее. Настоящее изобретение также относится к иммуногенным композициям, содержащим антиген или антигенный препарат и указанные водные адъювантные композиции. Предшествующий уровень техники Адъюванты иногда используют для улучшения иммунного ответа на любой заданный антиген. Тем не менее, включение адъювантов в вакцинную или иммуногенную композицию усложняет приготовление компонентов, а также усложняет распределение и приготовления вакцинной композиции. Разработчик композиции должен учитывать приготовление каждого адъювантного компонента, а также антигенного компонента. В частности, необходимо учитывать совместимость антигенного компонента с адъювантным компонентом. Это особенно необходимо в том случае, когда лиофилизированные антигены или антигенные препараты предназначены для разведения адъювантным препаратом. В этом случае важно,чтобы буфер адъювантного препарата подходил для антигена или антигенного препарата, и чтобы адъювант не затрагивал иммуногенность или растворимость антигена. Краткое изложение сущности изобретения Авторы настоящего изобретения обнаружили, что некоторые антигены особенно чувствительны к явлению, известному как "высаливание", которое может быть определено как осаждение белка из его раствора в результате насыщения солью, такой как хлорид натрия. Авторы настоящего изобретения обнаружили, что чувствительные антигены могут агрегироваться и осаждаться при низкой концентрации хлорида натрия, такой как 150 мМ. Таким образом, согласно настоящему изобретению предложена водная адъювантная композиция,содержащая: (а) агонист TLR-4 (Toll-подобного рецептора 4) и сапонин в составе липосом и (б) неионный агент, обеспечивающий изотоничность, где ионная сила адъювантной композиции составляет менее 100 мМ. Предпочтительно неионный агент, обеспечивающий изотоничность, в водной адъювантной композиции по изобретению представляет собой полиол. Более предпочтительно полиол представляет собой сорбит или сахарозу. Предпочтительно указанный агонист TLR-4 в водной адъювантной композиции по изобретению представляет собой 3D-MPL (3-деацилированный монофосфориллипид А). Предпочтительно указанный сапонин в водной адъювантной композиции по изобретению представляет собой QuilA или его производное. Более предпочтительно производное QuilA представляет собой QS21. Согласно настоящему изобретению также предложена иммуногенная композиция, содержащая антиген или антигенный препарат и водную адъювантную композицию по изобретению. Согласно настоящему изобретению также предложен способ приготовления указанной иммуногенной композиции, включающий стадию разведения лиофилизированной композиции, содержащей по меньшей мере один антиген или антигенный препарат вместе с водной адъювантной композицией по изобретению. Согласно настоящему изобретению также предложен набор для использования в указанном способе приготовления иммуногенной композиции, содержащий (1) лиофилизированную композицию, содержащую антиген или антигенный препарат, и (2) водную адъювантную композицию по изобретению. Предложенная водная изотоническая адъювантная композиция может быть использована для более широкого спектра белковых антигенов, включая антигены, чувствительные к "высаливанию", а также нечувствительные к "высаливанию". Краткое описание графических материалов Фиг. 1. График литической активности QS21. Фиг. 2. Процентное содержание каждого конгенера 3D-MPL (3-деацилированный монофосфориллипид А) в разных композициях ASA (адъювантная система А). Фиг. 3. Цикл сублимационной сушки, использованный для лиофилизации PRAME/CpG. Фиг. 4. Наглядное сравнение PRAME (антиген, преимущественно экспрессирующийся в меланоме) и NYESO-1, разведенных в ASA (150 мМ NaCl) и ASA (сорбит). Фиг. 5. Гуморальный ответ у мышей, иммунизированных PRAME/CpG, приготовленными с различными адъювантными композициями, в эксперименте 1. Фиг. 6. Противоопухолевая защита у мышей, иммунизированных PRAME/CpG, приготовленными с различными адъювантными композициями, в эксперименте 1. Фиг. 7. Гуморальный ответ у мышей, иммунизированных PRAME/CpG, приготовленными с ASA(150 мМ NaCl), ASA (сорбит) или жидкой композицией ASA (70 мМ NaCl), в эксперименте 2. Фиг. 8. CD4+ ответ у мышей, иммунизированных PRAME/CpG, приготовленными с ASA (150 мМNaCl), ASA (сорбит) или жидкой композицией ASA, в эксперименте 2.ASA (150 мМ NaCl), ASA (сорбит) или жидкой композицией ASA, в эксперименте 2. Подробное описание изобретения В настоящем изобретении описана замена или частичная замена агента, обеспечивающего изотоничность, который представляет собой соль, такую как хлорид натрия, в водной адъювантной композиции с неионным агентом, обеспечивающим изотоничность. Общеизвестно, что для парентерального введения растворы должны быть физиологически изотоническими (т.е. иметь фармацевтически приемлемую осмоляльность) во избежание деформации или лизиса клеток. "Агент, обеспечивающий изотоничность" представляет собой соединение, которое является физиологически допустимым и придает композиции (например, иммуногенным композициям по изобретению) подходящую тоничность для предотвращения свободного прохождения воды через клеточные мембраны, находящиеся в контакте с композицией. Известны водные адъювантные композиции, которые содержат 100 мМ хлорида натрия или более,например адъювантная система A (ASA), раскрытая в WO 2005/112991 и WO 2008/142133, или липосомальные адъюванты, раскрытые в WO 2007/068907. Как изложено в WO 2008/142133, такие адъювантные композиции могут быть использованы в качестве разбавителя для разведения лиофилизированных композиций, содержащих антигены или антигенные препараты, перед вакцинацией. Важно, чтобы такие разведенные композиции были изотоническими, т.е. имели концентрацию соли, по существу, такую же,как в клетках организма и крови, чтобы инъекция не вызывала сморщивание или расширение клеток. Как правило, хлорид натрия используют в качестве агента, обеспечивающего изотоничность. Авторы настоящего изобретения обнаружили, что некоторые антигены особенно чувствительны к "высаливанию",представляющему собой процесс, в результате которого белки в растворе агрегируются или коагулируются, когда находятся растворах с высокой концентрацией соли. Концентрация соли, при которой белковые антигены агрегируются, варьирует от белка к белку. Авторы настоящего изобретения идентифицировали группу антигенов, которые агрегируются при относительно низких концентрациях соли, например при концентрации хлорида натрия примерно 100 мМ или менее. Это означает, что некоторые известные адъювантные композиции не подходят для разведения или использования с композициями, содержащими эти антигены, поскольку происходит агрегация. Согласно настоящему изобретению предложены водные адъювантные композиции, которые могут быть использованы с такими антигенами, т.е. антигенами, которые агрегируются при концентрациях соли хлорида натрия менее 100 мМ. Водные адъювантные композиции по изобретению содержат агонистTLR-4 и сапонин в липосомальной композиции и неионный агент, обеспечивающий изотоничность, где концентрация хлорида натрия в адъювантной композиции составляет менее примерно 100 мМ, например менее 90, 80, 70, 60, 50, 40, 30, 20 или 15 мМ. В конкретном воплощении концентрация хлорида натрия в адъювантной композиции составляет менее 10 или 5 мМ или менее. В еще одном конкретном воплощении адъювантная композиция, по существу, не содержит хлорид натрия. "По существу, не содержит" означает, что концентрация хлорида натрия составляет 0 или почти 0 мМ (т.е. 1, 2 или 3 мМ). Специалист в данной области техники легко может определить концентрацию ионов натрия (Na+) и хлорид-ионов (Cl-) с использованием известных методов и наборов. Например, натрий может быть определен с использованием такого набора, как набор для ферментативного анализа на натрий (номер по каталогу: BQ011EAEL) от Biosupply. Хлорид может быть определен с использованием такого набора, как набор для ферментативного анализа на хлорид (номер по каталогу: BQ006EAEL) от Biosupply. Согласно настоящему изобретению предложена также водная изотоническая адъювантная композиция, содержащая агонист TLR-4, и сапонин в липосомальной композиции, и неионный агент, обеспечивающий изотоничность, где ионная сила составляет менее 100 мМ, например менее 90, 80, 70, 60, 50,40, 30, 20 или 15 мМ. В конкретном воплощении ионная сила в адъювантной композиции составляет менее 10 или 5 мМ или менее. В еще одном конкретном воплощении адъювантная композиция обладает ионной силой, которая составляет почти 0 или очень близка к 0 мМ. Ионная сила адъюванта или иммуногенной композиции по изобретению может быть измерена с использованием способов, известных специалистам в данной области техники, например с использованием кондуктометра. Необходимо, чтобы неионный агент, обеспечивающий изотоничность, для использования в водной адъювантной композиции по изобретению, который предназначен для объединения с антигенной композицией, был подходящим для применения у людей, а также совместимым с антигенами в антигенной композиции и совместимым также с другими компонентами адъювантной композиции. В частности, водные адъювантные композиции должны быть такими, чтобы антигены в антигенной композиции, когда они объединены с адъювантной композицией, были способны оставаться в растворе и сохранять свою иммуногенность. В одном из воплощений настоящего изобретения подходящие неионные агенты, обеспечивающие изотоничность, представляют собой полиолы, сахара (в частности, сахарозу, фруктозу, декстрозу или глюкозу) или аминокислоты, такие как глицин. В одном из воплощений полиол представляет собой сахарный спирт, в частности C3-6 сахарный спирт. Примеры сахарных спиртов включают глицерин, эрит-2 024074 рит, трейтол, арабит, ксилит, рибит, сорбит, маннит, дульцит и идит. В конкретном примере этого воплощения подходящий неионный агент, обеспечивающий изотоничность, представляет собой сорбит. В конкретном воплощении изобретения неионный агент, обеспечивающий изотоничность, в композициях по изобретению представляет собой сахарозу и/или сорбит. В одном из воплощений подходящая концентрация полиола в водной адъювантной композиции составляет от примерно 3 до примерно 15% (мас./об.), в частности от примерно 3 до примерно 10%(мас./об.), например от примерно 3 до примерно 7 % (мас./об.), например от примерно 4 до примерно 6%(мас./об.). В качестве конкретного примера этого воплощения полиол представляет собой сорбит. Водная адъювантная композиция содержит агонист Toll-подобного рецептора (TLR) 4 и сапонин в липосомальной композиции. Это означает, что сапонин и агонист TLR-4 приготовлены с липосомами. Термин "липосомы" в общем относится к одно- или многопластинчатым (в частности, 2-, 3-, 4-, 5-,6-, 7-, 8-, 9- или 10-пластинчатым в зависимости от числа образованных липидных мембран) липидным структурам, вмещающим в себя водное содержимое. Липосомы и липосомные композиции известны в данной области. Липиды, которые способны образовывать липосомы, включают все вещества, обладающие жировыми или жироподобными свойствами. Липиды, которые могут составлять липиды в липосомах, могут быть выбраны из группы, включающей в себя глицериды, глицерофосфолипиды, глицерофосфинолипиды, глицерофосфонолипиды, сульфолипиды, сфинголипиды, фосфолипиды, изопренолиды,стероиды, стеарины, стерины, археолипиды, синтетические катионные липиды и углеводсодержащие липиды. В одном из воплощений липосомы содержат фосфолипид. Подходящие фосфолипиды включают(но ими не ограничиваются) фосфохолин (PC), представляющий собой промежуточное соединение в синтезе фосфатидилхолина; природные фосфолипидные производные: яичный фосфохолин, яичный фосфохолин, соевый фосфохолин, гидрогенизированный соевый фосфохолин, сфингомиелин в качестве природных фосфолипидов; и синтетические фосфолипидные производные: фосфохолин (дидеканоил-L-фосфатидилхолин [DDPC], дилауроилфосфатидилхолин [DLPC], димиристоилфосфатидилхолин[DPPE],1,2-дистеароил-sn-глицеро-3 фосфоэтаноламин [DSPE], 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин [DOPE]), фосфосерин, полиэтиленгликоль [PEG] фосфолипид (mPEG-фосфолипид, полиглицерин-фосфолипид, функционализированный фосфолипид, терминально активированный фосфолипид). В одном из воплощений липосомы содержат 1-пальмитоил-2-олеоил-глицеро-3-фосфоэтаноламин. В одном из воплощений используется высокоочищенный фосфатидилхолин, выбранный из группы, состоящей из фосфатидилхолина (яичного),гидрогенизированного фосфатидилхолина (яичного), фосфатидилхолина (соевого), гидрогенизированного фосфатидилхолина (соевого). В еще одном воплощении липосомы содержат фосфатидилэтаноламин[POPE] или его производное. Размер липосомы может варьировать от 30 нм до нескольких микрон в зависимости от фосфолипидной композиции и способа, использованного для ее приготовления. В конкретных воплощениях изобретения размер липосомы находится в диапазоне от 50 до 500 нм и в конкретных воплощениях от 50 до 200 нм. Динамическое лазерное светорассеяние является методом, используемым для измерения размера липосом, известным специалистам в данной области. Подходящие липосомы содержат нейтральный липид, например фосфатидилхолин, который предпочтительно является некристаллическим при комнатной температуре, например фосфатидилхолин яичного желтка, диолеоилфосфатидилхолин (DOPC) или дилаурилфосфатидилхолин. В конкретном воплощении липосомы по настоящему изобретению содержат DOPC. Липосомы также могут содержать заряженный липид, который увеличивает стабильность структуры липосома-сапонин для липосом, состоящих из насыщенных липидов. В этих случаях количество заряженного липида предпочтительно составляет от 1 до 20% (мас./мас.), предпочтительно от 5 до 10%. Соотношение стерина к фосфолипиду составляет от 1 до 50% (мол./мол.), предпочтительно 20 до 25%. Особенно подходящий сапонин для использования в настоящем изобретении представляет собойQuil А и его производные. Quil А представляет собой препарат сапонина, впервые описанный Dalsgaardet al. в 1974 ("Saponin adjuvants", Archiv. fur die gesamte Virusforschung, vol. 44, Springer Verlag, Berlin,p. 243-254) как обладающий адъювантной активностью. Высокоэффективной жидкостной хроматографией (HPLC) выделены очищенные фрагменты Quil A, которые сохраняют адъювантную активность без токсичности, ассоциированной с Quil А (ЕР 0362278), например QS7 и QS21 (также известные как QA7 иQA21). QS-21 представляет собой природный сапонин, выделенный из коры Quillaja saponaria Molina,который индуцирует CD8+ цитотоксические T-клетки (CTL), клетки Th1 и антительный ответ с преобла-3 024074 данием антител lgG2a. В контексте настоящего изобретения QS21 является предпочтительным сапонином. В подходящей форме настоящего изобретения сапониновый адъювант в иммуногенной композиции представляет собой производное Saponaria molina quil А, предпочтительно иммунологически активную фракцию Quil А, такую как QS-17 или QS-21, предпочтительно QS-21. В конкретном воплощении QS21 используют в его менее реактогенной композиции, где он погашен экзогенным стерином, таким как, например, холестерин. Существует несколько конкретных форм менее реактогенных композиций, где QS21 погашен экзогенным холестерином. В конкретном воплощении сапонин/стерин находится в форме липосомной структуры (WO 96/33739, пример 1). Подходящие стерины включают -ситостерин, стигмастерин, эргостерин, эргокальциферол и холестерин. В одном из конкретных воплощений иммуногенная композиция содержит холестерин в качестве стерина. Эти стерины известны в данной области. Например, холестерин раскрыт в Merck Index, 11th Ed.,p. 341, как природный стерин, обнаруженный в животном жире. В тех случаях когда активная фракция сапонина представляет собой QS21, тогда соотношениеQS21:стерин типично составляет от 1:100 до 1:1 (мас./мас.), предпочтительно от 1:10 до 1:1 (мас./мас.) и предпочтительно от 1:5 до 1:1 (мас./мас.). Предпочтительно стерин присутствует в избытке, причем соотношение QS21:стерин составляет по меньшей мере 1:2 (мас./мас.). В одном из воплощений соотношение QS21:стерин составляет 1:5 (мас./мас.). Стерин предпочтительно представляет собой холестерин. Водная адъювантная композиция содержит агонист Toll-подобного рецептора 4 (TLR-4). Под "агонистом TLR" подразумевается компонент, способный вызывать сигнальный ответ через TLR-сигнальный путь, либо напрямую в качестве лиганда, либо опосредовано через образование эндогенного или экзогенного лиганда (Sabroe et al., JI 2003, р. 1630-5). Агонист TLR-4 способен вызывать сигнальный ответ через TLR-4 сигнальный путь. Подходящим примером агониста TLR-4 является липополисахарид, предпочтительно нетоксичное производное липида А, в частности монофосфориллипид А или, более конкретно, 3-деацилированный монофосфориллипид A (3D-MPL). 3D-MPL продается под наименованием MPL от GlaxoSmithKline Biologicals N.A. и упоминается в данном документе как MPL или 3D-MPL (см., например, патенты США 4436727, 4877611, 4866034 и 4912094). 3D-MPL стимулирует главным образом CD4+ Т-клеточные ответы с IFN-g (Th1) фенотипом. 3D-MPL может быть получен способами, раскрытыми в GB 2220211 А. Химически он представляет собой смесь 3-деацилированного монофосфориллипида А с 3, 4, 5 или 6 ацилированными цепями. В композициях по настоящему изобретению для приготовления иммуногенной композиции может быть использован 3D-MPL с небольшим размером частиц. 3D-MPL с небольшим размером частиц имеет такой размер частиц, который позволяет подвергать его стерилизующей фильтрации через фильтр 0,22 мкм. Такие препараты описаны в WO 94/21292. Предпочтительно для приготовления иммуногенных композиций по настоящему изобретению используют порошкообразный 3D-MPL. Другими агонистами TLR-4, которые могут быть использованы, являются алкилглюкозаминидфосфаты (AGP), например агонисты, раскрытые в WO 98/50399 или в патенте США 6303347 (где также раскрыты способы получения AGP), предпочтительно RC527 или RC529, или фармацевтически приемлемые соли AGP, которые раскрыты в патенте США 6764840. Некоторые AGP являются агонистамиTLR-4, и некоторые агонисты являются антагонистами TLR-4. Считается, что и те, и другие полезны в качестве иммуностимуляторов. Другими подходящими агонистами TLR-4 являются агонисты, раскрытые в WO 2003/011223 и вWO 2003/099195, такие как соединение I, соединение II и соединение III, раскрытые на с. 4-5 вWO 2003/011223 как ER803022, ER803058, ER803732, ER804053, ER804057m ER804058, ER804059,ER804442, ER804680 и ER804764. Например, один из подходящих агонистов TLR-4 представляет собойER804057. Водные адъювантные композиции по изобретению содержат и сапонин, и агонист TLR4. В конкретном примере водная адъювантная композиция содержит QS21 и 3D-MPL. Агонист TLR-4, такой как липополисахарид, например 3D-MPL, может быть использован в количествах от 1 до 100 мкг на дозу иммуногенной композиции для человека. 3D-MPL может быть использован в количестве примерно 50 мкг, например от 40 до 60 мкг, предпочтительно от 45 до 55 мкг, или от 49 до 51 мкг, или 50 мкг. В еще одном воплощении доза иммуногенной композиции для человека содержит 3D-MPL в количестве примерно 25 мкг, например от 20 до 30 мкг, предпочтительно от 21 до 29 мкг, или от 22 до 28 мкг, или от 28 до 27 мкг, или от 24 до 26 мкг, или 25 мкг. Сапонин, такой как QS21, может быть использован в количествах от 1 до 100 мкг на дозу иммуногенной композиции для человека. QS21 может быть использован в количестве примерно 50 мкг, например 40-60 мкг, предпочтительно от 45 до 55 мкг, или от 49 до 51 мкг, или 50 мкг. В еще одном воплощении доза иммуногенной композиции для человека содержит QS21 в количестве примерно 25 мкг, например от 20 до 30 мкг, предпочтительно от 21 до 29 мкг, или от 22 до 28 мкг, или от 28 до 27 мкг, или от 24 до 26 мкг, или 25 мкг. В тех случаях когда как оба агонист TLR-4 и сапонин присутствуют в иммуногенной композиции,тогда подходящее массовое соотношение агониста TLR-4 к сапонину составляет от 1:5 до 5:1, предпочтительно 1:1. Например, когда 3D-MPL присутствует в количестве 50 или 25 мкг, тогда QS21 также может присутствовать в количестве соответственно 50 или 25 мкг на дозу иммуногенной композиции для человека. Когда адъювант объединен с жидкой формой антигенной композиции, тогда адъювантная композиция будет находиться в подходящем объеме дозы для людей, который составляет приблизительно половину от конечного объема дозы, предназначенного для людей, например объем 500 мкл адъюванта для конечной дозы для людей 1 мл или объем 250 мкл для конечной дозы для людей 0,5 мл. Адъювантную композицию разбавляют при объединении с композицией антигена с получением конечной дозы вакцины для людей. Конечный объем такой дозы будет, разумеется, варьировать в зависимости от исходного объема адъювантной композиции и объема антигенной композиции, добавляемой к адъювантной композиции. В альтернативном воплощении водный адъювант используют для разведения лиофилизированной антигенной композиции. В этом воплощении подходящий объем адъювантной композиции в дозе для людей приблизительно равен конечному объему дозы для людей. Жидкую адъювантную композицию добавляют во флакон, содержащий лиофилизированную антигенную композицию, и используют для разведения лиофилизированной антигенной композиции. Таким образом, в настоящем изобретении предложен способ приготовления иммуногенной композиции, включающий стадии разведения лиофилизированной композиции, содержащей по меньшей мере один описанный здесь антиген или антигенный препарат с водной адъювантной композицией, как определено в данном описании. В еще одном воплощении изобретения предложен набор, содержащий (1) лиофилизированную композицию, содержащую антиген или антигенный препарат, и (2) описанную здесь водную адъювантную композицию. В конкретном воплощении изобретения предложен набор, содержащий (1) лиофилизированную композицию, содержащую описанный здесь антиген или антигенный препарат, и (2) описанную здесь водную адъювантную композицию. В одном из воплощений лиофилизированная композиция дополнительно содержит агонист TLR-9,например, как изложено в WO 2008/142133. В альтернативном воплощении предложен набор, где CpG не лиофилизирован совместно с антигеном. CpG может быть либо смешанным с водной адъювантной композицией, либо может находиться в отдельном флаконе в водной или лиофилизированной форме. Соответственно, в альтернативном воплощении предложен набор, содержащий (1) лиофилизированную композицию, содержащую описанный здесь антиген; (2) водную адъювантную композицию и (3) агонист TLR9 (например, иммуностимулирующий CpG олигонуклеотид). Агонист TLR9 для применения в наборах по изобретению представляет собой иммуностимулирующий олигонуклеотид, в частности олигонуклеотид, содержащий неметилированный мотив CpG. Такие олигонуклеотиды общеизвестны и описаны, например, в WO 96/02555, WO 99/33488 и US 5865462. Подходящие агонисты TLR9 для применения в описанных здесь иммуногенных композициях представляют собой олигонуклеотиды, содержащие CpG, возможно содержащие два или более динуклеотидных мотивов CpG, отделенных друг от друга по меньшей мере тремя, предпочтительно по меньшей мере шестью или более нуклеотидами. МотивCpG представляет собой цитозиновый нуклеотид, за которым следует гуаниновый нуклеотид. В одном из воплощений межнуклеотидная связь в олигонуклеотиде представляет собой фосфородитиоатную или, возможно, фосфоротиоатную связь, хотя также могут быть использованы фосфодиэфирные и другие межнуклеотидные связи, включая олигонуклеотиды со смешанными межнуклеотидными связями. Способы получения фосфоротиоатных или фосфородитиоатных олигонуклеотидов описаны в US 5666153, US 5278302 и WO 95/26204. Предусмотрен олигонуклеотид, содержащий разные межнуклеотидные связи, например смешанные фосфоротиоатные фосфодиэфиры. Могут быть использованы другие межнуклеотидные связи, которые стабилизируют олигонуклеотид. Примеры CpG олигонуклеотидов, подходящих для включения в описанные здесь иммуногенные композиции, имеют указанные ниже последовательности. В одном из воплощений эти последовательности содержат фосфоротиоат-модифицированные межнуклеотидные связи. Альтернативные CpG олигонуклеотиды могут содержать вышеуказанные последовательности, в которых они имеют незначительные делеции или добавки. Согласно настоящему изобретению предложена также иммуногенная композиция, содержащая антиген или антигенный препарат и описанную здесь водную адъювантную композицию, где указанная иммуногенная композиция имеет концентрацию хлорида натрия менее примерно 100 мМ, например менее 90, 80, 70, 60, 50, 40, 30, 20 или 15 мМ. В конкретном воплощении концентрация хлорида натрия в иммуногенной композиции составляет менее 10 или примерно 5 мМ или менее. В еще одном конкретном воплощении иммуногенная композиция, по существу, не содержит хлорид натрия. "По существу, не содержит" означает, что концентрация хлорида натрия составляет 0 или почти 0 мМ. Согласно настоящему изобретению предложена также иммуногенная композиция, содержащая антиген или антигенный препарат и описанную здесь водную адъювантную композицию, где ионная сила иммуногенной композиции составляет менее 100 мМ, например менее 90, 80, 70, 60, 50, 40, 30, 20 или 15 мМ. В конкретном воплощении ионная сила в иммуногенной композиции составляет менее 10 или 5 мМ или менее. В еще одном конкретном воплощении иммуногенная композиция имеет ионную силу,которая составляет 0 или почти 0 мМ. Понятно, что если иммуногенная композиция приготовлена с использованием лиофилизированной антигенной композиции, содержащей агонист TLR-9, то иммуногенная композиция также содержит агонист TLR-9. Таким образом, в одном из воплощений предложена иммуногенная композиция, содержащая антиген или антигенный препарат, агонист TLR9 и агонист TLR-4 и сапонин в липосомальной композиции, где иммуногенная композиция имеет концентрацию соли менее примерно 100 мМ, например менее 90, 80, 70, 60, 50, 40, 30, 20 или 15 мМ. В конкретном примере этого воплощения концентрация хлорида натрия в иммуногенной композиции составляет менее 10 или примерно 5 мМ или менее. В еще одном воплощении предложена иммуногенная композиция, содержащая антиген или антигенный препарат, агонист TLR9 и агонист TLR-4 и сапонин в липосомальной композиции, где ионная сила составляет менее 100 мМ, например менее 90, 80, 70, 60, 50, 40, 30, 20 или 15 мМ. В конкретном воплощении ионная сила в иммуногенной композиции составляет менее 10 или 5 мМ или менее. В еще одном конкретном воплощении иммуногенная композиция имеет ионную силу, которая составляет 0 или почти 0 мМ. В еще одном воплощении предложена иммуногенная композиция, содержащая антиген или антигенный препарат, агонист TLR9 и 3D-MPL и QS21 в липосомальной композиции, где иммуногенная композиция имеет концентрацию соли менее примерно 100 мМ, например менее 90, 80, 70, 60, 50, 40, 30, 20 или 15 мМ. В конкретном примере этого воплощения концентрация хлорида натрия в иммуногенной композиции составляет менее 10 или примерно 5 мМ или менее. В еще одном воплощении предложена иммуногенная композиция, содержащая антиген или антигенный препарат, агонист TLR9 и 3D-MPL и QS21 в липосомальной композиции, где ионная сила составляет менее 100 мМ, например менее 90, 80, 70, 60, 50, 40, 30, 20 или 15 мМ. В конкретном воплощении ионная сила в иммуногенной композиции составляет менее 10 или 5 мМ или менее. В еще одном конкретном воплощении иммуногенная композиция обладает ионной силой, которая составляет 0 или почти 0 мМ. В еще одном воплощении предложена иммуногенная композиция, содержащая антиген или антигенный препарат и 3D-MPL и QS21 в липосомальной композиции и CpG олигонуклеотид, где иммуногенная композиция имеет концентрацию соли менее примерно 50 мМ, например менее примерно 40, 30,20 или 15 мМ. В конкретном примере этого воплощения концентрация хлорида натрия в иммуногенной композиции составляет менее 10 или 5 мМ или менее. В одном из воплощений антиген или антигенный препарат, используемый в иммуногенной композиции, представляет собой любой антиген, который осаждается, коагулируется или агрегируется после его смешивания и/или растворения в растворе, имеющем концентрацию хлорида натрия более 50, 60, 70,80, 90 или 100 мМ. В одном из воплощений антиген или антигенный препарат, используемый в иммуногенных композициях по изобретению, представляет собой любой антиген, который осаждается, коагулируется или агрегируется после смешивания и/или растворения в растворе, где ионная сила составляет менее 100 мМ,например менее 90, 80, 70, 60, 50, 40, 30, 20, 15 или 10 мМ. В конкретном воплощении антигены по изобретению осаждаются, коагулируются или агрегируются в растворах с ионной силой 5 мМ или менее. Специалист в данной области может определить, соответствует ли антиген этому определению, путем растворения и/или смешивания антигена в таком растворе. Антиген, который не соответствует этому определению, еще будет находиться в растворе, т.е. жидкость еще будет прозрачной без осаждения, в течение 24 ч после растворения. Антиген, который осаждается, коагулируется или агрегируется после смешивания и/или растворения в растворе, можно увидеть визуально по осаждению и мутности раствора. Дополнительно, агрегация, которая не обнаруживается визуально, может быть обнаружена известными специалисту методами, которые включают SEC-HPLC (эксклюзионная высокоэффективная жидкостная хроматография), но не ограничиваются этим методом. В еще одном воплощении антиген или антигенный препарат происходит из HIV (вирус иммунодефицита человека), Neisseria meningitidis, или представляет собой опухолеспецифический антиген. В конкретном воплощении опухолеспецифический антиген выбран из PRAME или NYESO-1 или его фрагмен-6 024074PRAME (также известный как DAGE) представляет собой антиген, который может быть использован в качестве опухолеспецифического антигена по настоящему изобретению. Антиген и его препарат описаны в патенте США 5830753. PRAME можно найти в Annotated Human Gene Database H-Inv DB под номерами доступа: U65011.1, BC022008.1, AK129783.1, BC014974.2, CR608334.1, AF025440.1,CR591755.1, BC039731.1, CR623010.1, CR611321.1, CR618501.1, CR604772.1, CR456549.1 и CR620272.1. Также могут быть использованы слитые белки, содержащие антиген PRAME. Может быть использован PRAME или его фрагмент или производное, возможно в форме слитого белка с гетерологичным партнером слияния. В частности, антиген PRAME предпочтительно может быть использован в форме слитого белка с белком D Haemophilus influenzae В, или его фрагментом, или его производным. Фрагмент белка D, который может быть использован, предпочтительно не включает секреторную последовательность или сигнальную последовательность. Предпочтительно белок-партнер слияния содержит аминокислоты Met-Asp-Pro на N-конце или в пределах N-конца последовательности слитого белка, где белок-партнер слияния не включает секреторную последовательность или сигнальную последовательность белка D. Например, белок-партнер слияния может содержать или состоять из приблизительно или точно аминокислот с 17 по 127, с 18 по 127, с 19 по 127 или с 20 по 127 белка D. Подходящие антигены PRAME на основе слитых белков с белком D описаны в WO 2008/087102, полное содержание которой включено в данное описание посредством ссылки.NY-ESO-1 представляет собой еще один антиген, который может быть использован в качестве опухолеспецифического антигена по настоящему изобретению. Может быть использован NY-ESO-1, или его фрагмент, или производное, возможно в форме слитого белка с гетерологичным партнером слияния.NY-ESO-1 описан в US 5804381, полнее содержание которого включено в данное описание посредством ссылки. Белок NY-ESO-1 имеет длину приблизительно 180 аминокислот и может быть описан как состоящий из трех областей: (а) N-концевой области, состоящей из аминокислот примерно 1-70; (б) центральной области, состоящей из аминокислот 71-134; и (в) С-концевой области, состоящей из аминокислот 135-180. NY-ESO-1 может быть использован в качестве слитого белка, например в качестве слитого белка с LAGE-1, который представляет собой дополнительный СТ антиген, или его фрагментом (см.WO 2008/089074, полное содержание которой включено в данное описание посредством ссылки). При использовании фрагментов NY-ESO-1 эти фрагменты предпочтительно включают один или более эпитопов МНС (главный комплекс гистосовместимости) класса 1 или класса 2, например фрагменты, известные как A31, DR1, DR2, DR4, DR7, DP4, В 35, В 51, Cw3, Cw6 и A2 (см. WO 2008/089074). Еще один антиген, который может быть использован в соответствии с настоящим изобретением,хотя он по сути не чувствителен к NaCl, представляет собой антиген MAGE, например антиген семействаMAGE-3, такой как MAGE-A3. Например, антигены MAGE-3 описаны как подходящие для приготовления в комбинации с NY-ESO-1 (см. WO 2005/105139, полное содержание которой включено в данное описание посредством ссылки). Антигены MAGE, такие как MAGE-A3, можно использовать сами по себе или в форме производного, например химически модифицированного производного, и/или в форме слитого белка с гетерологичным партнером слияния. Например, антиген MAGE может содержать восстановленные дисульфидные мостики с образованием свободных тиолов, которые дериватизированы, например, карбоксамидными или карбоксиметильными группами (см. WO 99/40188, полное содержание которой включено в данное описание посредством ссылки). В частности, антигены MAGE предпочтительно могут быть использованы в форме слитого белка с белком D Haemophilus influenzae В, или его фрагментом, или его производным. Например, приблизительно первая треть белка D или N-концевые 100-110 аминокислот белка D могут быть использованы в качестве партнера слияния (см. WO 99/40188). В еще одном воплощении антиген или антигенная композиция может представлять собой производное любого из описанных здесь антигенов. Используемый здесь термин "производное" относится к антигену, который модифицирован относительно его природной формы. Производные по настоящему изобретению достаточно сходны с нативными антигенами, чтобы сохранять антигенные свойства и способность вызывать иммунный ответ против природного антигена. Чтобы определить, вызывает ли данное производное такой иммунный ответ, можно использовать подходящий иммунологический анализ,такой как твердофазный иммуноферментный анализ (ELISA) или проточная цитометрия. Используемый здесь термин "фрагмент" относится к фрагментам опухолеспецифического антигена или производного этого антигена, которые содержат по меньшей мере один эпитоп, например эпитопCTL (цитотоксических Т-лимфоцитов), как правило, пептид по меньшей мере из 8 аминокислот. Фрагменты по меньшей мере из 8, например 8-10 аминокислот или длиной вплоть до 20, 50, 60, 70, 100, 150 или 200 аминокислот считаются входящими в объем изобретения, если фрагмент демонстрирует антигенность, т.е. если фрагмент сохраняет основные эпитопы (например, эпитопы CTL), и этот фрагмент способен индуцировать иммунный ответ, который перекрестно реагирует с природным опухолеспецифическим антигеном. Иллюстративными фрагментами могут быть фрагменты длиной 8-10, 10-20, 20-50,50-60, 60-70, 70-100, 100-150, 150-200 аминокислотных остатков (включая любое значение в этих диапазонах). Согласно настоящему изобретению предложена описанная здесь иммуногенная композиция для применения в медицине, в частности в лечении и/или предупреждении заболевания. Согласно настоящему изобретению предложена также описанная здесь иммуногенная композиция для применения в иммунотерапевтическом лечении рака. В конкретных примерах этого воплощения изобретения предложена описанная здесь иммуногенная композиция для применения в иммунотерапевтическом лечении одного или более видов рака, выбранных из группы, состоящей из рака предстательной железы, рака молочной железы, колоректального рака,рака легкого, рака поджелудочной железы, рака почки, рака яичника или меланомы. Согласно настоящему изобретению предложен способ лечения или профилактики рака у индивидуума, нуждающемся в таком лечении или профилактике, включающий стадию введения указанному индивидууму эффективного количества описанной здесь иммуногенной композиции. В конкретных примерах этого воплощения изобретения предложен способ лечения или профилактики рака, выбранного из группы, состоящей из рака предстательной железы, рака молочной железы,колоректального рака, рака легкого, рака поджелудочной железы, рака почки, рака яичника или меланомы. Настоящее изобретение далее дополнительно иллюстрируется примерами, не ограничивающими его объем. Примеры Пример 1. Приготовление адъювантной композиции ASA (сорбит). Готовили адъювантную композицию, содержащую 3-деацилированный MPL и QS21 в липосомальной композиции. Ее готовили следующим образом. А. Способ получения липосом. Смесь липида (такого как синтетический фосфатидилхолин), холестерина и 3-O-деацилированногоMPL в органическом растворителе высушивали в вакууме. Затем добавляли водный раствор (такой как забуференный фосфатом физиологический раствор [100 мМ NaCl, 20 мМ фосфата pH 6,1]) и сосуд встряхивали до тех пор, пока не образовалась суспензия липида. Эту суспензию затем предварительно гомогенизировали с использованием смесителя с высоким усилием сдвига и затем гомогенизировали при высоком давлении до тех пор, пока размер липосом, который измеряли методом DLS (динамическое светорассеяние), не уменьшился до примерно 9010 нм. Липосомы затем подвергали стерилизующей фильтрации. Б. Приготовление композиции ASA. Стадия 1. Разведение концентрированных липосом.Na2/K фосфатный буфер 100 мМ pH 6,1, разведенный в 10 раз, добавляли в воду для инъекций до достижения концентрации фосфатного буфера в конечной композиции 10 мМ. Затем добавляли 30%-ный(мас./об.) раствор сорбита в воде для инъекций (WFI) до достижения концентрации 4,7% в конечной композиции. Эту композицию перемешивали в течение 15-45 мин при комнатной температуре. Концентрированные липосомы (изготовленные из DOPC (1,2-диолеил-sn-глицеро-3-фосфохолин),холестерина и MPL, 40, 10 и 2 мг/мл соответственно) затем добавляли в смесь до достижения концентрации 100 мкг/мл MPL в конечной композиции. Смесь затем перемешивали в течение 15-45 мин при комнатной температуре. Стадия 2. Добавление QS21. Используя перистальтический насос, исходный QS21 (оттаявший в течение 24 ч при к.т. (комнатная температура) или в течение 2 суток при 4C для 200 мл) добавляли со скоростью 200 мл/мин к разведенным липосомам при перемешивании с использованием магнитной мешалки до достижения концентрации 100 мкг/мл в конечной композиции. Смесь перемешивали в течение 15-45 мин. Конечная композиция ASA содержала 100 мкг MPL/мл и 100 мкг QS21/мл. Стадия 3. Измеренное значение pH составляло 6,10,3. Стадия 4. Стерилизующая фильтрация. Стерилизующую фильтрацию осуществляли при постоянной скорости 400 мл/мин на полиэфирсульфоновом (PES) фильтре от PALL Corporation. Стадия 5. Хранение при температуре от 2 до 8C. Полученную адъювантную композицию, содержащую 3-O-деацилированный MPL и QS21 в липосомальной композиции и содержащую сорбит (обозначенную ASA (сорбит, затем хранили при 4C. Пример 2. Приготовление адъювантной композиции ASA (150 мМ NaCl). А. Способ получения липосом. Смесь липида (такого как синтетический фосфатидилхолин), холестерина и 3-деацилированногоMPL (3D-MPL) в органическом растворителе высушивали в вакууме. Затем добавляли физиологический забуференный фосфатами раствор и сосуд встряхивали до тех пор, пока весь липид не оказался в суспензии. Эту суспензию затем предварительно гомогенизировали с использованием смесителя с высоким усилием сдвига и затем гомогенизировали при высоком давлении до тех пор, пока размер липосом, который измеряли методом DLS, не уменьшился примерно до 9010 нм. Липосомы затем подвергали стери-8 024074 лизующей фильтрации на мембране PES 0,22 мкм. В. Приготовление композиции ASA. Стадия 1. Разведение концентрированных липосом.Na2/K фосфатный буфер 100 мМ pH 6,45, разведенный в 10 раз, и NaCl 1,5 М добавляли к воде для инъекций до достижения соответственно концентраций 10 мМ фосфата и NaCl 150 мМ в конечной композиции. Эту смесь перемешивали в течение 5 мин при комнатной температуре. Концентрированные липосомы (изготовленные из DOPC, холестерина и MPL, 40, 10 и 2 мг/мл соответственно) затем добавляли к смеси до достижения концентрации 100 мкг/мл MPL в конечной композиции. Смесь затем перемешивали в течение 5-15 мин при комнатной температуре. Стадия 2. Добавление QS21. Исходный QS21 (оттаявший в течение 24 ч при к.т. или в течение 2 суток при 4C для 200 мл) добавляли к разведенным липосомам при перемешивании с использованием магнитной мешалки до достижения концентрации 100 мкг/мл в конечной композиции. Смесь перемешивали при к.т. Стадия 3. Измеренное значение pH составляло 6,10,3. Стадия 4. Стерилизующая фильтрация. Стерилизующую фильтрацию осуществляли на полиэфирсульфоновом (PES) фильтре от PALLCorporation. Стадия 5. Хранение при температуре от 2 до 8C. Конечная композиция ASA представляла собой 2 мг DOPC, 500 мкг холестерина, 100 мкг 3-O-деацилированного MPL, 100 мкг QS21 на 1 мл. Пример 3. Литическая активность QS21. Известно, что QS21 лизирует эритроциты (RBC). Адъювантную композицию ASA (сорбит), приготовленную, как описано в примере 1, тестировали, чтобы убедиться в том, что литическая активностьQS21 гасится так же, как можно наблюдать с использованием эквивалентной адъювантной композиции,содержащей 150 мМ NaCl (ASA (150 мМ NaCl. Литическую активность QS21 измеряли гемолитическим анализом с использованием эритроцитов(RBC) цыплят. RBC центрифугировали при 550 g при 4C. Супернатант удаляли. Осадок тщательно ресуспендировали в буфере PBS (забуференный фосфатами физиологический раствор) до достижения начального объема, и такую же операцию повторяли до исчезновения красной окраски супернатанта (как правило трижды). Осадок хранили при 4C в течение максимум 3-4 суток, если его не использовали сразу же (и вновь промывали в день использования), или разводили примерно в 10 раз в буфере, если использовали в тот же день. Непосредственно перед использованием готовили серию доз QS21 в буфере для ASA (в солевом или в сорбитном буфере в зависимости от тестируемого образца ASA) и готовили образцы адъюванта(содержащие эквивалент 50 или 90 мкг QS21, что означает эквивалент 500 или 900 мкл ASA). Конечный объем доводили до 900 мкл в стандартах и образцах соответствующим буфером (содержащим или не содержащим сорбит в зависимости от буфера тестируемого образца). Опалесценция ASA влияет на оптическую плотность (OD). Готовили "пустые контрольные образцы" ASA, и их OD вычитали из OD тестируемых образцов ASA. Эти пустые контрольные образцы имели тот же самый объем ASA, как и объем тестируемых образцов, но доведенный до 1 мл буфером. В эти пустые контрольные образцы RBC не добавляли. Стандарты и образцы затем инкубировали с RBC (100 мкл разведенных RBC добавляли к 900 мкл стандартов и образцов) в течение 30 мин при комнатной температуре (к.т.). Образцы затем центрифугировали в течение 5 мин при 900g. После центрифугирования измеряли оптическую плотность при 540 нм. Определение литической активности проводили тестированием на предельное содержание. 1. Предел обнаружения (LOD) определяли как наименьшую концентрацию QS21, приводящую кOD: выше базового уровня (OD0,1),примерно в три раза выше, чем OD буфера ("0 мкг" QS21),в восходящей части кривой,определенной для каждого теста. 2. Литическая активность QS21 удерживалась положительной в адъювантных образцах, если OD для адъювантного образца была больше, чем ODLOD. Пример кривой QS21. Предел обнаружения в этом анализе составляет 0,9 мкг QS21 и OD 0,12. Гашение QS21 в адъювантной композиции, содержащей 150 мМ хлорида натрия, оценивали как составляющее более 98,2% для протестированного эквивалента 50 мкг QS21. В случае тестирования эквивалента 90 мкг гашение составляет более 99%. Гашение QS21 затем сравнивали с эквивалентной адъювантной композицией, содержащей сорбит и только 5 мМ хлорида натрия. Данные получали после хранения ASA при 4C или после ускоренной стабилизации (7 суток при 37C). Для ASA в сорбите построение стандартной кривой осуществляли с QS21 в буфере, содержащем сорбит. Тестировали эквивалент 50 мкг QS21, за исключением , когда тестировали эквивалент 90 мкг QS21. Вывод: QS21 адекватно гасится в буфере с низким содержанием хлорида натрия. Пример 4. Конгенеры MPL. С химической точки зрения 3D-MPL представляет собой смесь 3-деацилированного монофосфориллипида А с 4, 5 или 6 ацилированными цепями. Каждая отдельная молекула 3D-MPL называется конгенером. Важно, чтобы композиция конгенеров молекул оставалась постоянной без изменения соотношения конгенеров. Также важно, чтобы любой используемый буфер обеспечивал такую же композицию конгенеров, как в концентрированных липосомах, использованных для приготовления адъювантной композиции. Как показано на фиг. 2, композицию конгенеров исследовали в 3D-MPL концентрированных липосомах (конц. липосомы LIP07-217, первый столбец на фиг. 2), адъювантной композиции, содержащей 3D-MPL липосомы и QS21 в буфере 150 мМ NaCl (адъювант 150 мМ NaCl, или ASA (150 мМ NaCl), второй столбец), и адъювантной композиции, содержащей 3D-MPL липосомы и QS21 в сорбите и буфере 5 мМ NaCl (адъювант сорбит, или ASA (сорбит), столбцы 3-7). Композицию конгенеров также исследовали в двух партиях адъюванта ASA (сорбит) на 0 и 7 сутки после приготовления и выдержки при 37C, чтобы убедиться в том, что с течением времени изменений нет (см. последние четыре столбца на фиг. 2). Относительное распределение тетра-, пента- и гексаацилированных конгенеров MPL в концентрированных липосомах или образцах ASA (сорбит) определяли методом IP-HPLC-Fluo детекции (ионпарная высокоэффективная жидкостная хроматография с флуоресцентной детекцией) (ARD). И стандарты, и образцы дериватизировали дансилгидразином, который вводит флуоресцентно-активный хромофор на дисахаридный скелет. Дериватизированные образцы анализировали на обращенно-фазовой колонкеC18 с использованием гидроксида тетрабутиламмония (ТВАОН) в качестве ион-парного реагента. Конгенеры, содержащие одинаковое количество жирных ацильных групп, элюировали отдельными группами(тетраацил, пентаацил и гексаацил). Распределение конгенеров определяли путем сравнения площади пика каждой группы с общей площадью пиков всех конгенеров MPL. На фиг. 2 представлено процентное содержание каждого конгенера. Не обнаружено никакого значимого различия в композиции конгенеров между адъювантными буферами, и композиция родственных молекул была согласующейся с течением времени в сорбитном буфере. Пример 5. Приготовление композиций, использованных в примерах. 5.1. Приготовление PRAME с CpG (CpG 2006 использован во всех примерах). 5.1.1. Приготовление PRAME с CpG с ASA (150 мМ NaCl) для использования в примерах 6 и 7 в экспериментах 1 и 2. 30%-ный (мас./об.) раствор сахарозы (приготовленной в воде для инъекций) добавляли в воду для инъекций до достижения концентрации сахарозы 5%. Буфер Tris-HCl 100 мМ pH 9,5 затем добавляли до достижения концентрации Tris-буфера 75 мМ. Затем добавляли боратный буфер 100 мМ pH 9,8 до достижения концентрации боратного буфера 5 мМ. Затем добавляли 10%-ный (мас./об.) раствор Poloxamer 188 (приготовленный в воде для инъекций) до достижения концентрации 0,313%. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 5 мин при к.т. Затем добавляли раствор CpG в концентрации примерно 20 мг/мл (в воде для инъекций) до достижения концентрации 1050 мкг/мл в конечной композиции. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 5 мин при к.т. Затем добавляли антиген PRAME до достижения концентрации белка 1250 мкг/мл. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 15 мин при к.т. Измеряли pH (9,51). Полученную смесь по 0,5 мл заполняли в стеклянные флаконы емкостью 3 мл, затем подвергали сублимационной сушке. Фиг. 3 иллюстрирует цикл сублимационной сушки, использованный для PRAME (продолжительность 40 ч). Полученный после лиофилизации остаток разводили 625 мкл водной адъювантной композиции,приготовленной, как описано в примере 2, содержащей 150 мМ NaCl. Остаток после лиофилизации содержал 1,25-кратный избыток дозы антигена, чтобы иметь нужное соотношение антиген/адъювант после разведения конечной композицией 16 мМ Tris, 4 мМ бората, 4% сахарозы, 0,24% Poloxamer 188,840 мкг/мл CpG и 1000 мкг/мл PRAME. 5.1.2. Приготовление PRAME с CpG для "жидкой композиции" (70 мМ NaCl) для эксперимента 1 примера 7. Концентрированный адъювантный препарат.PBS, модифицированный, 10-кратно концентрированный, pH 6,1, разведенный в 10 раз, добавляли в воду для инъекций до достижения 1-кратно концентрированного буфера в конечной композиции. Предварительно смешанный раствор, приготовленный из липосом и QS21, предварительно разведенного до 400 мкг/мл, готовили отдельно. Предварительную смесь перемешивали с использованием магнитной мешалки в течение 15 мин при комнатной температуре. Концентрированные липосомы, используемые в предварительной смеси, изготовлены из 40 мг/мл DOPC, 10 мг/мл холестерина и 2 мг/мл 3-деацилированного MPL. Предварительную смесь добавляли к PBS до достижения концентрации MPL 200 мкг/мл и концентрации QS21 200 мкг/мл в конечной композиции. Смесь перемешивали с использованием магнитной мешалки в течение 15-30 мин при к.т. Затем добавляли CpG примерно 23 мг/мл до достижения конечной концентрации 1680 мкг/мл. Смесь перемешивали с использованием магнитной мешалки в течение 15-30 мин при к.т. Измеренный pH составлял 6,10,1. ASA фильтровали на PES фильтре 0,22 мкм и хранили при 4C до применения. Конечная композиция. Сахарозу 25%, борат 25 мМ pH 9,8 и Lutrol 10% добавляли к WFI до достижения соответственно 9,25%, 5 мМ и 0,24% в конечной композиции. Добавляли 2-кратно концентрированный препарат ASA + CpG с получением в результате 1-кратной концентрации в конечной композиции. Смесь перемешивали в течение 5 мин при к.т. Затем добавляли антиген PRAME в сахарозе 3,15%, борат 5 мМ и смесь перемешивали в течение 5 мин при к.т. 5.1.3. Приготовление PRAME с CpG для "жидкой композиции" для эксперимента 2 примера 7. Концентрированный адъювантный препарат.ASA для жидкой композиции готовили, как описано ниже. Фосфатный буфер 1 М (pH 6,1 после 100-кратного разведения) добавляли при перемешивании с использованием магнитной мешалки к WFI до достижения 45 мМ конечной концентрации с учетом концентрации фосфата 50 мМ в концентрированных липосомах. Сорбит 35% затем добавляли до достижения конечной концентрации 21,15%. Кон- 11024074 центрированные липосомы, изготовленные из 40 мг/мл DOPC, 10 мг/мл холестерина и 2 мг/мл 3-деацилированного MPL, добавляли к смеси до достижения конечной концентрации MPL 450 мкг/мл.QS21 (в концентрации примерно 5000 мкг/мл) добавляли до достижения конечной концентрации QS21 450 мкг/мл. Смесь перемешивали в течение 15 мин при к.т. Измеряли pH и доводили до pH 6,10,1. Конечная концентрация в этом ASA составляла соответственно 450 мкг/мл для MPL, 450 мкг/мл для QS21,45 мМ для фосфата, 22,5 мМ для NaCl, 21,15% для сорбита. Конечная композиция. 30%-ный (мас./об.) раствор сахарозы (приготовленный в воде для инъекций) добавляли в воду для инъекций до достижения концентрации сахарозы 4% в конечной композиции. Буфер Tris-HCl 1M pH 9,0 затем добавляли до достижения концентрации Tris-буфера в конечной композиции 16 мМ. Затем добавляли боратный буфер 100 мМ pH 9,8 до достижения концентрации боратного буфера в конечной композиции 4 мМ. Затем добавляли 10%-ный (мас./об.) раствор Poloxamer 188 (приготовленный в воде для инъекций) до достижения концентрации 0,24% в конечной композиции. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 5 мин при к.т. Раствор CpG в концентрации примерно 20 мг/мл (в воде для инъекций) затем добавляли до достижения концентрации 840 мкг/мл в конечной композиции. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 5 мин при к.т. Затем добавляли буфер для антигена PRAME (борат 5 мМ-сахароза 3,15% pH 9,8) до достижения концентрации антигена PRAME 1000 мкг/мл. Антиген PRAME затем добавляли до достижения концентрации белка 8 мкг/мл в конечной композиции. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 15 мин при к.т. 4,5-кратно концентрированную ASA в сорбите добавляли до достижения конечных концентраций 100 мкг/мл MPL и QS21. Измеряли pH (8,0). 5.1.4. Приготовление PRAME с CpG для ASA (сорбит) и ASA (сахароза) для эксперимента 1 примера 7. 30%-ный (мас./об.) раствор сахарозы (приготовленный в воде для инъекций) добавляли в воду для инъекций до достижения концентрации сахарозы в композиции 5%, затем добавляли боратный буфер 100 мМ pH 9,8 до достижения концентрации боратного буфера в этой композиции 5 мМ, затем добавляли буфер Tris-HCl 100 мМ pH 9,0, разведенный 20-кратно, до достижения концентрации Tris-буфера в этой композиции 5 мМ. Затем добавляли 10%-ный (мас./об.) раствор Poloxamer 188 (приготовленный в воде для инъекций) до достижения концентрации в композиции 0,3%. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 5 мин при к.т. Затем добавляли раствор CpG в концентрации примерно 20 мг/мл (в воде для инъекций) до достижения концентрации 1050 мкг/мл в композиции. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 5 мин при к.т. Затем добавляли антиген PRAME до достижения концентрации белка 1250 мкг/мл в конечной композиции. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 15 мин при к.т. Измеренное значение pH составляло 9,4. Полученную смесь заполняли по 0,5 мл в стеклянные флаконы емкостью 3 мл, затем подвергали сублимационной сушке.ASA (сорбит) готовили, как указано в примере 1, с некоторыми небольшими отличиями: концентрация сорбита составляла 4,6%, и QS21 предварительно разводили до 400 мкг/мл, после чего добавляли к разведенным концентрированным липосомам.ASA (сахароза) готовили, как указано в примере 1, со следующими отличиями: сорбит заменяли сахарозой (использовали 30%-ный (мас./об.), исходный раствор сахарозы, и конечная концентрация сахарозы составляла 8,3%) и QS21 предварительно разводили до 400 мкг/мл, затем добавляли к разведенным концентрированным липосомам. Полученный после лиофилизации остаток разводили 625 мкл водной адъювантной композиции, и конечная композиция содержала 4 мМ Tris, 4 мМ борат, 4% сахарозы, 0,24% Poloxamer 188, 840 мкг/млCpG и 1000 мкг/мл PRAME. 5.1.5. Приготовление PRAME с CpG для ASA (сорбит) для эксперимента 2 примера 7. 30%-ный (мас./об.) раствор сахарозы (приготовленный в воде для инъекций) добавляли в воду для инъекций до достижения концентрации в композиции 5%, затем добавляли буфер Tris-HCl 1 M pH 9,0,разведенный 50-кратно, до достижения концентрации Tris-буфера в этой композиции 20 мМ, затем добавляли боратный буфер 100 мМ pH 9,8, разведенный 20-кратно до достижения концентрации боратного буфера в этой композиции 5 мМ. Затем добавляли 10%-ный (мас./об.) раствор Poloxamer 188 (приготовленный в воде для инъекций) до достижения концентрации в композиции 0,3%. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 5 мин при к.т. Затем добавляли раствор CpG в концентрации примерно 20 мг/мл (в воде для инъекций) до достижения концентрации 1050 мкг/мл в композиции. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 5 мин при к.т. Затем добавляли антиген PRAME до достижения концентрации белка 1250 мкг/мл в конечной композиции. Смесь перемешивали с использованием магнитной мешалки (150 об/мин) в течение 15 мин при к.т. Измеренное значение pH составляло 9,1. Полученную смесь заполняли по 0,5 мл в стеклянные флаконы емкостью 3 мл, затем подвергали сублимационной сушке.ASA (сорбит) готовили, как описано в примере 1. Полученный после лиофилизации остаток разводили 625 мкл водной адъювантной композиции, и конечная композиция содержала 16 мМ Tris, 4 мМ борат, 4% сахарозы, 0,24% Poloxamer 188, 840 мкг/мл CpG и 1000 мкг/мл PRAME. 5.2. Приготовление NY-ESO1 с CpG. 5.2.1. Приготовление NY-ESO1 с CpG для примера 6.Na/K2 фосфатный буфер 200 мМ pH 6,3, разведенный в 20 раз, добавляли при перемешивании с использованием магнитной мешалки к воде для инъекций до достижения концентрации 12,5 мМ в конечной композиции. Затем к смеси добавляли следующие эксципиенты в следующей последовательности: монотиоглицерин в концентрации 10% (мас./об.), до достижения конечной концентрации 0,3125%,Poloxamer 188 в концентрации 5% (мас./об.), до достижения концентрации 0,0625%, сахарозу 25% до достижения конечной концентрации 5% и основание L-аргинин 287 мМ до достижения концентрации 6,25 мМ. CpG в количестве примерно 20 мг/мл затем добавляли к этой смеси до достижения концентрации 1050 мкг/мл в конечной композиции. Смесь перемешивали с использованием магнитной мешалки(примерно 150 об/мин) при комнатной температуре в течение 10 мин. Измеряли pH, его значение было 7,10,3. Перемешивание с использованием магнитной мешалки ускоряли для создания вихревого перемешивания. Затем добавляли NY-ESO1 до достижения конечной концентрации 750 мкг/мл. Перемешивание с использованием магнитной мешалки затем замедляли до примерно 150 об/мин и смесь перемешивали при комнатной температуре в течение 5 мин. Отбирали аликвоту для определения конечного pH(который должен составлять 7,02). Конечный продукт затем подвергали сублимационной сушке. Полученный после лиофилизации остаток разводили 625 мкл буфера для ASA (150 мМ NaCl и сорбит). Пример 6. Предотвращение "высаливания" в адъювантной композиции, содержащей в качестве буфера сорбит. Фиг. 4 демонстрирует, что уменьшение концентрации соли до 5 мМ и включение сорбита в адъювантную композицию предотвращает "высаливание" как PRAME, так и NY-ESO-1 в иммуногенных композициях (приготовленных, как описано в примере 5.1.1 и 5.2.1 соответственно). На фиг. 4: 1. Антиген PRAME, разведенный в буфере для ASA 150 мМ NaCl. 2. Антиген PRAME, разведенный в буфере для ASA сорбит. 3. Антиген NYESO-1, разведенный в буфере для ASA 150 мМ NaCl. 4. NYESO-1 антиген разведенных в буфере для ASA сорбит. Фиг. 4 представляет собой фотографическое сравнение PRAME и NYESO-1, разведенных в ASA(150 мМ NaCl) и ASA (сорбит). Как можно видеть, PRAME, разведенный в ASA (150 мМ NaCl), выглядит мутным по сравнению с PRAME, разведенным в ASA (сорбит). Аналогично, NY-ESO, разведенный вASA (150 мМ NaCl), выглядит мутным по сравнению с антигеном NY-ESO, разведенным в ASA (сорбит). Пример 7. Мышиная модель in vivo. Эксперимент 1. Семь групп по 20 самок мышей CB6F1 (гибрид мышей C57BL/6 и Balb/C) в возрасте 6-8 недель дважды иммунизировали внутримышечно (каждые две недели альтернативными инъекциями в левую и правую икроножную мышцу) белком PRAME, приготовленным в фиксированной дозе ASA + CpG, соответствующей 1/10 дозы для человека (50 мкл, содержащие 5 мкг MPL, 5 мкг QS21 и 42 мкг CpG7909). Через 14 суток после последней иммунизации четырем группам мышей (n=8 в каждой группе) подкожно вводили 105 опухолевых клеток CT26-PRAME, как описано ниже. Семь групп мышей представляли собой: группа 1: буфер,группа 2: совместно лиофилизированный PRAME + CpG, ресуспендированный в "классическом"ASA (150 мМ NaCl), в котором белок PRAME осаждается,группа 3: совместно лиофилизированный PRAME + CpG, ресуспендированный в ASA (сахароза),группа 4: совместно лиофилизированный PRAME + CpG, ресуспендированный в ASA (сахароза,инкубация в течение 48 ч при 25C),группа 5: совместно лиофилизированный PRAME + CpG, ресуспендированный в ASA (сорбит),группа 6: PRAME + ASA - "жидкая" композиция, содержащая 70 мМ NaCl + CpG,группа 7: PRAME + ASA - "жидкая" композиция, содержащая 70 мМ NaCl + CpG (+ полоксамер). Через 7 суток после последней иммунизации анализировали клеточный ответ по способности Т-клеток секретировать цитокины (n=4 группы по 3 мыши). Все мыши получали по 0,4 мкг PRAME в 1/10 дозы для человека адъювантной системы ASA + CpG(5 мкг MPL, 5 мкг QS21 и 42 мкг CpG). Результаты. Рост опухоли. Средний рост опухоли с течением времени по результатам измерений площади поверхности (мм 2)(+SD (стандартное отклонение на группу представлен на фиг. 6. PRAME, приготовленный с ASA вую защиту (больший рост опухоли) по сравнению с PRAME ASA (сорбит) + CpG. Клеточный ответ (через 7 суток после 2 иммунизации, n=4 группы по 3 мыши на группу). Частота CD4 и CD8 Т-клеток, способных продуцировать цитокины, такие как IFN и TNF, после иммунизации мышей опухолевым антигеном PRAME ASA-CpG свидетельствует о способности различных композиций вызывать функциональный клеточный ответ. Через 7 суток после второй иммунизации процентное содержание CD4 и CD8 Т-клеток, продуцирующих цитокины (IFN и TNF), измеряли методом окрашивания внутриклеточных цитокинов (ICS) на клетках селезенки иммунизированных мышей.% CD4, продуцирующих IFN и TNF (среднее значениестандартное отклонение), представлен на фиг. 5. В этом эксперименте измеримый CD8 ответ не обнаружен. Показано, что белок PRAME, приготовленный в ASA (150 мМ NaCl) + CpG, осаждается и вызывает меньший специфический Т-клеточный ответ по сравнению с PRAME, приготовленным в ASA (сорбит) +CpG. Аналогично, хороший PRAME-специфический CD4 ответ получен, когда белок PRAME приготовлен в ASA (сорбит) + CpG и в "жидкой" композиции ASA (70 мМ NaCl) + CpG (статистического расхождения нет). Тестировали также гуморальный иммунный ответ, но данные после 2 инъекций не были интерпретируемыми. Эксперимент 2. Четыре группы по 24 самки мышей CB6F1 (гибрид мышей C57BL/6 и Balb/C) в возрасте 6-8 недель иммунизировали четыре раза внутримышечно (каждые две недели альтернативными инъекциями в левую и правую икроножную мышцу) белком PRAME, приготовленным в фиксированной дозе ASA + CpG,соответствующей 1/10 дозы для человека (50 мкл, содержащие 5 мкг MPL, 5 мкг QS21 и 42 мкгCpG7909). Через 14 суток после последней иммунизации четырем группам мышей (n=12 в каждой группе) подкожно вводили 105 опухолевых клеток CT26-PRAME, как описано ниже. Четыре группы мышей представляли собой: группа 1: буфер,группа 2: совместно лиофилизированный PRAME + CpG, ресуспендированный в "классическом"ASA (150 мМ NaCl), в котором белок PRAME осаждается,группа 3: совместно лиофилизированный PRAME + CpG, ресуспендированный в ASA (сорбит),группа 4: PRAME + ASA - "жидкая" композиция + CpG (+ полоксамер). Через 14 суток после последней иммунизации иммунный ответ анализировали с использованием различных считываний в соответствии со следующим: гуморальный ответ (n=12),клеточный ответ по способности Т-клеток секретировать цитокины (n=4 группы по 3 мыши),защитный эффект против опухолевого заражения (n=12). Все мыши получали 0,4 мкг PRAME в 1/10 дозы для человека ASA + CpG адъювантной системы(5 мкг MPL, 5 мкг QS21 и 42 мкг CpG). Результаты. Рост опухолей. Средний рост опухолей с течением времени по результатам измерений площади поверхности (мм 2)(+CD) на группу представлен на фиг. 9. PRAME, приготовленный в ASA (150 мМ NaCl) + CpG, вызывает меньшую противоопухолевую защиту (больший рост опухоли) по сравнению с PRAME ASA (сорбит) +CpG. Аналогичная защита наблюдается для PRAME ASA (сорбит) + CpG и PRAME в жидкой композиции ASA + CpG). Анализ образца: Гуморальный ответ. Образцы сыворотки крови мышей (n=12) тестировали методом ELISA на присутствие PRAMEспецифических антител через 14 суток после последней из 4 иммунизации, как описано ниже. Антительный ответ (общее количество Ig) оценивали методом ELISA с использованием очищенного рекомбинантного белка PRAME в качестве покрывающего антигена. Образцы сыворотки крови иммунизированных животных анализировали на присутствие PRAME-специфических антител. Среднее геометрическое стандартных титров (n=12 мышей)доверительный интервал 95%, полученных после 4 иммунизации,представлено на фиг. 7. PRAME/ASA + CpG, содержащий классический ASA (150 мМ NaCl), вызывает весьма незначительный антительный ответ, тогда как PRAME/ASA + CpG, содержащий ASA (сорбит),индуцирует очень высокие титры антител. Этот ответ аналогичен ответу, вызываемому жидкой композицией ASA. Клеточный ответ (через 14 суток после 4 иммунизации, n=4 группы по 3 мыши на обрабатываемую группу). Частота CD4 и CD8 Т-клеток, способных продуцировать цитокины, такие как IFN и TNF, после иммунизации мышей PRAME ASA-CpG опухолевым антигеном, свидетельствует о способности различных композиций вызывать функциональный клеточный ответ. Через 14 суток после четвертой иммунизации процентные содержания CD4 и CD8 Т-клеток, продуцирующих цитокины (IFN и TNF), измеряли методом окрашивания внутриклеточных цитокинов (ICS) на клетках селезенки иммунизированных% CD4, продуцирующих IFN и TNF (среднее значениестандартное отклонение) представлен на фиг. 8. р-значения намного ниже 0,05, что свидетельствует о значительном различии между группой 2 и группами 3 и 4. Измеримый ответ в виде CD8 в этом эксперименте не обнаружен. Показано, что белок PRAME, приготовленный в ASA (150 мМ NaCl) + CpG, осаждается и вызывает статистически меньший специфический T-клеточный ответ по сравнению с PRAME, приготовленным вASA (сорбит) + CpG. И наоборот, сходный хороший PRAME-специфический CD4 ответ получен, когда белок PRAME приготовлен в ASA (сорбит) + CpG и в "жидкой" композиции ASA + CpG. Метод. Модель опухоли CT26-PRAME и рост опухоли. Клеточную линию CT26-PRAME получали путем трансфицирования клеточной линии СТ 26 карциномы ободочной кишки экспрессирующей плазмидой млекопитающего, pCDNA3, кодирующей кДНК для PRAME (Invitrogen, Carlsbad, CA). В результате селекции с G418 (200 мкг/мл) и клонирования с ограниченным разведением получили клон, экспрессирующий PRAME (CT26-PRAME), что определено количественной PCR (полимеразная цепная реакция) в режиме реального времени (103 копий мРНКPRAME/копия мышиного -актина, который находится в диапазоне уровня экспрессии PRAME опухолями человека). Клетки CT26-PRAME выращивали in vitro при 37C с 5% СО 2 в среде RPMI с 10% фетальной телячьей сыворотки, 1% L-глутамина, 1% пенициллина-стрептомицина, 1% не-незаменимых аминокислот,1% пирувата натрия и 0,1% -меркаптоэтанола. Клетки трипсинизировали, дважды промывали в бессывороточной среде и в 200 мкл среды RPMI подкожно инъецировали в правый бок четырех групп мышейCB6F1 через 14 суток после последней иммунизации PRAME, как описано выше. Рост индивидуальной опухоли оценивали дважды в неделю. Произведение 2 основных диаметров каждой опухоли регистрировали с течением времени, и эти данные представлены как средняя площадь поверхности опухоли (мм 2) в каждой группе животных. Анализ образца: Гуморальный ответ. Перед добавлением образцов сыворотки крови планшет для иммуноанализа покрывали антигеномPRAME в течение ночи при 4C. После взаимодействия с сывороткой крови в течение 90 мин при 37C биотинилированное кроличье полное антитело против мышиных иммуноглобулинов добавляли в течение 90 мин при 37C. Комплекс антиген-антитело выявляли инкубированием со стрептавидинбиотинилированным пероксидазным комплексом в течение 30 мин при 37C. Этот комплекс затем выявляли путем добавления тетраметилбензидина (ТМВ) в течение 10 мин при комнатной температуре и реакцию останавливали добавлением 0,2 М H2SO4. Оптические плотности регистрировали при 450 нм. Метод анализа образца: Клеточный ответ (продукция IFN/TNF). Продукцию IFN и TNF CD4 и CD8 T-клетками измеряли методом проточной цитометрии (LSR2 от Becton Dickinson) с использованием окрашивания внутриклеточных цитокинов (ICS) на клетках селезенки иммунизированных мышей (4 группы по 3 мыши на группу) после 2-часовой стимуляции пулом перекрывающихся 15-мерных пептидов, покрывающих всю последовательность белка PRAME. Стимуляция Т-клеток. Клетки селезенки иммунизированных животных повторно стимулировали пулом 123 15-мерных пептидов, перекрывающихся 11 аминокислотами, покрывающих всю последовательность PRAME. Пептиды (1 мкг/мл/пептид) смешивали с 106 Т-клеток (клетки селезенки) в течение 2 ч при 37C в 96-луночном планшете (U-образные лунки) в конечном объеме 200 мкл RPMI с 5% FCS (фетальная телячья сыворотка), содержащей 2 мкг/мл антитела против CD49d и 2 мкг/мл антитела против CD28. После инкубирования добавляли 50 мкл брефелдина (1/1000) в RPMI 5% FCS. Внутриклеточное окрашивание. Окрашивание CD4/CD8: клетки трансфицировали в 96-луночном планшете (конические лунки); центрифугировали при 1000 об/мин в течение 5 мин при 4C; промывали 250 мкл буфера FACS (PBS, 1% FCS) клеточные осадки инкубировали с 50 мкл 2.4G2 1/50 в буфере FACS в течение 10 мин при 4C; 50 мкл Master mix CD4-PE (разведение Mab: 1/200) и CD8PerCP (разведение Mab: 1/200) в буфереCytofix/cytoperm: Pharmingen (BD) кат.554722. Буфер perm/wash: Pharmingen(BD) кат.554723. Крысиные антитела против мышиных CD49d, очищенные NA LE: BD кат 553154. Крысиные антитела против мышиных CD28, очищенные NA LE: BD кат 553295. Крысиные антитела против мышиных CD8a perCp: BD кат 553036. Крысиные антитела против мышиных CD4 РЕ: BD кат 556616. Крысиные антитела против мышиных IFN APC: BD кат 554413. Крысиные антитела против мышиных TNF FITC: BD кат 554418. Антитела против мышиных CD16/CD32 (2.4G2) Becton Dickinson кат 553142 (0,5 мг/мл).(б) неионный агент, обеспечивающий изотоничность,где ионная сила адъювантной композиции составляет менее 100 мМ. 2. Водная адъювантная композиция по п.1, где неионный агент, обеспечивающий изотоничность,представляет собой полиол. 3. Водная адъювантная композиция по п.2, где полиол представляет собой сорбит или сахарозу. 4. Водная адъювантная композиция по любому из пп.1-3, где указанный агонист TLR-4 представляет собой 3D-MPL (3-деацилированный монофосфориллипид А). 5. Водная адъювантная композиция по любому из пп.1-4, где указанный сапонин представляет собой QuilA или его производное. 6. Водная адъювантная композиция по п.5, где производное QuilA представляет собой QS21. 7. Иммуногенная композиция, содержащая антиген или антигенный препарат и водную адъювантную композицию по любому из пп.1-6. 8. Способ приготовления иммуногенной композиции по п.7, включающий стадию разведения лиофилизированной композиции, содержащей по меньшей мере один антиген или антигенный препарат вместе с водной адъювантной композицией по любому из пп.1-6. 9. Набор для использования в способе приготовления иммуногенной композиции по п.8, содержащий (1) лиофилизированную композицию, содержащую антиген или антигенный препарат; и (2) водную адъювантную композицию по любому из пп.1-6.
МПК / Метки
МПК: A61K 39/00
Метки: агент, иммуногенной, обеспечивающий, композиции, водная, иммуногенная, приготовления, адъювантная, набор, изотоничность, неионный, основе, содержащая, композиция, способ
Код ссылки
<a href="https://eas.patents.su/22-24074-vodnaya-adyuvantnaya-kompoziciya-soderzhashhaya-neionnyjj-agent-obespechivayushhijj-izotonichnost-immunogennaya-kompoziciya-i-nabor-na-ee-osnove-i-sposob-prigotovleniya-immunogenno.html" rel="bookmark" title="База патентов Евразийского Союза">Водная адъювантная композиция, содержащая неионный агент, обеспечивающий изотоничность, иммуногенная композиция и набор на ее основе и способ приготовления иммуногенной композиции</a>
Предыдущий патент: Способ и устройство для нанесения покрытий
Следующий патент: Переработка углеводородного газа
Случайный патент: Производные n-(аминогетероарил)-1н-индол-2-карбоксамидов, их получение и их применение в терапии