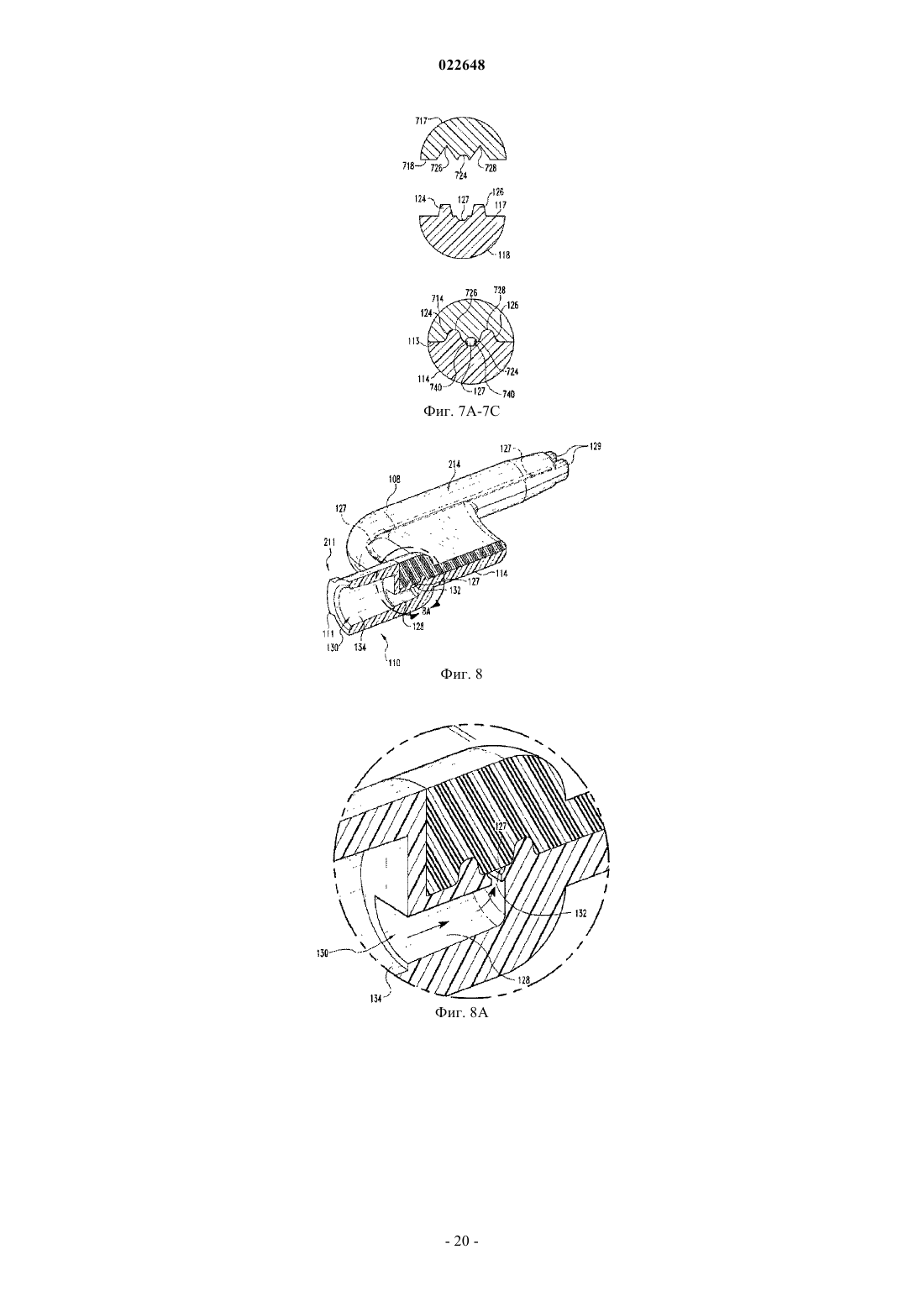
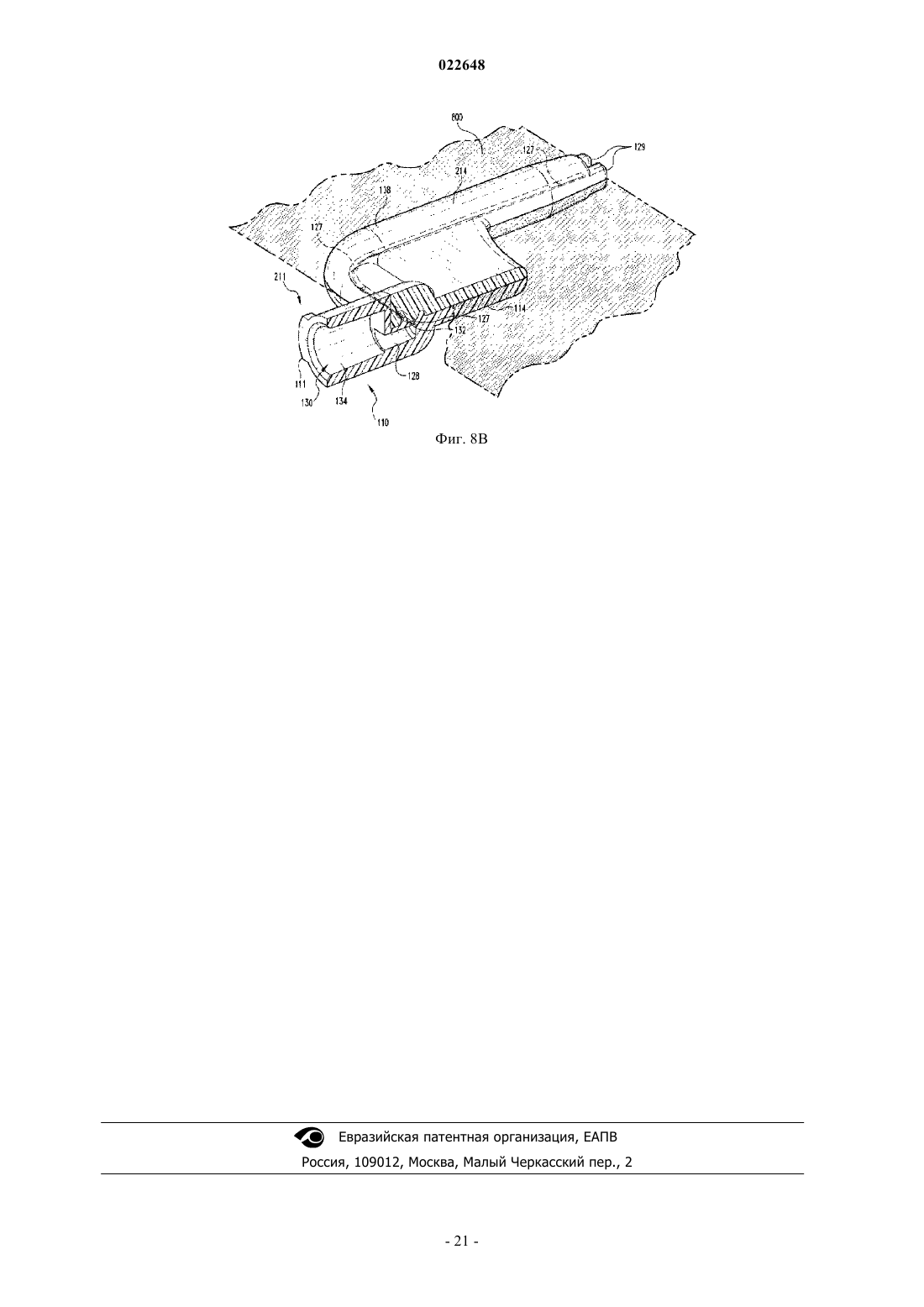
Способы контролирования боли у животных семейства лошадиных с применением трансдермального раствора фентанила
Номер патента: 22648
Опубликовано: 29.02.2016
Авторы: Риггс Кари Линетт, Оуэнс Джейн Гренвилль, Марр Эми Луиз, Моузин Дуглас Юджин
Формула / Реферат
1. Способ контролирования боли, включающий трансдермальное введение нуждающемуся в этом животному семейства лошадиных терапевтически эффективного количества композиции, содержащей фентанил, усилитель проникновения и летучую жидкость, где указанная композиция представляет собой раствор, где фентанил вводится в дозе от примерно 0,01 до примерно 0,1 мг/кг массы животного.
2. Способ по п.1, где боль контролируют в течение эффективного периода времени, составляющего примерно 12 ч.
3. Способ по п.1 или 2, где композицию вводят в виде единичной дозы.
4. Способ по любому из пп.1-3, где усилитель проникновения представляет собой октилсалицилат, а летучая жидкость представляет собой изопропанол.
5. Способ по любому из пп.1-4, где боль связана с проведенной или предполагаемой для проведения операцией у животного семейства лошадиных или с коликами.
6. Способ по любому из пп.1-5, отличающийся тем, что композиция содержит от примерно 0,1 до примерно 10% (мас./об.) фентанила, от примерно 0,1 до примерно 10% (мас./об.) усилителя проникновения и от примерно 80 до примерно 99,8% (мас./об.) летучей жидкости.
7. Трансдермальный состав в виде раствора со стандартной дозой для применения у животных семейства лошадиных, содержащий терапевтически эффективное количество композиции, содержащей фентанил; усилитель проникновения, выбранный из группы, состоящей из длинноцепочечного алкил-пара-аминобензоата, длинноцепочечного алкилдиметил-пара-аминобензоата, длинноцепочечного алкилциннамата, длинноцепочечного алкилметоксициннамата, длинноцепочечного алкилсалицилата, октилдиметил-пара-аминобензоата, октил-пара-метоксициннамата, октилсалицилата или их смесей; и летучую жидкость, выбранную из группы, состоящей из этанола, этилацетата, изопропанола, ацетона, этилформиата, метанола, метилацетата, метилэтилкетона, пентана, хлороформа или их смесей, при этом указанный состав содержит от примерно 0,01 до примерно 0,1 мг фентанила на 1 кг массы тела животного семейства лошадиных.
8. Состав по п.7, где указанный состав подходит для введения один раз по меньшей мере каждые 12 ч.
Текст
СПОСОБЫ КОНТРОЛИРОВАНИЯ БОЛИ У ЖИВОТНЫХ СЕМЕЙСТВА ЛОШАДИНЫХ С ПРИМЕНЕНИЕМ ТРАНСДЕРМАЛЬНОГО РАСТВОРА ФЕНТАНИЛА В изобретении предложены способы контролирования боли у животных семейства лошадиных в течение эффективного периода времени, включающие трансдермальное введение композиции,содержащей фентанил, усилитель проникновения и летучую жидкость, при этом композиция представляет собой раствор. В изобретении также предложена единичная стандартная доза композиции.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Опиоиды являются важной частью мультимодальной периоперационной анальгезии, особенно для боли от умеренной до сильной. В здравоохранении применение опиоидов во время и после операции на большинстве мягких тканей и при ортопедической хирургии считается стандартом лечения и включается в алгоритмы проведения специфического лечения. В ветеринарии применение ограничивается нежелательными фармакокинетическими параметрами у многих животных, в том числе низкой биодоступностью при пероральном введении и быстрым выведением опиоидов. Фентанил является сильнодействующим полным агонистом -опиоидного рецептора, характеризующимся примерно 100-кратными анальгезирующими свойствами по сравнению с морфием. Однако низкая биодоступность при пероральном введении и быстрое выведение ограничивают применение фентанила для многих животных. Кроме того, применение фентанила для животных, таких как животные семейства лошадиных, может ограничиваться дозозависимым действием на возбуждение центральной нервной системы (ЦНС), желудочно-кишечным стазом и увеличением двигательной активности после введения. С целью преодоления указанных ограничений и продления продолжительности терапевтического действия предпринимались попытки применения различных способов доставки фентанила. Например,способы трансдермального применения, например в виде пластырей, обладают потенциальными преимуществами по сравнению с пероральным и парентеральным введением, включая неинвазивное дозирование, незатрагивание желудочно-кишечного тракта, отсутствие эффекта первого прохождения, устойчивость, непрерывность доставки лекарственного средства вместо дискретного процесса, потенциальное сокращение побочных эффектов путем устранения пиков при доставке, возможное сокращение недостатков в эффективности путем устранения спадов концентрации при доставке и снижение частоты дозирования для обеспечения удобства лечения и облегчения соблюдения схемы лечения. В качестве примера трансдермальную доставку фентанила в составе пластыря применяли для животных семейств псовых и лошадиных. Однако применение пластырей с фентанилом для лошадиных приводило к возникновению множества дополнительных недостатков, таких как отсутствие официального разрешения на применение для лошадиных, низкая скорость доставки фентанила у лошадиных, низкая степень доставки фентанила у лошадиных, возможность повреждения пластырей, нанесенных на лошадиных, возможность поедания пластырей, нанесенных на лошадиных, и последующего токсичного отравления в результате поедания,необходимость надлежащего контроля и утилизации использованных пластырей, возможность отклонения от заявленного использования и несанкционированного применения пластырей и отсутствие регулирующего надзора и фармаконадзора для отслеживания побочных эффектов у лошадиных. Таким образом, существует потребность в способе применения фентанила, позволяющем преодолевать некоторые или все из ограничений действия опиоидов, доставленных парентеральным способом,пероральным способом или посредством пластыря, для эффективного контролирования боли в ветеринарной медицине. Соответственно, в настоящем изобретении предложены способы применения трансдермальных фармацевтических составов, содержащих раствор фентанила, обладающих требуемыми свойствами и обеспечивающих связанные с ними преимущества при контролировании боли у лошадиных. В настоящем изобретении показано, что кожный барьер для проникновения лекарственного средства у лошадиных можно преодолевать при помощи трансдермального состава, содержащего фентанил,усилитель проникновения и летучую жидкость. Посредством нанесения фентанила на роговой слой у лошадиных с последующей пролонгированной системной абсорбцией настоящее изобретение позволяет преодолевать ограничения, вызванные неудовлетворительной пероральной биодоступностью, а также малой продолжительностью действия фентанила, введенного перорально или парентерально. Краткое описание чертежей Положения некоторых вариантов реализации настоящего изобретения будут более понятны при рассмотрении описания в сочетании с прилагаемыми чертежами, где: на фиг. 1 приведен вид в перспективе собранного аппликатора, присоединенного к устройству доставки текучей среды и расположенного на теле животного для подачи состава на животное. На данном чертеже в иллюстративных целях использовано животное семейства псовых. В соответствии с некоторыми вариантами реализации настоящего изобретения устройство для доставки применяют для подачи состава на животное семейства лошадиных; на фиг. 2 приведен вид в перспективе собранного аппликатора в соответствии с некоторыми вариантами реализации; на фиг. 2 А приведен вид выходного отверстия собранного аппликатора, приведенного на фиг. 2,сбоку в разрезе по линии 2 А; на фиг. 3 приведен вид в перспективе нижней части аппликатора в соответствии с некоторыми вариантами реализации; на фиг. 4 приведен другой вид в перспективе нижней части аппликатора в соответствии с некоторыми вариантами реализации; на фиг. 4 А приведен разрез верхней части аппликатора, приведенного на фиг. 5, по линии 5 А; на фиг. 4 В приведен разрез нижней части аппликатора, приведенного на фиг. 4, по линии 4 В; на фиг. 4 С приведен разрез собранного аппликатора, приведенного на фиг. 2, по линии 4 С; на фиг. 5 приведен вид в перспективе верхней части аппликатора в соответствии с некоторыми вариантами реализации; на фиг. 5 А приведен разрез верхней части аппликатора согласно другому варианту реализации; на фиг. 5 В приведен разрез нижней части аппликатора согласно другому варианту реализации; на фиг. 5 С приведен разрез собранного аппликатора после ультразвуковой сварки верхней части,приведенной на фиг. 5 А, и нижней части, приведенной на фиг. 5 В; на фиг. 6 приведен вид сбоку собранного аппликатора, приведенного на фиг. 2, в разрезе по линии 6; на фиг. 7 А приведен разрез верхней части аппликатора согласно другому варианту реализации; на фиг. 7 В приведен разрез нижней части аппликатора согласно другому варианту реализации; на фиг. 7 С приведен разрез собранного аппликатора после ультразвуковой сварки верхней части,приведенной на фиг. 7 А, и нижней части, приведенной на фиг. 7 В; на фиг. 8 приведен разрез собранного аппликатора в соответствии с некоторыми вариантами реализации; на фиг. 8 А приведен увеличенный разрез части приведенного на фиг. 8 собранного аппликатора,показанной окружностью 8 А; и на фиг. 8 В приведен разрез собранного аппликатора, приведенного на фиг. 8 с показанной плоскостью, проходящей через сочленение. В настоящем изобретении предложены способы контролирования боли у животных семейства лошадиных, включающие трансдермальное введение композиции, содержащей фентанил, усилитель проникновения и летучую жидкость, где композиция представляет собой раствор. В изобретении также предложена единичная стандартная доза композиции. Настоящее изобретение обеспечивает несколько преимуществ при доставке фентанила лошадиным. Во-первых, настоящее изобретение обеспечивает неожиданные преимущества в фармакокинетических параметрах, таких как всасывание, у лошадиных по сравнению с результатами, полученными для других видов. Применение настоящего изобретения для лошадиных приводит к более быстрому, более интенсивному всасыванию с большей скоростью по сравнению со всасыванием у других видов, например у собак. Во-вторых, при введении для контролирования боли настоящее изобретение позволяет применять неожиданно малую терапевтически эффективную дозу для введения лошадиным по сравнению с дозами,вводимыми другим видам. Особые преимущества малых доз, вводимых лошадиным, включают снижение возможности злоупотребления, а также более предпочтительный профиль безопасности для индивидуального введения фентанила лошадиным в соответствии с заявленными способами. В-третьих, применение настоящего изобретения обеспечивает преимущества по сравнению с введением фентанила лошадиным в виде пластыря. Например, в настоящем изобретении предложено введение фентанила в составе, который лошадиным трудней повредить или съесть по сравнению с фентанилом,вводимым лошадиным в виде пластыря. Кроме того, поскольку настоящее изобретение представляет собой трансдермальный раствор, а не устройство, изобретение не требует поддержания контакта с кожей животного семейства лошадиных для поддержания требуемой абсорбции фентанила. В-четвертых, сведены к минимуму накопление пустых емкостей, ранее содержавших фентанил,возможность отклонения от заявленного использования и несанкционированного применения настоящего изобретения, а также утилизация вне контроля лицензированного ветеринара. В-пятых, настоящее изобретение позволяет обеспечить неожиданные преимущества в фармакокинетических параметрах у лошадиных по сравнению с результатами, полученными при введении фентанила лошадиным в виде пластырей. Например, фармакокинетические свойства фентанила в организме животных семейства лошадиных описывали после трансдермального введения фентанила с помощью трансдермального пластыря. Среднее время достижения максимальной концентрации в плазме (Tmax) после трансдермального введения фентанила (0,033-0,043 мг/кг) при помощи пластыря составляло примерно 8 ч. Кроме того, максимальная концентрация в плазме (Cmax) после трансдермального введения фентанила при помощи пластыря составляла примерно 2,6 нг/мл. В другом примере трансдермальное введение фентанила при помощи пластыря в дозе 0,06-0,067 мг/кг приводило к тому, что фармакокинетические параметры фентанила у лошадиных были чрезвычайно изменчивы. Фармакокинетическая изменчивость включает Tmax в диапазоне 8,5-14,5 ч иCmax в диапазоне 0,67-5,12 нг/мл. Для сравнения, настоящее изобретение требует более короткого периода времени для достиженияTmax и позволяет достичь гораздо больших значений Cmax. Таким образом, настоящее изобретение позволяет достигать больших концентраций фентанила в плазме лошадиных с большей скоростью по сравнению с фентанилом, вводимым с помощью нанесения обычных пластырей. В способах в соответствии с настоящим изобретением применяют введение животным семейства лошадиных композиции для контролирования боли. Термин "животное семейства лошадиных", приме-2 022648 няемый в настоящем описании, относится к любому члену семейства лошадиных, включая, например,лошадей, пони, миниатюрных лошадей, миниатюрных пони, ослов, мулов и зебр. Термины "контролировать боль" и "контролирование боли", применяемые в настоящем описании,относятся к предупреждению, минимизации или устранению боли у животных семейства лошадиных. Термин "боль", применяемый в настоящем описании, представляет собой все виды боли, включая травматическую боль в результате повреждения тканей, послеоперационную боль, ожог, воспалительную боль, боль, связанную с заболеванием (например, раком, артритом или инфекцией), боль, связанную с повреждением нервов, невропатией и другими видами невралгических, нейропатических и идиопатических болевых синдромов, и боль конкретного органа или ткани, например глазную и роговичную боли,боли в костях, боли в сердце, кожные боли, висцеральные боли (почечные, желудочно-кишечные боли,колики и т.п.), боли в суставах, зубные боли, боли мягких тканей и мышечные боли. Термин "боль" также включает боли различной степени тяжести, т.е. легкие, умеренные и сильные боли, а также острые и хронические боли. В некоторых вариантах реализации настоящего изобретения в способах применяют введение лошадиным композиции для контролирования боли на протяжении эффективного периода времени. Термин"эффективный период времени", применяемый в настоящем описании, включает период, составляющий по меньшей мере 6 ч. В некоторых вариантах реализации эффективный период времени включает период, составляющий по меньшей мере 6 ч, период, составляющий по меньшей мере 8 ч, период, составляющий по меньшей мере 12 ч, период, составляющий по меньшей мере 24 ч, период, составляющий по меньшей мере 48 ч, период, составляющий по меньшей мере 72 ч, или период, составляющий по меньшей мере 96 ч. Композиция, вводимая в соответствии с настоящим изобретением, содержит фентанил, усилитель проникновения и летучую жидкость. Фентанил является полным агонистом -опиоидного рецептора, а также известен под химическими названиями, такими как N-фенил-N-[1-(2-фенилэтил)-4 пиперидинил]пропанамид,N-(1-фенилэтил-4-пиперидил)пропионанилид илиN-(1-фенэтил-4 пиперидинил)-N-фенилпропионамид. Химическая структура фентанила представляет собой: Термин "фентанил", применяемый в настоящем описании, относится к основанию фентанила и фармацевтически приемлемым солям фентанила. Термин "фармацевтически приемлемая соль" относится к соли присоединения, которая существует в сочетании с кислотным или основным фрагментом фентанила. Указанные соли включают фармацевтически приемлемые соли, перечисленные в HANDBOOK OF PHARMACEUTICAL SALTS: PROPERTIES,SELECTION AND USE, P.H. Stahl and С.G. Wermuth (Eds.), Wiley-VCH, New York, 2002, которые известны специалистам в данной области техники. Фармацевтически приемлемые соли присоединения кислоты образуются в случае взаимодействия фентанила и любого из его промежуточных соединений, содержащих основную функциональную группу, с фармацевтически приемлемой кислотой. Фармацевтически приемлемые кислоты, обычно применяемые для образования указанных солей присоединения кислоты,включают неорганические и органические кислоты. Фармацевтически приемлемые соли присоединения основания образуются в случае взаимодействия фентанила и любого из его промежуточных соединений,содержащих кислотную функциональную группу, с фармацевтически приемлемым основанием. Фармацевтически приемлемые основания, обычно применяемые для образования указанных солей присоединения основания, включают органические и неорганические основания. В дополнение к фармацевтически приемлемым солям в настоящее изобретение включены другие соли. Указанные соли могут выступать в качестве промежуточных соединений при очистке соединений или при получении других фармацевтически приемлемых солей или могут являться подходящими для применения для идентификации, исследования или очистки. Термин "усилитель проникновения", применяемый в настоящем описании, относится к химическому соединению, которое способствует транспортировке лекарственного средства через кожный барьер. Усилитель проникновения в соответствии с настоящим изобретением способен действовать путем нарушения упаковки липидов кожи и, таким образом, изменения барьера в роговом слое, путем изменения действия лекарственного средства на границе раздела рогового слоя эпидермиса или путем воздействия на термодинамическую активность лекарственного средства. Усилитель проникновения может обладать малой токсичностью для кожи и представлять собой традиционные усилители проникновения через кожу. В некоторых вариантах реализации усилитель проникновения представляет собой липофильное химическое соединение. Усилители проникновения и способы их применения описаны, например, в патентах США 6299900, 6818226 и 6916486. Усилители проникновения в соответствии с настоящим изобретением являются особенно подходящими для трансдермальной доставки анальгетиков через кожу животных, таких как животные семейства лошадиных. В данной области техники известен ряд усилителей проникновения. В некоторых вариантах реализации усилители проникновения включают жирные кислоты, сложные эфиры жирных кислот, жирные спирты, гликоли и сложные эфиры гликолей, 1,3-диоксоланы и 1,3-диоксаны, макроциклические кетоны, содержащие по меньшей мере 12 атомов углерода, оксазолидиноны и производные оксазолидинонов, сложные эфиры алкил-2-(N,N-дизамещенных амино)алканоатов, (N,N-дизамещенные амино)алканолалканоаты, солнцезащитные сложные эфиры и смеси указанных соединений. В некоторых вариантах реализации усилители проникновения выбирают из группы, состоящей из олеиновой кислоты,олеилового спирта, циклопентадеканона (СРЕ-218), моноолеата сорбита, моноолеата глицерина, монолаурата пропиленгликоля, монолаурата полиэтиленгликоляи, 2-н-нонил-1,3-диоксолана (SEPA), додецил-2-(N,N-диметиламино)пропионата (ДДАИП) или производных солей указанных соединений,2-этилгексил-2-этилгексаноата, изопропилмиристата, диметилизосорбида, 4-децилоксазолидинон-2-она(SR-38, TCPI, Inc.), 3-метил-4-децилоксазолидинон-2-она, октилдиметил-пара-аминобензоата, октилпара-метоксициннамата, октисалата и смесей указанных соединений. В некоторых вариантах реализации усилители проникновения могут представлять собой солнцезащитные сложные эфиры, такие как соединения, описанные в патенте США 6299900. Например, соединения могут представлять собой безопасные для кожи солнцезащитные сложными эфирами формулыR2 представляет собой длинноцепочечный алкил; каждый из R3 и R4 независимо представляет собой водород, низший алкил илиq равняется 1 или 2. В некоторых вариантах реализации усилители проникновения представляют собой сложные эфиры,содержащие длинноцепочечные алкил-пара-аминобензоаты, длинноцепочечные алкилдиметил-парааминобензоаты, длинноцепочечные алкилциннаматы, длинноцепочечные алкилметоксициннаматы или длинноцепочечные алкилсалицилаты. В некоторых вариантах реализации усилители проникновения выбирают из группы, состоящей из октилдиметил-пара-аминобензоата ("Padimate О"), октил-параметоксициннамата, октилсалицилата (также известного как октисалат) или смесей указанных соединений. В одном из вариантов реализации усилитель проникновения представляет собой октилсалицилат. Термин "летучая жидкость", применяемый в настоящем описании, относится к любой фармакологически подходящей жидкой композиции, известной в данной области техники. Например, летучая жидкость может легко испаряться при низких температурах или иметь тенденцию быстро испаряться. После нанесения на кожу быстрое испарение летучих жидкостей в соответствии с настоящим изобретением может приводить к перенасыщению другими ингредиентами композиции. В некоторых вариантах реализации летучие жидкости в соответствии с настоящим изобретением включают безопасные для кожи растворители. В некоторых вариантах реализации летучая жидкость представляет собой низший спирт или смесь таких спиртов. В некоторых вариантах реализации летучая жидкость выбрана из группы, состоящей из этанола, этилацетата, изопропанола, ацетона, этилформиата, метилацетата, метилэтилкетона, пентана и хлороформа или смеси указанных соединений. В других вариантах реализации летучая жидкость представляет собой этанол или изопропанол или смесь указанных соединений. В одном из вариантов реализации летучая жидкость представляет собой изопропанол. В способах в соответствии с настоящим изобретением применяют введение композиции, причем композиция находится в растворе. В некоторых вариантах реализации согласно настоящему изобретению композиция содержит фентанил, усилитель проникновения и летучую жидкость в различных количествах в зависимости от отношения массы к объему раствора. В некоторых вариантах реализации композиция содержит от примерно 0,1 до примерно 10% фентанила, от примерно 0,1 до примерно 10% усилителя проникновения и от примерно 80 до примерно 99,8% летучей жидкости по массе. В другом варианте реализации композиция содержит от примерно 1 до примерно 10% фентанила, от примерно 1 до примерно 10% усилителя проникновения и от примерно 80 до примерно 98% летучей жидкости по массе. В другом варианте реализации композиция содержит от примерно 2 до примерно 8% фентанила, от примерно 2 до примерно 8% усилителя проникновения и от примерно 84 до примерно 96% летучей жидкости по массе. В другом варианте реализации композиция содержит от примерно 3 до примерно 7% фентанила, от примерно 3 до примерно 7% усилителя проникновения и от примерно 86 до примерно 94% 3 летучей жидкости по массе. В еще одном варианте реализации композиция содержит от примерно 1 до примерно 5% фентанила, от примерно 1 до примерно 5% усилителя проникновения и от примерно 90 до примерно 98% летучей жидкости по массе. В другом варианте реализации композиция содержит примерно 5% фентанила, примерно 5% усилителя проникновения и примерно 90% летучей жидкости по массе. Кроме того, в способах в соответствии с настоящим изобретением применяют введение композиции, где введение представляет собой трансдермальное введение. Термин "трансдермальный", применяемый в настоящем описании, имеет свое стандартное значение для данной области техники и относится к прохождению агента по меньшей мере через один слой кожи животного, например животного семейства лошадиных. Кроме того, термин "трансдермальный" используют аналогично термину "местный" в описании применения агентов к коже. Оба термина, "местный" и "трансдермальный", применяются в настоящем описании в самом широком смысле для обозначения введения лекарственного средства через поверхность кожи животного с последующим прохождением лекарственного средства через слой кожи. Если не указано или не подразумевается иное, термины местная доставка лекарственного средства и трансдермальная доставка лекарственного средства используются, как взаимозаменяемые. Согласно строгой точке зрения на доставку лекарственного средства термин "трансдермальный" иногда применяют только для обозначения системной доставки через кожу, в то время как термин "местный" требует только доставки в кожу или на кожу для достижения локального эффекта. Изобретение, описанное в настоящем изобретении, в равной степени применимо к трансдермальным и местным способам доставки и описывается при помощи термина "трансдермальный" исключительно для удобства. В способах в соответствии с настоящим изобретением можно применять трансдермальное введение композиции, когда желательно наличие композиции не в виде трансдермального пластыря. При проведении способов согласно настоящему изобретению количество фентанила в композиции является достаточным для достижения терапевтического эффекта. Термин "терапевтически эффективное количество", применяемый в настоящем описании, относится к количеству, которое обеспечивает требуемый эффект у животных семейства лошадиных, и включает как лечение, так и профилактическое введение. Количество можно изменяться для каждого животного семейства лошадиных и может зависеть от ряда факторов, в том числе от общего физического состояния животного семейства лошадиных и первопричины состояния, подлежащего лечению. Количество фентанила, применяемое для контролирования боли, обеспечивает приемлемую скорость изменения и поддерживает требуемый ответ на целевом уровне. Терапевтически эффективное количество композиции, примеряемое в способах согласно настоящему изобретению, может быть легко установлено одним из специалистов в данной области техники при помощи общедоступных материалов и способов. В одном из вариантов реализации согласно настоящему изобретению терапевтически эффективное количество фентанила для доставки можно определить количественно путем определения количества миллиграмм фентанила на 1 кг массы тела животного семейства лошадиных. В некоторых вариантах реализации терапевтически эффективное количество фентанила в композиции может составлять от примерно 0,001 и до примерно 1 мг/кг массы тела животного семейства лошадиных. В другом варианте реализации терапевтически эффективное количество фентанила в композиции может составлять от примерно 0,005 и до примерно 0,5 мг/кг массы тела животного семейства лошадиных. В некоторых вариантах реализации терапевтически эффективное количество фентанила в композиции может составлять от примерно 0,01 и до примерно 0,1 мг/кг массы тела животного семейства лошадиных. В некоторых вариантах реализации терапевтически эффективное количество фентанила в композиции может составлять от примерно 0,01 и до примерно 0,08 мг/кг массы тела животного семейства лошадиных. В некоторых вариантах реализации терапевтически эффективное количество фентанила в композиции может составлять от примерно 0,002 и до примерно 0,06 мг/кг массы тела животного семейства лошадиных. В одном из вариантов реализации терапевтически эффективное количество фентанила, содержащегося в композиции,составляет примерно 0,05 мг/кг. В одном из вариантов реализации терапевтически эффективное количество фентанила, содержащегося в композиции, составляет примерно 0,04 мг/кг. В одном из вариантов реализации терапевтически эффективное количество фентанила, содержащегося в композиции, составляет примерно 0,03 мг/кг. В одном из вариантов реализации терапевтически эффективное количество фентанила, содержащегося в композиции, составляет примерно 0,02 мг/кг. В одном из вариантов реализации терапевтически эффективное количество фентанила, содержащегося в композиции, составляет примерно 0,01 мг/кг. В одном из вариантов реализации композиция согласно настоящему изобретению содержит примерно 5 мас.% фентанила в растворе (т.е. 50 мг/мл), а терапевтически эффективное количество фентанила, содержащегося в композиции, составляет примерно 0,04 мг/кг. В другом варианте реализации композиция согласно настоящему изобретению содержит примерно 2,5 мас.% фентанила в растворе (т.е. 25 мг/мл), а терапевтически эффективное количество фентанила, содержащегося в композиции, составляет примерно 0,04 мг/кг. В другом варианте реализации композиция согласно настоящему изобретению содержит примерно 2,3 мас.% фентанила в растворе (т.е. 23 мг/мл), а терапевтически эффективное количество фентанила, содержащегося в композиции, составляет примерно 0,04 мг/кг. В некоторых вариантах реализации терапевтически эффективное количество представляет собой количество, достаточное для достижения минимальной эффективной концентрации в плазме (МЭК). Как правило, МЭК определяют как минимальную концентрацию анальгетика в плазме, достаточную для устранения у пациента нужды в дополнительном анальгетике. МЭК фентанила у людей устанавливали на группе взрослых людей, подвергшихся брюшной хирургии. После операции фентанил доставляли при скорости базисной ВВ (внутривенной) инфузии 20 мкг/ч, с 20 микрограммовыми болюсами, вводимыми пациентами самостоятельно, если боль становилась неприемлемой. Образец крови, отбираемый непосредственно перед введением пациенту дополнительного анальгетика, принимали за МЭК. В течение 48 ч МЭК изменялась от 0,23 до 1,18 нг/мл (в среднем 0,63 нг/мл) и оставалась относительно постоянной для конкретного пациента в течение 48-часового периода исследования. Таким образом, у людей, у которых наблюдалось облегчение боли при 0,2 нг/мл, концентрация оставалась постоянной с течением времени, так же как и у людей, у которых наблюдалось облегчение боли при 1,18 нг/мл. Это позволило сделать вывод, что 6-кратная разница в минимальных эффективных концентрациях фентанила определяется индивидуальными ответными реакциями. Поскольку животное семейства лошадиных не способно потребовать дополнительный анальгетик,количественное определение истинного значения МЭК остается сложной задачей и зависит от наблюдателя, дающего заключение, исходя из предполагаемой боли, связанной с поведением лошадиных. Несмотря на указанные ограничения, исследования на основе поведения способны дать оценку обезболивания и концентрации фентанила в плазме у лошадиных для приблизительного определения обезболивания и концентрации лекарственного средства. В некоторых вариантах реализации настоящего изобретения боль у лошадиных связана с проведенной или предполагаемой для проведения операцией. В одном из вариантов реализации проведенная или предполагаемая для проведения операция представляет собой ортопедическую хирургию. Термин "ортопедическая хирургия", применяемый в настоящем описании, относится к хирургической процедуре, связанной с сохранением или восстановлением функционирования опорно-двигательного аппарата, его суставов и связанных структур. В другом варианте реализации проведенная или предполагаемая для проведения животному семейства лошадиных операция представляет собой хирургию мягких тканей. Термин "хирургия мягких тканей", применяемый в настоящем описании, относится к хирургической процедуре, связанной с сохранением или восстановлением функционирования мышечной, жировой, фиброзной тканей, кровеносных сосудов или других вспомогательных тканей организма, например сухожилий, связок, фасций, кожи,нервов или синовиальных мембран. В некоторых вариантах реализации согласно настоящему изобретению боль связана с коликами у лошадиных. Термин "колики", применяемый в настоящем описании, охватывает все виды желудочнокишечных состояний, которые вызывают боль, а также другие причины болей в животе, не связанных с желудочно-кишечным трактом. Колики могут включать висцеральную составляющую. Колики у лошадиных можно лечить хирургическими и нехирургическими способами. В некоторых вариантах реализации согласно настоящему изобретению боль связана с ламинитом у лошадиных. Термин "ламинит", применяемый в настоящем описании, связан с расстройством в мягких тканях у лошадиных. Ламинит у лошадиных можно лечить хирургическими и нехирургическими способами. Ламинит дополнительно можно классифицировать как острый или хронический ламинит. В одном из вариантов реализации согласно настоящему изобретению композиция перед введением содержится в емкости для многократного приема. Емкость для многократного приема, содержащая композицию согласно настоящему изобретению, можно изготавливать из стекла, пластика или другого материала. В одном из вариантов реализации согласно настоящему изобретению композицию вводят в виде нескольких доз. В одном из вариантов реализации согласно настоящему изобретению композицию вводят в виде единичной дозы. В другом варианте реализации согласно настоящему изобретению композицию вводят в виде единичной стандартной дозы. Термин "стандартная доза", применяемый в настоящем описании,представляет собой определенное количество композиции, содержащей заданное количество фентанила. В целом, количество фентанила равно дозе фентанила, которое предполагается ввести животному семейства лошадиных, или подходящей части указанной дозы, такой как, например, половина или одна треть указанной дозы. В соответствии со способами согласно настоящему изобретению термины "единичная доза" и "единичная стандартная доза" включают варианты реализации, в которых композицию можно трансдермально вводить за один или несколько раз. В одномиз вариантов реализации единичную дозу или единичную стандартную дозу композиции можно трансдермально вводить животному семейства лошадиных за один раз в один участок на коже животного семейства лошадиных. В другом варианте реализации единичную дозу или единичную стандартную дозу композиции трансдермально вводят животному семейства лошадиных за один раз в один участок на коже животного семейства лошадиных, причем за один раз вводят примерно 0,9 мл раствора композиции. В одном из вариантов реализации единичную дозу или единичную стандартную дозу композиции можно трансдермально вводить животному семейства лошадиных за несколько раз в один участок на коже животного. В другом варианте реализации единичную дозу или единичную стандартную дозу композиции трансдермально вводят животному семейства лошадиных за несколько раз в один участок на коже животного семейства лошадиных, причем в каждый раз вводят примерно до 0,9 мл раствора композиции. В одном из вариантов реализации единичную дозу или единичную стандартную дозу композиции можно трансдермально вводить животному семейства лошадиных за несколько раз более чем в один участок на коже животного. В другом варианте реализации единичную дозу или единичную стандартную дозу композиции трансдермально вводят животному семейства лошадиных за несколько раз более чем в один участок на коже животного, причем в каждый раз вводят примерно до 0,9 мл раствора композиции. В вариантах реализации, в которых применяется многократное введение композиции, многократное введение животному семейства лошадиных можно осуществлять в течение целесообразного периода времени. В одном из вариантов реализации композицию можно трансдермально вводить животному семейства лошадиных в участок, из которого выстрижен волосяной покров. В другом варианте реализации композицию можно трансдермально вводить животному семейства лошадиных в участок, из которого волосяной покров не выстрижен. В одном из вариантов реализации композицию можно трансдермально вводить животному семейства лошадиных в участок, на котором кожа очищена. Например, кожу животного семейства лошадиных можно очищать при помощи дезинфицирующего раствора. В другом варианте реализации композицию можно трансдермально вводить животному в участок, на котором кожа не очищена. В одном из вариантов реализации согласно настоящему изобретению композицию трансдермально вводят животному семейства лошадиных в спинной участок. В соответствии со способами согласно настоящему изобретению термин "спинной" имеет свое стандартное значение и в контексте настоящего описания относится к участку на верхней части тела животного, т.е. вдоль спины животного семейства лошадиных. В одном из вариантов реализации согласно настоящему изобретению композицию трансдермально вводят животному семейства лошадиных в брюшной участок. В соответствии со способами согласно настоящему изобретению термин "брюшной" имеет свое стандартное значение и в контексте настоящего описания относится к брюху животного, т.е. области вдоль нижней части тела. В другом варианте реализации согласно настоящему изобретению композицию трансдермально вводят животному семейства лошадиных в переднюю ногу. В соответствии со способами согласно настоящему изобретению термин "передняя нога" имеет свое стандартное значение и в контексте настоящего описания относится к любому проксимальному или дистальному участку на любой из передних ног животного семейства лошадиных. В другом варианте реализации согласно настоящему изобретению композицию трансдермально вводят животному семейства лошадиных в заднюю ногу. В соответствии со способами согласно настоящему изобретению термин "задняя нога" имеет свое стандартное значение и в контексте настоящего описания относится к любому проксимальному или дистальному участку на любой из задних ног животного. В одном из вариантов реализации согласно настоящему изобретению композицию трансдермально вводят животному семейства лошадиных в шею. В соответствии со способами согласно настоящему изобретению термин "шея" имеет свое стандартное значение и в контексте настоящего описания относится к любому участку на любой из сторон шеи. В одном из вариантов реализации согласно настоящему изобретению композицию трансдермально вводят животному семейства лошадиных в тыльный участок. В соответствии со способами согласно настоящему изобретению термин "тыльный" имеет свое стандартное значение и в контексте настоящего описания относится к любому участку на тела животного семейства лошадиных от шеи до конца позвоночника. В другом варианте реализации согласно настоящему изобретению композицию трансдермально вводят животному семейства лошадиных в участок рядом с гривой. В другом варианте реализации согласно настоящему изобретению композицию трансдермально вводят животному семейства лошадиных в участок под гривой. Указанный вариант реализации может обладать дополнительными преимуществами согласно настоящему изобретению, поскольку грива может защищать исполнителя (т.е. ветеринара) от места введения. Таким образом, случайная абсорбция композиции исполнителем сводится к минимуму. Композиции согласно настоящему изобретению включают композиции, которые также возможно содержат один или более других активных ингредиентов в дополнение к фентанилу. Термины "активный ингредиент" и "терапевтический ингредиент", применяемые в настоящем описании, относятся к терапевтически эффективному соединению, а также любым пролекарствам указанного соединения и фармацевтически приемлемым солям, гидратам и сольватам соединения и пролекарств. Другие активные ингредиенты можно объединять с фентанилом и можно вводить отдельно или в том же фармацевтическом составе. Специалист в данной области техники может легко определить требуемое количество других активных ингредиентов на основании терапии с фентанилом. В одном из примеров реализации способов по настоящему изобретению устройство для трансдермальной подачи может быть использовано для введения композиции в организм животного семейства лошадиных. В одном из примеров реализации устройство для трансдермальной подачи может представ-7 022648 лять собой аппликатор для подачи представленного в настоящем описании состава в организм животного. Пример устройства для трансдермальной подачи описан, например, в международной патентной заявке PCT/US2010/053206 и в заявке на патент США 12/581658. В одном из примеров аппликатор включает в себя корпус, содержащий первую и вторую части, соединенные друг с другом, причем указанные первая и вторая части образуют канал, расположенный между ними и содержащий по меньшей мере один выход; втулку, выполненную заодно с первой частью и отходящую от нее, причем втулка образует водовод; и изогнутый проход, соединяющий водовод с каналом. Согласно данному примеру реализации водовод, изогнутый проход и канал сообщаются друг с другом посредством текучей среды. Согласно еще одному аспекту настоящего изобретения предложен способ подачи представленного в настоящем описании состава из аппликатора, включающего в себя корпус, содержащий первую и вторую части, соединенные друг с другом с образованием канала, и втулку, отходящую от корпуса, причем втулка выполнена с возможностью прикрепления к шприцу. Способ включает прикрепление втулки к шприцу, содержащему состав; размещение выхода аппликатора на теле животного или вблизи него; выпуск состава из шприца в аппликатор; прохождение состава по втулке и по изогнутому проходу в канал и подачу состава из аппликатора через выход. Представленные в настоящем описании аппликаторы являются особенно подходящими для трансдермальной доставки доз контролируемых вводимых животным веществ (например, фентанила) в шерстный покров и кожу животного, в частности животным может быть животное семейства лошадиных. В некоторых примерах реализации устройство для доставки состава содержит устройство-аппликатор или наконечник, совместимый со стандартным шприцем с наконечником Люэра и состоящий из корпуса,позволяющего распределять состав по участку поверхности кожи или шерстного покрова животного. С этой целью корпус аппликатора содержит один или несколько выходов, выполненных в виде ножек или зубцов, выполненных с возможностью проникновения через волосяной покров животного и, соответственно, с возможностью доставки состава непосредственно в кожу или шерстный покров животного. Согласно некоторым аспектам выход или выходы также содержат два разнесенных в пространстве штыря или ножки, отходящие от дистального конца выхода, что позволяет свободно подавать дозу состава на поверхность тела животного. В частности, вследствие того, что разнесенные в пространстве ножки отходят в направлении наружу от дистального конца аппликатора, они представляют собой единственную часть конструкции собранного аппликатора, непосредственно соприкасающуюся с поверхностью тела животного и плотно прилегающую к ней. Далее, вследствие того, что отверстие выхода расположено между разнесенными в пространстве штырями таким образом, что оно не соприкасается непосредственно с поверхностью тела животного и плотно не прилегает к ней в процессе подачи состава, состав может быть свободно подан и распределен по телу животного без физических препятствий или прерываний. Неограничивающее изображение аппликатора в собранном виде, соединенного с устройством для доставки текучей среды согласно настоящему изобретению, показано на фиг. 1. В частности, на фиг. 1 показан вид в перспективе пользователя 100, осуществляющего подачу представленного в настоящем описании состава на тело животного 102. Согласно данному иллюстративному и неограничивающему изображению устройство 104 для доставки текучей среды, содержащее состав, прикрепляют к устройству-аппликатору 106 с возможностью отсоединения и затем размещают на поверхности тела животного 102 или вблизи него. Несмотря на то что в данном иллюстративном варианте реализации устройство 104 для доставки текучей среды показано в виде стандартного шприца, необходимо понимать, что доставка состава может быть осуществлена посредством любого известного устройства для доставки текучей среды или соединителя, который может быть прикреплен к устройству-аппликатору 106 с возможностью отсоединения и который содержит резервуар для размещения и/или хранения дозируемого и подаваемого состава. Другие подобные неограничивающие примеры устройств для доставки текучей среды, которые также могут быть использованы в настоящем изобретении, включают, без ограничения, шприцы,катетеры, воротниковые иглы, трубки для внутривенного вливания и цилиндрические устройства для доставки текучей среды. Согласно нижеприведенному подробному описанию устройства-аппликаторы 106 обычно состоят по меньшей мере из двух частей или половин (т.е. из частей 114 и 214), соединенных друг с другом или собранных с образованием конструкции аппликатора. В отличие от многих других традиционных устройств-аппликаторов, состоящих из одной части аппликатора или из двух взаимодополняющих частей,предложенные устройства содержат две части 114, 214, являющиеся в некоторой степени структурно взаимодополняющими, но имеющие форму, позволяющую осуществлять подачу состава из собранных устройств без значительного сопутствующего протекания или накопления остатков состава. Более конкретно, части 114, 214 имеют такую форму, что в соединенном виде они препятствуют вытеканию состава из корпуса аппликатора. Кроме того, структурная ориентация подающего канала, образованного между первой и второй частями, имеет форму, способствующую подаче, по существу, всего объема состава из устройства-аппликатора в процессе подачи. Таким образом, необходимо понимать, что, по меньшей мере, некоторые неожиданные преимущества обусловлены конечной формой и конфигурацией подающего канала, образованного собранными частями аппликатора. На фиг. 2 показан вид в перспективе полностью собранного аппликатора 106. Аппликатор 106 содержит корпус 108, задающий входную втулку 110 и выход 112. Согласно нижеприведенному подробному описанию входная втулка 110 выполнена с возможностью прикрепления к устройству 104 для доставки состава в процессе подачи, а выходная часть 112 выполнена с возможностью проникновения через волосяной покров тела животного, в результате чего состав может быть надлежащим образом подан из устройства на поверхность тела животного. Аппликатор 106 может быть выполнен из полиэтилена, полипропилена, поливинилацетата, полиэтилентерефталата,полибутилентерефталата и политетрафторэтилена, а также подобных веществ. В отношении сборки устройства: аппликатор 106 содержит первую и вторую части или поверхности (114, 214), соединенные или собранные с образованием корпуса 108. Согласно фиг. 3 и 4 первая часть 114 содержит верхнюю поверхность 117, нижнюю поверхность 118, задний край 119, выполненный заодно с входной втулкой 110, и первую и вторую стороны 120, 122, причем первая и вторая стороны заданы двумя, по существу, параллельными выходными концами или ножками 123, 125, которые отходят от плоской средней части 121, расположенной между первой и второй сторонами 120, 122, и которые частично окружают ее. Два ребра 124, 126, разнесенные в пространстве и параллельные друг другу, отходят вверх от верхней поверхности 117 первой предварительно собранной части 114 и размещены, по существу, вдоль внешней границы указанной части. В некоторых примерах реализации ребра 124, 126 имеют трапециевидную форму и содержат четыре стороны, причем верхняя и нижняя стороны параллельны друг другу. Согласно данному примеру реализации разнесенные в пространстве ребра 124, 126 содержат выполненный между ними паз или канал 127. Согласно некоторым аспектам паз 127 утоплен или углублен до уровня ниже верхней поверхности 117 первой части с образованием канала для доставки состава к выходным концам 123, 125 и, в конечном итоге, на тело животного. Для образования утопленного канала паз 127 выполнен в виде углубления,расположенного ниже поверхности 117 и имеющего, по существу, полукруглую форму. Более детальный и неограничивающий пример изображения указанной полукруглой геометрии приведен на фиг. 4 В, на которой показан разрез первой части 114, выполненный по линии 4 В на фиг. 4. Несмотря на то что на иллюстративном изображении показана полукруглая форма паза или канала 127, необходимо понимать,что может быть использована любая известная геометрическая форма, позволяющая образовать канал,позволяющий обеспечить протекание через него текучей среды или другого подобного жидкого агента. Согласно вышеприведенному описанию необходимо понимать, что первая предварительно собранная часть 114 выполнена с возможностью соединения со второй предварительно собранной частью 214 и с возможностью подгонки к ней с образованием полностью собранного устройства-аппликатора 106. Кроме того, канал или паз 127, выполненный между ребрами 124 и 126, размещен таким образом и имеет такую форму, что канал для текучей среды или водовод для подачи состава образован между устройством 104 для доставки текучей среды и подающим концом выхода 112 после соединения части 114 с частью 214 и подгонки к ней. На фиг. 5 вторая предварительно собранная часть 214 имеет форму, по существу, сходную с формой первой предварительно собранной части 114 и взаимодополняющую ее; однако вторая часть 214 не содержит соответствующей части входной втулки или конструкции ребер и паза, имеющихся в первой части 114. Напротив, вторая часть 214 содержит верхнюю поверхность 217, нижнюю поверхность 218 и задний край 219, содержащий закругленную часть 221, расположенную, по существу, по центру вдоль заднего края 219 и выполненную с возможностью, по существу, выравнивания с входной втулкой 110 первой части при сборке. Для обеспечения указанного выравнивания входная втулка 110 содержит плоский концевой участок 110 а, имеющий взаимодополняющую форму относительно плоского концевого участка 214 а второй части 214 и выполненный с возможностью бесшовного сопряжения с ним. Вторая предварительно собранная часть 214 также содержит первую и вторую стороны 220, 222, заданные двумя, по существу, параллельными выходными концами или ножками 223, 225, которые отходят, по существу, от плоской средней части 227, расположенной между первой и второй сторонами 220, 222, и которые окружают ее. Выступ или энергонаправляющий элемент 224, образованный двумя разнесенными в пространстве пазами 226, 228, отходит от нижней поверхности 218 второй части и расположен, по существу, вдоль ее внешней границы. Более подробное и неограничивающее иллюстративное изображение указанной геометрической конфигурации приведено на фиг. 4 А, на которой показан разрез второй части 214, выполненный по линии 4 А на фиг. 5. При сборке аппликатора 106 два разнесенных в пространстве ребра 124, 126 первой предварительно собранной части 114 выполнены с возможностью, по существу, выравнивания (и сопряжения) с разнесенными в пространстве пазами 226, 228 второй части 214 с образованием хода или канала 127 для подачи состава. В некоторых примерах реализации ход 127 выполнен асимметричным относительно бесшовного соединения 113 между первой и второй частями 114, 214. Вид первой и второй частей 114, 214, выровненных и сопряженных, в полной сборке показан на фиг. 4 С и 6, на которых соответственно показан разрез собранного аппликатора 106 по фиг. 2, выполненный по линии 4 С, и разрез собранного аппликатора 106 по фиг. 2, выполненный по линии 6. Согласно, в частности, фиг. 4 С после сварки первой и второй частей разнесенные в пространстве ребра 124, 126 входят в пазы 226, 228, в результате чего образуется бесшовное соединение 113 между двумя поверхностями 114, 214 и образуется канал 127 между указанными поверхностями. В частности,по существу, плоская часть канала 127 задана бесшовным соединением 113. В полностью собранном виде канал 127 образует ход для текучей среды между входной втулкой 110 и одним или несколькими выходами 112. Согласно фиг. 2 А дистальный конец 112 а выхода аппликатора открыт (см. позицию 127 а), в результате чего состав может быть полностью выведен из канала 127 в процессе подачи. В другом варианте реализации первая и вторая предварительно собранные части 114, 214 могут быть соединены друг с другом с образованием собранного аппликатора 106 посредством различных способов формования и изготовления пластика. Однако согласно некоторым аспектам аппликатор 106 выполнен путем ультразвуковой сварки первой и второй предварительно собранных частей 114, 214. Согласно данному неограничивающему примеру реализации первую и вторую предварительно собранные части 114, 214 сопрягают и выравнивают друг с другом согласно вышеприведенному описанию и выполняют ультразвуковую сварку, например, вдоль выступа 224, вследствие чего части оказываются бесшовно сварены или соединены друг с другом. Как известно специалисту в области изготовления и сварки пластика, процесс ультразвуковой сварки двух пластиковых деталей вдоль энергонаправляющего элемента, выполненного в одной из собранных деталей, позволяет обеспечивать прочное соединение, устойчивое на разрыв. В частности, под действием энергии ультразвука место контакта между деталями расплавляется с образованием тем самым бесшовного соединения. Кроме того, швы подобного типа обычно могут быть упрочнены путем увеличения глубины шва или увеличения размера энергонаправляющего элемента для обеспечения большей площади шва. Соответственно, необходимо понимать, что точные формы и размеры собранных компонентов, представленных в настоящем описании, не имеют большого значения, а специалисту будут очевидны варианты наилучших размеров и форм компонентов,позволяющие достичь наилучшего результата сварки для конкретного собираемого подающего устройства-аппликатора. Тем не менее, вариант реализации аппликатора 106 согласно фиг. 4 А-4 С обладает некоторыми преимуществами. В частности, преимущество конструкции первой части 114 и второй части 214 заключается в образовании, по существу, полукруглого канала 127, способствующего подаче состава через указанный канал, в результате которого после использования в канале остается минимальный объем остатка. Одна из причин указанного преимущества заключается в том, что путь сварочного шва, т.е. бесшовного соединения 113, расположен поблизости от пути протекания текучей среды, т.е. канала 127. Другая причина заключается в том, что вследствие наличия, по существу, плоской части канала 127, ребра 124, 126 могут быть размещены ближе друг к другу. Следовательно, канал 127 может иметь меньшие размеры,что позволяет уменьшить общий объем канала, что, в свою очередь, по существу, уменьшает объем остатка состава, остающегося в канале после подачи состава через канал. Другое преимущество показанного варианта реализации аппликатора 106 заключается в форме пазов 226, 228 и бурта 224 во второй части 214. Каждый паз имеет, по существу, V-образную форму, а выступ 224 является, по существу, плоским, согласно фиг. 4 А, в результате чего при сопряжении и выравнивании первой и второй предварительно собранных частей 114, 214 в канале 127 образуется лишь незначительная заливина или заливин не образуется вообще. Например, в ходе ультразвуковой сварки ультразвуковая энергия плавит энергонаправляющий элемент, т.е. выступ 224, с образованием соединения 113 между первой и второй частями 114, 214. На фиг. 4 С показано, что после сварки первой части 114 и второй части 214 образуется канал 127 без заливины. Заливина может препятствовать или нарушать ток состава по каналу 127. При наличии заливины в канале 127 после подачи состава в канале могут оставаться большие объемы остаточной текучей среды. Вследствие уменьшения или устранения заливины канал 127 сохраняет, по существу, полукруглую форму на всем протяжении, что согласно вышеприведенному описанию позволяет уменьшить объем остатка состава, остающегося в канале после использования. Однако вышеуказанное несправедливо для имеющих другую форму пазов и/или выступа во второй части. На фиг. 5 А, например, показан другой вариант реализации второй части 514, содержащей верхнюю поверхность 517 и нижнюю поверхность 518. Кроме того, показан другой разрез второй части 514, на котором пазы 526, 528 имеют трапециевидную форму. Трапециевидные пазы 526, 528 соответствуют по форме трапециевидным ребрам 124, 126 первой части 114 (фиг. 5 В). Энергонаправляющий элемент или выступ 524 второй части 514 выполнен,по существу, плоским и, соответственно, сходен с выступом 224 по фиг. 4 А. Согласно фиг. 5 С после сварки первой и второй частей разнесенные в пространстве ребра 124, 126 входят в пазы 526, 528, в результате чего образуется бесшовное соединение 113 между двумя поверхностями 117, 518 и канал 127 между указанными поверхностями. Однако в отличие от полукруглого канала 127 по фиг. 4 С в результате сопряжения трапециевидных пазов 526, 528 с трапециевидными ребрами 126, 128 образуется заливина 540, заполняющая часть канала 127. Заливина 540 уменьшает размер канала 127, в результате чего канал 127 более не имеет полукруглую форму. Одна из причин образования заливины в канале заключается в сложности сварки трапециевидных пазов 526, 528 с трапециевидными ребрами 126, 128. На фиг. 7 А показан другой вариант реализации второй части 714, содержащей верхнюю поверх- 10022648V-образную форму и, соответственно, сходные с пазами 226, 228 по фиг. 4 А. Однако вторая часть 714 также содержит энергонаправляющий элемент или выступ 724, имеющий неплоскую форму. Напротив,выступ 724 спрессован над нижней поверхностью 718 и имеет полукруглое поперечное сечение. Форма выступа 724 соответствует форме полукруглого канала 127 первой части 114, как показано на фиг. 7 В. Как можно видеть на фиг. 7 С, при сварке первой и второй частей разнесенные в пространстве ребра 124,126 входят в пазы 726, 728, в результате чего образуется бесшовное соединение 113 между двумя поверхностями 117, 718 и канал между указанными поверхностями. Канал 127, выполненный между первой и второй частями, имеет, по существу, круглое поперечное сечение, но в канале образуется заливина 740, препятствующая прохождению текучей среды по каналу. Заливина образуется в канале 127 вследствие затруднений при сварке двух частей друг с другом. Как можно видеть на фиг. 7 А, например, выступ 724 более не является, по существу, плоским. В частности, вдоль выступа 724, соприкасающегося с первой частью 114 для ультразвуковой сварки двух частей друг с другом, имеется очень небольшое количество материала. Таким образом, для обеспечения образования надлежащего соединения для удержания первой и второй частей вместе, заливина заполняет участки вдоль краев канала 127. Следовательно, несмотря на то что точные формы и размеры собранных компонентов, рассмотренных в настоящем описании, не имеют большого значения, преимущество может быть достигнуто, если собранные компоненты имеют формы и размеры, позволяющие добиться образования небольшого объема заливины или ее отсутствия. Ниже приведено более подробное описание различных деталей аппликатора 106. Согласно, в частности, фиг. 6, 8-8 В входная втулка 110 сообщается с первой частью 114 посредством текучей среды через проход 128, расположенный между двумя отверстиями 130, 132. Необходимо понимать, что сообщение между входной втулкой 110 и первой частью 114 посредством текучей среды задает водовод для проведения по нему состава из устройства 104 для доставки текучей среды в паз или канал 127. Точнее, входная втулка 110 содержит первое отверстие 130, расположенное на проксимальном конце 211 входной втулки 110 и выполняющее роль входного отверстия для размещения в нем выводного конца устройства для доставки текучей среды (такого, как устройство 104 по фиг. 1). Напротив первого отверстия 130 расположено второе отверстие 132, сообщающееся с пазом или каналом 127 корпуса 108 посредством текучей среды. Таким образом, входная втулка 110 выполнена с возможностью образования функционального отверстия для устройства 104 для доставки текучей среды, в результате чего может быть осуществлена легкая и удобная подача состава из указанного устройства. Входная втулка 110 содержит два язычка 111, выполненных с возможностью фиксации устройства для доставки текучей среды (не показано). В частности, устройство для доставки текучей среды (например, устройство 104 по фиг. 1) вводят в первое отверстие 130 и плотно соединяют с входной втулкой 110 посредством любых соединительных средств, известных из уровня техники. Примеры соединительных средств включают, без ограничения, винтовые соединения типа Люэр. Винтовые соединения типа Люэр широко известны в медицине и обычно используются для соединения шприца или другого подобного источника жидкости или газа с линией катетера или медицинским устройством. Кроме того, как известно специалисту, соединители типа Люэр могут быть охватывающими или охватываемыми и могут выполнять роль устройств с соединением типа Люэр-Лок, Люэр-Слип и т.д. Согласно некоторым аспектам соединение типа Люэр выполнено между устройством 104 для доставки текучей среды и язычками 111 входной втулки 110. Из вышеприведенного описания очевидно, что проход 128 для потока значительно уменьшается в диаметре в направлении потока текучей среды (т.е. от входной втулки 110 к дистальному концу 112 а выхода 112). Это необходимо для приспособления аппликатора к соединению с более крупными устройствами для доставки текучей среды на конце втулки 110, с одной стороны, и с крайне небольшим каналом 127, по которому текучая среда перемещается перед ее подачей из выхода или выходов 112, с другой стороны. Указанное уменьшение диаметра вызывает образование значительного давления в проходе 128,которое, в свою очередь, может привести к протечке при наличии ослабленных или легко повреждаемых участков, таких как сварочные швы на протяжении пути 128. С целью решения указанных проблем конструкции путь 120 выполнен изогнутым или непрямым, т.е. не представляет собой прямой путь между первым и вторым отверстиями 130, 132, и меняет направление один или несколько раз. Таким образом,путь 128 полностью выполнен внутри одной части (части 114) аппликатора, что позволяет избежать наличия сварочных швов на всем протяжении конструкции, образующей проход 128. Согласно фиг. 8 В,например, граница перехода между первой и второй частями, т.е. соединение 113 (фиг. 2), образует плоскость 800, проходящую через них. Согласно чертежу данного варианта реализации проход 128 смещен относительно плоскости 800. Благодаря размещению пути тока в одной части аппликатора (а не в двух частях, задающих проход потока между ними) и, следовательно, отсутствию каких-либо сварочных швов на участке, заданном путем 128 тока, вероятность протечки при прохождении текучей среды между устройством 104 для доставки текучей среды и каналом 127 значительно снижена или вовсе устранена. Конструкция, образующая проход 128, показана на фиг. 8 и 8 А, где водовод, образованный входной втулкой 110, содержит короткую полую цилиндрическую камеру 134, расположенную между первым и вторым отверстиями 130, 132 и оканчивающуюся, по существу, по центру, переходя в канал 127 через второе отверстие 132. Камера 134 обычно выполнена таким образом, что она имеет переменные размеры(т.е. ширина и высота камеры между первым отверстием 130 и вторым отверстием 132 варьируются). Согласно данному аспекту внутренний диаметр камеры 134 меняется для снижения диаметра и получения конфигурации, необходимой для поддержания прохода 128 в одной части 114 аппликатора. Согласно вышеприведенному описанию было обнаружено, что указанная конфигурация позволяет избежать протечек состава по мере его прохождения между устройством для доставки текучей среды и каналом. Согласно некоторым аспектам в конструкцию аппликаторов согласно настоящему изобретению изнутри может быть встроена одна или более трубок или других подобных внутренних трубчатых конструкций. Например, во избежание возможных сопутствующих протечек в области соединения между устройством для доставки текучей среды и аппликатором или вдоль соединения 113, образованного между первым и вторым литыми частями 114, 214, на части входной втулки 110 и/или внутри образованного канала 127 корпуса аппликатора могут быть выполнены одна или несколько внутренних камер. Несмотря на то что подобная дополнительная конструкция может быть включена в любой из вариантов реализации без выхода за пределы объема изобретения, необходимо понимать, что подобные конструкции не являются обязательными. В частности, было обнаружено, что использование изогнутого прохода и взаимодополняющей конструкции частей аппликатора позволяет обеспечить лишенную трубок конструкцию,не только лишенную отводов, но также способную работать без возникновения протечек. В некоторых вариантах реализации камера 134 содержит выступы или другие сходные конструкции для обеспечения изогнутой конфигурации и сужающегося диаметра прохода 128. Согласно другим аспектам проход 128 расположен под бесшовным соединением 113, выполненным между первой и второй частями 114, 214 и под каналом 127, образованным между ними. Согласно некоторым аспектам второе отверстие 132 направляет состав в канал в направлении, по существу, перпендикулярном продольному направлению канала 127. Подобный вариант реализации показан, например, на фиг. 8 и 8 А. Несмотря на то что размеры и/или геометрическая форма второго отверстия 132 могут быть изменены с целью приспособления устройства к доставке определенного состава,отверстие 132 имеет, по существу, прямоугольную форму. Согласно еще одному проиллюстрированному аспекту изогнутый проход 128 содержит, по существу, полукруглую часть, соединенную с водоводом для проведения по нему состава из устройства 104 для доставки текучей среды в канал 127. Согласно данному проиллюстрированному аспекту изогнутый проход 128 оканчивается на втором отверстии 132, расположенном, по существу, перпендикулярно относительно, по существу, полукруглой части изогнутого прохода 128. После того как состав полностью проходит и обходит канал 127 и достигает дистального конца 112 а одного или нескольких выходов 112, он готов к подаче на поверхность тела или шерстный покров животного. Согласно вышеприведенному описанию выход 112 может проникать через волосяной покров животного и достигать его кожи с целью равномерного распределения состава по поверхности тела животного. С этой целью выход 112 может содержать один или несколько штырей 129, способствующих подаче состава на поверхность тела животного. В некоторых вариантах реализации штыри 129 содержат разнесенные в пространстве ножки или зубцы, выполненные с возможностью проникновения через волосяной покров животного 102, в результате чего аппликатор 106 может, по существу, достичь поверхности тела животного в ходе введения состава или соприкоснуться с ней. Указанное проникновение позволяет обеспечить более эффективное местное или трансдермальное высвобождение агента. Кроме того,специалисту в области доставки лекарственных средств и подачи текучих сред будет очевидно, что использование дополнительных штырей или других подобных выступов из выхода 112 препятствует капиллярному воздействию или притяжению (т.е. препятствует перемещению состава наверх по внешней стороне выхода) в процессе введения состава. Сведение к минимуму и/или полное устранение эффекта капиллярного воздействия имеет особые преимущества при использовании составов, считающихся вредными и/или опасными. Настоящее изобретение также включает трансдермальный состав с единичной дозой, содержащий терапевтически эффективное количество композиции, содержащей фентанил, усилитель проникновения,выбранный из группы, состоящей из длинноцепочечного алкил-пара-аминобензоата, длинноцепочечного алкилдиметил-пара-аминобензоата, длинноцепочечного алкилциннамата, длинноцепочечного алкилметоксициннамата, длинноцепочечного алкилсалицилата, октилдиметил-пара-аминобензоата, октил-параметоксициннамата, октисалицилата или смесей указанных соединений, и летучую жидкость, выбранную из группы, состоящей из этанола, этилацетата, изопропанола, ацетона, этилформиата, метанола,метилацетата, метилэтилкетона, пентана и хлороформа или смеси указанных соединений, подходящих для введения. В некоторых вариантах реализации композиция содержит фентанил в дозе от примерно 0,01 до примерно 0,1 мг/кг массы тела животного семейства лошадиных. В некоторых вариантах реализации композиция содержит фентанил в дозе примерно 0,04 мг/кг массы тела животного семейства лошадиных. В некоторых вариантах реализации трансдермальный состав с единичной дозой контролирует боль у животных семейства лошадиных в течение эффективного периода времени. В некоторых вариантах реализации эффективный период времени включает период, составляющий по меньшей мере 6 ч,составляющий по меньшей мере 8 ч, период, составляющий по меньшей мере 12 ч, период, составляющий по меньшей мере 24 ч, период, составляющий по меньшей мере 48 ч, период, составляющий по меньшей мере 72 ч, или период, составляющий по меньшей мере 96 ч. В одном из вариантов реализации трансдермальный состав с единичной дозой вводят один раз по меньшей мере каждые 6 ч. В одном из вариантов реализации трансдермальный состав с единичной дозой вводят один раз по меньшей мере каждые 8 ч. В одном из вариантов реализации трансдермальный состав с единичной дозой вводят один раз по меньшей мере каждые 12 ч. В одном из вариантов реализации трансдермальный состав с единичной дозой вводят один раз по меньшей мере каждые 24 ч. В одном из вариантов реализации трансдермальный состав с единичной дозой вводят один раз по меньшей мере каждые 48 ч. В другом варианте реализации трансдермальный состав с единичной дозой вводят один раз по меньшей мере каждые 72 ч. В другом варианте реализации трансдермальный состав с единичной дозой вводят один раз по меньшей мере каждые 96 ч. В соответствии со способами согласно настоящему изобретению термин "трансдермальный состав с единичной дозой" включает варианты реализации, в которых композицию можно трансдермально вводить за один или несколько раз. В одном из вариантов реализации трансдермальный состав композиции с единичной дозой можно трансдермально вводить животному семейства лошадиных за один раз в один участок на коже животного. В другом варианте реализации трансдермальный состав композиции с единичной дозой можно трансдермально вводить животному семейства лошадиных за несколько раз в более чем один участок на коже животного. В другом варианте реализации трансдермальный состав композиции с единичной дозой можно трансдермально вводить животному семейства лошадиных за несколько раз в один участок на коже животного. В некоторых вариантах реализации трансдермальный состав композиции с единичной дозой содержит от примерно 0,1 до примерно 10 мл раствора композиции. В некоторых вариантах реализации трансдермальный состав композиции с единичной дозой содержит от примерно 0,2 до примерно 8 мл раствора композиции. В некоторых вариантах реализации трансдермальный состав композиции с единичной дозой содержит от примерно 0,3 до примерно 6 мл раствора композиции. В некоторых вариантах реализации трансдермальный состав композиции с единичной дозой содержит от примерно 0,5 до примерно 5 мл раствора композиции. В некоторых вариантах реализации трансдермальный состав композиции с единичной дозой содержит от примерно 0,7 до примерно 3 мл раствора композиции. В некоторых вариантах реализации трансдермальный состав композиции с единичной дозой содержит от примерно 0,8 до примерно 2 мл раствора композиции. В одном из вариантов реализации трансдермальный состав композиции с единичной дозой содержит примерно 0,9 мл раствора композиции. В другом варианте реализации трансдермальный состав композиции с единичной дозой содержит примерно 1,0 мл раствора композиции. В одном из вариантов реализации трансдермальный состав композиции с единичной дозой трансдермально вводят животному семейства лошадиных за один раз в один участок на коже животного, причем за один раз вводят примерно 0,9 мл раствора композиции. В другом варианте реализации трансдермальный состав композиции с единичной дозой трансдермально вводят животному семейства лошадиных за несколько раз в один участок на коже животного, причем каждый раз вводят примерно до 0,9 мл раствора композиции. В другом варианте реализации трансдермальный состав композиции с единичной дозой трансдермально вводят животному семейства лошадиных за несколько раз в более чем один участок на коже животного, причем каждый раз вводят примерно до 0,9 мл раствора композиции. В вариантах реализации, в которых применяется многократное введение композиции, многократное введение животному семейства лошадиных можно осуществлять в течение целесообразного периода времени. Также рассматриваются следующие варианты реализации. 1. Способ контролирования боли, включающий трансдермальное введение нуждающемуся в этом животному семейства лошадиных терапевтически эффективного количества композиции, содержащей фентанил, усилитель проникновения и летучую жидкость, где указанная композиция представляет собой раствор. 2. Способ по п.1, где боль контролируют в течение эффективного периода времени. 3. Способ по п.2, где эффективный период времени составляет примерно 6 ч. 4. Способ по п.2, где эффективный период времени составляет примерно 8 ч. 5. Способ по п.2, где эффективный период времени составляет примерно 12 ч. 6. Способ по п.2, где эффективный период времени составляет примерно 24 ч. 7. Способ по п.2, где эффективный период времени составляет примерно 48 ч. 8. Способ по любому из пп.1-7, где композицию вводят в виде единичной дозы. 9. Способ лечения боли, включающий трансдермальное введение животному семейства лошадиных, нуждающемуся в лечении, терапевтически эффективного количества композиции, содержащей фентанил, усилитель проникновения и летучую жидкость, где указанную композицию вводят в виде единичной дозы и где доза является эффективной для лечения боли в течение примерно 12 ч. 10. Способ по любому из пп.1-9, где усилитель проникновения представляет собой октилсалицилат. 11. Способ по любому из пп.1-10, где летучая жидкость представляет собой пропанол. 12. Способ по любому из пп.1-11, где боль связана с коликами. 13. Способ по любому из пп.1-11, где боль связана с ламинитом. 14. Способ по любому из пп.1-13, где боль связана с проведенной или предполагаемой для проведения животному семейства лошадиных операцией. 15. Способ по п.14, где операция представляет собой ортопедическую хирургию. 16. Способ по п.14, где операция представляет собой хирургию мягких тканей. 17. Способ по п.4, где операция связана с коликами. 18. Способ по любому из пп.1-17, где трансдермальное введение осуществляют животному семейства лошадиных в спинной участок. 19. Способ по любому из пп.1-17, где трансдермальное введение осуществляют животному семейства лошадиных в брюшной участок. 20. Способ по любому из пп.1-17, где трансдермальное введение осуществляют животному семейства лошадиных в переднюю ногу. 21. Способ по любому из пп.1-17, где трансдермальное введение осуществляют животному семейства лошадиных в шею. 22. Способ по любому из пп.1-17, где трансдермальное введение осуществляют животному семейства лошадиных в участок под гривой. 23. Способ по любому из пп.1-22, где композицию вводят в виде нескольких доз. 24. Способ по любому из пп.1-23, где композицию вводят в виде единичной дозы. 25. Способ по любому из пп.1-24, где композиция содержит от примерно 0,1 до примерно 10%(мас./об.) фентанила, от примерно 0,1 до примерно 10% (мас./об.) усилителя проникновения и от примерно 80 до примерно 99,8% (мас./об.) летучей жидкости. 26. Способ по любому из пп.1-25, где композиция содержит от примерно 3 до примерно 7%(мас./об.) фентанила, от примерно 3 до примерно 7% (мас./об.) усилителя проникновения и от примерно 86 до примерно 94% (мас./об.) летучей жидкости. 27. Способ по любому из пп.1-26, где композиция содержит примерно 5% (мас./об.) фентанила,примерно 5% (мас./об.) усилителя проникновения и примерно 90% (мас./об.) летучей жидкости. 28. Способ по любому из пп.1-27, где фентанил содержится в дозе в количестве от примерно 0,001 до примерно 1 мг/кг массы животного семейства лошадиных. 29. Способ по любому из пп.1-28, где фентанил содержится в дозе в количестве от примерно 0,01 до примерно 0,1 мг/кг массы животного семейства лошадиных. 30. Способ по любому из пп.1-29, где фентанил содержится в дозе в количестве примерно 0,04 мг/кг массы животного семейства лошадиных. 31. Способ по любому из пп.1-29, где фентанил содержится в дозе в количестве примерно 0,01 мг/кг массы животного семейства лошадиных. 32. Способ по любому из пп.1-31, где композицию вводят с одним или более другими терапевтическими ингредиентами. 33. Способ по любому из пп.1-32, где композицию вводят с применением устройства для трансдермальной подачи лекарственного средства. 34. Трансдермальный состав в виде раствора с единичной дозой, содержащий терапевтически эффективное количество композиции, содержащей фентанил, усилитель проникновения, выбранный из группы, состоящей из длинноцепочечного алкил-пара-аминобензоата, длинноцепочечного алкилдиметил-пара-аминобензоата, длинноцепочечного алкилциннамата, длинноцепочечного алкилметоксициннамата,длинноцепочечного алкилсалицилата,октилдиметил-пара-аминобензоата,октил-параметоксициннамата, октисалицилата или смесей указанных соединений, и летучую жидкость, выбранную из группы, состоящей из этанола, этилацетата, изопропанола, ацетона, этилформиата, метанола,метилацетата, метилэтилкетона, пентана, хлороформа или смеси указанных соединений. 35. Состав по п.34, подходящий для введения в дозе от примерно 0,001 до примерно 1 мг фентанила на 1 кг массы тела животного семейства лошадиных. 36. Состав по любому из пп.34, 35, подходящий для введения в дозе от примерно 0,01 до примерно 0,1 мг фентанила на 1 кг массы тела животного семейства лошадиных. 37. Состав по любому из пп.34-36, подходящий для введения в дозе примерно 0,04 мг фентанила на 1 кг массы тела животного семейства лошадиных. 38. Состав по любому из пп.34-36, подходящий для введения в дозе примерно 0,01 мг фентанила на 1 кг массы тела животного семейства лошадиных. 39. Состав по любому из пп.34-38, который вводят один раз по меньшей мере каждые 6 ч. 40. Состав по любому из пп.34-38, который вводят один раз по меньшей мере каждые 8 ч. 41. Состав по любому из пп.34-38, который вводят один раз по меньшей мере каждые 12 ч. 42. Состав по любому из пп.34-38, который вводят один раз по меньшей мере каждые 24 ч. 43. Состав по любому из пп.34-38, который вводят один раз по меньшей мере каждые 48 ч. Пример 1. Сравнительное фармакокинетическое исследование трансдермальной композиции фентанила, вводимой животным семейства лошадиных и псовых. Для сравнения фармакокинетических параметров композиции согласно настоящему изобретению после трансдермального введения можно проводить исследование способов согласно настоящему изобретению. Например, для лошадиных и псовых оценивали фармакокинетические параметры фентанила,введенного в составе композиции согласно настоящему изобретению. Композицию согласно настоящему изобретению трансдермально вводили животным семейства лошадиных в дозе примерно 0,04 мг/кг. Композицию трансдермально вводили через выстриженную и очищенную кожу на задней ноге животного семейства лошадиных. После введения животному семейства лошадиных максимальную среднюю концентрацию фентанила в плазме наблюдали примерно 5 ч, и рассчитанное значение составило примерно 9 нг/мл. Максимальная средняя концентрация фентанила в плазме, наблюдавшаяся у лошадиных, оказалась по меньшей мере в четыре раза больше, чем целевая терапевтическая концентрация (т.е. примерно 1 нг/мл), наблюдавшаяся у псовых и у людей. После трансдермального введения композиции согласно настоящему изобретению продолжительность времени, необходимого для достижения терапевтической концентрации фентанила в плазме у лошадиных, составила менее 1 ч. Кроме того, концентрации фентанила в плазме у лошадиных оставалась выше порога терапевтической концентрации в течение примерно 12 ч. Примерно через 24 ч после введения композиции согласно настоящему изобретению средняя концентрация фентанила в плазме у лошадиных снизилась примерно до 0,116 нг/мл. Вводимые дозы композиции согласно настоящему изобретению хорошо переносились лошадиными, и в месте введения не наблюдалось аномальных побочных реакций. Также в результате введения доз композиции у лошадиных не наблюдалось чрезмерного возбуждения ЦНС. Фармакокинетические параметры фентанила после трансдермального введения композиции согласно настоящему изобретению приведены в табл. 1. Фармакокинетические параметры фентанила, вводимого в композиции согласно настоящему изобретению лошадиным, являются уникальными по сравнению с фармакокинетическими параметрами вводимой псовым композиции согласно настоящему изобретению. Например, у лошадиных количество фентанила, поступающего в большой круг кровообращения в результате трансдермального введения композиции, оказалось выше ожиданий, основанных на сравнительных аллометрических расчетах абсорбции фентанила у псовых. Кроме того, у псовых для достижения концентрации фентанила в плазме по меньшей мере 1 нг/мл требуются значительно большие дозы трансдермально вводимого фентанила. Таблица 1 Фармакокинетика фентанила после трансдермального применения композиции у лошадиных и псовых Различные исследования введения фентанила посредством трансдермального пластыря показали,что терапевтически эффективная доза фентанила для лошадиных меньше по сравнению с дозой для псовых. Указанные сводные данные приведены в табл. 2. Таблица 2 Терапевтически эффективные дозы фентанила, вводимого посредством трансдермальных пластырей (Duragesic) Кроме того, трансдермальное введение композиции согласно настоящему изобретению приводило к неожиданно большей абсорбции фентанила у лошадиных по сравнению с предположительной величиной всасывания, оцененной на основе введения фентанила посредством трансдермального пластыря. Например, терапевтически эффективная доза фентанила, трансдермально вводимого лошадиным посредством трансдермального пластыря, оказалась примерно в 7 раз меньше, чем терапевтически эффективная доза фентанила для псовых. Для сравнения, терапевтически эффективная доза фентанила, трансдермально вводимого лошадиным посредством композиции согласно настоящему изобретению, оказалась примерно в 70 раз меньше, чем терапевтически эффективная доза фентанила для псовых. Данные результаты позволяют считать, что абсорбция фентанила в результате трансдермального введения лошадиным композиции согласно настоящему изобретению является уникальной и отличной от ожиданий, основанных на сравнительных данных для фентанила, трансдермально вводимого псовым посредством трансдермального пластыря. Кроме того, трансдермальное введение лошадиным композиции согласно настоящему изобретению позволяет достичь менее изменчивых фармакокинетических параметров фентанила по сравнению с введением фентанила псовым посредством трансдермального пластыря. Указанные сводные данные приведены в табл. 3. Таблица 3 Сравнение фармакокинетических параметров фентанила,вводимого лошадиным посредством трансдермального применения композиции или трансдермального пластыря ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ контролирования боли, включающий трансдермальное введение нуждающемуся в этом животному семейства лошадиных терапевтически эффективного количества композиции, содержащей фентанил, усилитель проникновения и летучую жидкость, где указанная композиция представляет собой раствор, где фентанил вводится в дозе от примерно 0,01 до примерно 0,1 мг/кг массы животного. 2. Способ по п.1, где боль контролируют в течение эффективного периода времени, составляющего примерно 12 ч. 3. Способ по п.1 или 2, где композицию вводят в виде единичной дозы. 4. Способ по любому из пп.1-3, где усилитель проникновения представляет собой октилсалицилат,а летучая жидкость представляет собой изопропанол. 5. Способ по любому из пп.1-4, где боль связана с проведенной или предполагаемой для проведения операцией у животного семейства лошадиных или с коликами. 6. Способ по любому из пп.1-5, отличающийся тем, что композиция содержит от примерно 0,1 до примерно 10% (мас./об.) фентанила, от примерно 0,1 до примерно 10% (мас./об.) усилителя проникновения и от примерно 80 до примерно 99,8% (мас./об.) летучей жидкости. 7. Трансдермальный состав в виде раствора со стандартной дозой для применения у животных семейства лошадиных, содержащий терапевтически эффективное количество композиции, содержащей фентанил; усилитель проникновения, выбранный из группы, состоящей из длинноцепочечного алкилпара-аминобензоата, длинноцепочечного алкилдиметил-пара-аминобензоата, длинноцепочечного алкилциннамата, длинноцепочечного алкилметоксициннамата, длинноцепочечного алкилсалицилата, октилдиметил-пара-аминобензоата, октил-пара-метоксициннамата, октилсалицилата или их смесей; и летучую жидкость, выбранную из группы, состоящей из этанола, этилацетата, изопропанола, ацетона, этилформиата, метанола, метилацетата, метилэтилкетона, пентана, хлороформа или их смесей, при этом указанный состав содержит от примерно 0,01 до примерно 0,1 мг фентанила на 1 кг массы тела животного семейства лошадиных. 8. Состав по п.7, где указанный состав подходит для введения один раз по меньшей мере каждые 12 ч.
МПК / Метки
МПК: A61K 9/00, A61K 31/4468, A61K 47/10, A61K 47/14
Метки: раствора, животных, способы, контролирования, трансдермального, боли, применением, лошадиных, семейства, фентанила
Код ссылки
<a href="https://eas.patents.su/22-22648-sposoby-kontrolirovaniya-boli-u-zhivotnyh-semejjstva-loshadinyh-s-primeneniem-transdermalnogo-rastvora-fentanila.html" rel="bookmark" title="База патентов Евразийского Союза">Способы контролирования боли у животных семейства лошадиных с применением трансдермального раствора фентанила</a>
Предыдущий патент: Система извлечения катализатора, устройство для реакции синтеза углеводородов, реакционная система для синтеза углеводородов и способ извлечения катализатора
Следующий патент: Производные 6,7-дигидропиразоло[1,5-a]пиразин-4-иламина, пригодные в качестве ингибиторов бета-секретазы (bace)
Случайный патент: Амфифильные оксамидные органические гелеобразователи для получения гелей на основе органических растворителей, воды и углеводородного промышленного топлива