4-замещенные пирролидин-2-оны и их применение
Номер патента: 16518
Опубликовано: 30.05.2012
Авторы: Шуле Арно, Кеснель Янник, Атес Селаль, Люркен Франсуа
Формула / Реферат
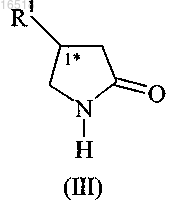
1. Оптические изомеры 4-замещенных пирролидин-2-онов формулы (III)
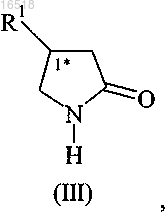
в которой R1 обозначает C1-С3-алкил, необязательно замещенный по меньшей мере одним галогеном, или С2-С4-алкенил, замещенный двумя атомами галогена,
характеризующиеся энантиомерным избытком не менее 95% соединения формулы (III), содержащего стереогенный центр, отмеченный (1*) в указанной конфигурации (R) или (S).
2. Оптические изомеры по п.1, характеризующиеся энантиомерным избытком не менее 96% соединения формулы (III), содержащего стереогенный центр, отмеченный (1*) в указанной конфигурации (R) или (S).
3. Оптические изомеры по п.1, характеризующиеся энантиомерным избытком не менее 97% соединения формулы (III), содержащего стереогенный центр, отмеченный (1*) в указанной конфигурации (R) или (S).
4. Оптические изомеры по п.1, характеризующиеся энантиомерным избытком не менее 98% соединения формулы (III), содержащего стереогенный центр, отмеченный (1*) в указанной конфигурации (R) или (S).
5. Оптические изомеры по п.1, характеризующиеся энантиомерным избытком не менее 99% соединения формулы (III), содержащего стереогенный центр, отмеченный (1*) в указанной конфигурации (R) или (S).
6. Оптические изомеры формулы (III) по п.1, в которой R1 обозначает н-пропил.
7. Оптические изомеры формулы (III) по п.1, в которой R1 обозначает этил.
8. Оптические изомеры формулы (III) по п.1, в которой R1 обозначает 2,2-дифторвинил.
9. Оптические изомеры формулы (III) по п.2, в которой стереогенный центр (1*) обладает конфигурацией (R).
10. Оптические изомеры формулы (III) по п.3, в которой стереогенный центр (1*) обладает конфигурацией (S).
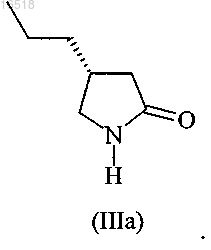
11. Соединение (R)-4-пропилпирролидин-2-он формулы (IIIa)
12. Соединение (S)-4-(2,2-дифторвинил)пирролидин-2-он формулы (IIIb)

13. Соединение по п.11 или 12, характеризующееся энантиомерным избытком не менее 95% соединения формулы (IIIa) или соединения формулы (IIIb) соответственно.
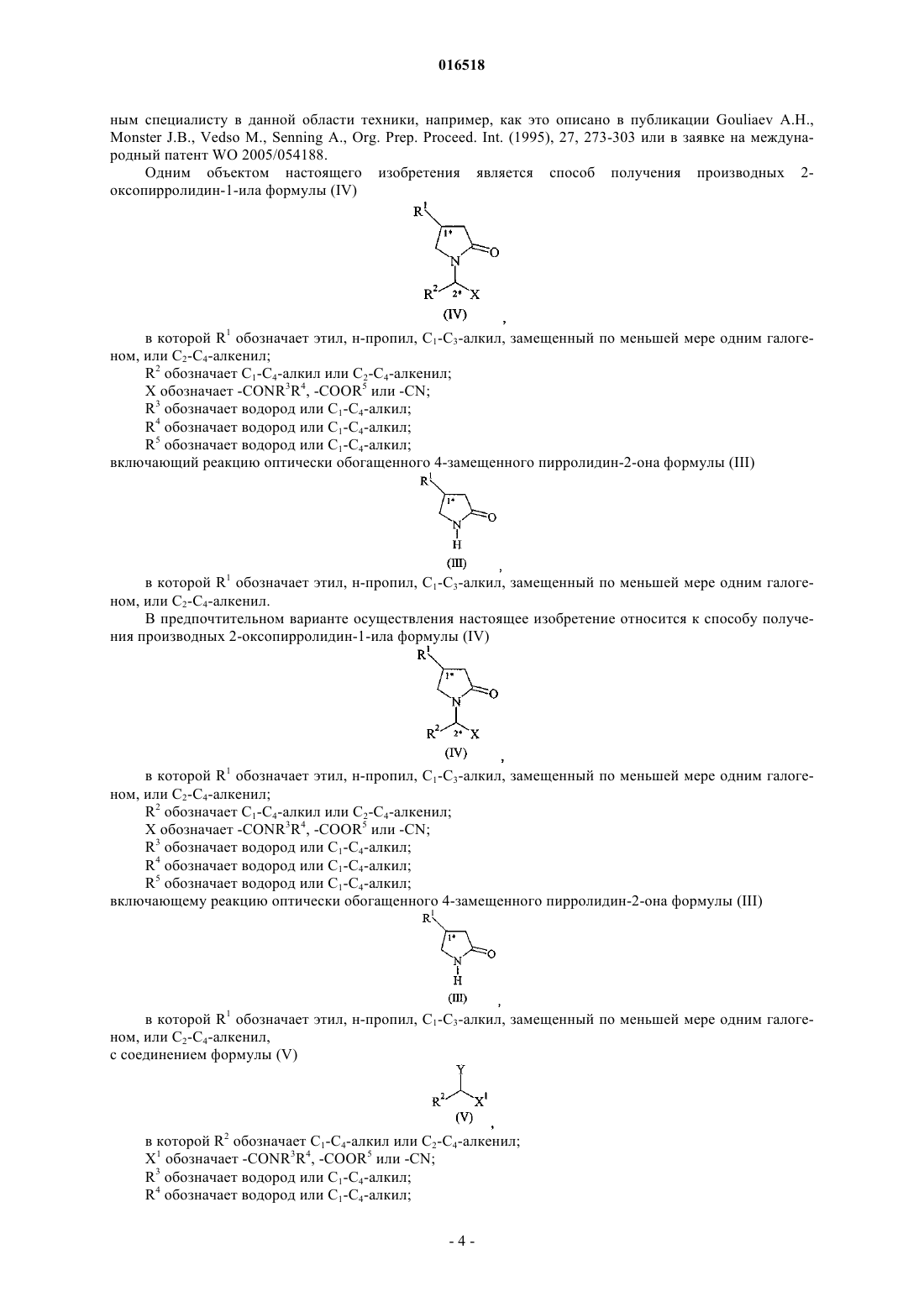
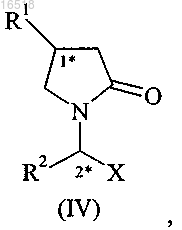
14. Способ получения в основном диастереоизомерно чистых производных 2-оксопирролидин-1-ила формулы (IV)

в которой R1 обозначает C1-С3-алкил, замещенный по меньшей мере одним галогеном, включая этил, н-пропил, или С2-С4-алкенил, замещенный двумя атомами галогена;
R2 обозначает С1-С4-алкил или С2-С4-алкенил;
X обозначает -CONR3R4, -COOR5 или -CN;
R3 обозначает водород или С1-С4-алкил;
R4 обозначает водород или С1-С4-алкил;
R5 обозначает водород или С1-С4-алкил; включающий:
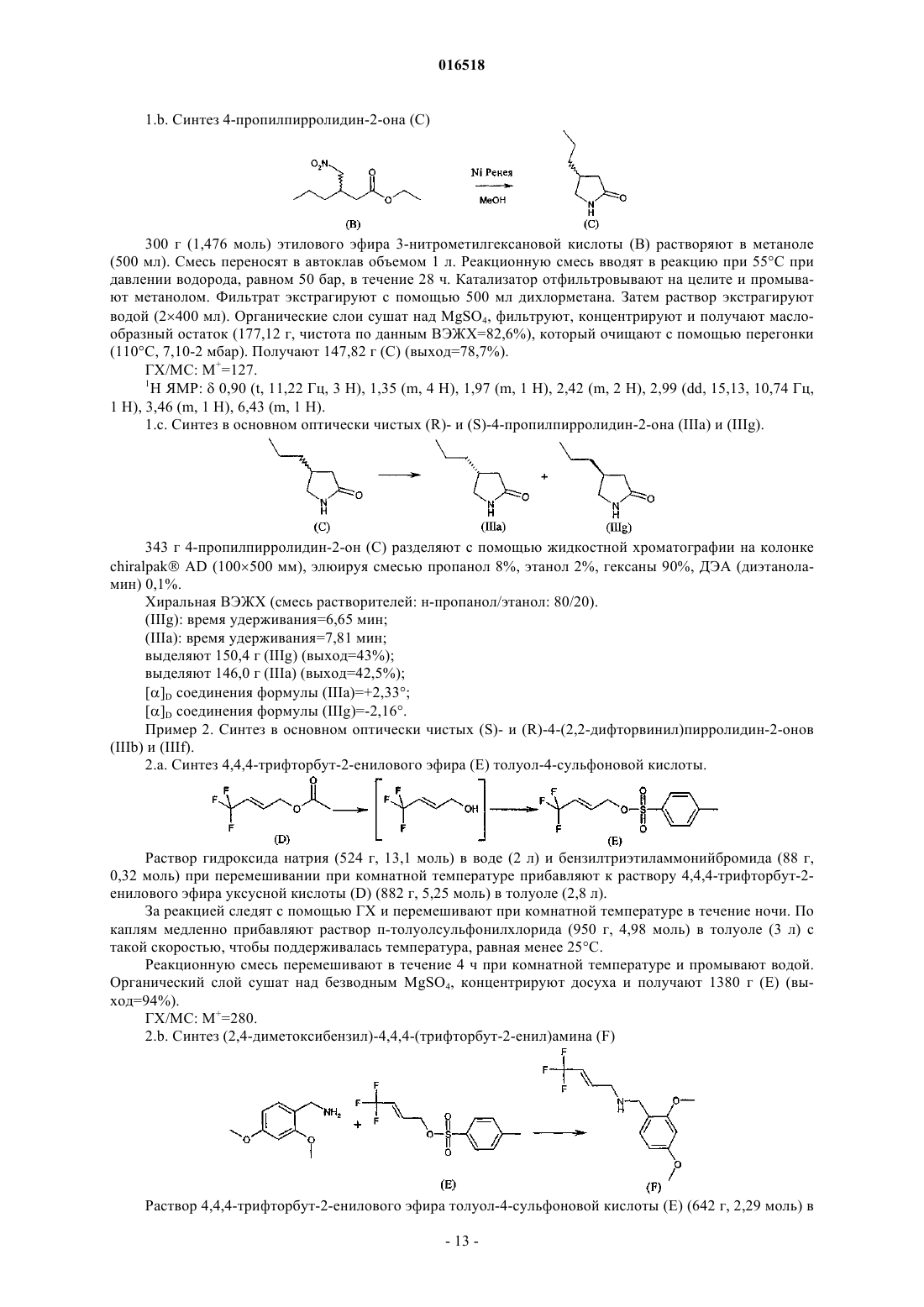
(i) реакцию в основном оптически чистого 4-замещенного пирролидин-2-она формулы (III)
в которой R1 обозначает C1-С3-алкил, замещенный по меньшей мере одним галогеном, включая этил, н-пропил, или С2-С4-алкенил, замещенный двумя атомами галогена,
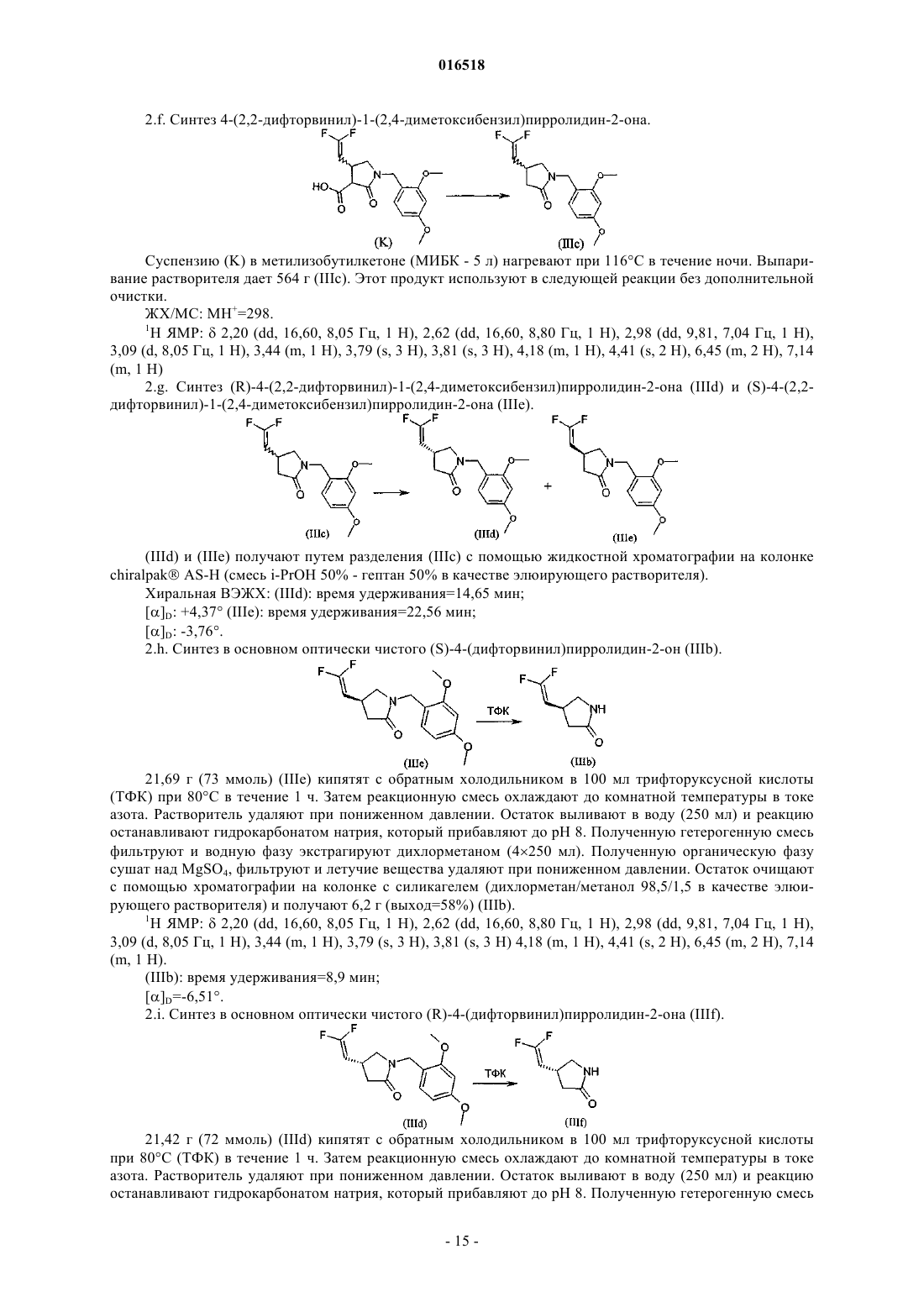
с соединением формулы (V)
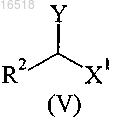
в которой Y обозначает отщепляющуюся группу, выбранную из галогена, сульфонатной группы и -N2+;
R2 обозначает С1-С4-алкил или С2-С4-алкенил;
X1 обозначает -CONR3R4, -COOR5 или -CN;
R3 обозначает водород или С1-С4-алкил;
R4 обозначает водород или С1-С4-алкил;
R5 обозначает водород или С1-С4-алкил,
в присутствии основания, выбранного из группы, включающей гидрид калия, гидрид натрия, метоксид натрия, метоксид калия, изопропоксид натрия, трет-бутоксид натрия и трет-бутоксида калия, и в растворителе, выбранном из группы, включающей изопропанол, трет-бутанол, диметоксиэтан и толуол;
(ii) разделение смеси эпимеров соединений формулы (IV), полученных в результате стадии (i).
15. Способ получения в основном диастереоизомерно чистых производных 2-оксопирролидин-1-ила формулы (IV)
в которой R1 обозначает С1-С3-алкил, замещенный по меньшей мере одним галогеном, включая этил, н-пропил, или С2-С4-алкенил, замещенный двумя атомами галогена;
R2 обозначает С1-С4-алкил или С2-C4-алкенил;
X обозначает -CONR3R4;
R3 обозначает водород;
R4 обозначает водород;
включающий:
(i) реакцию в основном оптически чистого 4-замещенного пирролидин-2-она формулы (III)

в которой R1 обозначает этил, н-пропил, C1-С3-алкил, замещенный по меньшей мере одним галогеном, или С2-С4-алкенил, замещенный двумя атомами галогена,
с соединением формулы (V)
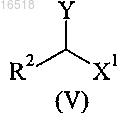
в которой R2 обозначает С1-С4-алкил или С2-С4-алкенил;
X1 обозначает -COOR5;
R5 обозначает С1-С4-алкил;
Y обозначает отщепляющуюся группу, выбранную из галогена, сульфонатной группы и -N2+,
в присутствии основания, выбранного из группы, включающей гидрид калия, гидрид натрия, метоксид натрия, метоксид калия, изопропоксид натрия, трет-бутоксид натрия и трет-бутоксида калия, и в растворителе, выбранном из группы, включающей изопропанол, трет-бутанол, диметоксиэтан и толуол;
(ii) осуществление аммонолиза смеси эпимеров соединения формулы (VI), полученных в результате стадии (i)
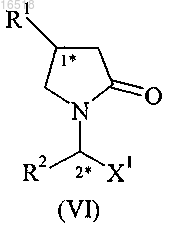
где R1 обозначает C1-С3-алкил, замещенный по меньшей мере одним галогеном, включая этил, н-пропил, или С2-С4-алкенил, замещенный двумя атомами галогена;
R2 обозначает С1-С4-алкил или С2-С4-алкенил;
X1 обозначает -COOR5;
R5 обозначает С1-С4-алкил;
(iii) разделение смеси эпимеров соединений формулы (IV), полученных в результате стадии (ii)
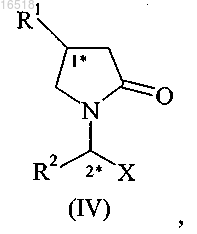
в которой R1 обозначает C1-С3-алкил, замещенный по меньшей мере одним галогеном, включая этил, н-пропил, или С2-С4-алкенил, замещенный двумя атомами галогена;
R2 обозначает С1-С4-алкил или С2-С4-алкенил;
X обозначает -CONR3R4;
R3 обозначает водород;
R4 обозначает водород.
16. Способ по любому из пп.14 или 15, в котором указанная смесь эпимеров включает эпимеры, отношение количеств которых близко к 1.
17. Способ получения бриварацетама (I)
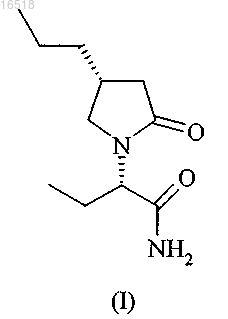
включающий следующие стадии:
(i) реакцию в основном оптически чистого (R)-4-пропилпирролидин-2-она (IIIa) с соединением формулы (V)
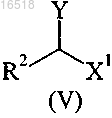
в которой Y обозначает отщепляющуюся группу, выбранную из атомов галогена;
R2 обозначает этил;
X1 обозначает COOR5;
R5 обозначает С1-С4-алкил,
в присутствии основания, выбранного из группы, включающей гидрид калия, гидрид натрия, метоксид натрия, метоксид калия, изопропоксид натрия, трет-бутоксид натрия и трет-бутоксида калия, и в растворителе, выбранном из группы, включающей изопропанол, трет-бутанол, диметоксиэтан и толуол;
(ii) осуществление аммонолиза смеси эпимеров соединений формулы (VIa), полученных в результате стадии (i);
(iii) разделение бриварацетама (I) и соединения формулы (VII)
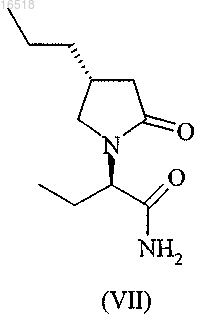
полученных в результате стадии (ii).
18. Способ по п.17, который включает эпимеризацию соединения формулы (VII) в смесь бриварацетама (I) и соединения формулы (VII) посредством взаимодействия соединения формулы (VII) с основанием, выбранным из группы, включающей гидрид калия, гидрид натрия, метоксид натрия, метоксид калия, изопропоксид натрия, трет-бутоксид натрия и трет-бутоксид калия.
Текст
В изобретении представлены оптически обогащенные или в основном оптически чистые 4 замещенные пирролидин-2-оны формулы (III) и их применение для синтеза производных 2-оксопирролидин-1-ила. 016518 Настоящее изобретение относится к 4-замещенным пирролидин-2-онам и их применению для получения производных 2-оксопирролидин-1-ила. Производные 2-оксопирролидин-1-ила, такие как (2S)-2-[(4R)-2-оксо-4-пропилпирролидин-1 ил]бутанамид(I) и (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидин-1-ил]бутанамид(II), известны под международными непатентованными названиями бриварацетам (I) и селетрацетам(II) соответственно и методики их получения и их применение в качестве фармацевтических средств описаны в международной заявке WO 01/62726. Эти производные являются особенно подходящими для лечения неврологических нарушений. В международных заявках WO 01/64637 и WO 03/014080 описаны способы получения производных 2-оксопирролидин-1-ила с использованием пирролидин-2-онов. Согласно изобретению неожиданно установлено, что оптически обогащенные 4-замещенные пирролидин-2-оны или оптически чистые 4-замещенные пирролидин-2-оны можно использовать в качестве исходных веществ для синтеза производных 2-оксопирролидин-1-ила. Одним объектом настоящего изобретения являются оптические изомеры 4-замещенных пирролидин-2-онов формулы (III) в которой R1 обозначает C1-С 3-алкил, необязательно замещенный по меньшей мере одним галогеном, или С 2-С 4-алкенил, замещенный двумя атомами галогена,характеризующиеся энантиомерным избытком не менее 95% соединения формулы (III), содержащего стереогенный центр, отмеченный (1) в указанной конфигурации (R) или (S). Термин "алкил" при использовании в настоящем изобретении означает группу, которая является насыщенным, одновалентным углеводородным радикалом, содержащим линейный (неразветвленный),разветвленный или циклический фрагмент или их комбинацию. Предпочтительный алкил содержит 1-3 атома углерода. Алкильные группы необязательно могут быть замещены 1-5 заместителями, независимо выбранными из группы, включающей галоген, гидроксигруппу, алкоксигруппу, сложноэфирную группу,ацил, цианогруппу, ацилоксигруппу, карбоксигруппу, амидную группу и аминогруппу. Предпочтительными алкильными группами являются метил, этил, н-пропил, необязательно замещенный по меньшей мере одним атомом галогена. Термин "алкенил" при использовании в настоящем изобретении означает незамещенный или замещенный разветвленный, неразветвленный или циклический углеродный радикал или их комбинацию,содержащий по меньшей мере одну двойную связь. Предпочтительный алкенил содержит 2-4 атома углерода. "Алкенильные" фрагменты необязательно могут быть замещены 1-5 заместителями, независимо выбранными из группы, включающей галоген, гидроксигруппу, алкоксигруппу, сложноэфирную группу,ацил, цианогруппу, ацилоксигруппу, карбоксигруппу, амидную группу и аминогруппу. Предпочтительный алкенил замещен по меньшей мере одним галогеном. Более предпочтительный алкенил замещен по меньшей мере двумя галогенами. Наиболее предпочтительным алкенилом является 2,2-дифторвинил. Термин "галоген" при использовании в настоящем изобретении означает атом фтора, хлора, брома или йода. Предпочтительным галогеном является фтор или бром. Термин "гидроксигруппа" при использовании в настоящем изобретении обозначает группу формулы -ОН. Термин "алкоксигруппа" при использовании в настоящем изобретении обозначает группу формулы-ORa, в которой Ra обозначает С 1-С 4-алкил, определенный выше. Термин "ацил" при использовании в настоящем изобретении обозначает группу формулы RbCO-, в которой Rb обозначает С 1-С 4-алкил, определенный выше. Термин "сложноэфирная группа" при использовании в настоящем изобретении обозначает группу формулы -COORc, в которой Rc обозначает C1-С 4-алкил, определенный выше. Термин "цианогруппа" при использовании в настоящем изобретении обозначает группу формулы-1 016518 Термин "ацилоксигруппа" при использовании в настоящем изобретении обозначает группу формулы -O-CORd, в которой Rd обозначает С 1-С 4-алкил, определенный выше, или арильную группу. Термин "арил" при использовании в настоящем изобретении означает органический радикал, образованный из ароматического углеводорода путем удаления одного атома водорода, например фенил. Термин "карбоксигруппа" при использовании в настоящем изобретении означает группу формулы-СООН. Термин "аминогруппа" при использовании в настоящем изобретении означает группу формулы-NH2, NHRe или NRfRe, в которой Re и Rf являются алкильными группами, определенными выше в настоящем описании. Термин "амидная группа" при использовании в настоящем изобретении означает группу формулы-NH2-CO-, -NHRg или -NRgRh-CO, в которой Rg и Rh являются алкильными группами, определенными выше в настоящем описании. Соединения формулы (III) в своей структуре содержат по меньшей мере один стереогенный центр,отмеченный (1). Стереогенный центр может находиться в R- или S-конфигурации, эти обозначения R иS используются в соответствии с правилами, приведенными в публикации Pure. Appl. Chem., 45 (1976),11-30. Выражение "оптически обогащенные" при использовании в настоящем изобретении при указании конкретного соединения означает, что более 50%, предпочтительно более 75%, более предпочтительно более 85%, наиболее предпочтительно более 94% соединения содержит стереогенный центр, отмеченный(1) в указанной конфигурации (R) или (S). В предпочтительном варианте осуществления настоящее изобретение относится к в основном оптически чистым 4-замещенным пирролидин-2-онам формулы (III) в которой R1 обозначает этил, н-пропил, C1-С 3-алкил, замещенный по меньшей мере одним галогеном, или С 2-С 4-алкенил. Выражение "в основном оптически чистое" при использовании в настоящем изобретении при указании конкретного соединения означает, что не менее 95%, предпочтительно не менее 96%, более предпочтительно не менее 97%, наиболее предпочтительно не менее 98%, еще более предпочтительно не менее 99% соединения содержит стереогенный центр, отмеченный (1) в указанной конфигурации (R) или(S). Оптически обогащенные или в основном оптически чистые 4-замещенные пирролидин-2-оны являются особенно полезными для синтеза производных 2-оксопирролидин-1-ила, которые можно использовать для лечения или использовать для приготовления лекарственного средства, предназначенного для лечения различных заболеваний. Предпочтительно, если R1 обозначает н-пропил или С 2-С 4-алкенил. Более предпочтительно, если R1 обозначает н-пропил или С 2-C4-алкенил, указанный С 2-С 4-алкенил замещен по меньшей мере одним галогеном. Наиболее предпочтительно, если R1 обозначает н-пропил или С 2 алкенил, указанный С 2 алкенил замещен по меньшей мере одним галогеном. В предпочтительном варианте осуществления R1 обозначает н-пропил или С 2 алкенил, указанный С 2 алкенил замещен по меньшей мере двумя галогенами. Наилучший R1 обозначает н-пропил или 2,2-дифторвинил. Предпочтительно, если в случае, когда R1 обозначает н-пропил, не менее 95%, предпочтительно не менее 96%, более предпочтительно не менее 97%, наиболее предпочтительно не менее 98%, еще более предпочтительно не менее 99% соединения формулы (III) содержит стереогенный центр, отмеченный(1) в конфигурации (R). Предпочтительно, если в случае, когда R1 обозначает 2,2-дифторвинил, не менее 95%, предпочтительно не менее 96%, более предпочтительно не менее 97%, наиболее предпочтительно не менее 98%,еще более предпочтительно не менее 99% соединения формулы (III) содержит стереогенный центр, отмеченный (1) в конфигурации (S). В предпочтительном варианте осуществления настоящее изобретение относится к соединению (R)4-пропилпирролидин-2-он формулы (IIIa) Предпочтительно, если соединение (IIIa) является в основном оптически чистым. В другом предпочтительном варианте осуществления настоящее изобретение относится к соединению (S)-4-(2,2-дифторвинил)пирролидин-2-он формулы (IIIb) Предпочтительно, если соединение (IIIa) является в основном оптически чистым. В основном оптически чистые 4-замещенные пирролидин-2-оны (IIIa) и (IIIb) являются особенно полезными для синтеза бриварацетама (I) и селетрацетама (II) соответственно. В основном оптически чистые 4-замещенные пирролидин-2-оны формулы (III) можно получить путем хирального разделения соответствующих рацемических 4-замещенных пирролидин-2-онов. Предпочтительно, если такое хиральное разделение проводят на стационарной фазе, выбранной из группы,включающей chiralpak AD, chiralpak AD-H, chiralcel OD, chiralcel OD-H, chiralcel OJ, chiralcelOJ-H, chiralcel OG, chiralcel OG-H, chiralcel OB-H, которые продает фирма Daicel Chemical Industries, Ltd. (Japan). Разделение рацемических 4-замещенных пирролидин-2-онов можно провести с использованием разных элюирующих растворителей. Примерами элюирующих растворителей являются алканы, спирты и их смеси. Обычно в контексте настоящего изобретения смеси этих растворителей используют в соотношении, которое зависит от типа применяющейся и от разделяемых 4-замещенных пирролидин-2-онов. Предпочтительно, если в зависимости от разделяемых 4-замещенных пирролидин-2-онов используют смеси аланы/спирты в соотношении 90/10, 85/15 или 50/50. Более предпочтительно, если алкан выбран из группы, включающей н-гексан, 2-метилпентан, н-гептан и их смеси, и спирт выбран из группы,включающей метанол, этанол, изопропанол, н-пропанол и их смеси. Предпочтительными смесями спиртов являются смеси н-пропанол/этанол в соотношении 75/25 или 50/50 и н-пропанол/метанол в соотношении 75/25 или 50/50. Обычно выбор растворителя и стационарной фазы в соответствии с разделяемым субстратом должен быть очевиден для специалиста в данной области техники. Альтернативно, стадию разделения можно проводить для защищенных производных 2 оксопирролидин-1-ила, например, производных 2-оксопирролидин-1-ила общей формулы (IIIc), и получить защищенные в основном оптически чистые производные 2-оксопирролидин-1-ила общих формул(IIId) и (IIIe), у которых затем удаляют защитные группы и получают искомые в основном оптически чистые 4-замещенные пирролидин-2-оны формулы (III) Разделение (IIIc) обычно проводят с использованием смеси алкан/спирт в соотношении 50/50, предпочтительно смеси гексана или гептана этанолом, изопропанолом или н-пропанолом в соотношении 50/50, наиболее предпочтительно смеси гептан/изопропанол в соотношении 50/50. Удаление защитных групп можно проводить по реакции производных 2-оксопирролидин-1-ила общих формул (III) и (IIIe) с кислотой, предпочтительно трифторуксусной кислотой, по обычным методикам, известным специалисту в данной области техники. Можно использовать самые различные защитные группы, выбор которых должен быть очевиден для специалиста в данной области техники. Рацемические 4-замещенные пирролидин-2-оны можно получить по обычным методикам, извест-3 016518 ным специалисту в данной области техники, например, как это описано в публикации Gouliaev A.H.,Monster J.В., Vedso M., Senning A., Org. Prep. Proceed. Int. (1995), 27, 273-303 или в заявке на международный патент WO 2005/054188. Одним объектом настоящего изобретения является способ получения производных 2 оксопирролидин-1-ила формулы (IV) в которой R1 обозначает этил, н-пропил, C1-С 3-алкил, замещенный по меньшей мере одним галогеном, или С 2-С 4-алкенил;R3 обозначает водород или С 1-С 4-алкил;R4 обозначает водород или С 1-С 4-алкил;R5 обозначает водород или С 1-С 4-алкил; включающий реакцию оптически обогащенного 4-замещенного пирролидин-2-она формулы (III) в которой R1 обозначает этил, н-пропил, C1-С 3-алкил, замещенный по меньшей мере одним галогеном, или С 2-С 4-алкенил. В предпочтительном варианте осуществления настоящее изобретение относится к способу получения производных 2-оксопирролидин-1-ила формулы (IV) в которой R1 обозначает этил, н-пропил, C1-С 3-алкил, замещенный по меньшей мере одним галогеном, или С 2-С 4-алкенил;R3 обозначает водород или С 1-С 4-алкил;R4 обозначает водород или С 1-С 4-алкил;R5 обозначает водород или С 1-С 4-алкил; включающему реакцию оптически обогащенного 4-замещенного пирролидин-2-она формулы (III) в которой R1 обозначает этил, н-пропил, C1-С 3-алкил, замещенный по меньшей мере одним галогеном, или С 2-C4-алкенил,с соединением формулы (V)R3 обозначает водород или С 1-С 4-алкил;R4 обозначает водород или С 1-С 4-алкил;R5 обозначает водород или С 1-С 4-алкил;Y обозначает отщепляющуюся группу, выбранную из группы, включающей галоген, сульфонатную группу и -N2+. Предпочтительно, если способ получения производных 2-оксопирролидин-1-ила формулы (IV),предлагаемых в настоящем изобретении, включает реакцию в основном оптически чистых 4-замещенных пирролидин-2-онов формулы (III). Термин "отщепляющаяся группа" при использовании в настоящем изобретении обладает значением, известным специалисту в данной области техники (Advanced Organic Chemistry: reactions, mechanismsand structure - Third Edition by Jerry March, John Wiley and Sons Ed.; 1985, page 179), и означает группу,которая является частью молекулы субстрата и присоединена к ней; в реакции, в которой молекула субстрата подвергается замещению (например, с помощью нуклеофила), отщепляющаяся группа подвергается замещению. Термин "сульфонатная группа" при использовании в настоящем изобретении обозначает группу формулы -O-SO2-Ri, в которой Ri обозначает алкил или арил, определенный выше в настоящем описании. Предпочтительными сульфонатными группами являются метансульфонатная, пара-толуолсульфонатная и трифторметансульфонатная группа. Соединение формулы (V), в которой Y обозначает -N2+, можно образовать in situ из соответствующего соединения, содержащего аминогруппу, по реакции с NaNO2 в присутствии кислоты по методикам,описанным, например, в следующих публикациях: J. Chem. Soc. Chem. Commun. 1976, 234; J. Am. Chem.Soc. 1949, 71, 1096; J. Am. Chem. Soc. 1990, 112(17), 6388; Helv. Chem. Acta, 1963, 46, 927 или по любым обычным методикам, известным специалисту в данной области техники. Реакция соединения (III) с соединением (V) происходит в присутствии основания в растворителе. Предпочтительное основание выбрано из группы, включающей гидрид калия, гидрид натрия, метоксид натрия, метоксид калия, изопропоксид натрия, трет-бутоксид натрия и трет-бутоксид калия. Предпочтительный растворитель выбран из группы, включающей изопропанол, трет-бутанол, диметоксиэтан и толуол. Реакцию обычно проводят при температуре от 0 до 25 С. Реакция оптически обогащенных или в основном оптически чистых 4-замещенных пирролидин-2 онов формулы (III) с соединением формулы (V) обычно дает соединения формулы (VI) в которой R1 обозначает этил, н-пропил, С 1-С 3-алкил, замещенный по меньшей мере одним галогеном, или С 2-С 4-алкенил;R3 обозначает водород или С 1-С 4-алкил;R4 обозначает водород или С 1-С 4-алкил;R5 обозначает водород или С 1-С 4-алкил. В соединениях (III), (IV), (V) и (VI), предлагаемых в настоящем изобретении, предпочтительно, если R1 обозначает н-пропил или С 2-С 4-алкенил. Более предпочтительно, если R1 обозначает н-пропил или С 2-C4-алкенил, указанный С 2-С 4-алкенил замещен по меньшей мере одним галогеном. Наиболее предпочтительно, если R1 обозначает н-пропил или С 2 алкенил, указанный С 2 алкенил замещен по меньшей мере одним галогеном. Предпочтительно, если R1 обозначает н-пропил или С 2 алкенил, указанный С 2 алкенил замещен по меньшей мере двумя галогенами. Наилучший R1 обозначает н-пропил или дифторвинил. Предпочтительно, если R2 обозначает С 1-С 4-алкил. Более предпочтительно, если R2 обозначает этил. Предпочтительно, если X обозначает -CONR3R4. Предпочтительно, если R3 обозначает водород. Предпочтительно, если R4 обозначает водород. Предпочтительно, если Х 1 обозначает COOR5. Предпочтительно, если R5 обозначает С 1-С 4-алкил. Более предпочтительно, если R5 обозначает метил. В контексте настоящего изобретения предпочтительно, если Y обозначает галоген или сульфонатную группу. В контексте настоящего изобретения более предпочтительно, если Y обозначает галоген. В контексте настоящего изобретения более предпочтительно, если Y обозначает бром. Использование оптически обогащенных или в основном оптически чистых 4-замещенных пирроли-5 016518 дин-2-онов обеспечивает то преимущество, что уменьшается содержание нежелательных стереоизомеров производных 2-оксопирролидин-1-ила (IV) и (VI), образующихся во время реакции, и тем самым повышается эффективность способа в целом. Предпочтительно, если способ получения производных 2-оксопирролидин-1-ила формулы (IV),предлагаемых в настоящем изобретении в которой X обозначает -CONR3R4 и R3 и R4 обозначают водород,дополнительно включает аммонолиз соединений формулы (VI) в которой X1 обозначает -COOR5 и R5 обозначает С 1-С 4-алкил. Предпочтительно, если R5 обозначает метил. Аммонолиз можно проводить при условиях, описанных в заявке на международный патентWO 03/014080 или по любой обычной методике, известной специалисту в данной области техники. Соединения формулы (IV) и соединения формулы (VI) в своей структуре содержат по меньшей мере два стереогенных центра, отмеченных (1) и (2). Стереогенные центры могут находиться в R- или Sконфигурации, указанные обозначения R и S используются в соответствии с правилами, приведенными в публикации Pure. Appl. Chem., 45 (1976) 11-30. Соединения формулы (IV) и соединения формулы (VI) могут независимо представлять собой смесь диастереоизомеров. Предпочтительно, если соединения формулы (IV) и соединения формулы (VI) независимо являются смесью эпимеров. Термин "эпимеры" при использовании в настоящем изобретении в случае указания диастереоизомеров обозначают два диастереоизомера, содержащие только один стереогенный центр в разных конфигурациях. Наиболее предпочтительно, если соединения формулы (IV) и соединения формулы (VI) независимо являются смесью эпимеров по отношению к стереогенному центру (2). Указанная смесь может содержать эпимеры, отношение количеств которых равно 1. Предпочтительно, если указанная смесь содержит эпимеры, отношение количеств которых близко к 1. Предпочтительный эпимер соединений формулы (IV) и предпочтительный эпимер соединений формулы (VI) представляет собой эпимер, содержащий стереогенный центр (2) в (S)-конфигурации. В предпочтительном варианте осуществления соединения формулы (IV) и соединения формулы(VI), предлагаемые в настоящем изобретении, являются диастереоизомерно обогащенными. Выражение "диастереоизомерно обогащенный" при использовании в настоящем изобретении при указании конкретного соединения означает, что не менее 95%, предпочтительно не менее 96%, более предпочтительно не менее 97%, наиболее предпочтительно не менее 98%, еще более предпочтительно не менее 99% соединения содержит стереогенный центр, отмеченный (1) в указанной конфигурации (R) или (S), и что более 50%, предпочтительно более 75%, более предпочтительно более 85%, наиболее предпочтительно более 94% соединения содержит стереогенный центр, отмеченный (2) в указанной конфигурации (R) или (S). Более предпочтительно, если соединения формулы (IV) и соединения формулы (VI), предлагаемые в настоящем изобретении, являются в основном диастереоизомерно чистыми. Выражение "в основном диастереоизомерно чистый" при использовании в настоящем изобретении при указании конкретного соединения означает, что не менее 95%, предпочтительно не менее 96%, более предпочтительно не менее 97%, наиболее предпочтительно не менее 98%, еще более предпочтительно не менее 99% соединения содержит стереогенный центр, отмеченный (1) в указанной конфигурации (R) или (S), и что не менее 95%, предпочтительно не менее 96%, более предпочтительно не менее 97%, наиболее предпочтительно не менее 98%, еще более предпочтительно не менее 99% соединения содержит стереогенный центр, отмеченный (2) в указанной конфигурации (R) или (S). Аммонолиз можно проводить для смеси диастереоизомеров соединений формулы (VI), для смеси эпимеров соединений формулы (VI), для диастереоизомерно обогащенных соединений формулы (VI) или для диастереоизомерно чистых соединений формулы (VI).-6 016518 Обычно аммонолиз диастереоизомерно обогащенных соединений формулы (VI) дает диастереоизомерно обогащенные соединения формулы (IV). Обычно аммонолиз в основном диастереоизомерно чистых соединений формулы (VI) дает диастереоизомерно чистые соединения формулы (IV). Предпочтительно, если аммонолиз проводят для смеси эпимеров соединений формулы (VI). Обычно конфигурация стереогенного центра (1) и конфигурация стереогенного центра (2) соединений формулы (IV) являются такими же, как соответственно конфигурация стереогенного центра (1) и стереогенного центра (2) соединений формулы (VI). В основном диастереоизомерно чистые соединения формулы (IV) и диастереоизомерно чистые соединения формулы (VI) можно получить соответственно путем разделения смеси диастереоизомеров соединений формулы (IV) или соединений формулы (VI), или альтернативно путем разделения соответственно смеси эпимеров соединений формулы (IV) или соединений формулы (VI) по любой обычной методике, известной специалисту в данной области техники. Предпочтительно, если указанное разделение проводят с помощью хроматографии с использованием ахиральной или хиральной стационарной фазы по обычным методикам, известным специалисту в данной области техники. Диастереоизомерно обогащенные соединения формулы (IV) и диастереоизомерно обогащенные соединения формулы (VI) можно превратить соответственно во в основном диастереоизомерно чистые соединения формулы (IV) и в основном диастереоизомерно чистые соединения формулы (VI) по обычным методикам, известным специалисту в данной области техники. Это можно выполнить, например, путем разделения или перекристаллизации по обычным методикам, известным специалисту в данной области техники. Предпочтительно, если в основном диастереоизомерно чистые соединения формулы (IV) и в основном диастереоизомерно чистые соединения формулы (VI) получают путем разделения соответственно диастереоизомерно обогащенных соединений формулы (IV) и диастереоизомерно обогащенных соединений формулы (VI). В другом варианте осуществления способ, предлагаемый в настоящем изобретении, включает стадию разделения. Конфигурация стереогенного центра (1) и конфигурация стереогенного центра (2) соединений формулы (IV) и соединений формулы (VI) могут быть одинаковыми или разными. Предпочтительной конфигурацией стереогенного центра (2) соединений формулы (IV) и соединений формулы (VI) является (S). Наиболее предпочтительно, если в основном диастереоизомерно чистые соединения формулы (IV) и в основном диастереоизомерно чистые соединения формулы (VI) содержат не менее 95%, предпочтительно не менее 96%, более предпочтительно не менее 97%, наиболее предпочтительно не менее 98%,еще более предпочтительно не менее 99% стереогенного центра, отмеченного (2) в конфигурации (S). В основном диастереоизомерно чистые соединения формулы (IV) и основном диастереоизомерно чистые соединения формулы (VI) можно подвергнуть эпимеризации и получить соответственно смесь эпимеров соединений формулы (IV) или соединений формулы (VI), указанных выше в настоящем изобретении. Указанную смесь эпимеров можно дополнительно разделить и получить в основном диастереоизомерно чистые соединения формулы (IV) или в основном диастереоизомерно чистые соединения формулы (VI). Обычно в контексте настоящего изобретения указанная эпимеризация дает смесь эпимеров. Обычно отношение количеств эпимеров равно менее 100, предпочтительно менее 3, более предпочтительно менее 2 и наиболее предпочтительно, если оно равно 1. Таким образом, способ, предлагаемый в настоящем изобретении, предпочтительно дополнительно включает стадию эпимеризации. Обычно эпимеризацию проводят для в основном диастереоизомерно чистых соединений формулы(IV) или для в основном диастереоизомерно чистых соединений формулы (VI), которые содержат стереогенный центр (2) в нежелательной конфигурации. Поэтому предпочтительно, если стадию эпимеризации проводят для в основном диастереоизомерно чистых соединений формулы (IV) или для в основном диастереоизомерно чистых соединений формулы(VI), в которых стереогенный центр (2) обладает конфигурацией (R). Более предпочтительно, если указанную эпимеризацию проводят для в основном диастереоизомерно чистых соединений формулы (IV), в которых стереогенный центр (2) обладает конфигурацией (R). Наиболее предпочтительно, если указанную эпимеризацию проводят для в основном диастереоизомерно чистых соединений формулы (IV), в которых X обозначает -CONH2 и в которых стереогенный центр (2) обладает конфигурацией (R). Указанная стадия эпимеризации может обеспечить регенерацию нежелательных в основном диастереоизомерно чистых соединений формулы (IV) или формулы (VI) и тем самым уменьшить количество отходов в промышленном масштабе и таким образом повысить выход продукции. Эпимеризацию обычно проводят по реакции в основном диастереоизомерно чистого соединения-7 016518 формулы (IV) или в основном диастереоизомерно чистого соединения формулы (VI) с основанием в растворителе. Обычно основание выбрано из группы, включающей гидрид калия, гидрид натрия, метоксид натрия, метоксид калия, изопропоксид натрия, трет-бутоксид натрия и трет-бутоксида калия. В случае, когда R1 обозначает С 2-C4-алкенил, основанием предпочтительно является изопропоксид натрия, трет-бутоксид натрия или трет-бутоксида калия. Эти основания исключают образование нежелательных побочных продуктов, которые могут образоваться вследствие присоединения основания к С 2-С 4 алкенилу. Согласно изобретению неожиданно установлено, что такое присоединение может протекать, например, когда метоксид натрия или метоксид калия вводят в реакцию с соединением формулы (IV) или соединением формулы (VI), в которой R1 обозначает С 2-С 4-алкенил, предпочтительно 2,2-дифторвинил. Предпочтительный растворитель выбран из группы, включающей изопропанол, трет-бутанол, диметоксиэтан и толуол. Более предпочтительным растворителем является изопропанол. В предпочтительном варианте осуществления настоящее изобретение относится к применению оптически обогащенных 4-замещенных пирролидин-2-онов формулы (III) в качестве промежуточных продуктов для синтеза. В другом предпочтительном варианте осуществления настоящее изобретение относится к применению в основном оптически чистых 4-замещенных пирролидин-2-онов формулы (III) в качестве промежуточных продуктов для синтеза. Другим объектом настоящего изобретения является применение в основном оптически чистых или оптически обогащенных 4-замещенных пирролидин-2-онов формулы (III) для синтеза диастереоизомерно обогащенных соединений формулы (IVa) или (VIa) Другим объектом настоящего изобретения является применение в основном оптически чистых или оптически обогащенных 4-замещенных пирролидин-2-онов формулы (III) для синтеза диастереоизомерно обогащенных соединений формулы (IVb) или (VIb) В соединениях (VIa) и (VIb), R5 является таким, как определено выше в настоящем описании. Настоящее изобретение предпочтительно относится к применению 4-пропилпирролидин-2-она для синтеза бриварацетама (I). Настоящее изобретение более предпочтительно относится к применению оптически обогащенного 4-пропилпирролидин-2-она для синтеза бриварацетама (I). Настоящее изобретение еще более предпочтительно относится к применению в основном оптически чистого 4-пропилпирролидин-2-она для синтеза бриварацетама (I). Настоящее изобретение наиболее предпочтительно относится к применению (R)-4 пропилпирролидин-2-она для синтеза бриварацетама (I). Другим объектом настоящего изобретения является применение 4-(2,2-дифторвинил)пирролидин-2 она для синтеза селетрацетама (II). Настоящее изобретение предпочтительно относится к применению оптически обогащенного 4-(2,2 дифторвинил)пирролидин-2-она для синтеза селетрацетама (II). Настоящее изобретение более предпочтительно относится к применению в основном оптически чистого 4-(2,2-дифторвинил)пирролидин-2-она для синтеза селетрацетама (II). Настоящее изобретение наиболее предпочтительно относится к применению (S)-4-(2,2 дифторвинил)пирролидин-2-она для синтеза селетрацетама (II). В предпочтительном варианте осуществления настоящее изобретение относится к способу получения бриварацетама (I) указанный способ включает реакцию в основном оптически чистого (R)-4-пропилпирролидин-2-она(IIIa). В другом предпочтительном варианте осуществления настоящее изобретение относится к способу получения бриварацетама (I), указанный способ включает реакцию в основном оптически чистого (R)-4 пропилпирролидин-2-она (IIIa) с соединением формулы (V)R5 обозначает С 1-С 4-алкил. Предпочтительно, если R5 обозначает метил. В контексте настоящего изобретения предпочтительно, если Y обозначает галоген или сульфонатную группу. В контексте настоящего изобретения более предпочтительно, если Y обозначает галоген. В контексте настоящего изобретения наиболее предпочтительно, если Y обозначает бром. Предпочтительно, если способ получения бриварацетама (I) дополнительно включает аммонолиз соединения формулы (VIa) в которой R5 обозначает С 1-С 4-алкил с получением смеси бриварацетама (I) и соединения (VII) В соединении (VIa) R5 предпочтительно обозначает метил. Более предпочтительно, если способ получения бриварацетама (I) дополнительно включает разделение бриварацетама (I) и соединения (VII), описанное выше в настоящем изобретении. Наиболее предпочтительно, если способ получения бриварацетама (I) дополнительно включает эпимеризацию соединения формулы (VII) в смесь бриварацетама (I) и соединения формулы (VII), описанную выше в настоящем изобретении, за указанной эпимеризацией следует другая стадия разделения. В еще более предпочтительном варианте осуществления способ получение бриварацетама (I) включает повторение указанной эпимеризации и указанной другой стадии разделения. В другом предпочтительном варианте осуществления настоящее изобретение относится к способу получения селетрацетама (II) Указанный способ включает реакцию в основном оптически чистого (S)-4-(2,2 дифторвинил)пирролидин-2-она (IIIb). В другом предпочтительном варианте осуществления настоящее изобретение относится к способу получения селетрацетама (II), указанный способ включает реакцию в основном оптически чистого (S)-4(2,2-(дифторвинил)пирролидин-2-она с соединением формулы (V)R5 обозначает С 1-С 4-алкил. Предпочтительно, если R5 обозначает метил. В контексте настоящего изобретения предпочтительно, если Y обозначает галоген или сульфонатную группу. В контексте настоящего изобретения более предпочтительно, если Y обозначает галоген. В контексте настоящего изобретения наиболее предпочтительно, если Y обозначает бром. Предпочтительно, если способ получения селетрацетама (II) дополнительно включает аммонолиз соединения формулы (VIb) в которой R5 обозначает С 1-С 4-алкил,с получением смеси селетрацетама (II) и соединения (VIII) В соединении (VIb) R5 предпочтительно обозначает метил. Более предпочтительно, если способ получения селетрацетама (II) дополнительно включает разделение селетрацетама (II) и соединения формулы (VIII), описанное выше в настоящем изобретении. Наиболее предпочтительно, если способ получения селетрацетама (II) дополнительно включает эпимеризацию соединения формулы (VIII) в смесь селетрацетама (I) и соединения формулы (VIII), описанную выше в настоящем изобретении, за указанной эпимеризацией следует другая стадия разделения. В еще более предпочтительном варианте осуществления способ получения селетрацетама (II) включает повторение указанной эпимеризации и указанной другой стадии разделения.- 10016518 Примеры Приведенные ниже примеры представлены только для иллюстративных целей и не предназначены для рассмотрения и не должны рассматриваться в качестве каким-либо образом ограничивающих настоящее изобретение. Специалисты в данной области техники должны понимать, что без выхода за пределы объема и сущности настоящего изобретения можно выполнить обычные изменения и модификации приведенных ниже примеров. Характеризацию соединений примеров 1 и 2 проводят по указанным ниже методикам и при указанных условиях. Спектры ЯМР (ядерного магнитного резонанса) снимают на Фурье-ЯМР спектрометре Bruker AC 250 с использованием компьютера Aspect 3000 и 5 мм двухпозиционного 1H/13C зонда для образцов илиBruker DRX 400 Фурье-ЯМР, снабженным компьютером SG Indigo2 и 5 мм обладающего инвертированной геометрией трехпозиционного 1H/13C/15N зонда для образцов. Соединение исследуют в растворе ДМСО-d6 (или CDCl3) при температуре зонда, равной 313 K или 300 K, и при концентрации, равной 20 мг/мл. Прибор синхронизируют по дейтериевому сигналу ДМСО-d6 (или CDCl3). Химические сдвиги приведены в част./млн в слабопольную сторону от триметилсилана, использующегося в качестве внутреннего стандарта. Исследования с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) проводят с использованием следующих систем: системы ВЭЖХ Agilent 1100, снабженной колонкой INERTSIL ODS 3 С 18, DP 5 мкм, 2504,6 мм. Градиентный режим от 100% растворителя А (ацетонитрил, вода, Н 3 РО 4 (5/95/0,001, об./об./об. до 100% растворителя В (ацетонитрил, вода, Н 3 РО 4 (95/5/0,001, об./об./об. в течение 6 мин с выдерживанием при 100% В в течение 4 мин. Скорость потока устанавливают равной 2,5 мл/мин. Хроматографию проводят при 35 С; системы ВЭЖХ HP 1090, снабженной колонкой HPLC Waters Symetry С 18, 2504,6 мм. Градиентный режим от 100% растворителя А (МеОН, вода, Н 3 РО 4 (15/85/0,001 М, об./об./М до 100% растворителя В (МеОН, вода, Н 3 РО 4 (85/15/0,001 М, об./об./М в течение 10 мин с выдерживанием при 100% В в течение 10 мин. Скорость потока устанавливают равной 1 мл/мин. Хроматографию проводят при 40 С. Масс-спектрометрические исследования в режиме ЖХ/МС проводят следующим образом. Условия проведения ВЭЖХ. Исследования проводят с использованием системы WATERS Alliance ВЭЖХ, снабженной колонкойINERTSIL ODS 3, DP 5 мкм, 2504,6 мм. Градиентный режим от 100% растворителя А (ацетонитрил,вода, ТФК (трифторуксусная кислота) (10/90/0,1, об./об./об. до 100% растворителя В (ацетонитрил, вода, ТФК (90/10/0,1, об./об./об. в течение 7 мин с выдерживанием при 100% В в течение 4 мин. Скорость потока устанавливают равной 2,5 мл/мин и используют деление пробы 1/25 непосредственно перед источником ионов, полученных ионизацией при атмосферном давлении (ИАД). Условия МС (масс-спектрометрия). Образцы растворяют в смеси ацетонитрил/вода, 70/30, об./об. в концентрации, равной примерно 250 мкг/мл. Спектры ИАД (+ или -) снимают с использованием масс-спектрометра с ионной ловушкойFINNIGAN (San Jose, СА, USA) LCQ. Источник ионов ИАД работает при 450 С и нагреватель капилляров - при 160 С. Источник ионов ИЭР (ионизация электрораспылением) работает при 3,5 кВ и нагреватель капилляров - при 210 С. Масс-спектрометрические исследования в режиме прямого введения пробы/электронного удара(ЭУ) проводят следующим образом: образцы испаряют путем нагревания пробы от 50 до 250 С в течение 5 мин. Спектры ЭУ снимают с использованием тандемного квадрупольного масс-спектрометра FINNIGAN (San Jose, CA, USA) TSQ 700. Температуру источника устанавливают равной 150 С. Масс-спектрометрические исследования с использованием тандемного квадрупольного массспектрометра TSQ 700 (Finnigan MAT, San Jose, CA, USA) проводят в режиме ГХ/МС с использованием газового хроматографа, модель 3400 (Varian, Walnut Creek, CA, USA), снабженного инжектором с делением/без деления пробы и колонкой с плавленым диоксидом кремния DB-5MS (15 м 0,25 мм внутренний диаметр, 1 мкм), выпускающейся фирмой JW Scientific (Folsom, CA, USA). В качестве газаносителя используют гелий (чистота 99,999%). Инжектор (автоматический пробоотборник СТС A200S) и линия подачи работают при температуре 290 и 250 С соответственно. Образец (1 мкл) инжектируют без деления пробы и температуру печи программируют следующим образом: 50 С в течение 5 мин, повышение до 280 С (23 С/мин) и выдерживание в течение 10 мин. Спектрометр TSQ 700 работает в режиме электронного удара (ЭУ) или химической ионизации (ХИ/СН 4) (диапазон масс 33-800, длительность сканирования 1,00 с). Температуру источника устанавливают равной 150 С. Удельное вращение регистрируют с помощью поляриметра Perkin-Elmer 341. Угол вращения регистрируют при 25 С для 1% раствора в МеОН. Для некоторых молекул вследствие плохой растворимости в качестве растворителя используют CH2Cl2 или ДМСО. Температуры плавления определяют с помощью прибора для измерения температуры плавленияBchi 535 или 545 Tottoli-type и не корректируют или по температуре начала изменения при исследова- 11016518 нии с помощью дифференциальной сканирующей калориметрии на приборе Perkin Elmer DSC 7. Препаративные разделения с помощью хроматографии проводят на силикагеле 60 Merck, с частицами размером 15-40 мкм, эталон 1,15111,9025, с использованием колонок с осевым прессованием Novasep (внутренний диаметр 80 мм), скоростей потока от 70 до 150 мл/мин. Используют количества силикагеля и смеси растворителей, указанные в соответствующих методиках. Препаративные разделения с помощью хиральной хроматографии проводят на сорбенте DAICELChiralpak AD 20 мкм, на колонке 100500 мм с использованием лабораторного прибора и различных смесей низших спиртов и С 5-С 8 линейных, разветвленных или циклических алканов при скорости потока, равной 350 мл/мин. Смеси растворителей описаны в соответствующих методиках. Характеризацию соединений примеров 3 и 4 проводят по указанным ниже методикам и при указанных условиях. Спектры ЯМР снимают на спектрометре Bruker 400 МГц в виде растворов в дейтерированном хлороформе (CDCl3). Химические сдвиги приведены в част./млнв слабопольную сторону от триметилсилана, использующегося в качестве внутреннего стандарта, и отсчитывают от дейтерированного растворителя (CDCl3). Данные 1 Н ЯМР приводят в следующем порядке: химические сдвиги, мультиплетность (s, синглет;d, дублет; t, триплет; q, квартет; m, мультиплет; кажущийся и/или мультиплетный резонанс), константа спин-спинового взаимодействия (J) в герцах (Гц) и количество протонов. Исследования с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) проводят с использованием системы Alliance Waters 2695, снабженной колонкой Sunfire C18 (3,5 мкм, 2,1150 мм).GRAD 90/10 представляет собой градиентную методику, в которой используют градиентный режим от смеси растворителей исходного состава (растворитель А (Н 2 О, 80% об./об.), растворитель В (CH3CN,10% об./об.) и растворитель С (Н 2 О + 1% Н 3 РО 4 об./об., 10% об./об. до смеси растворителей конечного состава (растворитель А (Н 2 О, 0% об./об.), растворитель В (CH3CN, 90% об./об.) и растворитель С (Н 2 О + 1% Н 3 РО 4 об./об., 10% об./об. в течение 10 мин и после этого используют период восстановления равновесия в течение 5 мин в растворителях исходного состава. ISO80 представляет собой изократическую методику, в которой элюент обладает следующим составом: растворитель А (Н 2 О + 1% Н 3 РО 4 об./об.,80% об./об.) и растворитель В (CH3CN + 1% Н 3 РО 4 об./об., 20% об./об.). ISO85 представляет собой изократическую методику, в которой элюент обладает следующим составом: растворитель А (Н 2 О + 1% Н 3 РО 4 об./об., 85% об./об.) и растворитель В (CH3CN + 1% Н 3 РО 4 об./об., 15% об./об.). Исследования с помощью газовой хроматографии проводят на приборе Agilent 6890 series, снабженном колонкой Altech GC DB-5MS (15 м 0,25 мм). Масс-спектроскопия (МС): спектры ИАД снимают с использованием масс-спектрометра с ионной ловушкой FINNIGAN (San Jose, CA, USA) LCQ. Источник ионов ИАД работает при 450 С и нагреватель капилляров - при 160 С. Источник ионов ИЭР работает при 3,5 кВ и нагреватель капилляров - при 210 С. Температуры плавления определяют с помощью дифференциальной сканирующей калориметрии на приборе DSC Perkin Elmer Pyris 1. Пример 1. Синтез в основном оптически чистых (R)- и (S)-4-пропилпирролидин-2-онов (IIIa) и(IIIg). 1.a. Синтез этилового эфира 3-нитрометилгексановой кислоты (В) При перемешивании к раствору этилового эфира гекс-2-еновой кислоты (А) (450 г, 3,164 моль,1 экв.) в нитрометане (858 мл, 15,822 моль, 5 экв.), охлажденному до 0 С, в атмосфере азота по каплям прибавляют 481,8 г (3,164 моль, 1 экв.) 1,8-диазабицикло[5,4,0]ундец-7-ена (ДБУ). Реакционную смесь вводят в реакцию при комнатной температуре в течение 3 ч и реакцию останавливают 6 М водным раствором хлорида водорода путем создания рН 4. Раствор экстрагируют диэтиловым эфиром (500 мл + 2300 мл). Органические слои сушат над MgSO4, фильтруют, концентрируют и получают маслообразный остаток (672,13 г, чистота по данным ВЭЖХ=78,9%), который очищают с помощью жидкостной хроматографии при элюировании дихлорметаном. Получают 639,41 г этилового эфира 3 нитрометилгексановой кислоты (В) (выход=99,4%). ГХ/МС: МН+=204.(500 мл). Смесь переносят в автоклав объемом 1 л. Реакционную смесь вводят в реакцию при 55 С при давлении водорода, равном 50 бар, в течение 28 ч. Катализатор отфильтровывают на целите и промывают метанолом. Фильтрат экстрагируют с помощью 500 мл дихлорметана. Затем раствор экстрагируют водой (2400 мл). Органические слои сушат над MgSO4, фильтруют, концентрируют и получают маслообразный остаток (177,12 г, чистота по данным ВЭЖХ=82,6%), который очищают с помощью перегонки(110 С, 7,10-2 мбар). Получают 147,82 г (С) (выход=78,7%). ГХ/МС: М+=127. 1 Н ЯМР:0,90 (t, 11,22 Гц, 3 Н), 1,35 (m, 4 Н), 1,97 (m, 1 Н), 2,42 (m, 2 Н), 2,99 (dd, 15,13, 10,74 Гц,1 Н), 3,46 (m, 1 Н), 6,43 (m, 1 Н). 1.с. Синтез в основном оптически чистых (R)- и (S)-4-пропилпирролидин-2-она (IIIa) и (IIIg). 343 г 4-пропилпирролидин-2-он (С) разделяют с помощью жидкостной хроматографии на колонкеchiralpak AD (100500 мм), элюируя смесью пропанол 8%, этанол 2%, гексаны 90%, ДЭА (диэтаноламин) 0,1%. Хиральная ВЭЖХ (смесь растворителей: н-пропанол/этанол: 80/20).[]D соединения формулы (IIIg)=-2,16. Пример 2. Синтез в основном оптически чистых (S)- и (R)-4-(2,2-дифторвинил)пирролидин-2-онов Раствор гидроксида натрия (524 г, 13,1 моль) в воде (2 л) и бензилтриэтиламмонийбромида (88 г,0,32 моль) при перемешивании при комнатной температуре прибавляют к раствору 4,4,4-трифторбут-2 енилового эфира уксусной кислоты (D) (882 г, 5,25 моль) в толуоле (2,8 л). За реакцией следят с помощью ГХ и перемешивают при комнатной температуре в течение ночи. По каплям медленно прибавляют раствор п-толуолсульфонилхлорида (950 г, 4,98 моль) в толуоле (3 л) с такой скоростью, чтобы поддерживалась температура, равная менее 25 С. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре и промывают водой. Органический слой сушат над безводным MgSO4, концентрируют досуха и получают 1380 г (Е) (выход=94%). ГХ/МС: М+=280. 2.b. Синтез (2,4-диметоксибензил)-4,4,4-(трифторбут-2-енил)амина (F)- 13016518 толуоле (2 л) при перемешивании медленно прибавляют к смеси 2,4-диметоксибензиламина (401 г,2,40 моль) и карбоната калия (700 г, 5,06 моль) в толуоле (4 л) при 65 С. Смесь перемешивают при 65 С в течение ночи и экстрагируют раствором HCl (25 л, 1 н.). К кислому водному слою, промытому толуолом (47 л), прибавляют карбонат калия до рН 8. Этот слой экстрагируют толуолом (27 л). Органический слой сушат над безводным MgSO4, концентрируют и получают 495 г (F) (выход=78%). ЖХ/МС: МН+=276. 2.с. Синтез метилового эфира N-(2,4-диметоксибензил)-N-(4,4,4-трифторбут-2-енил)малонаминовой кислоты (G). Концентрированную серную кислоту (344 г, 3,5 моль) при 0 С по каплям прибавляют моноэтилмалонату калия (695 г, 4,08 моль) в ацетонитриле (7 л). Раствор перемешивают в течение 30 мин при 0 С. К реакционной смеси при 0 С прибавляют N,N'-карбонилдиимидазол (659 г, 4,06 моль). Смесь перемешивают в течение 30 мин при 0 С и прибавляют (F) (625 г, 2,27 моль). Через 30 мин при 0 С нерастворимый осадок удаляют фильтрованием. Фильтрат концентрируют досуха. К остатку прибавляют толуол и этот раствор промывают водой и раствором HCl (1 н.). Органический слой сушат над безводным MgSO4, концентрируют и получают 888 г (G) (выход=100%). ЖХ/МС: МН+=376. 2.d. Синтез этилового эфира 4-(2,2-дифторвинил)-1-(2,4-диметоксибензил)-2-оксопирролидин-3 карбоновой кислоты (H). Бензилтриэтиламмонийбромид (92 г, 1,04 моль) и карбонат калия (188 г, 1,36 моль) при перемешивании и кипячении с обратным холодильником прибавляют к раствору (G) (779 г, 2,00 моль) в ацетоне(4 л). Через 4 ч прибавляют 200 г карбоната калия. Реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи. 200 г карбоната калия прибавляют дважды (через 4 ч). Нерастворимый осадок удаляют фильтрованием. Фильтрат сушат над безводным MgSO4, концентрируют и получают 748 г (Н). Продукт без обработки используют в следующей реакции. ЖХ/МС: МН+=370 (2 пика). 2.е. Синтез 4-(2,2-дифторвинил)-1-(2,4-диметоксибензил)-2-оксопирролидин-3-карбоновой кислоты Раствор карбоната калия (581 г, 4,20 моль) в воде (4 л) при перемешивании и кипячении с обратным холодильником прибавляют к раствору (Н) в метаноле (1 л). Смесь перемешивают в течение 18 ч, промывают толуолом (25 л), подкисляют до рН 2 с помощью концентрированной HCl (750 мл). Водный слой экстрагируют этилацетатом. Этот органический слой промывают водой, сушат над безводным Суспензию (K) в метилизобутилкетоне (МИБК - 5 л) нагревают при 116 С в течение ночи. Выпаривание растворителя дает 564 г (IIIc). Этот продукт используют в следующей реакции без дополнительной очистки. ЖХ/МС: МН+=298. 1 Н ЯМР:2,20 (dd, 16,60, 8,05 Гц, 1 Н), 2,62 (dd, 16,60, 8,80 Гц, 1 Н), 2,98 (dd, 9,81, 7,04 Гц, 1 Н),3,09 (d, 8,05 Гц, 1 Н), 3,44 (m, 1 Н), 3,79 (s, 3 Н), 3,81 (s, 3 Н), 4,18 (m, 1 Н), 4,41 (s, 2 Н), 6,45 (m, 2 Н), 7,14(IIId) и (IIIe) получают путем разделения (IIIc) с помощью жидкостной хроматографии на колонке[]D: -3,76. 2.h. Синтез в основном оптически чистого (S)-4-(дифторвинил)пирролидин-2-он (IIIb).(ТФК) при 80 С в течение 1 ч. Затем реакционную смесь охлаждают до комнатной температуры в токе азота. Растворитель удаляют при пониженном давлении. Остаток выливают в воду (250 мл) и реакцию останавливают гидрокарбонатом натрия, который прибавляют до рН 8. Полученную гетерогенную смесь фильтруют и водную фазу экстрагируют дихлорметаном (4250 мл). Полученную органическую фазу сушат над MgSO4, фильтруют и летучие вещества удаляют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (дихлорметан/метанол 98,5/1,5 в качестве элюирующего растворителя) и получают 6,2 г (выход=58%) (IIIb). 1 Н ЯМР:2,20 (dd, 16,60, 8,05 Гц, 1 Н), 2,62 (dd, 16,60, 8,80 Гц, 1 Н), 2,98 (dd, 9,81, 7,04 Гц, 1 Н),3,09 (d, 8,05 Гц, 1 Н), 3,44 (m, 1 Н), 3,79 (s, 3 Н), 3,81 (s, 3 Н) 4,18 (m, 1 Н), 4,41 (s, 2 Н), 6,45 (m, 2 Н), 7,14[]D=-6,51. 2.i. Синтез в основном оптически чистого (R)-4-(дифторвинил)пирролидин-2-она (IIIf). 21,42 г (72 ммоль) (IIId) кипятят с обратным холодильником в 100 мл трифторуксусной кислоты при 80 С (ТФК) в течение 1 ч. Затем реакционную смесь охлаждают до комнатной температуры в токе азота. Растворитель удаляют при пониженном давлении. Остаток выливают в воду (250 мл) и реакцию останавливают гидрокарбонатом натрия, который прибавляют до рН 8. Полученную гетерогенную смесь- 15016518 фильтруют и водную фазу экстрагируют дихлорметаном (4250 мл). Полученную органическую фазу сушат над MgSO4, фильтруют и летучие вещества удаляют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (дихлорметан/метанол 98,5/1,5 в качестве элюирующего растворителя) и получают 7,5 г (выход=72%) (IIIf). 1 Н ЯМР:2,20 (dd, 16,60, 8,05 Гц, 1 Н), 2,62 (dd, 16,60, 8,80 Гц, 1 Н), 2,98 (dd, 9,81, 7,04 Гц, 1 Н),3,09 (d, 8,05 Гц, 1 Н), 3,44 (m, 1 Н), 3,79 (s, 3 Н), 3,81 (s, 3 Н) 4,18 (m, 1 Н), 4,41 (s, 2 Н), 6,45 (m, 2 Н), 7,14[]D=+ 6,64. Пример 3. Синтез бриварацетама (I). 3.а. Синтез метилового эфира (S)- и (R) 2-R)-2-оксо-4-пропилпирролидин-1-ил)масляной кислоты Взвесь 60% суспензии гидрида натрия в минеральном масле (0,94 г, 23,4 ммоль) в тетрагидрофуране (30 мл) охлаждают до 0 С в атмосфере азота. Раствор в основном оптически чистого (R)-4 пропилпирролидин-2-она (IIIa) (2 г, 15,7 ммоль) в тетрагидрофуране (2 мл) прибавляют в течение 15 мин. Реакционную смесь перемешивают 10 мин при 0 С, затем в течение 20 мин прибавляют раствор метилового эфира метил-2-броммасляной кислоты (V) (3,69 г, 20,4 ммоль) в тетрагидрофуране (2 мл). Реакционную смесь перемешивают при 0 С до максимального превращения исходного вещества и затем реакционной смеси дают нагреться до комнатной температуры и ее разбавляют водой (20 мл). Тетрагидрофуран удаляют выпариванием и остаток экстрагируют изопропилацетатом (20 мл + 10 мл). Объединенные органические слои сушат над безводным сульфатом магния и выпаривают и получают 3 г (13,2 ммоль,86%) смеси эпимеров соединения (VIa), в виде смеси эпимера (VIaa) и эпимера (VIab). 1 Н ЯМР (400 МГц, CDCl3) смеси эпимеров (VIaa) и (VIab):4,68 (dd, J=10,8, J=5,1, 21H); 3,71 (s,23 Н); 3,60 (t кажущийся, J=8,2, 1H); 3,42 (t кажущийся, J=8,7, 1H); 313 (dd, J=9,2, J=6,8, 1H); 2,95 (dd,J=9,2, J=6,8, 1H); 2,56 (dd, J=16,6, J=8,7, 21H); 2,37 (dm, 21H); 2,10 (m, 21H); 2,00 (m, 21H); 1,68 (m,21H); 1,46 (m, 22H); 1,36 (m, 22H); 0,92 (m, 26H). 13C ЯМР (400 МГц, CDCl3) смеси эпимеров (VIaa) и (VIab): =175,9; 175,2; 171,9; 55,3; 52,4; 49,8; 49,5; 38,0; 37,8; 37,3; 36,9; 32,5; 32,2; 22,6; 22,4; 21,0; 14,4; 11,2; 11,1. ВЭЖХ (GRAD 90/10) смеси эпимеров (VIaa) и (VIab): время удерживания=9,84 мин (100%). ГХ смеси эпимеров (VIaa) и (VIab): время удерживания=13,33 мин (98,9%). МС смеси эпимеров (VIaa) и (VIab) (ИЭР): 228 МН+. 3.b. Аммонолиз смеси соединений (VIaa) и (VIab). Раствор (VIaa) и (VIab), полученный на предыдущей стадии реакции (1,46 г, 6,4 ммоль), в 50% мас./мас. водном растворе аммиака (18 мл) при 0 С перемешивают при комнатной температуре в течение 5,5 ч. Белый осадок, который образуется во время реакции, отфильтровывают, промывают водой, сушат и получают 0,77 г (3,6 ммоль, выход=56%) белого твердого вещества, которое является смесью бриварацетама (I) и соединения (VII) в соотношении 1:1. 1 Н ЯМР смеси (I) и (VII) (400 МГц, CDCl3):6,36 (s, широкий, 1H); 5,66 (s, широкий, 1 Н); 4,45 (m,1H); 3,53 (ddd, J=28,8, J=9,7, J=8,1, 1H); 3,02 (m, 1H); 2,55 (m, 1H); 2,35 (m, 1H); 2,11 (m, 1H); 1,96 (m, 1H); 1,68 (m, 1H); 1,38 (dm, 4H); 0,92 (m, 6H). 13C ЯМР смеси (I) и (VII) (400 МГц, CDCl3):176,0; 175,9; 172,8; 172,5; 56,4; 56,3; 50,0; 49,9; 38,3; 38,1; 37,3; 37,0; 32,3; 32,2; 21,4; 21,3; 21,0; 20,9; 14,4; 10,9; 10,8. ВЭЖХ (GRAD 90/10) смеси (I) и (VII) время удерживания=7,67 мин (100%). Температура плавления смеси (I) и (VII)=104,9 С (нагревание от 40 до 120 С со скоростью 10 С/мин). Соединения (I) и (VII) разделяют по обычным методикам, известным специалисту в данной области- 16016518 техники. Типичное препаративное разделение проводят для 11,7 г смеси соединений (I) и (VII) состава 1:1: Используют колонку DAICEL Chiralpak AD 20 мкм, 100500 мм при 30 С при скорости подачи 300 мл/мин, 50% EtOH - 50% гептан. Разделение дает 5,28 г (45%) соединения (VII), время удерживания=14 мин, и 5,20 г (44%) соединений (I), время удерживания=23 мин. 1H ЯМР соединения (VII) (400 МГц, CDCl3):6,14 (s, широкий, 1 Н); 5,27 (s, широкий, 1 Н); 4,43 (t кажущийся, J=8,1, 1H); 3,53 (t кажущийся, J=9,1, 1H); 3,01 (t кажущийся, J=7,8, 1H); 2,53 (dd, J=16,5,J=8,8, 1H); 2,36 (m, 1H); 2,14 (dd, J=16,5, J=8,1, 1H); 1,97 (m, 1H); 1,68 (m, 1H); 1,43 (m, 2H); 1,34 (m, 2H); 0,92 (m, 6H) 3c. Эпимеризация соединения (2R)-2-R)-2-оксо-4-пропилпирролидин-1-ил)бутирамида (VII). Соединение (VII) (200 мг, 0,94 ммоль) при комнатной температуре прибавляют к раствору третбутоксида натрия (20 мг, 10% мас./мас.) в изопропаноле (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Растворитель выпаривают и получают 200 мг (0,94 ммоль, 100%) белого твердого вещества. Указанное твердое вещество является смесью бриварацетама (I) и (VII) в соотношении 49,3/50,7. ВЭЖХ (ISO80): время удерживания=7,45 мин (49,3%) бриварацетам (I); время удерживания=8,02 мин (50,7%) соединение (VII). Пример 4. Синтез селетрацетама (II). 4.а. Синтез метилового эфира (S) и (R) 2-[(S)-4-(2,2-дифторвинил)-2-оксопирролидин-1 ил]масляной кислоты (VIba) и (VIbb) Взвесь 60% суспензии гидрида натрия в минеральном масле (0,80 г, 20,4 ммоль) в тетрагидрофуране (28 мл) охлаждают до 0 С в атмосфере азота. Раствор в основном оптически чистого (S)-4-(2,2 дифторвинил)пирролидин-2-она (IIIb) (2 г, 13,6 ммоль) в тетрагидрофуране (8 мл) прибавляют в течение 30 мин. Реакционную смесь перемешивают 10 мин при 0 С, затем в течение 15 мин прибавляют раствор метилового эфира метил-2-броммасляной кислоты (V) (3,20 г, 17,6 ммоль) в тетрагидрофуране (2 мл). Реакционную смесь перемешивают при 0 С в течение 4,5 ч и затем реакционной смеси дают нагреться до комнатной температуры и ее разбавляют водой (15 мл). Тетрагидрофуран удаляют выпариванием и остаток экстрагируют изопропилацетатом (210 мл). Объединенные органические слои сушат над безводным сульфатом магния и выпаривают и получают 3g (12,1 ммоль, 89%) соединения (VIb), в виде смеси эпимера (VIba) и эпимера (VIbb). 1 Н ЯМР смеси эпимеров (VIba) и (VIbb) (400 МГц, CDCl3):4,69 (dd, J=10,8, J=5,2; 21H); 4,31 (m,21H); 3,72 (s, 23H); 3,75-3,70 (m, 1H); 3,51 (t кажущийся, J=8,3, 1 Н); 3,30-3,05 (m, 22 Н); 2,67 (ddd,J=16,7, J=8,5, J=3,3, 21H); 2,26 (dd кажущийся, J=16,7, J=7,9, 21H); 2,02 (m, 21H); 1,67 (m, 21H); 0,93(t, J=7,6, 23H). 13 С ЯМР смеси эпимеров (VIba) и (VIbb) (400 МГц, CDCl3):174,6; 174,4; 171,8; 80,7; 80,6; 80,5; 80,4; 80,3; 80,2; 80,1; 55,4; 55,3; 52,5; 49,9; 49,4; 38,2; 38,0; 27,5; 27,4; 27,3; 27,2; 22,7; 22,5; 11,2. ВЭЖХ (GRAD 90/10) смеси эпимеров (VIba) и (VIbb): время удерживания=9,07 мин (99,1%). ГХ смеси эпимеров (VIba) и (VIbb): время удерживания=13,33 мин (98,9%). С (ИАД) смеси эпимеров (VIba) и (VIbb): 248 МН+. 4.b. Аммонолиз смеси (VIba) и (VIbb) Раствор (VIba) и (VIbb), полученный на предыдущей стадии реакции (1,8 г, 7,3 ммоль), в водном растворе аммиака 50% мас./мас. (3 мл) при 0 С перемешивают при комнатной температуре в течение 6,5 ч. Белый осадок, который образуется во время реакции, отфильтровывают, промывают водой, сушат- 17016518 и получают 1,0 г (4,3 ммоль, 59%) белого твердого вещества, которое является смесью селетрацетама (II) и соединения (VIII) в соотношении 1:1. 1 Н ЯМР смеси эпимеров (II) и (VIII) (400 МГц, CDCl3):6,30 (s, широкий, 1H); 5,62 (s, широкий,1 Н); 4,47 (t, J=7,4, 1 Н); 4,26 (dm, J=24,1, 1H); 3,65 (dt кажущийся, J=52,4, J=8,7, 1H); 3,18 (m, 2H); 2,67 (m,1H); 2,26 (m, 1H); 1,96 (m, 1H); 1,69 (m, 1H); 0,92 (t, J=7,4, 3H). 13C ЯМР смеси эпимеров (II) и (VIII) (400 МГц, CDCl3):174,8; 174,6; 172,6; 172,4; 80,5; 80,3; 79,9; 56,3; 50,0; 49,8; 38,4; 38,2; 27,4; 27,2; 21,7; 21,6; 11,0; 10,9. Температура плавления смеси (II) и (VIII)=132,6 С (нагревание от 35 до 220 С со скоростью 10 С/мин). Соединения (II) и (VIII) разделяют по обычным методикам, известным специалисту в данной области техники. Типичное препаративное разделение проводят для 7,4 г смеси соединений (II) и (VIII) состава 1:1: Используют колонку DAICEL Chiralpak AD 20 мкм, 100500 мм при 30 С при скорости подачи 300 мл/мин, 50% EtOH - 50% гептан. Разделение дает 3,70 г (50%) соединения (VIII), время удерживания=20 мин, и 3,65 г (49%) соединений (II), время удерживания=31 мин. 1 Н ЯМР соединения (II) (400 МГц, CDCl3):6,13 (s, широкий, 1H); 5,37 (s, широкий, 1H); 4,45 (t кажущийся, J=8,6, 1H); 4,24 (dd, J=24,5, J=8,8, 1 Н); 3,58 (m, 1H); 3,18 (m, 2H); 2,69 (dd, J=17,4, J=8,7, 1H); 2,23 (dd, J=16,5, J=8,7, 1H); 1,95 (m, 1H); 1,71 (m, 1H); 0,93 (t, J=6,8, 3H). 1H ЯМР соединения (VIII) (400 МГц, CDCl3):6,09 (s, широкий, 1H); 5,33 (s, широкий, 1H); 4,45 (t кажущийся, J=8,6, 1H); 4,25 (dd, J=24,1, J=9,7, 1H); 3,68 (t кажущийся, J=8,6, 1H); 3,18 (m, 1H); 3,13 (m,1H); 2,65 (dd, J=17,2, J=8,6, 1H); 2,29 (dd, J=17,2, J=8,0, 1H); 1,97 (m, 1H); 1,68 (m, 1H); 0,93 (t, J=6,9, 3H). 4c. Эпимеризация соединения формулы (VIII). Соединение формулы (VIII) (500 мг, 2,16 ммоль) при комнатной температуре прибавляют к раствору трет-бутоксида натрия (50 мг, 10% мас./мас.) в изопропаноле (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 6 ч, во время реакции образуется белый осадок. Взвесь охлаждают до 5 С и перемешивают в течение 30 мин при 5 С. Осадок отфильтровывают, сушат и получают 150 мг (0,65 ммоль, 30%) белого твердого вещества. Указанное белое твердое вещество является смесью селетрацетама (II) и соединения (VIII) в соотношении 47,9/52,1. ВЭЖХ (ISO85): время удерживания=7,66 мин (52,1%) соединение (VIII); время удерживания=8,23 мин (47,9%) селетрацетам (II). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Оптические изомеры 4-замещенных пирролидин-2-онов формулы (III) в которой R1 обозначает C1-С 3-алкил, необязательно замещенный по меньшей мере одним галогеном, или С 2-С 4-алкенил, замещенный двумя атомами галогена,характеризующиеся энантиомерным избытком не менее 95% соединения формулы (III), содержащего стереогенный центр, отмеченный (1) в указанной конфигурации (R) или (S). 2. Оптические изомеры по п.1, характеризующиеся энантиомерным избытком не менее 96% соединения формулы (III), содержащего стереогенный центр, отмеченный (1) в указанной конфигурации (R) или (S). 3. Оптические изомеры по п.1, характеризующиеся энантиомерным избытком не менее 97% соединения формулы (III), содержащего стереогенный центр, отмеченный (1) в указанной конфигурации (R) или (S). 4. Оптические изомеры по п.1, характеризующиеся энантиомерным избытком не менее 98% соединения формулы (III), содержащего стереогенный центр, отмеченный (1) в указанной конфигурации (R) или (S). 5. Оптические изомеры по п.1, характеризующиеся энантиомерным избытком не менее 99% соединения формулы (III), содержащего стереогенный центр, отмеченный (1) в указанной конфигурации (R) или (S). 6. Оптические изомеры формулы (III) по п.1, в которой R1 обозначает н-пропил. 7. Оптические изомеры формулы (III) по п.1, в которой R1 обозначает этил. 8. Оптические изомеры формулы (III) по п.1, в которой R1 обозначает 2,2-дифторвинил. 9. Оптические изомеры формулы (III) по п.2, в которой стереогенный центр (1) обладает конфигурацией (R). 10. Оптические изомеры формулы (III) по п.3, в которой стереогенный центр (1) обладает конфигурацией (S). 13. Соединение по п.11 или 12, характеризующееся энантиомерным избытком не менее 95% соединения формулы (IIIa) или соединения формулы (IIIb) соответственно. 14. Способ получения в основном диастереоизомерно чистых производных 2-оксопирролидин-1 ила формулы (IV) в которой R1 обозначает C1-С 3-алкил, замещенный по меньшей мере одним галогеном, включая этил, н-пропил, или С 2-С 4-алкенил, замещенный двумя атомами галогена;R3 обозначает водород или С 1-С 4-алкил;R4 обозначает водород или С 1-С 4-алкил;R5 обозначает водород или С 1-С 4-алкил; включающий:(i) реакцию в основном оптически чистого 4-замещенного пирролидин-2-она формулы (III) в которой R1 обозначает C1-С 3-алкил, замещенный по меньшей мере одним галогеном, включая этил, н-пропил, или С 2-С 4-алкенил, замещенный двумя атомами галогена,с соединением формулы (V)R3 обозначает водород или С 1-С 4-алкил;R4 обозначает водород или С 1-С 4-алкил;R5 обозначает водород или С 1-С 4-алкил,в присутствии основания, выбранного из группы, включающей гидрид калия, гидрид натрия, метоксид натрия, метоксид калия, изопропоксид натрия, трет-бутоксид натрия и трет-бутоксида калия, и в растворителе, выбранном из группы, включающей изопропанол, трет-бутанол, диметоксиэтан и толуол;(ii) разделение смеси эпимеров соединений формулы (IV), полученных в результате стадии (i). 15. Способ получения в основном диастереоизомерно чистых производных 2-оксопирролидин-1 ила формулы (IV) в которой R1 обозначает С 1-С 3-алкил, замещенный по меньшей мере одним галогеном, включая этил, н-пропил, или С 2-С 4-алкенил, замещенный двумя атомами галогена;(i) реакцию в основном оптически чистого 4-замещенного пирролидин-2-она формулы (III) в которой R1 обозначает этил, н-пропил, C1-С 3-алкил, замещенный по меньшей мере одним галогеном, или С 2-С 4-алкенил, замещенный двумя атомами галогена,с соединением формулы (V)(ii) осуществление аммонолиза смеси эпимеров соединения формулы (VI), полученных в результате стадии (i) где R1 обозначает C1-С 3-алкил, замещенный по меньшей мере одним галогеном, включая этил, нпропил, или С 2-С 4-алкенил, замещенный двумя атомами галогена;(iii) разделение смеси эпимеров соединений формулы (IV), полученных в результате стадии (ii) в которой R1 обозначает C1-С 3-алкил, замещенный по меньшей мере одним галогеном, включая этил, н-пропил, или С 2-С 4-алкенил, замещенный двумя атомами галогена;R4 обозначает водород. 16. Способ по любому из пп.14 или 15, в котором указанная смесь эпимеров включает эпимеры, от- 20016518 ношение количеств которых близко к 1. 17. Способ получения бриварацетама (I)(i) реакцию в основном оптически чистого (R)-4-пропилпирролидин-2-она (IIIa) с соединением формулы (V) в которой Y обозначает отщепляющуюся группу, выбранную из атомов галогена;(ii) осуществление аммонолиза смеси эпимеров соединений формулы (VIa), полученных в результате стадии (i); полученных в результате стадии (ii). 18. Способ по п.17, который включает эпимеризацию соединения формулы (VII) в смесь бриварацетама (I) и соединения формулы (VII) посредством взаимодействия соединения формулы (VII) с основанием, выбранным из группы, включающей гидрид калия, гидрид натрия, метоксид натрия, метоксид калия, изопропоксид натрия, трет-бутоксид натрия и трет-бутоксид калия.
МПК / Метки
МПК: C07D 207/26
Метки: 4-замещенные, пирролидин-2-оны, применение
Код ссылки
<a href="https://eas.patents.su/22-16518-4-zameshhennye-pirrolidin-2-ony-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">4-замещенные пирролидин-2-оны и их применение</a>
Предыдущий патент: Рекомбинантная псевдоаденовирусная наночастица, фармацевтическая композиция для профилактики или терапии гриппа (варианты), способ профилактики или терапии гриппа
Следующий патент: Аэрационный дегазатор
Случайный патент: Способ получения высокочистых мелоксикама и калиевой соли мелоксикама