Способ получения растительных клеток, аккумулирующих каротиноиды, и выделенная днк, используемая для осуществления способа
Формула / Реферат
1. Способ получения растительных клеток, аккумулирующих каротиноиды, которые в норме не содержат каротиноидов, включающий трансформацию растительного материала выделенной молекулой ДНК, которая включает
(а) экспрессионную кассету, способную направлять образование в растительных клетках фитоенсинтазы, происходящей из растений, грибов или бактерий, и
(б) экспрессионную кассету, способную направлять образование в растительных клетках фитоендесатуразы, происходящей из растений, грибов или бактерий, причем, когда фитоендесатураза происходит из бактерий, указанная фитоенсинтаза не имеет бактериального происхождения, и
отбор трансформированного растительного материала, содержащего клетки, которые аккумулируют каротиноиды.
2. Способ по п.1, где указанная молекула ДНК включает
(а) экспрессионную кассету, способную направлять образование в растительных клетках фитоенсинтазы, происходящей из растений,
(б) экспрессионную кассету, способную направлять образование в растительных клетках фитоендесатуразы, происходящей из бактерий.
3. Способ по любому из пп.1 или 2, где фитоендесарутаза кодируется геном CrtI Erwinia uredovora.
4. Способ по п.3, где фитоендесарутаза кодируется геном CrtI Erwinia uredovora.
5. Способ по любому из пп.1-4, где указанная фитоендесатураза слита с подходящим пластидным транзитным пептидом.
6. Способ по любому из пп.1-5, где указанная фитоендесатураза экспрессируется под контролем тканеспецифического или конститутивного промотора.
7. Способ по п.6, где указанная фитоендесатураза экспрессируется под контролем конститутивного промотора.
8. Способ по любому из пп.1-7, где указанная фитоендесатураза экспрессируется под контролем тканеспецифического промотора.
9. Способ по п.8, где указанная фитоенсинтаза происходит из Narcissus pseudonarcissus.
10. Способ по любому из пп.1-9, где указания ДНК дополнительно включает последовательность, кодирующую селективный маркер.
11. Способ по любому из пп.1-10, где растительный материал трансформируют посредством агробактерий, которые содержат указанную ДНК.
12. Способ по любому из пп.1-11, где указанная растительная клетка является клеткой риса.
13. Способ по любому из пп.1-12, где указанная клетка риса является клеткой эндосперма.
14. Трансаформированная растительная клетка, полученная с помощью способа по любому пп.1-13.
15. Растительная клетка по п.14, которая является клеткой эндосперма риса.
16. Выделенная молекула ДНК, которая включает
(а) экспрессионную кассету, способную направлять образование в растительных клетках фитоенсинтазы, происходящей из растений, и
(б) экспрессионную кассету, способную направлять образование в растительных клетках фитоендесатуразы, происходящей из бактерий,
используемая для осуществления способа по любому из пп.2-10.
17. ДНК по п.16, где фитоендесарутаза происходит из гена CrtI Erwinia uredovora.
18. ДНК по п.16, оптимизированная для экспрессии в растении.
Текст
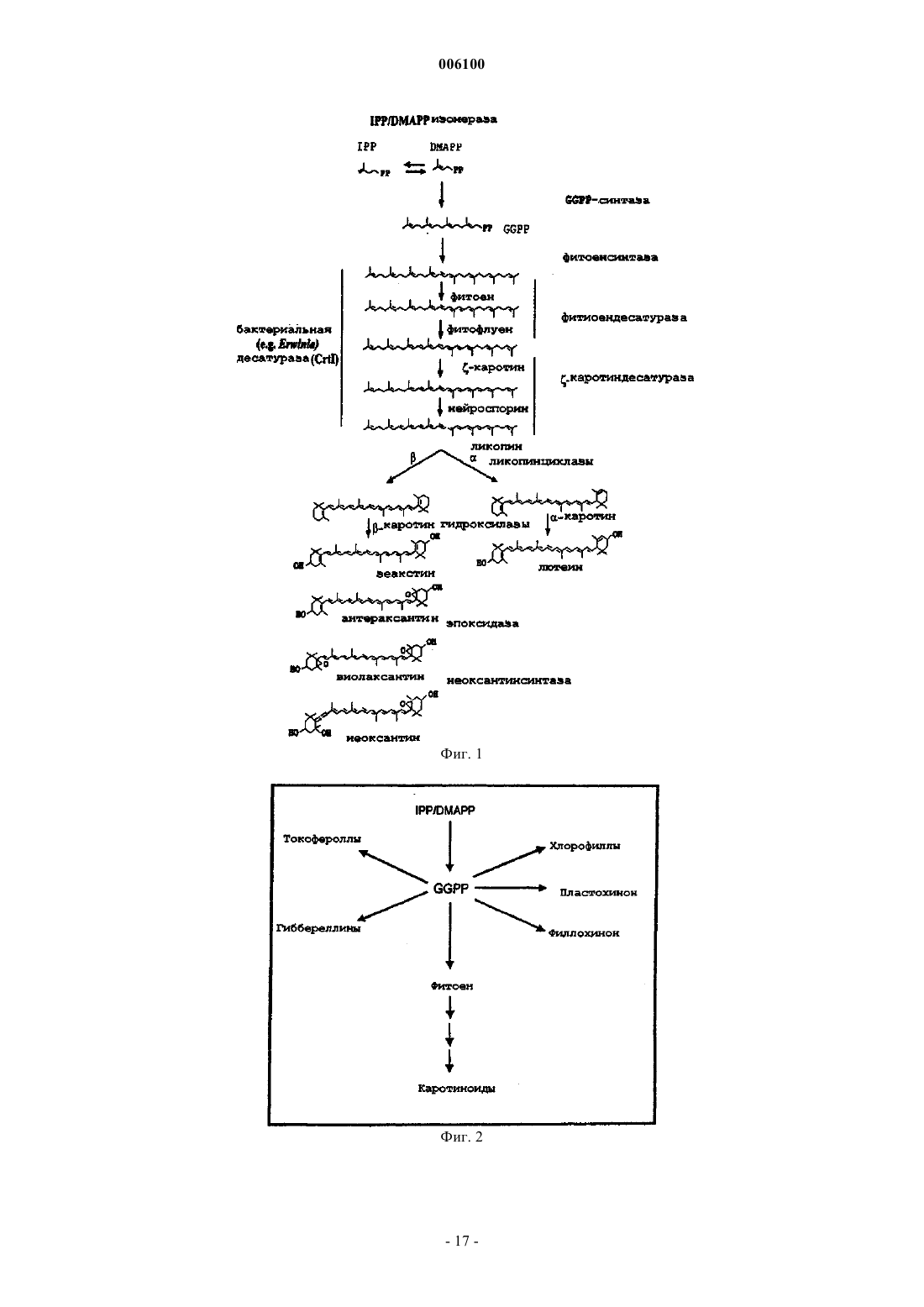
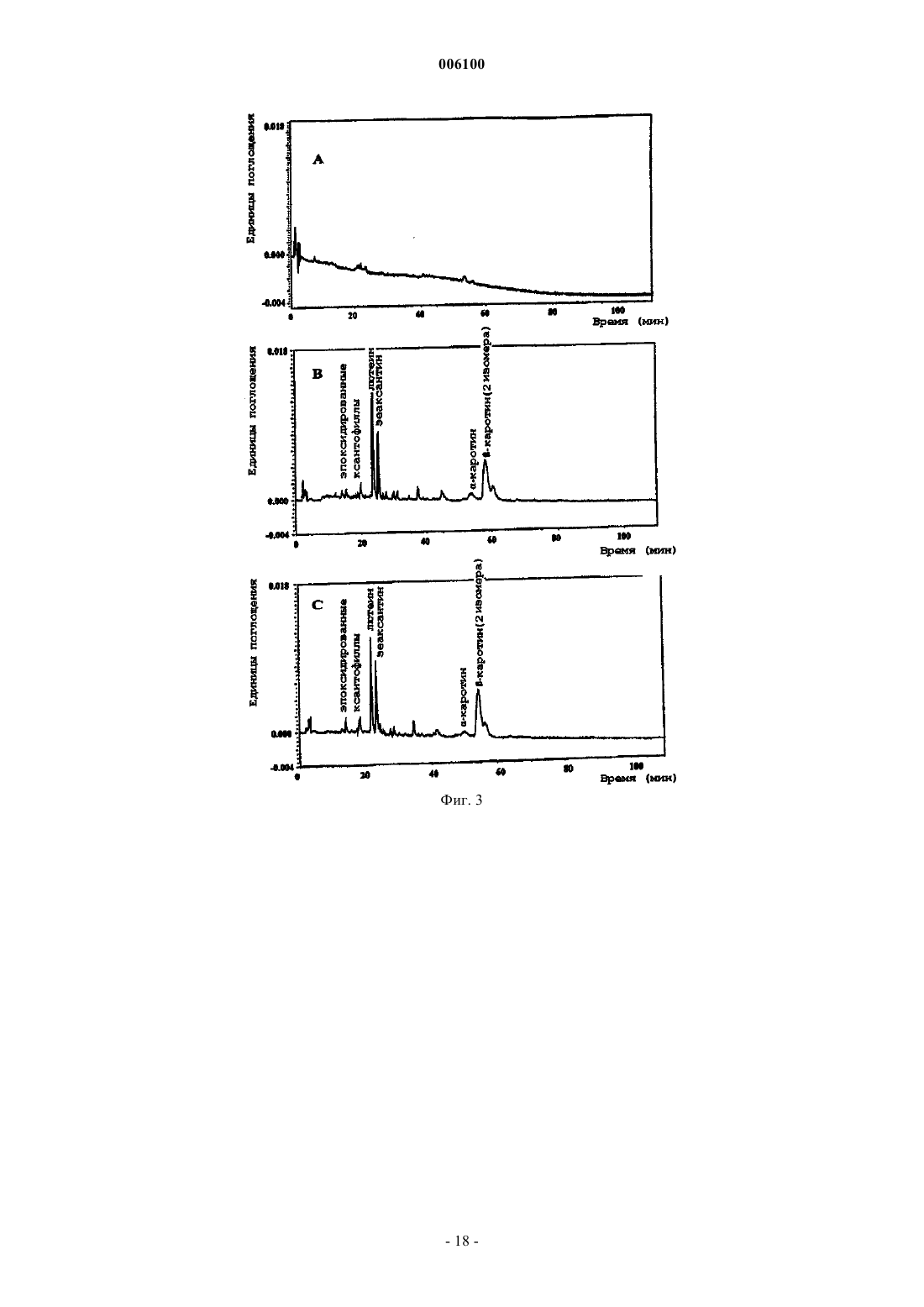
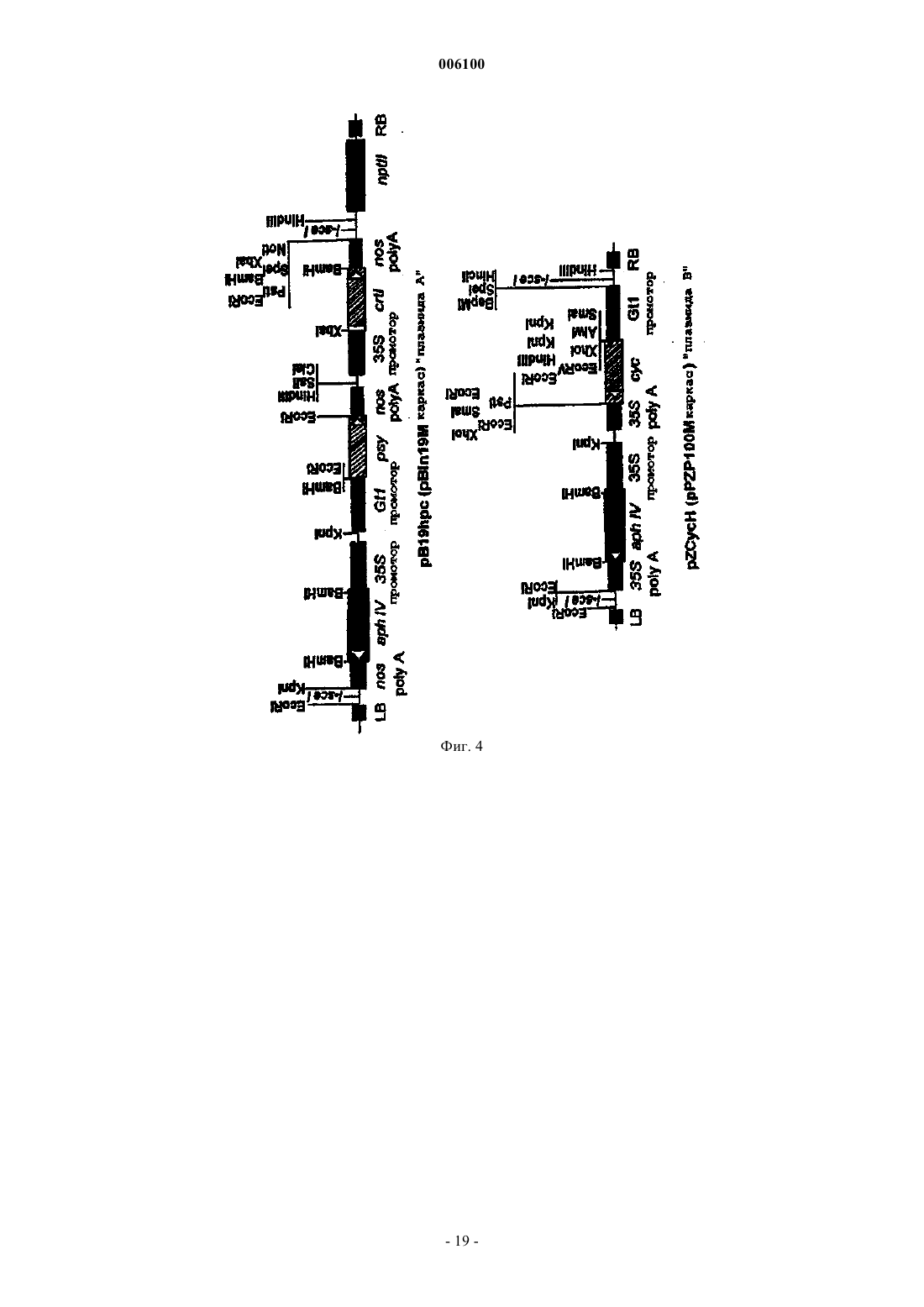
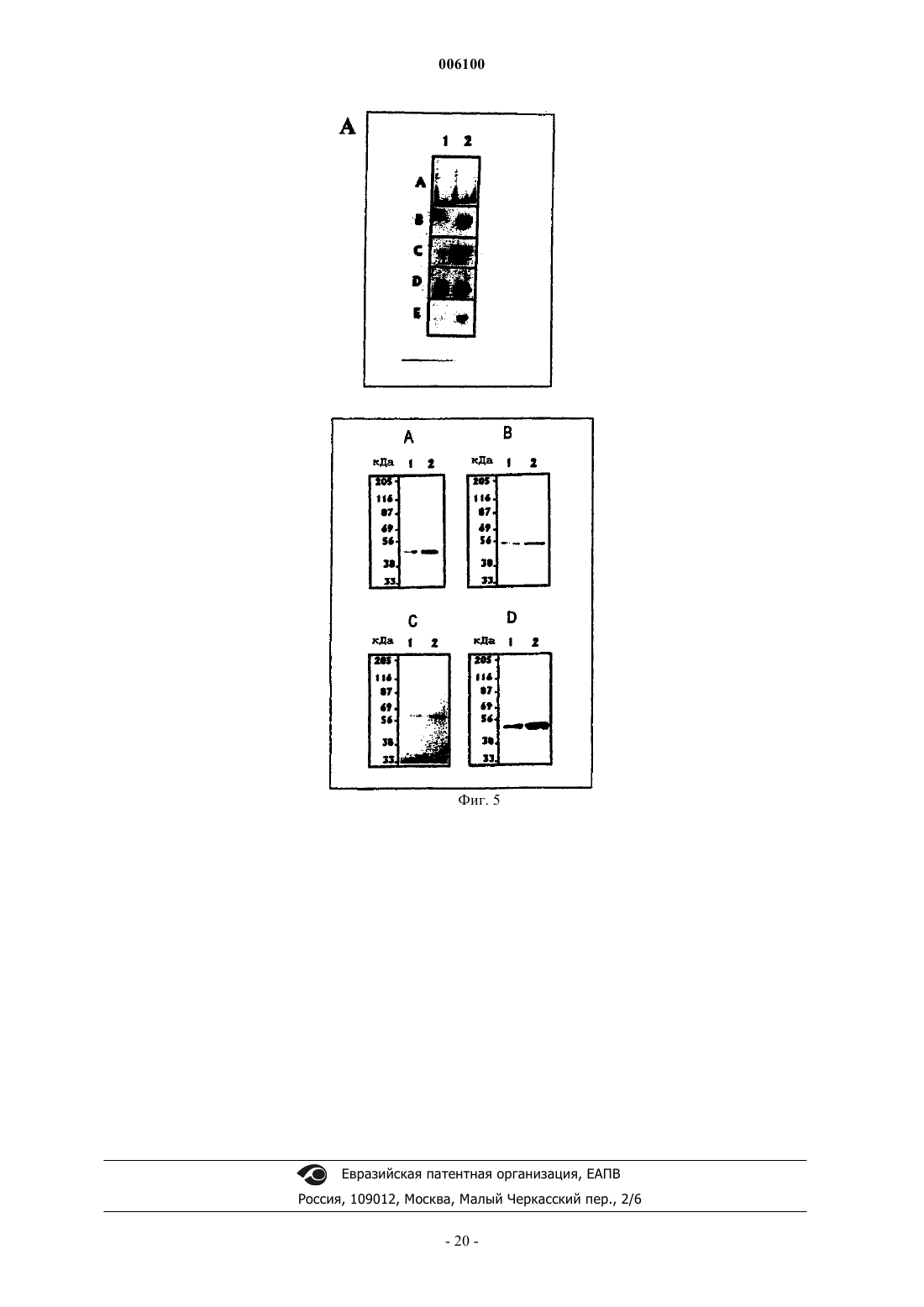
006100 Данное изобретение относится к области трансформации растительных клеток, семян и тканей и целых растений. Более конкретно, данное изобретение относится к встраиванию рекомбинантных нуклеотидных последовательностей, кодирующих один или несколько ферментов, специфических для пути биосинтеза каротиноидов, в растительный материал для улучшения его агрономической и пищевой ценности. Недостаточность провитамина А (-каротина) представляет собой очень серьезную проблему для здоровья, приводящую к тяжелым клиническим симптомам в части популяции мира, живущей на зерновых, таких как рис, в качестве основного или почти единственного главного пищевого продукта. Подсчитано, что только в юго-восточной Азии пять миллионов детей развивают каждый год глазное заболевание ксерофтальмию, из которых 0,25 миллиона со временем становятся слепыми (Sommer, 1988; Grant,1991). Кроме того, хотя недостаточность витамина А не является непосредственным определяющим фактором смерти, она коррелирует с увеличенной восприимчивостью к потенциальным летальным недугам,таким как диарея, респираторные заболевания и детские заболевания, такие как корь (Grant, 1991). Согласно статистике, собранной UNICEF, улучшенное питание с провитамином могло бы предотвращать 12 млн смертей ежегодно среди детей в возрасте 1-4 лет и дополнительные 0,25-0,5 млн смертей во время более позднего детства (Humphrey et al., 1992). В силу этих причин очень желательным является повышение уровней каротиноидов в основных пищевых продуктах. Кроме того, известно, что каротиноиды способствуют предотвращению нескольких видов рака и установлена роль лютеина и зеаксантина в сетчатке в предотвращении дегенерации желтого пятна (см., например, Brown et al., 1998; Schalch, 1992). Кроме того, каротиноиды имеют широкий диапазон применений, таких как применение в качестве красителей в пище человека и кормах животных, а также в качестве фармацевтических веществ. Кроме того, существует увеличивающийся интерес к каротиноидам как нутрицевтическим соединениям в функциональной пище. Это связано с тем, что некоторые каротиноиды, например -каротин, проявляют характер провитамина А у млекопитающих. Каротиноиды представляют собой 40-углеродные (С 40) изопреноиды, образованные конденсацией восьми изопреновых единиц, образованных из биосинтетического предшественника изопентенилдифосфата (см. фиг. 1). По номенклатуре каротиноиды делятся на два класса, а именно каротины, содержащие углеводороды, тогда как оксигенированные производные называют ксантофиллами. Их существенная функция в растениях заключается в том, чтобы защищать против фотоокислительного повреждения в фотосинтетическом аппарате пластид. Кроме того, они участвуют в собирании света во время фотосинтеза и представляют собой интегральные компоненты фотосинтетических реакционных центров. Каротиноиды являются прямыми предшественниками фитогормона абсцизовой кислоты. Биосинтез каротиноидов, изображенный схематически на фиг. 1, был исследован, и этот путь был выяснен в бактериях, грибах и растениях (см., например, Britton, 1988). В растениях каротиноиды образуются в пластидах. Ранним промежуточным продуктом биосинтетического пути каротиноидов является геранилгеранилдифосфат (GGPP), образуемый ферментом геранилгеранилдифосфатсинтазой из изопентенилдифосфата (IPP) и диметилаллилдифосфата (DMAPP, см. фиг. 1). Следующая ферментативная стадия, также представляющая первую каротиноид-специфическую реакцию, катализируется ферментом фитоенсинтазой. Эта реакция включает в себя двухступенчатую реакцию, приводящую к конденсации голова к голове двух молекул GGPP с образованием первого, еще неокрашенного продукта каротина, фитоена(Dogbo et al., 1988, Chamovitz et al., 1991; Linden et al., 1991; Pecker et al., 1992). Фитоенсинтаза встречается в двух формах, растворимой/неактивной и мембраносвязанной/активной, и требует соседних гидроксигрупп для активности, когда она присутствует в поверхности пластидных галактолипидсодержащих мембран (Schledz et al., 1996). Хотя образование фитоена является сходным в бактериях и растениях, метаболизация фитоена явно различается. В растениях два генных продукта действуют последовательным образом для генерирования окрашенного каротина ликопина (Beyer et al., 1989). Они представлены ферментами фитоендесатуразой(PDS, см., например Hugueney et al., 1992) и -каротиндесатуразой (ZDS, см., например Albrect et al.,1996). Каждый из них вводит две двойные связи с образованием -каротина через фитофлуен и ликопина через нейроспорин соответственно. Считается, что PDS кинетически связана с мембраносвязанной окислительно-восстановительной цепью (Nievelstein et al., 1995) с использованием пластохинона (Mayer et al.,1990; Schulz et al., 1993; Norris et al., 1995), тогда как ZDC действует кинетически другим путем (Albrechtet al., 1996). В растениях весь этот путь, по-видимому, включает в себя промежуточные продукты в цисконфигурации (Bartley et al., 1999). В противоположность этому, во многих бактериях, таких как бактерии рода Erwinia, вся последовательность десатурации, образующая все четыре двойные связи, достигается единственным генным продуктом (CrtI), превращающим непосредственно фитоен в ликопин (см.,например Miawa et al., 1990; Armstrong et al., 1990, Hundle et al., 1994). Известно, что этот тип бактериальной десатуразы является нечувствительным к некоторым вызывающим этиоляцию гербицидам, которые эффективно ингибируют фитоендесатуразу растительного типа. В растениях два генных продукта катализируют циклизацию ликопина, а именно - и -1 006100 ликопинциклазы, образующие - и -иононовые конечные группы соответственно (см., например,Cunningham et al., 1993; Scolnik and Bartley, 1995, Cunningham et al., 1996). В растениях образуются в норме -каротин, несущий две -иононовые конечные группы, и -каротин, несущий однуи одну иононовую конечную группу. Образование растительных ксантофиллов опосредовано сначала двумя генными продуктами, - и-гидроксилазами (Masamoto et al., 1998), действующими в положении С 3 и С 3' каркаса каротина, - и-каротина соответственно. Полученные ксантофиллы называются лютеин и зеаксантин. Дальнейшие реакции оксигенации катализируются зеаксантинэпоксидазой, катализирующей введение эпоксигрупп в положении С 5,С 6 и С 5',С 6' каркаса зеаксантина (Marin et al., 1996). Это приводит к образованию антераксантина и виолаксантина. Эта реакция является обратимой под действием другого генного продукта, виолаксантиндеэпоксидазы (Bugos and Yamamoto, 1996). Генный продукт, приводящий к образованию неоксантина, еще должен быть идентифицирован. Гены и кДНК, кодирующие гены биосинтеза каротиноидов, были клонированы из различных организмов в диапазоне от бактерий до растений. Бактериальные и цианобактериальные гены включают в себя гены Erwinia herbicola (Application WO91/13078, Armstrong et al., 1990), Erwinia uredovora (Misawa etSynechococcus sp. (Genbank accession number X63873), Flavobacterium sp. штамм R1534 (Pasamontes et al.,1997). Гены и кДНК, кодирующие ферменты биосинтетического пути каротиноидов высших растениях,были клонированы из различных источников, в том числе Arabidopsis thaliana, Sinapis alba, Capsicum annuum, Narcissus pseudonarcissus, Lycopersicon esculentum и т.д., как можно заключить на основании информации из публичных баз данных. В настоящее время относительно мало известно о применении этих клонированных генов для трансформации высших растений и полученных эффектах. Экспрессия фитоенсинтазы томатов может влиять на уровни каротиноидов в плоде (Bird et al., 1991; Bramley et al., 1992; Fray and Grierson, 1993). Сообщалось также, что конститутивная экспрессия фитоенсинтазы в трансформированных растениях томатов приводит к низкорослости карликовости вследствие направления метаболита GGPP из пути биосинтеза гиббереллина на другой путь (Fray et al., 1995). Такие проблемы не были замечены при конститутивной экспрессии фитоенсинтазы из Narcissum pseudonarcissus в эндосперме риса (Burkhardt et al.,1997). Известно, что CrtI Erwinia uredovora в качестве бактериальной десатуразы функционирует в растениях и сообщает устойчивость к вызывающим этиоляцию гербицидам (Misawa et al., 1993). Много попыток предпринималось на протяжении лет для изменения или усиления биосинтетических путей каротиноидов в различных растительных тканях, таких как вегетативные ткани или семена,или в бактериях. См., например, WO 96/13149, WO 98/06862, WO 98 24300, WO 96/28014 и патент США 5618988. Все они ограничиваются манипуляцией с предсуществующими реакциями биосинтеза каротиноидов в этих клетках. Другие применения, нацеленные на изменение биосинтеза каротиноидов в богатых маслом семенах, являются отличающимися, так как они обеспечивают сток для обеспечения избытка каротиноидов, образующихся вследствие увеличения, вызываемого трансформацией. Очевидно, что существует необходимость в способе трансформации растительного материала для получения трансформантов, способных экспрессировать все ферменты биосинтетического пути каротиноидов, необходимые для получения представляющих интерес каротинов и ксантофиллов. Сущность изобретения Данное изобретение обеспечивает средства и способы трансформации клеток, семян, тканей растений или целых растений для получения трансформантов, способных экспрессировать все ферменты пути биосинтеза каротиноидов, которые являются существенными для целевых хозяев-растений для накопления представляющих интерес каротинов и/или ксантофиллов. Данное изобретение обеспечивает также молекулы ДНК, сконструированные, чтобы быть пригодными для проведения способа данного изобретения, и плазмиды или векторные системы, содержащие указанные молекулы. Кроме того, данное изобретение обеспечивает трансгенные клетки, семена, ткани растений и целые растения, которые проявляют улучшенную пищевую ценность и содержат такие молекулы ДНК и/или которые были произведены с использованием способов данного изобретения. Таким образом, данное изобретение обеспечивает как введение de novo и экспрессию биосинтеза каротиноидов, который особенно важен в отношении растительного материала, который известен как материал, по существу не содержащий каротиноидов, такого как эндосперм риса и семена многих других злаков, так и модификацию предсуществующего биосинтеза каротиноидов для положительной или отрицательной регуляции накопления определенных представляющих интерес промежуточных продуктов. Краткое описание чертежей Фиг. 1 показывает общий путь биосинтеза каротиноидов растений. Названия ферментов даются жирным шрифтом. Также показана реакция, катализируемая бактериальной каротиндесатуразой CrtIтипа. Фиг. 2 показывает, что промежуточный продукт геранилгеранилдифосфат (GGPP) не только участвует в биосинтезе каротиноидов, но и служит в качестве строительного блока в путях, ведущих к различ-2 006100 ным соединениям через реакции пренилирования (например, токоферолам, хинонам, хлорофиллам) или через отличающуюся реакцию, использующую не содержащие пренила акцепторные молекулы (например, гиббереллинам, вкусовым или ароматическим веществам). Фиг. 3 представляет ВЖХ-анализы шлифованных семян риса (эндосперма) из нетрансформированных (фиг. 3 А) и трансформированных (плазмидой А, фиг. 3 В; плазмидой А плюс В, фиг. С) растений риса. Появление каротиноидов, циклических каротинов и ксантофиллов видно в записях самописца,представляя трансформированные семена. Фиг. 4 схематически иллюстрирует экспрессионные кассеты, используемые в плазмиде А и плазмиде В. LB, левая граница; RB, правая граница; psy, фитоенсинтаза, кДНК из Narcissuspseudonarcissus; crtI, ген каротиндесатуразы из Erwinia uredovora; cyc, ликопинциклаза, кДНК из Narcissus pseudonarcissus; aphIV, гигромицинфосфотрансфераза; GtI, промотор глютелина I риса; 35S, промотор CaMV 35S; nos, терминатор нопалинсинтазы; NptlI, ген устойчивости к канамицину. Фиг. 5 - нозерн-блот с использованием РНК из необработанных (дорожка 1) и СРТА-обработанных(дорожка 2) цветков нарциссов. Иммобилизованную РНК удаляли периодически для гибридизации с использованием меченых зондов для В, фитоенсинтазы; В, фитоендесатуразы; С, -каротиндесатуразы; Е, ликопинциклазы. В, вестерн-блот с использованием белковых экстрактов из необработанных (дорожка 1) и обработанных (дорожка 2) цветков нарциссов. Блоты зондировали антителами к А, фитоенсинтазе; В, фитоендесатуразе; С,-каротиндесатуразе; D, ликопинциклазе. Аббревиатуры, используемые во всем описании Систематические названия относящихся к предмету каротиноидов, упоминаемых здесь: Фитоен: 7,8,11,12,7', 8', 11', 12' -октагидро-, -каротин Фитофлуен: 7,8,11,12,7',8' -гексагидро-, -каротинGGPP: геранилгеранилдифосфат В применении здесь термин растение обычно включает в себя эукариотические водоросли, эмбриофиты, в том числе Bryophyta, Pteridophyta и Spermatophyta, такие как Gymnospermae и Angiospermae,причем последние включают в себя Magnoliopsida, Rosopsida (настоящие двудольные), Liliopsida (однодольные). Характерные и предпочтительные примеры включают в себя семена злаков, например риса, пшеницы, ячменя, овса, амаранта, льна, тритикале, ржи, кукурузы и других злаков; масличные семена, такие как семена масличных Brassica, семена хлопчатника, сои, сафлора, подсолнечника, кокосового ореха,пальмы, и т.п.; другие съедобные семена или семена растений с пригодными в пищу частями, в том числе тыкву пепо, тыкву крупноплодную столовую, кунжут, мак, виноград, фасоль золотистую (маш), земляной орех, горох, бобы, редис, люцерну, какао, кофейное дерево, коноплю посевную, древесные орехи,такие как орехи, миндали, кария пекан, турецкий горох и т.д. Кроме того, картофель, морковь, батат, томаты, перец, маниок, ивы, дубы, вяз, клены, яблони, бананы; декоративные цветы, такие как лилии, орхидные растения, осоки, розы, лютики, петуньи, флоксы, фиалки, подсолнечники и т.п. В общем, данное изобретение применимо к декоративным видам, а также к видам, культивируемым для пищи, волокна,-3 006100 древесных продуктов, дубильных материалов, красителей, пигментов, камедей, смол латексных продуктов, жиров, масел, лекарственных средств, напитков и т.п. Предпочтительно целевое растение, выбранное для трансформации, культивируют для пищевых продуктов, таких как, например, зерно, корни, бобы, орехи, овощи, клубни, плоды, специи и т.п. Подробное описание изобретения Согласно данному изобретению обеспечены средства и способы трансформации клеток, семян, тканей растений или целых растений для получения трансформантов, способных экспрессировать все ферменты пути биосинтеза каротиноидов, которые являются существенными для целевых растений-хозяев для накопления представляющих интерес каротинов и/или ксантофиллов. Согласно другому аспекту данного изобретения указанные способы могут быть также использованы для модификации предсуществующего биосинтеза каротиноидов для положительной или отрицательной регуляции накопления определенных промежуточных продуктов или представляющих интерес продуктов. Кроме того, обеспечены специфические молекулы ДНК, которые содержат нуклеотидные последовательности, несущие одну или несколько экспрессионных кассет, способные управлять образованием одного или нескольких ферментов, характерных для пути биосинтеза каротиноидов, выбранных из группы, состоящей из: фитоенсинтазы, происходящей из растений, грибов или бактерий,фитоендесатуразы, происходящей из растений, грибов или бактерий,-каротиндесатуразы, происходящей из растений или цианобактерий, и ликопинциклазы, происходящей из растений, грибов или бактерий. Согласно предпочтительному варианту вышеупомянутая экспрессионная кассета содержит один или несколько генов или одну или несколько кДНК, кодирующих растительную, грибную или бактериальную фитоенсинтазу, растительную, грибную или бактериальную фитоендесатуразу, растительную каротиндесатуразу или растительную, грибную или батериальную ликопинциклазу, каждые из которых функционально связаны с подходящим конститутивным, индуцибельным или тканеспецифическим промотором, позволяющим их экспрессию в клетках, семенах, тканях растений или в целых растениях. Особенно предпочтительные гены или кДНК кодируют растительную фитоенсинтазу, бактериальную фитоендесатуразу или растительную ликопинциклазу. Большое и все еще увеличивающееся число генов, кодирующих фитоенсинтазу (растительную или бактериальную), каротиндесатуразу типа CrtI (бактериальную) и ликопинциклазу (растительную и бактериальную), было выделено, и они являются доступными из баз данных. Они происходят из различных источников и доступны для применения в способах данного изобретения. Предпочтительно, чтобы эти молекулы ДНК дополнительно содержали по меньшей мере один селектируемый маркерный ген или кДНК, функционально связанные с подходящим конститутивным, индуцируемым или тканеспецифическим промотором, причем наиболее предпочтительной в качестве селективного маркера является гигромицинфосфотрансфераза под контролем конститутивного промотора. Хотя квалифицированный специалист может выбрать любой доступный промотор, функционально активный в растительном материале, в конструировании подходящих экспрессионных кассет согласно данному изобретению предпочтительно функционально связывать соответствующую нуклеотидную последовательность, кодирующую фитоендесатуразу, -каротиндесатуразу или ликопинциклазу с тканеспецифическими или конститутивными промоторами, тогда как нуклеотидную последовательность, кодирующую фитоенсинтазу, предпочтительно экспрессировать под контролем тканеспецифического промотора во избежание вмешательства образования гиббереллинов. Понятно, что нуклеотидная последовательность как функциональный элемент молекулы ДНК данного изобретения может содержать любую комбинацию одного или нескольктх вышеупомянутых генов или кДНК. В особенно предпочтительном варианте данного изобретения указанная последовательность содержит функциональные экспрессионные кассеты как для фитоенсинтазы, так и для бактериальной или грибной фитоендесатуразы, и может после включения в подходящую плазмидную или векторную систему (плазмиду А) вводиться в целевой растительный материал либо отдельно, либо вместе со вторым вектором (плазмидой В), содержащим нуклеотидную последовательность, которая кодирует ликопинциклазу. Кроме того, данное изобретение обеспечивает плазмиды или векторные системы, содержащие одну или несколько вышеуказанных молекул ДНК или нуклеотидных последовательностей, которые предпочтительно получены из Agrobacterium tumefaciens. Рассматриваемое изобретение дополнительно обеспечивает трансгенные клетки, семена, ткани растений и целые растения, которые проявляют улучшенную пищевую ценность и содержат одну или несколько указанных молекул ДНК, плазмид или векторов и/или которые получены с использованием способа данного изобретения. Данное изобретение основано на том факте, что ранний промежуточный продукт геранилгеранилдифосфат (GGPP) не только служит для каротиногенеза, но представляет собой точку разветвления, служащую для нескольких различных биосинтетических путей (фиг. 2). Таким образом, был сделан вывод,что этот предшественник встречается в пластидах всех растительных тканей, несущих каротиноиды или-4 006100 нет, таких как эндосперм риса. Таким образом, источник GGPP может быть использован для достижения целей данного изобретения, т.е. введения биосинтетического пути каротиноидов, частично или в виде целого, и/или усиления или ускорения предсуществующего биосинтетического пути каротиноидов. Термин не содержащие каротиноидов, используемый во всем описании для дифферециации между определенными целевыми растительными клетками или тканями, означает, что известно, что соответствующий растительный материал, не трансформированный в соответствии с данным изобретением, является по существу не содержащим каротиноидов, как это имеет место, например, для запасающих органов, таких как, например, эндосперм риса и т.п. Не содержащие каротиноидов не означает, что клетки или ткани, которые накапливают каротиноиды в почти недетектируемых количества, являются исключенными. Предпочтительно указанный термин будет определять растительный материал, имеющий содержание каротиноидов 0,001% (маc./маc.) или ниже. Что касается выбора подходящих источников, из которых могут быть получены ферменты каротиноидного пути, должно быть понятно, что кодирующие последовательности Cyanobacteria, являющиеся гомологичными соответствующим растительным последовательностям, могут быть также использованы в соответствии с данным изобретением. В предпочтительном варианте данного изобретения фитоенсинтазу высшего растения (ген) функционально связывают с промотором, придающим тканеспецифическую экспрессию. Их объединяют на одной и той же плазмиде (плазмиде А) с бактериальной (CrtI-типа) фитоендесатуразой (геном), последнюю сливают с последовательностью ДНК, кодирующей транзитный пептид, и функционально связывают с промотором, позволяющим конститутивную экспрессию. Трансформация растений этой конструкцией в подходящем векторе будет управлять образованием ликопина в ткани, выбранной промотором,контролирующим фитоенсинтазу, например в семенах не содержащих каротиноидов злаков. Неожиданно эта трансформация одна может инициировать синтез каротиноидов за пределами образования ликопина в направлении стоящих ниже по ходу биосинтеза ксантофиллов, таких как лютеин, зеаксантин, антераксантин, виолаксантин и неоксантин, даже в не содержащей каротиноидов ткани, такой как эндосперм риса. Кроме того, наблюдается образование -каротина. Таким образом, образуется комплект каротиноидов, сходный с комплектом каротиноидов, присутствующим в зеленых листьях. Этот неожиданный феномен (здесь называемый также механизмом превышения) может быть обусловлен конститутивной экспрессией соответствующих более поздних генов (ликопинциклаз, -каротингидроксилаз, эпоксидаз),которые становятся активированными опосредованным трансформацией обеспечением субстрата или,альтернативно, индукцией экспрессии генов биосинтеза каротиноидов, вызванной трансформацией. В случае, когда этот механизм превышения не функционирует, котрансформация (плазмида В) геном или кДНК, кодирующим ликопинциклазу, может преодолеть эту проблему и сделать возможным, по меньшей мере, образование - или -каротина (провитамина А). В случаях, когда механизм превышения функционирует, эта котрансформация может усиливать эффекты, вызываемые фитоенсинтазой и каротиндесатуразой CrtI-типа. Таким образом, данное изобретение включает в себя введение биосинтетического пути каротиноидов за пределами точки, задаваемой генетически трансформацией плазмидами А или А плюс В. Плазмида А способна усиливать продуцирование каротиноидов в несущих каротиноиды тканях. Эти трансформации приводят к усилению пищевой ценности пищи человека и корма животных. Дополнительным преимуществом использования бактериальной фитоендесатуразы CrtI-типа для трансформации является то, что указанный фермент будет экспрессироваться также в хлоропластах листьев, придавая посредством этого устойчивость к вызывающим этиоляцию гербицидам, поражающим фитоендесатуразу растений. Таким образом, данное изобретение включает в себя также использование устойчивости к вызывающим этиоляцию гербицидам в сочетании с трансгенными растениями, несущими, по меньшей мере, плазмиду А. Вторая плазмида В может нести ген для растительной ликопинциклазы; альтернативно, может быть использована бактериальная ликопинциклаза, снабженная транзитной последовательностью. Их функционально связывают с промотором, предпочтительно придающим ту же самую тканеспецифичность экспрессии, что и в случае фитоенсинтазы в плазмиде А. Котрансформация плазмид А и В приводит к дополнению ткани-мишени, такой как корень, плодовые клубни или семена, полной информацией для проведения биосинтетического пути каротиноидов от геранилгеранилдифосфата с образованием каротина. В случае предсуществующих или индуцированных более поздних реакций этого пути эта котрансформация (см. выше) делает возможным увеличенное содержание каротиноидов и увеличенное образование произведенных из -каротина ксантофиллов. Все используемые гены функционально снабжены последовательностью ДНК, кодирующей транзитную последовательность, позволяющую импорт в пластиду. Это достигается либо технологией рекомбинантных ДНК, либо с использованием транзитной последовательности, присутствующей в используемой растительной кДНК. Затем эта трансформация делает возможным образование каротиноидов с использованием пула предшественника геранилгеранилдифосфата, локализованного в пластидах. Это центральное соединение не является каротиноидом и не представляет собой предшественник, который-5 006100 относится только к биосинтезу каротиноидов (см. фиг. 2). Растения должны экспрессировать введенный ген (гены) и предпочтительно являются гомозиготными по их экспрессии. Обычно, этот ген будет функционально связан с промотором, функционально активным в целевых клетках-хозяевах конкретного растения. Экспрессия должна быть на таком уровне,чтобы получить желаемое свойство из данного гена. Например, экспрессиия селектируемого маркерного гена должна обеспечить подходящую селекцию трансформантов, полученных в соответствии со способами данного изобретения. Подобным образом, экспрессия одного или нескольких генов пути биосинтеза каротиноидов и ксантофиллов для повышения качества питания должна приводить к растению,имеющему относительно более высокое содержание одного или нескольких промежуточных продуктов этого пути по сравнению с этим содержанием того же самого вида, который не подвергался способу трансформации данного изобретения. С другой стороны, обычно будет желательно ограничение избыточной экспрессии представляющих интерес гена или генов во избежание значимого неблагоприятного воздействия на нормальную физиологию этого растения, т.е. до той степени, когда его культивирование становится затруднительным. Ген или гены, кодирующие представляющие интерес фермент или ферменты, могут быть использованы в экспрессионных кассетах для экспрессии в трансформированных растительных тканях. Для достижения целей данного изобретения, т.е. для введения или дополнения биосинтетического пути каротиноидов в представляющем интерес целевом растении, это растение трансформируют по меньшей мере одной экспрессионной кассетой, содержащей район инициации транскрипции, связанный с представляющим интерес геном. Район инициации транскрипции может быть нативным или аналогичным относительно хозяина или чужеродным или гетерологичным относительно хозяина. Под чужеродным районом имеется в виду, что данный район инициации транскрипции не обнаруживается в хозяине дикого типа, в которого вводят данный район инициации транскрипции. Особый интерес представляют собой районы инициации транскрипции, ассоциированные с запасными белками, такими как глютелин, пататин, напин, круциферин, р-конглюцинин, фазеолин или т.п. Транскрипционная кассета будет включать в себя в направлении транскрипции 5'-3, район инициации транскрипции и трансляции, представляющую интерес последовательность ДНК и район терминации транскрипции и трансляции, функциональные в растениях. Район терминации может быть нативным с районом инициации транскрипции, может быть нативным с представляющей интерес ДНК или может быть получен из других источников. Подходящие районы терминации доступны из Ti-плазмиды A. tumefaciens, такие как районы терминации октопинсинтазы и нопалинсинтазы (см. также Guerineau et al.,1991; Proudfood, 1991; Sanfacon et al., 1991; Mogen et al., 1990; Munroe et al., 1990; Ballas et al., 1989; Joshiet al., 1987). В большинстве случаев представляющие интерес данного изобретения ген или гены будут нацелены на пластиды, такие как хлоропласты, для экспрессии. Таким образом, в том случае, когда представляющий интерес ген не встраивается непосредственно в пластиду, экспрессионная кассета будет дополнительно содержать последовательность, кодирующую транзитный пептид для направления представляющего интерес гена в пластиду. Такие транзитные пептиды известны в данной области (см., например,Von Heijne et al., 1991; Clark et al., 1989; Della-Cioppa et al., 1987; Romer et al., 1993 и Shah et al., 1986). Любые гены пути каротиноидов, применимые в данном изобретении, могут использовать нативные или гетерологичные транзитные пептиды. Конструкция может также содержать любые другие необходимые регуляторы, такие как трансляционные консенсусные последовательности растений (Joshi, 1987), интроны (Luehersen and Walbot, 1991) и т.п., функционально связанные с представляющей интерес нуклеотидной последовательностью. Последовательности интронов в гене, который желательно ввести, могут увеличивать уровень его экспрессии путем стабилизации транскрипта и эффективной транслокации его из ядра. Среди таких известных интронных последовательностей находятся интроны гена убиквитина растений (Cornejo, 1993). Кроме того,наблюдали, что одна и та же конструкция, встроенная в различных локусах на геноме, может варьироваться по уровню экспрессии в растениях. Считается, что этот эффект обусловлен отчасти положением этого гена на хромосоме, т.е. индивидуальные изоляты будут иметь различные уровни экспрессии (см.,например: Hoever et al., 1994). Дополнительные регуляторные последовательности ДНК, которые могут быть использованы для конструирования экспрессионных кассет, включают в себя, например, последовательности, которые способны регулировать транскрипцию ассоциированной последовательности ДНК в растительных тканях в смысле индукции или репрессии. Например, имеются некоторые гены растений, о которых известно, что они индуцируются различными внутренними и внешними факторами, такими как растительные гормоны, тепловой шок, химикалии, патогены, недостаток кислорода, свет, стресс и т.д. Другая группа последовательностей ДНК, которые могут регулироваться, включает в себя химически запускаемые последовательности, которые присутствуют, например, в генах PR (патогенезотносящихся) белков табака и являются индуцибельными под действием химических регуляторов, таких-6 006100 как описанные в ЕР-А 0 332 104. Еще одним важным обстоятельством при экспрессии чужеродных генов в растениях является уровень стабильности трансгенного генома, т.е. тенденция чужеродного гена к сегрегации из популяции. Если селектируемый маркер связан с представляющим интерес геном или экспрессионной кассетой, то может быть использован отбор для сохранения трансгенного растения. Может быть выгодным включение 5'-лидерных последовательностей в конструкцию экспрессионной кассеты. Такие лидерные последовательности могут действовать, усиливая трансляцию. Трансляционные лидерные последовательности известны в данной области и включают в себя: лидеры пикорнавируса, например лидер EMCV (5'-некодирующий район энцефаломиокардита; Elroy-Stein et al., 1989); лидеры потивирусов, например лидер TEV (вирус табачной гравировки; Allisson et al., 1986); и связывающий белок тяжелой цепи иммуноглобулина человека (BiP, Macejak and Sarnow, 1991); нетранслируемый лидер из мРНК белка оболочки вируса мозаики люцерны (РНК 4 AMV; Jobling and Gehrke 1987); лидер вируса мозаичной болезни табака (TMV; Gallie et al., 1989); и лидер вируса хлоротичной мозаичности маиса (MCMV; Lommel et al., 1991; см. также Della-Cioppa et al., 1987). В зависимости от того, где должна быть экспрессирована представляющая интерес ДНК, может быть желательно синтезировать эту последовательность с предпочтительными для растения кодонами или альтернативно с предпочтительными для хлоропласта кодонами. Предпочтительные для растения кодоны могут быть определены из кодонов с наивысшей встречаемостью в белках, экспрессируемых в наибольшем количестве в конкретном представляющем интерес виде растения (см. патенты ЕР-А 0359 472; ЕР-А 0386962; WO 91/16432; Pertak et al., 1991 и Murray et al., 1989). Таким образом нуклеотидные последовательности могут быть оптимизированы для экспрессии в любом растении. Общепризнанным является то, что вся последовательность гена или любая часть последовательности гена может быть оптимизированной или синтетической. То есть, могут быть также использованы синтетические или частично оптимизированные последовательности. В отношении конструирования предпочтительных для хлоропластов генов, см. USPN 5545817. В получении транскрипционной кассеты могут быть произведены манипуляции с различными ДНК-фрагментами так, чтобы обеспечить последовательности ДНК в правильной ориентации и, если нужно, в правильной рамке считывания. Для этой цели могут быть использованы адаптеры или линкеры для соединения фрагментов ДНК или другие манипуляции могут быть привлечены для обеспечения подходящих сайтов рестрикции, удаления ненужной ДНК, удаления сайтов рестрикции или т.п. Для этой цели могут быть использованы мутагенез in vitro, репарация праймеров, рестрикция, отжиг, резекция,лигирование или т.п., где могут участвовать вставки, делеции или замены, например, транзиции и трансверсии. Экспрессионную кассету, несущую представляющий интерес ген, помещают в экспрессирующий вектор стандартными способами. Выбор подходящего экспрессирующего вектора будет зависеть от способа введения экспрессирующего вектора в клетки-хозяева. Типичный экспрессирующий вектор содержит элементы прокариотической ДНК, кодирующие бактериальную точку начала репликации, и ген устойчивости к антибиотику для обеспечения роста и селекции экспрессирующего вектора в бактериальном хозяине; клонирующий сайт для вставки экзогенной последовательности ДНК, который в данном контексте кодировал бы один или несколько специфических ферментов биосинтетического пути каротиноидов; элементы эукариотической ДНК, которые контролируют инициацию транскрипции экзогенного гена, такие как промотор; и элементы ДНК, которые контролируют процессинг транскриптов, такие как последовательность терминации транскрипции/полиаденилирования. Он может также содержать такие последовательности, которые необходимы для возможной интеграции этого вектора в хромосому. В предпочтительном варианте этот экспрессирующий вектор содержит также ген, кодирующий селектируемый маркер, такой как, например, гигромицинфосфотрансфераза (van den Elzen et al., 1985), который функционально связан с промотором. Дополнительные примеры генов, которые придают устойчивость к антибиотикам и, следовательно, пригодны в качестве селектируемых маркеров, включают в себя гены, кодирующие неомицинфосфотрансферазу (устойчивость к канамицину) (Velten et al., 1984); ген устойчивости к канамицину (NPT II), произведенный из Tn5 (Bevan et al., 1983); ген PAT, описанный в Thompson et al., (1987), и хлорамфениколацетилтрансферазы. В отношении общего описания экспрессирующих векторов растений и генов селектируемых маркеров, пригодных в соответствии с данным изобретением, см. Gruber et al., (1993). Как описано выше, можно также исключить дополнительный селектируемый маркер из экспрессирующей кассеты, содержащей бактериальный ген crtI, генный продукт которого, как было показано, сообщает устойчивость к вызывающим этиоляцию гербицидам. В специфическом варианте предпочтительно, чтобы crtI находился под контролем конститутивного или тканеспецифического промотора. В более специфическом варианте предпочтительно, чтобы ген crtI контролировался промотором, специфическим для зеленых фотосинтетически активных тканей или клеток и функционально активным в них. Промоторный элемент, используемый для контроля экспрессии представляющего интерес гена и маркерного гена, соответственно, может быть любым совместимым с растением промотором. Это могут быть промоторы генов растений, такие как промотор малой субъединицы рибулозо-1,5-7 006100 бисфосфаткарбоксилазы (RUBISCO), или промоторы из индуцирующих опухоли плазмид Agrobacteriumtumefaciens, такие как промоторы нопалинсинтазы и октопинсинтазы, или вирусные промоторы, такие как промоторы 19S и 35S вируса мозаичной болезни цветной капусты (CaMV) и промотор 35S вируса мозаики норичника шишковатого. См., например, международную заявку WO 91/19806 в отношении обзора известных промоторов растений, которые пригодны для применения в данном изобретении. Тканеспецифические промоторы обеспечивают то, что накопление одного или нескольких указанных генных продуктов является особенно высоким в ткани, в которой должны экспрессироваться продукты биосинтетического пути каротиноидов или ксантофиллов; некоторая экспрессия может происходить в других частях этого растения. Примеры известных тканеспецифических промоторов включают в себя промотор глютелина 1 (Kim et al., 1993; Okita et al., 1989; Zheng et al., 1993), клубеньнаправленный промотор пататина класса I (Bevan et al., 1986); промоторы, ассоциированные с генамиADPGPP клубня картофеля (Muller et al., 1990); промотор -конглицинина сои, также известный как белок 7S, который запускает направленную на семена транскрипцию (Bray, 1987) и направленные на семена промоторы генов зеина эндоспермамаиса (Pedersen et al., 1982). Следующим типом промотора, который может быть использован в соответствии с данным изобретением, является промотор убиквитина растений. Промоторы убиквитина растений хорошо известны в данной области, как показано Kay et al.,(1987) и ЕР-А 0342926. Равным образом пригодными для данного изобретения являются промоторы актина, промоторы гистонов и промоторы тубулина. Примеры предпочтительных химически индуцируемых промоторов, таких как промотор PR-la табака, описаны подробно в ЕР-А 0332104. Другой предпочтительной категорией промоторов являются промоторы, которые индуцируются ранением. Предпочтительные промоторы этого типа включают в себя промоторы, описанные Stanford et al., (1989), Xu et al.,(1993), Logemann et al., (1989), Rohrmeier Lehle (1993), Firek et al., (1993) и Warner et al., (1993). Клетки, семена, ткани растений и целые растения, обсуждаемые в контексте данного изобретения,могут быть получены любым из нескольких способов. Специалистам в данной области будет понятно,что выбор способа должен зависеть от типа растения, т.е. однодольного или двудольного, предназначенного для трансформации. Такие способы обычно включают в себя прямой перенос генов, химически индуцируемый перенос генов, электропорацию, микроинъекцию (Crossway et al., 1986; Neuhaus et al., 1987),опосредованный Agrobacterium перенос генов, ускорение баллистических частиц с использованием, например, устройств, доступных из Agracetus, Inc., Madison, Wisconsin и Dupont, Inc., Wilmington, Delaware(см., например, Sanford et al., U.S. 4 945 050; и Mc Cabe et al., 1988) и т.п. Одним из способов получения данных трансформированных растений или их частей является прямой перенос генов, в котором клетки растений культивируют или выращивают иным образом при подходящих условиях в присутствии ДНК-олигонуклеотидов, содержащих нуклеотидную последовательность, которую желательно ввести в это растение или его часть. Источником донорной ДНК обычно является плазмида или другой подходящий вектор, содержащий желательные ген или гены. Для удобства,здесь авторы будут ссылаться на плазмиды, подразумевая, что обсуждаются также другие подходящие векторы, содержащие желательные ген или гены. Любая подходящая ткань растения, которая поглощает эту плазмиду, может быть обработана по способу прямого переноса генов. Такая растительная ткань включает в себя, например, репродуктивные структуры на ранней стадии развития, в частности, перед мейозом, и особенно за 1-2 недели перед мейозом. Обычно премейотические репродуктивные органы окунают в плазмидный раствор, например, инъекцией плазмидного раствора непосредственно в растение в репродуктивные органы или вблизи от репродуктивных органов. Затем растения самоопыляют или перекрестно опыляют пыльцой из другого растения, обработанной таким же образом. Плазмидный раствор обычно содержит 10-50 мкг ДНК в приблизительно 0,1-10 мл на относящуюся к цветку структуру, но может быть использовано большее или меньшее количество, в зависимости от размера конкретной относящейся к цветку структуры. Растворителем обычно является стерильная вода, солевой раствор или буферный солевой раствор или общепринятая растительная среда. Если желательно, плазмидный раствор может также содержать агенты для химической индукции или усиления поглощения плазмиды, такие как, например, ПЭГ, Са 2+ или т.п. После экспонирования репродуктивных органов плазмидой относящуюся к цветку структуру выращивают до созревания и семена собирают. В зависимости от плазмидного маркера производят отбор трансформированных растений с использованием маркерного гена путем проращивания или роста растений в чувствительной к маркеру или предпочтительно маркер-резистентной среде. Например, семена,полученные из растений, обработанных плазмидами, имеющими ген устойчивости к канамицину, будут оставаться зелеными, тогда как растения без этого маркера являются альбиносами. Присутствие транскрипции мРНК желательного гена и экспрессия пептида могут дополнительно демонстрироваться общепринятыми способами блоттинга по Саузерну, Нозерн- и Вестерн-блоттинга. В другом способе, подходящем для проведения данного изобретения, протопласты растений обрабатывают для индукции поглощения плазмиды. Получение протопластов хорошо известно в данной области и обычно включает в себя расщепление клеток растений целлюлазой и другими ферментами в течение достаточного периода времени для удаления клеточной стенки. Обычно протопласты отделяют из смеси для расщепления просеиванием и промыванием. Затем протопласты суспендируют в подходящей-8 006100 среде, такой как, например, среда F, среда СС и т.д., обычно при 104-107 клеток/мл. Затем к этой суспензии добавляют плазмидный раствор, описанный выше, и индуктор, такой как полиэтиленгликоль, Са 2+,вирус Сендай или т.п. Альтернативно плазмиды могут быть включены в липосомы. Раствор плазмид и протопластов инкубируют затем в течение подходящего периода времени, обычно около 1 ч при приблизительно 25 С. В некоторых случаях может быть желательным подвергнуть эту смесь тепловому шоку кратковременным нагреванием до приблизительно 45 С, например, в течение 2-5 мин и быстрым охлаждением до температуры инкубации. Затем обработанные протопласты клонируют и отбирают по экспрессии желательных гена или генов, например, посредством экспрессии маркерного гена и общепринятых способов блоттинга. Затем регенерируют целые растения из этих клонов общепринятым образом. Способ электропорации является похожим, за исключением того, что обычно к смеси голых плазмид и протопластов прилагают электрический ток в камере для электропорации в отсутствие или в присутствии полиэтиленгликоля, Са 2+ или т.п. Типичная электропорация включает в себя 1-10 импульсов 40-10000 В постоянного тока в течение 1-2000 мкс обычно с 0,2-секундными интервалами между импульсами. Могут быть также использованы чередующиеся импульсы тока сходной интенсивности. Более часто заряженный конденсатор разряжают через камеру для электропорации, содержащую суспензию плазмид/протопластов. Эта обработка приводит к обратимому увеличению проницаемости биомембран и, следовательно, позволяет встраивание ДНК в соответствии с данным изобретением. Электропорированные растительные протопласты восстанавливают их клеточные стенки, делятся и образуют каллусную ткань (см., например, Riggs et al., 1986). Другой способ, пригодный для трансформации клеток-мишеней, включает в себя применение Agrobacterium. В этом способе Agrobacterium, содержащую плазмиду с желательным геном или кассеты генов, используют для инфицирования растительных клеток и введения плазмиды в геном клетокмишеней. Затем клетки, экспрессирующие ген, отбирают и клонируют, как описано выше. Например,один из способов введения представляющего интерес гена в ткань-мишень, например в клубень, корень,зерно или боб, при помощи плазмиды, например Ri-плазмиды и Agrobacterium, например, A. rhizogenes или A. tumefaciens, заключается в использовании небольшой рекомбинантной плазмиды, пригодной для клонирования в Escherichia coli, в которую был сплайсирован фрагмент Т-ДНК. Эту рекомбинантную плазмиду расщепляют с открыванием в сайте внутри Т-ДНК. Часть ДНК-пассажира сплайсируют в это отверстие. ДНК-пассажир состоит из гена или генов данного изобретения, которые должны быть включены в ДНК растения, а также селектируемого маркера, например гена устойчивости к антибиотику. Затем эту плазмиду повторно клонируют в плазмиду большего размера и затем вводят в штамм Agrobacterium, несущий немодифицированную Ri-плазмиду. Во время роста бактерий редкая двойная рекомбинация будет иногда иметь место, приводя к бактериям, Т-ДНК которых несет вставку: ДНК-пассажир. Такие бактерии идентифицируют и отбирают по их выживанию на среде, содержащей антибиотик. Такие бактерии используют для вставки их Т-ДНК (модифицированной ДНК-пассажиром) в геном растений. Эта процедура с использованием А. rhizogenes или A. tumefaciens дает трансформированные клетки растений, которые могут быть регенерированы в здоровые, жизнеспособные растения (см., например,Hinchee et al., 1988). Другим подходящим подходом является бомбардировка клеток микроснарядами, которые покрыты трансформирующей ДНК (Wang et al., 1988) или ускоряются через ДНК-содержащий раствор в направлении подлежащих трансформации клеток посредством импульса давления, посредством чего они тонко диспергируются в туман с этим раствором в результате этого импульса давления (ЕР-А 0434616). Бомбардировка микроснарядами была выдвинута в качестве эффективного способа трансформации клеток, в том числе клеток растений. В Stanford et al. (1989) сообщалось, что бомбардировка микроснарядами была эффективной для доставки нуклеиновой кислоты в цитоплазму растительных клеток Allium сера (лука). Christou et al., (1988) сообщили о стабильной трансформации каллуса сои геном устойчивости к канамицину посредством бомбардировки микроснарядами. Те же авторы сообщают о проникновении у приблизительно 0,1-5% клеток и нашли наблюдаемые уровни активности фермента NPTII и устойчивость в трансформированных каллусах к канамицину до 400 мг/л. McCabe et al., (1988) сообщили о стабильной трансформации Glycine max (сои) с использованием бомбардировки микроснарядами. Кроме того, McCabe et al. сообщают о получении трансформированного растения R1 из химерного растения Ro(маис); Fromm et al., 1990 и Gordon-Kamm et al., 1990 (маис. Альтернативно может быть трансформирована непосредственно пластида растения. Стабильную трансформацию хлоропластов сообщают для высших растений, см., например, Svab et al., (1990); Svaband Maliga, (1993); Staub and Maliga, (1993). Этот способ основан на доставке способом дробовика частиц ДНК, содержащей селектируемый маркер, и нацеливании этой ДНК на геном пластид посредством гомологичной рекомбинации. В таких способах экспрессия пластидных генов может достигаться с использованием промотора пластидных генов или транс-активацией молчащего несомого пластидами трансгена, помещенного для экспрессии от селективной промоторной последовательности, такой как последовательность, узнаваемая РНК-полимеразой Т 7. Молчащий пластидный ген активируют экспрессией этой специфической РНК-полимеразы из конструкции ядерной экспрессии и нацеливанием этой-9 006100 полимеразы на пластиду с использованием транзитного пептида. Тканеспецифическая экспрессия может быть получена в таком способе с использованием ядерно-кодируемой и направленной на пластиду специфической РНК-полимеразы, экспрессируемой от подходящего специфического для ткани растения промотора. Такая система сообщалась McBride et al. (1994). Перечень возможных способов трансформации, приведенный выше в качестве примера, не является полным и не предназначен для ограничения каким-либо образом предмета данного изобретения. Таким образом, данное изобретение включает в себя также трансгенный растительный материал,выбранный из группы, состоящей из протопластов, клеток, каллусов, тканей, органов, семян, эмбрионов,семяпочек, зигот и т.д. и, в частности, целых растений, который был трансформирован при помощи способа в соответствии с данным изобретением и включает в себя рекомбинантную ДНК данного изобретения в экспрессируемой форме, и способы получения указанного трансгенного растительного материала. Положительные трансформанты регенерируют в растения согласно процедурам, хорошо известным в данной области (см., например, McCormick et al., 1986). Затем эти растения могут быть выращены и их опыляют тем же самым трансформированным штаммом или отличающимися штаммами перед тем, как потомство может быть оценено на присутствие желательных свойств и/или степень, в которой экспрессируются эти желательные свойства, и полученный гибрид, имеющий желательное фенотипическое свойство, идентифицируют. Первая оценка может включать в себя, например, уровень бактериальной/грибковой резистентности трансформированных растений. Две или более генерации могут выращиваться для гарантии, что рассматриваемое фенотипическое свойство стабильно сохраняется и наследуется, а затем семена собирают для гарантии того, что был получен желательный фенотип или другое свойство. В рамки данного изобретения включены также трансгенные растения, в частности, трансгенные фертильные растения, трансформированные при помощи способа данного изобретения, и их вегетативное и/или полученное половым путем потомство, которое все еще обнаруживает новое и желательное свойство или новые свойства вследствие трансформации материнского растения. Термин потомство понимается как охватывающий как полученное вегетативным, так и полученное половым путем потомство трансгенных растений. Это определение включает в себя также все мутанты и варианты, получаемые посредством известных процессов, таких как, например, слияние клеток или селекция мутантов, и все еще проявляющие характерные свойства исходного трансформированного растения, вместе со всеми продуктами скрещивания и слияния трансформированного растительного материала. Части растений, такие как, например, цветки, стебли, плоды, листья, корни, берущие начало в трансгенных растениях или их потомстве, ранее трансформированных по способу данного изобретения,и, следовательно, состоящие, по меньшей мере, частично из трансгенных клеток, являются также предметом данного изобретения. Следующие ниже примеры являются иллюстративными, а не ограничивающими данное изобретение. Депонирование биологического материала Штаммы Е. coli, несущие экспрессионные кассеты в соответствии с данным изобретением, были депонированы согласно условиям Будапештского Договора Немецкой коллекцией микроорганизмов и клеточных культур (DSMZ) в Брауншвайге, Германии под следующими номерами доступа: Штамм Номер доступаDSM 12713 Примеры Введение биосинтеза провитамина А (-каротина) и ксантофиллов в не содержащий каротиноидов эндосперм риса (Oryza sativa) Образование фитоена (Burkhardt et al., 1997) Предыдущие биохимические исследования с использованием радиоактивно меченого изопентенилдифосфата показали, что эндосперм риса обладает ферментативно активной GGPP-синтазой, обеспечивая, следовательно, важный предшественник для биосинтеза каротиноидов. Таким образом, модельный сорт Taipei 309 японского риса трансформировали бомбардировкой микроснарядами с кДНК, кодирующей фитоенсинтазу из нарцисса (Narcissus pseudonarcissus (Асc. No. X78814, Schledz and Beyer, 1996,Schledz et al., 1996) под контролем конститутивного и под контролем эндосперм-специфического промотора. Было показано, что в трансгенных растениях риса фермент нарцисса был активным накоплением invivo неокрашенного каротина фитоена в эндосперме риса. Таким образом, впервые было продемонстрировано, что в принципе возможно сконструировать первую каротиноид-специфическую ферментативную стадию в биосинтезе каротиноидов в нефотосинтетической, не содержащей каротиноидов ткани.- 10006100 Введение биосинтетического пути каротиноидов в направлении ликопина, -каротина (провитамина А) и ксантофиллов в эндосперм риса Конструирование плазмид(В отношении стандартных молекулярно-биологических способов см. Sambrook et al., 1989. В отношении схематического представления конструкций см. фиг. 4). Структурными генами, кодирующими ферменты биосинтеза каротиноидов, были:crtI: каротиндесатураза из бактерии Erwinia uredovora, слитая с транзитной последовательностьюRubisco гороха (Misawa et al., 1993). сус: ликопинциклаза из Narcissus pseudonarcissus (Acc. No. X98796). Конструирование pB19hpc (называемой в тексте плазмидой А) ДНК-фрагмент, несущий интактный ген фитоендесатуразы (crtI) из Erwinia uredovora с транзитной пептидной последовательностью малой субъединицы Rubisco (tp) гороха ниже CaMV 35S-промотора и выше сигнала nos 3'-полиаденилирования, конструировали согласно Misawa et al., (1993) и лигировали в расщепленную HindIII/EcoRI плазмиду pUC19 с получением плазмиды pUCET4. crtI-экспрессионную кассету вырезали из pUCET4 в виде HindIII/EcoRI-фрагмента и лигировали в расщепленную HindIII/EcoRI плазмиду pBluescriptKS с получением плазмиды pBaalI. Плазмиду pGtlPsyH (Burckhardt et al.,1997), несущую экспрессионную кассету psy, состоящую из кДНК фитоенсинтазы из Narcissus pseudonarcissus (Асc. No. X78814) под контролем промотора глютелина I риса (GtI; Kim et al., 1993; Okita etal., 1989; Zheng et al., 1993) и сигнал nos 3'-полиаденилирования, расщепляли SacII и концы затупляли с использованием ДНК-полимеразы Т 4. Для получения экспрессионной кассеты psy проводили второе расщепление с использованием KpnI. Затем SacII(затупленный)/KpnI-фрагмент лигировали в расщепленную Xhol(затупленный)/KpnI плазмиду pBaall с получением плазмиды рВаа 12, несущей экспрессионные кассеты crtI и psy. Полилинкерные сайты pUCl8 были заменены, чтобы содержать следующие сайты рестрикции в следующем порядке: HindIII, I-SceI, KpnI, NotI, SmaI, IsceI, EcoRI. Полученную плазмиду pUC18M расщепляли KpnI и NotI. ДНК-фрагмент, несущий экспрессионные кассеты crtI и psy, вырезали из рВаа 12 с использованием KpnI и NotI и лигировали в расщепленную плазмиду pUC18M, упомянутую выше. Полученная плазмида рВаа 13 содержит двойную экспрессионную кассету, фланкированную двумя сайтами рестрикции мегануклеаз (I-SceI). Экспрессионную кассету гена гигромицинфосфотрансферазы aph IV, содержащую aph IV под контролем промотора CaMV35S и сигнал полиаденилирования CaMV 35S, вырезали из pRice (см. конструирование плазмиды В) в виде KpnI-фрагмента и лигировали в расщепленную KpnI плазмиду рВаа 13. Полученные плазмиды рВаа 142 и рВаа 141 содержат кассету устойчивости к гигромицину в той же самой ориентации, что и экспрессионная кассета psy (pBaal42), или в противоположной ориентации (рВаа 141). Вектор pBinl9 (Bevan, 1984) расщепляли EcoRI и HindIII и синтетическую олигонуклеотидную последовательность, содержащую следующие сайты рестрикции в следующем порядке: HindIII, I-SceI,KpnI, NotI, SmaI, IsceI, EcoRI, вводили с использованием стандартного протокола с получением pBinl9M. Экспрессионные кассеты crtI, psy и aph IV вырезали из рВаа 142 с использованием мегануклеазных сайтов I-sceI и лигировали в pBinl9M после расщепления I-scel. Затем полученную плазмиду pB19hpc использовали для трансформации. Конструирование pZCycH (называемой в тексте плазмидой В). Промотор глютелина 1 Gtl вырезали из pKSl (Okita et al., 1989) с использованием EcoRI/BglII и лигировали в расщепленную BamHI/MunI pV34 (Futtere and Potrykus, неопубликованные данные) между двумя сайтами мегануклеазы I-sceI с получением плазмиды pV34Gtl. Экспрессионную кассету гена aphIV гигромицинфосфотрансферазы, содержащую сигнал полиаденилирования CaMV35S, за которым следуют aph IV под контролем промотора CaMV35S и второй сигнал полиаденилирования CaMV 35S после него, вырезали из pCIB900 (Wunn et al., 1996) с использованием SalI и SacI. После лигирования XhoIадаптора в сайт SalI в полученный фрагмент эту кассету лигировали в плазмиду pV34Gtl с получением плазмиды (pRice). Ген сус ликопинциклазы из Narcissus pseudonarcissus (Асc. No. X 98796) вырезали из плазмиды pGEM4CYC (Bonk et al., 1997) с использованием Ес 136II и BamHI. После обработки фрагментом Кленова сус лигировали в расщепленную Ес 136II плазмиду pRice с получением pRiceCYC. Вектор pPZPlOO (Hajdukiewicz et al., 1994) расщепляли EcoRI и HindIII и синтетическую олигонуклеотидную последовательность, содержащую следующие сайты рестрикции в следующем порядке: HindIII, I-SceI, KpnI, NotI, SmaI, IsceI, EcoRI, вводили с использованием стандартного протокола с получением pPZPlOOM. Двойную кассету сус aph IV вырезали из pRiceCYC с использованием мегануклеазы IsceI и лигировали в расщепленную IsceI плазмиду pPZPlOOM с получением трансформационной плазмиды pZCycH. Индукция и трансформация каллуса Индукция каллуса: Незрелые семена сорта ТР 309 японского риса в стадии молочной спелости собирали из выращиваемых в оранжерее растений, поверхностно стерилизовали в 70% этаноле (об./об.) в течение 1 мин, инкубировали в 6%-ом гипохлориде кальция в течение одного часа на качалке и промы- 11006100 вали 3-5 раз стерильной дистиллированной водой. Затем выделяли незрелые зародыши из стерилизованных семян под бинокулярным микроскопом на чистом лабораторном столе с током воздуха и культивировали на среде NB (N6-соли и В 5-витамины, дополненные 30 г/л мальтозы, 500 мг/л пролина, 300 мг/л гидролизата казеина, 500 мг/л глутамина и 2 мг/л 2,4-D, pH 5,8). Спустя 4-5 дней колеоптили удаляли и разбухшие щитки субкультивировали на свежей среде NB в течение 3-5 дней до инокуляции Agrobacterium. Опосредованная Agrobacterium трансформация: Однонедельные предварительно культивированные незрелые зародыши погружали в суспензию клеток Agrobacterium tumefaciens LBA 4404, как описано(Uze et al., 1997). Для котрансформации двух отдельных векторов, pZPsC и pZCycH, LBA4404/pZPsC(OD600=2,0), смешанную с равным объемом LBA4404/pZCycH (OD600=1,0), после индукции ацетонсиригоном использовали для инокуляции. Инокулированные предкультивированные зародыши кокультивировали на среде NB, дополненной 200 мМ ацетонсирингоном, в течение 3 дней, субкультивировали на среде для восстановления нормального состояния (NB с 250 мг/л цефотаксима) в течение одной недели и затем переносили на селективную среду NB в присутствии 30 мг/л гигромицина и 250 мг/л цефотаксима и выдерживали на ней в течение 4-6 недель. Растения регенерировали из полученных резистентных каллусов на среде NB, дополненной 0,5 мг/мл NAA и 3 мг/л БАП, в течение 4 недель, укореняли и переносили в оранжерею. Блоттинг по Саузерну Для доказательства присутствия трансгенов проводили блоттинг по Саузерну в соответствии со стандартными способами (Sambrook et al., 1989) с использованием гомологичных меченых зондов, полученных из фитоенсинтазы, CrtI и циклазы. Анализ каротиноидных пигментов Семена (1 г) из RO-растений вылущивали и обрабатывали в течение 8 ч наждачной бумагой на качалке для удаления оболочки семян. Согласно визуальному обследованию трансформированные линии обнаруживали ясно детектируемую желтоватую окраску вследствие присутствия каротиноидов. Кроме того, наблюдали картину расщепления, которая в некоторых случаях была очень близка к ожидаемому отношению 3(желтых) к 1 (белому). Сумму семян из индивидуальных линий (50, каждая) растирали до тонкого порошка при помощи микродисмембратора (Braun, Melsungen). Этот порошок экстрагировали несколько раз ацетоном до полного обесцвечивания. Объединенные экстракты сушили под током азота. Остаток растворяли в хлороформе и использовали количественно для ВЖХ-анализа с применением системы Waters HPLC, снабженной детектором из ряда фотодиодов и колонкой С 30 с обращенной фазой (YMC Europe GmbH). Раделение проводили с использованием системы растворителей А: МеОН: трет-бутилметиловый эфир (1:1, об./об.),В: МеОН:трет-бутилметиловый эфир:Н 2 О (6:1,2:1,2, об./об./об.) с применением градиента 100% В - 43% В в пределах 25 мин, затем до 0% В в пределах следующих 75 мин. Эти последние условия поддерживали в течение дополнительных 10 мин перед повторным уравновешиванием. Примеры полученных результатов приведены на фиг. 3 А для нетрансформированного контроля, на фиг. 3 В для линии, несущей только плазмиду А, и на фиг. 3 С для линии, несущей плазмиду А и В. Очевидно, что каротиноиды накапливаются в трансформантах. Контроли иногда обнаруживали некоторые следовые количества каротиноидов, которые могут быть в их наибольшей части отнесены к семенной оболочке, которую трудно удалить полностью. Среди каротиноидов, детектированных в трансформированных семенах, -каротин(провитамин А) представляет основной продукт (до 60%). Кроме того, был активным ксантофиллобразующий путь, приводящий к образованию лютеина и зеаксантина, а также некоторых количеств эпоксидированных каротиноидов. Был сделан вывод, что эта последняя часть этого пути либо индуцируется трансформацией, либо индуцируется продуктами, полученными в результате трансформации. Альтернативно путь образования ксантофиллов конститутивно экспрессируется в эндосперме риса, приводя к образованию ксантофиллов зеаксантина и лютеина плюс некоторых дополнительных минорных компонентов, представляющих эпоксидированные ксантофиллы. Линии, трансформированные только плазмидой А, обнаружили в принципе то же самое распределение каротиноидов, но содержание этих каротиноидов было обычно более низким, так что приведенные выше выводы относятся и к ликопинциклазе в эндосперме риса. Присутствие лютеина и зеаксантина рассматривается как неожиданная дополнительная ценность вследствие их положительных эффектов, например, для зрения (см., например, Brown et al., 1998;Schlach, 1992). Очевидно, что многочисленные модификации и вариации данного изобретения возможны в свете приведенных выше обсуждений. Таким образом, должно быть понятно, что в пределах объема прилагаемой формулы изобретения, данное изобретение может практиковаться и иным образом, чем это конкретно описано. Предшественник геранилгеранилдифосфат встречается повсеместно в растительном материале Для испытания присутствия GGPP в других тканях, чем рис, проводили инкубационные эксперименты аналогично описанному выше для эндосперма риса с эндоспермом, выделенным из двух лабораторных разновидностей пшеницы, двух разновидностей ячменя, и плодами банана Cavendish. Незрелые- 12006100 зерна пшеницы и ячменя вылущивали, эндосперм выжимали и зародыш удаляли. Инкубационные эксперименты проводили в 100 мМ Трис/НС 1-буфере рН 7,4, 10 мМ МgС 12, 1 мМ МnС 12, 3 мМ АТФ в присутствии 0,5 мкКи [1-14 С]изопентенилдифосфата в течение 6 ч при 25 С. Отдельные анализы дополняли щелочной фосфатазой для дефосфорилирования образованных пренилдифосфатов. Спустя 3-6 ч липидорастворимый материал, содержащий соответствующие пренилспирты, выделяли экстракцией смесью хлороформ/метанол (2.1, об./об.). Затем следовал ВЖХ-анализ, как описано выше. В эндосперме из испытанных разновидностей пшеницы (обеих, по существу не содержащих каротиноидов) наблюдали очень ярко выраженный сигнал, который, как было доказано с использованием аутентичного дефосфорилированного GGPP (полученного с применением рекомбинантной GGPPсинтазы из Sinapis alba), представлял геранилгераниол. Таким образом, введение посредством трансформации биосинтеза провитамина А в пшеницу, по-видимому, является возможным, как и в случае риса. Меньшие, но детектируемые количества GGPP в форме соответствующего спирта наблюдали в ячмене,как выражение того факта, что эндосперм ячменя обнаруживает некоторый небольшой фон образования каротиноидов. Подобным образом, бананы Cavendish продуцируют каротиноиды и, следовательно, присутствие GGPP-образующих активностей, которые, в частности, наблюдали в зрелом состоянии, не были неожиданными. Индукция при помощи СРТА генов биосинтеза каротиноидов Давно известный ингибитор ликопинциклазы СРТА(гидрохлорид 2-(4 хлорфенилтио)триэтиламина) и родственные соединения (см., например, El-Sayed Osman et al., 1984; Fosket and Radin, 1982) имитируют в отношении накопления ликопина трансформацию плазмидой А. В поисках демонстрации положительной регуляции генов биосинтеза каротиноидов авторы изобретения синтезировали СРТА согласно способу Scheutz and Baldwin (1957) и применили это соединение в 1 мМ водном растворе к цветкам нарцисса. Эта фотосинтетически неактивная ткань отвечала накоплением ликопина, как ожидалось. Однако, необъяснимо с точки зрения первичного действия СРТА (ингибитора) содержание каротиноидов почти удвоилось. Поэтому проводили Нозерн- и Вестерн-блот-анализы для демонстрации возможной индукции обилия транскриптов, кодирующих ферменты биосинтеза каротиноидов, или обилия ферментов. Фиг. 5 А дает результаты Нозерн-блотов. Тотальную РНК выделяли из необработанных (дорожка 1) и СРТА-обработанных цветков. Иммобилизованную РНК периодически очищали для проведения последующей гибридизации с зондами для фитоенсинтазы (В) , фитоендесатуразы (С), -каротиндесатуразы и ликопинциклазы. Очевидно, что, за исключением -каротиндесатуразы, все специфические каротиногенные РНК, в том числе ликопинциклазы, увеличиваются в количестве. Для Вестерн-блот-анализа (см. фиг. 5 В) общий белок выделяли из необработанных и СРТАобработанных цветков и после электрофореза в ДСН-полиакриламидном геле (30 мкг белка на дорожку) переносили на нитроцеллюлозные мембраны. Блоты проявляли антителами к фитоенсинтазе (А), фитоендесатуразе (В), -каротиндесатуразе (С) и ликопинциклазе. Видно, что на уровне белка имеет место увеличение в количестве ферментов при обработке СРТА. На основании данных для риса, приведенных выше, авторы сделали вывод, что каротиноиды (или произведенные из них продукты) могут генетически индуцировать образование каротиноидов по типу механизма обратной связи. Таким образом, данное изобретение обеспечивает средства для введения генной инженерией биосинтетического пути каротиноидов в не содержащие каротиноидов ткани или для повышения производительности предсуществующих биосинтетических путей каротиноидов. Этот способ может быть использован для улучшения пищевой ценности, фармакологии или вида семян, плодов, клубней, цветков или листьев. Данное изобретение применимо прежде всего в улучшении питательных нужд, где не является особенно необходимым продуцирование больших количеств каротиноидов. Рис, например, в его обмолоченной форме состоит из эндосперма, который не содержит детектируемых окрашенных каротиноидов. Они присутствуют в семенной оболочке, которая удаляется во время обработки. Эта обработка требуется для возможности долгосрочного хранения рисового зерна. Данное изобретение является первым примером конструирования de-novo пути биосинтеза каротиноидов и применимо к другим тканям агрономически важных не содержащих каротиноидов культур,например, к семенам некоторых других злаков, или тканям корней, которые не содержат окрашенных или неокрашенных каротиноидов. Это не исключает потенциала данного способа для увеличения или модификации предсуществующих каротиноидов. Цитированные ссылкиZheng et al. (1993) Plant J. 4, 357-366 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения растительных клеток, аккумулирующих каротиноиды, которые в норме не содержат каротиноидов, включающий трансформацию растительного материала выделенной молекулой ДНК, которая включает(а) экспрессионную кассету, способную направлять образование в растительных клетках фитоенсинтазы, происходящей из растений, грибов или бактерий, и(б) экспрессионную кассету, способную направлять образование в растительных клетках фитоендесатуразы, происходящей из растений, грибов или бактерий, причем, когда фитоендесатураза происходит из бактерий, указанная фитоенсинтаза не имеет бактериального происхождения, и отбор трансформированного растительного материала, содержащего клетки, которые аккумулируют каротиноиды. 2. Способ по п.1, где указанная молекула ДНК включает(а) экспрессионную кассету, способную направлять образование в растительных клетках фитоенсинтазы, происходящей из растений,(б) экспрессионную кассету, способную направлять образование в растительных клетках фитоендесатуразы, происходящей из бактерий. 3. Способ по любому из пп.1 или 2, где фитоендесарутаза кодируется геном CrtI Erwinia uredovora. 4. Способ по п.3, где фитоендесарутаза кодируется геном CrtI Erwinia uredovora. 5. Способ по любому из пп.1-4, где указанная фитоендесатураза слита с подходящим пластидным транзитным пептидом. 6. Способ по любому из пп.1-5, где указанная фитоендесатураза экспрессируется под контролем тканеспецифического или конститутивного промотора. 7. Способ по п.6, где указанная фитоендесатураза экспрессируется под контролем конститутивного промотора. 8. Способ по любому из пп.1-7, где указанная фитоендесатураза экспрессируется под контролем тканеспецифического промотора. 9. Способ по п.8, где указанная фитоенсинтаза происходит из Narcissus pseudonarcissus. 10. Способ по любому из пп.1-9, где указанная ДНК дополнительно включает последовательность,кодирующую селективный маркер. 11. Способ по любому из пп.1-10, где растительный материал трансформируют посредством агробактерий, которые содержат указанную ДНК. 12. Способ по любому из пп.1-11, где указанная растительная клетка является клеткой риса. 13. Способ по любому из пп.1-12, где указанная клетка риса является клеткой эндосперма. 14. Трансаформированная растительная клетка, полученная с помощью способа по любому пп.1-13. 15. Растительная клетка по п.14, которая является клеткой эндосперма риса. 16. Выделенная молекула ДНК, которая включает(а) экспрессионную кассету, способную направлять образование в растительных клетках фитоенсинтазы, происходящей из растений, и(б) экспрессионную кассету, способную направлять образование в растительных клетках фитоендесатуразы, происходящей из бактерий,используемая для осуществления способа по любому из пп.2-10. 17. ДНК по п.16, где фитоендесарутаза происходит из гена CrtI Erwinia uredovora. 18. ДНК по п.16, оптимизированная для экспрессии в растении.
МПК / Метки
МПК: C12N 15/52, A01H 5/00
Метки: каротиноиды, клеток, способа, используемая, растительных, способ, днк, выделенная, аккумулирующих, получения, осуществления
Код ссылки
<a href="https://eas.patents.su/21-6100-sposob-polucheniya-rastitelnyh-kletok-akkumuliruyushhih-karotinoidy-i-vydelennaya-dnk-ispolzuemaya-dlya-osushhestvleniya-sposoba.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения растительных клеток, аккумулирующих каротиноиды, и выделенная днк, используемая для осуществления способа</a>
Предыдущий патент: Способ лечения острого нейродегенеративного расстройства
Следующий патент: Бифенилкарбоксамиды, полезные в качестве снижающих содержание липидов агентов
Случайный патент: Дозированные формы азитромицина с пониженными побочными эффектами