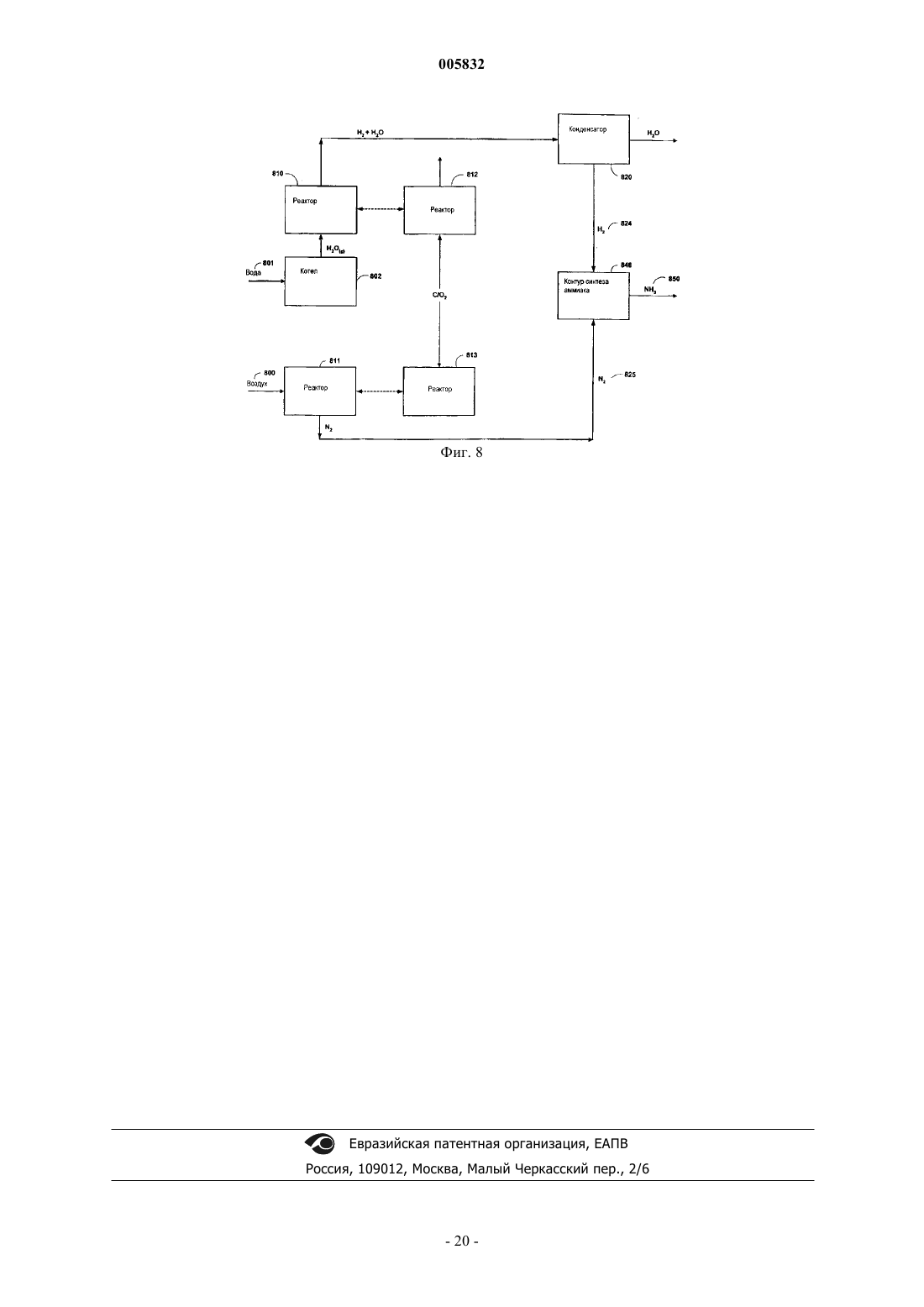
Способ получения водорода
Номер патента: 5832
Опубликовано: 30.06.2005
Авторы: Уэйэнд Томас Э., Киндиг Дж.Келли, Дэвис Бойд Р., Одл Роберт Р.
Формула / Реферат
1. Способ получения потока водородсодержащего газа, включающий в себя стадии
a) генерации водяного пара;
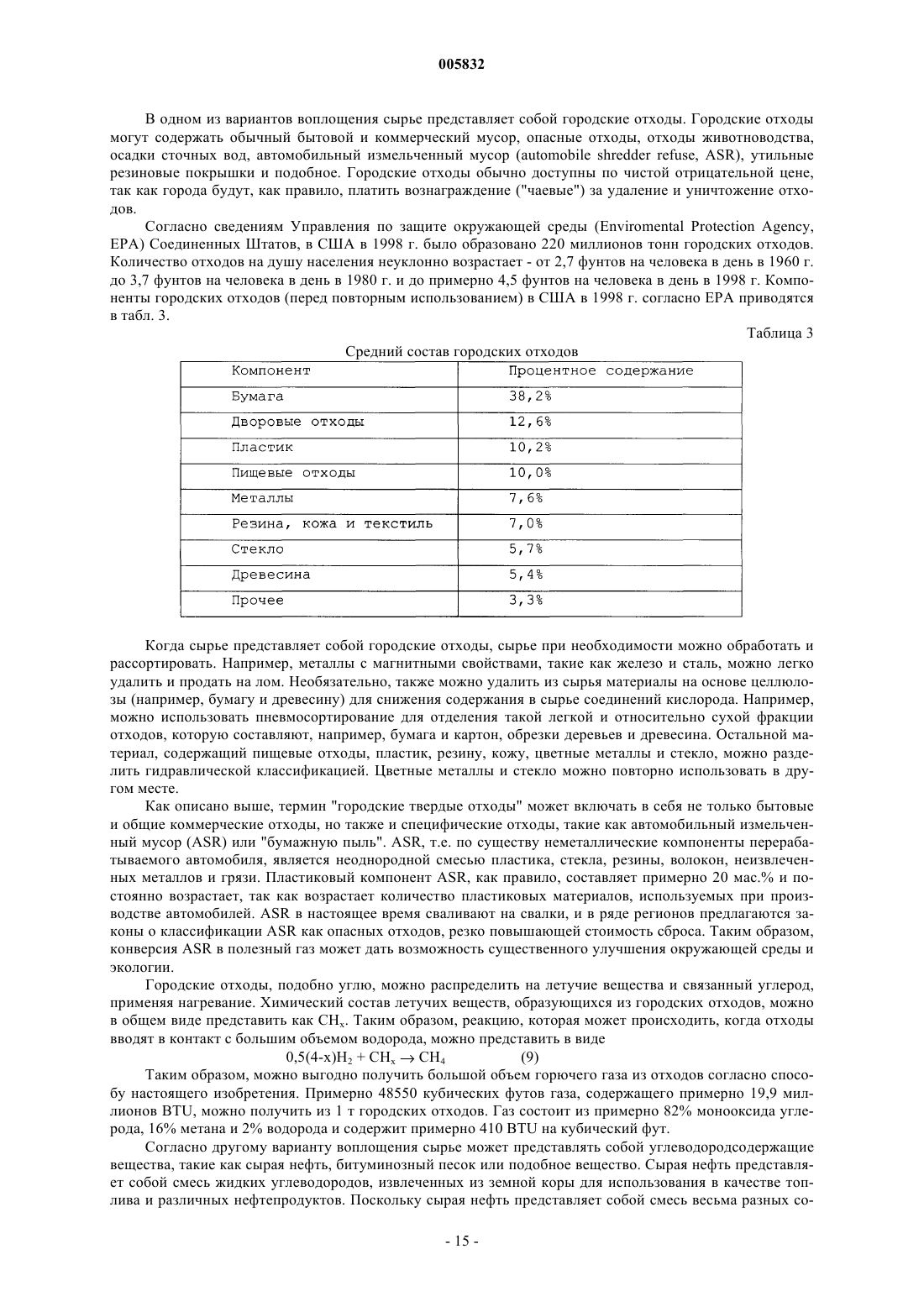
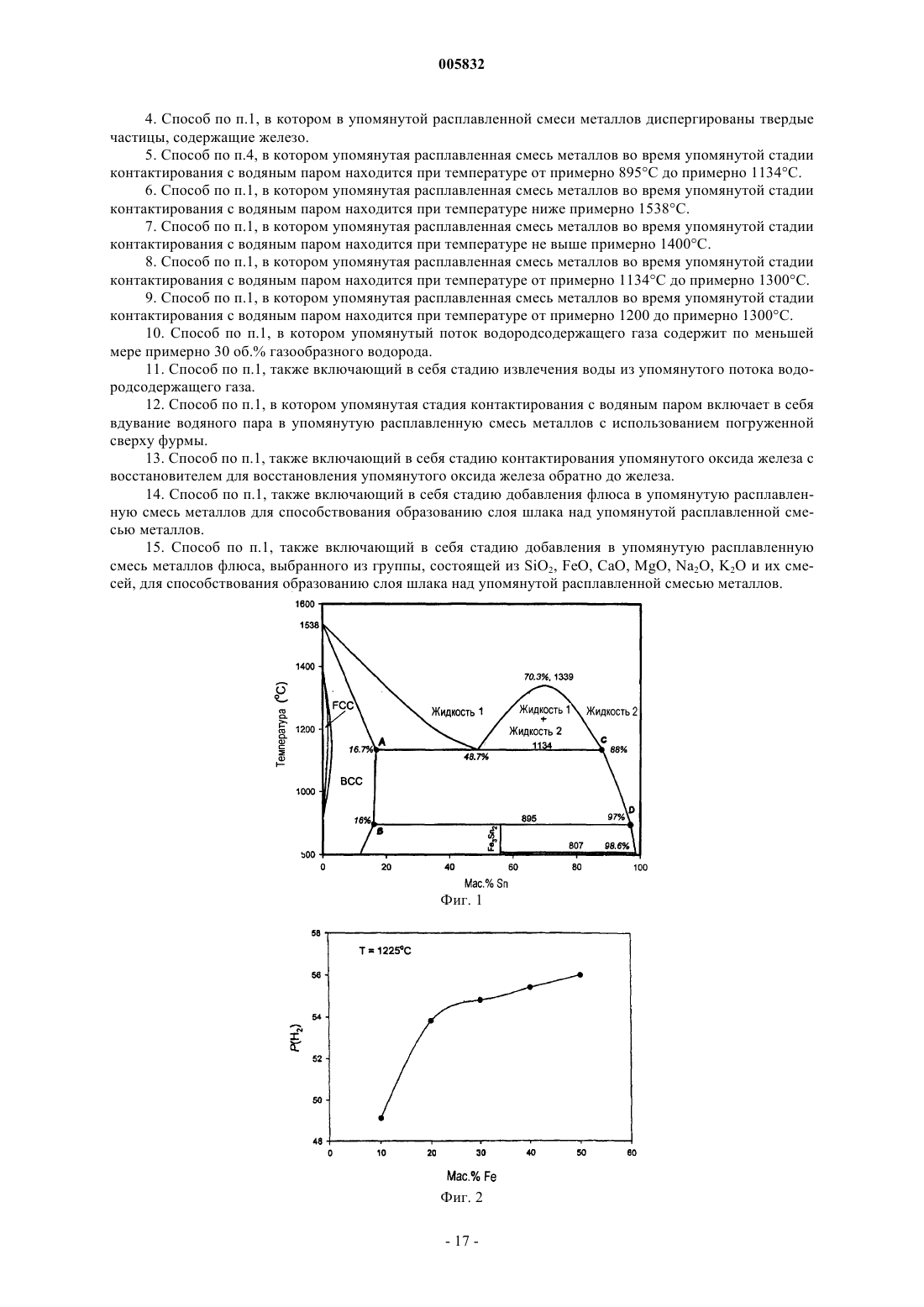
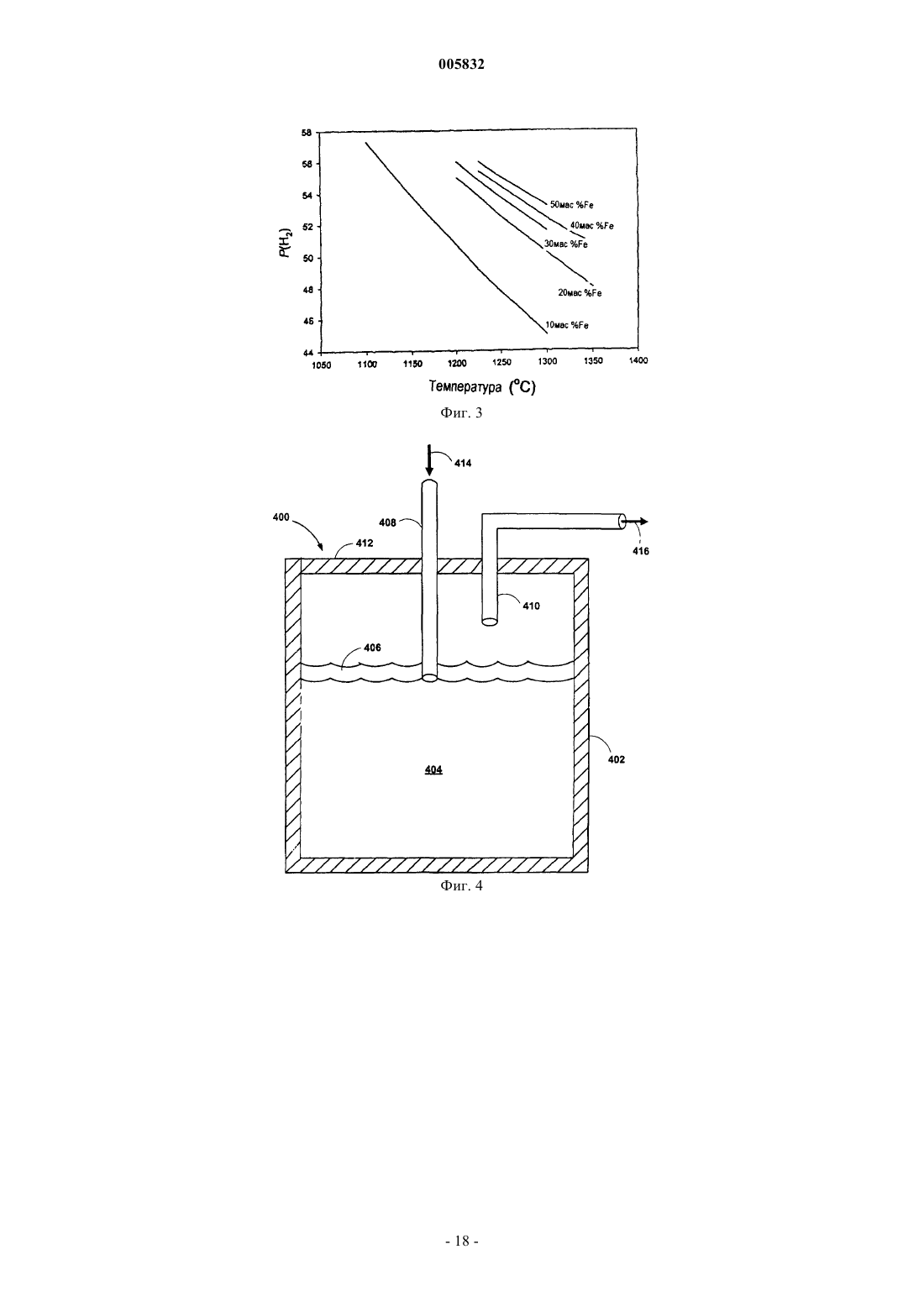
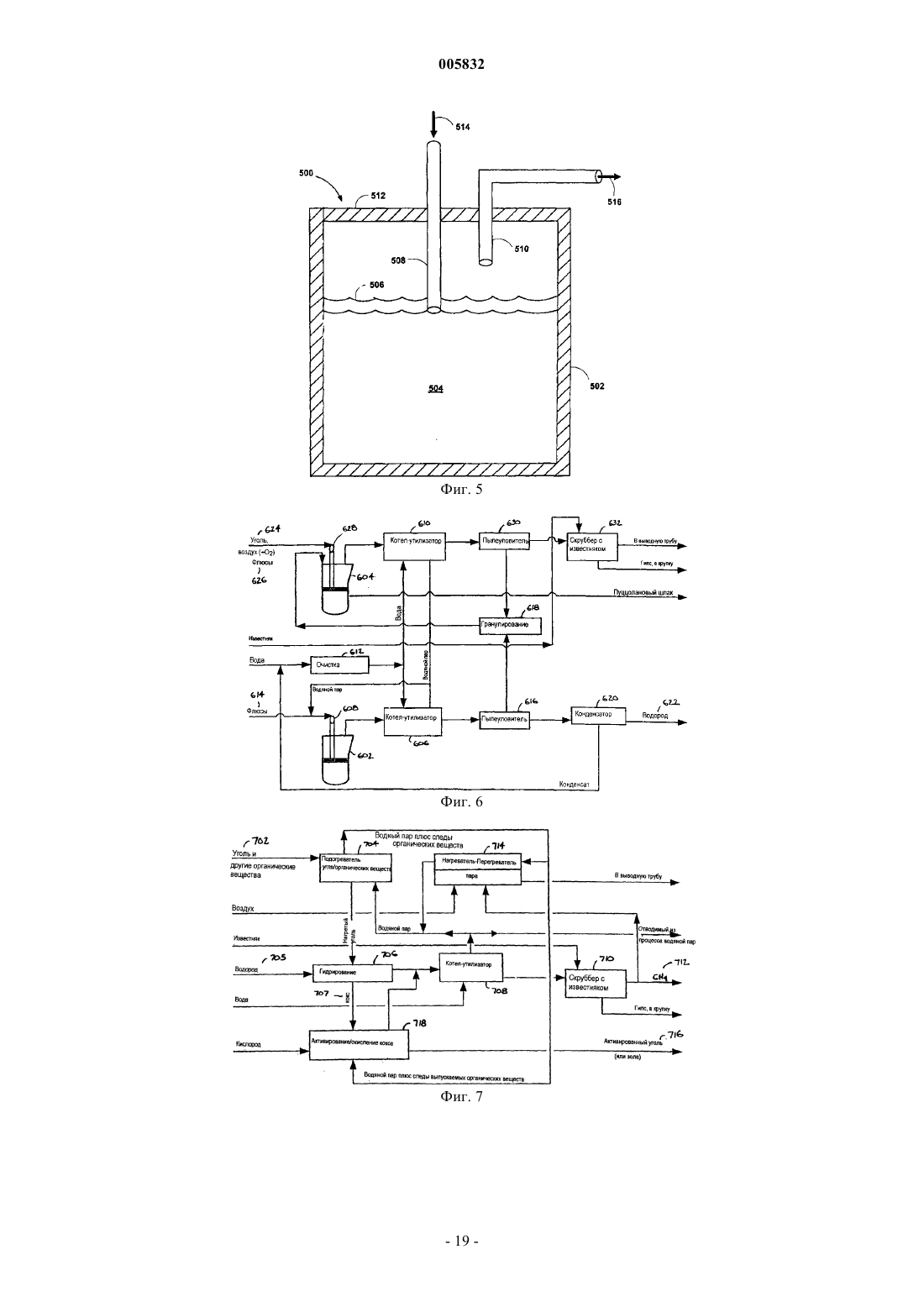
b) контактирования упомянутого водяного пара в реакторе с расплавленной смесью металлов, содержащей по меньшей мере примерно 20 мас.% железа, растворенного в первом металле-разбавителе, причем упомянутый первый металл-разбавитель представляет собой олово, и при этом по меньшей мере часть упомянутого железа окисляется до оксида железа и по меньшей мере часть упомянутого водяного пара восстанавливается с образованием водорода; и
c) извлечения упомянутого потока водородсодержащего газа из упомянутого реактора.
2. Способ по п.1, в котором упомянутая расплавленная смесь металлов также содержит второй химически активный металл.
3. Способ по п.1, в котором упомянутая расплавленная смесь металлов также содержит второй металл-разбавитель.
4. Способ по п.1, в котором в упомянутой расплавленной смеси металлов диспергированы твердые частицы, содержащие железо.
5. Способ по п.4, в котором упомянутая расплавленная смесь металлов во время упомянутой стадии контактирования с водяным паром находится при температуре от примерно 895шC до примерно 1134шC.
6. Способ по п.1, в котором упомянутая расплавленная смесь металлов во время упомянутой стадии контактирования с водяным паром находится при температуре ниже примерно 1538шC.
7. Способ по п.1, в котором упомянутая расплавленная смесь металлов во время упомянутой стадии контактирования с водяным паром находится при температуре не выше примерно 1400шC.
8. Способ по п.1, в котором упомянутая расплавленная смесь металлов во время упомянутой стадии контактирования с водяным паром находится при температуре от примерно 1134шC до примерно 1300шC.
9. Способ по п.1, в котором упомянутая расплавленная смесь металлов во время упомянутой стадии контактирования с водяным паром находится при температуре от примерно 1200 до примерно 1300шC.
10. Способ по п.1, в котором упомянутый поток водородсодержащего газа содержит по меньшей мере примерно 30 об.% газообразного водорода.
11. Способ по п.1, также включающий в себя стадию извлечения воды из упомянутого потока водородсодержащего газа.
12. Способ по п.1, в котором упомянутая стадия контактирования с водяным паром включает в себя вдувание водяного пара в упомянутую расплавленную смесь металлов с использованием погруженной сверху фурмы.
13. Способ по п.1, также включающий в себя стадию контактирования упомянутого оксида железа с восстановителем для восстановления упомянутого оксида железа обратно до железа.
14. Способ по п.1, также включающий в себя стадию добавления флюса в упомянутую расплавленную смесь металлов для способствования образованию слоя шлака над упомянутой расплавленной смесью металлов.
15. Способ по п.1, также включающий в себя стадию добавления в упомянутую расплавленную смесь металлов флюса, выбранного из группы, состоящей из SiO2, FeO, CaO, MgO, Na2O, K2O и их смесей, для способствования образованию слоя шлака над упомянутой расплавленной смесью металлов.
Текст
005832 Предпосылки создания изобретения 1. Область техники, к которой относится изобретение Настоящее изобретение относится к способу получения газообразного водорода. Конкретнее, настоящее изобретение относится к способу получения газообразного водорода путем восстановления водяного пара, в котором водяной пар вводят в контакт с расплавленным металлом с образованием оксида металла и водородсодержащего потока газа. Оксид металла затем можно обратно восстановить до металла для дальнейшего получения водорода. Газообразный водород можно использовать для генерирования энергии и в различных химических процессах, таких как обработка угля и получение аммиака. 2. Уровень техники Водород (Н 2) является ценным потребительским продуктом и специальным химическим веществом,которое важно для многих промышленных процессов, в том числе производства аммиака и переработки(очистки) нефти и нефтепродуктов. Кроме того, водород можно непосредственно конвертировать в электрическую энергию в топливных элементах с эффективностью, достигающей 80%. Вода является единственным побочным продуктом конверсии водорода в топливных элементах, поэтому токсические выбросы устраняются. По указанным причинам водород широко рассматривается как топливо будущего. Известно, что газообразный водород можно получить из многих видов сырья, таких как природный газ, биомасса или вода, с использованием различных методов, таких как риформинг, газификация или электролиз. Наиболее распространенными методами являются риформинг метана с водяным паром (SMR от анг. steam methane reformation), газификация угля, восстановление водяного пара, газификация биомассы и пиролиз, а также электролиз. Считается, что риформинг метана с водяным паром является наиболее экономичным и коммерчески жизнеспособным способом, который доступен в настоящее время. В способе SMR метан (СН 4) осуществляют взаимодействие с водяным паром (Н 2O) с образованием потока газа, содержащего водород и монооксид углерода (СО). Сырьем, как правило, является природный газ, и стоимость природного газа составляет существенную часть общей стоимости производства. Со способом SMR связаны по меньшей мере две главные трудности. Одной трудностью является зависимость стоимости получения водорода от цены на природный газ. Цена на природный газ является весьма непостоянной из-за соотношений предложение/спрос, которые прогнозируются на будущее. Вовторых, полученный с помощью SMR водород, смешан со значительным количеством оксидов углерода,которые можно только частично удалить мокрой очисткой или адсорбцией при разности давлений, и оба эти способа являются дорогостоящими. Оксиды углерода, остающиеся в SMR-водороде, вредны для катализаторов, используемых в топливных элементах и при получении из водорода аммиака (NН 3). Получение водорода методом газификации угля представляет собой другую общепринятую коммерческую технологию, но является конкурентноспособным только тогда, когда природный газ чрезмерно дорог. В способе газификации угля в газогенераторе используют водяной пар и кислород (O2) для получения водород, содержащего газа. Затем из синтез-газа можно выделить водород высокой степени чистоты путем реакции конверсии водяного пара с последующим удалением диоксида углерода (СO2) адсорбцией при разности давлений или мокрой очисткой. Примеси, такие как кислые газы, также должны быть отделены от водорода. Водород также можно получить газификацией других углеводородов, таких как нефтяной остаток. В способе восстановления водяного пара используется окисление металла для удаления кислорода из водяного пара (т.е. восстановление водяного пара), причем посредством этого образуется газообразный водород. Такое взаимодействие иллюстрируется уравнением 1. хМе + уН 2OМеxОy + уН 2 (1) Для того чтобы завершить цикл в двухстадийном способе восстановления водяного пара, оксид металла следует снова восстановить до металла с использованием восстановителя. Например, монооксид углерода (СО) имеет сродство к кислороду, схожее со сродством к кислороду водорода, а при примерно 812 С они равны. При температурах выше примерно 812 С СО имеет большее сродство к кислороду, чем водород. Таким образом, если в состоянии равновесия СО имеет сродство к кислороду большее, чем сродство металла, СО будет восстанавливать оксид, образовавшийся по уравнению 1, обратно до металла. МexОy + уСОхМе + уСO2 (2) Вообще говоря, функция пары металл/оксид металла состоит в переносе кислорода из водяного пара в восстанавливающий газ (СО) без появления возможности контакта пары водяной пар/водород со стадии получения водорода с парой металл/оксид металла со стадии восстановления оксида металла. В общем процессе металл и оксид металла не расходуются. Парциальное давление кислорода (рO2) имеет отношение к легкости, с которой можно окислить металл (например, водяным паром) и можно восстановить оксид (например, с помощью СО). Соответствующим математическим выражением является pH2O/pH2, пропорциональное парциальному давлению кислорода. Также эквивалентная и обратная величина представляет собой фракцию водорода, выраженную в виде Некоторые металлы энергично реагируют с водой с выделением водорода. Примерами таких металлов являются литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Се), франций (Fr), бериллий (Be),магний (Мg), кальций (Са), стронций (Sr), барий (Ва), радий (Ra), алюминий (Аl), кремний (Si), фосфор(La), гафний (Hf), тантал (Та) и галлий (Ga). Парциальное давление кислорода в состоянии равновесия с указанными металлами и их оксидами, присутствующими вместе, очень низкое. Как только оксиды образуются, их нельзя эффективно восстановить монооксидом углерода снова до металла. Напротив, существует другая группа металлов, которые образуют незначительные количества водорода при взаимодействии с водой. Примерами таких металлов являются никель (Ni), медь (Сu), рутений (Ru), родий (Rh),палладий (Pd), серебро (Аg), кадмий (Cd), рений (Re), осмий (Os), иридий (Ir), платина (Pt), золото (Аu),ртуть (Нg), свинец (Рb), висмут (Bi), селен (Se) и теллур (Те). Парциальное давление кислорода в состоянии равновесия с указанными металлами и их оксидами, присутствующими вместе, достаточно высокое. Следовательно, оксиды можно легко восстановить монооксидом углерода. Между этими двумя разнородными группами металлов имеются другие металлы, характеризующиеся сродством к кислороду приблизительно таким же, как сродство к кислороду водорода. В такую промежуточную группу металлов входят германий (Ge), железо (Fe), цинк (Zn), вольфрам (W), молибден(Мо), индий (In), олово (Sn), кобальт (Со) и сурьма (Sb). Они представляют собой элементы, которые легко образуют водород из водяного пара, при этом образующийся оксид можно восстановить монооксидом углерода. Иными словами, указанные металлы имеют такое сродство к кислороду, что для них равновесное отношение pH2O/pH2 является достаточно низким для получения водорода на практике, но оксид металла легко восстанавливается углеродом при обычных пирометаллургических температурах(например, примерно 1200 С). Такие металлы в данном описании относят к химически активным металлам, причем это означает, что как металл можно окислить водяным паром, так и оксид металла можно восстановить монооксидом углерода. Процесс восстановления водяного пара/окисления железа был основным промышленным способом производства водорода в 19 и начале 20 столетия. При повышенной температуре железо извлекает кислород из воды, причем остается чистый водород. 3Fe + 4 Н 2OFе 3O4 + 4 Н 2(4) Для максимизации получения водорода требуется избыток воды над данным количеством железа. После получения водорода избыток воды конденсируется, причем остается незагрязненный водородом водяной пар. Продуктами реакции в процессе восстановления водяного пара/окисления железа являются чистый водород и вюстит (FeO) и/или магнетит (Fе 3O4). Для того чтобы регенерировать металл, используют монооксид углерода или углерод, который захватывает кислород из оксида железа, причем образуются металлическое железо и монооксид углерода или диоксид углерода (СO2). В первые годы производства водорода указанные две стадии осуществляли в разных реакторах. Первичные компоненты стоимости получения водорода таким способом включали в себя стоимость используемого железа за вычетом величины, получаемой для полученного оксида железа, и стоимости получения избытка водяного пара, требуемого для протекания реакции (функция температуры). Такую стоимость можно снизить путем использования преимуществ, получаемых от извлечения избыточной энергии из водяного пара. В известном уровне техники имеется множество примеров вышеописанного способа. В патенте США 1345905, выданном Abbott, описывается получение водорода из водяного пара путем окисления железа с использованием нескольких реакторов. В конструкции из четырех реакторов один реактор используют для окисления железа (получение водорода), два реактора используют для восстановления железа, и четвертый реактор используют для предварительного нагревания реагентов. Газовые потоки можно переводить из реактора в реактор для непрерывного получения водорода. В патенте США 4343624, выданном Belke et al., описывается 3-стадийный способ получения водорода и аппарат, использующие в качестве источника водорода водяной пар. На первой стадии из такого сырья, как уголь, получают газ с низким BTU (от англ. British thermal unit, т.е. британская тепловая единица), содержащий водород и монооксид углерода. Затем газ с низким BTU на второй стадии взаимодействует с магнетитом с образованием железа, диоксида углерода и водяного пара. Затем водяной пар и железо взаимодействуют на третьей стадии с образованием водорода и магнетита. Утверждается, что магнетит можно вернуть на вторую стадию для использования в реакции восстановления, например, путем непрерывного возвращения магнетита в реактор на второй стадии через питатель. По меньшей мере одну из стадий осуществляют во вращающемся реакторе с псевдоожиженным слоем. В патенте США 4555249, выданном Leas, описывается газоразделительная установка, содержащая реагент в виде порошка, например, сплава железа, имеющего существенные различия по массе между восстановленной формой и окисленной формой. Установка имеет две зоны для размещения порошка реагента - зону окисления и зону восстановления, причем газообразный водород извлекают из зоны-2 005832 окисления. Так как реагент в виде порошка из окисленной формы превращается в восстановленную форму, масса порошка возрастает, и изменение по массе используют для переноса восстановленного порошка в зону окисления, в то время как окисленный порошок продвигается в зону восстановления. В статье "Н 2, полученный из биосинтетического газа окислением и восстановлением железа" ("Н 2from Biosyngas via Iron Reduction and Oxidation"), Straus et al., описывается способ получения водорода из биосинтетического газа. Биосинтетический газ, содержащий Н 2, СО, Н 2O и CO2 со следами N2 и СН 4, используют для восстановления магнетита до железа. Затем железо охлаждают и подают в генератор водорода, где железо вводят в контакт с водяным паром с образованием водорода путем восстановления водяного пара. Затем оксид железа охлаждают и возвращают в реактор для восстановления оксидов металлов для взаимодействия с биосинтетическим газом. К недостаткам способа восстановления водяного пара с использованием железа относится то, что при взаимодействии твердого железа с водяным паром образуется слой оксида, который препятствует дальнейшему взаимодействию водяного пара с железом под слоем оксида, и поэтому скорость реакции лимитируется скоростью диффузии газа через слой оксида. Также скорость реакции зависит от площади поверхности железа, доступного для взаимодействия. Однако большая площадь поверхности равнозначна малому размеру частиц, а маленькие частицы являются дорогостоящими для данного способа. Кроме того, существуют трудности, связанные с восстановлением оксида железа. Один из способов восстановления оксида железа включает в себя выплавку железа из оксида и, следовательно, имеет в качестве одного из недостатков высокую температуру из-за высокой температуры плавления железа (1538 С). В другом способе оксид железа восстанавливают до металла в твердом состоянии углеродом и/или восстанавливающим газом. Однако последний способ неэффективен и затруднен кинетически. Исключая восстановление в твердом состоянии, на каждую тонну произведенного водорода необходимо физически переместить из одного реактора (для окисления металла) в другой (для восстановления металла) минимум 20,8 т железа и 28,7 т магнетита. Кроме железа, в способах восстановления водяного пара были использованы другие металлы. В патенте США 1050902, выданном Acker, описывается применение в способе восстановления водяного пара олова или цинка с образованием водорода и регенерация металла посредством восстановления оксида металла углем. В патенте США 3821362, выданном Spacil, описывается применение Sn/SnO2 для получения водорода. Расплав олова распыляют и вводят в контакт с водяным паром с образованием SnO2 и газообразного водорода. Затем SnO2 вводят в контакт с генераторным газом, состоящим из H2, N2 и СО, который образуется при контакте угольной пыли с воздухом. SnO2 восстанавливают до жидкого олова, которое затем снова перемещают в первый реактор. Подобный этому способ получения водорода описывается также в патенте США 3979505, выданном Seitzer. В патентах США 4310503 и 4216199, выданных Erickson, описывается всестороннее исследование возможностей олова действовать в качестве переносчика кислорода из водяного пара в диоксид углерода. В продолжение этой работы имеется также сообщение Erickson в работе "Водород из угля путем окисления-восстановления олова" ("Hydrogen from Coal via Tin Redox"), выполненной для Office ofErickson сообщает, что выход водорода, который можно получить с данным количеством углеродсодержащей восстанавливающей композиции, можно повысить, используя многостадийный способ, в котором следующие одна за другой стадии осуществляют последовательно в порядке повышения равновесного рН 2/рН 2 О реакции окисления металла водяным паром. В числе веществ, используемых в качестве промежуточных соединений (т.е. пары металл/оксид металла), были чистые твердые вещества, такие как железо, вюстит (FeO), оксид вольфрама (WO2), молибден и германий; чистые жидкости, такие как олово и индий; и растворенные жидкости, такие как олово, индий, германий, цинк и железо, где "растворенное" означает, что промежуточное соединение имеет активность менее 1. Эффект использования растворенной жидкости состоит в том, что повышается парциальное давление кислорода (т.е. уменьшается водородная фракция), и водорода образуется меньше. Erickson сообщает, что подходящие растворители для таких растворенных жидкостей можно выбрать из числа одного или нескольких химически неактивных металлов с высоким парциальным давлением кислорода, например, меди, свинца и никеля. Также сообщается, что олово, т.е. химически активный металл, может служить в качестве растворителя для индия. При получении водорода с использованием олова в способе восстановления водяного пара первой реакцией является следующая реакция:(5) Для того чтобы обеспечить разумную кинетику для вышеуказанной реакции, требуется температура выше примерно 900 С, и олово при такой температуре является жидким (Тпл.=232 С). При таких высоких температурах термодинамические данные указывают, что для того, чтобы реакция протекала, требуется большой избыток водяного пара. Потребность в большом избытке водяного пара создает ряд проблем. Тепло следует рекуперировать в ходе процесса для того, чтобы способ был экономичным, включая тепло испарения воды в форме водяного пара. Технически рекуперация большей части такого тепла возможна,-3 005832 хотя ее осуществление требует дополнительных средств. Также большой избыток водяного пара должен вступать в физический контакт с оловом, например, путем барботирования через расплавленное олово. Практически такой контакт возможен только в том случае, если водяной пар и реактор работают при большом давлении, и, как правило, способы, которые осуществляются при больших давлениях, являются достаточно дорогостоящими. Например, для получения одной тонны водорода требуется взаимодействие 9,94 т водяного пара с 29,4 т олова (стехиометрический расчеты). Кроме того, для получения одной тонны водорода при 900 С требуется 35,7 т водяного пара для удовлетворения термодинамических требований. Если такое общее требуемое количество водяного пара (44,6 т) пропускают через стехиометрическое количество олова при атмосферном давлении, скорость прохождения водяного пара через пространство, которое иначе будет заниматься оловом, должна быть свыше 100 м/с. Это приводит к номинальному времени пребывания менее 1/100 с. Даже если давление в системе поднять до 100 атм, только 0,85 с имеется у реакции для достижения равновесия. Можно использовать олово в избытке относительно стехиометрической потребности, и под влиянием большей массы (большего объема) олова номинальное время пребывания должно возрасти. Однако такой подход к увеличению номинального времени пребывания является дорогостоящим, поскольку требуются реактор повышенного размера для взаимодействия олова и водяного пара и повышенный запас олова. Таким образом, остается потребность в способе получения водорода, разумном с технической точки зрения и жизнеспособном экономически. Способы как с системой водяной пар/железо, так и с системой водяной пар/олово с технической точки зрения практически осуществимы. Однако ни один из них не удовлетворяет требованиям по экономической жизнеспособности. Способ с системой водяной пар/железо не является удовлетворительным ввиду следующего: (1) получение водорода контролируется диффузией; (2) стоимость перемещения металла высока; и (3) высока сложность (стоимость) восстановления железа. Способ с системой водяной пар/олово не удовлетворяет требованию по экономической жизнеспособности из-за плохих кинетических параметров при низких температурах (ниже примерно 800 С) и плохих термодинамических параметров при более высоких температурах. Следствием плохих термодинамических параметров является требование прохождения больших количеств водяного пара через расплавленный металл, что повышает сложность и стоимость способа. В силу указанных и других факторов авторам настоящего изобретения не известен коммерчески доступный подход к осуществлению на практике способа восстановления водяного пара, несмотря на высокие потребности в водороде. Раскрытие изобретения Согласно одному из вариантов воплощения настоящего изобретения, предложен способ получения потока водородсодержащего газа. Способ включает в себя стадии генерации водяного пара и контактирования водяного пара с расплавленной смесью металлов, содержащей по меньшей мере примерно 20 маc.% железа, растворенного в металле-разбавителе, причем по меньшей мере часть железа окисляется до оксида железа и по меньшей мере часть водяного пара восстанавливается с образованием потока водородсодержащего газа. Предпочтительно металлом-разбавителем является олово. За счет контактирования водяного пара с железом, растворенным в металле-разбавителе, уменьшаются проблемы, связанные с термодинамическими и кинетическими ограничениями, присущими прежним способам восстановления водяного пара. Согласно другому варианту воплощения, предложен способ получения водородсодержащего газа, в котором водяной пар генерируют и вводят в контакт с расплавленной смесью металлов при температуре по меньшей мере примерно 1100 С. Расплавленная смесь металлов содержит химически активный металл, растворенный в металле-разбавителе, при этом химически активный металл окисляется, а водяной пар восстанавливается с образованием водорода. Применение температур по меньшей мере примерно 1100 С для расплавленной смеси металлов делает возможным получение водорода в благоприятных термодинамических и кинетических условиях. Согласно еще одному варианту воплощения предложен способ получения потока водородсодержащего газа, включающий в себя стадии генерации водяного пара, контактирования водяного пара с расплавленной смесью металлов в реакторе, причем в расплавленной смеси металлов диспергированы содержащие химически активный металл частицы. Содержащие химически активный металл частицы выгодным образом поставляют дополнительный химически активный металл в расплавленную смесь металлов, когда химически активный металл окисляется водяным паром. Согласно другому варианту воплощения предложен способ получения потока водородсодержащего газа, включающий в себя стадии контактирования водяного пара с расплавленной смесью металлов в реакторе, причем химически активный металл растворен в металле-разбавителе. Химически активный металл окисляется водяным паром до оксида металла. Затем оксид металла обратно восстанавливают в этом же реакторе до химически активного металла. Поток водородсодержащего газа, полученный согласно описанному выше, можно использовать во многих процессах, и он является особенно подходящим для обработки углеродсодержащих веществ, таких как уголь или отходы, и для производства химических продуктов, таких как аммиак.-4 005832 Краткое описание чертежей Фиг. 1 представляет собой фазовую диаграмму двойной системы олово-железо, которая полезна согласно настоящему изобретению; фиг. 2 показывает скорость получения водорода согласно варианту воплощения настоящего изобретения как функцию содержания железа в реакторе; фиг. 3 показывает скорость получения водорода согласно варианту воплощения настоящего изобретения как функцию содержания железа и температуры реакции; фиг. 4 представляет собой схему реактора, работающего в режиме восстановления водяного пара согласно варианту воплощения настоящего изобретения; фиг. 5 представляет собой схему реактора, работающего в режиме восстановления оксида металла согласно варианту воплощения настоящего изобретения; фиг. 6 иллюстрирует технологическую схему непрерывного получения водорода согласно настоящему изобретению; фиг. 7 иллюстрирует технологическую схему обработки угля или другого содержащего органические вещества материала согласно настоящему изобретению; фиг. 8 иллюстрирует технологическую схему получения аммиака согласно настоящему изобретению. Подробное описание изобретения Согласно настоящему изобретению газообразный водород (Н 2) образуется за счет контакта водяного пара (Н 2O) с расплавленной смесью металлов, содержащей по меньшей мере один химически активный металл, который по меньшей мере частично растворен по меньшей мере в одном металлеразбавителе. Металл-разбавитель также может быть способен реагировать с водяным паром, но по определению является химически менее активным в отношении водяного пара, чем химически активный металл. Таким образом, кислород из водяного пара преимущественно взаимодействует с химически активным металлом с окислением химически активного металла до оксида металла и с восстановлением части водяного пара, в результате чего образуется поток водородсодержащего газа, который также будет содержать избыток водяного пара. В предпочтительном варианте воплощения получение водорода продолжается до тех пор, пока концентрация растворенного химически активного металла в расплавленной смеси металлов не снизится до минимальной концентрации, которая диктуется экономическими соображениями, и в указанной точке подачу водяного пара прекращают. Затем в реактор вводят восстановитель в условиях интенсивного перемешивания, например, с использованием погруженной сверху фурмы (трубы). В таких условиях оксид металла химически восстанавливается обратно до химически активного металла, который снова растворяется в расплавленной смеси металлов. Посредством переключения потока водяного пара и восстановителя между двумя или большим числом реакторов, водород можно получать,по существу, непрерывно. Способ настоящего изобретения обеспечивает существенные преимущества по сравнению со способами восстановления водяного пара из известного уровня техники. Для того чтобы инициировать получение водорода, водяной пар вводят в контакт с расплавленной смесью металлов, содержащей по меньшей мере первый химически активный металл и по меньшей мере первый металл-разбавитель. Химически активный металл, по определению, более реакционноспособен в отношении водяного пара, чем металл-разбавитель. Химически активный металл предпочтительно имеет сродство к кислороду, подобное сродству к кислороду водорода, и взаимодействует с водяным паром с образованием оксида металла. Например, химически активный металл можно выбрать из германия (Ge),железа (Fe), цинка (Zn), вольфрама (W), молибдена (Мо), индия (In), олова (Sn), кобальта (Со) и сурьмы(Sb). Расплавленная смесь металлов может содержать один или несколько химически активных металлов. Химически активный металл предпочтительно должен (1) быть растворимым в металле(ах)разбавителе(ях); (2) иметь очень низкое давление паров при температуре(ах) окисления/восстановления; и (3) образовывать один или несколько оксидов при взаимодействии с водяным паром, который(е) также имеет(ют) низкое давление паров при температуре(ах) окисления/восстановления. Особенно предпочтительным химически активным металлом согласно настоящему изобретению является железо, и согласно одному из вариантов воплощения химически активный металл в расплавленной смеси металлов состоит,по существу, из железа. Химически активный металл, по меньшей мере, частично растворяется в другом металле или смеси металлов. Металл, в котором растворяется химически активный металл, в данном описании называется металлом-разбавителем. Металл-разбавитель также может реагировать с водяным паром, и в таком случае его можно выбрать из группы химически активных металлов, описанной выше, при условии, что металл-разбавитель менее реакционноспособен, чем химически активный металл. С другой стороны, металл-разбавитель можно выбрать среди металлов, для которых парциальное давление кислорода (рO2) в равновесии с металлом и оксидами вместе является относительно высоким. К ним относятся никель (Ni),медь (Сu), рутений (Ru), родий (Rh), палладий (Pd), серебро (Аg), кадмий (Cd), рений (Re), осмий (Os),иридий (Ir), платина (Pt), золото (Аu), ртуть (Нg), свинец (Рb), висмут (Bi), селен (Se) и теллур (Те). В расплавленной смеси металлов можно использовать несколько металлов-разбавителей. Металл-5 005832 разбавитель не должен представлять собой металл, для которого парциальное давление кислорода в равновесии с металлом и оксидами вместе является слишком низким. Предпочтительно металл-разбавитель должен (1) объединяться с химически активным металлом,образуя жидкость в температурном интервале от 400 до 1300 С; (2) иметь очень низкое давление паров в указанном температурном интервале; и (3) обладать способностью удерживать химически активный металл в растворе. Согласно предпочтительному варианту воплощения настоящего изобретения металлразбавитель представляет собой олово, и в одном из вариантов воплощения металл-разбавитель состоит,по существу, из олова. Однако расплавленная смесь металлов также может содержать дополнительные металлы-разбавители, в частности медь и никель. Особенно предпочтительная расплавленная смесь металлов для восстановления водяного пара согласно настоящему изобретению содержит железо в качестве химически активного металла и олово в качестве металла-разбавителя. Железо имеет высокую растворимость в расплавленном олове при повышенных температурах, и температура плавления такой смеси существенно ниже, чем температура плавления чистого железа (1538 С). Хотя олово также реагирует с водяным паром, оно химически менее активно, чем железо. Из-за термодинамических требований для реакций восстановления водяного пара с образованием газообразного водорода требуется избыток водяного пара, превышающий стехиометрическую потребность. Общая потребность в водяном паре (массовое отношение требуемого водяного пара к полученному водороду) для железа при всех температурах намного меньше, чем для олова, и в расплавленной смеси металлов преимущественно будет окисляться железо. Не вдаваясь в теорию, предполагается, что некоторое количество химически активного олова окисляется до оксида олова, но сразу же обратно восстанавливается до олова. Термодинамическая потребность в водяном паре для олова при 660 С приблизительно равно термодинамической потребности в водяном паре для железа при 1200 С. Однако получение водорода с использованием олова в качестве химически активного металла при 660 С непрактично, так как кинетические показатели (т.е. скорость реакции) очень плохие, и, следовательно, требуются очень длительные времена пребывания (т.е. время, на протяжении которого водяной пар контактирует с оловом). При 1200 С кинетические показатели как для олова, так и для железа являются превосходными. Однако потребность в водяном паре для олова значительно выше, чем для железа. Согласно настоящему изобретению время пребывания водяного пара в контакте с химически активным металлом возрастает за счет использования металла-разбавителя. В целях иллюстрации, в табл. 1 и 2 сравниваются термодинамические потребности в водяном паре и номинальные времена пребывания при температуре 1200 С и различных давлениях для варианта воплощения настоящего изобретения с растворенным железом (50 мас.% железа в олове) и в случае чистого олова. Табл. 1 иллюстрирует общее количество водяного пара,требуемое для получения одной тонны водорода при 1200 С. Таблица 1 Табл. 2 иллюстрирует номинальные времена пребывания водяного пара в контакте при скорости получения водорода 4,439 т/ч. Из табл. 1 и 2 видно, что системы с чистым оловом требуют для получения водорода существенно больше водяного пара, чем системы с растворенным железом согласно настоящему изобретению. Табл. 2 также показывает, что номинальное время пребывания, имеющееся у олова для взаимодействия с водяным паром, существенно меньше, чем номинальное время пребывания, имеющееся для взаимодействия с водяным паром у железа, растворенного в олове. Номинальное или кажущееся время пребывания представляет собой время, имеющееся для прохождения водяным паром (реагентом процесса) пространства,занимаемого используемым химически активным металлом. В табл. 2 объем расплава является количеством металла, необходимым стехиометрически при скорости получения водорода 4,439 т/ч. На протяжении указанного времени в идеале водород будет образовываться в количестве, соответствующем термодинамическому отношению рН 2/рН 2O. Количество химически активного металла, превышающее стехиометрическое количество, можно использовать для увеличения номинального времени пребывания, но следствием является увеличение размера реактора и стоимости. Повышенное давление также повышает время реакции, имеющееся для взаимодействия водяного пара и химически активного металла, однако,это также повышает стоимость. Таким образом, одним из существенных преимуществ использования химически активного металла, растворенного в металле-разбавителе согласно настоящему изобретению, является то, что время пребывания водяного пара в реакторе повышается в соответствии с массой химически активного металла. Иными словами, данная масса железа будет занимать первый объем как чистое железо, но та же масса железа будет распределена примерно в двойном объеме, если железо составляет 50 мас.% смеси с металлом-разбавителем, таким как олово. Фиг. 1 представляет собой фазовую диаграмму для железа и олова, адаптированную из работы HariKumar, K.С., et al., Calphad, 20, 2, 139-149 (1996). Из фиг. 1 можно видеть, что одним из действий добавления железа (химически активный металл) к олову (металл-разбавитель) является существенно более низкая температура плавления железа. Ликвидус смеси металлов снижается от 1538 С (чистое железо) до примерно 1134 С, когда сплав состоит из примерно 48,7 мас.% олова и 51,3 маc.% железа. Согласно одному из вариантов воплощения предпочтительно, чтобы смесь металлов оставалась при температуре выше линии ликвидуса АС на фиг. 1 (например, выше 1134 С). Однако температура реакции металла с водяным паром, которая слишком высока, существенно добавляет к стоимости операций. Для полностью расплавленной системы железо/олово, показанной на фиг. 1, металл необходимо поддерживать при температуре выше температуры ликвидуса в примерно 1134 С, предпочтительнее - при температуре по меньшей мере примерно 1200 С. В целях разумной экономии температура не должна превышать 1500 С и предпочтительнее не должна превышать 1400 С. Особенно предпочтительный температурный интервал для полностью расплавленной смеси олово/железо составляет от примерно 1200 С до 1300 С. При 1200 С примерно 50 мас.% железа растворяется в олове с достаточным перегревом, и смесь остается в расплавленном состоянии, когда железо окисляется. В дополнение к этому, взаимодействие между водяным паром и жидким железом, растворенным в олове, с образованием чистого водорода при 1200 С также является достаточно энергичным, и кинетические параметры реакции превосходны. Кроме того, термодинамические параметры для системы водяной пар/железо при 1200 С являются относительно хорошими, причем для получения каждой тонны водорода требуется избыток водяного пара только примерно в 12,2 т (1,37 моль водяного пара на моль водорода). Согласно такому варианту воплощения, предпочтительно, чтобы смесь металлов сначала содержала примерно 3 мас.% железа в расплавленной смеси металлов, предпочтительнее - по меньшей мере примерно 10 маc.% железа, еще предпочтительнее - по меньшей мере примерно 20 мас.% железа и даже еще предпочтительнее - по меньшей мере примерно 50 мас.% железа в расплавленной смеси металлов. Далее количество железа в расплавленной смеси металлов не должно превышать предпочтительно примерно 85 мас.% и предпочтительнее - не должно превышать примерно 80 мас.%. Остальная часть смеси металлов в предпочтительном варианте воплощения состоит, по существу, из олова. Соответственно, количество олова в системе предпочтительно не превышает примерно 97 мас.%, предпочтительнее - не превышает примерно 90 мас.% и еще предпочтительнее - не превышает примерно 80 мас.%. Расплавленная смесь металлов предпочтительно содержит по меньшей мере примерно 15 мас.% олова, а предпочтительнее содержит по меньшей мере примерно 20 мас.% олова.-7 005832 Хотя настоящее изобретение требует наличия расплавленной смеси металлов, согласно одному из вариантов воплощения в расплавленной смеси металлов могут быть диспергированы нерастворимые фазы, например, в форме частиц. Такой ансамбль расплавленной смеси металлов и нерастворимой фазы называют суспензией. Согласно одному из вариантов воплощения, водяной пар вводят в контакт с суспензией, содержащей расплавленную смесь металлов и твердую вторую фазу, причем вторая твердая фаза содержит частицы, содержащие химически активный металл, и адаптирована для поставки дополнительного химически активного металла в расплавленную смесь металлов. Предпочтительно указанные частицы являются металлическими частицами (т.е. не частицами оксида). Например, суспензия может содержать богатые железом металлические частицы в расплаве железо/олово, насыщенном железом. Когда происходит процесс восстановления водяного пара, растворенное железо удаляется из расплавленной смеси металлов за счет окисления железа, и дополнительное железо из богатых железом частиц растворяется в расплавленном металле для сохранения части расплавленного металла суспензии, насыщенной железом. Если обратиться к диаграмме на фиг. 1, то состав в пределах двухфазной области, определенной точкой А (83,3 мас.% Fe при 1134 С), точкой В (84 мас.% Fe при 895 С), точкой С (12 маc.% Fe при 1134 С) и точкой D (3 маc.% Fe при 895 С), содержит расплав железо/олово с примерно от 3 до 84 мас.% всего железа и часть железа в виде богатых железом металлических частиц, диспергированных в расплаве. При заданной температуре между 895 и 1134 С, когда железо удаляется из расплава металлов из-за окисления, дополнительное твердое железо будет растворяться из богатых железом частиц, причем посредством этого концентрация железа в расплаве поддерживается на уровне насыщения до тех пор, пока твердое железо не израсходуется. Такое возмещение железа, израсходованного на окисление, железом,исходящим из богатых железом частиц, сохраняет высокую активность железа, что, в свою очередь, максимизирует получение водорода. Например, при температуре примерно 950 С и общем содержании железа примерно 50 мас.% расплавленная смесь металлов будет содержать примерно 4 мас.% растворенного железа в системе. Когда растворенное железо окисляется, будет растворяться дополнительное металлическое железо из частиц, богатых железом, для поддержания уровня растворенного в металле железа, в 4 мас.%. Поэтому активность железа остается неизменной вследствие растворения частиц, богатых железом. Таким образом, согласно такому варианту воплощения суспензия, содержащая расплавленную смесь металлов и железосодержащие частицы, остается при температуре ниже температуры ликвидуса 1134 С и равной примерно 895 С, предпочтительнее от примерно 900 до примерно 1134 С. Одним из преимуществ такого способа является то, что активность железа остается постоянной и действительно очень близка к единице, а следовательно, скорость получения водорода остается постоянной и максимизируется в ходе восстановления водяного пара. Нужный эффект постоянной активности химически активного металла также можно было бы наблюдать, если осуществлять способ в пределах области интервала смешиваемости на фиг. 1; однако, активность железа иногда может быть ниже единицы. Между парциальным давлением водорода в отходящем газе, температурой реакции и массовым процентом содержания железа в составе расплавленного металла существует термодинамическая зависимость. Термодинамический параметр, называемый "активностью" железа, изменяется в зависимости от концентрации железа и сильно влияет на отношение водорода к воде в отходящем газе. Получение водорода максимизируется работой в пределах фазовых областей, в которых установлена высокая активность железа в широком интервале составов, через применение второй фазы в равновесии с реагирующей фазой. Это применимо как к области жидкость-жидкость выше линии АС на фиг. 1, так и к области твердое вещество-жидкость ниже линии АС и справа от линии АВ. Однако настоящее изобретение не исключает работу в жидкой фазе, богатой железом. Фиг. 2 иллюстрирует взаимосвязь количества водорода в отходящем газе как функции содержания железа в расплавленной смеси металлов. Кривая на фиг. 2 рассчитана на основании термодинамических параметров реакции при 1225 С. Очевидно, что скорость образования водорода быстро снижается, когда содержание железа падает с 29 до 10 мас.%. Фиг. 3 показывает образование водорода как функцию температуры и содержания железа. При уровнях ниже 20 мас.% железа и температурах выше примерно 1134 С производительность по водороду ухудшается, так как (1) существенно падает рН 2/рН 2O; и (2) имеются в распоряжении только короткие промежутки времени перед тем, как должны быть переключены газовые потоки (т.е. водяного пара и восстановителя оксида металла). Таким образом, водяной пар вводят в контакт с расплавленной смесью металлов с образованием водорода и превращением химически активного металла в оксид металла. Водяной пар вводят в контакт с расплавленной смесью металлов так, чтобы способствовать хорошему смешиванию и контакту с расплавленной смесью металлов. Например, водяной пар можно ввести в контакт с расплавленной смесью металлов путем вдувания(инжектирования) через погружаемую сверху фурму или трубку (top-submerged lance) или через пористый керамический диффузор, установленный на дне реактора. Предпочтительные в этом отношении сис-8 005832 темы реакторов обсуждаются ниже. Температуру реактора можно регулировать для поддержания, по существу, постоянной температуры путем регулирования температуры и количества входящего водяного пара и/или путем добавления кислорода в реактор. Реактор для восстановления водяного пара при необходимости можно поддерживать при повышенном давлении для адекватного времени пребывания в реакторе, как описано выше. Например, может потребоваться поддерживать реактор при повышенном давлении, таком как по меньшей мере примерно 15,3 атм (225 фунт-сил/дюйм 2). Несколько повышенное давление (например, давление в трубопроводе примерно 200 фунт-сил/дюйм 2) также может быть благоприятным для обеспечения достаточного давления для переноса водяного пара. Однако существенно повышенное давление повышает капитальные затраты, и поэтому предпочтительно, чтобы давление в реакторе для восстановления водяного пара не превышало примерно 600 фунт-сил/дюйм 2, и предпочтительнее - не превышало примерно 225 фунтсил/дюйм 2. Согласно настоящему изобретению над расплавленной смесью металлов поддерживается слой шлака. Слой шлака обеспечивает ряд преимуществ, в том числе предупреждает выход оксида железа из реактора. Температура в реакторе для восстановления водяного пара должна быть достаточной для поддержания слоя шлака, образующегося над расплавленной смесью, в расплавленном состоянии в широком интервале составов. Когда химически активный металл окисляется, будет происходить снижение концентрации химически активного металла в смеси металлов, и при этом смесь металлов должна оставаться расплавленной, когда химически активный металл окисляется. Подобно интервалу составов для расплавленного металла, описанному ранее с учетом фиг. 1, можно установить интервал предпочтительных составов шлака для обеспечения адекватной жидкотекучести и реакционноспособности шлака и предупреждения пенообразования, как необходимо при заданной температуре. Например, для регулирования свойств шлака в реактор можно добавить флюсы. Одна из флюсовых систем, определяемая поверхностью жидкости, может состоять из SiO2, FeO, CaO, MgO, Na2O и K2O. Однако в указанный или другие шлаки можно вводить серу, а также другие катионы для приобретения шлаком удовлетворительного химического состава. Оксид металла (например, вюстит и/или магнетит), который образуется за счет восстановления водяного пара, может выгодным образом улавливаться (растворяться или суспендироваться) в слое шлака в реакторе. При предпочтительных температурах оксид железа включается в шлак, который легче смеси металлов. Поэтому, когда растворенное железо уходит из расплавленной смеси металлов, оксид железа поднимается сквозь расплавленный металл и включается в слой шлака над расплавленным металлом. Преимуществом такого варианта воплощения настоящего изобретения является то, что оксид, образовавшийся в результате взаимодействия химически активного металла с водяным паром, имеет плотность,которая меньше плотности расплавленной смеси металлов, в результате чего оксид поднимается к слою шлака. Предпочтительно оксид металла является по меньшей мере примерно на 10% менее плотным, чем расплавленная смесь металлов. Это также создает возможность оседания металла из слоя шлака в расплавленную смесь металлов после восстановления оксида металла. Как описано выше, такое накапливание оксида железа в шлаке может потребовать введения флюса, такого как SiO2, FeO, CaO, MgO, Na2O иK2O или их смесей, для поддержания шлака в предпочтительном состоянии в смысле вязкости, реакционноспособности, пенообразовании и т.п. Расплавленная смесь металлов должна находиться в подходящем реакторе для поддержания подходящих условий реакции. Кроме того, реагенты должны подаваться так, чтобы обеспечивалось хорошее смешивание и большая площадь поверхности контакта. В химической и, особенно, в металлургической промышленности используют высокотемпературные реакторы, подходящие для установления хорошего контакта газ/жидкость. В предпочтительной реакторной системе по настоящему изобретению используют погружаемую сверху фурму для вдувания водяного пара в расплавленный металл. Такие реакторы используют при коммерческом получении олова из оловянной руды (касситерита). Примеры реакторов с использованием погружаемой сверху фурмы для вдувания реагентов описываются в патенте США 3905807, Floyd, патенте США 4251271, Floyd, патенте США 5251879, Floyd, патенте США 5282881, Baldock et al.,патенте США 5308043, Floyd et al., и патенте США 6066771, Floyd et al. Каждый из указанных патентов включен в данное описание в качестве ссылки во всей своей полноте. В таких реакторах реагенты(например, водяной пар) можно вдувать в расплавленный металл при исключительно высоких скоростях,приближающихся к скорости звука (Mach 1), причем посредством этого обеспечивается хорошее смешивание реагентов. Реактор, включающий в себя фурму для вдувания водяного пара, иллюстрируется фиг. 4. Реактор 400 имеет огнеупорные боковые стенки 402, которые приспособлены для содержания расплавленной смеси 404 металлов. При необходимости можно обеспечить средства нагревания (не показаны) для поддержания температуры в реакторе 400. Погружаемая сверху фурма 408 проходит через верхнюю стенку 412 реактора и приспособлена для вдувания водяного пара в смесь металлов 404 при высокой вязкости. Предпочтительно погружаемая сверху фурма 408 оканчивается и подает водяной пар ниже поверхности слоя шлака 406 и вблизи поверхности раздела между расплавленной смесью 404 металлов и слоем 406-9 005832 шлака. Когда через фурму 408 подают водяной пар, железо в смеси 404 металлов окисляется до оксида железа. Оксид железа всплывает и накапливается в слое 406 шлака. Газообразный продукт 416 реакции,содержащий газообразный водород, смешанный с водяным паром, удаляется через выпускной канал 410,после чего излишек водяного пара можно сконденсировать и получить поток, по существу, чистого газообразного водорода. Процесс восстановления водяного пара продолжают до тех пор, пока скорость образования водорода не снизится до существенно низкого уровня. Затем в реактор, содержащий расплавленную смесь металлов и шлак, вводят восстановитель для восстановления оксида железа обратно до металла. Момент,когда процесс восстановления водорода прекращают и начинают процесс восстановления оксида металла, можно легко установить на основании экономических соображений. Иными словами, в некоторый момент скорость образования водорода в реакторе для восстановления водяного пара будет снижаться до уровня, который экономически выгоден для прекращения восстановления водяного пара и начала регенерации металла из оксида металла. На указанной стадии регенерации, которую можно рассматривать как восстановительную очистку от шлака, оксид железа в шлаке восстанавливается и возвращается в расплав в виде железа. Это достигается за счет снижения потенциала окисления системы путем введения в реактор восстановителя. Восстановитель снижает потенциал окисления системы, причем посредством этого железо снова переходит в расплав. Восстановитель может представлять собой монооксид углерода, уголь и/или другой источник углерода. Согласно предпочтительному варианту воплощения, потенциал окисления системы снижают путем вдувания в шлак чистого угля в виде частиц, газообразного углеводорода или жидкого углеводорода с кислородсодержащим газом в условиях интенсивного перемешивания. Уголь в виде частиц или углеводород могут включать в себя кокс, уголь или другой органический материал. Также можно использовать жидкий углеводород, такой как 6 или другая нефть. Также можно использовать отходы, такие как утильные покрышки. Утильные покрышки могут выгодным образом подавать в реактор дополнительное железо для восполнения случайных потерь железа. Погружаемая сверху фурма предпочтительна для введения в реактор воздуха или другого кислородсодержащего газа способом, обеспечивающим хорошее перемешивание. Перед вдуванием восстанавливающей композиции реактор можно продуть, например, водяным паром, для удаления из реактора остатков водорода. После завершения восстановительной очистки от шлака реактор можно снова продуть воздухом или водяным паром с целью удаления остатков углерода, который может быть растворен в железе, и/или с целью удаления любых захваченных элементов, которые могут иметься либо в расплаве, либо в шлаке, и которые в ином случае могут загрязнить полученный водород, когда в реактор снова возвращают водяной пар. В предпочтительном варианте воплощения согласно настоящему изобретению восстановитель, полученный из источника углерода, такого как уголь, и источник кислорода, такой как обогащенный кислородом воздух, вдувают в расплавленную смесь металлов и слой шлака. Уголь можно вдувать через погружаемую сверху фурму вместе с (с помощью) воздухом, или же его можно добавить отдельно. Выгодно использовать именно уголь в качестве источника восстановителя, поскольку по сравнению с нефтью и газом он является как более распространенным, так и относительно недорогим. Уголь также может поставлять железо в реактор для восполнения железа, которое теряется при переработке. Утильные покрышки и другие отходы (в т.ч. производственные) также могут поставлять некоторое количество железа. Процесс восстановления оксида металла продолжают до тех пор, пока в расплавленной смеси металлов снова не растворится достаточное количество железа. Предпочтительно условия реакции при работе в режиме восстановления оксида металла до металла,по существу, идентичны условиям во время восстановления водяного пара. Иными словами, предпочтительно, чтобы температура и давление в реакторе для восстановления оксида металла были такими же или очень схожими с температурой и давлением в реакторе для восстановления водяного пара. Так, температура предпочтительно, по меньшей мере, превышает температуру ликвидуса (например, примерно 1134 С для системы олово/железо), а предпочтительнее равна по меньшей мере 1200 С. Предпочтительно температура не превышает примерно 1400 С, а предпочтительнее не превышает примерно 1300 С. В особенно предпочтительном варианте воплощения температура составляет примерно 1200 С в обоих реакторах, и при этом давление в реакторе для восстановления водяного пара несколько превышает атмосферное, а в реакторе для восстановления оксида металла несколько ниже атмосферного давления. Теперь следует обратиться к фиг. 5, иллюстрирующей реактор 500, работающий в режиме восстановления оксида металла. Предпочтительно физически реактор идентичен реактору для восстановления водяного пара, показанному на фиг. 4, и имеет огнеупорные боковые стенки 502. Смесь 504 металлов сначала содержит в основном олово, хотя будет присутствовать и некоторое количество железа. Слой 506 шлака содержит оксид железа, образовавшийся во время процесса восстановления водяного пара,описанного выше. Углерод 514, например в форме угля, можно вдувать через фурму 508, проходящую через верхнюю стенку 512 реактора, вместе с источником кислорода, например, обогащенным кислородом воздухом. С другой стороны, углерод можно добавлять в реактор отдельно, а газообразный источник кислорода можно вдувать через фурму. В условиях восстановления, поддерживаемых в реакторе восста- 10005832 новления оксида металла путем введения углерода и кислорода, оксид железа восстанавливается обратно до железа, которое затем снова растворяется в расплавленной смеси 504 металлов. Отходящие газы 516,такие как диоксид углерода и азот, можно удалить через выводной канал 510. На стадии восстановления оксида металла из угля образуется зола, которая также будет входить в состав шлака. Шлак, который может являться пуццолановым, когда в качестве флюса добавляют СаО,можно периодически или непрерывно выгружать, измельчать и использовать как замену портландцемента. С другой стороны, шлак можно частично гранулировать путем гашения водой. Затем гранулированный шлак можно выпустить и сбросить в отходы. Примеси в угле (например, сера, хлор и фтор), которые во время сжигания превращаются в газообразные вещества (такие как диоксид серы, хлороводород и фтороводород), можно удалить мокрой очисткой. С другой стороны, серу можно превратить в сульфат аммония, который используют в качестве удобрения, и остальные примеси ввести во взаимодействие для придания им твердого состояния, так что их можно отправить в отходы. Диоксид углерода и азот являются единственными газообразными веществами, выходящими из процесса восстановления оксида металла. Регулирование потенциала окисления шлака регулирует количество оксида железа в шлаке, которое восстанавливается до железа, впоследствии поступающего в расплав во время восстановления оксида металла. Этого можно достичь, регулируя относительное количество угля (или другого углеродсодержащего топлива) и кислорода, которые вводят в шлак. Некоторое количество оксида железа, определяемое химией шлака, будет растворяться в шлаке. Другая часть оксида железа может присутствовать в шлаке в виде твердых частиц, если шлак насыщен оксидом железа. Согласно вышеописанному очевидно, что два или большее число реакторов могут работать на получение водорода параллельно в непрерывном режиме. Когда железо из расплавленной смеси металлов израсходуется в реакторе восстановления водяного пара и когда оксид железа восстановится до металла в реакторе восстановления оксида металла, их функции можно поменять путем переключения потоков,входящих и выходящих из реакторов. Хотя функциональность реакторов меняется, движения металла и оксида металла в реакторы и из них не происходит. Это оказывает существенное и благоприятное влияние на стоимость. Можно использовать реакторы с одной погружаемой сверху фурмой для вдувания водяного пара или введения углерода и кислорода для образования монооксида углерода. С другой стороны, можно использовать реактор с двумя фурмами (одним для водяного пара и другим для смеси углерод/кислород). Также можно обеспечить дополнительные каналы для вдувания водяного пара, например,в боковых стенках реактора. Технологическая схема, иллюстрирующая непрерывное получение водорода с использованием двух реакторов согласно настоящему изобретению, приводится на фиг. 6. В процессе получения водорода используют два реактора 602 и 604, где один из реакторов работает в режиме восстановления водяного пара, в то время как другой реактор работает в режиме восстановления оксида металла. Как показано на фиг. 6, реактор 602 работает в режиме восстановления водяного пара и генерирует водород, а реактор 604 работает в режиме восстановления оксида металла. Водяной пар получают, нагревая воду в котлах-утилизаторах 606 и 610. Перед нагреванием в котлах воду следует подвергнуть очистке 612, например, с использованием обратного осмоса и деионизации,для удаления загрязнений, которые могут вредно влиять на работу котлов или внести примеси в продукт,представляющий собой газообразный водород. Водяной пар получают в указанных котлах и подают в реактор 602 при температуре перегрева, которая достаточна для поддержания изотермических условий в реакторе 602 восстановления водяного пара при рабочей температуре, например, примерно 1200 С. Водяной пар вдувают в реактор 602 через погружаемую сверху фурму 608. Погружаемая сверху фурма обеспечивает хорошее перемешивание и большую площадь поверхности контакта между водяным паром и расплавленной смесью металлов для способствования реакции восстановления водяного пара/окисления металла. Реактор 602 закрывают герметично для предотвращения выхода водорода и водяного пара из реактора. Также реактор можно поддерживать при умеренном давлении для обеспечения достаточного времени контакта водяного пара со смесью металлов и выпуска водорода под давлением. В реактор при необходимости можно добавить другие материалы. Например, можно добавить флюсы 614 для регулирования свойств слоя шлака, который образуется над расплавленной смесью металлов,когда при реакции восстановления водяного пара металл окисляется. Возможные флюсы включают в себя SiO2, FeO, CaO, MgO, Na2O или K2O. Кроме того, другие материалы, такие как соединения олова,касситеритовая руда, или другие материалы, такие как соединения железа или железная руда, можно добавлять для восполнения потерь содержания металла. Согласно особенно предпочтительному варианту воплощения в реактор для восполнения потерь олова вводят касситеритовую руду (SnO2). Водородсодержащий газ, в который входят водород и избыток водяного пара, удаляют из реактора 602. Водородсодержащий газ можно пропустить через котел-утилизатор 606 для получения тепла для дополнительного водяного пара, посредством чего экономят тепло. Поток водородсодержащего газа также может содержать некоторые загрязнения, такие как субоксид олова (SnO), гидрированный субоксид олова (SnO2H2), и захваченные частицы (застывшего) шлака, которые улетучиваются или выносятся из ванны расплавленного металла и шлака, и такие загрязнения можно удалить в пылеуловителе 616.- 11005832 Например, летучие соединения олова можно сконденсировать из газового потока и вместе с частицами шлака уловить либо в котле-утилизаторе, либо в пылеуловителе. После отделения эти материалы можно гранулировать 618 и, необязательно, подать в реактор 602, работающий в режиме восстановления водяного пара, или реактор 604, работающий в режиме восстановления оксида металла, для восполнения содержащегося металла и регулирования химии шлака. После удаления загрязнений, если они имеются,газовый поток с водородом обрабатывают в конденсаторе 620 и/или холодильнике (не показан) для конденсации избытка водяного пара из водородсодержащего газового потока и получения потока 622 водорода высокой чистоты. Воду, сконденсированную из водородсодержащего газового потока, можно повторно использовать для получения дополнительного водяного пара. Одновременно оксиды металлов восстанавливаются в реакторе 604. Оксиды металлов восстанавливаются восстановителем, таким как СО, который можно получить, вдувая уголь 624 (или другой углеродсодержащий материал) и кислород 626 через погружаемую сверху фурму 628. Как и в реакторе 602,погружаемая сверху фурма 628 обеспечивает хорошее перемешивание и большую площадь поверхности контакта между реагентами. Кислородсодержащий газ также следует вдувать с использованием погружаемой сверху фурмы или подобного устройства. Частицы угля в реактор 604 можно загружать другими способами, например, просто сбрасывая уголь в реактор. Минералы, образующие золу, которые, как правило, являются частью угля (или другого углеродсодержащего материала), используемого вместе с кислородом для того, чтобы вызвать восстановление оксидов химически активных металлов, входят в состав шлака в реакторе 604. Когда используют уголь 624 и в шлаке имеется адекватное количество оксида кальция (СаО), слой шлака может представлять собой товарный пуццолановый побочный продукт. Как и в реактор 602, в реактор 604 можно вводить другие материалы, такие как флюсы, например, для регулирования свойств шлака, таких как жидкотекучесть шлака или склонность к вспениванию. Газ, отходящий из реактора 604 восстановления оксида металла, может содержать диоксид углерода, азот и некоторые загрязняющие вещества из угля, такие как сера. Тепло от отходящего газа можно использовать в котле-утилизаторе 610, где генерируется водяной пар. Затем поток газа можно обработать в пылеуловителе 630 для удаления загрязнителей в виде частиц. Оставшиеся газы можно обработать в скруббере 632 с известняком с образованием невредных для окружающей среды дымовых газов и гипса из серы, источником которой является уголь. С другой стороны, серу можно обработать безводным аммиаком с образованием сульфата аммония - полезного вещества для удобрения почвы. Таким образом, когда железо из расплавленной смеси металлов в реакторе 602 восстановления водяного пара израсходуется и когда оксид железа в реакторе 604 восстановления оксида металла восстановится, их функции можно реверсировать переключением потоков, входящих и выходящих из реакторов. Перед переключением газовых потоков реакторы можно продуть для удаления оставшихся газов и загрязнений, если они имеются. Соответственно, газообразный водород можно получать, по существу, в непрерывном режиме. Газообразный водород, полученный согласно настоящему изобретению, предпочтительно может иметь высокую степень чистоты. Предпочтительно поток газа содержит по меньшей мере примерно 30 об.% водорода, и остальное составляет главным образом вода в форме водяного пара. Предпочтительно чистота водорода после удаления в конденсаторе остаточной воды превышает примерно 99% или более,а предпочтительно превышает примерно 99,9%. Преимуществом настоящего изобретения является то,что не требуется отделять газообразный водород от других газов, таких как монооксид углерода и диоксид углерода, как в случае, когда водород получают либо риформингом метана с водяным паром, либо газификацией угля, которые являются основными способами получения водорода в настоящее время. В случае, когда в потоке газа сначала присутствуют соединения углерода (например, СО) из-за наличия в расплавленной смеси растворенного углерода, газ можно извлекать и сжигать как топливо до тех пор,пока чистота водорода не достигнет желательного уровня. Иными словами, растворенный углерод будет преимущественно взаимодействовать с водяным паром с образованием СО, прежде чем за счет окисления химически активного металла получается водород в большом количестве. Далее, способ и аппаратура настоящего изобретения делают возможным получение больших объемов чистого водорода при низкой стоимости. Водород имеет топливный показатель 51623 BTU/фунт и полезен в качестве компонента горючего газа. Водород также можно использовать для процессов гидрирования и в полупроводниковом производстве. Кроме того, водород непосредственно используют как топливо в топливном элементе, таком как мембранный топливный элемент с протонным обменом (PEMFC от англ. Proton Exchange Membrane Fuel Cell). Один из аспектов настоящего изобретения относится к обработке угля для получения энергии из угля, причем с минимизацией выбросов в атмосферу вредных побочных продуктов, которые в обычных процессах связаны с превращением угля в энергию. Способ дает возможность извлечения доступного энергетического содержания угля в форме газа со средним BTU, причем в то же время снижается выброс в атмосферу вредных побочных продуктов. Уголь относительно распространен в Соединенных Штатах и многих других регионах, в том числе,в странах третьего мира с недоразвитой инфраструктурой производства энергии. Одной из проблем, свя- 12005832 занных с использованием угля, является то, что уголь, как правило, необходимо очищать или продувать от содержащихся в нем минеральных веществ, в том числе, серы; тем не менее, как правило, существует дополнительная потребность в мокрой очистке газа после сжигания для соответствия стандартам по окружающей среде. Преимуществом настоящего изобретения является то, что угольное сырье может включать в себя низкосортный уголь, в том числе уголь с высоким содержанием серы и другие низкосортные угли. Используемый в данном описании термин "низкосортный уголь" относится к углю с содержанием серы,превышающим 2 мас.%, и содержанием золы, превышающим 10 мас.%. Вообще говоря, способ настоящего изобретения включает в себя обеспечение угольным сырьем установки гидрирования и контактирование сырья с обрабатывающим газом, содержащим Н 2, полученный согласно описанному выше. Углеводороды в угле, являющиеся летучими, реагируют с водородом с образованием метана (СН 4). Газы, выходящие из установки гидрирования, при необходимости можно очистить и получить продукт в виде чистого газа с высоким BTU. Часть такого газа можно сжечь в комбинированном циклическом генераторе, причем в таком генераторе используют преимущество высокой эффективности конверсии тепла в электричество. Другую часть газа можно сжечь в обычном котле с нелетучим чистым углем, образовавшимся в установке гидрирования. Уголь может быть, по существу, свободен от серы, поскольку обрабатывающий водородсодержащий газ является сильным десульфирующим агентом. В одном из вариантов воплощения еще одну часть угля, полученного в установке гидрирования,можно вернуть на стадию восстановления оксида металла, где оксид металла восстанавливается обратно до химически активного металла. Таким образом, уголь выгодно распределяется на летучие компоненты(обрабатываемые водородом) и нелетучий чистый уголь (взаимодействующий с кислородом). Согласно фиг. 7, уголь 702, при необходимости с другими органическими материалами, сначала подают в подогреватель 704, где температура угля повышается. Затем нагретый уголь передают в установку 706 гидрирования, где уголь вводят в контакт с водородом 705, полученным согласно описанному выше способу. Установка 706 гидрирования может представлять собой реактор с псевдоожиженным слоем или другой реактор, подходящий для обработки угля в виде частиц. Установка предпочтительно работает при давлении окружающей среды или близком к атмосферному, например, при давлении не более примерно 5 фунт-сил/дюйм 2. Стоимостное преимущество настоящего изобретения состоит в том, что установка 706 гидрирования не работает при существенно повышенных давлениях. При высоких давлениях образуется дополнительный метан - газ с очень высоким числом BTU. Однако для целей конвертирования угля в экологически чистую энергию по стоимости более эффективно получать горючие газы монооксид углерода и водород из кокса, т.е. остатка со стадии гидрирования. Газы, полученные при взаимодействии кокса и водяного пара (СО и Н 2), объединяют с метаном после гидрирования, и получают ценный газ со среднимBTU. Реакцию в установке 706 гидрирования осуществляют, предпочтительно, при температуре по меньшей мере примерно 700 С, а предпочтительно - не выше примерно 1100 С, например, от примерно 800 до примерно 900 С. Реакция, происходящая в установке гидрирования, является экзотермической, и поэтому потребность во внешнем тепле минимальна. Уголь представляет собой сложную смесь химических соединений, которые главным образом являются органическими соединениями. Хотя уголь, преимущественно, представляет собой углеводород, в угле захвачены примеси, такие как сера и азот. Такие примеси, высвобождаемые при сжигании угля,приводят к образованию серной кислоты и азотной кислоты, если выделяются в атмосферу, и отходящий газ типичной электростанции, работающей на угле, следует от них очищать. Кроме того, когда уголь сжигают, углерод соединяется с кислородом из атмосферы и образует СО 2 - хорошо известный "парниковый" газ, удерживающий земное тепло. Согласно настоящему изобретению, когда уголь 702 обрабатывают в установке 706 гидрирования обрабатывающим водородным газом 705, уголь не сжигается. Скорее его нагревают для удаления летучих компонентов, имеющихся в угле. Такие летучие компоненты преимущественно образуют продукт в виде газа с высоким BTU, состоящего большей частью из метана. Остаток от удаления летучих веществ очищают, воздействуя водородом, причем удаляют серу и азот, и полученный очищенный уголь (т.е. кокс 707) можно: (а) сжигать в обычном котле с метаном и без излишнего образования вредных побочных продуктов; (b) превратить в монооксид углерода и водород, которые добавляют к метану из реактора 706 гидрирования для получения газа со средним BTU для сжигания; (с) активировать кислородом и водяным паром с образованием активированного угля 716; или (d) использовать в некоторой комбинации перечисленных способов. Поток метансодержащего газа, полученного реакцией гидрирования, можно пропустить через котел-утилизатор 708 для рационального использования теплотворной способности газового потока. Затем можно использовать скруббер 710 с известняком, известью или аммиаком для удаления из потока метансодержащего газа загрязнений, таких как сера, причем посредством этого получают метансодержащий газ 712 высокой степени чистоты. Сера в угле будет образовывать сероводород (H2S), который можно- 13005832 удалить из потока метансодержащего газа. Выгодно очищать поток метансодержащего газа перед сжиганием, если оно предполагается, так как сжигание создает газовый поток большего объема. Газ метан можно сжечь на месте для получения электроэнергии или можно обработать для удаления СО (если он есть) и поставить потребителям в виде очень сухого газа. Кроме того, часть СН 4 можно вернуть на операции в других установках для снабжения процесса теплом. Например, часть СН 4 можно отвести в парообразователь 714 водяного пара. Обработка водородом выгодно удаляет примеси, имеющиеся в угле 702, причем получают продукт в виде чистого кокса (кокосовый продукт) 707. Кокс 707 при необходимости можно обработать в установке активации/окисления 718 с образованием (а) чистого активированного угля 716; (b) чистого кокса;(с) смешанного газа, состоящего из водорода и монооксида углерода; или (d) использовать в некоторой комбинации перечисленных способов. Согласно одному из вариантов воплощения настоящего изобретения часть кокса 707 можно вернуть в реактор восстановления оксида металла (фиг. 5) для восстановления оксида металла. Уголь будет превращаться в СО и золу, уходящую в шлак, который можно периодически выгружать. Оставшийся кокс из установки 706 гидрирования можно сжигать в обычном котле с метаном для получения дополнительной энергии. Кроме того, часть водорода 705, полученного восстановлением водяного пара, можно отвести из установки 706 гидрирования и использовать непосредственно в качестве источника топлива либо отдельно, либо в комбинации с метаном. Например, водород можно непосредственно сжечь в котле, двигателе внутреннего сгорания или топливном элементе. Как описано выше, основным сырьем для установки гидрирования по настоящему изобретению может быть низкосортный уголь, а также высокосортный уголь. Действительно, использование низкосортного угля в качестве сырья может быть выгодно, так как такой уголь, как правило, доступен по низкой цене. В одном из вариантов воплощения угольное сырье представляет собой низкосортный уголь с содержанием серы по меньшей мере 1 мас.%, предпочтительнее - по меньшей мере примерно 2 мас.%. Уголь можно предварительно обработать, например, измельчить уголь и удалить влагу. Например, желательно измельчить уголь для уменьшения максимального размера частиц до величины не более примерно 1 мм. Когда сырье представляет собой измельченный уголь, процесс гидрирования приводит к тонкоизмельченному углеродистому продукту высокой степени чистоты. Обработка водородом согласно настоящему изобретению превращает содержащиеся в угле летучие вещества (например, углеводороды) в метан. Предпочтительно по меньшей мере примерно 90 мас.%,предпочтительнее - по меньшей мере примерно 95 мас.% и еще предпочтительнее - по меньшей мере примерно 99 мас.% летучих веществ превращаются в метан. Как описано выше, уголь часто содержит загрязняющие примеси, в том числе много серы. Способ настоящего изобретения позволяет выгодно и одновременно удалять загрязнения из фракции летучих веществ угля, а также из остаточного кокса. Сера, например, взаимодействует с водородом и образует сероводород, который можно легко удалить из потока отходов. Кроме того, способ настоящего изобретения делает возможным получение энергии из угольного сырья, причем в то же время производится существенно меньше диоксида углерода на киловатт-час производимой энергии, чем в типичном случае производит обычная электростанция, работающая на основе сжигания угля. Такое низкое соотношение диоксида углерода и киловатт-часов производимой электроэнергии возникает потому, что по способу настоящего изобретения, т.е. уголь - твердое топливо, превращается в газообразное топливо со средним BTU. Эффективность превращения тепловой энергии в электрическую (выраженная в процентах) для твердого топлива колеблется от двадцати с лишним до тридцати с небольшим, в то время как для газообразного топлива конверсия тепла в электричество составляет 55-60%. Уменьшение выброса диоксида углерода является фактором, важным для окружающей среды, и добавляет способу ценности. Как описано выше, уголь, который получают в установке гидрирования, может представлять собой активированный уголь. Активированный уголь является аморфной формой углерода, отличающейся высокой адсорбционной способностью в отношении многих газов, паров и коллоидных твердых веществ. Площадь внутренней поверхности активированного угля превышает несколько сотен м 2/грамм, а плотность не превышает примерно 0,85 г/см 3. Активированный уголь имеет большую ценность и может использоваться для очистки воздуха и воды, обработки отходов, удаления ртути (Нg) и SOx из дымовых газов и т.п. Таким образом, способ гидрирования, примененный к углю, дает поток газа с высоким BTU,а также ценный побочный продукт. Кроме угля, подобным образом можно обрабатывать другое углеводородсодержащее сырье для получения ценного газообразного продукта, содержащего метан (СН 4). Сырье загружают в установку гидрирования, где оно при повышенной температуре контактирует с большими объемами содержащего H2 газа, так что часть сырья превращается в СН 4. Одно из преимуществ настоящего изобретения состоит в том, что сырье может быть действительно любым содержащим углеводороды сырьем, в том числе сырьем, доступным по весьма низкой цене, илидаже по цене ниже себестоимости.- 14005832 В одном из вариантов воплощения сырье представляет собой городские отходы. Городские отходы могут содержать обычный бытовой и коммерческий мусор, опасные отходы, отходы животноводства,осадки сточных вод, автомобильный измельченный мусор (automobile shredder refuse, ASR), утильные резиновые покрышки и подобное. Городские отходы обычно доступны по чистой отрицательной цене,так как города будут, как правило, платить вознаграждение ("чаевые") за удаление и уничтожение отходов. Согласно сведениям Управления по защите окружающей среды (Enviromental Protection Agency,EPA) Соединенных Штатов, в США в 1998 г. было образовано 220 миллионов тонн городских отходов. Количество отходов на душу населения неуклонно возрастает - от 2,7 фунтов на человека в день в 1960 г. до 3,7 фунтов на человека в день в 1980 г. и до примерно 4,5 фунтов на человека в день в 1998 г. Компоненты городских отходов (перед повторным использованием) в США в 1998 г. согласно EPA приводятся в табл. 3. Таблица 3 Средний состав городских отходов Когда сырье представляет собой городские отходы, сырье при необходимости можно обработать и рассортировать. Например, металлы с магнитными свойствами, такие как железо и сталь, можно легко удалить и продать на лом. Необязательно, также можно удалить из сырья материалы на основе целлюлозы (например, бумагу и древесину) для снижения содержания в сырье соединений кислорода. Например,можно использовать пневмосортирование для отделения такой легкой и относительно сухой фракции отходов, которую составляют, например, бумага и картон, обрезки деревьев и древесина. Остальной материал, содержащий пищевые отходы, пластик, резину, кожу, цветные металлы и стекло, можно разделить гидравлической классификацией. Цветные металлы и стекло можно повторно использовать в другом месте. Как описано выше, термин "городские твердые отходы" может включать в себя не только бытовые и общие коммерческие отходы, но также и специфические отходы, такие как автомобильный измельченный мусор (ASR) или "бумажную пыль". ASR, т.е. по существу неметаллические компоненты перерабатываемого автомобиля, является неоднородной смесью пластика, стекла, резины, волокон, неизвлеченных металлов и грязи. Пластиковый компонент ASR, как правило, составляет примерно 20 маc.% и постоянно возрастает, так как возрастает количество пластиковых материалов, используемых при производстве автомобилей. ASR в настоящее время сваливают на свалки, и в ряде регионов предлагаются законы о классификации ASR как опасных отходов, резко повышающей стоимость сброса. Таким образом,конверсия ASR в полезный газ может дать возможность существенного улучшения окружающей среды и экологии. Городские отходы, подобно углю, можно распределить на летучие вещества и связанный углерод,применяя нагревание. Химический состав летучих веществ, образующихся из городских отходов, можно в общем виде представить как СНx. Таким образом, реакцию, которая может происходить, когда отходы вводят в контакт с большим объемом водорода, можно представить в виде 0,5(4-х)Н 2 + СНxСН 4(9) Таким образом, можно выгодно получить большой объем горючего газа из отходов согласно способу настоящего изобретения. Примерно 48550 кубических футов газа, содержащего примерно 19,9 миллионов BTU, можно получить из 1 т городских отходов. Газ состоит из примерно 82% монооксида углерода, 16% метана и 2% водорода и содержит примерно 410 BTU на кубический фут. Согласно другому варианту воплощения сырье может представлять собой углеводородсодержащие вещества, такие как сырая нефть, битуминозный песок или подобное вещество. Сырая нефть представляет собой смесь жидких углеводородов, извлеченных из земной коры для использования в качестве топлива и различных нефтепродуктов. Поскольку сырая нефть представляет собой смесь весьма разных со- 15005832 ставляющих в разных пропорциях, физические свойства изменяются в широких пределах, и многие виды сырой нефти имеют очень низкую ценность из-за присутствующих в них загрязнений. Настоящее изобретение дает выгодную возможность перерабатывать такие низкосортные виды сырой нефти в полезный газ. Битуминозный песок представляет собой осадок сыпучего песка или частично отвердевшего песчаника, насыщенный высоковязким битумом. Нефть, извлеченная из песков, как правило, относят к синтетическому сырью, и она является потенциально существенной формой ископаемого топлива. Однако извлечение нефти из битуминозного песка является трудным и дорогостоящим. Настоящее изобретение дает выгодную возможность получения полезного газа из песка, низкосортного в других отношениях. Также следует понимать, что в качестве сырья можно использовать сочетание двух или большего числа вышеописанных компонентов. Например, поток рассортированных городских отходов можно дополнить угольной пылью. Еще один аспект настоящего изобретения относится к получению аммиака с использованием в качестве реагентов газообразных водорода и азота. Одним из важных аспектов способа по настоящему изобретению является получение in situ больших количеств Н 2 при относительно низкой стоимости. Полагают, что одним из основных препятствий для способов получения аммиака, описанных в известном уровне техники, является потребность в больших объемах водорода и высокая стоимость, связанная с газообразным водородом. Согласно настоящему изобретению большие объемы газообразного водорода можно получить экономично in situ. Согласно настоящему изобретению азот и водород соединяют в молярном соотношении H2:N2 примерно 3:1 для того, чтобы максимизировать получение аммиака (NН 3). В типичном способе получения аммиака газ, содержащий водород и азот, сжимают до давления примерно 200 атм над железным катализатором при температуре от примерно 380 до примерно 450 С. Способ получения аммиака, включающий в себя вышеописанные способы получения водорода и азота, иллюстрируется на фиг. 8. Для получения водорода воду 801 подают в котел 802, и полученный водяной пар подают в один из реакторов 810 или 812. Затем полученный газообразный водород подают в конденсатор 820 для удаления воды и далее подают в контур 848 синтеза аммиака. Одновременно воздух 800 подают в реактор 811 окисления для отделения кислорода от воздуха и получения потока 825 газообразного азота. В варианте воплощения, показанном на фиг. 8, реактор 811 представляет собой реактор окисления металла, в то время как реактор 813 является реактором восстановления оксида металла. Преимущественно можно использовать один реактор для получения восстанавливающего газа для обеих операций получения водорода и получения азота. Таким образом, газообразный водород 824 и газообразный азот 825 подают в контур 848 синтеза аммиака. Контур синтеза аммиака предпочтительно работает при повышенном давлении, например, до примерно 200 атм. Кроме того, контур синтеза аммиака работает при повышенной температуре и может включать в себя катализатор. Получение аммиака из водорода и азота описывается в патенте США 4600571, McCarroll et al.; патенте США 4298588, Pinto и патенте США 4088740, Gaines. Каждый из вышеуказанных патентов США включен в данное описание в качестве ссылки со всей своей полноте. Полученный аммиак можно использовать в ряде применений. Например, аммиак можно превратить в мочевину для применения в качестве удобрений. Также аммиак можно использовать для снижения выбросов NOx на электростанциях, работающих на основе сжигания угля, и для получения различных аммонийсодержащих соединений. Хотя различные варианты воплощения настоящего изобретения описаны подробно, очевидно, что специалисты в данной области техники могут осуществить различныемодификации и адаптации указанных вариантов воплощения. Однако следует ясно представлять, что такие модификации и адаптации входят в пределы сущности и объема настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения потока водородсодержащего газа, включающий в себя стадииb) контактирования упомянутого водяного пара в реакторе с расплавленной смесью металлов, содержащей по меньшей мере примерно 20 мас.% железа, растворенного в первом металле-разбавителе,причем упомянутый первый металл-разбавитель представляет собой олово, и при этом по меньшей мере часть упомянутого железа окисляется до оксида железа и по меньшей мере часть упомянутого водяного пара восстанавливается с образованием водорода; иc) извлечения упомянутого потока водородсодержащего газа из упомянутого реактора. 2. Способ по п.1, в котором упомянутая расплавленная смесь металлов также содержит второй химически активный металл. 3. Способ по п.1, в котором упомянутая расплавленная смесь металлов также содержит второй металл-разбавитель.- 16005832 4. Способ по п.1, в котором в упомянутой расплавленной смеси металлов диспергированы твердые частицы, содержащие железо. 5. Способ по п.4, в котором упомянутая расплавленная смесь металлов во время упомянутой стадии контактирования с водяным паром находится при температуре от примерно 895 С до примерно 1134 С. 6. Способ по п.1, в котором упомянутая расплавленная смесь металлов во время упомянутой стадии контактирования с водяным паром находится при температуре ниже примерно 1538 С. 7. Способ по п.1, в котором упомянутая расплавленная смесь металлов во время упомянутой стадии контактирования с водяным паром находится при температуре не выше примерно 1400 С. 8. Способ по п.1, в котором упомянутая расплавленная смесь металлов во время упомянутой стадии контактирования с водяным паром находится при температуре от примерно 1134 С до примерно 1300 С. 9. Способ по п.1, в котором упомянутая расплавленная смесь металлов во время упомянутой стадии контактирования с водяным паром находится при температуре от примерно 1200 до примерно 1300 С. 10. Способ по п.1, в котором упомянутый поток водородсодержащего газа содержит по меньшей мере примерно 30 об.% газообразного водорода. 11. Способ по п.1, также включающий в себя стадию извлечения воды из упомянутого потока водородсодержащего газа. 12. Способ по п.1, в котором упомянутая стадия контактирования с водяным паром включает в себя вдувание водяного пара в упомянутую расплавленную смесь металлов с использованием погруженной сверху фурмы. 13. Способ по п.1, также включающий в себя стадию контактирования упомянутого оксида железа с восстановителем для восстановления упомянутого оксида железа обратно до железа. 14. Способ по п.1, также включающий в себя стадию добавления флюса в упомянутую расплавленную смесь металлов для способствования образованию слоя шлака над упомянутой расплавленной смесью металлов. 15. Способ по п.1, также включающий в себя стадию добавления в упомянутую расплавленную смесь металлов флюса, выбранного из группы, состоящей из SiO2, FeO, CaO, MgO, Na2O, K2 О и их смесей, для способствования образованию слоя шлака над упомянутой расплавленной смесью металлов.
МПК / Метки
МПК: C01B 3/08
Метки: способ, водорода, получения
Код ссылки
<a href="https://eas.patents.su/21-5832-sposob-polucheniya-vodoroda.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения водорода</a>