Производные дитерпеноидов, обладающие биологическими свойствами
Номер патента: 21536
Опубликовано: 30.07.2015
Авторы: Феррари Патриция, Бьянки Джузеппе, Гоббини Мауро, Черри Альберто, Торри Марко, Ферранди Мара
Формула / Реферат
1. Соединение, имеющее общую формулу I
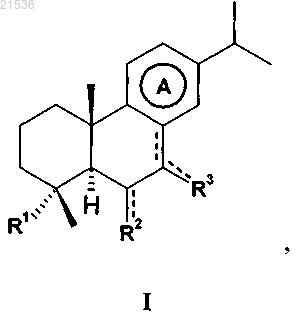
где R1 представляет собой -CH=NOR4 со значением иминокси, -CH2NHOR4, -CH2XR5, -CH=CHR6, -CH=NR7 или амино(С3-С6)алкил;
R7 представляет собой гуанидино;
R6 представляет собой амино(C1-C6)алкил;
R5 представляет собой амино(C1-C6)алкил;
R4 представляет собой Н, амино(С2-С6)алкил, (C3-C6)гетероциклоалкил, гидрокси(С2-С6)алкил, или гидрокси(С2-С6)алкилокси(С2-С6)алкил, или карбоксиалкил;
X представляет собой О или S;
эндоциклический символ --- представляет собой одинарную или двойную связь, в случае, когда он представляет собой двойную связь, символ ---, соединяющий R3 с карбоциклом, представляет собой одинарную связь, а карбоциклическое кольцо А является частично ненасыщенным;
символ ---, соединяющий R2 с карбоциклом, представляет собой одинарную или двойную связь;
R2 представляет собой Н или гидроксил, когда символ ---, соединяющий R2 с карбоциклом, представляет собой одинарную связь; или
R2 представляет собой О или N~OR8, когда символ ---, соединяющий R2 с карбоциклом, представляет собой двойную связь, со значением карбонила или оксима соответственно;
R8 представляет собой H или (C1-C6)алкил;
символ ---, соединяющий R3 с карбоциклом, представляет собой одинарную или двойную связь;
R3 представляет собой Н, когда символ ---, соединяющий R3 с карбоциклом, представляет собой одинарную связь; или
R3 представляет собой О или N~OR8, когда символ ---, соединяющий R3 с карбоциклом, представляет собой двойную связь, со значением карбонила или оксима соответственно;
карбоциклическое кольцо А является ароматическим или частично ненасыщенным; при условии что, когда R4 представляет собой Н, R2 не представляет собой Н;
их оптически активные формы, такие как энантиомеры, диастереомеры, их рацематные формы и их фармацевтически приемлемые соли.
2. Соединение по п.1, отличающееся тем, что R1 представляет собой -CH=NOR4.
3. Соединение по любому из пп.1, 2, отличающееся тем, что R4 представляет собой амино(С2-С6)алкил или (C3-C6)гетероциклоалкил.
4. Применение соединений по любому из пп.1-3 в качестве лекарственного средства для предотвращения и/или лечения гипертонии, сердечной недостаточности, гипертрофии сердца, почечной недостаточности, гломерулосклероза, протеинурии и стеноза сосудов после хирургической операции на сосудах.
5. Применение по п.4, где сердечно-сосудистое заболевание представляет собой гипертонию.
6. Применение по п.5, где гипертония обусловлена действием эндогенного уабаина.
7. Способ лечения пациента, страдающего гипертонией, сердечной недостаточностью, гипертрофией сердца, почечной недостаточностью, гломерулосклерозом, протеинурией и стенозом сосудов после хирургической операции на сосудах, включающий введение соединения по пп.1-3.
8. Фармацевтическая композиция, содержащая соединение по пп.1-3 совместно с фармацевтически приемлемым наполнителем.
9. Способ синтеза соединений по п.1, где символ R1 представляет собой -CH=NOR4 со значением иминокси; карбоциклическое кольцо А является ароматическим или частично ненасыщенным, a R2 и R3 такие, как определено в п.1, включающий осуществление реакции соединения формулы II
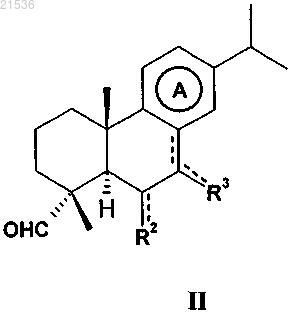
где карбоциклическое кольцо А является ароматическим или частично ненасыщенным;
R2 и R3 такие, как определено выше,
с соединением формулы (III)
где R4 такой, как определено выше;
x представляет собой целое число от 0 до 3,
в пиридине при комнатной температуре.
Текст
Изобретение относится к новым производным дитерпеноидов формулы I, способам их получения и фармацевтическим композициям, содержащим указанные соединения, для лечения сердечно-сосудистых заболеваний, недержания мочи, астмы или болезни Альцгеймера и/или для предотвращения обструктивных поражений сосудов вследствие артериотомии и/или ангиопластики и для предотвращения повреждения органов у пациентов, страдающих гипертонией.(71)(73) Заявитель и патентовладелец: СИГМА-ТАУ ИНДУСТРИЕ ФАРМАСЬЮТИКЕ РИУНИТЕ С.П.А. Настоящее изобретение относится к новым производным дитерпеноидов, способу их получения и фармацевтическим композициям, содержащим указанные соединения, для предотвращения и/или лечения сердечно-сосудистых нарушений, обструктивных поражений сосудов вследствие артериотомии и/или ангиопластики и для предотвращения повреждения органов у пациентов, страдающих гипертонией. Уровень техники Соединения согласно настоящему изобретению относятся к классу производных дитерпеноидов и,как было показано, обладают действием в отношении сердечно-сосудистой системы, что позволяет применять их для предотвращения и/или лечения гипертонии, сердечной недостаточности, гипертрофии сердца, почечной недостаточности, гломерулосклероза, протеинурии, стеноза сосудов после хирургической операции на сосудах и для предотвращения повреждения органов у пациентов, страдающих гипертонией. Сердечно-сосудистые заболевания по-прежнему являются первопричиной заболеваемости и смертности в западном мире; среди этих заболеваний двумя наиболее распространенными заболеваниями являются гипертония и сердечная недостаточность. Гипертония является одним из наиболее значимых факторов риска сердечно-сосудистых заболеваний, при этом данным заболеванием страдает более 1/3 населения старше 60 лет. Застойная сердечная недостаточность поражает 1-2% населения и даже 10% пожилых людей; ожидается, что данный процент будет повышаться (Sharpe N., et al., The Lancet, 1998,352, (suppl. 1), 3-17). Кроме того, гипертония может являться одной из наиболее важных причин сердечной недостаточности у пожилых людей (Remme W.J., et al., Eur. Heart J., 2001, 22, 1527-1560). Несмотря на то что существует ряд эффективных лекарственных средств для лечения как гипертонии, так и сердечной недостаточности, проводятся дополнительные исследования для обнаружения более эффективных и более безопасных соединений. Некоторые лекарственные средства используют в комбинации для лечения сердечной недостаточности, при этом среди агентов с положительным инотропным действием наиболее часто назначаемым сердечным гликозидом наперстянки, способным повышать производительность миокарда, является дигоксин (digoxin). Однако очень хорошо известным недостатком лекарственных средств на основе наперстянки является их аритмогенный побочный эффект. Признаки токсичности наперстянки, такие как нарушения проводимости и сердечные аритмии, которые являются характеристиками токсичности наперстянки (Hoffman, B.F., et al., Digitalis and Allied Cardiac Glycosides; The Pharmacological Basis of Therapeutics, 8th ed.; Goodman Gilman A.; Nies A.S., Rail T.W., Taylor P., Eds.; PergamonPress, New York, 1990, 814-839), появляются при концентрации в сыворотке крови, в 2-3 раза превышающей терапевтическую дозу. Соединения согласно настоящему изобретению подходят для предотвращения и/или лечения сердечно-сосудистых заболеваний. Действительно, указанные соединения способны противодействовать эффектам мутантного -аддуцина и уабаина, оба из которых, как известно, вовлечены в гипертонию у человека и связанные с ней осложнения в органах и гипертрофию сердца и/или сердечную недостаточность. Более того, соединения согласно настоящему изобретению не ингибируют Na-K АТФазный насос и,следовательно, не вызывают проблем с точки зрения безопасности (например, аритмогенных побочных эффектов), связанных с таким ингибированием. Эндогенный уабаин (ЕО) нашел широкое признание в качестве нового гормона, способного регулировать кровяное давление за счет различных механизмов и, в частности за счет модулирования обменаNa в почках. Более того, было обнаружено, что высокие уровни ЕО в кровотоке связаны с гипертрофией сердца и почек в моделях на животных, таких как модель гипертонии, вызванной уабаином, у крыс(Pierdomenico S.D., et al., Am. J. Hypertens., 2001, 14, I, 44; Stella P., et al., J. Int. Med., 2008, 263, 274). Было обнаружено, что мутации в генах, кодирующих белок цитоскелета аддуцин, связаны с гипертонией и связанными с ней осложнениями в органах (Bianchi G., et al., Hypertension, 2005, 45, 3, 331). В частности, аддуцин вовлечен во многие клеточные процессы, некоторые из которых подвержены влиянию мутаций и имеют отношение к гипертонии и связанным с ней осложнениям в органах, такие как:i) регуляция времени удержания некоторых интегральных белков на клеточной поверхности (Na-K АТФаза, интегрин) (Efendiev R., et al., Circ. Res., 2004, 95, 11, 1100; Torielli L., et al., Am. J. Renal Physiol.,2008, 295, 2, F478);ii) влияние на конститутивную способность реабсорбции Na+ тубулярными клетками почек (Bianchiiii) регуляция экспрессии некоторых клубочковых белков подоцитов (нефрон, синаптоподин), связанных с протеинурией и прогрессированием повреждения почек как в моделях на животных, так и у людей (Ferrandi M., et al, J. Mol. Med., 2010, 88, 203). Экспериментальные данные, полученные как в модели гипертонии у крыс миланской линии (MHS),так и у людей, подтверждают роль полиморфизмов аддуцина в гипертонии и связанном с ней осложнении в органах, включая ухудшение функции почек и протеинурию (Citterio L., et al., Biochim. Biophys. Как EO, так и мутантный аддуцин могут приводить к гипертонии, гипертрофии органов, почечной недостаточности, протеинурии, отрицательному ремоделированию сосудов и повышению риска сердечно-сосудистых заболеваний за счет повышающей регуляции Na-K-насоса, активации Src-зависимого пути трансдукции сигнала или других путей, модулирующих актиновый цитоскелет. Было обнаружено, что производные абиетиновой кислоты и дегидроабиетиновой кислоты, являющиеся объектами настоящего изобретения, обладают подходящими фармакологическими свойствами в отношении сердечно-сосудистой системы и/или способны предотвращать повреждение органов и/или предотвращать протеинурию. В частности, было обнаружено, что производные абиетиновой кислоты или дегидроабиетиновой кислоты, являющиеся объектами настоящего изобретения, противодействуют действию ЕО и мутантного аддуцина на кровяное давление и ухудшению функции почек, а также протеинурии. Другая важная биологическая активность соединений согласно настоящему изобретению заключается в их способности уменьшать протеинурию, индуцируемую эндогенным уабаином, и предотвращать повреждение органов. Было описано, что некоторые производные дегидроабиетиновой кислоты обладают противоязвенными свойствами (Wada H., et al., Chem. Pharm. Bull., 1985, 33, 4). В WO 2005/084141 предложено конкретное дегидроабиетановое производное 1, обладающее указанными свойствами за счет способности ингибировать ацил-CoA:холестерин-ацилтрансферазу. В EP 1421936 (т.е. национальной фазе WO 2002/087559 в Европе, по которой в настоящее время получен отказ) были описаны производные веществ, открывающих калиевые каналы, формулы 2. Однако среди них специально сообщалось только о трех производных, структурно отличающихся от соединений согласно настоящему изобретению. Авторы данного изобретения также опубликовали дополнительные данные, касающиеся указанных соединений формулы 2, подтверждающие тот факт, что производные абиетиновой кислоты не были активны в отношении большой проводимости K+, несмотря на совсем небольшие различия в их химических структурах каналов в противоположность описанным производным пимаровой кислоты В WO 10/024298 предложены производные модулятора калиевых каналов формулы 3, которые структурно отличаются от соединений согласно настоящему изобретению Также около 40 лет назад сообщалось о получении очень малого числа противоаритмических соединений, получаемых в результате этерификации абиетиновой кислоты (Sefcovic P., et al., ChemickeZvesti, 1961, 15, 554); однако соединения согласно настоящему изобретению не были описаны или предложены. Был предложен энантиоселективный и каталитический синтез оксимового производного абиетиновой кислоты с использованием в качестве исходных веществ соответствующего энантиочистого нитроаналога (Czekelius С, et al., Angew. Chem. Int. Ed., 2005, 44, 612). Более 40 лет назад был описан синтез производных дегидроабиетиновой кислоты, обусловленный известными антибактериальными свойствами указанных каркассодержащих аддуктов (von Rudolf A., et Тем не менее, как следует из литературы, по-прежнему существует потребность в разработке новых производных, обладающих подходящими фармакологическими свойствами в отношении сердечнососудистой системы и/или способных предотвращать повреждение органов и/или протеинурию. Описание изобретения Настоящее изобретение относится к новым производным абиетиновой кислоты и дегидроабиетиновой кислоты формулы I или их соли, гидрату или сольвату для получения композиции для предотвращения и/или лечения гипертонии, сердечной недостаточности, гипертрофии сердца, почечной недостаточности, гломерулосклероза, протеинурии, стеноза сосудов после хирургической операции на сосудах и для предотвращения повреждения органов у пациентов, страдающих гипертонией: в которой R1 представляет собой -CH=NOR4 со значением иминокси, -CH2NHOR4, -CH2XR5,-CH=CHR6, -CH=NR7, амино(C3-C6)алкил или гетероциклоалкилалкил, где гетероциклоалкильный фрагмент выбран из группы, состоящей из пиперидинила, пирролидинила и тетрагидрофуранила;R6 представляет собой амино(C1-C6)алкил или гетероциклоалкилалкил, где гетероциклоалкильный фрагмент выбран из группы, состоящей из пиперидинила, пирролидинила и тетрагидрофуранила;R5 представляет собой амино(C1-C6)алкил или гетероциклоалкилалкил, где гетероциклоалкильный фрагмент выбран из группы, состоящей из пиперидинила, пирролидинила и тетрагидрофуранила;X представляет собой О или S; эндоциклический символ представляет собой одинарную или двойную связь, в случае, когда он представляет собой двойную связь, символ, соединяющий R3 с карбоциклом, представляет собой одинарную связь, а карбоциклическое кольцо А является частично ненасыщенным;, соединяющий R2 с карбоциклом, представляет собой одинарную или двойную связь; символ 2, соединяющий R2 с карбоциклом, представляет собой одинарную связь; или, соединяющий R2 с карбоциклом, представляет собой двойную связь, со значением карбонила или оксима соответственно;, соединяющий R3 с карбоциклом, представляет собой одинарную или двойную связь; 3, соединяющий R3 с карбоциклом, представляет собой одинарную связь; или, соединяющий R3 с карбоциклом, представляет собой двойную связь, со значением карбонила или оксима соответственно; карбоциклическое кольцо А является ароматическим или частично ненасыщенным; при условии что, когда R4 представляет собой Н, R2 не представляет собой Н; их оптически активным формам, таким как энантиомеры, диастереомеры, их рацематным формам и их фармацевтически приемлемым солям. Вариантом реализации настоящего изобретения является вариант соединений формулы I для применения в качестве лекарственных средств. В другом варианте реализации указанное лекарственное средство применяют для предотвращения и/или лечения сердечно-сосудистых заболеваний, обструктивных поражений сосудов вследствие артериотомии и/или ангиопластики и для предотвращения повреждения органов у пациентов, страдающих гипертонией. В предпочтительном варианте реализации указанное лекарственное средство применяют для предотвращения и/или лечения гипертонии, сердечной недостаточности или для предотвращения повреждения органов у пациентов, страдающих гипертонией. Если не указано иное, термин "алкил" относится к линейным или разветвленным алкильным группам, содержащим от 1 до 20 атомов углерода, или предпочтительно от 1 до 12 атомов углерода, или еще более предпочтительно от 1 до примерно 6 атомов углерода. Термин "амино" относится к группе -NH2. Термин "амино(C1-C6)алкил" относится к алкильной группе, содержащей до 6 атомов углерода, определенной выше, содержащей в качестве заместителей аминогруппу, определенную выше. Термин "гетероциклоалкил" относится к насыщенному или частично ненасыщенному (но не ароматическому) 5-, 6- или 7-членному кольцу, содержащему один или более атомов азота, кислорода или серы, которые могут быть одинаковыми или разными, при этом указанные кольца могут содержать в качестве заместителей низший алкил, низший алкенил или арил. Предпочтительный гетероциклоалкил включает пирролидин, пиперидин, пиперазин, кетопиперазин, 2,5-дикетопиперазин, морфолин, тиоморфолин,дигидропиранил, тетрагидропиранил, тетрагидрофуран, дигидропиррол, имидазолидин, дигидропиразол,пиразолидин и т.п. Еще более предпочтительным гетероциклоалкилом является пирролидин, пиперидин,пиперазин и морфолин. Термин "гидроксиалкил" относится к алкильной группе, определенной выше, содержащей в качестве заместителей гидроксильную группу. Термин "алкилокси" относится к группе -O-R, где R включает "(C1-C6)алкил", "(C3-C10)циклоалкил" и "гетероциклоалкил". Термин "алкилоксиалкил" относится к алкильной группе, определенной выше, содержащей в качестве заместителей алкилоксигруппу, определенную выше. Термин "гидроксиалкилоксиалкил" относится к алкилоксиалкильной группе, определенной выше,содержащей в качестве заместителей гидроксильную группу. Термин "карбоксиалкил" относится к алкильным группам, определенным выше, содержащим карбоксизаместитель. Предпочтительный карбоксиалкил представляет собой группы, в которых алкильный радикал содержит от 1 до 6 атомов углерода, включая 2-карбоксиметил, 2-карбоксиэтил и т.п. Термин "фармацевтически приемлемые соли" относится к солям ниже определенных соединений формулы I, которые сохраняют желаемую биологическую активность. Примеры таких солей включают,но не ограничиваются ими, соли присоединения кислот, образованные неорганическими кислотами (например, соляная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота, азотная кислота и т.п.), и соли, образованные органическими кислотами, такими как уксусная, щавелевая, винная, янтарная, яблочная, фумаровая, малеиновая, аскорбиновая, бензойная, дубильная, памовая, альгиновая, полиглутаминовая, нафталинсульфоновая, толуолсульфоновая, нафталиндисульфоновая, метансульфоновая и полигалактуроновая кислоты. Когда соль представляет собой соль монокислоты (например, гидрохлорид, гидробромид, п-толуолсульфонат или ацетат), используют по меньшей мере 1 мол.экв. и, как правило, молярный избыток кислоты. Однако когда необходимы такие соли, как сульфат, гемисукцинат, гидрофосфат или фосфат, как правило, используют соответствующие и точные химические эквиваленты кислоты. Подходящие фармацевтически приемлемые соли присоединения основания для соединения согласно настоящему изобретению включают соли металлов, полученные из алюминия,кальция, лития, магния, калия, натрия и цинка, или органические соли, полученные из лизина,N,N'-дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглюмина(N-метилглюкамин) и прокаина. Соли натрия являются наиболее предпочтительными. Кроме того, согласно настоящему изобретению предложен способ получения соединений формулыI, которые могут быть получены, как подробно описано ниже. Соединения общей формулы I, где символ R1 представляет собой -CH=NOR4 со значением иминокси; карбоциклическое кольцо А является ароматическим или частично ненасыщенным и R2 и R3 такие,как определено выше, могут быть получены, например, путем осуществления реакции соединения формулы II где карбоциклическое кольцо А является ароматическим или частично ненасыщенным;x представляет собой целое число от 0 до 3,в пиридине при комнатной температуре. В качестве альтернативы соединения общей формулы I, где символ R1 представляет собой-CH=NOR4 со значением иминокси; карбоциклическое кольцо А является ароматическим или частично ненасыщенным, R2 и R3 такие, как определено выше, могут быть получены, например, путем осуществления взаимодействия соединения формулы (II), определенного выше, с соединением формулы (III), определенным выше, в апротонном растворителе, таком как тетрагидрофуран, в присутствии Во всех указанных превращениях любая интерферирующая реакционноспособная группа может быть защищена, а затем с нее могут быть сняты защитные группы в соответствии с общепринятыми методиками, описанными в органической химии (см., например, Greene Т.W. and P.G.M. Wuts "ProtectiveGroups in Organic Synthesis", J. WileySons, Inc., 3rd Ed., 1999) и хорошо известными специалисту в данной области техники. Все указанные превращения являются лишь примерами общепринятых методик, описанных в органической химии (см., например, J. March "Advanced Organic Chemistry", J. WileySons, Inc., 4th Ed.,1992) и хорошо известных специалисту в данной области техники. Авторы настоящего изобретения обнаружили, что производные формулы I и их фармацевтически приемлемые соли, полученные в соответствии с настоящим изобретением, представляют собой подходящие агенты для предотвращения и/или лечения сердечно-сосудистых заболеваний, обструктивных поражений сосудов вследствие артериотомии и/или ангиопластики и для предотвращения повреждения органов у пациентов, страдающих гипертонией. Следовательно, другим объектом настоящего изобретения является способ лечения млекопитающего, страдающего сердечно-сосудистыми заболеваниями, обструктивными поражениями сосудов вследствие артериотомии и/или ангиопластики, включающий введение терапевтически эффективного количества соединения формулы I, описанного выше. В настоящем описании термин "терапевтически эффективное количество" относится к количеству терапевтического средства, необходимому для лечения, облегчения целевого заболевания или состояния,или для оказания обнаруживаемого терапевтического эффекта. Фармацевтические композиции будут содержать по меньшей мере одно соединение формулы I в качестве активного ингредиента в таком количестве, чтобы обеспечить значительный терапевтический эффект. Композиции, предусмотренные настоящим изобретением, являются полностью традиционными и их получают способами, которые являются общей практикой в фармацевтической промышленности,такими как, например, способы, проиллюстрированные в Remington's Pharmaceutical Science Handbook,Mack Pub. N.Y. - последнее издание. В соответствии с выбранным путем введения композиции будут находиться в твердой или жидкой форме, подходящей для перорального, парентерального или внутривенного введения. Композиции согласно настоящему изобретению содержат наряду с активным ингредиентом по меньшей мере один фармацевтически приемлемый носитель или наполнитель. Они могут, в частности, представлять собой подходящие коадъюванты для составов, например солюбилизирующие агенты, диспергирующие агенты, суспендирующие агенты и эмульгаторы. Для любого соединения терапевтически эффективная доза может быть изначально установлена либо в анализах культур клеток, либо на моделях у животных, как правило, мышей, крыс, морских свинок,кроликов, собак или свиней. Модель у животного также можно использовать для определения соответствующего диапазона концентраций и пути введения. Такую информацию затем можно использовать для определения подходящих доз и путей введения у людей. При расчете эквивалентной дозы для человека (HED) рекомендуется использовать таблицу пересчета, приведенную в Руководстве для промышленности (Guidance for Industry) и документе экспертов (Reviewers document) (2002, Управление США по контролю за качеством пищевых продуктов и лекарственных средств, Роквилл, Мэриленд, США). Точная эффективная доза для субъекта, представляющего собой человека, будет зависеть от тяжести болезненного состояния, общего состояния здоровья субъекта, возраста, массы тела и пола субъекта,питания, времени и частоты введения, комбинации (комбинаций) лекарственных средств, чувствительности реакции и переносимости/ответа на терапию. Данное количество может быть определено путем проведения рутинных экспериментов и по усмотрению врача. В целом, эффективная доза будет составлять от 0,001 до 10 мг/кг, предпочтительно от 0,05 до 50 мг/кг. Композиции могут быть введены пациенту отдельно или могут быть введены в комбинации с другими агентами, лекарственными средствами или гормонами. Лекарственное средство также может содержать фармацевтически приемлемый носитель для введения терапевтического агента. Указанные носители включают антитела и другие полипептиды, гены и другие терапевтические агенты, такие как липосомы, при условии, что указанный носитель сам не индуцирует выработку антител, вредных для индивидуума, получающего композицию, и которые могут быть введены, не вызывая при этом неспецифической токсичности. Подходящие носители могут представлять собой большие, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и частицы неактивных вирусов. Полное описание фармацевтически приемлемых носителей можно найти в Remington's Pharmaceutical Sciences (Mack Pub. Co., N. J. 1991). Фармацевтически приемлемые носители в терапевтических композициях могут дополнительно содержать жидкости, такие как вода, физиологический раствор, глицерин и этанол. Кроме того, в указанных композициях могут присутствовать вспомогательные вещества, такие как смачивающие агенты или эмульгаторы, буферные вещества и т.п. Указанные носители позволяют изго-5 021536 тавливать фармацевтические композиции в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, растворов, суспензий и т.п. для приема пациентом. После получения композиции согласно настоящему изобретению могут быть напрямую введены субъекту. Субъекты, которых лечат, могут представлять собой животных; в частности, можно лечить субъектов, представляющих собой человека. Лекарственное средство согласно настоящему изобретению можно вводить разными путями, включая, но не ограничиваясь ими, пероральное, внутривенное, внутримышечное, внутриартериальное, интрамедуллярное, интратекальное, внутрижелудочковое, трансдермальное или чрескожное применение,подкожные, интраперитонеальные, интраназальные, энтеральные, местные, сублингвальные, интравагинальные или ректальные способы. Композиции для перорального введения могут принимать форму нерасфасованных жидких растворов или суспензий или нерасфасованных порошков. Однако чаще указанные композиции представлены в единичных лекарственных формах для облегчения точного дозирования. Термин "единичные лекарственные формы" относится к физически раздельным объектам, подходящим для использования в качестве единичных доз для введения субъектам, представляющим собой человека, и другим млекопитающим; причем каждая доза содержит заранее определенное количество активного вещества, рассчитанное таким образом, чтобы обеспечить необходимый терапевтический эффект, совместно с подходящим фармацевтическим наполнителем. Типичные дозированные лекарственные формы включают заправляемые дозированные ампулы или шприцы с жидкими композициями или пилюли, таблетки, капсулы и т.п. в случае твердых композиций. В указанных композициях соединение согласно настоящему изобретению, как правило, представляет собой незначительный компонент (от примерно 0,1 до примерно 50 мас.% или предпочтительно от примерно 1 до примерно 40 мас.%), а оставшаяся часть представляет собой различные наполнители или носители и технологические добавки,помогающие образовывать желаемую лекарственную форму. Лечение путем введения доз может представлять собой режим однократных доз или режим многократных доз. Другим объектом настоящего изобретения является применение указанных соединений общей формулы I для получения лекарственного средства, подходящего для лечения сердечно-сосудистых заболеваний, таких как сердечная недостаточность и гипертония. Гипертония поражает примерно 30% населения мира и представляет собой основную предотвращаемую причину ранней заболеваемости и смертности в результате основных явлений в сердечно-сосудистой системе и сосудистых осложнений в органах, таких как коронарная болезнь сердца, хроническая сердечная недостаточность, инсульт, почечная недостаточность, отрицательное ремоделирование сосудов, повреждение сетчатки и когнитивные расстройства (Ritz E., Am. J. Cardiol., 2007, 100(3A), 53J-60J; Messerli F.H., et al., Lancet, 2007, 370, 9587,591). Другим объектом настоящего изобретения являются фармацевтические композиции, содержащие одно или более соединений формулы I, описанных выше, в комбинации с наполнителями и/или фармакологически приемлемыми разбавителями. Рассматриваемые композиции могут наряду с соединениями формулы I содержать известные действующие начала. Другой вариант реализации настоящего изобретения представляет собой способ получения фармацевтических композиций, характеризующийся смешиванием одного или более соединений формулы I с подходящими наполнителями, стабилизаторами и/или фармацевтически приемлемыми разбавителями. Другой вариант реализации настоящего изобретения представляет собой вариант соединений формулы I, описанных выше, где R1 представляет собой -CH=NOR4, где R4 представляет собой амино(C1-C6)алкил или гетероциклоалкил. Следующие проиллюстрированные примеры представляют собой никоим образом не полный перечень того, что настоящее изобретение предполагает защитить.AcOEt: этилацетат,AcOH: уксусная кислота,9-BBN: 9-борабицикло[3.3.1]нонан,ДХМ: дихлорметан,DIAD: диизопропилазодикарбоксилат,ДМСО: диметилсульфоксид,Et2O: диэтиловый эфир,EtOH: этанол,HMPA: гексаметилфосфорамид,H2O2: пероксид водорода,H2SO4: серная кислота,IBX: 2-йодоксибензойная кислота,KOtBu: третбутоксид калия,МеОН: метанол,NaBH3CN: цианоборогидрид натрия,NaH: гидрид натрия,NaHCO3: бикарбонат натрия,NaH2PO4: фосфат натрия,NaOH: гидроксид натрия,Na2SO4: сульфат натрия,Na2S2O3 тиосульфат натрия,NH4OH: гидроксид аммония,PTSA: паратолуолсульфоновая кислота,RT: комнатная температура,ТГФ: тетрагидрофуран. Общие замечания. Колоночную флэш-хроматографию проводили с использованием силикагеля (Merck 230-400 меш). Масс-спектральные данные получали с помощью технологии ионизации электронным ударом при 70 эВ на масс-спектрометре Finnigan INCOS-50 с использованием зонда прямого действия (direct exposureChem., 2010, 45, 811), 33 мг дигидрохлорида 2-аминоэтоксиамина в 1 мл пиридина перемешивали при комнатной температуре в течение 1 ч. Пиридин выпаривали и неочищенную реакционную смесь очищали путем флэш-хроматографии с использованием в качестве элюента ДХМ/МеОН/NH4OH в соотношении 95/5/0,5. Растворитель удаляли под вакуумом и остаток растворяли в МеОН. Добавляли стехиометрическое количество фумаровой кислоты и выпаривали раствор досуха под вакуумом. Соединение, указанное в заголовке, получали в виде белого твердого вещества. Выход: 35% (43 мг). 1H-ЯМР (300 МГц, ДМСО-d6) : 8,70 (bb, 4H), 7,28 (s, 1H), 7,15 (d, 1H), 6,95 (dd, 1H), 6,83 (d, 1H),6,41 (s, 2H), 4,05 (t, 2H), 2,97 (t, 2H), 2,77 (m, 3H), 2,29 (m, 1H), 1,80-1,20 (m, 8H), 1,14 (s, 3H), 1,13 (d, 6H),1,10 (s, 3H). МС: 342 (М+). Соединения из примеров 2-8 синтезировали в соответствии с экспериментальными условиями, описанными в примере 1, с использованием соответствующего амина вместо дигидрохлорида 2-аминоэтоксиамина. Этап солеобразования пропускали для соединений, которые не содержали какуюлибо основную аминогруппу в боковой цепи. Пример 2.(Е)-15-(4-Аминобутоксиимино)-13-изопропилподокарпа-8,11,13-триенфумарат. Соединение, указанное в заголовке, получали просто путем растирания его в смеси AcOEt/Et2O после образования соли. Выход: 49% (100 мг).(Е)- 15-R)-3-Пирролидинилоксиимино)-13-изопропилподокарпа-8,11,13-триенфумарат. Соединение, указанное в заголовке, получали просто путем растирания его в Et2O после образования соли. Выход: 80% (5,10 г). 1(Е)-15-S)-3-Пирролидинилоксиимино)-13-изопропилподокарпа-8,11,13-триенфумарат. Соединение, указанное в заголовке, получали просто путем растирания его в Et2O после образования соли. Выход: 72% (243 мг). 1(Е)-15-(4-Пиперидинилоксиимино)-13-изопропилподокарпа-8,11,13-триенфумарат. Соединение, указанное в заголовке, получали просто путем растирания его в Et2O после образования соли. Выход: 90% (185 мг). 1(Е)-15-(3-Гидроксипропоксиимино)-13-изопропилподокарпа-8,11,13-триен. Очистку путем флэш-хроматографии осуществляли с использованием в качестве элюента смеси нгексан/AcOEt в соотношении 75:25. Выход: 52% (130 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6) : 7,20 (s, 1H), 7,15 (d, 1H), 6,95 (dd, 1H), 6,83 (d, 1H), 4,43 (t, 1H), 3,97(Е)-15-Гуанидиноимино-13-изопропилподокарпа-8,11,13-триен. Раствор 80 мг гидрохлорида аминогуанидина в 0,8 мл 1 н. HCl добавляли к раствору 200 мг 13-изопропилподокарпа-8,11,13-триен-15-альдегида в 1 мл диоксана. Смесь нагревали до 80C в течение 5 ч. После охлаждения удаляли растворитель при пониженном давлении и неочищенную реакционную смесь очищали путем флэш-хроматографии с использованием в качестве элюента ДХМ/MeOH/NH4OH в соотношении 90/10/1. Чистые фракции выпаривали досуха. Соединение, указанное в заголовке, получали в виде белого твердого вещества. Выход: 92% (221 мг). 1(Е)-15-Карбоксиметоксиимино-13-изопропилподокарпа-8,11,13-триен. Раствор 160 мг 2-аминооксиуксусной кислоты в 2 мл H2O добавляли к раствору 200 мг 13-изопропилподокарпа-8,11,13-триен-15-альдегида в 5 мл ТГФ. После перемешивания при комнатной температуре в течение 4 ч удаляли растворитель при пониженном давлении, и неочищенную реакционную смесь очищали путем флэш-хроматографии с использованием в качестве элюента ДХМ/МеОН в соотношении 9:1. Соединение, указанное в заголовке, получали в виде белого твердого вещества. Выход: 91% (230 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6) : 12,64 (bb, 1H), 7,31 (s, 1H), 7,15 (d, 1H), 6,95 (dd, 1H), 6,84 (d, 1H),4,44 (s, 2H), 2,76 (m, 3H), 2,28 (m, 1H), 1,80-1,20 (m, 8H), 1,14 (d, 6H), 1,13 (s, 3H), 1,07 (s, 3H). МС: 357 (М+). Пример 11.(Е)-15-(2-Аминоэтоксиимино)-13-изопропил подокарпа-8,11,13-триен-6-она фумарат. Этап А. Метил-7-оксо-13-изопропилподокарпа-8,11,13-триен-15-карбоксилат. Раствор 5,72 г CrO3 в 100 мл AcOH/H2O в соотношении 4:1 добавляли при 10C в течение 15 мин и при энергичном перемешивании к раствору 5,00 г метил-13-изопропилподокарпа-8,11,13-триен-15 карбоксилата (Gonzalez M.A., et al., Eur. J. Med. Chem., 2010, 45, 811) в 80 мл AcOH. Затем реакционную смесь охлаждали до 4C и перемешивали в течение 2 дней перед вливанием в 500 мл H2O, и несколько раз экстрагировали Et2O. Объединенные органические экстракты промывали Н 2 О, 5% вод. NaHCO3 до достижения нейтрального рН и солевым раствором. Органическую фазу сушили над Na2SO4, и удаляли растворитель при пониженном давлении. Остаток очищали путем флэш-хроматографии с использованием смеси циклогексан/AcOEt в соотношении 95/5 с получением желаемого аддукта. Выход: 58% (3,05 г). 1H-ЯМР (300 МГц, ДМСО-d6) : 7,68 (d, 1H), 7,50 (dd, 1H), 7,40 (d, 1H), 3,59 (s, 3H), 2,90 (m, 1H),2,80 (dd, 1H), 2,48 (dd, 1H), 2,38 (m, 1H), 2,09 (dd, 1H), 1,75-1,40 (m, 5H), 1,26 (s, 3H), 1,20 (s, 3H), 1,18 (d,6H). МС: 328 (М+). Этап В. Метил-7-ацетокси-13-изопропилподокарпа-6,8,11,13-тетраен-15-карбоксилат. Раствор 4,30 г метил-7-оксо-13-изопропилподокарпа-8,11,13-триен-15-карбоксилата и 0,25 мг PTSA в 51 мл изопропенилацетата нагревали в колбе с обратным холодильником в течение 3 дней. После охлаждения раствор промывали 5% водным NaHCO3 (320 мл) и солевым раствором. После сушки надNa2SO4 раствор концентрировали при пониженном давлении. Полученный остаток очищали путем флэшхроматографии с использованием смеси н-гексан/AcOEt в соотношении 93/7 с получением желаемого аддукта. Выход: 74% (3,56 г). 1 Н-ЯМР (300 МГц, ДМСО-d6) : 7,17 (dd, 1H), 7,13 (d, 1H), 6,96 (d, 1H), 5,34 (d, 1H), 3,58 (s, 3H),2,85 (m, 1H), 2,80 (d, 1H), 2,27 (s, 3H), 2,17 (m, 1H), 1,80-1,50 (m, 5H), 1,31 (s, 3H), 1,16 (d, 3H), 1,15 (d,3H), 1,10 (s, 3H). МС: 370 (М+). Этап С. 6-Гидрокси-7-оксо-13-изопропилподокарпа-8,11,13-триен-15-карбоксилат. 12,1 мл перуксусной кислоты по каплям добавляли при 0C к раствору 3,55 г метил-7-ацетокси-13 изопропилподокарпа-6,8,11,13-тетраен-15-карбоксилата в 50 мл CHCl3. После 24 ч при комнатной температуре реакционную смесь охлаждали до 0C и добавляли 10% водный раствор NaI до появления коричневого цвета. Через 10 мин добавляли насыщенный водный раствор Na2S2O3 до исчезновения коричневого цвета. Фазы отделяли и водный слой экстрагировали CHCl3 (350 мл). Объединенные органические фазы сушили над Na2SO4 и выпаривали досуха с получением смеси метил-6-ацетокси-7-оксо-13 изопропилподокарпа-8,11,13-триен-15-карбоксилата и метил-6-гидрокси-7-оксо-13-изопропилподокарпа-8,11,13-триен-15-карбоксилата в соотношении 3/2. Выход: 93% (3,44 г). Метил-6-ацетокси-7-оксо-13-изопропилподокарпа-8,11,13-триен-15-карбоксилат. 1 Этап D. 13-Изопропилподокарпа-8,11,13-триен-6,15-диол. К раствору 0,83 г смеси метил-6-ацетокси-7-оксо-13-изопропилподокарпа-8,11,13-триен-15 карбоксилата и метил-6-гидрокси-7-оксо-13-изопропилподокарпа-8,11,13-триен-15-карбоксилата в соотношении 3/2 в 15 мл AcOH добавляли 3 капли концентрированной H2SO4, а затем 0,16 г 10% Pd/C. Смесь гидрировали при комнатной температуре при давлении 50 фунтов/кв.дюйм в течение 3 ч. Фильтровали реакционную смесь. Полученный раствор разбавляли Et2O и нейтрализовали путем добавления 5% водного NaHCO3. Отделяли фазы, и водную фазу экстрагировали Et2O. Объединенные органические фазы промывали 5% водным NaHCO3, солевым раствором, сушили над Na2SO4 и выпаривали. Остаток очищали путем флэш-хроматографии с использованием смеси н-гексан/AcOEt в соотношении 9/1 с получением смеси метил-6-ацетокси-13-изопропилподокарпа-8,11,13-триен-15-карбоксилата и лактона 6-гидрокси-13-изопропилподокарпа-8,11,13-триен-15-карбоновой кислоты в соотношении 7/3. Выход: 68% (0,54 г). Метил-6-ацетокси-13-изопропилподокарпа-8,11,13-триен-15-карбоксилат. 1MC: 298 (М+). Смесь, указанную выше, добавляли к суспензии 540 мг LiAlH4 в 15 мл сухого ТГФ при 0C. Реакционную смесь нагревали в колбе с обратным холодильником в течение 1 ч, а затем охлаждали до 0C. Реакционную смесь гасили путем добавления 0,54 мл H2O, 0,54 мл 30% NaOH и 1,65 мл H2O. После нагревания до комнатной температуры реакционную смесь фильтровали и полученный фильтрат промывали AcOEt и ДХМ. Концентрировали органическую фазу при пониженном давлении и остаток растворяли в ДХМ, промывали солевым раствором, сушили над Na2SO4 и выпаривали досуха с получением желаемого аддукта. Выход: 99% (445 мг). 1MC: 302 (M+). Этап Е. 6-Оксо-13-изопропилподокарпа-8,11,13-триен-15-альдегид. 312 мг 13-изопропилподокарпа-8,11,13-триен-6,15-диола в 4 мл сухого ДХМ добавляли к суспензии 667 мг РСС в 4 мл сухого ДХМ и перемешивали при комнатной температуре в течение 2 ч. Затем реакционную смесь вливали в 40 мл Et2O. Черную смесь фильтровали через слой флоризила. Выпаривали фильтрат и остаток очищали путем флэш-хроматографии с использованием смеси н-гексан/AcOEt в соотношении 9/1 с получением желаемого аддукта. Выход: 45% (138 мг). 1MC: 298 (M+). Этап F: (Е)-15-(2-аминоэтоксиимино)-13-изопропилподокарпа-8,11,13-триен-6-она фумарат Раствор 154 мг дигидрохлорида 2-аминоэтоксиамина и 165 мг Na2HPO412H2O в 1 мл воды добавляли к раствору 138 мг 6-оксо-13-изопропилподокарпа-8,11,13-триен-15-альдегида в 2 мл ТГФ и реакционную смесь перемешивали в течение ночи. Добавляли NaCl, разделяли фазы и водную фазу экстрагировали ТГФ. Объединенные органические экстракты выпаривали. Остаток очищали путем флэшхроматографии с использованием в качестве элюента ДХМ/МеОН/NH4OH в соотношении 90/10/1. Растворитель удаляли при пониженном давлении и полученный остаток растворяли в МеОН перед добавлением стехиометрического количества фумаровой кислоты. Затем раствор выпаривали досуха с получением желаемого аддукта. Выход: 70% (153 мг). 1(Е)-15-(2-Аминоэтоксиимино)-13-изопропилподокарпа-8,11,13-триен-7-она фумарат. Этап А. 13-Изопропилподокарпа-8,11,13-триен-7,15-диол. 700 мг раствора метил-7-оксо-13-изопропилподокарпа-8,11,13-триен-15-карбоксилата в 20 мл сухого ТГФ по каплям добавляли к перемешиваемой суспензии 810 мг LiAlH4 в 15 мл сухого ТГФ при 0C. Реакционную смесь нагревали в колбе с обратным холодильником в течение 1 часа, а затем охлаждали до 0C. Реакционную смесь гасили путем добавления 0,82 мл Н 2 О, 0,82 мл 30% NaOH и 2,4 мл H2O. После нагревания до комнатной температуры реакционную смесь фильтровали и полученный фильтрат промывали AcOEt и ДХМ. Концентрировали органическую фазу при пониженном давлении и полученный остаток растворяли в ДХМ, промывали солевым раствором, сушили над Na2SO4 и выпаривали досуха с получением желаемого аддукта. Выход: 55% (350 мг). 1H-ЯМР (300 МГц, ДМСО-d6) : 7,30 (d, 1H), 7,10 (d, 1H), 6,99 (dd, 1H), 5,09 (d, 1H), 4,50 (m, 2H),3,27 (dd, 1H), 2,90 (dd, 1H), 2,79 (m, 1H), 2,22 (m, 1H), 1,96 (dd, 1H), 1,80-1,40 (m, 7H), 1,17 (s, 3H), 1,16 (d,6H), 0,75 (s, 3H). МС: 302 (М+). Этап В. 7-Оксо-13-изопропилподокарпа-8,11,13-триен-15-альдегид. 1,30 г IBX добавляли к перемешиваемому раствору 350 мг 13-изопропилподокарпа-8,11,13-триен 7,15-диола в 7 мл ДМСО. Через 1 ч раствор гасили 40 мл воды, а затем 40 мл Et2O. Фильтровали реакционную смесь и фильтрат тщательно промывали Et2O. Разделяли фазы и органический экстракт концентрировали при пониженном давлении. Полученный остаток очищали путем флэш-хроматографии с использованием смеси н-гексан/AcOEt в соотношении 95/5 с получением желаемого аддукта. Выход: 75% (250 мг). 1 Н-ЯМР (300 МГц, ДМСО-d6) : 9,25 (s, 1H), 7,70 (d, 1H), 7,51 (dd, 1H), 7,42 (d, 1H), 2,92 (m, 1H),2,74 (dd, 1H), 2,44 (dd, 1H), 2,39 (m, 1H), 1,97 (dd, 1H), 1,87-1,25 (m, 5H), 1,22 (s, 3H), 1,18 (d, 6H), 1,12 (s,3H). МС: 298 (М+). Этап С. (Е)-15-(2-Аминоэтоксиимино)-13-изопропилподокарпа-8,11,13-триен-7-она фумарат. Желаемый аддукт синтезировали в соответствии с экспериментальными условиями, описанными в примере 1, с использованием 7-оксо-13-изопропилподокарпа-8,11,13-триен-15-альдегида вместо 13 изопропилподокарпа-8,11,13-триен-15-альдегида. Соединение, указанное в заголовке, также растирали вEt2O с получением белого твердого вещества. Выход: 88% (188 мг). 1(Е)-15-(2-Аминопропоксиимино)-13-изопропилподокарпа-8,11,13-триен-7-она фумарат. Указанное соединение синтезировали в соответствии со способом, описанным в примере 12, и с использованием дигидрохлорида 3-аминопропоксиамина вместо дигидрохлорида 2-аминоэтоксиамина на этапе С. Соединение, указанное в заголовке, получали в виде белого твердого вещества. Выход: 79% (90 мг). 1(Е)-15-(2-Аминопропоксиимино)-13-изопропилподокарпа-8,11,13-триен-6-она фумарат. Указанное соединение синтезировали в соответствии со способом, описанным в примере 11, и с использованием дигидрохлорида 3-аминопропоксиамина вместо дигидрохлорида 2-аминоэтоксиамина на этапе F. Соединение, указанное в заголовке, получали в виде белого твердого вещества. Выход: 61% (134 мг). 1(Е,Е)-15-(2-Аминоэтоксиимино)-6-гидроксиимино-13-изопропилподокарпа-8,11,13-триенфумарат. Смесь 139 мг (Е)-15-(2-аминоэтоксиимино)-13-изопропилподокарпа-8,11,13-триен-6-она фумарата и 309 мг гидрохлорида гидроксиламина в 3,5 мл пиридина перемешивали при комнатной температуре в течение 3 дней, а затем при 70C в течение 6 ч. Затем смесь охлаждали и удаляли пиридин при пониженном давлении. Неочищенную реакционную смесь очищали путем флэш-хроматографии с использованием в качестве элюента ДХМ/МеОН/NH4OH в соотношении 93/7/0,7. После удаления растворителя под вакуумом, добавляли стехиометрическое количество фумаровой кислоты и раствор выпаривали досуха с получением соединения, указанного в заголовке, в виде белого твердого вещества. Выход: 20% (28 мг).(Е,Е)-15-(2-Аминоэтоксиимино)-7-гидроксиимино-13-изопропилподокарпа-8,11,13-триенфумарат. Указанное соединение синтезировали в соответствии со способом, описанным в примере 15, и с использованием (Е)-15-(2-аминоэтоксиимино)-13-изопропилподокарпа-8,11,13-триен-7-она фумарата вместо (Е)-15-(2-аминоэтоксиимино)-13-изопропилподокарпа-8,11,13-триен-6-она фумарата. Соединение,указанное в заголовке, получали в виде белого твердого вещества. Выход: 62% (45 мг). 1(Е,Е)-15-(3-Аминопропоксиимино)-7-гидроксиимино-13-изопропилподокарпа-8,11,13 триенфумарат. Указанное соединение синтезировали в соответствии со способом, описанным в примере 16, и с использованием (Е)-15-(2-аминопропоксиимино)-13-изопропилподокарпа-8,11,13-триен-7-она фумарата вместо (Е)-15-(2-аминоэтоксиимино)-13-изопропилподокарпа-8,11,13-триен-7-она фумарата. Соединение, указанное в заголовке, получали в виде белого твердого вещества. Выход: 58% (45 мг). 1(Е,Е)-6,15-Дигидроксиимино-13-изопропилподокарпа-8,11,13-триен. Указанное соединение синтезировали в соответствии со способом, описанным в примере 15, и с использованием 6-оксо-13-изопропилподокарпа-8,11,13-триен-15-альдегида вместо(Е)-15-(2 аминоэтоксиимино)-13-изопропилподокарпа-8,11,13-триен-6-она фумарата. Соединение, указанное в заголовке, получали в виде белого твердого вещества. Выход: 29% (28 мг). 1MC: 318 (M+). Этап В. 6-Гидрокси-7-оксо-13-изопропилподокарпа-8,11,13-триен-15-альдегид. Соединение, указанное в заголовке, которое очищали путем флэш-хроматографии с использованием смеси н-гексан/AcOEt в соотношении 75/25, получали в соответствии с методикой, описанной в примере 12, этап В, и с использованием 13-изопропилподокарпа-8,11,13-триен-6,7,15-триола вместо 13 изопропилподокарпа-8,11,13-триен-7,15-диола. Выход: 65% (520 мг).(dd, 1H), 2,94 (m, 1H), 2,38 (m, 2H), 1,85-0,95 (m, 5H), 1,30 (s, 3H), 1,22 (s, 3H), 1,19 (d, 6H). МС: 314 (М+). Этап С. (Е)-15-(2-Аминоэтоксиимино)-6-гидрокси-13-изопропилподокарпа-8,11,13-триен-7-она фумарат. Соединение, указанное в заголовке, получали в виде белого твердого вещества согласно методике,описанной в примере 1, но с проведением реакции в течение двух дней (вместо 1 ч) и с использованием 6-гидрокси-7-оксо-13-изопропилподокарпа-8,11,13-триен-15-альдегида вместо 13-изопропилподокарпа 8,11,13-триен-15-альдегида. Выход: 30% (150 мг). 1(E)-15-(3-Аминопропоксиимино)-6-гидрокси-13-изопропилподокарпа-8,11,13-триен-7-она фумарат. Соединение, указанное в заголовке, получали в виде белого твердого вещества согласно методике,описанной в примере 19, этап С, и с использованием дигидрохлорида 3-аминопропоксиамина вместо дигидрохлорида 2-аминоэтоксиамина на этапе С. Выход: 38% (143 мг). 1(Е,Е)-15-(3-Аминопропоксиимино)-7-гидроксиимино-13-изопропилподокарпа-8,11,13-триен-6-ола фумарат. Соединение, указанное в заголовке, получали в виде белого твердого вещества согласно методике,описанной в примере 16, и с использованием (Е)-15-(3-аминопропоксиимино)-6-гидрокси-13 изопропилподокарпа-8,11,13-триен-7-она фумарата вместо(Е,Е)-15-(3-Аминоэтоксиимино)-7-гидроксиимино-13-изопропилподокарпа-8,11,13-триен-6-ола фумарат. Соединение, указанное в заголовке, получали в виде белого твердого вещества согласно методике,описанной в примере 21, и с использованием (Е)-15-(2-аминоэтоксиимино)-6-гидрокси-13 изопропилподокарпа-8,11,13-триен-7-она фумарата вместо(3-цианопропил)трифенилфосфоний бромида в 8 мл сухого ТГФ при 0C. После 30 мин при 0C смесь нагревали до комнатной температуры и добавляли раствор 0,20 г 13-изопропилподокарпа-8,11,13-триен 15-альдегида в 6 мл сухого ТГФ. Реакционную смесь перемешивали в течение 45 мин, а затем гасили путем добавления 60 мл 5% водного NaH2PO4 и AcOEt. Разделяли фазы и водную фазу экстрагировалиAcOEt. Объединенные органические экстракты сушили над Na2SO4 и растворитель удаляли при пониженном давлении. Остаток очищали путем флэш-хроматографии с использованием смеси н-гексан/AcOEt в соотношении 9/1 с получением желаемого аддукта. Выход: 98% (230 мг).Na (2,3 г по частям) добавляли в течение 4 ч к раствору 250 мг (Z)-15-(3-цианопропилиден)-13 изопропилподокарпа-8,11,13-триена в 25 мл EtOH в колбе с обратным холодильником при перемешивании. Смесь охлаждали до комнатной температуры и добавляли 50 мл 5% водного раствора NaH2PO4 с последующей 1 н. HCl до достижения рН, равного 8. Реакционную смесь экстрагировали ДХМ (3100 мл) и органические фазы концентрировали при пониженном давлении. Остаток очищали путем флэшхроматографии с использованием в качестве элюента ДХМ/МеОН/NH4OH в соотношении 90/10/1. После удаления растворителя под вакуумом остаток растворяли в МеОН и добавляли стехиометрическое количество фумаровой кислоты. Удаляли МеОН при пониженном давлении с получением желаемого аддукта в виде белого твердого вещества. Выход: 95% (243 мг). 1H-ЯМР (300 МГц, ацетон-d6) : 7,17 (d, 1H), 6,97 (dd, 1H), 6,87 (d, 1H), 5,29 (m, 1H), 5,20 (m, 1H),2,95-2,25 (m, 8H), 1,90-1,25 (m, 10H), 1,26 (s, 3H), 1,20 (s, 3H), 1,19 (d, 6H). МС: 349 (М+). Этап В. (Z)-15-(5-Аминопентилиден)-13-изопропилподокарпа-8,11,13-триенфумарат. Соединение, указанное в заголовке, получали в виде белого твердого вещества согласно методике,описанной в примере 23, этап В, и с использованием (Z)-15-(4-цианобутилиден)-13-изопропилподокарпа 8,11,13-триена вместо (Z)-15-(3-цианопропилиден)-13-изопропилподокарпа-8,11,13-триена. Выход: 80% (260 мг). 1H-ЯМР (300 МГц, ДМСО-d6) : 7,98 (bb, 4H), 7,13 (d, 1H), 6,94 (dd, 1H), 6,82 (d, 1H), 6,40 (s, 2H),5,14 (m, 2H), 2,74 (m, 5H), 2,26 (m, 1H), 2,17 (m, 2H), 1,77-1,20 (m, 12H), 1,16 (s, 3H), 1,14 (d, 6H), 1,12 (s,3H). МС: 353 (М+). Пример 25. 15-(4-Аминобутил)-13-изопропилподокарпа-8,11,13-триенфумарат. Смесь 400 мг (Z)-15-(4-аминобутилиден)-13-изопропилподокарпа-8,11,13-триена и 130 мг 10% Pd/C в 50 мл абсолютного EtOH гидрировали при комнатной температуре при давлении H2, равном 1 атм, в течение 2 ч. Отфильтровывали катализатор и растворитель удаляли под вакуумом. Неочищенную реакционную смесь очищали путем флэш-хроматографии с использованием в качестве элюента ДХМ/МеОН/NH4OH в соотношении 90/10/1. После удаления растворителя при пониженном давлении остаток растворяли в МеОН и добавляли стехиометрическое количество фумаровой кислоты. Удаляли МеОН при пониженном давлении с получением желаемого аддукта в виде белого твердого вещества. Выход: 65% (350 мг). 1H-ЯМР (300 МГц, ДМСО-d6) : 8,00 (bb, 4H), 7,13 (d, 1H), 6,93 (dd, 1H), 6,82 (d, 1H), 6,40 (s, 2H),2,77 (m, 5H), 2,25 (m, 1H), 1,80-1,10 (m, 16H), 1,13 (d, 6H), 1,12 (s, 3H), 0,86 (s, 3H). МС: 341 (М+). Пример 26. 15-(4-Аминопентил)-13-изопропилподокарпа-8,11,13-триенфумарат. Соединение, указанное в заголовке, получали в виде белого твердого вещества согласно методике,описанной в примере 25, и с использованием (Z)-15-(5-аминопентилиден)-13-изопропилподокарпа 8,11,13-триенфумарата вместо (Z)-15-(4-аминобутилиден)-13-изопропилподокарпа-8,11,13-триена. Выход: 69% (385 мг). 1(60% в масле) и 49 мг NaI в 5 мл 1,2-диметоксиэтана. Через 15 мин добавляли 1,75 мл аллилбромида и реакционную смесь перемешивали в течение 2 ч. Добавляли 10 мл MeOH/H2O в соотношении 1/1 и разделяли фазы. Водную фазу экстрагировали Et2O и объединенные органические экстракты сушили надNa2SO4, и растворитель удаляли под вакуумом. Остаток очищали путем флэш-хроматографии с использованием смеси н-гексан/AcOEt в соотношении 98/2 с получением желаемого аддукта. Выход: 79% (511 мг). 1MC: 312 (M+). Этап В. 13-Изопропил-15-(3-гидроксипропокси)подокарпа-8,11,13-триен. К раствору 510 мг 13-изопропил-15-аллилоксиподокарпа-8,11,13-триена в 10 мл сухого ТГФ при 0C добавляли 960 мг 9-BBN. Через 1 ч смесь нагревали до комнатной температуры и перемешивали в течение 2 дней. Реакцию завершали после нагревания в колбе с обратным холодильником в течение еще одного часа. После охлаждения до комнатной температуры добавляли 17 мл EtOH с последующим добавлением 0,31 мл 6 н. NaOH и 0,36 мл 30% Н 2 О 2. Через 3 ч выпаривали растворитель и остаток удаляли с помощью Et2O и воды. Разделяли фазы и органическую фазу сушили над Na2SO4, и выпаривали под вакуумом. Остаток очищали путем флэш-хроматографии с использованием смеси н-гексан/AcOEt в соотношении 8/2. После удаления растворителя при пониженном давлении получали желаемый аддукт в виде смеси 13-изопропил-15-(3-гидроксипропокси)подокарпа-8,11,13-триена и 13-изопропил-15-(2 гидроксипропокси)подокарпа-8,11,13-триена в соотношении 3/7. Выход: (515 мг). 1 Н-ЯМР (300 МГц, ацетон-d6) : 7,17 (d, 1H), 6,96 (dd, 1H), 6,86 (d, 1H), 4,45-1,20 (m, 21H), 1,19 (s,3H), 1,18 (d, 6H), 0,88 (s, 3H). МС: 330 (М+). Этап С. 13-Изопропил-15-(3-фталимидопропокси)подокарпа-8,11,13-триен. К раствору 613 мг полученной выше смеси в соотношении 3/7 в 20 мл сухого ТГФ добавляли 522 мг фталимида и 931 мг трифенилфосфина. Реакционную смесь охлаждали до 0C и добавляли 0,70 мл DIAD. Через 24 ч выпаривали растворитель и остаток удаляли с помощью Et2O. Фильтровали реакционную смесь и фильтрат выпаривали под вакуумом. Остаток очищали путем флэш-хроматографии с использованием смеси н-гексан/AcOEt в соотношении 9/1 с получением желаемого аддукта. Выход: 24% (200 мг, 2 этапа). 1MC: 459 (M+). Этап D. 15-(3-Аминопропокси)-13-изопропилподокарпа-8,11,13-триенфумарат. Раствор 199 мг 15-(3-фталимидопропокси)-13-изопропилподокарпа-8,11,13-триена и 0,62 мл гидразингидрата в 5 мл абсолютного EtOH нагревали в колбе с обратным холодильником в течение 3 ч. После охлаждения смесь фильтровали и растворитель удаляли под вакуумом. Остаток очищали путем флэшхроматографии с использованием в качестве элюента ДХМ/МеОН/NH4OH в соотношении 93/7/0,7. После удаления растворителя при пониженном давлении остаток растворяли в МеОН и добавляли стехиометрическое количество фумаровой кислоты. Удаляли МеОН при пониженном давлении с получением желаемого аддукта в виде белого твердого вещества. Выход: 57% (110 мг). 1M.A., et al., Eur. J. Med. Chem., 2010, 45, 811) в 15 мл ДХМ. После охлаждения до 0C добавляли 0,29 мл метансульфонилхлорида. Реакционную смесь перемешивали в течение 1,5 ч при комнатной температуре. Добавляли Н 2 О и разделяли фазы. Водную фазу экстрагировали ДХМ. Объединенные органические экс- 15021536 тракты промывали 0,5 н. HCl, водой и солевым раствором. После удаления растворителя под вакуумом получали желаемый аддукт в виде белого твердого вещества. Выход: 94% (1,21 г). 1H-ЯМР (300 МГц, ацетон-d6) : 7,18 (d, 1H), 6,98 (dd, 1H), 6,88 (d, 1H), 4,13 (d, 1H), 3,85 (d, 1H),3,11 (s, 3H), 2,85 (m, 3H), 2,34 (m, 1H), 1,90-1,25 (m, 8H), 1,22 (s, 3H), 1,18 (d, 6H), 0,99 (s, 3H). МС: 350 (М+). Этап В. 13-Изопропил-15-(3-гидроксипропилтио)подокарпа-8,11,13-триен. Раствор 0,90 мл 3-меркаптопропанола в 12 мл НМРА и 3,0 мл ДМФА дегазировали Ar и охлаждали до 0C. Добавляли 0,40 г NaH (60% в масле) и перемешивали реакционную смесь в течение 10 мин. Добавляли раствор 1,20 г 13-изопропил-15-метансульфонилоксиподокарпа-8,11,13-триена в 3 мл НМРА и 2,0 мл ДМФА. Реакционную смесь нагревали до 130C и перемешивали при данной температуре в течение 30 мин. Затем реакционную смесь охлаждали и добавляли 250 воды перед экстрагированием три разаEt2O. Объединенные органические экстракты промывали водой, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Остаток очищали путем флэш-хроматографии с использованием смеси н-гексан/AcOEt в соотношении 75/25 с получением желаемого аддукта. Выход: 89% (1,20 г). 1 Н-ЯМР (300 МГц, ацетон-d6) : 7,17 (d, 1H), 6,97 (dd, 1H), 6,88 (d, 1H), 3,62 (m, 2H), 3,53 (m, 1H),2,83 (m, 3H), 2,77 (d, 1H), 2,58 (t, 2H), 2,44 (d, 1H), 2,31 (m, 1H), 1,90-1,25 (m, 10H), 1,19 (s, 3H), 1,18 (d,6H), 1,03 (s, 3H). МС: 346 (М+). Этап С. 13-Изопропил-15-(3-фталимидопропилтио)подокарпа-8,11,13-триен. Соединение, указанное в заголовке, получали в виде белого твердого вещества согласно методике,описанной в примере 27, этап С, и с использованием 13-изопропил-15-(3-гидроксипропилтио)подокарпа 8,11,13-триена вместо 13-изопропил-15-(3-гидроксипропокси)подокарпа-8,11,13-триена. Выход: 92% (1,30 г). 1H-ЯМР (300 МГц, ацетон-d6) : 7,83 (m, 4H), 7,16 (d, 1H), 6,96 (dd, 1H), 6,84 (d, 1H), 3,76 (t, 2H),2,80 (m, 4H), 2,58 (t, 2H), 2,42 (d, 1H), 2,29 (m, 1H), 1,96 (m, 2H), 1,85-1,19 (m, 8H), 1,19 (d, 6H), 1,17 (s,3H), 1,01 (s, 3H). МС: 475 (М+). Этап D. 15-(3-Аминопропилтио)-13-изопропилподокарпа-8,11,13-триенфумарат. Соединение, указанное в заголовке, получали в виде белого твердого вещества согласно методике,описанной в примере 27, этап D, и с использованием 15-(3-фталимидопропилтио)-13 изопропилподокарпа-8,11,13-триена вместо 15-(3-фталимидопропокси)-13-изопропилподокарпа-8,11,13 триена. Выход: 61% (138 мг). 1H-ЯМР (300 МГц, ДМСО-d6) : 9,14 (s, 1H), 7,16 (d, 1H), 6,98 (dd, 1H), 6,87 (d, 1H), 5,11 (d, 1H),3,95 (m, 1H), 3,17 (dd, 1H), 2,78 (m, 1H), 2,68 (dd, 1H), 2,26 (m, 1H), 1,85 (d, 1H), 1,80-0,90 (m, 5H), 1,16 (s,3H), 1,15 (d, 6H), 1,12 (s, 3H). МС: 300 (М+). Этап В. (Е)-15-(2-Аминоэтоксиимино)-13-изопропилподокарпа-8,11,13-триен-6-ола фумарат. Раствор 54 мг 6-гидрокси-13-изопропилподокарпа-8,11,13-триен-15-альдегида и 215 мг дигидрохлорида 2-аминоэтоксиамина в 1 мл пиридина нагревали до 60C при перемешивании в течение ночи. Удаляли пиридин под вакуумом и неочищенную реакционную смесь очищали путем флэшхроматографии с использованием в качестве элюента ДХМ/МеОН/NH4OH в соотношении 90/10/1. Растворитель удаляли в вакууме и остаток растворяли в МеОН, после чего добавляли стехиометрическое количество фумаровой кислоты, и раствор выпаривали досуха под вакуумом. Соединение, указанное в заголовке, получали в виде белого твердого вещества. Выход: 50% (43 мг).(Е)-15-(2-Аминопропоксиимино)-13-изопропилподокарпа-8,11,13-триен-6-ола фумарат. Соединение, указанное в заголовке, получали в виде белого твердого вещества согласно методике,описанной в примере 29, этап В, и с использованием дигидрохлорида 3-аминопропоксиамина вместо дигидрохлорида 2-аминоэтоксиамина. Выход: 67% (57 мг). 1(Е)-15-(2-Аминоэтоксиимино)-13-изопропилподокарпа-7,13-диенфумарат. Соединение, указанное в заголовке, получали в виде белого твердого вещества согласно методике,описанной в примере 1, и с использованием 13-изопропилподокарпа-7,13-диен-15-альдегида (Gonzalez(Е)-15-(2-Аминопропоксиимино)-13-изопропилподокарпа-7,13-диенфумарат. Соединение, указанное в заголовке, получали в виде белого твердого вещества согласно методике,описанной в примере 31, и с использованием дигидрохлорида 3-аминопропоксиамина вместо дигидрохлорида 2-аминоэтоксиамина. Выход: 64% (38 мг). 1H-ЯМР (300 МГц, ДМСО-d6) : 8,10 (bb, 4H), 7,17 (s, 1H), 6,35 (s, 2H), 5,71 (s, 1H), 5,34 (m, 1H),3,96 (t, 2H), 2,75 (t, 2H), 2,30-1,00 (m, 17H), 1,07 (s, 3H), 0,96 (d, 6H), 0,76 (s, 3H). МС: 358 (М+). Пример 33. 15-(4-Пиперидинилоксиамино)-13-изопропилподокарпа-8,11,13-триенфумарат. 1 н. HCl добавляли к раствору 230 мг свободного основания (Е)-15-(4-пиперидинилоксиимино)-13 изопропилподокарпа-8,11,13-триена в 3 мл МеОН до достижения рН, равного 3. Затем добавляли 58 мгNaBH3CN и рН постоянно поддерживали, равным 3, путем добавления 0,3 н. HCl, рН контролировали с помощью рН-стата. Реакционную смесь перемешивали в течение ночи. Затем удаляли МеОН при пониженном давлении и водный остаток доводили до рН 10-12 путем добавления 4 н. NaOH. Реакционную смесь три раза экстрагировали Et2O; органическую фазу сушили над Na2SO4 и выпаривали досуха. Остаток очищали путем флэш-хроматографии с использованием в качестве элюента ДХМ/МеОН/NH4OH в соотношении 90/10/1. Растворитель удаляли под вакуумом и остаток растворяли в МеОН, после чего добавляли стехиометрическое количество фумаровой кислоты, и раствор выпаривали досуха под вакуумом. Соединение, указанное в заголовке, получали в виде белого твердого вещества. Выход: 65% (196 мг). 1(d, 1H), 6,60 (s, 2H), 4,01 (m, 1H), 3,22-2,68 (m, 9H), 2,25 (m, 1H), 2,05-1,15 (m, 13H), 1,13 (d, 6H), 1,11 (s,3H), 0,93 (s, 3H). МС: 384 (М+). Результаты биологических экспериментов. Антигипертензивное свойство различных производных изучали in vivo на трех моделях гипертонии у животных (т.е. конгенные крысы с мутантным -аддуцином, крысы, страдающие гипертонией, вызванной уабаином, и крысы миланской линии, страдающие гипертонией). Конгенные крысы с мутантным -аддуцином (NA) Соединение из примера 4 вводили через желудочный зонд в различных дозах в течение шести недель крысам, несущим мутацию -аддуцина (штамм NA). Такую мутацию, приводящую к гипертонии и осложнению в органах (Bianchi G., et al., Proc. Natl. Acad. Sci., 1994, 91, 3999), получали путем интрогрессии сегмента хромосомы 14, содержащего локус -аддуцина, крыс миланской линии, страдающих гипертонией (MHS), имеющих мутантный вариант, крысам миланской линии, имеющим нормальное кровяное давление (MNS), несущим вариант -аддуцина дикого типа (Tripodi G., et al., Biochem. Biophys.Res. Commun., 2004, 324, 562). Систолическое артериальное давление (САД) и частота сердечных сокра- 17021536 Крысы, страдающие гипертонией, вызванной уабаином (OHR). Гипертонию провоцировали путем подкожной инфузии уабаина (15 мкг/кг/сутки) у крыс, имеющих нормальное кровяное давление, как уже описано (Ferrari P., et al., J. Pharmacol. Exp. Ther., 1998, 285, 83). Соединения вводили через желудочный зонд один раз в сутки в течение шести недель в дозе, указанной в табл. 2. Таблица 2 Крысы миланской линии, страдающие гипертонией (MHS). Крысы миланской линии, страдающие гипертонией, представляют собой модель наследственной гипертонии у крыс, поддерживаемой мутацией -аддуцина и повышенными уровнями циркулирующего эндогенного уабаина (Ferrari P., et al., Hypertension: Pathophysiology, Diagnosis and Management, vol. 1,Laragh J.H. and Brenner B.M. (Eds.), Raven Press Publishers, New York, USA, 1261-1279 (1995. Соединения вводили через желудочный зонд (10 мкг/кг/сутки) в течение 6 недель. Систолическое артериальное давление и частота сердечных сокращений после 6-недельного лечения представлены в табл. 3. Таблица 3 Соединения из примеров 12 и 27 значительно снижали САД у крыс MHS в тестируемой дозе, при этом соединение из примера 4 не было эффективно в отношении САД. Ни одно из производных не влияло на ЧСС у MHS. Исследовали влияние соединения из примера 4 на выделение белка с мочой. Повышенные уровни циркулирующего эндогенного уабаина не только связаны с гипертонией, но также могут влиять на функцию почек и увеличивать риск почечной недостаточности и протеинурии (Stella P., et al., J. Int. Med.,2008, 263, 274), которые представляют собой основные осложнения в органах, связанные с гипертонией. Модель OHR у крыс демонстрировала повышенное выделение белка с мочой и концентрацию креатинина в плазме крови, связанную с пониженным клиренсом креатинина по сравнению с контрольными крысами, получавшими инфузию физиологического раствора. Крыс OHR перорально лечили соединением из примера 4 в дозе 0,1 мкг/кг/сутки в течение 6 недель. В конце лечения крыс помещали в отдельные метаболические клетки для сбора мочи в течение 24 ч. Протеинурию и креатинин в моче измеряли с помощью коммерческих наборов (Sentinel). Крыс умерщвляли, и забирали кровь для измерения креатинина в плазме крови. Данные представлены в табл. 4. Таблица 4 Соединение из примера 4 в дозе 0,1 мкг/кг/сутки значительно снижало выделение белка с мочой у крыс OHR. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее общую формулу IX представляет собой О или S; эндоциклический символ представляет собой одинарную или двойную связь, в случае, когда он представляет собой двойную связь, символ, соединяющий R3 с карбоциклом, представляет собой одинарную связь, а карбоциклическое кольцо А является частично ненасыщенным; символ, соединяющий R2 с карбоциклом, представляет собой одинарную или двойную связь; 2, соединяющий R2 с карбоциклом, представляет собой одинарную связь; или, соединяющий R2 с карбоциклом, представляет собой двойную связь, со значением карбонила или оксима соответственно;, соединяющий R3 с карбоциклом, представляет собой одинарную или двойную связь; 3, соединяющий R3 с карбоциклом, представляет собой одинарную связь; или, соединяющий R3 с карбоциклом, представляет собой двойную связь, со значением карбонила или оксима соответственно; карбоциклическое кольцо А является ароматическим или частично ненасыщенным; при условии что, когда R4 представляет собой Н, R2 не представляет собой Н; их оптически активные формы, такие как энантиомеры, диастереомеры, их рацематные формы и их фармацевтически приемлемые соли. 2. Соединение по п.1, отличающееся тем, что R1 представляет собой -CH=NOR4. 3. Соединение по любому из пп.1, 2, отличающееся тем, что R4 представляет собой амино(С 2-С 6)алкил или (C3-C6)гетероциклоалкил. 4. Применение соединений по любому из пп.1-3 в качестве лекарственного средства для предотвращения и/или лечения гипертонии, сердечной недостаточности, гипертрофии сердца, почечной недостаточности, гломерулосклероза, протеинурии и стеноза сосудов после хирургической операции на сосудах. 5. Применение по п.4, где сердечно-сосудистое заболевание представляет собой гипертонию. 6. Применение по п.5, где гипертония обусловлена действием эндогенного уабаина. 7. Способ лечения пациента, страдающего гипертонией, сердечной недостаточностью, гипертрофией сердца, почечной недостаточностью, гломерулосклерозом, протеинурией и стенозом сосудов после хирургической операции на сосудах, включающий введение соединения по пп.1-3. 8. Фармацевтическая композиция, содержащая соединение по пп.1-3 совместно с фармацевтически приемлемым наполнителем. 9. Способ синтеза соединений по п.1, где символ R1 представляет собой -CH=NOR4 со значением иминокси; карбоциклическое кольцо А является ароматическим или частично ненасыщенным, a R2 и R3 такие, как определено в п.1, включающий осуществление реакции соединения формулы II где карбоциклическое кольцо А является ароматическим или частично ненасыщенным;x представляет собой целое число от 0 до 3,в пиридине при комнатной температуре.
МПК / Метки
МПК: C07D 211/46, C07C 251/54, A61K 31/15, C07C 211/31, C07C 251/34
Метки: обладающие, дитерпеноидов, производные, биологическими, свойствами
Код ссылки
<a href="https://eas.patents.su/21-21536-proizvodnye-diterpenoidov-obladayushhie-biologicheskimi-svojjstvami.html" rel="bookmark" title="База патентов Евразийского Союза">Производные дитерпеноидов, обладающие биологическими свойствами</a>
Предыдущий патент: Способ получения этанола и высших спиртов
Следующий патент: Аминозамещенные производные бисфенилпентановой кислоты в качестве ингибиторов nep
Случайный патент: Способ приготовления суспензии катализатора и устройство












