Гликозилирование белков
Формула / Реферат
1. Способ гликозилирования белка, включающий стадии:
i) модификации белка для включения алкиновой и/или азидной группы и
ii) взаимодействия модифицированного белка пункта (i) с
(a) углеводным фрагментом, модифицированным для включения азидной группы, и/или
(b) углеводным фрагментом, модифицированным для включения алкиновой группы в присутствии Cu(I) катализатора, где указанный Cu(I) катализатор получают в растворителе в присутствии стабилизирующего лиганда.
2. Способ по п.1, где стабилизирующий лиганд представляет собой стабилизирующий аминный лиганд.
3. Способ по п.2, где указанный лиганд представляет собой тристриазолиламинный лиганд.
4. Способ по любому из предшествующих пунктов, где указанный Cu(I) катализатор выбирают из группы, состоящей из CuBr и CuI.
5. Способ по п.4, где указанный Cu(I) катализатор представляет собой Cu(I)Br.
6. Способ по любому из предшествующих пунктов, где указанная модификация белка включает замещение одной или нескольких аминокислот в белке одним или несколькими неприродными аналогами аминокислот.
7. Способ по п.6, где указанный неприродный аналог аминокислоты представляет собой аналог метионина.
8. Способ по любому из предшествующих пунктов, где указанный аналог метионина представляет собой гомопропаргилглицин или азидогомоаланин.
9. Способ по любому из предшествующих пунктов, где указанный белок включает более 10 аминокислот.
10. Способ по п.9, где указанный белок включает от 10 до 1000 аминокислот.
11. Способ по любому из предшествующих пунктов, где указанный белок имеет молекулярную массу свыше 10 кДа.
12. Способ по п.10, где указанный белок имеет молекулярную массу от 10 до 100 кДа.
13. Способ по любому из предшествующих пунктов, где указанный белок выбирают из группы, состоящей из гликопротеинов, белков крови, гормонов, ферментов, рецепторов, антител, интерлейкинов и интерферонов.
14. Способ по п.13, где указанный белок является гормоном.
15. Способ по п.14, где указанный гормон представляет собой эритропоэтин.
16. Способ по любому из предшествующих пунктов, где указанная модификация белка (стадия i) дополнительно включает стадию модификации белка для включения тиоловой группы.
17. Способ по п.16, где указанную тиоловую группу вводят путем инсерции цистеинового остатка в аминокислотную последовательность белка.
18. Способ по п.16 или 17, где способ включает взаимодействие модифицированного белка, модифицированного на стадии (i) с тиолселективным углеводным реагентом.
19. Способ по п.18, где указанный тиолселективный углеводный реагент представляет собой реагент, который взаимодействует с тиоловой группой в белке для введения гликозильного остатка, связанного с белком через дисульфидную связь.
20. Способ по п.19, где указанный тиолселективный углеводный реагент представляет собой гликотиосульфонатный реагент.
21. Способ по п.20, где указанный гликотиосульфонатный реагент представляет собой гликометантиосульфонатный реагент.
22. Способ по любому из пп.16-19, где указанный тиолселективный реагент представляет собой гликоселенилсульфидный реагент.
23. Белок формулы (III)
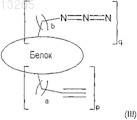
где а и b представляют целые числа от 0 до 5; и р и q представляют целые числа от 1 до 5, и указанный белок включает по крайней мере 10 аминокислот.
24. Гликозилированный белок формулы (IV)
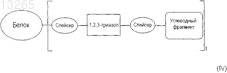
где t обозначает целое число от 1 до 5; и спейсер, который может отсутствовать, представляет собой алифатический фрагмент, содержащий от 1 до 8 атомов С; и указанный белок включает по крайней мере 10 аминокислот.
25. Гликозилированный белок по п.24, где указанный спейсер выбирают из группы, состоящей из С1-6 алкильной группы и С1-6 гетероалкила.
26. Гликозилированный белок по п.25, где указанный спейсер выбирают из группы, состоящей из метила, этила и СН2(Х)y, где X обозначает О, N или S и у равен 0 или 1.
27. Гликозилированный белок по любому из пп.24-26, где указанный белок имеет формулу (V)
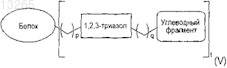
где р и q обозначают целое число от 0 до 5 и t обозначает целое число от 1 до 5.
28. Гликозилированный белок по п.27, где указанный белок имеет формулу (VI)
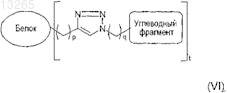
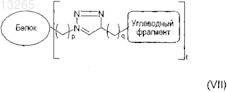
29. Гликозилированный белок по п.27, где указанный белок имеет формулу (VII)
30. Гликозилированный белок формулы (VIII)
![]()
где u и t обозначают целые числа от 1 до 5; спейсер, который может отсутствовать, представляет собой алифатический фрагмент, содержащий от 1 до 8 атомов С; и W и Z представляют собой углеводные фрагменты, которые могут быть одинаковыми или различными.
31. Гликозилированный белок по п.30, имеющий формулу (IX)
![]()
где р, q, r и s обозначают целые числа от 0 до 5.
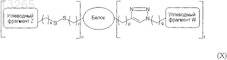
32. Гликозилированный белок по п.31, имеющий формулу (X)
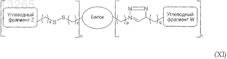
33. Гликозилированный белок по п.31, имеющий формулу (XI)
34. Белок по любому из пп.23-33, где указанный белок включает от 10 до 1000 аминокислот.
35. Белок по любому из пп.23-33, где указанный белок имеет молекулярную массу свыше 10 кДа.
36. Белок по п.35, где указанный белок имеет молекулярную массу от 10 до 100 кДа.
37. Белок по любому из пп.23-36, где указанный белок выбирают из группы, состоящей из гликопротеинов, белков крови, гормонов, ферментов, рецепторов, антител, интерлейкинов и интерферонов.
38. Белок по п.37, где указанный белок является гормоном.
39. Белок по п.38, где указанный гормон представляет собой эритропоэтин.
40. Применение белка по любому из пп.23-39 в качестве лекарственного средства.
Текст
013265 Область техники, к которой относится изобретение Настоящая заявка относится к способам гликозилирования белков и к гликозилированным белкам,получаемым в соответствии с такими способами. Предпосылки создания изобретения Гликозилирование белков, осуществляемое в ходе трансляции и в виде пост-трансляционного процесса, играет жизненно важную роль в реализации их биологических функций и в поддержании их стабильности (R. Dwek, Chem. Rev., 96:683-720 (1996. Например, гликозилирование играет существенную роль в таких важных биологических процессах, как сигнальная функция клеток, регуляция, развитие и иммунитет. Однако изучение этих явлений встречает определенные проблемы, определяемые тем фактом, что гликопротеины существуют в природе в виде смесей так называемых гликоформ, которые содержат одинаковый пептидный скелет, но различаются по характеру и сайту гликозилирования. Кроме того, поскольку гликозилирование белков непосредственно не контролируется генетическими механизмами клетки, экспрессия терапевтически полезных гликопротеинов в культуре клеток млекопитающих ведет к образованию гетерогенных смесей гликоформ. В этой связи способность к синтезу гомогенных гликопротеиновых гликоформ является не только условием для проведения качественного исследования,но также представляет собой растущую потребность для процесса изготовления гликоформ терапевтического назначения, которые в настоящее время поставляются на фармацевтический рынок в виде смесей множества гликоформ (например, эритропоэтин и интерлейкины). Таким образом, контроль степени и характера гликозилирования белка даст возможность исследовать и контролировать поведение такого белка в биологических системах. Известно множество способов гликозилирования белков, включая химический синтез. Химический синтез гликопротеинов имеет определенные преимущества, и, не в последнюю очередь, возможность получения чистых гликопретеиновых гликоформ. В одном из таких известных синтетических способов используются тиол-селективные углеводные реагенты, гликозилметантиосульфонатные реагенты (гликоМТС). Такие гликозилметантиосульфонатные реагенты взаимодействуют с тиоловыми группами в белке для введения гликозильного остатка, присоединяемого к белку через дисульфидную связь (см., например, WO00/01712). Реакция образования триазола, катализируемая Cu(I), используется в ряде исследований, проводимых с использованием меченных соединений (Link et al., J. Am. Chem. Soc. 125:11164-11165, 2003; Linket al., J. Am. Chem. Soc. 126:10598-10602, 2004; и Speers et al., Chemistry and Biology 11: 535-546, 2004), а также в синтезе (Tornoe et al., J. Org. Chem. 67(9):3057-3064, 2002). Притягательность данной реакции заключается в высокой селективности реакции азидов с алкинами и возможность проводить данную реакцию в водной среде в присутствии большого числа других функциональных групп. В последнее время в научной литературе появились сообщения с описанием синтеза триазолсвязанных гликозилированных аминокислот и небольших гликопептидов, включая соответствующим образом защищенные по функциональным группам углеводы и защищенные аминокислоты/пептиды(Kuijpers et al., Og. Lett. 6(18): 3123-3126, 2004). Имеются также сообщения о других типах триазолсвязанных гликоконъюгатов (Chittaboina et al., Tetrahedron Lett. 46: 2331-2336, 2005), которые были синтезированы с использованием защищенных производных углеводов. Лин и Валаш (Lin and Walash) модифицировали циклический пептид из 10 аминокислот, Nацетилцистеаминтиоэфир (SNAC) для целей введения алкиновой группировки в данный пептид. Указанный метод включал замещение аминокислот в рассматриваемом пептиде неприродным аминокислотным аналогом, пропаргилглицином, проводимое в разных положениях молекулы пептида (Van Hest et al., J.Am. Chem. Soc. 122: 1282-1288 (2000) и Kiick et al., Tetrahedron 56: 9487-9493 (2000. Затем модифицированные пептиды подвергали конъюгации с азидосахарами с целью получения гликозилированных циклических пептидов. Существует потребность в более простом способе, чем известные в настоящее время и описанные в литературе способы, например, в таком способе, для которого не требовалось бы использование защищенных гликозилирующих реагентов при гликозилировании более сложных структур, например белков,и который бы позволял проводить гликозилирование по множественным сайтам в большом числе разных белков. Краткое описание сущности изобретения В первом аспекте настоящее изобретение относится к способу модификации белка, где указанный способ включает модификацию белка для включения в него по меньшей мере одной алкиновой группы и/или одной азидогруппы. В контексте настоящего описания термин "азидо" группа относится к (N=N=N), и термин "алкиновая" группа относится к соединению с тройной СС связью. Модификация белка обычно включает замещение одной или нескольких аминокислот одним или несколькими аминокислотными аналогами, включающими алкиновую группу и/или азидогруппу. Альтернативно или в дополнение к вышесказанному, модификация белка может включать введение одной или нескольких природных аминокислот в белок, как обсуждается в данном описании. В рамках другого альтернативного варианта модификация белка может включать модификацию боковой цепи аминокис-1 013265 лот путем включения химической группы, например тиоловой группы. Модификация белка путем включения азидной, алкиновой или тиоловой группы обычно происходит во вполне определенном, заданном положении в аминокислотной последовательности белка. В предпочтительном аспекте настоящего изобретения модификация белка включает замещение одной или нескольких аминокислот в белке одним или несколькими неприродными (то есть не встречающимися в природе) аналогами аминокислот. Неприродный аналог аминокислоты может представлять собой аналог метионина. Указанным аналогом метионина может быть гомопропаргилглицин (Hpg) VanHest et al., J. Am. Chem. Soc. 122: 1282-1288 (2000, гомоаллилглицин (Hag) (Van Hest et al., FEBS Letters,428, 68-70 (1998 и/или азидогомоаланин (Aha) (Kiick et al., Proc. Natl. Acad. Sci. USA, 99, 19-24 (2002,предпочтительно гомопропаргилглицин. Модификация белка путем введения одной или нескольких неприродных аминокислот, например аналогов метионина, может быть осуществлена в соответствии с известными в данной области способами, как описано, например, в работе Ван Хеста (Van Hest et al., J. Am.Chem. Soc. 122: 1282-1288 (2000. Конкретно, модификация белка путем введения одного или нескольких аналогов метионина вовлекает сайт-направленный мутагенез для встраивания в последовательность нуклеиновой кислоты, кодирующей белок, кодона AUG, кодирующего метионин. Предпочтительно, встраивание указанного кодона метионина осуществляют в заранее заданном положении в последовательности нуклеиновой кислоты, кодирующей белок, например, в то положение на участке последовательности нуклеиновой кислоты, которое кодирует N-конец (или аминоконец) белка. Затем может быть проведена экспрессия белка путем трансляции последовательности нуклеиновой кислоты, содержащей встроенный кодон метионина, в ауксотрофном дефицитном по метионину бактериальном штамме в присутствии аналогов метионина, например Aha или Hpg. Способ согласно настоящему изобретению может включать модификацию белка, направленную на включение в него алкиновой группы на стадии замещения одной или нескольких аминокислот в белке гомопропаргилглицином или гомоаллилглицином. Альтернативно или дополнительно, способ согласно настоящему изобретению может включать модификацию белка для включения в него азидогруппы на стадии замещения одной или нескольких аминокислот в белке азидогомоаланином. Предпочтительно, способ согласно настоящему изобретению включает модификацию белка для включения в него азидогруппы (как приведено в настоящем описании) и алкиновой группы (как приведено в настоящем описании). Термин "белок" в контексте настоящего описания применяется в широком смысле и обозначает множество (минимум 2 аминокислоты) аминокислотных остатков (в основном, более 10 аминокислот),соединенных друг с другом пептидными связями. Любая аминокислота, включенная в состав белка,предпочтительно является -аминокислотой. И любая аминокислота может иметь D- или L-форму. В предпочтительном аспекте настоящего изобретения рассматриваемый белок включает тиоловую(-SH) группу, присутствующую, например, в одном или нескольких цистеиновых остатках. Указанные один или несколько цистеиновых остатков могут присутствовать в белке в естественных условиях. В том случае, когда белок не включает цистеиновый остаток, такой белок может быть модифицирован с целью введения в него одного или нескольких цистеиновых остатков. Одна или несколько тиоловых групп могут быть введены в состав белка путем химической модификации белка, например, введением тиоловой группы в боковую цепь аминокислоты или введением одного или нескольких цистеиновых остатков. Альтернативно, белок, содержащий тиол, может быть получен путем сайт-направленного мутагенеза,проводимого с целью включения цистеинового остатка. Сайт-направленный мутагенез представляет собой известную в данной области методику (см. например, WO 00/01712). Конкретно, в рамках этой методики осуществляется встраивание цистеинового остатка в белок путем инсерции кодона UGU в последовательность нуклеиновой кислоты, кодирующей белок. Предпочтительно, инсерцию кодона для цистеина осуществляют в заданном положении в последовательности нуклеиновой кислоты, кодирующей белок, например, так чтобы указанный кодон был локализован на участке последовательности нуклеиновой кислоты, кодирующей С-конец (или карбоксильный конец) белка. После этого модифицированный белок может быть экспрессирован, например, в клеточной системе экспрессии. Термин "белок" в контексте настоящего описания обозначает множество аминокислотных остатков,соединенных друг с другом пептидными связями. Он имеет тот же смысл, что термины пептид и полипептид и используется взаимозаменяемо с ними. Термин "белок" в контексте настоящего описания также включает фрагменты, аналоги и производные белка, где указанные фрагмент, аналог и производное, по существу, сохраняют биологическое свойства или функцию базового для них белка. Указанный белок может иметь линейную структуру, но, предпочтительно, он имеет нелинейную структуру, характеризующуюся наличием складчатой, например третичной или четвертичной, конформации. Рассматриваемый белок может содержать одну или несколько конъюгированных с ним простетических групп, например, такой белок может представлять собой гликопротеин, липопротеин или хромопротеин. Предпочтительно указанный белок является сложным белком. Предпочтительно указанный белок включает от 10 до 1000 аминокислот, например, от 10 до 600-2 013265 аминокислот, в частности, в таком диапазоне, как от 10 до 200 или от 10 до 100 аминокислот. Таким образом, указанный белок может включать от 10 до 20, 50, 100, 150, 200 или 500 аминокислот. В предпочтительном аспекте настоящего изобретения указанный белок имеет молекулярную массу свыше 10 кДа. При этом белок может иметь молекулярную массу, равную по меньшей мере 20 кДа или по меньшей мере 60 кДа, например, она может составлять от 10 до 100 кДа. Указанный белок может относиться к группе фибриллярных белков или к группе глобулярных белков. Предпочтительно, указанный белок является глобулярным белком. Предпочтительно, указанный белок является биологически активным белком. Например, рассматриваемый белок может быть выбран из группы, состоящей из гликопротеинов, сывороточных альбуминов и других белков крови, гормонов, ферментов, рецепторов, антител, интерлейкинов и интерферонов. Примеры соответствующих белков включают факторы роста, факторы дифференциации, цитокины,например интерлейкины (в частности, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12,IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20 или IL-21, либо альфа, либо бета), интерфероны (например, IFN-альфа, IFN-бета, IFN-гамма), фактор некроза опухоли (TNF), IFN-гамма-индуцирующий фактор (IGIF), белок, определяемый при морфогенезе костей (BMP); хемокины, трофические факторы; рецепторы цитокинов; ферменты захвата свободных радикалов. В предпочтительном аспекте настоящего изобретения указанный белок является гормоном. Предпочтительно, указанный белок является эритропоэтином. В белке, модифицированном согласно способу настоящего изобретения, удается сохранить присущую белку полезную функцию/активность. В еще одном предпочтительном аспекте настоящего изобретения указанный белок является ферментом. Предпочтительно, указанный белок представляет собой глюкозилцерамидазу (D-глюкоцереброзидазу) (Cerezyme) или бета-гликозидазу из Sulfolobus solfataricus (SSbG). Настоящее изобретение также основано на сайт-специфичном введении метки, такой как алкиновая,азидная или тиоловая группа, в боковую цепь аминокислоты, в заданном положении аминокислотной последовательности белка (как было описано выше), после чего осуществляют реакции последовательного и ортогонального гликозилирования, которые являются специфичными для каждой соответствующей метки. Таким путем может быть достигнуто дифференциальное многосайтовое химическое гликозилирование белка. Таким образом, второй аспект настоящего изобретения относится к способу гликозилирования белка, где указанный способ включает стадии:i) модификации белка согласно способу первого аспекта настоящего изобретения; иii) взаимодействия модифицированного белка по пункту (i) сa) углеводным фрагментом, модифицированным для введения в него азидной группы; и/илиb) углеводным фрагментом, модифицированным для введения в него алкиновой группы в присутствии Cu(I) катализатора. Термин "гликозилирование" в контексте настоящего описания относится к общему способу присоединения гликозильной единицы к другому фрагменту посредством ковалентной связи. В типичном случае, если белок модифицируют на стадии (i) путем введения в него алкиновой группы, то реакцию на стадии (ii) проводят с углеводным фрагментом согласно пункту (а) . Тогда как, если белок модифицируют на стадии (i) путем введения в него азидной группы, реакцию на стадии (ii) проводят с углеводным фрагментом согласно пункту (b). Предпочтительно, согласно настоящему изобретению, модификация белка (стадия i) дополнительно включает стадию модификации белка, как определено здесь, для введения в него тиоловой группы, например, с помощью инсерции цистеинового остатка. В предпочтительном аспекте настоящее изобретение относится к способу гликозилирования белка,где указанный способ включает стадии:i) (а) модификации белка для включения в него алкиновой и/или азидной группы; и(b) до или после модификации согласно пункту (а), необязательной модификации белка для включения в него тиоловой группы; иii) последующей реакции белка, модифицированного согласно (i), углеводным фрагментом (с) в присутствии Cu(I) катализатора, до или после реакции с тиол-селективным углеводным реагентом (d),c) с углеводным фрагментом, модифицированным путем введения в него азидной группы; и/или алкиновой группы; иd) с тиол-селективным углеводным реагентом. Стадии (i) (а) и (b) являются такими, как описаны в настоящем тексте. В том случае, когда белок подвергают модификации, с тем чтобы модифицированный белок содержал цистеиновый остаток, модификация белка, направленная на введение тиоловой группы, не является обязательной. Альтернативно, может быть желательно включить одну или несколько тиоловых групп, в дополнение к уже имеющимся в белке. Тиол-селективный углеводный реагент может включать любой реагент, который взаимодействует с-3 013265 тиоловой группой в белке, что позволяет ввести гликозильный остаток, присоединенный к белку через дисульфидную связь. Тиол-селективный углеводный реагент может включать, без ограничения, гликоалкантиосульфонатный реагент, например, гликометантиосульфонатный реагент (глико-МТС) (см. документ WO 00/01712, содержание которого включено в настоящее описание полностью), гликоселенилсульфидные реагенты (см. документ WO 2005/000862, содержание которого включено в настоящее описание полностью) и гликотиосульфонатные реагенты (см. документ WO 2005/0008 62, содержание которого включено в настоящее описание полностью). Гликометантиосульфонатные реагенты представляют собой фрагмент формулы СН 3-SO2-S-углевод. Гликотиосульфонатные и гликоселенилсульфидные (SeS) реагенты описываются в основном формулой I, в соответствии с WO2005/000862 (где указанный документ включен в настоящее описание посредством ссылки). Конкретно, гликоселенилсульфидные (SeS) реагенты описываются формулой R-S-Xуглеводный фрагмент, где X обозначает Se, и R обозначает необязательно замещенную С 1-10 алкильную, фенильную, пиридильную или нафтильную группу. Гликотиосульфонатные реагенты описываются формулой R-S-X-углеводный фрагмент, где X обозначает SO2, и R обозначает необязательно замещенную фенильную, пиридильную или нафтильную группу. Такие реагенты обеспечивают сайт-селективное присоединение углевода к белку через дисульфидную связь. Предпочтительно, подлежащие модификации углеводы включают моносахариды, дисахариды, трисахариды, тетрасахариды, олигосахариды и другие полисахариды, а также включают любой углеводный фрагмент, который присутствует в природных гликопротеинах или в биологических системах. В их число включаются гликозильные или гликозидные производные, например глюкозильные, глюкозидные,галактозильные или галактозидные производные. Гликозильные и гликозидные группы включают как ,так игруппы. Подходящие углеводные фрагменты включают глюкозу, галактозу, фукозу, GlcNAc, GalNAc, сиаловую кислоту и маннозу, и полисахариды, включающие по меньшей мере один из остатков глюкозы, галактозы, фукозы, GlcNAc, GalNAc, сиаловой кислоты и/или маннозы. Углеводные фрагменты включают Glc(Ac)4-, Glc(Bn)4-, Gal(Ac)4-, Glc(Bn)4-, Glc(Ac)4(1,4)GlcMan(1-6)(Ac)4Man(1-3)(Ac)2Man-, -EtGal, -EtGlc, EtGlc, -EtMan, -Et-Lac, Glc(Ac)2, -Glc(Ac)3, -EtGlc(Ac)2, -EtGlc(Ac)3, -EtGlc(Ac)4, -EtGlc(Ac)2, -EtGlc(Ac)3, -EtGlc(Ac)4, -Et-Man(Ac)3, -EtMan(Ac)4, -EtGal(Ac)3, -EtGal(Ac)4, -Et-Lac(Ac)5, -Et-Lac(Ac)6, -Et-Lac(Ac)7 и их эквиваленты без защитных групп. Любые сахаридные единицы в составе углеводного фрагмента, получаемые из природных сахаров,могут иметь природную энантиомерную форму, которая может представлять собой либо D-форму (например, D-глюкозу или D-галактозу), либо L-форму (например, L-рамнозу или L-фукозу). Любые аномерные связи могут быть представлены - или -связями. В одном варианте осуществления настоящего изобретения углеводы, модифицируемые с целью включения в них азидной группы, представляют собой гликозилазиды. В одном варианте осуществления настоящего изобретения углеводы, модифицируемые с целью включения в них алкиновой группы, представляют собой алкинилгликозиды. Предпочтительно, углеводные фрагменты, модифицированные азидной и/или алкиновой группой/ами (например, гликозилазид и/или алкинигликозид) не включают защитную группу, то есть они не защищены. Незащищенные азид- или алкинмодифицированные углеводные фрагменты могут быть получены путем присоединения азидной или алкиновой группы к защищенному сахару. Защитные группы,подходящие для экранирования -ОН групп в углеводном фрагменте, включают ацетат (Ас), бензил (Bn),силил (например, трет-бутилдиметилсилил (TBDMSi) и трет-бутилдифенилсилил (TMDPSi, ацетали,кетали и метоксиметил (MOM). Позже защитную группу удаляют, до или после присоединения углеводного фрагмента к белку. В рамках такого способа проводят реакцию, определенную как реакция на стадии (ii), с незащищенным гликозидом. В предпочтительном аспекте настоящего изобретения Cu(I) катализатор представляет собой CuBr или CuI. Предпочтительно, катализатором является CuBr. Cu(I) катализатор может быть получен при использовании Cu(II) соли (например, Cu(II)SO4) в реакции, которая приводит к восстановлению до Cu(I) при добавлении восстановителя (например, аскорбата, гидроксиламина, сульфита натрия или элементарной меди) in situ в реакционную смесь. Предпочтительно Cu(I) катализатор получают путем непосредственного добавления Cu(I)Br к реакционной смеси. Предпочтительно получают Cu(I)Br с высокой степенью чистоты, например, с чистотой, равной по меньшей мере 99%, такой как 99,999%. ПредпочтительноCu(I) (например, Cu(I)Br) получают в растворителе, в присутствии стабилизирующего лиганда, например, азотистого основания. Указанный лиганд стабилизирует Cu(I) в реакционной смеси; в его отсутствие происходит быстрое окисление до Cu(II), Предпочтительно, указанный лиганд представляет собой тристриазолиламинный лиганд (Wormald and Dwek, Structure, 7, R155-R160 (1999. Растворитель для данного катализатора имеет рН в диапазоне 7,2-8,2. Растворитель может представлять собой смешиваемый с водой растворитель (например, трет-BuOH) или водный буфер, такой как фосфатный буфер. Предпочтительно растворителем является ацетонитрил.-4 013265 Реакция на стадии (ii) представляет собой реакцию циклоприсоединения по типу [3+2] между алкиновой группой (на белке и/или на гликозиде) и азидной группой (на белке и/или на гликозиде) с образованием замещенных 1,2,3-триазолов (Huigsen, Proc. Chem. Soc. 356-369 (1961, которые содержат связь между белком и одним или несколькими сахарами. Другой аспект настоящего изобретения относится к белку, модифицированному по способу первого или второго аспекта настоящего изобретения. Еще один аспект настоящего изобретения относится к белку формулы (I), (II) или (III) где а и b обозначают целые числа от 0 до 5 (например, 0, 1, 2, 3, 4 или 5): р и q обозначают целые числа от 1 до 5 (например, 1, 2, 3, 4 или 5); и где указанный белок соответствует приведенному в настоящем описании определению. Еще один аспект настоящего изобретения относится к гликозилированному белку, модифицированному по способу согласно второму аспекту настоящего изобретения. Настоящее изобретение также относится к гликозилированному белку формулы (IV) где t обозначает целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); и спейсер, который может отсутствовать, представляет собой алифатический фрагмент, содержащий от 1 до 8 атомов С. В предпочтительном аспекте настоящего изобретения спейсер представляет собой замещенную или незамеченную С 1-6 алкильную группу. Предпочтительно спейсер отсутствует или представляет собой метил или этил. В другом предпочтительном аспекте настоящего изобретения спейсер представляет собой гетероалкил, в котором гетероатом представлен О, N или S, и алкил представлен метилом или этилом. Предпочтительно гетероалкильная группа имеет формулу СН 2(Х)y, где X обозначает О, N или S, и Y обозначает 0 или 1. В типичном случае гетероатом непосредственно связан с углеводным фрагментом. Заместитель представляет собой галоген или фрагмент, содержащий от 1 до 30 поливалентных атомов, выбранных из С, N, О, S и Si, а также моновалентных атомов, выбранных из Н и галогена. В одном классе рассматриваемых соединений заместитель, если он присутствует, например, выбран из галогена и фрагментов, содержащих 1, 2, 3, 4 или 5 поливалентных атомов, а также моновалентные атомы, выбранные из водорода и галогена. Поливалентные атомы могут быть, например, выбраны из С, N, О, S, и В и могут, например, представлять собой С, N, S и О. Термин "замещенный", используемый в тексте настоящего описания применительно к фрагменту или группе, обозначает, что один или несколько атомов водорода в соответствующем фрагменте, в частности 1, 2 или 3 атома водорода, замещены, независимо друг от друга, соответствующим числом описанных заместителей. Следует также понимать, что заместители находятся только в тех положениях, которые являются химически возможными, и специалист в данной области способен определить (экспериментально или теоретически), без дополнительных усилий, какое из конкретных замещений является возможным. На-5 013265 пример, аминогруппы или гидроксильные группы со свободным водородом могут быть нестабильными,если они связываются с атомами углерода ненасыщенными (например, олефиновыми) связями. Кроме того, следует также понимать, что приведенные в описании заместители сами могут быть замещены любым заместителем, и такое замещение также ограничивается определенными рамками возможности их осуществления, как это известно специалистам в данной области. Замещенный алкил может представлять собой, например, алкил, определенный выше, который, в свою очередь, также замещен одним или несколькими заместителями, где указанные заместители, которые могут быть одинаковыми или разными, выбирают из гидроксигруппы, этерифицированного гидроксила, галогена (например фтора), гидроксиалкила (например, 2-гидроксиэтила), галогеналкила (например, трифторметила или 2,2,2-трифторэтила), аминогруппы, замещенной аминогруппы (например, Nалкиламино, N,N-диалкиламино или N-алканоиламино), алкоксикарбонила, фенилалкоксикарбонила,амидино, гуанидино, гидроксигуанидино, формамидино, изотиоуреидо, уреидогруппы, меркаптогруппы,ацила, ацилокси, такого как, например, этерифицированная карбоксигруппа, карбоксигруппы, сульфогруппы, сульфамоила, карбамоила, цианогруппы, азогруппы, нитрогруппы и т.п. В предпочтительном аспекте настоящего изобретения гликозилированный белок имеет формулу (V) где р и q обозначают целые числа от 0 до 5 (например, 0, 1, 2, 3, 4 или 5); и t обозначает целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); и где белок и углеводный фрагмент соответствуют приведенному в настоящем описании определению. Белок или углеводный фрагмент могут быть присоединены к 1,2,3-триазолу в положении 1 или 2,как показано ниже в формулах (VI) и (VII). Таким образом, гикозилированный белок согласно настоящему изобретению может иметь формулу (VI) или (VII) где белок, углеводный фрагмент, р, q и t соответствуют приведенному в настоящем описании определению. Предпочтительно р равно 2. Предпочтительно q равно 0. Настоящее изобретение также относится к гликозилированному белку формулы (VIII) где и обозначает целое число от 1 до 5 (например, 1, 2, 3, 4 или 5); спейсер и t соответствуют приведенному в настоящем описании определению, и W и Z представляют собой углеводные фрагменты, которые могут быть одинаковыми или разными. Предпочтительно, гликозилированный белок имеет формулу (IX) где спейсер, р, q, t и u соответствуют приведенному в настоящем описании определению; и где r и s обозначает целые числа от 0 до 5 (например, 0, 1, 2, 3, 4 или 5). Предпочтительно, гликозилированный белок имеет формулу (X) или (XI) где белок, углеводный фрагмент, спейсер, р, q, r, s, t и u соответствуют приведенному в настоящем описании определению. Гликозилированные белки согласно настоящему изобретению в типичном случае сохраняют присущую им функцию, а некоторые белки могут демонстрировать даже усиление данной функции, например повышенную ферментативную активность (относительно негликозилированного фермента) после гликозилирования в соответствии с настоящим изобретением. Гликозилированные белки согласно настоящему изобретению могут также демонстрировать дополнительные связывающие способности по типу белок-белок с другими белками, например способность связываться с лектином. Таким образом,способ согласно настоящему изобретению полезен с точки зрения возможности манипулировать белковыми функциями, например, с целью включения в белок дополнительной, не свойственной ему функциональной способности, такой как способность к связыванию по типу белок-белок с другими белками,например с лектинами. Гликозилированные белки согласно настоящему изобретению могут использоваться в медицине,например, при лечении или с целью профилактики заболевания или патологического состояния. Таким образом, настоящее изобретение относится к фармацевтической композиции, содержащей рассматриваемый в нем гликозилированный белок в сочетании с фармацевтически приемлемым носителем или разбавителем. Белки согласно настоящему изобретению могут быть полезны, например, при лечении анемии или болезни Гоше. В тексте всего описания и в формуле изобретения слова "включает" и "содержит", а также различные вариации данных слов, например, "включающий", следует трактовать как "включающие", но "не ограничивающиеся" и их не следует понимать как исключающие какие-либо другие фрагменты, добавки,компоненты, целые числа или стадии. В тексте всего описания изобретения и в формуле изобретения единственное число относится равным образом к множественному числу, если из контекста явно не следует иное. В частности, в случае использования неопределенного артикля следует понимать, что данная фраза относится также к множественному числу, если из контекста явно не следует иное. Признаки, целые числа, характеристики, соединения, химические фрагменты или группы, описанные в сочетании с конкретным аспектом, вариантом или примером согласно настоящему изобретению,следует понимать как применимые к любому другому аспекту, варианту или примеру, описанному здесь,если указанные характеристики не являются несовместимыми с ними. Ниже настоящее изобретение описывается со ссылкой на следующие не ограничивающие его примеры. Примеры Множественный сайт-направленный мутагенез Получают ряд мутантов -галактозидазы SsG с использованием набора для множественного сайтнаправленного мутагенеза (Quik-Change Multi Site-Directed Mutagenesis Kit), доступного от компанииStratagene [каталожный номер 200514]. Плазмиду pET28d, содержащую SsG C344, используют в качестве матрицы 1. Соответствующие мутагенные праймеры получают при замене остатков Met остаткамиIle и проводят обычный синтез с использованием синтезатора Sigma-Genosys в следующем формате: Таким способом могут быть введены мутанты с желательным количеством Met остатков (от 1 до 10). Другие мутации осуществляют по методике однократного сайт-направленного мутагенеза с использованием набора комплементарных прямых и обратных мутагенных праймеров: Таблица S2 Соответствующие мутантные белки могут быть экспрессированы с использованием описанного ниже протокола экспрессии. Экспрессия белка с включенным аналогом Met Экспрессию белков с включенным в их состав гомопропаргилглицином (Hpg) или азидогомоаланином (Aha) проводят по протоколу среднего смещения 2. Ночную культуру Escherichia coli B834 (DE3),pET28d SsG C344S растят в среде с определенными молекулярными характеристиками (16 ч), содержащей добавки канамицина (50 мкг/мл) и L-метионина (40 мкг/мл). Используют ночную культуру для инокуляции предварительно нагретой (до 37 С) культуральной среды (1,0 л, указанного выше состава) и клетки растят в течение 3 ч (до OD600 1,2). Смещение среды осуществляют путем центрифугирования(6000 об/мин, 10 мин, 4 С), ресуспендирования в среде, не содержащей метионина (0,5 л), и переноса в предварительно нагретую (37 С) культуральную среду (1,0 л), содержащую неприродную аминокислоту(DL-Hpg, в концентрации 80 мкг/мл, L-Aha, в концентрации 40 мкг/мл). Культуру встряхивают в течение 15 мин при 29 С и затем подвергают индукции путем добавления IPTG до концентрации 1,0 мМ. Экспрессию белка проводят при той же температуре, 29 С в течение 12 ч. Полученную культуру центрифугируют (9000 об/мин, 15 мин, 4 С) и осадок клеток замораживают при -80 С. Белок очищают аффинной хроматографией с использованием никеля: клеточный осадок переносят в буфер для связывания (50 мл) и клетки разрушают озвучиванием (330 с, с амплитудой до 60%), после чего суспензию центрифугируют (20000 об/мин, 20 мин, 4 С). Супернатант фильтруют (0,8 мкм) и белок очищают на колонке для аффинной хроматографии с никелем, проводя элюцию возрастающими концентрациями имидазола. Элюцию сопровождают определением УФ поглощения при 280 нМ и соответствующие фракции объединяют. Объединенные фракции подвергают диализу (MWCO 1214 кДа) при 22 С в течение ночи против натрий-фосфатного буфера (50 мМ, рН 6,5, 4,01). Белковый раствор фильтруют (0,2 мкм) и хранят при температуре 4 С.L-гомоазидоаланин синтезируют по реакции перегруппировки Хофманна, проводят диазоперенос и удаление защитной группы по стратегии, описанной в литературе.3DL-гомопропаргилглицин получают из дизтилацетамидомалоната путем алкилирования гомопропаргилом, с последующими гидролизом и декарбоксилированием, как было описано ранее.2 1-Азидо-2-ацетимидо-2-дезоксиD-гликопиранозид 1N-Ac-глюкозилазид синтезируют из соответствующим образом защищенного ацетилом гликозилхлорида с проведением впоследствии реакции деацетилирования Земплена (Zemplen)4. Хитобиозилазид 2 Хитобиозилазид получают по методике, описанной Макмилланом с соавт. (Macmillan et al)5. Реагент -глюкопиранозил-MTS получают из известного бромида путем удаления защитной группы и замещения метантиосульфонатом, по описанной в литературе методике 6. Азидоэтилманнопиранозид 3 синтезируют в соответствии с описанными в литературе процедурами из пентаацетата маннозы путем гликозилирования бромэтанолом с последующим замещением азидом 6,7. трис-Триазольный лиганд 11 Трис-триазольный лиганд 11 получают из азидоэтилацетата и трипропаргиламина, по описанной ранее методике 8. Этинил-С-галактозид 5 ЭтинилС-галактозид получают по процедуре, используемой для получения известного Сглюкозида, описанной в работе Xu, Jinwang; Egger, Anita; Bernet, Bruno; Vasella, Andrea; Helv. Chim. Acta; 79 (7), 1996, 2004-2022. Диэтилгомопропаргилацетамидомалонат (55 мг, 0,20 ммоль), HO3GlcNAc-N3 1 (101 мг, 0,41 ммоль),аскорбат натрия (202 мг, 10 ммоль) и лиганд трис-триазолеиламина 11 (6 мг, 0,012 ммоль) растворяют в смеси MOPS буфера (рН 7,5, 0,2 М; 4,0 мл) и трет-бутилового спирта (2,0 мл). К перемешиваемому раствору добавляют раствор сульфата меди(II) (0,1 М, 100 мкл, 0,01 ммоль) и реакционную смесь перемешивают в течение 28 ч при комнатной температуре. Затем выпаривают растворитель при пониженном давлении и полученный остаток очищают флэш-хроматографией на колонке (силикагель, AcOEt до 15% МеОН в AcOEt). Полученный продукт имеет вид бесцветной пленки (83 мг, 79%) . Метил-(S)-2-[N-ацетиламино]-4-1-(2-дезокси-N-ацетиламиноD-глюкопиранозил)[1,2,3]триазол-4 илбутаноат Бромид меди (10 мг, 0,070 ммоль) растворяют в ацетонитриле (1 мл) и добавляют лиганд (0,58 мл 0,12 М раствора в ацетонитриле). Указанный раствор (38 мкл, с 5% содержанием катализатора) добавляют к раствору алкинаминокислоты (15 мг, 0,08 ммоль) и сахара 2 (31 мг, 0,13 ммоль) в натрийфосфатном буфере (0,5 мл, 0,15 М, рН 8,2). Реакционную смесь перемешивают в атмосфере аргона при комнатной температуре в течение 1 ч, после чего проводят анализ методом ТСХ, результаты которого указывают на исчезновение исходного алкинового материала. Далее смесь разбавляют этилацетатом и промывают водой (10 мл), после чего водный слой промывают AcOEt. Водный слой выпаривают досуха при пониженном давлении. Остаток очищают колоночной хроматографией (силикагель 1:1, этилAcOEt/iPrOH до 4:4:2 H2O/iPrOH/AcOEt) с получением требуемого 1,2,3-триазола (26 мг, 74%) в виде бесцветного стеклоподобного твердого вещества. Метил-(S)-2-[N-ацетиламино]-4-4-(-D-галактопиранозил)[1,2,3]-триазол-1-илбутаноат Бромид меди (10 мг, 0,07 0 ммоль) растворяют в ацетонитриле (1 мл) и добавляют лиганд тристриазолиламин (0,58 мл, 0,12 М в ацетонитриле). Раствор (45 мкл, с 5% содержанием катализатора) добавляют к раствору аминокислоты (20 мг, 0,10 ммоль) и сахара 5 (28 мг, 0,13 ммоль) в натрий-фосфатном буфере (0,5 мл, 0,15 М, рН 8,2). Реакционную смесь перемешивают в атмосфере аргона при комнатной температуре в течение 3 ч. Далее реакционную смесь выпаривают досуха при пониженном давлении и остаток очищают колоночной хроматографией (силикагель 9:1, AcOEt/MeOH до 4:4:2 H2O/iPrOH/AcOEt) с получением требуемого 1,2,3-триазола (37 мг, 97%) в виде белого твердого вещества.- 10013265 простой ферментативный синтез SiaLacNAc с высоким выходом (по процедуре, описанной в литературе:Baisch, et al.). Ни на одной стадии очистки, за исключением стадии флэш-хроматографии на колонке, не требуется получать какой-либо из продуктов. 2-Ацетамидо-2-дезокси-1-пропаргилD-глюкопиранозид 2-Ацетамидо-2-дезокси-1-пропаргилD-глюкопиранозид был описан ранее. Для целей настоящего изобретения его получают по описанной ниже схеме, в соответствии с методикой Vauzeilles, Boris; 2-Ацетамидо-2-дезокси-1-пропаргилD-глюкопиранозид (15,0 мг, 0,058 ммоль) и динатриевую соль уридин-5'-дифосфогалактозы (59 мг, 0,092 ммоль) растворяют в 1,0 мл натрий-какодилатного буфера (0,1 М, 25 мМ MnCl2, 1 мг/мл бычьего сывороточного альбумина, рН 7,41). Добавляют -1,4 галактозилтрансферазу (ec 2.4.1.22, 0,8 Ед) и щелочную фосфатазу (ec 3.1.3.1, 39 Ед) и смесь осторожно встряхивают при температуре 37 С в течение 21 ч, после чего проводят ТСХ (вода: изопропиловый спирт: этилацетат, 1:2:2), результаты которого указывают на полной потребление акцептирующего сахара (Rf 0,8). Реакционную смесь лиофилизируют на силикагеле и очищают флэш-хроматографией на колонке (вода: изопропиловый спирт: этилацетат, 2:5:6) с получением 23,7 мг (97% выход) белого аморфного твердого вещества. Пропаргил-(5-ацетимидо-3,5-дидезокси-d-глицероD-галакто-2-нонулопиранозилоновая кислота(23)D-галактопиранозил-(14)-2-ацетимидо-2-дезоксиD-глюкопиранозид 2-Ацетамидо-2-дезокси-4-Od-галактопиранозил-1-пропаргил-D-глюкопиранозид (12 мг, 0,028 ммоль) и растворяют в 1,4 мл воды. Добавляют какодилат натрия (60 мг, 0,28 моль, до конечной концентрации: 0,2 М), тетрагидра.т хлорида марганца (8 мг, 0,041 ммоль, до конечной концентрации 29 мМ) и бычий сывороточный альбумин (2 мг). рН доводят до значения 7,1 перед добавлением натриевой соли цитидин-5'-монофосфо-N-ацетилнейраминовой кислоты (19,8 мг, 1 эквивалент), -2,3-(N)-сиалилтрансферазы, рекомбинантный вариант из Spodoptera frugiperda, ec 2.4.99.6, 30 мЕд) и щелочную фосфатазу (ec 3.1.3.1, 30 Ед), после чего смесь осторожно встряхивают при температуре 37 С в течение 70 ч, и затем реакционную смесь лиофилизируют на силикагеле и очищают флэш-хроматографией на колонке (вода:изопропиловый спирт:этилацетат, 5:11:15) с получением 20,9 мг аморфного твердого вещества (выход 95%). Тест ELISA для оценки роли сульфотирозина в связывании Р-селектина Проводят эксперименты с целью демонстрации того, что белки, гликозилированные согласно настоящему изобретению, обладают измененными биологическими свойствами по связыванию. Тест ELISA был модифицирован относительно описанной ранее в литературе процедуры тестирования. Модифицированные белки SsG вносят в ячейки микротитрационного планшета в количестве 200 нг/ячейку (NUNC Maxisorp, 2 мкг/мл, 50 мМ карбонатный буфер, рН 9,6). Добавляют дитиотреитол (5 мкл/ячейку, 50 мг/мл, в воде) для снижения имитирующего эффекта сульфатированного тирозина применительно к соответствующим линиям. Планшет инкубируют при температуре 4 С в течение 15 ч. Содержимое ячеек блокируют добавлением бычьего сывороточного альбумина (25 мг/мл, в буфере для анализа: 2 мМ CaCl2, 10 мМ Трис, 150 мМ NaCl, рН 7,2, 200 мкл/ячейку) на 2 ч при температуре 37 С. Планшеты промывают промывочным буфером (буфер для анализа, содержащий 0,05% об./об. Твин 20, 3400 мкл на ячейку) перед добавлением Р-селектина (от Calbiochem, каталожный номер 561306, рекомбинантный вариант в СНО-клетках с усеченной последовательностью, без трансмембранного и цитоплазматического доменов, в двойном серийном разведении из 400 нг/ячейку до 1,6 нг/ячейку, для каждого различным образом модифицированного мутанта SsG в 100 мкл промывочного буфера). Планшеты инкубируют при 37 С в течение 3 ч. После промывания дважды промывочным буфером ячейки инкубируют с анти-Р-селектиновым антителом (IgG1 подтип, Chemicon, клон AK-6, 100 нг/ячейку, в 100 мкл буфера для анализа) в течение 1 ч при температуре 21 С (плюс 3 контрольных ячейки) и промывают промывочным буфером (3300- 11013265 мкл/ячейку). Каждую из ячеек инкубируют с анти-мышиным IgG-специфичным конъюгатом с пероксидазой хрена (от Sigma, A 0168) в течение 1 ч при температуре 21 С. Ячейки промывают промывочным буфером(3300 мкл). Наличие связывания визуализируют путем добавления раствора субстрата ТМВ (от SigmaAldrich, T0440, 100 мкл на ячейку) и инкубируют в темноте при температуре 22 С до тех пор, когда величина поглощения при 370 нм не установится в линейном диапазоне (примерно через 15 мин). В рамках указанной выше методики проводят исследование по оптимизации процесса с использованием 1,5 экв. этинил-С-галактозида 5, относительно Aha.- по данным 1 Н ЯМР (D2O, 500 МГц); величина подтвержденного выхода в результате очистки,при рН 8,2 составляет 84%. Получение фрагмента Тамма-Хорсфолла (Tamm-Horsfall) Аналоги (H2N-Gln-Asp-Phe-Aha/Hpg-Ile-Thr-Asp-Ile-Cys-Leu-Leu-Glu-C(О)NH2) пептидного фрагмента Тамма-Хорсфолла (ТНр) (295-306; H2N-Gln-Asp-Phe-Asn-Ile-Thr-Asp-Ser-Leu-Leu-Glu-C(O)NH2)12 были синтезированы в соответствии с методами Fmoc-химии на амиде МВНА-полистироловой смолыRink [1% дивинилбензол, Novabiochem каталожный номер 01-64-0037] с использованием пептидного синтезатора, включающего устройство для микроволновой обработки, Liberty-CEM. Репрезентативная процедура проведения глико-циклоприсоединения Aha-содержащего белка азидопротеина ЭтинилС-галактозид (5 мг, 0,027 ммоль) 5 растворяют в натрий-фосфатном буфере (0,5 М, рН 8,2, 200 мкл). К указанному выше раствору добавляют раствор белка (0,2 мг в 300 мкл) и все хорошо перемешивают. Проводят предварительное смешивание свежеприготовленного раствора бромида меди(I)(99,999%) в ацетонитриле (33 мкл в концентрации 10 мг/мл) с ацетонитрильным раствором лиганда тристриазолиламина 11 (12,5 мкл в концентрации 120 мг/мл). К смеси добавляют раствор ранее образованного Cu-комплекса (45 мкл) и реакционную смесь перемешивают на качалке в течение 1 ч при комнатной температуре. Затем реакционную смесь центрифугируют для удаления какого-либо осадка солей Cu(II),супернатант обессоливают на колонке PD 10 и затем проводят элюцию деминерализованной водой (3,5 мл). Элюент концентрируют на мембранном концентраторе vivaspin (при отсечении величины пороговой молекулярной массы 10 кДа) и промывают 50 мМ раствором ЭДТА и затем деминерализованной водой(350 мкл). В итоге раствор концентрируют до 100 мкл и определяют характеристики продукта методамиLC-MS, гель-электрофореза в SDS-PAGE, CD, путем расщепления трипсином и при проведении анализа продуктов расщепления трипсином методами LC-MS/MS. Данные анализа методом ВЭЖХ/МС после расщепления трипсином для репрезентативного исходного материала SsG-Cys344Ser-Met21Aha-Met43-Aha-Met73Aha-Met148Aha-Met204Aha-Met236AhaMet275Aha-Met280Aha-Met383Aha-Met439Aha Таблица S3 Данные анализа методом ВЭЖХ/МС после трипсинового расщепления региоселективно тригалактозилированного SsG-Cys344Ser-Met21Aha-Met43-T-Gal-Met73Aha-Met148Aha-Met204Aha-Met236AhaMet275Aha-T-Gal-Met280Aha-T-Gal-Met383Aha-Met439Aha Таблица S4 Примечание: Нумерация остатков основана на фактически имеющихся аминокислотах и включаетHis-метку. Нумерация, использованная в остальной части текста, основана на последовательности SsG дикого типа. Таким образом, например, трипсиновый фрагмент Т 29 280-292 соответствует участку 274286 (K)D[TGal]EAVE[TGal]AENDNR(W). Гликоциклоприсоединение Hpg-содержащего белка алкинилпротеина Аналогичную процедуру используют для модификации Hpg-содержащих белков. В данном случае углевод, содержащий азид (HO3GlcNAcN3) 1, используют в данной реакции вместо алкинилСгликозида. Двойная дифференциальная гликоконъюгация ТНр фрагмента К раствору только что синтезированного пептида (пептида с включением Hpg или Aha, 0,5 мг) в водном фосфатном буфере (50 мМ, рН 8,2, 0,3 мл) добавляют раствор глюкозида MTS-реагента 7 в воде(50 мкл, 33 мМ, 5 экв.). Реакционную смесь помещают на качалку на 1 ч и затем отбирают аликвоты для анализа по методу LCT-MS с использованием колонки Phenomenex Gemini 5 мк С 18 110 А (скорость потока 1,0 мл/мин, градиент мобильной фазы: 0,05% муравьиной кислоты в H2O до 0,05% муравьиной кислоты в MeCN в течение 20 мин). Раствор комплексного медного катализатора получают при растворении бромида меди (5 мг,99,999% чистоты) и трис-триазольного лиганда 11 (18 мг) в MeCN (0,5 мл). Этинилсахар 5 или азидосахар 1 (6 мг) растворяют в реакционной смеси, используемой для гликоконъюгации через дисульфидную связь до добавления комплексного соединения меди(I) (15 мкл). Завершение реакции между Aha-пептидом и этинилсахаром, определяемое по результатам анализаHpg-пептид и азидосахар, добавляют в избыточном количестве раствор комплекса меди(I) (10 мкл). Еще через 1 ч проводят анализ LC-MS, который показывает полное превращение исходного материала в желательный конъюгированный продукт. Реакционные сайты маркированы на схеме кружками: Комментарии по оптимизации условий гликоциклоприсоединения Тристриазоловый лиганд 11 был описан ранее в литературе 13 в качестве агента, используемого при стабилизации Cu(I) в водной реакционной смеси. В его отсутствии происходит быстрое окисление доCu(II). В связи с низкой растворимостью CuBr в других растворителях, был выбран ацетонитрил. Было показано, что слабо щелочная буферная система (рН 7,5 - рН 8,5) лучше всего подходит для реакции модификации. Многие ранее описанные в литературе примеры основаны на восстановлении insitu соли Cu(II) при добавлении к реакционной смеси восстановителя. Все попытки авторов использовать восстановление in situ Cu(II) в направлении каталитической модификации белка были безрезультатными. Качество спектральных характеристик соответствующих образцов было низким, и удаление свертки дает недостаточный сигнал для определения шумового коэффициента. Ферментативная активность Проводят кинетический анализ, который показывает, что мутантные белки и гликоконъюгаты сохраняют ферментативную активность (данные не приведены). Исследования по связыванию с лектином Были проведены эксперименты, которые показали, что гликоконъюгированные сахара влияют на биологическую доставку. Лектин-связывающие свойства 15 гликоконъюгированных SsG мутантов были охарактеризованы в рамках анализа их удерживающей способности на аффинных колонках с иммобилизованным лектином[Galab, каталожный номер PNA, Arachis hypogaea: 051061, Con A: 051041, Triticum vulgaris, K-WGA1001]. Элюированные фракции визуализируют с использованием реагента Брэдфорда 14 и определяют поглощение при длине волны 595 нм. Таблица S7Man SsG демонстрирует явное связывание с лектином бобовых конканавалином A (Con A), тогда как Glc-конъюгат (Glc SsG) не демонстрирует выраженного связывания выше фонового значения. То же самое было показано для случая связывания -Gal-триазол-конъюгированного SsG с галактофильным лектином из арахиса, агглютинином (PNA). Хитобиозный конъюгат (GlcNAc SsG) и, в меньшей степени, GlcNAc конъюгаты, как было показано по результатам хроматографического анализа на спинаффинных колонках, также связываются с лектиновым агглютинином из зародышей пшеницы (WGA),задерживая высвобождение неогликопептидов. Отсутствие связывания глюкозных конъюгатов, в отличие от маннозных конъюгатов, можно объяснить меньшей аффинностью Con А для глюкозы 16. Относительное связывание моносахаридов с Con А,как было показано, происходит в следующем порядке: MeMan:Man:MeGlu:Glu, в соотношении 21:4:5:1. Из этого следует, что маннозные моносахариды связываются в 4 раза прочнее с Con А, чем моносахариды глюкозы. Ароматический триазол также может вносить вклад в повышенное связывание маннозида, в сравнении с глюкозидом, осуществляемое через дисульфидную связь 17. Отсутствие связывания, выявляемое в некоторых конструкциях и не выявляемое в ряде других указанных выше конструкций, демонстрирует потребность в надежной процедуре получения гликопротеинов. Доступность растворителей В настоящий момент имеется лишь несколько исследований, относящихся к реакционной способности белков в химических реакциях, из числа тех, которые дают возможность провести интегрированную оценку 18 доступности аминокислотных остатков 19-21. Кристаллическую структуру SsG получали в соответствии с методикой, описанной в работе 22. Доступность растворителя для мономера А в димерной форме SsG определяют по методике Naccess23. Результаты оценки доступности мономера В дают практически идентичные значения. Значения, приведенные в виде относительной полной доступности боковой цепи, представляют особый интерес для данного исследования. Она является мерой доступности боковой цепи данной аминокислоты X относительно доступности той же самой боковой цепи в трипептиде Ala-X-Ala. В этой связи можно ожидать, что доступность N-концевого остатка Met1 при исследовании SsG мутантов даст более высокие значения,чем расчетные значения для белка дикого типа (WT), поскольку экспрессированные мутанты содержатMet1-Gly2, отделенный His7-меткой от остальной части последовательности (остатки не пронумерованы). Доступность растворителей проводят далее с использованием природной аминокислотной последовательности, а не на мутантах, например, содержащих включенный гомоазидоаланин и гомопропаргилглицин. Расчеты проводят с использованием зондов разных размеров (1,0, 1,4 и 2,9 ), и было показано, что по мере повышения размера зонда становится доступным все меньшее число боковых цепей аминокислот. На основании приведенных данных (см., приведенную ниже таблицу), следует ожидать, что метиониновые остатки в положениях 1, 43, 275 и 280 являются относительно доступными. То же самое можно ожидать в случае мутантов, которые являются их аналогами по метионину. Таблица S8- 16013265 Цилиндрическая форма TIM Наиболее распространенной третичной складчатой структурой, наблюдаемой при исследовании кристаллических структур белков, является TIM цилиндр. Считается, что он присутствует в 10% всех белков 24. Гликопротеин Тамма-Хорсфолла (Tamm-Horsfall)(THp) ТНр представляет собой наиболее широко представленную форму гликопротеина у млекопитающих 12,25. Как известно и N-, и О-гликозилирование играют ключевую роль в биологической функции ТНр 26. Известно, что семь из восьми возможных сайтов гликозилирования являются Nгликозилированными. В их число входит Asn-298 остаток 27. Гликозилирование эритропоэтина и гликозилцерамидазы В случае эритропоэтина, соответствующими сайтами гликозилирования являются Asn24, Asn38 иAsn 83 для N-связанных углеводов. Данный белок содержит единственный сайт О-связанного гликозилированного в положении Ser126. С использованием методики множественного сайт-направленного мутаганеза и включения метиониновых аналогов в сайты вновь введенных Met (природная последовательность Еро содержит только один метионин (М 54 данный белок может быть модифицирован. Глюкозилцерамидаза (D-глюкоцереброзидаза), представляющая собой гликопротеин размером 60 кДа, который играет важную роль в развитии болезни Гоше, также может быть гликозилирована по данной методике. Список цитированной литературы 1. Hancock, S. M., Corbett, K., Fordham-Skelton, A. P., Gatehouse, J. A.Davis, В. G. Developing promiscuous glycosidases for glycoside synthesis: Residues W433 and E432 in Sulfolobus solfataricus betaglycosidase are important glucoside- and galactoside-specificity determinants. ChemBioChem 6, 866-875i) модификации белка для включения алкиновой и/или азидной группы иii) взаимодействия модифицированного белка пункта (i) с(a) углеводным фрагментом, модифицированным для включения азидной группы, и/или(b) углеводным фрагментом, модифицированным для включения алкиновой группы в присутствииCu(I) катализатора, где указанный Cu(I) катализатор получают в растворителе в присутствии стабилизирующего лиганда. 2. Способ по п.1, где стабилизирующий лиганд представляет собой стабилизирующий аминный лиганд. 3. Способ по п.2, где указанный лиганд представляет собой тристриазолиламинный лиганд. 4. Способ по любому из предшествующих пунктов, где указанный Cu(I) катализатор выбирают из группы, состоящей из CuBr и CuI. 5. Способ по п.4, где указанный Cu(I) катализатор представляет собой Cu(I)Br. 6. Способ по любому из предшествующих пунктов, где указанная модификация белка включает замещение одной или нескольких аминокислот в белке одним или несколькими неприродными аналогами аминокислот. 7. Способ по п.6, где указанный неприродный аналог аминокислоты представляет собой аналог метионина. 8. Способ по любому из предшествующих пунктов, где указанный аналог метионина представляет собой гомопропаргилглицин или азидогомоаланин. 9. Способ по любому из предшествующих пунктов, где указанный белок включает более 10 аминокислот. 10. Способ по п.9, где указанный белок включает от 10 до 1000 аминокислот. 11. Способ по любому из предшествующих пунктов, где указанный белок имеет молекулярную массу свыше 10 кДа. 12. Способ по п.10, где указанный белок имеет молекулярную массу от 10 до 100 кДа. 13. Способ по любому из предшествующих пунктов, где указанный белок выбирают из группы, состоящей из гликопротеинов, белков крови, гормонов, ферментов, рецепторов, антител, интерлейкинов и интерферонов. 14. Способ по п.13, где указанный белок является гормоном. 15. Способ по п.14, где указанный гормон представляет собой эритропоэтин. 16. Способ по любому из предшествующих пунктов, где указанная модификация белка (стадия i) дополнительно включает стадию модификации белка для включения тиоловой группы. 17. Способ по п.16, где указанную тиоловую группу вводят путем инсерции цистеинового остатка в аминокислотную последовательность белка. 18. Способ по п.16 или 17, где способ включает взаимодействие модифицированного белка, модифицированного на стадии (i) с тиолселективным углеводным реагентом. 19. Способ по п.18, где указанный тиолселективный углеводный реагент представляет собой реагент, который взаимодействует с тиоловой группой в белке для введения гликозильного остатка, связанного с белком через дисульфидную связь. 20. Способ по п.19, где указанный тиолселективный углеводный реагент представляет собой гликотиосульфонатный реагент. 21. Способ по п.20, где указанный гликотиосульфонатный реагент представляет собой гликометантиосульфонатный реагент. 22. Способ по любому из пп.16-19, где указанный тиолселективный реагент представляет собой гликоселенилсульфидный реагент. 23. Белок формулы (III) где а и b представляют целые числа от 0 до 5; и р и q представляют целые числа от 1 до 5, и указанный белок включает по крайней мере 10 аминокислот. 24. Гликозилированный белок формулы (IV) где t обозначает целое число от 1 до 5; и спейсер, который может отсутствовать, представляет собой алифатический фрагмент, содержащий от 1 до 8 атомов С; и указанный белок включает по крайней мере 10 аминокислот. 25. Гликозилированный белок по п.24, где указанный спейсер выбирают из группы, состоящей из С 1-6 алкильной группы и С 1-6 гетероалкила. 26. Гликозилированный белок по п.25, где указанный спейсер выбирают из группы, состоящей из метила, этила и СН 2(Х)y, где X обозначает О, N или S и у равен 0 или 1. 27. Гликозилированный белок по любому из пп.24-26, где указанный белок имеет формулу (V) где р и q обозначают целое число от 0 до 5 и t обозначает целое число от 1 до 5. 28. Гликозилированный белок по п.27, где указанный белок имеет формулу (VI) 29. Гликозилированный белок по п.27, где указанный белок имеет формулу (VII) 30. Гликозилированный белок формулы (VIII) где u и t обозначают целые числа от 1 до 5; спейсер, который может отсутствовать, представляет собой алифатический фрагмент, содержащий от 1 до 8 атомов С; и W и Z представляют собой углеводные фрагменты, которые могут быть одинаковыми или различными. 31. Гликозилированный белок по п.30, имеющий формулу (IX) где р, q, r и s обозначают целые числа от 0 до 5.- 19013265 32. Гликозилированный белок по п.31, имеющий формулу (X) 33. Гликозилированный белок по п.31, имеющий формулу (XI) 34. Белок по любому из пп.23-33, где указанный белок включает от 10 до 1000 аминокислот. 35. Белок по любому из пп.23-33, где указанный белок имеет молекулярную массу свыше 10 кДа. 36. Белок по п.35, где указанный белок имеет молекулярную массу от 10 до 100 кДа. 37. Белок по любому из пп.23-36, где указанный белок выбирают из группы, состоящей из гликопротеинов, белков крови, гормонов, ферментов, рецепторов, антител, интерлейкинов и интерферонов. 38. Белок по п.37, где указанный белок является гормоном. 39. Белок по п.38, где указанный гормон представляет собой эритропоэтин. 40. Применение белка по любому из пп.23-39 в качестве лекарственного средства.
МПК / Метки
МПК: C07K 1/107
Метки: белков, гликозилирование
Код ссылки
<a href="https://eas.patents.su/21-13265-glikozilirovanie-belkov.html" rel="bookmark" title="База патентов Евразийского Союза">Гликозилирование белков</a>
Предыдущий патент: Производные n-(гетероарил)-1н-индол-2-карбоксамидов и их применение в качестве лигандов ваниллоидного рецептора trpv1
Следующий патент: Фармацевтическая композиция, содержащая симвастатин и эзетимиб
Случайный патент: Композиции, содержащие фосфатидные кислоты.












