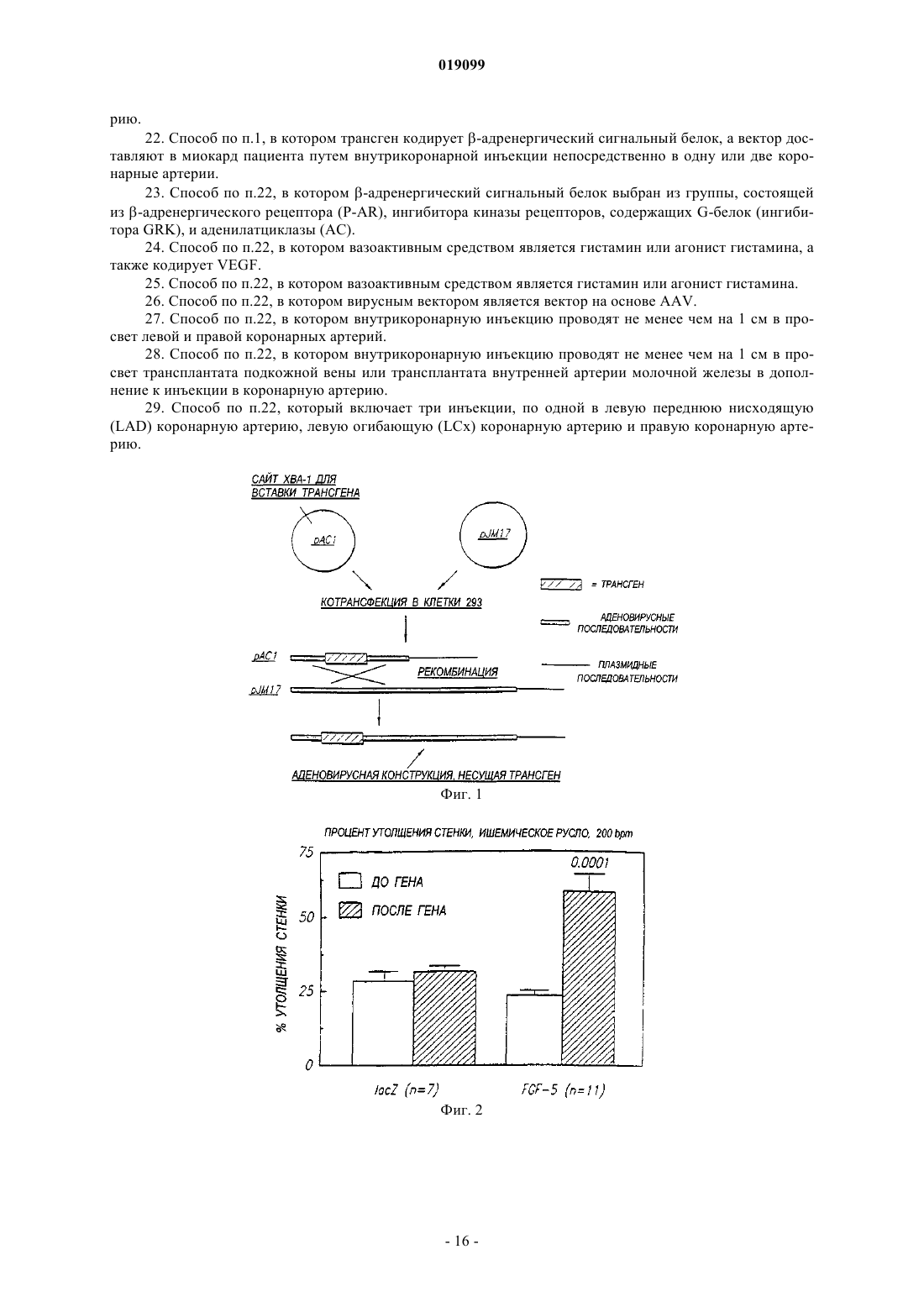
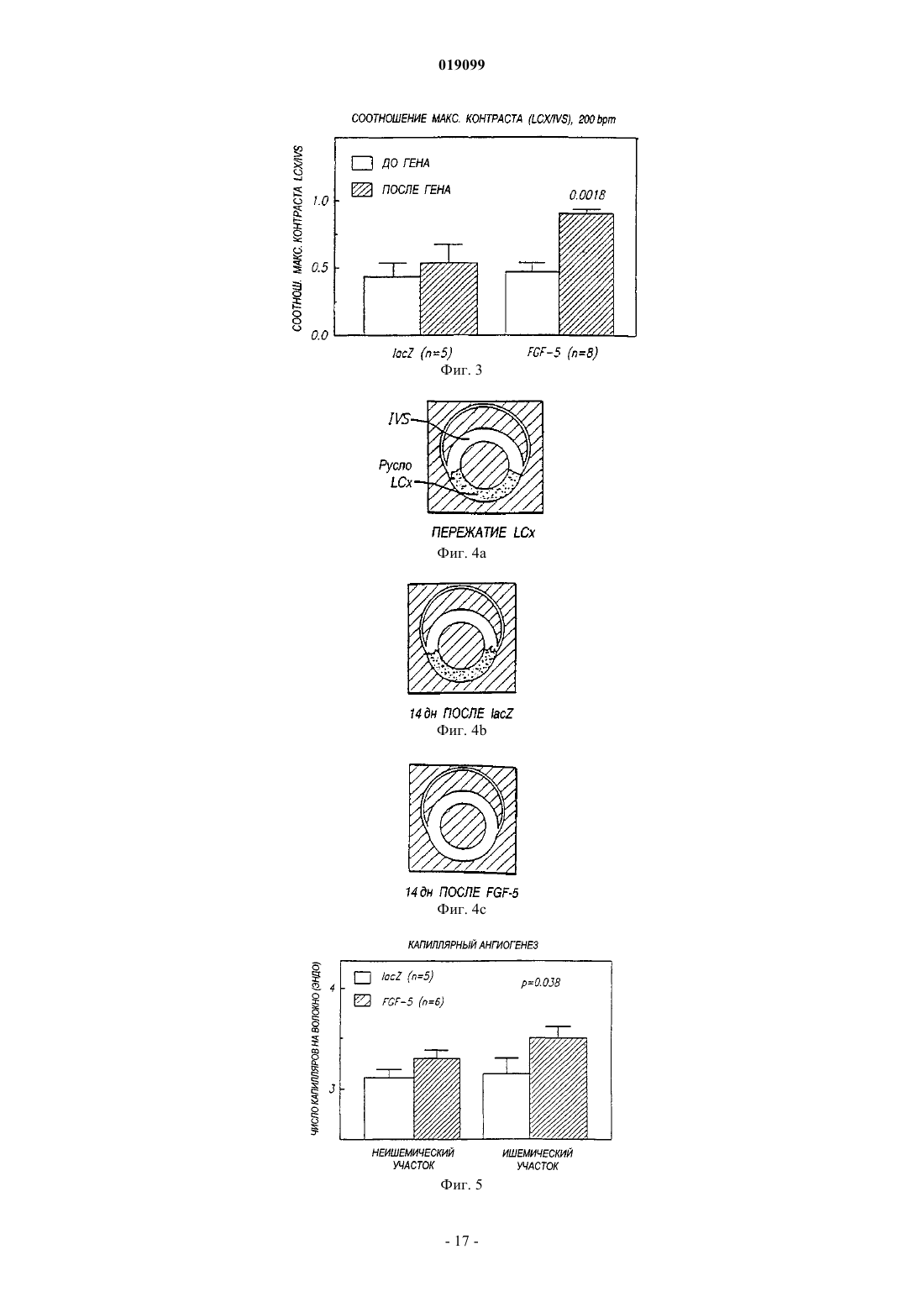
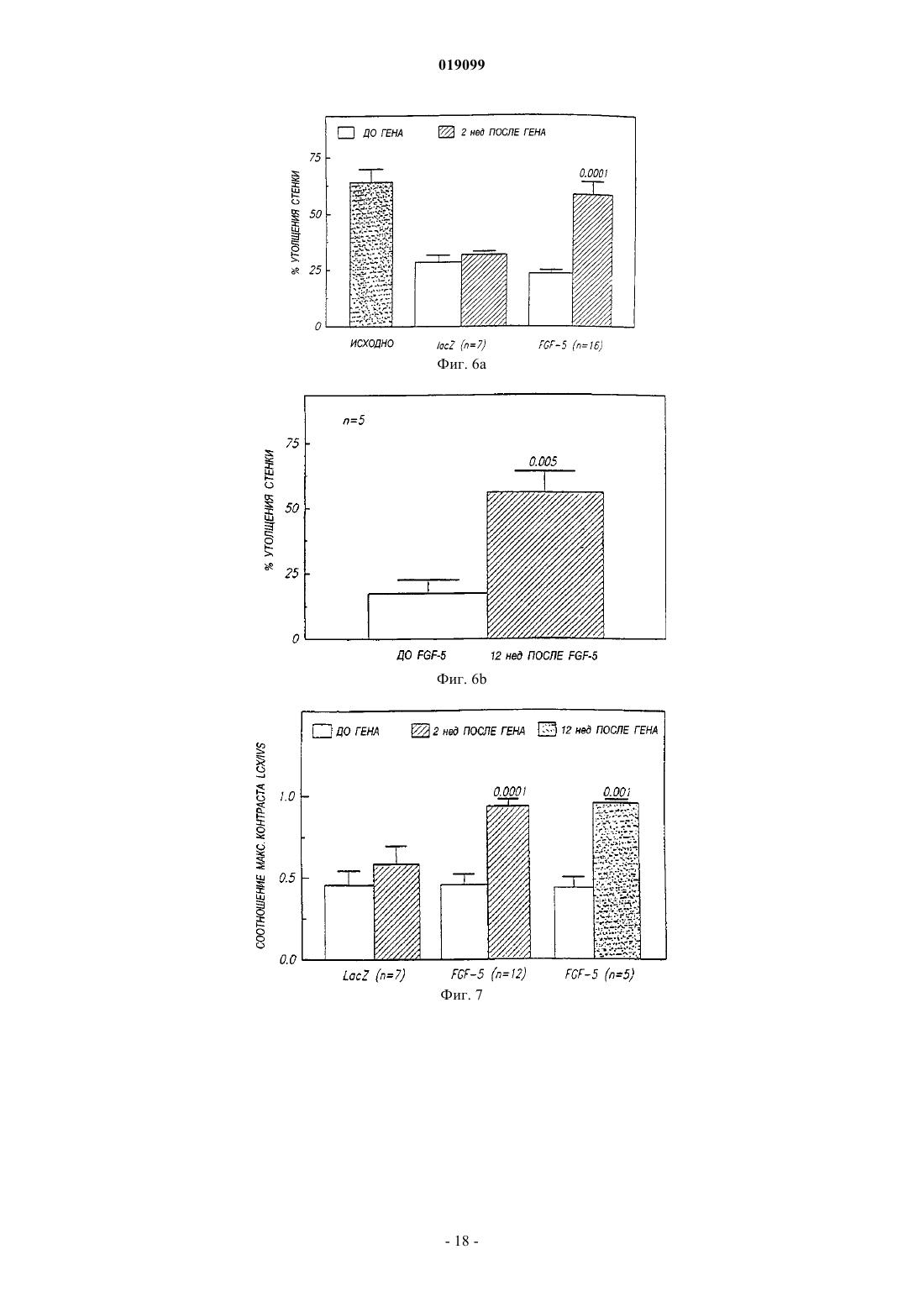
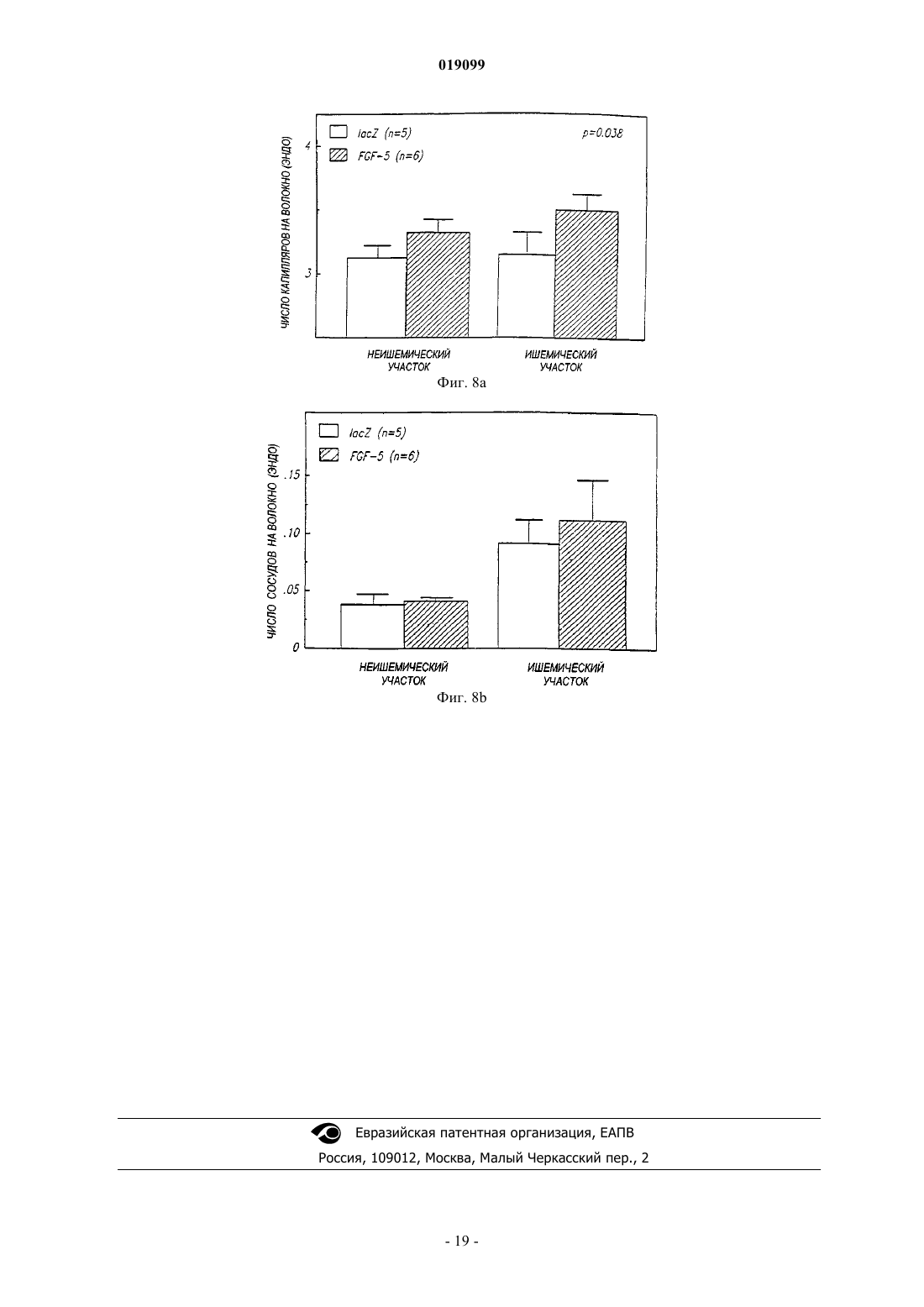
Способ направленной доставки трансгена в миокард пациента с ишемией миокарда
Формула / Реферат
1. Способ направленной доставки трансгена в миокард пациента с ишемией сердца, включающий введение дефектного по репликации вирусного вектора путем внутриартериальной инъекции непосредственно в артерию, снабжающую миокард, причем вектор содержит трансген, кодирующий белок, который необходимо экспрессировать в ткани миокарда, и указанную внутриартериальную инъекцию проводят одновременно с инфузией или после инфузии вазоактивного средства в артерию.
2. Способ по п.1, в котором вазоактивное средство вводят в артерию по крайней мере за 2 мин до инъекции вектора.
3. Способ по п.1, в котором вазоактивным средством является гистамин или агонист гистамина, а трансген кодирует белок фактора роста сосудистого эндотелия (VEGF).
4. Способ по п.3, в котором вазоактивным средством является гистамин или агонист гистамина.
5. Способ по п.1, в котором вирусным вектором является вектор на основе аденоассоциированного вируса (AAV).
6. Способ по п.5, в котором вводят от 107 до 1011 частиц вектора в одной инъекции.
7. Способ по п.6, в котором вводят около 1011 частиц вектора в одной инъекции.
8. Способ по п.1, в котором трансген функционально связан с конститутивным промотором.
9. Способ по п.1, в котором трансген функционально связан с тканеспецифичным промотором.
10. Способ по п.1, в котором трансген функционально связан с промотором, специфичным для желудочковых миоцитов сердца.
11. Способ по п.10, в котором промотор, специфичный для желудочковых миоцитов сердца, имеет последовательность промотора легкой цепи-2 желудочкового миозина.
12. Способ по п.10, в котором промотор, специфичный для желудочковых миоцитов сердца, имеет последовательность промотора тяжелой цепи миозина.
13. Способ по п.1, в котором трансген кодирует белок, входящий в группу, состоящую из aFGF, bFGF, FGF-4, FGF-5 и VEGF.
14. Способ по п.1, в котором вектор вводят путем внутрикоронарной инъекции непосредственно в одну или более коронарных артерий.
15. Способ по п.14, в котором трансген кодирует белок, входящий в группу, состоящую из aFGF, bFGF, FGF-4, FGF-5 и VEGF.
16. Способ по п.14, в котором вазоактивным средством является гистамин или агонист гистамина, а трансген кодирует VEGF.
17. Способ по п.14, в котором вазоактивным средством является гистамин или агонист гистамина.
18. Способ по п.14, в котором вирусным вектором является вектор на основе AAV.
19. Способ по п.14, в котором внутрикоронарную инъекцию проводят не менее чем на 1 см в просвет левой и правой коронарных артерий.
20. Способ по п.14, в котором внутрикоронарную инъекцию проводят не менее чем на 1 см в просвет трансплантата подкожной вены или трансплантата внутренней артерии молочной железы в дополнение к инъекции в коронарную артерию.
21. Способ по п.14, который включает три инъекции, по одной в левую переднюю нисходящую (LAD) коронарную артерию, левую огибающую (LCx) коронарную артерию и правую коронарную артерию.
22. Способ по п.1, в котором трансген кодирует β-адренергический сигнальный белок, а вектор доставляют в миокард пациента путем внутрикоронарной инъекции непосредственно в одну или две коронарные артерии.
23. Способ по п.22, в котором β-адренергический сигнальный белок выбран из группы, состоящей из β-адренергического рецептора (P-AR), ингибитора киназы рецепторов, содержащих G-белок (ингибитора GRK), и аденилатциклазы (АС).
24. Способ по п.22, в котором вазоактивным средством является гистамин или агонист гистамина, а также кодирует VEGF.
25. Способ по п.22, в котором вазоактивным средством является гистамин или агонист гистамина.
26. Способ по п.22, в котором вирусным вектором является вектор на основе AAV.
27. Способ по п.22, в котором внутрикоронарную инъекцию проводят не менее чем на 1 см в просвет левой и правой коронарных артерий.
28. Способ по п.22, в котором внутрикоронарную инъекцию проводят не менее чем на 1 см в просвет трансплантата подкожной вены или трансплантата внутренней артерии молочной железы в дополнение к инъекции в коронарную артерию.
29. Способ по п.22, который включает три инъекции, по одной в левую переднюю нисходящую (LAD) коронарную артерию, левую огибающую (LCx) коронарную артерию и правую коронарную артерию.
Текст
СПОСОБ НАПРАВЛЕННОЙ ДОСТАВКИ ТРАНСГЕНА В МИОКАРД ПАЦИЕНТА С ИШЕМИЕЙ МИОКАРДА Изобретение касается способа направленной доставки трансгена в миокард пациента с ишемией сердца, который применим для генной терапии заболевания in vivo и включает инъекцию вектора непосредственно в артерии, снабжающие миокард, предпочтительно в сочетании с вазоактивным средством, которое вводится путем инфузии в артерию перед или одновременно с введением вектора.(71)(73) Заявитель и патентовладелец: ТЕ РИДЖЕНТС ОФ ТЕ ЮНИВЕРСИТИ ОФ КАЛИФОРНИЯ Область техники, к которой относится изобретение Настоящее изобретение относится к генной терапии, а конкретно к генной терапии посредством вирусов и другим е формам и к определенным векторным конструкциям, включающим аденовирусные конструкции, и методам, пригодным для доставки желаемых генов. В более узком смысле изобретение касается доставки генов, пригодных для стимуляции ангиогенеза в сердце, посредством вирусов и способов лечения недостаточности периферических сосудов и сердечной недостаточности, включая ишемию миокарда, и других заболеваний с помощью таких векторов и методов доставки генов. Предшествующий уровень техники Американское кардиологическое общество сообщало (1995 Statistical Supplement), что около 60 млн взрослых в Соединенных Штатах страдают сердечно-сосудистыми заболеваниями, включая 11 млн взрослых, страдающих коронарной болезнью сердца. Вследствие сердечно-сосудистых заболеваний в Соединенных Штатах умирает ежегодно почти миллион человек, что составляет более 40% общей смертности. В 1995 г. 1,5 млн взрослых в Соединенных Штатах был поставлен диагноз стенокардия, они испытывали приступы сердечной ишемии, вызывающие боли в груди. В Соединенных Штатах наблюдается около 350000 новых случаев стенокардии каждый год. Ишемия миокарда возникает, когда сердечная мышца не получает достаточного кровоснабжения и поэтому лишается необходимых уровней кислорода и питательных веществ. Наиболее обычной причиной ишемии миокарда является атеросклероз, который вызывает закупорку кровеносных сосудов (коронарных артерий), обеспечивающих кровоток в сердечной мышце. Существующие в настоящее время методы лечения включают фармакотерапию, хирургическое шунтирование коронарных артерий и подкожную реваскуляризацию с применением таких методов, как балонная ангиопластия. Стандартная фармакотерапия основывается на стратегиях, которые включают или усиление кровоснабжения сердечной мышцы, или снижение потребности сердечной мышцы в кислороде и питательных веществах. Усиление кровоснабжения сердечной мышцы достигается такими средствами, как блокаторы кальциевых каналов или нитроглицерин. Считается, что эти средства увеличивают диаметр пораженных артерий, вызывая расслабление гладкой мускулатуры стенок артерий. Снижение потребности сердечной мышцы в кислороде и питательных веществах достигается с помощью таких средств, понижающих гемодинамическую нагрузку на сердце, как артериальные вазодиляторы, или таких средств, снижающих сократительную реакцию сердца на данную гемодинамическую нагрузку, как антагонисты -адренергических рецепторов. Хирургическое лечение ишемической болезни сердца основано на шунтировании пораженных артериальных сегментов путем пересадки шунтов в стратегических точках (обычно пересаживают подкожную вену или внутреннюю артерию молочной железы). Все эти стратегии применяются для снижения частоты или полного устранения приступов ишемии, однако им всем присущи различные ограничения. В предварительных сообщениях описывается образование новых сосудов в сердце при прямом введении ангиогенных белков или пептидов для лечения ишемии миокарда. Отмечалось, что некоторые представители семейства факторов роста фибробластов (FGF), а именно кислый фактор роста фибробластов (aFGF), основный фактор роста фибробластов (bFGF), фактор роста фибробластов-5 (FGF-5) и другие участвуют в регуляции ангиогенеза в процессах роста и развития. Роль белка aFGF в стимуляции ангиогенеза у взрослых животных, например, недавно была предметом сообщения. В нем утверждается,что белок aFGF в покрытом коллагеном матриксе, помещенный в брюшную полость взрослых крыс,приводит к образованию хорошо васкуляризованной и нормально перфузируемой структуры (Thompsonet al., PNAS 86: 7928-7932, 1989). Инъекция белка bFGF в коронарные артерии взрослых собак при коронарной закупорке, как сообщалось, приводила к снижению коронарной дисфункции, уменьшению инфарктов миокарда и повышению васкуляризации в сосудистом русле, оказавшемся под угрозой (Yanagisawa-Miwa et al., Science 257: 1401-1403, 1992). Сообщалось о подобных результатах на животных моделях ишемии миокарда при использовании белка bFGF (Harada et al., J. Clin. Invest 94: 623-630, 1994,Unger et al., Am. J. Physiol. 266: H1588-H1595, 1994). Условием достижения ангиогенного эффекта этих белков, однако, была необходимость повторного или длительного введения белка, что ограничивает пользу от применения этих белков для стимуляции ангиогенеза в клинических условиях. Другими словами, успешное лечение людей потребовало бы постоянного или длительного введения одного или большего числа этих ангиогенных пептидов или белков,которые сами по себе непозволительно дорогие и к тому же должны вводиться через катетеры, вставленные в коронарные артерии, что еще более увеличит стоимость и сложность лечения. Недавно в различных публикациях было посулировано использование переноса генов для лечения или предупреждения заболеваний, включая сердечные заболевания. Например, см. Mazur et al., "Coronarygene transfer to cardiac and vascular smooth muscle", сообщается о применении переноса генов посредством вирусов в целях регуляции функции клеток гладких мышц сосудов сердца. Leiden et al. утверждают,-1 019099 что рекомбинантный аденовирус, содержащий последовательность ДНК, кодирующую генный продукт,можно доставить в клетку гладких мышц сердца или сосудов и поддерживать е до тех пор, пока этот генный продукт не будет экспрессироваться. Согласно Leiden et al. функция мышечных клеток регулируется путем изменения транскрипции генов и изменений в образовании такого продукта транскрипции гена, как полинуклеотид или полипептид. Существуют помехи успешному переносу генов в такие органы, как сердце, с помощью аденовируса или других векторов. Например, внедрение трансгена в быстро делящуюся популяцию клеток приведет к существенному снижению продолжительности экспрессии трансгена. Примеры подобных клеток включают эндотелиальные клетки, из которых состоит внутренний слой всех кровеносных сосудов, и фибробласты, которые рассеяны по всему сердцу. Прицельная доставка трансгена осуществляется таким образом, чтобы только желательные клетки получали и экспрессировали его, а сам трансген не распределялся системно - эти факторы также являются решающими. Если этого не достигнуть, то произойдет системная экспрессия трансгена и возникнут связанные с этим проблемы. Например, отмечались воспалительные инфильтраты после переноса генов в печень посредством аденовируса (Yang et al., Proc. Natl.Acad. Sci. U.S.A. 91: 4407, 1994). В описанном и заявленном здесь изобретении рассматриваются и преодолеваются эти и другие проблемы, связанные с предшествующим уровнем техники. Краткое описание фигур Фиг. 1 - это схема, показывающая конструирование аденовируса, кодирующего трансген, путем"спасительной" рекомбинации. Фиг. 2 показывает процент утолщения стенки (% WTh) в ишемическом русле при стимуляции правого предсердия (HR=200 bpm), рассчитанный по измерениям толщины стенки в конце диастолы(EDWTh) и толщины стенки в конце систолы (ESWTh) до и через 141 день после переноса гена lacZ(контрольный ген) и гена FGF-5. Функция ишемического русла повышалась в 2,6 раза после переноса гена FGF-5 (р=0,0001), а контрольный ген на не не влиял. Фиг. 3 показывает показатель максимального контраста (он коррелирует с кровотоком), выраженный как отношение максимальной интенсивности видеоснимка в ишемическом участке (русло LCx) к максимальной интенсивности видеоснимка в межжелудочковой перегородке (IVS), измеренное на видеоснимках с помощью компьютерной программы анализа видеоснимков при стимуляции предсердий (200bpm) до и через 141 день после переноса гена lacZ (контрольный ген) и гена FGF-5. Кровоток в ишемическом русле повышался в 2 раза до нормального уровня после переноса гена FGF-5 (р=0,0018), но составил 50% от нормального уровня после контрольного гена. Фиг. 4 показывает диаграммы, соответствующие контрастной эхокардиографии миокарда (не показано). Белым цветом показано усиление контраста (повышение кровотока), а темным цветом показано снижение кровотока. Фиг. 4 А показывает острую окклюзию LCx у нормальной свиньи. Фиг. 4 В показывает 141 день после переноса гена lacZ, а фиг. 4 С показывает 141 день после переноса гена FGF-5. Фиг. 5 показывает отношение числа капилляров к числу волокон, которое определяли под микроскопом в ишемических и неишемических участках после переноса генов FGF-5 и lacZ. Наблюдалось усиление ангиогенеза после переноса гена FGF-5 (р 0,038). Сущность изобретения Настоящее изобретение нацелено на такой подход к генной терапии, который пригоден для направленной доставки трансгена в миокард пациента с ишемией сердца. Заявленный способ включает введение вектора для генной терапии внутрь сосуда. Одна из целей настоящего изобретения - обеспечить такой способ лечения ишемии сердца, в котором ангиогенный белок или пептид (такой как FGF-5 или FGF-4) образуется в терапевтически значимом количестве непрерывно в миокарде продолжительное время, путем направленного введения в сердце векторной конструкции, содержащей ген указанного ангиогенного белка или пептида, предпочтительно такого вирусного вектора, как дефектная по репликации аденовирусная конструкция, вводимая путем внутрикоронарной инъекции предпочтительно с помощью катетера, введенного значительно (обычно не меньше чем на 1 см) глубже устья одной или обеих коронарных артерий или одного или большего числа трансплантантов подкожной вены или внутренней артерии молочной железы. Таким образом, предусматривается введение в одну коронарную артерию или трансплантированную артерию. Предпочтительна инъекция в обе,правую и левую, системы коронарного кровообращения. Особенно предпочтительно введение с помощью трех инъекций, по одной в левую переднюю нисходящую (LAD) и левую огибающую (LCx) коронарные артерии и одну в правую коронарную артерию. Для дальнейшего усиления доставки гена, как описано здесь, вектор для доставки гена предпочтительно вводится совместно с инфузией вазоактивного средства (например, гистамина, агониста гистамина или белка фактора роста сосудистого эндотелия (VEGF в участок, предназначенный для внутрисосудистой доставки; наиболее предпочтительно путем инфузии вазоактивного средства за несколько минут до введения вектора. Другим аспектом настоящего изобретения является способ лечения сердечной недостаточности у больных, страдающих ишемией миокарда, включающий доставку вектора со вставленным в него трансгеном в миокард больного путем внутрикоронарной инъекции, предпочтительно инъекции вектора непосредственно в одну или обе коронарные артерии (или трансплантанты) для трансфекции сердечных миоцитов в поврежденном миокарде, причем указанный вектор содержит трансген, кодирующий ангиогенный белок или пептид, например FGF-5, FGF-4, aFGF, bFGF или VEGF (фактор роста сосудистого эндотелия), и экспрессирует трансген в сердце, стимулируя, таким образом, ангиогенез в пораженном участке миокарда. Можно использовать также другие трансгены, например, кодирующие -адренергические сигнальные белки, как описано ниже. Векторы, применяемые в изобретении, могут быть плазмиды или предпочтительно вирусные векторы, например дефектный по репликации аденовирус или вирус, родственный аденовирусам (AAV). Путем инъекции такого препарата вирусного вектора, который не содержит вируса дикого типа, глубоко в просвет одной или обеих коронарных артерий (или трансплантантов),предпочтительно в обе, правую и левую, коронарные артерии (или трансплантанты), и предпочтительно в количестве 107-1013 вирусных частиц, что определяется оптической денситометрией (более предпочтительно 109-1011 вирусных частиц), можно локально транфецировать желаемое количество клеток, особенно сердечных миоцитов, в пораженном миокарде генами, кодирующими ангиогенный белок или пептид, тем самым обеспечивая максимумальную терапевтическую эффективность переноса генов и сводя к минимуму нежелательный ангиогенез вне сердца и возможность воспалительной реакции на вирусные белки. Если, к примеру, используется промотор, специфичный к вентрикулярным миоцитам, то этот промотор более безопасно обеспечивает экспрессию и ограничивает е сердечными миоцитами с тем,чтобы избежать возможных вредных эффектов на ангиогенез в таких несердечных тканях, как сетчатка. Для дальнейшего усиления локализованной доставки вектора для переноса генов согласно изобретению можно вводить вазоактивное средство, предпочтительно гистамин, или агонист гистамина, или белок фактора роста сосудистого эндотелия (VEGF) в миокард, применяя катетер описанным здесь способом. Настоящее изобретение обеспечивает приготовление фильтрованного аденовирусного вектора для инъекций, содержащего рекомбинантный аденовирусный вектор, предпочтительно имеющий конечный титр в 107-1013 вирусных частиц, причем вектор не содержит вируса дикого типа, а содержит частичную аденовирусную последовательность, из которой удалены один или несколько аденовирусных генов, необходимых для обеспечения способности к репликации, например гены Е 1 А/Е 1 В, и трансген, кодирующий ангиогенный белок или пептид, например aFGF, bFGF, FGF-4, FGF-5 и VEGF, под управлением промотора, обрамленного (фланкированного) частичной последовательностью аденовируса; и фармацевтически приемлемый носитель. Используя этот препарат аденовирусного вектора для инъекций, необязательно в сочетании с вазоактивным средством, например гистамином, или агонистом гистамина, или белком фактора роста сосудистого эндотелия (VEGF) для усиления переноса гена, как описано здесь, можно проводить эффективный перенос гена FGF посредством аденовируса для лечения, например, клинической ишемии миокарда без каких-либо нежелательных эффектов. Настоящее изобретение обеспечивает способ приготовления вирусного препарата, содержащего рекомбинантный вектор, способный экспрессировать ангиогенный белок или пептид в миокарде in vivo,который включает стадии клонирования трансгена, предпочтительно кодирующего такой ангиогенный белок или пептид, как FGF-4, FGF-5, aFGF, bFGF и VEGF, в плазмиду, содержащую промотор и полилинкер, обрамленный частичной аденовирусной последовательностью левого конца генома аденовируса 5 человека, из которого удалены один или несколько аденовирусных генов, необходимых для обеспечения репликации, например гены Е 1 А/Е 1 В; котрансфекции указанной плазмиды в клетки млекопитающих, трансформированные недостающими генами, необходимыми для репликации, и плазмиды, содержащей полный геном аденовируса-5 человека и дополнительную вставку, которая делает плазмиду слишком большой для инкапсулирования, вследствие чего происходит "спасительная" рекомбинация между плазмидой со вставленным трансгеном и плазмидой, содержащей полный аденовирусный геном,и образуется рекомбинантный геном, содержащий трансген без необходимых для репликации генов,причем рекомбинантный геном имеет небольшой размер, достаточный для инкапсуляции; идентификации успешных рекомбинантов в клеточных культурах; размножения полученного рекомбинанта в клетках млекопитающих, трансформированных недостающими генами, необходимыми для репликации; и очистки размноженных рекомбинантов, чтобы получить рекомбинантный вектор, не содержащий вируса дикого типа, и, необязательно, пропускания очищенного вектора через фильтр, предпочтительно фильтр в 10-50 мкм, более предпочтительно через фильтр в 30 мкм. В следующем аспекте настоящего изобретения эффективность доставки генов с помощью такого вектора, как вирусный вектор (например, аденовирус или родственый аденовирусам), усиливается путем введения вектора в такой кровяной сосуд, как артерия, в которую одновременно или предварительно вводят вазоактивное средство, например гистамин, или агонист гистамина, или белок фактора роста сосудистого эндотелия (VEGF), как описано здесь. Наиболее предпочтительно вазоактивное средство вводят в кровеносный сосуд за несколько минут до введения вектора. Подробное описание изобретения Трансгены настоящего изобретения В настоящем изобретении могут применяться различные белковые или пептидные факторы роста,-3 019099 способные улучшать кровоток миокарда в ишемических участках сердца (или скелетных мышц в случае заболеваний периферических сосудов), а также другие трансгены. В качестве примеров экспрессируемых ангиогенных белков или пептидов могут служить такие ангиогенные белки или пептиды, как aFGF,bFGF, FGF-4 и FGF-5. Ангиогенная активность семейства FGF достаточно хорошо установлена в условиях инфузии белка (Yanagisawa-Miwa et al., Science 257: 1401-1403, 1992, Harada et al., J. Clin. Invest 94: 623-630, 1994, Unger et al., Am. J. Physiol. 266: H1588-H1595, 1994). Можно также использовать ген VEGF(фактора роста сосудистого эндотелия), мощного стимулятора роста новых сосудов. Успех подхода переноса генов требует как синтеза генного продукта, так и его секреции трансфецированной клеткой. С этой точки зрения, предпочтителен ген, кодирующий FGF-5 или FGF-4, и ему отдают предпочтение потому, что он содержит последовательность, кодирующую сигнальный пептид, обеспечивая тем самым,что генный продукт после экспрессии достигнет сердечной (или скелетной) мышцы и будет индуцировать ангиогенез. Ангиогенные белки, которые можно использовать таким образом, включают представителей семейства факторов роста фибробластов (FGF), факторов роста сосудистого эндотелия (VEGF),факторов роста тромбоцитов (PDGF), инсулиноподобных факторов роста (IGF) и другие. Представители семейства FGF включают aFGF (FGF-1), bFGF (FGF-2), FGF-4 (также известный как "hst/KS3"), FGF-5,FGF-6, но не ограничиваются ими. Было показано, что VEGF экспрессируется сердечными миоцитами в ответ на ишемию in vitro и in vivo; он является регулятором ангиогенеза в физиологических условиях, а также при адаптивной реакции на патологические состояния (Banai et al., Circulation 89: 2183-2189, 1994). Семейство VEGF включает представителей подсемейства VEGF-A (например, VEGF-121, VEGF-145,VEGF-165, VEGF-189 и VEGF-206), а также представителей подсемейства VEGF-B (например, VEGF167 и VEGF-186) и подсемейства VEGF-C, но не ограничиваются ими. PDGF включает PDGF А и PDGF В. Нуклеотидные последовательности генов, кодирующих эти белки, и соответствующие аминокислотные последовательности известны в этой области (например, см. эти и другие последовательности в базе данных последовательностей GENBANK). По семейству FGF, например, см. Burgess, Ann. N.Y. Acad.Therapy 6: 1457-1465, 1995; Zhan et al., Mol. Cell. Biol. 8: 3487, 1988; Seddon et al., Ann. N.Y. Acad. Sci. 638: 98-108,1991. По hst/KS3 человека (т.е. FGF-4) см. Taira et al., Proc. Natl. Acad. Sci. USA 84: 29802984, 1987. По VEGF человека см., например, Tischer et al., J. Biol. Chem. 206: 11947-11954, 1991 и приведенные там ссылки; Muhlhauser et al., Circ. Res. 77: 1077-1086, 1995). Информация о последовательностях таких генов и кодируемых ими полипептидов легко получить из таких баз данных последовательностей, как GenBank или EMBL. Полинуклеотиды, кодирующие эти белки, можно также получить из генных библиотек, например, с помощью PCR или методов гибридизации, общепринятых в этой области. Гены, кодирующие FGF-4, FGF-5 или FGF-6, предпочтительны, так как эти белки содержат функциональные секреторные сигнальные последовательности и свободно секретируются клетками. Многие, если не большинство, белки VEGF человека (включая VEGF-121 и VEGF-165, но не ограничиваясь ими) также свободно секретируются и могут диффундировать после секреции. Так, после экспрессии эти ангиогенные белки могут свободно попадать в интерстиции сердца и индуцировать ангиогенез. Что касается других ангиогенных белков, таких как aFGF (FGF-1) и bFGF (FGF-2), у которых отсутствует природная секреторная сигнальная последовательность, то можно получить рекомбинантные гибридные белки,обладающие секреторными сигнальными последовательностями, используя стандартную методику получения рекомбинантной ДНК, известную специалистам в этой области. Считается, что природные aFGF и bFGF в некоторой степени секретируются, однако включение дополнительной секреторной сигнальной последовательности можно использовать для усиления секреции белка. Обычно секреторная сигнальная последовательность располагается на N-конце желаемого белка, но е можно поместить в любом положении, дающем возможность секреции ангиогенного фактора. Например, полинуклеотид, содержащий подходящую сигнальную последовательность, можно пришить к 5'-концу первого кодона выбранного гена ангиогенного белка. Подходящие секреторные сигнальные последовательности включают сигнальные последовательности генов FGF-4, FGF-5, FGF-6 или сигнальную последовательность другого секретируемого белка, такого как IL-1. Ангиогенные белки можно модифицировать так, чтобы они содержали сигнальную последовательность другого белка, например, путем замещения остатков в ангиогенном белке остатками, направляющими секрецию секретируемого второго белка, как описано в параллельной заявке U.S. Serial08/852779, поданной 6 мая 1997 г., включенной здесь путем ссылки. Можно использовать сигнальную последовательность, полученную из белка, который в норме секретируется сердечными миоцитами. Для лечения людей предпочтительны гены, кодирующие ангиогенные белки человеческого происхождения, хотя можно также использовать ангиогенные белки, происходящие от других млекопитающих, которые проявляют межвидовую активность, т.е. обладают ангиогенной активностью у человека. Наряду с ангиогенными факторами могут также применяться -адренергические сигнальные белки(ACs), как подробно описано в одновременно рассматриваемой заявке U.S. Serial08/924757, поданной 5 сентября 1997 г. (которая основана на U.S. Serial60/048933, поданной 16 июня 1997 г., и U.S. Serial 08/708661, поданной 5 сентября 1996 г.), а также PCT/US 97/15610, поданной 5 сентября 1997 г. Эти и все другие патентные заявки и ссылки, упомянутые в данной патентной заявке, инкорпорированы при упоминании здесь. Векторы для доставки генов В способах настоящего изобретения вектором может служить плазмидный вектор или вирусный вектор, например дефектный по репликации аденовирусный вектор или вирусный вектор, родственный аденовирусам. Источники, описывающие конструкцию и применение ряда векторов, включая вирусные и невирусные векторы, изложены ниже. Для иллюстрации нужный ген переносится в сердце (или скелетную мышцу), включая сердечные миоциты (и скелетные миоциты), in vivo и направляет конститутивное образование кодируемого белка. Возможно несколько различных подходов к переносу генов. Предпочтительной системой является независимая от хелпера дефектная по репликации система аденовируса человека. Используя эту систему, мы показали, что трансфекции подвергаются более 60% клеток миокарда in vivo при однократной внутрикоронарной инъекции (Giordano and Hammond, Clin. Res. 42: 123A, 1994). Нерепликативные рекомбинантные аденовирусные векторы особенно полезны при трансфекции коронарного эндотелия и сердечных миоцитов, что приводит к высокой эффективности трансфекции после внутрикоронарной инъекции. То же самое относится и к трансфекции желаемых клеток периферической сосудистой системы. В рекомбинантных аденовирусных векторах на основе аденовируса-5 человека (Virology 163: 614617, 1988) отсутствуют необходимые ранние гены аденовирусного генома (обычно Е 1 А/Е 1 В), и они поэтому неспособны к репликации, если только их не выращивать на пермиссивных клеточных линиях,обеспечивающих им продукты недостающих генов. Вместо отсутствующих последовательностей аденовирусного генома можно клонировать нужный трансген и экспрессировать в тканях/клетках, инфицированных дефектным по репликации аденовирусом. Несмотря на то что перенос генов на основе аденовируса не приводит к интеграции трансгена в геном хозяина (менее 0,1% вызванных аденовирусом трансфекций заканчиваются внедрением трансгена в ДНК хозяина) и, вследствие этого, нестабилен, аденовирусные векторы можно размножить при высоком титре и трансфецировать неделящиеся клетки. Хотя трансген не переходит в дочерние клетки, это годится для переноса генов во взрослые неделящиеся миоциты скелетных мышц и сердца. Ретровирусные векторы обеспечивают стабильный перенос генов, и сейчас можно получать высокие титры путем псевдотипирования ретровируса (Burns et al., Proc. Natl.Acad. Sci. (USA) 90: 8033-8037, 1993), но современные ретровирусные векторы не способны эффективно трансдуцировать неделящиеся клетки (взрослые миоциты скелетных мышц и сердца). Кроме того, нельзя оправдать возможный риск внедрения трансгена в ДНК хозяина, если достаточен краткосрочный перенос генов. Действительно, авторы обнаружили, что ограниченная продолжительность экспрессии ангиогенного белка достаточна для существенного ангиогенеза, и краткосрочный перенос генов при сердечнососудистых и периферических заболеваниях является терапевтически адекватным. Клетки человека линии 293, являющиеся эмбриональными почечными клетками человека, трансформированными аденовирусными генами Е 1 А/Е 1 В, служат типичными представителями полезных пермиссивных клеточных линий. Однако можно использовать и другие клеточные линии, в которых могут размножаться дефектные по репликации аденовирусные векторы, включая клетки HeLa. Конструирование рекомбинантных аденовирусных векторов и других векторов для доставки генов Все аденовирусные векторы, применяемые в настоящем изобретении, можно сконструировать методом "спасительной" рекомбинации, описанным в Graham, Virology 163: 614-617, 1988. Коротко, нужный трансген клонируется в челночный вектор, содержащий промотор и полилинкер, обрамленные частичной аденовирусной последовательностью, из которой удалены гены Е 1 А/Е 1 В. В качестве примеров челночного вектора могут служить плазмида pAC1 (Virology 163: 614-617, 1988) (или аналогичная), несущая части левого конца генома аденовируса-5 человека (Virology 163: 614-617, 1988) без последовательностей Е 1 А и Е 1 В, кодирующих ранние белки, необходимые для репликации вируса, и плазмидаACCMVPLPA (J. Biol. Chem. 267: 25129-25134, 1992), содержащая полилинкер, промотор CMV и сигнал полиаденилирования SV40, обрамленные частичными последовательностями аденовируса, из которых были удалены гены Е 1 А/Е 1 В. Использование плазмид pAC1 и ACCMVPLPA облегчает процесс клонирования. Челночный вектор затем трансфецируется вместе с плазмидой, содержащей полный геном аденовируса-5 человека, слишком длинной, чтобы быть инкапсулированной в клетки 293. Котрансфекцию можно проводить методом осаждения фосфатом кальция или липофекцией (Biotechniques 15:868-872,1993). Плазмида JM17 несет полный геном аденовируса-5 человека плюс части вектора pBR322, включая ген резистентности к ампициллину (4,3 kb). Хотя JM17 кодирует все аденовирусные белки, необходимые для образования зрелых вирусных частиц, она слишком большая для инкапсулирования (40 kb по сравнению с 36 kb у дикого типа). В небольшой субпопуляции котрансфецированных клеток происходит"спасительная" рекомбинация между содержащим трансген челночным вектором типа плазмиды pAC1 и плазмидой, несущей полный геном аденовируса-5 человека, типа плазмиды pJM17, что ведет к образованию рекомбинантного генома, лишенного последовательностей Е 1 А/Е 1 В, но содержащего нужный трансген, и при этом вторично теряется другая последовательность (последовательность pBR322) во время рекомбинации, вследствие чего достаточно малый размер позволяет инкапсулироваться (см. фиг. 1). В отношении вышеуказанного метода мы уже опубликовали успешные результаты (Giordano et al.,Circulation 88: 1-139, 1993 и Giordano and Hammond, Clin. Res. 42: 123A, 1994). Управляемый CMV кодирующий -галактозидазу аденовирус HCMVSP1lacZ (Clin. Res. 42: 123A, 1994) можно применять для оценки эффективности переноса генов путем обработки X-gal. В исходном способе переноса генов применяются аденовирусные векторы, как изложено выше. Достоинства этих векторов заключаются в их способности осуществлять перенос генов с высокой эффективностью (более 60% клеток органа-мишени трансфецируются in vivo), легкости накопления вируса с высоким титром и способности этих векторов осуществлять перенос генов в такие клетки, как сердечные миоциты, которые не делятся. Источники, описывающие ряд других векторов для переноса генов, известны в этой области, некоторые из них процитированы. К таким векторам относятся, например, другие вирусные векторы (такие как вирусы, родственные аденовирусам (AAV, липосомы и другие липидсодержащие комплексы, и другие макромолекулярные комплексы, способные осуществлять доставку полинуклеотида в клетку хозяина. Как описано выше и в цитированных источниках, векторы могут также содержать другие компоненты и функциональные элементы, которые еще более модулируют доставку генов и/или экспрессию генов каким-то другим образом сообщают полезные свойства клеткам-мишеням. К таким компонентам относятся, например, компоненты, влияющие на связывание или посадку на клетки (включая компоненты, осуществляющие связывание, специфичное к типу клетки или ткани); компоненты, влияющие на захват нуклеиновой кислоты вектора клеткой; компоненты, влияющие на локализацию полинуклеотида внутри клетки после захвата (типа веществ, способствующих ядерной локализации); и компоненты,влияющие на экспрессию полинуклеотида. К таким компонентам могут также относиться маркеры, типа маркеров для обнаружения и/или селекции, которые можно использовать для обнаружения или селекции клеток, захвативших и экспрессирующих нуклеиновую кислоту, доставленную вектором. Такие компоненты могут представлять естественное свойство вектора (такое как применение определенных векторов,обладающих компонентами или свойствами, способствующими связыванию и захвату), или векторы можно модифицировать для придания таких свойств. Маркеры для селекции могут быть положительными, отрицательными или бифункциональными. Маркеры для положительной селекции позволяют селекцию клеток, несущих маркер, тогда как маркеры для отрицательной селекции позволяют избирательно элиминировать клетки, несущие маркер. Был описан целый ряд подобных маркерных генов, включая бифункциональные (т.е. положительные/отрицательные) маркеры (например, см. Lupton S., WO 92/08796, опубликовано 29 мая 1992 г.; и Lupton S., WO 94/28143, опубликовано 8 декабря 1994 г.). Такие маркерные гены могут обеспечить дополнительную меру контроля, что может быть полезным в плане генной терапии. Большое число таких векторов известно в этой области, и они, в общем, доступны (например, см. различные источники, цитированные выше). Дополнительные источники, описывающие аденовирусные векторы и другие вирусные векторы,которые можно использовать в способах настоящего изобретения, включают следующие: Horwitz M.S.,Adenoviridae and Their Replication, in Fields B. et al. (eds.) Virology, Vol. 2, Raven Press, New York, pp. 1679-1721, 1990); Graham F. et al., pp. 109-128 in Methods in Molecular Biology, Vol. 7: Gene Transfer amd(8 сентября 1995); Haddada H. et al., WO 94/26914 (24 ноября 1994); Perricaudet M. et al., WO 95/02697 (26 января 1995); Zhang W. et al., WO 95/25071 (12 октября 1995). Многие аденовирусные плазмиды также доступны из коммерческих источников, включая, например, Microbix Biosystems of Toronto, Ontario (например, см. Microbix Product Information Sheet: Plasmids for Adenovirus Vector Construction, 1996). См. также статьи Vile et al., Nature Biotechnology, 15: 840-841, 1997, Feng et al., Nature Biotechnology, 15: 866870, 1997, описывающие конструирование и применение химерных аденовирусных/ретровирусных векторов, которые можно использовать для доставки генов. Дополнительные источники, описывающие AAV векторы, которые могут применяться в способах настоящего изобретения, включают следующие: Carter В., Handbook of Parvoviruses, vol. I, pp. 169-228,1990; Berns, Virology, pp. 1743-1764 (Raven Press 1990); Carter В., Curr. Opin. Biotechnol., 3: 533-539, 1992;Therapy 5: 793-801, 1994; Flotte T.R. et al., Gene Therapy 2: 357-362, 1995; Allen J.M., WO 96/17947 (13 июня 1996) и Du et al., Gene Therapy, 3: 254-261, 1996. Дополнительные источники, описывающие невирусные векторы, которые могут применяться в способах настоящего изобретения, включают следующие: Ledley F.D., Human Gene Therapy 6: 1129-1144,1995; Miller N. et al., FASEB Journal 9: 190-199, 1995; Chonn A. et al., Curr. Opin. in Biotech. 6: 698-708,1995; Schofield J.P. et al., British Med. Bull. 51: 56-71, 1995; Brigham K.L. et al., J. Liposome Res. 3: 31-49,-6 019099and Ciccarone, WO 95/17373 (29 июня 1995); Lin et al., WO 96/01840 (25 января 1996). Тканеспецифичные промоторы В настоящем изобретении также рассматривается посадка на клетку не только путем введения трансгена в коронарную артерию или бедренную артерию, например, но и использование тканеспецифичных промоторов. Пришивая, например, тканеспецифичные контролирующие транскрипцию последовательности легкой цепи-2 миозина левого желудочка (MLC2V) или тяжелой цепи миозина (MHC) к такому трансгену, как ген FGF-5, заключенный в аденовирусную конструкцию, можно ограничить экспрессию трансгена миоцитами желудочков сердца. Эффективность экспрессии гена lacZ и степень специфичности, придаваемая промоторами MLC2V и МНС, были определены с помощью рекомбинантной аденовирусной системы настоящего изобретения. О специфической для сердца экспрессии ранее сообщали Lee et al. (J. Biol. Chem. 267: 15875-15885, 1992). Промотор MLC2V состоит из 250 bp (пар оснований) и легко помещается в упаковочную структуру аденовируса-5. Промотор тяжелой цепи миозина, известный как сильный промотор транскрипции, служит в качестве приемлемого альтернативного кардиоспецифического промотора и состоит из менее чем 300 bp. Другие промоторы, такие как промотор тропонина-С, хотя он и высокоэффективен и достаточно мал, сильно уступают в тканеспецифичности. При использовании промоторов MLC2V или МНС и введении трансгена in vivo считается, что сердечные миоциты сами (т.е. без сопутствующей экспрессии в эндотелиальных клетках, гладкомышечных клетках и фибробластах сердца) обеспечат адекватную экспрессию такого ангиогенного белка, как FGF-5, для стимуляции ангиогенеза. Ограничение экспрессии сердечными миоцитами также благоприятно в отношении полезности переноса генов для лечения клинической ишемии миокарда. Ограничивая экспрессию сердцем, можно избежать возможных вредных эффектов ангиогенеза в несердечных тканях, таких как сетчатка. Кроме того, из всех клеток сердца именно миоциты, вероятно, обеспечат наиболее длительную экспрессию трансгена, так как эти клетки не подвергаются быстрому обновлению; поэтому экспрессия не будет снижаться вследствие деления и отмирания клеток, что имело бы место в эндотелиальных клетках. Промоторы, специфичные к эндотелию, уже доступны для этой цели (Lee et al., J. Biol. Chem. 265: 10446-10450, 1990). В настоящем изобретении в отношении лечения сердечных заболеваний в настоящее время отдается предпочтение введению в сердце путем внутрикоронарной инъекции высоким титром вектора и трансфекции всех типов клеток. Размножение и очистка аденовирусных векторов Успешные рекомбинантные векторы можно очистить на бляшках стандартными методами. Полученные вирусные векторы размножаются в клетках 293, обеспечивающих им функции Е 1 А и Е 1 В, до титров в предпочтительном диапазоне 1010-1012 вирусных частиц/мл. Клетки можно инфицировать при 80% слиянии и собирать через 48 ч после этого. После 3 циклов замораживания-оттаивания клеточные обломки удаляют центрифугированием, а вирус очищают ультрацентрифугированием в градиенте CsCl(предпочтительно двукратное ультрацентрифугирование в градиенте CsCl). Перед введением in vivo препараты вируса обессоливают гель-фильтрацией через колонку с сефарозой, типа Sephadex G25. Препарат затем фильтруют через фильтр в 30 мкм, тем самым снижая вредное влияние внутрикоронарной инъекции нефильтрованного вируса (угрожающие жизни сердечные аритмии) и способствуя эффективному переносу гена. Полученный препарат вируса имеет конечный титр вируса в пределах 1011-1012 вирусных частиц/мл. Рекомбинантный аденовирус должен быть высокоочищенным, не содержать вируса дикого типа (способного к репликации). Неочищенные конструкции могут вызвать сильный иммунный ответ у животного-хозяина. С этой точки зрения размножение и очистку для исключения загрязнений и вируса дикого типа можно проводить путем идентификации успешных рекомбинантов методом PCR,используя соответствующие праймеры, проводя два цикла очистки на бляшках и двукратное ультрацентрифугирование в градиенте CsCl. Кроме того, мы обнаружили, что проблем, связанных с сердечными аритмиями, вызванными введением пациентам аденовирусного вектора, можно избежать фильтрацией рекомбинантного аденовируса через фильтры соответствующего размера перед внутрикоронарным введением. Эта стратегия, кажется, также существенно улучшает перенос и экспрессию генов. Введение рекомбинантного вектора Векторы настоящего изобретения, включая вирусные векторы, а также невирусные векторы, могут находиться в виде препаратов для инъекций, содержащих такой, например, фармацевтически приемлемый носитель, как физраствор, если нужно. Предпочтительным вектором является дефектный по репликации аденовирусный вектор, как описано выше. Конечный титр такого вектора в препарате для инъекций предпочтительно находится в пределах 107-1013 вирусных частиц, что делает возможным эффективный перенос генов. Другие фармацевтические носители, композиции и дозы описаны ниже. Векторные конструкции с трансгеном вводятся в миокард путем инфузии в одну или обе коронарные артерии (или трансплантированные сосуды) с помощью стандартных методов, основанных на применении подкожных катетеров, под флуороскопической наводкой, в количестве, достаточном для экспрессии трансгена на таком уровне, который дает возможность высокоэффективной терапии. Инъекцию следует делать глубоко в просвет (примерно на 1 см в просвет артерии) коронарных артерий (или трансплантированных сосудов) и предпочтительно в обе коронарные артерии, поскольку развитие колатеральных кровеносных сосудов очень различается у отдельных пациентов. Таким образом,инъекция в одну коронарную артерию или трансплантированную артерию допускается; однако, предпочтительно введение в обе, правую и левую, коронарные артерии. Введение с помощью трех инъекций, по одной в левую переднюю нисходящую (LAD) и левую огибающую (LCx) коронарную артерию и одну в правую коронарную артерию особенно предпочтительно. Инъекция материала непосредственно в просвет коронарной артерии через коронарные катетеры (предпочтительно в сочетании с вазоактивным средством, например гистамином, или агонистом гистамина, или белком VEGF в случае, когда желательна интенсивная генная терапия) дает возможность более эффективно доставить ген и свести к минимуму потерю рекомбинантных векторов в проксимальную аорту во время инъекции. Мы обнаружили,что экспрессия гена при таком способе доставки не происходит в гепатоцитах и вирусная РНК не обнаруживается в моче в любое время после внутрикоронарной инъекции. Любые разновидности коронарных катетеров, или перфузионный катетер Stack, например, можно использовать в настоящем изобретении. Кроме того, можно применять другие методики, известные рядовым специалистам в этой области, для доставки генов в стенку артерий. Введение генов в другие органы или ткани путем внутриартериальной инфузии в артерию, снабжающую ткань-мишень, можно проводить подобным образом предпочтительно в сочетании с инфузией вазоактивного средства, например гистамина, или агониста гистамина, или белкового фактора роста сосудистого эндотелия (VEGF), для усиления доставки гена, как описано здесь и проиллюстрировано. В качестве иллюстрации для лечения недостаточности периферических сосудов (характеризующейся недостаточным кровоснабжением ног) рекомбинантные векторы, экспрессирующие ангиогенный пептид или белок, можно вводить через катетер, вставленный в проксимальную часть бедренной артерии или артерий, предпочтительно в сочетании с вазоактивным средством, например гистамином или агонистом гистамина, осуществляя, таким образом, перенос генов в клетки скелетных мышц, получающих кровоснабжение из бедренных артерий. Это даст ангиогенный стимул, приводящий к индукции ангиогенеза и последующему увеличению кровотока в подвергнутых лечению скелетных мышцах ног. Вазоактивное средство, как оно применяется здесь, означает природное или синтетическое вещество, вызывающее повышение проницаемости сосудов и усиливающее перенос таких макромолекул, как векторы для переноса генов, через стенки капилляров. Увеличивая проницаемость сосудов для макромолекул или облегчая иным способом перенос макромолекул в капиллярное русло, перфузируемое артерией, вазоактивные средства могут усилить доставку этих векторов в намеченные участки и, таким образом, эффективно усилить общую экспрессию трансгена в ткани-мишени. В показательных примерах,следующих ниже (например, см. пример 5), в качестве вазоактивного средства использовали гистамин и обнаружили, что он существенно увеличивает перенос вектора в такой участок инфузии, как миокард. Производные гистамина (и те агонисты, которые взаимодействуют с H1-рецептором гистамина), которые можно использовать, включают, например, 2-метилгистамин, 2-пиридилэтиламин, бетагистин и 2 тиазолилэтиламин. Эти и другие антагонисты гистамина описаны, например, в Garrison J.C., Goodmanand Gilman's The Pharmacological Basis of Therapeutics (8th Ed: Gilman A.G., Rall T.W., Nies A.S., Taylor P.,eds) Pergamon Press, 1990, pp. 575-582. Наряду с гистамином и агонистами гистамина, которые можно использовать в качестве вазоактивных средств, факторы роста сосудистого эндотелия (VEGFs) и агонисты VEGF (как описано выше и в цитируемых источниках) также могут вызывать повышение проницаемости сосудов и могут, следовательно, применяться в качестве вазоактивных средств для усиления доставки генов в плане композиций и способов, описанных здесь. Как и гистамин, VEGF предпочтительно вводят в кровеносный сосуд,снабжающий намеченный участок, за несколько минут до инфузии вектора. VEGFs человека были описаны, например, Tischer et al., J. Biol. Chem. 206: 11947-11954, 1991, и приведенные там источники; иMuhlhauser et al., Circ. Res. 77: 1077-1086, 1995. Вазоактивные средства можно вводить одновременно с введением вектора, но предпочтительно вводятся в намеченный участок (например, преинфузией) за несколько минут до введения вектора с тем,чтобы вазоактивное средство смогло вызвать реакцию в инфузируемых клетках перед обработкой клеток вектором. Желая не ограничиваться теорией, полагают, что введение такого вазоактивного средства может усилить транскапиллярный везикулярный транспорт через клеточную стенку эндотелия капилляров,тем самым облегчая перенос таких макромолекулярных комплексов, как вирусные векторы. Модель ишемии миокарда на животных Важной предпосылкой для успешных исследований по генной терапии является (а) создание животной модели, прилогаемой к клинической ишемии миокарда, которая сможет дать полезные сведения относительно механизмов ангиогенеза в условиях ишемии миокарда, и (b) точная оценка эффектов пере-8 019099 носа гена. С этой точки зрения, уровень предшествующей техники не является удовлетворительным. Мы прибегли к модели ишемии миокарда на свинье, которая имитирует клиническую недостаточность коронарных артерий. Установка амероидного зажима (ameroid) вокруг левой огибающей коронарной артерии(LCx) приводит к постепенному полному закрытию (в течение 7 дней после установки) с минимальным инфарктом (1% левого желудочка, 41% русла LCx) (Roth et al., Circulation 82: 1778, 1990, Roth et al., Am.Hammond et al., J. Clin. Invest. 92: 2644, 1993). В покое функция миокарда и кровоток нормальны в участке, ранее перфузируемом зажатой артерией (который называют ишемической зоной) вследствие развития коллатеральных сосудов, но резерв кровотока недостаточен для предотвращения ишемии при увеличении потребности в кислороде. Таким образом, русло LCx подвергается эпизодической ишемии, как при клинической стенокардии. Развитие коллатеральных сосудов и соотношения кровоток-функция стабилизируются за 21 день после установки амероида и остаются без изменений на протяжении 4 месяцев (Rothet al., Circulation 82: 1778, 1990, Roth et al., Am. J. Physiol. 235: H1279, 1987, White et al., Circ. Res. 71: 1490, 1992). Как установлено путем телеметрии, животные проявляют периодическую ишемическую дисфункцию в пораженном сосудистом русле в течение всего дня, что связано с внезапным повышением частоты сердцебиений при приеме пищи, помехах от персонала и т.п. (неопубликованные данные). Таким образом, в модели имеется сосудистое русло со стабильными, но неадекватными коллатеральными сосудами, и оно подвергается периодической ишемии. Другим четким достоинством модели является наличие участка с нормальной перфузией и функцией (русло LAD) рядом с участком нарушенной перфузии и функции (русло LCx), что обеспечивает контрольное русло у каждого животного. Для оценки местной перфузии миокарда использовали контрастную эхокардиографию миокарда. Контрастный материал состоит из микроагрегатов галактозы и усиливает эхогенность (белизну) изображения. Микроагрегаты распределяются в коронарных артериях и стенках миокарда пропорционально току крови (Skyba et al., Circulation 90: 1513-1521, 1994). Было показано, что максимальная интенсивность контраста тесно коррелирует с током крови в миокарде, что измерялось с помощью микросфер(Skyba et al., Circulation 90: 1513-1521, 1994). Для подтверждения того, что эхокардиографические снимки, использованные в настоящем изобретении, точно выявляют русло LCx, и что контрастная эхокардиография миокарда может применяться для оценки кровотока в миокарде, устанавливали гидравлический зажим-манжетку вокруг проксимальной части LCx рядом с амероидом. В настоящем исследовании, когда животных забивали, то сердца фиксировали перфузией (глутаральдегид, физиологическое давление, in situ) для количественного анализа роста капилляров под микроскопом. Для обнаружения ДНК и мРНК ангиогенного белка в миокарде животных, которым делали перенос генов, применяли PCR. Кроме того, как описано ниже, через две недели после переноса генов образцы миокарда всех пяти инфицированных lacZ животных показали существенную -галактозидазную активность при гистологическом анализе. Наконец, с помощью поликлонального антитела к ангиогенному белку была подтверждена экспрессия ангиогенного белка в клетках и миокарде животных, которым делали перенос генов. Стратегия терапевтических исследований включала выбор времени для переноса трансгена, способ введения трансгена и выбор ангиогенного гена. В амероидной модели ишемии миокарда перенос генов осуществляли после стабильного, но недостаточного развития коллатеральных сосудов. Предыдущие исследования на амероидной модели включали введение ангиогенных пептидов во время закрытия амероида, перед развитием ишемии и коллатеральных сосудов. Однако эту стратегию не применяли по нескольким причинам. Во-первых, предыдущие исследования не подходили для точного повторения условий, в которых бы осуществлялось лечение клинической ишемии миокарда, при которых перенос генов осуществляется в условиях развития ишемии миокарда; предыдущие исследования имеют аналогию с введением пептида до начала ишемии и поэтому имеют меньшее значение. Во-вторых, на основе предыдущих исследований на клеточной культуре предположили, что ишемический стимул в сочетании с пептидом будет оптимальной средой для стимуляции ангиогенеза. Этого можно достичь оптимальным образом, вводя трансген в то время, когда ишемия миокарда уже наступила. С этими решениями связан выбор метода введения трансгена. Условие, что эта методика должна быть применима для последующего лечения больных коронарной болезнью сердца, сделало невозможными некоторые подходы (непрерывная инфузия пептида в коронарную артерию, прямое введение плазмиды в сердце, покрытие сердца составом из смолы, содержащей пептид, что обеспечивает долгосрочный медленный выброс). Наконец,свиная модель является отличным средством для наблюдения за региональным кровотоком и функцией до и после доставки гена. Использование контрольных животных, получавших ту же конструкцию с рекомбинантным аденовирусом, но содержащую ген-репортер, обеспечивало контроль для этих исследований. Специалисты в этой области поймут, что результаты, описанные ниже для свиней, предсказывают результаты на человеке. Природное коронарное кровообращение у свиньи очень близко к таковому у человека, включая отсутствие природных коронарных коллатеральных сосудов. Терапевтическое применение Векторы настоящего изобретения, такие как дефектный по репликации аденовирус, позволяют осуществлять с высокой эффективностью перенос генов in vivo без цитопатического эффекта или воспаления в зоне экспрессии гена. На основании этих результатов, описанных подробнее в нижеследующих примерах, видно, что достигается высокая степень генного переноса in vivo, достаточная, чтобы вызвать функциональные изменения in vivo. В случае лечения сердечной недостаточности перенос гена ангиогенного белка путем внутрикоронарной инъекции будет стимулировать ангиогенез и усиливать работу сердца. Таким образом, можно проводить лечение сердечной ишемии сразу после появления ишемических приступов. Кроме того, после генного переноса в ишемическом участке увеличится количество капилляров и кровоток, улучшится функция. Применение этих методов в клинике будет очень полезно,особенно вначале у тех, кто страдает неоперабельным заболеванием коронарных артерий и вызывающей инвалидность стенокардией. Данные настоящего изобретения показывают, что перенос рекомбинантного аденовируса, несущего ген, экспрессирующий фактор роста фибробластов (например, FGF-5), вызывает значительное снижение ишемии миокарда. Ангиогенные белки и трансгены могут также применяться в композициях и способах лечения, описанных в заявке на патент U.S. Serial08/852779, поданной 6 мая 1997 г., включенной в это описание путем ссылки. Как здесь описано, можно применять вазоактивные средства, например гистамин, или агонист гистамина, или белок VEGF, в сочетании с этими способами и композициями для дальнейшего усиления доставки генов в намеченный участок путем внутрисосудистой инъекции. Как отмечено выше, -адренергические сигнальные белки (-ASPs), например -адренергические рецепторы (-ARs), ингибиторы киназы рецепторов, содержащих G-белки (ингибиторы GRK), и аденилатциклазы (ACs) могут также применяться для усиления функции сердца, как подробно описано и проиллюстрировано в заявке на патент U.S. Serial08/924757, поданной 5 сентября 1997 г. (основанной наPCT/US 97/15610, поданной 5 сентября 1997 г., причем каждая из них включена в это описание путем ссылки. Как описано здесь, можно применять вазоактивные средства, например гистамин, или агонист гистамина, или белок VEGF, в сочетании с этими способами и композициями для дальнейшего усиления доставки генов в намеченный участок путем внутрисосудистой инъекции. Композиции или препараты изобретения для удобства могут быть представлены в виде составов,пригодных для внутрикоронарного введения. Подходящий для введения формат наилучшим образом может определить практикующий врач для каждого пациента индивидуально. Подходящие фармацевтически приемлемые носители и их составы описаны в стандартных рецептурных монографиях, напримерRemington's Pharmaceuticals Sciences by E.W. Martin. См. также Wang Y.J. and Hanson M.A. "Parental formulations of proteins and peptides: stability and stabilizers", Journals of Parental Sciences and Technology,Technical Report No. 10, Supp. 42:2S (1988). Векторы настоящего изобретения должны быть предпочтительно составлены в растворе при нейтральном рН, например при рН от 6,5 до 8,5, более предпочтительно примерно от 7 до 8, в присутствии наполнителя, поддерживающего изотоничность раствора, например 4,5% маннитола или 0,9% хлористого натрия, причем рН поддерживается с помощью известных в этой области буферных растворов, таких как фосфат натрия, которые обычно считаются безопасными,вместе с таким общепринятым консервантом, как метакрезол от 0,1 до 0,75%, более предпочтительно от 0,15 до 0,4% метакрезола. Требуемую изотоничность можно поддерживать с помощью хлористого натрия или других фармацевтически приемлемых средств, таких как декстроза, борная кислота, тартрат натрия, пропиленгликоль, многоатомные спирты (такие как маннитол и сорбитол), или другие неорганические или органические вещества. Хлористый натрий предпочтителен особенно для буферов, содержащих ионы натрия. При желании можно приготовить растворы вышеуказанных составов для увеличения срока годности и стабильности. Терапевтически полезные композиции изобретения готовят путем смешивания ингредиентов, следуя общепринятым процедурам. Например, нужные компоненты можно смешивать, получая концентрированную смесь, которую затем можно довести до конечной концентрации и вязкости добавлением воды и/или буфера для контроля рН или дополнительного вещества для поддержания изотоничности. Для применения врачами композиции будут поставляться в дозированной форме, содержащей то количество вектора изобретения, которое будет эффективным в одной или множественных дозах для индукции ангиогенеза на нужном уровне. Как признается всеми в этой области, эффективное количество терапевтического средства варьирует в зависимости от многих факторов, включая возраст и вес пациента, физическое состояние пациента, намеченный уровень ангиогенеза и другие факторы. Эффективная доза предпочтительного соединения этого изобретения, такого как дефектный по репликации аденовирус, в типичном случае находится в диапазоне по меньшей мере 107 вирусных частиц,предпочтительно около 109 вирусных частиц и более предпочтительно около 1011 вирусных частиц. Количество вирусных частиц предпочтительно не должно превышать 1013. Как уже отмечалось, точная доза для введения определяется лечащим врачом, но предпочтительно должна содержаться в 1 мл забуференного фосфатом физраствора. Предпочтительный в настоящее время способ введения в случае сердечных заболеваний заключается во внутрикоронарной инъекции в одну или обе коронарные артерии (или в один или несколько транс- 10019099 плантантов подкожной вены или внутренней артерии молочной железы) с помощью соответствующего коронарного катетера. Как описано здесь, предпочтительно введение в обе, правую и левую, коронарные системы кровотока. Введение путем трех инъекций, по одной в левую переднюю нисходящую (LAD) и левую огибающую (LCx) коронарные артерии и одну в правую коронарную артерию особенно предпочтительно. Хотя, конечно, удобно делать инъекции в две левые коронарные артерии подряд, их можно делать до или после инъекции в правую коронарную артерию. В ситуациях, когда правая коронарная артерия труднодоступна (в результате закупорки без соединяющих коллатералей, например, или вследствие того, что она слишком мала для избирательной инъекции), полную дозу вектора можно вводить путем инъекции в левый коронарный кровоток (предпочтительно LAD и LCx, как указано выше). Каждую инъекцию обычно проводят в течение одной или нескольких минут, в типичном случае примерно полторы минуты. Предпочтительным в настоящее время способом введения в случае заболевания периферических сосудов является инъекция в проксимальную часть бедренной артерии или артерий с помощью соответствующего артериального катетера. Как описано здесь, вазоактивные средства можно вводить в намеченный участок одновременно с или перед введением вектора, например, с помощью катетера для облегчения переноса генов. Применение таких средств приводило к усилению эффективности доставки гена, что проявлялось в увеличении процента клеток в намеченном участке, экспрессирующих трансген. Что касается физиологических и фармакологических эффектов гистамина и других вазоактивных средств, см., например, Altura B.M. andand Physiological and Pharmacalogical Actions (Rocha e Silva M., ed.) Handbuch der Experimentellen Pharmakologie, Vol. 18, Part 2, Springer Verlag, Berlin 1978, pp. 1-39. Производные гистамина (и те агонисты, что взаимодействуют с гистаминовым H1-рецептором), которые можно использовать, включают, например,2-метилгистамин, 2-пиридилэтиламин, -гистин и 2-тиазолилэтиламин. Эти и другие агонисты гистамина описаны, например, в Garrison J.C., Goodman and Gilman's The Pharmacological Basis of Therapeutics(8th Ed.: Gilman A.G., Rail T.W., Nies A.S., Taylor P., eds.) Pergamon Press, 1990, pp. 575-582. Для облегчения понимания настоящего изобретения представлены следующие примеры, в которых описаны результаты ряда экспериментов. Эксперименты, относящиеся к этому изобретению, не следует,конечно, понимать как конкретные ограничения изобретения и таких вариантов изобретения, известных сейчас или разработанных позднее, которые в понимании специалистов в этой области считались бы относящимися к сфере этого изобретения, как здесь описано и затем заявлено. Пример 1. Аденовирусные конструкции. Использовали независимую от хелпера дефектную по репликации систему аденовируса-5 человека. Работали с генами lacZ и FGF-5. Полную по длине кДНК для FGF-5 человека выделяли из плазмидыpLTRI22E (Zhen et al. Mol Cell Biol 8:3487, 1988) как EcoRl фрагмент в 1,1 kb, который включает 981 bp открытой рамки считывания гена, и клонировали в полилинкер плазмиды ACCMVPLPA, содержащей промотор CMV и сигнал полиаденилирования SV40, обрамленный частичными аденовирусными последовательностями, из которых были удалены гены Е 1 А и Е 1 В (необходимые для репликации вируса). Эту плазмиду трансфецировали (липофекция) в клетки 293 совместно с плазмидой JM17, содержащей полный геном аденовируса-5 человека с дополнительной вставкой в 4,3 kb, что делает pJM17 слишком большой для инкапсулирования. Гомологичная "спасительная" рекомбинация приводила к аденовирусным векторам, содержащим трансген в отсутствие последовательностей Е 1 А/Е 1 В. Хотя эти рекомбинанты не были репликативными в клетках млекопитающих, они могли размножаться в клетках 293, предварительно трансформированных Е 1 А/Е 1 В и поставляющих продукты этих незаменимых генов. Трансфецированные клетки наблюдали на предмет цитопатических явлений, которые обычно возникали через 10-14 дней после трансфекции. Для выявления успешных рекомбинантов клеточные супернатанты из чашек, проявляющих цитопатические явления, обрабатывали протеиназой K (50 мг/мл с 0,5% додецилсульфата натрия и 20 мМ ЭДТА) при 56 С в течение 60 мин, экстрагировали фенол/хлороформом и осаждали этанолом. Успешных рекомбинантов затем идентифицировали с помощью PCR, используя праймеры (Biotechniques 15: 868-872, 1993), комплементарные промотору CMV и последовательностям полиаденилирования SV40 для амплификации вставки (ожидаемый фрагмент в 1,1 kb), и праймеры (Biotechniques 15: 868-872, 1993), предназначенные для одновременной амплификации аденовирусных последовательностей. Успешных рекомбинантов затем подвергали двум циклам очистки бляшек. Вирусные препараты размножали в клетках 293 до титров между 1010 и 1012 вирусных частиц и очищали двойным центрифугированием в градиенте CsCl перед употреблением. Рекомбинантные аденовирусы, кодирующие галактозидазу или FGF-5, конструировали с помощью полных по длине кДНК. Система, использовавшаяся для выработки рекомбинантных аденовирусов, имела предел упаковки 5 kb для трансгенных вставок. Предложенные гены, управляемые промотором CMV и содержащие последовательности полиаденилирования SV40, имели менее 4 kb, попадая в пределы упаковки. Рекомбинантные векторы очищали на бляшках стандартными методами. Полученные вирусные векторы размножали в клетках 293 до титров в пределах 1010-1012 вирусных частиц. Клетки инфицировали при конфлюентности 80% и собирали через 36-48 ч. После циклов замораживания-оттаивания клеточные остатки удаляли путем стандартного центрифугирования, а вирус далее очищали двойным ультрацентрифугированием в градиете CsCl (непрерывный градиент 1,33/1,45 CsCl; цезий готовили в 5 мМ трис, 1 мМ ЭДТА (рН 7,8); 90000g (2 ч),105000g (18 ч. Перед инфицированием in vivo препараты вируса обессоливали гель-фильтрацией через колонки с сефарозой, типа Sephadex G25. Полученный препарат вируса имел конечный титр вируса в пределах 1011-1012 вирусных частиц. Аденовирусная конструкция была высокоочищенной, не содержала вируса дикого типа (способного к репликации). Пример 2. Кардиомиоциты взрослых крыс в клеточной культуре. Кардиомиоциты взрослых крыс выделяли перфузией по Лангендорфу содержащим коллагеназу перфузатом по стандартным методам. Палочкообразные клетки выращивали на чашках, покрытых ламинином, и через 24 ч инфицировали кодирующим -галактозидазу аденовирусом, полученным выше в примере 1, в соотношении 1:1. Еще через 36 ч клетки фиксировали глутаральдегидом и инкубировали сX-gal. Обычно 70-90% взрослых миоцитов экспрессировали -галактозидазный трансген после инфицирования рекомбинантным аденовирусом. При соотношении 1-2:1 не наблюдалось цитотоксичности. Пример 3. Миокард свиньи in vivo. Аденовирусный вектор, полученный в примере 1 и кодирующий -галактозидазу, размножали в пермиссивных клетках 293 и очищали ультрацентрифугированием в градиенте CsCl до конечного титра 1,51010 вирусных частиц по методике примера 1. Анестезированную под искусственным дыханием свинью в 40 кг подвергали торакотомии. Вставляли иглу-бабочку 26 размера в среднюю часть левой передней нисходящей (LAD) коронарной артерии и вводили вектор (1,51010 вирусных частиц) в объеме 2 мл. Закрывали грудную клетку и оставляли животное в покое. На четвертый день после введения животное забивали. Сердце фиксировали глутаральдегидом, делали срезы и инкубировали с X-gal в течение 16,5 ч. После заливки и нарезки срезов ткань окрашивали эозином. Анализ тканевых срезов под микроскопом (трансмуральные срезы русла LAD через 96 ч после внутрикоронарного введения аденовируса, содержащего lacZ) показал, что наблюдается значительный уровень переноса гена в коронарном русле LAD, причем на многих срезах ткани более 50-60% клеток давали положительную окраску на -галактозидазу. Участки миокарда, удаленные от кровеносного руслаLAD, не проявляли окрашивания X-gal и служили в качестве отрицательного контроля, при этом наблюдалась диффузная экспрессия гена в миоцитах и в клетках эндотелия. Большинство миоцитов проявляли-галактозидазную активность (голубая окраска) и в последующих опытах с внутрикоронарным введением через закрытую грудную клетку такая же активность была отмечена через 14 дней после переноса гена (n=8). Не наблюдалось признаков воспаления или некроза в участках экспрессии гена. Пример 4. Модель ишемии на свиньях. Животные состояли из 18 домашних свиней (30-40 кг). Проводили левую торакотомию, используя стерильные инструменты (Hammond et al. J. Clin. Invest. 92: 2644-2652; и Roth et al. J. Clin. Invest. 91: 939949, 1993). Вставляли катетеры в левое предсердие и аорту, что давало возможность измерять местный кровоток и следить за давлением. Вшивали провода в левое предсердие для записи ЭКГ и стимуляции предсердий. Наконец, устанавливали амероид на проксимальной части LCx. После достижения стабильного уровня ишемии опытная группа (n=11) получала аденовирусную конструкцию, включающую FGF-5(ангиогенный ген), управляемый промотором CMV. Контрольным животным (n=7) проводили генный перенос с помощью аденовирусной конструкции, несущей репортерный ген lacZ, управляемый промотором CMV. Исследования начинали через 353 дня после установки амероида в то время, когда стабилизировалось развитие коллатеральных сосудов и вызванная стимулятором дисфункция (Roth et al. Am. J. Physiol. 253: H1279-1288, 1987 и Roth et al. Circulation 82: 1778-1789). Бодрствующих животных подвешивали на стропах и записывали давление в LV, LL и в аорте и электрокардиограмму в цифровом формате в реальном времени (в покое и при стимуляции предсердия при 200 bpm). Получали двумерные и M-mode снимки с помощью ультразвуковой системы изображения Hewlett Packard. Снимки делали из правой парастернальной точки на уровне средней папиллярной мышцы и записывали на ленту VHS. Снимки записывали у животных в базальном состоянии и опять при стимуляции правого предсердия (HR = 200 bpm). Эти опыты проводили за день до переноса гена и повторяли через 141 день. Величины произведения частота-давление и давление в левом желудочке были близкими в обеих группах до и после генного переноса, что указывает на схожесть потребления кислорода миокардом и условий работы сердца. Проводили эхокардиографические измерения по стандартным критериям (Sahn et al. Circulation 58: 1072, 1978). Толщину стенки в конце диастолы (EDWTh) и в конце систолы (ESWTh) измеряли по трем последовательным биениям сердца и усредняли. Рассчитывали утолщение стенки в процентах (% WTh) как[(EDWTh-ESWTh)/EDWTh]l00. Данные анализировали, не зная, какой ген получило животное. Для проверки воспроизводимости эхокардиографических измерений животным (n=5) делали снимки 2 дня подряд, что показало высокую корреляцию (r2=0,90; р=0,005). Через 353 дня после установки амероида уже после того, как амероид был закрыт, но еще до переноса гена, проводили контрастную эхокардиографию с помощью контрастного материала (Levovist), который вводили в левое предсердие во время стимуляции предсердий (200 bmp). Исследования повторяли через 141 день после переноса гена. Измеряли максимальную интенсивность контраста на видеоснимках с помощью компьютерной программы анализа видеоизображений (Color Vue II, Nova Microsonics,Indianapolis, Indiana), что давало объективную меру интенсивности видеоснимков. Исследования контраста проводили, не зная, какой ген получило животное. По завершении исследования животных анестезировали и проводили торакотомию по средней линии. Изолировали брахицефальную артерию, вставляли канюлю и перевязывали другие крупные сосуды. Животным вводили внутривенно гепарин (10000 ЕД) и папаверин (60 мг). Вводили хлористый калий,чтобы вызвать остановку сердца в диастоле, и пережимали аорту. Вводили физраствор через канюлю в брахицефальную артерию (давление 120 мм Hg столба), тем самым перфузируя коронарные артерии. Перфузировали раствор глутаральдегида (6,25% в 0,1 М какодилатном буфере) (давление 120 мм Hg столба) до достижения хорошей фиксации сердца (10-15 мин). Затем сердце удаляли, выявляли сосудистые русла с помощью цветных красителей, которые вводили антероградно через левую переднюю нисходящую (LAD), левую огибающую (LCx) и правую коронарные артерии. Осматривали амероид, чтобы подтвердить закрытие. Отбирали образцы из нормально перфузированных и ишемических участков, делили их на три части и эндокардиальную и эпикардиальную трети заливали в пластик. Проводили анализ под микроскопом для оценки числа капилляров, как описано ранее (Mathieu-Costello et al. Am. J. Physiol. 369: H204, 1990). Делали по четыре поперечных среза толщиной 1 м из каждого подобразца (эндокарда и эпикарда из каждого участка) и с помощью просчета точек определяли отношение числа капилляров к числу волокон при 400-кратном увеличении. Просчитывали от 20 до 25 полей под сильным увеличением на подобразец. В каждом участке отношение числа капилляров к числу волокон было одинаковым в эндокарде и эпикарде, так что 40-50 полей на участок усредняли для получения трансмурального соотношения капилляров к числу волокон. Для подтверждения того, что улучшение функции и кровотока в этом участке происходило от экспрессии трансгена, применяли PCR и RT-PCR для обнаружения ДНК и мРНК трансгенного FGF-5 в миокарде животных, которым делали перенос гена FGF-5. Используя прямой (sense) праймер к промоторуPCR ожидаемый фрагмент в 500 bp. Используя прямой праймер к началу последовательности FGF-5[ATGAGCTTGTCCTTCCTCCTC] (SEQ ID No. 3) и обратный праймер ко внутренней последовательности FGF-5 [GAAAATGGGTAGAGATATGCT] (SEQ ID No. 2), амплифицировали методом RT-PCR ожидаемый фрагмент в 400 bp. Наконец, с помощью поликлонального антитела против FGF-5 (Kitaoka et al. Science 35: 3189, 1994) была подтверждена экспрессия белка FGF-5 через 48 ч и через 141 день после переноса гена FGF-5 в клетках и миокарде животных, которым делали перенос гена FGF-5. Использовали независимую от хелпера дефектную по репликации систему аденовируса-5 человека,сконструированную в примере 1, для получения векторов, содержащих трансгены. Работали с генамиlacZ и FGF-5. Материал для введения in vivo был высокоочищенным и не содержал аденовируса дикого типа (способного к репликации). Таким образом, сводили к минимуму заражение аденовирусом и воспалительную инфильтрацию в сердце. Введение материала прямо в просвет коронарной артерии с помощью коронарных катетеров сделало возможным эффективно направить ген на мишень. При введении этим способом не наблюдалось экспрессии трансгена в гепатоцитах и вирусная РНК не обнаруживалась в моче ни в какое время после внутрикоронарного введения. Введение конструкции (4,0 мл, содержащие около 1011 вирусных частиц аденовируса) проводили путем инъекции по 2,0 мл в левую и правую коронарные артерии (коллатеральный кровоток в русло LCx,по-видимому, происходил из обоих сосудов). Животных анестезировали и получали доступ к артериям через надрез в правой сонной артерии; вставляли оболочку 5F Cordis. Использовали многоцелевой (А 2) коронарный катетер 5F для входа в коронарные артерии. Закрытие амероида в LCx подтверждали путем введения контраста в левую главную коронарную артерию. Кончик катетера затем помещали в просвет артерии на глубину 1 см, чтобы минимальное количество материала попадало в проксимальную аорту при инъекции. Эту процедуру проводили с каждой свиньей. После проведения переноса генов использовали три стратегии для подтверждения успешного внедрения и экспрессии гена. (1) Некоторые конструкции включали ген-репортер (lacZ); (2) отбирали образцы миокарда с соответствующим сосудистым руслом и делали иммуноблоты для оценки присутствияFGF-5 и (3) применяли PCR для обнаружения мРНК и ДНК FGF-5. Данные по местной сократительной функции на фиг. 2 показывают, что свиньи, получавшие lacZ,проявляли одинаковую степень вызванной стимулятором дисфункции в ишемическом участке до и через 141 день после генного переноса. Напротив, свиньи, получавшие при переносе ген FGF-5, проявляли в 2,6 раза большее утолщение стенки в ишемическом участке при стимуляции (р=0,0001). Эти данные показывают, что перенос гена FGF-5 согласно изобретению был связан с улучшением сократимости ишемического участка во время стимуляции. Изменение толщины стенки в участке с нормальной перфузией(межжелудочковая перегородка) было в норме во время стимуляции и на него не влиял перенос гена (% утолщения стенки: группа lacZ: до гена 5611%, после гена 519%; группа FGF-5: до гена 637%, после гена 585%; нет отличий по двустороннему вариационному анализу). Данные по отдельным определениям хорошо воспроизводились (утолщение боковой стенки: r2=0,90; р=0,005). Процент снижения функции по эхокардиографическим измерениям через грудную клетку был очень близок к проценту снижения по сономикрометрическим измерениям во время стимуляции предсердий в той же модели (Hammond et al. J.Clin. Invest. 92: 2644, 1993), что подтверждает точность эхокардиографии при оценке ишемической дисфункции. Столбики на фиг. 2 показывают средние значения, полоски обозначают 1 SE. Фиг. 4 А-4 С представляют собой диаграммы, соответствующие результатам контрастной эхокардиографии миокарда. Фиг. 4 А иллюстрирует острую окклюзию LCx у нормальной свиньи, где показано отсутствие кровотока в русле LCx (черный цвет), тогда как в перегородке (IVS) он повышается (белый цвет), что подтверждает правильность снимка, выявляющего русло LCx, и то, что уменьшение кровотока связано со снижением усиления контраста. Фиг. 4 В иллюстрирует различия в усилении контраста между IVS и руслом LCx через 14 дней после переноса гена lacZ, показывая, что кровоток в этих двух участках отличается во время стимуляции предсердий (200 bpm). На фиг. 4 С усиление контраста выглядит одинаковым в IVS и в руслеLCx через 14 дней после переноса гена FGF-5, показывая, что кровоток в этих двух участках одинаков во время стимуляции предсердий. На фиг. 3 суммирован компьютерный анализ интенсивности видеоснимков в двух участках по всем животным. На фиг. 3 данные выражены как отношение максимальной интенсивности видеоснимка (коррелирует с кровотоком в миокарде) в ишемическом участке (русло LCx) к максимальной интенсивности видеоснимка в межжелудочковой перегородке (IVS, участок, получающий нормальный кровоток через непережатую левую переднюю нисходящую коронарную артерию). Равенство кровотока в двух участках дает отношение, равное 1,0. Это отношение до переноса генов в среднем равнялось 0,5, указывая, что кровоток в русле LCx был значительно меньшим, чем в перегородке. Фиг. 3 показывает, что животные,которым делали перенос гена lacZ, имели постоянный дефицит кровотока в ишемическом участке. Животные, которым делали перенос гена FGF-5, проявляли однородное усиление контраста в обоих участках, указывающее на 2-кратное улучшение кровотока в ишемическом участке миокарда (р=0,0018 по двустороннему вариационному анализу). Столбики представляют средние значения, а полоски обозначают 1 SE. Гистограмма на фиг. 5 суммирует данные микроскопического анализа, показывая, что отношение числа капилляров к числу волокон в ишемических и неишемических участках животных, которым делали перенос гена FGF-5, увеличивается по сравнению с теми же участками в сердце животных, которым делали перенос гена lacZ. Столбики представляют средние значения от 5-6 животных в каждой группе. Полоски обозначают 1 SE, значение р по двустороннему вариационному анализу эффекта гена. Анализ проводили, не зная экспериментальных групп. Электрофореграммы после амплификации PCR подтвердили присутствие ДНК JM17-CMV-FGF-5(ожидаемый фрагмент в 500 bp) в руслах LAD и LCx трех свиней через 14 дней после переноса гена FGF5. Электрофореграмма после амплификации RT-PCR подтвердила присутствие мРНК FGF-5 в сердце(ожидаемый фрагмент в 400 bp) в руслах LAD и LCx через 14 дней после переноса гена FGF-5, но неlacZ. Кроме того, через 2 недели после переноса генов образцы миокарда всех 5 животных, которым вводили lacZ, проявляли значительную -галактозидазную активность при гистологическом исследовании. Наконец, иммуноблоты клеточной среды из культуры фибробластов с применением поликлональных антител к FGF-5 подтвердили экспрессию белка и внеклеточную секрецию через 2 дня после переноса гена FGF-5 (n=4 чашки), но не после переноса гена lacZ. Экспрессию белка также подтвердили в образцах миокарда через 141 день после переноса гена FGF-5, но не после переноса гена lacZ (n=4). Как описано выше, векторы, родственные аденовирусам, и другие векторы для переноса генов, известные в этой области, можно использовать аналогичным образом. Пример 5. Применение вазоактивного средства для усиления генного переноса. В одном аспекте настоящего изобретения, как описано выше, эффективность переноса генов с помощью такого вектора, как вирусный вектор, повышается путем введения вектора в кровеносный сосуд,в который одновременно или предварительно вводится вазоактивное средство, такое как гистамин. В этом показательном примере мы исследовали влияние гистамина (в качестве примера вазоактивного средства) на перенос гена с помощью вышеуказанного аденовирусного вектора, экспрессирующего репортерный ген lacZ (как в примере 1). Мы нашли, что инфузия гистамина в коронарную артерию резко повышает эффективность генного переноса. Свинью анестезировали и получали доступ к артериям через правую сонную артерию. Вводили многоцелевой катетер 5 French в правую коронарную артерию (RCA) и продвигали на 2 см в устье. Вводили примерно 3 мл физраствора в течение 3 мин и сразу после этого примерно 1,5 мин вводили 2 мл содержащих 31011 вирусных частиц (vp) аденовируса, экспрессирующего lacZ. Затем вынимали катетер из RCA и вставляли в левую переднюю нисходящую коронарную артерию (LAD), опять продвигая кончик катетера на 2 см в просвет LAD. После вставления вводили 3 мл гистамина в концентрации 25 мкг гистамина на 1 мл в течение 3 мин, а затем быстро в течение 2,25 мин вводили 3 мл раствора, содержащего 4,51011 vp аденовируса, экспрессирующего lacZ. В типичном случае инфузию гистамина проводили за несколько минут перед введением вектора. Не наблюдалось значительных изменений системного кровяного давления, скорости сердцебиений или сердечного ритма во время или после инфузии гистамина. Катетер вынимали, закрывали шею и животное оставляли в покое. Следует отметить, что несмотря на то, что общее число вирусных частиц, введенных в русло LAD, было примерно в 1,5 раза больше, чем в русло RCA (вследствие различного размера этих русел в свином сердце), это превышение общего числа вирусных частиц более чем компенсировалось различными размерами русла-мишени, так как русло LAD примерно в 2-3 раза больше, чем русло RCA. Через 5 дней животное забивали и сердце перфузировали параформальдегидом. Делали трансмуральные срезы из участка RCA и участка LAD. Образцы инкубировали в растворе X-gal, субстрата галактозидазы и через 16 ч материал заливали, нарезали на срезы и наносили на предметные стекла и окрашивали эозином. Микроскопический анализ показал сильное увеличение эффективности генного переноса в руслеLAD по сравнению с руслом RCA. В частности, в отсутствие обработки гистамином примерно 30% сердечных миоцитов экспрессировали lacZ после внутрикоронарного введения. Напротив, почти все миоциты в зоне LAD экспрессировали трансгенный lacZ, что указывает на повышение эффективности переноса гена в несколько раз в участке, обработанном вазоактивным средством, в отличие от контрольного участка. Таким образом, применение вазоактивного средства, как показано здесь, привело к почти полной доставке гена в намеченную ткань. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ направленной доставки трансгена в миокард пациента с ишемией сердца, включающий введение дефектного по репликации вирусного вектора путем внутриартериальной инъекции непосредственно в артерию, снабжающую миокард, причем вектор содержит трансген, кодирующий белок, который необходимо экспрессировать в ткани миокарда, и указанную внутриартериальную инъекцию проводят одновременно с инфузией или после инфузии вазоактивного средства в артерию. 2. Способ по п.1, в котором вазоактивное средство вводят в артерию по крайней мере за 2 мин до инъекции вектора. 3. Способ по п.1, в котором вазоактивным средством является гистамин или агонист гистамина, а трансген кодирует белок фактора роста сосудистого эндотелия (VEGF). 4. Способ по п.3, в котором вазоактивным средством является гистамин или агонист гистамина. 5. Способ по п.1, в котором вирусным вектором является вектор на основе аденоассоциированного вируса (AAV). 6. Способ по п.5, в котором вводят от 107 до 1011 частиц вектора в одной инъекции. 7. Способ по п.6, в котором вводят около 1011 частиц вектора в одной инъекции. 8. Способ по п.1, в котором трансген функционально связан с конститутивным промотором. 9. Способ по п.1, в котором трансген функционально связан с тканеспецифичным промотором. 10. Способ по п.1, в котором трансген функционально связан с промотором, специфичным для желудочковых миоцитов сердца. 11. Способ по п.10, в котором промотор, специфичный для желудочковых миоцитов сердца, имеет последовательность промотора легкой цепи-2 желудочкового миозина. 12. Способ по п.10, в котором промотор, специфичный для желудочковых миоцитов сердца, имеет последовательность промотора тяжелой цепи миозина. 13. Способ по п.1, в котором трансген кодирует белок, входящий в группу, состоящую из aFGF,bFGF, FGF-4, FGF-5 и VEGF. 14. Способ по п.1, в котором вектор вводят путем внутрикоронарной инъекции непосредственно в одну или более коронарных артерий. 15. Способ по п.14, в котором трансген кодирует белок, входящий в группу, состоящую из aFGF,bFGF, FGF-4, FGF-5 и VEGF. 16. Способ по п.14, в котором вазоактивным средством является гистамин или агонист гистамина, а трансген кодирует VEGF. 17. Способ по п.14, в котором вазоактивным средством является гистамин или агонист гистамина. 18. Способ по п.14, в котором вирусным вектором является вектор на основе AAV. 19. Способ по п.14, в котором внутрикоронарную инъекцию проводят не менее чем на 1 см в просвет левой и правой коронарных артерий. 20. Способ по п.14, в котором внутрикоронарную инъекцию проводят не менее чем на 1 см в просвет трансплантата подкожной вены или трансплантата внутренней артерии молочной железы в дополнение к инъекции в коронарную артерию. 21. Способ по п.14, который включает три инъекции, по одной в левую переднюю нисходящую рию. 22. Способ по п.1, в котором трансген кодирует -адренергический сигнальный белок, а вектор доставляют в миокард пациента путем внутрикоронарной инъекции непосредственно в одну или две коронарные артерии. 23. Способ по п.22, в котором -адренергический сигнальный белок выбран из группы, состоящей из -адренергического рецептора (P-AR), ингибитора киназы рецепторов, содержащих G-белок (ингибитора GRK), и аденилатциклазы (АС). 24. Способ по п.22, в котором вазоактивным средством является гистамин или агонист гистамина, а также кодирует VEGF. 25. Способ по п.22, в котором вазоактивным средством является гистамин или агонист гистамина. 26. Способ по п.22, в котором вирусным вектором является вектор на основе AAV. 27. Способ по п.22, в котором внутрикоронарную инъекцию проводят не менее чем на 1 см в просвет левой и правой коронарных артерий. 28. Способ по п.22, в котором внутрикоронарную инъекцию проводят не менее чем на 1 см в просвет трансплантата подкожной вены или трансплантата внутренней артерии молочной железы в дополнение к инъекции в коронарную артерию. 29. Способ по п.22, который включает три инъекции, по одной в левую переднюю нисходящую
МПК / Метки
МПК: A61K 48/00
Метки: миокарда, трансгена, пациента, ишемией, направленной, способ, миокард, доставки
Код ссылки
<a href="https://eas.patents.su/20-19099-sposob-napravlennojj-dostavki-transgena-v-miokard-pacienta-s-ishemiejj-miokarda.html" rel="bookmark" title="База патентов Евразийского Союза">Способ направленной доставки трансгена в миокард пациента с ишемией миокарда</a>
Предыдущий патент: Арилметилбензохиназолиноны в качестве позитивных аллостерических модуляторов рецептора м1
Следующий патент: Способ оценки нефтезаводского сырья
Случайный патент: Способ передачи электрического сигнала