Способ инабор для количественного определения и обнаружения микроорганизмов
Формула / Реферат
1. Способ, использующий внутренний стандарт, для количественного определения и обнаружения любых ДНК- или РНК-содержащих микроорганизмов, отличающийся тем, что он включает (1) использование или определение стандартной концентрации микроорганизма или концентрации ДНК или РНК, содержащейся в этом микроорганизме, называемом стандартным микроорганизмом, в виде интервала концентраций стандартного микроорганизма, полученного последовательным разведением микроорганизма, предварительно стандартизованного по концентрациям содержащихся в нем ДНК или РНК, образующих внешний стандарт, (2) сравнение количества продукта обратной транскрипции и/или амплификации РНК или ДНК полученного из неизвестной концентрации микроорганизма с количествами амплификата РНК или ДНК известных концентраций упомянутого микроорганизма, при этом определяемый микроорганизм или его геном, который надо определить, идентичен стандартному микроорганизму или его геному, обрабатываемому паралельно, а способ также включает внутренний контроль эффективности амплификации или обратной транскрипции.
2. Способ по п.1, отличающийся тем, что стадия (2) состоит из сравнительного обнаружения, основанного на сравнении концентрации стандартного микроорганизма с концентрацией определяемого микроорганизма, предпочтительно определяемой методом разветвленной ДНК или любым другим методом, который не амплифицирует ДНК или РНК стандартного или определяемого микроорганизмов.
3. Способ по п.1, отличающийся тем, что он включает:
1) отбор и очистку заданного количества определяемого микроорганизма из образцов, полученных из организма человека, животных или из растений, или из клеточных культур, при этом количество микроорганизма должно быть достаточным, чтобы обеспечить такие концентрации исследуемой ДНК или РНК, которые можно измерить прямыми методами;
2) экстракцию ДНК или РНК и измерение проэкстрагированного количества;
3) определение числа нуклеотидных оснований исследуемого микроорганизма,
4) определение расчетным путем суммарной молекулярной массы ДНК или РНК упомянутого микроорганизма, исходя из этого числа нуклеотидных оснований и средней известной молекулярной массы одного нуклеотида;
5) определение расчетным путем количества ДНК или РНК каждого микроорганизма, производимого таким же образом с использованием числа Авогадро;
6) приготовление и/или использование интервала концентраций стандартного микроорганизма, полученного последовательным разбавлением микроорганизма, предварительно стандартизованного по концентрациям содержащихся в нем ДНК или РНК, образующих внешний стандарт, для которого (а) концентрация ДНК или РНК и (б) концентрация микроорганизмов известна для каждого разбавления,
7) экстрагирование ДНК или РНК стандартного и определяемого микроорганизмов с последующим одновременным обнаружением их в экстрактах методом разветвленной ДНК или любым другим методом, который не амплифицирует ДНК или РНК стандартного или определяемого микроорганизма, и/или проведением обратной транскрипции и/или, по крайней мере, одной амплификации и регистрацией полученных результатов, и
8) сравнение концентраций ДНК или РНК стандартного и определяемого микроорганизмов или продуктов амплификации определяемого микроорганизма с продуктами амплификации внешнего стандарта для определения по ним концентрации ДНК или РНК или суммарной концентрации микроорганизма в каждом образце определяемого микроорганизма.
4. Способ по п.3, отличающийся тем, что стадии (2)-(5) выполняют простым прямым измерением числа микроорганизмов.
5. Способ по любому из пп.1-4, отличающийся тем, что он включает внутренний контроль, последовательность и затравки которого не связаны с определяемыми ДНК или РНК и который имеет вид гетерологической плазмидной ДНК или транскрипты РНК, для контроля эффективности амплификации или обратной транскрипции-амплификации.
6. Способ по пп.1 или 2, отличающийся тем, что приготовление известных концентраций микроорганизма осуществляют путем приготовления известных концентраций:
- того же самого инактивированного микроорганизма, ДНК или РНК, которого по-прежнему можно обнаруживать или количественно определять с помощью метода разветвленной ДНК и/или способа обратной транскрипции и/или амплификации, идентичным в случае ДНК или РНК нативного вируса,
- полной нуклеотидной последовательности, проэкстрагированной из того же микроорганизма, или
- полной нуклеотидной последовательности, полученной синтезом.
7. Способ по любому из пп.1-6, отличающийся тем, что приготавливают известные стандартные концентрации микроорганизма того вида, который следует количественно определить или обнаружить и который состоит полностью из ДНК или РНК, или приготавливают концентрации ДНК или РНК генома упомянутого микроорганизма, соответствующего известным концентрациям этого микроорганизма для их хранения до передачи пользователю.
8. Способ по любому из пп.1-7, отличающийся тем, что определяют количество микроорганизмов в любых средах или образцах или обнаруживают минимальное измеряемое количество микроорганизма или большее количество, чем минимальное измеряемое количество.
9. Набор средств для количественного определения и обнаружения ДНК- или РНК-содержащих микроорганизмов, отличающийся тем, что он содержит следующие компоненты, помещенные в подходящие контейнеры и/или находящиеся в виде соответствующих устройств:
- серия известных стандартных концентраций микроорганизма того вида, который следует количественно определить или обнаружить и который состоит полностью из ДНК или РНК, или концентраций ДНК или РНК, соответствующих известным концентрациям вышеупомянутого микроорганизма;
- средства для экстракции, обнаружения и/или обратной транскрипции и/или амплификации в основном с помощью полимеразной цепной реакции, обратной транскрипции-полимеразной цепной реакции или NASBA, ДНК или РНК определяемого и стандартного микроорганизмов;
- средства для анализа ДНК или РНК определяемого и стандартного микроорганизмов или обнаружения продуктов амплификации; и
- средство внутреннего контроля.
10. Набор средств по п.9, отличающийся тем, что он содержит средства для простого прямого измерения числа микроорганизмов.
11. Набор средств по пп.9 и 10, отличающийся тем, что в упомянутом средстве внутреннего контроля последовательность и затравки не связаны с определяемыми ДНК или РНК, и оно предпочтительно имеет вид гетерологической плазмидной ДНК или транскрипта РНК, для контролирования эффективности амплификации или обратной транскрипции-амплификации.
Текст
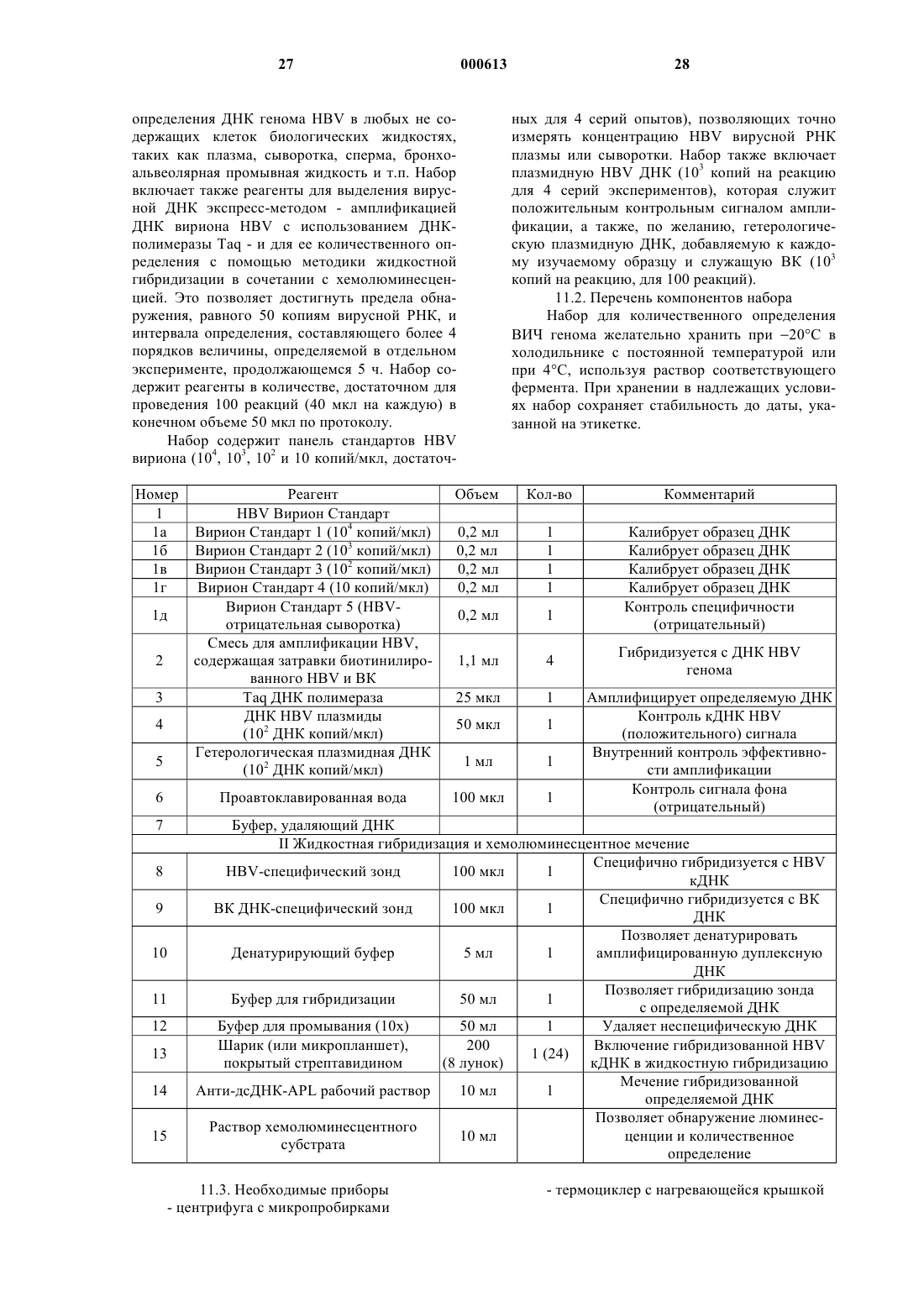
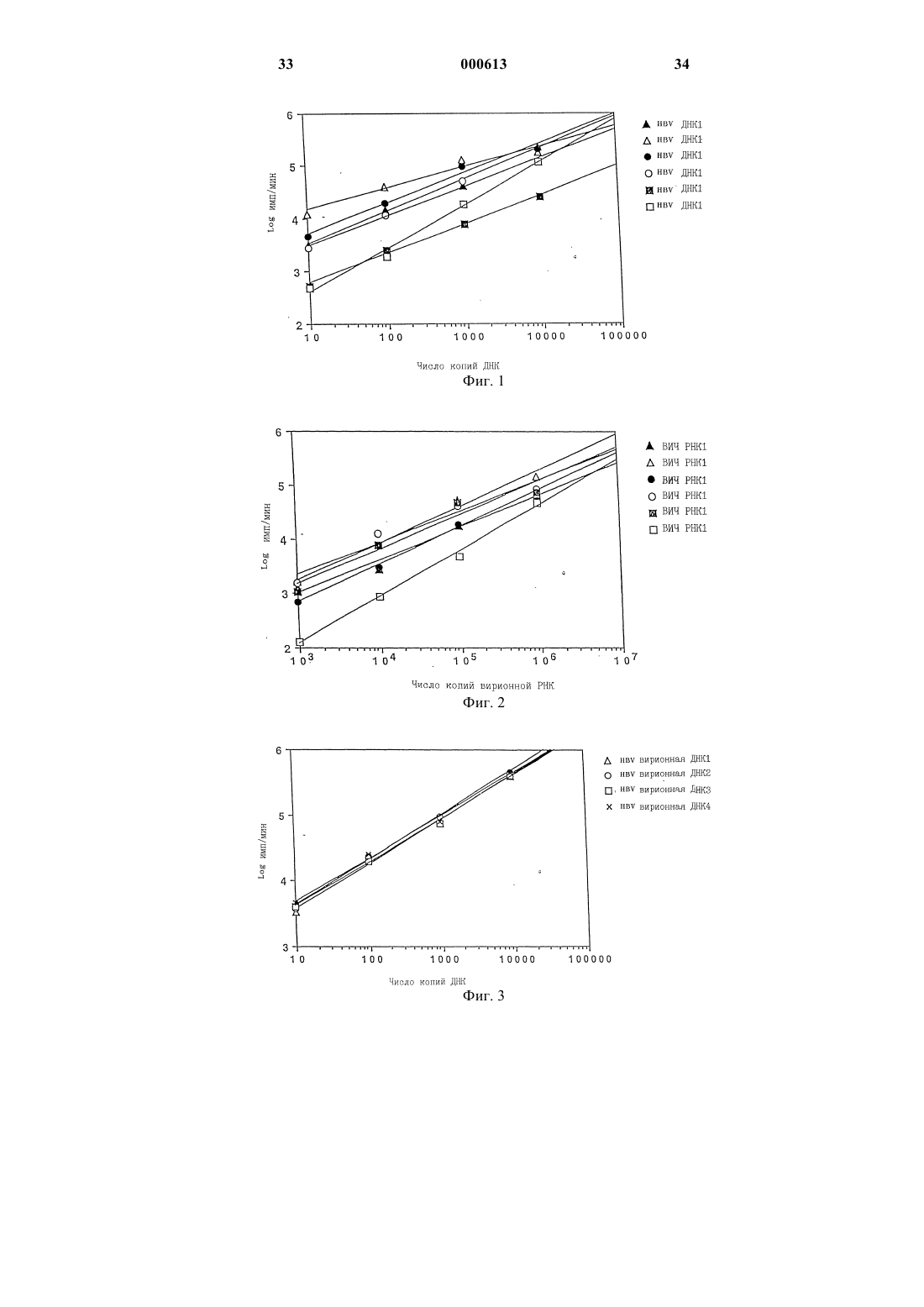
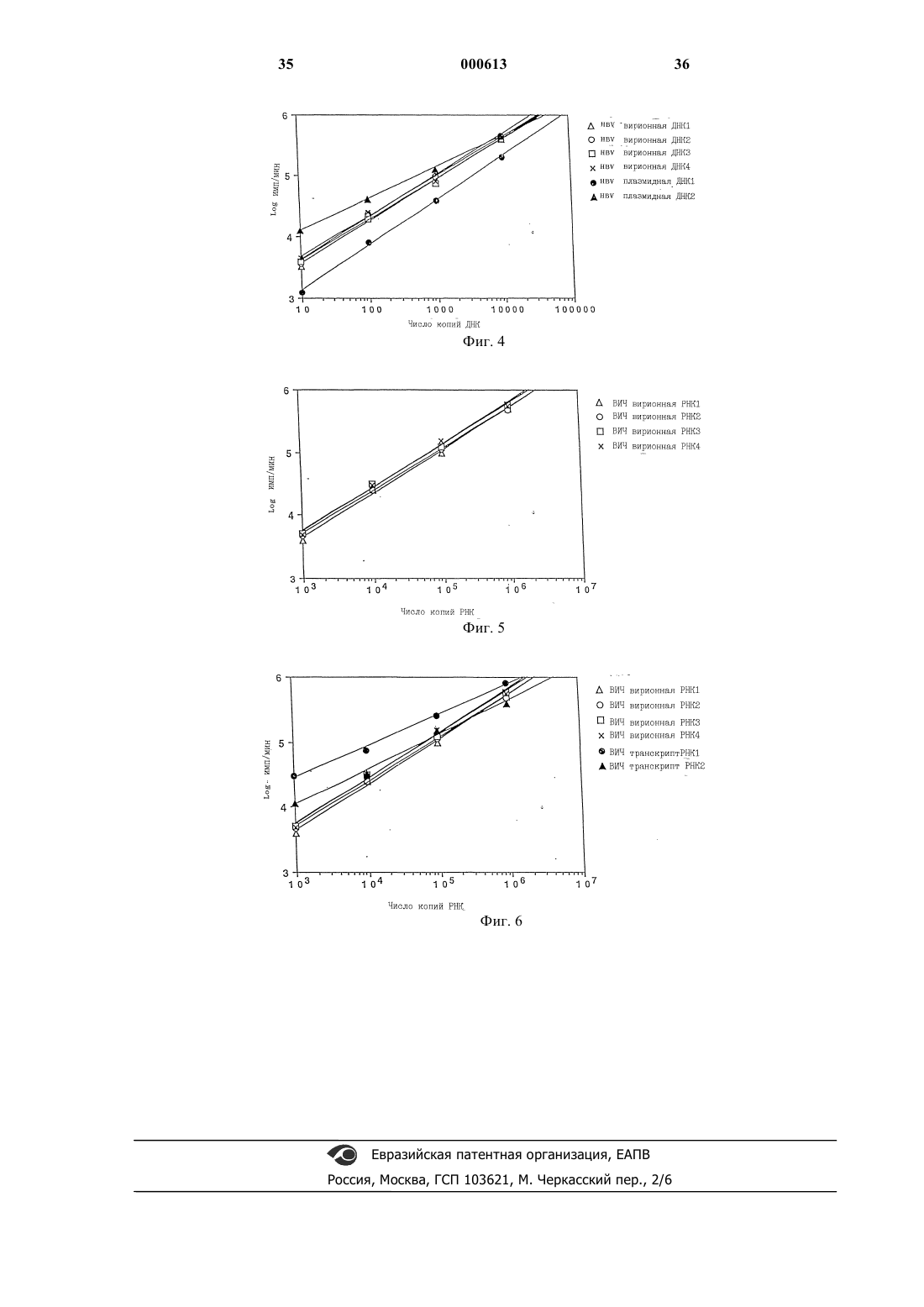
1 Настоящее изобретение относится к количественному определению и обнаружению микроорганизмов. В частности, оно относится к количественному определению и/или обнаружению микроорганизмов, имеющих ДНК- или РНК-содержащий геном. Настоящее изобретение применимо ко всем известным микроорганизмам, таким как вирусы, бактерии, простейшие, кровепаразиты,которые имеют ДНК- или РНК-содержащий геном и воздействуют на человека, животных или растения, а также к микроорганизмам, находящимся в человеке, животных и растениях в патологическом или нормальном состоянии. Изобретение также применимо для количественного определения и обнаружения этих микроорганизмов в продуктах жизнедеятельности этих животных, включая человека, и растений, а также микроорганизмов, способных к существованию в воде. Далее, способ, составляющий предмет изобретения, будет описан для количественной оценки заражения человеческими РНКсодержащими вирусами иммунодефицита(ВИЧ) и ДНК-содержащими вирусами гепатита В (HBV). В настоящее время изучение эпидемиологии, лечения и профилактики болезней человека, животных и растений является актуальной задачей здравоохранения, ветеринарии и сельского хозяйства. Идентификация и количественное определение микроорганизмов в таких средах, как ткани, биологические жидкости и invitro-препараты являются стадиями, необходимыми для правильного решения этой задачи. Единственными современными технологическими средствами, которые позволяют провести молекулярную идентификацию и количественную оценку микроорганизмов с учетом размера большинства микроорганизмов, особенно вирусов, и их концентрации в биологических средах(обычно порядка 101-1012 микроорганизмов в мл), являются средства, которые используют амплификацию фрагмента генома. Наиболее часто применяемый в настоящее время метод амплификации генома называется полимеразной цепной реакцией или ПЦР. Таким образом, с помощью фермента полимеразы можно амплифицировать ДНК-содержащий фрагмент генома. Подобным же образом можно провести обратную транскрипцию РНК в ДНК и амплификацию с помощью пары обратная транскриптаза+полимераза или с помощью фермента, выполняющего обе эти операции. После того, как фрагмент генома амплифицирован, этот фрагмент "амплификат" определенным образом идентифицируется различными методами (методом радиоактивного или окрашенного зонда,по размеру фрагмента). Методы количественной оценки ВИЧ с помощью ПЦР описаны, например, М. Holodniy и др. (J. Infect. Dis., 163, 862-866 (1991); S. Aoki 000613Sei и др. (J. AIDS Res. Hum. Retrovirus, 8, 12631270 (1992); P. Bagnarelli и др. (J. Virol., 66,7328-7335 (1992); M. Piatak Jr. и др. (Science,259, 1749-1755 (1993); S. M. Bruisten и др. (AIDS 7 (Suppl. 2), S15-S20 (1993). Методы количественной оценки ДНК вируса гепатита С описаны, например, U. Kumar и др. (J. Virol. Methods, 47 (1-2), 95-102 (1994);(2), 265-9 (1995); K.K. Young и др. (J. Clin. Microbiol., 33 (3), 654-7 (1995). Методы количественной оценки РНК вируса гепатита В описаны, например, Р. Lehtovaara и др. (PCR Methods Appl., 3 (3), 169-75Microbiol., 27 (9), 1930-33 (1989). Однако соотношение между амплифицированным продуктом и исходной ДНК или РНК в действительности меняется от опыта к опыту; поэтому возникает необходимость измерения стандарта, концентрации которого известны. До сих пор амплификационные возможности ПЦР могли быть оценены с помощью клеток, в которых определяемый геном присутствует только в постоянном числе копий, или с помощью плазмид, каждая из которых имеет единственный фрагмент гена. Таким путем могло быть установлено, что благодаря ПЦР даже единственный фрагмент гена может быть определенным образом идентифицирован ПЦР. Также установлено, что существует пропорциональное соотношение между концентрациями ДНК плазмид, которые являются объектами амплификации, и концентрациями ДНК, измеренных после амплификации. Однако было найдено, что это соотношение меняется от эксперимента к эксперименту, потому что ПЦР амплификация является биологическим процессом, обусловленным действием полимеразы,которое не регулируется в столь полной мере,чтобы этот процесс стал чисто физической техникой. Это привело исследователей и инженеров биотехнологических компаний к введению стандартизации в каждый эксперимент по количественному определению вирусов. До сих пор стандартизация состояла в приготовлении серии концентраций (обычно от трех до пяти) стандартной плазмиды, у которой ДНК фрагмент,подлежащий амплификации, имеет те же затравки и в зависимости от технологии несколько отличающуюся или идентичную последовательность. Соотношение амплификации ДНК равных концентраций двух плазмид с одинаковыми затравками, различающимися по длине, а значит и по последовательности, (1) может отличаться от случая к случаю и (2) не обязательно быть равным тем концентрациям ДНК из 3 идентичных нативных вирусов в пределах одного эксперимента. Задача оказывается еще сложнее, если она состоит в количественном определении или идентификации таких РНК-содержащих вирусов, как, например, вирус СПИД (ВИЧ). В случае РНК-содержащих вирусов, стадия ПЦР амплификации должна, в сущности, сочетаться со стадией обратной транскрипции (сокращенно ОТ), которая часто осуществляется или с помощью другого фермента, обратной транскриптазы, или с помощью фермента, обладающего обеими функциями (обратной транскрипцией и ДНК амплификацией). В обоих случаях коммерчески доступные в настоящее время ферменты позволяют получать соотношения обратной транскрипции, которые могут меняться от эксперимента к эксперименту от 10:1 (т.е. 10 копий РНК дают 1 копию ДНК) до 100:1 (100 копий РНК дают 1 копию ДНК). До сих пор основная проблема, а именно, несопоставимость результатов, получаемых в последовательных экспериментах, была решена одновременной инкубацией всего интервала концентраций стандартного фрагмента РНК (стандартный транскрипт), используя одни и те же затравки, у которых амплифицируемая часть или идентична, если она используется в качестве внешнего стандарта, или отличается по последовательности или по длине, если она используется в коамплификации, при этом транскрипт затем инкубируется в той же пробирке, что и РНК исследуемого микроорганизма, который следует определить. Таким образом патент FR-A-2691162 раскрывает метод количественного определения микроорганизмов, особенно подходящий для ретровирусов, включающий использование в качестве внешнего стандарта концентрации клеточных культур, инфицированных определенными количествами вышеупомянутых ретровирусов, оттитрованных в их эталонном вирусном белке или "сердцевинном белке", особенно белке р 24/25 или р 27 ВИЧ-1 или ВИЧ-2 вирусов. К сожалению, по-видимому, концентрации двух транскриптов могут быть различны, и могут даже отличаться от концентраций РНК, полученных из одинаковых концентраций вирусов. В заключение можно сказать, что- известная техника обратной транскрипции и/или амплификации не обеспечивает идентичные результаты для одного и того же образца при переходе от эксперимента к эксперименту;- следует использовать стандарт, который может быть внутренним или внешним;- внешний стандарт, состоящий из плазмиды для ДНК-содержащих микроорганизмов или из транскрипт РНК для РНК-содержащих микроорганизмов, позволяет получить только относительное количественное определение, так как 4 соотношение амплификации необязательно равно соотношению амплификации ДНК или РНК всего микроорганизма;- кроме того, коамплифицированный внутренний стандарт включает различные длины или последовательности плазмид или транскрипта и обладает теми же недостатками, что и внешний стандарт, использующий плазмиду или транскрипт. При современном состоянии науки амплификация плазмидной ДНК не точно пропорциональна амплификации вирусной ДНК. Что касается стандарта, используемого в настоящее время для РНК-содержащих вирусов, им является транскрипт, обладающий теми же недостатками,что и плазмида, к которой добавляется возможность деградации свободной РНК. Таким образом, возникла необходимость в количественном определении и тестах обнаружения микроорганизмов, дающих абсолютные значения числа определяемых микроорганизмов. Установлено, что можно количественно определять или обнаруживать абсолютные значения любых ДНК- или РНК-содержащих микроорганизмов при условии, что 1) известно или возможно определить каким-либо способом стандартную концентрацию микроорганизма или концентрацию ДНК или РНК, содержащуюся в этом микроорганизме,называемом стандартным микроорганизмом; и 2) сравнивают количество продукта обратной транскрипции и/или амплификации РНК или ДНК, полученного из неизвестной концентрации микроорганизма с количествами амплификата РНК или ДНК, полученных из нескольких известных концентраций вышеупомянутого микроорганизма. Такой способ составляет первый объект настоящего изобретения. В соответствии с возможностью альтернативного осуществления стадия (2) может состоять из сравнительного обнаружения, основанного на сравнении концентраций стандарта с концентрациями определяемого микроорганизма,обнаруженного предпочтительно с помощью так называемого метода разветвленной ДНК или любым другим методом обнаружения, который не амплифицирует ДНК или РНК стандарта или определяемого микроорганизма. Для приготовления известных концентраций микроорганизма следуют любой из методик, известных квалифицированным микробиологам, предпочтительно используя центрифугирование и очищение из образцов человека, животных или растений или из клеточных культур любого количества определяемого микроорганизма с последующей экстракцией ДНК или РНК из этих очищенных отцентрифугированных препаратов традиционными способами. Количества, которые должны быть использованы в следующей стадии процесса, выбирают по 5 желанию, с выполнением единственного требования, чтобы они были достаточными для получения в конечном счете таких количеств ДНК или РНК стандартного микроорганизма, чтобы их можно было измерить прямыми микробиологическими методами, которые не используют амплификацию ПЦР типа и которые могут осуществить квалифицированные сотрудники. На практике, с учетом точности современного лабораторного оборудования, подходящими количествами являются количества порядка нескольких сотен нанограммов или нескольких микрограммов. Целесообразно, чтобы способ, являющийся предметом изобретения, состоял из следующих стадий: 1) некоторое количество микроорганизма,которое следует определить, отбирают из образцов человека, животных или растений или из клеточных культур и затем очищают, при этом количество микроорганизма должно быть достаточным для того, чтобы обеспечить такие концентрации исследуемых ДНК или РНК, которые можно определить прямыми методами; 2) ДНК или РНК экстрагируют и количество, выраженное в нг или мкг, измеряют; 3) далее используют число нуклеотидных оснований рассматриваемого микроорганизма. Это число может быть известно, например, из банка данных или может быть определено традиционными методами; 4) суммарную молекулярную массу ДНК или РНК вышеупомянутого микроорганизма рассчитывают из этого числа нуклеотидных оснований, известная средняя молекулярная масса одного нуклеотида составляет около 330 дальтон; 5) используя число Авогадро (6,021023),рассчитывают таким образом количество ДНК или РНК каждого микроорганизма; 6) приготавливают серию концентраций стандартного микроорганизма последовательными разбавлениями микроорганизма, предварительно стандартизованного по концентрациям его ДНК или РНК, и/или используют ее в качестве внешнего стандарта, для которого (а) концентрация ДНК или РНК и (б) концентрация микроорганизма известны, таким образом, для каждого разбавления; 7) экстрагируют ДНК или РНК стандартного и определяемого микроорганизмов, и одновременно в обоих экстрактах проводят обнаружение микроорганизма с помощью так называемого метода разветвленной ДНК или любым другим методом, который не амплифицирует ДНК или РНК стандартного или определяемого микроорганизмов, и/или экстракты подвергают обратной транскрипции и/или, по крайней мере,одной амплификации, полученные в результате данные регистрируют, и 8) сравнивают концентрации ДНК или РНК стандартного и определяемого микроорга 000613 6 низмов или сравнивают продукты амплификации определяемых микроорганизмов с продуктами амплификации внешнего стандарта для определения концентрации ДНК или РНК или концентрации всего микроорганизма в каждом образце определяемого микроорганизма. В качестве примеров литературных источников, содержащих указания или ссылки на банк данных о числе нуклеотидных оснований микроорганизмов, можно привести следующие работы: Virus Res., 23, 39-53 (1992); Gene, 81,275-284 (1989); Virology, 177, 305-311 (1990); J.Gen. Virol., 69, 2575-2583 (1988). Если микроорганизмы достаточно большие для прямого обнаружения и подсчета оптическими и/или электронными методами, целесообразно использовать вариант метода, согласно которому вышеприведенные стадии 2-5 настоящего изобретения заменяют на простое непосредственное измерение числа микроорганизмов. Согласно наиболее предпочтительному варианту осуществления изобретения, способ,составляющий предмет изобретения, может по желанию включать внутренний контроль, предпочтительно в форме ДНК гетерологической плазмиды или транскрипта РНК, последовательность и затравки которых не связаны с определяемыми ДНК или РНК. Целесообразно добавлять вышеупомянутый внутренний контроль к каждому изучаемому образцу. Внутренний контроль (в дальнейшем ВК) служит для контроля эффективности амплификации или ОТ-амплификации. Возможен вариант, когда приготовление известных концентраций микроорганизма может быть заменено в способе, составляющем предмет изобретения, на приготовление известных концентраций- того же самого инактивированного микроорганизма, ДНК или РНК которого попрежнему можно обнаруживать и количественно определять с помощью такого способа, как так называемый способ разветвленной ДНК и/или обратной транскрипции и/или амплификации, выполняемые таким же образом, как и в случае ДНК или РНК нативного вируса;- полной нуклеотидной последовательности, проэкстрагированной из того же самого микроорганизма; или- полной нуклеотидной последовательности, полученной синтезом. В соответствии с наиболее подходящим вариантом способа, являющегося предметом изобретения, выбирают известные стандартизованные концентрации того микроорганизма,целиком состоящего из ДНК или РНК, который нужно количественно определить или обнаружить, или приготавливают концентрации ДНК или РНК генома вышеупомянутого микроорганизма, соответствующие известным концентра 7 циям этого микроорганизма, и хранят их до использования потребителем. Для упрощения описания изобретения,ниже в качестве иллюстрации сделана ссылка на обнаружение микроорганизма, выполненное амплификацией, точнее говоря, с помощью ПЦР или ОТ-ПЦР. При этом и другие методы амплификации могут быть также использованы,например, метод NASBA, т.е. метод, основанный на анализе последовательности нуклеиновых кислот. Количественное молекулярное определение и обнаружение по способу, изложенному в изобретении, представляют большой интерес для случая как маленьких, так и более крупных микроорганизмов, но только тогда, когда они находятся в малых концентрациях или когда традиционные эмпирические методики оценки микроорганизмов больше не используются в развитых странах. Настоящее изобретение также относится к набору или комплекту средств для проведения количественного определения или обнаружения ДНК- или РНК-содержащих микроорганизмов,включающему следующие составляющие, помещенные в подходящие контейнеры и/или находящиеся в виде соответствующих приборов:- серия известных стандартных концентраций определяемого микроорганизма, целиком состоящего из ДНК или РНК, или серия концентраций ДНК или РНК, соответствующих известным концентрациям вышеупомянутого микроорганизма;- средства для экстракции, обнаружения и/или обратной транскрипции и/или амплификации, особенно ПЦР, ОТ-ПЦР или NASBA амплификации ДНК или РНК определяемого и стандартного микроорганизмов;- средства для анализа ДНК или РНК определяемого и стандартного микроорганизмов или для обнаружения продуктов амплификации. Вышеупомянутый набор или комплект средств может также по желанию включать внутренний контроль, например, в виде приблизительно 103 копий/мкл гетерологической плазмидной ДНК или транскрипты РНК в качестве контроля эффективности амплификации или ОТ-амплификации. Следует отметить, что средства для анализа продуктов ПЦР или ОТ-ПЦР могут не содержаться в наборе, но необходимы для использования в сочетании с ним. Эти средства могут включать, например, приборы и/или реагенты для определения методами электрофореза, колориметрии, радиометрии или любым другим подходящим аналитическим методом. Вышеупомянутые способ и средства обеспечивают абсолютное количественное определение ДНК- или РНК-содержащих микроорганизмов новым способом, так как определяемый микроорганизм или его геном обнаруживается идентично стандартному микроорганизму или 8 его гену, обработанным одновременно. Кроме того, было найдено, что этот способ и эти средства обеспечивают универсальную методику количественной оценки и идентификации, поскольку они позволяют количественно определять любые микроорганизмы. Кроме количественного определения микроорганизмов способом и средством, составляющими предмет изобретения, они могут быть использованы для обнаружения минимального количества микроорганизмов, которое можно измерить современными методами обратной транскрипции и/или амплификации ДНК- или РНК-содержащих микроорганизмов. Практически наименьшее измеримое количество составляет порядка одного-пяти микроорганизмов для ДНК-содержащих микроорганизмов и порядка 10-100 микроорганизмов для РНК-содержащих микроорганизмов. Ниже приведено подробное описание изобретения, сопровождаемое приложенными графиками, которые ни в коей мере не ограничивают вышеупомянутое изобретение, и где на фиг. 1 представлен график изменения чувствительности обнаружения и эффективности амплификации различных ПЦР экспериментов, проведенных с несколькими различными стандартными концентрациями ДНК одного и того же вируса; на фиг. 2 представлен график изменения чувствительности обнаружения и эффективности амплификации различных ОТ-ПЦР экспериментов, проведенных с несколькими различными стандартными концентрациями РНК одного и того же вируса; на фиг. 3 представлен график изменения эффективности амплификации в пределах одного из ПЦР экспериментов, проведенных с несколькими различными концентрациями препаратов вирусных ДНК, взятых от разных пациентов; на фиг. 4 представлен график изменения эффективности амплификации в ПЦР экспериментах, проведенных с несколькими концентрациями ДНК из нескольких препаратов одного и того же вируса и с несколькими концентрациями ДНК двух различных плазмид, соответственно; на фиг. 5 представлен график изменения эффективности амплификации в ОТ-ПЦР экспериментах, проведенных с различными концентрациями препаратов вирусных РНК, взятых от разных пациентов; на фиг.6 представлен график изменения эффективности амплификации в ОТ-ПЦР экспериментах, проведенных с несколькими концентрациями препаратов вирусных РНК, взятых от разных пациентов, и с двумя различными транскриптами РНК, соответственно. Таким образом, в соответствии с вышеуказанным для получения 300 нг ВИЧ РНК из культуры клеток последняя была сконцентриро 9 вана, очищена и проэкстрагирована. Зная, что суммарное число нуклеотидов ВИЧ составляет 19000 и что молекулярная масса одного нуклеотида равна 330 дальтонам, было найдено, что суммарная молекулярная масса ВИЧ РНК равна 6 300 000 дальтонов. Используя число Авогадро,рассчитано точное число вирусных геномов и,следовательно, число вирусов, которое составили 300 нг РНК. Это число равно приблизительно 31010 вирусов. Зная концентрацию вируса в аликвоте очищенного вирусного препарата,можно затем приготовить стандартную серию концентраций этого вируса и использовать ее в реализации настоящего изобретения. Настоящее изобретение обеспечивает надежную идентификацию и/или абсолютное количественное определение микроорганизмов,так как определяемый микроорганизм идентичен стандартному микроорганизму. Кроме того,способ, используемый в настоящем изобретении, универсален, поскольку он позволяет количественно определять все микроорганизмы,количество которых одновременно измеряется. Настоящий способ и набор для его осуществления могут быть использованы не только для количественного определения микроорганизмов в любых средах или образцах, но также и для обнаружения минимального количества микроорганизмов, которые можно измерить современными методами обратной транскрипции и/или амплификации РНК- или ДНКсодержащих микроорганизмов. Для ДНК-содержащих микроорганизмов минимальное количество, которое можно измерить, составляет порядка 1-5 микроорганизмов,а для РНК-содержащих микроорганизмов - порядка 10-100 микроорганизмов. Настоящее изобретение, обеспечивая простые и эффективные средства и технику стандартизации определений, вносит весомый вклад в успешное развитие средств и методов количественного in vitro определения микроорганизмов. Изобретение более подробно иллюстрируется следующими примерами, которые ни в коей мере не ограничивают изобретение и в которых пропорции и проценты приведены в весовых отношениях, если не оговорено иначе. Пример 1. Демонстрация важности универсального стандарта для обнаружения и количественного определения интересуемой ДНК с помощью ПЦР. Было изучено изменение чувствительности обнаружения и эффективности ПЦР амплификации ДНК в зависимости от разных концентраций одного и того же HBV. Образцы плазмы с высоким титром HBsAg были взяты у хронических носителей вируса гепатита В с помощью плазмофереза. ДНК вириона HBV была очищена центрифугированием (на центрифуге Spinco 25 25000 об./мин в течение ночи при 4 С) через слой 30% (вес/об.) сахарозы в ТЕВМ среде (0,01 10 М Tris-HCl, рН 7,6, 0,001 М Nа-ЭДТА, 1% сыворотка бычьего альбумина и 0,3% 2 меркаптоэтанол). Чистоту фракционированныхHBV вирионов контролировали с помощью электронной микроскопии. ДНК вирионов была проэкстрагирована с помощью промышленного набора для очистки ДНК. Полученная вирионная ДНК была количественно определена с помощью спектрофотометрии. Число копий вирусной ДНК подсчитывали с помощью молекулярной массы вирионного генома HBV ДНК. Возможен также вариант подсчета числа вирионов с помощью электронной микроскопии. Серию разбавленных растворов HBV ДНК (10,100, 1000, 10000 копий) подвергали последовательно идентичным циклам ПЦР (при 94 С в течение 60 с, при 56 С в течение 60 с и при 72 С в течение 90 с) со 100 пмол HBV-затравочных пар специфичных для С гена: (GCTTTGGGGATGCTGG). Специфические продукты ПЦР анализировали дот-блот гибридизацией, используя зонды, меченные на концах - 32P(TCAGCTCTGTATCGAGAAGCC), число импульсов в минуту (имп./мин) каждого ПЦР сигнала регистрировали с помощью счетчика бетаизлучения. Результаты регистрировали и строили график (фиг. 1). Ясно видно, что стандарт дал бы другие результаты и что поэтому его следует использовать в каждом эксперименте одновременно с определяемым образцом. Таким образом, как видно из кривых фиг. 1, для каждого вводимого количества ДНК постоянной матрицы (число копий) существует большой разброс концентраций продуктов ПЦР от эксперимента к эксперименту. Пример 2. Демонстрация важности универсального стандарта для обнаружения и количественного определения интересуемой РНК с помощью ОТ-ПЦР. Было изучено изменение чувствительности обнаружения и эффективности обратной транскрипции/ПЦР амплификации РНК разных концентраций одного и того же ВИЧ-1. РНК ВИЧ-1 вириона очищали пропусканием надосадочной жидкости культуры кровяных мононуклеарных бластных клеток, инфицированной первичным изолятом, через колонку с сефарозой. Чистоту фракционированных ВИЧ-1 вирионов контролировали электронной микроскопией. Вирионная РНК была проэкстрагирована с помощью промышленного набора для выделения РНК. Полученная вирусная РНК была количественно определена с помощью спектрофотометрии. Число копий вирусной РНК подсчитывали с помощью молекулярной массы вирусного генома ВИЧ-1 РНК. После добавления 1 микрограмма тРНК серию разбавленных образцов РНК (1000000, 100000, 10000, 1000 копий) таблетировали и суспендировали в 10 мкл. Аликвоту РНК 10 мкл и 1 мкг упомянутой тРНК, не 11 содержащую ВИЧ, сразу прибавляли к каждой ОТ-ПЦР реакционной смеси (90 мкл), содержащей 10 единиц обратной транскриптазы рекомбинантного вируса лейкоза Молони мышей и 3 единицы ДНК полимеразы амплиТаq для амплификации gag гена ВИЧ. ОТ-ПЦР проводили в течение 25 мин при 42 С, 5 мин при 94 С и затем свыше 40 ПЦР циклов (при 94 С в течение 60 с, при 56 С в течение 60 с и при 72 С в течение 90 с), используя 100 пмол каждой из ВИЧ-затравочных пар специфичных для gag гена: (GGAACATCAAGCAGCCATGC/TCCTTTGGTCCTTGTCTTATGTC). Специфические ПЦР продукты анализировали дот-блоттингом,используя затравку, меченную на конце - 32P(имп./мин) каждого ПЦР сигнала регистрировали с помощью счетчика бета-излучения. Результаты регистрировали и строили график (фиг. 2). Оказалось, что разброс результатов очень велик от эксперимента к эксперименту. Здесь также отчетливо видно, что стандарт дал бы другие результаты и что поэтому его следует использовать в каждом эксперименте одновременно с определяемым образцом. Таким образом, как видно из кривых фиг. 2, для каждого постоянного вводимого количества РНК (число копий) существует большой разброс концентраций продуктов ПЦР от эксперимента к эксперименту. Пример 3. Обоснование стандарта ДНК вириона. Этот пример показывает, что эффективность амплификации одинакова, когда используются одинаковые циклы ПЦР ДНК нативногоHBV вириона, взятые из сывороток различных пациентов, инфицированных HBV. Серию разбавленных образцов различных ДНК HBV вириона, приготовленную, как описано в примере 1, подвергали такому же числу циклов ПЦР в таком же эксперименте. Продукт ПЦР (выход) количественно определяли дот-блоттингом и по числу импульсов в минуту. Результаты, представленные в виде графика на фиг. 3, показывают, что эффективность ПЦР амплификации одинакова, независимо от источника HBV вириона (в данном случае для 4 разных источников). Пример 4. Обоснование стандарта ДНК вириона. Действуя как указано в примере 3, но каждый раз используя в тех же циклах ПЦР ДНК нативного вириона и ДНК взятых из двух HBV плазмид (вводимое количество), можно определить сравнительные эффективности ПЦР амплификации (см. фиг. 4). ДНК фрагменты последовательности С гена HBV были получены с помощью ПЦР из сывороток HBVAg+ и лигированы в плазмиды 12 кривые были подтверждены секвенировнием ДНК, выполненным с помощью соответствующего промышленного набора. Результаты, представленные в виде графика на фиг. 4, показывают, что известное число копий может иметь или не иметь эффективность амплификации, сравнимую с эффективностью амплификации такого же числа копий нативной вирусной ДНК, взятых из нескольких образцов. Таким образом, из примеров 3 и 4 следует,что известные концентрации ДНК HBV вириона из различных источников составляют идеальный универсальный стандарт, в то время как фрагменты вирусной ДНК, интегрированные в различные плазмиды, ведут себя по-разному по отношению друг к другу и отлично от нативных ДНК. Пример 5. Обоснование стандарта РНК вириона. Этот пример показывает, что эффективность амплификации одинакова, когда используются одинаковые циклы ОТ-ПЦР РНК нативного ВИЧ вириона, взятых из сывороток различных пациентов, инфицированных ВИЧ. Серию разбавленных образцов различных РНК ВИЧ вириона, приготовленных, как описано в примере 2, подвергали циклу ОТ-ПЦР в таком же эксперименте. Продукт ПЦР (выход) количественно определяли дот-блоттингом и по числу импульсов в минуту. Результаты, представленные в виде графика на фиг. 5, показывают, что эффективность ОТ-ПЦР амплификации одинакова, независимо от источника ВИЧ вириона. Пример 6. Обоснование стандарта РНК вириона. Действуя, как указано в примере 5, но каждый раз используя в тех же циклах ОТ-ПЦР РНК нативного вириона и транскрипт РНК с известным числом копий (вводимое количество), можно определить сравнительные эффективности ОТ-ПЦР амплификации (см. фиг. 6). Фрагменты РНК последовательности gag гена ВИЧ-1 получали транскрипцией ДНК шаблон ВИЧ-1 (рВR322-плазмидная ВИЧ-Z6 ДНК и рВН 10-R3-плазмидная ВИЧIIIB ДНК соответственно) с помощью Т 7 РНК-полимеразы (ВИЧ транскрипты РНК 1 и РНК 2 соответственно). Результаты, представленные в виде графика на фиг. 6, показывают, что эффективность ОТ-ПЦР амплификации матричной РНК с известным числом копий отличается от эффективности амплификации РНК образца. Таким образом, из примеров 5 и 6 следует,что известные концентрации РНК ВИЧ вириона из различных источников представляют идеальный универсальный стандарт, в то время как фрагменты вирусной РНК, интегрированные в различные плазмиды, ведут себя по-разному по отношению друг к другу и отлично от нативных РНК. Таким образом- для контроля эффективности амплификации в количественном ПЦР тесте использование ДНК вириона в качестве внешнего стандарта в соответствии с настоящим изобретением гораздо точнее и удобнее, чем использование плазмидной ДНК в качестве внешнего или внутреннего стандарта;- для контроля эффективности амплификации в количественном ОТ-ПЦР тесте использование РНК вириона в качестве внешнего стандарта в соответствии с настоящим изобретением гораздо точнее и удобнее, чем использование транскрипта РНК в качестве внешнего или внутреннего стандарта. Пример 7. Набор для количественного определения генома вируса иммунодефицита человека (ВИЧ) при его визуальном обнаружении. 7.1. Введение В соответствии с настоящим изобретением набор для количественного определения генома вируса иммунодефицита человека (ВИЧ) предназначен для обнаружения и количественного определения РНК генома ВИЧ (включая все генотипы ВИЧ-0, ВИЧ-1 и ВИЧ-2) в любых не содержащих клеток биологических жидкостях(таких как плазма, сыворотка, сперма, бронхоальвеолярная промывная жидкость и т.п.), а также надосадочная культуральная жидкость. Набор включает также реагенты для выделения вирусной РНК экспресс-методом - обратной транскрипцией РНК ВИЧ вириона в кДНК с помощью обратной транскриптазы клонированного вируса мышиного лейкоза Молони в сочетании с амплификацией с использованием ДНКполимеразы Taq и, в конечном итоге, для ее коНомер 1 14 личественного обнаружения с помощью простой методики визуализации в агарозном геле. Это позволяет достигнуть предела обнаружения,равного 1000 копий вирусной РНК, и интервала количественного определения, составляющего более 4 порядков величины, определяемой в отдельном эксперименте, продолжающемся 8 ч. Набор содержит реагенты в количестве, достаточном для проведения 100 реакций (40 мкл на каждую) в конечном объеме 50 мкл по протоколу. Набор содержит панель стандартов ВИЧ вириона (в дальнейшем, "вирион стандарт"),содержащих, как объяснялось выше 104, 103, 102 и 10 копий/мкл, достаточных для 4 серий опытов, позволяющих точно измерять концентрацию ВИЧ вирусной РНК в плазме или сыворотке. Набор также включает плазмидную ВИЧ ДНК (102 копий на реакцию для 4 серий экспериментов), которая служит положительным контрольным сигналом амплификации, а также по желанию, гетерологическую транскрипту РНК, добавляемую к каждому изучаемому образцу и служащую внутренним контролем (в дальнейшем, "ВК") (103 копий на реакцию, для 100 реакций). 7.2. Перечень компонентов набора Набор для количественного определения ВИЧ генома желательно хранить при 20 С в холодильнике с постоянной температурой или при 4 С, используя раствор соответствующего фермента. При хранении в надлежащих условиях набор сохраняет стабильность до даты, указанной на этикетке. Реагент ВИЧ Вирион Стандарт Вирион Стандарт 1 Исходный буфер для РНК Смесь для амплификации ВИЧ,содержащая ВИЧ затравки и,по желанию, ВК затравки(отрицательный) Служит носителем РНК для образцов РНК Растворяет образцы РНК Гибридизуется с ВИЧ РНК и кДНК геномами Обратная транскрипция определяемой РНК и амплификация кДНК Контроль кДНК ВИЧ сигнала(положительный) Внутренний контроль эффективности ОТ-амплификации Контроль сигнала фона (отрицательный)- раствор для выделения РНК 7.3.2. Приборы- генератор и баня для электрофореза. 7.4. Протокол количественного определения ВИЧ с помощью ОТ-амплификации генома 7.4.1. Экстракция РНК/100 мкл вирион стандарта ВИЧ и образцы плазмы или сыворотки гомогенизировали с 400 мкл раствора для выделения РНК несколькими вращениями гомогенизатора. Добавляли 60 мкл хлороформа, интенсивно встряхивали в течение 15 с и оставляли на льду на 10 мин. Суспензию центрифугировали с 12000 g при 4 С в течение 15 мин. После добавления хлороформа и центрифугирования гомогенат образовывал две фазы: нижнюю фенол-хлороформенную фазу (около 240 мкл) и верхнюю водную фазу (около 320 мкл). РНК оставались исключительно в водной фазе, в то время как ДНК и белки оказывались на границе раздела фаз и в органической фазе. Водную фазу (300 мкл) переносили в чистые пробирки. Был добавлен равный объем изопропанола, и образцы выдерживали 1 ч при 20 С. Образцы центрифугировали 10 мин при 12000 g (4 С), и гранулу быстро высушивали. Надосадочную жидкость удаляли, гранулу РНК промывали один раз взбалтыванием с 75% этанолом (500 мкл) и затем сушили ее в вакууме. Гранулу РНК растворяли в 11 мкл исходного РНК буфера. Осадок РНК образовывал бело-желтую гранулу, видимую только в большом количестве на дне пробирки. Важно не дать грануле РНК полностью высохнуть, так как высыхание сильно уменьшает ее растворимость. 7.4.2. Обратная транскрипция РНК и амплификация кДНК Образцы РНК (10 мкл) и положительный/отрицательный контроль добавляли в чистые (200 мкл) пробирки. 40 мкл смеси для обратной транскрипции/амплификации ВИЧ (38,9 мкл смеси для амплификации ВИЧ + 1,1 мкл смеси ферментов) помещали в каждую пробирку. Пробирки переносили в термоциклер с нагревающейся крышкой и выдерживали их- с последующим выдерживанием при 55 С в течение 5 мин и затем при 72 С в течение 5 мин. 7.5. Визуализация и количественное определение 10 мкл послереакционной смеси наносили на 1,5%-ный агарозный гель, содержащий 0,5 мкг/мл бромистого этидия, и проводили электрофорез при 150 В в течение 10 мин. Специфически амплифицированные последовательности ВИЧ могут быть легко визуализированы благодаря различию в размерах. Области копирования ВИЧ вирионной РНК в 100-мкл образцах плазмы или сыворотки могут быть определены сравнением их полос амплификации с амплификационными полосами ВИЧ вирион стандарта (полуколичественное определение). Пример 8. Набор для количественного определения генома вируса иммунодефицита человека (ВИЧ) при обнаружении его с помощью устройства, считывающего показания оптической плотности. 8.1. Введение В соответствии с настоящим изобретением, набор для количественного определения генома вируса иммунодефицита человека (ВИЧ) предназначен для обнаружения и количественного определения РНК генома ВИЧ, включая все генотипы ВИЧ-0, ВИЧ-1 и ВИЧ-2 в любых не содержащих клеток биологических жидкостях (таких как плазма, сыворотка, сперма,бронхоальвеолярная промывная жидкость и т.п.), а также надосадочная культуральная жидкость. Набор включает также реагенты для выделения вирусной РНК экспресс-методом - обратной транскрипцией РНК ВИЧ вириона в кДНК с помощью обратной транскриптазы клонированного вируса мышиного лейкоза Молони в сочетании с амплификацией с использованием ДНК-полимеразы Taq и, в конечном итоге, для ее количественного обнаружения с помощью методики жидкостной DIG-гибридизации. Это позволяет достигнуть предела обнаружения,равного 100 копиям вирусной РНК, и интервала количественного определения, составляющего около 2 порядков величины, определяемой в отдельном эксперименте, продолжающемся 8 ч. Набор содержит реагенты в количестве, достаточном для проведения 100 реакций (40 мкл на каждую) в конечном объеме 50 мкл по протоколу. Набор содержит панель стандартов ВИЧ вириона, содержащих 103, 102, 10 и 1 копию/мкл, достаточных для 4 серий опытов и позволяющих точно измерять концентрацию ВИЧ вирусной РНК в плазме или сыворотке. Набор также включает плазмидную ВИЧ ДНК(102 копий на реакцию для 4 серий экспериментов), которая служит положительным контрольным сигналом амплификации, а также, по жела 17 нию, гетерологическую матричную РНК, добавляемую к каждому изучаемому образцу и служащую ВК (103 копий на реакцию, для 100 реакций). 8.2. Перечень компонентов набора Набор для количественного подсчета ВИЧ генома желательно хранить при 20 С в холоНомер 1 1 а 1 б 1 в 1 г 1 д 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 18 дильнике с постоянной температурой или при 4 С, используя раствор соответствующего фермента. При хранении в надлежащих условиях набор сохраняет стабильность до даты, указанной на этикетке.I Связанная обратной транскрипцией амплификация ВИЧ генома и DIG мечение ВИЧ Вирион Стандарт Вирион Стандарт 1 0,4 мл 1 Калибрует образец РНК(отрицательный) Служит носителем РНК для образцов тРНК (0,1 мг/мл) 1 мл 1 РНК Исходный буфер для РНК 250 мкл 4 Растворяет РНК образцы Смесь для амплификации ВИЧ,Гибридизуется с ВИЧ РНК и кДНК содержащая ВИЧ затравки и ВК 1 мл 4 геномов затравки (5% DIG-dUTP) Обратная транскрипция определяемой Смесь ферментов 28 мкл 4 РНК и амплификация кДНК ДНК ВИЧ плазмиды Контроль кДНК ВИЧ сигнала 40 мкл 1(положительный) Внутренний контроль эффективности Гетерологическая транскрипта 1 мл 1 ОТ-амплификации РНК (103 копий/мкл) Контроль сигнала фона Автоклавированная вода 40 мкл 1II Жидкостная гибридизация и обнаружение DIG Включение ВИЧ кДНК в жидкостную Биотинилированный ВИЧ зонд 200 мкл 1 гибридизацию Биотинилированный внутренний Включение ВК кДНК в жидкостную 100 мкл 1 контроль ДНК-специфичный зонд гибридизацию Позволяет денатурировать амплифициДенатурирующий буфер 4 мл 1 рованную дуплексную ДНК Позволяет гибридизовать зонд с опреБуфер для гибридизации 40 мл 1 деляемой ДНК Буфер для промывания (10 х) 50 мл 1 Удаляет неспецифичную ДНК Шарик (или микропланшет),200 Включение гибридизованной кДНК 1(24) покрытый стрептавидином(8 лунок) ВИЧ в жидкостную гибридизацию Связывается с DIG молекулами специАнти-DIG-POD рабочий раствор 40 мл 1 фически амплифицированного продукта Способствует развитию окраски в POD Раствор ABTS субстрата 40 мл 1 системе- раствор для выделения РНК- водяная баня или инкубатор для жидкостной гибридизации- автоматическое устройство, считывающее показания оптической плотности. 19 8.4. Протокол количественного определения ВИЧ с помощью ОТ-амплификации генома 8.4.1. Экстракция РНК 100 мкл вирион стандарта ВИЧ и образцы плазмы или сыворотки гомогенизировали с 400 мкл раствора для выделения РНК несколькими вращениями в гомогенизаторе. Добавляли 60 мкл хлороформа, интенсивно встряхивали в течение 15 с и оставляли на льду на 10 мин. Суспензию центрифугировали с 12000 g при 4 С в течение 15 мин. После добавления хлороформа и центрифугирования гомогенат образовывал две фазы: нижнюю фенол-хлороформенную фазу (около 240 мкл) и верхнюю водную фазу (около 320 мкл). РНК оставались исключительно в водной фазе, в то время как ДНК и белки оказывались на границе раздела фаз и в органической фазе. Водную фазу (300 мкл) переносили в чистые пробирки. Был добавлен равный объем изопропанола и образцы выдерживали 1 ч при 20 С. Образцы центрифугировали 10 мин при 12000 g (4 С) и гранулу быстро высушивали. Надосадочную жидкость удаляли, гранулу РНК промывали один раз взбалтыванием с 75% этанолом (500 мкл) и затем сушили ее в вакууме. Гранулу РНК растворяли в 11 мкл исходного буфера для РНК. Осадок РНК образовывал бело-желтую гранулу, видимую только в большом количестве на дне пробирки. Важно не дать грануле РНК полностью высохнуть, так как высыхание сильно уменьшает ее растворимость. 8.4.2. Обратная транскрипция РНК и амплификация кДНК Образцы РНК (10 мкл) и положительный/отрицательный контроль добавляли в чистые (200 мкл) пробирки. 40 мкл смеси для обратной транскрипции/амплификации ВИЧ (38,7 мкл смеси для амплификации ВИЧ + 1,1 мкл смеси ферментов + 0,2 мкл DIG-dUTP) распределяли в каждую пробирку. Пробирки переносили в термоциклер с нагревающейся крышкой и выдерживали их- с последующим выдерживанием при 55 С в течение 5 мин и затем при 72 С в течение 5 мин. 20 8.5. Обнаружение и количественное определение 2-мкл порцию амплифицированного продукта (х 2) и ее 10-кратно разбавленный раствор(х 2) добавляли в чистые пробирки и смешивали с 18 мкл раствора для денатурации в течение 10 мин при комнатной температуре. После доведения объема раствора до 180 мкл раствором для гибридизации (х 4), содержащим ВИЧ и ВК зонды, взбалтывания, нанесения раствора пипеткой в лунки микропланшета, покрытого стрептавидином, с его последующей инкубацией при 37 С на вибраторе в течение 2 ч раствор сбрасывают,и каждую лунку промывают 3 раза 200 мкл буфера для промывания. Добавили 200 мкл рабочего раствора анти-DIG-POD с последующей инкубацией при 37 С в течение 30 мин на шейкере. После 3-х кратного промывания по средствам 200 мкл буфера для промывания в каждую лунку добавили 200 мкл раствора субстратаABTS с последующей инкубацией при 37 С в течение 30 мин при встряхивании. Во время инкубации планшет держат в темноте. Показания оптической плотности считывают при 405 нм. Число частиц ВИЧ в мл для каждого образца плазмы или сыворотки получают с помощью автоматической компьютерной системы, использующей стандартные кривые, полученные с помощью ВИЧ вирион стандарта (абсолютное количественное определение). Пример 9. Набор для количественного определения генома вируса иммунодефицита человека (ВИЧ) при обнаружении его с помощью флуоресценции. 9.1. Введение В соответствии с настоящим изобретением, набор для количественного определения генома вируса иммунодефицита человека (ВИЧ) предназначен для тех же целей, объектов, реактивов и методов, что описаны в примере 8, за исключением того, что интервал количественного определения составлял более 4 порядков величины, определяемой в отдельном эксперименте, продолжающемся 7 ч. 9.2. Перечень компонентов набора Набор для количественного определения ВИЧ генома желательно хранить при 20 С в холодильнике с постоянной температурой или при 4 С, используя раствор соответствующего фермента. При хранении в надлежащих условиях набор сохраняет стабильность до даты, указанной на этикетке.I Связанная обратной транскрипцией амплификация ВИЧ генома ВИЧ Вирион Стандарт Вирион Стандарт 1 0,4 мл 1 Калибрует образец РНК Исходный буфер для РНК Смесь для амплификации ВИЧ,содержащая ВИЧ затравки и ВК затравки Обратная транскрипция определяемой РНК и амплификация кДНК Контроль кДНК ВИЧ сигнала (полоДНК ВИЧ плазмиды (102 ДНК 40 мкл 1 копий/мкл) жительный) Гетерологическая транскрипта Внутренний контроль эффективности 1 мл 1 РНК (103 копий/мкл) ОТ-амплификации Контроль сигнала фона (отрицательАвтоклавированная вода 40 мкл 1 ный)II Жидкостная гибридизация и измерение флуоресценции Микропланшет, покрытый ВИЧ Включение ВИЧ кДНК в жидкостную 8 лунок 12 зондами (+-штаммы) гибридизацию Микропланшет, покрытый зонВключение ВК кДНК в жидкостную 8 лунок 12 дом ВК гибридизацию Позволяет денатурировать амплифиДенатурирующий буфер 2 мл 1 цированную дуплексную ДНК Позволяет гибридизовать зонд с опреБуфер для гибридизации 20 мл 1 деляемой ДНК Сохраняет специфически амплифициБуфер для промывания 100 мл 1 рованную ДНК в микропланшете Позволяет обнаружить послеамплиФлуорохром 10 мл 1 фикационную дуплексную ДНК Смесь ферментов(отрицательный) Служит носителем РНК для образцов РНК Растворяет РНК образцы- раствор для выделения РНК. 9.3.2. Приборы- вакуумная установка или насос центрифуги- водяная баня или инкубатор для жидкостной гибридизации- чувствительный флуорометр. 9.4. Протокол количественного определения ВИЧ с помощью ОТ-амплификации генома 9.4.1. Экстракция РНК 100 мкл вирион стандарта ВИЧ и образцы плазмы или сыворотки гомогенизировали с 400 мкл раствора для выделения РНК несколькими вращениями гомогенизатора. Добавляли 60 мкл хлороформа, интенсивно встряхивали в течение 15 с и оставляли на льду на 10 мин. Суспензию центрифугировали с 12000 g при 4 С в течение 15 мин. После добавления хлороформа и центрифугирования гомогенат образовывал две фазы: нижнюю фенол-хлороформенную фазу (около 240 мкл) и верхнюю водную фазу (около 320 мкл). РНК оставались исключительно в водной фазе, в то время как ДНК и белки оказывались на границе раздела фаз и в органической фазе. Водную фазу (300 мкл) переносили в чистые пробирки. Был добавлен равный объем изопропанола и образцы выдерживали 1 ч при 20 С. Образцы центрифугировали 10 мин при 12000 g (4 С) и гранулу быстро высушивали. Надосадочную жидкость удаляли, гранулу РНК промывали один раз взбалтыванием с 75% этанолом (500 мкл) и затем сушили ее в вакууме. Гранулу РНК растворяли в 11 мкл исходного буфера для РНК. Осадок РНК образовывал бело-желтую гранулу, видимую только в большом количестве на дне пробирки. Важно не дать грануле РНК полностью высохнуть, так как высыхание сильно уменьшает ее растворимость. 9.4.2. Обратная транскрипция РНК и амплификация кДНК Образцы РНК (10 мкл) и положительный/отрицательный контроль добавляли в чистые (200 мкл) пробирки. 40 мкл смеси для обратной транскрипции/амплификации ВИЧ (38,9 мкл смеси для амплификации ВИЧ + 1,1 мкл- с последующим выдерживанием при 55 С в течение 5 мин и затем при 72 С в течение 5 мин. 9.5. Обнаружение и количественное определение 5 мкл (х 2) послереакционной смеси прибавляли в чистые пробирки и смешивали с 15 мкл раствора для денатурации в течение 10 мин при комнатной температуре. После доведения объема раствора до 180 мкл раствором для гибридизации (х 2), взбалтывания, нанесения раствора пипеткой в лунки микропланшета, покрытого ВИЧ зондами, с его последующей инкубацией при 37 С при встряхивании в течение 2 ч раствор сбрасывают, и каждую лунку промывают 3 раза 200 мкл буфера для промывания. Затем добавляют 100 мкл раствора флуорохрома и переносят микропланшет в автоматический Номер 1 1 а 1 б 1 в 1 г 1 д 2 3 4 5 6 7 8 9 10 11 12 13 24 флуорометр для измерения флуоресценции и печати результатов. Пример 10. Набор для количественного определения генома вируса иммунодефицита человека (ВИЧ) при обнаружении его с помощью хемолюминесценции. 10.1. Введение В соответствии с настоящим изобретением, набор для количественного определения генома вируса иммунодефицита человека (ВИЧ) предназначен для тех же целей, объектов, реактивов и методов, что описаны в примере 8, за исключением того, что интервал количественного определения составлял более 4 порядков величины, определяемой в отдельном эксперименте, продолжающемся 7 ч. 10.2. Перечень компонентов набора Набор для количественного определения ВИЧ генома желательно хранить при 20 С в холодильнике с постоянной температурой. При хранении в надлежащих условиях набор сохраняет стабильность до даты, указанной на этикетке.I Связанная обратной транскрипцией амплификация ВИЧ генома ВИЧ Вирион Стандарт Вирион Стандарт 1 (103 копий/мкл) 0,4 мл 1 Калибрует образец РНК Вирион Стандарт 2 (102 копий/мкл) 0,4 мл 1 Калибрует образец РНК Вирион Стандарт 3 (10 копий/мкл) 0,4 мл 1 Калибрует образец РНК Вирион Стандарт 4 (1 копия/мкл) 0,4 мл 1 Калибрует образец РНК Вирион Стандарт 5 Контроль специфичности 0,4 мл 1(отрицательный) Служит носителем РНК для тРНК (0,1 мг/мл) 1 мл 1 образцов РНК Исходный буфер для РНК 250 мкл 4 Растворяет РНК образцы Смесь для амплификации ВИЧ,Гибридизуется с ВИЧ РНК и содержащая затравки биотинилиро 1 мл 4 кДНК геномов ванного ВИЧ и ВК Обратная транскрипция опредеСмесь ферментов 28 мкл 4 ляемой РНК и амплификация кДНК ДНК ВИЧ плазмиды Контроль кДНК ВИЧ сигнала 40 мкл 1(положительный) Гетерологическая транскрипта РНК Внутренний контроль эффективно 1 мл 1(103 копий/мкл) сти ОТ-амплификации Контроль сигнала фона Провтоклавированная вода 40 мкл 1II Жидкостная гибридизация и хемолюминесцентное мечение Специфично гибридизуется с ВИЧ ВИЧ-специфический зонд 100 мкл 1 кДНК Специфично гибридизуется с ВК ВК ДНК-специфический зонд 100 мкл 1 кДНК Денатурирующий буфер 5 мл 1 Позволяет денатурировать амплифицированную дуплексную ДНК Позволяет гибридизацию зонда с Буфер для гибридизации 50 мл 1 определяемой ДНК Удаляет неспецифическую ДНК в Буфер для промывания (10 х) 50 мл 1 микропланшете- раствор для выделения РНК. 10.3.2. Приборы- вакуумная установка или насос центрифуги- водяная баня или инкубатор для жидкостной гибридизации- люминометр. 10.4. Протокол количественного определения ВИЧ ОТ-амплификацией генома 10.4.1. Экстракция РНК 100 мкл вирион стандарта ВИЧ и образцы плазмы или сыворотки гомогенизировали с 400 мкл раствора для выделения РНК несколькими вращениями гомогенизатора. Добавляли 60 мкл хлороформа, интенсивно встряхивали в течение 15 с и оставляли на льду на 10 мин. Суспензию центрифугировали с 12000 g при 4 С в течение 15 мин. После добавления хлороформа и центрифугирования гомогенат образовывал две фазы: нижнюю фенол-хлороформенную фазу (около 240 мкл) и верхнюю водную фазу (около 320 мкл). РНК оставались исключительно в водной фазе, в то время как ДНК и белки оказывались на границе раздела фаз и в органической фазе. Водную фазу (300 мкл) переносили в чистые пробирки. Был добавлен равный объем изопропанола и образцы выдерживали 1 ч при 20 С. Образцы центрифугировали 10 мин при 12000 g (4 С) и гранулу быстро высушивали. Надосадочную жидкость удаляли, гранулу РНК промывали один раз взбалтыванием с 75% этанолом (500 мкл) и затем сушили ее в вакууме. Гранулу РНК растворяли в 11 мкл исходного буфера для РНК. Осадок РНК образовывал бело-желтую гранулу, видимую только в большом количестве на дне пробирки. Важно не дать грануле РНК полностью высохнуть, так как высыхание сильно уменьшает ее растворимость. 10.4.2. Обратная транскрипция РНК и амплификация кДНК Образцы РНК (10 мкл) и положительный/отрицательный контроль добавляли в чистые (200 мкл) пробирки. 40 мкл смеси для об Включение гибридизованной кДНК ВИЧ в жидкостную гибридизацию Мечение гибридизованной определяемой ДНК Позволяет обнаружение и количественное определение люминесценции ратной транскрипции/амплификации ВИЧ (38,9 мкл смеси для амплификации ВИЧ + 1,1 мкл смеси ферментов) распределили в каждую пробирку. Пробирки переносили в термоциклер с нагревающейся крышкой и выдерживали их- с последующим выдерживанием при 55 С в течение 5 мин и затем при 72 С в течение 5 мин. 10.5. Обнаружение и количественное определение 5 мкл (х 2) послереакционной смеси добавляли в 2 чистые пробирки и смешивали с 15 мкл раствора для денатурации в течение 10 мин при комнатной температуре. После доведения объема раствора до 180 мкл раствором для гибридизации (х 2), содержащим ВИЧ-специфический зонд или внутренний контроль (ВК)-ДНКспецифичный зонд, взбалтывания, нанесения раствора пипеткой в шарик, покрытый стрептавадином, или в лунку микропланшета, покрытого стрептавадином, с его последующей инкубацией при 37 С при встряхивании в течение 2 ч раствор сбрасывали, и каждую лунку промывали 3 раза 200 мкл буфера для промывания. Добавляли 200 мкл антител анти-дсДНК вместе с щелочной фосфатазой (APL), после чего инкубировали при 37 С в течение 30 мин на вибраторе. После трехкратного промывания 200 мкл буфера для промывания добавляли 100 мкл раствора хемолюминесцентного субстрата. Затем микропланшет сразу же переносили в люминометр для измерения хемолюминесценции и распечатывания результатов. Число частиц ВИЧ в мл для каждого образца плазмы или сыворотки получают с помощью автоматической компьютерной системы, использующей стандартные кривые, полученные с помощью ВИЧ вирион стандарта (абсолютное количественное определение). Пример 11. Набор для количественного определения генома вируса гепатита В человека(HBV) при обнаружении его с помощью хемолюминесценции. 11.1. Введение В соответствии с настоящим изобретением, набор для количественного определения генома вируса гепатита В человека (HBV) предназначен для обнаружения и количественного определения ДНК генома HBV в любых не содержащих клеток биологических жидкостях,таких как плазма, сыворотка, сперма, бронхоальвеолярная промывная жидкость и т.п. Набор включает также реагенты для выделения вирусной ДНК экспресс-методом - амплификацией ДНК вириона HBV с использованием ДНКполимеразы Taq - и для ее количественного определения с помощью методики жидкостной гибридизации в сочетании с хемолюминесценцией. Это позволяет достигнуть предела обнаружения, равного 50 копиям вирусной РНК, и интервала определения, составляющего более 4 порядков величины, определяемой в отдельном эксперименте, продолжающемся 5 ч. Набор содержит реагенты в количестве, достаточном для проведения 100 реакций (40 мкл на каждую) в конечном объеме 50 мкл по протоколу. Набор содержит панель стандартов HBV вириона (104, 103, 102 и 10 копий/мкл, достаточНомер 1 1 а 1 б 1 в 1 г 28 ных для 4 серий опытов), позволяющих точно измерять концентрацию HBV вирусной РНК плазмы или сыворотки. Набор также включает плазмидную HBV ДНК (103 копий на реакцию для 4 серий экспериментов), которая служит положительным контрольным сигналом амплификации, а также, по желанию, гетерологическую плазмидную ДНК, добавляемую к каждому изучаемому образцу и служащую ВК (103 копий на реакцию, для 100 реакций). 11.2. Перечень компонентов набора Набор для количественного определения ВИЧ генома желательно хранить при 20 С в холодильнике с постоянной температурой или при 4 С, используя раствор соответствующего фермента. При хранении в надлежащих условиях набор сохраняет стабильность до даты, указанной на этикетке. Калибрует образец ДНК Калибрует образец ДНК Калибрует образец ДНК Калибрует образец ДНК Контроль специфичностиHBV Вирион Стандарт Вирион Стандарт 1 (104 копий/мкл) Вирион Стандарт 2 (103 копий/мкл) Вирион Стандарт 3 (102 копий/мкл) Вирион Стандарт 4 (10 копий/мкл) Вирион Стандарт 5 (HBVотрицательная сыворотка) Смесь для амплификации HBV,содержащая затравки биотинилированного HBV и ВКTaq ДНК полимераза ДНК HBV плазмиды Гибридизуется с ДНК HBV генома Амплифицирует определяемую ДНК Контроль кДНК HBV(положительного) сигнала Внутренний контроль эффективности амплификации Контроль сигнала фонаII Жидкостная гибридизация и хемолюминесцентное мечение Специфично гибридизуется с HBVHBV-специфический зонд 100 мкл 1 кДНК Специфично гибридизуется с ВК ВК ДНК-специфический зонд 100 мкл 1 ДНК Позволяет денатурировать Денатурирующий буфер 5 мл 1 амплифицированную дуплексную ДНК Позволяет гибридизацию зонда Буфер для гибридизации 50 мл 1 с определяемой ДНК Буфер для промывания (10x) 50 мл 1 Удаляет неспецифическую ДНК Шарик (или микропланшет),200 Включение гибридизованной HBV 1 (24) покрытый стрептавидином(8 лунок) кДНК в жидкостную гибридизацию Мечение гибридизованной Анти-дсДНК-APL рабочий раствор 10 мл 1 определяемой ДНК Позволяет обнаружение люминесРаствор хемолюминесцентного ценции и количественное 10 мл субстрата определение- водяная баня для жидкостной гибридизации- люминометр. 11.4. Протокол приготовления пробы и амплификации 11.4.1. Приготовление пробы 50 мкл вирион стандарта HBV и образцы плазмы или сыворотки гомогенизировали с 50 мкл буфера, удаляющего ДНК, и выстаивали при 98 С в течение 15 мин. Затем пробирки центрифугировали 10 мин при 7500 g. После центрифугирования ДНК оставались исключительно в жидкой фазе (10-15 мкл), в то время как белки были в осадке. 11.4.2. Амплификация кДНК 10 мкл жидкой фазы переносили в чистые(200 мкл) пробирки. 40 мкл смеси для амплификации HBV (40 мкл HBV амплификационной смеси + 5 мкл Taq ДНК полимеразы) вносили в каждую пробирку. Пробирки переносили в термоциклер с нагревающейся крышкой и выдерживали их- с последующим выдерживанием при 72 С в течение еще 5 мин. 11.5. Визуализация и количественное определение 5 мкл (х 2) послереакционной смеси добавляли параллельно в 2 чистые пробирки и смешивали с 15 мкл раствора для денатурации в течение 10 мин при комнатной температуре. После доведения объема раствора до 180 мкл раствором для гибридизации (х 2), содержащимHBV-специфический зонд или ВК-ДНКспецифичный зонд, взбалтывания, нанесения раствора пипеткой в шарик, покрытый стрептавадином, или в лунку микропланшета, покрытого стрептавадином, с его последующей инкубацией при 37 С при встряхивании в течение 2 ч раствор сбрасывали, и каждую лунку промывали 3 раза 200 мкл буфера для промывания. Добавляли 200 мкл антител анти-дсДНК вместе с щелочной фосфатазой (APL), после чего инкубировали при 37 С в течение 30 мин на вибраторе. После трехкратного промывания 200 мкл буфера для промывания добавляли 100 мкл раствора хемолюминесцентного субстрата. Затем микропланшет сразу же переносили в люминометр для измерения люминесценции и распечатывания результатов. Число частиц HBV в мл для каждого образца плазмы или сыворотки получают с помощью автоматической компьютерной системы, использующей стандартные кривые, полученные с помощью HBV вирион стандарта (абсолютное количественное определение). 30 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ, использующий внутренний стандарт, для количественного определения и обнаружения любых ДНКили РНКсодержащих микроорганизмов, отличающийся тем, что он включает (1) использование или определение стандартной концентрации микроорганизма или концентрации ДНК или РНК, содержащейся в этом микроорганизме, называемом стандартным микроорганизмом, в виде интервала концентраций стандартного микроорганизма, полученного последовательным разведением микроорганизма, предварительно стандартизованного по концентрациям содержащихся в нем ДНК или РНК, образующих внешний стандарт, (2) сравнение количества продукта обратной транскрипции и/или амплификации РНК или ДНК, полученного из неизвестной концентрации микроорганизма с количествами амплификата РНК или ДНК известных концентраций упомянутого микроорганизма, при этом определяемый микроорганизм или его геном, который надо определить, идентичен стандартному микроорганизму или его геному, обрабатываемому,а способ также включает внутренний контроль эффективности амплификации или обратной транскрипции. 2. Способ по п.1, отличающийся тем, что стадия (2) состоит из сравнительного обнаружения, основанного на сравнении концентрации стандартного микроорганизма с концентрацией определяемого микроорганизма, предпочтительно определяемой методом разветвленной ДНК или любым другим методом, который не амплифицирует ДНК или РНК стандартного или определяемого микроорганизмов. 3. Способ по п.1, отличающийся тем, что он включает: 1) отбор и очистку заданного количества определяемого микроорганизма из образцов человека, животных или растений, или из клеточных культур, при этом количество микроорганизма должно быть достаточным, чтобы обеспечить такие концентрации исследуемой ДНК или РНК, которые можно измерить прямыми методами; 2) экстракцию ДНК или РНК и измерение проэкстрагированного количества; 3) определение числа нуклеотидных оснований исследуемого микроорганизма; 4) определение расчетным путем суммарной молекулярной массы ДНК или РНК упомянутого микроорганизма, исходя из этого числа нуклеотидных оснований и средней известной молекулярной массы одного нуклеотида; 5) определение расчетным путем количества ДНК или РНК каждого микроорганизма,производимого таким же образом с использованием числа Авогадро; 6) приготовление и/или использование интервала концентраций стандартного микроорга 31 низма, полученного последовательным разбавлением микроорганизма, предварительно стандартизованного по концентрациям содержащихся в нем ДНК или РНК, образующих внешний стандарт, для которого (а) концентрация ДНК или РНК и (б) концентрация микроорганизмов известна для каждого разбавления; 7) экстрагирование ДНК или РНК стандартного и определяемого микроорганизмов с последующим одновременным обнаружением их в экстрактах методом разветвленной ДНК или любым другим методом, который не амплифицирует ДНК или РНК стандартного или определяемого микроорганизма, и/или проведением обратной транскрипции и/или, по крайней мере, одной амплификации и регистрацией полученных результатов; и 8) сравнение концентраций ДНК или РНК стандартного и определяемого микроорганизмов или продуктов амплификации определяемого микроорганизма с продуктами амплификации внешнего стандарта для определения по ним концентрации ДНК или РНК или суммарной концентрации микроорганизма в каждом образце определяемого микроорганизма. 4. Способ по п.3, отличающийся тем, что стадии (2)-(5) выполняют простым прямым измерением числа микроорганизмов. 5. Способ по любому из пп.1-4, отличающийся тем, что он включает внутренний контроль, последовательность и затравки которого не связаны с определяемыми ДНК или РНК и который имеет вид гетерологической плазмидной ДНК или транскрипты РНК, для контроля эффективности амплификации или обратной транскрипции-амплификации. 6. Способ по пп.1 или 2, отличающийся тем, что приготовление известных концентраций микроорганизма осуществляют путем приготовления известных концентраций- того же самого инактивированного микроорганизма, ДНК или РНК, которого попрежнему можно обнаруживать или количественно определять с помощью метода разветвленной ДНК и/или способа обратной транскрипции и/или амплификации, идентичным в случае ДНК или РНК нативного вируса,- полной нуклеотидной последовательности, проэкстрагированной из того же микроорганизма, или 32 7. Способ по любому из пп.1-6, отличающийся тем, что приготавливают известные стандартные концентрации микроорганизма того вида, который следует количественно определить или обнаружить и который состоит полностью из ДНК или РНК, или приготавливают концентрации ДНК или РНК генома упомянутого микроорганизма, соответствующего известным концентрациям этого микроорганизма для их хранения до передачи пользователю. 8. Способ по любому из пп.1-7, отличающийся тем, что определяют количество микроорганизмов в любых средах или образцах или обнаруживают минимальное измеряемое количество микроорганизма или большее количество, чем минимальное измеряемое количество. 9. Набор средств для количественного определения и обнаружения ДНК- или РНКсодержащих микроорганизмов, отличающийся тем, что он содержит следующие компоненты,помещенные в подходящие контейнеры и/или находящиеся в виде соответствующих устройств:- серия известных стандартных концентраций микроорганизма того вида, который следует количественно определить или обнаружить и который состоит полностью из ДНК или РНК,или концентраций ДНК или РНК, соответствующих известным концентрациям вышеупомянутого микроорганизма;- средства для экстракции, обнаружения и/или обратной транскрипции и/или амплификации в основном с помощью полимеразной цепной реакции, обратной транскрипцииполимеразной цепной реакции или NASBA,ДНК или РНК определяемого и стандартного микроорганизмов;- средства для анализа ДНК или РНК определяемого и стандартного микроорганизмов или обнаружения продуктов амплификации; и- средство внутреннего контроля. 10. Набор средств по п.9, отличающийся тем, что он содержит средства для простого прямого измерения числа микроорганизмов. 11. Набор средств по пп.9 и 10, отличающийся тем, что в упомянутом средстве внутреннего контроля последовательность и затравки не связаны с определяемыми ДНК или РНК, и оно предпочтительно имеет вид гетерологической плазмидной ДНК или транскрипта РНК, для контролирования эффективности амплификации или обратной транскрипции-амплификации.
МПК / Метки
МПК: C12Q 1/68, G01N 33/569
Метки: микроорганизмов, инабор, количественного, обнаружения, способ, определения
Код ссылки
<a href="https://eas.patents.su/19-613-sposob-inabor-dlya-kolichestvennogo-opredeleniya-i-obnaruzheniya-mikroorganizmov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ инабор для количественного определения и обнаружения микроорганизмов</a>
Предыдущий патент: Доска объявлений с встроенными громкоговорителями
Следующий патент: Температурно-согласованный интерференционный слой для создания оптической разности хода
Случайный патент: Распыляемая композиция для колерования