Композиции, содержащие лактадгерин или его варианты, и способы их использования
Номер патента: 3643
Опубликовано: 28.08.2003
Авторы: Амигорена Себастьян, Рапосо Граса, Тери Клотильд
Формула / Реферат
1. Применение лактадгерина или его варианта для получения композиции для регулирования иммунного ответа.
2. Применение по п.1 для ингибирования перекрестного праймирования антигенов.
3. Применение по п.2 варианта лактадгерина, не содержащего функциональный сайт связывания с фосфолипидом и/или функциональный сайт связывания с интегрином.
4. Применение по п.1 для стимуляции фагоцитоза антигенов дендритными клетками.
5. Применение по п.1 для стимуляции перекрестного праймирования антигенов.
6. Применение лактадгерина или его вариантов для получения композиции для доставки антигена, цитокина или токсичной молекулы к дендритным клеткам.
7. Применение по любому из предшествующих пунктов, где лактадгерин или его вариант является человеческим лактадгерином или его вариантом.
8. Иммуногенная композиция, включающая лактадгерин или его вариант, связанный с антигеном или цитокином.
9. Композиция по п.8, где указанный антиген или цитокин ковалентно связан с лактадгерином или его вариантом.
10. Композиция по п.8, включающая липосому, где липосома включает лактадгерин или его вариант, ковалентно связанные с антигеном или цитокином.
11. Иммуногенная композиция, включающая лактадгерин или его вариант, связанный с антигеном.
12. Композиция по п.11, где антиген представляет собой белок, полипептид, пептид, вирус или бактерию.
13. Химерный белок, включающий лактадгерин или его вариант, слитый с иммуногеном или иммуностимуляторным полипептидом.
14. Нуклеиновая кислота, кодирующая белок по п.13.
15. Липосома, включающая рекомбинантный лактадгерин или его вариант.
16. Иммуногенная композиция, включающая химерный белок по п.13 или липосому по п.15.
17. Рекомбинантный вирус, экспрессирующий лактадгерин в виде поверхностной молекулы.
18. Рекомбинантная клетка, экспрессирующая лактадгерин в виде поверхностной молекулы.
Текст
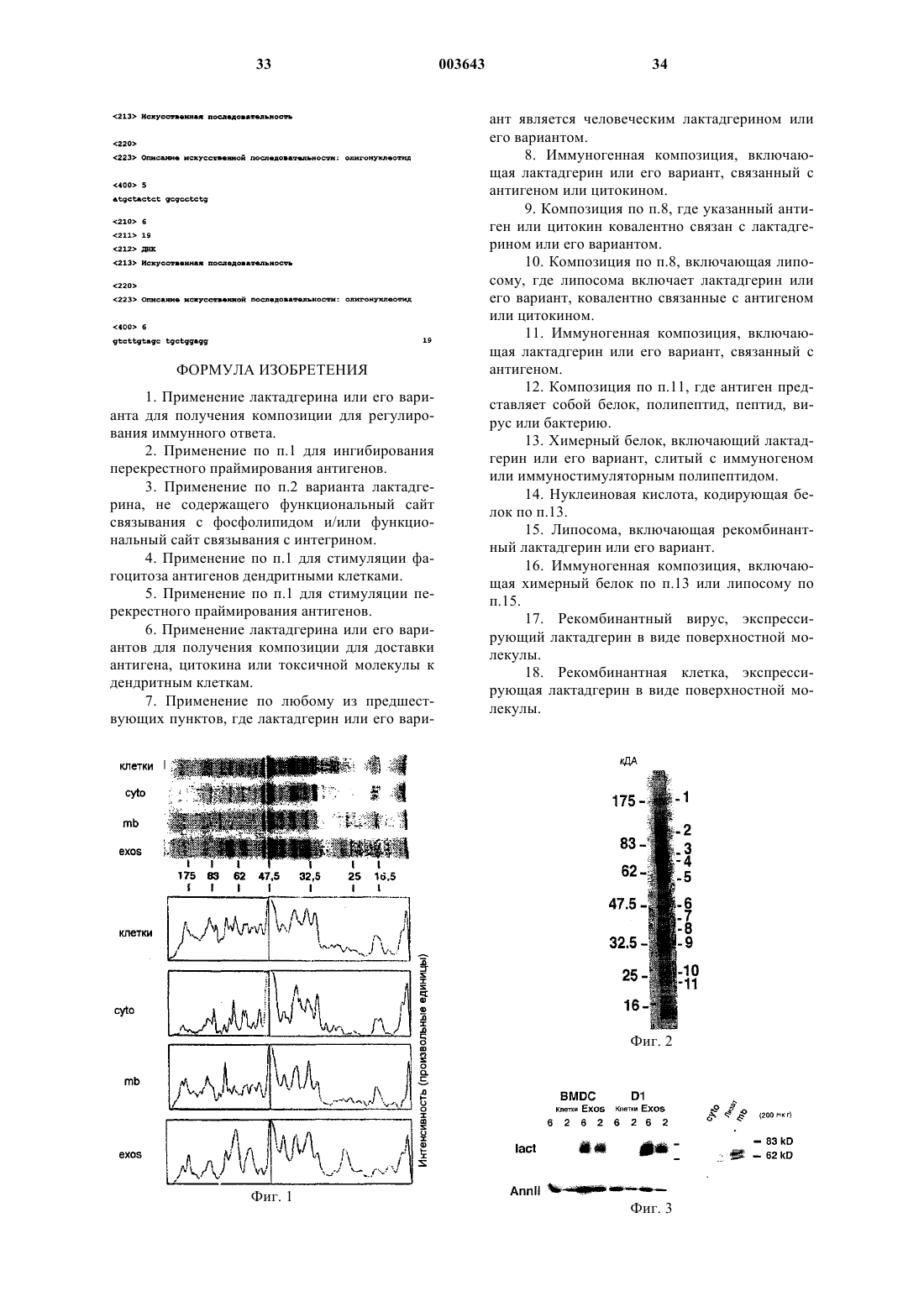
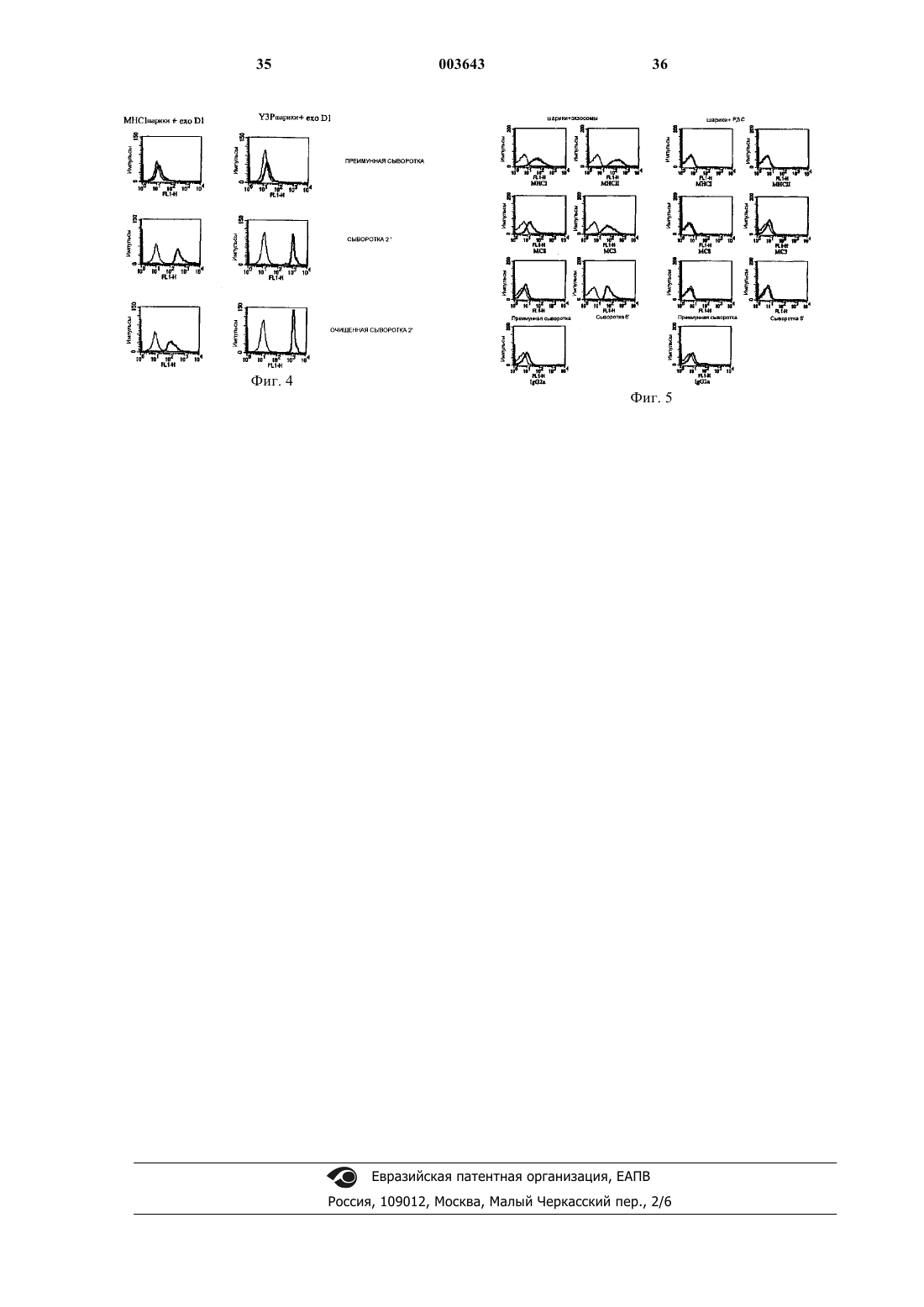
1 Настоящее изобретение относится к новым способам и композиции, применимым в области биологии, медицины и в экспериментальных целях. Более конкретно настоящее изобретение относится к композициям и способам регулирования (т.е. индуцирование, ингибирование, стимуляция и т.д.) или контроля за иммунным ответом, более конкретно реакцией, опосредованной ЦТЛ, а также к способам доставки молекул к дендритным клеткам in vitro, ex vivo или invivo. Настоящее изобретение относится также к новым белкам, нуклеиновым кислотам и векторам и к их применению в обсуждавшихся выше областях, например, для перекрестного праймирования антигенов, фагоцитоза молекул дендритными клетками и т.д. Настоящее изобретение также относится к способам отбора молекул, способных регулировать реакцию, опосредованную ЦТЛ. Распознавание антигена иммунной системой может осуществляться по различным механизмам. В частности, презентация антигенов хелперным Т-лимфоцитам требует процессинга указанных антигенов антиген-презентирующими клетками и их связывания с молекулами МНС класса II. Такое распознавание, по существу, приводит к стимуляции специфичных клонов В-лимфоцитов, которые затем вырабатывают антитела, специфичные по отношению к данному антигену. С другой стороны, презентация антигена цитотоксическим Т-лимфоцитам (ЦТЛ) требует фагоцитоза антигена компетентными клетками(главным образом, дендритными клетками),причем эти клетки содержат подходящие молекулы МНС класса I и способны стимулировать антиген-специфичные ЦТЛ. Это явление, которое носит название "перекрестные презентации" антигенов или "перекрестного праймирования" ЦТЛ, наблюдается, например, для вирусных или опухолевых антигенов, а также для антигенов,содержащих апоптотические тельца (образующиеся в результате вирусной инфекции, опухолей, дегенерации клеток или превращений нормальных клеток и т.д.). Поэтому перекрестная презентация антигенов является основным путем элиминации антигенов, которые связаны с патологическими состояниями. Способность индуцировать или способствовать перекрестному праймированию антигенов in vivo или in vitro обеспечила бы весьма эффективный подход к лечению таких патологических состояний. Как было указано выше, перекрестное праймирование антигенов обязательно требует фагоцитоза дендритными клетками корпускулярных антигенов, т.е. антигенов, включенных в тельца, включающие, например, липиды, такие как фосфатидилсерин. Такие корпускулярные антигены включают, например, апоптотические тельца, пузырьки или клеточные мембраны. 2 Изобретение относится к идентификации соединения, участвующего в фагоцитозе корпускулярного антигена дендритными клетками. Более конкретно, настоящее изобретение относится к идентификации соединения, которое опосредует взаимодействие между корпускулярными антигенами и дендритными клетками,и выполняет функцию адаптера перекрестного праймирования. Настоящее изобретение также относится к новым композициям, включающим молекулу,связанную с определенным выше адаптером или его вариантом. Настоящее изобретение может применяться для регуляции иммунного ответа, в частности, для ослабления иммунного ответа или наоборот для облегчения (усиления) иммунного ответа на определенный антиген. Настоящее изобретение относится также к новым векторам(таким как белки или липосомы), которые могут применяться для доставки выбранной молекулы к дендритной клетке. Настоящее изобретение относится также к способам отбора соединений,которые могут регулировать перекрестное праймирование антигенов или доставку антигенов к дендритным клеткам, а также к способам контроля за иммунным ответом у субъекта. Антиген-презентирующие клетки (АПК) включают фрагменты схемы эндоцитоза, включая мультивезикулярные тельца (МВТ), которые являются сайтами связывания антигенных белков с молекулами главного комплекса гистосовместимости (МНС) класса II. Эти комплексы распознаются Т-лимфоцитами. В частности,было показано, что EBV-трансформированные В-лимфоциты (B-EBV) секретируют такие пузырьки, называемые экзосомами (Raposo et al.,Mol. Biol. Cell 8 (1997) 2619). Полученные из BEBV экзосомы содержат комплексы пептидМНС класса II и способны представлять их непосредственно CD4+T лимфоцитам (Raposo etal., 1997). Позднее были описаны пузырьки,секретируемые другими антиген-презентирующими клетками, дендритными клетками (ДК)(Zitvogel et al., Nature Medicine 4 (1998)594). ДК являются единственными АПК, способными вызывать первичный и вторичный иммунные ответы. Чтобы осуществить это, они выработали значительный ряд специфических свойств, которые и делают их уникальными АПК. ДК существуют в двух состояниях зрелости: незрелые ДК эффективны в отношении эндоцитоза антигена и фагоцитоза, но не эффективны в отношении активации Т-клеток, тогда как зрелые ДК отрицательно регулируют их способность к интернализации, но экспрессируют высокие уровни МНС и костимулирующих молекул, что делает их чрезвычайно эффективными в отношении активации Т-клеток. Полученные из ДК экзосомы накапливают МНС класса II и несут также молекулы МНС класса I. Продуцируемые ДК экзосомы, будучи 3 экспонированы опухолевым антигенным пептидом, вызывают мощные иммунные реакции,приводящие к отторжению образовавшихся опухолей (Zitvogel et al., 1998). Хотя механизмы этих наблюдаемых противоопухолевых эффектов до сих пор не известны, эффективность опосредованной экзосомами имунной стимуляции позволяет предположить, что эти пузырьки действительно могут физиологически опосредовать активацию реакции Т-клеточного ответа. Пытаясь понять молекулярные основы эффектов, полученных из ДК экзосом, на иммунную систему, заявители определили условия их продуцирования ДК и проанализировали их белковый состав. Полученные результаты показывают, что секретирование экзосом отрицательно модулируется по созревании ДК и что экзосомы концентрируют ограниченное количество белков. В частности, помимо молекул МНС класса II, был идентифицирован один основной адгезионный и направляющий мембранный белок, который ведет себя как молекулярный эффектор воздействия экзосом на иммунную систему, и его функция состоит в направлении экзосом к клеточной мишени in vivo. Более конкретно, настоящее изобретение показывает, что лактадгерин (известный также как MFG-E8) продуцируется дендритными клетками, экспонируется на поверхности экзосом и участвует в фагоцитозе корпускулярных антигенов дендритными клетками. Настоящее изобретение также относится к вариантам лактадгерина, которые ведут себя как конкуренты лактадгерина и могут применяться для ингибирования фагоцитоза корпускулярных антигенов дендритными клетками. Настоящее изобретение также относится к новым способам доставки молекул к дендритным клеткам с использованием векторов, полученных из лактадгерина или его вариантов. Зрелый человеческий лактадгерин представляет собой белок из 364 аминокислот. Кроме того, лактадгерин является секреторным белком и включает сигнал секреции. SEQ ID NO: 1 представляет аминокислотную последовательность человеческого лактадгерина. Остатки 1-23(подчеркнуты) представляют собой сигнал секреции, а остатки 24-387 представляют собой первичную структуру зрелого секретированного белка. Были также идентифицированы, выделены и секвенированы мышиный, бычий и свиной лактадгерины (см., например, Stubbs et al.,PNAS 87 (1990) 8417; Hvarregaard et al., Eur.J.Biochem. 240 (1996) 628). Последовательность мышиного лактадгерина представлена также вSEQ ID NO: 3. Аминокислотные остатки 1-22 представляют сигнал секреции, а остатки 23-463 представляют первичную структуру зрелого секретированного белка. Остатки 111-147 удалены в сплайсинговых вариантах мышиного лактадгерина. 4 Исходно лактадгерин был описан на поверхности глобул молочного жира (см. Stubbs etal., supra). Кроме того, этот белок был обнаружен до сих пор главным образом в тканях млекопитающих и в культивируемых эпителиальных клетках млекопитающих. В литературе в отношении лактадгеринов не сообщалось о каких-либо функциях, помимо их присутствия во время лактогенеза. Настоящее изобретение обеспечивает доказательство того, что лактадгерин селективно продуцируется дендритными клетками, более конкретно, незрелыми дендритными клетками,экспонируется на поверхности антигенных пузырьков и функционирует как адаптер антигенной перекрестной презентации ЦТЛ. Поэтому настоящее изобретение относится к композициям и способам использования лактадгерина или его вариантов для опосредования иммунного ответа. Настоящее изобретение относится также к вариантам лактадгерина, которые можно использовать для ингибирования перекрестного праймирования, или для доставки антигенов к антиген-презентирующим клеткам, в частности,к дендритным клеткам. Настоящее изобретение относится также к композициям, включающим лактадгерин или его варианты с выбранными молекулами, в частности, гибридными молекулами и/или липосомами, включающими рекомбинантные молекулы лактадгерина. Более конкретно целью настоящего изобретения является применение лактадгерина или его вариантов для регулирования иммунной реакции in vitro, ex vivo или in vivo. Конкретной целью изобретения является использование лактадгерина или его вариантов для получения композиции для регулирования иммунного ответа, в частности, ЦТЛ-реакции. Другой конкретной целью изобретения является применение лактадгерина или его вариантов для ингибирования перекрестного праймирования антигенов, в частности, фагоцитоза антигенов дендритными клетками. Лактадгерин содержит несколько функциональных доменов. В частности, лактадгерин включает два EGF-подобных домена с RGDпоследовательностью, которая участвует в связывании с интегрином. Интегрин (более конкретно интегрин (v5 присутствует на поверхности дендритных клеток, и этот участок лактадгерина участвует во взаимодействии этого белка с дендритными клетками. Кроме того,по-видимому, это взаимодействие является селективным. Лактадгерин содержит также домен,гомологичный С-концевой области человеческих факторов коагуляции VIII и V, который представляет сайт связывания фосфолипидов и,в частности, фосфатидилсерина. В настоящем изобретении постулируется и раскрывается, что лактадгерин взаимодействует с корпускулярными антигенами за счет сайтов связывания фосфолипидов и с дендритными 5 клетками за счет RGD домена, и таким образом опосредует фагоцитоз указанных корпускулярных антигенов. Целью настоящего изобретения является применение лактадгерина или его вариантов,более конкретно человеческого лактадгерина или его вариантов, для образования цитотоксических Т-лимфоцитов, специфичных по отношению к выбранному антигену. Другой целью настоящего изобретения является применение лактадгерина или его вариантов, более конкретно человеческого лактадгерина или его вариантов, для доставки антигена к дендритным клеткам. В контексте настоящего изобретения лактадгерин означает белок млекопитающего, экспрессированный на поверхности глобул молочного жира, и включающий RGD-сайт и домен,гомологичный С-концевой области фактора VIII(т.е. домен, подобный фактору VIII). Более конкретно, белок может быть человеческим, бычьим, мышиным или свиным, предпочтительно человеческим. В конкретном осуществлении под лактадгерином подразумевается человеческий лактадгерин, содержащий SEQ ID NO: 1 или любой ее функциональный аналог. Термин"функциональные аналоги" означает природные аналоги, образующиеся, например, в силу полиморфизма или в результате пост-трансляционных модификаций, в частности, в результате сплайсинга (сплайсингов) или делеции, замещения или добавления отдельной аминокислоты,по сравнению с SEQ ID NO: 1, и которые сохраняют, по крайней мере, одно функциональное свойство человеческого лактадгерина. Функциональные аналоги включают также лактадгерин других видов, в частности, мышиный лактадгерин SEQ ID NO: 3. Используемый в соответствии с настоящим изобретением лактадгерин может быть либо выделен из природных источников, либо получен с помощью технологий рекомбинантных ДНК, что будет описано далее в качестве примера. Термин "вариант" лактадгерина в контексте настоящего изобретения означает искусственный белок, т.е. белок, созданный искусственным путем и который не встречается в природе как таковой. Такие варианты обычно сохраняют, по крайней мере, одно биологическое свойство лактадгерина, например свойство связывания лактадгерина, и обычно включают одно или несколько следующих изменений в первичной структуре:(а) делецию одного или нескольких аминокислотных остатков, более предпочтительно нескольких последовательных аминокислотных остатков. В предпочтительном осуществлении делегированный вариант включает делецию нескольких аминокислотных остатков, которые перекрываются, по крайней мере, частично с доменом лактадгерина, участвующим в связы 003643 6 вании фосфолипидов (ФЛ), в частности фосфатидилсерина (ФС) и/или интегрина. Делеция может включать до 250 аминокислот, предпочтительно, например, до 200 аминокислот. Кроме того, в одном варианте могут быть осуществлены несколько делеций;(b) мутацию по одному или нескольким аминокислотным остаткам, более предпочтительно, по крайней мере, по одному аминокислотному остатку, входящему в лактадгериновый сайт связывания ФС или интегрина. Мутация(мутации) может быть консервативной или неконсервативной. Предпочтительно, чтобы мутация (мутации) в сайте связывания делала (делали) сайт связывания нефункциональным. Более предпочтительно, чтобы вариант по настоящему изобретению включал от 0 до 10 точечных мутаций, еще более предпочтительно от 0 до 5;(с) добавление одного или нескольких аминокислотных остатков. Добавляемые остатки предпочтительно расположены на N-или Сконцах варианта, хотя могут быть добавлены и внутренние остатки. Добавленные остатки могут иметь различные функции. Например, они могут представлять собой метки, которые можно использовать в способе очистки (GST, myc и т.д.). Добавленные остатки могут быть также адаптерами, которые можно использовать для связи варианта с выбранной молекулой, такой как антиген, нуклеиновая кислота, рецептор или мембранный липид. Такие адаптеры могут представлять собой, например, полилизин или другие основные аминокислоты, спейсер или любой другой ДНК-связывающий мотив. Адаптер может быть также сигналом направленной миграции, таким, например, как трансмембранный домен белка или липида. Кроме того, добавленные остатки могут также представлять выбранную молекулу, слитую с лактадгерином,что будет обсуждаться далее более подробно. Кроме того, как было указано выше, варианты по настоящему изобретению могут объединять одну или несколько модификаций одного или нескольких указанных выше типов. Конкретным вариантом лактадгерина по настоящему изобретению является вариант, не содержащий функциональный сайт связывания ФЛ (в частности, функциональный сайт связывания ФС) и/или функциональный сайт связывания интегрина. Варианты, не содержащие функциональный сайт связывания ФЛ, практически не способны связывать фосфолипиды, такие как фосфатидилсерин. Однако такие варианты могут сохранять функциональный сайт связывания интегрина и поэтому вести себя как конкуренты нативного лактадгерина. Варианты, не содержащие функциональный сайт связывания ФЛ(т.е. фосфатидилсерина), могут быть получены различными способами. В конкретном воплощении указанные варианты не содержат ни одного или часть сайтов связывания фосфатидил 7 серина (ФС). В другом конкретном воплощении такие варианты содержат мутированный сайт связывания ФС. Естественно, варианты по настоящему изобретению могут также включать как делеции, так и мутации в сайте связывания ФС. Сайт связывания фосфатидилсерина лактадгерина расположен, по существу, в Сконцевых аминокислотных остатках лактадгерина, более конкретно, в 150 С-концевых аминокислотных остатках. Поэтому вариантом по настоящему изобретению может быть любой вариант лактадгерина, содержащий мутацию и/или делецию в 150 С-концевых аминокислотных остатках, и, по существу, не способный связываться с фосфатидилсерином. Более предпочтительным вариантом является полипептид,включающий SEQ ID NO: 1, причем указанная последовательность включает далее мутацию и/или делецию в любом из аминокислотных остатков 242-387. В конкретном осуществлении настоящего изобретения вариант включает делецию, по крайней мере, 5, предпочтительно, по крайней мере, 10, еще более предпочтительно, по крайней мере, 20 последовательных аминокислот вышеуказанной С-концевой области. В конкретном воплощении делеция охватывает все 150 С-концевых аминокислотных остатков, более предпочтительно аминокислотные остатки 242-387 SEQ ID NO:1. Другим конкретным воплощением настоящего изобретения является лактадгерин без 25 С-концевых аминокислот, в частности полипептид, включающий аминокислотные остатки 24-363 SEQ ID NO:1, или полипептид, включающий аминокислотные остатки 23-439 SEQ ID NO: 3. Примеры мутаций включают любую супрессию или замену одного или нескольких отдельных аминокислотных остатков в 150 Сконцевых аминокислотах лактадгерина. Замена может быть либо консервативной, либо неконсервативной, предпочтительно неконсервативной. Конкретные примеры мутантных вариантов по настоящему изобретению включают любой лактадгерин, содержащий одну или несколько точечных мутаций в 25 С-концевых аминокислотах и, по существу, не способный связываться с ФС. Более конкретными примерами являются полипептиды SEQ ID NO: 2 или 4, содержащие одну или несколько точечных мутаций в 25 С-концевых аминокислотах. Данные варианты по настоящему изобретению особенно интересны, так как они способны к связыванию с интегрином v5, т.е. с дендритными клетками, более предпочтительно с незрелыми (человеческими) дендритными клетками, причем они практически не способны связываться с ФС. Эти варианты особенно удобны для доставки молекул к дендритным клеткам, в частности, для доставки молекул антигенов к дендритным клеткам. Эти варианты могут также 8 способствовать перекрестному представлению выбранного антигена дендритными клетками и тем самым вызывать специфичный ЦТЛ-ответ против выбранной молекулы антигена. Варианты лактадгерина, не содержащие функционального сайта связывания интегрина,практически не способны к эффективному связыванию с дендритными клетками. Такие полипептиды могут представлять собой любые варианты лактадгерина, не содержащие ни одного или часть сайта связывания интегрина, или которые содержат мутантный сайт связывания интегрина. Сайт связывания интегрина лактадгерина, по существу, находится в RGD-мотиве,расположенном в N-концевой части молекулы. Например, сайт связывания интегрина человеческого лактадгерина SEQ ID NO: 1 расположен в остатках 46-48, а сайт связывания интегрина мышиного лактадгерина SEQ ID NO: 4 расположен в остатках 87-89. Поэтому настоящее изобретение относится к любому лактадгерину,включающему мутацию и/или делецию в RGDмотиве/или RGD-мотива, и который практически не способен связываться с дендритными клетками. Конкретные примеры таких вариантов представляют собой полипептиды SEQ IDNO: 1, в которых отсутствует один, два или все аминокислотные остатки RGD в положении 4648, и полипептиды SEQ ID NO: 4, в которых отсутствует один, два или все аминокислотные остатки RGD в положении 87-89. Такие варианты можно использовать, например, чтобы помешать перекрестному праймированию антигенов in vitro, ex vivo или invivo, путем конкуренции с нативным лактадгерином за связывание с корпускулярными антигенами. Другие типы ингибиторов представлены полипептидами, включающими главным образом сайт связывания фосфолипида лактадгерина, например, пептидами, включающими аминокислотные остатки 364-385 SEQ ID NO: 1 или их вариантами. Другие ингибиторы представлены антителами, специфичными для лактадгерина, в частности лактадгерина ФЛ, или для сайтов связывания интегрина. Такие антитела (либо поликлональные, либо моноклональные) могут быть выработаны в результате иммунизации животного соответствующими пептидами и использованы для ослабления иммунного ответа. Соответственно, целью настоящего изобретения является также вариант лактадгерина,в котором отсутствует функциональный сайт связывания ФЛ или интегрина. Вышеуказанные варианты можно получить в соответствии с обычными методиками, известными специалистам, и раскрытыми более подробно в примерах. Например, их можно получить с помощью технологии рекомбинантных ДНК, исходя из молекулы нуклеиновой кислоты, кодирующей лактадгерин. Более конкретно конструкцию нуклеиновой кислоты, кодирую 9 щую лактадгерин, как определено выше, можно получить и модифицировать в соответствии с обычными методиками для введения в нее мутации (мутаций) и/или осуществления в ней делеции (делеций). Такие методики включают расщепление рестрикционными ферментами и/или экзонуклеазами, лигирование, сайтнаправленный мутагенез, амплификацию, синтез искусственных нуклеотидов и т.п. Такие модификации можно осуществить in vitro, на выделенной нуклеиновой кислоте, обычно полученной или реплицированной в компетентной клетке-хозяине, такой как эукариотическая клетка или прокариотическая клетка, или полученной в результате амплификации со специфическими праймерами, например, из дендритной клетки. В этой связи настоящее изобретение относится также к нуклеиновой кислоте, кодирующей полипептид, как определено выше. Указанная нуклеиновая кислота может быть молекулой ДНК или РНК, или синтетической нуклеиновой кислотой. Настоящее изобретение относится также к любому вектору, включающему нуклеиновую кислоту, как определено выше. Такими векторами могут быть плазмиды,космиды, эписомы, YACS, вирусные векторы и т.д. Предпочтительные векторы включают также промоторный участок, который вызывает экспрессию нуклеиновой кислоты, так же как,необязательно, сигнал терминации транскрипции (т.е. последовательность полиаденилирования). Конструкцию таких векторов и выбор промоторного участка может быть сделан специалистом в соответствии с обычными методиками и рутинными экспериментами. На практике вектор может быть плазмидой, полученной изpUC, plC, pBR или pBS, или вирусным вектором, полученным, например, из ретровирусов,аденовирусов или AAV. Настоящее изобретение относится также к клетке, включающей нуклеиновую кислоту или вектор, как определено выше, и к ее использованию, например, для получения вариантов, как определено выше. Рекомбинантная клетка по настоящему изобретению может быть прокариотической (такой как бактерия) или эукариотической (такой как дрожжевая клетка, клетка млекопитающего, клетка насекомого и т.д.). Указанные клетки можно получить обычными способами (электропорацией, осаждением, с помощью генной пушки, опосредованной липидом трансфекции и т.д.). Другой целью настоящего изобретения является композиция, включающая вариант лактадгерина без функционального сайта связывания ФЛ или интегрина. Такую композицию можно использовать, например, для модуляции перекрестного праймирования антигенов. Конкретной целью настоящего изобретения является композиция, включающая лактадгерин или его вариант, связанный с выбранной молекулой. 10 И конечно, настоящее изобретение относится к использованию лактадгерина или его вариантов для доставки молекул к дендритным клеткам. В этой связи любую выбранную молекулу можно связать с лактадгерином или его вариантом, как определено выше, для доставки указанной молекулы к дендритным клеткам in vitro, exvivo или in vivo, и/или для того, чтобы вызвать ЦТЛ реакцию. Выбранную молекулу можно связать с лактадгерином или его вариантом различным образом, ковалентно или нековалентно. Ковалентную связь (связывание) можно осуществить, используя любые химические, ферментативные или генетические методики. На практике химическое присоединение можно осуществить, используя обычные химические адаптеры и/или реакции, в частности, используя амидные, аминные или кислотные связи с использованием спейсеров, таких как карбонилдиимидазол и т.п., или без них. Химическое присоединение можно также осуществить, используя систему стрептавидин/биотин или любой другой аналогичный способ. Один конкретный способ присоединения выбранной молекулы к лактадгерину включает рекомбинантные ДНК-конструкции (т.е. генетическое связывание). В этой связи можно получить химерную нуклеиновую кислоту, включающую участок, кодирующий лактадгерин или его вариант, и участок, кодирующий выбранный полипептид, оперативно связанные друг с другом, т.е. в одной и той же рамке считывания, так что после экспрессии в клетке хозяина получают гибридный (химерный) белок. Выбранный полипептид (или пептид) можно слить с лактадгерином или его вариантом в N-концевом или в С-концевом положении. Предпочтительно, выбранный полипептид или пептид (т.е. гетерологичный фрагмент) слить по С-концу лактадгерина или его варианта в соответствии с настоящим изобретением. Соответственно конкретной целью настоящего изобретения является химерный белок(или полипептид), включающий лактадгерин или его вариант, слитый с гетерологичным полипептидом или фрагментом. Другой конкретной целью настоящего изобретения является продукт, включающий лактадгерин или его вариант, связанный с гетерологичной молекулой. Как было указано выше,связь может быть ковалентной или нековалентной. Кроме того, так как лактадгерин опосредует фагоцитоз корпускулярных антигенов, настоящее изобретение также относится к искусственным липосомам (или липидным пузырькам), включающим лактадгерин (предпочтительно рекомбинантный) или его варианты, как раскрыто выше. 11 Лактадгерин может быть связан с поверхностью липосомы по его сайту связывания ФЛ. В этом варианте искусственная липосома по настоящему изобретению предпочтительно включает, по крайней мере, фосфатидилсерин как составляющий липид. Лактадгерин или его вариант может быть связан с липосомной мембраной через рецепторный фрагмент, способный связывать лигандный фрагмент, присутствующий в мембране липосомы. В частности, как указано выше, можно получить вариант лактадгерина, который включает дополнительные остатки или структуру, которые обеспечат связывание указанного варианта лактадгерина с выбранным рецептором или лигандом. В конкретном варианте вариант лактадгерина включает пептид, который связывает рецептор, присутствующий на липосомной мембране. Такой пептид может быть биотином, который связывается со стрептавидином, введенным в липосомную мембрану. В другом конкретном варианте лактадгерин или его вариант заключен в мембрану липосомы. Такое включение (закрепление) можно осуществить, в частности, используя вариант лактадгерина, включающий якорный участок,например, такой как трансмембранный домен. Такой якорный участок можно ввести в вариант как добавленный остаток в дополнении к остаткам лактадгерина или в качестве замены его остатков, и в частности, в качестве замены сайта связывания ФЛ. Вставку можно осуществить,используя вариант лактадгерина, содержащий липид с одного из его концов, предпочтительно с С-конца, способами, известными специалистам. В этом конкретном варианте липид (т.е. жирную кислоту) связывают с С-концом лактадгерина или его варианта, обладающего способностью связывать интегрин, используя обычные методики, и полученный продукт подвергают контакту с липосомой. Таким образом, настоящее изобретение относится также к любой композиции липидных пузырьков, включающей рекомбинантный белок, содержащий, по крайней мере, сайт связывания интегрина лактадгерином, более конкретно человеческим лактадгерином. Липидные пузырьки можно получить известными способами. Например, осуществляют контактирование выбранных липидов в подходящей среде для образования липидных бислоев и пузырьков. Лактадгерин или его варианты можно добавить к продукту до, во время или после образования искусственных липосом. Кроме того, искусственные липосомы включают экзосомы, продуцируемые клетками, которые включают рекомбинантные молекулы лактадгерина. Настоящее изобретение относится также к полипептиду, содержащему (а) аминокислотную последовательность лактадгерина без функционального сайта связывания ФЛ, и (b) гетероло 003643 12 гичный фрагмент, позволяющий закрепить указанный полипептид в липидной мембране. Выгодно также, чтобы композиции липосом по настоящему изобретению включали далее, по крайней мере, одну выбранную молекулу, такую как антиген. Такой выбранной молекулой может быть липид, полипептид, нуклеиновая кислота, химическая молекула и т.д. Предпочтительно, чтобы выбранной молекулой был полипептид (такой как любой белок,пептид и т.д.) или нуклеиновая кислота. В этой связи настоящее изобретение относится также к полипептиду, включающему (а) аминокислотную последовательность лактадгерина без функционального сайта связывания ФЛ, и (b) гетерологичный фрагмент, позволяющий связать указанный полипептид с нуклеиновой кислотой. Такой полипептид способен образовывать комплексы с нуклеиновыми кислотами,такими как, например, плазмиды, и направлять указанные нуклеиновые кислоты к дендритным клеткам in vitro, ex vivo или in vivo. Настоящее изобретение относится к нуклеиновой кислоте,кодирующей первичную структуру вышеуказанного полипептида. Еще более предпочтительно, чтобы молекулой был антиген, т.е. соединение, против которого желательна выработка иммунной реакции, особенно ЦТЛ реакции, цитокин (такой какIL12, IL4, GM-CSF и т.д., которые могут, например, стимулировать активацию и/или дифференцировку дендритных клеток) или токсичная молекула, которую можно использовать для исключения дендритных клеток. Примеры молекул антигенов включают,например, вирусные белки или пептиды, белки бактерий или пептиды, или опухолевые антигены, такие как MART-1, MAGE, BAGE, PSA,p53, Rb, Ras и т.д. Антигены могут быть интактными (т.е. целыми белками) или могут быть в форме их фрагментов. Предпочтительным вариантом настоящего изобретения является иммуногенная композиция, включающая лактадгерин или его вариант в связи с выбранной молекулой антигена. Вакцины иммуногенных композиций по настоящему изобретению можно использовать в применении к млекопитающим, таким как человек или животные. Антигенной молекулой может быть любой белок, полипептид или пептид, содержащий один или несколько эпитопов, вирус, фрагмент вируса, вирусный белок, полипептид или пептид, бактерия и т.д. Кроме того, вирус или бактерия могут быть инактивированы или ослаблены (т.е. обладать низкой инфекционной способностью или патогенностью). Вирус или бактерия могут представлять сам антиген или носитель антигена. В конкретном варианте настоящее изобретение относится к иммуногенной композиции, включающей вирус или бактерию,где указанный вирус или бактерия экспрессиру 13 ет лактадгерин или его вариант на своей поверхности. Лактадгерин или его вариант могут быть экспрессированы в результате химического, генетического, ферментативного или нековалентного присоединения. В конкретном варианте настоящее изобретение относится к рекомбинантному вирусу, где указанный рекомбинантный вирус экспрессирует лактадгерин или его вариант как молекулу на поверхности. Вирусом может быть любой вирус, ретровирус, аденовирус, AAV, герпесвирус и т.д. Лактадгерин или его вариант могут быть,например, экспрессированы как генетический гибрид с оболочковым белком. Рекомбинантный вирус может включать далее рекомбинантный геном, кодирующий белок, полипептид или пептид, включая иммуногенную или иммуностимулирующую молекулу. В другом конкретном варианте настоящее изобретение относится к рекомбинантной клетке, причем указанная рекомбинантная клетка экспрессирует лактадгерин или его вариант как молекулу на поверхности. Более предпочтительно, чтобы рекомбинантная клетка была получена из патогенных бактерий. Эти рекомбинантные бактерии представляют таким образом усовершенствованные иммуногенные композиции, которые можно использовать для вызова эффективных иммунных ответов in vivo или invitro, особенно эффективных ЦТЛ-реакций. Рекомбинантные клетки можно получить в результате экспрессии в указанных клетках нуклеиновой кислоты, кодирующей лактадгерин или его вариант, необязательно связанной с сигнальным пептидом, обеспечивающим закрепление молекулы в клеточной мембране. Лактадгерин или его вариант могут также быть экспрессированы в результате контактирования клетокin vitro с лактадгерином или его вариантом. В этой связи настоящее изобретение относится также к гибридному полипептиду, включающему (а) аминокислотную последовательность лактадгерина без функционального сайта связывания ФЛ, слитому с (b) антигенным полипептидом или пептидом. Настоящее изобретение относится также к любой нуклеиновой кислоте, кодирующей такой гибридный полипептид. Указанные полипептиды и нуклеиновые кислоты можно использовать для получения композиций вакцин, в частности, композиций противоопухолевых вакцин, которые можно вводить в той форме, в какой они есть, например, с помощью внутримышечных инъекций. Выбранная молекула может быть представлена в цитозоле липосомы и/или может быть закреплена в ее мембране и/или связана с поверхностью указанной липосомы. Выбранная молекула может быть объединена с указанной липосомой обычными способами, как было указано выше, в частности, за счет инкубирования молекулы с составляющими липидами до или во время формирования липосомы. 14 Настоящее изобретение относится также к рекомбинантным клеткам-хозяевам, в частности к рекомбинантным бактериям, которые экспрессируют лактадгерин или его вариант. Более предпочтительно, чтобы рекомбинантные бактерии экспрессировали лактадгерин или его вариант, обладающие способностью связывать интегрин. Введение в бактерию, например, рекомбинантного лактадгерина или его варианта позволяет обеспечить захват фракций бактериальных мембран дендритными клетками, и обеспечить эффективную выработку иммунных ответов, например, против бактериальных антигенов. Композиции, варианты, химерные белки или липосомы по настоящему изобретению можно использовать in vitro, ex vivo или in vivo.In vitro их можно использовать, например, чтобы направить или сенсибилизировать дендритные клетки, например, к нужной молекуле. В этом плане в настоящем изобретении обсуждается также способ доставки молекулы к дендритным клеткам, предпочтительно к незрелым дендритным клеткам, in vitro, ex vivo или invivo, включающий осуществление контакта указанной дендритной клетки (или популяции клеток, включающей дендритную клетку) с соединением, композицией или гибридным белком,как определено выше. Этот способ можно осуществить в любом подходящем приспособлении(планшете, чашке, ампуле, колбе и т.д.) при концентрации лактадгерина или его варианта в интервале от 0,01 до 1000 мкг/мл. Варианты лактадгерина можно также использовать для того, чтобы направить любое соединение к дендритным клеткам, in vitro, exvivo или in vivo. Например, описанные выше варианты лактадгерина, содержащие функциональный сайт связывания интегрина, можно использовать для направления вектора (такого как вирусный, полимерный, катионный или полипептидный вектор) к дендритным клеткам. Конкретные примеры включают рекомбинантные аденовирусы. Поэтому настоящее изобретение относится к использованию лактадгерина или его варианта, содержащих функциональный сайт связывания интегрина, для направления вектора (такого как вирусный, полимерный,катионный или полипептидный вектор) к дендритным клеткам. В настоящем изобретении раскрыта также композиция, включающая вектор,связанный с лактадгерином или его вариантом. Композиции, варианты, химерные белки или липосомы по настоящему изобретению можно также использовать in vitro в способе скринирования и/или идентификации соединений, которые могут регулировать перекрестное праймирование антигенов и/или фагоцитоз антигенов и/или доставку молекул к дендритным клеткам. В частности, дендритные клетки можно подвергнуть контактированию с композициями, вариантами, химерными белками или 15 липосомами по настоящему изобретению в присутствии предполагаемого продукта-кандидата или смеси, и определить способность указанного продукта-кандидата или смеси ингибировать или облегчать захват (или связывание) указанной композиции. Настоящее изобретение относится также к способу скринирования (существенно in vitro) соединений, обладающих способностью индуцировать или ингибировать экспрессию лактадгерина. В этой связи в настоящем изобретении предложен способ, включающий (i) осуществление контакта тестового соединения (или смеси) с культурой клеток, продуцирующих сравнительный уровень лактадгерина, (ii) измерение количества лактадгерина, продуцируемого указанной культурой клеток, и (iii) сравнение указанного количества со сравнительным уровнем. Культура клеток может быть, например, дендритными клетками, предпочтительно, стабильной линией дендритных клеток. Дозу лактадгерина можно подобрать в соответствии с обычными методиками, такими как иммуноанализ с использованием специфических антител, PCR и т.д. Соединения, способные усиливать экспрессию лактадгерина, можно использовать для стимуляции иммунитета субъекта, в частности,ЦТЛ-реакции субъекта. Настоящее изобретение относится также к меченым композициям или вариантам, как раскрыто выше, и к их использованию для контроля за иммунным ответом. В частности, настоящее изобретение можно использовать для определения присутствия экзосом в биологическом образце и для корреляции уровня экзосом до физиологического состояния субъекта. Способ определения включает, например, отбор образца(такого как образец крови субъекта) , контактирование указанного образца с композицией,включающей лактадгерин или его вариант, обладающие способностью связывать интегрин, и определение присутствия (и необязательно количества) экзосом, связанных с указанным лактадгерином или его вариантом. Диагностика высоких уровней экзосом в биологическом образце может быть скоррелирована с патологическим состоянием, при котором экзосомы продуцируются, например, дендритными клеткамиIn vivo настоящее изобретение можно использовать для регулирования иммунного ответа, для доставки молекул к дендритным клеткам, регулирования фагоцитоза антигенов и/или для перекрестного праймирования антигенов, а также для контроля за иммунным ответом. В частности, настоящее изобретение относится также к использованию лактадгерина, предпочтительно человеческого лактадгерина, или кодирующей его нуклеиновой кислоты, для стимуляции иммунного ответа у субъекта. В частности, введение человеческого лактадгерина или кодирующей его нуклеиновой кислоты 16 субъекту, у которого имеется опухоль, должно повысить иммунный ответ указанного субъекта на опухоль. Для такого конкретного применения предпочтительно внутримышечное введение. Для in vivo применений можно использовать обычные дозы, адаптированные специалистами. Предпочтительно для использования invivo вводить композиции путем инъекций, таких как, например, внутривенные, внутриартериальные, внутрибрюшинные, подкожные,внутримышечные. Их можно также вводить любыми другими способами. Предпочтительно приготавливать их с соответствующими приемлемыми носителями, такими как буферы (фосфат, калий, хлорид и т.д), изотонические растворы, физиологические растворы, в соответствующих дозах, таких как, например, от 0,1 до 10000 мкг белка в единичной дозовой форме. Композиции могут также включать стабилизирующие агенты (такие как добавки, высокомолекулярные молекулы, т.е. альбумин, декстран и т.д), поверхностно-активные агенты и т.д. Другие аспекты и преимущества настоящего изобретения будут раскрыты в следующих примерах, которые следует рассматривать только как иллюстративные и никак не ограничительные. Описание чертежей Фиг. 1 - полный состав белка метаболически меченых экзосом и D1 клеток. Экзосомы, выделенные из надосадочной жидкости метаболически меченых D1 клеток,обрабатывают с помощью 12% SDS-геля (Exos),вместе с лизатом (включая как цитолитические,так и мембранные компоненты), полученным из целых клеток (Cells), или с цитозолем (Cyto),или с полными мембранами (mb), полученными из тех же клеток в отсутствии детергента. Высушенный гель обрабатывают с помощью авторадиографии в течение 24 ч (белки более 45 кДа) или 48 ч (белки менее 45 кДа). Картину максимумов для каждой полосы получают с помощью программного обеспеченияN1Himage. Звездочками отмечены белки, присутствующие в достаточном количестве в клетках и отсутствующие в экзосомах, точками отмечены белки, которыми обогащены экзосомы. Фиг. 2 - картина для белков в D1 экзосомах, выявленная окрашиванием кумасси синим. 30 мкг экзосом выделяют с помощью 815% градиентного SDS-геля и окрашивают кумасси ярко-синим. Характер полосы идентичен полосе, полученной с помощью метаболически меченых экзосом. Основные полосы (1-11) анализируют, расщепляя трипсином и с помощьюMALDI-TOF (см. табл. 1). Фиг. 3 - анализ с помощью вестернблоттинга экспрессии лактадгерина в экзосомах,полученных из мышиных ДК. Значительная иммунореактивность была обнаружена для сыворотки А для экзосом, полученных из ДК, но не для полных клеточных лизатов. Промежу 17 точная реактивность наблюдалась для экзосом,полученных из опухолевых клеток (TS/A, карцинома клеток молочной железы), или для выделенных мембранных препаратов из ДК. Аннексия-специфические антитела реагируют со всеми экзосомными препаратами и клеточными лизатами. Фиг. 4 - FACscan анализ экспрессии лактадгерина для экзосом, полученных из D1. Латексные шарики с нанесенными экзосомами илиFCS инкубируют с антилактадгериновыми антителами (сыворотка А) или соответствующей преиммунной сывороткой. Затем шарики инкубируют со вторичными FITC-мечеными антикроличьими антителами до проведения FACscan анализа. Значительное специфическое окрашивание покрытых экзосомами шариков наблюдается для сыворотки А, но не для преиммунной сыворотки. Фиг. 5 - FACscan анализ экспрессии лактадгерина для экзосом, полученных из D1. Латексные шарики, покрытые экзосомами илиFCS, инкубируют с анти-МНС класса I, антиМНС класса II, контрольными IgG2a антителами или антилактадгериновыми моноклинальными (МС 3 или МС 8) или поликлональными антителами (сыворотка В). Связывание антител с шариками выявляют с помощью FITCмеченых антимышиных или антикроличьих IgG антител (Jackson Laboratories) до FACscan анализа. Сильное окрашивание покрытых экзосомами шариков наблюдается для анти-МНС класса I и II, а также с различными антилактадгериновыми моноклональными и поликлональными антителами. Материалы и методы Клеточные линии. Полученная из селезенки мышиная ДК клеточная линия D1 была описана ранее (Winzier et al., 1997). Ее культивируют в среде Дюльбекко, модифицированной Iscove (IMDM,Sigma, St Quentin, France), дополненной 10% фетальной телячьей сывороткой, не содержащей эндотоксина (FCS, Life Technologies, Cergy,France) и 30% R1 средой (GMCSF-трансфектированная NIH-3T3 фибробластная кондиционированная среда). Осуществляют пассаж клеток дважды в неделю в 145 мм nоn tissue-culture обработанных чашках Петри (4-5 х 106 клеток на чашку). Для контроля за их неактивированным состоянием уровень экспрессии поверхностными клетками МНС класса II и костимуляторных молекул регулярно проверяют с помощью сканирования активированных флуоресценцией клеток (FACS) по способу (Winzier et at., 1997). Иммунно-электронная микроскопия. Клетки D1, как незрелые, так и зрелые, после обработки LPS в течение 24 ч фиксируют 2% параформальдегидом в фосфатном буфере 0,2 М рН 7,4 (РВ) в течение 2 ч при комнатной температуре. Фиксированные клетки обрабатывают для ультратонкого секционирования и им 003643 18 мунометят, как указано выше (Raposo et al.,1997; Liou et al., 1996). Короче, после промывки РВ и РВ-50 мМ глицином клетки вводят в 7,5% желатин. Небольшие блоки инфильтруют 2,3 М сахарозой при 4 С в течение 2 ч, а затем замораживают в жидком азоте. Ультратонкие криосрезы, полученные с помощью ультрарезака(об./об.) и косвенно метят иммунозолотом с крысиными моноклональными антикласс II антителами М 5114, а затем поликлональными антикрысиными поликлональными антителамиCell Biology, Utrecht University The Netherlands). Полученные срезы в конце контрастируют и заключают в смесь метилцеллюлозы и уранилацетата и исследуют с помощью электронного микроскопа СМ 120 Twin Phillips(Eindover, The Netherlands). Очистка экзосом. Экзосомы приготавливают либо из надосадочной жидкости трехдневной D1 культуры,или из свежей культуральной среды, которую инкубировали в течение 24 ч с трехдневнымиD1 клетками. Не было выявлено никакой разницы между полными композициями экзосом, выделенных из трехдневной или из 24-часовой надосадочных жидкостей. Экзосомы очищают описанным ранее способом (Raposo et al., 1996). Короче, среду освобождают от клеток и осколков с помощью трехкратного последовательного центрифугирования при 300 g (5 мин), 1200 g(20 мин) и 10000 g (30 мин), затем экзосомы выделяют в осадок после центрифугирования в течение 1 ч при 70000 g. Экзосомы промывают один раз в большом объеме PBS, центрифугируют при 70000 g в течение 1 ч и снова суспендируют в 50-200 мл PBS с 0,01% азидом натрия(NaN3). Количество выделенных экзосомальных белков определяют с помощью анализа Брэдфорда (Bradford, Biorad, Ivry, France). Флотация экзосом с градиентом сахарозы. 90 мг экзосом снова суспендируют в 1 млHepes 20 мМ, рН 7,2, содержащем 2,5 М сахарозы и коктейль ингибиторов протеазы (см. следующий раздел). Непрерывный градиент сахарозы 2-0,25 М вводят поверх экзосом и это центрифугируют в течение 16 ч при 35000 об./мин вSW41 роторе. Фракции по 1 мл каждая отбирают из верхней части градиента, центрифугируют в течение 1 ч при 100000 g и осадок помещают на 10% SDS-гель для проведения Вестернблоттинга. Анализ белков с помощью SDS-PAGE. Полные белки приготавливают из 108 D1 клеток, подвергшихся лизису в 1 мл Tris 50 мм рН 7,5, NACl 0,3 М, Triton Х-100 0,5%, NaN3 0,1%, с коктейлем антипротеаз (CLAP: химостатин, леупептин, апротинин, пепстатин, 100 мМ каждого, Sigma) в течение 5 мин при 4 С. Лиза 19 ты освобождают от ядер с помощью центрифугирования при 10000 g. Для выделения цитозоля и полных мембран примерно 2 х 107 D1 клеток снова суспендируют при 4 С в 0,3 мл триэтаноламина, 10 мМ, EDTA 1 мМ, уксусной кислоте 10 мМ, сахарозе 250 мМ, тщательно растирают до рН 7,4 (ТЕА-сахароза) дополняют CLAP и гомогенизируют 60 пассажами через 25G иглу. Ядра и осколки клеток удаляют центрифугированием в течение 10 мин при 1200 g. Надосадочную жидкость, полученную после удаления ядер, центрифугируют в течение 1 ч при 100000g; затем цитозол удаляют вместе с надосадочной жидкостью и осадок (все мембраны) снова суспендируют в 0,3 мл смеси ТЕА-сахарозаCLAP. Метаболическое мечение клеток и экзосом. Метаболическое мечение D1 клеток осуществляют на трехдневных культурах: клетки промывают один раз в RPMI, не содержащей метионин/цистеин, подвергают голоданию в течение 1 ч при 37 С в RPMI, не содержащей метионин/цистеин, дополненной 30% диализованной R1 средой, и инкубируют в течение ночи при 37 С в 20 мл свежей RPMI, не содержащей метионин/цистеиндиализованной R1, дополненной 5% не содержащей эндотоксин FCS и 10-20 мКи/мл 35S-метионин/цистеином (Promix 35S,ICN, Orsay, France). Среду для введения метки удаляют, клетки промывают один раз в полнойD1 культуральной среде и затем инкубируют в течение 24 ч при 37 С. Экзосомы выделяют из надосадочной жидкости; из клеток приготавливают полные лизаты, цитозол и полные мембраны. Белки (20000 имп/мин каждого образца) разделяют с помощью 12% SDS-PAGE, сушат и обрабатывают с помощью авторадиографии. Картину максимумов для каждой полосы получают, используя программное обеспечениеN1Himage. Анализ белков с помощью MALDI-TOF. 30 мг белков из экзосом или полных лизатов обрабатывают с помощью 6-15% SDS-PAGE и окрашивают кумасси синим (Biorad). Основные полосы в экзосомных препаратах вырезают из геля. Короче, белки расщепляют трипсином в течение 4 ч при 37 С и полученную картину для пептидов анализируют с помощью метода Matrix-Assisted Laser Desorption/Ionisation - Time ofFlight (MALDI-TOF). Пептидный профиль для каждой из полос сравнивают с профилями для белков, имеющимися в базе данных, используя программу MS-Fit.Beстерн-блоттинг. Препараты экзосом разделяют с помощьюSDS-PAGE и белки переносят на PVDF мембраны. Реактивность антител определяют, используя специфические вторичные HRP-меченые антикроличий IgG антитела (Jackson Laboratories) и ECL (Amersham). 20 РАСscan анализ экзосом. Для определения лактадгерина на полученных из ДК экзосомах используют новый анализ, основанный на химических сшивках экзосом с активированными латексными шариками (не содержащий поверхностно-активных агентов латекс, Д:3,9 мкм, Interfacial DynamicsCorp., Pordaiid, Or. USA). Нанесение покрытия осуществляют, инкубируя 10 мкл шариков с 30 мкг очищенных экзосом в течение 2 ч при комнатной температуре. Покрытые экзосомами шарики насыщают в 1 М глицине в течение 30 мин при комнатной температуре и инкубируют со специфическими и FITC-вторичными антителами (антимышиный или антикроличий IgG, Jackson Laboratories) в PBS 3% FCS, перед проведением анализа с помощью Facscalibur (BectonDickinson). Культура человеческих ДК. Клетки крови от здоровых добровольцев получают в результате переливания собственной крови, из которой предварительно удалены определенные клеточные и плазменные составляющие (Cobe Spectra cell separator). Моноядерные клетки выделяют с помощью Ficoll-Paque(Pharmacia) с градиентом плотности. Прилипшие к пластику РВМС (моноядерные клетки периферической крови) от здорового донора инкубируют в течение 7 дней с GM-CSF и IL-4 или IL-13, в RPIM-1640 (Life Technologies) среде, дополненной 10% фетальной телячьей сывороткой. В конце культивирования клетки анализируют с помощью цитометрии в потоке для определения их фенотипа для CD1a, CD3, CD14,CD19, CD15, CD40, CD80, CD83, CD86 и антиHLA-DR. Они демонстрируют фенотипные характеристики незрелых дендритных клеток, как было ранее описано Chapuis et al., Eur. J. Immunol, 1997, 27:431-441 (т.е. для CD1a+, CD3-,CD14-, CD19-, CD15-, CD40+, CD80+, CD83-,CD86+ и анти HLA-DR+). Экзосомы собирают из культуральной надосадочной жидкости так же, как собирали экзосомы из D1 клеточной линии Примеры 1. Полный состав белков экзосом. Для выяснения молекулярной основы противоопухолевого действия экзосом in vivo было предпринято интенсивное исследование характеристик белкового состава экзосом. D1 клетки метят метаболически в течение ночи с помощью смеси 35S-метионин/цистеина, один раз промывают и добавляют к клеткам на 24 ч свежую не радиоактивную среду. Метаболически меченые экзосомы выделяют из этой надосадочной жидкости. По результатам двух независимых экспериментов количество радиоактивности, выделенное в экзосомах, составило 0,25% (0,05%) радиоактивности, включенной в клетки. Количество радиоактивности, выделенной в экзосомальных белках (80 имп/мин/мг), оказалось аналогичным количеству, которое выделилось в белках из целых клеток (100 имп/мин/мг), что подтверждает тот факт, что экзосомальные препараты состоят из полученных из клеток белков,и они не загрязнены белками из внеклеточной среды. Белковый профиль для экзосом из метаболически меченых клеток анализируют с помощью SDS-PAGE и авторадиографии и сравнивают с профилем для полных D1 лизатов, цитозоля или полных клеточных мембран. Как представлено на фиг. 1, экзосомы демонстрируют уникальный состав белков. По крайней мере, 7 белков (примерно 180, 90, 70, 58, 43, 32 и 27 кДа, точки на фиг. 1, полоса "exos") оказались в большем количестве в экзосомальных препаратах по сравнению с составом для целых клеток,цитозоля или полных мембран. Восемь других основных белков из целых клеток, цитозоля или полных мембран отсутствуют или присутствуют в меньшем количестве в экзосомах (см. звездочки на фиг.1, полоса "клетки"). Интересно, что две из интенсивных полос для экзосом (70 и 58 кДа) не определяются в цитозоле или в целыхD1 клетках, что предполагает особенно жесткий механизм обогащения этих белков в экзосомах. Поэтому экзосомы концентрируют уникальный субнабор клеточных белков, который,по-видимому, и отвечает за биологические активности экзосом. Для идентификации присутствующих в экзосомах белков 30 мкг экзосомальных белков вводят в 8-15% SDS-гель: характер полос, окрашенных кумасси ярко-синим,очень близок к характеру полос метаболически меченых экзосом (сравните фиг. 1 и 2). Поэтому все типы основных белков в экзосомальных препаратах обязаны своим происхождением клеткам, а не фетальной телячьей сыворотке(FCS). Все эти основные полосы вырезают (полосы 1-11 на фиг. 2), расщепляют трипсином, и полученные пептиды анализируют с помощьюFlight (MALDI-TOF). Профили для пептидов,полученные для различных полос, сравнивают с теоретическими пептидными профилями известных белков из базы данных. Полученные результаты (см. табл. 1 далее) показывают, что среди идентифицированных полос одна соответствует лактадгерину (известному также как Полное число пептидов 28 15 2. Дендритные клетки, но не макрофаги,продуцирующие лактадгерин. Учитывая вышеприведенные доказательства присутствия лактадгерина на экзосомах,продуцируемых дендритными клетками, был 22 проведен анализ дендритных клеток для определения того, действительно ли они продуцируют лактадгерин. С этой целью осуществляют реакцию амплификации на полной РНК, полученной из дендритных клеток, используя олигонуклеотидные праймеры, специфические для мРНК лактадгерина. Используют следующие последовательности олигонуклеотидов: Олиго 1 (SEQ ID NO:5): 5'-ATGCTACTCTGCGCCTCTG-3' Олиго 2 (SEQ ID NO:6): 5'-GTCTTGTAGCTGCTGGAGG-3' Полную РНК получают из 5-7 х 106 клеток способом с использованием гуанидинтиоцианата (Chomezinski and Sacchi, Annal. Biochem. 162(1987) 156). Реакцию обратной транскрипции осуществляют в объеме 20 мкл: 1 мкг РНК смешивают с dNTPs (250 мкМ каждого окончательно), случайными гексануклеотидами (2 нгGibco-BRL) и PHKsin (20 Ед., Promega) в конечном объеме 15 мкл, нагревают при 60 С в течение 5 мин и охлаждают до 42 С. Добавляют четыре мкл 5xAMV-обратной транскриптазы (RT),буфер и 1 мкл AMV-RT (25 Ед/мкл, Boehringer) и реакцию ведут при 42 С в течение 2 ч. PCRреакцию осуществляют в конечном объеме 50 мкл, используя 3,5 мкл из реакции обратной транскрипции, dNTPs (200 мкМ каждой конечн.), МgСl2 (2 мМ конечн.), Taq или Tfi полимеразу (Promega) и олигонуклеотиды, специфичные для мышиной MFG-E8 кДНК (500 нМ каждой окончат.). Полученную смесь нагревают при 94 С в течение 5 мин, подвергают 35 циклам (94 С 30 с, 53 С 30 с, 72 С 45 с), и в конце 72 С 2 мин. В качестве контроля проводят аналогичную PCR-реакцию с олигонуклеотидами,специфичными для мышиной актиновой кДНК,и проводят 25 циклов (94 С 30 с, 55 С 30 с и 72 С 30 с). 20 мкл из PCR-реакций обрабатывают на 1% агарозном геле, содержащем бромид этидия, и наблюдают при УФ освещении. Амплифицированные полосы соответствуют 830 парам оснований для MFG-E8 и 800 парам оснований для актина. Экспрессию гена, кодирующего MFG-E8,анализируют с помощью RT-PCR в различных мышиных клеточных линиях: D1 (дендритная клеточная линия), J774 (клеточная линия макрофагов), Р 815 (мастоцитома) и TS/A (аденокарцинома молочной железы). D1 используют либо в их незрелом состоянии, либо после 24 ч обработки в присутствии LPS, которые стимулируют их созревание. Экспрессию MFG-E8 определяют только в незрелых D1 клетках, и для TS/A карциномы молочной железы; ни зрелые D1 клетки, ни макрофаги или мастоцитомы не экспрессируют MFG-E8. Хорошее качество кДНК подтверждается амплификацией полосы актина во всех образцах. 3. Экспрессия лактадгерина в мышиных и человеческих ДК и полученных из ДКэкзосомах - Продуцирование антител. В этом примере приготавливают антитела,направленные против человеческого или мы 23 шиного лактадгерина. Эти антитела используют для контроля за присутствием и экспрессией лактадгерина в мышиных или ДК и полученных из ДК экзосомах. Эти антитела можно также использовать для ингибирования взаимодействия между конкретными антигенами и ДК. Вырабатывают три различные кроличьи антисыворотки против пептидов мышиного лактадгерина. Пептиды, синтезированные искусственно, включают RGD домен лактадгерина и имеют следующие последовательности:SEQ ID NO: 4) для RGD домена мышиного лактадгерина. Этот пептид используют для получения сыворотки А,- CEEISQEVRGDVFPSY (остатки 38-53SEQ ID NO: 1) для RGD домена человеческого лактадгерина. Этот пептид используют для получения сыворотки В,смесь трех пептидов, гомологичных в мышином и человеческом лактадгеринеID NO: 1), CVTGIITQGARDFG (остатки 299311 SEQ ID NO: 1) и 20 LPVSTLRL (остатки 370-387 SEQ ID NO: 1). Эти пептиды используют для получения сыворотки С. Кролики реагировали на все пептиды, кроме последнего. Сыворотка А очень сильно реагирует с уникальной полосой 50-55 кДа, когда экзосомы из незрелых D1 клеток или из ДК, полученных из свежего костного мозга, анализируют с помощью Вестерн-блоттинга (фиг. 3, левая полоса). На полных D1 клеточных лизатах реактивность едва детектируется, но ее можно выявить,если использовать выделенные мембраны (фиг. 3, правая полоса). Откладывают равные количества белков, 2 или 6 мкг/полосу, и их качество оценивают, используя антианнексин II антитела параллельно ( фиг. 3, нижняя полоса). Для определения лактадгерина на полученных из ДК экзосомах используют FACscan анализ, основанный на химических сшивках экзосом с активированными латексными шариками. Антимышиные лактадгериновые антитела(сыворотка А), но не соответствующая преиммунная сыворотка, также реагируют с покрытыми экзосомами латексными шариками (фиг. 4). Антитела к МНС класса I (НС 10) и Н (IB5) молекулам реагируют с шариками, покрытыми экзосомами, полученными из человеческих ДК,но не с контрольными шариками, покрытымиFCS (фиг. 4). Аналогично, два античеловеческих лактадгерина моноклональных антител МС 3 и МС 8 также связываются с экзосомами, но не с шариками, покрытыми FCS. Аналогичные результаты получены с использованием поликлональных антител к лактадгерину (сыворотка В),которые в противоположность соответствующей преиммунной сыворотке также связываются с экзосомами (фиг. 5). 24 Эти результаты четко демонстрируют, что экзосомы, полученные как из мышиных, так и из человеческих ДК, содержат лактадгерин. Раскрытые в этом примере пептиды и антитела можно использовать в других способах по настоящему изобретению. 4. Конструирование варианта человеческого лактадгерина, который не содержит функционального сайта связывания интегрина. В этом примере раскрыт способ создания вариантов лактадгерина, у которых отсутствует функциональный сайт связывания интегрина. Полученные при этом варианты практически не способны связываться с интегрином, более конкретно, с интегрином v5. Поэтому указанные варианты эффективно не связываются с дендритными клетками, более конкретно с человеческими дендритными клетками, особенно с незрелыми человеческими дендритными клетками. Более предпочтительно, чтобы эти варианты сохраняли способность связываться с фосфолипидами, особенно фосфатидилсерином. Эти молекулы действительно представляют собой конкуренты природного лактадгерина в отношении связывания корпускулярных антигенов, таких как апоптотические тельца или пузырьки, и препятствуют развитию иммунной реакции,особенно с перекрестными праймированными антигенами. Варианты лактадгерина, у которых отсутствует функциональный сайт связывания с интегрином, конструируют следующим способом. Создают конструкцию нуклеиновой кислоты, включающую последовательность, кодирующую человеческий лактадгерин, как представлено в SEQ ID NO: 1, или, по крайней мере,аминокислотные остатки 24-387 указанной последовательности, соответствующие зрелому белку. Такая последовательность представлена,например, в SEQ ID NO: 2. Очевидно, что варианты указанной последовательности также можно использовать в качестве исходного материала. Такую конструкцию, обычно плазмиду,реплицируют в компетентной клетке-хозяине,для получения нужного количества нуклеиновой кислоты. Затем нуклеиновую кислоту обрабатывают, чтобы сделать нефункциональным ее сайт связывания с интегрином, который она кодирует. В этом плане сайт связывания интегрина расположен практически в N-концевой части белка, более конкретно в аминокислотных остатках Arg Gly Asp в положении 46-48 SEQ IDNO: 1. В конкретном примере нуклеиновую кислоту обрабатывают, расщепляя всю или часть последовательности, кодирующей аминокислотные остатки 1-100 SEQ ID NO: 1, причем указанная делеция лишает белок способности связываться с интегрином v5. Еще более предпочтительно модифицировать нуклеиновую кислоту путем делеции всей или части последо 25 вательности, кодирующей аминокислотные остатки 1-100 SEQ ID NO: 1, причем указанная делеция должна включать, по крайней мере, всю или часть последовательности, кодирующей аминокислотные остатки Arg Gly Asp в положении 46-48 SEQ ID NO: 1. Предпочтительные варианты делеции включают делецию аминокислотных остатков 46-48, 45-49, 40-50 или 3555 SEQ ID NO: 1, необязательно в сочетании с делецией аминокислотных остатков 1-23, представляющих сигнал секреции. Такие делеции можно осуществить различными способами. В частности, делецию осуществляют, обрабатывая нуклеиновую кислоту рестрикционным ферментом, который расщепляет указанную нуклеиновую кислоту в соответствующем участке (включая искусственно созданные рестрикционные сайты), необязательно с последующим расщеплением фрагментов экзонуклеазами и/или лигированием полученных фрагментов. В другом конкретном примере нуклеиновую кислоту модифицируют с помощью мутации (мутаций) во всей или в части последовательности, кодирующей аминокислотные остатки 1-100 SEQ ID NO: 1, причем указанная мутация (мутации) лишают белок способности связывать интегрин v5. Еще более предпочтительно модифицировать нуклеиновую кислоту с помощью мутации (мутаций) во всей или в части последовательности, кодирующей аминокислотные остатки 1-100 SEQ ID NO: 1, причем указанная часть включает, по крайней мере, всю или часть последовательности, кодирующей аминокислотные остатки Arg Gly Asp в положении 46-48 SEQ ID NO: 1. Предпочтительные примеры вариантов включают, по крайней мере,мутацию одной аминокислоты, выбранной из аминокислотных остатков Arg Gly Asp в положении 46-48 SEQ ID NO: 1. Мутацию можно осуществить различными способами, включая сайт-направленный мутагенез, амплификацию с мутированными праймерами, синтез нуклеиновых кислот и клонирование и т.д. Мутация может также привести к супрессии одного отдельного аминокислотного остатка или к его замене другим консервативным или неконсервативным аминокислотным остатком. После получения нуклеиновых кислот проверяют их строение с помощью расщепления и/или секвенирования. Затем полученные нуклеиновые кислоты экспрессируют в клеткехозяине, например, в бактерии, в дрожжевой клетке или в клетке млекопитающего, и полученные таким образом варианты выделяют. Конкретными вариантами настоящего изобретения являются- белок, включающий аминокислотные остатки 49-387 SEQ ID NO: 1;- белок SEQ ID NO: 1 с делецией аминокислотных остатков 46-48;- белок SEQ ID NO: 1 с делецией аминокислотных остатков 1-23 и 46-48;- белок, включающий аминокислотные остатки 23-387 SEQ ID NO: 1, с мутацией в аминокислотном остатке Arg в положении 46;- белок, включающий аминокислотные остатки 23-387 SEQ ID NO: 1, с мутацией в аминокислотном остатке Gly в положении 47;- белок, включающий аминокислотные остатки 23-387 SEQ ID NO: 1, с мутацией в аминокислотном остатке Asp в положении 48; 5. Конструирование варианта человеческого лактадгерина, лишенного функционального сайта связывания фосфатидилсерина. Этот пример раскрывает способ конструирования вариантов лактадгерина, лишенных функционального сайта связывания фосфатидилсерина (ФС). Полученные варианты практически не способны связываться с ФС и поэтому эффективно не связывают корпускулярные антигены, такие как апоптотические тельца и пузырьки. С другой стороны, указанные варианты выгодно сохраняют способность лактадгерина связываться с дендритными клетками, более конкретно с человеческими дендритными клетками, особенно человеческими незрелыми дендритными клетками. Соответственно, эти молекулы представляют собой конкуренты природным лактадгеринами в отношении связывания с дендритными клетками, препятствуя тем самым перекрестному праймированию антигенов. Эти варианты можно также использовать для доставки молекул к дендритным клеткам, в частности, для облегчения (т.е. усиления) захвата (например, фагоцитоза) молекул дендритными клетками in vitro, ex vivo или in vivo. Варианты лактадгерина, у которых отсутствует функциональный сайт связывания с ФС,конструируют следующим способом. Создают конструкцию нуклеиновой кислоты, включающую последовательность, кодирующую человеческий лактадгерин, как представлено в SEQ ID NO: 1, по способу примера 4. Затем нуклеиновую кислоту обрабатывают таким образом, чтобы сделать нефункциональным сайт связывания ФС лактадгерина, который она кодирует. В этом отношении сайт связывания лактадгерина расположен практически в Сконцевой части белка, более конкретно в аминокислотных остатках 242-387 SEQ ID NO: 1,еще более предпочтительно в аминокислотных остатках 350-387 SEQ ID NO: 1. В конкретном примере нуклеиновую кислоту модифицируют с помощью делеции всей или части последовательности, кодирующей аминокислотные остатки 242-387 SEQ ID NO: 1,более предпочтительно, по меньшей мере, аминокислотные остатки 360-387 SEQ ID NO: 1,причем указанная делеция делает белок неспособным связываться с ФС. Такую делецию можно осуществить различными способами. В частности, делецию осуществляют, обрабатывая нуклеиновую кислоту рестрикционным ферментом, который расщепляет указанную нуклеино 27 вую кислоту в соответствующем участке (включая искусственно созданные рестрикционные сайты), необязательно с последующим расщеплением фрагментов экзонуклеазами, и/или лигированием полученных фрагментов. В другом конкретном примере нуклеиновую кислоту модифицируют с помощью мутации (мутаций) во всей или в части последовательности, кодирующей аминокислотные остатки 242-387 SEQ ID NO: 1, более предпочтительно, по крайней мере, в последовательности, кодирующей аминокислотные остатки 360-387SEQ ID NO: 1, причем указанная мутация (мутации) делает белок неспособным связываться с ФС. Мутацию можно осуществить различными способами, включая сайт-направленный мутагенез, амплификацию с мутированными праймерами, синтез нуклеиновых кислот и клонирование и т.д. После получения нуклеиновых кислот проверяют их строение с помощью расщепления и/или секвенирования. Затем полученные нуклеиновые кислоты экспрессируют в клеткехозяине, например, в бактерии, в дрожжевой клетке или в клетке млекопитающего, и полученные таким образом варианты выделяют. Конкретными вариантами настоящего изобретения являются- белок, включающий аминокислотные остатки 1-242 SEQ ID NO: 1;- белок, включающий аминокислотные остатки 24-242 SEQ ID NO: 1;- белок SEQ ID NO: 1 с делецией аминокислотных остатков 360-387;- белок SEQ ID NO: 1, с мутацией в одном или нескольких аминокислотных остатках последовательности 360-387. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение лактадгерина или его варианта для получения композиции для регулирования иммунного ответа. 2. Применение по п.1 для ингибирования перекрестного праймирования антигенов. 3. Применение по п.2 варианта лактадгерина, не содержащего функциональный сайт связывания с фосфолипидом и/или функциональный сайт связывания с интегрином. 4. Применение по п.1 для стимуляции фагоцитоза антигенов дендритными клетками. 5. Применение по п.1 для стимуляции перекрестного праймирования антигенов. 6. Применение лактадгерина или его вариантов для получения композиции для доставки антигена, цитокина или токсичной молекулы к дендритным клеткам. 7. Применение по любому из предшествующих пунктов, где лактадгерин или его вари 003643 34 ант является человеческим лактадгерином или его вариантом. 8. Иммуногенная композиция, включающая лактадгерин или его вариант, связанный с антигеном или цитокином. 9. Композиция по п.8, где указанный антиген или цитокин ковалентно связан с лактадгерином или его вариантом. 10. Композиция по п.8, включающая липосому, где липосома включает лактадгерин или его вариант, ковалентно связанные с антигеном или цитокином. 11. Иммуногенная композиция, включающая лактадгерин или его вариант, связанный с антигеном. 12. Композиция по п.11, где антиген представляет собой белок, полипептид, пептид, вирус или бактерию. 13. Химерный белок, включающий лактадгерин или его вариант, слитый с иммуногеном или иммуностимуляторным полипептидом. 14. Нуклеиновая кислота, кодирующая белок по п.13. 15. Липосома, включающая рекомбинантный лактадгерин или его вариант. 16. Иммуногенная композиция, включающая химерный белок по п.13 или липосому по п.15. 17. Рекомбинантный вирус, экспрессирующий лактадгерин в виде поверхностной молекулы. 18. Рекомбинантная клетка, экспрессирующая лактадгерин в виде поверхностной молекулы.
МПК / Метки
МПК: C07K 14/47, C12N 1/21, A61K 38/00
Метки: варианты, композиции, лактадгерин, способы, использования, содержащие
Код ссылки
<a href="https://eas.patents.su/19-3643-kompozicii-soderzhashhie-laktadgerin-ili-ego-varianty-i-sposoby-ih-ispolzovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции, содержащие лактадгерин или его варианты, и способы их использования</a>
Предыдущий патент: Лекарственные средства, содержащие производные полигидроксиалкилпиразина, новые производные полигидроксиалкилпиразина и их получение
Следующий патент: Композиция для получения защитного покрытия, предназначенного для защиты древесины
Случайный патент: Способ защиты финансовых транзакций