Арилэтинилпиримидины
Номер патента: 25165
Опубликовано: 30.11.2016
Авторы: Виейра Эрик, Штадлер Хайнц, Ешке Георг, Линдеманн Лотар
Формула / Реферат
1. Производные этинила формулы I
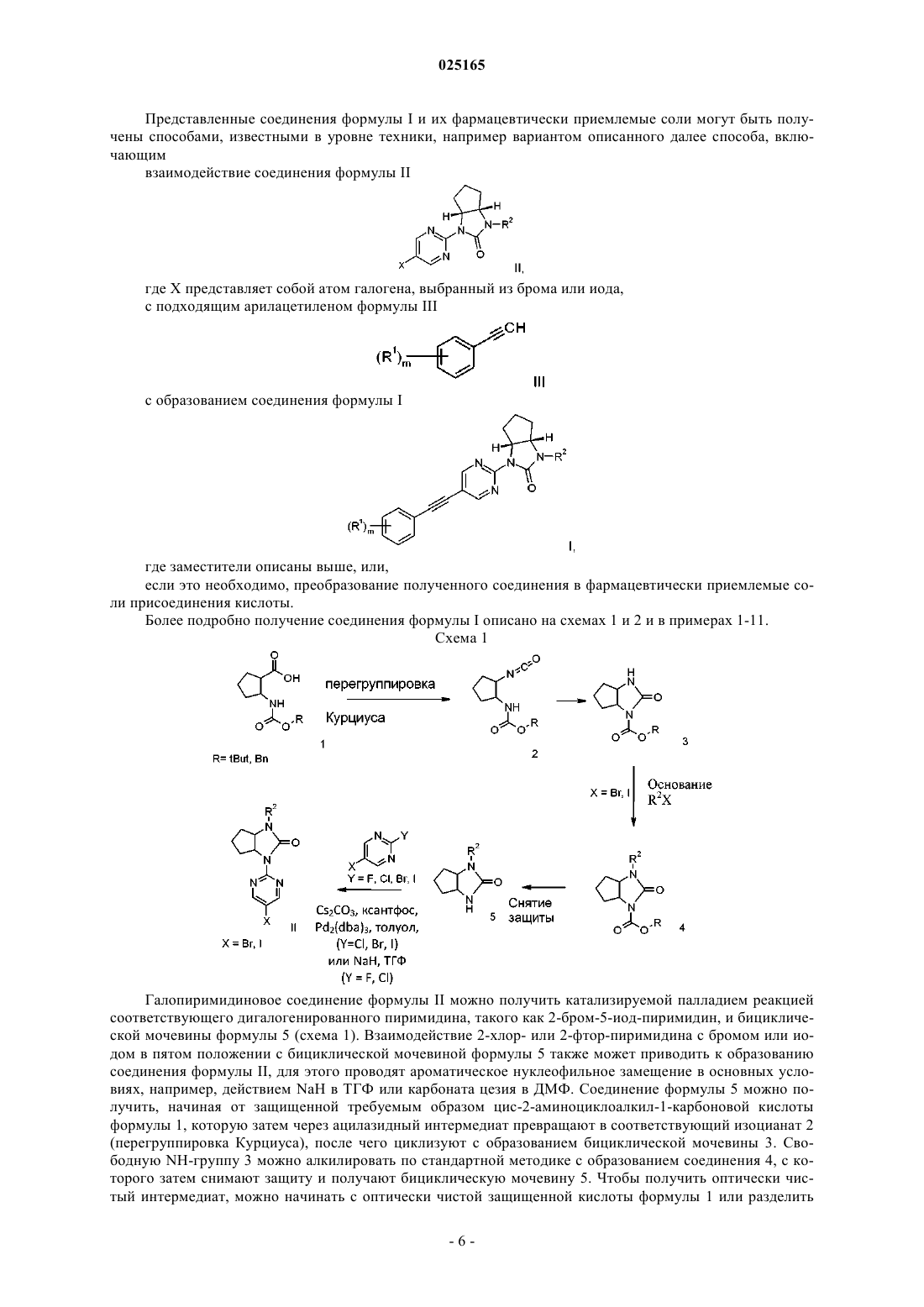
где R1 представляет собой водород или галоген;
R2 представляет собой C1-3-алкил или -(CH2)n-O-CH3;
n означает 2 или 3;
m означает 1 или 2;
или их фармацевтически приемлемые соли присоединения кислоты и/или стереоизомеры.
2. Производные этинила формулы I по п.1
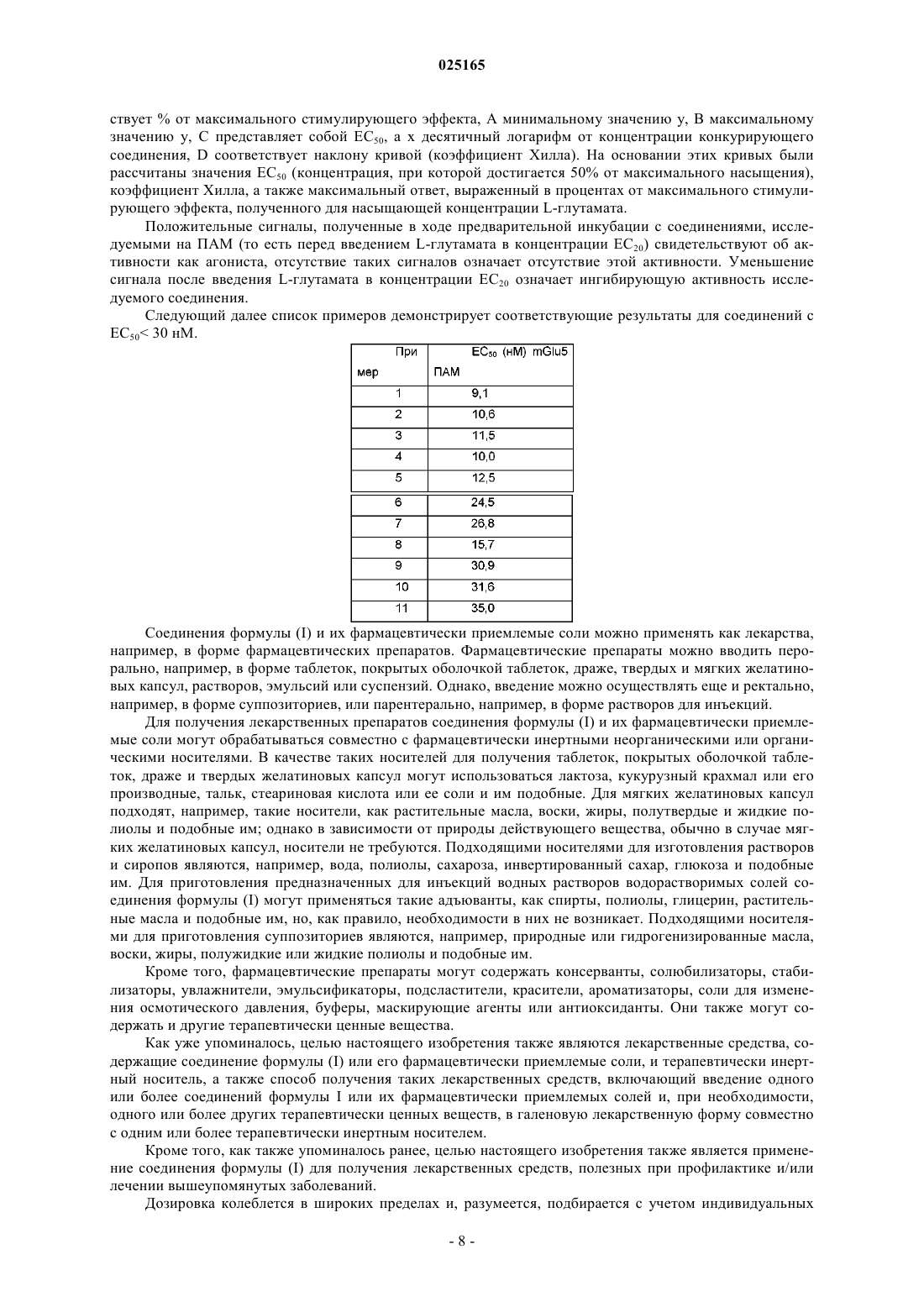
где R1 представляет собой водород или фтор;
R2 представляет собой этил, -(CH2)2-OCH3 или -(CH2)3-OCH3;
m означает 1 или 2;
или их фармацевтически приемлемые соли присоединения кислоты и/или стереоизомеры.
3. Производные этинила формулы I по любому из пп.1, 2, где соединения представляют собой
(-)-(3aR,6aS)-1-этил-3-(5-фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он;
(-)-(3aR,6aS)-1-этил-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он;
(-)-(3aR,6aS)-1-этил-3-(5-(4-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он;
(-)-(3aR,6aS)-1-этил-3-(5-(2,5-дифторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он;
(-)-(3aR,6aS)-1-(2-метоксиэтил)-3-(5-фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он;
(-)-(3aR,6aS)-1-(2-метоксиэтил)-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он;
(-)-(3aR,6aS)-1-(2-метоксиэтил)-3-(5-(4-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он;
(-)-(3aR,6aS)-1-(2-метоксиэтил)-3-(5-(2,5-дифторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он;
(-)-(3aR,6aS)-1-(3-метоксипропил)-3-(5-фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он;
(-)-(3aR,6aS)-1-(3-метоксипропил)-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он или
(-)-(3aR,6aS)-1-(3-метоксипропил)-3-(5-(4-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он.
4. Фармацевтическая композиция, обладающая активностью аллостерического модулятора подтипа 5 метаботропного глутаматного рецептора (mGluR5), содержащая по меньшей мере одно соединение по любому из пп.1-3 или его фармацевтически приемлемую соль присоединения кислоты.
5. Применение соединения по любому из пп.1-3 в качестве аллостерического модулятора подтипа 5 метаботропного глутаматного рецептора (mGluR5).
6. Применение соединения по любому из пп.1-3 в виде смеси энантиомеров, диастереомеров или в энантиомерно чистой форме, а также его фармацевтически приемлемой соли присоединения кислоты в качестве аллостерического модулятора подтипа 5 метаботропного глутаматного рецептора (mGluR5).
7. Применение соединения по любому из пп.1-3 или его фармацевтически приемлемой соли присоединения кислоты для изготовления лекарственного средства для лечения или профилактики заболеваний, связанных с аллостерическими модуляторами рецепторов mGluR5.
8. Применение по п.7 для лечения или профилактики шизофрении, когнитивных расстройств, синдрома фрагильной Х-хромосомы или аутизма.
9. Применение соединения по любому из пп.1-3 для лечения или профилактики шизофрении, когнитивных расстройств, синдрома фрагильной X-хромосомы или аутизма.
10. Способ лечения шизофрении, когнитивных расстройств, синдрома фрагильной Х-хромосомы или аутизма, включающий введение эффективного количества соединения по любому из пп.1-3.
Текст
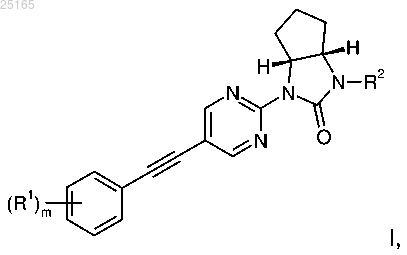
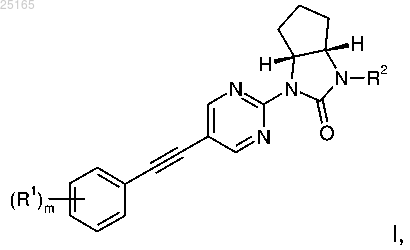
Изобретение относится к производным этинила формулы I где R1 представляет собой водород или галоген; R2 представляет собой C1-3-алкил или -(CH2)nO-CH3; n означает 2 или 3; m означает 1 или 2; или к их фармацевтически приемлемым солям присоединения кислоты, рацемическим смесям или соответствующим энантиомерам, и/или оптическим изомерам, и/или стереоизомерам. Обнаружено, что соединения общей формулыI представляют собой аллостерические модуляторы подтипа 5 метаботропного глутаматного рецептора (mGluR5) с улучшенными свойствами для лечения шизофрении, когнитивных расстройств, синдрома фрагильной Х-хромосомы или аутизма. Настоящее изобретение относится к производным этинила формулы I где R1 представляет собой водород или галоген;m означает 1 или 2; или их фармацевтически приемлемым солям присоединения кислоты, рацемическим смесям или соответствующим энантиомерам и/или оптическим изомерам. В настоящее время неожиданно обнаружили, что соединения общей формулы I являются аллостерическими модуляторами подтипа 5 метаботропного глутаматного рецептора (mGluR5) и демонстрируют выгодные биохимические, физико-химические и фармакодинамические свойства по сравнению с соединениями из уровня техники. Передача сигнала в центральной нервной системе (ЦНС) осуществляется путем взаимодействия выделяемого нейроном нейропередатчика с нейрорецептором. Глутамат является основным возбуждающим нейропередатчиком в мозгу и играет уникальную роль в большом количестве функций центральной нервной системы (ЦНС). Глутамат-зависимые нейрорецепторы делят на две основные группы. Первая основная группа, так называемые ионотропные рецепторы,образует лиганд-зависимые ионные каналы. Метаботропные глутаматные рецепторы (mGluR) принадлежат ко второй основной группе и, более того, относятся к семейству рецепторов, сопряженных с Gбелком (G-protein coupled receptors, GPCR). В настоящее время известно восемь различных членов семейства mGluR, у некоторых из них имеются подтипы. По гомологии своей аминокислотной последовательности механизмам передачи сигнала и селективности к агонистам эти восемь рецепторов можно разделить на три подгруппы: mGluR1 иmGluR5 принадлежат к группе I, mGluR2 и mGluR3 к группе II, а mGluR4, mGluR6, mGluR7 и mGluR8 к группе III. Лиганды метаботропных глутаматных рецепторов первой группы можно использовать для лечения или профилактики острых и/или хронических неврологических расстройств, таких как психоз, эпилепсия, шизофрения, болезнь Альцгеймера, когнитивные расстройства и нарушения памяти, а также хроническая и острая боль. Другие связанные с ними показания для лечения представляют собой нарушения работы мозга, вызванные операциями шунтирования или трансплантацией, плохое кровоснабжение мозга, повреждения спинного мозга и головы, вызванная беременностью гипоксия, остановка сердца и гипогликемия. Кроме того, к числу таких заболеваний относятся ишемия, хорея Хантингтона, амиотропный латеральный склероз (АЛС), туберозный склероз (ТЗС), вызванная СПИДом деменция, повреждения глаз, ретинопатия,идиопатический паркинсонизм или паркинсонизм, вызванный приемом лекарств, а также состояния, связанные с дефицитом глутамата, такие как, например, мышечные спазмы, конвульсии, мигрень, недержание мочи, никотиновая зависимость, опиатная зависимость, тревожность, рвота, дискинезия и депрессии. Расстройства, полностью или частично опосредуемые mGluR5, например, представляют собой острые, травматические и хронические дегенеративные заболевания нервной системы, такие как болезнь Альцгеймера, сенильная деменция, болезнь Паркинсона, хорея Хантингтона, амиотропный латеральный склероз и множественный склероз, психиатрические заболевания, такие как шизофрения и тревожность,депрессия, боль и наркотическая зависимость (Expert Opin. Ther. Patents (2002), 12, (12. Новое направление в разработке селективных модуляторов представляет собой поиск соединений,действующих по аллостерическому механизму, то есть модулирующих рецептор путем связывания с сайтом, отличающимся от высоко консервативного ортостерического сайта связывания. Возникшие недавно аллостерические модуляторы mGluR5 представляют собой новые фармацевтические препараты,действующие по этому привлекательному механизму. Аллостерические модуляторы описаны, например,в заявках WO2008/151184, WO2006/048771, WO2006/129199, WO2005/044797 и, в особенности,WO2011/128279, а также в статьях в журналах Molecular Pharmacology, 40, 333-336, 1991; The Journal ofPharmacology and Experimental Therapeutics, т. 313, No. 1, 199-206, 2005. В уровне техники описаны положительные аллостерические модуляторы. Эти соединения сами по себе не активируют рецепторы непосредственно, но заметно усиливают вызванные агонистами ответы,повышают их активность и доводят эффективность до максимума. Связывание таких соединений повышает сродство агонистов глутамат-связывающего сайта рецептора к его N-концевому сайту связывания. Таким образом, аллостерическая модуляция представляет собой привлекательный механизм, позволяю-1 025165 щий усилить уместную физиологическую активацию рецептора. В настоящее время наблюдается недостаток селективных аллостерических модуляторов рецептора mGluR5. Обычные модуляторы рецептораmGluR5, как правило, характеризуются недостаточной растворимостью в воде и демонстрируют плохую оральную биодоступность. Таким образом, сохраняется потребность в эффективных селективных аллостерических модуляторах рецептора mGluR5, лишенных этих недостатков. Как показано далее, настоящее изобретение решает эту проблему. Сравнение соединений по изобретению и похожих соединений из уровня техники. Структурно подобные соединения из уровня техники рассматриваются в заявке WO2011128279 (= ссылка 1, Hoffmann-La Roche), для сравнения здесь представлены наиболее похожие по структуре соединения из этой заявки (примеры 106, 170 и 174). Пример 106 описан в заявке в виде рацемической смеси. Удалось осуществить оптическое разделение этой смеси (используя методику разделения, подобную той,что описана в примере 1, этап 5). В качестве примера для сравнения выбран наиболее активный энантиомер. То же самое касается и примера 170 из ссылки 1, для сравнения был выбран оптически чистый (-)энантиомер. Для полноты, пример 174 показан в форме рацемата и в точности соответствует примеру 174 из ссылки 1. Сравнение соединений по изобретению и соединения сравнения из примера 106. Растворимость всех соединений по изобретению более чем в 200 раз выше, чем у соединения сравнения, несмотря на то, что пиримидиновое ядро является менее основным, чем пиридиновое ядро примера 106, а группы R4 более липофильны, чем метильная группа соединения сравнения. Этот неожиданный результат демонстрирует явное преимущество соединений по настоящему изобретению, по сравнению со структурно похожими соединениями из уровня техники, в отношении растворимости, что очень важно для поглощения, количества несвязанной свободной фракции и других фармакологических свойств лекарств. Сравнение соединений по изобретению и соединения сравнения из примеров 170 и 174. Растворимость по сравнению с соединениями из примеров 170 и 174 ссылки 1 также улучшается,несмотря на наличие диазинового ядра в соединениях сравнения. Основным преимуществом, однако,является то, что соединения по изобретению не демонстрируют спонтанного связывания с глутатионом,которое свидетельствует об активности типа присоединения по Михаэлю (анализ GSH). С точки зрения безопасности лекарства взаимодействие химически активных лекарств с протеинами (ковалентное связывание с протеинами, КВС) является нежелательным явлением. Протеины могут образовывать ковалентные аддукты с молекулами лекарства, проявляющими свойства акцептора по Михаэлю, через свои нуклеофильные аминокислотные боковые цепи (например, цистеин, серии, лизин и т.д.). Образование аддуктов лекарство-протеин может вести к нежелательным реакциям со стороны иммунной системы,распознающей ковалентно связанные протеины как "чужие". Такие иммунные ответы могут приводить к аллергическим реакциям разной интенсивности, называемой иммунной токсичностью. Являющийся "золотым стандартом" анализ КВС (ковалентное связывание с протеинами), который позволяет определить образование ковалентных аддуктов путем инкубации тестируемых соединений с микросомами печени, необходимо проводить с материалом, меченым 14C. Для задач повседневного скрининга это неудобно. Удобным для повседневного скрининга является анализ спонтанного присоединения глутатиона, и соединения, которые показывают в нем значимую активность как акцепторы по Михаэлю, скорее всего, будут проявлять активность и в анализе КВС. Тот факт, что активной формой в данном случае является родительское соединение, а не метаболически индуцированный активный метаболит, дополнительно повышает важность анализа. Приведенные выше данные показывают, что соединения по изобретению характеризуются значительно меньшей тенденцией к образованию спонтанных ковалентных аддуктов с глутатионом (NO FLAG), в то время как соответствующие соединения сравнения образуют значительное количество ковалентных аддуктов с глутатионом, что вызвано их свойствами акцепторов по Михаэлю (FLAG). В общем случае, можно сказать, что соединения по настоящему изобретению обладают ясно выраженным преимуществом, по сравнению со структурно похожими соединениями из уровня техники, в отношении их лекарственной безопасности, в связи с тем, что они характеризуются менее выраженными свойствами акцепторов по Михаэлю. Анализ растворимости с использованием метода лиофильной сушки (Lyophilisation solubility assay(LYSA). Процедуру этого автоматизированного высокопроизводительного анализа можно разделить на два этапа. Сначала маточные растворы исследуемых соединений в ДМСО разбавляют, чтобы получить четырехточечные кривые калибровки. Площадь пика при оптимальной длине волны для каждого исследуемого соединения определяют автоматически методом ультрабыстрой жидкостной хроматографии. Определение площадей пиков и времен удерживания на основании исходных данных осуществляется автоматически. На основании значений четырех концентраций и соответствующих им площадей пиков рассчитывают наклон и пересечение с осями калибровочной кривой. Коэффициент корреляции полученной линии регрессии должен превышать 0,99. На втором этапе из маточных растворов в ДМСО готовят растворы образца в двух повторах. ДМСО удаляют на испарителе. После упаривания твердые осадки вещества растворяют в 0,05 М фосфатном буфере (pH 6,5), 1 ч перемешивают и затем еще 2 ч встряхивают. После того как полученные растворы постоят одну ночь (около 20 ч), их фильтруют с использованием микро планшета для титрования. Фильтрат и его десятикратные разведения затем автоматически анализируют методом высоко-эффективной жидкостной хроматографии (ВЭЖХ). Площади пиков и времена удерживания образцов определяют при той же длине волны, что и при калибровке. Растворимость рассчитывают по следующему уравнению:S=(A-b)/a(10 для образца, разбавленного в отношении 1/10),где S представляет собой растворимость в мкг/мл; А - площадь пика образца; а - наклон иb - пересечение калибровочной кривой. Так как этот метод не является оптимальным для растворимости, значительно меньшей 1 мкг/мл,соединениям, у которых пик не был обнаружен при максимальном разведении (что означает растворимость, значительно меньшую 1 мкг/мл) присвоено значение (1). Соединение сравнения 106 уравновесили в течение 24 ч в 0,05 М фосфатном буфере (pH 6,5) способом, идентичным выполняемому в ходе анализа LYSA. Количество растворенного вещества непосредственно определили обычным методом ВЭЖХ вручную. Анализ спонтанного присоединения глутатиона. 10 мкМ исследуемого вещества растворили в фосфатном буфере при pH 7,4 и 24 ч инкубировали с 5 мМ GSH (глутатионом) при комнатной температуре. Образцы затем проанализировали на массспектрометре и определили, образовался ли аддукт между веществом и глутатионом. Образцы, для которых удалось четко определить массу ковалентного аддукта (М+307), получили пометку FLAG (положительные). Если аддукт не был обнаружен, делалась пометка NO FLAG (отрицательные). Соединения формулы I характеризуются наличием ценных терапевтических свойств. Их можно применять для лечения или профилактики расстройств, связанных с аллостерическими модуляторами рецептора mGluR5. Наиболее предпочтительными показаниями для соединений - аллостерических модуляторов являются шизофрения и когнитивные расстройства. Настоящее изобретение относится к соединениям формулы I и их фармацевтически приемлемым солям, к этим соединениям как фармацевтически активным веществам, к способам их получения, а также к их применению при лечении или профилактике расстройств, связанных с аллостерическими модуляторами рецептора mGluR5, таких как шизофрения и когнитивные расстройства, и к фармацевтическим композициям, содержащим соединения формулы I. Далее приводятся определения общих терминов, используемых в настоящем описании по отдельности или совместно. Термин "галоген" означает хлор, бром, иод или фтор. Термин "фармацевтически приемлемая соль" или "фармацевтически приемлемая соль присоедине-4 025165 ния кислоты" обозначает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и подобные им. Одно воплощение изобретения представляет собой соединения формулы где R1 представляет собой водород или фтор;m означает 1 или 2; или их фармацевтически приемлемые соли присоединения кислоты, рацемические смеси или соответствующие энантиомеры и/или оптические изомеры. Далее приведены примеры соединения формулы I: Получение соединения формулы I по настоящему изобретению можно осуществить путем последовательного или параллельного проведения этапов синтеза. Синтез соединений по изобретению представлен на схемах 1 и 2. Специалисты в уровне техники достаточно квалифицированы, чтобы провести реакцию и очистить полученные продукты. Заместители и индексы, указанные в следующем далее описании способов по изобретению, соответствуют приведенным выше определениям. Соединения формулы I можно изготовить способами, описанными далее, способами, представленными в примерах, или аналогичными. Условия, требуемые для проведения отдельных этапов реакции,известны специалистам в уровне техники. Последовательность реакций не ограничена изображенной на схемах, в зависимости от исходных материалов и их соответствующей реактивности, последовательность этапов реакции можно свободно менять. Исходные материалы либо доступны коммерчески, либо могут быть получены способами, аналогичными описанным ниже, способами, изложенными в ссылках, которые процитированы в описании и примерах, либо способами, известными в уровне техники. Представленные соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными в уровне техники, например вариантом описанного далее способа, включающим взаимодействие соединения формулы II где X представляет собой атом галогена, выбранный из брома или иода,с подходящим арилацетиленом формулы III с образованием соединения формулы I где заместители описаны выше, или,если это необходимо, преобразование полученного соединения в фармацевтически приемлемые соли присоединения кислоты. Более подробно получение соединения формулы I описано на схемах 1 и 2 и в примерах 1-11. Схема 1 Галопиримидиновое соединение формулы II можно получить катализируемой палладием реакцией соответствующего дигалогенированного пиримидина, такого как 2-бром-5-иод-пиримидин, и бициклической мочевины формулы 5 (схема 1). Взаимодействие 2-хлор- или 2-фтор-пиримидина с бромом или иодом в пятом положении с бициклической мочевиной формулы 5 также может приводить к образованию соединения формулы II, для этого проводят ароматическое нуклеофильное замещение в основных условиях, например, действием NaH в ТГФ или карбоната цезия в ДМФ. Соединение формулы 5 можно получить, начиная от защищенной требуемым образом цис-2-аминоциклоалкил-1-карбоновой кислоты формулы 1, которую затем через ацилазидный интермедиат превращают в соответствующий изоцианат 2(перегруппировка Курциуса), после чего циклизуют с образованием бициклической мочевины 3. Свободную NH-группу 3 можно алкилировать по стандартной методике с образованием соединения 4, с которого затем снимают защиту и получают бициклическую мочевину 5. Чтобы получить оптически чистый интермедиат, можно начинать с оптически чистой защищенной кислоты формулы 1 или разделить рацемическую смесь на любой стадии синтеза способами, известными специалисту в уровне техники. Схема 2 Соединение формулы II (X = Br, I) может взаимодействовать с подходящим арилацетиленом формулы III с образованием соединения формулы I, заместители которого описаны выше, a m соответствует 1 или 2. Описанные в настоящем документе соединения формулы I, а также их фармацевтически приемлемые соли применяют для лечения или профилактики психоза, эпилепсии, шизофрении, болезни Альцгеймера, когнитивных расстройств и нарушений памяти, хронической и острой боли, нарушений в работе мозга, вызванных операциями шунтирования или трансплантацией, плохого кровоснабжения мозга,повреждения спинного мозга и головы, вызванной беременностью гипоксии, остановки сердца и гипогликемии, ишемии, хореи Хантингтона, амиотропного латерального склероза (АЛС), вызванной СПИДом деменции, повреждений глаз, ретинопатии, идиопатического паркинсонизма или паркинсонизма, вызванного приемом лекарств, мышечных спазмов, конвульсий, мигрени, недержания мочи, желудочнокишечного рефлюкса, повреждений печени или печеночной недостаточности, вызванной заболеванием или приемом лекарств, синдрома фрагильной X-хромосомы, туберозного склероза, синдрома Дауна, аутизма, никотиновой зависимости, опиатной зависимости, тревожности, рвоты, дискинезии, пищевых расстройств, в частности нервной булимии и анорексии, а также депрессий, в особенности, для лечения и профилактики острых и/или хронических неврологических расстройств, тревожности, лечения хронической и острой боли, недержания мочи и ожирения. Предпочтительными показаниями является шизофрения и когнитивные расстройства. Настоящее изобретение относится также к применению описанного здесь соединения формулы I и его фармацевтически приемлемой соли для изготовления лекарства, предпочтительно для лечения и профилактики вышеназванных заболеваний. Описания и результаты биологических анализов. Анализ мобилизации внутриклеточного Ca2+. Создали моноклональную HEK-293 клеточную линию, стабильно трансфицированную кДНК, кодирующей рецептор mGlu5a человека; для работы с положительными аллостерическими модуляторами(ПАМ) mGlu5 была выбрана клеточная линия с низким уровнем экспрессии рецепторов и низкой встроенной активностью рецепторов, которая позволяет различить действие агонистов и ПАМ. Клетки растили в соответствии со стандартными протоколами (Freshney, 2000) в среде Dulbecco's Modified Eagle Medium с высоким содержанием глюкозы и 1 mM глутамина, с добавлением 10 об.% инактивированной термообработкой телячьей сывороткой, 50 мкг/мл гигромицина и 15 мкг/мл бластицидина (все реагенты и антибиотики для работы с клеточной линии приобретены в компании "Инвитроген", Базель, Швейцария). Приблизительно за 24 ч до начала эксперимента 5104 клеток/ячейку высеяли в покрытые поли-Oлизином 96-лучночные планшеты с черным/прозрачным дном. Клетки в течение 1 ч при 37C загружали 2,5 мкМ фторо-4 АМ в загрузочном буфере (1HBSS, 20 мМ HEPES), после чего их пять раз промыли загрузочным буфером. После этого клетки перенесли в функциональную систему скрининга лекарственных препаратов (Functional Drug Screening System 7000, "Хамаматсу", Париж, Франция), к ним добавили 11 последовательных полулогарифмических последовательных разведений исследуемых соединений при 37C, после чего 10-30 мин инкубировали при непрерывной регистрации флуоресценции. По завершении этого этапа предварительной инкубации к клеткам добавили агонист L-глутамат в концентрации, соответствующей EC20 (как правило, около 80 мкМ) при непрерывной регистрации флуоресценции; чтобы учесть суточные колебания в ответе клеток, непосредственно перед началом каждого эксперимента определяли значение EC20 глутамата, для чего для него записывали полную кривую доза-ответ. Ответы измеряли как повышение пика флуоресценции (за вычетом базового уровня, то есть флуоресценции без добавления L-глутамата), нормализованное на максимальный стимулирующий эффект,полученный для насыщающей концентрации L-глутамата. Графики зависимости процента от максимальной стимулирующей активности строили с использованием XLfit, программы для проведения кривой по точкам, итеративно строящей график по алгоритму Левенбурга - Марквардта. Конкурентное ингибирование по одному сайту анализировали с помощью уравнения y = A + B-A)/(1+x/C)D, где y соответ-7 025165 ствует % от максимального стимулирующего эффекта, А минимальному значению y, В максимальному значению y, С представляет собой EC50, а x десятичный логарифм от концентрации конкурирующего соединения, D соответствует наклону кривой (коэффициент Хилла). На основании этих кривых были рассчитаны значения EC50 (концентрация, при которой достигается 50% от максимального насыщения),коэффициент Хилла, а также максимальный ответ, выраженный в процентах от максимального стимулирующего эффекта, полученного для насыщающей концентрации L-глутамата. Положительные сигналы, полученные в ходе предварительной инкубации с соединениями, исследуемыми на ПАМ (то есть перед введением L-глутамата в концентрации EC20) свидетельствуют об активности как агониста, отсутствие таких сигналов означает отсутствие этой активности. Уменьшение сигнала после введения L-глутамата в концентрации EC20 означает ингибирующую активность исследуемого соединения. Следующий далее список примеров демонстрирует соответствующие результаты для соединений с Соединения формулы (I) и их фармацевтически приемлемые соли можно применять как лекарства,например, в форме фармацевтических препаратов. Фармацевтические препараты можно вводить перорально, например, в форме таблеток, покрытых оболочкой таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако, введение можно осуществлять еще и ректально,например, в форме суппозиториев, или парентерально, например, в форме растворов для инъекций. Для получения лекарственных препаратов соединения формулы (I) и их фармацевтически приемлемые соли могут обрабатываться совместно с фармацевтически инертными неорганическими или органическими носителями. В качестве таких носителей для получения таблеток, покрытых оболочкой таблеток, драже и твердых желатиновых капсул могут использоваться лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли и им подобные. Для мягких желатиновых капсул подходят, например, такие носители, как растительные масла, воски, жиры, полутвердые и жидкие полиолы и подобные им; однако в зависимости от природы действующего вещества, обычно в случае мягких желатиновых капсул, носители не требуются. Подходящими носителями для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар, глюкоза и подобные им. Для приготовления предназначенных для инъекций водных растворов водорастворимых солей соединения формулы (I) могут применяться такие адъюванты, как спирты, полиолы, глицерин, растительные масла и подобные им, но, как правило, необходимости в них не возникает. Подходящими носителями для приготовления суппозиториев являются, например, природные или гидрогенизированные масла,воски, жиры, полужидкие или жидкие полиолы и подобные им. Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажнители, эмульсификаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать и другие терапевтически ценные вещества. Как уже упоминалось, целью настоящего изобретения также являются лекарственные средства, содержащие соединение формулы (I) или его фармацевтически приемлемые соли, и терапевтически инертный носитель, а также способ получения таких лекарственных средств, включающий введение одного или более соединений формулы I или их фармацевтически приемлемых солей и, при необходимости,одного или более других терапевтически ценных веществ, в галеновую лекарственную форму совместно с одним или более терапевтически инертным носителем. Кроме того, как также упоминалось ранее, целью настоящего изобретения также является применение соединения формулы (I) для получения лекарственных средств, полезных при профилактике и/или лечении вышеупомянутых заболеваний. Дозировка колеблется в широких пределах и, разумеется, подбирается с учетом индивидуальных потребностей в каждом конкретном случае. В целом, эффективная дозировка для перорального или парентерального введения находится в интервале от 0,01 до 20 мг/кг/день, причем для всех описанных показаний предпочтительной является дозировка 0,1-10 мг/кг/день. Суточная доза для взрослого человека весом 70 кг соответственно лежит в интервале от 0,7 до 1400 мг в день, предпочтительно от 7 до 700 мг в день. Получение фармацевтических композиций, содержащих соединения по изобретению. Таблетки представленного ниже состава получают обычным способом, мг/таблетку:(рац)-(3aSR,6aRS)-2-оксо-гексагидроциклопентаимидазол-1 Раствор (рац)-цис-2-(трет-бутоксикарбониламино)циклопентапекарбоновой кислоты (CAS: 13631570-3) (2,28 г, 9,98 ммоль) и N-метилморфолина (1,1 г, 1,21 мл, 11,0 ммоль, 1,1 экв.) 10 мин перемешивали в 28 мл дихлорэтана при комнатной температуре. После этого в систему по каплям при комнатной температуре добавили азид дифенилфосфорной кислоты (3,02 г, 2,37 мл, 11,0 ммоль, 1,1 экв.), и бесцветный раствор 45 мин перемешивали при комнатной температуре, цвет раствора за это время стал светложелтым. Раствор нагрели до 75C, перемешивали в течение ночи и позволили остыть. После обработки смесью дихлорметан/вода объединенные органические фазы упарили до сухого состояния. Оранжевый твердый осадок растерли в порошок с этилацетатом и профильтровали с получением 1,27 г белого твердого вещества. Исходный раствор сконцентрировали, и выпавшее в осадок вещество профильтровали еще раз, получив дополнительно 0,55 г продукта. Указанное в заголовке соединение получено в виде кристаллического белого твердого вещества с общим выходом 1,82 г (81%), MS: m/e = 227,3 (М+Н+). Этап 2. трет-Бутиловый эфир (рац)-(3aSR,6aRS)-3-этил-2-оксо-гексагидроциклопентаимидазол-1 карбоновой кислоты К раствору трет-бутилового эфира (3aSR,6aRS)-2-оксо-гексагидроциклопентаимидазол-1 карбоновой кислоты (пример 1, этап 1) (1,50 г, 6,63 ммоль) в 25 мл ДМФ добавили 60% суспензию гидрида натрия в минеральном масле (207 мг, 8,62 ммоль, 1,3 экв.). Суспензию 45 мин перемешивали при комнатной температуре (выделение газа), после чего добавили иодэтан (1,34 г, 0,696 мл, 8,62 ммоль, 1.3 экв.), и смесь перемешивали при комнатной температуре в течение ночи. После концентрирования в вакууме и обработки системой этил ацетат/вода получили 1,60 г желтого масла, содержащего капли минерального масла, которое непосредственно использовали на следующем этапе без дополнительной характеризации. К раствору трет-бутилового эфира (3aSR,6aRS)-3-этил-2-оксо-гексагидроциклопентаимидазол-1 карбоновой кислоты (пример 1, этап 2) (1,60 г, 6,29 ммоль) в 15 мл дихлорметана добавляли трифторуксусную кислоту (5,74 г, 3,9 мл, 50,3 ммоль, 8 экв.) и 15 ч перемешивали желтый раствор при комнатной температуре. Реакционную смесь погасили насыщенным раствором бикарбоната натрия и довели pH водной фазы до 9. После обработки системой дихлорметан/вода органические фазы высушили, профильтровали и сконцентрировали в вакууме с получением 0,801 г желтого масла, которое непосредственно использовали на следующем этапе без дополнительного исследования. Этап 4. (рац)-(3aSR,6aRS)-1-(5-Бромпиримидин-2-ил)-3-этилгексагидроциклопентаимидазол-2-он(340 мг,1,19 ммоль),(3aR,6aS)-1 этилгексагидроциклопента[d]имидазол-2(1H)-он (пример 1, этап 3) (184 мг, 1,19 ммоль, 1,0 экв.), 622 мг карбоната цезия (1,9 ммоль, 2 экв.), и 4,5-бис(дифенилфосфино)-9,9-диметилксантена (ксантфоса) 28 мг,0,048 ммоль, 0,04 экв.) в 8 мл толуола в атмосфере аргона добавляли трис(дибензилиденацетон)дипалладий(0) (Pd2(dba)3) (22 мг, 0,024 ммоль, 0,02 экв.). Смесь одну ночь перемешивали при 50C. Затем ее непосредственно загрузили на 20 г силикагелевую колонку и элюировали градиентом 20-80% этилацетата в гептане с получением указанного в заголовке соединения (229 мг, 62%) в виде светло-коричневого твердого вещества, MS: m/e = 311,1, 313,0 (М+Н+). Этап 5.(рац)-(3aRS,6aSR)-1-Этил-3-(5-фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он. В пробирке для микроволновой печи растворяли 80 мг (0,26 ммоль) (рац)-1-(5-бромпиримидин-2 ил)-3-этилгексагидроциклопента[d]имидазол-2(1H)-она (пример 1, этап 4) в 3 мл ДМФ. Через раствор продули аргон. В систему добавили этинилбензол (57 мкл, 53 мг, 0,52 ммоль, 2 экв.), бис(трифенилфосфин)палладий(II) хлорид (9 мг, 0,013 ммоль, 0,05 экв.), иодид меди(I) (1,5 мг, 7,7 мкмоль,0,03 экв.), трифенилфосфин (2,0 мг, 7,7 мкмоль, 0,03 экв.) и 107 мкл триэтиламина (78 мг, 0,77 ммоль, 3 экв.). Темно-коричневый раствор одну ночь перемешивали при 75C, адсорбировали на диоксиде кремния и очищали флэш-хроматографией (силикагель, 20 г, градиент 0-80% EtOAc в гептане) с получением 72,7 мг (85%) указанного в заголовке соединения в виде коричневого твердого вещества, MS: m/e = 333,3(М+Н+). Этап 6. (-)-(3aR,6aS)-1-Этил-3-(5-фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2 он. Рацемическую смесь (-)-(3aR,6aS)- и (+)-(3aS,6aR)-1-этил-3-(5-фенилэтинилпиримидин-2 ил)гексагидроциклопентаимидазол-2-она (70 мг) разделили методом хиральной ВЭЖХ (Reprosil ChiralNR - 550 см, 20 мкМ; 40% этанол/гептан, 35 мл/мин, 18 бар). Пики определяли на УФ-детекторе и детекторе оптического вращения (ДОВ), у одного пика получен отрицательный сигнал -)-энантиомер), а у другого положительный сигнал +)-энантиомер). (-)-Энантиомер (30,5 мг) получили в виде грязнобелого твердого вещества, MS: m/e = 333,3 (М+Н+). Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 5, начиная от (рац)-1-(5-бромпиримидин-2-ил)-3-этилгексагидроциклопента[d]имидазол-2(1H)-она (при- 10025165+/-)-(3aRS,6aSR)-1-этил-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2 он), в виде светло-коричневого вещества, MS: m/e = 351,3 (М+Н+); эту смесь затем разделили методом хиральной ВЭЖХ в тех же условиях, которые были описаны в примере 1, этап 6, с получением энантиомерно чистого энантиомера (-)-(3aR,6aS)-1-этил-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-она в виде светло-желтого полутвердого вещества; MS: m/e = 351,3 (М+Н+),и его энантиомера Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 5, начиная от (рац)-1-(5-бромпиримидин-2-ил)-3-этилгексагидроциклопента[d]имидазол-2(1H)-она (пример 1, этап 4) и 1-этинил-4-фторбензола с получением рацемической смеси +/-)-(3aRS,6aSR)-1-этил-3(5-(4-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он) в виде грязно-белого твердого вещества; MS: m/e = 351,3 (М+Н+). Разделение методом хиральной ВЭЖХ в тех же условиях,которые были описаны в примерах 1 и 2, привело к получению энантиомерно чистых энантиомеров (-)(3aR,6aS)-1-этил-3-(5-(4-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-она в виде грязно-белого твердого вещества; MS: m/e = 351,3 (М+Н+) и (+)-(3aS,6aR)-1-этил-3-(5-(4 фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-она в виде грязно-белого твердого вещества; MS: m/e = 351,3 (М+Н+). Пример 4. (-)-(3aR,6aS)-1-Этил-3-(5-(2,5-дифторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 5, начиная от (рац)-1-(5-бромпиримидин-2-ил)-3-этилгексагидроциклопента[d]имидазол-2(1 Н)-она (пример 1, этап 4) и 1-этинил-2,5-дифторбензола с получением рацемической смеси +/-)-(3aRS,6aSR)-1 этил-3-(5-(2,5-дифторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он) в виде светлокоричневого твердого вещества; MS: m/e = 369,2 (М+Н+). Разделение методом хиральной ВЭЖХ в тех же условиях, которые были описаны в примере 1, привело к получению энантиомерно чистых энантиомеров(рац)-(3aSR,6aRS)-3-(2-метоксиэтил)-2-оксо Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 2, начиная от трет-бутилового эфира (рац)-(3aSR,6aRS)-2-оксо-гексагидроциклопентаимидазол-1 карбоновой кислоты (пример 1, этап 1), и с использованием 1-бром-2-метоксиэтана вместо иодэтана,продукт представлял собой светло-желтое масло, которое непосредственно использовали на следующем этапе без дополнительной характеризации. Этап 2. (рац)-(3aRS,6aSR)-1-(2-Метоксиэтил)гексагидроциклопентаимидазол-2-он Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 3,начиная от трет-бутилового эфира(рац)-(3aSR,6aRS)-3-(2-метоксиэтил)-2-оксогексагидроциклопентаимидазол-1-карбоновой кислоты (пример 10, этап 1), продукт представлял собой светло-желтое масло, которое непосредственно использовали на следующем этапе без дополнительной характеризации. Этап 3. Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 4, взаимодействие проводили между трет-бутиловым эфиром (рац)-(3aSR,6aRS)-3-(2-метоксиэтил)-2 оксо-гексагидроциклопентаимидазол-1-карбоновой кислоты (пример 10, этап 2) и 2-бром-5 иодпиримидином с получением требуемого продукта в виде светло-коричневого твердого вещества, MS:m/e = 341,0, 343,1 (М+Н+). Этап 4. (рац)-(3aRS,6aSR)-1-(2-Метоксиэтил)-3-(5-фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он. Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 5, начиная от (рац)-(3aSR,6aRS)-1-(5-бромпиримидин-2-ил)-3-(2-метоксиэтил)гексагидроциклопентаимидазол-2-она (пример 10, этап 3) и этинилбензола с получением рацемической смеси (рац)(3aRS,6aSR)-1-(2-метоксиэтил)-3-(5-фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-она в виде светло-желтого масла; MS: m/e = 363,3 (М+Н+). Этап 5. (-)-(3aR,6aS)-1-(2-Метоксиэтил)-3-(5-фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он. Смесь разделили методом хиральной ВЭЖХ в тех же условиях, которые были описаны в примере 1,получив энантиомерно чистые энантиомеры(-)-(3aR,6aS)-1-(2-метоксиэтил)-3-(5-фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он в виде аморфного твердого вещества желтого цвета, MS: m/e = 363,3 (М+Н+) и (+)-(3aS,6aR)-1-(2-метоксиэтил)-3-(5-фенилэтинилпиримидин-2 ил)гексагидроциклопентаимидазол-2-он в виде аморфного твердого вещества желтого цвета, MS: m/e = 363,3 (М+Н+). Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 5,начиная от(рац)-(3aSR,6aRS)-1-(5-бромпиримидин-2-ил)-3-(2-метоксиэтил)гексагидроциклопентаимидазол-2-она (пример 5, этап 3) и 1-этинил-3-фторбензола с получением рацемической смеси +/-)-(3aRS,6aSR)-1-(2-метоксиэтил)-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-она в виде светло-коричневого масла, MS: m/e = 381,3 (М+Н+), которую затем разделили методом хиральной ВЭЖХ в тех же условиях, которые были описаны в примере 1, получив энантиомерно чистые энантиомеры (-)-(3aR,6aS)-1-(2-метоксиэтил)-3-(5-(3-фторфенилэтинилпиримидин-2 ил)гексагидроциклопентаимидазол-2-он в виде аморфного твердого вещества желтого цвета, MS: m/e = 381,3 (М+Н+), и (+)-(3aS,6aR)-1-(2-метоксиэтил)-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он в виде аморфного твердого вещества желтого цвета, MS: m/e = 381,3 (М+Н+). Пример 7. (-)-(3aR,6aS)-1-(2-Метоксиэтил)-3-(5-(4-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 5, начиная от (рац)-1-(5-бромпиримидин-2-ил)-3-(2-метоксиэтил)гексагидроциклопента[d]имидазол 2(1 Н)-она (пример 5, этап 3) и 1-этинил-4-фторбензола с получением рацемической смеси +/-)(3aRS,6aSR)-1-(2-метоксиэтил)-3-(5-(4-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-она в виде грязно-белого твердого вещества; MS: m/e = 381,3 (М+Н+). Разделение методом хиральной ВЭЖХ в тех же условиях, которые были описаны в примере 1, позволило получить энантиомерно чистые энантиомеры Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 5, начиная от (рац)-1-(5-бромпиримидин-2-ил)-3-(2-метоксиэтил)гексагидро-циклопента[d]имидазол 2(1 Н)-она (пример 5, этап 3) и 1-этинил-2,5-дифторбензола с получением рацемической смеси +/-)(3aRS,6aSR)-1-(2-метоксиэтил)-3-(5-(2,5-дифторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-она в виде светло-коричневого твердого вещества, MS: m/e = 399,2 (М+Н+). Разделение методом хиральной ВЭЖХ в тех же условиях, которые были описаны в примере 1, позволило получить энантиомерно чистые энантиомеры(рац)-(3aSR,6aRS)-3-(3-метоксипропил)-2-оксо Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 2, начиная от трет-бутилового эфира (рац)-(3aSR,6aRS)-2-оксо-гексагидроциклопентаимидазол-1 карбоновой кислоты (пример 1, этап 1), а вместо иодэтана применяли 1-бром-3-метоксипропан, в результате получили требуемое соединение в виде светло-желтого масла, которое непосредственно использовали на следующем этапе без дополнительной характеризации. Этап 2. (рац)-(3aRS,6aSR)-1-(3-Метоксипропил)гексагидроциклопентаимидазол-2-он Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 3,начиная от трет-бутилового эфира(рац)-(3aSR,6aRS)-3-(3-метоксипропил)-2-оксогексагидроциклопентаимидазол-1-карбоновой кислоты (пример 9, этап 2) с получением требуемого продукта в виде светло-коричневого масла, которое непосредственно использовали на следующем этапе без дополнительной характеризации. Этап 3. (рац)-(3aRS,6aSR)-1-(3-Метоксипропил)-3-(5-фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он. В 10-мл пирекс-пробирке в 2 мл толуола растворили 2-бром-5-(фенилэтинил)пиримидин (CAS: 1338493-52-9)(рац)-(3aRS,6aSR)-1-(3-метоксипропил)гексагидроциклопентаимидазол-2-он (68,0 мг, 309 мкмоль, 1,0 экв.). В систему добавили карбонат цезия (201 мг, 618 мкмоль, 2,0), ксантфос (7,15 мг, 12,4 мкмоль, 0,04 экв.) и Pd2(dba)3 (5,65 мг, 6,18 мкмоль, 0,02 экв.), после чего 3 ч перемешивали красно-коричневую реакционную смесь при 90C. Смесь затем профильтровали, адсорбировали на диоксиде кремния и очистили флэш-хроматографией(силикагель, 20 г с 1 г Silica-NH2, градиент 30-100% EtOAc в гептане, 301 нм) с получением указанного в заголовке соединения в виде желтого масла; MS: m/e = 377,6 (М+Н+). Этап 5. (-)-(3aR,6aS)-1-(3-Метоксипропил)-3-(5-фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он. Разделение методом хиральной ВЭЖХ в тех же условиях, которые были описаны в примере 1, позволило получить энантиомерно чистые энантиомеры (-)-(3aR,6aS)-1-(3-метоксипропил)-3-(5 фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он в виде аморфного твердого вещества желтого цвета;(+)-(3aS,6aR)-1-(3-метоксипропил)-3-(5 фенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он в виде аморфного твердого вещества желтого цвета; MS: m/e = 377,6 (М+Н+). Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 4, осуществив реакцию трет-бутилового эфира (рац)-(3aSR,6aRS)-3-(3-метоксипропил)-2-оксогексагидроциклопентаимидазол-1-карбоновой кислоты (пример 9, этап 2) и 2-бром-5-иодпиримидина; после обработки и очистки флэш-хроматографией (силикагель, градиент 35-90% EtOAc в гептане) исходный продукт получили в виде желтого масла, которое непосредственно использовали на следующем этапе без дополнительной характеризации. Этап 2. (-)-(3aR,6aS)-1-(3-Метоксипропил)-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он. Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 5,начиная от(рац)-(3aSR,6aRS)-1-(5-бромпиримидин-2-ил)-3-(3-метоксипропил)гексагидроциклопентаимидазол-2-она и 1-этинил-3-фторбензола с получением рацемической смеси +/-)(3aRS,6aSR)-1-(3-метоксипропил)-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-она в виде коричневого масла; MS: m/e = 395,6 (М+Н+), которое затем разделили методом хиральной ВЭЖХ в тех же условиях, которые были описаны в примере 1, получив энантиомерно чистые энантиомеры (-)-(3aR,6aS)-1-(3-метоксипропил)-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он в виде оранжевого масла; MS: m/e = 395,6 (М+Н+) и (+)-(3aS,6aR)-1-(3 метоксипропил)-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он в виде оранжевого масла; MS: m/e = 395,6 (М+Н+). Пример 11. (-)-(3aR,6aS)-1-(3-Метоксипропил)-3-(5-(4-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он Указанное в заголовке соединение получили в соответствии с общей методикой из примера 1, этап 5, начиная от (рац)-(3aSR,6aRS)-1-(5-бромпиримидин-2-ил)-3-(3-метоксипропил)гексагидроциклопентаимидазол-2-она и 1-этинил-4-фторбензола с получением рацемической смеси +/-)-(3aRS,6aSR)-1-(3 метоксипропил)-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-она в виде коричневого масла; MS: m/e = 395,6 (М+Н+), которое затем разделили методом хиральной ВЭЖХ в тех же условиях, которые были описаны в примере 1, получив энантиомерно чистые энантиомеры (-)(3aR,6aS)-1-(3-метоксипропил)-3-(5-(3-фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он в виде оранжевого масла; MS: m/e = 395,6 (М+Н+) и (+)-(3aS,6aR)-1-(3-метоксипропил)-3-(5-(3 фторфенилэтинилпиримидин-2-ил)гексагидроциклопентаимидазол-2-он в виде оранжевого масла; MS: ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные этинила формулы I где R1 представляет собой водород или галоген;m означает 1 или 2; или их фармацевтически приемлемые соли присоединения кислоты и/или стереоизомеры. 2. Производные этинила формулы I по п.1 где R1 представляет собой водород или фтор;m означает 1 или 2; или их фармацевтически приемлемые соли присоединения кислоты и/или стереоизомеры. 3. Производные этинила формулы I по любому из пп.1, 2, где соединения представляют собой(-)-(3aR,6aS)-1-(3-метоксипропил)-3-(5-(4-фторфенилэтинилпиримидин-2 ил)гексагидроциклопентаимидазол-2-он. 4. Фармацевтическая композиция, обладающая активностью аллостерического модулятора подтипа 5 метаботропного глутаматного рецептора (mGluR5), содержащая по меньшей мере одно соединение по любому из пп.1-3 или его фармацевтически приемлемую соль присоединения кислоты. 5. Применение соединения по любому из пп.1-3 в качестве аллостерического модулятора подтипа 5 метаботропного глутаматного рецептора (mGluR5). 6. Применение соединения по любому из пп.1-3 в виде смеси энантиомеров, диастереомеров или в энантиомерно чистой форме, а также его фармацевтически приемлемой соли присоединения кислоты в качестве аллостерического модулятора подтипа 5 метаботропного глутаматного рецептора (mGluR5). 7. Применение соединения по любому из пп.1-3 или его фармацевтически приемлемой соли присоединения кислоты для изготовления лекарственного средства для лечения или профилактики заболе- 16025165 ваний, связанных с аллостерическими модуляторами рецепторов mGluR5. 8. Применение по п.7 для лечения или профилактики шизофрении, когнитивных расстройств, синдрома фрагильной Х-хромосомы или аутизма. 9. Применение соединения по любому из пп.1-3 для лечения или профилактики шизофрении, когнитивных расстройств, синдрома фрагильной X-хромосомы или аутизма. 10. Способ лечения шизофрении, когнитивных расстройств, синдрома фрагильной Х-хромосомы или аутизма, включающий введение эффективного количества соединения по любому из пп.1-3.
МПК / Метки
МПК: A61K 31/506, C07D 403/04
Метки: арилэтинилпиримидины
Код ссылки
<a href="https://eas.patents.su/18-25165-ariletinilpirimidiny.html" rel="bookmark" title="База патентов Евразийского Союза">Арилэтинилпиримидины</a>
Предыдущий патент: Соединение гуанидинобензойной кислоты
Следующий патент: Производные пиридина
Случайный патент: Композиция из биомассы для покрытия частиц удобрения или корма для животных, способ ее получения, удобрение и корм для животных