Применение частиц носителя диоксида кремния для улучшения технологических характеристик фармацевтического агента
Номер патента: 22950
Опубликовано: 31.03.2016
Авторы: Йу Ричард, Олияй Реза, Меннинг Марк М., Кирни Брайан П., Матиас Анита А., Козиара Джоанна М., Стрикли Роберт Г.
Формула / Реферат
1. Фармацевтическая композиция, содержащая множество частиц диоксида кремния, имеющих одну или более пор, и соединение формулы (I)
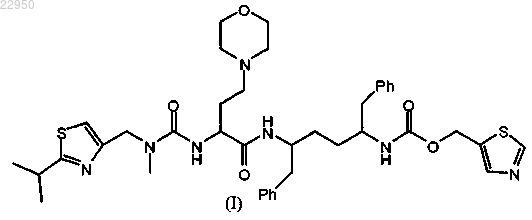
или его фармацевтически приемлемую соль, нанесенные на частицы диоксида кремния, причем гигроскопичность частиц диоксида кремния и соединения формулы (I) выше, чем гигроскопичность смеси соединения/частиц диоксида кремния.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что прессуемость композиции выше, чем прессуемость множества частиц твердого носителя.
3. Фармацевтическая композиция по п.1, отличающаяся тем, что частицы диоксида кремния имеют средний диаметр от примерно 10 до примерно 120 мкм и удельную поверхность, определенную по методу БЭТ, от примерно 40 до примерно 400 м2/г и каждая из множества частиц диоксида кремния имеет одну или более пор.
4. Фармацевтическая композиция по п.3, отличающаяся тем, что диоксид кремния представляет собой гидрофильный высокодисперсный диоксид кремния.
5. Фармацевтическая композиция по любому из пп.3, 4, отличающаяся тем, что частицы диоксида кремния имеют средний диаметр 20-40 мкм.
6. Фармацевтическая композиция по любому из пп.3-5, отличающаяся тем, что частицы диоксида кремния имеют удельную поверхность, определенную по методу БЭТ, по меньшей мере 150 м2/г.
7. Фармацевтическая композиция по любому из пп.3-6, отличающаяся тем, что соединение формулы (I) покрывает стенки пор и поверхность частиц диоксида кремния.
8. Фармацевтическая композиция по любому из пп.1-5, отличающаяся тем, что массовая доля соединения формулы (I) в расчете на массу частиц диоксида кремния составляет 50±10%.
9. Фармацевтическая композиция по любому из пп.1-8, дополнительно включающая одно или более фармацевтически приемлемых вспомогательных веществ.
10. Фармацевтическая композиция по п.9, которая представлена в лекарственной форме для перорального введения.
11. Фармацевтическая композиция по любому из пп.1-10, отличающаяся тем, что соединение формулы (I) имеет повышенное до 99±1% содержание стереоизомера формулы (Ia)
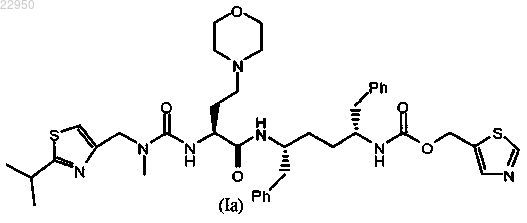
12. Способ получения фармацевтической композиции по любому из пп.1-11, включающий нанесение соединения формулы (I)
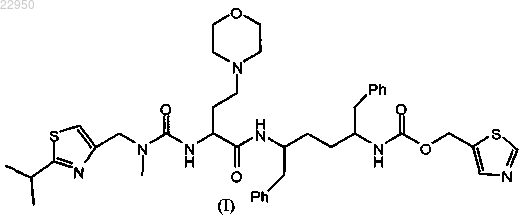
на множество частиц диоксида кремния в присутствии подходящего растворителя с получением смеси, причем гигроскопичность частиц диоксида кремния и соединения формулы (I) выше, чем гигроскопичность комбинации соединения/частиц диоксида кремния.
13. Способ по п.12, отличающийся тем, что прессуемость указанной смеси выше, чем прессуемость множества частиц диоксида кремния.
14. Способ по п.12, отличающийся тем, что частицы диоксида кремния имеют средний диаметр от примерно 10 до примерно 120 мкм и удельную поверхность, определенную по методу БЭТ, от примерно 40 до примерно 400 м2/г и каждая из множества частиц диоксида кремния имеет одну или более пор.
15. Способ по п.14, отличающийся тем, что частицы диоксида кремния представляют собой гидрофильный высокодисперсный диоксид кремния.
16. Способ по п.14 или 15, отличающийся тем, что частицы диоксида кремния имеют средний диаметр 20-40 мкм.
17. Способ по любому из пп.14-16, отличающийся тем, что частицы диоксида кремния имеют удельную поверхность, определенную по методу БЭТ, по меньшей мере 150 м2/г.
18. Способ по любому из пп.14-17, отличающийся тем, что отношение массы соединения формулы (I) к массе частиц диоксида кремния составляет 1.0±0.5.
19. Способ по любому из пп.14-18, отличающийся тем, что растворитель представляет собой (С1-С6)спирт.
20. Способ по любому из пп.14-18, отличающийся тем, что растворитель содержит этанол.
21. Фармацевтическая композиция, полученная способом, описанным в любом из пп.12-20.
22. Таблетка для ингибирования цитохрома Р-450, содержащая 1) соединение формулы (I)
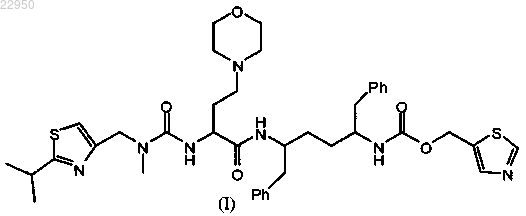
или его фармацевтически приемлемую соль, нанесенные на частицы диоксида кремния; и 2) множество частиц диоксида кремния, причем гигроскопичность частиц диоксида кремния и соединения формулы (I) выше, чем гигроскопичность смеси соединения/частиц диоксида кремния.
23. Таблетка по п.22, отличающаяся тем, что прессуемость таблетки выше, чем прессуемость множества частиц диоксида кремния.
24. Таблетка по п.22, отличающаяся тем, что частицы диоксида кремния имеют средний диаметр от примерно 10 до примерно 120 мкм и удельную поверхность, определенную по методу БЭТ, от примерно 40 до примерно 400 м2/г и каждая из множества частиц диоксида кремния имеет одну или более пор.
25. Таблетка по любому из пп.22 или 24, дополнительно включающая другой терапевтический агент.
26. Таблетка по п.25, отличающаяся тем, что дополнительный терапевтический агент представляет собой дарунавир.
27. Таблетка по п.25, отличающаяся тем, что дополнительный терапевтический агент представляет собой атазанавир.
28. Таблетка по п.25, отличающаяся тем, что дополнительный терапевтический агент представляет собой дизопроксил фумарат тенофовира.
29. Таблетка по п.25, отличающаяся тем, что дополнительный терапевтический агент представляет собой элвитегравир.
30. Таблетка по п.25, отличающаяся тем, что дополнительный терапевтический агент представляет собой эмтрицитабин.
31. Таблетка по п.22, дополнительно включающая 3) микрокристаллическую целлюлозу; 4) гидроксипропилцеллюлозу; 5) кроскармеллозу натрия и 6) стеарат магния.
32. Таблетка по любому из пп.22-31, отличающаяся тем, что соединение формулы (I) имеет повышенное до 99±1% содержание стереоизомера формулы (Ia)
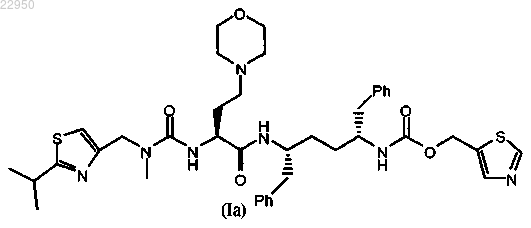
33. Таблетка по любому из пп.24-32, которая содержит примерно 10 мг соединения формулы (I); примерно 115 мг частиц диоксида кремния; примерно 151 мг микрокристаллической целлюлозы; примерно 6 мг гидроксипропилцеллюлозы; примерно 15 мг кроскармеллозы натрия и примерно 3 мг стеарата магния.
34. Таблетка по любому из пп.24-32, которая содержит примерно 25 мг соединения формулы (I); примерно 115 мг частиц диоксида кремния; примерно 136 мг микрокристаллической целлюлозы; примерно 6 мг гидроксипропилцеллюлозы; примерно 15 мг кроскармеллозы натрия и примерно 3 мг стеарата магния.
35. Таблетка по любому из пп.24-32, которая содержит примерно 100 мг соединения формулы (I); примерно 115 мг частиц диоксида кремния; примерно 61 мг микрокристаллической целлюлозы; примерно 6 мг гидроксипропилцеллюлозы; примерно 15 мг кроскармеллозы натрия и примерно 3 мг стеарата магния.
36. Фармацевтическая композиция, содержащая множество частиц диоксида кремния, соединение формулы (Ia)
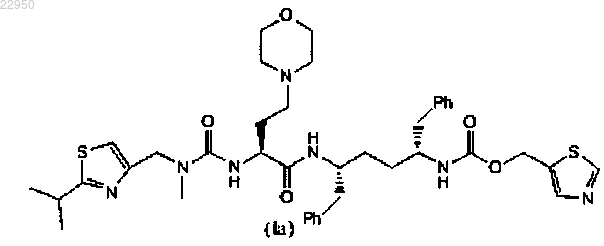
нанесенное на частицы диоксида кремния, дизопроксил фумарат тенофовира, эмтрицитабин и элвитегравир, причем гигроскопичность частиц диоксида кремния и соединения формулы (Ia) выше, чем гигроскопичность смеси соединения формулы (Ia)/частиц диоксида кремния.
37. Фармацевтическая композиция по п.36, отличающаяся тем, что прессуемость указанной композиции выше, чем прессуемость множества частиц твердого носителя.
38. Фармацевтическая композиция по п.36, отличающаяся тем, что частицы диоксида кремния имеют средний диаметр от примерно 10 до примерно 120 мкм и удельную поверхность, определенную по методу БЭТ, от примерно 40 до примерно 400 м2/г и каждая из множества частиц диоксида кремния имеет одну или более пор.
39. Композиция по п.38, отличающаяся тем, что диоксид кремния представляет собой гидрофильный высокодисперсный диоксид кремния.
40. Композиция по любому из пп.38, 39, отличающаяся тем, что частицы диоксида кремния имеют средний диаметр 20-40 мкм.
41. Композиция по любому из пп.38-40, отличающаяся тем, что частицы диоксида кремния имеют удельную поверхность, определенную по методу БЭТ, по меньшей мере 150 м2/г.
42. Композиция по любому из пп.38-41, отличающаяся тем, что соединение формулы (Ia) покрывает стенки пор и поверхность частиц диоксида кремния.
43. Композиция по любому из пп.38-42, отличающаяся тем, что отношение массы соединения формулы (Ia) к массе частиц диоксида кремния составляет 1±0.05%.
44. Композиция по п.38, которая представлена в лекарственной форме для перорального введения.
45. Таблетка для ингибирования цитохрома Р-450, содержащая фармацевтическую композицию по п.36 или 38.
Текст
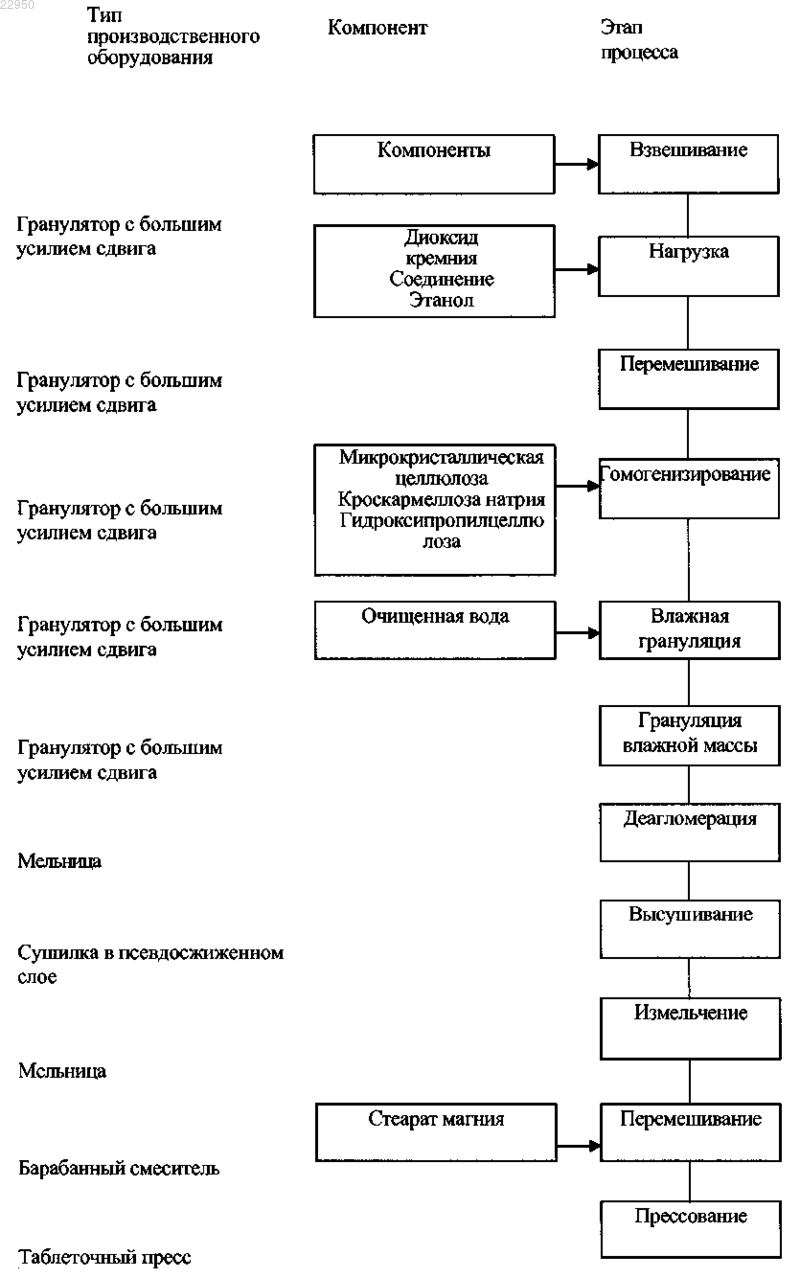
ПРИМЕНЕНИЕ ЧАСТИЦ НОСИТЕЛЯ ДИОКСИДА КРЕМНИЯ ДЛЯ УЛУЧШЕНИЯ ТЕХНОЛОГИЧЕСКИХ ХАРАКТЕРИСТИК ФАРМАЦЕВТИЧЕСКОГО АГЕНТА Согласно изобретению предложена фармацевтическая композиция, содержащая множество частиц диоксида кремния, имеющих одну или более пор, и соединение формулы (I) или его фармацевтически приемлемую соль, нанесенное на частицы диоксида кремния, а также способы ее получения и лекарственные формы, полученные из указанной композиции. Приоритет изобретения Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США 61/049935, поданной 2 мая 2008 г.; предварительной заявке на патент США 61/150655, поданной 6 февраля 2009 г.; и предварительной заявке на патент США 61/150652, поданной 6 февраля 2009 г. Содержание каждой из этих заявок полностью включено в настоящую заявку посредством ссылки. Уровень техники В публикации международной заявки WO 03/037379 раскрыто использование гранулированных материалов на основе полученного пирогенетическим способом диоксида кремния в определенных особых фармацевтических композициях. Также описаны адсорбаты, включающие гранулированный материал и еще одно вещество (например, фармацевтически активный компонент). В публикации международной заявкиWO 2008/010921 раскрыты соединения и фармацевтические композиции, которые улучшают фармакокинетические свойства вводимых вместе с ними лекарственных препаратов путем ингибирования монооксигеназы цитохрома Р-450. Один из таких ингибиторов представляет собой соединение формулы (I) К сожалению, свойства соединения формулы (I) в твердом состоянии создают сложности для его обработки и применения в промышленных масштабах. Например, его низкая температура стеклования,гигроскопичность и отсутствие кристалличности, наряду с его не сыпучей природой, вызывают особые сложности при его обработке и преобразовании в лекарственную форму (например, таблетку). В настоящее время существует необходимость в улучшенных лекарственных формах соединения формулы (I) и усовершенствованных способах обработки и преобразования в лекарственную форму соединения формулы (I) в промышленных масштабах. Такие улучшенные способы могут устранить одну или более из существующих на сегодняшний день проблем, связанных с обработкой соединения и преобразованием его в лекарственную форму. Краткое описание изобретения Когда соединение формулы (I) или его фармацевтически приемлемую соль смешивают с частицами определенного особого твердого носителя (например, производными диоксида кремния), получающаяся в результате комбинация приобретает неожиданным образом улучшенные физические свойства. Например, несмотря на то что как соединение формулы (I), так и исходные материалы коллоидного диоксида кремния в примере 2 являются гигроскопичными по своей природе, получающаяся в результате комбинация имеет сравнительно низкую гигроскопичность. Кроме того, получающаяся в результате комбинация представляет собой сыпучий порошок с высокой способностью к нагрузке для соединения формулы(I), приемлемой физической и химической стабильностью, способностью быстрого высвобождения лекарственного средства и превосходной прессуемостью. Таким образом, получающаяся в результате комбинация может с легкостью быть преобразована в твердые формы дозирования (например, таблетки),обладающие хорошей способностью высвобождения лекарственного средства, низкой ломкостью, хорошей химической и физической стабильностью и низким содержанием остаточных растворителей. Композиции согласно изобретению представляют собой значительное достижение, благодаря которому возможно более интенсивное развитие промышленного производства соединения формулы (I) для применения его в лечении вирусных инфекций, таких как ВИЧ. Соответственно согласно одному варианту реализации изобретения предложена композиция, включающая множество частиц твердого носителя, каждая из которых имеет поверхность и/или поры, и соединение формулы (I) или его фармацевтически приемлемую соль, в порах или на поверхности частиц твердого носителя. Согласно другому варианту реализации изобретения также предложен способ, включающий нанесение соединения формулы (I) в присутствии подходящего растворителя на множество частиц твердого носителя с получением смеси. Такая смесь может использоваться для приготовления фармацевтических лекарственных форм, которые включают соединение формулы (I). Согласно другому варианту реализации изобретения предложена таблетка, включающая 1) соединение формулы (I) и 2) множество частиц твердого носителя. Согласно другому варианту реализации изобретения предложена фармацевтическая композиция,-1 022950 содержащая множество частиц твердого носителя; соединение формулы (Ia); дизопроксил фумарат тенофовира; эмтрицитабин и элвитегравир. Согласно изобретению предложена композиция для применения в медицинских целях (например,для применения при ингибировании цитохрома Р-450 у млекопитающих), а также применение композиции согласно изобретению для получения лекарственного препарата, пригодного для ингибирования цитохрома Р-450 у млекопитающего, такого как человек. Согласно другому варианту реализации изобретения также предложены композиции, полученные в соответствии со способами, описанными в данной заявке. Краткое описание чертежей Фиг. 1 иллюстрирует процесс получения фармацевтической лекарственной формы согласно изобретению, а также способы обработки согласно изобретению; фиг. 2 иллюстрирует данные оценки поглощения воды из примера 2 для типичной композиции согласно изобретению; фиг. 3 иллюстрирует данные оценки прессуемости из примера 3 для типичной композиции согласно изобретению; фиг. 4 иллюстрирует получение фармацевтической лекарственной формы согласно изобретению, а также способы обработки согласно изобретению; фиг. 5 иллюстрирует получение фармацевтической лекарственной формы согласно изобретению, а также способы обработки согласно изобретению; фиг. 6 иллюстрирует получение дополнительных лекарственных форм согласно изобретению, а также дополнительные способы обработки согласно изобретению. Подробное описание изобретения Специалистам в данной области техники будет очевидно, что соединения формулы (I) могут существовать - и могут быть выделены - в оптически активных и рацемических формах. Некоторые соединения могут проявлять полиморфизм. Необходимо понимать, что настоящее изобретение включает любые рацемические, оптически активные, полиморфные или стереоизомерические формы или их смеси, соединения формулы (I), которые обладают полезными свойствами, описанными в настоящей заявке. При этом методы получения оптически активных форм хорошо известны в данной области техники (например, путем разделения рацемической формы с помощью перекристаллизации, путем синтеза из оптически активных исходных материалов, путем хирального синтеза или путем хроматографического разделения с использованием хиральной неподвижной фазы). Согласно одному варианту реализации изобретения соединение формулы (I), которое включено в композиции согласно настоящему изобретению, имеет повышенное содержание стереоизомера формулы который представляет собой тиазол-5-илметил (2R,5R)-5-S)-2-(3-2-изопропилтиазол-5 ил)метил)-3-метилуреидо)-4-морфолинбутанамидо)-1,6-дифенилгексан-2-илкарбамат. Согласно одному варианту реализации соединение формулы (I) имеет повышенное до 855% содержание стереоизомера формулы (Ia). Согласно другому варианту реализации соединение формулы (I) имеет повышенное до 905% содержание стереоизомера формулы (Ia). Согласно другому варианту реализации соединение формулы (I) имеет повышенное до 952% содержание стереоизомера формулы (Ia). Согласно другому варианту реализации соединение формулы (I) имеет повышенное до 991% содержание стереоизомера формулы (Ia). Согласно другому варианту реализации соединение формулы (I) является чистым стереоизомером формулы (Ia). Твердые носители. Соединение формулы (I) может использоваться в сочетании с твердым носителем, представляющим собой диоксид кремния. При использовании в данной заявке термин "нанесенный на твердый носитель" включает (но не ограничивается этим значением) внесение соединения формулы (I) в поры и нанесение на поверхность твердого носителя. Производные диоксида кремния, подходящие для использования в композиции согласно изобретению, и способы получения таких производных диоксида кремния включают производные и способы,описанные в публикации международной заявкиWO 03/037379 и ссылках, приведенных в данной заявке. Как правило, эти производные диоксида кремния включают гранулированный гидрофильный высокодисперсный диоксид кремния со средним диаметром частиц от 10 до 120 мкм и удельной поверхностью, определенной по методу БЭТ, от 40 до 400 м/г (в соответствии со стандартом DIN 66 131 для азота). Также объем пор производных диоксида кремния обычно составляет от примерно 0,5 до 2,5 мл/г,-2 022950 причем поры, имеющие диаметр менее чем примерно 5 нм, составляют менее чем примерно 5% от общего объема пор, остальные поры являются мезопорами и макропорами. Кроме того, производные диоксида кремния, как правило, имеют рН в диапазоне от примерно 3.6 до примерно 8.5 и трамбовочную плотность от примерно 220 до примерно 700 г/л. Конкретный кремнеоксидный материал, который, в частности, пригоден в композициях и способах согласно настоящему изобретению, представляет собой AEROPERL 300 (высокодисперсный диоксид кремния), производства Evonik Degussa AG (Дюссельдорф, Германия). Однако также могут использоваться другие материалы, имеющие физические и химические свойства, подобные материалам из диоксида кремния, описанным в настоящей заявке. Согласно одному варианту реализации изобретения частицы диоксида кремния имеют средний диаметр 20-40 мкм. Согласно одному варианту реализации изобретения частицы диоксида кремния имеют удельную поверхность, определенную по методу БЭТ, по меньшей мере 150 м/г. Согласно одному варианту реализации изобретения частицы диоксида кремния имеют удельную поверхность, определенную по методу БЭТ, по меньшей мере 200 м 2/г. Согласно одному варианту реализации изобретения частицы диоксида кремния имеют удельную поверхность, определенную по методу БЭТ, по меньшей мере 250 м 2/г. Согласно одному варианту реализации изобретения частицы диоксида кремния имеют удельную поверхность, определенную по методу БЭТ, по меньшей мере 275 м 2/г. В композициях согласно изобретению соединение формулы (I), как правило, находится в порах или на поверхности частиц высокодисперсного кремния. Было определено, что, как правило, на эти частицы диоксида кремния может быть нанесено вплоть до примерно 60 мас.% соединения формулы (I) по отношению к массе носителя. Высокая емкость является важной характеристикой в фармацевтической области применения. Согласно одному варианту реализации изобретения отношение массы соединения формулы (I) к массе частиц диоксида кремния составляет 2015%. Согласно одному варианту реализации изобретения отношение массы соединения формулы (I) к массе частиц диоксида кремния составляет 5010%. Согласно одному варианту реализации изобретения отношение массы соединения формулы (I) к массе частиц диоксида кремния составляет 4515%. Согласно одному варианту реализации изобретения отношение массы соединения формулы (I) к массе частиц диоксида кремния составляет 1.00.5. Согласно одному варианту реализации изобретения (масса соединения формулы II), разделенная на (массу твердого носителя, например производного диоксида кремния), в композиции составляет от примерно 0,8 до примерно 1,2. Согласно другому варианту реализации изобретения (масса соединения формулыII), разделенная на (массу твердого носителя, например производного диоксида кремния), в композиции составляет 1.00.5. Композиции согласно настоящему изобретению, являющиеся пригодными для введения в качестве лекарственных препаратов, как правило, содержат одно или более фармацевтически приемлемых вспомогательных веществ. Нанесение. Соединение формулы (I) может быть нанесено на твердый носитель с использованием любого подходящего способа. Например, соединение формулы (I) может быть нанесено на твердый носитель путем:a) распыления раствора соединения (например, раствора соединения в спиртовом растворителе, таком как этанол) на твердый носитель, например, как описано в примере 1, ниже;b) объединения соединения формулы (I), подходящего растворителя (например, летучего растворителя, такого как дихлорметан) и твердого носителя; выпаривания растворителя и отделения полученного в результате твердого материала; илиc) объединение соединения формулы (I) и подходящего летучего растворителя (например, галогенированного углеводорода, такого как дихлорметан), и твердого носителя; добавления антирастворителя(например, сильно неполярного растворителя, такого как гексаны или гептан) и отделения полученного в результате твердого материала (как описано в примере 4). На фиг. 1 представлено получение фармацевтической лекарственной формы, содержащей соединение формулы (I), в соответствии со способом согласно настоящему изобретения. Соединение формулы(I) может быть объединено с подходящим растворителем и множеством частиц диоксида кремния с получением смеси. Необязательно, соединение формулы (I) может быть объединено с подходящим растворителем при одновременном перемешивании. Как правило, процентное массовое отношение соединения формулы (I) к частицам диоксида кремния до момента объединения составляет примерно 5010%. Согласно одному варианту реализации изобретения массовое отношение соединения формулы (I) к частицам диоксида кремния до момента объединения составляет примерно 2010%. Согласно другому варианту реализации изобретения массовое отношение соединения формулы (I) к частицам диоксида кремния до момента объединения составляет примерно 3010%. В качестве растворителя может использоваться любой растворитель, в котором соединение формулы (I) растворимо. Как правило, растворитель содержит летучий органический растворитель, такой как, например, (С 1-C6)спирт (например, этанол). Как описано в примере 4 ниже, соединение формулы (I) может также быть нанесено на кремнеоксидный материал путем растворения соединения в подходящем растворителе с получением раствора,-3 022950 содержащего соединение I; добавления частиц диоксида кремния к раствору для получения смеси; возможного взбалтывания или перемешивания смеси; добавления антирастворителя к смеси и отделения твердой смеси, включающей соединение формулы (I) на частицах диоксида кремния. Подходящие растворители включают органические растворители, такие как кетоны (например, ацетон), спирты (например, этанол) и галогенизированные углеводороды (например, дихлорметан). Подходящие антирастворители включают сильно неполярные растворители (например, гексан или гептан). Конечная смесь в виде твердого вещества может быть выделена с помощью любого подходящего метода разделения (например,фильтрации). Одно или более фармацевтически приемлемых вспомогательных веществ могут быть объединены с этой смесью с получением второй смеси. Эти фармацевтически приемлемые вспомогательные вещества могут включать наполнители, связующие вещества и разрыхлители. Для того чтобы облегчить переработку смеси в последующем процессе грануляции в водных условиях, можно выбрать наполнители и разрыхлители, совместимые с этим процессом в водных условиях. Например, было обнаружено, что микрокристаллическая целлюлоза (наполнитель) и кроскармеллоза натрия (разрыхлитель) являются особенно совместимыми с последующим процессом грануляции в водных условиях. Также было обнаружено, что гидроксипропилцеллюлоза (связующее вещество) является особенно совместимой с последующим процессом грануляции. Согласно одному варианту реализации изобретения массовое отношение микрокристаллической целлюлозы к общей масее второй смеси составляет примерно 5020%. Согласно одному варианту реализации изобретения массовое отношение гидроксипропилцеллюлозы к общей массе второй смеси составляет примерно 21%. Согласно одному варианту реализации изобретения массовое отношение кроскармеллозы натрия составляет 52%. После добавления фармацевтически приемлемых вспомогательных веществ вторую смесь можно перемешать, например, с использованием механического смесителя, такого как гранулятор с большим усилием сдвига (Niro-Fielder, модель РМА-25). Ко второй смеси можно добавить воду с получением влажного гранулята, который затем может быть подвержен деагломерации, например, с помощью сита 20 меш. Высушивание, например, с использованием сушилки в псевдожиженном слое (Fluid Air, модель 20) позволяет получить высушенный материал, который включает твердые частицы. Согласно одному варианту реализации содержание влаги в высушенном материале составляет менее чем примерно 10.0%, что определено в соответствии со значениями потери в массе при высушивании (loss on drying, LOD). Согласно другому варианту реализации содержание влаги в высушенном материале составляет менее чем примерно 5.0%, что определено в соответствии со значениями потери в массе при высушивании (LOD). Согласно другому варианту реализации содержание влаги в высушенном материале составляет менее чем примерно 1.0%, что определено в соответствии со значениями потери в массе при высушивании (LOD). Размер частицы можно уменьшить,например, с использованием сита 40 меш или подходящей мельницы (Quadro CoMil, модель 197/S) для получения третьей смеси. Подходящее фармацевтически приемлемое смазывающее/скользящее вещество (например, стеарат магния, стеариновая кислота, стеарат кальция, стеарат цинка или прежелатинизированный крахмал) может быть объединено с третьей смесью с получением четвертой смеси. Согласно одному варианту реализации массовое отношение стеарата магния к общей массе четвертой смеси составляет 10,5%. Согласно одному варианту реализации изобретения предложена композиция, полученная в соответствии со способами, описанными в настоящей заявке. Согласно изобретению также предложен продукт,полученный на любом из этапов процессов, описанных в настоящей заявке. Фармацевтические лекарственные формы, включающие соединение формулы (I). Согласно одному варианту реализации изобретения предложены фармацевтические композиции,включающие соединение формулы (I), которые могут быть введены млекопитающему пациенту, такому как человек, в различных формах, адаптированных к выбранному способу введения (например, пероральному способу). Таким образом, композиции согласно настоящему изобретению могут вводиться в комбинации с одним или более фармацевтически приемлемыми компонентами, такими как инертный разбавитель или усваиваемый съедобный носитель. Они могут быть заключены в твердые или мягкие желатиновые капсулы, могут быть спрессованы в таблетки или же могут быть непосредственно включены в пищевые продукты рациона пациента. Для перорального введения в терапевтических целях активное соединение может быть комбинировано с одним или более вспомогательными веществами и использоваться в форме таблеток для приема внутрь, таблеток для трансбуккального применения, пастилок, капсул, пластинок и т.п. Такие композиции и препараты обычно содержат по меньшей мере 0,1% активного соединения. Процентное содержание композиций и препаратов, безусловно, может варьировать и обычно составляет от примерно 2 до примерно 60% от массы данной единичной дозированной формы. Содержание активного соединения в таких композициях, которые используются в терапевтических целях, является достаточным для достижения эффективного уровня дозировки. Таблетки, пастилки, пилюли, капсулы и т.п. могут также включать следующие компоненты: связующие вещества, такие как гидроксипропилцеллюлоза, повидон или гидроксипропил метилцеллюлоза; наполнители, такие как микрокристаллическая целлюлоза, прежелатинизированный крахмал, крахмал,маннит или моногидрат лактозы; дезинтегрирующие агенты, такие как кроскармеллоза натрия, сшитый повидон или натриевая соль гликолята крахмала; смазывающее вещество, такое как стеарат магния, стеариновая кислота или другие стеараты металлов; также может быть добавлен подсластитель, такой как сахароза, фруктоза, лактоза или аспартам или ароматизатор, такой как перечная мята, масло грушанки или вишневый ароматизатор. Если форма единицы дозирования представляет собой капсулу, она может включать, кроме вышеперечисленных агентов, жидкий носитель, такой как растительное масло или полиэтиленгликоль. Различные другие материалы могут использоваться в качестве покрытий или же другим образом модифицировать физическую форму твердой единицы дозирования. Например, таблетки,пилюли или капсулы могут быть покрыты желатином, полимерами, восками, шеллаком, сахаром и т.п. Безусловно, любой материал, используемый в приготовлении любой формы единицы дозирования, как правило, является фармацевтически приемлемым и фактически нетоксичным в используемых количествах. Кроме того, композиции согласно изобретению могут быть включены в препараты и устройства замедленного высвобождения. Композиции согласно изобретению могут также использоваться для местного применения, например трансдермального, трансбуккального или сублингвального. Соответственно согласно изобретению также предложены фармацевтические композиции, преобразованные в лекарственные формы для таких способов местного применения. Необходимые дозы соединений формулы I могут быть определены путем сравнения их in vitro активности и in vivo активности на животных моделях. Методы экстраполяции значений эффективных доз для мышей и других животных на человека известны в данной области. Количество композиции согласно изобретению, необходимое для использования в терапевтических целях,будет варьировать в зависимости от способа введения, природы заболевания, которое необходимо лечить, и возраста и состояния пациента, и в конечном итоге определяется лечащим врачом или врачомконсультантом. В целом, однако, приемлемая доза соединения формулы (I) находится в пределах от примерно 0,05 до примерно 100 мг/кг, например от примерно 0,05 до примерно 50 мг/кг массы тела в день, предпочтительно в пределах от 0,05 до 10 мг/кг/день, наиболее предпочтительно в пределах от 0,05 до 5 мг/кг/день. Соединение удобно преобразовано в единичную дозированную лекарственную форму; например,содержащую примерно от 5 до 500 мг, примерно от 5 до 250 мг или примерно от 10 до 100 мг соединения формулы (I). Согласно одному варианту реализации изобретения предложена композиция, содержащая примерно 5, примерно 25 или примерно 100 мг соединения формулы (I), преобразованная в единичную дозированную лекарственную форму, которая также включает частицы твердого носителя (например,частицы диоксида кремния) и один или более фармацевтически приемлемых носителей. Способность соединения формулы (I) ингибировать цитохром Р-450 может быть оценена в соответствии с методикой, описанной в публикации международной заявки WO 2008/010921. Комбинированные лекарственные формы. Как описано в публикации международной заявкиWO 2008/010921, соединение формулы (I) приводит к улучшению фармакокинетических свойств вводимого вместе с ним лекарственного препарата, например, путем ингибирования монооксигеназы цитохрома Р-450. Соответственно согласно другому варианту реализации фармацевтические композиции согласно настоящему изобретению могут также содержать по меньшей мере один дополнительный терапевтический агент. Дополнительный терапевтический агент может представлять собой любой агент, имеющий терапевтический эффект при использовании в комбинации с соединением согласно настоящему изобретению. Например, дополнительный терапевтический агент, используемый в комбинации с соединением формулы (I), может представлять собой любой агент, который подвержен окислительному метаболизму,зависимому от ферментов типа цитохрома Р-450, в особенности монооксигеназы цитохрома Р-450, например 1 А 2, 2 В 6, 2 С 8, 2 С 19, 2 С 9, 2D6, 2 Е 1, 3 А 4, 5, 7 и т.д. В одном примере дополнительный терапевтический агент может представлять собой любой противовирусный агент, например агент, направленный против ВИЧ, агент, направленный против ВГС и т.д.,антибактериальный агент, противогрибковый агент, имммуномодулятор, например иммуносупрессор,противоопухолевый препарат, химиотерапевтический агент, агенты, используемые при лечении заболеваний сердечно-сосудистой системы, неврологических заболеваний и т.д. В другом примере дополнительный терапевтический агент может представлять собой любой ингибитор протонной помпы, противосудорожное средство, НПВП, пероральное гипогликемическое средство, антагонист рецептора ангиотензина II, производное сульфонилмочевины, бета-блокатор, антидепрессант, антипсихотическое средство или анестетик, или их комбинацию. В другом примере дополнительный терапевтический агент может представлять собой любой 1) макролидный антибиотик, например кларитромицин, эритромицин, телитромицин, 2) антиаритмический препарат, например хинидин 3-ОН, 3) бензодиазепин, например алпразолам, диазепам 3 ОН, мидазолам, триазолам, 4) иммуномодулятор, например циклоспорин, такролимус (FK506), 5) противовирусный препарат, направленный против ВИЧ, например индинавир, нелфинавир, ритонавир, саквинавир, 6) прокинетик, например цисаприд, 7) антигистамин, например астемизол, хлорфенирамин, терфенидин, 8) блокатор кальциевых каналов, например амлодипин, дильтиазем, фелодипин, лерканидипин, нифедипин,нисолдипин, нитрендипин, верапамил, 9) ингибитор ГМГ-КоА-редуктазы, например аторвастатин, церивастатин, ловастатин, симвастатин, или 10) 6 бета-ОН-стероид, например эстрадиол, гидрокортизон, прогестерон, тестостерон. В другом примере дополнительный терапевтический агент может представлять собой альфентанил,апрепитант, арипипразол, буспирон, кафергот, кофеин, TMU, цилостазол, кокаин, N-деметилированное производное кодеина, дапсон, декстрометорфан, доцетаксел, домперидон, эплеренон, фентанил, финастерид, гливек, галоперидол, иринотекан, ЛААМ, лидокаин, метадон, натеглинид, ондансетрон, пимозид,пропранолол, кветиапин, хинин, салметерол, силденафил, сиролимус, тамоксифен, паклитаксел, терфенадин, тразодон, винкристин, залеплон или золпидем, или их комбинацию. Согласно одному конкретному варианту реализации изобретения предложена фармацевтическая композиция, содержащая 1) соединение формулы (I), 2) множество частиц твердого носителя и 3) по меньшей мере один дополнительный терапевтический агент, выбранный из группы, включающей соединения, ингибирующие протеазу ВИЧ, не нуклеозидные ингибиторы обратной транскриптазы ВИЧ, нуклеозидные ингибиторы обратной транскриптазы ВИЧ, нуклеотидные ингибиторы обратной транскриптазы ВИЧ, ингибиторы интегразы ВИЧ, не нуклеозидные ингибиторы ВГС, ингибиторы CCR5 и их комбинации, и 4) фармацевтически приемлемое вспомогательное вещество. Согласно одному конкретному варианту реализации изобретения предложена фармацевтическая композиция, содержащая 1) соединение формулы (I), 2) множество частиц диоксида кремния, каждая из которых имеет поверхность и поры со средним диаметром частиц от 10 до 120 мкм и удельной поверхностью, определенной по методу БЭТ, от 40 до 400 м 2/г, и 3) по меньшей мере один дополнительный терапевтический агент, выбранный из группы, включающей соединения, ингибирующие протеазу ВИЧ,не нуклеозидные ингибиторы обратной транскриптазы ВИЧ, нуклеозидные ингибиторы обратной транскриптазы ВИЧ, нуклеотидные ингибиторы обратной транскриптазы ВИЧ, ингибиторы интегразы ВИЧ,не нуклеозидные ингибиторы ВГС, ингибиторы CCR5 и их комбинации, и 4) фармацевтически приемлемое вспомогательное вещество. Согласно другому варианту реализации настоящего изобретения предложены фармацевтические композиции, содержащие 1) соединение формулы (I), 2) множество частиц твердого носителя и 3) по меньшей мере один дополнительный терапевтический агент, выбранный из группы, включающей ампренавир, атазанавир, фосампренавир, индинавир, лопинавир, ритонавир, нелфинавир, саквинавир, типранавир, бреканавир, дарунавир, ТМС-126, ТМС-114, мозенавир (DMP-450), JE-2147 (AG1776), L-756423,RO0334649, KNI-272, DPC-681, DPC-684, GW640385X, DG17, PPL-100, DG35, AG 1859, каправирин,эмивирин, делавиридин, эфавиренц, невирапин, (+)каланолид А, этравирин, GW5634, DPC-083, DPC-961,DPC-963, MIV-150, ТМС-120, ТМС-278 (рилпивирин), BILR 355 BS, VRX 840773, UK-453061, RDEA806,зидовудин, эмтрицитабин, диданозин, ставудин, залцитабин, ламивудин, абакавир, амдоксовир, элвуцитабин, аловудин, MIV-210, рацивир (-FTC), D-d4FC, фосфазид, фозивудин тидоксил, априцитибинAVX754, амдоксовир, KP-1461 и фосалвудин тидоксил (ранее HDP 99.0003), дизопроксил фумарат тенофовира, адефовир дипивоксил, GS-9131, куркумин, производные куркумина, цикориевую кислоту, производные цикориевой кислоты, 3,5-дикаффеолихиновую кислоту, производные 3,5-дикаффеолихиновой кислоты, ауринтрикарбоновую кислоту, производные ауринтрикарбонавой кислоты, фенилэтиловый эфир кофеиновой кислоты, производные фенилэтилового эфира кофеиновой кислоты, тирфостин, производные тирфостина, кверцетин, производные кверцетина, S-1360, зинтевир (AR-177), L-870812, L870810, MK-0518 (ралтегравир), элвитегравир, BMS-538158, GSK364735C, BMS-707035, МК-2048, ВА 011, энфувиртид, сифувиртид, FB006M, TRI-1144, AMD-070, SP01A, BMS-488043, BlockAide/CR, иммунитин, производные бензимидазола, производные бензо-1,2,4-тиадиазина, производные фенилаланина,аплавирок, викривирок и маравирок, циклоспорин, FK-506, рапамицин, паклитаксел, таксотер, кларитромицин, А-77003, А-80987, МК-639, саквинавир, VX-478, AG1343, DMP-323, XM-450, BILA 2011 BS,BILA 1096 BS, BILA 2185 BS, BMS 186,318, LB71262, SC-52151, SC-629 (N,N-диметилглицил-N-(2 гидрокси-3-4-метоксифенил)сульфонил)(2-метилпропил)амин)-1-(фенилметил)пропил)-3-метил-L-валинамид), KNI-272, CGP 53437, CGP 57813 и U-103017, и 4) фармацевтически приемлемый носитель или вспомогательное вещество. Согласно другому варианту реализации настоящего изобретения предложены фармацевтические композиции, содержащие 1) соединение формулы (I), 2) множество частиц диоксида кремния, каждая из которых имеет поверхность и поры со средним диаметром частиц от 10 до 120 мкм и удельной поверхностью, определенной по методу БЭТ, от 40 до 400 м 2/г, и 3) по меньшей мере один дополнительный терапевтический агент, выбранный из группы, включающей ампренавир, атазанавир, фосампренавир,индинавир, лопинавир, ритонавир, нелфинавир, саквинавир, типранавир, бреканавир, дарунавир, ТМС 126, ТМС-114, мозенавир (DMP-450), JE-2147 (AG1776), L-756423, RO0334649, KNI-272, DPC-681, DPC684, GW640385X, DG17, PPL-100, DG35, AG 1859, каправирин, эмивирин, делавиридин, эфавиренц, невирапин, (+) каланолид А, этравирин, GW5634, DPC-083, DPC-961, DPC-963, MIV-150, ТМС-120, ТМС 278 (рилпивирин), BILR 355 BS, VRX 840773, UK-453061, RDEA806, зидовудин, эмтрицитабин, диданозин, ставудин, залцитабин, ламивудин, абакавир, амдоксовир, элвуцитабин, аловудин, MIV-210, рацивир(-FTC), D-d4FC, фосфазид, фозивудин тидоксил, априцитибтин AVX754, амдоксовир, KP-1461 и фосалвудин тидоксил (ранее HDP 99.0003), дизопроксил фумарат тенофовира, адефовир дипивоксил, GS-9131,куркумин, производные куркумина, цикориевую кислоту, производные цикориевой кислоты, 3,5 дикаффеолихиновую кислоту, производные 3,5-дикаффеолихиновой кислоты, ауринтрикарбоновую кислоту, производные ауринтрикарбонавой кислоты, фенилэтиловый эфир кофеиновой кислоты, производные фенилэтилового эфира кофеиновой кислоты, тирфостин, производные тирфостина, кверцетин, производные кверцетина, S-1360, зинтевир (AR-177), L-870812, L-870810, MK-0518 (ралтегравир), элвитегравир, BMS-538158, GSK364735C, BMS-707035, MK-2048, ВА 011, энфувиртид, сифувиртид, FB006M,TRI-1144, AMD-070, SP01 A, BMS-488043, BlockAide/ CR, иммунитин, производные бензимидазола,производные бензо-1,2,4-тиадиазина, производные фенилаланина, аплавирок, викривирок и маравирок,циклоспорин, FK-506, рапамицин, паклитаксел, таксотер, кларитромицин, А-77003, А-80987, MK-639,саквинавир, VX-478, AG1343, DMP-323, XM-450, BILA 2011 BS, BILA 1096 BS, BILA 2185 BS, BMS 186,318, LB71262, SC-52151, SC-629 (N,N-диметилглицил-N-(2-гидрокси-3-4-метоксифенил)сульфонил)(2-метилпропил)амин)-1-(фенилметил)пропил)-3-метил-L-валинамид), KNI-272, CGP 53437, CGP 57813 и U-103017, и 4) фармацевтически приемлемый носитель или вспомогательное вещество. Согласно другому варианту реализации настоящего изобретения предложены фармацевтические композиции, содержащие 1) соединение формулы (I), 2) множество частиц твердого носителя и 3) два или три дополнительных терапевтических агента, например дополнительных терапевтических агента,выбранных из класса ингибиторов протеазы ВИЧ, не нуклеозидных ингибиторов обратной транскриптазы ВИЧ, нуклеозидных ингибиторов обратной транскриптазы ВИЧ, нуклеотидных ингибиторов обратной транскриптазы ВИЧ и ингибиторов интегразы ВИЧ. Два или три дополнительных терапевтических агента могут быть разными терапевтическими агентами, выбранными из одного класса терапевтических агентов или же выбранными из разных классов терапевтических агентов. Согласно другому варианту реализации настоящего изобретения предложены фармацевтические композиции, содержащие 1) соединение формулы (I), 2) множество частиц диоксида кремния, каждая из которых имеет поверхность и поры со средним диаметром частиц от 10 до 120 мкм и удельной поверхностью, определенной по методу БЭТ, от 40 до 400 м 2/г, и 3) два или три дополнительных терапевтических агента, например дополнительных терапевтических агента, выбранных из класса ингибиторов протеазы ВИЧ, не нуклеозидных ингибиторов обратной транскриптазы ВИЧ, нуклеозидных ингибиторов обратной транскриптазы ВИЧ, нуклеотидных ингибиторов обратной транскриптазы ВИЧ и ингибиторов интегразы ВИЧ. Два или три дополнительных терапевтических агента могут быть разными терапевтическими агентами, выбранными из одного класса терапевтических агентов или же выбранными из разных классов терапевтических агентов. Согласно другому варианту реализации изобретения предложены фармацевтические композиции,которые включают множество частиц твердого носителя и четырехкомпонентную комбинацию агентов,выбранную из следующих комбинаций: формула(I)/дизопроксил фумарат тенофовира/эмтрицитабин/элвитегравир. Способы комбинированной терапии. Согласно одному варианту реализации композиции согласно изобретению, содержащие соединение формулы (I), могут использоваться отдельно, например, для ингибирования монооксигеназы цитохрома Р-450. Согласно другому варианту реализации композиции согласно изобретению могут использоваться в комбинации с другими активными терапевтическими компонентами или агентами. Предпочтительно другие активные терапевтические компоненты или агенты метаболизируются ферментами семейства цитохрома Р-450 (или подвержены цитохром Р-450-зависимому окислительному метаболизму), например ферментами монооксигеназами, такими как 1 А 2, 2 В 6, 2 С 8, 2 С 19, 2 С 9, 2D6, 2 Е 1, 3 А 4, 5, 7 и т.д. Также предполагается, что композиции согласно изобретению, содержащие соединение формулы(I), могут быть введены совместно с любым другим активным терапевтическим агентом или компонентом, который, по существу, метаболизируется ферментами монооксигеназами семейства цитохрома Р 450, например монооксигеназой цитохромом Р-450 3 А, таким образом снижая метаболизируемое количество другого активного терапевтического агента или компонента или скорость, с которой он метаболизируется, что приводит к улучшению фармакокинетических свойств другого активного терапевтического агента или компонента. Такое улучшение может включать повышение уровня в плазме крови другого терапевтического агента или компонента или поддержание более эффективного с терапевтической точки зрения уровня в плазме крови другого терапевтического активного агента или компонента по сравнению с уровнем в плазме крови этого терапевтического агента или компонента при введении его в отсутствие композиции согласно изобретению, включающей соединение формулы (I). Совместное введение соединения формулы (I) с одним или более другими активными терапевтическими агентами в целом относится к одновременному или последовательному введению соединения формулы (I) и одного или более других активных терапевтических агентов таким образом, чтобы в организме пациента присутствовало терапевтически эффективное количество как соединения формулы (I),так и одного или более других активных терапевтических агентов. Совместное введение включает введение единиц дозирования соединения формулы (I) до или после введения единиц дозирования одного или более других активных терапевтических агентов, например введение соединения формулы (I) в течение секунд, минут или часов после введения одного или более активных терапевтических агентов. Например, сначала может быть введена единичная доза соединения формулы (I) с последующим введением в течение нескольких секунд или минут единичной дозы одного или более других активных терапевтических агентов. Альтернативно, сначала может быть введена единичная доза одного или более других терапевтических агентов с последующим введением единичной дозы соединения формулы (I) в течение нескольких секунд или минут. В некоторых случаях может быть предпочтительным изначальное введение единичной дозы соединения формулы (I) с последующим введением в течение нескольких часов (например, от 1 до 12 ч) единичной дозы одного или более других активных терапевтических агентов. В других случаях может быть предпочтительным изначальное введение единичной дозы одного или более других активных терапевтических агентов с последующим введением в течение нескольких часов (например, от 1 до 12 ч) единичной дозы соединения формулы (I). Конкретные варианты реализации изобретения Конкретные варианты реализации, описанные в данной заявке, являются исключительно иллюстративными и никоим образом не исключают другие варианты реализации изобретения. Согласно одному конкретному варианту реализации изобретения предложен способ, включающий нанесение соединения формулы (I) на множество частиц твердого носителя в присутствии подходящего растворителя для получения первой смеси; возможное перемешивание первой смеси; возможное добавление одного или более фармацевтически приемлемых вспомогательных веществ(например, наполнителя, связующего вещества и разрыхлителя) к смеси для получения второй смеси; возможное добавление другого терапевтического агента к смеси; возможное перемешивание второй смеси; возможное добавление воды ко второй смеси для получения влажного гранулята; возможная деагломерация влажного гранулята; возможная сушка для получения высушенного материала, который включает твердые частицы; возможное измельчение твердых частиц для получения третьей смеси; возможное комбинирование третьей смеси и фармацевтически приемлемого смазывающего вещества для получения четвертой смеси. Согласно одному конкретному варианту реализации изобретения предложена первая, вторая, третья или четвертая смесь, описанные выше. Согласно одному конкретному варианту реализации изобретения предложена композиция, включающая соединение формулы (I) или его фармацевтически приемлемую соль и множество частиц диоксида кремния, каждая из которых имеет поверхность и поры со средним диаметром частиц от примерно 10 до примерно 120 мкм и удельной поверхностью, определенной по методу БЭТ, от примерно 40 до примерно 400 м 2/г. Далее изобретение проиллюстрировано с помощью неограничивающих примеров. Получение соединения формулы (Ia). Соединение формулы (Ia) или его соль может быть получено путем соединения кислой соли формулы X, где М представляет собой противоион, с амином формулы IX с формированием соответствующего амида формулы (Ia), как описано в публикации международной заявки WO 2008/103949 (например,см. с. 254). Реакцию формирования амида можно осуществлять при стандартных условиях. Например, ее можно проводить в подходящем органическом растворителе (например, тетрагидрофуране или дихлорметане) в присутствии подходящего связывающего агента (например, EDCHCl и HOBt). Другие подходящие условия и связывающие реагенты для амида известны в данной области. Реакцию обычно проводят при температуре от примерно -30 С до примерно 20 С. Конечный реакционный раствор, включающий соединение формулы (Ia) в дихлорметане (ДХМ), можно непосредственно использовать в процессах, представленных на фиг. 6, с получением типичных композиций согласно изобретению, или же раствор соединения в дихлорметане может быть смешан с этанолом и полученная в результате смесь может быть очищена с удалением дихлорметана и получением раствора соединения формулы (Ia) в этаноле. Этот раствор в этаноле может быть смешан с частицами диоксида кремния и выпарен (как показано в левой колонке фиг. 6) для получения композиции, включающей соединение формулы (Ia), нанесенное на частицы диоксида кремния. Альтернативно, раствор соединения в дихлорметане может быть смешан с частицами диоксида кремния, добавлен антирастворитель и полученная в результате смесь может быть отфильтрована и высушена (как показано в правой колонке фиг. 6) с получением композиции, включающей соединение формулы (Ia), нанесенное на частицы диоксида кремния. Пример 1. Получение типичной композиции согласно изобретению. Раствор соединения формулы (Ia) в этаноле, приготовленный, как описано выше, использовали в следующем процессе. 1. Взвешивали 374 г раствора соединения (0.64 М) и вспомогательные вещества: 195,5 г коллоидного диоксида кремния, 103,7 г микрокристаллической целлюлозы, 10,2 г гидроксипропилцеллюлозы, 25,5 г кроскармеллозы натрия и 5,1 г стеарата магния. Корректировали массу соединения исходя из концентрации раствора и содержания примесей с соответствующим снижением массы микрокристаллической целлюлозы. 2. Добавляли коллоидный диоксид кремния в 3-L гранулятор с большим усилием сдвига и распыляли раствор соединения на коллоидный диоксид кремния в течение 6-8 мин при перемешивании порошка при скорости вращения лопасти 150 об/мин. 3. Перемешивали в течение дополнительных 2 мин для равномерного распределения раствора соединения в смеси коллоидного диоксида кремния. 4. Добавляли микрокристаллическую целлюлозу, гидроксипропилцеллюлозу и кроскармеллозу натрия в гранулятор с большим усилием сдвига/смеситель и перемешивали в течение 1 мин. 5. Проводили влажную грануляцию перемешанной смеси. Добавляли очищенную воду, гомогенизируя при этом при скорости вращения лопасти 150 об/мин и скорости вращения измельчителя 1800 об/мин, с формированием приемлемого гранулята (приблизительно 250-300 г воды). После добавления воды массу увлажняли при тех же параметрах вращения лопасти и измельчителя в течение 1 мин. При необходимости добавляли еще воду и проводили дополнительную грануляцию влажной массы для завершения процесса формирования гранул. 6. Пропускали влажный гранулят через мельницу или сито для разрушения крупных агломератов. 7. Переносили влажный гранулят на сушилку в псевдоожиженном слое и высушивали гранулы при температуре на входе 75 С. Гранулы сушили до тех пор, пока содержание влаги не составляло не более чем 1,0%, что определяли на основании потери в массе при высушивании (loss on drying, LOD). 8. Пропускали высушенный гранулят через мельницу при скорости вращения лопасти 1250 об/мин с ячейкой мельничного сита 0,032 дюйма. 9. Переносили измельченный высушенный гранулят в барабанный смеситель подходящего размера. 10. Добавляли стеарат магния к измельченному высушенному грануляту и гомогенизировали в течение 3 мин с получением конечной порошкообразной смеси. 11. Прессовали конечную порошкообразную смесь в таблетки с использованием таблеточного прес-9 022950 са. Пример 2. Оценка влагопоглощения для типичной композиции согласно изобретению. Влагопоглощение для AEROPERL 300 (высокодисперсного диоксида кремния), соединения и образца AEROPERL 300 (высокодисперсного диоксид кремния), содержащего 50,0 мас.% соединения,измеряли, как описано ниже. Соединение формулы (I) растворяли в этаноле и полученным раствором заливали образец высокодисперсного диоксида кремния, равный по массе количеству соединения формулы (I). Полученную в результате смесь тщательно перемешивали и растворитель выпаривали с получением материала соединение/AEROPERL 300 (высокодисперсный диоксид кремния), который использовали для оценки влагопоглощения ниже. Гигроскопичность образцов измеряли на основании динамики поглощения пара (dynamic vaporsorption, DVS) на приборе DVS Advantage-1 (Surface Measurement Systems, SMS, Allentown, PA). В эксперименте на DVS увеличение/снижение массы образца измеряли при различных уровнях относительной влажности (% ОВ) при постоянной температуре. Прибор включает микровесы с одной емкостью, содержащей образец (как правило, примерно 5-10 мг образца), и пустой емкостью для сравнения и генератор водяного пара для достижения желаемого уровня относительной влажности. Все эксперименты проводили при постоянной температуре 25 С. В случае всех экспериментов образцы сначала высушивали под непрерывным током сухого азота в течение 1 ч для получения сухой массы m0. Относительную влажность затем повышали до 75% и по мере того, как образцы поглощали воду, фиксировали увеличение массы. Все эксперименты проводились до тех пор, пока не достигалось массового равновесия при 75% ОВ (как правило, в течение 10-25 ч). Как показано на фиг. 2, гигроскопичность AEROPERL 300 (высокодисперсного диоксида кремния) и гигроскопичность соединения значительно выше, чем гигроскопичность смеси соединение/AEROPERL 300 (высокодисперсный диоксид кремния). При 75% ОВ соединение и Aeroperl адсорбировали 4,8 и 9,3 мас.% воды соответственно. При тех же условиях Aeroperl, насыщенный соединением, адсорбировал только 2,4% влаги. Пример 3. Оценка прессуемости типичной композиции согласно изобретению. Прессуемость композиции согласно изобретению - образца AEROPERL 300 (высокодисперсного диоксида кремния), насыщенного 50,0 мас.% соединения - сравнивали с прессуемостью подобной композиции, не включающей соединение. Прессуемость определяли с использованием гидравлического лабораторного пресса (Fred Carver, Inc., Wabash, IN, США) с единственной круглой 3/8-дюймовой плоской плитой со скошенными краями. Порошкообразные смеси прессовали с получением прессовок массой приблизительно 300 мг и прессовали в таблетки при силе прессования в пределах от 500 до 2000 фунтов. Массу прессовки определяли с помощью весов с верхней нагрузкой (Sartorius, Gttingen, Германия),толщину прессовки определяли с использованием микрометра (Absolute Digimatic, Mitutoyo, Токио, Япония) и прочность прессовки определяли с использованием тестера прочности (VK 200, Varian, Inc., PaloAlto, CA, США). Предел прочности (МПа) рассчитывали из средних значений для десяти прессовок с использованием следующего уравнения: где Tensile Strength (MPa) - предел прочности (МПа); Н - прочность прессовки, кгс (килограмм-сила, 1 кгс равен силе давления массы 1 кг); С - 9.80710-2 Пакг-1 см 2; Т - толщина прессовки, см;D - диаметр прессовки, см. Соединением формулы (I) насыщали высокодисперсный диоксид кремния, как описано в примере 1, и полученный в результате материал использовали для оценки прессуемости. Прессуемость композиции, включающей соединение, была намного больше по сравнению с прессуемостью композиции, не включающей соединение (т.е. плацебо), как показано на фиг. 3. Плацебокомпозиция имела слабую прессуемость, на что указывает низкий предел прочности в диапазоне от 0,6 до 1,2 МПа при силе прессования в пределах от 500 до 2000 фунт. Таблетки с низким пределом прочности не имеют внутренней прочности, необходимой для поддержания их целостности в процессе производства таблеток в промышленных масштабах и последующих этапов обработки, таких как нанесение пленочного покрытия. Композиция, включающая соединение, неожиданным образом проявляла повышенную способность к прессованию, на что указывает увеличение предела прочности от 2,7 до 7,1 МПа при силе прессования в пределах от 500 до 2000 фунт. Это значительное улучшение показателя предела прочности может обеспечить приемлемый предел прочности и способность поддержания целостности таблетки в процессе производства таблеток в промышленных масштабах. Пример 4. Получение соединения I, нанесенного на Aeroperl. Раствор соединения формулы (Ia) (60 г) в дихлорметане (300 мл) наполняли Aeroperl (60 г) и смесь перемешивали в течение по меньшей мере 30 мин. После этого медленно добавляли гептан (1,8 л) в течение 1 ч. Полученную в результате суспензию перемешивали в течение примерно 1 ч и твердое вещество отделяли путем фильтрации. Слой продукта промывали гептаном (500 мл). Полученный в результате продукт в виде твердого вещества сушили в вакууме при комнатной температуре в течение примерно 24 ч. Соединение формулы (I), нанесенное на Aeroperl (примерно 50 мас.%), отделяли в виде белого порошка (112 г продукта, выход 92,5%). Пример 5. Получение типичной композиции согласно изобретению. Типичную композицию согласно изобретению, включающую диоксид кремния в качестве твердого носителя, получали, как описано ниже. 1. Взвешивали 7,7 г раствора соединения (в этаноле) и вспомогательные вещества: 3,83 г диоксида кремния, 2,03 г микрокристаллической целлюлозы, 0,2 г гидроксипропилцеллюлозы, 0,5 г кроскармеллозы натрия и 0,1 г стеарата магния. Корректировали массу соединения на основе концентрации раствора и содержания примесей с сопутствующим снижением массы микрокристаллической целлюлозы. 2. Добавляли диоксид кремния (syloid 244) в ступку и наносили раствор соединения на диоксид кремния в течение 1-2 мин при перемешивании порошка с помощью пестика. 3. Перемешивали в течение дополнительных 2 мин для равномерного распределения раствора соединения в смеси диоксида кремния. 4. Добавляли микрокристаллическую целлюлозу, гидроксипропилцеллюлозу и кроскармеллозу натрия в ступку и перемешивали в течение 1 мин. 5. Проводили влажную грануляцию перемешенной смеси. Добавляли очищенную воду при перемешивании пестиком с получением приемлемого гранулята (приблизительно 7,5 г воды). 6. Пропускали влажный гранулят через сито для разрушения больших агломератов. 7. Переносили влажный гранулят на полочную сушилку и сушили гранулы при 50 С. Гранулы сушили до содержания влаги не более чем 1,0%, определяемом на основании потери в массе при высушивании (LOD). 8. Пропускали высушенный гранулят через сито. 9. Добавляли перемолотый высушенный гранулят в барабанный смеситель подходящего размера. 10. Добавляли стеарат магния к перемолотому высушенному грануляту и перемешивали в течение 1 мин с получением конечной порошкообразной смеси. 11. Прессовали конечную порошкообразную смесь в таблетки с использованием таблеточного пресса. Дополнительные типичные композиции согласно изобретению также получали с помощью процессов, соответствующих какому-либо из вышеописанных способов, за исключением замещения диоксида кремния, используемого в этих способах, на тальк, Aerosil 200 или Aerosli 200 VV. Пример 6. Получение типичной композиции согласно изобретению. Типичную композицию согласно изобретению получали, как описано ниже и как показано на фиг. 4. 1. Взвешивали 74,4 г соединения I, нанесенного на Aeroperl (готовили, как описано в примере 4) и вспомогательные вещества: 20,1 г микрокристаллической целлюлозы, 5,02 г кроскармеллозы натрия и 0,5 г стеарата магния. Корректировали массу соединения на основании процентного содержания соединения в оксиде кремния с учетом содержания примесей с соответствующим уменьшением массы микрокристаллической целлюлозы. 2. Добавляли соединение I на Aeroperl, микрокристаллическую целлюлозу и кроскармеллозу натрия в смеситель. Гомогенизировали в течение 5 мин. 3. Добавляли стеарат магния и гомогенизировали в течение 3 мин. 4. Высушенный гранулят гомогенизировали с использованием роликового пресса. Использовали следующие параметры: промежуток = 1,5 мм, сила 3,0 кН и размер ячеек 0,8 мм. 5. Пропускали гранулят через мельницу или сито для разрушения больших агломератов. 6. Прессовали конечную порошкообразную смесь в таблетки с использованием таблеточного пресса. Пример 7. Получение типичной композиции согласно изобретению. Типичная композиция согласно изобретению может быть получена, как описано ниже и как показано на фиг. 5. Взвешивали 40,9 г соединения I, нанесенного на Aeroperl (приготовленный, как описано в примере 4) и вспомогательные вещества: 15,8 г микрокристаллической целлюлозы, 3,0 г кроскармеллозы натрия и 0,3 г стеарата магния. Корректировали массу соединения на основе процентной нагрузки соединения на диоксид кремния и содержания примесей с соответствующим уменьшением массы микрокристаллической целлюлозы. 1. Добавляли соединение I на Aeroperl, микрокристаллическую целлюлозу и кроскармеллозу натрия в смеситель. Перемешивали в течение 5 мин. 2. Добавляли стеарат магния и перемешивали в течение 3 мин. 3. Прессовали конечную порошкообразную смесь в таблетки с использованием таблеточного пресса. Пример 8. Типичные лекарственные формы согласно изобретению. Далее следуют примеры типичных фармацевтических форм дозирования, включающих соединение формулы I, для использования в терапевтических или профилактических целях у человека. Перечисленные выше лекарственные формы могут быть получены с помощью стандартных методов, хорошо известных в области фармацевтики. Все публикации, патенты и патентные документы включены в данное изобретение посредством ссылки, как если бы они были по отдельности включены посредством ссылок. Изобретение описано на примере различных конкретных и предпочтительных вариантов и способов реализации. Однако необходимо понимать, что в рамках настоящего изобретения возможны различные вариации и модификации рассмотренных вариантов и способов реализации в духе изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая множество частиц диоксида кремния, имеющих одну или более пор, и соединение формулы (I) или его фармацевтически приемлемую соль, нанесенные на частицы диоксида кремния, причем гигроскопичность частиц диоксида кремния и соединения формулы (I) выше, чем гигроскопичность смеси соединения/частиц диоксида кремния. 2. Фармацевтическая композиция по п.1, отличающаяся тем, что прессуемость композиции выше,чем прессуемость множества частиц твердого носителя. 3. Фармацевтическая композиция по п.1, отличающаяся тем, что частицы диоксида кремния имеют средний диаметр от примерно 10 до примерно 120 мкм и удельную поверхность, определенную по методу БЭТ, от примерно 40 до примерно 400 м 2/г и каждая из множества частиц диоксида кремния имеет одну или более пор. 4. Фармацевтическая композиция по п.3, отличающаяся тем, что диоксид кремния представляет собой гидрофильный высокодисперсный диоксид кремния. 5. Фармацевтическая композиция по любому из пп.3, 4, отличающаяся тем, что частицы диоксида кремния имеют средний диаметр 20-40 мкм. 6. Фармацевтическая композиция по любому из пп.3-5, отличающаяся тем, что частицы диоксида кремния имеют удельную поверхность, определенную по методу БЭТ, по меньшей мере 150 м 2/г. 7. Фармацевтическая композиция по любому из пп.3-6, отличающаяся тем, что соединение формулы (I) покрывает стенки пор и поверхность частиц диоксида кремния. 8. Фармацевтическая композиция по любому из пп.1-5, отличающаяся тем, что массовая доля соединения формулы (I) в расчете на массу частиц диоксида кремния составляет 5010%. 9. Фармацевтическая композиция по любому из пп.1-8, дополнительно включающая одно или более фармацевтически приемлемых вспомогательных веществ. 10. Фармацевтическая композиция по п.9, которая представлена в лекарственной форме для перорального введения. 11. Фармацевтическая композиция по любому из пп.1-10, отличающаяся тем, что соединение формулы (I) имеет повышенное до 991% содержание стереоизомера формулы (Ia) 12. Способ получения фармацевтической композиции по любому из пп.1-11, включающий нанесение соединения формулы (I) на множество частиц диоксида кремния в присутствии подходящего растворителя с получением смеси, причем гигроскопичность частиц диоксида кремния и соединения формулы (I) выше, чем гигроскопичность комбинации соединения/частиц диоксида кремния. 13. Способ по п.12, отличающийся тем, что прессуемость указанной смеси выше, чем прессуемость множества частиц диоксида кремния. 14. Способ по п.12, отличающийся тем, что частицы диоксида кремния имеют средний диаметр от примерно 10 до примерно 120 мкм и удельную поверхность, определенную по методу БЭТ, от примерно 40 до примерно 400 м 2/г и каждая из множества частиц диоксида кремния имеет одну или более пор. 15. Способ по п.14, отличающийся тем, что частицы диоксида кремния представляют собой гидрофильный высокодисперсный диоксид кремния. 16. Способ по п.14 или 15, отличающийся тем, что частицы диоксида кремния имеют средний диаметр 20-40 мкм. 17. Способ по любому из пп.14-16, отличающийся тем, что частицы диоксида кремния имеют удельную поверхность, определенную по методу БЭТ, по меньшей мере 150 м 2/г. 18. Способ по любому из пп.14-17, отличающийся тем, что отношение массы соединения формулы(I) к массе частиц диоксида кремния составляет 1.00.5. 19. Способ по любому из пп.14-18, отличающийся тем, что растворитель представляет собой (С 1 С 6)спирт. 20. Способ по любому из пп.14-18, отличающийся тем, что растворитель содержит этанол. 21. Фармацевтическая композиция, полученная способом, описанным в любом из пп.12-20. 22. Таблетка для ингибирования цитохрома Р-450, содержащая 1) соединение формулы (I) или его фармацевтически приемлемую соль, нанесенные на частицы диоксида кремния; и 2) множество частиц диоксида кремния, причем гигроскопичность частиц диоксида кремния и соединения формулы (I) выше, чем гигроскопичность смеси соединения/частиц диоксида кремния. 23. Таблетка по п.22, отличающаяся тем, что прессуемость таблетки выше, чем прессуемость множества частиц диоксида кремния. 24. Таблетка по п.22, отличающаяся тем, что частицы диоксида кремния имеют средний диаметр от примерно 10 до примерно 120 мкм и удельную поверхность, определенную по методу БЭТ, от примерно 40 до примерно 400 м 2/г и каждая из множества частиц диоксида кремния имеет одну или более пор. 25. Таблетка по любому из пп.22 или 24, дополнительно включающая другой терапевтический агент. 26. Таблетка по п.25, отличающаяся тем, что дополнительный терапевтический агент представляет собой дарунавир. 27. Таблетка по п.25, отличающаяся тем, что дополнительный терапевтический агент представляет собой атазанавир. 28. Таблетка по п.25, отличающаяся тем, что дополнительный терапевтический агент представляет собой дизопроксил фумарат тенофовира. 29. Таблетка по п.25, отличающаяся тем, что дополнительный терапевтический агент представляет собой элвитегравир. 30. Таблетка по п.25, отличающаяся тем, что дополнительный терапевтический агент представляет собой эмтрицитабин. 31. Таблетка по п.22, дополнительно включающая 3) микрокристаллическую целлюлозу; 4) гидроксипропилцеллюлозу; 5) кроскармеллозу натрия и 6) стеарат магния. 32. Таблетка по любому из пп.22-31, отличающаяся тем, что соединение формулы (I) имеет повышенное до 991% содержание стереоизомера формулы (Ia) 33. Таблетка по любому из пп.24-32, которая содержит примерно 10 мг соединения формулы (I); примерно 115 мг частиц диоксида кремния; примерно 151 мг микрокристаллической целлюлозы; примерно 6 мг гидроксипропилцеллюлозы; примерно 15 мг кроскармеллозы натрия и примерно 3 мг стеарата магния. 34. Таблетка по любому из пп.24-32, которая содержит примерно 25 мг соединения формулы (I); примерно 115 мг частиц диоксида кремния; примерно 136 мг микрокристаллической целлюлозы; примерно 6 мг гидроксипропилцеллюлозы; примерно 15 мг кроскармеллозы натрия и примерно 3 мг стеарата магния. 35. Таблетка по любому из пп.24-32, которая содержит примерно 100 мг соединения формулы (I); примерно 115 мг частиц диоксида кремния; примерно 61 мг микрокристаллической целлюлозы; примерно 6 мг гидроксипропилцеллюлозы; примерно 15 мг кроскармеллозы натрия и примерно 3 мг стеарата магния. 36. Фармацевтическая композиция, содержащая множество частиц диоксида кремния, соединение формулы (Ia) нанесенное на частицы диоксида кремния, дизопроксил фумарат тенофовира, эмтрицитабин и элвитегравир, причем гигроскопичность частиц диоксида кремния и соединения формулы (Ia) выше, чем гигроскопичность смеси соединения формулы (Ia)/частиц диоксида кремния. 37. Фармацевтическая композиция по п.36, отличающаяся тем, что прессуемость указанной композиции выше, чем прессуемость множества частиц твердого носителя. 38. Фармацевтическая композиция по п.36, отличающаяся тем, что частицы диоксида кремния имеют средний диаметр от примерно 10 до примерно 120 мкм и удельную поверхность, определенную по методу БЭТ, от примерно 40 до примерно 400 м 2/г и каждая из множества частиц диоксида кремния имеет одну или более пор. 39. Композиция по п.38, отличающаяся тем, что диоксид кремния представляет собой гидрофиль- 14022950 ный высокодисперсный диоксид кремния. 40. Композиция по любому из пп.38, 39, отличающаяся тем, что частицы диоксида кремния имеют средний диаметр 20-40 мкм. 41. Композиция по любому из пп.38-40, отличающаяся тем, что частицы диоксида кремния имеют удельную поверхность, определенную по методу БЭТ, по меньшей мере 150 м 2/г. 42. Композиция по любому из пп.38-41, отличающаяся тем, что соединение формулы (Ia) покрывает стенки пор и поверхность частиц диоксида кремния. 43. Композиция по любому из пп.38-42, отличающаяся тем, что отношение массы соединения формулы (Ia) к массе частиц диоксида кремния составляет 10.05%. 44. Композиция по п.38, которая представлена в лекарственной форме для перорального введения. 45. Таблетка для ингибирования цитохрома Р-450, содержащая фармацевтическую композицию по п.36 или 38.
МПК / Метки
МПК: A61K 9/20
Метки: применение, улучшения, кремния, агента, технологических, характеристик, носителя, диоксида, частиц, фармацевтического
Код ссылки
<a href="https://eas.patents.su/18-22950-primenenie-chastic-nositelya-dioksida-kremniya-dlya-uluchsheniya-tehnologicheskih-harakteristik-farmacevticheskogo-agenta.html" rel="bookmark" title="База патентов Евразийского Союза">Применение частиц носителя диоксида кремния для улучшения технологических характеристик фармацевтического агента</a>
Предыдущий патент: Распорное приспособление для обшивки стенки, содержащее зажимные щеки для зажатия мембраны, и устройство обшивки стенки, содержащее такое приспособление
Следующий патент: Способ и система прокладки подводных трубопроводов по дну водоема
Случайный патент: Способ и устройство для очистки сточных вод












