Способ желатинизации фиброина шелка и регулирования времени желатинизации, способ инкапсуляции по меньшей мере одного компонента в фиброин шелка (варианты)
Номер патента: 19118
Опубликовано: 30.01.2014
Авторы: Ван Сяоцин, Леиск Гэри Г., Каплан Дэвид Л., Клуге Джон
Формула / Реферат
1. Способ желатинизации фиброина шелка, включающий обработку фиброина шелка ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации, где желатинизация фиброина шелка происходит менее чем за 24 ч после обработки ультразвуком, при этом фиброин шелка находится в форме водного раствора с рН 7,5 или выше.
2. Способ по п.1, где желатинизация фиброина шелка происходит менее чем за два часа после обработки ультразвуком.
3. Способ по п.1, где фиброин шелка подвергают желатинизации в период времени в интервале от 5 мин до 2 ч после обработки ультразвуком.
4. Способ по п.1, где дополнительно при обработке используют раствор соли.
5. Способ по п.4, где используют раствор соли, содержащий ионы калия, кальция, натрия, магния, меди, цинка или их комбинаций.
6. Способ по п.5, где используют раствор соли калия с концентрацией менее 100 ммоль/л и рН 4 или ниже.
7. Способ регулирования времени желатинизации фиброина шелка путем обработки раствора фиброина шелка ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации, где фиброин шелка подвергают желатинизации в течение примерно 2 ч, и при этом фиброин шелка находится в форме водного раствора с рН 7,5 или выше.
8. Способ по п.7, где фиброин шелка подвергают желатинизации в период времени в интервале от 5 мин до 2 ч после обработки ультразвуком.
9. Способ по п.7, где время желатинизации регулируют амплитудой обработки ультразвуком и концентрацией раствора фиброина шелка.
10. Способ по п.7, где дополнительно при обработке используют раствор соли.
11. Способ по п.10, где время желатинизации регулируют концентрацией раствора фиброина шелка и концентрацией раствора соли.
12. Способ по п.11, где концентрация фиброина шелка составляет 4% (весовая концентрация) или ниже, раствор соли содержит ионы калия и концентрация раствора соли калия находится в пределах от 20 до 100 ммоль/л.
13. Способ по п.12, где время желатинизации регулируют концентрацией и рН раствора соли.
14. Способ по п.13, где используют раствор соли калия с концентрацией в пределах от 20 до 100 ммоль/л и рН 4 или ниже.
15. Способ инкапсуляции по меньшей мере одного компонента в фиброин шелка, включающий
обработку раствора фиброина шелка ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации, при этом фиброин шелка находится в форме водного раствора с рН 7,5 или выше; и
введение компонента(ов) в раствор фиброина шелка до того, как произойдет желатинизация для получения компонента, инкапсулированного в фиброин шелка.
16. Способ по п.15, где используют компонент, который является лечебным препаратом и/или биологическим материалом.
17. Способ по п.16, где используют компонент, который представляет собой по меньшей мере один биологический материал, выбранный из группы, содержащей клетки, белки, пептиды, нуклеиновые кислоты, пептид-нуклеиновые кислоты, аптамеры, антитела, гормоны, ростовые факторы, цитокины, ферменты, антимикробные вещества и их комбинации.
18. Способ по п.17, где в качестве клеток используют стволовые клетки.
19. Способ по п.17, где в фиброин шелка вместе с биологическим материалом вводят среду для роста клеток.
20. Способ по п.16, где используют компонент, который является лечебным препаратом.
21. Способ по п.15, где желатинизация происходит в течение 2 ч.
22. Способ по п.15, где желатинизация происходит в период времени в интервале от 5 мин до 2 ч.
23. Способ по п.15, где дополнительно при обработке используют раствор соли.
24. Способ инкапсуляции по меньшей мере одного компонента в фиброин шелка, включающий
введение компонента(ов) в раствор фиброина шелка, при этом фиброин шелка находится в форме водного раствора с рН 7,5 или выше; и
обработку раствора фиброина шелка ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации с получением компонента, инкапсулированного в фиброин шелка.
25. Способ по п.24, где используют компонент, который является лечебным препаратом.
26. Способ по п.24, где желатинизация происходит в течение примерно 2 ч.
27. Способ по п.24, где желатинизация происходит в период времени в интервале от 5 мин до 2 ч.
Текст
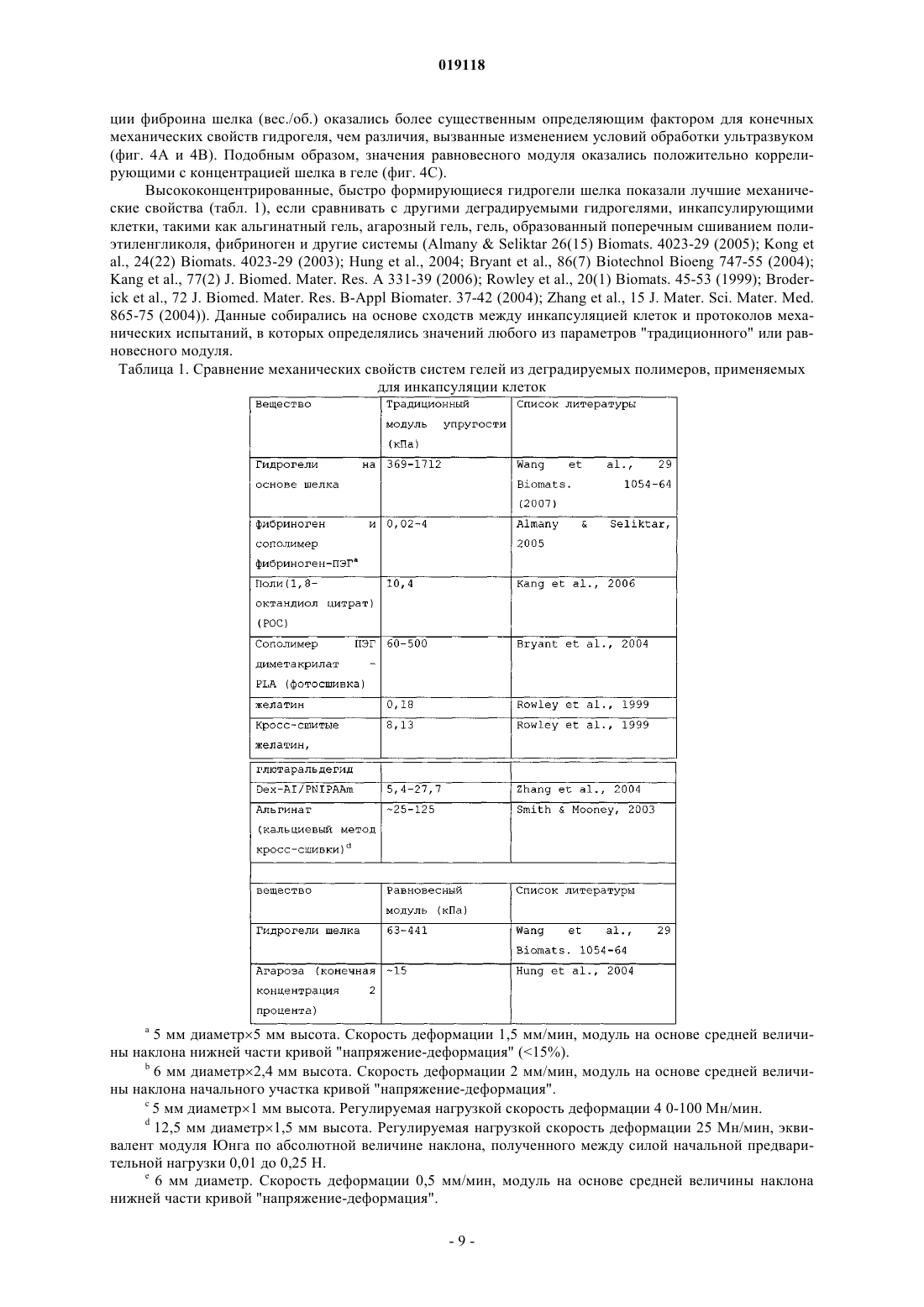
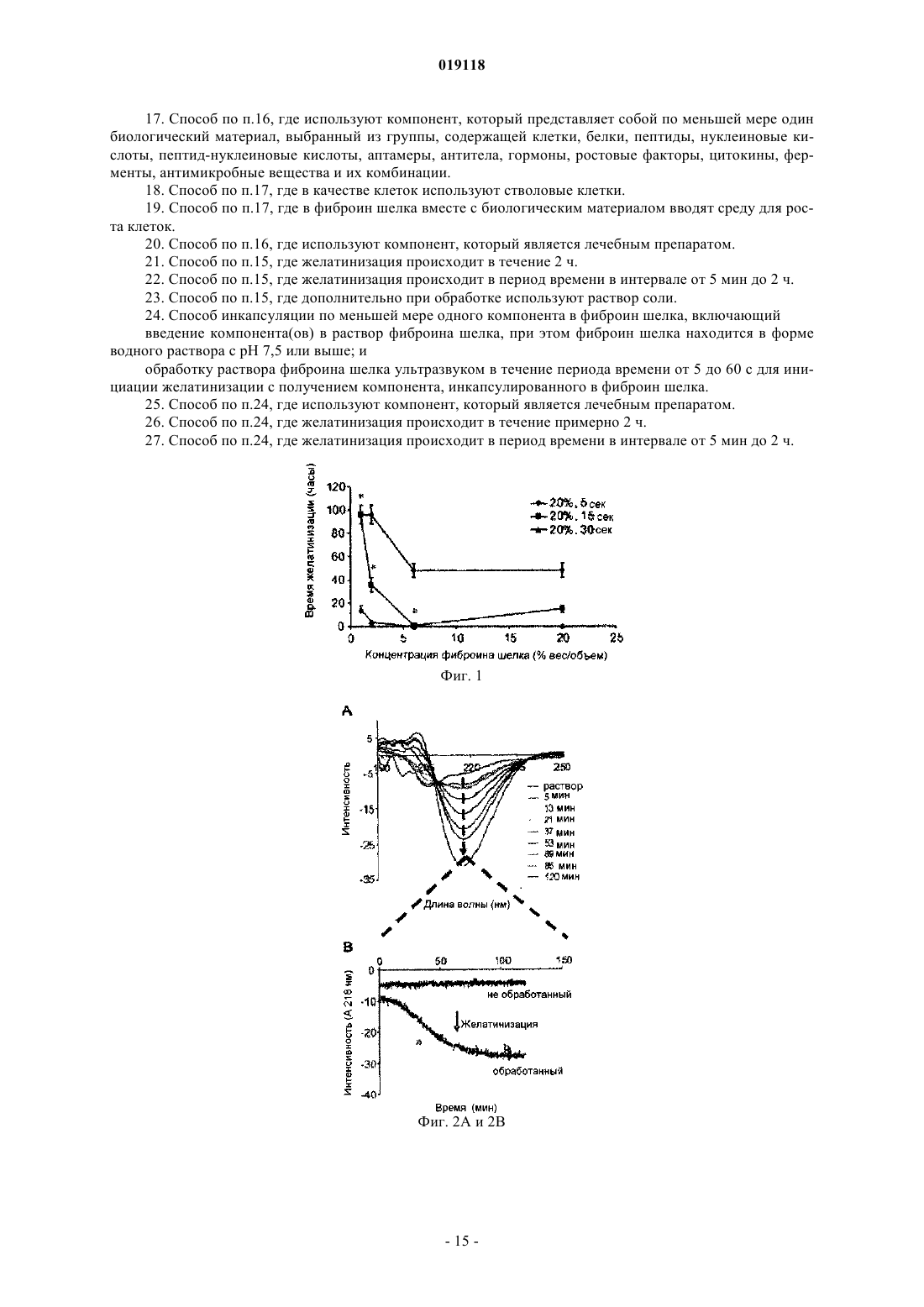
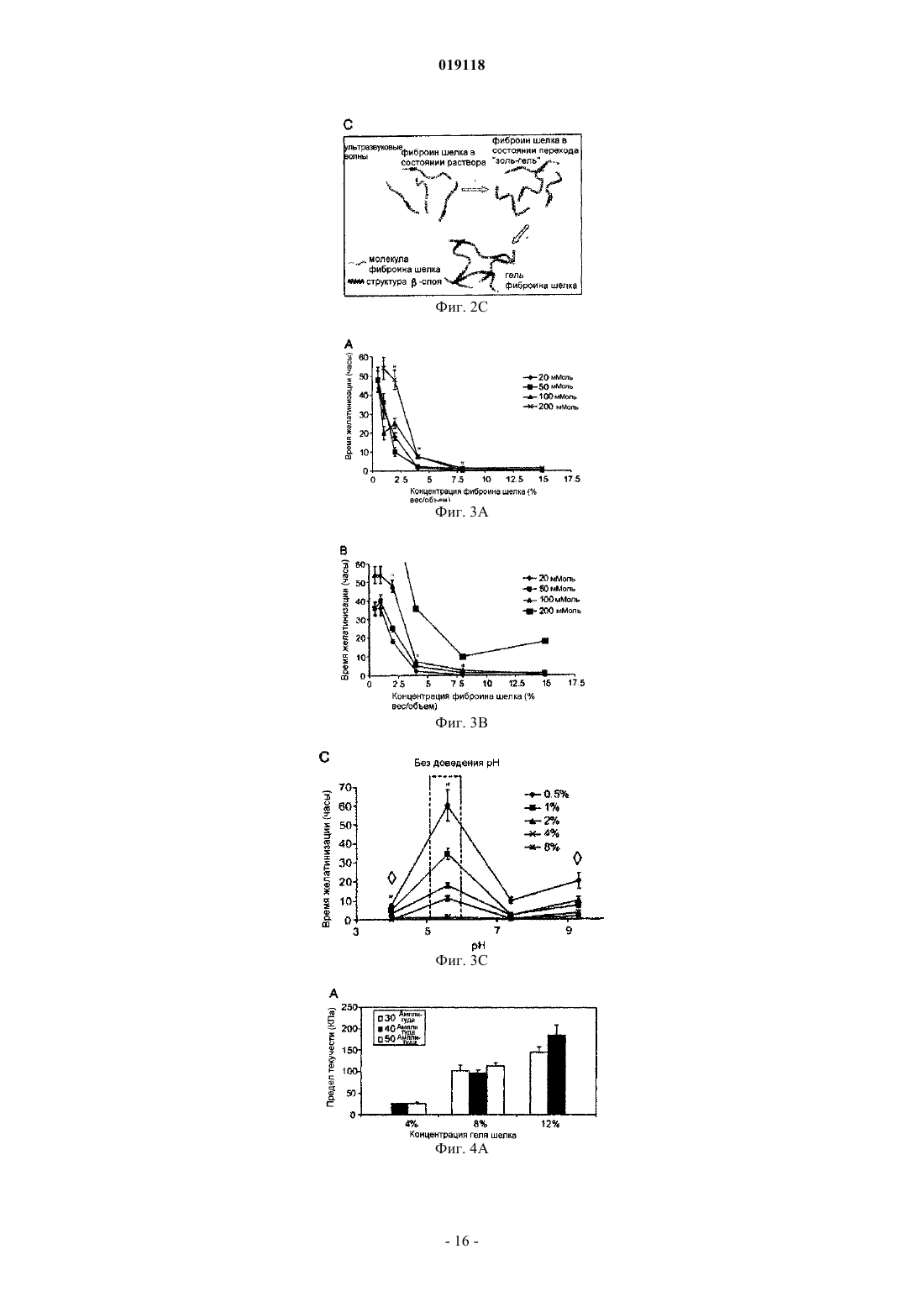
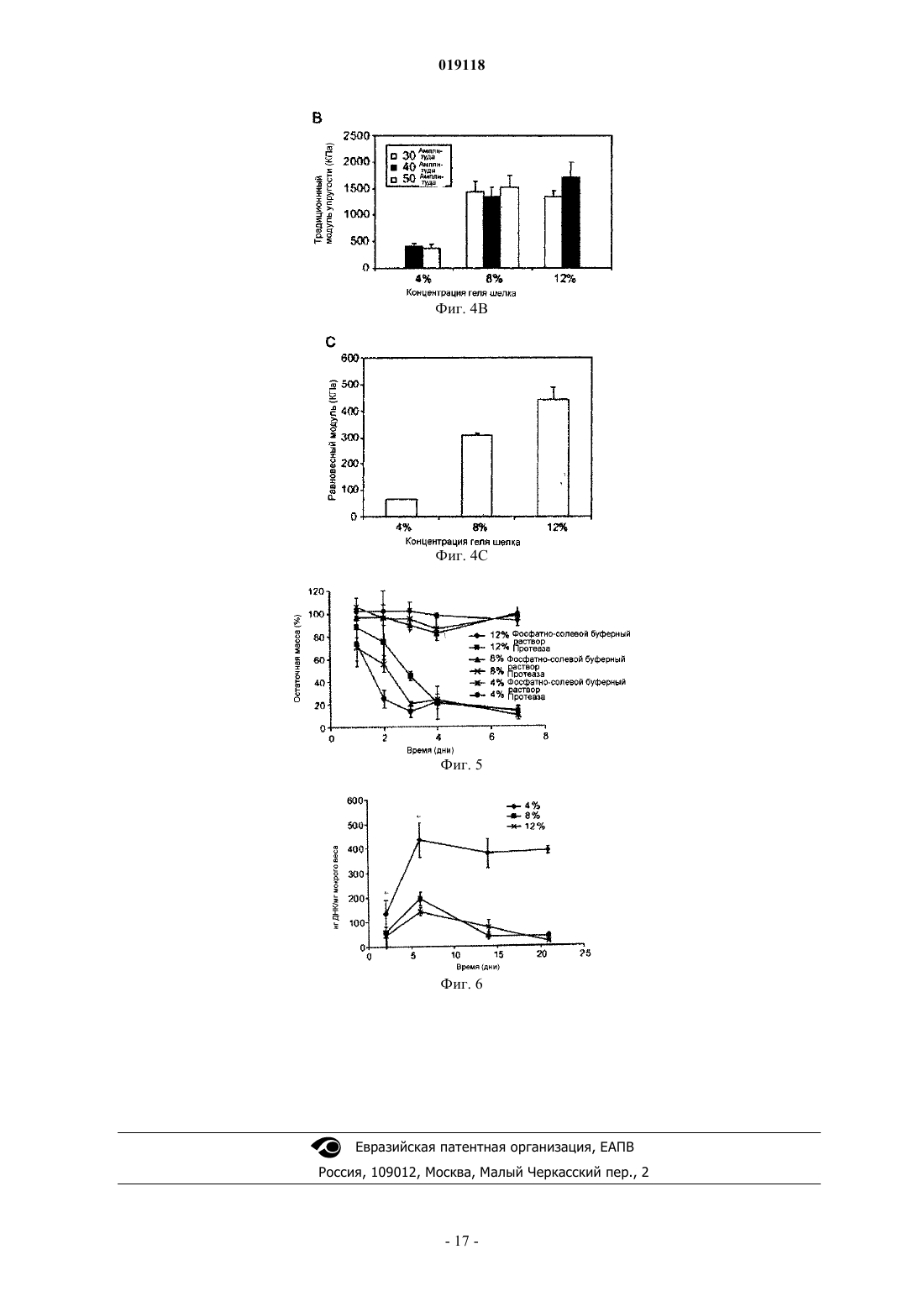
СПОСОБ ЖЕЛАТИНИЗАЦИИ ФИБРОИНА ШЕЛКА И РЕГУЛИРОВАНИЯ ВРЕМЕНИ ЖЕЛАТИНИЗАЦИИ, СПОСОБ ИНКАПСУЛЯЦИИ ПО МЕНЬШЕЙ МЕРЕ ОДНОГО КОМПОНЕНТА В ФИБРОИН ШЕЛКА (ВАРИАНТЫ) Изобретение относится к способу желатинизации фиброина шелка, который содержит обработку фиброина шелка, включая обработку ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации, где желатинизация фиброина шелка происходит менее чем за 24 ч после обработки ультразвуком, при этом фиброин шелка находится в форме водного раствора с рН 7,5 или выше. Изобретения также относится к способу регулирования времени желатинизации фиброина шелка путем ультразвуковой обработки раствора фиброина шелка в течение периода времени, достаточного для инициации желатинизации. Также предложены способы инкапсуляции по меньшей мере одного компонента в фиброин шелка, который включает обработку раствора фиброина шелка ультразвуком в течение периода времени, достаточного для инициации желатинизации, при этом фиброин шелка находится в форме водного раствора с рН 7,5 или выше. Полученный вышеуказанным способом инкапсулированный в фиброин шелка биологический материал подходит для приспособления для биодоставки.(71)(73) Заявитель и патентовладелец: ТРАСТИЗ ОФ ТАФТС КОЛЛЕДЖ Область техники Изобретение обеспечивает способы желатинизации фиброина шелка путем ультразвуковой обработки. Гидрогели, полученные данным способом, могут быть полезны, например, в качестве систем биодоставки. Уровень техники Биосовместимые и биологически разлагаемые полимерные гидрогели представляют собой полезные носители для доставки биоактивных молекул и клеток для применения в таких областях биомедицины, как тканевая инженерия и контролируемая скорость высвобождения лекарств. Очищенный нативный фиброин шелка формирует из водных растворов структуры гидрогелей, обогащенные складчатыми слоями с поперечными межмолекулярными связями, причем детали процесса и свойства геля зависят от параметров окружающей среды. В предшествующих методиках время желатинизации часто составляло дни и недели для водных растворов природного белка шелка, а для повышения кинетики использовались такие параметры, как высокая температура и низкий рН. Такие условия, хотя и пригодны для введения некоторых биоактивных молекул, могут оказаться слишком медленными для введения активной клетки и лабильных биоактивных молекул. Следовательно, в данной области техники существует необходимость в разработке способов быстрой желатинизации фиброина шелка при мягких физиологических условиях. Сущность изобретения Настоящее изобретение относится к способу желатинизации фиброина шелка. Способ желатинизации фиброина шелка согласно изобретению содержит обработку фиброина шелка, включая обработку ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации, где желатинизация фиброина шелка происходит менее чем за 24 ч после обработки ультразвуком, при этом фиброин шелка находится в форме водного раствора с рН, 7,5 или выше. Предпочтительно желатинизация фиброина шелка происходит менее чем за два часа после обработки ультразвуком. Причем фиброин шелка подвергают желатинизации в период времени в интервале от 5 мин до 2 ч после обработки ультразвуком. Обработку далее осуществляют с включением раствора соли, где раствор соли содержит ионы, выбранные из группы, состоящей из калия, кальция, натрия, магния, меди, цинка и их комбинаций. Предпочтительно фиброин шелка находится в форме водного раствора с рН, составляющим рН 4 или ниже, либо составляет рН 7,5 или выше, а соль является солью калия, концентрация соли менее 100 ммоль/л, а рН раствора соли составляет рН 4 или ниже. Вариант осуществления изобретения также относится к способу регулирования времени желатинизации фиброина шелка путем ультразвуковой обработки раствора фиброина шелка в течение периода времени, достаточного для инициации желатинизации. Способ регулирования времени желатинизации фиброина шелка путем обработки раствора фиброина шелка ультразвуком сргласно изобретению осуществляют в течение периода времени от 5 до 60 с для инициации желатинизации, где фиброин шелка подвергают желатинизации в течение примерно 2 ч при этом фиброин шелка находится в форме водного раствора с рН, 7,5 или выше. Предпочтительно фиброин шелка подвергают желатинизации в период времени в интервале от 5 мин до 2 ч после обработки ультразвуком, причем время желатинизации регулируют амплитудой обработки ультразвуком и концентрацией раствора фиброина шелка. Обработку далее осуществляют с включением раствора соли. Время желатинизации регулируют концентрацией раствора фиброина шелка и концентрацией раствора соли, где концентрация фиброина шелка составляет 4% (весовая концентрация) или ниже, раствор соли содержит ионы калия, и концентрация раствора соли калия находится в пределах от 20 до 100 ммоль/л. Время желатинизации регулируют концентрацией и рН раствора соли, где раствор соли содержит ионы калия, концентрация раствора соли калия находится в пределах от 20 до 100 ммоль/л и рН раствора составляет рН 4 или ниже. Предпочтительно время желатинизации составляет менее 2 ч. Следующий вариант осуществления относится к инкапсуляции компонента в фиброин шелка. Способ инкапсуляции по меньшей мере одного компонента в фиброин шелка согласно изобретению включает обработку раствора фиброина шелка ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации, при этом фиброин шелка находится в форме водного раствора с рН, 7,5 или выше; и введение компонента(ов) в раствор фиброина шелка до того, как произойдет желатинизация в растворе фиброина шелка; для получения компонента, инкапсулированного в фиброин шелка. Компонент может являться лечебным препаратом или биологическим материалом или и тем и другим. Также компонент может являться лечебным средством. Предпочтительно компонент представляет собой по меньшей мере один биологический материал,выбранный из группы, содержащей клетки, белки, пептиды, нуклеиновые кислоты, пептиднуклеиновые кислоты, аптамеры, антитела, гормоны, ростовые факторы, цитокины, ферменты, антимикробные вещества и их комбинации. Причем указанные клетки являются стволовыми клетками. В фиброин шелка вместе с биологическим материалом может вводиться среда для роста клеток. При этом желатинизация происходит в течение 2 ч. Предпочтительно желатинизация происходит в период времени в интервале от 5 мин до 2 ч. При этом обработку далее осуществляют с включением раствора соли. Предпочтительно фиброин шелка находится в форме водного раствора с рН, составляющим рН 4 или ниже, либо составляет рН 7,5 или выше. В другом варианте способ инкапсуляции по меньшей мере одного компонента в фиброин шелка включает введение компонента(ов) в раствор фиброина шелка, при этом фиброин шелка находится в форме водного раствора с рН, 7,5 или выше; и обработку раствора фиброина шелка ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации; для получения компонента, инкапсулированного в фиброин шелка. Еще одним аспектом заявленного изобретения является инкапсулированный в фиброин шелка биологический материал полученный вышеуказанным способом, где инкапсулированный в фиброин шелка биологический материал подходит для приспособления для биодоставки. Как указано выше, способ включает ультразвуковую обработку раствора фиброина шелка в течение периода времени, достаточного для инициации желатинизации, и введение компонента в раствор фиброина шелка до того, как в растворе фиброина шелка произойдет значительная желатинизация, таким образом получая компонент, инкапсулированный в фиброин шелка. В качестве альтернативы, компонент может быть добавлен в фиброин шелка перед обработкой ультразвуком. Компонент может представлять собой лечебный препарат или биологический материал, такой как клетка. К примеру мезенхимальные стволовые клетки, происходящие из костного мозга человека (hMSCs), были успешно введены в гидрогели фиброина шелка после обработки ультразвуком, за которой следовали быстрая желатинизация и поддержание клеточной функции. Гидрогели, полученные согласно способу изобретения, демонстрируют хорошие механические свойства и профили протеолитической деградации. Например, обработанные ультразвуком растворы фиброина шелка 4, 8 и 12% (вес./об.), с последующим добавлением hMSCs, желатинировались в период от 0,5 до 2 ч. Клетки росли и пролиферировали в 4% гелях в течение двадцати одного дня. Кроме того,низкие концентрации ионов K+ и низкие значения рН могут применяться для ускорения желатинизации. Описание чертежей Фиг. 1 иллюстрирует желатинизацию фиброина шелка (SF) при различных условиях обработки ультразвуком. Использовалось 0,5 мл водного раствора, обработка ультразвуком осуществлялась при амплитуде 20% и в течение времени от 5 до 30 с. Приведены средние величиныстандартное отклонение не менее чем по N=3 образцам для каждой группы. Значимые различия между группами (критерий Стьюдента, р 0,01). Фиг. 2 А-2 С иллюстрируют динамическое формирование -складчатых структур в течение процесса желатинизации. Фиг. 2 А показывает измерения кругового дихроизма (CD) для обработанных ультразвуком 2% (вес./об.) водных растворов фиброина шелка со сканированием длины волны каждые 8 мин после обработки ультразвуком в течение 120 мин. Фиг. 2 В показывает график увеличения эллиптичности при длине волны 217 нм (пик, соответствующий структуре -складчатого слоя), зарегистрированного в указанное время. Фиг. 2 С является схематической иллюстрацией механизма желатинизации шелка. Процесс желатинизации включает два кинетических этапа (а) структурный переход от случайной спирали к структуре -складчатого слоя с некоторыми межцепочечными физическими поперечными сшивками,образующимися за короткий промежуток времени; (b) распространение структуры -складчатого слоя с образованием большого количества межцепочечных поперечных взаимодействий, свойственных слоям, и организацией молекул в сеть геля за относительно длинный промежуток времени. Фиг. 3 А-3 С демонстрируют влияние соли и рН на желатинизацию фиброина шелка. До обработки ультразвуком растворы в различной концентрации были дополнены K+ (фиг. 3 А) и Са 2+ (фиг. 3 В) до конечных концентраций 20-200 мМоль. Фиг. 3 С показывает влияние изменения рН водного раствора фиброина шелка перед обработкой ультразвуком. Ультразвуковая обработка проводилась при амплитуде 20% в течение 15 с для всех образцов. Приведены средние величиныстандартное отклонение не менее чем по N=3 образцам для каждой группы. Значимые различия между группами (критерий Стьюдента,р 0,05). Фиг. 4 А-4 С демонстрирует графики анализа механических свойств гидрогелей фиброина шелка. Два верхних графика показывают опубликованные результаты для гидрогелей, не подвергавшихся обработке ультразвуком, а два нижних графика показывают результаты для гидрогелей, обработанных ультразвуком соответственно способу изобретения. Два графика слева демонстрируют эффекты напряжения при сжатии, а два графика справа демонстрируют эффекты модуля упругости при сжатии. Приготовление гидрогелей из водных растворов фиброина шелка (два верхних графика) проводилось при различных температурах, гидрогели, полученные обработкой ультразвуком (два нижних графика), были приготовлены при различных условиях обработки ультразвуком. Приведены средние величиныстандартное отклонение не менее чем по N=3 образцам. Фиг. 5 описывает ферментативную деградацию гидрогелей фиброина шелка. Гидрогели с концентрациями 4, 8 и 12% (вес./об.) были получены путем обработки ультразвуком и погружены либо в фосфатно-солевой буферный раствор рН 7,4 (контроль), либо в фосфатно-солевой буферный раствор, со-2 019118 держащий протеазу XIV (5 ед./мл) в течение семи дней. Остаточная масса была определена путем сравнения мокрого веса пробок геля в каждой временной точке с исходным мокрым весом. Приведены средние величиныстандартное отклонение не менее чем по N=4 образцам. Фиг. 6 графически описывает количественный анализ по ДНК клеток hMSCs, инкапсулированных в гидрогели фиброина шелка. Содержание ДНК в каждой группе гелей анализировалось с использованием красителя PicoGreen, результаты нормализовались по значениям мокрого веса каждой пробки геля. Приведены средние величиныстандартное отклонение не менее чем по N=4 образцам для каждой группы. 3 начимые различия между группами (критерий Стьюдента, р 0,05). Подробное описание изобретения Следует понимать, что настоящее изобретение не ограничено конкретными методикой, протоколами, реагентами и тому подобными, которые описаны в данном тексте и, соответственно, могут варьировать. Терминология, используемая в данном тексте, применяется только с целью описания конкретных вариантов осуществления изобретения и не предполагает ограничения объема настоящего изобретения,который определяется исключительно формулой изобретения. Формы единственного числа, использованные в данном тексте и формуле изобретения, включают множественное число и наоборот, при условии, что контекст в явном виде не указывает на обратное. При использовании в данном тексте, за исключением рабочих примеров, либо случаев, где указано обратное,все числа, выражающие количества ингредиентов или условия реакции, следует понимать как преобразованные во всех возможных случаях определением "примерно". Все указанные патенты либо другие публикации в явном виде введены ссылкой с целью описания и раскрытия, например, методов, описанных в таких публикациях, которые могут применяться в связи с настоящим изобретением. Данные публикации приведены исключительно в связи с их раскрытием до даты подачи настоящей заявки на изобретение. При этом ничто не должно быть истолковано как допущение, что авторы настоящего изобретения не имеют права противопоставить такое раскрытие с более ранним приоритетом на основании предшествующего изобретения или по каким-либо иным причинам. Все утверждения касательно даты представления и содержания этих документов основаны на информации, доступной заявителям, и не являются допущением в отношении дат либо содержания данных документов. Если не указано обратное, все технические и научные термины, использованные в данном тексте,имеют то же значение, которое обычно предполагается специалистом в области техники, к которой принадлежит настоящее изобретение. Хотя при применении или испытании изобретения могут использоваться различные известные методики, приспособления и материалы, при этом конкретные методики,приспособления и материалы описаны в данном тексте. Настоящее изобретение относится к способу быстрой желатинизации фиброина шелка. Способ описывает подвергание фиброина шелка обработке, включающей обработку ультразвуком в течение периода времени, достаточного для инициации желатинизации. Данный подход предоставляет методики,основанные на обработке ультразвуком, применяемые для ускорения перехода "золь-гель" контролируемым по времени образом. Время желатинизации может регулироваться от минут до часов на основе используемых параметров ультразвуковой обработки (выходная мощность, длительность по времении другие) и концентрации фиброина шелка в пределах физиологически приемлемых условий. После обработки ультразвуком, фиброин шелка претерпевает быстрые структурные изменения от случайных спиралей в -слои, соответственно желатинизации. Компонент, например лечебный препарат или биологический фактор, может быть добавлен до, во время либо после обработки ультразвуком и инкапсулирован в процессе желатинизации. Таким образом, настоящее изобретение предоставляет способы, полезные для различных биомедицинских целей, таких как те, в которых инкапсуляция клеток чувствительна ко времени. Гидрогели рассматриваются как полезные связующие для инкапсуляции и доставки клеток и биоактивных молекул, например, в целях тканевой инженерии и клеточной терапии, благодаря высокому содержанию воды; обычно 30% (ParkLakes, BIOMATS: INTRO. 2nd ed., Plenum Press, NY, 1992). Гидрогели, используемые в подобных целях, обладают механическими и структурными свойствами, схожими с некоторыми тканями и внеклеточными матриксами (ЕСМ), следовательно, они могут быть имплантированы с целью восстановления ткани или локального высвобождения лечебных препаратов. Для инкапсуляции и доставки клеток гидрогели предпочтительно должны быть образованы без повреждения клеток, быть нетоксичными для клеток и окружающей ткани, быть биосовместимыми, обладать подходящей способностью к переносу вещества для обеспечения диффузии питательных веществ и метаболитов, обладать достаточной механической целостностью и устойчивостью к манипуляциям, связанным с имплантацией, иметь контролируемые времена жизни, и должны сохранять объем геля после имплантации в течение адекватного конкретным целям периода времени (DruryMooney, 24 Biomats. 4337-51(2003). Для образования гидрогелей используется множество таких синтетических материалов, как полиэтилен оксид (РЕО), поливиниловый спирт (PVA), полиакриловая кислота (РАА), сополимер полипропилен фумарата и этиленгликоля (Р(PF-CO-EG, и такие вещества природного происхождения, как агароза,-3 019118 альгинат, хитозан, коллаген, фибрин, желатин и гиалуроновая кислота (НА). Желатинизация происходит,когда полимерные цепи сшиваются, химически или физически, в сети, что инициируется химическими реагентами (к примеру, кросс-линкерами) либо физическими стимуляторами (к примеру, рН и/или температура). Гидрогели, образованные синтетическими полимерами, предлагают преимущества в желатинизации и свойствах геля, которые контролируемы и воспроизводимы путем использования конкретных молекулярных весов, блочных структур и способа образования поперечных сшивок. Как правило, желатинизация природных полимеров в меньшей степени поддается контролю, хотя имеется тенденция к их использованию в качестве носителей клеток и биоактивных молекул для тканевой инженерии и имплантируемых медицинских устройств, так как их макромолекулярные свойства в большей степени схожи с таковыми внеклеточного матрикса, а продукты деградации не токсичны (Lee et al., 221 Int'l J. Pharma. 122 (2001); Smidsrod et al., 8 Trends Biotech. 71-78 (1990). Среди биоматериалов природного происхождения белок фиброина шелка, самоорганизующийся структурный белок в природных нитях тутового шелкопряда, изучался из-за его прекрасных механических показателей, биосовместимости, контролируемых скоростей деградации и индуцируемого формирования кристаллической структуры сетей -слоев (Altman et al., 24 Biomats. 401-16 (2003); JinKaplan,424 Nature 1057-61 (2003); Horan et al., 26 Biomats. 3385-93 (2005); Kim et al., 26 Biomats. 2775-85 (2005);Ishida et al., 23 Macromolecules 88-94 (1990); Nazarov et al., 5 Biomacromolecules 718-26 (2004. Фиброин шелка производился как материал с различными формальными параметрами, включая пленки, трехмерный пористый матрикс, электроформованные волокна и микросферические частицы для целей тканевой инженерии и контролируемого высвобождения лекарственных препаратов (Jin et al., 5 Biomacromolecules 711-7 (2004); Jin et al., 3 Biomacromolecules, 1233-39 (2002); Hino et al., 266 J. Colloid Interface Sci. 68-73(2003); Wang et al., 117 J. Control Release, 360-70 (2007. В природе водный раствор фиброина шелка производится в заднем отделе железы шелкопряда и затем хранится в среднем отделе в концентрации вплоть до 30% (вес./об.), при этом имеет высокое содержание случайных спиралей или альфа-спиральных структур. В процессе вытягивания нити на воздух,высокая сила трения и продольный поток вызывают самоорганизацию и структурный переход к структуре -слоев, что ведет к образованию твердых нитей (VollrathKnight, 410 Nature, 541-48 (2001. Присутствие ионов металла и изменения рН в различных отделах железы влияет на этот переход (Chen et al.,3 Biomacromolecules 644-8 (2002); Zhou et al., 109 J. Phys. Chem. В 16937-45 (2005); Dicko et al., 5 Biomacromolecules 704-10 (2004); Terry et al., 5 Biomacromolecules 768-72 (2004. In vitro водные растворы очищенного фиброина шелка претерпевают самоорганизацию в структуры (3-слоев и формируют гидрогели. На этот переход "золь-гель" оказывают влияние температура, рН и ионная сила (Wang et al., 36 Int'l J.Chem. В 21630-38 (2006. Предел прочности на сжатие и модуль гидрогелей шелка повышаются с увеличением концентрации фиброина шелка и температуры (Kim et al., 2004). Гидрогели фиброина шелка представляют интерес для многих биомедицинских целей. Например,гидрогели фиброина применялись в качестве костных заменителей для лечения дефектов губчатой кости критических размеров в дистальной части бедра кролика, где гели шелка демонстрировали лучшее восстановление кости, чем сополимер (D,L лактид-гликолид), взятый в качестве контроля (Fini et al., 26Biomats. 3527-36 (2005. Для многих областей применения клеточной терапии желатинизация должна быть индуцирована в относительно мягких условиях в относительно короткий промежуток времени (в течение часов). Если не рассматривать нефизиологические воздействия (такие как низкий рН, высокая температура, добавки),время желатинизации шелка может оказаться чрезмерно продолжительным в отсутствие химических модификаций природного белка фиброина шелка. Для концентраций фиброина шелка от 0,6 до 15%(вес./об.) время перехода "золь-гель" занимало от дней до недель при комнатной температуре или 37 С(Kim et al., 2004; Matsumoto et al., 2006; Fini et al., 2005. Добавление солей в концентрациях, превышающих физиологические уровни, незначительно изменяет кинетику желатинизации (Kim et al., 2004). Снижение рН (рН 5) или повышение температуры (60 С) могло уменьшить время желатинизации до нескольких часов (Kim et al., 2004; Fini et al., 2005; Motta et al., 15 J. Biomater. Sci. Polymer. Edu. 851-64(2004, но эти условия потенциально изменяют клеточную функцию и влияют на выживаемость клеток. В настоящем изобретении новейшие способы улучшения технологии и контроля желатинизации фиброина шелка усовершенствованы посредством обработки ультразвуком. Более конкретно, представлен новый способ, основанный на обработке ультразвуком, что улучшает переход "золь-гель" контролируемым во времени образом. Механически, процедура индуцирует физическую сшивку -слоев путем изменения гидрофобной гидратации белковых цепей фиброина. Способ позволяет добавлять клетки после обработки ультразвуком, за которой следует быстрая желатинизация. Время желатинизации может регулироваться от минут до часов путем выбора параметров обработки ультразвуком (выходная мощность и длительность) и концентраций фиброина шелка. Далее, способ обусловливает корректировку эффектов рН и концентрации соли на процесс желатинизации; динамические структурные изменения шелка после желатинизации; и поведение инкапсулированных клеток, таких, как мезенхимальные ство-4 019118 ловые клетки костного мозга человека (hMSCs), в гелях шелка. В соответствии с настоящим изобретением может использоваться любой тип фиброина шелка. Фиброин шелка, производимый шелкопрядами, такими как Bombyx mori, является наиболее распространенным и представляет собой экологически чистый, возобновляемый ресурс. Натуральные коконы шелкопряда являются коммерчески доступными. Существует, однако, множество видов шелка, включая шелк золотого кругопряда (Nephila clavipes), трансгенные шелка, генно-инженерные шелка и их варианты,которые могут быть использованы в качестве альтернативы. Водный раствор фиброина шелка может быть получен из коконов шелкопряда с применением техник, известных в данной области. Подходящие методики получения раствора фиброина шелка раскрыты, например, в WO/2005/012606. К примеру,шелк, используемый в биополимерах шелка, может быть получен путем экстракции серицина из коконов В. mori. Значимая желатинизация обычно происходит в течение 24 ч после обработки ультразвуком. Например, гель фиброина шелка образуется менее чем через четыре часа после обработки ультразвуком, к примеру, в течение 2 ч после обработки ультразвуком. В предпочтительном варианте воплощения фиброин шелка подвергается желатинизации в период времени от примерно 5 мин до примерно 2 ч после обработки ультразвуком. Таким образом, в зависимости от потребностей, время желатинизации может занимать от минут до часов, с учетом параметров обработки ультразвуком, используемых для изготовления раствора. Процедуры обработки ультразвуком известны в данной области техники. Для целей настоящего приложения, термины "ультрасоникация" и "обработка ультразвуком" используются как взаимозаменяемые и имеют одно значение. Обработка ультразвуком может осуществляться любыми способами, известными в данной области техники, которые применимы к обработке ультразвуком фиброина шелка. Обработка ультразвуком может предусматривать однократную обработку ультразвуком фиброина шелка, либо включать в себя множество отдельных воздействий. Обработка ультразвуком изучалась в контексте структурных изменений белка (Meinel et al., 71 J. Biomed. Mater. Res. A 25-34 (2004); Meinel et al.,88 Biotechnol. Bioeng. 379-91 (2004, и применялась для получения больших зон фазовых границ жидкость-газ, эффектов локального нагрева, механического/сдвигового напряжения и реакций свободных радикалов. В отличие от этого, в других исследованиях, связанных с желатинизацией белков, собранные белковые нано-волокна в геле дробились на более мелкие фрагменты при ультразвуковом воздействии(Hung et al., 32 Ann. Biomed. Eng. 35-49 (2004. В контексте "золь-гель" перехода для полимеров, обработка ультразвуком обычно использовалась для разрушения сетевых сшивок в геле и разжижения гидрогелей. Настоящее изобретение обусловливает новое применение обработки ультразвуком для стимуляции "золь-гель" перехода для шелка. Обработка ультразвуком должна длиться в течение периода времени, достаточного для инициации процесса желатинизации, но не такого долгого, чтобы нарушались механические свойства гидрогеля. Обычно, обработка ультразвуком может длиться от примерно 5 с до примерно 60 с, в зависимости от количества используемого фиброина шелка, концентрации раствора и других факторов, определяемых специалистами в данной области техники. Например, обработка ультразвуком длится от примерно 15 с до примерно 45 с. Желатинизация обычно начинается в начале обработки ультразвуком и продолжается после окончания процедуры. Обработка ультразвуком может включать другие виды воздействия, способствующие процессу желатинизации. Например, обработка может включать эффекты солевого раствора. Растворы солей известны в данной области техники как фактор, способствующий индукции желатинизации. Могут применяться обычные солевые растворы, содержащие ионы калия, кальция, натрия, магния, меди и/или цинка. Наличие калия в растворе соли может быть предпочтительно в данном контексте. Обработка также включает регулирование рН водного раствора фиброина. Как известно в данной области техники, доведение рН водного раствора может способствовать индукции желатинизации. Более конкретно, эффективной может быть корректировка рН до более высоких или низких значений. Так, например, может применяться водный раствор с рН около рН 4 или ниже, либо примерно рН 7,5 или выше. Особенно эффективным оказывается использование солевого раствора калия в низких концентрациях и с низким рН. Предпочтительный вариант осуществления изобретения ориентирован на использование соли калия, где концентрация соли менее 100 ммоль/л, а рН раствора около рН 4 или ниже. Изобретение также предусматривает способ регулирования времени желатинизации фиброина шелка путем обработки раствора фиброина шелка ультразвуком в течение периода времени, достаточного для инициации желатинизации, при условии, что желатинизация займет не более примерно 2 ч. Обработка ультразвуком приводит к взаимодействиям между цепями фиброина шелка. Предпочтительный вариант осуществления предусматривает способ регулирования времени желатинизации таким образом, что фиброин шелка подвергается желатинизациии в течение временного промежутка от примерно пяти минут до примерно 2 ч после процедуры обработки ультразвуком. Кроме того, для регулирования времени желатинизации могут применяться различные другие факторы. Например, время желатинизации может регулироваться изменением таких параметров, как амплитуда обработки ультразвуком и концентрация раствора фиброина шелка. Например, амплитуда находит-5 019118 ся в пределах от примерно 25% до примерно 35% выходной мощности (обычно от 7 до 10 Вт), а концентрация фиброина шелка находится в пределах от примерно 10% до примерно 15% (вес./об.). В следующем варианте осуществления изобретения, амплитуда находится в пределах от примерно 25% до примерно 55% выходной мощности (обычно, от 7 до 21 Вт), а концентрация фиброина шелка находится в пределах от примерно 5% до примерно 10% (вес./об.). Специалисты в данной области техники, опираясь на представленную патентную заявку, способны варьировать амплитуду обработки ультразвуком и концентрацию раствора фиброина шелка для достижения требуемой степени желатинизации и требуемого периода времени, за который происходит желатинизация. Также, время желатинизации может регулироваться путем добавления солевого раствора и подбора концентрации раствора фиброина шелка и концентрации солевого раствора. Солевой раствор может включать ионы калия, но также возможно использование других солевых растворов. В конкретном варианте осуществления изобретения концентрация фиброина шелка составляет 4% (вес./об.) или ниже, а концентрация раствора соли калия находится в пределах от 20 до 100 ммоль/л. Кроме того, время желатинизации может регулироваться подбором концентрации и рН солевого раствора, особенно если солевой раствор содержит ионы калия. В конкретном варианте осуществления изобретения солевой раствор представляет собой раствор соли калия с рН примерно рН 4 или ниже. Например, раствор соли калия имеет концентрацию от 20 до 100 ммоль/л. Изобретение также относится к способу инкапсуляции не менее одного компонента в фиброин шелка. Способ включает в себя (а) подвергание раствора фиброина шелка обработке ультразвуком в течение периода времени, достаточного для инициации желатинизации; и (b) введение компонента в фиброин шелка до того, как в растворе фиброина шелка произойдет существенная желатинизация, тем самым образуя инкапсулированный в фиброин шелка компонент. Компонент может быть введен в раствор фиброина шелка до, во время, или после обработки ультразвуком. Компонент может представлять собой любой материал, способный к инкапсуляции в гель фиброина шелка. Например, компонент может являться лечебным средством, таким как малые молекулы и препараты, либо биологическим материалом, таким как клетки (включая стволовые клетки), белки, пептиды,нуклеиновые кислоты (ДНК, РНК, миРНК), пептид - нуклеиновые кислоты, аптамеры, антитела, гормоны, ростовые факторы, цитокины или ферменты. Инкапсуляция лечебных средств или биологического материала необходима, поскольку инкапсулированный продукт может применяться в биомедицинских целях. При инкапсуляции лечебного средств препарат может быть введен в раствор фиброина шелка до, во время или после обработки ультразвуком, так как на большинстве лечебных препаратов обработка ультразвуком не сказывается отрицательным образом. С другой стороны, при инкапсуляции биологического материала обработка ультразвуком может негативно сказаться на биологическом материале, который,как правило, не должен быть введен в раствор фиброина шелка до окончания обработки ультразвуком. Возможно, эта мера не необходима для всех биологических материалов, но известно, что обработка ультразвуком повреждает или разрушает живые клетки, так что можно проявить предусмотрительность. В случае, когда компонент вводится после обработки ультразвуком, могут быть подобраны такие условия обработки ультразвуком, что желатинизация занимает некоторый период времени после обработки ультразвуком. Если желатинизация происходит во время обработки ультразвуком или сразу после ее окончания, времени может оказаться недостаточно для введения лечебного средства в раствор фиброина шелка. Например, в случае, когда компонент вводится после обработки ультразвуком, фиброин шелка подвергается желатинизации в период времени от примерно 5 мин до примерно 2 ч после обработки ультразвуком. Если компонент вводится до или во время обработки ультразвуком, желатинизация может происходить в течение обработки ультразвуком, сразу после либо в период времени по окончании обработки ультразвуком. Следовательно, если компонент вводится до или во время обработки ультразвуком, фиброин шелка может подвергаться желатинизации в пределах примерно 2 ч после обработки ультразвуком. При введении в фиброин шелка лечебных средств или биологического материала также наряду с компонентом могут добавляться другие вещества, известные в данной области техники. К примеру, может возникнуть необходимость в добавлении веществ, которые способствуют росту компонента (для биологических материалов), содействуют функциональным свойствам компонента после его высвобождения из инкапсулирующего материала, или повышают выживаемость компонента или сдерживают его действие в период инкапсуляции. Вещества, известные как способствующие клеточному росту, включают среды для роста клеток, такие как модифицированная по способу Дульбекко среда Игла (DMEM),эмбриональная бычья сыворотка (FBS), незаменимые аминокислоты и антибиотики, и ростовые и морфогенетические факторы, такие как фактор роста фибробластов (FGF), трансформирующие ростовые факторы (TGFs), фактор роста эндотелия сосудов (VEGF), эпидермальный фактор роста (EGF), инсулиноподобный фактор роста (IGF-I), костные морфогенетические белки (BMPs), факторы роста нервов и родственные белки. Дополнительные факультативные средства для доставки посредством гелей включают ДНК, миРНК, антисмысловые РНК, плазмиды, липосомы и родственные системы доставки генетических материалов; пептиды и белки, активирующие клеточные сигнальные каскады; пептиды и белки,-6 019118 способствующие минерализации или подобным клеточным событиям; адгезионные пептиды и белки для улучшения характеристик поверхностей раздела гель-ткань; антимикробные пептиды и белки и родственные соединения. Лечебные средства или биологический материал, инкапсулированные в фиброин шелка, являются пригодными для применения в устройствах биодоставки. Технологии применения фиброина шелка в качестве устройства для биодоставки известны специалистам в данной области техники. Структура гидрогеля фиброина шелка делает возможным наличие у средства биодоставки свойств контролируемого высвобождения. Контролируемое высвобождение позволяет осуществить предписанное дозирование во времени, с регулируемыми кинетиками высвобождения. В некоторых случаях доставка лечебных препаратов или биологического материала продолжается до мест, где необходимо лечение, например, дольше нескольких недель. Контролируемое во времени высвобождение, например, в течение нескольких дней или недель, или дольше, дает возможность продолжительной доставки лечебного средства или биологического материала для достижения целесообразных режимов лечения. Средство контролируемой доставки является эффективным, так как оно защищает лечебный препарат или биологический материал от деградации in vivo в жидкостях тела и ткани, например, путем расщепления протеазами. Далее, рассматривая способ индукции образования геля шелка с применением обработки ультразвуком, образцы водного раствора фиброина шелка объема 0,5 мл в концентрациях 1, 2, 6, 20% (вес./об.) обрабатывались ультразвуком, как описано ниже. Если поддерживать выходную мощность неизменной(амплитуда 20%), время желатинизации фиброина шелка снижалось с увеличением времени обработки ультразвуком (фиг. 1). Для каждого шага увеличения концентрации шелка от 1 до 6% (вес./об.), время желатинизации снижалось значительно (р 0,01 между образцами на фиг. 1). Образец с концентрацией 20% (вес./об.) имел близкое или даже более продолжительное время желатинизации по сравнению с образцом 6% (вес./об.) (фиг. 1). Такой реультат для образца с концентрацией шелка 20% имеет место, скорее всего, вследствие высокой вязкости раствора, при которой ультразвуковые волны не могут эффективно распространяться в растворе. Если использовалась выходная мощность амплитуды свыше 30%,обработка ультразвуком приводила к образованию густой пены, и фиброин шелка не формировал гомогенного геля. Это вспенивание не наблюдалось, если объем образца для обработки ультразвуком был повышен до 5 мл, даже при таких высоких значениях мощности как амплитуда 55%. Однако когда растворы с более высокими концентрациями шелка подвергались воздействию ультразвуком в объемах свыше 5 мл, происходила неравномерная желатинизация. Для оптимизации условий обработки ультразвуком и определений характеристик геля (рН, эффект солей и измерение кругового дихроизма (CD использовались малые объемы раствора шелка (без автоклавирования), а стерилизованные автоклавированием образцы растворов шелка были использованы для изучения механических свойств, деградации и инкапсуляции клеток. Примечательно, что, в сравнении с исходными растворами, автоклавирование не изменяет значительно использованные параметры обработки ультразвуком и связанные с ними времена желатинизации,предполагая, что после автоклавирования белок фиброина шелка сохраняет важнейшие свойства своей исходной структуры в растворе и способность к структурному переходу в форму -слоев при формировании геля. Структурные изменения вследствие автоклавирования могут быть исследованы в дальнейшем, но этот аспект обусловливает упрощение производства фармацевтических продуктов в промышленных масштабах. Как показывают наблюдаемые изменения при измерении CD, в процессе желатинизации фиброина шелка переход "золь-гель" был связан с увеличением частоты образования структур -слоев (фиг. 2 А). После обработки ультразвуком наблюдалось быстрое образование структур -слоев, за которым следовал медленный переход, как показано по увеличению эллиптичности при 217 нм (фиг. 2 В). Желатинизация фиброина шелка происходила в этой точке перехода, где начальное быстрое образование структур слоев замедлялось. Этот переход согласуется с ранее предпринятыми исследованиями (Matsumoto et al.,2006), что предполагает возможное участие схожих механизмов. Образование структур -слоев происходит в результате изменения гидрофобных взаимодействий и последующего образования поперечных сшивок. За этапом инициации следуют медленная организация цепей и образование сети геля за период времени, относительно длительный по сравнению с изначальными изменениями, провоцируемыми обработкой ультразвуком. Этот двухэтапный механизм желатинизации шелка схематически изображен на фиг. 2 С. Изученные параметры, способные влиять на скорость желатинизации, могут быть рассмотрены как способ перечислить основные этапы природного процесса формирования волокна у шелкопряда. Ключевые параметры обработки включают эффекты обработки ультразвуком, как имитатора повышенной силы сдвига, имеющей место в переднем отделе железы шелкопряда, тип и концентрации катионов и рН. Принято, что при обработке ультразвуком механическая вибрация вызывает образование и оседание пузырьков. В результате такой кавитации среда может подвергаться экстремальным локальным эффектам: нагрев (10000 К), высокое давление (200 бар) и высокая скорость деформации (107 с-1) (PaulusseSijbesma, 44 J. Polym. Sci.-Polym. Chem. 5445-53 (2006); Kemmere et al., 290 Macromol. Mater, Eng. 30210 (2005). Эти физические явления эксплуатировались в различных целях, включая самоорганизацию и желатинизацию сополимера N-изопропилакриламида/акриловой кислоты (Seida et al., 90 J. Appl. Polym.Sci. 2449-52 (2003, органических жидкостей с металлированными пептидами (Isozaki 119 Angew Chem. 2913-15 (2007 и синтетических самоорганизующихся пептидов (Yokoi et al., 102 Proc Nat Acad Sci USA 8414-19 (2005. Помимо пептидов, такие белки, как сывороточный альбумин человека и миоглобин, исследовались с применением обработки ультразвуком как средством охарактеризовать агрегацию и самоорганизацию, связанные с болезненным состоянием (Stathopulos et al., 13 Protein Sci. 3017-27 (2004); MasonPeters, PRACTICAL SONOCHEM: USESAPPL. ULTRASOUND (2nd ed., Chichester, West Sussex,UK (2002. Учитывая широту спектра поведения полимерных систем в ответ на обработку ультразвуком, скорее всего, несколько физических факторов связаны с обработкой ультразвуком, включая локальные повышения температуры, механическая/сила трения и увеличение поверхностей раздела водной и воздушной фаз влияют на процесс быстрой желатинизации фиброина шелка. В особенности, изменения гидрофобной гидратации, вызванные обработкой ультразвуком, могут приводить к усиленному образованию физических поперечных сшивок, таких как начальное взаимодействие цепей, связанное с образованием-слоев. В настоящем исследовании в течение процедуры обработки ультразвуком температура раствора повышалась от комнатной до 40-71 С на короткий период времени (5-6 мин), что отражает временный пик локальной температуры. В прошлом исследовании процесс желатинизации без обработки ультразвуком требовал нескольких дней, если грубый образец выдерживался при 60 С (Kim et al., 2004). Следовательно, локальные температурные эффекты, вероятно, вносят вклад в повышение кинетики желатинизации, но не только ответственны за обнаруженные кратковременные ответные реакции. Локализованная динамика цепей и изменения в статусе гидратации гидрофобных цепей, на которые оказывает влияние временное повышение теипературы, вероятно, ответственны за образование гидрофобных физических поперечных сшивок. Уникальные особенности последовательности гидрофобных блоков в белковых цепочках фиброина шелка особенно удобны для данного типа технологий из-за критической роли воды в регулировании взаимодействий внутри и между цепями (Jin et al., 2003). Возможно, было бы полезно распространить данную технологию на другие биополимерные системы для определения вклада химии цепей в процесс сборки цепей, контролируемой обработкой ультразвуком. Были опубликованы данные по деградации коллагена, связанной с обработкой ультразвуком, как способу фрагментации цепей для облегчения исследований повторной сборки (Giraud-GuilleBesseau, 113 J. Struct. Biol. 99-106 (1994. Следует заметить, что в настоящем изобретении способ обработки не приводит к значительной деградации цепей вследствие кратковременности обработки ультразвуком, что показано анализом разделения фрагментов в полнакриламидном геле с додецилсульфатом натрия. Перед обработкой ультразвуком водные растворы фиброина шелка были дополнены ионами K+ и 2+ Са до различных физиологически приемлемых концентраций. Как показано на фиг. 3 А, при низких концентрациях K+ (20-50 ммоль/л), время желатинизации значительно снижается с повышением концентрации K+ (р 0,05 между образцами). Однако при высоких концентрациях K+ (100-200 ммоль/л), желатинизация подавлялась (фиг. 3 А). Эти результаты были получены при концентрациях фиброина шелка от 0,5 до 8% (вес./об.). Для растворов с концентрацией фиброина шелка свыше 8%, не наблюдалось никакого эффекта соли, так как желатинизация происходила быстро во всех образцах (2 мин). По сравнению сK+, Са 2+ в тех же концентрациях индуцирует более медленный процесс желатинизации фиброина шелка(сравните фиг. 3 А и 3 В). Когда концентрации Са 2+ были увеличены от 20 до 200 ммоль/л, время желатинизации фиброина шелка значительно снизилось (р 0,05 между образцами на фиг. 3 В). В отличие от этого, в предыдущей работе (Kim et al., 2004) Са 2+ способствовал желатинизации фиброина шелка, тогда как K+ не оказывал эффекта - результат, отличающийся от результатов, полученных способом настоящего изобретения. Величина рН водного раствора фиброина шелка была подобрана перед обработкой ультразвуком с целью определения влияния рН на процесс желатинизации. Как снижение, так и повышение рН стимулировало желатинизацию (р 0,05 между образцами на фиг. 3 С). Эффект более низкого рН (рН 4) был более выраженным, чем эффект высокого рН (рН 9), при индукции желатинизации (р 0,05 между 0 образцами на фиг. 3 С), что соотносится с предыдущими исследованиями (Kim et al., 2004; Matsumoto et al.,2006). Кривые зависимости деформации гелей от напряжения, полученные по результатам определения механических свойств, демонстрировали линейную зависимость перед выходом на плато, предполагая,что гели имеют большие (5-10% деформация), вероятно, вязко-упругие характеристики, после чего образование трещин индуцирует необратимые повреждения. Гели, изготовленные в данном исследовании,проявляли сходство с гелями, исследованными в предшествующей работе (Kim et al., 2004), в том, что соответствующие концентрации фиброина шелка дают схожие значения величин как по устойчивости к деформации (фиг. 4 А), так и по "традиционному" модулю упругости (фиг. 4 В). Оба показателя, как оказалось, положительно коррелируют с концентрацией шелка в геле. При анализе, различия в концентра-8 019118 ции фиброина шелка (вес./об.) оказались более существенным определяющим фактором для конечных механических свойств гидрогеля, чем различия, вызванные изменением условий обработки ультразвуком(фиг. 4 А и 4 В). Подобным образом, значения равновесного модуля оказались положительно коррелирующими с концентрацией шелка в геле (фиг. 4 С). Высококонцентрированные, быстро формирующиеся гидрогели шелка показали лучшие механические свойства (табл. 1), если сравнивать с другими деградируемыми гидрогелями, инкапсулирующими клетки, такими как альгинатный гель, агарозный гель, гель, образованный поперечным сшиванием полиэтиленгликоля, фибриноген и другие системы (AlmanySeliktar 26(15) Biomats. 4023-29 (2005); Kong etKang et al., 77(2) J. Biomed. Mater. Res. A 331-39 (2006); Rowley et al., 20(1) Biomats. 45-53 (1999); Broderick et al., 72 J. Biomed. Mater. Res. B-Appl Biomater. 37-42 (2004); Zhang et al., 15 J. Mater. Sci. Mater. Med. 865-75 (2004. Данные собирались на основе сходств между инкапсуляцией клеток и протоколов механических испытаний, в которых определялись значений любого из параметров "традиционного" или равновесного модуля. Таблица 1. Сравнение механических свойств систем гелей из деградируемых полимеров, применяемых для инкапсуляции клеток 5 мм диаметр 5 мм высота. Скорость деформации 1,5 мм/мин, модуль на основе средней величины наклона нижней части кривой "напряжение-деформация" (15%).b 6 мм диаметр 2,4 мм высота. Скорость деформации 2 мм/мин, модуль на основе средней величины наклона начального участка кривой "напряжение-деформация".c 5 мм диаметр 1 мм высота. Регулируемая нагрузкой скорость деформации 4 0-100 Мн/мин.d 12,5 мм диаметр 1,5 мм высота. Регулируемая нагрузкой скорость деформации 25 Мн/мин, эквивалент модуля Юнга по абсолютной величине наклона, полученного между силой начальной предварительной нагрузки 0,01 до 0,25 Н.e 6 мм диаметр. Скорость деформации 0,5 мм/мин, модуль на основе средней величины наклона нижней части кривой "напряжение-деформация". 12,7 мм диаметр 2 мм высота. Скорость деформации 1 мм/мин. Модули упругости были получены по наклону кривой "напряжение-деформация", в пределах первых 10% значений по шкале деформации. Равновесный модуль подсчитан, исходя из равновесного состояния напряжения и начальной площади сечения при деформации 10%. Ранее изучалась ферментативная деградация (протеаза XIV) пленок фиброина шелка, твердых пористых платформ и нитей фиброина шелка (Horan et al., 2005; Kim et al., 2005; Jin et al., 2005). При использовании той же концентрации протеазы (5 ед./мл), все гидрогели фиброина шелка быстро деградировали, с потерей около 80% массы в первые 4 дня, причем скорость деградации после этого значительно падала (фиг. 5). Деградация гидрогелей зависела от концентрации фиброина шелка. При повышении концентрации от 4 до 12% (вес./об.), время деградации, за которое теряется 50% массы, увеличилось от 1,5 дней до 3 дней (фиг. 5). Контрольные образцы, гидрогели фиброина шелка, инкубированные в фосфатно-солевом буферном растворе вместо протеаз, были стабильны в период инкубации (фиг. 5). Быстрая деградация (в течение дней) гидрогелей шелка вследствие протеолитических процессов может пригодиться для некоторых приложений, таких как в случаях заживления раны или быстрой доставки медикаментов. Однако следует заметить, что времена протеолитической деградации, обсуждаемые в данном тексте, соответствуют параметрам для системы in vitro; тогда как in vivo время полу-жизни, как правило,длиннее, а временные рамки будут зависеть от типа ткани.hMSCs успешно инкапсулировались в ряде систем гидрогелей, таких как полиэтилен гликоль, агароза, коллаген и альгинат, из-за потенциала этих клеток для репарации ткани или регенерации и долговременного высвобождения медикамента (см. Nuttelman et al., 24 Matrix Biol. 208-18 (2005); Nuttelman etSci. 652-58 (2006. Гидрогели шелка с концентрацией белка менее 4% (вес./об.) трудно поддаются манипуляциям вследствие физических ограничений. Следовательно, для инкапсуляции hMSC использовались гидрогели с концентрациями фиброина шелка 4, 8 и 12% (вес./об.). При всех трех концентрациях геля клетки сохраняли свою исходную округлую форму и гомогенное распространение в первый день. На шестой день некоторые клетки обнаруживали дефекты в 12% геле, и изменялась клеточная морфология. На двадцать первый день клетки в 4% геле оставались в неизмененном состоянии, по сравнению с днем первым, тогда как клетки в 8 и 12% гелях были в значительной степени деформированы и слипались. Гистологический анализ выявил, что hMSCs внутри матрикса 4% геля сохраняют округлую форму и не агрегируют в период исследования, тогда как клетки возле поверхности гелей вырастали за пределы геля и изменяли морфологию от округлых до веретено-подобных, начиная с шестого дня. Все hMSCs, веретено-подобные возле поверхности геля или округлые инкапсулированные в толще геля, были живы, как показано по свечению зеленой флуоресценции методом анализа выживаемости клеток. Следовательно,hMSCs поддерживают свою активность и функцию в системе 4% гидрогеля шелка не менее двадцати одного дня. Однако hMSCs в 8 и 12% гелях значительно меняют морфологию и многие из них умирают,слипаются и/или растворяются, как видно по образованию пустот на изображениях гистологических препаратов, при этом наблюдается очень малое количество зеленых флуоресцирующих точек при анализе выживаемости клеток. Контрольный гель шелка, не содержавший инкапсулированных клеток, демонстрировал сильный фон красной флуоресценции, который маскировал красную флуоресценцию от мертвых клеток при анализе выживаемости клеток. Данные наблюдения и заключения далее были подтверждены количественным анализом ДНК (анализ с использованием красителя PicoGreen) (фиг. 6). Клетки заметно пролиферировали дольше первых шести дней во всех трех гидрогелях (р 0,05 между образцами на фиг. 6). Касательно 4% геля, количество клеток перестало возрастать после шести дней, указывая на то, что достигнута максимальная вместимость геля для пролиферации клеток. Похожее явление наблюдалось в других системах гидрогелей, таких как ПЭГ и альгинатный гель (Nuttleman et al., 2006; Ramdi et al., 207 Exp. Cell Res. 449-54 (1993. Что касается 8 и 12% гелей, то количество клеток в них снижалось через шесть дней, что согласуется с микроскопическим исследованием, гистологическими наблюдениями и результатами анализа выживаемости клеток. Потеря активности в гелях повышенной концентрации, вероятно, происходит вследствие ограничения обмена вещества, но также может быть следствием механических помех, сопутствующих высоким концентрациям геля. Возможность того, что гели шелка токсичны для клеток hMSCs, исключена, так какhMSCs, растущие на поверхности гелей шелка 4, 8 и 12% имели те же скорости роста, что и клетки, растущие в контрольной культуральной чашке, и клеточная морфология (форма веретена) была похожа для всех групп. Оптимизация условий стабилизации гелей низких концентраций (1 и 2%) может быть разработана следом за идеей, предложенной в данном тексте, а скорости диффузии кислорода и питательных веществ через гели шелка различной концентрации могут быть изучены подробно. В данном тексте приведен новый метод, основанный на обработке ультразвуком, что делает возможным быстрое формирование гидрогелей фиброина шелка. Желатинизация может быть вызвана в период от минут до часов, в зависимости от таких параметров обработки ультразвуком, как выходная мощность и длительность. Желатинизация сопровождалась образованием структур -слоев, вследствие изме- 10019118 нения гидрофобной гидратации. Низкие концентрации K+ и низкий рН повышают скорость желатинизации, тогда как присутствие Са 2+ и высокие концентрации K+ предотвращают желатинизацию. Гидрогели фиброина шелка обладают механическими свойствами, превосходящими таковые для других систем,описанных ранее, в промежутке 369-1712 кПа, судя по модулю упругости при сжатии. Механическая прочность геля возрастает с повышением концентрации раствора фиброина шелка. Гидрогели с 4%(вес./об.) содержанием фиброина шелка были пригодны к инкапсуляции hMSCs; клетки в течение недель сохраняли жизнеспособность и пролиферацию в статичных условиях культивировния. Далее настоящее изобретение будет охарактеризовано следующими примерами, которые предусмотрены как примерные варианты осуществления изобретения. Примеры Пример 1. Растворы фиброина шелка. Исходные водные растворы фиброина шелка были приготовлены, как описано ранее (Sofia et al., 54J. Biomed. Mater. Res. 139-48 (2001. Вкратце, коконы В. mori варились 40 мин в водном растворе 0,02 М карбоната натрия и затем были тщательно промыты чистой водой. После высушивания экстрагированный фиброин шелка растворяли в 9,3 М растворе LiBr при 60 С в течение 4 ч, в результате получали 20%(вес./об.) раствор. Для удаления соли этот раствор подвергался диализу против дистиллированной воды с использованием кассет для диализа Slide-a-Lyzer (MWCO 3,500, Pierce, Rockford, IL) в течение двух дней. После диализа раствор был оптически прозрачным, он центрифугировался для удаления малых количеств агрегатов шелка, которые образовывались в процессе выделения, обычно от загрязнений из окружающей среды, которые присутствуют на коконах. Конечная концентрация водного раствора фиброина шелка составляля приблизительно 8% вес./об.). Эта концентрация была определена путем взвешивания остатка твердого вещества из известного объема раствора, после высушивания. Растворы шелка с более низкими концентрациями были приготовлены путем разведения 8% раствора водой. Для получения раствора шелка с высокой концентрацией 8% раствор в кассетах для диализа Slide-a-Lyzer (MWCO 3,500, Pierce) подвергался диализу против 10% (вес./об.) раствора ПЭГ (10000 г/моль) при комнатной температуре не менее 24 ч (JinKaplan, 2003; Kim et al., 2004). Объем доводился водой до достижения нужной концентрации. Все растворы хранились при 4 С перед использованием. Пример 2. Растворы шелка с различными концентрациями соли и рН. Для того чтобы определить, какое влияние оказывает концентрация соли на желатинизацию шелка,к растворам шелка добавлялись исходные 1 М растворы KCl и CaCl2 до достижения конечных концентраций соли от 20 до 200 ммоль/л. Для определения влияния рН раствора на желатинизацию, растворы шелка титровались 1 М растворами HCl или NaOH, а значение рН отслеживалось с помощью рН-метра. Пример 3. Подбор условий желатинизации шелка. Для определения желатинизации шелка при различных условиях обработки ультразвуком 0,5 мл водного раствора шелка в пробирке Eppendorf объемом 1,5 мл подвергались обработке ультразвуком на ультразвуковом аппарате Branson 450 (Branson Ultrasonics Co., Danbury, CT), который содержал источник электропитания модель 450, конвертор ( детали 101-135-022), зонд 1/2 дюйма для дезинтеграции с наружной резьбой ( детали 101-147-037) и конический микрозонд с диаметром 1/8 дюйма ( детали 101148-062). Выходная мощность варьировалась от 10 до 50% амплитуды (3-21 Вт), а время обработки ультразвуком варьировалось от 5 до 30 с. Для определения влияния солей и рН на процесс желатинизации,аликвоты 0,5 мл растворов щелка, приготовленных как описано выше, обрабатывались ультразвуком при 20% амплитуды (7 Вт) и 15 с. После обработки ультразвуком растворы инкубировались при 37 С, а переход "золь-гель" отслеживался визуально путем переворачивания пробирки и проверки изменения прозрачности раствора (Matsumoto et al.). Опираясь на предварительные результаты, концентрации фиброина шелка вплоть до 12% (вес./об.) использовались для поддержания низкой вязкости, и 12% раствор желатинизировался быстрее, чем образцы с 8% и 4% растворами. Эти результаты изложены в табл. 2, ниже. Таблица 2. Время желатинизации водного раствора фиброина шелка после обработки ультразвуком в большом объеме (5-7 мл) Примечание: время желатинизации оценивалось и усреднялось по результатам не менее двух независимых экспериментов. Пример 4. Круговой дихроизм (CD). Аликвота 2% водного раствора шелка объемом 0,5 мл подвергалась воздействию ультразвуком при амплитуде 20% (7 Вт) в течение 30 с, и немедленно вносился в многослойную кварцевую ячейку с длиной пробега 0,01 мм (Nova Biotech, El Cajon, CA). Измерения CD проводились с помощью CD спектрофотометра Jasco-720 (Jasco Co., Japan). Все образцы сканировались при 37 С со временем накопления 4 с при скорости 100 нм/мин, усреднялись результаты экспериментов, повторенных 4 раза. Для измерения кинетики образования структур -слоев шелка в течение 2,5 ч отслеживались изменения эллиптичности при 217 нм, измерения проводились каждые 10 с. Пример 5. Механические испытания. Для удовлетворения условиям механического испытания обработкой ультразвуком были приготовлены большие объемы геля шелка. Растворы шелка 4, 8 и 12% (вес./об.) в стеклянных колбах автоклавировались в 20 мин при 121 С. Автоклавированный раствор был дополнен стерильным порошком Модифицированной по методу Дульбеко Среды Игла (DMEM порошок, Invitrogen, Carlsbad, СА) и бикарбонатом натрия (Sigma-Aldrich, St. Louis, МО) до концентрации 0,135 г/мл и 0,037 г/мл соответственно. Полученный раствор имел рН 7,4, что было проверено с применением рН-метра. Аликвота раствора объемом 7 мл вносилась в пластиковую пробирку Falcon объемом 15 мл и затем обрабатывалась ультразвуком при амплитудах 20, 30, 40% (7, 10, 15 Вт соответственно) в течение 30 с. Шесть мл обработанного ультразвуком раствора добавлялись в малые культуральные чашки (BD Falcon,35-3001, BD Biosciences, PaloAlto, CA), которые визуально оценивались в инкубаторе на 37 С с течением времени, с целью сближения параметров клеточной культуры, до тех пор, пока не завершилась желатинизация, что оценивалось по свойству непрозрачности и конденсации на поверхности геля. Затем сразу после желатинизации штамповались пробки диаметром 9,525 мм (2-3 мм в высоту) для механического испытания. Гелевые пробки предварительно помещались в полный раствор DMEM (Gibco/Invitrogen) на не менее чем 1 ч перед тестированием. Все образцы были погружены в DMEM для хранения и испытывались в пределах 24 ч. Образцы оценивались на разрывной машине "Инстрон" 3366 (Norwood, MA), оснащенной плитой для испытания на неограниченное сжатие и датчиком нагрузки 100 Н. Метод удлинения при сжатии был проведен при скорости удлинения 1 мм/мин. Определялись сжимающее напряжение и деформация, и на основе полуавтоматической методики был определен модуль упругости. Диаграмма зависимости деформации от напряжения была разделена на 8 сегментов ниже уровня отсечки напряжения, установленного за пределами начальной линейной области диаграммы. Используя способ подбора кривой методом наименьших квадратов, среди этих восьми сегментов сегмент с наибольшим уклоном кривой был определен как модуль упругости при сжатии для данного образца. Устойчивость к сжимающим нагрузкам определялась с применением метода определения предела текучести. Линия была нарисована параллельно линии модуля, но со смещением длины испытываемой части образца на 0,5%. Соответствующее значение напряжения, при котором смещенная линия пересекает кривую "напряжение-деформация", было определено как устойчивость матрикса к сжимающим нагрузкам. Данный анализ проводился согласно модификациям к методуASTM F451-95. Для оценки влияния условий обработки ультразвуком на механические рабочие характеристики испытания на неограниченное сжатие были проведены, следуя двум режимам. Во-первых, испытание напряжением до отказа применялось для выявления общепринятой характеристики материала - свойства жесткости, и для обнаружения предела безотказности (AlmanySeliktar 26(15) Biomats. 2467-77 (2005);Kong et al., 24(22) Biomats. 4023-29 (2003. Во-вторых, испытание на снятие напряжения использовалось для оценки свойств равновесного модуля, и проводилось на основе тестовых параметров, предложенныхHung и соавторами (32 Ann. Biomed. Eng. 35-49 (2004. Вместе, эти измерения предоставили возможность широкого сравнения с опубликованными свойствами других деградируемых гидрогелей, применяемых для инкапсуляции клеток. В каждой представленной группе оценивались N=4 образца, они анализировались с помощью разрывной машины "Инстрон" 3366 (Norwood, MA), оснащенной плитой для испытания на неограниченное сжатие и датчиком нагрузки 100 Ньютон, а данные выборки экспортировались с использованием программного обеспечения Bluehill версии 2.0. При испытании напряжением до отказа каждый образец сжимался при контролируемой скорости удлинения в 1 мм/мин, достигались нагрузки, начиная с номинального веса тары, и регистрировались высоты образца. Напряжение при сжатии и деформация были определены путем нормализации по геометрии образцов, а "традиционный" модуль упругости был вычислен как наклон касательной линии, ус- 12019118 тановленной в области 5% деформации каждой кривой "напряжение-деформация". Предел текучести определялся при смещении линии параллельно касательной к кривой в точке 2% деформации; точка, где касательная пересекала кривую "напряжение-деформация", была определена как предел текучести (который совпадает с пределом безотказности). При испытании на снятие напряжения, образцы были погружены в фосфатно-солевой буферный раствор и оставлены под номинальной нагрузкой тары на 200 с. После этого образцы сжимались при скорости 1 мм/с до достижения деформации 10% и выдерживались 20 мин. Равновесный модуль был вычислен путем нормировки снятия напряжения по 10% деформации. Пример 6. Ферментативная деградация гелей шелка in vitro. Пробки геля шелка (диаметр=4 мм; высота=2-3 мм) с концентрацией 4, 8, 12% (вес./об.) были получены, как описано выше, и затем погружены в 1 мл раствора протеазы XIV (Sigma-Aldrich) в 24 луночном планшете. Раствор протеазы был свежеприготовлен путем растворения сухого фермента в фосфатно-солевом буферном растворе до достижения концентрации 5 ед./мл и заменялся на вновь приготовленный раствор каждые 24 ч. Контрольные пробки были погружены в 1 мл фосфатно-солевого буферного раствора, который также заменялся каждые 24 ч. Все образцы инкубировались при 37 С. В дни 1, 2, 3, 4 и 7 четыре пробки промывались водой, протерты тонкой бумагой для удаления излишков воды с поверхности геля, и взвешены. Пример 7. Высев и культивирование hMSCs в гелях шелка. Клетки hMSCs были выделены из свежего цельного костного мозга, полученного путем аспирации от давших согласие доноров (Clonetic-Poietics, Walkersville, MD), как описано ранее (Meinel et al., 71 J.Biomed. Mater. Res. A 25-34 (2004); Meinel et al., 88 Biotechnol. Bioeng. 379-91 (2004. Культура наращивалась в среде роста, содержащей 90% DMEM, 10% эмбриональной бычьей сыворотки (FBS), 0,1 ммоль/л незаменимых аминокислот, 100 ед./мл пенициллина, 1000 ед./мл стрептомицина, 0,2% противогрибкового средства фунгизон и 1 нг/мл основного фактора роста фибробластов (bFGF). Перед использованием клетки, пересеянные 3-4 раза, собирались с культуральных чашек с помощью обработки трипсином и ресуспендировались в DMEM до получения плотности клеток 5107 клеток/мл. Пятнадцать мл раствора шелка с концентрациями 4, 8 и 12% (вес./об.) стерилизовались паром (автоклавировались) и к ним добавлялись сухая среда DMEM и бикарбонат натрия, как описано выше. Аликвота объемом 5 мл вносилась в пластиковую пробирку falcon на 15 мл, всего для каждой концентрации шелка были использованы две пробирки (контрольная и засеянная клетками). Раствор 4% (вес./об.) шелка (5 мл) был обработан ультразвуком в вытяжном шкафу с ламинарным потоком при 50% амплитуде в течение 30 с, и через 30 мин инкубации раствор был повторно обработан ультразвуком в тех же условиях. После второй обработки ультразвуком раствор охлаждался до комнатной температуры в пределах 5-10 мин, затем добавлялись 50 мл клеточной суспензии и перемешаны с раствором шелка, обработанным ультразвуком,для достижения конечной концентрации 5105 клеток/мл. Контрольный образец обрабатывался ультразвуком тем же способом, но к нему после обработки ультразвуком вместо клеточной суспензии были добавлены 50 мл DMEM. Аликвоты объемом 1,5 мл смеси были быстро накапаны пипеткой в лунки 12 луночного культурального планшета, для каждой группы образцов было приготовлено три лунки. Растворы шелка 8 и 12% (вес./об.) обрабатывались ультразвуком один раз при амплитудах 40% и 30% соответственно в течение 30 с. К раствору шелка добавлялась аликвота суспензии hMSC объемом 50 мл, и смесь высевалась, как описано выше. Затем все планшеты инкубировались при 37 С и 5% СО 2. Как только шелк желатинизировался в планшетах в пределах 0,5-2 ч, из гелей штамповались маленькие пробки (диаметр=4 мм; высота=2-3 мм) и помещались в лунки нового 24-луночного планшета. Затем пробки культивировались при 37 С и 5% СО 2 в 1 мл среды роста, содержащей 90% DMEM, 10% эмбриональной бычьей сыворотки (FBS), 0,1 ммоль/л незаменимых аминокислот, 100 ед./мл пенициллина, 1000 ед./мл стрептомицина и 0,2% противогрибкового средства фунгизон. Для микроскопирования были приготовлены клетки hMSC, инкапсулированные гелями шелка в объеме 0,5 мл, который культивировался при тех же условиях, что описаны выше, в 1 мл той же среды роста в 24-луночных планшетах,а изображения были получены в необходимые временные точки. Пример 8. Анализ клеток hMSCs, инкапсулированных в гели шелка. Фазово-контрастная микроскопия - на 2, 6, 14 и 21 дни культивирования проводился анализ клеточной морфологии с помощью фазово-контрастной световой микроскопии на приборе (Carl Zeiss, Jena,Germany), оснащенном Sony Exwave HAD 3 ПЗС цветной видеокамерой. Пролиферация клеток - пролиферация клеток определялась анализом ДНК. Вкратце, в каждой временной точке 4 гелевые пробки из каждой группы промывались фосфатно-солевым буферным раствором рН 7,4, взвешивались (мокрый вес) и измельчались микро-ножницами на льду. Содержание ДНК (N=4) измерялось с использованием красителя PicoGreen (Molecular Probes, Eugene, OR), согласно инструкциям изготовителя. Образцы измерялись флуорометрически при длине волны возбуждения 480 нм и длине волны испускания 528 нм. Содержание ДНК высчитывалось на основе стандартной кривой, полученной тем же способом, и далее нормализовалось по весу мокрого вещества каждой пробки геля. Выживаемость клеток: выживаемость hMSCs в пробках геля исследовалось методом анализа выживаемости клеток (Molecular Probes, Eugene, OR). Вкратце, по окончании культивирования гелевая пробка каждой группы, засеянная клетками hMSCs, промывалась фосфатно-солевым буферным раствором, разрезалась на две половины и инкубировалась в 2 ммоль/л растворе кальцеина AM (окрашивание живых клеток) и 4 ммоль/л растворе гомодимера этидия (EthD-1, окрашивание мертвых клеток) в фосфатносолевом буферном растворе в течение 30 мин при 37 С. Изображения поперечного сечения разрезанного геля получены с помощью конфокальной микроскопии на приборе (Bio-Rad MRC 1024, Hercules, CA) с программным обеспечением Lasersharp 2000 (возбуждение/испускание 495 нм/515 нм). Микроснимки глубинной проекции были получены с использованием серий горизонтальных срезов, представленных на различных расстояниях друг от друга (с нарастанием 1-10 мкм), на основе суммарной высоты хорошо определенной клеточной колонии. Были собраны кадровые изображения на различной глубине, и серии микроснимков позже были собраны для получения изображений, компилированных по оси z (по аппликате). Гистология. Гели шелка, засеянные клетками, промывались фосфатно-солевым буферным раствором и фиксировались 10% нейтральным буферным формалином в течение 2 дней перед гистологическим анализом. Образцы дегидратировались путем серий фракционирования этанолом, залиты парафином, и затем получена серия срезов толщиной 5 мм. Для гистологического анализа срезы были освобождены от парафина, регидратированы путем серий фракционирования этанолом и окрашены гематоксилином и эозином (НЕ). Пример 9. Статистические данные. Статистический анализ был проведен с использованием критерия Стьюдента. Различия рассматривались как значимые при рр 0,05 и высоко значимыми при рр 0,01. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ желатинизации фиброина шелка, включающий обработку фиброина шелка ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации, где желатинизация фиброина шелка происходит менее чем за 24 ч после обработки ультразвуком, при этом фиброин шелка находится в форме водного раствора с рН 7,5 или выше. 2. Способ по п.1, где желатинизация фиброина шелка происходит менее чем за два часа после обработки ультразвуком. 3. Способ по п.1, где фиброин шелка подвергают желатинизации в период времени в интервале от 5 мин до 2 ч после обработки ультразвуком. 4. Способ по п.1, где дополнительно при обработке используют раствор соли. 5. Способ по п.4, где используют раствор соли, содержащий ионы калия, кальция, натрия, магния,меди, цинка или их комбинаций. 6. Способ по п.5, где используют раствор соли калия с концентрацией менее 100 ммоль/л и рН 4 или ниже. 7. Способ регулирования времени желатинизации фиброина шелка путем обработки раствора фиброина шелка ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации, где фиброин шелка подвергают желатинизации в течение примерно 2 ч, и при этом фиброин шелка находится в форме водного раствора с рН 7,5 или выше. 8. Способ по п.7, где фиброин шелка подвергают желатинизации в период времени в интервале от 5 мин до 2 ч после обработки ультразвуком. 9. Способ по п.7, где время желатинизации регулируют амплитудой обработки ультразвуком и концентрацией раствора фиброина шелка. 10. Способ по п.7, где дополнительно при обработке используют раствор соли. 11. Способ по п.10, где время желатинизации регулируют концентрацией раствора фиброина шелка и концентрацией раствора соли. 12. Способ по п.11, где концентрация фиброина шелка составляет 4% (весовая концентрация) или ниже, раствор соли содержит ионы калия и концентрация раствора соли калия находится в пределах от 20 до 100 ммоль/л. 13. Способ по п.12, где время желатинизации регулируют концентрацией и рН раствора соли. 14. Способ по п.13, где используют раствор соли калия с концентрацией в пределах от 20 до 100 ммоль/л и рН 4 или ниже. 15. Способ инкапсуляции по меньшей мере одного компонента в фиброин шелка, включающий обработку раствора фиброина шелка ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации, при этом фиброин шелка находится в форме водного раствора с рН 7,5 или выше; и введение компонента(ов) в раствор фиброина шелка до того, как произойдет желатинизация для получения компонента, инкапсулированного в фиброин шелка. 16. Способ по п.15, где используют компонент, который является лечебным препаратом и/или биологическим материалом. 17. Способ по п.16, где используют компонент, который представляет собой по меньшей мере один биологический материал, выбранный из группы, содержащей клетки, белки, пептиды, нуклеиновые кислоты, пептид-нуклеиновые кислоты, аптамеры, антитела, гормоны, ростовые факторы, цитокины, ферменты, антимикробные вещества и их комбинации. 18. Способ по п.17, где в качестве клеток используют стволовые клетки. 19. Способ по п.17, где в фиброин шелка вместе с биологическим материалом вводят среду для роста клеток. 20. Способ по п.16, где используют компонент, который является лечебным препаратом. 21. Способ по п.15, где желатинизация происходит в течение 2 ч. 22. Способ по п.15, где желатинизация происходит в период времени в интервале от 5 мин до 2 ч. 23. Способ по п.15, где дополнительно при обработке используют раствор соли. 24. Способ инкапсуляции по меньшей мере одного компонента в фиброин шелка, включающий введение компонента(ов) в раствор фиброина шелка, при этом фиброин шелка находится в форме водного раствора с рН 7,5 или выше; и обработку раствора фиброина шелка ультразвуком в течение периода времени от 5 до 60 с для инициации желатинизации с получением компонента, инкапсулированного в фиброин шелка. 25. Способ по п.24, где используют компонент, который является лечебным препаратом. 26. Способ по п.24, где желатинизация происходит в течение примерно 2 ч. 27. Способ по п.24, где желатинизация происходит в период времени в интервале от 5 мин до 2 ч.
МПК / Метки
МПК: A61K 35/24
Метки: мере, варианты, меньшей, фиброина, инкапсуляции, компонента, регулирования, способ, шелка, одного, времени, желатинизации, фиброин
Код ссылки
<a href="https://eas.patents.su/18-19118-sposob-zhelatinizacii-fibroina-shelka-i-regulirovaniya-vremeni-zhelatinizacii-sposob-inkapsulyacii-po-menshejj-mere-odnogo-komponenta-v-fibroin-shelka-varianty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ желатинизации фиброина шелка и регулирования времени желатинизации, способ инкапсуляции по меньшей мере одного компонента в фиброин шелка (варианты)</a>
Предыдущий патент: Способ формирования проницаемости в горном массиве и устройство для его осуществления
Следующий патент: Способ основной обработки почвы и подготовки семенного ложа
Случайный патент: Способ обработки загрязненной воды посредством адсорбции и нанофильтрации