Композиция для инактивации оболочечного вируса (варианты), средства на ее основе для приготовления лекарства против вирусного заболевания, для приготовления больших количеств биосовместимого дезинфицирующего средства и для приготовления покрытия, содержащий ее набор для инактивации оболочечного вируса и способ инактивации оболочечного вируса
Формула / Реферат
1. Композиция для инактивации оболочечного вируса, характеризующаяся тем, что она включает по меньшей мере одну свободную от холестерина нефосфолипидную липосому (НФЛ), способную взаимодействовать с упомянутым оболочечным вирусом, и циклодекстрин или производные циклодекстрина, которые усиливают липидный обмен между упомянутой НФЛ и мембраной упомянутого оболочечного вируса, причем концентрация циклодекстрина или производных циклодекстрина в композиции составляет от 0,01 до 10 мМ.
2. Композиция по п.1, характеризующаяся тем, что упомянутая НФЛ в ней выполнена одноламеллярной, олиголамеллярной или мультиламеллярной.
3. Композиция по п.1, характеризующаяся тем, что включает циклодекстрин, выбранный из группы, состоящей из α-циклодекстрина, β-циклодекстрина и γ-циклодекстрина.
4. Композиция по п.3, характеризующаяся тем, что включает по меньшей мере одно производное циклодекстрина, выбранное из группы, состоящей из диметил-β-циклодекстрина, триметил-β-циклодекстрина, случайно метилированного-β-циклодекстрина, гидроксиэтил-β-циклодекстрина, 2-гидроксипропил-β-циклодекстрина, 3-гидроксипропил-β-циклодекстрина, 2,3-дигидроксипропил-β-циклодекстрина, 2-гидроксиизобутил-β-циклодекстрина, сульфобутиловый эфир-β-циклодекстрина, гликозил-β-циклодекстрина и мальтозил-β-циклодекстрина.
5. Композиция по любому из пп.1-4, характеризующаяся тем, что липидный обмен в основном состоит в обмене холестерина и/или сфинголипидов.
6. Композиция по любому из пп.1-5, характеризующаяся тем, что дополнительно включает противовирусное средство, выбранное из группы, состоящей из агента против вируса иммунодефицита человека (ВИЧ), агента против вируса гепатита В человека (ВГВ), агента против вируса гепатита С человека (ВГС), агента против вируса простого герпеса (ВПГ), агента против вируса ветряной оспы (ВВО), агента против цитомегаловируса (ЦМВ), агента против вируса гриппа и их комбинации.
7. Композиция по п.6, характеризующаяся тем, что в качестве агента против вируса гриппа она включает амантадин, римантадин, занамивир или оселтамивир.
8. Способ инактивации оболочечного вируса in vitro, характеризующийся тем, что на упомянутый оболочечный вирус действуют композицией по любому из пп.1-5 с возможностью обмена липидами между ними.
9. Фармацевтическая композиция, характеризующаяся тем, что включает фармацевтическое количество композиции по любому из пп.1-5 и, необязательно, по меньшей мере один фармацевтически приемлемый носитель.
10. Применение фармацевтической композиции по п.9 для приготовления лекарственного средства для лечения или предотвращения заболевания, связанного с оболочечным вирусом.
11. Применение композиции по любому из пп.1-5 для приготовления больших количеств биосовместимого дезинфицирующего средства.
12. Применение композиции по любому из пп.1-5 для приготовления покрывающего средства.
13. Набор для инактивации оболочечного вируса, включающий композицию по любому из пп.1-7, необязательно с реагентами или инструкциями по их использованию.
Текст
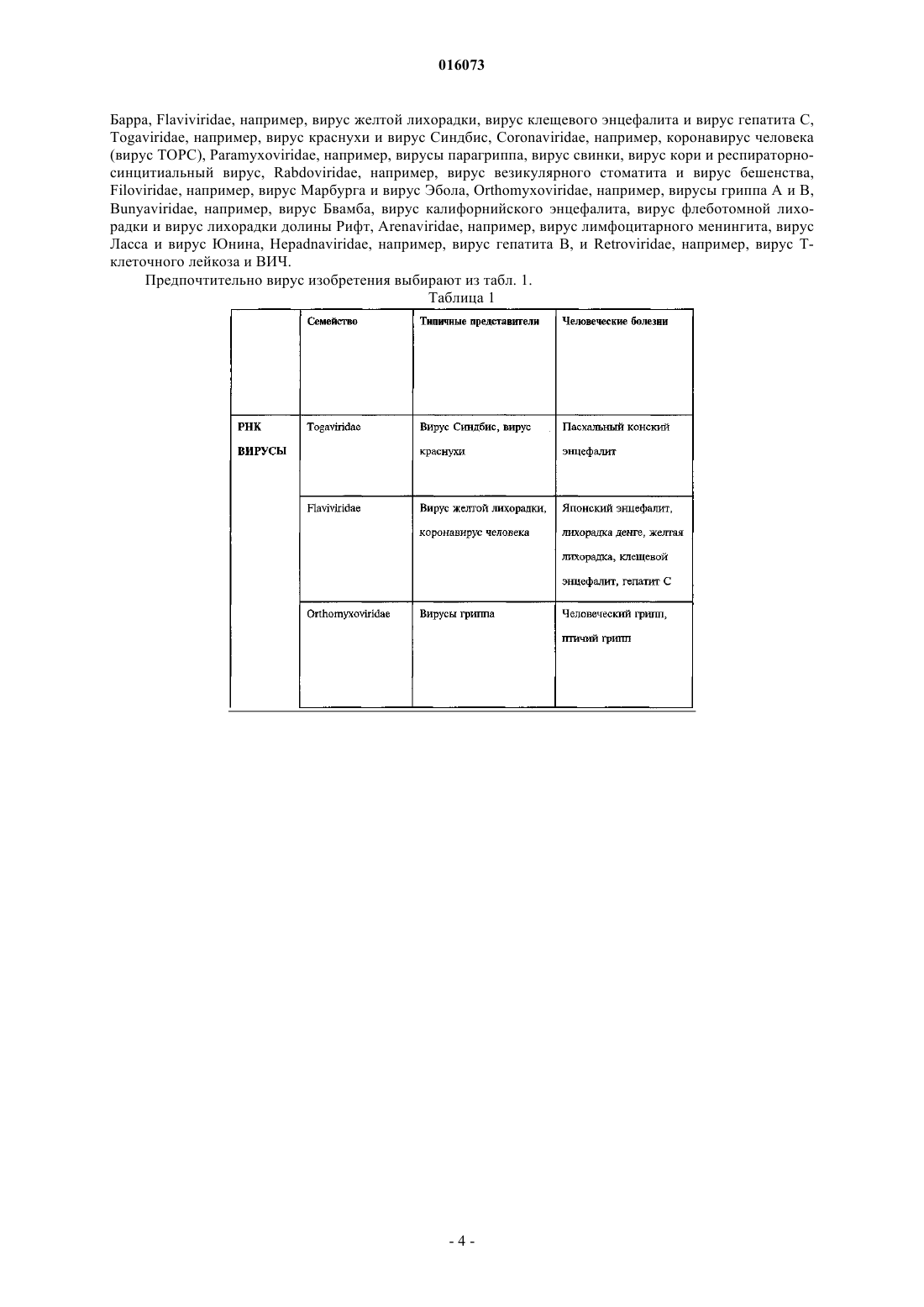
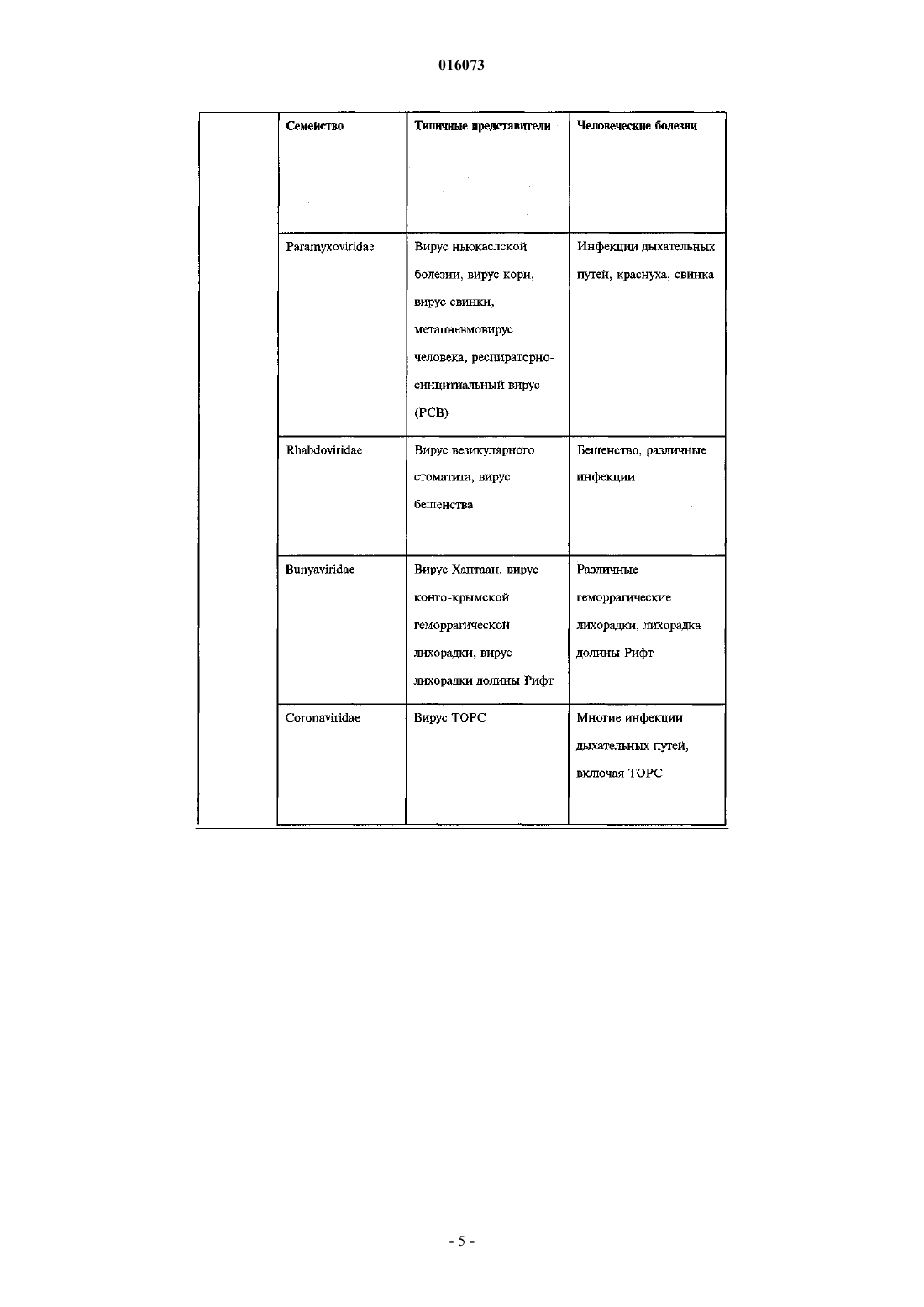
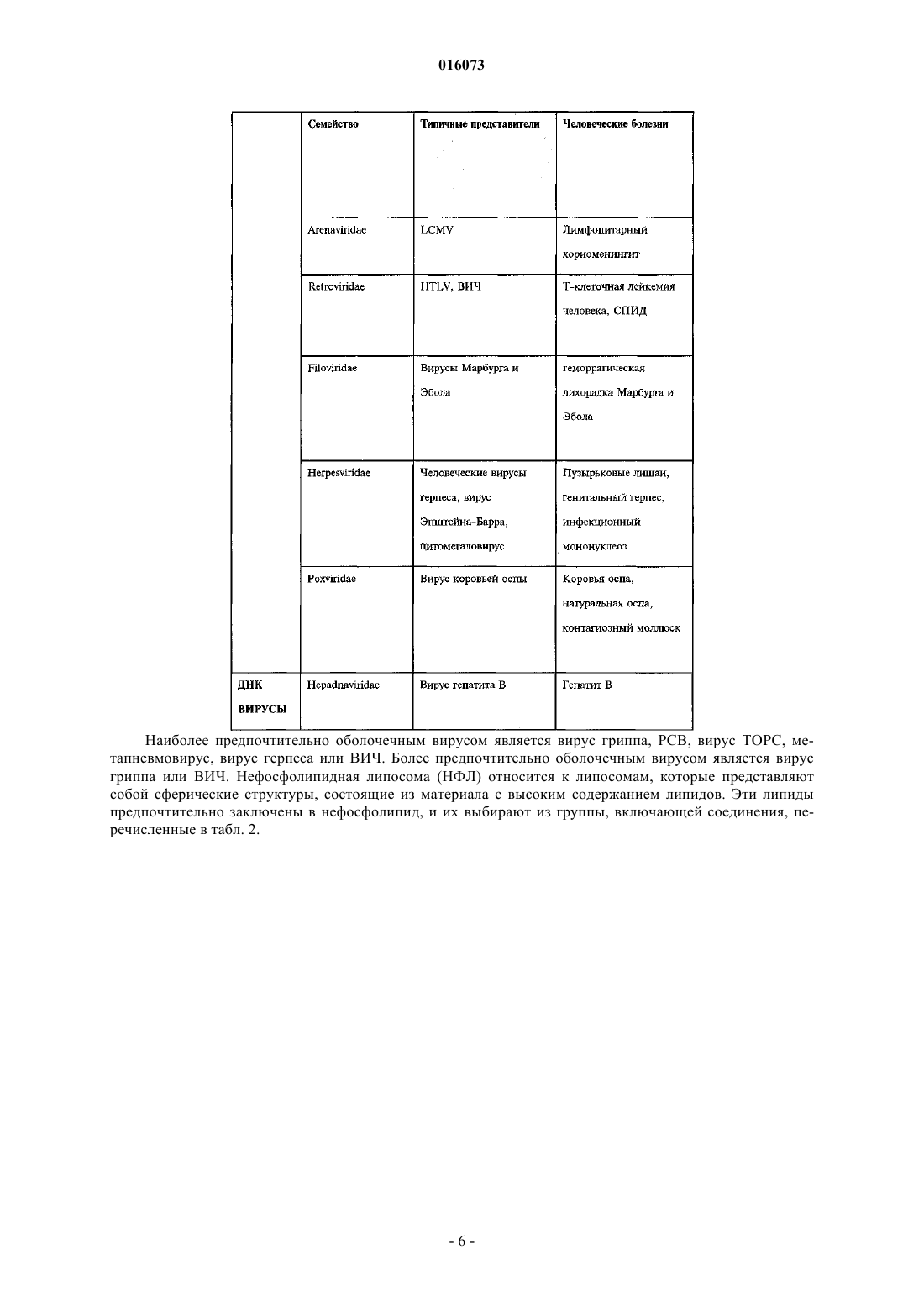
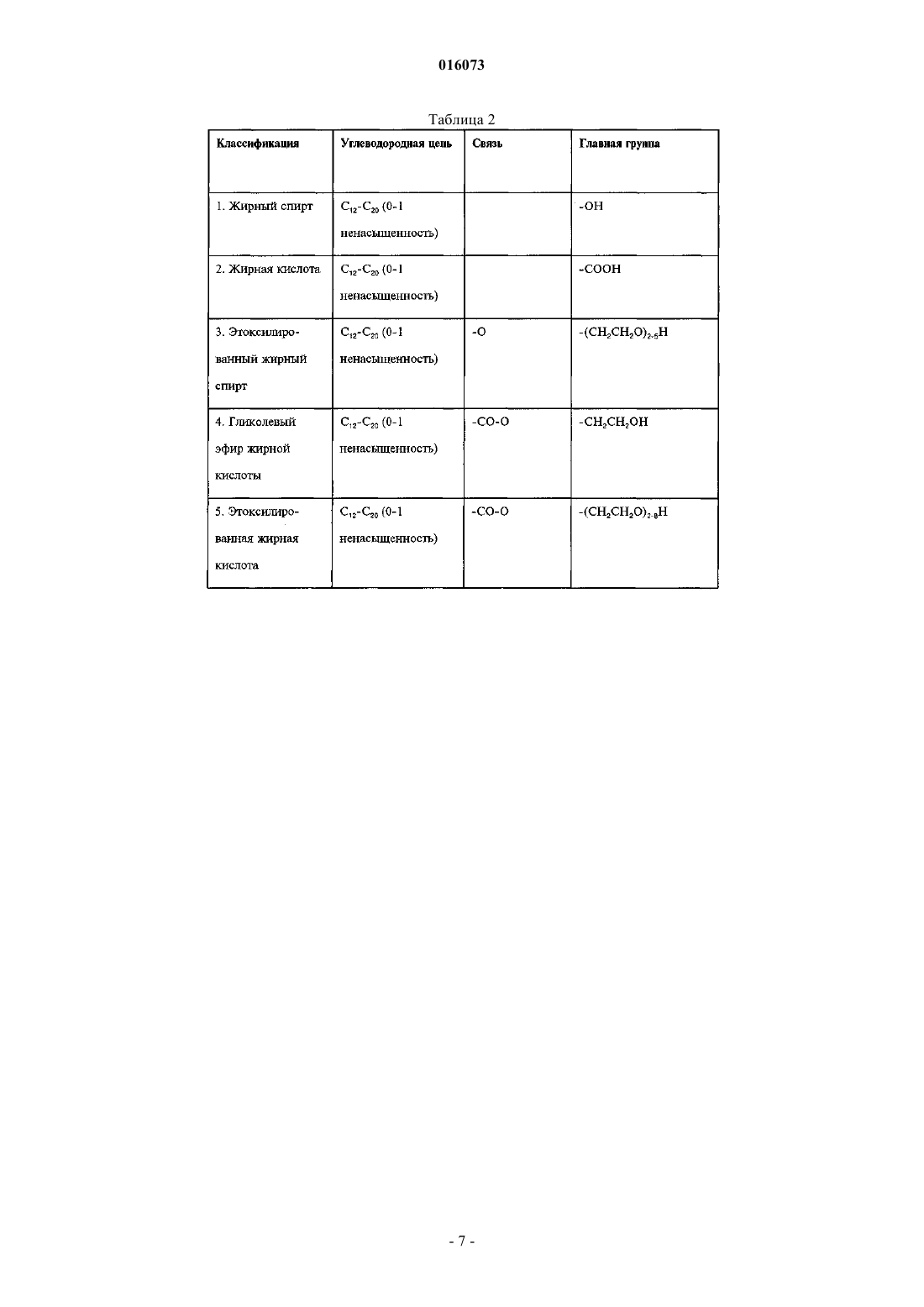
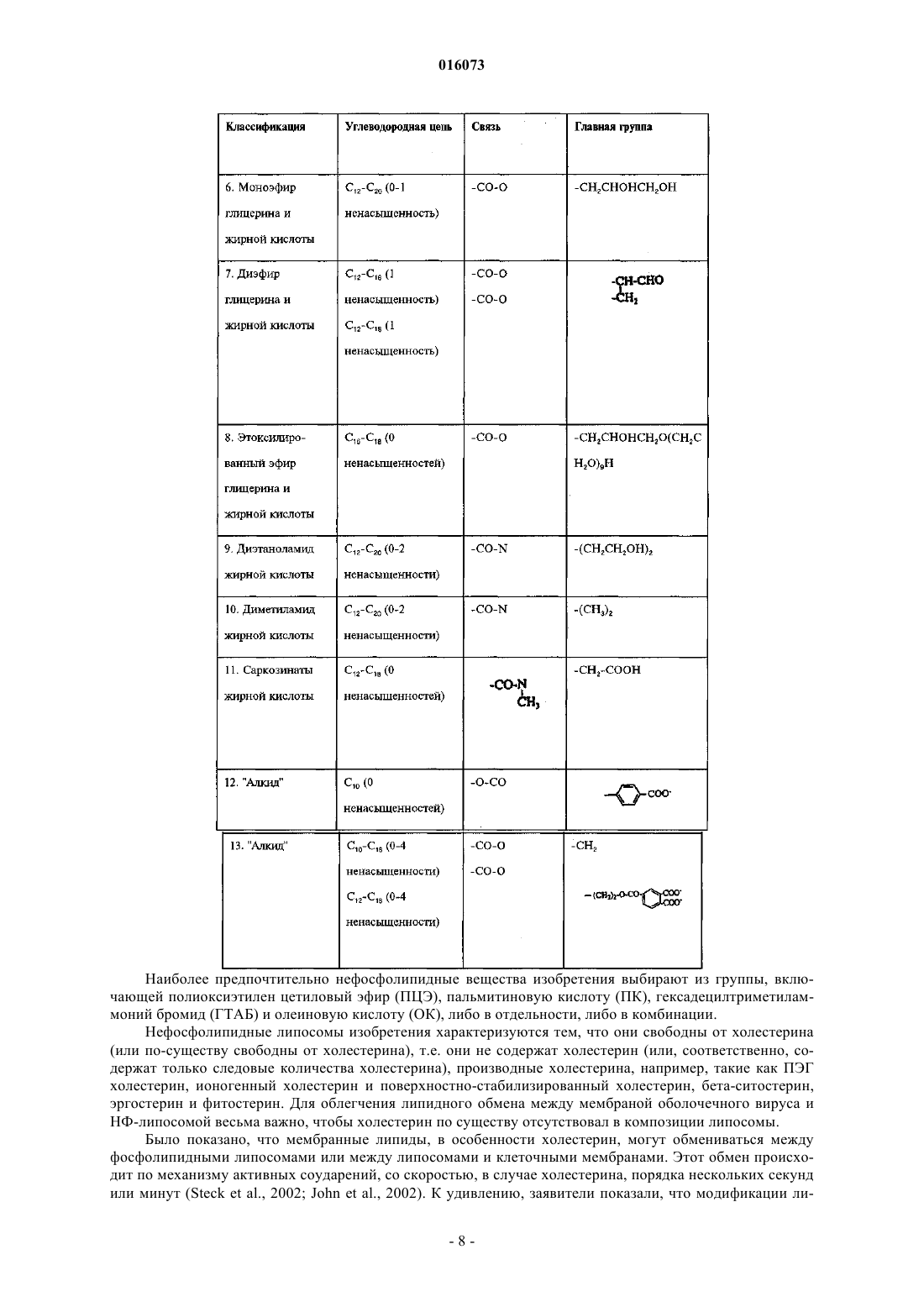
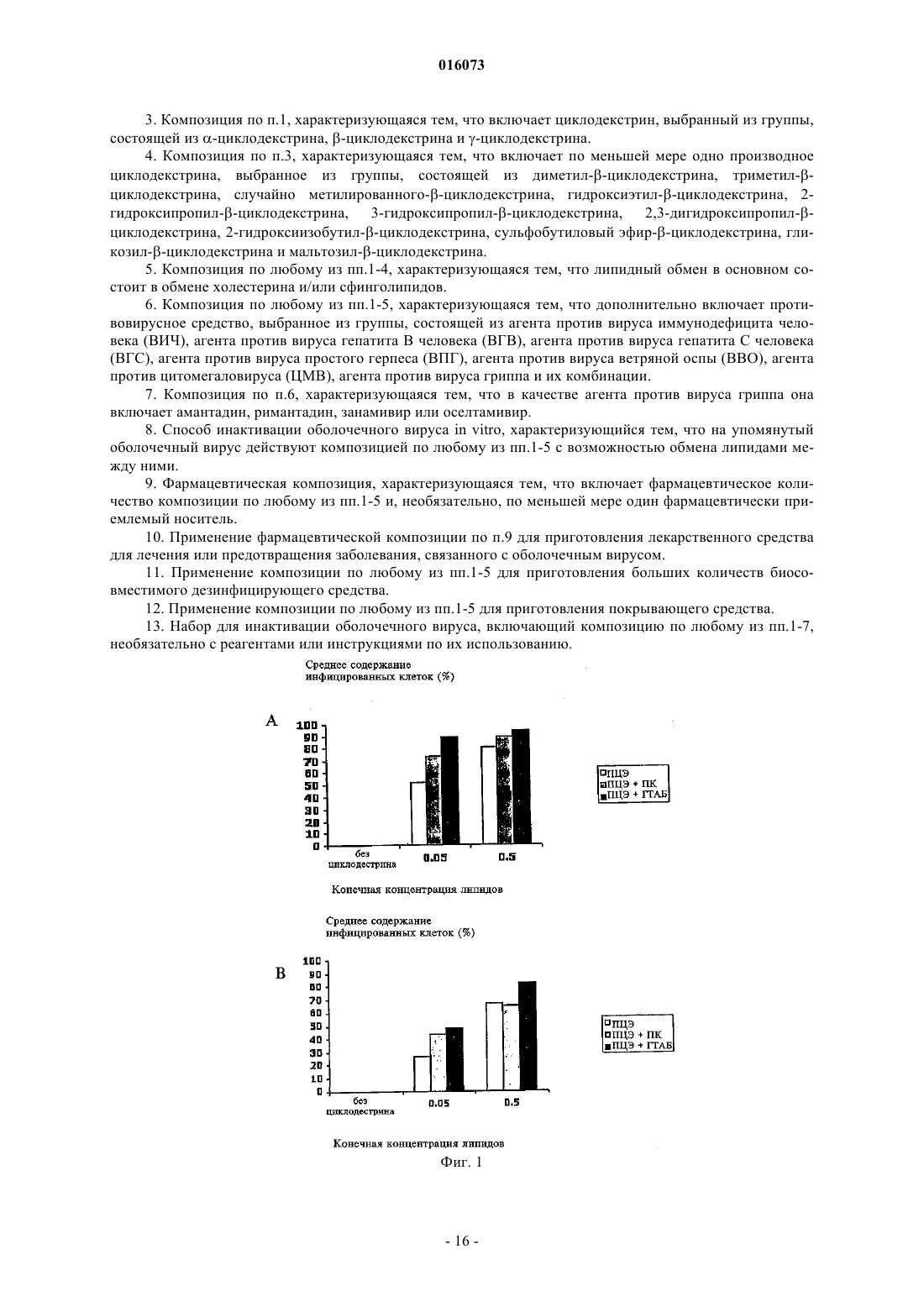
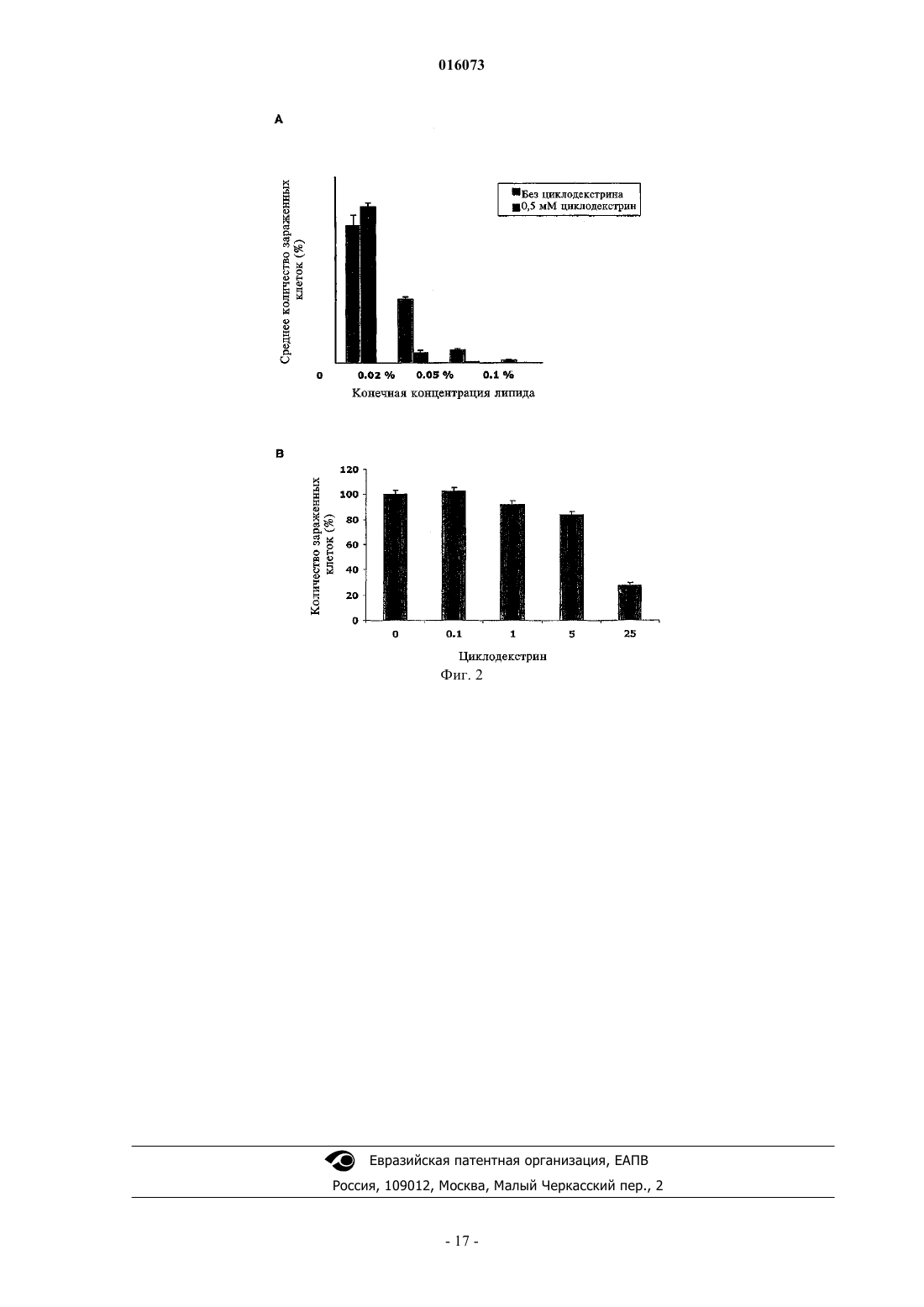
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента КОМПОЗИЦИЯ ДЛЯ ИНАКТИВАЦИИ ОБОЛОЧЕЧНОГО ВИРУСА (ВАРИАНТЫ),СРЕДСТВА НА ЕЕ ОСНОВЕ ДЛЯ ПРИГОТОВЛЕНИЯ ЛЕКАРСТВА ПРОТИВ ВИРУСНОГО ЗАБОЛЕВАНИЯ, ДЛЯ ПРИГОТОВЛЕНИЯ БОЛЬШИХ КОЛИЧЕСТВ БИОСОВМЕСТИМОГО ДЕЗИНФИЦИРУЮЩЕГО СРЕДСТВА И ДЛЯ ПРИГОТОВЛЕНИЯ ПОКРЫТИЯ, СОДЕРЖАЩИЙ ЕЕ НАБОР ДЛЯ ИНАКТИВАЦИИ ОБОЛОЧЕЧНОГО ВИРУСА И СПОСОБ ИНАКТИВАЦИИ ОБОЛОЧЕЧНОГО ВИРУСА Настоящее изобретение преимущественно относится к области предотвращения заболеваний,вызываемых оболочечными вирусами. Более конкретно, данное изобретение касается композиции для инактивации оболочечного вируса, содержащей по меньшей мере одну нефосфолипидную липосому (НФЛ), способную взаимодействовать с упомянутым оболочечным вирусом и с агентом, который усиливает липидный обмен между упомянутой НФЛ и мембраной упомянутого оболочечного вируса. 016073 Область техники, к которой относится изобретение Настоящее изобретение преимущественно относится к области предотвращения заболеваний, вызываемых оболочечными вирусами. Более конкретно, данное изобретение относится к композиции для инактивации оболочечного вируса, содержащей по меньшей мере одну нефосфолипидную липосому (сокращенно - НФЛ или НФ-липосома), способную взаимодействовать с упомянутым оболочечным вирусом и агент, который усиливает липидный обмен между упомянутой НФЛ и мембраной упомянутого оболочечного вируса. Сведения о предшествующем уровне техники Вирусы представляют собой контейнеры с генетическим материалом, который связан с несколькими вирус-специфическими белками. Они инфицируют выбранные клетки с помощью определенных рецепторов, реплицируются внутри них с помощью обычных клеточных механизмов и выходят, чаще всего с разрушением своих прежних организмов-хозяев. В противовирусных стратегиях используют иммунологические методики или лекарства, подавляющие вирус-специфичные функции, что является достаточно проблематичным, поскольку агенты против многих вирусов нарушают также и обычные клеточные функции. Поскольку вирусы развиваются в направлении минимального количества вирус-специфичных функций, вместо соответствующих обычных клеточных функций, то количество вирус-специфичных мишеней незначительно. Так как существует большое разнообразие вирусов, маловероятно, чтобы агент,нацеленный на активность, характерную для определенного вируса, аналогично действовал на другие вирусы. Поскольку геном вируса часто мутирует, вирусы часто вырабатывают устойчивость к специфичным, ранее эффективным агентам, уходя от селективного действия химиотерапевтических агентов. Таким образом, при тестировании большого количества противовирусных средств (несколько тысяч) только около 40 из них продолжали оставаться эффективными, половина из этих средств является агентами против вируса иммунодефицита человека (ВИЧ). Для достижения ощутимого эффекта, как правило,необходимо использовать комбинации агентов против ВИЧ. Похожим образом, "антигенная изменчивость" снижает защитные свойства вакцин (через год или приблизительно через это время в случае гриппа), и это является главной проблемой в борьбе с возможной пандемией гриппа. Вирусы можно подразделить на необолочечные и оболочечные вирусы. Оболочечные вирусы заключены в липопротеиновую мембрану, то есть оболочку. Эта оболочка происходит от клетки хозяина,так как вирус "отпочковывается" с ее поверхности и состоит главным образом из липидов, не кодируемых вирусным геномом. Даже если она несет на себе молекулярные детерминанты для адсорбции и входа в клетки-мишени и критически важна для инфекционной способности оболочечных вирусов, она не подвержена лекарственной устойчивости или антигенной изменчивости. Хотя липиды вирусной оболочки происходят из плазматической мембраны клетки хозяина, их соотношение в оболочке отличается от соотношения в мембране. Например, оболочка ВИЧ обогащается холестерином (в 2,5 раза) и сфингомиелином (в 3 раза), оба компонента концентрируются главным образом во внешней ламелле оболочки (Aloia, et al 1993). Мембраны вирусов гриппа обогащаются схожим образом (Scheiffele, et al 1999); о той же самой модели обогащения сообщалось для других оболочечных вирусов. Важно отметить, что, как недавно было показано, уменьшение содержания холестерина ухудшает инфекционную способность оболочечных вирусов (Ono and Freed, 2001; Simons and Ehehalt, 2002). В самом деле, данные указывают на то, что оболочки многих оболочечных вирусов содержат фазоворазделенные "липидные рафты", обогащенные холестерином, что таким образом наводит на мысль о том,что липиды вирусной оболочки могут являться мишенью в арсенале против оболочечных вирусов. Поскольку липидные рафты клеток, инфицированных вирусом, синтезируются этими клетками, то использование клеточно-направленных ингибиторов, таких как "статины", будет оказывать слишком большую системную токсичность, чтобы быть приемлемым в виде "противорафтовых агентов". Действительно, противорафтовые стратегии будут эффективными только против внеклеточных форм вируса в том случае, когда эти формы доступны внешне, а именно, в носоглотке, ротовой части глотки и в дыхательных путях (например, в случае гриппа), в мочеполовом тракте (например, в случае ВИЧ), в коже (например, в случае простого герпеса) или откладываются на поверхностях (при фомитах). Тот факт, что холестерин и другие липиды могут обмениваться между фосфолипидными ламеллами клеточных мембран, а также между липосомами, представляет собой важную информацию. McLean и Phillips (1981) отмечают, что короткий "полупериод", Т 1/2, 2-3 мин, переноса холестерина между липосомами указывает на столкновения между этими частицами. Steck et al. (2002) подтверждает это заключение. Они показали,что Т 1/2 переноса всего холестерина от красных клеток к акцептору составляет 1 с и зависит только от концентрации акцептора. Они предложили модель "активных соударений", согласно которой холестерин захватывается при столкновении. Т 1/2 для переноса флуоресцентного аналога сфингомиелина между мембранами составляет 21 с (Bai и Pagano, 1997), а "необычный" Т 1/2 для переноса С 18 жирных кислот от масла к воде составляет 1,3 с (Small, 2002). В противоположность этому, измеренный Т 1/2 для переноса фосфатидилхолина между липосомами составил 48 ч при 37 С (McLean и Phillips, 1981). Эти данные наводят на мысль о возможности инактивации оболочечных вирусов с помощью фосфолипидных липосом. Однако фосфолипидные липосомы являются чрезвычайно дорогостоящими, неус-1 016073 тойчивыми, к тому же маловероятно, чтобы они были доступны в количествах, необходимых для профилактики. Более того, сложно приготовить фосфолипидные липосомы с низким содержанием холестерина,которое требуется чтобы получить истинную экстракцию (а не двунаправленный обмен) этого липида, и для их получения требуется использование органических растворителей, которые являются основной причиной клеточной токсичности. Липосомы можно использовать для переноса лекарств с целью доставки фармацевтических или косметических композиций. Например, в публикации международной заявкиWO 1996/012472(Chinoin Gygyszer s Vegyszeti Termkek Gyra RT et al.) раскрыта липосомная композиция, содержащая в качестве активного ингредиента (-)-N-альфа-диметил-N-(2-пропинилфенилэтиламин) (селегилин) и/или его соль. Раскрытая композиция содержит селегилин в количестве 0,140% по массе и/или его соль, липиды - 240% по массе, предпочтительно фосфолипиды, холестерин - 010% по массе, спирт 020% по массе, гликоль - 025% по массе, антиоксидант - 03% по массе, консервант - 03% по массе,модификатор вязкости - 02% по массе, циклодекстрин или производное циклодекстрина - 050% по массе и воду в количестве 3090% по массе. В этой заявке также предложено введение указанной композиции для лечения болезни Альцгеймера, болезни Паркинсона, депрессии, инсульта, укачивания или миелита. Из WO 2005/030170 (Universite Pasteur et al.) также известен способ для инициирования контролируемого разрыва мембраны биосовместимой фосфолипидной липосомы, которую часто называют "хитрой" липосомой, что тем самым приводит к выделению содержимого липосомы во внешнее окружение. Высвобождающийся агент, предпочтительно -циклодекстрин, реализован в форме биосовместимой молекулы. По описанным выше причинам изобретатели установили преимущества использования липосом,например, нефосфолипидной липосомы, состоящей из одноцепочечных поли-(этиленгликоль)алкиловых эфиров [(ПЭГ)алкиловых эфиров], вместо фосфолипидных липосом (Wallach, 1996; Varanelli et al. 1996;Wallach и Varanelli, 1997). В патенте США 5561062 (на имя Varanelli et al.) уже предложен in vitro способ инактивации оболочечных вирусов путем использования олиголамеллярных липосом, предпочтительно не содержащих фосфолипидов, и препараты, используемые для данной инактивации. Этот способ основан на открытии того факта, что олиголамеллярные липосомы, которые предпочтительно не содержат в качестве основного структурного материала фосфолипиды, могут сливаться с оболочечным вирусом, и что нуклеиновая кислота вируса изменяет естественные свойства вскоре после слияния. Как правило, олиголамеллярную липосому заполняют масляным или водным раствором, содержащим агент, разрушающий нуклеиновую кислоту. В другой патентной заявке ЕР 1304103 А 1 (D.F.H Wallach) предложены липосомы, в которых все упомянутые липиды не являются фосфолипидами, а также их применение в качестве носителя, в частности в терапии, например, для профилактики синдрома приобретенного иммунодефицита (СПИД). Эти нефосфолипидные липосомы содержат по меньшей мере один внешний стабилизированный бислой, содержащий помимо прочего липид, модифицирующий бислой, выбранный из холестеринов, внутрилипосомное водное пространство и по меньшей мере одну частицу внутрилипосомной микроэмульсии, окруженную внутренним липидным монослоем. Инактивация вируса ВИЧ происходит вследствие слияния нефосфолипидной липосомы с мембраной упомянутого вируса. Эта способность сливаться, вероятно является следствием наличия холестерина в модулирующем липидном бислое и следствием отсутствия обмена липидов между упомянутой нефосфолипидной липосомой, содержащей холестерин и мембраной вируса ВИЧ. Слияние между описанной выше НФ-липосомой и мембраной оболочечного вируса не подходит для инактивации упомянутого оболочечного вируса in vivo, поскольку для ее протекания требуется длительное время. Несмотря на раскрытие вышеупомянутых патентов и патентных заявок до сих пор существует необходимость в разработке нового способа инактивации оболочечного вируса, который был бы быстрым и эффективным как in vitro, так и in vivo. Сущность изобретения Настоящее изобретение касается композиции для инактивации оболочечного вируса, которая характеризуется тем, что содержит по меньшей мере одну нефосфолипидную липосому (сокращенно НФЛ или НФ-липосома), способную взаимодействовать с оболочечным вирусом и агентом, который усиливает липидный обмен между упомянутой НФ-липосомой и мембраной упомянутого оболочечного вируса, где упомянутая НФ-липосома свободна от холестерина. Дополнительной целью настоящего изобретения является обеспечение способа инактивации оболочечного вируса, включающего взаимодействие упомянутого оболочечного вируса с композицией изобретения так, чтобы они обменивались липидами. Еще одной целью изобретения является обеспечение фармацевтической композиции, содержащей фармацевтически приемлемое количество композиции изобретения, необязательно в комбинации с одним или несколькими фармацевтически приемлемыми носителями.-2 016073 Другой аспект изобретения обеспечивает способ лечения или предотвращения заболевания, связанного с оболочечным вирусом, в организме индивидуума, который включает в себя стадию введения упомянутому больному изобретенной фармацевтической композиции к месту, расположенному вблизи от упомянутого оболочечного вируса. В изобретении также предполагается использование композиции изобретения при изготовлении лекарственного средства для лечения или предотвращения заболевания, связанного с оболочечным вирусом. Другой целью настоящего изобретения является обеспечение использования композиции изобретения при приготовлении больших количеств биосовместимого дезинфицирующего средства или покрывочного средства. Другие цели и преимущества изобретения будут очевидны специалистам в данной области техники при рассмотрении излагаемого далее подробного описания, в котором даются ссылки на следующие иллюстративные чертежи и на сопутствующие заявки. Перечень фигур, чертежей и иных материалов На фиг. 1 показано влияние композиций НФ-липосом на инактивацию двух различных рекомбинантных вирусов Сендай: (A) rSeV-Luc, экспрессирующий ген люциферазы и (В) rSeV-GFP, экспрессирующий зеленый флуоресцентный белок. ПЦЭ - полиоксиэтилен цетиловый эфир. ПК - пальмитиновая кислота. ГТАБ - гексадецилтриметиламмоний бромид. На фиг. 2 показано синергетическое влияние циклодекстрина на инактивацию оболочечного вируса(вирус Сендай) при различных разбавлениях НФ-липосом (0,02, 0,05 и 0,1%). На фиг. 3 показано прямое влияние увеличенных концентраций циклодекстрина, в отсутствии НФлипосом, на инактивацию оболочечного вируса (вирус Сендай). Сведения, подтверждающие возможность осуществления изобретения Настоящее изобретение относится к композиции для инактивации оболочечного вируса, содержащей, по меньшей мере, одну нефосфолипидную липосому, способную взаимодействовать с оболочечным вирусом и агентом, который усиливает липидный обмен между упомянутой НФ-липосомой и мембраной упомянутого оболочечного вируса, где упомянутая НФ-липосома свободна от холестерина. Не уточняемое количество в тексте, подразумевает, по меньшей мере единицу, либо единицу или более. Используемые в этом документе термины "липосома" и "липидный пузырек" применяются взаимозаменяемо для обозначения небольшой сферы, состоящей из липидных оболочек, окружающих центральную полость, которая состоит в основном из водной среды. Липиды находятся в форме бимолекулярных слоев, или ламелл, в онионно-подобной [onion-like] структуре. Используемые в этом документе термины "одноламеллярная", "олиголамеллярная", "мультиламеллярная" относятся к количеству периферийных бислоев, окружающих центральную полость липосомы, в частности, НФ-липосомы изобретения. Одноламеллярная НФЛ состоит из одного периферийного бислоя, окружающего центральную полость, тогда как мультиламеллярная НФЛ состоит из более чем двух периферийных бислоев. Олиголамеллярная НФЛ, которую можно рассматривать в качестве подкласса мультиламеллярной НФ-липосомы, состоит из 2-8 периферийных бислоев. Молекулярные бислои НФ-липосом имеют физическую структуру, схожую с классическими фосфолипидными бислоями. Например, было показано, что рентгеновская дифрактограмма C16(PEG)2 эфирных пузырьков показывает простые и основные рефлексы, что говорит о толщине гидратированного двойного слоя (5,86,1 нанометров) амфифильного вещества, с небольшим интервалом при более высоких концентрациях холестеринаполностью аналогично фосфолипидным бислоям. Промежуток в 6,1 нанометров соответствует двум максимально растянутым амфифильным молекулам вместе со слоем связанной воды (Mitchell, et al. 1983; Adam et al. 1984). Lantzsch et al. (1996) использовал методики флуоресцентного переноса для определения поверхностей поверхностного-активного типа C12(PEG)N в 1 пальмитоил-2-олеоил фосфатидилхолин/С 12(PEG)1-8 липосомах. В случае N = 13, расширение поверхности эквивалентно жидкокристаллической углеводородной фазе на молекулу C12(PEG)N. В случае N = 48,площадь поверхности на молекулу поверхностно-активного вещества увеличивалась постепенно, что наводит на мысль о скрученной конфигурации включенных молекул, с двумя молекулами воды на этиленгликолевый сегмент. Кроме того,водные дисперсии 1,2-тетрадецилили 1,2 гексадецилфосфатидилхолина допускают большие доли C16(PEG)4 (Madler et al., 1998). Используемые в этом документе термины "взаимодействовать" и "взаимодействие" означают оказание влияния одного объекта на другой посредством прямого контакта или на расстоянии. В настоящем изобретении агент, который усиливает липидный обмен, как описано выше, действует при соприкосновении или столкновении НФ-липосом изобретения с оболочечным вирусом или при возвратнопоступательном движении между НФ-липосомами изобретения и оболочечным вирусом. Примеры семейств оболочечных вирусов и некоторые представители этих семейств включают, но не ограничиваются следующие: Poxviridae, например, коровья оспа и натуральная оспа, Iridoviridae,Herpesviridae, например простой герпес, вирус ветряной оспы, цитомегаловирус и вирус Эпштейна-3 016073 Барра, Flaviviridae, например, вирус желтой лихорадки, вирус клещевого энцефалита и вирус гепатита С,Togaviridae, например, вирус краснухи и вирус Синдбис, Coronaviridae, например, коронавирус человека(вирус ТОРС), Paramyxoviridae, например, вирусы парагриппа, вирус свинки, вирус кори и респираторносинцитиальный вирус, Rabdoviridae, например, вирус везикулярного стоматита и вирус бешенства,Filoviridae, например, вирус Марбурга и вирус Эбола, Orthomyxoviridae, например, вирусы гриппа А и В,Bunyaviridae, например, вирус Бвамба, вирус калифорнийского энцефалита, вирус флеботомной лихорадки и вирус лихорадки долины Рифт, Arenaviridae, например, вирус лимфоцитарного менингита, вирус Ласса и вирус Юнина, Hepadnaviridae, например, вирус гепатита В, и Retroviridae, например, вирус Тклеточного лейкоза и ВИЧ. Предпочтительно вирус изобретения выбирают из табл. 1. Таблица 1 Наиболее предпочтительно оболочечным вирусом является вирус гриппа, РСВ, вирус ТОРС, метапневмовирус, вирус герпеса или ВИЧ. Более предпочтительно оболочечным вирусом является вирус гриппа или ВИЧ. Нефосфолипидная липосома (НФЛ) относится к липосомам, которые представляют собой сферические структуры, состоящие из материала с высоким содержанием липидов. Эти липиды предпочтительно заключены в нефосфолипид, и их выбирают из группы, включающей соединения, перечисленные в табл. 2. Наиболее предпочтительно нефосфолипидные вещества изобретения выбирают из группы, включающей полиоксиэтилен цетиловый эфир (ПЦЭ), пальмитиновую кислоту (ПК), гексадецилтриметиламмоний бромид (ГТАБ) и олеиновую кислоту (ОК), либо в отдельности, либо в комбинации. Нефосфолипидные липосомы изобретения характеризуются тем, что они свободны от холестерина(или по-существу свободны от холестерина), т.е. они не содержат холестерин (или, соответственно, содержат только следовые количества холестерина), производные холестерина, например, такие как ПЭГ холестерин, ионогенный холестерин и поверхностно-стабилизированный холестерин, бета-ситостерин,эргостерин и фитостерин. Для облегчения липидного обмена между мембраной оболочечного вируса и НФ-липосомой весьма важно, чтобы холестерин по существу отсутствовал в композиции липосомы. Было показано, что мембранные липиды, в особенности холестерин, могут обмениваться между фосфолипидными липосомами или между липосомами и клеточными мембранами. Этот обмен происходит по механизму активных соударений, со скоростью, в случае холестерина, порядка нескольких секунд или минут (Steck et al., 2002; John et al., 2002). К удивлению, заявители показали, что модификации ли-8 016073 пида происходят вследствие переноса (с высокой скоростью) холестерина и, возможно, сфинголипидов между вирусными частицами и липосомами изобретения. Заявители, неожиданно, показали, что композиция изобретения способна инактивировать оболочечные вирусы. Эта инактивация происходит посредством липидного обмена между НФ-липосомой и мембраной оболочечного вируса (ОВ). Липиды оболочечных вирусов синтезируются клеткой-хозяином, но откладываются в оболочках в других соотношениях, чем в плазматической мембране клетки-хозяина. Например, оболочка ВИЧ обогащается холестерином (в 2,5 раза) и сфингомиелином (в 3 раза), оба из которых располагаются главным образом во внешней ламелле оболочки (Aloia, et al. 1993). Мембраны вирусов гриппа обогащаются похожим образом (Scheiffele, et al. 1999), и такая же модель обогащения сообщалась для других оболочечных вирусов. Действительно, сильные доказательства указывают на то, что оболочки всех оболочечных вирусов содержат микродоменытак называемые "липидные рафты", обогащенные холестерином и сфинголипидами, которые встроены в сплошную среду липидного бислоя. Образование частиц оболочечных вирусов из липидных рафтов происходит селективно. Важно отметить, что при истощении холестерина блокируется инфекционная способность оболочечного вируса (Moore et al. 1978, Ono и Freed,2001; Simons и Ehehalt, 2002), что наводит на мысль о том, что липиды вирусной оболочки могут являться первичной целью в арсенале средств против оболочечных вирусов. Не являясь ковалентно-связанными, холестерин и некоторые другие липиды могут обмениваться между клеточной мембраной, мембранами ОВ и липосомами (например, Moore et al., 1978, Nussbaum,Lapidotn Loyter, 1987). McLean и Phillips (1981) отмечают, что короткий "полупериод" переноса, Т 1/2 = 23 мин, холестерина между фосфолипидными липосомами указывает на соударения между этими частицами. Steck et al. (2002) показали, что весь перенос холестерина от мембран красных клеток к акцепторной молекуле протекает за Т 1/21 с, в зависимости от концентрации акцептора. Они предложили модель "активных соударений" - механизм, в котором холестерин захватывается при столкновении поверхности мембраны с акцепторами. Т 1/2 для переноса флуоресцентного аналога сфингомиелина (21 с) между мембранами также является коротким (Bai и Pagano, 1997). В противоположность этому измеренный Т 1/2 для переноса фосфатидилхолина между липосомами составляет 48 ч при 37 С (McLean и Phillips,1981). Композиция изобретения также характеризуется тем, что кроме по меньшей мере одной НФлипосомы, содержит агент, который усиливает и/или катализирует липидный обмен между упомянутой НФ-липосомой и мембраной оболочечного вируса. Авторы также показали, что такой агент может селективно экстрагировать холестерин из клеточных мембран и усиливать липидный обмен между НФлипосомой и мембраной оболочечного вируса. Предпочтительно, данным агентом является циклодекстрин или стероидогенный острый регуляторный белок (StAR). Наиболее предпочтительно агентом является циклодекстрин или его производное. Циклодекстрины (ЦД) - это циклические олигомеры глюкозы, которые могут образовывать водорастворимые комплексы включения с малыми молекулами и частями больших соединений. Химически они представляют собой олигосахариды, содержащие по меньшей мере 6 D-(+) глюкопиранозных звеньев, соединенных посредством -(1,4) глюкозидных связей. Существует 3 природных циклодекстрина - -, и -циклодекстрины, которые различаются по размеру цикла и растворимости. Эти биосовместимые,циклические олигосахариды не вызывают иммунных реакций и малотоксичны для животных и людей. Циклодекстрины используют в фармацевтике для многих целей, включая улучшение биодоступности лекарств. -Циклодекстринможет селективно экстрагировать холестерин из клеточных мембран. При высоких концентрациях он также извлекает холестерин из вирусной оболочки и снижает инфекционную способность вируса. Однако, при высоких концентрациях -циклодекстрин проявляет клеточную токсичность и может вызывать либо лизис клеток, либо гибель клетки (апоптоз). Производные ЦД раскрываются в патенте США 5760017 (на имя Djedaini-Pilard et al.) и в международной заявке WO 1991/013100 (изобретатель Coates et al.), раскрытие которых включено в настоящий документ посредством ссылки. К примерам производных ЦД относятся (но перечень этим не ограничивается): диметилциклодекстрин,триметилциклодекстрин,случайно метилированный-циклодекстрин, гидроксиэтилциклодекстрин, 2-гидроксипропилциклодекстрин, 3-гидроксипропил-циклодекстрин, 2,3-дигидроксипропилциклодекстрин, 2-гидроксиизобутилциклодекстрин, сульфобутиловый эфирциклодекстрин, гликозилциклодекстрин и мальтозилциклодекстрин. Обычно агент добавляют в композицию. Под конец готовят подходящую концентрацию ЦД в воде или ЗФФР (забуференный фосфатом физиологический раствор) и добавляют в композицию так, чтобы получилась требуемая концентрация. Предпочтительно, концентрация циклодекстрина или производных циклодекстрина в композиции изобретения составляет от 0,01 до 50 мМ. Наиболее предпочтительно данная концентрация составляет от 0,1 до 10 мМ. При столь низкой концентрации -ЦД оказывает ограниченное влияние на целостность клетки и инфекционную способность вируса и, кроме этого, он катализирует перенос холестерина от вирусной мембраны к нефосфолипидным олиголамеллярным липосомам. Результаты, показанные на-9 016073 фиг. 2 свидетельствуют о сильном синергетическом действии -циклодекстрина на инактивацию оболочечного вируса, в особенности при очень низких концентрациях НФ-липосом. Альтернативно, агент, усиливающий липидный обмен между упомянутой НФ-липосомой и мембраной оболочечного вируса, может представлять собой стероидогенный острый регуляторный белок(СОРБ). Стероидогенный острый регуляторный (СОРБ) белок является важным компонентом регуляции биосинтеза стероидов в клетках надпочечников и гонадных клетках через цАМФ-зависимые пути обмена. Во многих случаях индукция транскрипции посредством цАМФ происходит в результате взаимодействия представителя семейства белков, связывающихся с цАМФ-ответным элементом (CREB), с общим типичным цАМФ-ответным элементом (CRE; 5'-TGACGTCA-3') находящимся в промоторе генов-мишеней (Pulak R. Manna et al (2002), Molecular Endocrinology 16 (1): 184-199). Предвидится, что укороченную форму СОРБ (например, N62 StAR; Tuckey et al., 2002 и Alpy et al.,2005) также можно использовать в качестве агента, усиливающего липидный обмен между НФлипосомой и мембраной оболочечного вируса. Эта укороченная форма СОРБ, как было показано, улучшает перенос холестерина между фосфолипидными липосомами примерно в 510 раз. Предпочтительно в таком случае СОРБ белок композиции находится в растворе. Композиция может находиться в жидком, твердом (например, в виде порошка) или в полутвердом состоянии. Обычно диаметр НФ-липосомы в композиции составляет от 0,2 до 10 мкм. Как правило, липидный обмен в основном заключается в обмене холестерина и/или сфинголипидов. Сфинголипиды - это класс липидов, происходящих из сфингозина - алифатического аминоспирта. Скелет сфингозина связан (обычно) через атом кислорода с заряженной главной группой, такой как этаноламин, серии или холин. Также его скелет связан через амидную группу с ацильной группой, такой как жирная кислота. Сфинголипиды часто обнаруживают в нервной ткани, они играют важную роль как при передаче сигнала, так и при распознавании клеток. Существует три основных типа сфинголипидов: церамиды, сфингомиелины и гликосфинголипиды, которые отличаются по заместителям при их главной группе. Церамиды являются простейшим типом сфинголипидов. Они состоят только из цепи жирной кислоты, соединенной через амидный мостик со сфингозином. В сфингомиелинах имеется молекула фосфорилхолина или фосфорилэтаноламина, образующая сложный эфир с 1-гидроксигруппой церамида. Гликосфинголипиды представляют собой церамиды с одним или несколькими остатками сахара, присоединенными через -гликозидный мостик при 1-гидроксильном положении. Гликосфинголипиды можно,кроме того, подразделить на цереброзиды и ганглиозиды. Цереброзиды имеют один глюкозный или галактозный остаток при 1-гидроксильном положении, тогда ганглиозиды имеют, по меньшей мере, три остатка сахара, один из которых представляет собой сиаловую кислоту. Обычно полагают, что сфинголипиды защищают клеточную поверхность от вредных факторов окружающей среды путем образования механически устойчивой и химически стойкой внешней оболочки липидного бислоя плазматической мембраны. Было обнаружено, что определенные сложные гликосфинголипиды участвуют в выполнении специфических функций, таких как распознавание клеток и передача сигналов. Первое свойство зависит,главным образом, от физических свойств сфинголипидов, тогда как передача сигналов включает специфические взаимодействия со схожими липидами, находящимися на соседних клетках, или с белками. Предпочтительно сфинголипидами изобретения являются сфингомиелины или их производные. Также настоящее изобретение охватывает способ инактивации оболочечного вируса, включающий в себя стадию взаимодействия оболочечного вируса с композицией изобретения, в котором упомянутой композиции НФ-липосом позволяют обмениваться своими липидами с упомянутым оболочечным вирусом. Способы изготовления этих липосом и сами липосомы описываются подробно в патентах США 4911928, 5147723, 5032457, 4895452 и в заявке на патент США с серийным 761253, раскрытия которых включены в этот документ по ссылке. Также настоящее изобретение охватывает фармацевтическую композицию, характеризуемую тем,что она содержит фармацевтически приемлемое количество композиции изобретения, необязательно в комбинации с одним или несколькими фармацевтически приемлемыми носителями. Выражение "фармацевтически приемлемый" относится к молекулярным объектам и композициям,которые физиологически приемлемы и, как правило, не вызывают аллергических и схожих нежелательных реакций, таких как желудочное расстройство, головокружение и подобные им реакции при введении в организм человека. Приемлемые носители, наполнители и стабилизаторы нетоксичны для реципиентов при используемых дозировках и концентрациях, и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты, такие как октадецилдиметилбензиламмоний хлорид; низкомолекулярные (с молекулярной массой менее 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу- 10016073 или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, тригаллоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов. Форма введения фармацевтической композиции может быть системной или местной. Например,введение такой композиции можно проводить различными парентеральными путями, например, подкожным, внутривенным, интрадермальным, внутримышечным, интраперитонеальным, интраназальным,трансдермальным, букальным способами, предпочтительно путем ингаляции или через имплантируемое приспособление, композицию можно также доставлять с помощью перистальтических средств. Описанную в этом документе фармацевтическую композицию можно также внедрять или наполнять в биопоглощаемую матрицу, при этом матрицу вводят в форме суспензии матрицы, геля или на твердой подложке. Кроме того, матрица может также состоять из биополимера. При использовании составов для введения in vivo, они должны быть стерильными, этого легко можно достигнуть, например, при использовании стерильных соединений для приготовления композиции изобретения. Следует понимать, что подходящие дозы фармацевтической композиции настоящего изобретения будут зависеть от возраста, пола, состояния здоровья и веса реципиента, от вида сопутствующего лечения, если оно проводится, и природы эффекта. Соответствующая форма дозировки будет зависеть от болезни, НФ-липосомы, усиливающего агента и способа введения, возможности включают распыляемый раствор или другие аэрозольные средства доставки в дыхательные пути, которые в частности эффективны для борьбы с гриппом и другими вирусами, инфицирующими эти пути. Другие способы местного применения инактивирующего раствора включают крема, жидкости для полоскания рта, зубные пасты, глазные капли, растворы, мази, гели, например, вагинальные гели, и смазки, например, кондомные смазки. Последние категории средств в частности эффективны для использования против ретровирусов, таких как ВИЧ. Настоящее раскрытие также предоставляет способ лечения или предотвращения заболевания, связанного с оболочечным вирусом, в организме индивидуума, который включает в себя стадию доставки упомянутому больному фармацевтической композиции, описанной в этом документе, до места вблизи от упомянутого оболочечного вируса. Опять же, к возможным средствам относятся распыляемый раствор или другие аэрозольные средства для доставки в дыхательные пути, крема, жидкости для полоскания рта,зубные пасты, растворы, гели, например вагинальные гели, глазные капли и смазки, например кондомные смазки. Взаимодействие композиции изобретения с оболочечным вирусом в воздушных путях нарушает оболочку вирусной мембраны и блокирует инфекционную способность вируса, тем самым блокируя распространение его в легких (индивидуальная профилактика-лечение). Композиция и инактивированные вирусы выводятся посредством физиологических процессов. Более того, после частичной или полной инактивации вирусов происходит ограничение их распространения на окружающих людей при вытеснении посредством откашливания или чиханья (профилактика населения). Термины "лечение или предотвращение" относятся как к терапевтическому лечению, так и к профилактическим и предупредительным мерам. К больным, которые нуждаются в лечении, относятся те, у кого уже имеется расстройство, а также те, расстройство которых предотвращается. Поэтому больной,подвергаемый лечению в этом документе, может иметь диагноз в виде наличия расстройства или предрасположенности или восприимчивости к расстройству. Предпочтительно больным является животное или человек. Наиболее предпочтительно термин животное относится к домашним и сельскохозяйственным животным (например, к домашним птицам) и животным зоопарка, спортивным или комнатным животным, таким как собаки, лошади, свиньи, кошки,коровы, обезьяны и т.д. Объем настоящего изобретения охватывает также использование фармацевтической композиции,описанной в этом документе, при изготовлении лекарственного средства для лечения или предотвращения заболевания, связанного с оболочечным вирусом. Также настоящим изобретением охватывается использование композиции изобретения при изготовлении больших количеств биосовместимого дезинфицирующего средства. Соответственно, композицию изобретения разбавляют при необходимости для получения простых суспензий или дисперсий в гидрогелях. Настоящее раскрытие также обеспечивает использование композиции изобретения при изготовлении покрывающего средства. Это покрывающее средство можно затем использовать для покрытия, например, хирургических свечей, мужских презервативов и персональных масок. Другим объектом настоящего изобретения является обеспечение набора для инактивации оболочечного вируса, при этом упомянутый набор включает композицию изобретения, необязательно вместе с реагентами и/или инструкциями по использованию. Набор настоящего изобретения может, кроме того, включать отдельную фармацевтическую дозированную форму, содержащую дополнительное противовирусное средство, выбираемое из группы, состоящей из агентов, перечисленных в табл. 3, и их комбинаций. Альтернативно, композиция изобретения может, кроме того, содержать дополнительное противовирусное средство, выбираемое из группы, включающей агенты, перечисленные в табл. 3, и их комбина- 11016073 ции. Предпочтительно, дополнительное противовирусное средство выбирают из группы против вируса гриппа, включающей амантадин, римантадин, занамивир и оселтамивир. Таблица 3. Опробованные противовирусные лекарства (Q4 2004) Инфекции ВИЧ Нуклеозидные ингибиторы обратной транскриптазы (NRTPI) Зидовудин, диданозин, залкитабин, ставудин, ламивудин, абакавир, эмтрицитабин. Нуклеотидные ингибиторы обратной транскриптазы (NtRTI) Тенофовир дизопроксил. Ненуклеозидные ингибиторы обратной транскриптазы (NNRTI) Невирапин, делавирдин, эфавиренц. Ингибиторы протеазы (PI) Саквинавир, ритонавир, индинавир, нелфинавир, ампренавир, лопинавир, атазанавир. Ингибиторы слияния (FI) Энфувиртид. Инфекции ВГВ Ламивудин, адефовир дипивоксил. Инфекции ВГСINF-, рибавирин. Инфекции ВПГ и ВВО Ацикловир (орально валацикловир), пенцикловир (орально фамцикловир), идоксуридин, трифлуридин, бривудин. Инфекции ЦМВ Ганцикловир (орально валганцикловир), фоскамет, цидофовир, формиврисен. Инфекции вирусом гриппа Амантадин, римантадин, занамивир, оселтамивир. ВИЧ - вирус иммунодефицита человека. ВГВ - вирус гепатита В человека. ВГС - вирус гепатита С человека. ВПГ - вирус простого герпеса. ВВО - вирус ветряной оспы. ЦМВ - цитомегаловирус. Источник литературы: De Clercq, Nat. Rev. Microbio. (2004) 2: 704-720. Как правило, набор включает контейнер и этикетку или листовку-вкладыш, расположенную в упаковке или прикрепленную к ней. К подходящим контейнерам относятся, например, бутыли, пузырьки,шприцы и т.д. Контейнеры могут быть сформированы из различных материалов, таких как стекло или пластик. Контейнер удерживает композицию, которая является эффективной для лечения расстройства, и может иметь стерильное входное отверстие (например, контейнер может представлять собой мешок для внутривенного раствора или флакон с пробкой, которую можно протыкать иглой для подкожной инъекции, или устройство для распыления аэрозоля). Этикетка или листовка-вкладыш на упаковке указывает на то, что композицию используют для лечения выбранного расстройства, например, вирусных инфекций. Альтернативно или дополнительно, набор может, кроме того, включать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (БВДИ), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме этого, он может включать другие материалы, которые желательны с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы. Специалисты в данной области техники примут во внимание, что описанное в этом документе изобретение может быть изменено и модифицировано иначе, чем описано в конкретных вариантах воплощения. Следует понимать, что изобретение включает все такие вариации и модификации без отклонения от сути и главных деталей. Изобретение также включает все стадии, признаки, композиции и соединения, относящиеся к данному описанию или указанные в нем, в отдельности или вместе, а также все и каждую комбинацию, или какие-либо две или более из упомянутых стадий и признаков. Поэтому настоящее раскрытие необходимо рассматривать во всех аспектах, как иллюстративное и неограничивающее, при этом объем изобретения обозначен прилагаемой формулой изобретения, и подразумевается, что все изменения, которые попадают в пределы значения и диапазон эквивалентности охватываются им. На протяжении данного описания даются различные ссылки, каждая из которых целиком и полностью включена в этот документ посредством ссылки. Вышеизложенное описание будет более понятным со ссылкой на следующие Примеры. Однако данные примеры являются лишь иллюстрацией способов осуществления настоящего изобретения на практике и не предназначены для ограничения объема изобретения. Примеры Пример 1. Материалы и методы Клетки и вирусы Клетки МК 2 (обезьяны) выращивают при 37 С в DMEM, содержащей 5% бычьего сывороточного альбумина (БСА), до тех пор, пока они не достигнут 70%-ного слияния. Используют два рекомбинантных вируса Сендай: (1) rSeV-Luc, который кодирует ген люцеферазыPhotinus pyralis в качестве маркера и (2) rSeV-GFP, который кодирует зеленый флуоресцентный белокAequora victoria в качестве маркера. Получение НФ-липосом В первую очередь использовали полиоксиэтилен цетиловый эфир (ПЦЭ), отдельно или в комбинации с пальмитиновой кислотой (ПК) или с гексадецилтриметиламмоний бромидом (ГТАБ) в указанном молярном соотношении. Смесь липидов нагревают до 50 С и смешивают с забуференным фосфатом физиологическим раствором (ЗФФР), который также предварительно нагревают до 50 С, используя двухшприцовый способ. Вкратце, этот способ заключается в следующем: 10-мл шприц, содержащий 0,5 г смеси липидов, соединяют со вторым 10-мл шприцом, содержащим 10 мл забуференного фосфатом физиологического раствора (ЗФФР) (конечная концентрация липида 5 %). Затем в липидную смесь вводят шприц с ЗФФР и полученную в результате смесь быстро пропускают вперед-назад примерно 20 раз до тех пор, пока не получится гомогенная смесь. Затем препарат проверяют на качество НФ-липосом методом фазовоконтрастной микроскопии. Анализ инактивации Препараты НФ-липосом разводят в ЗФФР до указанных концентраций. Разбавленные НФлипосомы затем смешивают с вирусами так, чтобы конечный объем составлял 100 мкл. Смеси вирусов с НФ-липосомами выдерживают при комнатной температуре в течение 30 мин, проводя встряхивание. Концентрации вирусов варьируют в диапазоне от 105 до 2106 частиц. После выдерживания смесь разбавляют до 500 мл в DMEM без БСА и добавляют прямо на клетки. Заражения проводят при 33 С в течение одного часа, а затем зараженные смеси вынимают. Клетки промывают один раз DMEM без БСА, добавляют 10 мл DMEM с 1 % БСА и выдерживание продолжают далее при 37 С в течение 36 ч. Эксперименты проводят три раза. Мониторинг В случае инфекций rSeV-Luc клетки лизируют, и определяют активность люциферазы, используя систему анализа люциферазы Promega. Измерения проводят с помощью TD-20/20 люминометра (TurnerDesigns). В случае инфекций rSeV-GFP клетки собирают трипсинизацией и подвергают FACS анализу с помощью FACS сканирующего прибора. Пример 2. Синергетическое действие циклодекстрина Клетки и вирус Клетки МК 2 (обезьяны) выращивают при 37 С в DMEM, содержащей 5% бычьего сывороточного альбумина (БСА), до тех пор, пока они не достигнут 70%-ного слияния. Используют рекомбинантный вирус Сендай, rSeV-Luc, который кодирует ген люциферазы Photinuspyralis. Получение НФ-липосом Как описано выше в примере 1. Анализ инактивации Препараты НФ-липосом разбавляют в ЗФФР до указанных концентраций. Разбавленные НФлипосомы затем смешивают с вирусами, либо отдельно (без циклодекстрина) либо в комбинации с 0,5 мМ (конечная концентрация) циклодекстрином в объеме 100 мкл. Смеси вирусов с НФ-липосомами затем выдерживают при комнатной температуре 20 мин, встряхивая их. Используют примерно 105 вирусных частиц. После выдерживания смеси разбавляют до 500 мл в DMEM без БСА и добавляют прямо на клетки. Заражения проводят при 33 С один час, а затем зараженные смеси вынимают. Клетки промывают один раз DMEM без БСА, добавляют 10 мл DMEM с 1% БСА и продолжают инкубировать при 37 С еще 36 часов. Эксперимент проводят два раза. Мониторинг Клетки МК 2 лизируют, и определяют активность люциферазы, используя систему анализа люциферазы Promega. Измерения проводят с помощью TD-20/20 люминометра (Turner Designs). Пример 3. Результаты Для того чтобы исследовать возможность инактивации оболочечных вирусов (ОВ) посредством модификации их оболочки, авторы используют в качестве модели вирус Сендай (SeV). SeV представляет собой оболочечный вирус семейства Paramyxoviridae и имеет генетические и структурные черты, сходные с несколькими патогенными вирусами человека. Это респираторный вирус, обычным хозяином которого является мышь, но его можно выращивать в различных эукариотических клетках, включая куриные яйца с развивающимся эмбрионом, в которых можно легко получать вирусные штаммы с высоким титром. Было показано, что подобно многим оболочечным вирусам, инфекционная способность SeV зависит от холестерина, хотя точный механизм еще не вполне ясен. Заявители используют 2 типа рекомбинантных SeV (rSeV) с различным маркерным геном, кодируемым в их геномах. В случае rSeV-Luc, кодирующем ген люциферазы, за уровнем заражения можно наблюдать, используя очень чувствительный- 13016073 биохимический метод анализа. rSeV-GFP, в свою очередь, кодирует ген зеленого флуоресцентного белка,и за заражением можно следить на клеточном уровне, используя флуоресцентный метод сортировки клеток (FACS), который позволяет провести точное определение количества зараженных клеток. Авторы получили три типа НФ-липосом, используя различные липидные соединения: (1) НФлипосомы, состоящие только из нейтрального компонента, полиоксиэтилен цетилового эфира (ПЦЭ). (2) НФ-липосомы, состоящие, главным образом, из ПЦЭ, но включающие 0,1 мол.% пальмитиновой кислоты (ПК), отрицательно заряженного липида. (3) НФ-липосомы, состоящие из ПЦЭ и 0,1 мол.% гексадецилтриметиламмоний бромида (ГТАБ), положительно заряженного липида. Как видно из фиг. 1, эффективность инактивации вирусов сильно зависит от липидного состава НФлипосом. Эти вариации наблюдают в случае обоих рекомбинантных вирусов в очень схожем диапазоне. Из этих результатов становится ясно, что наличие на поверхности НФ-липосом электрического заряда,как положительного, так и отрицательного, чрезвычайно повышает инактивацию вируса. Это можно объяснить двояко. Во-первых, электростатическое отталкивание между НФ-липосомами может предотвращать слипание, агрегацию или слияние пузырьков, тем самым улучшая качество и устойчивость препарата НФ-липосом. Во-вторых, благодаря фосфолипидному составу и наличию поверхностных гликопротеинов, вероятно, поверхность вирусной частицы заряжается при физиологическом рН. Присутствие локально-заряженных микродоменов на поверхности вирусной частицы может благоприятствовать взаимодействиям с заряженными НФ-липосомами за счет электростатического притяжения. Циклодекстрин - это фармацевтический агент, хорошо известный своей способностью экстрагировать холестерин из клеточных фосфолипидных мембран. Однако, диапазон используемых концентраций в большинстве in vitro экспериментов (50-100 мМ) является пагубным для клеточной целостности и может вызывать гибель клеток. Поэтому авторы решили исследовать возможность использования очень низких концентраций циклодекстрина для улучшения переноса холестерина от вирусных частиц к НФ-липосомам. Мотивы,которые стоят за этими экспериментами заключаются в следующем: при очень низких концентрациях(0,52 мМ) -циклодекстрин не оказывает токсичного действия на клетки, и при этом все еще способен экстрагировать холестерин из доменов липидных рафтов вируса. После захвата холестерина циклодекстрин направляется к НФ-липосомам и доставляет холестерин к нефосфолипидным мембранам. После этого пустой -циклодекстрин продолжает цикл экстракции до достижения концентрационного равновесия холестерина между НФ-липосомами и вирусными частицами. Таким образом, при такой низкой концентрации (-циклодекстрин будет служить в качестве катализатора переноса холестерина между вирусными оболочками и НФ-липосомами. На фиг. 2 ясно показано, что -циклодекстрин при концентрации в 0,5 мМ сильно усиливает инактивацию вирусов НФ-липосомами, состоящими из ПЦЭ с 0,1 мол.% олеиновой кислоты (OK) - отрицательно заряженным липидом. Как показано на фиг. 3, это усиливающее действие является следствием каталитической активности, поскольку прямое влияние циклодекстрина, в отдельности, на вирусные частицы наблюдается только при концентрации выше 5 мМ. СсылкиWallach DFH New non-phospholipid vesicles (nPLV) and their use in cosmetic, therapeutic and prophylactic applications, 2001. Европейская патентная заявка 1304103, PCT, нац. фаза в США в 2005.Working committee of the World Health organisation (Who). Avian influenza (H5N1) infection. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция для инактивации оболочечного вируса, характеризующаяся тем, что она включает по меньшей мере одну свободную от холестерина нефосфолипидную липосому (НФЛ), способную взаимодействовать с упомянутым оболочечным вирусом, и циклодекстрин или производные циклодекстрина,которые усиливают липидный обмен между упомянутой НФЛ и мембраной упомянутого оболочечного вируса, причем концентрация циклодекстрина или производных циклодекстрина в композиции составляет от 0,01 до 10 мМ. 2. Композиция по п.1, характеризующаяся тем, что упомянутая НФЛ в ней выполнена одноламеллярной, олиголамеллярной или мультиламеллярной.- 15016073 3. Композиция по п.1, характеризующаяся тем, что включает циклодекстрин, выбранный из группы,состоящей из -циклодекстрина, -циклодекстрина и -циклодекстрина. 4. Композиция по п.3, характеризующаяся тем, что включает по меньшей мере одно производное циклодекстрина, выбранное из группы, состоящей из диметилциклодекстрина, триметил-циклодекстрина, случайно метилированногоциклодекстрина, гидроксиэтилциклодекстрина, 2 гидроксипропилциклодекстрина, 3-гидроксипропилциклодекстрина, 2,3-дигидроксипропил-циклодекстрина, 2-гидроксиизобутилциклодекстрина, сульфобутиловый эфирциклодекстрина, гликозилциклодекстрина и мальтозилциклодекстрина. 5. Композиция по любому из пп.1-4, характеризующаяся тем, что липидный обмен в основном состоит в обмене холестерина и/или сфинголипидов. 6. Композиция по любому из пп.1-5, характеризующаяся тем, что дополнительно включает противовирусное средство, выбранное из группы, состоящей из агента против вируса иммунодефицита человека (ВИЧ), агента против вируса гепатита В человека (ВГВ), агента против вируса гепатита С человека(ВГС), агента против вируса простого герпеса (ВПГ), агента против вируса ветряной оспы (ВВО), агента против цитомегаловируса (ЦМВ), агента против вируса гриппа и их комбинации. 7. Композиция по п.6, характеризующаяся тем, что в качестве агента против вируса гриппа она включает амантадин, римантадин, занамивир или оселтамивир. 8. Способ инактивации оболочечного вируса in vitro, характеризующийся тем, что на упомянутый оболочечный вирус действуют композицией по любому из пп.1-5 с возможностью обмена липидами между ними. 9. Фармацевтическая композиция, характеризующаяся тем, что включает фармацевтическое количество композиции по любому из пп.1-5 и, необязательно, по меньшей мере один фармацевтически приемлемый носитель. 10. Применение фармацевтической композиции по п.9 для приготовления лекарственного средства для лечения или предотвращения заболевания, связанного с оболочечным вирусом. 11. Применение композиции по любому из пп.1-5 для приготовления больших количеств биосовместимого дезинфицирующего средства. 12. Применение композиции по любому из пп.1-5 для приготовления покрывающего средства. 13. Набор для инактивации оболочечного вируса, включающий композицию по любому из пп.1-7,необязательно с реагентами или инструкциями по их использованию.
МПК / Метки
МПК: A61K 9/127
Метки: способ, оболочечного, биосовместимого, инактивации, основе, количеств, средства, композиция, больших, против, покрытия, вируса, заболевания, вирусного, дезинфицирующего, набор, приготовления, варианты, содержащий, лекарства
Код ссылки
<a href="https://eas.patents.su/18-16073-kompoziciya-dlya-inaktivacii-obolochechnogo-virusa-varianty-sredstva-na-ee-osnove-dlya-prigotovleniya-lekarstva-protiv-virusnogo-zabolevaniya-dlya-prigotovleniya-bolshih-kolichestv.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция для инактивации оболочечного вируса (варианты), средства на ее основе для приготовления лекарства против вирусного заболевания, для приготовления больших количеств биосовместимого дезинфицирующего средства и для приготовления покрытия, содержащий ее набор для инактивации оболочечного вируса и способ инактивации оболочечного вируса</a>
Предыдущий патент: Применение состава соли кальция для изменения биофизических свойств слизистой оболочки
Следующий патент: Тканая структура для временного покрытия поверхности
Случайный патент: Коммуникационное устройство и способ блокировки элемента оборудования