Способ восстановительного алкилирования для получения n-(2-(r)-гидрокси-1-(s)-инданил)-2(r)-фенилметил-4(s)-гидрокси-5-(1-(4-(3-пиридилметил)-2-(s)-n’-трет.-бутилкарбоксамидо)-пиперазинил)-пентанамида
Номер патента: 635
Опубликовано: 29.12.1999
Авторы: Чанчози Стивен Дж., Херрнер Роберт С., Аскин Дэвид
Формула / Реферат
1. Способ восстановительного алкилирования для получения N-(2-(R)-гидрокси-1-(S)-инданил)-2(R)-фенилметил-4-(S)-гидрокси-5-(1-(4-(3-пиридилметил)-2(S)-N'-(трет.-бутилкарбоксамидо)-пиперазинил))-пентанамида структурной формулы
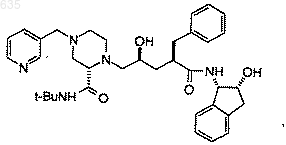
или его гидратов,
отличающийся тем, что осуществляют взаимодействие в течение, по крайней мере, 5 мин в подходящем растворителе одного эквивалента соединения структурной формулы
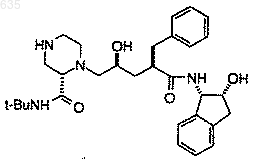
с избытком 3-пиридинкарбоксальдегида в присутствии избытка восстанавливающего агента, при температуре в интервале от около -78 до около 90шС.
2. Способ по п.1, отличающийся тем, что подходящий растворитель выбирают из сложного эфира, простого эфира, спирта, формамида, углеводорода и 1,2-дихлорэтана и любых смесей этих растворителей.
3. Способ по п.1, отличающийся тем, что походящий растворитель выбирают из сложного эфира и спирта или из них обоих.
4. Способ по п.1, отличающийся тем, что подходящий растворитель выбирают из изопропилацетата и этилацетата.
5. Способ по п.1, отличающийся тем, что восстанавливающий агент включает агент каталитического гидрирования.
6. Способ по п.1, отличающийся тем, что восстанавливающий агент выбран из группы, включающей NaBH4, NaCNBH3, NаВН(ОАс)3, Zn/HCl, Fe(CO)5/KOH-EtOH, муравьиную кислоту и селенофенол.
7. Способ по п.5, отличающийся тем, что восстанавливающий агент включает агент, выбранный из-NaCNBH3, NаВН(ОАс)3 и муравьиной кислоты.
8. Способ по п.6, отличающийся тем, что восстанавливающий агент включает агент, выбранный из NаВН(ОАс)3 и муравьиной кислоты.
9. Способ по п.1, отличающийся тем, что температурный интервал реакции поддерживают между около -40 и около 70шС.
10. Способ по п.8, отличающийся тем, что температурный интервал реакции поддерживают от около 20 до около 60шС.
11. Способ по п.1, отличающийся тем, что осуществляют взаимодействие, по крайней мере, в течение 5 мин в растворителе, выбранном из изопропилацетата и этилацетата, одного эквивалента соединения структурной формулы
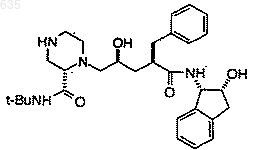
с одним- двумя эквивалентами 3-пиридинкарбоксальдегида, в присутствии восстанавливающего агента, выбранного из NaBH(OAc)3 и муравьиной кислоты, при температуре в интервале от около 20 до около 60шС с получением соединения J или его гидрата.
12. Способ по п.1, отличающийся тем, что смешивают в растворителе, выбранном из изопропилацетата и этилацетата, один эквивалент соединения структурной формулы
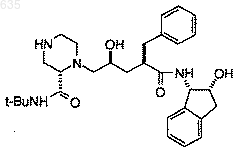
с одним-двумя эквивалентами 3-пиридинкарбоксальдегида; добавляют восстанавливающий агент, выбранный из NaBH(OAc)3 и муравьиной кислоты, и поддерживают в течение, по крайней мере, 5 мин полученную смесь при температуре в интервале от около 20 до около 60шС с получением соединения J или его гидрата.
Текст
1 Предпосылки изобретения Настоящая заявка относится к Merck 18996, U.S.S.N. 08/059038, подано 7 мая 1993 г. Настоящее изобретение относится к новому промежуточному соединению и к способу получения соединений, которые ингибируют протеазу, кодируемую вирусом иммунодефицита человека (HIV), и, в частности, к определенным олигопептидным аналогам, таким, как соединение J в приводимых далее примерах. Эти соединения представляют ценность с точки зрения предотвращения инфицирования HIV и лечения возникающего в результате синдрома приобретенного иммунодефицита (AIDS). Эти соединения пригодны также для ингибирования ренина и других протеаз. Описываемое здесь изобретение относится к конечной связеобразующей стадии J ингибитора HIV протеазы. В настоящем изобретении,предпоследнее промежуточное I превращают в J за счет введения 3-пиколильного фрагмента в форме 3-пиридинкарбоксальдегида 2 путем восстановительного алкилирования. Ретровирус, названный вирусом иммунодефицита человека (HIV), представляет собой этиологический агент комплексного заболевания, которое включает прогрессивное разрушение иммунной системы (синдром приобретенного иммунодефицита, (AIDS) и дегенерацию центральной и периферической нервных систем. Этот вирус был известен ранее как LAV, HTLVIII или ARV. Общей чертой репликации ретровирусов является интенсивная посттрансляционная обработка предшественников полипротеинов вирусно кодируемыми протеазами для создания зрелых вирусных протеинов,необходимых для сборки и функционирования вирусов. Ингибирование такой обработки предотвращает продуцирование нормальных инфекционных вирусов. Так например. Kohl, N.E.et al., Proc. Nat'l. Acad. Sci., 85, 4686 (1988) показали, что генетическая инактивация HIV кодируемых протеаз приводит к продуцированию незрелых неинфекционных вирусных частиц. Эти результаты показывают, что ингибированиеHIV протеаз представляет ценный метод лечения AIDS и предотвращения или лечения инфекций, вызванных HIV. В нуклеотидной последовательности HIV присутствует роl ген в одной открытой считы 000635 2 вающей рамке (Rather, L. et al., Nature, 313,277(1985. Гомологичность аминокислотных последовательностей предоставляет доказательство того, что роl последовательность кодирует обратную транскриптазу, эндонуклеазу и HIV протеазу (Toh, Н. et al., EMBO J., 4, 1267 (1985);Pearl, L.H. et al., Nature, 329, 351 (1987. Целевые соединения, включающие некоторые олигопептидные аналоги, которые можно получить из новых промежуточных соединений, и способы настоящего изобретения, представляют ингибиторы HIV протеаз, и они раскрыты в ЕРО 541 168, опубликованной 12 мая 1993 г. См.,например, там соединение J. Ранее синтез соединения J и родственных соединений осуществлялся способом в 12 стадий. Этот способ описан в ЕРО 541168. Последняя стадия в известных ранее способах включает непосредственное алкилирование предпоследнего промежуточного соединения I 3 пиколилхлоридом 3 до получения ингибитораHIV протеазы J. К недостаткам такого типа подхода относится классическая проблема избыточного алкилирования аминов алкилгалоидами с образованием солей четвертичного аммония. Избыточное алкилирование продукта J 3 пиколилхлоридом, бромидом или иодидом приводит к образованию соли 4. Происходит снижение выхода. Существуют также трудности в удалении соли 4, так как для полного удаления необходимы множественные водные промывки. Полное удаление соли 4 за счет промывок водой необходимо. Восстановительное алкилирование первичных и вторичных аминов карбонильными соединениями представляет классическую реакцию и подробно описано в литературе (March, J.Wiley and Sons, New York 1985 pp. 798-800). Восстановительное алкилирование вторичных аминов за счет использования NаСNВН 3 (Borch,R.F. et al., J. Am. Chem. Soc., 1971, 93, 28972904) и NаНВ(ОАс)3 (Abdel-Mdgid, A.F. et alTetrahedron Lett., 1990, 31, 5595-5598) описано недавно в литературе. Преимущество восстановительного алкилирования настоящего изобретения состоит в 3 том, что оно позволяет избежать образования побочных продуктов переалкилирования. Такой способ алкилирования упрощает способ выделения. Это позволяет также избежать снижения выхода. Исходный материал - 3-пиридинкарбоксальдегид 2 также является более желательным промежуточным соединением для крупномасштабного производства. Этот исходный материал имеет более низкий молекулярный вес, нежели 3-пиколилхлорид 3 (гидрохлорид), и как таковой, дешевле в расчете на кг веса. Это более стабильное и более технологичное промежуточное соединение, и оно не является канцерогенным или раздражающим, как 3, и с коммерческой точки зрения оно существенно дешевле,чем 3. Было неожиданно обнаружено, что предпоследнее промежуточное соединение I можно превратить в продукт J с высоким выходом и с высокой степенью чистоты за счет способа настоящего изобретения, не затрагивая остальных функциональностей исходного материала I и продукта J. Так например, в качестве побочной реакции не происходит конденсации с аминоинданольной концевой группой. Краткое описание изобретения В настоящем изобретении представлены новые способы синтеза соединений за счет восстановительного алкилирования. Целевое соединение пригодно в качестве ингибитора HIV протеазы, ренина и других протеаз. Подробное описание изобретения В настоящем изобретении предложены новые способы получения соединения J структурной формулы:(а) осуществления взаимодействия в течение, по крайней мере, 5 мин в подходящем растворителе одного эквивалента соединения структурной формулы с избытком 3-пиридинкарбоксальдегида в присутствии избытка восстанавливающего агента при температуре в интервале от около -78 С до около 90 С;(b) до получения соединения J или его гидрата. В другом варианте, в настоящем изобретении предложен способ получения соединения J структурной формулы(а) смешивания в подходящем растворителе одного эквивалента соединения структурной формулы(b) добавление избытка восстанавливающего агента, и поддержание температуры полученной смеси в течение, по крайней мере, 5 мин в интервале от около -78 С до около 90 С;(c) до получения соединения J или его гидрата. В предпочтительном варианте настоящее изобретение включает способ получения соединения J структурной формулы(а) осуществления взаимодействия в течение, по крайней мере, 5 мин в растворителе,выбранном из изопропилацетата и этилацетата,одного эквивалента соединения структурной формулы с от около одного эквивалента до около двух эквивалентов 3-пиридинкарбоксальдегида в присутствии восстанавливающего агента, выбранного из NаВН(ОАс)3 и муравьиной кислоты, при температуре в интервале от около 20 С до около 60 С;(b) до получения соединения J или его гидрата. В другом варианте настоящее изобретение включает способ получения соединения J структурной формулы:(а) смешивания в растворителе, выбранном из изопропилацетата и этилацетата, одного эквивалента соединения структурной формулы: с от около одного эквивалента до двух эквивалентов 3-пиридинкарбоксальдегида;(b) добавление восстанавливающего агента, выбранного из NаВН(ОАс)3 и муравьиной кислоты, и поддержание температуры полученной смеси в течение, по крайней мере, 5 мин в интервале от около 20 С до около 60 С;(с) до получения соединения J или его гидрата. В этом способе можно использовать различные растворители: такие сложные эфиры,как этилацетат, изопропилацетат; такие простые эфиры, как диэтиловый эфир, ТГФ, ДМЕ; такие спирты, как метанол, этанол, изопропанол и водные спиртовые системы; такие формамиды,как ДМФ; такие углеводородные растворители,как циклогексан и толуол; 1,2-дихлорэтан. Предпочтительные растворители включают сложноэфирные и спиртовые растворители и 1,2-дихлорэтан. Наиболее предпочтительными растворителями являются такие сложные эфиры, как изопропилацетат и этилацетат. В способе можно использовать различные восстанавливающие реагенты, такие как агенты гетерогенного каталитического гидрирования, или такие восстанавливающие агенты,какNaBH4,NaCNBH3, NаВН(ОАс)3, Zn/HCl, Fe(CO)5/KOHEtOH, муравьиная кислота и селенофенол. Предпочтительные восстанавливающие агенты включают NаСNВН 3, NаВН(ОАс)3 и муравьиную кислоту. Наиболее предпочтительные восстанавливающие агенты включаютNаВН(ОАс)3 и муравьиную кислоту. Восстановительное алкилирование ведут при температуре от -78 С до 90 С, в интервале от -40 С до 70 С - более предпочтительно, и наиболее предпочтительно -от 20 С до 60 С. Инкубационный промежуток времени должен составить, по крайней мере, 5 мин. Практически полностью реакция завершается обычно за 1-2 ч, и за ее окончанием легко следить с помощью обычных методов. 6 Способ и промежуточные соединения настоящего изобретения пригоны для получения в качестве конечного продукта соединений, которые могут ингибировать HIV протеазу, предотвращать или лечить инфекции, вызываемые вирусом иммунодефицита человека (HIV), и лечить такие последующие состояния, как AIDS. Лечение AIDS или предотвращение или лечение инфекций, вызываемых HIV, включает (но этим не ограничивается) лечение широкого круга состояний HIV инфекции; AIDS, ARC) комплекс, связанный с AIDS), как симтоматические,так и асимптотические, или реальную или потенциальную опасности экспонирования HIV. Так, например, конечный продукт соединений,полученных с помощью способа настоящего изобретения и промежуточные соединения настоящего изобретения являются полезными при лечении инфекций, вызываемых HIV после предполагаемого экспонирования HIV, вызванной, например, переливанием крови, трансплантацией органов, обменом жидкостей организма,укусом насекомых, случайным уколом иглой или попаданием крови пациента во время хирургической операции. Конечные продукты - ингибиторы HIV протеаз пригодны также для подготовки и проведения анализов скрининга для противовирусных соединений. Так, например, конечные продукты можно использовать для выделения энзимных мутантов, которые являются прекрасным скринирующим инструментом для более эффективных противовирусных соединений. Более того, такие соединения полезны для установления или определения связывающего сайта других противовирусных в отношении HIV протеаз, например, за счет конкурирующего ингибирования. Таким образом, соединенияконечные продукты и промежуточные продукты, полученные по способу настоящего изобретения, представляют собой коммерческие продукты, которые можно продавать для этих целей. Конечный продукт, соединение J - ингибитор HIV протеазы имеет структурную формулу или его фармацевтически приемлемые соли или их гидраты. Название соединения J: N-(2(R) -гидрокси 1(S)-инданил)-(2(R)-фенилметил-4(S)-гидрокси 5-(1-(4-(3-пиридилметил)-2(S)-N'-(трет.-бутилкарбоксамидо)-пиперазинил-пентанамид;N-(1(S)-2,3-дигидро-(2R)-гидрокси-1 Нинденил)-4(S)-гидрокси-2(R)-фенилметил-5-[4(3-пиридилментил)-2(S)-(трет.бутилкарбамоил)пиперазинил]пентанамид. Соединения - ингибиторы HIV протеазы,которые можно получить из промежуточных соединений и по способу настоящего изобретения, раскрыты в ЕРО 541164. Соединенияингибиторы HIV протеазы можно вводить нуждающемуся в таком лечении пациенту в виде фармацевтических композиций, включающих фармацевтический носитель и терапевтически эффективное количество соединения или его фармацевтически приемлемой соли. ЕРО 541164 раскрывает подходящие фармацевтические композиции, способы ведения, солевые формы и дозировки для этих соединений. Соединения настоящего изобретения могут иметь асимметрические центры и существовать как рацематы, рацемические смеси и индивидуальные диастереоизомеры или энантиомеры,причем все эти изомерные формы включены в объем настоящего изобретения. Кроме того,комбинации растворителей, заместителей и/или других переменных допустимы лишь в том случае, если такие комбинации приводят к получению стабильных соединений. Представительные экспериментальные процедуры, в которых использован новый способ, подробно изложены далее. Эти процедуры приведены лишь в качестве примеров и никоим образом не ограничивают нового способа настоящего изобретения. Пример 1. Способ восстановительного алкилирования с использованием NaBH(OAc)3 Предпоследнее промежуточное соединение 1 (1,00 г, 1,91 ммоля) растворяют в 20 мл сухого 1,2-дихлорэтана и добавляют альдегид 2(310 мг, 2,89 ммоля) и триацетоксиборгидрид натрия (500 мг, 2,83 ммоля). Полученную смесь перемешивают при 21 С. Спустя 1,25 ч реакция завершается более чем на 99%. Реакцию гасят,добавляя 10 мл насыщенного бикарбоната натрия, и слои разделяют. Органический слой 8 концентрируют и растворитель меняют на изопропилацетат. Сырую смесь в 12 мл изопропилацетата нагревают до 85 С и добавляют 300 мл воды для получения гомогенного раствора с некоторым количеством второй, водной фазы. Полученный раствор медленно охлаждают до 5 С, фильтруют и полученные кристаллы промывают (2 х 2 мл) изопропилацетатом. Получают 1,06 г соединения J в виде моногидрата(88%), твердого кристаллического вещества белого цвета, степень чистоты которого по данным ВЭЖХ составляет более 99,3%. Пример 2. Способ восстановительного алкилирования с использованием муравьиной кислоты Последнее соединение 1L (2,5 г, 4,78 ммоля) суспендируют в 10 мл изопропилацетата при 20 С, и альдегид 2 (450 мкл 4,78 ммоля) добавляют, затем суспензию нагревают до 45-50 С для растворения всей твердой части. Загружают муравьиную кислоту (200 мкл, 5,3 ммоля) и полученную смесь выдерживают при 50 С в течение 2 ч, причем к этому времени по данным ВЭЖХ оказывается, что исходный материал 1 полностью израсходован. Добавляют водныйNaOH (275 мкл) для доведения рН до 7,0. Полученную смесь нагревают до 60-65 С и выдерживают в течение 16 ч, разбавляют 25 мл изопропилацетата, промывают при 65 С, охлаждают до 25 С и фильтруют. Получают 1,30 г (43%) соединения J в виде твердого вещества белого цвета. Пример 3. Превращение инденоксида в цис-1-амино-2-инданол. Материалы Инденоксид Ацетонитрил Вода Конц. Н 2SO4 5 н. КОН К одному мл инденоксида (8,33 ммоля),растворенному в 10 мл ацетонитрила, добавляют 0,15 мл воды (8,33 ммоля). Полученную смесь охлаждают до 0-5 С в ледяной бане. 9 Прикапывают концентрированную серную кислоту, поддерживая при этом температуру бани ниже 10 С. После того, как добавлена вся кислота, температуре дают повыситься до 2025 С. Прозрачный раствор оставляют на 30 мин. К этой смеси добавляют 2 мл воды и полученный раствор нагревают в течение 30 мин. Когда метилоксазолин полностью превращается в цис-аминоинданол, реакционную смесь охлаждают до комнатной температуры. Добавляют раствор 5 н. КОН (3 мл, 15 ммолей). Это составляет 90% от теоретического расчета для серной кислоты. Раствор остается кислым (определено по лакмусу). Если рН возрастает выше этого значения, происходит 2 реацилирование и выход аминоинданола снижается. Отфильтровывают белый твердый продукт(К 2SO4). При перемешивании добавляют смолуDowex 15 мл (влажная за счет ацетонитрила). Перемешиваемую смолу выдерживают в течение 15 мин и отбирают образец для жидкостной хроматографии (dilx 50). Когда на жидкостной хроматограмме исчезает пик аминоинданола,смолу отфильтровывают, промывают ацетонитрилом, а затем метанолом. Влажную смолу обрабатывают раствором 50 мл 1 н. NН 3 в метаноле и полученную суспензию перемешивают при комнатной температуре в течение 30 мин. Смолу снова собирают с помощью фильтрации и сохраняют смесь метанол/NН 3. Добавляют следующую порцию 1 н.(20 мл) и смолу снова суспендируют. После удаления смолы растворы аминоинданола в смеси метанол/NН 3 объединяют и концентрируют до удаления NН 3. Анализ конечного раствора МеОН демонстрирует 1,0 г (выход 81%) цис-1-амино-2-инданола, готового для расщепления винной кислотой. Пример 4. Получение рацемического инденоксида. Инден (95%, 122 мл) растворяют в 812 мл метанола и 348 мл ацетонитрила, а затем фильтруют. Полученный фильтрат разбавляют 0,05 М раствором вторичного кислого фосфата (116 мл), затем рН доводят до 10,5 за счет 1 М водного гидроксида натрия. Водную перекись водорода (35%, 105 мл) разбавляют 53 мл воды и добавляют за 3 ч, поддерживая при этом температуру 25 С и рН при 10,5 за счет 1 М водного гидроксида натрия (120 мл всего). Через 6 ч добавляют 1 М водный метабисульфит натрия (26 мл), поддерживая рН выше 8,3 за счет добавления 1 М водного NaOH (39 мл). Добавляют 700 мл воды и полученную смесь экстрагируют метиленхлоридом (580 мл и 300 мл). Объединенные органические экстракты, содержащие инденоксид 117 г, концентрируют до объема 600 мл. Пример 5. Получение 10 Субстрат, (IS, 2R)-инденоксид, получают по способу D. J. O'Donnell et al., J. OrganicChemistry, 43, 4540 (1978) (включено сюда по ссылке). Пример 6. Получение цис-1-амино-2 инданола. Инденоксид (117 г), разбавленный до полного объема 600 мл метиленхлоридом, разбавляют ацетонитрилом (600 мл) и охлаждают до 20 С. Затем добавляют метансульфоновую кислоту (114 мл). Полученную смесь нагревают до 25 С и выдерживают 2 ч. Добавляют 600 мл воды и полученную смесь нагревают при 45 С в течение 5 ч. Выделяют органическую фазу и водную фазу нагревают при кипении с обратным холодильником в течение 4 ч, концентрируя до примерно 200 г/л. рН раствора доводят до 12,5 за счет 50% водного гидроксида натрия, а затем охлаждают до 5 С и фильтруют, сушат в вакууме до получения цис-1-амино-2-инданола. Пример 7. Получение IS-амино-2R-инданола.(IS, 2R)-инденоксид (85% ее) (250 г, 0,185 моля) растворяют в 300 мл хлорбензола и медленно добавляют к раствору метансульфоновой кислоты (250 мл, 0,375 моля) в 1250 мл ацетонитрила при температуре менее, чем около-10 С. Реакционную смесь нагревают до 22 С и выдерживают в течение 1,0 ч. К смеси добавляют воду и концентрируют за счет перегонки до тех пор, пока внутренняя температура не достигает 100 С. Реакционную смесь нагревают при 100 С в течение 2-3 ч, затем охлаждают до комнатной температуры. Добавляют 1000 мл хлорбензола, полученную смесь перемешивают, органическую фазу выделяют. рН оставшейся водной фазы, содержащей IS-амино, 2Rинданол (85% ее, 165 г, 60%) доводят до 12 за счет 50% водного гидроксида натрия, продукт отфильтровывают и сушат в вакууме при 40 С до получения IS-амино, 2R-инданола (85% ее,100 г). Пример 8. Получение IS-амино-2R инданола.(IS, 2R)-инденоксид (85% ее, 250 г, 0,185 моля) растворяют в 300 мл хлорбензола и 1200 мл гептанов и медленно добавляют раствор дымящейся серной кислоты (21% SO3; 184 мл) в 1250 мл ацетонитрила при температуре ниже,чем около -10 С. Реакционную смесь нагревают до 22 С и выдерживают в течение 1,0 ч. К смеси добавляют воду и все концентрируют за счет перегонки до тех пор, пока внутренняя температура не достигает 100 С. Реакционную смесь нагревают при 100 С в течение 2-3 ч, затем охлаждают до комнатной температуры. Добавляют 100 мл хлорбензола, полученную смесь перемешивают, органическую фазу выделяют. Оставшуюся водную фазу, содержащую ISамино,2R-инданол (85% ее, 205 г, 74%) разбавляют равным объемом ацетонитрила, рН дово 11 дят до 12,5 за счет 50% гидроксида натрия, и выделяют органическую фазу. Оставшуюся водную фазу экстрагируют дополнительным количеством ацетонитрила. Объединенные ацетонитрильные экстракты концентрируют в вакууме до получения IS-амино, 2R-инданола(85% ее, 205 г). В другом варианте оставшуюся водную фазу, содержащую IS-амино-2R-инданол (85% ее, 205 г 74%) разбавляют равным объемом бутанола и рН доводят до 12,5 за счет 50% водного гидроксида натрия, и выделяют органическую фазу. Органическую фазу промывают хлорбензолом. Добавляют L-винную кислоту,воду удаляют за счет перегонки, происходит кристаллизация соли винной кислоты аминоинданола. Пример 9. Применение бензонитрила. Инденоксид (5 г) растворяют в 50 мл бензонитрила при 25 С и добавляют серную кислоту (98%, 2,25 мл). Полученную смесь разбавляют 5 М водным раствором гидроксида натрия(50 мл) и экстрагируют метиленхлоридом. Органические экстракты концентрируют в вакууме до получения 5,03 г оксазолина. Пример 10. Выделение цис-1-амино-2 инданола. Цис-1-амино-2-инданол (100 г) растворяют в 1500 мл метанола и добавляют раствор Lвинной кислоты (110 г) в 1500 мл метанола. Полученную смесь нагревают до 60 С, а затем охлаждают до 20 С, фильтруют и сушат в вакууме до получения IS-амино,2R-инданольной соли Lвинной кислоты в виде метанольного сольвата(88 г). Пример 11. Получение IS-амино-2Rинданола. Метанольный сольват соли L-винной кислоты IS-амино,2R-инданола (88 г) растворяют в 180 мл воды и нагревают до 55-60 С. Полученный раствор осветляют за счет фильтрования, рН доводят до 12,5 50% водным гидроксидом натрия. Полученную смесь охлаждают до 05 С за 2 ч, затем выдерживают при этой температуре в течение 1 ч, промывают холодной водой и сушат в вакууме при 40 С до получения Материалы 1,2-Индандиол Ацетонитрил Вода Серная кислота 5 н. КОН 12 К 300 мг индандиола, растворенного в 3 мл ацетонитрила, содержащего 0,04 мл воды, добавляют по каплям при температуре 0-10 С объем 0,22 мл концентрированной серной кислоты. После завершения добавления ледяную баню удаляют и реакционную смесь нагревают до комнатной температуры. После 30 минутного выстаивания отбирают образец прозрачного раствора для Iс анализа (dilx 500). После того, как израсходован весь гликоль, раствор обрабатывают далее водой и нагревают до кипения с обратным холодильником на паровой бане, чтобы гидролизовать оксазолин. Когда по данным I с анализа гидролиз завершается, для нейтрализации серной кислоты добавляют 1,6 мл 5 н. КОН. Из раствора отфильтровывают сульфат калия. Определяют содержание цисаминоинданола в фильтрате, которое составляет 196 мг (66% от теоретического, с поправкой на непрореагировавший исходный материал 75%). Полученный раствор пропускают над 10 мл Dowex" 50 х 4 (Н+). Отработанное содержимое колонки проверяют на содержание продукта. Оказывается, что адсорбирован весь аминоинданол. После промывки смолы метанолом,продукт элюируют раствором 1 М в NН 3(сухом). Аммонийный метанол концентрируют для удаления NН 3 и полученный конечный раствор аминоинданола, готовый для разделения,анализируют (175 мг или % 59 от теоретического значения без поправки на непрореагировавший гликоль). Пример 13. Получение инданольных реагентов. Соединения-транс-2-бром-1-инданол получают по способу S. M. Sutter et. al., J Am.-транс-2-бром-1-инданол и цис- и транс-1,2 инданолы получают по способу M. Imuta et.al.,J. Org. Chem., 43, 4540(1978). Пример 14. Получение цис-1-амино-2 инданола из транс-2-бром-1-инданола. Транс-2-бром-инданол (10 г, 46,9 ммоля,разбавленный 100 мл ацетонитрила, содержащего 0,8 мл воды) охлаждают до -5 С, и добавляют концентрированную серную кислоту (5,2 мл). Полученную смесь выдерживают в течение 1 ч,затем добавляют 5 М водный гидроксид калия для доведения рН до 11. Реакционную смесь фильтруют, удаляя соли сульфата калия. РН водного ацетонитрильного фильтрата доводят до менее 2 с помощью серной кислоты и нагревают до 80-100 С, удаляя ацетонитрил за счет перегонки до получения водного раствора цис 1-аминоинданола. Полученный раствор концентрируют до объема 20 мл, затем рН доводят до 12,5 гидроксидом калия. Продукт кристаллизуется, его отфильтровывают и сушат в вакууме до получения цис-1 амино-2-инданола (4,25 г). Пример 15. Получение цис-IS-амино-2Rинданола из цис-(IS,2R)-инданола. Цис-(IS,2R)-инданол (1 г) растворяют в 10 л ацетонитрила, охлаждают до 0 С и добавляют концентрированную серную кислоту (1,0 мл). Полученную смесь выдерживают в течение 40 мин, нагревая до 20 С. Добавляют 0,8 мл воды,и полученную смесь нагревают до кипения с обратным холодильником. Добавляют водный 5 М гидроксид калия (1,6 мл) для доведения рН до более 11 и полученную твердую часть (сульфат калия) удаляют фильтрованием до получения водного раствора цис-IS-амино-2Rинданола (0,79 г, выход 66%). Пример 16. Получение цис-1-амино-2 инданoла из транс-1,2-индандиола. Транс-1,2-индандиол (1,5 г) растворяют в ацетонитриле (25 мл), охлажденном до 0 С, и добавляют концентрированную серную кислоту(1,1 мл). Полученную смесь постепенно нагревают до 20 С и выдерживают в течение 3 ч. Добавляют 2 мл воды и смесь нагревают до кипения с обратным холодильником. Добавляют концентрированный водный гидроксид натрия для доведения рН до 12. Полученную твердую часть отфильтровывают до получения водного ацетонитрильного раствора цис-1-амино-2 инданола (1,02 г, выход 63%). Пример 17. Получение цис-1-амино-2 инданола из цис-1,2-индандиола. Цис-1,2-индандиол (1,0 г) растворяют в ацетонитриле (20 мл), охлажденном до -40 С, и добавляют дымящуюся серную кислоту (21%SO3, 0,8 мл). Полученную смесь выдерживают в течение 1 ч, постепенно нагревая до 0 С. Добавляют воду и полученную смесь нагревают до 80 С в течение одного часа до получения водного раствора цис-1-амино-2-инданола. Пример 18. Получение амида 3.(99,7 вес.%, 99,9 пл.%, более 99,5% ее) Моногидрат карбоната натрия Диэтоксиметан (ДЕМ) 3-Фенилпропионилхлорид(8) Метансульфоновая кислота (МСК) 2-Метоксипропен (95% по данным ГХ) 5% Водный NаНСО 3 ВодаDEM и водного раствора карбоната натрия (760 г, 6,13 моля, Na2 СО 3 Н 3O в 6,4 л воды) в столитровом реакторе с четырьмя входными отверстиями, снабженном термопарным зондом, механической мешалкой и адаптером для впуска азота, и барботером, нагревают до 46-47 С и выдерживают в течение 15 мин. Реакционную смесь нагревают до 46-47 С и выдерживают в течение 15 мин для обеспечения растворения твердой части. РН водной фазы 11,5. В течение 2 ч добавляют чистый 3-фенилпропионилхлорид 8 (1,05 кг, 6,23 моля) при температуре от 47 до 59 С. Температура внутри реактора повышается с 47 до 59 С за время добавления 8; гидроксиамид 6 кристаллизуется из раствора во время добавления хлорангидрида. После завершения добавления реакционную смесь выдерживают при 59 С в течение 0,5 ч, а затем нагревают до 72 С для обеспечения растворения твердой части. Температуру повышают до 72 С для того, чтобы растворился гидроксиамид, так что по данным ВЭЖХ получают гомогенный образец, и упрощается разделение фаз. За ходом реакции следят по данным ВЭЖХ: 60:40 ацетонитрил/5,0 мМ каждого из КН 2 РО 4 и К 2 НРO4. Примерное время удерживания (мин) 4,1 6,3 12,5 Идентичность Гидроксиамид 6 Цис-аминоинданол 5 Побочный продукт амидный эфир После завершения добавления хлорангидрида и получасового выстаивания при 72 С по данным ВЭЖХ реакционная смесь демонстрирует: примерно 0,6% площади 5, примерно 0,2% площади побочного продукта - амидного эфира и 98% пощади гидроксиамида. Гидроксиамид 6 вовсе не так легко отделить при выделении ацетонитрила 7. Водную фазу выделяют и органическую фазу дважды промывают 4,5 л воды. Промытую органическую фазу концентрируют и сушат за счет азеотропной перегонки при атмосферном давлении. Начальный объем около 40 л концентрируют до 27 л. Добавляют 16 л свежего ДЕМ и все концентрируют при 88-89 С до 40 л. Суспензию гидроксамида 6 в сухом ДЕМ обрабатывают 1,28 л 2-метоксипропена, а затем 18,6 г МСК при 30 С. Добавление МСК в отсутствии 2-метоксипропена приводит к образованию аминоэфира. Эту примесь снова превращают в гидроксиамид 6 за счет щелочной обработки в конце образования ацетонида. РН образца объемом 1,0 мл, разбавленного 1,0 мл воды, составляет 2,8-3,0. Полученную смесь выдерживают при температуре 39-40 С в течение 3 ч. За образованием ацетонида следят с помощью ВЭЖХ, используя те же условия, что были указаны ранее в этом примере. Идентичность Гидроксиамид 6 Примесь метилен-кеталя Ацетонид 7 Побочный продукт амидный эфир Полученную смесь выдерживают при 3840 С до тех пор, пока 6 не составляет величину,равную или менее 0,4 процента. Типичный профиль % площади ВЭЖХ следующий: 0,4% площади гидроксиамид 6, 96,9% площади ацетонид 7, 0,2% -побочный продукт - эстерамид, 1,1% площади примесь метиленкеталя. Реакционную смесь охлаждают до 24 С и гасят 10,8 л 5% водного раствора бикарбоната натрия. Водную фазу выделяют и органическую фазу дважды промывают 10,8 л воды. РН водных промывок составляет 7,6. Если рН слишком низок, ацетонидная группа может претерпеть обратный гидролиз, и в результате получают гидроксиамид 6. Промытую органическую фазу (34,2 л) концентрируют за счет перегонки при атмосферном давлении при 78 С-80 С до конечного объема 3,5 л. Концентрацию ацетонида доводят до 525 г/л для сведения к минимуму потерь. Горячий раствор ДЕМ соединения 7 оставляют охлаждаться до 57 С, вводят затравку, состоящую из 0,5 г 7,охлаждают далее до 0 С, и выдерживают в течение получаса. Кристаллизация из раствора начинается при температуре от 53 до 55 С. Продукт выделяют фильтрованием, а влажную фильтровальную лепешку промывают холодным (0 С ДЕМ (300 мл). Промытую лепешку сушат в вакууме(880,4 миллибар, 26 Нg=66,04 см рт. ст.) при 30 С до получения 1,74 кг ацетонитрила 7 (90%,более 99,5% площади по данным ВЭЖХ). Ппример 19. Получение ацетонида 7 из соли (5 винная кислота).(-)-цис-1-Аминоиндан-2-ола тартрат метанольный сольват (44,3 вес.% свободного основания 5) Моногидрат карбоната натрия Диэтоксиметан (ДЕМ) 3-Фенилпропионилхлорид (8) Метансульфоновая кислота (МСК) 2-Метоксипропен (95% по данным ГХ) 5% Водный NаНСО 3 Вода Суспензию смеси, состоящей из (-) 5 тартратной соли метанольного сольвата (100 г, 44,3 г свободного основания, 297 ммоля) в 2,0 л(ДМЕ) и водного раствора карбоната натрия (63 г, 514 ммоля Nа 3 СО 3H2 О в 316 мл воды) в пятилитровом реакторе с четырьмя входными отверстиями, снабженном термопарным датчиком,механической мешалкой и адаптером ввода азота и барботером, нагревают до 50 С. В результате нагревания реакционной смеси до 60 С все 16 твердое вещество не растворяется. За 30 мин при 50 С добавляют чистый 3 фенилпропионилхлорид 8 (52 г, 312 ммолей), и полученную смесь оставляют выстаиваться при 50 С в течение 15 мин. За ходом реакции следят с помощью ВЭЖХ: 60:40 ацетонитрил/5,0 мМ каждого из КН 2 РO4 и К 2 НРO4, 1,0 мл/мин. Примерное время удерживания: Время удерживания 4,1 6,3 12,5 Идентичность Гидроксиамид 6 Цис-аминоинданол 5 Побочный продукт амидный эфир После завершения добавления хлорангидрида и 15-минутного выдерживания при 50 С анализ ВЭЖХ суспензионной смеси дает примерно 0,1% площади 5. Начиная с этого момента реакционную смесь нагревают до 75C. Температуру повышают до 75 С для растворения гидроксиамида 6 в ДЕМ и упрощения фазового разделения. Водную фазу выделяют, а органическую фазу дважды промывают водой (250 мл). Тартрат натрия удаляется в водную фазу,рН первой водной промывки составляет 8,98. РН двух водных промывок составляет 9,1 и 8,1,соответственно. Промытую органическую фазу концентрируют и сушат за счет перегонки при атмосферном давлении. Собирают примерно 1,0 л дистиллята и 750 мл свежего ДЕМ загружают в дистилляционную колбу. Дистилляцию при атмосферном давлении продолжают до тех пор,пока собирают другую порцию дистиллята 350 мл. KF раствора составляет 93 мг/л. Сухой раствор ДЕМ охлаждают до 30 С и обрабатывают 63 мл 2-метоксипропена, а затем 0,95 г МСК. рН 1,0 мл образца, разбавленного 1,0 мл воды, составляет 3,2. Реакционную смесь выдерживают при 35-42 С в течение 2 ч. Образование ацетонида контролируют с помощью ВЭЖХ, используя те же условия, что указаны ранее в этом примере. Примерные времена удерживания: см. ранее. Смесь выдерживают при 38-40 С до тех пор, пока соединение 6 не составляет величину,равную или менее 0,7 % площади. Типичный профиль % площадей по данным ВЭЖХ следующий: 0,4% площади гидроксиамид, 96,9% площади ацетонид 7, 0,2% площади побочный продукт - эстерамид, 1,1% площади - примесь метиленкеталя. Реакционную смесь охлаждают до 20 С, фильтруют для удаления видимой мути и гасят 520 мл 5% раствора бикарбоната натрия. Выделяют водную фазу, а органическую фазу промывают 500 мл воды, рН водной промывки составляет 7,4. Промытую органическую фазу(примерно 2,0 л) концентрируют за счет перегонки при атмосферном давлении при температуре 78-80 С до конечного объема 1,0 л. Концентрацию ацетонида в выделенной части поддерживают примерно 525 г/л для сведения к минимуму потерь при выделении. Горячий раствор 7 в ДЕМ оставляют охлаждаться до 50 17 52 С, вводят затравку 100 мг продукта и далее охлаждают до 5 С и выдерживают в течение 20 мин. Продукт начинает кристаллизоваться из раствора при 50 С. Его выделяют за счет фильтрования, и влажную лепешку промывают холодным (0 С) ДЕМ (2 х 40 мл). Промытую лепешку сушат в вакууме (880,4 миллибар, 26" Нg=66 0,4 мм рт. ст.) при 30 С до получения 83,8 г ацетонида 7 (87,9%, более 99,5% площади по данным ВЭЖХ). Пример 20. Получение ацетонида 7 (растворитель изопропилацетат). 18 охлаждают до -0-5 С. рН водной фазы и водных промывок составляет 7,5 и 7,9, соответственно. Перегонку при атмосферном давлении ведут до тех пор, пока растворитель с ИПАЦ не меняется на метилциклогексан. Начальный объем перед концентрированием составляет 1,65 л. Добавляют 1,5 л метилциклогексана для завершения замены растворителя с ИПАЦ на метилциклогексан. Температура реакционной смеси к концу замены растворителя составляет 101C, а конечный объем - примерно 900 мл. Реакционную смесь нагревают до 65-70 С для обеспечения растворения твердой части, затем охлаждают до 55 С, вводят затравку продукта и охлаждают до 0 С. Полученную смесь выдерживают при 0 С в течение 15 мин и продукт отфильтровывают и промывают холодным метилциклогексаном (200 мл). Промытую лепешку сушат в вакууме (880,4 миллибар, 26" Нg=660,4 мм рт. ст. (при 30 С до получения 151 г ацетонида 7 (87,5% площади более 99,5 по данным ВЭЖХ). Пример 21. Смесь (-)-цис-1-аминоиндан-2-ола 5 (80 г,535 ммолей) в 1,2 л ИПАЦ и 560 мл воды обрабатывают соединение 8 (90,8 г, 539 ммоля),поддерживая при этом рН между 8,0 и 10,5 при температуре 70-72 С за счет 5 н. гидроксида натрия (116 г, 580 ммолей). Ход реакции контролируют с помощью ВЭЖХ: 60:40 ацетонитрил/5,0 мМ каждого В конце реакции водную фазу выделяют, а органическую фазу промывают водой (400 мл) при температуре 72-73 С. РН водной фазы и водных промывок составляет 8,1 и 7,9, соответственно. Влажную ИПАЦ фазу сушат за счет перегонки при атмосферном давлении. Удаляют 3,0 л ПАЦ для снижения KF реакционной смеси до менее 100 мг/л. Конечный объем составляет примерно 1,60 л. Полученную суспензию в ИПАЦ гидроксиамида 6 обрабатывают 2-метоксипропеном (119 мл, 1,24 моля), а затем МСК (1,1 мл, 3,2 мольных %) при 35-38 С в течение 4,5 ч. За образованием ацетонида следят по данным ВЭЖХ,используя описанные ранее условия. Полученную смесь выдерживают при температуре 3840 С до тех пор, пока соединение 6 не составляет 0,4% площади или менее. Реакционную смесь фильтруют для удаления мутного осадка, и полученный фильтрат гасят холодным раствором бикарбоната натрия (950 мл) за 15 мин. Водную фазу выделяют, а органическую фазу промывают водой (400 мл). Раствор бикарбоната натрия[192,1] ТГФ, высушенный на ситах Вода 0,3 М H2SO4 6% NаНСО 3 ИПАЦ Кристаллический ацетонид 7 (200 г, 0,622 моля, 99,1 вес.%) растворяют в 1,25 л высушенного на ситах ТГФ (KF =11 мг/л) в атмосфере азота при 25 С с помощью механической мешалки. В итоге получают KF раствора 40 мг/л. Полученный раствор подвергают трем альтернативным циклам вакуум/продувка азотом для тщательного удаления из раствора растворенного в нем кислорода. К раствору в ТГФ добавляют аллилбромид. В результате получают KF 75 мг/л. Обычно полное превращение (более 99,5%) получают для KF-уровней пре-ЛДС раствора 200 мг/л с 10% избытком основания в этой процедуре. Затем раствор охлаждают до-20 С. Добавляют ТГФ раствор литийгексаметилдисилазида (ЛДС, 1,32 М) к раствору аллилбромид/ 7, с такой скоростью, чтобы температуру реакции поддерживать при -20 С. Добавление ЛДС занимает 30 мин. Полученную смесь выдерживают при -15 до -20 С, и когда конверсия достигает величины более 90%, гасят. За ходом реакции следят с помощью ВЭЖХ. Приблизительное время удерживания: побочный продукт гидроксиацетонид =5,3 мин, этилбензол=5,6 мин, ацетонид 7 = 6,6 мин; аллилацетонид 8 = 11,8 мин; эпи-8=13,3 мин. Спустя 1 ч реакция доходит до конверсии более 99,5%. Реакцию гасят, добавляя раствор лимонной кислоты(35,7 г, 0,186 моля) в 186 мл ТГФ. Полученную смесь выдерживают при 15 С в течение 30 мин после добавления лимонной кислоты. Полученную смесь концентрируют при пониженном давлении (около 948,2 миллибар, 28" Нg=711 мм рт. ст.) до около 30% начального объема, поддерживая температуру в реакторе 11-15 С, и собирая 900 мл дистиллята в охлаждаемой сухим льдом ловушке. Затем заменяют растворитель, используя всего 2,7 л изопропилацетата(ТПАЦ), продолжая перегонку при пониженном давлении. Замену растворителя прекращают,когда остается менее 1 мольного % ТГФ (по данным ЯМР, см. аналитический обзор ГХ метода). Максимальная температура в процессе перегонки не должна превышать 35 С. Неочищенную смесь ИПАЦ промывают 1,05 л дистиллированной воды, 1,18 л 0,3 М серной кислоты и 1,18 л 6% водного бикарбоната натрия. Объем органической фазы после промывки составляет 1,86 л. РН смеси трех водных промывок составляет 6,5, 1,3 и 8,5 соответственно. По данным ВЭЖХ, смесь в этот момент содержит 93-94% соединения 8, отношение целевого 8 к эпи-8 по данным ВЭЖХ составляет 96:4 (условия см. ранее). По данным ГХ в этот момент побочный продукт гексаметилдисилазан полностью удален при обработке. Пример 22. К раствору аллиламида 8 в ИПАЦ с предыдущей стадии при 25 С добавляют раствор 36,6 г бикарбоната натрия в 1,03 л дистиллированной воды и двухфазную смесь охлаждают до 5 С. Добавляют твердый N-хлорсукцинимид(141,2 г, 1,06 моля). После добавления НХС реакция не становится экзотермической. К этой смеси добавляют водный раствор иодида натрия(158,6 г, 1,06 моля), поддерживая температуру реакции при 6-11 С. Такое добавление занимает 30 мин, и полученная смесь становится темной. Смесь нагревают до 25 С и выдерживают при интенсивном перемешивании. За ходом реакции следят с помощью ВЭЖХ: система та же, что и раньше, примерные времена удерживания: иодогидрины 9, эпи-9, бис-эпи-9 = 8,1 мин; аллиламид 8 = 11,8 мин. Анализ смеси по данным ВЭЖХ после 2,25 ч дает более 99,5% превращения. Примерное соотношение диастереоизомеров 9:эпи-9:бис-эпи-9 в неочищенной смеси составляет примерно 94:2:4 к этому моменту времени, когда на этой системе можно достичь разделения компонент. Перемешивание прекращают и слои разделяют. К органической фазе добавляют водный сульфит натрия (80 г, 0,635 моля в 400 мл) за 10-15 мин. Температура смеси повышается с 26-29 С после добавления сульфита натрия. Полученную смесь перемешивают в течение 40 мин при 25 С. После добавления сульфита раствор практически обесцвечивается. Слои разделяют; KF органической фазы к этому моменту составляет 25 г/л. Объем органической фазы составляет 1,97 л. Количественный анализ смеси по данным ВЭЖХ (система та же, что и ранее) дает к этому моменту полный выход иодогидрина 9 86% (с поправкой на совместно элюируемые диастереоизомеры). Пример 23. Раствор иодогидрина 9 концентрируют в вакууме (948,2 миллибар, 28" Нg=711,2 мм рт. ст) до азеотропно высушенной смеси. Собирают всего 700 мл дистиллята, поддерживая температуру в реакторе 22-28 С. Дистиллят заменяют 500 мл ИПАЦ (KF = 275 мг/л). Раствор охлаждают до 26 С и за 10 мин добавляют 25% раствор NaOMe/MeOH (168,1 г). После добавления метоксида натрия температура падает до 24 С. Смесь темнеет, и быстро образуется смолистый твердый продукт, который снова растворяется. Смесь выдерживают в течение 1 ч при 25 С. За ходом реакции следят с помощью ВЭЖХ (условия те же, что и ранее); примерные времена удерживания: эпоксид эпи 21 10=6,5 мин, эпоксид 10, бис-эпи-10=7,1 мин,иодогидрин 9=8,1 мин. Поданным ВЭЖХ превращение иодогидрина в эпоксид соответствует 99%. После дополнительных 40 мин добавляют 4,1 г метанольного раствора метоксида натрия. Спустя 20 мин превращение по данным ВЭЖХ составляет 99,5%. Реакцию гасят, добавляя 366 мл воды при 25 С, затем все это коротко (10 мин) перемешивают и слои разделяют. Впоследствии было обнаружено, что продление времени реакции и перемешивания с водой,осаждения приводит к обратному ходу реакции к иодогидрину в этих условиях в пилотной установке. Эта проблема особенно актуально для водных промывок. Для исключения этой проблемы реакцию ведут при температуре 15 С. После достижения конверсии более 99% (1 ч после добавления NaOMe) смесь разбавляют ИПАЦ (40% от объема загрузки) и вначале промывают повышенным объемом воды (732 мл) при 20C. Более низкие температуры и более концентрированные смеси могут привести к преждевременному осаждению 10 во время промывок. Времена перемешивания/осаждения поддерживают минимальными (10/30 мин, соответственно). Таким образом обратную реакцию можно ограничить 1%. Неочищенную смесь,содержащую (97:3) эпоксид 10/иодогидрин 9,используют для выделения эпоксидного продукта, содержащего 0,6% иодогидрина. Эпоксидный продукт, содержащий это количество иодогидрина, используют далее без проблем. Органическую фазу промывают 3% сульфатом натрия (2 х 750 мл). Объем органической фазы составляет 1,98 л после промывок. рН трех водных промывок составляет 10,7, 9,4 и 8,6 соответственно. К этому моменту по данным ВЭЖХ содержание эпоксида 10 составляет 86% (с поправкой на 4% элюирующегося одновременно бис-эпи-10). ИПАЦ раствор эпоксида 10 концентрируют при пониженном давлении (948,2 миллибар, 28" Нg=711,2 мм рт.ст.) до объема около 600 мл, поддерживая температуру в реакторе 15-22 С. Растворитель заменяют на nРrОН, добавляя 750 мл н-РrОН, продолжая вакуумное концентрирование до реакционного объема около 500 мл, и поддерживая температуру в реакторе менее 30 С. Температуры, превышающие 35 С во время концентрирования/замены растворителя могут привести к нпропиловому эфиру, как продукту разложения побочного продукта, полученного из эпоксида 10. Анализ состава растворителя по данным ВЭЖХ 1 Н ЯМР дает содержание оставшегося ИПАЦ менее 1-мольного %. Густую суспензию охлаждают до -10 С за час и выдерживают в течение 45 мин. Твердую часть отфильтровывают и промывают 125 мл холодного н-РrОН. Полученный продукт сушат в вакуумном шкафу при 25 С до получения 188,5 г эпоксида 10 (98,9 22 производителя) указывает на отсутствие бисэпи-10 в выделенной части. Пример 24. Получение промежуточного 1. Твердый 2(S)-трет.-бутилкарбоксамид-4 трет.-бутоксикаронил-пиперазин 11 (159 г, 557 ммолей) и эпоксид 10 (200 г, 530 молей) загружают в двухлитровую трехгорлую колбу, снабженную механической мешалкой, обратным холодильником, обогревающей рубашкой, покрытой тефлоном, термопарой и отверстием для ввода азота. Добавляют 756 мл метанола и полученную смесь нагревают до кипения с обратным холодильником. Спустя 40 мин получают гомогенный раствор. Внутренняя температура при кипении с обратным холодильником составляет 64-65 С. За ходом реакции следят с помощью ВЭЖХ: 60:40 ацетонитрил, 10 мМ (КН 2 РО 4/ К 2 НРО 4). Примерное время удерживания: Время удерживания (мин) 4,8 6,6 8,2 8,9 15,2 Эту смесь выдерживают при температуре кипения с обратным холодильником до тех пор,пока площадь пика эпоксида 10 на ВЭЖХ хроматограмме не будет составлять 1,2-1,5%. Продукт присоединения в этот момент составляет площадь 94-95%. Метиловый эфир 13 присутствует в количестве, соответствующем 1,0-1,5% площади при завершении. Обычно для достижения такой конверсии необходимо время 24-26 ч при кипении с обратным холодильником. Полученную смесь охлаждают до -5 С и безводную газообразную НСl (194 г, 5,32 моля,примерно 10 экв.) барботируют непосредственно в метанольный раствор в атмосфере азота,причем температуру поддерживают 5-8 С в течение 2-3 ч. После завершения добавления смесь выдерживают при 5-8 С в течение 1-3 ч. В это время наблюдается выделение газа (двуокись углерода и изобутилен). За ходом реакции следят с помощью ВЭЖХ; условия те же, что и ранее. Примерное время удерживания: Время удерживания (мин) 6,0 7,0 11,9 15,1 16,5 25,0 Полученную смесь выдерживают при температуре 5-8 С до тех пор, пока Воc промежуточное 14 на составит менее 0,5% площади на ВЭЖХ хроматограмме. В этот момент предшественник 1 соответствует около 92-93% площади, соединение 15 соответствует менее 1,0% площади, а 16 - составляет 0,6 площади ВЭЖХ хроматограммы. Удаление защиты завершается после 4 ч при 5 С. Охлаждение и гашение реакции немедленно после завершения ограничивает разложение 1 до 15 и 16 в условиях гидролиза. Полученную смесь охлаждают до -10,-15 С. Эту смесь медленно добавляют в пятилитровую колбу, снабженную механической мешалкой, и содержащую холодный перемешиваемый раствор дистиллированной воды (700 мл) и метанола (300 мл) при 0-2 С; рН погашенной смеси поддерживают между 8,5-9,0 за счет добавления 23 вес.% водного раствора NaOH(что дает высоко экзотермическую реакцию),поддерживая при этом температуру 10-20 С. рН конечной смеси 9,0-9,5. Полученную смесь экстрагируют изопропилацетатом (3,0 л). Эту смесь перемешивают,слои разделяют. Отработанную фазу снова экстрагируют изопропилэтилацетатом (1,0 л). По данным ВЭЖХ содержание 1 в изопропилацетате составляет 94%. Объединенную органическую фазу (примерно 5,0 л) концентрируют при пониженном давлении (812,7-846,6 миллибар, 24-25"Нg = 609,6-635,0 мм рт.ст.) до объема около 1,12 л при температуре смеси 30/40 С. Температура в реакторе во время замены растворителя может повыситься до 40 С, что не сказывается на выходе и не приводит к разложению. Этот раствор неочищенного соединения 1 используют затем непосредственно на следующей стадии для получения соединения J. Пример 25. Получение моногидрата. Предшественник 1 Бикарбонат калия Вода Пиколилхлорид Изопропилацетат Изопропилацетатный раствор предшественника (4,96 л; 52,5 г/л предшественника) концентрируют при пониженном давлении до объема 1,18 л (200 г, 499 моля). Температуру смеси поддерживают между 35 С и 44 С, поддерживая давление 846,6 миллибар (25" Нg = 635 мм рт. ст.). Содержание метанола менее 1,0 об.%. Полученную суспензию обрабатывают водным раствором бикарбоната калия (152 г в 630 мл воды, 1,59 моля, примерно 3,0 экв. ) и нагревают до 60 С. Затем в течение 4 ч добавляют водный раствор пиколилхлорида (93,8 г в 94 мл воды; 572 ммоля, 1,14 экв.). В эту смесь вводят затравку моногидрата соединения J, после того, как загружают 75% загрузки пиколилхлорида. Температура смеси составляет 6065 С. В конце добавления суспензионную смесь выдерживают в течение 20 ч при 60-65 С. Реакция завершается, когда предпоследнее соединение (предшественник) по данным ВЭЖХ занимает менее 1,0% площади хроматограммы. Уровень пиколилхлорида при этом соответствует 0,5-0,8% площади. Затем смесь разбавляют 2,5 л изопропилацетата и 1,34 л воды, и нагревают до 78 С. Слои разделяют и органическую фазу промывают горячей водой (3 х 1,34 л) при 78 С. Промывка горячей водой удаляет бисалкилированное соединение J и его содержание снижается до менее 0,1% площади на хроматограмме. Органическую фазу медленно охлаждают до 75 С и вводят затравку - моногидрат соединения J (8,0 г), и затем охлаждают до 4 С в течение 2 ч. Полученную смесь фильтруют для того, чтобы собрать продукт, и влажную лепешку промывают холодным изопропилацетатом (2 х 335 мл). Влажную лепешку сушат в вакууме Карбоновую кислоту 18 суспендируют в 27 л EtOAc и 12 мл ДМФ в семидесятидвухлитровой трехгорлой колбе с механической мешалкой в атмосфере азота, и полученную суспензию охлаждают до 2 С. Добавляют оксалилхлрид,поддерживая температуру между 5 и 8 С. Добавление завершают за 5 ч. Во время экзотермического добавления выделяются СО иCO2. Образовавшаяся НСl в значительной части остается в растворе. Образуется осадок, который, вероятно, представляет НСl соль хлорангидрида пиразина. Анализ образования хлорангидрида осуществляют за счет гашения безводного образца реакционной смеси трет. 26 бутиламином. При завершении реакции остается менее 0,7% кислоты 18. Анализ для завершения образования хлорангидрида важен, так как незавершенная реакция приводит к образованию бис-третбутилоксамида в виде примеси. За ходом реакции можно следить с помощью ВЭЖХ: 25 см Dupont Zorbax PXC8 колонка со скоростью потока 1 мл/мин и детектированием на 250 нм; линейный градиент от 98% 0,1% водного Н 3 РO4 и 2% CH3CN до 50% водного Н 3 РO4 и 50% СН 3 СN за 30 мин. Время удерживания: кислота 18 = 10,7 мин, амид 19 = 28,1 мин. Реакционную смесь выдерживают при 5 С в течение 1 ч. Оставшуюся суспензию охлаждают до 0 С - и трет.бутиламин добавляют с такой скоростью, чтобы поддерживать внутреннюю температуру ниже 20 С. Это добавление занимает 6 ч, так как реакция сильно экзотермична. Небольшую порцию образующегося трет.-бутиламмонийгидрохлорида отбирают из реакции в виде пушистого твердого вещества белого цвета. Полученную смесь выдерживают при 18 С в течение дополнительных 30 мин. Выпавшие в осадок аммонийные соли отфильтровывают. Фильтровальную лепешку промывают 12 л EtOAc. Объединенные органические фазы промывают 6 л 3%NаНСО 3 и 2 х 2 л насыщенного водного раствора NaCI. Органическую фазу обрабатывают 200 г Darco G60 углем и фильтруют через SolkaFloc, и лепешку промывают 4 л EtOAc. Обработка углем эффективно удаляет слегка пурпурный цвет продукта. Раствор EtOAc соединения 19 концентрируют при давлении 10 миллибар до 25% исходного объема. Добавляют 30 л 1-пропанола и перегонку продолжают до конечного объема 20 л. В этот момент содержание ЕОАс оказывается ниже пределов детектирования с помощью 1H ЯМР (менее 1%). Изменение внутренней температуры в этом растворителе составляет менее 30 С. Раствор соединения 3 в смеси 1 пропанол/ЕtOАс стабилен. Его оставляют при кипении с обратным холодильником при атмосферном давлении на несколько дней. После выпаривания аликвот получают твердый продукт золотисто-коричневого цвета с Т.пл. 87-88 С. 13 С ЯМР (75 МгГц, СДСl3, мд): 161,8; 146,8; 145,0; 143,8; 142,1; 51,0; 28,5. Пример 27. Рац-2-трет.-бутилкарбоксамидпиперазин 20. Пиразин-2-трет.-бутилкарбоксамид 19 2,4 кг (13,4 моля) в 1-пропанольном растворе 12 л 20% Pd(OH)2/C 16 вес.% воды, 144 г. Пиразин-2-трет.-бутилкарбоксамид 19/1 пропанольный раствор помещают в 18 л автоклав. Добавляют катализатор и полученную смесь гидрируют при 65 С при давлении 3 атм. водорода. Через 24 ч реакционная смесь поглощает теоретическое количество водорода, и ГХ указывает на содержание 19 менее 1%. Полученную смесь охлаждают, продувают азотом и катализатор отфильтровывают через Solka Floс. Катализатор промывают 2 л теплого 1 пропанола. Было обнаружено, что использование теплого 1-пропанола при промывке фильтровальной лепешки улучшает фильтрацию и снижает потери продукта на фильтровальной лепешке За ходом реакции следят с помощью ГХ: 30 м Megabore колонка, от 100 С до 160 С при скорости 10 С в мин, выдержка 5 мин, затем со скоростью 10/мин до 250 С. Время удерживания: 19 = 7,0 мин, 20 = 9,4 мин. За ходом реакции можно также следить с помощью ТСХ с растворителем EtOAc/MeOH (50:50) и нингидрином в качестве проявляющего агента. Выпаривание аликвот показывает, что выход после амидирования и гидрирования составляет 88%, а концентрация 20 составляет 133 г/л. Выпаривание аликвот дает 20 в виде твердого белого вещества с Т.пл. 150-151 С; 13 С ЯМР (75 МгГц, Д 2 О, мд) 173,5; 59,8; 52,0; 48,7; 45,0; 44,8; 28,7. Пример 28. (S) -2-трет.-бутилкарбоксамидпиперазин-бис(S)-камфорсульфоновой кислоты соль (S)-21. Раствор амина 20 в 1-пропаноле загружают в 100 л колбу с присоединенным порционным концентратором. Раствор концентрируют при давлении 10 миллибар и температуре менее 25 С до объема примерно 12 л. В этот момент продукт выпадает из раствора, но снова переходит в раствор, когда смесь нагревают до 50 С. Анализ гомогенных аликвот показывает,что концентрация соединения 20 составляет 341 28 г/л. Концентрацию определяют с помощью ВЭЖХ; 25 см Dupont Zorbax RXC8 колонка при скорости потока 1,5 млн/мин и с детектированием на 210 нм, изократично (98/2) СН 3 СN/O,1% водного Н 3 РO4. Время удерживания соединения 20 составляет 2,5 мин. 39 л ацетонитрила и 2,4 л воды добавляют,чтобы получить прозрачный, коричневый раствор. Определение содержания воды по KF титру и отношение СН 3 СN / 1-пропанол по данным интеграла спектра 1H ЯМР показывают, что отношение СН 3 СN/1-пропанол/Н 2O составляет 26/8/1,6. Концентрация в растворе составляет 72,2 г/л.(S)-10-камфорсульфоновую кислоту загружают за 30 мин четырьмя порциями при 20 С. Температура повышается до 40 С после добавления КСК. Через несколько минут образуется густой белый осадок. Белую суспензию нагревают до 76 С для того, чтобы растворилась вся твердая часть, затем этот коричневый раствор оставляют охлаждаться до 21 С в течение 8 ч. Продукт выпадает в осадок при 62 С. Его фильтруют без выдерживания при 21 С и фильтровальную лепешку промывают 5 л смеси растворителей СН 3 СN/1-пропанол/Н 2 О 26/8/1,6. Его сушат при 35 С в вакуумном шкафу в атмосфере азота до получения 5,6 кг (39%) соединения 21 в виде твердого кристаллического вещества, Т.пл. 288-290 С (с разложением []D25 = 18,9 (с=0,37, H2O) 13 С ЯМР (75 МгГц, D2O, мл) 222,0; 164,0; 59,3; 54,9; 53,3; 49,0; 48,1; 43,6; 43,5; 43,1; 40,6; 40,4; 28,5; 27,2; 25,4; 19,9; 19,8. Содержание ее материала составляет 95% по следующим данным анализа хиральной ВЭЖХ: аликвоту 21 (33 мг) суспендируют в 4 мл EtOH и 1 мл EtsN. Добавляют Вос 2 О (11 мг) и реакционную смесь выдерживают в течение 1 ч. Растворитель полностью удаляют в вакууме, а остаток растворяют в примерно 1 мл EtOAc и фильтруют через пастеровскую пипетку с SiO2,используя в качестве элюента EtOAc. Фракции выпаренного продукта снова растворяют в гексане с концентрацией примерно 1 мг/мл. Энантиомеры разделяют на колонке Da i celChiracell AS с системой растворителя гексан/ИПА (97:3) при скорости потока 1 мл/мин и с детектированием на 228 нм. Время удерживания: S антипод=7,4 мин, R=9,7 мин. Пример 29. (S) -2-трет.-бутилкарбоксамид 4-трет.-бутоксикарбонилпиперазин 11 из соли 21. К (S)-KCK соли 21 в столитровой трехгорлой колбе с капельной воронкой в атмосфере азота добавляют EtOH, затем триэтиламин при 25 С. Твердая часть легко растворяется при добавлении Еt3N. Вос 2O растворяют в EtOAc и загружают через капельную воронку, раствор Вос 2 в EtOAc добавляют с такой скоростью,чтобы поддерживать температуру ниже 25 С. Добавление занимает 3 ч. Реакционную смесь выдерживают в течение 1 ч после завершения добавления раствора Вос 2 О. За ходом реакции можно следить с помощью ВЭЖХ: 25 см колонка Dupont ZorbaxRXC8 со скоростью потока 1 мл/мин и детектированием на 228 нм. Изократично (50/50)NaOH. Время удерживания соединения 11 = 7,2. Хиральный анализ проведен на той же системе,что и в предыдущей стадии. За ходом реакции можно также следить с помощью ТСХ, используя в качестве растворителя 100% EtOAc (Rf = 0,7). Затем раствор концентрируют до примерно 10 л при внутренней температуре менее 20 С в порционном концентраторе при давлении 10 миллибар. Замену растворителя осуществляют,медленно вводя 20 л EtOAc, и снова концентрируют до примерно 10 л. Реакционную смесь промывают в экстракторе 60 л EtOAc. Органическую фазу промывают 16 л 5% водного раствора Nа 2 СО 3, 2 х 10 л дистиллированной воды и 2 х 6 л насыщенного водного хлорида натрия. Объединенные водные промывки подвергают обратной экстракции 20 л EtOAc и органическую фазу промывают 2 х 3 л воды и 2 х 4 л насыщенного водного хлорида натрия. Объединенные EtOAc экстракты концентрируют при давлении 10 миллибар при внутренней температуре ниже 20 С в 100 л порционном концентраторе до примерно 8 л. Растворитель заменяют на циклогексан, медленно добавляя 20 л циклогексана, и снова концентрируя до примерно 8 л. К суспензии добавляют 5 л циклогексана и 280 млEtOAc и полученную смесь нагревают до кипения с обратным холодильником до тех пор, пока все не переходит в раствор. Этот раствор охлаждают и вводят затравку (10 г) при 58 С. Суспензию охлаждают до 22 С за 4 ч и продукт отфильтровывают после часа выстаивания при 22 С. Фильтровальную лепешку промывают 1,8 л циклогексана и сушат в вакуумном шкафу в атмосфере азота до получения 1,87 кг (77%, более 99,9% площади хроматограммы ВЭЖХ, R изомер ниже уровня детектирования) соедине 30 ния 11 в виде слегка желтовато-коричневатого порошка.[]D25 = 22,0 (с = 0,20 МеОН). Т.плав. 107 С. 13 С ЯМР (75 МгГц, СDСl3 , мд): 170,1; 154,5; 79,8; 58,7; 50,6; 46,6; 43,6; 43,4; 28,6; 28,6; 28,3. Хотя приведенное описание учит принципам настоящего изобретения, вместе с примерами, приведенными с целью иллюстрации, следует учитывать, что практика настоящего изобретения охватывает все обычные варианты,адаптации и модификации, которые попадают в объем приводимой формулы изобретения и ее эквивалентов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ восстановительного алкилирования для получения N-(2-(R)-гидрокси-1-(S)инданил)-2(R)-фенилметил-4-(S)-гидрокси-5-(1(4-(3-пиридилметил)-2(S)-N'-(трет.-бутилкарбоксамидо)-пиперазинил-пентанамида структурной формулы или его гидратов, отличающийся тем, что осуществляют взаимодействие в течение, по крайней мере, 5 мин в подходящем растворителе одного эквивалента соединения структурной формулы с избытком 3-пиридинкарбоксальдегида в присутствии избытка восстанавливающего агента,при температуре в интервале от около -78 до около 90 С. 2. Способ по п.1, отличающийся тем, что подходящий растворитель выбирают из сложного эфира, простого эфира, спирта, формамида,углеводорода и 1,2-дихлорэтана и любых смесей этих растворителей. 3. Способ по п.1, отличающийся тем, что походящий растворитель выбирают из сложного эфира и спирта или из них обоих. 4. Способ по п.1, отличающийся тем, что подходящий растворитель выбирают из изопропилацетата и этилацетата. 5. Способ по п.1, отличающийся тем, что восстанавливающий агент включает агент каталитического гидрирования. 6. Способ по п.1, отличающийся тем, что восстанавливающий агент выбран из группы,включающей NaBH4, NaCNBH3, NаВН(ОАс)3, 31Zn/HCl, Fe(CO)5/KOH-EtOH, муравьиную кислоту и селенофенол. 7. Способ по п.5, отличающийся тем, что восстанавливающий агент включает агент, выбранный из NaCNBH3, NаВН(ОАс)3 и муравьиной кислоты. 8. Способ по п.6, отличающийся тем, что восстанавливающий агент включает агент, выбранный из NаВН(ОАс)3 и муравьиной кислоты. 9. Способ по п.1, отличающийся тем, что температурный интервал реакции поддерживают между около -40 и около 70 С. 10. Способ по п.8, отличающийся тем, что температурный интервал реакции поддерживают от около 20 до около 60 С. 11. Способ по п.1, отличающийся тем, что осуществляют взаимодействие, по крайней мере, в течение 5 мин в растворителе, выбранном из изопропилацетата и этилацетата, одного эквивалента соединения структурной формулы 32 с одним-двумя эквивалентами 3-пиридинкарбоксальдегида, в присутствии восстанавливающего агента, выбранного из NaBH(OAc)3 и муравьиной кислоты, при температуре в интервале от около 20 до около 60 С с получением соединения J или его гидрата. 12. Способ по п.1, отличающийся тем, что смешивают в растворителе, выбранном из изопропилацетата и этилацетата, один эквивалент соединения структурной формулы с одним-двумя эквивалентами 3-пиридинкарбоксальдегида; добавляют восстанавливающий агент, выбранный из NaBH(OAc)3 и муравьиной кислоты, и поддерживают в течение, по крайней мере, 5 мин полученную смесь при температуре в интервале от около 20 до около 60 С с получением соединения J или его гидрата.
МПК / Метки
МПК: C07D 401/06
Метки: восстановительного, алкилирования, способ, n-(2-(r)-гидрокси-1-(s)-инданил)-2(r)-фенилметил-4(s)-гидрокси-5-(1-(4-(3-пиридилметил)-2-(s)-n'-трет.-бутилкарбоксамидо)-пиперазинил)-пентанамида, получения
Код ссылки
<a href="https://eas.patents.su/17-635-sposob-vosstanovitelnogo-alkilirovaniya-dlya-polucheniya-n-2-r-gidroksi-1-s-indanil-2r-fenilmetil-4s-gidroksi-5-1-4-3-piridilmetil-2-s-n-tret-butilkarboksamido-piperazinil-pentanam.html" rel="bookmark" title="База патентов Евразийского Союза">Способ восстановительного алкилирования для получения n-(2-(r)-гидрокси-1-(s)-инданил)-2(r)-фенилметил-4(s)-гидрокси-5-(1-(4-(3-пиридилметил)-2-(s)-n’-трет.-бутилкарбоксамидо)-пиперазинил)-пентанамида</a>
Следующий патент: Тройные радиофармацевтические комплексы
Случайный патент: Способ установки кольцевого уплотнителя на трубчатый элемент для скважины





















