Применение композиции арилциклоалкиламида для получения лекарственного препарата для лечения нарушения внутреннего уха
Формула / Реферат
1. Применение композиции, включающей арилциклоалкиламин или его фармацевтически приемлемую соль, где арилциклоалкиламин является антагонистом рецептора NMDA, и биосовместимый полимер или комбинацию биосовместимых полимеров, для получения лекарственного препарата в форме геля для лечения нарушения внутреннего уха путем нанесения на тканевую структуру между средним и внутренним ухом.
2. Применение композиции по п.1, где препарат представляет собой термореактивный гель.
3. Применение композиции по одному из предыдущих пп.1, 2, в которой биосовместимый полимер выбран из группы, включающей встречающиеся в естественных условиях полисахариды или синтетические полимеры или их смесь.
4. Применение композиции по п.3, в которой биосовместимый полимер выбран из блок-сополимеров.
5. Применение композиции по п.3 или 4, в которой биосовместимый полимер выбран из группы, включающей гиалуроновую кислоту, лецитиновые гели, (поли)аланиновые производные, плюроники, поли(этилен)гликоль, полоксамер, хитозан, ксилоглюкан, коллаген, фибрин или их смесь.
6. Применение композиции по одному из предыдущих пп.3-5, в которой биосовместимый полимер является биоразлагаемым.
7. Применение композиции по любому из пп.1-6, в которой арилциклоалкиламин имеет общую формулу I
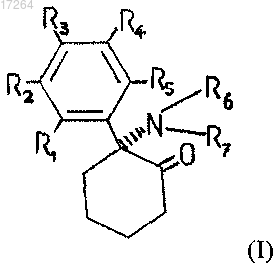
в которой R1, R2, R3, R4, R5, R6 и R7 обозначают H, Cl, F, I, CH3, CH2CH3, NH2, OH, CONH2, COCl или СООН.
8. Применение композиции по одному из предыдущих пп.1-7, в которой фармацевтическое действующее вещество представляет собой 2-(2-хлорфенил)-2-(метиламино)циклогексанон (кетамин), предпочтительно (S)-кетамин.
9. Применение композиции по одному из предыдущих пп.1-8, которая дополнительно содержит компоненты, выбранные из группы, включающей фармацевтически приемлемые наполнители, буферы, эксципиенты, добавки и субстанции, повышающие проницаемость разделяющей тканевой структуры между средним и внутренним ухом.
10. Применение композиции по п.9, в которой повышающая проницаемость субстанция представляет собой гистамин.
11. Применение композиции по любому из пп.1-10, где лекарственный препарат представляет собой препарат с пролонгированным высвобождением.
12. Применение композиции по п.11, при котором лекарственный препарат представляет собой препарат с пролонгированным высвобождением действующего вещества, причем оно высвобождается в течение периода времени, составляющего от нескольких часов до нескольких недель.
13. Применение композиции по любому из пп.1-12, где лекарственный препарат предназначен для направленного высвобождения действующего вещества на выбранной разделяющей тканевой структуре между средним и внутренним ухом с использованием биоадгезии или механических свойств.
14. Применение композиции по любому из пп.1-4, где лекарственный препарат представляет собой имплантат.
15. Применение композиции по любому из пп.1-14 для лечения шума в ушах, потери слуха, воспалений или инфекций внутреннего уха, аутоиммунных нарушений, головокружения или болезни Меньера.
16. Применение композиции по любому из пп.1-14 для приготовления лекарственного препарата, предназначенного для лечения индуцированной экситотоксичностью дегенерации клеток внутреннего уха или связанной с возрастом дегенерации клеток внутреннего уха.
17. Применение композиции по любому из пп.1-14, где лекарственный препарат вводят млекопитающему, страдающему заболеванием внутреннего уха.
18. Применение композиции по п.1, где лекарственный препарат вводят путем инфузии, инъекции или с помощью хирургического инструмента.
Текст
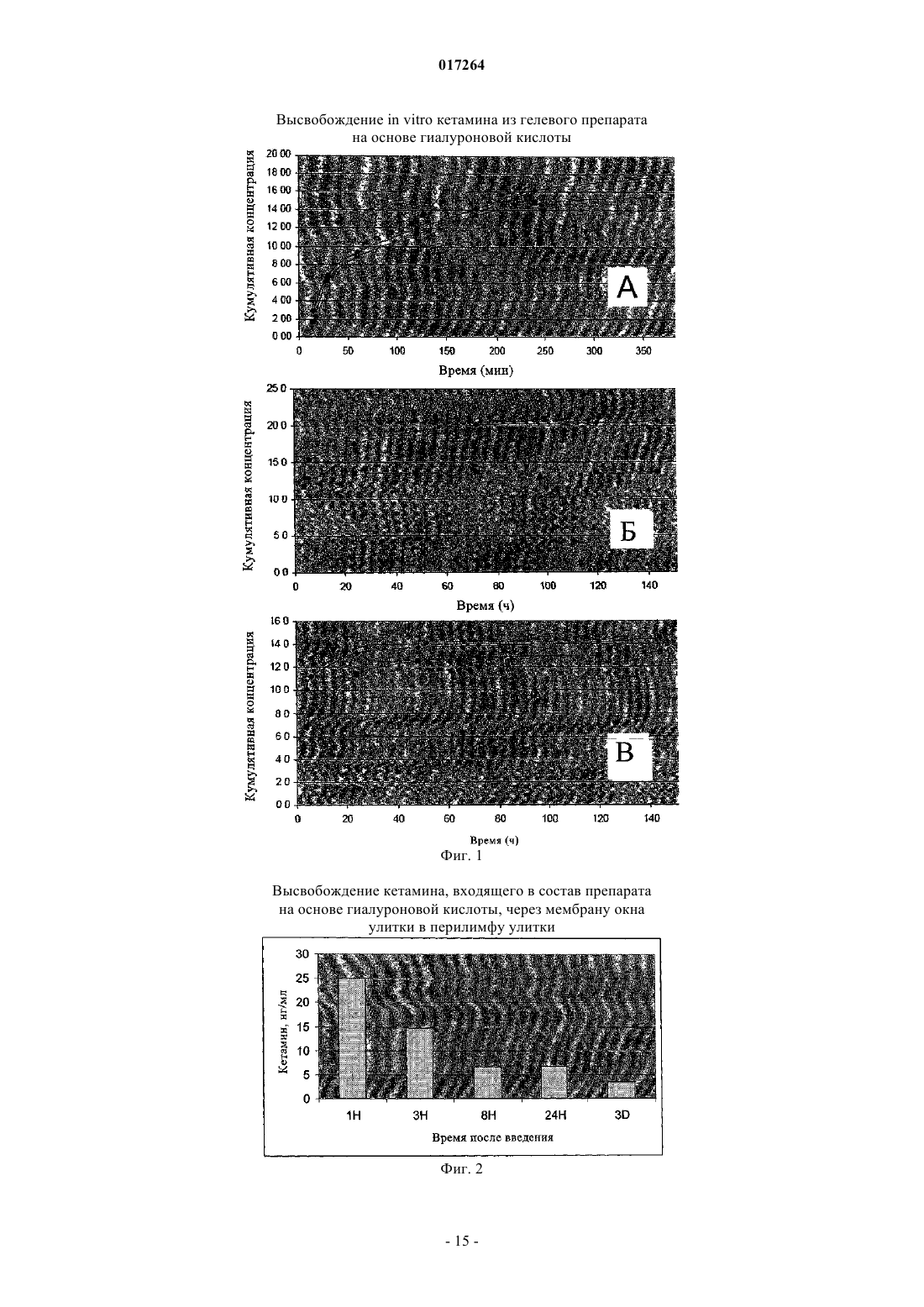
ПРИМЕНЕНИЕ КОМПОЗИЦИИ АРИЛЦИКЛОАЛКИЛАМИДА ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЯ ВНУТРЕННЕГО УХА Приведено описание применения композиции, включающей арилциклоалкиламин или его фармацевтически приемлемую соль, где арилциклоалкиламин является антагонистом рецептораNMDA, и биосовместимый полимер или комбинацию биосовместимых полимеров, для получения лекарственного препарата в форме геля для лечения нарушения внутреннего уха, например шума в ушах, путем нанесения на тканевую структуру между средним и внутренним ухом.(71)(73) Заявитель и патентовладелец: АУРИС МЕДИКАЛЬ АГ (CH) 017264 Область техники, к которой относится изобретение Настоящее изобретение относится к композициям, содержащим одно или несколько фармацевтических соединений, которые предназначены для предупреждения и/или лечения шума в ушах и других нарушений внутреннего уха. Предпосылки создания изобретения Различные нарушения внутреннего уха, например потеря слуха, инфекционное заболевание внутреннего уха или шум в ушах привлекают повышенное внимание с точки зрения разработки новых методов лечения. Например, шум в ушах, т.е. восприятие звука при отсутствии внешнего акустического источника, представляет собой широко распространенное нарушение внутреннего уха. Оценки показывают, что от 7 до 14% популяции обращались к своему лечащему врачу по поводу шума в ушах, в то время как шум в ушах, который может приводить к инвалидности, встречается примерно у 1-2,4% людей(Vesterarger V., British Medical Journal, 314 (7082), 1997, p. 728-731). Шум в ушах часто связан с другими нарушениями слуха, такими как потеря слуха или гиперакузия, т.е. гиперчувствительность к звуку(Sahley Т. и Nodar R., Hearing Research (152), p. 43-54), и часто его причина связана с нарушениями во внутреннем ухе. Для лечения заболеваний внутреннего уха, например, шума в ушах, уже были тестированы на моделях с использованием животных и на людях различные фармацевтические соединения, такие как лидокаин, габепентин, нортриптлин, мелатонин, кароверин, баклофен, алпразолам, гациклидин,7-хлоркинуренат или кетамин. Хотя для некоторых из них были получены многообещающие результаты,ни одно из указанных соединений до настоящего времени не нашло регулярного клинического применения. Одно из имеющих решающее значение препятствий для разработки эффективных путей лечения заключается в том, что внутреннее ухо подобно головному мозгу защищено биологическим барьером. При системном введении лекарственного средства для достижения требуемого терапевтического действия во внутреннем ухе, как правило, необходимо использовать сравнительно высокие дозы, что сопровождается риском возникновения сильных побочных действий на центральную или периферическую нервную систему. С другой стороны, как установлено в результате фармакокинетических исследований внутреннего уха, местное введение во внутреннее ухо позволяет осуществлять направленное введение соединений, при котором требуются существенно более низкие дозы (Chen et al., Audiol. Neurootol. 8,2003, p. 49-56). Доступ во внутреннее ухо можно осуществлять через различные разделяющие тканевые структуры между средним и внутренним ухом, такие как вторичная барабанная перепонка (мембрана окна улитки), овальное окно/основание стремени, кольцевая связка или эндолимфатический мешок/эндолимфатический проток. Местное введение соединения во внутреннее ухо можно осуществлять с помощью различных методов введения. Они включают применение устройств для транспорта и/или введения соединения направленным образом к мембранам окна улитки или овального окна, где оно диффундирует во внутреннее ухо или где осуществляют его активную инфузию. Примерами могут служить ушные турунды (см., например, US 6120484 на имя Silverstein), катетеры для окна улитки (см., например, US 5421818; 5474529; 5476446; 6045528, все на имя Arenberg, или 6377849 и его разделение 2002/0082554 на имя Lenarz) или микроимплантаты (см., например, WO 2004/064912 на имя Jukarainen et al.). Кроме того, можно применять устройства, которые вводят в канал улитки лабиринта внутреннего уха или иную часть улитки (см.,например U.S. 6309410 на имя Kuzma). Другим методом введения является транстимпаническая инъекция (которую иногда называют также "интратимпанической инъекцией"), которая заключается в том, что лекарственное средство вводят путем инъекции через барабанную перепонку в среднее ухо, как правило,с целью осуществления диффузии через мембрану окна улитки (см. описание, например, у Light J. иSilverstein H., Current Opinion in OtolaryngologyHead and Neck Surgery (12), 2004, p. 378-383). Этот метод уже давно применяют в клинической практике, и он представляет собой относительно несложное вмешательство, которое можно осуществлять в кабинете врача. Для повторных инъекций в барабанную перепонку можно вставлять вентиляционную трубку для внутреннего уха, через которую лекарственное средство можно вводить в барабанную полость. Носители лекарственного средства, обладающие слишком большой вязкостью для введения путем инъекции, можно вносить через небольшое отверстие в барабанной перепонке, которое делают с помощью хирургического инструмента. Для повышения терапевтической эффективности фармацевтических соединений, предназначенных для терапии внутреннего уха, можно применять, в частности, препараты, содержащие гели, пены или фибрины или другие носители лекарственного средства. Они могут обеспечивать контролируемое высвобождение лекарственного средства в течение продолжительного периода времени, например в течение нескольких часов, дней или недель, усиливать его диффузию во внутреннее ухо в результате повышения проницаемости разделяющей тканевой структуры между средним и внутренним ухом или удерживания препарата в непрерывном контакте с такой структурой. Это выгодно отличается от введения фармацевтического соединения в растворе, при котором может требоваться осуществлять несколько инъекций, может происходить перколяция лекарственного средства назад в ушной канал или его значительная потеря через эвстахиевую трубу и может оказаться трудным или невозможным обеспечить непрерывный контакт с разделяющей тканевой структурой между средним и внутренним ухом. В идеаль-1 017264 ном варианте носитель лекарственного средства является биосовместимым, а также биоразложимым, в последнем случае не требуется осуществлять последующее его удаление. Диффузия фармацевтических соединений через разделяющие тканевые структуры между средним и внутренним ухом, в частности мембрана окна улитки, зависит от различных факторов, таких как молекулярная масса, концентрация, жирорастворимость, электрический заряд и толщина мембраны(Goycoolea М. и Lundman L., Microscopy Research and Technique 36, 1997, p. 201-211). Если отсутствуют экспериментальные данные, полученные in vivo или на образце ткани мембраны, то способность проникать через разделяющие тканевые структуры между средним и внутренним ухом и, следовательно, пригодность любого фармацевтического соединения или препарата для местного введения во внутреннее ухо остаются неизвестными.in vivo, что гиалуроновая кислота повышает проницаемость мембраны окна улитки и в результате этого тестируемая субстанция лидокаин быстрее диффундирует во внутреннее ухо и оказывает большее действие. Chandrasekhar S. (OtologyNeurotology (22), 2001, p. 18-23) продемонстрировал в опытах in vivo,что транстимпаническая инъекция дексаметазона в сочетании с гистамином приводит к более высоким концентрациям этого стероида в перилимфе внутреннего уха, чем при его введении без гистамина. Существует обширная литература, касающаяся (местного) введения фармацевтических соединений с целью лечения заболеваний внутреннего уха. В течение некоторого времени в клинической практике использовали местное введение стероидов и аминогликозидов для обработки внутреннего уха (см., например, Hoffer et al., Otolaryngologic Clinics of North America (37), 2004, p. 1053-1060). У Sakata et al.,International Tinnitus Journal (2), 1996, p. 129-135 приведено описание интратимпанической инфузии дексаметазона в барабанную полость людей. У Hoffer et al., Otolaryngologic Clinics of North America (36),2003, p. 353-358 приведено описание транстимпанических инъекций растворов метилпреднизолона для лечения шума в ушах после шумовой травмы или внезапной глухоты. Во всех этих случаях лекарственные соединения применяли в растворах. Однако имеется мало сведений о местном применении для лечения заболеваний внутреннего уха с использованием других препаратов. В WO 1997/38698 на имя Manning et al. описано применение биосовместимых полимеров для введения фармацевтических соединений во внутреннее ухо для лечения заболеваний среднего и внутреннего уха, например болезни Меньера или вирусных и бактериальных инфекционных заболеваний. Представлены полученные in vitro экспериментальные данные о высвобождении гентамицина при использовании композиции с гиалуроновой кислотой. В WO 2004/022069 на имя Puel et al. описано введение нейромодуляторов, в частности антагонистовNMDA (N-метил-D-аспартат) гациклидина, D-AP5, MK 801 и 7-хлорокинурената, в виде различных препаратов, включающих такие носители лекарственного средства, как пенный гель, гиалуроновая кислота или фибриновый клей, для лечения различных заболеваний внутреннего уха. Кроме того, вWO 2004/022069 описано много альтернативных методов введения, предназначенных для внесения препарата во внутреннее ухо. Принимая во внимание указанную выше литературу и недостатки, присущие многим фармацевтическим композициям, применяемым для местного введения, существует необходимость в разработке других фармацевтических композиций, пригодных для местного лечения нарушений внутреннего уха,которые можно легко инъецировать во внутреннее ухо, которые обеспечивают высвобождение лекарственного средства в течение продолжительного периода времени и обеспечивают поступление высокого процента лекарственного средства во внутреннее ухо. Краткое изложение сущности изобретения В настоящем изобретении предложены композиции, содержащие (I) фармацевтическое действующее вещество, выбранное из группы, включающей арилциклоалкиламин или его производное, аналог или фармацевтически активную соль, и (II) биосовместимый полимер или комбинацию биосовместимых полимеров. Указанные композиции или лекарственные средства, содержащие указанные композиции,можно применять для предупреждения и/или лечения заболеваний внутреннего уха, например шума в ушах. Композиция, предлагаемая в настоящем изобретении, содержит основу из биосовместимого полимера, в которую включено в терапевтически эффективном количестве по меньшей мере одно из указанных выше фармакологических действующих веществ. Арилциклоалкиламиновый агент может, например, подавлять или снижать ощущение шума в ушах. Предпочтительно композицию приготавливают таким образом, чтобы после введения в среднее ухо она была способна оставаться в контакте по меньшей мере с одной из разделяющих тканевых структур между средним и внутренним ухом и обеспечивать пролонгированное высвобождение фармакологического действующего вещества во внутреннее ухо. Предпочтительно биосовместимый полимер является биоразложимым, а также он может повышать проницаемость мишени, представляющей собой разделяющую тканевую структуру между средним и внутренним ухом, для усиления диффузии фармакологического действующего вещества.-2 017264 Краткое описание чертежей На фигурах показано: на фиг. 1 - кумулятивное высвобождение S-(+)-кетамина из гелевых препаратов на основе 5 и 7,5%ной гиалуроновой кислоты в фосфатный буфер в зависимости от времени; на фиг. 2 - концентрация S-(+)-кетамина в перилимфе после высвобождения из препарата на основе 2,8%-ной гиалуроновой кислоты, который был помещен в нишу окна улитки морских свинок и затем диффундировал через мембрану окна улитки во внутреннее ухо; на фиг. 3 - концентрация S-(+)-кетамина в перилимфе после высвобождения либо из препарата на основе 0,7%-ной гиалуроновой кислоты, либо из препарата на основе 20%-ного полоксамера, которые были инъецированы в нишу окна улитки морских свинок и затем диффундировали через мембрану окна улитки во внутреннее ухо. Подробное описание изобретения Основой настоящего изобретения являются выявленные экспериментальным путем композиции,которые можно применять, прежде всего, для местного введения арилциклоалкиламина или его производного, аналога или фармацевтически активной соли, прежде всего, для лечения нарушений внутреннего уха. Препарат, предлагаемый в изобретении, содержит в качестве основного действующего вещества соединение из класса арилциклоалкиламинов. В классе арилциклоалкиламинов предпочтительными являются соединения общей формулы (I) в которой R1, R2, R3, R4, R5, R6 и R7 обозначают Н, Cl, F, I, СН 3, СН 2 СН 3, NH2, ОН, CONH2, COCl или СООН. Одним из наиболее предпочтительных соединений из класса арилциклоалкиламинов является кетамин. Кетамин (C13H16ClNO (свободное основание), 2-(2-хлорфенил)-2-(метиламино)циклогексанон),имеющий структурную формулу представляет собой неконкурентный антагонист NMDA-рецептора, который связывается с РСР-связывающим сайтом, отдельным сайтом NMDA-рецепторного комплекса, расположенным в ионном канале, блокируя тем самым трансмембранный поток ионов. В качестве действующего вещества в композиции, предлагаемой в изобретении, можно применять любое производное, аналог и/или энантиомерную форму кетамина или арилциклоалкиламинового производного формул (II) или (I) соответственно. Кетамин можно получать методами, описанными в US 3254124. Более конкретно, предпочтительное соединение представляет собой (S)-кетамин, поскольку он связывается с РСР-связывающим сайтомal., Eur. Neuropsychopharmacol. 7, 1997, p. 25-38). Синтез оптических изомеров можно осуществлять согласно методу, описанному в DE 2062620 или WO 01/98265, которые включены в настоящее описание в качестве ссылки. Арилциклоалкиламиновое производное, входящее в фармацевтическую композицию, предлагаемую в настоящем изобретении, может находиться в форме фармацевтически приемлемой соли. Примерами таких солей являются (но не ограничиваясь ими) соли, образованные с органическими кислотами (например, с уксусной, молочной, лимонной, яблочной, муравьиной, винной, стеариновой, аскорбиновой,янтарной, бензойной, метансульфоновой, толуолсульфоновой или памовой кислотой), неорганическими кислотами (например, соляной, азотной, дифосфорной, серной или фосфорной кислотой) и полимерными кислотами (например, дубильной кислотой, карбоксиметилцеллюлозой, полимером молочной кислоты,полигликолевой кислотой или сополимерами полимеров молочной кислоты-гликолевой кислоты). В предпочтительном варианте осуществления настоящего изобретения кетамин можно вводить в виде гидрохлорида (C13H17Cl2NO) или в форме свободного основания. Изобретение относится к композициям, которые включают арилциклоалкиламиновый агент, необязательно в сочетании по меньшей мере с одним другим фармакологически активным агентом. Их можно приготавливать в такой форме, чтобы можно было осуществлять их местное введение в среднее ухо для контролируемого высвобождения агента с целью его максимального проникновения во внутреннее ухо. Предпочтительно композицию прикрепляют к разделяющей тканевой структуре между средним и внутренним ухом с помощью биоадгезии или на основе механических свойств.-3 017264 Биосовместимый полимер, содержащийся в композиции, предлагаемой в изобретении, может выполнять эти функции в основном с помощью двух механизмов. Во-первых, за счет того, что обеспечивается поступление фармацевтического соединения к мишени, т.е. разделяющей тканевой структуре между средним и внутренним ухом, откуда оно диффундирует во внутреннее ухо. Для этого полимер должен оставаться в области-мишени в течение промежутка времени, необходимого для достижения требуемой продолжительности и эффективности фармакологического лечения, либо благодаря адгезии к соответствующей области слизистой оболочки среднего уха, либо благодаря своим вязким свойствам, которые гарантируют, что препарат остается на месте. Во-вторых, за счет повышения проницаемости мишени, т.е. разделяющей тканевой структуры между средним и внутренним ухом, для облегчения проникновения фармацевтического соединения во внутреннее ухо. Композиция, содержащая фармацевтически активный арилциклоалкиламиновый агент (ниже в настоящем описании часто обозначен просто как "действующее вещество"), может находиться в твердом,полутвердом, гелеобразном или жидком состоянии. Предпочтительно композиция представляет собой раствор, суспензию, эмульсию или термореактивный гель. Композиция, предлагаемая в изобретении, содержит биосовместимый полимер или комбинацию биосовместимых полимеров. Биосовместимый(е) полимер(ы) отличается(ются) тем, что он(и) практически не вступает(ют) во взаимодействие с организмом или жидкостью организма человека/животного. Они могут представлять собой полимеры, встречающиеся в естественных условиях, такие как встречающиеся в естественных условиях полисахариды, или полученные путем синтеза. Предпочтительно полимер, содержащийся в композиции, расщепляется in vivo либо в результате гидролиза, либо под действием ферментов, с образованием биосовместимых безопасных в токсикологическом отношении побочных продуктов, которые затем удаляются обычными метаболическими путями. Биоразложимыми являются различные типы встречающихся в естественных условиях синтетических и биосинтетических полимеров. Полимер на основе С-С-каркаса имеет тенденцию не подвергаться биоразложению, в то время как содержащие гетероатом каркасы полимеров придают свойство биоразложимости. Таким образом, полимерам можно придавать свойство биоразложимости путем соответствующего добавления химических связей, таких как, среди прочего, ангидридная, сложноэфирная или амидная связи. Разложение происходит в результате гидролиза или путем ферментативного расщепления, приводящего к разделению каркаса полимера. Предпочтительными являются биоразложимые полимеры, имеющие гидролизуемые химические связи. Для того чтобы его можно было применять в медицинских композициях, биоразложимый полимер должен быть биосовместимым и предпочтительно должен удовлетворять другим критериям, таким как способность подвергаться процессингу под действием биологических материалов, способность к стерилизации и обладание контролируемой стабильностью или способностью к разложению в условиях биологического окружения. Таким образом, биосовместимость полимера часто определяется продуктами разложения, а необязательно самим полимером. В качестве полимеров в фармацевтических композициях можно применять сложные полиэфиры на основе полилактида (ПЛА), полигликолида (ПГА), поликапролактона (ПКЛ) и их сополимеров. В результате разложения этих материалов образуются соответствующие оксикислоты, что делает их безопасными при применении in vivo. К другим биоразложимым полимерам относятся, например, полигидроксиалканоаты из класса ПГБ-ПГВ (полигидроксибутилат-полигидроксивинилат), другие сложные полиэфиры и встречающиеся в естественных условиях полимеры, в частности модифицированные полисахариды, например крахмал, целлюлоза и хитозан. Биосовместимый полимер можно выбирать также из блок-сополимеров. Пригодными продуктами могут служить, например, многоблочные сополимеры поли(этиленоксида), ПЭО и поли(бутилентерефталата), ПБТ. Такие продукты подвергаются как гидролизу (благодаря наличию сложноэфирных связей), так и окислению (благодаря наличию связей, образованных простыми эфирами). Скорость расщепления зависит от молекулярной массы и состава ПЭО. Сополимер, обладающий наибольшей способностью поглощать воду, разлагается наиболее быстро. Композиции, предлагаемые в изобретении, могут содержать гомогенную форму биосовместимого полимера или могут содержать смесь одного, двух или большего количества различных полимеров, которая может образовываться вследствие того, что разнообразие полимеров, получаемых промышленными методами, приводит к производству негомогенной смеси полимеров, или которую можно получать путем объединения различных полимеров на отдельной стадии смешения. Биосовместимый полимер, применяемый в композиции, предлагаемой в настоящем изобретении,предпочтительно обладает способностью образовывать гели, которые могут быть как биоразложимыми,так и небиоразложимыми, водными или неводными или представлять собой гели на основе микросфер. Примерами гелеобразующих биосовместимых полимеров являются (но не ограничиваясь ими) гиалуроновая кислота, соответственно гиалуронаты, лецитиновые гели, (поли)аланиновые производные,плюроники, поли(этиленгликоль), полоксамеры, хитозаны, ксилоглюканы, коллагены, фибрины, сложные полиэфиры, поли(лактиды), поли(гликолиды) или их сополимеры ПЛГА, изобутират ацетата целлюлозы и глицеринмоноолеат. Предпочтительными являются гели, которые можно легко вводить в среднее-4 017264 ухо, которые высвобождают лекарственное средство в течение продолжительного периода времени и позволяют обеспечивать поступление более высокого процента лекарственного средства во внутреннее ухо. Гиалуроновая кислота, которую предпочтительно применяют в качестве биосовместимого полимера в композиции, предлагаемой в настоящем изобретении, представляет собой физиологическую субстанцию, которая широко распространена во внеклеточном матриксе соединительных тканей во всех органах организма. Она встречается в формах с различной молекулярной массой, и имеются данные о том, что она не обладает антигенными свойствами. Кроме того, она обладает очень хорошей биосовместимостью и является также биоразложимой. Такие высокомолекулярные полимеры широко применяют в фармацевтической и косметической промышленности, например, в качестве офтальмохирургического средства при различных наружных процедурах, таких как интра- и экстракапсулярная хирургическая операция по поводу катаракты, внутриглазная имплантация линз, кератопластика, хирургическая операция по поводу глаукомы и посттравматическая операция. Гиалуроновые кислоты применяют также при лечении проблем с суставами. Гиалуроновая кислота представляет собой встречающийся в естественных условиях полисахарид, гликозаминогликан, состоящий из полимера с длинной цепью, содержащего повторяющиеся дисахаридные звенья Na-гликуронат-N-ацетилглюкозамина. Основное свойство гиалуроновой кислоты заключается в том, что она связывает воду и в результате образует разложимый гель с высокой вязкостью. Вязкость растворов гиалуроновой кислоты повышается при увеличении концентрации и молекулярной массы. Фармацевтические действующие вещества можно либо растворять, либо суспендировать в геле гиалуроновой кислоты. Было установлено, что фосфолипиды в сочетании с некоторыми другими добавками представляют собой очень перспективный носитель для местного введения лекарственного средства, т.е. лецитиновый органогель (LO). LO являются термодинамически стабильными, прозрачными, вязкоупругими, биосовместимыми и изотропными гелями, состоящими из фосфолипидов (лецитин), соответствующего органического растворителя и полярного растворителя. Желеобразная фаза состоит из трехмерной сети переплетенных обратимых цилиндрических (полимероподобных) мицелл, которые иммобилизуют непрерывную или макроскопически внешнюю органическую фазу, превращая тем самым жидкость в гель. Образование трехмерной сети в органогеле является результатом перехода на уровне мицелл в обладающую низкой вязкостью ньютоновскую жидкость, которая состоит из лецитиновых обратимых мицелл, находящихся в неполярной органической жидкости. При добавлении воды из этого сферического обратимого мицеллярного состояния липидных агрегатов образуются удлиненные трубчатые мицеллы, которые затем переплетаются с образованием временной трехмерной сети в объеме раствора. Последняя служит для иммобилизации внешней органической фазы, в результате чего возникает гелевая форма или желеподобное состояние первоначально невязкого раствора. Поли(этиленгликоль), ПЭГ, представляет собой производное поли(этиленоксида), ПЭО, которое имеет дополнительные гидроксильные группы на каждом из концов молекулы. Главными свойствами,которые делают ПЭГ привлекательным в качестве полимера для применения в фармацевтических композициях, являются биосовместимость, гидрофильность и возможность многостороннего использования. Простой водорастворимый линейный полимер можно модифицировать путем химического взаимодействия с получением водонерастворимых, но обладающих способностью набухать в воде гидрогелей. Абсорбирующие полимеры, которые могут функционировать в качестве гидрогелей, можно получать, например, подвергая полимеры ковалентному перекрестному сшиванию или создавая ассоциированные полимеры, которые состоят из гидрофильных и гидрофобных компонентов ("эффективные" поперечные связи, представляющие собой водородные связи). Термореактивные гели содержат полимеры, которые являются жидкими при низкой температуре,но образуют обладающие большой вязкостью почти твердые имплантаты, если их помещают в область,находящуюся при температуре тела. Наиболее распространенными из этих обратимых термореактивных систем являются полоксамеры. Если их растворяют в концентрации, превышающей 20 мас.%, то растворы остаются жидкими при низких температурах, но будут образовывать обладающие большой вязкостью твердообразные имплантаты при повышении температуры (как правило, до уровня, составляющего примерно 15 С). Точную температуру гелеобразования можно изменять путем изменения содержания полоксамера или путем добавления других эксципиентов. Если в них находятся растворимые лекарственные средства, то последние высвобождаются путем диффузии через полимер. Полимерные имплантаты не остаются интактными в течение продолжительного периода времени. В областях, где имеется значительный поток жидкости (например, в подкожном пространстве), имплантаты могут сохраняться в течение периода времени вплоть до 12-24 ч. Полоксамеры не являются биоразложимыми, поскольку они представляют собой простые полиэфиры (блок-сополимеры полиоксиэтилена и полиоксипропилена). Они экскретируются интактными в мочу, так как представляют собой сравнительно низкомолекулярные полимеры (20 кДа). Они могут нести соразмерную лекарственную нагрузку, хотя им присуще имеющее существенное значение явление разрыва, особенно в случае гидрофильных лекарственных средств. Кинетический профиль для гидрофобных лекарственных средств имеет тенденцию к замедлению, преимущественно в результате изоляции лекарственного средства в гидрофобном ядре имплантата.-5 017264 К термореактивным гелям, которые являются биоразложимыми и обладают способностью к более медленному высвобождению, чем полоксамеры, относятся ПЛА-ПЭГ или трехблочные сополимеры ПЭГ-ПЛГА-ПЭГ. Как и в случае полоксамерных систем, они являются жидкими при низкой температуре. После введения они образуют полутвердый гель. Хитин представляет собой второй после целлюлозы наиболее распространенный в мире встречающийся в естественных условиях полимер. После деацетилирования из него получают биоматериал хитозан, из которого после гидролиза образуется олигосахарид с очень малой молекулярной массой. Хитозан является биосовместимым и обладает антибактериальными свойствами. Хитозан-глицеринфосфатный раствор обладает способностью образовывать обратимый термореактивный гель. И в этом случае также он является жидким при низких температурах и становится полутвердым при температуре тела после его введения. Эту систему можно применять, например, для введения гормона роста. Хитозан сохраняет способность растворяться в воде вплоть до значения рН 6,2. При любом рН, превышающем это значение,происходит нейтрализация заряда и осаждение полимера. Добавление фосфатов на основе сахара трансформирует хитозан в термообратимую гелевую систему для введения лекарственного средства. Помимо термообратимых гелей в композиции, предлагаемой в настоящем изобретении, можно применять другие реагирующие на стимулы полимеры, которые в значительной степени зависят от баланса полимер-полимер и взаимодействий полимер-растворитель при воздействии различных стимулов,включая изменения температуры, значения рН, ионной силы, концентрации растворителя, давления,сдвигового напряжения, интенсивности света, электрических или магнитных полей или комбинации указанных факторов. Примером обратимого зависящего от значения рН гидрогеля является водный раствор полимера поли(акриловой кислоты), который претерпевает опосредуемый значением рН фазовый переход при концентрации выше 0,1 мас.%. Чувствительный к стимулу гель можно получать также из расщепляемого ферментами полипептидного полимера. Полипептидные связи в полипептидном полимере более стабильны к гидролизу, чем,например, сложноэфирные связи в полимерной системе ПЭГ/ПЛГА, что обеспечивает также более высокую стабильность при хранении. Полипептидный носитель может включать также биоразложимый полимер, имеющий биоразложимый полипептидный блок, связанный с вторым полимерным блоком, в результате чего образуется привитой или линейный полимер. Примером полипептидного полимера является поли(аланин) и его производные. Полипептидный носитель может представлять собой также белковую матрицу, известную как фибрин. Фибриноген представляет собой встречающийся в естественных условиях белок, который при объединении с ферментом, представляющим собой тромбин, т.е. другой встречающийся в естественных условиях белок, образует биоматрицу, известную как фибрин. Можно применять также другие биосовместимые полимеры, включая крахмал, целлюлозы,желатины, плюроники, тетроники, где два последних представляют собой поли(этиленоксидные)/поли(пропиленоксидные) материалы. Другими материалами, которые можно применять, являются хондроитинсульфаты и общий класс мукополисахаридов (например, гликозаминогликаны) и другие биосовместимые полимеры, имеющие характеристики, близкие к характеристикам гиалуроновой кислоты. Лекарственное средство, содержащее композицию, предлагаемую в изобретении, предпочтительно приготавливают в виде препарата с пролонгированным высвобождением лекарственного средства, который высвобождает фармацевтическое(ие) действующее(ие) вещество(а) в течение периода времени от нескольких часов до нескольких недель. В первом варианте осуществления настоящего изобретения действующее(ие) вещество(а) образует(ют) ядро, окруженное инертным диффузионным барьером, состоящим из биосовместимого полимера. К таким системам относятся, например, мембраны, капсулы, микрокапсулы, липосомы и полые волокна. В этом случае высвобождение действующего вещества контролируется в основном диффузией. Во втором варианте осуществления изобретения композиция представляет собой раствор биосовместимого полимера, в котором действующее вещество растворено, эмульгировано или диспергировано. Как и в системах с использованием резервуара, диффузия действующих(его) веществ(а) через полимерную матрицу является ограничивающей скорость стадией, и скорости высвобождения зависят от выбора полимера и, следовательно его влияния на коэффициент диффузии и разделения действующего вещества, предназначенного для высвобождения. В другом варианте осуществления настоящего изобретения композиция представляет собой сетчатый полимерный гель, образующий макромолекулярную "клетку", в которой диспергировано действующее вещество. В альтернативном варианте композиция, предлагаемая в настоящем изобретении, может представлять собой сетчатый смешанный гель, состоящий из комбинации биосовместимых гидрофильных полимеров, в котором диспергировано действующее вещество. В следующем варианте осуществления изобретения композиция представляет собой сетчатый гель из биосовместимого полимера или сетчатый смешанный гель, состоящий по меньшей мере из двух гидрофильных полимеров, который содержит действующее вещество, ковалентно связанное с макромолекулами по меньшей мере одного из полимеров.-6 017264 Диапазон скоростей высвобождения фармацевтических соединений из гелей на основе полимеров можно увеличивать за счет образования таких поперечных связей, когда соседние цепи полимера связываются в результате образования ковалентных связей. Образовавшийся сетчатый полимер расщепляется медленнее и в результате этого дольше удерживает фармакологическое действующее вещество. В данной области хорошо известны различные сшивающие агенты и методы создания поперечных связей в биоразложимых материалах. Предпочтительно создание поперечных связей (сшивание) осуществляют таким образом, чтобы конечный сетчатый продукт, используемый в качестве средства для введения, был практически нетоксичным (например, путем термического сшивания, радиационного (с помощью гамма-лучей) сшивания, сшивания с помощью ультрафиолетового излучения, химического сшивания и т.д.) В целом, степень сшивания обратно пропорциональна степени набухания или абсорбции воды, сформированной полимерной структурой. Степень набухания или абсорбция воды регулирует скорость транспорта лекарственного средства полимерной структурой. Еще в одном варианте осуществления настоящего изобретения высвобождение действующего вещества из полимера контролируется химическим путем. Такой контроль можно обеспечивать с использованием поддающихся биоэрозии или концевых цепей. Биоэрозию полимера можно рассматривать как превращение продукта, который был нерастворим в воде, в продукт, растворимый в воде. В такой системе действующее вещество идеально равномерно распределяют в полимере. Когда окружающий действующее вещество полимер подвергается эрозии, то действующее вещество высвобождается. В системе,основанной на использовании концевых цепей, действующее вещество ковалентно связывают с полимером, и оно высвобождается при разрыве связи под действием воды или ферментов. В активируемых растворителем контролируемых системах действующее вещество растворяют или диспергируют в полимерной матрице, и оно не способно диффундировать через матрицу. В одном из типов контролируемых растворителем систем, когда окружающая жидкость, например вода, проникает в матрицу, полимер набухает и его температура стеклования понижается до уровня ниже температуры окружающей среды. Таким образом, набухший полимер переходит в эластичное состояние, что позволяет содержащемуся в нем лекарственному средству диффундировать через герметизирующее вещество. Другой метод расширения диапазона скоростей высвобождения ионных соединений заключается в том, что фармакологическое действующее вещество включают в гидрофобный несущий ионную пару комплекс, как описано в WO 1997/38698. В этом случае фармакологическое действующее вещество может присутствовать в составе гидрофобного несущего ионную пару комплекса с амфифильным веществом. Предпочтительными амфифильными соединениями для образования гидрофобного несущего ионную пару комплекса с арилциклоалкиламиновым действующим веществом являются додецилсульфат натрия (ДСН) и сульфосукцинат бис-(2-этилгексил)натрия (АОТ). Гидрофобный несущий ионную пару комплекс можно получать согласно методам, известным в данной области. Дополнительную информацию, касающуюся гидрофобного несущего ионную пару комплекса, можно найти в публикации РСТ WO 94/08599, опубликованной 28 апреля 1994 г., и находящейся в рассмотрении заявки на патент США, серийный номер 08/473008, зарегистрированной 6 июня 1995 г., содержание которых полностью включено в настоящее описание в качестве ссылки. Можно также объединять указанные выше варианты осуществления изобретения, обеспечивая контролируемое высвобождение действующего вещества, например, путем создания геля, содержащего микросферы. В этом случае высвобождение действующего вещества может контролироваться гелевой системой, а также микросферами, суспендированными в полимерной гелевой системе. Большинство из описанных выше систем на основе вязкого геля (например, гиалуронат) можно создавать таким образом, чтобы они удерживали суспендированные микросферы. Гель может обеспечивать тесный контакт с разделяющей тканевой структурой между средним и внутренним ухом и тем самым давать осуществляться транспорту действующих(его) веществ(а) через мембрану во внутреннее ухо с помощью микросфер. Скорости высвобождения действующего вещества очень сильно зависят от размера микросфер, содержащих действующее вещество, более крупные микросферы, как правило, высвобождают капсулированные соединения более медленно и в течение более продолжительных периодов времени. Для того чтобы достичь введения действующего вещества с постоянной скоростью, может оказаться полезным смешивать микросферы различных размеров для обеспечения постоянной скорости высвобождения в течение пролонгированного периода времени. Кроме того, гель, содержащий микросферы, может содержать также субстанции, повышающие проницаемость мембраны, вследствие чего микросферы могут более легко проникать через мембрану. Различные описанные выше системы, пригодные для контролируемого высвобождения действующего вещества, можно включать также в имплантат, который можно помещать, например, на мембрану окна улитки и который обеспечивает введение действующего вещества контролируемым образом. В одном из вариантов осуществления изобретения имплантат состоит практически из среды, представляющей собой носитель, объединенной с действующим веществом. Среда-носитель может представлять собой биосовместимый полимер, который может быть биоразложимым или не являться таковым,или комбинацию биосовместимых полимеров, которые могут быть соединены поперечными связями. Эту композицию можно приготавливать таким образом, чтобы ее можно было вводить путем инъекции,-7 017264 и ее вязкость может изменяться, например она может переходить из жидкого в состояние с большой вязкостью или твердое состояние после введения в среднее ухо, что характерно для описанных выше термореактивных гелей, например полоксамеров. Высвобождение действующего вещества, содержащегося в среде-носителе, может происходить с помощью диффузии, сопротивления растворителя, электродиффузии, осмоса, активного/пассивного транспорта или их комбинации. В другом варианте осуществления изобретения имплантат может содержать ядро и по меньшей мере одну мембрану, покрывающую ядро. Ядро может содержать композицию, состоящую из действующих(его) веществ(а), растворенных(ого) или диспергированных(ого) в биосовместимом(ых) полимере(ах). Мембрана может состоять из такой же полимерной композиции, что и ядро, или другой композиции, или эластомерной композиции. В таком имплантате скорость высвобождения действующего вещества контролируется свойствами ядра и необязательно свойствами мембран(ы). Так, скорость(и) высвобождения действующих веществ может контролироваться либо только ядром, либо только мембраной,либо мембраной в сочетании с ядром. Можно также, чтобы скорость высвобождения в основном контролировалась ядром, а мембрана осуществляла только конечный контроль скорости высвобождения. Если мембрана, покрывающая ядро, состоит из двух или большего количества слоев, то составы полимера или эластомера, применяемые для каждого слоя, могут быть одинаковыми или различными. Использование комбинации слоев мембраны, различающихся либо толщиной, либо материалом, либо ими обоими, дает дополнительную возможность контролировать скорость высвобождения действующих(его) веществ(а). Если имплантат содержит более одного фармацевтического действующего вещества, то ядро может представлять собой один элемент, который содержит различные действующие вещества, растворенные или диспергированные в одной и той же полимерной композиции. В другом варианте осуществления изобретения ядро состоит по меньшей мере из двух частей, где каждая часть содержит по меньшей мере одно фармацевтическое действующее вещество. Полимерные композиции различных частей ядра можно выбирать в зависимости от требуемых скоростей высвобождения различных действующих веществ, и они в каждой части могут быть одинаковыми или различными. Различные части ядра могут быть расположены либо одна рядом с другой, либо таким образом, что одна часть заключает в себе по меньшей мере частично, другую часть ядра. Различные части ядра могут быть пространственно отделены друг от друга и/или могут быть разделены разделяющей мембраной. Разделяющие мембраны могут быть проницаемыми или непроницаемыми по меньшей мере для одного из фармацевтических действующих веществ. Можно также использовать мембрану, которая является проницаемой для первого действующего вещества, но непроницаемой для второго действующего вещества. В качестве материалов для мембран(ы) имплантата можно применять, например, эластомеры на основе силоксана, представляющие собой эластомеры, состоящие из поли(двузамещенных силоксанов), в которых заместители в основном представляют собой замещенные или незамещенные (низш.)алкильные или фенильные группы. Широко применяемым и предпочтительным полимером такого типа является поли(диметилсилоксан). Можно применять также мембраны из сополимера этилена-винилацетата, которые функционируют в качестве ограничивающего скорость барьера для диффузии действующего вещества. Кинетические характеристики фармакологического действующего вещества определяются не только высвобождением из композиции, но возможно даже в большей мере степенью проницаемости разделяющей тканевой структуры между средним и внутренним ухом. Поэтому фармацевтические композиции, предлагаемые в настоящем изобретении, предпочтительно содержат субстанции, повышающие проницаемость разделяющей тканевой структуры между средним и внутренним ухом таким образом, чтобы фармакологическое действующее вещество могло диффундировать во внутреннее ухо в течение определенного периода времени в больших количествах или более быстро в определенном количестве или чтобы во внутреннее ухо могли проникать более крупные молекулы. Однако такое улучшенное проникновение должно быть достигнуто без нарушения осмотического баланса между перилимфой внутреннего уха и барабанной полостью среднего уха и без индукции токсичности в улитке. Особое внимание необходимо уделять потенциальной ототоксичности, обусловленной усиливающими проницаемость субстанциями, которые сами могут проникать через окно улитки и оказывать цитотоксическое действие во внутреннем ухе. Известно, например, что стрептолизин значительно увеличивает проницаемость окна улитки, но это сопровождается цитотоксичностью. Примером субстанции, увеличивающей проницаемость разделяющей тканевой структуры между средним и внутренним ухом, является гистамин. Установлено, что гиалуроновая кислота также увеличивает проницаемость разделяющей тканевой структуры между средним и внутренним ухом, не вызывая при этом ототоксичности, и поэтому ее предпочтительно применяют в качестве биосовместимого полимера в композиции, предлагаемой в настоящем изобретении.-8 017264 Кроме того, композиция, предлагаемая в настоящем изобретении, может содержать одно или несколько других фармакологических действующих веществ. Ушные композиции, предлагаемые в настоящем изобретении, могут содержать различные ингредиенты, в том числе другие биологически активные агенты, такие как антибиотики, например фторхинолоны, противовоспалительные агенты, например стероиды, кортизон, аналгетики, антипирин, бензокаин, прокаин, антиоксиданты, например метионин,N-ацетилцистеин, тролокс, нейротрофины, например GDNF или BDNF, противоапоптозные или противонекрозные агенты, например леупептин, ингибиторы каспазы и т.д. Фармацевтические композиции, предлагаемые в настоящем изобретении, которые можно применять для местного введения во внутреннее ухо, содержат в терапевтически эффективном количестве действующее(ие) вещество(а) и при необходимости другие компоненты, такие как неорганические или органические твердые или жидкие фармацевтически приемлемые носители или наполнители, буферы, эксципиенты и добавки. Пригодные для местного введения наполнители представляют собой органические или неорганические субстанции, которые являются фармацевтически приемлемыми и которые не вступают во взаимодействие с действующими веществами, например физиологический раствор, спирты, растительные масла, бензиловые спирты, алкиленгликоли, полиэтиленгликоли, триацетат глицерина, желатин, углеводы,такие как лактоза или крахмал, стеарат магния, тальк и вазелин. Указанные препараты могут быть стерилизованными и/или могут содержать вспомогательные субстанции, такие как замасливатели, консерванты, такие как тиомерсал (например, в концентрации 50%), стабилизаторы и/или смачивающие агенты,эмульгаторы, соли для изменения осмотического давления, буферные субстанции, красители и/или ароматизаторы. Предпочтительно выбирают такие эксципиенты для местного введения, которые не повышают поступление агента в системный кровоток или центральную нервную систему после введения в ухо. Например, в целом предпочтительно, чтобы эксципиент для местного введения не обладал значительными закупоривающими свойствами, которые усиливают чрескожный перенос через слизистую оболочку в системный кровоток. К таким обладающим закупоривающими свойствами наполнителям относятся углеводородные основания, безводные абсорбирующие основания, такие как гидрофильный вазелин и безводный ланолин (например, аквафор (Aquaphor, и основания, образующие эмульсию типа вода в масле,такие как ланолин и кольдкрем. Более предпочтительными являются наполнители, которые практически не обладают закупоривающими свойствами, в целом к ним относятся наполнители, которые являются водорастворимыми, такие как основания, образующие эмульсию типа масло в воде (кремы или гидрофильные мази) и водорастворимые основания, такие как наполнители на основе полиэтиленгликоля и водные растворы, образующие гели с различными агентами, такими как метилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилметилцеллюлоза (например, K Y Gel). Специалисты в данной области могут общепринятым методом и, прежде всего, с использованием одного из многочисленных стандартных руководств в данной области, таких как Remington'sPharmaceutical Sciences, vol. 18, Mack Publishing Co., Easton, PA (1990), прежде всего ch. 87, выбрать для конкретного применения пригодные эксципиенты и наполнители для местного введения. Например, биологически активные агенты, предлагаемые в настоящем изобретении, можно объединять с усиливающими агентами, которые усиливают проникающую способность агента. Фармацевтическую композицию, содержащую действующее(ие) вещество(а), биосовместимый(е) полимер(ы) и при необходимости адъюванты, например консерванты, стабилизаторы, смачивающие агенты, эмульгаторы, сшивающие агенты, можно приготавливать любым из методов, хорошо известных в данной области, например с помощью общепринятых методов смешения, грануляции, конфекционирования, растворения или лиофилизации. Композицию можно применять для приготовления лекарственного средства, предназначенного для лечения заболеваний внутреннего уха. Примерами таких применений являются лечение шума в ушах,потери слуха, воспаления или инфекции внутреннего уха, аутоиммунного нарушения уха, головокружения, болезни Меньера, дегенерации клеток внутреннего уха или связанной с возрастом дегенерации клеток внутреннего уха. Введение композиции или лекарственного средства, предлагаемого в изобретении, млекопитающему, страдающему заболеванием внутреннего уха, можно осуществлять с помощью различных методов введения. Предпочтительно введение осуществляют, помещая композицию или лекарственное средство в среднее ухо. Лекарственное средство, соответственно имплантат, предпочтительно можно вводить путем инфузии, инъекции или размещая его с помощью хирургического инструмента. Такие методы включают применение устройств или носителей лекарственного средства для транспорта и/или введения препарата направленным образом к разделяющим тканевым структурам между средним и внутренним ухом, где он диффундирует во внутреннее ухо или где осуществляют его активную инфузию. Примерами могут служить ушные турунды (см., например, US 6120484 на имя Silverstein),катетеры для окна улитки (см., например, US 5421818; 5474529; 5476446; 6045528, все на имя Arenberg,или US 6377849 и его разделение 2002/0082554 на имя Lenarz), микроимплантаты (см., например,WO 2004/064912 на имя Jukarainen et al.) или устройства, которые вводят в канал улитки лабиринта внут-9 017264 реннего уха или иную часть улитки (см., например US 6309410 на имя Kuzma). Они включают также применение интратимпанической инъекции, когда препарат вводят путем инъекции в среднее ухо через являющуюся мишенью область разделяющей тканевой структуры между средним и внутренним ухом,такую как ниша окна улитки (см., например, Light J. и Silverstein H., Current Opinion in OtolaryngologyHead and Neck Surgery (12), 2004, p. 378-383). Инъекцию можно осуществлять непосредственно через барабанную перепонку с помощью вентиляционной трубки, вставленной в барабанную перепонку, или через отверстие в барабанной перепонке (например, с помощью тимпаномеатального лоскута). Объем препарата, предназначенного для инъекции, как правило, составляет от 200 до 500 мкл. Препараты, которые нельзя вводить путем инъекции или инфузии с использованием вышеуказанных средств, можно наносить на разделяющую тканевую структуру между средним и внутренним ухом,являющуюся мишенью, через небольшое отверстие в барабанной перепонке с помощью хирургического инструмента. Препарат можно вводить до, в процессе развития или после возникновения нарушения внутреннего уха. Предназначенное для введения количество может варьироваться в зависимости от метода введения,продолжительности лечения, состояния индивидуума, подлежащего лечению, серьезности нарушения внутреннего уха, при этом окончательное решение должно приниматься штатным врачом. Продолжительность лечения может составлять от примерно 1 ч до нескольких дней, недель и месяцев, и оно может превратиться в постоянное лечение. В случае продолжительного лечения может потребоваться введение повторных доз препарата. Терапевтически эффективные количества подлежащего введению соединения могут составлять от примерно 0,1 нг/ч до примерно 100 мкг/ч. Терапевтически эффективную дозу определяют как количество, достаточное для подавления или уменьшения нарушения внутреннего уха у подвергающегося лечению индивидуума. Терапевтически эффективная доза представляет собой также количество, эффективное для подавления или уменьшения нарушения внутреннего уха у пораженного болезнью индивидуума. Как указано выше, терапевтически эффективная доза может варьироваться в зависимости от выбора конкретного соединения, конкретного состояния, подлежащего лечению, и метода введения рассматриваемого соединения. Например, более низкая доза аналога кетамина, обладающего более высокой аффинностью к связыванию, может быть более эффективной, чем доза кетамина, обладающего более низкой аффинностью к связыванию. Поэтому предпочтительными являются арилциклоалкиламины, обладающие более высокой аффинностью к связыванию. Продолжительность лечения также может варьироваться в зависимости от конкретной формы нарушения внутреннего уха, для которого требуется лечение, а именно острой, подострой или хронической. Можно руководствоваться тем соображением, что более кратковременное лечение является предпочтительным в том случае, если не происходит рецидива нарушения внутреннего уха после прекращения лечения. Более продолжительное лечение можно применять для индивидуума, у которого сохраняется нарушение внутреннего уха после кратковременного лечения. Ниже изобретение более подробно пояснено на примерах и прилагаемых чертежах, которые не ограничивают объем настоящего изобретения. На фиг. 1 представлены данные о кумулятивном высвобождении S-(+)-кетамина из гелевых композиций на основе 5- и 7,5%-ной гиалуроновой кислоты (НА) в фосфатный буферный раствор в зависимости от времени.(А) Кетамин быстро высвобождается из геля в отсутствие ограничивающей скорость мембраны; всего лишь через 1 ч концентрация уже достигает почти 50% общего уровня кумулятивной концентрации в ЗФР. Концентрация гиалуроновой кислоты оказывает слабое влияние на скорость высвобождения.(Б) При использовании ячейки Франца с диализирующей мембраной для имитации мембраны окна улитки происходит существенное замедление высвобождения кетамина в ЗФР, которое в этом случае занимает примерно три дня. По-видимому, скорость высвобождения сильно замедляется при повышении концентрации гиалуроновой кислоты.(В) При использовании в ячейке Франца фильтрующей мембраны высвобождение кетамина продлевается до примерно 60 ч, причем при более высокой концентрации гиалуроновой кислоты в геле высвобождение происходит более медленно, чем при более низкой концентрации. На фиг. 2 представлены данные о концентрации S-(+)-кетамина в перилимфе после высвобождения из препарата на основе 2,8%-ной гиалуроновой кислоты, который был помещен в нишу окна улитки морских свинок и затем диффундировал через мембрану окна улитки во внутреннее ухо. Образцы перилимфы для определения концентрации кетамина брали через 1 ч (1 Н), 3 ч (3 Н), 8 ч (8 Н), 24 ч (24 Н) и 3 дня(3D). На фиг. 3 представлены данные о концентрации S-(+)-кетамина в перилимфе после высвобождения либо из препарата на основе 0,7%-ной гиалуроновой кислоты, либо из препарата на основе 20%-ного полоксамера, которые были инъецированы в нишу окна улитки морских свинок и затем диффундировали через мембрану окна улитки во внутреннее ухо. Образцы перилимфы для определения концентраций кетамина брали через 3 и 48 ч после введения.- 10017264 Пример 1. Методы и материалы. Высвобождение кетамина, представляющего собой антагонист рецептора NMDA, который, как было установлено ранее, обладает эффективностью в отношении лечения кохлеарного шума в ушах, из препарата на основе геля гиалуроновой кислоты оценивали с помощью двухстадийного подхода. На первой стадии проводили эксперименты in vitro для оценки кинетики высвобождения препарата. Затем полученные результаты использовали в качестве отправной точки в исследованиях in vivo на животных. Исследования in vitro. Приготавливали раствор гиалуроновой кислоты (Hylumed, фирма Genzyme Corp.) в забуференном фосфатом соляном растворе (ЗФР) с концентрациями 5 и 7,5%. Было установлено, что при концентрации 8% манипуляции с гелем затруднены вследствие его высокой вязкости. Гидрохлорид S-(+)-кетамина(фирма Sigma-Aldrich) растворяли в концентрации 2 мас.%, что эквивалентно 73 мМ. Для оценки важности фактора лекарственной загрузки тестировали также концентрации 0,5 и 2,5%. Высвобождение фармакологического действующего вещества измеряли в ЗФР, представляющем собой обычную накопительную жидкость для исследований по контролируемому высвобождению, либо без какой-либо мембраны, либо с использованием фильтрационной мембраны или диализирующей мембраны (Spectropore) в ячейке Франца (фирма PermeGear). Мембраны применяли для имитации ограничивающей скорость мембраны окна улитки. Температуру жидкости поддерживали на постоянном уровне, соответствующем температуре тела. Нижнюю камеру ячейки Франца заполняли 5 мл ЗФР в качестве накопительной жидкости. В накопительной жидкости находился стержень для непрерывного перемешивания. Верхнюю камеру заполняли примерно 50 мг геля и собирали ячейку. В различные моменты времени брали аликвоты (как правило, по 1 мл) и анализировали с помощью УФ-спектрометрии (устройство типа Agilent 8453). Измеряли абсорбцию при 215 нм и рассчитывали концентрацию с использованием коэффициента экстинкции,равного 30 мл/мгсм. Поскольку объем аликвоты был известен, то можно было определять общее высвободившееся количество. Каждый раз после отбора аликвоты в камеру ячейки Франца возвращали такой же объем ЗФР. Исследования in vivo. На основе полученных в опытах in vitro результатов тестировали различные концентрации гиалуроновой кислоты (Hylumed Medical, молекулярная масса 2,4 миллиона, фирма Genzyme Corp.) в отношении ее сохранения в нише окна улитки и потенциального воздействия на слух в результате интерференции со свободным перемещением мембраны окна улитки. Слуховые пороги оценивали на пигментированных морских свинках путем измерения потенциала действия соединения (САР) слухового нерва с помощью электрода, имплантированного в мембрану окна улитки животных (с использованием для сравнения электрода (референс-электрод), помещенного в затылочную мышцу). Референс-электрод и электрод, имплантированный в окно улитки, припаивали к вилке, закрепленной на черепе. Для этой цели и для введения 2 мкл гелевого препарата в нишу окна улитки открывали буллу у анестезированного животного с помощью хирургической процедуры на задней части ушной раковины (дорсальный подход). Затем буллу снова закрывали с помощью зубного цемента (Texton, фирма SS White Manufacturing), раны дезинфицировали раствором бетадина и зашивали. На первой стадии приготавливали гель в концентрации 5% в искусственной перилимфе, который тестировали ранее в опытах in vitro, и помещали на кончике предварительно стерилизованного хирургического инструмента в нишу окна улитки морской свинки. Присутствие геля в нише оценивали визуально, т.е. оценивали, вытекает ли гель или остается на месте. САР измеряли непосредственно перед введением геля и затем еще раз после введения. Поскольку вязкость геля оказалась слишком высокой и были выявлены кратковременные влияния на слуховой порог, то после этого осуществляли понижающее титрование концентрации геля (3,5%, 3,2%) до конечной концентрации 2,8%, т.е. уровня, при котором гель можно было легко помещать в нишу окна улитки, он хорошо удерживался на месте и при этом не наблюдалось потери слуха. Для тестирования использовали по одному животному для каждой концентрации. На второй стадии осуществляли фармакокинетическое исследование на пигментированных морских свинках для оценки in vivo диффузии кетамина из препарата на основе геля гиалуроновой кислоты через мембрану окна улитки во внутреннее ухо. В общей сложности для оценки концентраций фармацевтического соединения в перилимфе через 1, 3, 8, 24 и 72 ч после введения геля использовали 30 животных; для каждого момента времени проводили опыты на 6 животных. Животных анестезировали путем однократной i.р.-инъекции 6%-ного пенобарбитала из расчета 0,3 мл/кг (Ceva sante animale) и вскрывали правую ушную буллу путем хирургической процедуры на задней части ушной раковины (дорсальный подход). Затем на мембрану окна улитки внутреннего уха помещали 2 мкл препарата на основе геля гиалуроновой кислоты (2,8% Hylumed Sterile в искусственной перилимфе, молекулярная масса 2,44 миллиона; фирма Genzyme Corp.), содержащего S-(+)-кетамин(фирма Sigma-Aldrich) в концентрации 1 мМ. В каждый из перечисленных выше моментов времени животных в одной группе обезглавливали под глубокой анестезией (пентобарбитал, 50 мг/кг). Из височной кости удаляли правую улитку и вскрывали буллу. После этого путем кохлеостомии просверливали не- 11017264 большое отверстие (диаметром 0,2 мм) в основании улитки. Через отверстие с помощью стерильной стеклянной микропипетки (диаметр кончика 0,1 мм), соединенной с помощью стерильного катетера со стерильным микрошприцем, брали образец перилимфы объемом 10 мкл. Затем образцы анализировали с помощью жидкостной хроматографии/масс-спектрометрии с пределом количественной оценки 0,2 нг/млApplied Biosystems; колонка: Zorbax SB CN 502,1 мм, 5 мкм-Agilent technologies). Результаты. Исследования in vitro. Как видно из данных, представленных на фиг. 1, гель на основе гиалуроновой кислоты высвобождает кетамин сравнительно быстро, т.е. в течение всего лишь нескольких часов. Кинетика высвобождения существенно изменяется, когда используют ограничивающую скорость мембрану, в этом случае высвобождение растягивается на несколько дней. При более высокой концентрации гиалуроновой кислоты,составляющей 7,5%, препарат на основе геля на основе гиалуроновой кислоты высвобождает кетамин более медленно, чем при концентрации 5%. Лекарственная загрузка также оказывает существенное влияние на кинетику высвобождения. Когда гель содержал 0,5 мас.% кетамина, то фармацевтическое соединение высвобождалось в ячейку Франца,снабженную фильтрационной мембраной, почти так же быстро, как и в случае простого раствора гидрохлорида кетамина. Только после увеличения коэффициента загрузки до 2,5% кинетика высвобождения заметно замедлялась. Начальное выделение было довольно низким, в течение первого часа высвобождалось всего лишь примерно 20%. Таким образом, по-видимому, применение максимально возможного коэффициента загрузки должно удлинять период высвобождения. Исследования in vivo. Как видно из данных, представленных на фиг. 2, максимальная концентрация кетамина в перилимфе внутреннего уха после диффузии через мембрану окна улитки из геля на основе 2,8%-ной гиалуроновой кислоты достигалась в течение 1 ч. Затем концентрации быстро снижались, при этом последние обнаруживаемые уровни были выявлены через три дня. На основе этих результатов можно сделать несколько интересных выводов. 1. Гелевый препарат обладает способностью высвобождать кетамин во внутреннее ухо в течение трех дней - несмотря на намного более низкую концентрацию гиалуроновой кислоты (2,8 по сравнению с 5%, соответственно 7,5%) и лекарственную загрузку, которая была примерно в 73 раза меньше (0,027% по сравнению с концентрациями, составляющими вплоть до 2,5 мас.%), чем в экспериментах in vitro. Таким образом, он представляет собой привлекательный тип препарата для лечения нарушений внутреннего уха. 2. Измеренные концентрации кетамина в перилимфе являются очень низкими по сравнению с исходной концентрацией фармакологического действующего вещества в геле. Это может быть обусловлено потерей кетамина в среднем ухе, абсорбцией в слизистой оболочке, невозможностью проникновения большего количества фармацевтического соединения в перилимфу путем пассивного процесса диффузии или быстрым клиренсом лекарственного средства из перилимфы. Кроме того, методика отбора образцов приводит к занижению уровня измеряемых концентраций, поскольку для получения даже минимальных количеств необходимо вытягивать перилимфу также из тех областей внутреннего уха, в которые фармацевтическое соединение, по-видимому, не поступило. Т.е. в этом случае имеет место "разбавление" концентраций. В данной области хорошо известно, что концентрации фармакологических соединений в улитке максимальны в области ее основания, намного ниже в среднем завитке и практически отсутствуют в апикальной области и за ее пределами (лестница преддверия). 3. Принимая во внимание многочисленные параметры, которые могут оказывать влияние на кинетику высвобождения из гелевого препарата, помещенного в нишу окна улитки, и диффузию через нишу окна улитки, следует признать, что модели in vitro обладают очень ограниченной способностью в отношении оценки того, проникает ли фармакологическое действующее вещество, предназначенное для лечения нарушения внутреннего уха, во внутреннее ухо и каким образом это происходит. Таким образом,по-видимому, для этой цели необходимо использовать модель in vivo. Пример 2. В то время как в проведенных ранее экспериментах исследовалась кинетика высвобождения кетамина из обладающих сравнительно высокой вязкостью гелевых препаратов, которые нельзя инъецировать в среднее ухо, затем при создании изобретения были проведены оценки двух гелевых препаратов,которые можно вводить путем инъекции, что обладает преимуществом с точки зрения простоты применения. Методы и материалы. Пигментированным морским свинкам (всего в опыте использовали 16 животных) вводили с помощью 1 мл шприца, соединенного с иглой, по 100 мкл гелевого препарата на основе либо гиалуроновой кислоты (Hylumed Sterile, фирма Genzyme Corp.), либо полоксамера (Lutrol F127, фирма BASF), содержащего гидрохлорид S-(+)-кетамина (фирма Cristalia). Половине животных вводили гель на основе 0,5%ной гиалуроновой кислоты, приготовленный в забуференном фосфатом растворе с рН 7,4, который полу- 12017264 чали согласно требованиям Европейской Фармакопеи (ref. 4005000). Кетамин растворяли в геле до концентрации 1 мМ с помощью магнитной мешалки в течение ночи при 4 С. Оставшейся половине животных вводили гель на основе 20%-ного полоксамера также через 1 мл шприц, соединенный с иглой. Гель приготавливали путем медленного добавления 600 мг порошкообразного Lutrol к 3 мл такого же забуференного фосфатом раствора с использованием магнитной мешалки (500 об/мин). Затем процесс смешения продолжали в течение 16 ч до получения прозрачного раствора, имеющего минимальную вязкость. Как и в случае геля на основе гиалуроновой кислоты, кетамин растворяли в растворе полоксамера до концентрации 1 мМ с помощью магнитной мешалки в течение ночи. Сразу после контакта с тканью среднего уха морских свинок происходило застудневание полоксамера, и он становился почти твердым. Для осуществления инъекции гелевых препаратов морских свинок анестезировали путем однократной i.р.-инъекции 6%-ного пенобарбитала из расчета 0,3 мл/кг (Ceva sante animale) и вскрывали правую ушную буллу путем хирургической процедуры на задней части ушной раковины (дорсальный подход). Затем буллу снова закрывали с помощью зубного цемента (Texton, фирма SS White Manufacturing), раны дезинфицировали раствором бетадина и зашивали. Через 3 ч животных в каждой группе, обработанной гелевым препаратом, обезглавливали под глубокой анестезией (пентобарбитал, 50 мг/кг) для взятия образцов перилимфы, остальных животных умерщвляли через 48 ч. Из височной кости удаляли правую улитку и вскрывали буллу. После этого путем кохлеостомии просверливали небольшое отверстие (диаметром 0,2 мм) в основании улитки. Через отверстие с помощью стерильной стеклянной микропипетки(диаметр кончика 0,1 мм), соединенной с помощью стерильного катетера со стерильным микрошприцем,брали образец перилимфы объемом 10 мкл. Затем образцы анализировали с помощью жидкостной хроматографии/масс-спектрометрии с пределом количественной оценки 0,2 нг/мл (устройство для ЖХВР:Perkin Elmer, серия 200; масс-спектрометрический детектор: MSD Sciex API 4000 Applied Biosystems; колонка: Zorbax SB CN 502,1 мм, 5 мкм-Agilent technologies). Результаты. Как продемонстрировано на фиг. 3, применение менее вязкого препарата на основе гиалуроновой кислоты не приводило к существенному изменению концентрации в перилимфе через 3 и 48 ч после введения. Это свидетельствует о том, что при использовании инъецируемого препарата достигается сходная концентрация во внутреннем ухе. Кроме того, на фиг. 3 показано, что полоксамеры обеспечивают эффективное проникновение через мембрану окна улитки, при этом концентрация в перилимфе через 3 ч более чем в два раза превышала концентрацию, достигаемую при использовании гиалуроновой кислоты. Это может быть обусловлено различной кинетикой высвобождения или тем фактом, что затвердевание геля в нише окна улитки, приводящее к его фиксации в определенном месте, обеспечивает лучший контакт с мембраной окна улитки. Через 3 ч части намного более жидкого препарата на основе гиалуроновой кислоты уже могли вытекать из ниши окна улитки, соответственно даже из пространства среднего уха, в глотку. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение композиции, включающей арилциклоалкиламин или его фармацевтически приемлемую соль, где арилциклоалкиламин является антагонистом рецептора NMDA, и биосовместимый полимер или комбинацию биосовместимых полимеров, для получения лекарственного препарата в форме геля для лечения нарушения внутреннего уха путем нанесения на тканевую структуру между средним и внутренним ухом. 2. Применение композиции по п.1, где препарат представляет собой термореактивный гель. 3. Применение композиции по одному из предыдущих пп.1, 2, в которой биосовместимый полимер выбран из группы, включающей встречающиеся в естественных условиях полисахариды или синтетические полимеры или их смесь. 4. Применение композиции по п.3, в которой биосовместимый полимер выбран из блоксополимеров. 5. Применение композиции по п.3 или 4, в которой биосовместимый полимер выбран из группы,включающей гиалуроновую кислоту, лецитиновые гели, (поли)аланиновые производные, плюроники,поли(этилен)гликоль, полоксамер, хитозан, ксилоглюкан, коллаген, фибрин или их смесь. 6. Применение композиции по одному из предыдущих пп.3-5, в которой биосовместимый полимер является биоразлагаемым. 7. Применение композиции по любому из пп.1-6, в которой арилциклоалкиламин имеет общую формулу I в которой R1, R2, R3, R4, R5, R6 и R7 обозначают H, Cl, F, I, CH3, CH2CH3, NH2, OH, CONH2, COCl или СООН. 8. Применение композиции по одному из предыдущих пп.1-7, в которой фармацевтическое действующее вещество представляет собой 2-(2-хлорфенил)-2-(метиламино)циклогексанон (кетамин), предпочтительно (S)-кетамин. 9. Применение композиции по одному из предыдущих пп.1-8, которая дополнительно содержит компоненты, выбранные из группы, включающей фармацевтически приемлемые наполнители, буферы,эксципиенты, добавки и субстанции, повышающие проницаемость разделяющей тканевой структуры между средним и внутренним ухом. 10. Применение композиции по п.9, в которой повышающая проницаемость субстанция представляет собой гистамин. 11. Применение композиции по любому из пп.1-10, где лекарственный препарат представляет собой препарат с пролонгированным высвобождением. 12. Применение композиции по п.11, при котором лекарственный препарат представляет собой препарат с пролонгированным высвобождением действующего вещества, причем оно высвобождается в течение периода времени, составляющего от нескольких часов до нескольких недель. 13. Применение композиции по любому из пп.1-12, где лекарственный препарат предназначен для направленного высвобождения действующего вещества на выбранной разделяющей тканевой структуре между средним и внутренним ухом с использованием биоадгезии или механических свойств. 14. Применение композиции по любому из пп.1-4, где лекарственный препарат представляет собой имплантат. 15. Применение композиции по любому из пп.1-14 для лечения шума в ушах, потери слуха, воспалений или инфекций внутреннего уха, аутоиммунных нарушений, головокружения или болезни Меньера. 16. Применение композиции по любому из пп.1-14 для приготовления лекарственного препарата,предназначенного для лечения индуцированной экситотоксичностью дегенерации клеток внутреннего уха или связанной с возрастом дегенерации клеток внутреннего уха. 17. Применение композиции по любому из пп.1-14, где лекарственный препарат вводят млекопитающему, страдающему заболеванием внутреннего уха. 18. Применение композиции по п.1, где лекарственный препарат вводят путем инфузии, инъекции или с помощью хирургического инструмента.- 14017264 Высвобождение in vitro кетамина из гелевого препарата на основе гиалуроновой кислоты Фиг. 1 Высвобождение кетамина, входящего в состав препарата на основе гиалуроновой кислоты, через мембрану окна улитки в перилимфу улитки- 15017264 Высвобождение кетамина, входящего в состав препаратов на основе гиалуроновой кислоты или полоксамера,через мембрану окна улитки в перилимфу улитки
МПК / Метки
МПК: A61P 27/16, A61K 9/00, A61K 31/137
Метки: нарушения, уха, арилциклоалкиламида, лекарственного, лечения, композиции, получения, применение, внутреннего, препарата
Код ссылки
<a href="https://eas.patents.su/17-17264-primenenie-kompozicii-arilcikloalkilamida-dlya-polucheniya-lekarstvennogo-preparata-dlya-lecheniya-narusheniya-vnutrennego-uha.html" rel="bookmark" title="База патентов Евразийского Союза">Применение композиции арилциклоалкиламида для получения лекарственного препарата для лечения нарушения внутреннего уха</a>
Предыдущий патент: Центробежный очиститель жидкости
Следующий патент: Применение антитела imc-a12, которое является ингибитором igf-ir, для лечения рака предстательной железы
Случайный патент: Система и способ алкилирования углеводорода