Кучное выщелачивание с применением хлоридов
Формула / Реферат
1. Гидрометаллургический способ кучного извлечения меди из материала, содержащего сульфидный медный минерал, причем указанный способ включает операции
выщелачивания указанного материала в кислом хлоридном растворе или смешанном хлоридно-сульфатном растворе в присутствии растворенного кислорода и ионов меди(II) в качестве окислителей,
поддерживания значения поверхностного потенциала указанного минерала менее 600 мВ (относительно н.в.э.) с тем, чтобы вызвать растворение сульфида меди и
извлечения меди из раствора.
2. Способ по п.1, отличающийся тем, что значение потенциала поддерживают в диапазоне от 550 до 600 мВ (относительно н.в.э.).
3. Способ по п.2, отличающийся тем, что значение потенциала выбирают в зависимости от концентрации хлорида.
4. Способ по пп.1, 2 или 3, отличающийся тем, что материалом, содержащим сульфидный медный минерал, является бедная руда переходного типа или бедная первичная руда.
5. Способ по пп.1, 2 или 3, отличающийся тем, что материалом, содержащим сульфид меди, является бедная вторичная руда.
6. Способ по любому из пп.1-5, отличающийся тем, что значение рН указанного раствора составляет менее 3.
7. Способ по п.6, отличающийся тем, что значение рН указанного раствора находится в диапазоне от 1 до 2.
8. Способ по любому из пп.1-7, включающий операцию регулирования рН раствора путем добавления H2SO4, HCl или HNO3.
9. Способ по любому из пп.1-8, отличающийся тем, что содержание растворенного кислорода составляет более 1 млн-1.
10. Способ по любому из пп.1-9, отличающийся тем, что концентрацию хлорида поддерживают на уровне от 5 до 100 г/дм3.
11. Способ по любому из пп.1-10, отличающийся тем, что концентрацию хлорида регулируют путем добавления по меньшей мере одного из следующих агентов: HCl, NaCl, MgCl2, минерализованной воды, морской воды или хлоридсодержащей технологической воды.
12. Способ по любому из пп.1-11, включающий операцию регулирования соотношения Cu(II) и Cu(I) в выщелачивающем растворе.
13. Способ по любому из пп.1-12, отличающийся тем, что сульфидный медный минерал представляет собой по меньшей мере один из следующих минералов: борнит, халькозин, халькопирит, ковеллин и энаргит.
Текст
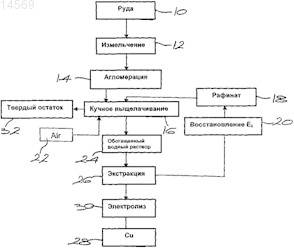
В настоящем изобретении предложен способ кучного выщелачивания с применением хлоридов для извлечения меди из первичного медного сульфидного минерала, при этом указанный минерал подвергают выщелачиванию в кислом хлоридном растворе или смешанном хлоридносульфатном растворе в присутствии кислорода при значении поверхностного потенциала минерала менее 600 мВ (относительно н.в.э.) для перевода сульфида меди в раствор.(71)(73) Заявитель и патентовладелец: БИ ЭЙЧ ПИ БИЛЛИТОН СА ЛИМИТЕД 014569 Уровень техники Настоящее изобретение относится к гидрометаллургическому способу извлечения меди из сульфидных медных минералов, таких как борнит, халькозин, халькопирит, ковеллин и энаргит. Халькопирит является одним из сульфидных медных минералов, труднее всего поддающихся выщелачиванию при низкой температуре в системах на основе кислого хлорида железа(III) и сульфата железа(III). Об этом свидетельствует, например, низкая скорость протекания реакции выщелачивания минерала, которая снижается со временем. Данное явление связывают с процессом "пассивации", однако механизм указанной реакции до конца не изучен. Было показано, что протекание процесса окислительного растворения халькопирита зависит от значения потенциала и что начало "пассивации", по-видимому, имеет место, когда значение поверхностного потенциала (смешанного потенциала) превышает примерно 0,6 В (относительно нормального водородного электрода (н.в.э Исследования также показали, что в условиях обычного процесса выщелачивания с применением железосодержащих систем, например, биовыщелачивания или атмосферного выщелачивания в системах на основе хлорида железа(III) и сульфата железа(III), смешанный потенциал минерала обычно находится в так называемой "пассивной области" процесса анодного окисления, при этом значение потенциала раствора обычно находится в диапазоне от 800 до 900 мВ (н.в.э.) относительно инертного платинового электрода. В этом диапазоне значений потенциала минерал подвергается процессу "пассивации", который обычно проявляется в снижении скорости выщелачивания. Это является одной из основных проблем при проведении окислительного растворения халькопирита в таких системах. Предложено много способов решения проблемы "пассивации", одним из которых является термофильное биовыщелачивание при повышенных температурах. Согласно одному из способов бедные халькопиритсодержащие руды подвергают кучному биовыщелачиванию. Процесс проводят таким образом,чтобы обеспечить постепенное повышение температуры материала в куче от температуры окружающей среды до температуры, достаточной для протекания процесса биовыщелачивания с применением умеренно термофильных или термофильных микроорганизмов, что позволяет повысить скорость растворения халькопирита. Успех этой стратегии в большой степени зависит от присутствия в руде доступного пирита в достаточном количестве и его успешного окисления, обеспечивающего выделение требуемого выделения тепла. Из уровня техники известен ряд способов извлечения меди из халькопирита. Известные способы включают способы, приведенные в следующих патентных документах:(а) US 6277341, где в качестве окислителя используют сульфат железа(III), a поверхностный потенциал халькопирита поддерживают в диапазоне 350-450 мВ (н.в.э.);(б) WO 03038137 А, где предложено проведение процесса восстановления с последующим проведением процесса окисления с использованием, по меньшей мере, трехвалентного железа и кислорода для окисления серы в халькопирите;(в) патент UBS, в котором предложен способ выщелачивания концентрата халькопирита в сульфатном выщелачивающем растворе с использованием пирита в качестве катализатора при температуре свыше 50 С;(г) патент CYPRUS, в котором предложено взаимодействие сульфата меди с концентратом халькопирита при повышенных температурах с образованием нерастворимого сульфида меди, растворимого сульфата железа и серной кислоты и выщелачивание сульфида меди с применением кислорода в кислой среде, либо с применением хлорида железа(III) или хлорида меди(II), либо в аммиачном растворе; и(д) CL 40891, который относится к способу агломерации, подходящему для агломерации вторичных руд, предполагающему добавление хлорида кальция и стехиометрических количеств кислоты. При этом содержание хлорида является высоким и раствор является сильно кислым. Вышеприведенный обзор относится, главным образом, к халькопириту, однако подобный подход в большей или меньшей степени применим и в отношении других сульфидных медных минералов. Извлечение меди из бедной первичной руды переходного типа, содержание пирита в которой является недостаточным для создания в куче температуры, подходящей для проведения биовыщелачивания с применением умеренно термофильных или термофильных микроорганизмов, в настоящее время остается проблематичным. Настоящее изобретение направлено, по меньшей мере, на частичное решение обозначенной выше проблемы. Однако область применения настоящего изобретения не ограничена лишь извлечением меди из бедных первичных руд переходного типа при низких температурах и включает также выщелачивание богатых рудных концентратов при повышенных температурах. Краткое описание изобретения В настоящем изобретении предложен способ кучного извлечения меди из материала, содержащего сульфидный медный минерал, при этом предложенный способ включает в себя операции выщелачивания указанного материала в кислом хлоридном растворе или смешанном хлоридно-сульфатном растворе в присутствии растворенного кислорода, обеспечения значения поверхностного потенциала указанного минерала менее 600 мВ (н.в.э.) для растворения сульфида меди и извлечения меди из раствора. Для оптимального выщелачивания халькопирита предпочтительно поддерживать указанный потен-1 014569 циал в диапазоне от 550 до 600 мВ (н.в.э.). Оптимальное значение потенциала зависит от концентрации хлорида. В зависимости от конкретного применения предложенный способ можно осуществлять при обычной или повышенной температуре. Сульфидный медный минерал может включать борнит, халькозин, халькопирит, ковеллин и энаргит. Данные примеры минералов не являются ограничивающими. Способ согласно настоящему изобретению подходит для выщелачивания сульфида меди из бедных первичных руд переходного типа. Область применения настоящего изобретения, однако, не ограничена лишь рудами данного вида и может также включать в себя выщелачивание бедных вторичных руд. Во всех случаях выщелачивание можно осуществлять в рудной колонне (ore column), отвале, куче или чановом реакторе, в настоящем описании для удобства указанных под общим названием "куча". Значение рН раствора может составлять менее 3 и предпочтительно составляет от 1 до 2. Значение рН можно регулировать любым подходящим способом, например добавлением H2SO4, HCl или HNO3. Содержание растворенного кислорода предпочтительно составляет более 1 млн-1. Концентрацию хлорида можно регулировать таким образом, чтобы она составляла от 5 до 100 г/дм 3,добавляя HCl или любую подходящую хлоридную соль, включая NaCl, MgCl2, минерализованную воду,морскую воду или технологическую воду, содержащую хлорид. В общем случае, поверхностный потенциал минерала можно регулировать путем изменения параметров системы выщелачивания. Согласно одному из способов регулируют соотношение Cu(II) и Cu(I). При применении способа согласно настоящему изобретению для выщелачивания в рудной колонне, отвале, куче или чановом реакторе регулируют соотношение Cu(II) и Cu(I) в выщелачивающем растворе. Было установлено, что при проведении выщелачивания по способу согласно настоящему изобретению кинетика выщелачивания остается линейной, а признаки "пассивации" были незначительными или отсутствовали. Таким образом, скорость растворения минерала, содержащего медь, остается постоянной,и с течением времени обеспечивается, по существу, полное растворение. Также было установлено, что при определенных условиях медь и железо, содержащиеся в халькопирите, переходят в раствор в количествах, близких к стехиометрическим. В случае халькопирита растворение, вероятнее всего, может происходить в соответствии со следующей схемой реакций, включающей в себя последовательность неокислительного/окислительного процессов. Неокислительный процесс или Хотя уравнение 2 в случае хлоридных или смешанных хлоридно-сульфатных растворов является немного более предпочтительным с точки зрения термодинамики, чем уравнение 1, оба уравнения используются в качестве отправной точки согласно предложенному механизму реакции и приводят к той же промежуточной окислительной реакции, которая отражена в уравнении 6, и той же итоговой реакции,которая приведена в уравнении 9. Уравнения 2 и 3 могут быть записаны как Окислительный процесс Из уравнений 3 и 5 Это уравнение описывает катализируемое медью окисление растворимого сероводорода растворенным кислородом. Как следует из уравнения 1 Уравнения 7 и 8 могут быть записаны в виде Эти уравнения описывают процесс окисления растворимого сероводорода ионом двухвалентной меди, регенерацию окислителя (иона двухвалентной меди) за счет окисления одновалентной меди до иона двухвалентной меди растворенным кислородом. Уравнение 6 представляет собой суммарное уравнение для каждого из путей реакции. Повидимому, в этих условиях окисление сероводорода приводит к сдвигу равновесия в реакции, отображенной в уравнении 1 или 2, и итоговому процессу растворения, представленному уравнением 9. Итоговая реакция Не желая быть связанными какой-либо конкретной теорией, авторы настоящего изобретения отме-2 014569 чают, что предложенный выше механизм реакции растворения халькопирита при низком значении смешанного потенциала [0,6 В (н.в.э.)] в присутствии растворенного кислорода в хлоридсодержащих или смешанных хлорид/сульфатсодержащих системах согласуется с экспериментальными данными. В противоположность тому, что, как считают, происходит при значении смешанного потенциала менее 0,6 В (н.в.э.), авторы настоящего изобретения полагают, что при значениях потенциала выше указанной величины, которые находятся в пределах "пассивной области" анодного процесса окисления,халькопирит подвергается прямому анодному окислению в соответствии со следующей реакцией в полуэлементе В общем случае принимают, что итоговые реакции, в зависимости от того, выступают ли в качестве окислителя в хлоридсодержащих системах ионы меди(II) (уравнение 11) или железа(III) (уравнение 12),являются следующими: Как показывают экспериментальные наблюдения, элементарная сера (S0), образующаяся в ходе прямого анодного окисления минерала халькопирита (уравнение 10), и сера, образующаяся в ходе проведения предложенного неокислительного/окислительного процесса (уравнения 2, 3 и 5), могут различаться. Кроме того, минералогические исследования образцов остатков материалов после выщелачивания показали, что лишь очень небольшое количество серы, образующейся в ходе процесса растворения в условиях низкого значения смешанного потенциала [0,6 В (н.в.э.)] в присутствии растворенного кислорода,связано с частицами халькопирита. Образующаяся сера присутствует, главным образом, (i) в виде более крупных глобул и (ii) вокруг более мелких частиц других сульфидных минералов, таких как пирит(FeS2). Другими словами, по-видимому, сера образуется не на поверхности халькопирита. Однако в случае, когда значение смешанного потенциала выше 0,6 В (н.в.э.) и находится в "области пассивации" процесса анодного окисления, по-видимому, тонкодисперсная сера с плотноупакованной структурой образуется непосредственно на поверхности минерала. А это значит, что потенциалзависимый процесс определяет тип (морфологию) серы, а также ее поведение в ходе реакции. Это схематически показано на фиг. 1, где используется следующая терминология для описания различных типов серы, которые, как полагают, могут образовываться (табл. 1). Таблица 1 Образование серы Роль параметров и ингредиентов, применяемых в способе согласно настоящему изобретению, можно кратко охарактеризовать следующим образом. Хлорид влияет на тип и морфологию серы и ее поведение; стабилизирует частицы Cu(I), что позволяет регулировать окислительно-восстановительный потенциал (Eh) с помощью пары Cu(II)/Cu(I); улучшает термодинамику неокислительной реакции; может увеличивать скорость неокислительной реакции; повышает формальный потенциал пары Cu(II)/Cu(I); приводит к уменьшению количества кислоты, требуемого для достижения того же значения рН; влияет на скорость окисления Cu(I) до Cu(II); влияет на содержание растворенного кислорода (РК). МедьCu(II) является окислителем; ионы Cu катализируют окисление H2S; пара Cu(II)/Cu(I) регулирует потенциал раствора; влияет на окисление Cu(I) до Cu(II);-3 014569 концентрация Cu(II) влияет на скорость окисления Cu(I) до Cu(II); скорость окисления Cu(I) до Cu(II) зависит от концентрации Cu(I). Растворенный кислород является окислителем в реакции окисления Cu(I) до Cu(II) и позволяет регулировать Eh.Eh определяет смешанный потенциал поверхности минерала, который регулирует механизм растворения халькопирита. Железо нет непосредственной роли в механизме. Кислота выщелачивающий реагент, инициирующий неокислительную реакцию; обеспечивает регулирование значения рН; влияет на кинетические параметры растворения халькопирита; влияет на скорость окисления Cu(I) до Cu(II).H2S промежуточный продукт, образующийся в ходе неокислительной реакции; растворимый H2S диффундирует в направлении от поверхности халькопирита; окисление H2S приводит к получению преимущественно вторичной элементарной S0. Сульфат влияет на регулирование значения рН; влияет на содержание РК. Высота над уровнем моря влияет на содержание РК. Реагенты, способные обеспечивать улучшение кинетических параметров окисления H2S: пирит; магнетит, гематит; активированный уголь или каменный уголь; цеолиты и серебро, висмут, кадмий и ртуть. Краткое описание чертежей Далее настоящее изобретение дополнительно поясняется с помощью примеров со ссылками на прилагаемые чертежи, где фиг. 1 представляет собой схематическую диаграмму, поясняющую концепцию экспериментальных исследований механизма образования элементарной серы, типа (морфологии) образующейся серы, а также ее поведения; фиг. 2 представляет собой график, который показывает влияние концентрации хлорида на формальный потенциал пары Cu(II)/Cu(I); на фиг. 3(а) представлены графики зависимости растворения меди от времени при низком значении потенциала (испытание 1) и при высоком значении потенциала (испытание 2); на фиг. 3(б) представлены графики зависимости потенциала раствора от времени для испытаний 1 и 2; на фиг. 4 представлены результаты серии испытаний, в которой демонстрируется влияние растворнного кислорода на скорость растворения халькопирита при низком значении потенциала (в отсутствии ионов железа(III и при высоком значении потенциала (в присутствии ионов железа(III; фиг. 5 представляет собой график зависимости растворения меди от времени, иллюстрирующий определенный диапазон значений потенциала раствора, обеспечивающий оптимальное выщелачивание халькопирита, и результаты, полученные при выщелачивании в условиях согласно предложенному способу; фиг. 6 представляет собой сравнительный график зависимости растворения меди от времени, иллюстрирующий важность присутствия растворенного кислорода при выщелачивании при нахождении потенциала раствора в пределах определенного оптимального диапазона значений; на фиг. 7(а) представлен график зависимости растворения меди от времени, иллюстрирующий возможность реализации двухстадийного (неокислительного/окислительного) выщелачивания согласно одному из вариантов реализации изобретения; на фиг. 7(б) представлен график зависимости потенциала раствора от времени для двухстадийного(неокислительного/окислительного) выщелачивания; фиг. 8(а) представляет собой схематическую диаграмму, которая иллюстрирует кучное выщелачивание, где понижение потенциала рафината достигается путем его внешней обработки; и фиг. 8(б) представляет собой схематическую диаграмму, которая иллюстрирует альтернативный способ кучного выщелачивания, где понижение потенциала рафината достигается с помощью первоначального выщелачивания вторичных сульфидов меди и последующего использования этого выщелачивающего раствора для выщелачивания первичных сульфидов меди.-4 014569 Описание предпочтительных вариантов реализации изобретения Был проведен ряд испытаний для определения некоторых ключевых аспектов способа согласно настоящему изобретению с использованием различных содержащих халькопирит образцов. Полученные результаты представлены в табл. 1. Все значения потенциалов в дальнейшем приведены относительно нормального водородного электрода (н.в.э.). Таблица 1 Тестовые образцы Примечания: 1 Доля меди, привнесенная халькопиритом (ДМПХ). 2 Подвергнутый мокрому грохочению. 3 Подвергнутый сухому грохочению. Пример 1. Влияние потенциала раствора. Были проведены две серии испытаний по выщелачиванию тонко измельченного содержащего халькопирит концентрата (конц. А) в стеклянных стаканах емкостью 1 л. Каждая реакционная смесь или суспензия этого концентрата содержала 10 г/дм 3 твердого вещества; перемешивание суспензии осуществляли магнитной мешалкой. Далее суспензии выдерживали на воздухе при 20 С. Кислотность поддерживали на уровне рН 0,5 с помощью добавления 98%-ной концентрированной серной кислоты (H2SO4) там,где это было необходимо. Потенциал раствора не регулировали. Задачей этих испытаний было исследование влияния потенциала раствора, а точнее - влияния высокого и низкого потенциала на скорость растворения халькопирита. Для этого раствор в испытании I содержал только кислоту (98% H2SO4), дистиллированную воду и хлорид натрия (NaCl) для обеспечения низкого значения потенциала, тогда как раствор в испытании II дополнительно содержал сульфат железа(Fe2(SO4)3) для обеспечения сравнительно высокого значения потенциала. Подробные условия проведения испытаний приведены в табл. 2. Таблица 2 Условия проведения испытаний (пример 1) Примечание: 1) нижний индекс "0" относится к начальным условиям (t=0 ч); 2) рН суспензии регулировали добавлением 98%-ной H2SO4; 3) скорость перемешивания регулировали; 4) температуру суспензии регулировали; 5) потенциал раствора не регулировали. На фиг. 3(a) представлены кривые растворения меди от времени в испытаниях I и II, а на фиг. 3(б) приведены соответствующие значения потенциала раствора. Как показывают результаты испытаний, при низком значении потенциала (в отсутствие иона трехвалентного железа) растворилось 70,4% меди, тогда как при высоком значении потенциала (в присутствии иона трехвалентного железа) растворилось лишь 6,87%; время проведения испытания составляло 912 ч. Пример 2. Влияние растворенного кислорода. Была выполнена серия экспериментов по выщелачиванию для установления влияния растворенного-5 014569 кислорода на скорость растворения халькопирита при низком значении потенциала (в отсутствие иона трехвалентного железа) и при высоком значении потенциала (в присутствии иона трехвалентного железа). Эксперименты были выполнены с использованием тонко измельченного содержащего халькопирит концентрата (конц. Б) во встряхиваемых колбах емкостью 100 мл. Каждая суспензии содержала 1 г/дм 3 твердого вещества; перемешивание осуществляли путем встряхивания колб на орбитальном встряхивателе при 200 об/мин в термостате с регулируемой температурой. Газообразный азот, насыщенный парами воды, барботировали через суспензии, из которых было необходимо удалить растворенный кислород. Для этого газ барботировали через суспензию с помощью двух игл для инъекций, которые были введены в колбу через резиновую мембрану, которая плотно закрывала колбу. Суспензии, из которых не нужно было удалять растворенный кислород, были закрыты пробками из ваты. Подробные условия проведения испытаний, включающие различные составы растворов, суммированы в табл. 3. На фиг. 4 представлены результаты, полученные через 24 ч при 35 и 50 С. Таблица 3 Условия проведения испытаний (пример 2) Примечания: 1) концентрацию растворенного кислорода не регулировали; 2) скорость встряхивания регулировали; 3) значение рН суспензии не регулировали; 4) температуру суспензии регулировали; 5) потенциал раствора не регулировали. При низком потенциале раствора (0,2 М HCl) наблюдалось заметное различие между итоговым растворением меди, полученным в присутствии растворенного кислорода (воздух), и растворением в отсутствие растворенного кислорода (N2). Например, 22,2% (воздух) относительно 11,0% (N2) при 35 С и 43,5% (воздух) относительно 15,4% (N2) при 50 С; указанные результаты были получены через 24 ч. При высоком потенциале раствора (0,2 М HCl, 0,1 М FeCl3 и 0 М NaCl - 1,5 М NaCl) не наблюдалось заметного различия между итоговым растворением меди, независимо от того, проводились ли испытания в присутствии или в отсутствие растворенного кислорода как при температуре 35 С, так и при температуре 50 С. Исходя из этого можно заключить, что в этих условиях не происходило окисления халькопирита растворенным кислородом в соответствии с уравнением 9. В этих условиях окислительное растворение халькопирита главным образом обусловлено ионами трехвалентного железа в соответствии с уравнением 12 Полученные результаты являются доказательством различных механизмов реакции в условиях высокого потенциала раствора (в присутствии ионов трехвалентного железа) и в условиях низкого потенциала раствора (в отсутствие ионов трехвалентного железа). Это подтверждается различным влиянием,которое оказывает присутствие в системе растворенного кислорода на скорость растворения, например: скорость возрастает при низком потенциале (в отсутствие ионов трехвалентного железа) и скорость не изменяется при высоком потенциале (в присутствии ионов трехвалентного железа). Кроме того,скорость является более высокой при низком значении потенциала и в присутствии растворенного кислорода по сравнению со скоростью при высоком значении потенциала (независимо от отсутствия или присутствия растворенного кислорода) и скорость является более низкой при низком значении потенциала и в отсутствие растворенного кислорода по сравнению со скоростью при высоком значении потенциала (независимо от отсутствия или присутствия растворенного кислорода).-6 014569 Полученные результаты подчеркивают важность роли растворенного кислорода при проведении выщелачивания в условиях низкого потенциала раствора (в отсутствие ионов трехвалентного железа). Пример 3. Влияние регулируемого потенциала раствора в присутствии растворенного кислорода. Было проведено исследование влияния регулируемого потенциала раствора на скорость растворения халькопирита в присутствии растворенного кислорода: чтобы установить, является ли потенциал ключевым параметром для осуществления успешного выщелачивания халькопирита в хлоридных или смешанных хлоридно-сульфатных системах; и если это так чтобы определить диапазон значений потенциала для оптимального выщелачивания халькопирита. С этой целью была проведена серия экспериментов по выщелачиванию тонко измельченного содержащего халькопирит концентрата (конц. А) в стеклянных реакторах емкостью 1 л. Каждый реактор был оснащен разделительными перегородками и поливинилхлоридной крышкой с несколькими входными отверстиями, на которую было установлено перемешивающее устройство с приводом с регулируемой скоростью вращения, содержащее лопастную мешалку. Каждый реактор был также оборудован датчиком для измерения окислительно-восстановительного потенциала, стеклянным барботером и входными отверстиями для барботирования воздуха, азота или кислорода. Датчик для измерения окислительновосстановительного потенциала измерял значение потенциала раствора суспензии, которое поддерживалось на заданном уровне с помощью контура регулирования системы сбора данных Labview. Указанный контур регулирования производил открывание или закрывание электромагнитного клапана, обеспечивая надлежащее барботирование газа. Каждый реактор был также помещен в термостатируемую среду. Все эксперименты по выщелачиванию в данной серии проводили при 35 С при следующих соответствующих значениях потенциала растворов: 540, 550, 580, 600 и 620 мВ. Испытание при 540 мВ проводили, поддерживая заданное значение потенциала с помощью барботирования через суспензию газообразного азота, насыщенного парами воды, начиная с момента времени t=100 ч. Испытания при 550, 580 и 600 мВ проводили, поддерживая заданное значение потенциала путем подачи воздуха. Испытание при 620 мВ проводили, первоначально поддерживая заданное значение потенциала введением воздуха; однако с момента времени t=328 ч через суспензию барботировали газообразный кислород, насыщенный парами воды. Подробные условия проведения испытаний приведены в табл. 4. Таблица 4 Условия проведения испытаний (пример 3) Примечания: 1) концентрацию растворенного кислорода не регулировали; 2) значение рН суспензии не регулировали; 3) температуру суспензии регулировали; 4) потенциал раствора регулировали; 5) скорость перемешивания регулировали. На фиг. 5 представлены кривые зависимости растворения меди от времени для пяти испытаний по выщелачиванию, в которых растворение меди после 1000 ч достигало 30,3% (540 мВ), 73,1% (550 мВ),79,2% (580 мВ), 76,2% (600 мВ) и 22,5% (620 мВ). В испытании при 550 мВ было получено 88,0% растворение спустя 1240 ч. Можно установить два граничных условия, а именно нижнюю границу при 550 мВ и верхнюю границу при 600 мВ, которые определяют диапазон значений потенциала раствора, обеспечивающий оптимальную скорость растворения халькопирита в исследуемых системах. Это отражено в уравнении 13 где Eh оптим. представляет собой потенциал раствора в мВ, обеспечивающий оптимальную скорость-7 014569 растворения халькопирита. Результаты при 540 мВ были получены при барботировании газообразного азота, т.е. в отсутствие растворенного кислорода. Возможно, границы диапазона оптимальных значений потенциала раствора могут быть расширены со стороны нижней границы, которая может быть принята равной менее 550 мВ. Однако отмечено, что обеспечение и поддержание таких низких значений потенциала в присутствии растворенного кислорода с концентрацией, достаточной для обеспечения оптимального выщелачивания в исследуемых системах, является очень сложной задачей. Значения потенциала включают значения, полученные для раствора или суспензии относительно платинового (Pt) электрода. Однако диффузные эффекты можно проигнорировать, поскольку в этих экспериментах был использован тонко измельченный (+25-38 мкм), высокообогащенный (+80%) и выделенный содержащий халькопирит концентрат (конц.А), и весь объем реакционной смеси хорошо перемешивался. Поэтому в условиях низкого потенциала потенциал раствора в объеме (Eh) и потенциал поверхности халькопирита, или смешанный потенциал (Emixed), в высокой степени совпадают (уравнение 14) где Eh представляет собой потенциал в объеме раствора, мВ;Emixed представляет собой смешанный потенциал (на поверхности минерала халькопирита), мВ. Уравнение 14 может быть подтверждено результатами измерений потенциала, выполненных с применением цельных электродов из халькопирита во время этих и других испытаний. Кроме этого, во время нахождения системы в оптимальном диапазоне значений потенциала раствора и в присутствии достаточного количества растворенного кислорода (более 1 млн-1) в условиях, описанных выше, были сделаны следующие наблюдения: сохраняется линейная кинетика, т.е. нет уменьшения скорости растворения ("пассивации"); молярное соотношение выщелачиваемой меди и выщелоченного железа достигает соотношения почти 1:1 в течение всего времени выщелачивания; растворение халькопирита является практически полным; скорость растворения в большой степени не зависит от потенциала и скорость растворения постоянна и составляет 310-12 моль Cu/см 2 с. Пример 4. Влияние регулируемого потенциала раствора в отсутствие растворенного кислорода. Важность присутствия растворенного кислорода для скорости растворения халькопирита в условиях низкого потенциала раствора (в отсутствие ионов трехвалентного железа) уже была показана в примере 2. Чтобы подтвердить это в условиях регулируемого потенциала и, в частности, при нахождении значения потенциала в пределах оптимального диапазона от 550 до 600 мВ, было выполнено несколько серий экспериментов по выщелачиванию в отсутствие растворенного кислорода. Испытания были выполнены с использованием тонко измельченного содержащего халькопирит концентрата (конц. А) в тех же стеклянных реакторах емкостью 1 л, которые описаны в примере 3. Все испытания проводили при 35 С с подачей газообразного азота (насыщенного парами воды) при 550, 580 и 600 мВ. Значение потенциала раствора поддерживали на заданном уровне путем регулирования соотношения Cu(II)/Cu(I) с помощью электрического тока. Подробные условия проведения испытаний приведены в табл. 5. Таблица 5 Условия проведения испытаний (пример 4) Примечания: 1) значение рН суспензии не регулировали; 2) температуру суспензии регулировали; 3) потенциал раствора регулировали; 4) скорость перемешивания регулировали. На фиг. 6 представлены кривые зависимости растворения меди от времени в этих испытаниях в-8 014569 сравнении с результатами испытаний, выполненных при соответствующих значениях потенциала в присутствии растворенного кислорода (в примере 3). Общее количество меди, растворившееся через 1000 ч,было следующим: 550 мВ: 73,1% (воздух) относительно 14,8% (N2); 580 мВ: 79,2% (воздух) относительно 14,2% (N2); 600 мВ: 76,2% (воздух) относительно 15,0% (N2). Полученные результаты показывают, что для достижения оптимальной скорости растворения халькопирита необходимо присутствие в системе растворенного кислорода, даже если потенциал раствора поддерживают в пределах оптимального диапазона значений от 550 мВ до 600 мВ. Пример 5. Возможность осуществления двустадийного (неокислительного/окислительного) выщелачивания. Для установления возможности успешного проведения выщелачивания халькопирита с применением варианта вышеуказанного способа согласно настоящему изобретению была проведена серия экспериментов по выщелачиванию. Было выполнено двустадийное выщелачивание, которое включало в себя этап первоначального выщелачивания в неокислительных условиях низкого потенциала раствора (стадия 1), за которым следовало выщелачивание в окислительных условиях (стадия 2). Испытание было проведено с использованием тонко измельченного подвергнутого сухому грохочению (+25-38 мкм) образца содержащего халькопирит концентрата (конц. А) в стеклянном реакторе емкостью 1 л (как описано в примере 3). Содержание твердого вещества в суспензии составляло 10 г/дм 3,температуру поддерживали на уровне 35 С. Для обеспечения низких значений потенциала раствора суспензию поддерживали в деаэрированном состоянии путем непрерывного барботирования газообразного азота (насыщенного парами воды) в течение первых 139 ч (стадия 1); после этого обеспечивали более высокое значение потенциала посредством барботирования газообразного кислорода (насыщенного парами воды) (стадия 2). Подробные условия проведения испытаний приведены в табл. 6. Таблица 6 Условия проведения испытаний (пример 5) Примечания: 1) значение рН суспензии не регулировали; 2) температуру суспензии регулировали; 3) потенциал раствора не регулировали; 4) скорость перемешивания регулировали. На фиг. 7(a) представлены профили растворения меди и потенциала раствора для данного испытания. Первоначально лишь очень небольшое количество меди растворяется в течение периода барботирования азота - 11,1% по прошествии 139 ч. Потенциал в течение этого периода составлял 500 мВ (стадия 1). Скорость растворения меди заметно возрастала после введения кислорода, что обеспечивало общее растворение 95,5% по прошествии 787 ч. Значение потенциала в течение этого периода изменялось от 570 до 591 мВ (стадия 2). Предшествующие испытания выполняли в основном с использованием халькопирита (для которого применим указанный оптимальный диапазон значений потенциала раствора), однако полагают, что полученные результаты в равной степени справедливы и для борнита, халькозина, ковеллина и энаргита или, в общем случае, для медных сульфидных минералов. Фиг. 8(a) и 8(б) представляют собой блок-схемы двух процессов кучного выщелачивания по способу согласно настоящему изобретению. На фиг. 8(a) руду 10 (руда С) подвергают измельчению (12) и агломерации (14) с применением водного раствора кислоты с рН менее 2,0. Этот раствор может представлять собой технологический рафинат или раствор, рН которого регулируют любым подходящим способом, например, добавлением H2SO4, HCl или HNO3. Агломерация (14) обладает двумя преимуществами, а именно она позволяет регулировать содержание тонкодисперсного рудного материала, что влияет на перколяцию и аэрацию кучи, и обеспечивает растворение кислоторастворимых вторичных медных сульфидов. Количество вторичных медных сульфидов, переходящих в раствор в ходе данного процесса, может быть увеличено путем выдержки агломерированной руды перед орошением кучи. Если для агломерации применяют водный раствор кислоты, этот раствор может содержать хлорид в количестве от 5 до 100 г/дм 3 за счет добавления какой-либо-9 014569 подходящей хлоридной соли, включая NaCl, MgCl2, минерализованную воду, морскую воду или хлоридсодержащую технологическую воду. После формирования кучи и выдержки (если требуется), проводят выщелачивание (16) кучи путем орошения руды выщелачивающим раствором 18 с рН 2,0 или менее, предпочтительно 1,0. Если выщелачивающий раствор является свежеприготовленным, он может содержать следующие компоненты: хлорид в количестве от 5 до 100 г/дм 3 за счет добавления HCl или какой-либо подходящей хлоридной соли,включая NaCl, MgCl2 или морскую воду; медь в количестве от 0,05 до 10 г/дм 3 за счет добавления соответствующей хлоридной или сульфатной соли; и железо в количестве от 0 до 20 г/дм 3 за счет добавления соответствующей хлоридной или сульфатной соли. Если в качестве выщелачивающего раствора применяют полученный ранее рафинатный раствор, содержание хлорида и железа можно регулировать путем изменения условий равновесного протекания процесса в установке, а содержание меди - с помощью возврата экстрагирующего растворителя. Может возникнуть необходимость пополнения количества указанных компонентов, которое осуществляют описанным выше способом, для обеспечения содержаний указанных компонентов, требуемых для оптимального выщелачивания. Потенциал выщелачивающего раствора предпочтительно поддерживают равным менее 620 мВ(н.в.э.), например, путем регулирования состава выщелачивающего раствора или понижения активного потенциала. Понижение активного потенциала (20) можно выполнять путем пропускания выщелачивающего раствора через колонну, содержащую такие материалы, как металлическая медь, определенные типы активированного угля, с помощью добавления восстанавливающих агентов, таких как аскорбиновая кислота, с помощью барботирования через раствор SO2 или СО, с помощью инициирования осаждения ярозита. Воздух 22 вводят в основание кучи для повышения содержания растворенного кислорода в руде. Обогащенный водный раствор 24 из кучи подвергают экстракции 26 и затем выделяют медь с помощью электролиза 30. Твердый остаток 32 материала кучи после выщелачивания утилизируют любым подходящим образом. На фиг. 8(б) показан модифицированный процесс, отличающийся тем, что потенциал выщелачивающего раствора понижают до уровня, требуемого для выщелачивания первичного сульфида меди, с помощью первоначального орошения кучи, содержащей вторичные сульфидные медные минералы 16 А. Полученный обогащенный выщелачивающий раствор 34 затем используют для орошения кучи, содержащей первичные сульфидные медные минералы 16 Б. Согласно некоторым вариантам процесса, изображенного на фиг. 8(б), может быть сформирована куча, содержащая верхний слой вторичных сульфидных медных минералов в количестве, достаточном для понижения потенциала раствора до уровня, необходимого для проведения выщелачивания остальной части кучи (первичных сульфидных медных минералов в нижнем слое), или может быть осуществлена агломерация подвергнутых размолу вторичных сульфидных медных минералов, помещенных поверх первичных сульфидных медных минералов, для понижения значения потенциала выщелачивающего раствора in situ до требуемого уровня. Как было отмечено, требуемое содержание растворенного кислорода в куче (1 млн-1 или выше) можно получить с помощью системы аэрации 22, устанавливаемой в основание кучи в процессе ее формирования. Альтернативно или дополнительно можно обеспечить требуемое содержание растворенного кислорода с помощью высокого расхода орошающего потока, аэрированного перед орошением. Литература 1. Majima, H., Awakura, Y., Hirato, Т. and Tanaka, Т., The Leaching of Chalkopyrite in Ferric ChlorideChem., 37, 1984, pp.77-80. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гидрометаллургический способ кучного извлечения меди из материала, содержащего сульфидный медный минерал, причем указанный способ включает операции выщелачивания указанного материала в кислом хлоридном растворе или смешанном хлоридносульфатном растворе в присутствии растворенного кислорода и ионов меди(II) в качестве окислителей,поддерживания значения поверхностного потенциала указанного минерала менее 600 мВ (относительно н.в.э.) с тем, чтобы вызвать растворение сульфида меди и извлечения меди из раствора. 2. Способ по п.1, отличающийся тем, что значение потенциала поддерживают в диапазоне от 550 до- 10014569 600 мВ (относительно н.в.э.). 3. Способ по п.2, отличающийся тем, что значение потенциала выбирают в зависимости от концентрации хлорида. 4. Способ по пп.1, 2 или 3, отличающийся тем, что материалом, содержащим сульфидный медный минерал, является бедная руда переходного типа или бедная первичная руда. 5. Способ по пп.1, 2 или 3, отличающийся тем, что материалом, содержащим сульфид меди, является бедная вторичная руда. 6. Способ по любому из пп.1-5, отличающийся тем, что значение рН указанного раствора составляет менее 3. 7. Способ по п.6, отличающийся тем, что значение рН указанного раствора находится в диапазоне от 1 до 2. 8. Способ по любому из пп.1-7, включающий операцию регулирования рН раствора путем добавления H2SO4, HCl или HNO3. 9. Способ по любому из пп.1-8, отличающийся тем, что содержание растворенного кислорода составляет более 1 млн-1. 10. Способ по любому из пп.1-9, отличающийся тем, что концентрацию хлорида поддерживают на уровне от 5 до 100 г/дм 3. 11. Способ по любому из пп.1-10, отличающийся тем, что концентрацию хлорида регулируют путем добавления по меньшей мере одного из следующих агентов: HCl, NaCl, MgCl2, минерализованной воды, морской воды или хлоридсодержащей технологической воды. 12. Способ по любому из пп.1-11, включающий операцию регулирования соотношения Cu(II) иCu(I) в выщелачивающем растворе. 13. Способ по любому из пп.1-12, отличающийся тем, что сульфидный медный минерал представляет собой по меньшей мере один из следующих минералов: борнит, халькозин, халькопирит, ковеллин и энаргит.
МПК / Метки
МПК: C22B 3/04, C22B 15/00, C22B 3/06
Метки: применением, кучное, выщелачивание, хлоридов
Код ссылки
<a href="https://eas.patents.su/16-14569-kuchnoe-vyshhelachivanie-s-primeneniem-hloridov.html" rel="bookmark" title="База патентов Евразийского Союза">Кучное выщелачивание с применением хлоридов</a>
Предыдущий патент: Боковой упор и содержащее его устройство для фиксации положения и обеспечения боковой устойчивости рельса
Следующий патент: Строительный элемент для строительства стен с использованием наполнителя, в частности грунта или подобного материала
Случайный патент: Способ сейсмического наблюдения за подземной зоной путем одновременного использования нескольких вибросейсмических источников












