Электрод, способ его изготовления, металловоздушный топливный элемент и металлогидридный элемент
Формула / Реферат
1. Электрод для использования в электрохимическом элементе, содержащий материал-аккумулятор водорода и металл с высокой удельной энергией, выбранный по меньшей мере из одного из Al, Zn, Mg и Fe или сплава любого из них, причем материал-аккумулятор водорода и металл с высокой удельной энергией размещены в электроде таким образом, что металл с высокой удельной энергией способен действовать в качестве анодного материала для элемента, при этом металл с высокой удельной энергией и/или материал-аккумулятор водорода присутствует в электроде в виде, при котором он смешан с политетрафторэтиленом и/или углеродом.
2. Электрод по п.1, в котором металл с высокой удельной энергией размещен в электроде в виде первого листа, а материал-аккумулятор водорода размещен в электроде в виде второго листа.
3. Электрод по п.1 или 2, в котором материал-аккумулятор водорода представляет собой сплав, выбранный из группы, состоящей из сплавов редкоземельного металла/мишметалла, циркониевых сплавов, титановых сплавов и смесей таких сплавов.
4. Электрод по пп.1-3, в котором материал-аккумулятор водорода представляет собой гидрид металла, выбранного из группы, состоящей из АВ5, АВ2, AB и А2В, где А - металл IIb группы, переходный металл, редкоземельный металл или металл из ряда актиноидов, а В - металл из ряда переходных металлов.
5. Электрод по п.4, в котором
AB5 имеет гексагональную или орторомбическую структуру и представляет собой LaNi5 или NmNi5, где Nm - комбинация La и других редкоземельных элементов;
AB2 представляет собой ZnMn2 со структурой фазы Лавеса;
АВ представляет собой TiFe со структурой CsCl и
A2B представляет собой Ti2Ni со сложной структурой.
6. Электрод по любому из пп.1-5, который дополнительно содержит водородный электрокатализатор.
7. Электрод по п.6, в котором водородный электрокатализатор представляет собой благородный металл, Ni, Fe, Cr или сплав, содержащий по меньшей мере один из этих металлов.
8. Электрод по п.6 или 7, в котором водородный электрокатализатор находится в виде чистого порошка, осажденного на материал-носитель с большой площадью поверхности.
9. Электрод по п.8, в котором материал-носитель с большой площадью поверхности представляет собой активированный уголь или графит.
10. Электрод по любому из пп.1-9, в котором металл с высокой удельной энергией и материал-аккумулятор водорода находятся в виде единого листа.
11. Электрод по любому из пп.6-10, в котором металл с высокой удельной энергией, материал-аккумулятор водорода и водородный электрокатализатор находятся в виде единого листа.
12. Электрод по любому из пп.6-10, в котором металл с высокой удельной энергией и водородный электрокатализатор находятся в виде первого листа, а материал-аккумулятор водорода находится в виде второго листа.
13. Электрод по любому из пп.6-10, в котором металл с высокой удельной энергией находится в виде первого листа, материал-аккумулятор водорода находится в виде второго листа, а водородный электрокатализатор находится в виде третьего листа.
14. Электрод по любому из пп.10-13, в котором в один из листов запрессован или закаландрирован сетчатый токосъемник.
15. Электрод по любому из пп.1-14, в котором металл с высокой удельной энергией находится в виде гранул или порошка.
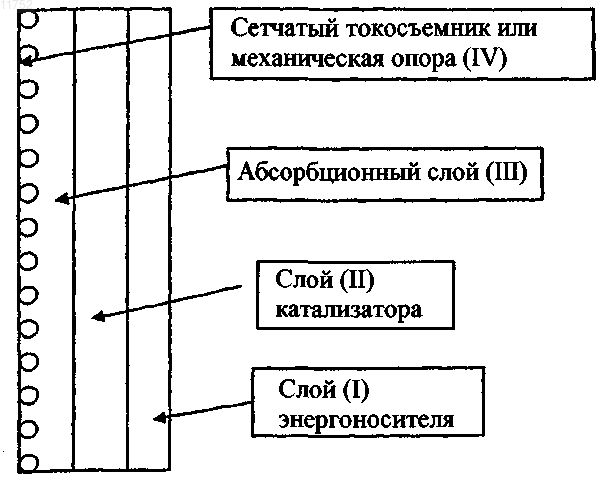
16. Электрод по любому из пп.1-15, который содержит слой энергоносителя; слой катализатора; слой абсорбции водорода и один или оба из сетчатого токосъемника и механической опоры.
17. Электрод электрохимического элемента, представляющий собой электрод по любому из пп.1-16, содержащий материал-аккумулятор водорода для абсорбции водорода, получаемого при реакции упомянутого металла с высокой удельной энергией с электролитом в упомянутом элементе.
18. Электрод электрохимического элемента, представляющий собой электрод по любому из пп.1-16, содержащий металл с высокой удельной энергией, который при реакции с электролитом в упомянутом элементе образует водород, аккумулируемый в материале-аккумуляторе водорода.
19. Способ изготовления электрода по любому из пп.1-16 для использования в электрохимическом элементе, включающий в себя
спекание или формование со связующим по меньшей мере одного из металла с высокой удельной энергией и материала-аккумулятора водорода по меньшей мере в один тонкий лист и
каландрирование или прессование упомянутого по меньшей мере одного листа с формированием электрода.
20. Способ по п.19, в котором регулируют пористость с использованием политетрафторэтилена в качестве связующего.
21. Способ по п.19 или 20, в котором контакт частиц с частицами увеличивают путем добавления углерода.
22. Способ по любому из пп.19-21, в котором в упомянутый по меньшей мере один лист запрессовывают или закаландрировывают токосъемник.
23. Металловоздушный топливный элемент, содержащий в качестве анода электрод по любому из пп.1-16.
24. Металлогидридный элемент аккумуляторной батареи, содержащий в качестве анода электрод по любому из пп.1-16.
25. Элемент по п.24, который представляет собой никель-металлогидридный элемент.
26. Элемент по п.25, в котором для предотвращения коррозии гидрида металла организована гальваническая связь между отдельными слоями, содержащими, соответственно, металл с высокой удельной энергией и гидрид металла.
Текст
011752 Введение Изобретение относится к электроду для использования в электрохимическом элементе (химическом источнике тока). Более конкретно, изобретение относится к решению проблем коррозии металлов, таких как алюминий (Al), магний (Mg), цинк (Zn) и железо (Fe), в металловоздушных топливных элементах и металлогидридных аккумуляторных батареях. Изобретение предлагает также способ увеличения энергоемкости между зарядками и пикового значения плотности мощности для систем металловоздушных топливных элементов и Ni/металлогидридных аккумуляторных батарей. Уровень техники Традиционные топливные элементы. Топливные элементы конструируются с целью высокоэффективного преобразования химической энергии в электрическую энергию. В противоположность аккумуляторным батареям, в которых химическая энергия аккумулируется внутри системы, топливные элементы конструируются так, что реагирующие вещества поступают из внешнего окружения. Это дает возможность получить эффективные энергетические системы с высокой удельной энергией на единицу массы и объема. В большинстве топливных элементов катодная реакция представляет собой восстановление кислорода из воздуха. В качестве энергоносителя часто используют водород, при этом он окисляется в ходе анодной реакции. Хранение (аккумулирование) водорода представляет собой одну из главных проблем, которую необходимо преодолеть до того, как станет возможным массовое производство таких систем. Удельная энергия водорода на единицу массы и объема мала по сравнению с традиционными ископаемыми видами топлива. При температурах ниже 150 С существуют два главных типа топливных элементов. 1. В топливном элементе с протонообменной мембраной (РЕМ, от англ. proton exchangemembrane) электроды для реакций кислорода и водорода наносят на мембрану из полимера перфторсульфоновой кислоты (PFSA, от англ. perfluorosulfone acid) (Nafion). Такая мембрана эффективно разделяет эти две реакции и обеспечивает систему с высокой ионной проводимостью при температурах выше 70 С. Электроды представляют собой тонкие слои (20 мкм). Высокая каталитическая активность обеспечивается благодаря использованию углеродного носителя с нанесенными катализаторами из благородных металлов. 2. В щелочном топливном элементе (AFC, от англ. alkaline fuel cell) электроды выполняют из пористых слоев толщиной от 300 до 1000 мкм. Реакции водорода и кислорода протекают внутри этого слоя. Два электрода разделены щелочным электролитом с высокой ионной проводимостью. Наиболее общий способ изготовления таких электродов заключается в смешении пористых порошков и катализаторов с политетрафторэтиленом (ПТФЭ, или Тефлон). Двойная пористая структура с гидрофобными и гидрофильными порами обеспечивает каналы для транспорта жидкости и газа внутри электрода. При анодной реакции водород транспортируется по газовым каналам в этой структуре. Реакция водорода протекает на каталитических частицах, распределенных внутри пористой структуры. Для каталитических частиц часто используют углеродный носитель. Этот углеродный носитель не имеет каталитической активности по отношению к реакции водорода. Было предложено несколько решений проблем, связанных с низкой удельной энергией водорода на единицу объема. Один из альтернативных вариантов заключается в использовании вместо водорода жидкостей, таких как метанол, для анодной реакции. Разумная скорость окисления была получена при использовании метанола в топливных элементах с РЕМ. Однако срок службы таких систем является неудовлетворительным. Главным образом это обусловлено просачиванием метанола сквозь мембрану. Метанол диффундирует через мембрану и реагирует с катодом. Образуется СО, который отравляет катализатор. Для преодоления этой проблемы метанол разбавляют водой. Однако это снижает энергоемкость системы. Металловоздушные топливные элементы. Альтернативный подход заключается в использовании металлов в качестве энергоносителей. Удельная энергия на единицу массы и объема у металлов, таких как цинк (Zn), алюминий (Al), магний(Mg) или железо (Fe), велика. Например, теоретическое значение удельной энергии у Zn составляет 1310 Втч/кг (EZn-воздух=1,6 В), а для Al достигает 8194 Втч/кг (EAl-воздух=2,75 В). Кроме того, использование металла в качестве анодного материала делает возможной перезарядку систем топливных элементов. В качестве катода в металловоздушных топливных элементах часто используют воздушный электрод. Его изготавливают из углеродных порошков с ПТФЭ в качестве связующего, формирующего пористую структуру, которая обеспечивает возможность транспорта жидкости и газа таким же самым образом, как и в упомянутых выше щелочных топливных элементах. Описание способа изготовления воздушных электродов дано в заявке на патент Норвегии 2003/3110, принадлежащей тому же заявителю, что и настоящее изобретение. От металлического электрода воздушный электрод часто отделяет щелочной раствор или полимер. Использование щелочного раствора дает преимущество, заключающееся в быстрой кинетике реакции кислорода. Могут быть использованы и другие растворы (например, морская вода),однако это увеличивает перенапряжение при кислородной реакции и, таким образом, снижает электрическую эффективность системы.-1 011752 В противоположность щелочным топливным элементам в металловоздушных топливных элементах вместо водородного электрода в качестве анода используют металлический электрод. Вся энергия аккумулируется, таким образом, внутри системы, и газовые каналы для транспорта водорода к аноду не требуются. Металлический электрод может быть электродом в виде сплошной пластины, спеченным пористым электродом, спеченной смесью металла и оксидов или электродом из порошка или гранул. Структура и конструкция этого электрода в значительной степени определяются конкретным применением. Преимущество при этом заключается в том, чтобы этот электрод был слегка пористым, поскольку образующиеся при растворении металла металлические оксиды часто имеют более низкую плотность, чем чистые металлы. Такие металлы, как Zn, Al, Mg или Fe, являются хорошими кандидатами благодаря их высокой удельной энергии. Если требуются перезаряжаемые системы, то необходимо предпринять некоторые меры предосторожности для гарантирования того, что рост дендритов металла не приведет к закорачиванию топливного элемента при контакте с воздушным электродом. Добавки в электролит могут снизить такой рост дендритов. Кроме того, для снижения роста дендритов эти металлы могут быть легированы. Главная проблема в случае металловоздушных систем заключается в неконтролируемом растворении металла при образовании водорода. Электролит (часто - щелочной раствор) будет растворять металлы в ходе коррозионной реакции. Эта реакция будет протекать в том случае, когда электроды хранятся при потенциалах разомкнутой цепи, а для некоторых металлов также и при эксплуатации металловоздушной системы. Скорость коррозионной реакции определяет снижение электрической эффективности этой системы. Для снижения коррозии были предприняты попытки легировать данные материалы (Zn,Al, Mg, Fe) свинцом (Pb), ртутью (Hg) или оловом (Sn). Известно, что эти элементы увеличивают перенапряжение при реакции водорода. Альтернативный подход заключался в добавлении в электролит ингибиторов коррозии. Все же эти решения пока не приводили к удовлетворительным результатам, особенно для металлов с самой высокой удельной энергией (Al и Mg). Коррозия металлов в металловоздушных топливных элементах считается главной причиной того,что топливные элементы этого типа до сих пор не были выведены на рынок. Коррозия в случае данных металлов со временем приводит к снижению энергоемкости. Это обусловлено растворением металла при образовании водорода. Коррозия этих металлов протекает с выделением водорода в соответствии со следующими уравнениями: где n определяется используемым металлом (M). Это приводит к следующей суммарной реакции коррозии: Из уравнения (3) видно, что количество выделившегося водорода на металлический эквивалент определяется конкретным металлом. Например, 1 моль водорода образуется при растворении 1 моля Zn. С другой стороны, при растворении 1 моля Al образуется 1,5 моля водорода. Скорость выделения водорода может быть найдена из обратимого потенциала водородной реакции. Обратимый потенциал водородной реакции (2) в щелочном растворе составляет -0,828 В. Потенциал разомкнутой цепи является потенциалом металлической поверхности, когда анодной реакцией является растворение металла, а выделение водорода - катодной реакцией. Разность между потенциалом разомкнутой цепи и обратимым потенциалом выделения водорода определяет скорость катодной реакции выделения водорода. Если эта разность потенциалов велика (как в случае Al и Mg), то скорость выделения водорода высока, и она будет происходить, даже если электрод находится в условиях анодной поляризации. Если эта разность потенциалов мала (как в случае Zn), то скорость выделения водорода при разомкнутой цепи мала, и она является незначительной в условиях анодной поляризации. Для металловоздушных топливных элементов это означает, что при использовании металлов, которые дают высокую разность потенциалов (Al, Mg), скорость выделения водорода будет высока, когда электроды находятся на хранении, и также будет значительна, когда этот топливный элемент находится в эксплуатации. Как видно из уравнения (3), скорость выделения водорода пропорциональна скорости растворения металла, а скорость растворения металла пропорциональна снижению емкости металловоздушного топливного элемента. Поэтому, для того чтобы использовать материалы с высокой удельной энергией, такие как Al или Mg, должно быть найдено решение проблемы снижения энергоемкости. Для материалов с более низкими скоростями выделения водорода, таких как Zn и Fe, такое решение также необходимо, если требуются длительные времена хранения.Ni/металлогидридные аккумуляторные батареи. Из приведенного выше описания можно видеть, что металловоздушный топливный элемент имеет большое сходство как с аккумуляторной батареей, так и с топливными элементами. Воздушный электрод - это типичный электрод топливного элемента, а металлический электрод - типичный электрод аккумуляторной батареи.Ni/металлогидридные аккумуляторные батареи состоят из металлогидридного анода и никельоксидного катода. Энергоемкость этой системы обусловлена абсорбцией водорода в металлогидридном сплаве. Этот водород будет диффундировать к поверхности и вступать в реакцию, производя электрическую энергию при эксплуатации аккумуляторной батареи. При этом на катоде будет восстанавливаться оксид никеля. Щелочной электролит разделяет эти два электрода. Для получения высоких скоростей реакции и коротких пробегов при диффузии металлогидридный электрод выполняют в виде спрессованной порошковой таблетки. Много усилий было затрачено для достижения контакта одних частиц с другими частицами и для получения быстрой поверхностной кинетики реакции водорода. Требуется несколько циклов заряда - повторного заряда для того, чтобы удалить поверхностные оксиды на гидридах металлов и, тем самым, активировать данный материал. Энергоемкость лимитируется количеством водорода внутри гидрида металла. Максимальная нагрузка ограничена скоростью диффузии водорода из объема к поверхности гидрида металла. При разработке металловоздушных топливных элементов основная проблема заключалась в растворении металла при образовании водорода за счет коррозионной реакции. Эта проблема является особенно серьезной при использовании таких металлов, как Al или Mg, но она также присутствует и в случае Zn и Fe. Это особенно справедливо в случае применений металловоздушных топливных элементов с порошковыми металлическими электродами (для снижения падения напряжения на анодной реакции), когда скорость коррозии велика из-за большой площади подвергающейся воздействию поверхности. Для разрешения этой проблемы до сих пор использовали два основных подхода. 1. Добавляли ингибиторы коррозии в электролит для ингибирования реакции водорода. 2. Металлы легировали элементами, увеличивающими перенапряжение реакции водорода. Одна из попыток усовершенствования электродного материала для топливных элементов показана в патенте США 5795669, раскрывающем композиционный электродный материал, включающий в себя два материала-катализатора. Один материал-катализатор представляет собой активный в газовой фазе катализатор, а другой содержит активный электрохимический катализатор. В патенте США 6447942 показано использование металлических аккумулирующих материалов для анода в щелочных топливных элементах и блоков электролиза воды обратимых топливных элементов. Такие материалы имеют высокие каталитические свойства в отношении реакции водорода. Кроме того, там показано, что аккумулирование водорода позволяет осуществлять мгновенный запуск системы. Недостаток заключается в том, что традиционная активация любого гидридообразователя достигается за счет повторяющейся абсорбции и десорбции водорода под давлением. Это невозможно осуществить,если элементы не сконструированы устойчивыми к высоким давлению и температуре. В публикации заявки на патент США 2002/0064709 представлено решение отмеченной выше проблемы с давлением. Предлагалось, что при добавлении гидридных химических соединений (таких как борогидрид натрия, гидрид натрия, гидрид лития и т.п.) в смесь со сплавами гидридов металлов образование водорода в результате растворения гидридных химических соединений предварительно заряжает материал-аккумулятор водорода, увеличивает пористость и усиливает коррозионную защиту сплавааккумулятора водорода. В этом патенте в качестве образующих водород материалов описаны только гидридные химические соединения, а использование материала гидридного химического соединения ограничено только отмеченными выше эффектами. В патенте США 6492056 получают композитный материал. Этот композит состоит из сплавоваккумуляторов водорода и электрокаталитических материалов. Каталитически активные материалы присутствуют для увеличения скорости реакции водорода. Кроме того, присутствуют материалыаккумуляторы водорода. Водород, таким образом, может аккумулироваться внутри анода топливного элемента или реагировать с высокой скоростью. Это дает преимущество, заключающееся в мгновенном запуске и возможности возврата энергии из таких процессов, как рекуперативное (регенеративное) торможение. Как можно видеть из этих патентов, они направлены на усовершенствование водородного электрода топливных элементов. Материалы-аккумуляторы водорода добавляют для обеспечения возможности быстрого запуска топливного элемента, а гидридные химические соединения добавляют для активации материалов-аккумуляторов водорода. В патенте США 6258482 анод аккумуляторной батареи выполняют из порошка сплавааккумулятора водорода, который включает в себя агломераты частиц сплава-аккумулятора водорода,объединенные вместе посредством металлического слоя. В качестве металлического слоя предлагается такой металл, как Fe или Zn.-3 011752 В отмеченном выше патенте США задача заключается в обеспечении возможности использования небольших размеров частиц сплавов-аккумуляторов водорода. Это будет улучшать начальную разрядную емкость, а также увеличить срок службы при повторении циклов заряда-разряда щелочных аккумуляторных батарей, использующих такие электроды со сплавами-аккумуляторами водорода. Для того чтобы использовать небольшие частицы гидридов металлов, необходимо предотвратить образование оксидных пленок. В данном патенте США заявлено, что покрытие поверхности сплавов-аккумуляторов водорода пленкой металла, такого как Fe, Zn или другие, будет предотвращать окисление и снижать контактное сопротивление. Задача, решаемая в данном патенте США, заключается в обеспечении возможности образования металлического поверхностного слоя на частицах гидрида металла и объединения этих частиц для снижения контактного сопротивления. Данный патент США не касается факта того, что Fe, Zn или другие металлы могут растворяться в щелочной среде при образовании водорода. Использование этих металлов в качестве источника водорода внутри электрода не является задачей данного патента США. В настоящем изобретении целью введения металлических частиц или отдельных металлических слоев в структуру электрода заключается в обеспечении возможности использования металлов с высокой удельной энергией, таких как Al, Mg, Zn или Fe, в качестве источника водорода для аккумулирования гидридов металлов и поверхностного окисления водорода. При этом будет использоваться водород, образующийся в процессе коррозии металлов с высокой удельной энергией, а также это делает возможным аккумулирование водорода во время зарядки системы батарей. Кроме того, один вариант реализации изобретения состоит в том, что металл с высокой удельной энергией сам действует в качестве анода аккумуляторной батареи. В настоящем изобретении коррозия определяется как растворение металлов с высокой удельной энергией (Al, Zn, Mg или Fe) на растворенные ионы или оксиды. В силу активности сильно щелочного электролита металлы с высокой удельной энергией будут корродировать при образовании водорода. Когда металлы с высокой удельной энергией применяются в аккумуляторных батареях (в условиях анодной поляризации), эти металлы растворяются из-за приложенного анодного потенциала. При этом будет наблюдаться пониженная скорость образования водорода. Сущность изобретения В настоящем изобретении представлен новый подход к проблеме коррозии. Изобретение основано на том факте, что при коррозионной реакции только часть энергии теряется в виде тепловой энергии, а большая часть энергии по-прежнему присутствует в виде водорода. Изобретение относится также к способу аккумулирования и преобразования этой энергии в электрическую энергию. Для аккумулирования получаемого при коррозии водорода могут быть использованы материалы со способностью абсорбировать (поглощать) водород, а каталитические в отношении реакции водорода материалы могут быть использованы для увеличения скорости реакции окисления водорода. Кроме того, для решения проблемы коррозии в случае металловоздушных топливных элементов изобретение может также быть применено к аноду для аккумуляторных батарей металлогидридного типа(например, Ni-металлогидридных аккумуляторных батареях). В таких батареях используются материалы-аккумуляторы водорода. Смесь материалов-аккумуляторов водорода и/или электрокатализаторов иAl, Mg, Zn или Fe может заменить в таких батареях чистый материал-аккумулятор в качестве анодов. Добавление Al, Mg, Zn или Fe будет увеличивать срок службы и нагрузочную пиковую мощность металлогидридных аккумуляторных батарей. В этом контексте металлы с высокой удельной энергией (высокой плотностью энергии) представляют собой металлы, которые реагируют с образованием оксидов в ходе реакции с кислородом (например, металлы, которые корродируют в выбранных окружающих средах). Эти задачи в настоящем изобретении решаются посредством смешения или спекания сплавоваккумуляторов водорода и водородных электрокатализаторов с металлами, такими как Al, Mg, Zn и Fe. Полученный с помощью Al, Mg, Zn и Fe водород реагирует затем на этом электрокатализаторе с выдачей электрической энергии. Если металловоздушная батарея не находится в эксплуатации, водород может аккумулироваться в материале-аккумуляторе водорода. В своем первом аспекте изобретение предлагает электрод для использования в электрохимическом элементе (химическом источнике тока), содержащий материал-аккумулятор водорода и металл с высокой удельной энергией, причем материал-аккумулятор водорода и металл с высокой удельной энергией размещены в электроде таким образом, что металл с высокой удельной энергией способен действовать в качестве источника водорода для материала-аккумулятора водорода при реакции с электролитом в этом элементе, и/или металл с высокой удельной энергией способен действовать в качестве анодного материала для этого элемента. В одном варианте реализации металл с высокой удельной энергией представляет собой по меньшей мере один из Al, Mg, Zn и Fe, или сплав любого из этих металлов. Металл с высокой удельной энергией может также быть смешан с ПТФЭ или графитом, или с ними обоими. Графит улучшает проводимость электрода. Материал-аккумулятор водорода может быть сплавом, выбранным из группы, состоящей из сплавов редкоземельного металла/мишметалла, циркониевых сплавов, титановых сплавов и смесей этих сплавов, и может также быть смешан с ПТФЭ и/или углеродом. Более конкретно,-4 011752 материал-аккумулятор водорода может быть гидридом металла, выбранного из группы, состоящей из АВ 5, АВ 2, АВ и А 2 В, где А - металл IIb группы, переходный металл, редкоземельный металл или металл из ряда актиноидов, а В - металл из ряда переходных металлов. Кроме того, АВ 5 (гексагональной или орторомбической структуры) представляет собой LaNi5 или MmNi5, где Mm - комбинация лантана и других редкоземельных элементов, АВ 2 представляет собой ZnMn2 со структурой фазы Лавеса, АВ представляет собой TiFe со структурой CsCl и А 2 В представляет собой Ti2Ni со сложной структурой. Электрод может также содержать водородный электрокатализатор, причем этот водородный электрокатализатор может представлять собой благородный металл (например, платина (Pt), или палладий(Pd, или никель (Ni), железо (Fe) или хром (Cr), или сплав, содержащий по меньшей мере один из металлов - платины (Pt), палладия (Pd), никеля (Ni), железа (Fe) или хрома (Cr). Еще в одном варианте реализации водородный электрокатализатор представляет собой чистый порошок, осажденный на материалноситель с большой площадью поверхности, например на активированный уголь или графит. Еще в одном варианте реализации изобретения металл с высокой удельной энергией и сплаваккумулятор водорода образуют единый лист. В другом варианте реализации один лист образуют металл с высокой удельной энергией, сплав-аккумулятор водорода и электрокатализатор. Возможно также, что электрод изготовлен из двух листов, причем металл с высокой удельной энергией образует первый лист,а сплав-аккумулятор водорода образует второй лист или же металл с высокой удельной энергией и электрокатализатор образуют первый лист, а сплав-аккумулятор водорода образует второй лист. Трехслойный электрод реализуется в том случае, когда металл с высокой удельной энергией образует первый лист, сплав-аккумулятор водорода образует второй лист, а электрокатализатор образует третий лист. В один из этих листов может быть запрессован или закаландрирован сеточный токосъемник. Металл с высокой удельной энергией может быть выполнен из гранул или порошка. Дополнительно, металл с высокой удельной энергией может быть смешан с ПТФЭ (Тефлоном) и/или графитом. Также материалаккумулятор водорода может быть выполнен из гранул или порошка, смешанных с ПТФЭ (Тефлоном) и/или графитом. Электродные слои могут быть выполнены в виде слоя энергоносителя, слоя катализатора, абсорбционного слоя (слоя поглощения) и сеточного токосъемника или механической опоры. Во втором своем аспекте изобретение предлагает способ изготовления электрода для использования в электрохимическом элементе, содержащем сплав-аккумулятор водорода и металл с высокой удельной энергией, включающий в себя спекание или формование со связующим порошка металла с высокой удельной энергией и/или сплава-аккумулятора водорода по меньшей мере в один тонкий лист и каландрирование или прессование этого листа для формирования электрода. Пористость может контролироваться посредством использования ПТФЭ в качестве связующего. Контакт частиц друг с другом может быть увеличен добавлением углерода. В другом варианте реализации в этот лист запрессовывают или закаландрировывают (вводят при каландрировании) токосъемник. В третьем своем аспекте изобретение предлагает металловоздушный топливный элемент, содержащий анодный электрод в соответствии с вышеуказанным. В четвертом своем аспекте изобретение предлагает металлогидридный элемент, содержащий анодный электрод в соответствии с вышеуказанным. В пятом своем аспекте изобретение предлагает применение металла с высокой удельной энергией в сочетании с материалом-аккумулятором водорода для предотвращения коррозии в металловоздушных топливных элементах, а в шестом своем аспекте изобретение предлагает применение металла с высокой удельной энергией в сочетании с материалом-аккумулятором водорода для обеспечения самозаряда в Niметаллогидридных аккумуляторных батареях. В седьмом аспекте предложено применение металла с высокой удельной энергией в сочетании с материалом-аккумулятором водорода в электроде в Ni-металлогидридных аккумуляторных батареях для увеличения энергоемкости. Еще в одном дополнительном аспекте предложено применение металла с высокой удельной энергией для увеличения пиковой мощности в Ni-металлогидридных аккумуляторных батареях. Дополнительно, в девятом аспекте предложено применение металлов с высокой удельной энергией,таких как Al, Zn, Mg или Fe, для предотвращения коррозии гидрида металла в Ni-металлогидридных аккумуляторных батареях. Дополнительно, в десятом аспекте предложено применение материалааккумулятора водорода в электроде электрохимического элемента, также содержащем материал с высокой удельной энергией, для абсорбции водорода, образующегося в результате реакции металла с высокой удельной энергией с электролитом в этом элементе. Дополнительно, в одиннадцатом аспекте изобретения предложено применение металла с высокой удельной энергией в электроде электрохимического элемента, также содержащем материал-аккумулятор водорода, в качестве источника водорода для материала-аккумулятора водорода при реакции металла с высокой удельной энергией с электролитом в этом элементе. Автору настоящего изобретения известны всего лишь несколько патентов, в которых сообщалось об объединении материалов для использования нескольких их свойств для электродов топливных элементов. Они были упомянуты выше. До сих пор не сообщалось об использовании материаловаккумуляторов водорода и электрокатализаторов в металлическом электроде для металловоздушных то-5 011752 пливных элементов. Известны использование материалов-аккумуляторов водорода в водородном электроде для щелочных топливных элементов (AFC), а также использование гидридных химических соединений, которые реагируют с образованием водорода. Однако эти электроды отличаются от описываемых здесь металлических электродов по ряду признаков. Известные из предшествующего уровня техники электроды выполнены с возможностью обеспечения быстрого запуска щелочного топливного элемента. Предлагалось также, что при использовании этих добавок (гидридов металлов) возможно достижение обратимости топливного элемента и использование его для электролиза воды. Аноды AFC изготовляли с использованием способов приготовления пористых электродов для гарантирования достаточного транспорта газа из внешнего окружения. Это отличается от настоящего изобретения, поскольку металлический электрод в металловоздушных топливных элементах не взаимодействует с внешним окружением. Материалы-аккумуляторы водорода в упомянутых ранее патентах специально изготавливали для получения быстрой абсорбции и десорбции водорода с целью улучшения динамического поведения щелочных топливных элементов. Все отмеченные ранее патенты ограничены необходимостью подачи водорода из внешнего окружения для обеспечения функционирования. Ни в одном из этих патентов не обращалось внимания на аспект использования металла с высокой удельной энергией, такого как Al, Zn, Mg или Fe, для аккумулирования энергии внутри системы и выделения этой энергии в результате коррозии этих металлов. В настоящем изобретении материалы-аккумуляторы водорода и/или электрокатализаторы используют в сочетании с металлом, таким как Al, Zn, Mg или Fe. Это делается с целью увеличения электроэнергетической эффективности этих металлов. Такие металлы могут быть также, в сочетании с материалами-аккумуляторами водорода, использованы в качестве анода для Ni-металлогидридных аккумуляторных батарей. Это даст повышенную энергоемкость этих систем и увеличит пиковую нагрузку для таких батарей. Настоящее изобретение охарактеризовано в прилагаемой формуле изобретения. Краткое описание чертежей Ниже будут описываться варианты реализации изобретения, причем фиг. 1 иллюстрирует возможный способ сборки электрода согласно варианту реализации изобретения с использованием нескольких листов с различными свойствами; фиг. 2 показывает двухслойный электрод согласно варианту реализации изобретения, включающий в себя поглотитель водорода (гидрид металла) и электрокатализатор в одном слое и энергоноситель (металл с высокой удельной энергией) в отдельном слое; фиг. 3 показывает однослойный электрод, включающий в себя энергоноситель (металл с высокой удельной энергией), поглотитель водорода (гидрид металла) и электрокатализатор согласно варианту реализации изобретения; фиг. 4 иллюстрирует электрод согласно варианту реализации изобретения, используемый в никельметаллогидридной аккумуляторной батарее; фиг. 5 иллюстрирует электрод согласно варианту реализации изобретения, используемый в металловоздушном топливном элементе; фиг. 6 показывает резистор, подсоединенный в гальванической связи между гидридом металла и металлами с высокой удельной энергией в электроде согласно варианту реализации изобретения; фиг. 7 показывает плотность тока для анодной поляризации (100 мВ) электродов согласно варианту реализации изобретения, приготовленных из 20 мас.% Mg, смешанного с 65 мас.% углерода, с 1 мас.% Pt катализатора и без него, и 15 мас.% ПТФЭ, и с электролитом в виде 6,6 М KOH при 20 С. фиг. 8 показывает кривые поляризации электродов согласно варианту реализации изобретения, приготовленных из 20 мас.% Zn, 65 мас.% углеродного носителя с 1 мас.% Pt катализатора или без него и 15 мас.% ПТФЭ; фиг. 9 показывает скорость окисления водорода в 6,6 M KOH при 20 С на угольном электроде на связке из ПТФЭ с 1 мас.% Pt катализатора на углеродном носителе; фиг. 10 показывает окисление водорода при перенапряжении +100 мВ в 6,6 M КОН на электроде согласно варианту реализации изобретения, содержащем сплав Ni-P, который был осажден на Al, и углеродный порообразователь. Подробное описание В варианте реализации настоящего изобретения энергетически плотные металлы объединяют с материалами-аккумуляторами водорода (которые используются в Ni-металлогидридных аккумуляторных батареях) и электрокаталитическими материалами. Это позволяет водороду, полученному в результате коррозии энергетически плотных металлов, аккумулироваться внутри металлогидридного материала или участвовать в электрохимической реакции на электрокатализаторе. Таким образом, потери энергии вследствие коррозии энергоносителей (Al, Mg, Zn или Fe) минимизируются, а удельная энергия металлогидридных аккумуляторных батарей может быть увеличена. На фиг. 1 показан вариант реализации электрода согласно изобретению. Этот электрод состоит из четырех слоев: слой (I) энергоносителя (Al, Mg, Zn или Fe), слой (II) катализатора (пористый электрокатализатор с материалом-носителем или без него) и абсорбционный слой (III) (материалы-аккумуляторы-6 011752 водорода). Эти слои приготавливают в виде тонких слоев и спрессовывают друг с другом. В один или во все эти слои может быть запрессован или закаландрирован сетчатый токосъемник (VI). Вместе с тем,также возможны другие варианты реализации с меньшим количеством слоев, что будет объяснено позднее. Электроды могут быть получены различными способами. Наилучший способ основан на использовании металлических порошков, которые спекают или формуют со связующим в тонкие листы с контролируемой пористостью при использовании ПТФЭ в качестве связующего. Для увеличения контакта частиц друг с другом может быть добавлен углерод. Электроды могут быть получены каландрированием или прессованием. На фиг. 1 показан способ сборки электрода согласно варианту реализации изобретения. На фиг. 1 слой (I) энергоносителя (Zn, Al, Mg, или Fe), слой (II) катализатора (пористый электрокатализатор с материалом-носителем или без него) и абсорбционный слой (III) (материалы-аккумуляторы водорода) приготавливают в виде тонких листов, спрессованных друг с другом. Сетчатый токосъемник(VI) может быть запрессован или закаландрирован в один или во все эти листы. Водород (образовавшийся при коррозии энергоносителя) будет диффундировать в слой аккумулятора водорода или реагировать на слое электрокатализатора. Возможно также использовать только один или два листа. Это осуществляют смешением энергоносителя с материалом-аккумулятором водорода в одном листе, или смешением материала-аккумулятора водорода с электрокатализатором в одном листе, или смешением электрокатализатора и энергоносителя в одном листе, или смешением всех этих компонентов во всего лишь одном листе (проиллюстрировано на фиг. 2 и 3). Некоторые из этих возможностей будут проиллюстрированы далее в приведенных ниже примерах. На фиг. 2 и 3 показаны два альтернативных варианта реализации изобретения. На фиг. 2 электрод выполнен из двух слоев, а на фиг. 3 электрод - из одного слоя. На фиг. 2 поглотитель водорода (гидрид металла) и электрокатализатор приготовлены в одном слое, а энергоноситель (металл с высокой удельной энергией, например, Zn, Al, Fe или Mg) приготовлен в отдельном слое. На фиг. 3 энергоноситель(металлы с высокой удельной энергией, например, Zn, Al, Fe или Mg) совместно с поглотителем водорода (гидриды металлов) и электрокатализатором приготовлены в одном слое. Преимущество использования трех отдельных слоев состоит в том, что может быть достигнут лучший контроль за реакциями на индивидуальных листах. С другой стороны, при смешении более чем одного из этих материалов в одном и том же листе диффузионный пробег становится короче и взаимодействие между индивидуальными порошками увеличивается. Еще одно преимущество состоит в том, что это может привести в результате к более простым способам изготовления благодаря наличию меньшего количества этапов смешения и каландрирования. Как отмечено ранее, энергоноситель для металловоздушного топливного элемента представляет собой металл, такой как Zn, Al, Mg или Fe. Существует большое количество материалов-аккумуляторов водорода, которые могут быть использованы. Главными классами интерметаллических сплавов, образующих гидриды металлов, являются АВ 5, АВ 2, АВ и А 2 В, где А - металл IIb группы, переходный металл, редкоземельный металл или металл из ряда актиноидов; В - металл из ряда переходных металлов. Примерами АВ 5 (гексагональной или орторомбической структуры) являются LaNi5 или MmNi5, где Mm,или так называемый мишметалл, - это комбинация лантана и других редкоземельных элементов. Примером АВ 2 является ZnMn2 со структурой фазы Лавеса. Примером АВ является TiFe со структурой CsCl. Примером А 2 В является Ti2Ni со сложной структурой. Для катализа окисления водорода могут быть использованы благородные металлы, такие как платина (Pt) или палладий (Pd). Они могут присутствовать в виде чистых порошков или могут быть нанесены (осаждены) на материал-носитель с большой площадью поверхности, такой как активированный уголь или графит. Менее дорогостоящими материалами, которые могут быть использованы для катализа окисления водорода, являются никель (Ni), железо (Fe) и хром (Cr). Для увеличения каталитической активности они могут использоваться в виде порошков с высокой площадью поверхности. Альтернативный вариант состоит в том, что их наносят на материал-носитель. Для дальнейшего увеличения каталитической активности можно использовать аморфные сплавы Ni, Cr и Fe. Для получения таких сплавов осуществляют электрохимическое или химическое осаждение Ni, Cr или Fe с одновременным осаждением (соосаждением) серы (S), бора (В) или фосфора (Р). Такие сплавы также абсорбируют водород и могут действовать как материалы-аккумуляторы водорода. Описанные выше металлогидридные материалы продемонстрировали высокую каталитическую активность в отношении реакции водорода и могут быть использованы как комбинированные материалы-аккумуляторы и электрокатализаторы. Другая возможность заключается в том, что электрокатализаторы осаждают на гидридные сплавыаккумуляторы, или в том, что электрокатализаторы осаждают на энергоносители (Zn, Al, Mg или Fe). Последняя возможность заключается в том, что сплавы-аккумуляторы наносят на энергоносители вместе с электрокатализаторами или без них. Гранулы, состоящие из металлов с высокой удельной энергией, могут быть выполнены в виде отдельного листа. Этот лист может быть объединен с листом гидрида металла или листом электрокатализатора или же листом с сочетанием гидрида металла и электрокатализатора. На фиг. 2 эта конфигурация показана с использованием порошков в качестве материалов-энергоносителей. В этой конфигурации порошки могут быть заменены гранулами.-7 011752 На фиг. 5 показан электрод согласно изобретению, используемый в металловоздушном топливном элементе. Электрод согласно изобретению использован в качестве анода, а в качестве катода использован воздушный электрод, восстанавливающий кислород из воздуха. Щелочной электролит разделяет два этих электрода. На катоде кислород из воздуха диффундирует в пористый электрод. С противоположной стороны электролит частично заливает структуру. В пределах катода образуется граница раздела трех фаз. Большая площадь поверхности делает возможными высокие скорости реакции кислорода. На аноде происходит окисление металла и/или водорода. Если анод с катодом соединены, то через эту систему будет течь ток. Другое применение электрода согласно изобретению заключается в его использовании в металлогидридных аккумуляторных батареях (таких как Ni-металлогидридные аккумуляторные батареи), например так, как показано на фиг. 4. На фиг. 4 электрод согласно изобретению использован в качестве анода, тогда как в качестве катода использован никелевый электрод. Щелочной электролит разделяет два этих электрода. Для предотвращения короткого замыкания элемента между данными электродами введен сепаратор. Как показано в приведенных ниже примерах, возможно смешение металлов (Zn, Al, Mg или Fe) с материалами-аккумуляторами водорода. В случае применения смеси материалов-аккумуляторов и материалов-энергоносителей (Al, Mg, Fe, Zn) вместо чистого материала-аккумулятора водорода батарея становится самозаряжаемой. В результате растворения металлов-энергоносителей (Zn, Al, Mg или Fe) медленно образуется водород. Этот водород, который образовался за счет коррозии Zn, Al, Mg или Fe, диффундирует затем в металлогидридный материал-аккумулятор и заряжает систему. Это значительно увеличивает срок службы батареи. Растворение энергоносителей и реакции абсорбции-десорбции водорода являются обратимыми и поэтому такая батарея может быть перезаряжена. Кроме того, действие металлов-энергоносителей вNi/металлогидридных аккумуляторных батареях будет увеличивать пиковую мощность, поскольку растворение энергоносителя сопровождается малыми поляризационными потерями и не имеет диффузионных ограничений. Дополнительные выгоды заключаются в том, что может быть сформирована гальваническая связь между металлами, такими как Zn, Al, Mg и Fe, и более благородными металлами, такими как сплавыаккумуляторы на основе Ni. Результатом этого будет катодная поляризация более благородного металла и облегчение адсорбции и абсорбции водорода. Дополнительные выгоды от гальванической связи заключаются в том, что она может снизить скорость коррозии сплавов-аккумуляторов и, таким образом,увеличить срок службы Ni/металлогидридных аккумуляторных батарей. Если материал-энергоноситель(Al, Zn, Mg или Fe) и сплав-аккумулятор разделены на два листа, то для гальванической связи между этими материалами может быть введен резистор. Это может быть выгодно для снижения катодного перенапряжения сплава-аккумулятора и, таким образом, снижения выделения водорода на этом сплаве. Это показано на фиг. 6. Примеры Пример 1. В нижеследующем примере проиллюстрирован эффект от добавления электрокатализатора к металлическому электроду. Показано, что электрокатализатор будет увеличивать общую плотность тока при окислении водорода, получающегося в результате коррозионной реакции на металлах. Порошковый электрод приготавливали с использованием металлических порошков, таких как Zn,Al, Mg или Fe, углеродного порошка с носителем катализатора и без него и ПТФЭ. Электрод приготавливали смешением этих порошков в высокоскоростной мельнице на 20000 об/мин. Это давало агломерат. Данный агломерат превращали в глину с использованием углеводородного растворителя. Глину подвергали каландрированию в электрод. При каландрировании в электрод в качестве токосъемника вводили никелевую (Ni) сетку. Количество металла (Zn, Mg, Al, Fe) варьировали от 5 до 95 мас.%. Добавляли по меньшей мере 5 мас.% ПТФЭ для связывания электрода в единое целое. На фиг. 7 показаны скорость окисления водорода на Pt-м катализаторе и ток растворения в случае растворения Mg. На данной фигуре показана плотность тока i [А/см 2] в зависимости от времени Т [с] для анодной поляризации (100 мВ) электродов, приготовленных из 20 мас.% Mg, смешанного с 65 мас.% углерода и 15 мас.% ПТФЭ, с электролитом из 6,6 M KOH при 20 С. Были приготовлены два электрода: один с платиновым (Pt) катализатором на углеродном носителе, а второй - с углеродным носителем безPt-го катализатора. Для образца с Pt на углеродном носителе количество осажденной на углерод Pt составляло 1 мас.%. В этом примере металл с высокой удельной энергией (Mg) и катализатор (Pt на углеродном носителе) приготавливали в виде одного слоя. Задача заключалась в том, чтобы определить влияние катализатора на получающийся при растворении Mg водород. Это достигается сравнением электрода, содержащего Pt-й катализатор, с электродом без Pt на углеродном носителе. В случае образца без катализатора ток обусловлен только растворением Mg. В случае образца с добавленным Pt-м катализатором наблюдается дополнительный вклад в ток. Этот ток обусловлен окислением водорода на катализаторе.-8 011752 При окислении водорода наблюдается падение плотности тока со временем. Это обусловлено приложенным анодным потенциалом. Анодная поляризация снижает скорость образования водорода из Mg,а потому и количество водорода, доступного для окисления. Данный эксперимент ясно демонстрирует выгоду от добавления электрокатализаторов к металлическим электродам в металловоздушных топливных элементах, поскольку это увеличит ток за счет окисления водорода, получаемого в результате коррозии или анодного растворения металлов. На фиг. 8 показаны кривые поляризации, на которых плотность тока i [А/см 2] представлена в зависимости от времени Т [с], для двух Zn-х электродов, приготовленных таким же самым образом, как описано выше для Mg-х электродов. Снова один электрод был приготовлен с Pt-м катализатором, а другой без него. Из кривых анодной поляризации ясно видно, что скорость окисления значительно увеличивается при добавлении Pt-го катализатора также и для металлов с более низкой скоростью образования водорода. Электроды на фиг. 8 приготовлены из 20 мас.% Zn, 65 мас.% углеродного носителя и 15 мас.% ПТФЭ. Электролитом был 6,6 М KOH при 20 С. Также и в случае этих электродов один из них был изготовлен с 1 мас.% Pt, осажденной на углеродный носитель, а другой - с чистым углеродным носителем. Пример 2. Как показано на фиг. 1 и 2, электроды могут быть приготовлены путем соединения нескольких слоев с различным составом. В данном примере показано, что водород, образовавшийся в слое чистого металла-энергоносителя, будет диффундировать в слой чистого катализатора и там окисляться, давая дополнительный вклад в ток. Приготавливали два отдельных слоя, а затем объединяли путем совместного их каландрирования. Один слой приготавливали с металлом с высокой удельной энергией, а другой представлял собой углеродный слой. Оба слоя были изготовлены из порошков агломерированием и каландрированием, как это описано выше. В металлическом электроде не присутствовал катализатор или углерод, а только ПТФЭ и металлы, такие как Al, Zn, Mg, Fe, или комбинации этих металлов. Углеродные электроды приготавливали с использованием 15 мас.% ПТФЭ и 85 мас.% углерода. На этот углеродный носитель осаждали 1 мас.% Pt. Если в каком-либо слое используется углерод, то получается пористая структура. Это позволяет осуществить быструю диффузию водорода в этот слой. Катализатор (Pt) на углеродном носителе делает возможным окисление водорода. Два этих слоя собирали и спрессовывали друг с другом. Для предотвращения электрического контакта между этими слоями между ними помещали лист пористого полипропилена. Перфорированный лист полипропилена не препятствовал газовой диффузии. В этом случае зависимость ток-потенциал для двух данных слоев может быть измерена отдельно. На фиг. 9 показан анодный ток i [А/см 2] на углеродном слое с Pt-м катализатором в зависимости от приложенного потенциала Е для различных количеств Zn в металлическом электроде. На фиг. 9 показана скорость окисления водорода для этого слоя в 6,6 M KOH при 20 С. Водород, образовавшийся за счет коррозии Zn, диффундирует в углеродный слой и реагирует на Pt-м катализаторе. Количество Zn в слоеZn варьировали от 0 до 100 мас.%; при этом на фиг. 9 показаны графики для 0, 80, 95 и 100 мас.% Zn. В случае образца со 100% Zn использовали пластину из чистого Zn. Как можно видеть, в случае углеродного электрода протекает лимитируемая диффузией анодная реакция. Это обусловлено тем, что вырабатываемый на Zn-м электроде водород диффундирует в углеродный электрод и реагирует на катализаторе. При снижении количества ПТФЭ в Zn-м электроде выделение водорода из этого Zn-го электрода увеличивается. Как показано на фиг. 9, лимитируемая диффузией реакция окисления водорода усиливается на углеродном электроде с увеличением выработки водорода. Данный пример ясно показывает, что водород, вырабатываемый в результате нежелательной коррозии металлов, таких как Al, Mg, Zn и Fe, может быть полезно использован в отдельном углеродном слое с электрокатализатором. Использование слоя катализатора дает преимущество, заключающееся в том, что увеличивается электроэнергетическая эффективность металла с высокой удельной энергией. В этом случае минимизируются потери энергии вследствие растворения металла. Пример 3. В данном примере показано, что водород, образовавшийся в результате коррозии металлов, может аккумулироваться в металлах-аккумуляторах водорода и реагировать на поверхности этих металловаккумуляторов. Электроды приготавливали из металлических порошков Al, Fe, Zn или Mg, углерода с катализатором или без него и ПТФЭ. На металлические порошки осаждали сплав Ni, обладающий способностью аккумулировать водород. Это осуществляли путем либо электрохимического осаждения Ni-P, либо осаждения Ni-P методом химического восстановления. Порошки агломерировали и подвергали каландрированию, как описано выше. На фиг. 10 показано окисление водорода при перенапряжении 100 мВ в 6,6 М KOH на электроде согласно варианту реализации изобретения, содержащем сплав Ni-P, который был осажден на Al, и углеродный порообразователь. Коррозия Al приводила к образованию водорода. Этот водород абсорбировался в упомянутый сплав. При анодной поляризации абсорбированный водород реагирует с поверхностью.-9 011752 Ток увеличивается, если дополнительный водород от коррозии Al-го листа попадает на электрод. На фиг. 10 показана плотность тока i [А/см 2] при анодном перенапряжении 100 мВ в зависимости от времени Т [с]. Измерения тока были выполнены после того, как коррозия растворила весь Al. Нижняя кривая плотности тока показывает окисление водорода, который был аккумулирован в сплаве Ni-P в течение растворения Al. Верхняя кривая плотности тока показывает окисление водорода в том случае, когда растворяется дополнительный слой Al, и водород диффундирует в электрод и реагирует с каталитической поверхностью сплава Ni-P. Данный пример показывает, что водород от коррозии металлов может быть аккумулирован в сплаве-аккумуляторе водорода во время растворения металла, и что при анодных перенапряжениях этот водород будет реагировать на поверхности этого сплава-аккумулятора. В этом случае потери в электроэнергетической емкости из-за растворения металла с высокой удельной энергией могут быть минимизированы за счет аккумулирования энергии в виде водорода в гидридах металлов. Этот водород может быть эффективно преобразован в электрическую энергию путем использования катализаторов реакции водорода. Из рассмотрения описанных выше конкретных вариантов реализации изобретения специалистам в данной области техники будет очевидно, что могут быть использованы и другие варианты реализации,включающие в себя изложенные принципы. Рассмотренные выше и другие примеры изобретения приведены только в качестве примера, а фактический объем изобретения должен определяться по нижеследующей формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Электрод для использования в электрохимическом элементе, содержащий материал-аккумулятор водорода и металл с высокой удельной энергией, выбранный по меньшей мере из одного из Al, Zn, Mg иFe или сплава любого из них, причем материал-аккумулятор водорода и металл с высокой удельной энергией размещены в электроде таким образом, что металл с высокой удельной энергией способен действовать в качестве анодного материала для элемента, при этом металл с высокой удельной энергией и/или материал-аккумулятор водорода присутствует в электроде в виде, при котором он смешан с политетрафторэтиленом и/или углеродом. 2. Электрод по п.1, в котором металл с высокой удельной энергией размещен в электроде в виде первого листа, а материал-аккумулятор водорода размещен в электроде в виде второго листа. 3. Электрод по п.1 или 2, в котором материал-аккумулятор водорода представляет собой сплав, выбранный из группы, состоящей из сплавов редкоземельного металла/мишметалла, циркониевых сплавов,титановых сплавов и смесей таких сплавов. 4. Электрод по пп.1-3, в котором материал-аккумулятор водорода представляет собой гидрид металла, выбранного из группы, состоящей из АВ 5, АВ 2, AB и А 2 В, где А - металл IIb группы, переходный металл, редкоземельный металл или металл из ряда актиноидов, а В - металл из ряда переходных металлов. 5. Электрод по п.4, в которомAB5 имеет гексагональную или орторомбическую структуру и представляет собой LaNi5 илиAB2 представляет собой ZnMn2 со структурой фазы Лавеса; АВ представляет собой TiFe со структурой CsCl иA2B представляет собой Ti2Ni со сложной структурой. 6. Электрод по любому из пп.1-5, который дополнительно содержит водородный электрокатализатор. 7. Электрод по п.6, в котором водородный электрокатализатор представляет собой благородный металл, Ni, Fe, Cr или сплав, содержащий по меньшей мере один из этих металлов. 8. Электрод по п.6 или 7, в котором водородный электрокатализатор находится в виде чистого порошка, осажденного на материал-носитель с большой площадью поверхности. 9. Электрод по п.8, в котором материал-носитель с большой площадью поверхности представляет собой активированный уголь или графит. 10. Электрод по любому из пп.1-9, в котором металл с высокой удельной энергией и материалаккумулятор водорода находятся в виде единого листа. 11. Электрод по любому из пп.6-10, в котором металл с высокой удельной энергией, материалаккумулятор водорода и водородный электрокатализатор находятся в виде единого листа. 12. Электрод по любому из пп.6-10, в котором металл с высокой удельной энергией и водородный электрокатализатор находятся в виде первого листа, а материал-аккумулятор водорода находится в виде второго листа. 13. Электрод по любому из пп.6-10, в котором металл с высокой удельной энергией находится в виде первого листа, материал-аккумулятор водорода находится в виде второго листа, а водородный электрокатализатор находится в виде третьего листа.- 10011752 14. Электрод по любому из пп.10-13, в котором в один из листов запрессован или закаландрирован сетчатый токосъемник. 15. Электрод по любому из пп.1-14, в котором металл с высокой удельной энергией находится в виде гранул или порошка. 16. Электрод по любому из пп.1-15, который содержит слой энергоносителя; слой катализатора; слой абсорбции водорода и один или оба из сетчатого токосъемника и механической опоры. 17. Электрод электрохимического элемента, представляющий собой электрод по любому из пп.1-16,содержащий материал-аккумулятор водорода для абсорбции водорода, получаемого при реакции упомянутого металла с высокой удельной энергией с электролитом в упомянутом элементе. 18. Электрод электрохимического элемента, представляющий собой электрод по любому из пп.1-16,содержащий металл с высокой удельной энергией, который при реакции с электролитом в упомянутом элементе образует водород, аккумулируемый в материале-аккумуляторе водорода. 19. Способ изготовления электрода по любому из пп.1-16 для использования в электрохимическом элементе, включающий в себя спекание или формование со связующим по меньшей мере одного из металла с высокой удельной энергией и материала-аккумулятора водорода по меньшей мере в один тонкий лист и каландрирование или прессование упомянутого по меньшей мере одного листа с формированием электрода. 20. Способ по п.19, в котором регулируют пористость с использованием политетрафторэтилена в качестве связующего. 21. Способ по п.19 или 20, в котором контакт частиц с частицами увеличивают путем добавления углерода. 22. Способ по любому из пп.19-21, в котором в упомянутый по меньшей мере один лист запрессовывают или закаландрировывают токосъемник. 23. Металловоздушный топливный элемент, содержащий в качестве анода электрод по любому из пп.1-16. 24. Металлогидридный элемент аккумуляторной батареи, содержащий в качестве анода электрод по любому из пп.1-16. 25. Элемент по п.24, который представляет собой никель-металлогидридный элемент. 26. Элемент по п.25, в котором для предотвращения коррозии гидрида металла организована гальваническая связь между отдельными слоями, содержащими, соответственно, металл с высокой удельной энергией и гидрид металла. Иллюстрация возможного способа сборки электрода при использовании нескольких листов с различными свойствами- 11011752 Иллюстрация электрода, включающего в себя поглотитель водорода (гидрид металла) и электрокатализатор в одном слое и энергоноситель Фиг. 5 Иллюстрация резистора, подсоединенного между электродами для гальванической связи между гидридом металла и металлами с высокой удельной энергией Фиг. 6 Плотность тока для анодной поляризации (100 мВ) 20 мас.% Mg,смешанного с 65 мас.% углерода, с 1 мас.% Pt-го катализатора и без него и 15 мас.% ПТФЭ. Электролитом являлся 6,6 М KOH при 20 С- 13011752 Кривые поляризации электродов, приготовленных из 20 мас.% Zn,65% мас.% углеродного носителя с 1 мас.% Pt-го катализатора или без него и 15 мас.% ПТФЭ. Электролитом являлся 6,6 М KOH при 20 С Фиг. 8 Скорость окисления водорода в 6,6 М KOH при 20 С на угольном электроде на связке из ПТФЭ с 1 мас.% Pt-го катализатора на углеродном носителе. Производящий водород Zn-й электрод был запрессован в угольный электрод,но отделен изолирующим листом, который допускал диффузию газа. Получаемый в результате коррозии Zn водород реагирует на Pt-м катализаторе угольного электрода. Количество Zn на Zn-м электроде варьировали от 0 до 100 мас.%- 14011752 Окисление водорода при перенапряжении 100 мВ в 6,6 М KOH на электроде,содержащем сплав Ni-P, который был осажден на Al, и углеродный порообразователь. Коррозия Al приводит к образованию водорода. Этот водород абсорбировался в сплав. При анодной поляризации абсорбированный водород реагирует на поверхности. Ток увеличивается, когда на электрод попадает дополнительный водород от коррозии Al-го листа
МПК / Метки
МПК: H01M 4/62, H01M 4/30, H01M 4/26, H01M 4/04, H01M 4/36, H01M 12/08, H01M 10/34, H01M 4/38, C01B 3/00, H01M 4/64, H01M 4/24
Метки: электрод, элемент, способ, металлогидридный, изготовления, металловоздушный, топливный
Код ссылки
<a href="https://eas.patents.su/16-11752-elektrod-sposob-ego-izgotovleniya-metallovozdushnyjj-toplivnyjj-element-i-metallogidridnyjj-element.html" rel="bookmark" title="База патентов Евразийского Союза">Электрод, способ его изготовления, металловоздушный топливный элемент и металлогидридный элемент</a>
Предыдущий патент: Укупорочное устройство
Следующий патент: Диагностическая система для проведения амплификации и детекции последовательностей нуклеиновых кислот
Случайный патент: Гранулярные препараты габоксадола












