Диагностическая система для проведения амплификации и детекции последовательностей нуклеиновых кислот
Номер патента: 11753
Опубликовано: 30.06.2009
Авторы: Карльсен Франк, Лихтенберг Ян, Шонфельд Фридхельм, Ферпоорте Забет, Фон Гермар Фритьоф
Формула / Реферат
1. Интегрированная диагностическая система "лаборатория-на-чипе" для подготовки к анализу образца текучей среды, содержащего клетки и/или частицы, включающая следующие компоненты, расположенные на общей подложке:
(a) входное отверстие для образца текучей среды;
(b) блок лизиса для лизиса клеток и/или частиц, содержащихся в образце текучей среды;
(c) блок экстракции нуклеиновой кислоты для экстракции нуклеиновых кислот из клеток и/или частиц, содержащихся в образце текучей среды;
(d) резервуар, содержащий текучую среду для лизиса;
(e) резервуар, содержащий растворитель для элюирования для перемещения нуклеиновых кислот, накапливающихся в блоке экстракции нуклеиновой кислоты;
в которой входное отверстие для образца сообщается с блоком лизиса посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан;
в которой блок лизиса сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан;
в которой резервуар, содержащий текучую среду для лизиса, сообщается с блоком лизиса посредством текучей среды, а для контроля потока текучей среды между ними имеется клапан;
в которой резервуар, содержащий растворитель для элюирования, сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, а для контроля потока текучей среды между ними имеется клапан; и
в которой, кроме того, имеется единый насос или шприц для приведения в действие всех жидкостей.
2. Система по п.1, где резервуар, содержащий текучую среду для лизиса, сообщается с входным отверстием посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан.
3. Система по п.1 или 2, где резервуар, содержащий элюент, сообщается с входным отверстием посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан.
4. Система по любому из пп.1-3, кроме того, включающая: (g) блок взаимодействия нуклеиновой кислоты, предпочтительно блок амплификации и детекции последовательности нуклеиновой кислоты, в которой блок экстракции нуклеиновой кислоты сообщается с блоком взаимодействия нуклеиновой кислоты посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан.
5. Система по любому из пп.1-4, кроме того, включающая: (h) блок для отходов, в которой блок для отходов сообщается с блоком лизиса посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан.
6. Система по любому из пп.1-5, кроме того, включающая: (i) резервуар, содержащий растворитель для промывки, предпочтительно этанол, этот резервуар сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан.
7. Система по любому из пп.1-6, кроме того, включающая: (j) резервуар, содержащий дополнительный растворитель для промывки, предпочтительно изопропанол, этот резервуар сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан.
8. Система по п.6 или 7, в которой резервуар, содержащий растворитель для элюирования, сообщается посредством текучей среды с резервуаром, содержащим первый растворитель для промывки, и/или с резервуаром, содержащим второй растворитель для промывки.
9. Система по п.8, в которой растворитель для элюирования, первый растворитель для промывки и/или второй растворитель для промывки содержатся в общем резервуаре.
10. Система по п.9, в которой растворитель для элюирования, первый растворитель для промывки и/или второй растворитель для промывки отделены друг от друга в общем резервуаре при помощи текучей среды, предпочтительно воздуха.
11. Система по п.9 или 10, в которой общий резервуар включает трубку, сообщающуюся с входным отверстием и блоком лизиса посредством текучей среды.
12. Система по любому из пп.1-11, кроме того, включающая: (k) средство для введения жидкого образца и/или воздуха во входное отверстие, где указанное средство предпочтительно включает насос или шприц.
13. Система по любому из пп.1-11, кроме того, включающая блок фильтрации, причем этот блок сообщается с блоком лизиса посредством текучей среды.
14. Система по п.13, в которой блок фильтрации включает один или несколько фильтров тупиковой фильтрации, фильтров перекрестного потока, например микроструктурированных каналов, пористых полых волокон или мембран, гравитационных осадителей, центрифуг, акустических клеточных фильтров, оптических ловушек, способов, основанных на диэлектрофорезе (DEP), электрофорезе, проточной цитометрии и адсорбции.
15. Система по любому из пп.1-11, в которой блок лизиса, кроме того, включает средства фильтрации образца текучей среды.
16. Система по п.15, в которой указанные средства включают один или несколько фильтров тупиковой фильтрации, фильтров перекрестного потока, например микроструктурированных каналов, пористых полых волокон или мембран, гравитационных осадителей, центрифуг, акустических клеточных фильтров, оптических ловушек, способов, основанных на диэлектрофорезе (DEP), электрофорезе, проточной цитометрии и адсорбции.
17. Система по любому из предыдущих пунктов, причем система, кроме того, включает средства для нагревания содержимого блока лизиса и/или блока экстракции нуклеиновой кислоты.
18. Система по п.17, в которой указанное средство включает один или несколько элементов Peltier, расположенных в блоке лизиса, и/или блоке экстракции нуклеиновой кислоты, или рядом с ними.
19. Система по любому из предыдущих пунктов, в которой блок экстракции нуклеиновой кислоты, по крайней мере, частично заполнен гранулами или частицами кремния.
20. Система по п.19, в которой блок экстракции нуклеиновой кислоты, кроме того, включает один или несколько наборов электродов рядом с гранулами или частицами кремния для накопления и/или предварительного концентрирования элюированных нуклеиновых кислот.
21. Система по п.20, в которой указанный один или несколько комплектов электродов включают платиновые электроды.
22. Система по любому из предыдущих пунктов для экстракции нуклеиновых кислот, присутствующих в биологической текучей среде, молочном продукте, текучей среде окружающей среды или питьевой воде.
23. Прибор для анализа биологических образцов и/или образцов окружающей среды, причем прибор включает систему, определенную в любом из предыдущих пунктов.
24. Набор для анализа биологических образцов и/или образцов окружающей среды, причем набор включает систему, определенную в одном из пп.1-22, и средства для приведения в контакт образца и системы.
25. Прибор по п.23 или набор для анализа по п.24, который является одноразовым.
Текст
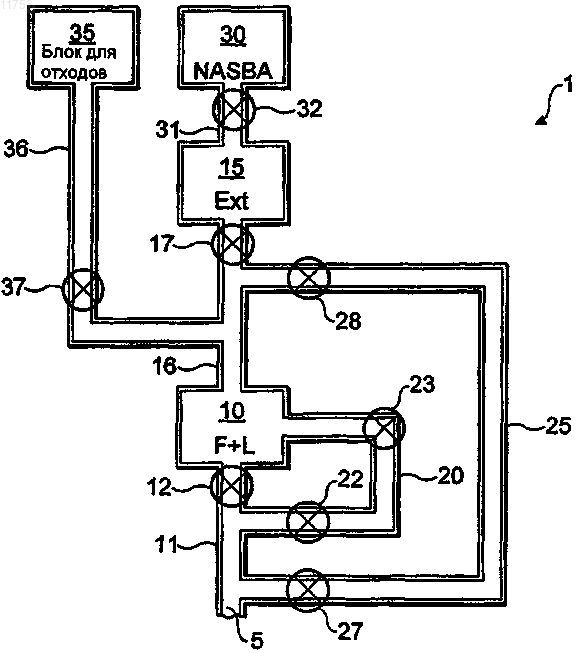
011753 Настоящее изобретение относится к экстракции нуклеиновой кислоты (НК), и в частности к интегрированной диагностической системе "лаборатория-на-чипе" для проведения комбинированной экстракции и концентрации НК. Система может применяться для проведения амплификации и детекции последовательности НК в жидком образце, содержащем клетки. Существует значительный интерес к разработке упрощенных систем анализа для детекции биологических молекул, которые могли бы позволить неквалифицированному пользователю выполнять сложные процедуры анализа без излишних ошибок. Кроме того, существует большая заинтересованность в разработке систем закрытого анализа, для которых требуется минимальное количество жидких реагентов и которые могут быть автоматизированы для выполнения процедуры анализа при минимальном вмешательстве со стороны пользователя и, предпочтительно, уменьшены в размере для получения удобной системы для тестирования в удобном для пользователя месте. Это особенно важно в области здравоохранения, главным образом, в диагностике, где наблюдается возрастающая потребность в системах биологического анализа, которые можно эффективно и безопасно применять в кабинете врача-хирурга, клинике, ветеринарном хирургическом кабинете или даже на дому у пациента или на открытой местности. Микроустройства "лаборатория-на-чипе" являются приемлемым вариантом для осуществления закрытых биологических реакций, для которых минимальное использование требуется пользователю реагента, а также которые позволяют использовать малые объемы образцов, что является значительным преимуществом для биологических реакций, для которых требуются дорогостоящие реагенты. Для достижения как очистки, так и для предварительного концентрирования химики-аналитики, в основном, прибегали к любому способу экстракции. Эти способы включают удаление интересующих аналитов из матрицы образца или, в другом варианте, удаление всех других составляющих из матрицы образца, оставляя интересующие аналиты. Способы экстракции могут включать перенос образцов из одной жидкой фазы в другую или фиксацию образцов из жидкой фазы на твердую поверхность. В первом случае предварительное концентрирование образцов, в общем, не достигается, если растворитель активно удаляется из фазы, содержащей эти образцы. Однако в последнем случае может быть достигнуто предварительное концентрирование, если: (а) доступный участок связи является достаточно большим,чтобы связать количество молекул, большее, чем присутствует в растворе в контакте с поверхностью в любой момент времени, и (b) образцы могут быть эффективно удалены из твердой фазы с использованием лишь небольшого количества растворителя для элюирования. Так как предварительное концентрирование является важным аспектом процедуры предварительной обработки образца нуклеиновой кислоты,то было принято использовать экстракцию твердой фазы. Известный способ экстракции нуклеиновой кислоты включает связывание ДНК с частицами окиси кремния в присутствии хаотропного агента (см.Boom et al., J. Clin. Microbiol. 1990, 28, 495-503). В настоящем изобретении предусмотрена интеграция способа твердофазной экстракции ДНК в микрогидравлические устройства. В настоящем изобретении могут быть комбинированы экстракция и концентрация НК. Применяемый здесь термин "микроустройство или система" означает любое устройство, произведенное с применением технологий, которые обычно, но не исключительно, применяются в серийном производстве полупроводниковых микроэлектронных устройств и в последние годы для продукции полупроводниковых микромеханических устройств. Подобные технологии микрообработки включают,например, эпитаксиальное выращивание (например, парофазное, жидкофазное, молекулярно-пучковое,металлоорганическое химическое парофазное осаждение), литографию (например, фото-, электроннолучевую, рентген-, ионно-лучевую), травление (например, химическое, газофазное, плазменное), электроосаждение, распыление, диффузионное легирование и ионную имплантацию. Несмотря на то, что могут применяться некристаллические материалы, такие как стекло, микроустройства обычно получают на кристаллических полупроводниковых субстратах, таких как оксид силикона или арсенид галлия, преимуществом которых является возможность электронных схем интеграции в систему обычными технологиями производства интегральных схем. Комбинации микрокомпонента с одним или несколькими другими элементами, такими как стеклянная пластинка или дополнительный микроэлемент, часто применяются и могут находиться в объеме применяемого здесь термина "придание микроформы". Также в объем термина "придание микроформы" входят полимерные реплики, полученные, например, из кристаллического полупроводникового субстрата. Выделение и очистка ДНК и/или РНК от бактериальных клеток и вирусных частиц является основной стадией во многих областях, например в диагностике, мониторинге окружающей среды, судебной медицине и исследованиях в области молекулярной биологии. Придание микроформы является эффективным способом конструирования для производства устройств для осуществления биологических процессов, при которых требуются очень небольшие объемы образцов, таких как секвенирование и детекция ДНК. Одно такое устройство для осуществления полимеразной цепной реакции (ПЦР) с последующей стадией детекции раскрыто в патенте США 5674742. Для переноса ДНК-праймеров, реагентов полимеразы и реагентов нуклеотидов из трех отдельных камер хранения в единую реакционную камеру, если требуется осуществление процесса ПЦР, при необходимости, с циклическим изменением температуры в реакционной камере, применяются генераторы волн Лэмба.-1 011753 Другое микроустройство для осуществления стадии химической реакции, сопровождаемой шагом электрофоретического разделения, раскрыто в Analytical Chemistry 1994, 66, 4127-4132. Травленные структуры в силиконовом субстрате, покрытом стеклянной пластинкой, обеспечивают реакционную камеру и связи с резервуарами для буфера, аналита, реагента и для отходов аналита, а также столбец электрофореза, связанный с резервуаром для отходов. Амплификация, основанная на последовательности нуклеиновых кислот (NASBA), является праймерзависимой технологией, которая может применяться для непрерывной амплификации нуклеиновых кислот в отдельной смеси при неизменной температуре (способ изотермической амплификации нуклеиновой кислоты), и является одним из первых описанных способов амплификации РНК на основе транскрипции. Для амплификации нуклеиновой кислоты NASBA обычно является простой и быстрой альтернативой ПЦР и способна осуществить амплификацию миллиарда участков РНК за 90 мин. По отношению к другим системам амплификации, таким как технология ПЦР, способность NASBA однородно и изотермически амплифицировать РНК аналитов расширяет широту ее применения от диагностики вирусов до индикации биологической активности, например экспрессии гена и жизнеспособности клетки. Технология NASBA описана, например, в журнале Nature350, стр. 91 и 92. Амплификация нуклеиновой кислоты в NASBA достигается совместной ферментативной активностью обратной транскриптазы вируса миобластомы птиц, РНК-азы Н и РНК-полимеразы Т 7, совместно с парой праймеров, что приводит к накоплению, главным образом, одноцепочечной РНК, которая может легко использоваться для детекции с помощью способов гибридизации. Применение внутреннего стандарта РНК в NASBA приводит к способу количественной детекции нуклеиновой кислоты с динамическим диапазоном в четыре регистрации, но для которого требуется шесть реакций амплификации на квантификацию. Этот способ резко улучшается при применении множественных, различимых, внутренних стандартов РНК, добавляемых в различных количествах, и технологии детекции на основе электрохемилюминесценции (ECL). Эта однотрубочная количественная (Q) NASBA требует только одного шага процесса амплификации на квантификацию и дает возможность добавлять внутренние стандарты к клиническому образцу в буфере для лизиса до фактического выделения нуклеиновой кислоты. Преимущество этого подхода в том, что эффективность выделения нуклеиновой кислоты нисколько не влияет на результат количественного анализа, в отличие от способов, в которых внутренние стандарты смешиваются с нуклеиновой кислотой дикого типа после их выделения из клинического образца. Количественный способ NASBA описан в журналеNASBA, может все же быть трудоемкой процедурой, обычно включающей детекцию на основе гранул фермента и электрохемилюминесцентную (ECL) детекцию или флуоресцентную корреляционную спектрофотометрию. Однако, поскольку эти методы разнородны или требуют какой-либо обработки образцов или робототехнических устройств, которые в настоящее время являются экономически невыгодными, они относительно редко применяются при необходимости обработки большого количества материала. Однородная процедура, при которой детекция продукта производится одновременно с целевой амплификацией с помощью генерации направленного сигнала, будет облегчать крупномасштабный скрининг и полную автоматизацию. В последнее время была представлена новая технология детекции нуклеиновой кислоты, основанная на зондах (молекулярных маяках), которые флуоресцируют только при гибридизации с их мишенью. Флюидика является наукой о течении жидкости, например, по трубам. В микроустройствах поток текучей среды через один или большее число наборов реакционных камер микро- или наноразмера обычно достигается с применением насоса, такого как пипетка, ротационный насос или находящийся вне устройства источник с предварительно созданным вакуумом или давлением. В другом варианте микронасос, или вакуумная камера, или элементы генерации волн Лэмба могут быть представлены непосредственно в виде части устройства. Для контроля потока текучих сред через реакционные камеры могут применяться другие комбинации элементов контроля потока, включая насосы, клапаны и камеры с предварительно созданным вакуумом и повышенным давлением. Другие механизмы для перемещения текучих сред в системе включают электроосмотический поток. Международная заявка на патентWO02/22265 относится к микросистеме реакционной камеры,которая может применяться в способе осуществления NASBA. Международная заявка на патентPCT/GB02/005945 относится к микроизготовленной системе реакционной камеры и способу перемещения текучей среды. Система может также применяться в способе осуществления NASBA. Международная заявка на патент PCT/GB03/004768 касается микрогидравлического устройства для фрагментации нуклеиновой кислоты. Устройство может применяться в микроизготовленной системе реакционной камеры или совместно с ней для осуществления NASBA. Настоящее изобретение относится к системе для осуществления процесса подготовки образца на образце текучей среды, содержащей клетки и/или частицы, система включает:(a) входное отверстие для образца текучей среды;(b) блок лизиса для лизиса клеток и/или частиц, содержащихся в образце текучей среды;(c) блок экстракции нуклеиновой кислоты для экстракции нуклеиновых кислот из клеток и/или частиц, содержащихся в образце текучей среды;(d) резервуар, содержащий текучую среду для лизиса;(e) резервуар, содержащий растворитель для элюирования для удаления нуклеиновых кислот, накапливающихся в блоке экстракции нуклеиновой кислоты; в которой входное отверстие образца сообщается с блоком лизиса посредством текучей среды, для контроля потока текучей среды между ними имеется дополнительный клапан; в которой блок лизиса сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, для контроля потока текучей среды между ними имеется дополнительный клапан; в которой резервуар, содержащий текучую среду для лизиса, сообщается с блоком лизиса посредством текучей среды, для контроля потока текучей среды между ними имеется дополнительный клапан; и в которой резервуар, содержащий растворитель для элюирования, сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, для контроля потока текучей среды между ними имеется дополнительный клапан. Для обычной диагностики система может применяться на образцах объемом в миллилитр. Система основана на предварительной загрузке некоторых реагентов. В настоящем изобретении экстракция и концентрирование нуклеиновой кислоты могут сочетаться. Соответственно, настоящее изобретение относится к интегрированной системе диагностики "лаборатория-на-чипе" для осуществления процесса подготовки образца. Система может применяться для осуществления NASBA в микроизготовленной системе реакционной камеры или совместно с ней. По крайней мере, некоторым из компонентов системы предпочтительно придана микроформа. Предпочтительно блок лизиса, блок экстракции нуклеиновой кислоты, резервуар текучей среды для лизиса и резервуар растворителя для элюирования являются микроизготовленными и интегрированными,то есть сформированы на общем субстрате. Резервуар, содержащий текучую среду для лизиса, предпочтительно сообщается с входным отверстием посредством текучей среды, для контроля потока текучей среды между ними имеется дополнительный клапан. Резервуар, содержащий растворитель для элюирования, предпочтительно сообщается с входным отверстием посредством текучей среды, для контроля потока текучей среды между ними имеется дополнительный клапан. Система по настоящему изобретению обычно, кроме того, включает: (g) блок взаимодействия нуклеиновой кислоты, в которой блок экстракции нуклеиновой кислоты сообщается с блоком взаимодействия нуклеиновой кислоты посредством текучей среды, для контроля потока текучей среды между ними имеется дополнительный клапан. Предпочтительно блок взаимодействия нуклеиновой кислоты представлен в микроформе и предпочтительно интегрирован с другими компонентами. В блоке взаимодействия может быть осуществлена любая обычная реакция. Предпочтительно реакция позволяет осуществлять детекцию целевой специфической последовательности и/или количественный анализ. Блок взаимодействия нуклеиновой кислоты обычно включает блок амплификации и детекции последовательности нуклеиновых кислот, который запускает детекцию специфических последовательностей с помощью реакции амплификации нуклеиновой кислоты. Примеры включают ПЦР и изотермические технологии амплификации, такие как NASBA. Самой предпочтительной является NASBA в реальном времени с применением молекулярных маяков. Соответственно, в предпочтительном аспекте настоящее изобретение предоставляет интегрированную систему диагностики "лаборатория-на-чипе" для осуществления подготовки образца, процесса амплификации и детекции последовательности нуклеиновых кислот в образце текучей среды, содержащем клетки и/или частицы, более предпочтительно NASBA в реальном времени. В международной заявке на патентWO02/22265 описана микросистема реакционной камеры для осуществления NASBA. Система по настоящему изобретению предпочтительно включает концентрирование, например, инфицированных эпителиальных клеток, лизис и экстракцию мРНК и амплификацию и детекцию в реальном времени. Система может применяться, например, для скрининга карциномы шейки матки. Система по настоящему изобретению будет обычно, кроме того, включать: (h) блок для отходов,блок для отходов в системе сообщается с блоком лизиса посредством текучей среды, для контроля потока текучей среды между ними имеется дополнительный клапан. Предпочтительно блок для отходов представлен в микроформе и предпочтительно интегрирован с другими компонентами. Система будет обычно, кроме того, включать: (i) резервуар, содержащий растворитель для промывки,этот резервуар сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, для контроля потока текучей среды между ними имеется дополнительный клапан. Предпочтительно резервуар, содержащий растворитель для промывки, представлен в микроформе и предпочтительно интегрирован с другими компонентами. Растворитель для промывки может быть выбран из любого подходящего растворителя, но предпочтительно выбирается тот, который может легко испаряться, например этанол. Система обычно, кроме того, включает: (j) резервуар, содержащий растворитель для промывки, этот резервуар сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, для контроля потока текучей среды между ними имеется дополнительный клапан. Предпочтительно резервуар,содержащий растворитель для промывки, является микроизготовленным и предпочтительно интегрирован-3 011753 с другими компонентами. Растворитель для промывки может быть выбран из любого подходящего растворителя, но предпочтительно выбирается тот, который может легко испаряться, например изопропанол. Резервуар, содержащий растворитель для элюирования, преимущественно сообщается посредством текучей среды с резервуаром, содержащим первый растворитель для промывки (например, этанол), и/или с резервуаром, содержащим второй растворитель для промывки (например, изопропанол). Более предпочтительно растворитель для элюирования, первый растворитель для промывки (например, этанол) и/или второй растворитель для промывки (например, изопропанол) содержатся в общем резервуаре. Это может быть достигнуто с помощью разделения друг от друга в общем резервуаре растворителя для элюирования, первого растворителя для промывки и/или второго растворителя для промывки при помощи текучей среды, такой как, например, воздух. Могут применяться другие "разделяющие" текучие среды (жидкости или газы), однако, при условии, что они не способны смешиваться или,по крайней мере, в основном, не способны смешиваться с растворителем для элюирования, первым растворителем для промывки и/или вторым растворителем для промывки. В предпочтительном варианте осуществления растворитель для элюирования, этанол и/или изопропанол содержатся в трубке или канале, который сообщается с входным отверстием и блоком лизиса. Растворитель для элюирования, этанол и/или изопропанол разделяются с помощью промежутков текучей среды, таких как, например, воздушные промежутки. Система обычно, кроме того, включает: (k) средства введения образца текучей среды и/или воздуха во входное отверстие. Указанное средство предпочтительно включает насос или пипетку. В другом варианте подобный способ может включать одну или несколько камер переменного объема, связанных с входным отверстием, в котором изменение объема камеры(камер) переменного объема ограничивает и/или воздействует на втекание во входное отверстие и/или вытекание из него образца текучей среды. Камера переменного объема обычно включает гибкую мембрану, покрывающую полое углубление на нижележащем субстрате. В международной заявке на патент PCT/GB02/005945 описана предпочтительная система перемещения текучей среды. Система может преимущественно приводиться в действие с помощью единственной насосной системы. Блок лизиса может иметь любую подходящую форму и конфигурацию, но обычно будет представлен в форме канала или камеры. Блок лизиса предпочтительно предназначен для лизиса эукариотических и прокариотических клеток и частиц, содержащихся в образце текучей среды. По желанию, система может, кроме того, включать блок фильтрации, этот блок сообщается с блоком лизиса посредством текучей среды. Блок фильтрации может включать, например, фильтр перекрестного потока или пористый фильтр. В другом варианте блок лизиса может, кроме того, самостоятельно включать средства фильтрации образца текучей среды. Указанное средство может включать, например,фильтр перекрестного потока или пористый фильтр, который может быть интегрирован с блоком лизиса. По желанию, система может, кроме того, включать блок фрагментации, этот блок сообщается с блоком лизиса посредством текучей среды. В другом варианте блок лизиса может, кроме того, самостоятельно включать средства фрагментации образца текучей среды. В качестве шага предварительной обработки образца часто бывает необходимой случайная фрагментация ДНК или РНК. Фрагментация может быть выполнена биохимически с применением рестрикционных энзимов или с помощью приложения физической силы для разрушения молекул (см., например, Р.N. Hengen, Trends in Biochem. Sci., vol. 22,pp. 273-274, 1997 and P.F. Davison, Proc. Nat. Acad. Sci. USA, vol. 45, pp.1560-1568, 1959). Фрагментация ДНК с помощью сдвига обычно включает пропускание образца через короткое сужение. В предпочтительном варианте осуществления ДНК и/или РНК разрушаются под воздействием механической силы при прокачивании через узкое отверстие в результате быстрого растяжения молекулы. Поток, приводимый в действие давлением, может привести к формированию силы сдвига, которая приводит к фрагментации нуклеиновых кислот. В международной заявке на патент PCT/GB03/004768 описано микрогидравлическое устройство для фрагментации нуклеиновой кислоты. Блок лизиса может, кроме того, самостоятельно включать средства фильтрации образца текучей среды и средства фрагментации образца текучей среды. Система может, кроме того, включать средства нагревания содержимого блока лизиса и/или блока экстракции нуклеиновой кислоты. Указанное средство может включать, например, один или большее число элементов Peltier, расположенных в блоке лизиса и/или блоке экстракции нуклеиновой кислоты или рядом с ними. Блок экстракции нуклеиновой кислоты может иметь любую подходящую форму и конфигурацию,но обычно будет иметь форму канала или камеры. Блок экстракции нуклеиновой кислоты предпочтительно предназначен для экстракции эукариотических и прокариотических клеток и частиц, содержащихся в образце текучей среды. Блок экстракции нуклеиновой кислоты может быть, по крайней мере, частично заполнен гранулами или частицами оксида кремния. Для накопления и/или предварительного концентрирования элюированных нуклеиновых кислот рядом с гранулами или частицами оксида кремния могут быть предоставлены один или большее число комплектов электродов. Один или большее число комплектов электродов могут включать, например, платиновые электроды. В связи с этим, могут быть предоставлены средства для-4 011753 создания разности потенциалов между электродами. Экстракционная камера предпочтительно сформирована из поли(диметилсилоксана) (PDMS) или включает его. Блок обычно включает субстрат и прилежащее покрытие, экстракционный блок ограничивается углублением на поверхности субстрата и прилежащей поверхностью покрытия. Субстрат предпочтительно сформирован из силиконполи(диметилсилоксана) (PDMS). В присутствии хаотропных агентов НК связывается с кремниевыми поверхностями. Объединение электродов (например, платиновых электродов) может преимущественно применяться для обратимого накопления и предварительного концентрирования на одном чипе элюированной НК. Таким образом, настоящее изобретение позволяет осуществлять комбинированную экстракцию и обогащение нуклеиновой кислоты. В предпочтительном варианте осуществления блок экстракции нуклеиновой кислоты включает канал из поли(диметилсилоксана) (PDMS), наполненный гранулами кремния. Система или, по крайней мере, вариант ее оригинала обычно сформированы из полупроводникового материала или включают его, несмотря на то, что могут также применяться диэлектрики (например,стекло, плавленый кремний, кварц, полимерные материалы и керамические материалы) и/или металлические материалы. Примеры полупроводниковых материалов включают один или большее число из элементов IV группы (то есть кремний и германий); соединений элементов III-V группы (например, арсенид галлия, фосфид галлия, антимонид галлия, фосфид индия, арсенид индия, арсенид алюминия и антимонид алюминия); соединений элементов II-VI группы (например, сульфид кадмия, селенид кадмия, сульфид цинка, селенид цинка) и соединений элементов IV-VI группы (например, сульфид свинца, селенид свинца, теллурид свинца, теллурид олова). Арсенид кремния и галлия являются предпочтительными полупроводниковыми материалами. Система может быть изготовлена с применением стандартных процессов, обычно связанных с серийным производством полупроводниковых микроэлектронных устройств и в последние годы с продукцией полупроводниковых микромеханических устройств. Подобные технологии микрообработки включают, например, эпитаксиальное выращивание (например, парофазное, жидкофазное, молекулярно-пучковое, металлоорганическое химическое парофазное осаждение), литографию (например, фото-, электронно-лучевую, рентген-, ионно-лучевую), травление(например, химическое, газофазное, плазменное), электроосаждение, распыление, диффузионное легирование, ионную имплантацию и микрообработку. Могут также применяться некристаллические материалы, такие как стекло и полимерные материалы. Примеры полимерных материалов включают PMMA (полиметилметакрилат), COC (циклоолефиновый сополимер), полиэтилен, полипропилен, PL (полилактид), PBT (полибутилентерефталат) и PSU (полисульфон), включая смеси двух или большего их числа. Предпочтительным полимером является PDMS или COC. Устройство/система будут обычно интегрально сформированы. Устройство/система могут быть в микроформе на общем материале подложки, например на полупроводниковом материале, как здесь было описано, несмотря на то, что может применяться диэлектрический материал подложки, такой как, например, стекло или керамический материал. Несмотря на это, обычный материал подложки предпочтительно является пластиком или полимерным материалом, и подходящие примеры приведены выше. Система может быть предпочтительно сформирована с помощью копирования, например, с кремниевого оригинала. Преимущества применения пластмасс вместо кремниевого стекла для миниатюризированных структур велики, по крайней мере, для применения в области биологии. Одним из наибольших преимуществ является снижение стоимости массового производства при применении таких способов, как микроинъекционное формование, горячее тиснение и литье. Фактор 100 или больше весьма вероятен для сложных структур. Возможность копирования структур для многослойных закладных формовочных деталей дает большую гибкость в свободе выбора проектных решений. Взаимосвязь между микро- и макромиром во многих случаях более простая, так как везде предметом выбора является комбинирование обычно применяемых стандартных компонентов. Для технологий сборки могут применяться различные подходы, как, например, US-сварка с поддержкой микроструктур, лазерная сварка, склеивание и ламинирование. Другими свойствами, которые являются выгодными, являются изменения поверхности. Для миниатюризированных структур, направленных на биологические исследования, важно, чтобы поверхность была биологически совместимой. С помощью утилизации обработки плазмы и полимеризации плазмы гибкость и вариации ассортимента могут быть приспособлены под покрытие. Химическая устойчивость к воздействию кислот и оснований намного лучше у пластмасс, чем у силиконовых субстратов,которые легко подвергаются разъеданию. Большинство способов детекции в области биотехнологии включают оптические измерения. Поэтому главным свойством пластмассы является ее прозрачность по сравнению с кремнием, который является непрозрачным. Полимерная микрогидравлическая технология в настоящее время является признанной в еще развивающейся области рынка "лабораторий-на-чипе". Предполагается, что микроизготовленная система, как здесь было описано, также касается наноизготовленных устройств. Для кремниевого или полупроводникового оригинала возможно формирование с помощью, например, травления или микрообработки одной или большего числа камер переменного объема, микрогидравлических каналов, реакционных камер и жидкостных соединений в силиконовом субстрате с точными-5 011753 измерениями микромасштаба. Затем по силиконовому оригиналу может быть изготовлена пластиковая копия. Таким образом, пластиковый субстрат с протравленной или механически обработанной микроструктурой может быть связан с покрытием любым подходящим способом (например, с применением адгезива или с помощью нагревания). Дополнительные клапаны, применяемые в системе, могут принимать любую походящую форму. Например, клапаны могут легко регулировать поток в трубке или канале, соединяющем два блока. Может иметься поршневой элемент, который может подниматься или опускаться в отверстии трубки или канала под действием контактного устройства. Применение системы включает следующие возможные стадии в качестве примера. Вариант 1.(iv) Блок фрагментации может включать как лизис образца, так и подготовку образца.(v) Амплификация и детекция (предпочтительно мультиплексная) в реальном времени (NASBA). Настоящее изобретение также относится к способу производства интегрированной системы диагностики "лаборатория-на-чипе", как здесь было описано, этот способ предусматривает:A. получение субстрата, имеющего на своей поверхности углубление для входного отверстия, углубление для блока лизиса, углубление для блока экстракции нуклеиновой кислоты, углубление для резервуара текучей среды для лизиса и углубление для резервуара растворителя для элюирования;C. связывание покрытия с субстратом, для создания: (а) входного отверстия, (b) блока лизиса,(с) блока экстракции нуклеиновой кислоты, (d) резервуара текучей среды для лизиса и (е) резервуара растворителя для элюирования, ограничивая каждый элемент соответствующим углублением в указанной поверхности субстрата и прилежащей поверхности покрытия. Предполагается, что к применяемому здесь термину "углубление" также относится множество элементов, включая, например, прорези, щели, отверстия, бороздки и каналы, включая их части. Способ может, кроме того, включать стадию введения текучей среды для лизиса в резервуар текучей среды для лизиса либо до, либо после связывания покрытия с субстратом. Способ может, кроме того, предусматривать стадию введения растворителя для элюирования в резервуар растворителя для элюирования либо до, либо после связывания покрытия с субстратом. Способ может, кроме того, предусматривать стадию введения этилового спирта в резервуар растворителя для элюирования либо до, либо после связывания покрытия с субстратом. Способ может, кроме того, предусматривать стадию введения изопропанола в резервуар растворителя для элюирования либо до, либо после связывания покрытия с субстратом. Растворитель для элюирования, и/или этиловый спирт, и/или изопропанол предпочтительно отделены друг от друга с помощью текучей среды, предпочтительно воздуха, несмотря на то, что может применяться любая не способная смешиваться текучая среда (жидкость или газ). В предпочтительном варианте осуществления способ предусматривает введение растворителя для элюирования в резервуар растворителя для элюирования после связывания покрытия с субстратом; введение первого объема воздуха в резервуар растворителя для элюирования; введение этанола в резервуар растворителя для элюирования, в результате чего этанол отделяется от растворителя для элюирования с помощью указанного первого объема воздуха; введение второго объема воздуха в резервуар растворителя для элюирования; введение изопропанола в резервуар растворителя для элюирования, в результате чего изопропанол отделяется от этанола с помощью указанного второго объема воздуха. Субстрат может быть сформирован, например, из оксида кремния, а вышележащее покрытие, например, из стекла. В этом случае стеклянное покрытие является предпочтительно анодно-соединенным с кремниевым субстратом произвольно через промежуточную пленку из оксида кремния, сформированную на поверхности субстрата. Углубления в оксиде кремния могут быть сформированы с применением реактивного ионного травления. Для субстрата и/или покрытия могут также применяться другие материалы, например полимерные материалы. Подобные материалы могут быть изготовлены с применением, например, кремниевой копии. В другом варианте устройство может быть изготовлено с помощью структурирования закладных формовочных деталей с помощью вальцевания и микрообработки электрическим разрядом (EDM), с последующим инъекционным формованием частей чипа, с последующей механической обработкой полимерных частей, например, сверлением, вальцеванием, обдиркой. Впоследствии это может сопровождаться введением фильтра, связыванием растворителя и установкой жидкостных соединений. Примеры полимерных материалов включают PMMA (полиметилметакрилат), COC (циклоолефиновый сополимер), полиэтилен, полипропилен, PL (полилактид), PBT (полибутилентерефталат) и PSU (полисульфон), включая смеси двух или большего числа этих соединений. Предпочтительным является COC. Предпочтительно, и особенно при необходимости оптических наблюдений содержимого клетки,-6 011753 вышележащее покрытие изготавливается из оптически прозрачной субстанции или материала, такого как стекло, Pyrex или COC. Часто применяются комбинации микрокомпонента с одним или большим числом других элементов,таких как стеклянная пластинка или дополнительный микроизготовленный элемент, и предполагается,что они подпадают в объем применяемого здесь термина "микроизготовленный". Часть или вся основа субстрата может быть предоставлена с покрытием толщиной обычно до 1 мкм,предпочтительно менее 0,5 мкм. Покрытие предпочтительно сформировано из одного или большего числа соединений из группы, включающей полиэтиленгликоль (PEG), альбумин бычьей сыворотки (BSA),твин и декстраны. Предпочтительными декстранами являются те, которые имеют молекулярную массу от 9000 до 200000, особенно предпочтительны те, что имеют молекулярную массу от 20000 до 100000, в частности от 25000 до 75000, например от 35000 до 65000. Твин (полиоксиэтиленсорбитан) может быть любым подходящим от Sigma Aldrich Company. Полиэтиленгликоли являются предпочтительными в качестве средств покрытия, как по отдельности, так и в комбинации. К полиэтиленгликолям относится чистый полиэтиленгликоль, то есть имеющий формулу НО-(СН 2 СН 2 О)n-Н, в которой n является целым числом, в зависимости от которого предоставляется полиэтиленгликоль, имеющий молекулярную массу обычно от 200 до 10000, особенно полиэтиленгликоль с молекулярной массой от 1000 до 5000; или химически модифицированный полиэтиленгликоль, в котором один или большее число олигомеров этиленгликоля связаны посредством гомобифункциональных групп, таких как, например, фосфатные группы или ароматические спейсеры. Особенно предпочтительными являются полиэтиленгликоли, известные как FK108 (цепь полиэтиленгликоля, связанная с другой посредством фосфата); и полиэтиленгликоль,продаваемый Sigma Aldrich Company как изделие Р 2263. Вышеуказанные покрытия, нанесенные на поверхности клетки/камеры, входных отверстий, выходных отверстий и/или каналов, могут улучшать движение жидкости в системе. В частности, выявлено, что образец подвергается меньшей адгезии или прилипанию к подобным поверхностям. Предпочтительными являются покрытия из полиэтиленгликоля. Для кремниевого или полупроводникового оригинала возможно формирование, с помощью, например, травления или механической микрообработки одной или большего числа камер переменного объема, микрогидравлических каналов, реакционных камер и жидкостных соединений в кремниевом субстрате с точными измерениями микромасштаба (глубокое реактивное ионное травление (DRIE) является предпочтительной технологией). Затем по кремниевому оригиналу может быть изготовлена пластиковая копия. Таким образом, пластиковый субстрат с протравленной или механически обработанной микроструктурой может быть связан с покрытием любым подходящим способом (например, с применением адгезива или с помощью нагревания), формируя при этом камеру(ы) закрытой фрагментации, входное(ые) отверстие(я), выходное(ые) отверстие(я) и соединяющий(е) канал(ы). Устройство включает субстрат с желательной микроструктурой, сформированной на его верхней поверхности. Субстрат может быть, например, кремниевым или пластиковым субстратом, сформированным с помощью копирования с кремниевого оригинала. Субстрат связан его верхней поверхностью с покрытием, формируя, таким образом, ряд блоков/камер, входных отверстий, выходных отверстий и/или каналов. Покрытие может быть сформировано, например, из пластика или стекла. Покрытие предпочтительно является прозрачным, что позволяет наблюдать за текучей средой. В общем, устройство является предпочтительно изготовленным с помощью глубокого реактивного ионного травления (DRIE) кремния для сжатий с высоким аспектным отношением, сопровождаемых анодным соединением стеклянного покрытия. В другом варианте устройство может быть изготовлено с помощью структурирования закладных формовочных деталей, с помощью вальцевания и микрообработки электрическим разрядом (EDM), с последующим инъекционным формованием частей чипа, с последующей механической обработкой полимерных частей, например, сверлением, вальцеванием, обдиркой. Впоследствии это может сопровождаться введением фильтра, связыванием растворителя и установкой жидкостных соединений. Образец нуклеиновой кислоты может быть, например, биологической текучей средой, молочным продуктом, текучими средами окружающей среды и/или питьевой водой или может быть получен из них. Примеры включают кровь, сыворотку, слюну, мочу, молоко, питьевую воду, морскую воду и воду из бассейна. Следует понимать, что выделение и очистка ДНК и/или РНК от бактериальных клеток и вирусных частиц во многих сложных биологических образцах, таких как, например, кровь и молоко, становится возможной только после отделения вирусных частиц и бактериальных клеток от других частиц в образце. Также следует понимать, что с целью концентрирования бактериальных клеток и вирусных частиц, то есть для уменьшения объема исходного материала, может оказаться необходимым выполнение дополнительных шагов подготовки образца до перехода к разрушению клеточной стенки бактерий или протеиновой оболочки вирусов и выделения нуклеиновых кислот. Это важно, когда исходный материал состоит из большого объема, например, водного раствора, содержащего относительно небольшое количество бактериальных клеток или вирусных частиц. Этот тип исходного материала обычно встречается в методах тестирования окружающей среды, например при регулярном мониторинге бактериальной контаминации питьевой воды. Система предпочтительно сконструирована для обработки образца объемом 10-100 мл. Настоящее изобретение также относится к прибору для анализа биологических образцов и/или об-7 011753 разцов из окружающей среды, прибор включает описанную здесь систему. Прибор может быть одноразовым прибором. Настоящее изобретение также относится к набору реактивов для анализа биологических образцов и/или образцов из окружающей среды, набор включает описанную здесь систему и средства для контактирования образца с системой. Набор реактивов может быть одноразовым набором. Примеры Ниже будет описано настоящее изобретение в качестве примера со ссылкой на прилагаемые чертежи, из которых фиг. 1 является схематической иллюстрацией многослойного расположения, используемого для интеграции плоской мембраны в устройство с одноразовым полимерным чипом, для применения в настоящем изобретении; фиг. 2 является схематической иллюстрацией конструкции клапана для применения с системой настоящего изобретения; фиг. 3 а-d являются схематическими иллюстрациями конструкции клапана для применения с системой настоящего изобретения; фиг. 4 является схематической иллюстрацией возможного расположения камеры для гранул настоящего изобретения; фиг. 5 является схематической иллюстрацией конструкции системы настоящего изобретения, показывающей заполнение буфером для лизиса (фиг. 5 а) и экстракционными текучими средами (фиг. 5b); фиг. 6 является схематической иллюстрацией расположения чипа в предпочтительном варианте осуществления настоящего изобретения; фиг. 7 является схематической иллюстрацией конструкции системы другого предпочтительного варианта осуществления настоящего изобретения; фиг. 8 относится к примерам; фиг. 9 относится к примерам. Конструкция пластикового чипа настоящего изобретения предпочтительно включает подающие каналы, реакционные камеры и системы микрогидравлического привода и предпочтительно обработана с помощью инъекционного формования сополимера циклоолефина (COC). Закладная формовочная деталь для, например, 12-канального чипа может быть произведена с применением высокопрецизионного вальцевания. Объем детекции обычно составляет приблизительно 80 нЛ (4002000100 pm). До покрытия 5% раствором полиэтиленгликоля (PEG) (Sigma Chemical Со., St. Louis, МО), пластиковый чип предпочтительно первоначально активируется кислородной плазмой. После покрытия чип может быть запаян мембраной COC толщиной приблизительно 75 мкм посредством сварки растворителем с применением, например, бициклогексила. Для предотвращения фоновой флюоресценции от тепловой подушки на вершине элемента Peltier на нижнюю сторону чипа предпочтительно напыляется тонкая пленка золота (приблизительно 25 нм). В случае необходимости, элементы Peltier могут быть интегрированы в держатель образца, обеспечивающий контроль температуры пластиковых чипов. На вершину элементов Peltier могут быть помещены алюминиевые блоки для защиты чипов от равномерного рассеивания тепла. Тепловая подушка предпочтительно устанавливается на алюминиевых блоках для создания термического контакта между чипами и источником теплоты. На держатель образца обычно помещается термопара, измеряющая температуру воздуха и имеющая контур обратной связи с элементами Peltier. Регулирование температуры может контролироваться извне на портативном компьютере. Как предварительно описано, NASBA является способом изотермической (приблизительно при 41 С) амплификации, специфически предназначенным для амплификации любой одноцепочечной последовательности РНК. Реакция NASBA может применяться в большом числе методов, например для детекции наличия специфических вирусных РНК, РНК других инфекционных или патогенных агентов или некоторых клеточных РНК. Одновременная активность трех ферментов обратной транскриптазы вируса миобластомы птиц, РНК-азы Н и РНК-полимеразы Т 7 создает основную технологию реакции амплификации. Два олигонуклеотидных праймера определяют специфичность реакции и флуоресцентных молекулярных зондов-маяков, которые являются специфичными к РНК мишени. Приблизительно за 90 мин интересующая последовательность нуклеиновой кислоты может быть амплифицирована до 109 копий. Блок оптической детекции предпочтительно сконструирован для возбуждения флуорофоров в реакционных камерах с длиной волны приблизительно 494 нм и детекции образуемого флуоресцентного излучения с длиной волны приблизительно 525 нм. Излучение возбужденных флурофоров может быть отфильтровано с применением полосового фильтра (465-500 нм) до коллимации излучения с помощью линзы. Для фокусирования освещения и концентрирования флуоресцентного излучения может применяться аналогичная линза Френели. Другая линза может применяться для фокусирования флуоресцентного излучения на поверхность детектора (например, фотоэлектронного умножителя). Сбор данных и подготовка детектированного сигнала могут быть осуществлены на портативном компьютере с применением MATLAB 6.0.-8 011753 088 Release 12 (The MathWorks Inc., Natick, MA). Эффективная предварительная обработка образца является важным фактором в контексте систем микротехнологического анализа. В частности, устройства концентрации необходимы для возможности детекции малых чисел специфических частиц, как, например, клеток, бактерий или вирусов, находящихся в биологических образцах. В области техники известно многообразие способов концентрации, включая, например, технологии фильтрации, такие как тупиковая фильтрация и фильтрация в перекрестном потоке, с применением различных видов средств фильтрации (микроструктурированные каналы, пористые полые волокна или мембраны), гравитационных осадителей, центрифуг, акустических клеточных фильтров, оптических ловушек, способов, основанных на диэлектрофорезе (DEP), электрофорезе, проточной цитометрии и адсорбции. Предпочтительный способ концентрации включает тупиковую фильтрацию. Это относительно простой и дешевый способ, который может легко быть интегрирован в одноразовый полимерный чип. Кроме того, применение плоских мембран гарантирует высокую гибкость в области применения, так как доступно множество мембран, а обработка поверхности, такая как, например, покрытие полиэтиленгликолем или Твин 20, может быть легко осуществлена. Интеграция плоской мембраны в полимерный одноразовый чип может быть достигнута при применении многослойного устройства, как схематически показано на фиг. 1. Чип включает покрывающую мембрану 40, канал для текучей среды 41 и фильтрующую мембрану 44. Верхняя и нижняя границы чипа показаны под номерами 42 и 43, соответственно. Предпочтительно один или большее число клапанов интегрированы в устройство для возможности контроля потока на чипе. Конструкции подходящих клапанов показаны на фиг. 2 и 3. В отношении фиг. 2,могут применяться мембраны с предварительно приданной формой или плоские мембраны. Чип 45 включает канал для текучей среды 46 и мембрану с предварительно приданной формой 47. Вертикальная стрелка показывает открытое положение. На фиг. 3 а-d показан чип, имеющий корпус, который включает верхнюю часть корпуса 50, основную часть корпуса 52 и помещенную между ними мембрану 51. Рядом с мембраной 51 имеется микрогидравлический канал 57. В соответствующих углублениях основной части корпуса 52 имеются поршень 54 и клапан 55. Текучая среда/жидкость находится в емкости 53 над поршнем 54 (см. фиг. 3 а). Клапан 55 установлен в верхнее положение с натяжением (см. фиг. 3 а). В этом положении он герметично закрывает микрогидравлический канал 57 таким образом, чтобы через него не могла пройти никакая текучая среда. Для опускания клапана 55 в открытое положение может применяться конический контактный штырь 56b (см. фиг. 3b, 3 с и 3d). В частности, когда контактный штырь 56b проталкивается вверх, он попадает с помощью фрикционной установки в соответствующее углубление в клапане 55. Так же при проталкивании вверх конического контактного штыря 56 а поршень 54 попадает с помощью фрикционной установки в соответствующее углубление в поршне 54. Для перемещения жидкости из емкости 53 контактные штыри 56 а и 56b проталкиваются в соответствующие углубления в поршне 54 и клапане 55, соответственно, и жидкость выталкивается из емкости 53 (см. фиг. 3 с и 3d). После применения чипа конические контактные штыри 56 а и 56b извлекаются, соответственно, из поршня 54 и клапана 55. Изобретатели установили, что гранулы кремния хорошо подходят для экстракции и очистки РНК. Обычно для экстракции могут применяться 0,3-0,4 мг гранул с диаметром от 15 до 35 мкм, но также возможно применение больших гранул кремния (до приблизительно 200 мкм в диаметре). Возможное расположение камеры для гранул показано на фиг. 4. Камера для гранул 60 загружена предварительно увлажненными гранулами кремния 61 до связи чипов. После связи контейнер с гранулами удерживается с помощью сужений размером 100 мкм. Форма камеры для гранул и расположение жидкостных соединений 62 (входное отверстие) и 63 (выходное отверстие) гарантируют, что применяемая жидкость проходит через гранулы кремния 61, даже если камера для гранул 60 не заполнена полностью. Объем камеры для гранул 60 составляет приблизительно 6,5 мкл, и она подходит для экстракции из образца, имеющего объем обычно 10-50 мкл. В течение всего процесса предварительной обработки предпочтительно применяются четыре жидкости: буфер для лизиса (обычно приблизительно 100 мкл), изопропанол (обычно приблизительно 40 мкл), этиловый спирт (обычно приблизительно 40 мкл) и буфер для элюирования (обычно приблизительно 5-20 мкл). Последние три необходимы для экстракции. Изобретатели установили, что эффективным является хранение буфера для лизиса в канале (обычно в извитом канале) на верхнем чипе 70 а (см. фиг. 5 а) и хранение экстракционных жидкостей в двух W-образных и U-образных резервуарах на нижней части 70b (см. фиг. 5b). Все резервуары для хранения могут быть легко заполнены через небольшие (0,5 мм 0,5 мм) боковые каналы, обозначенные на фиг. 5 с помощью положения игл представленных пипеток 75 а-d. После наполнения боковые каналы могут быть герметично закрыты с применением любых подходящих средств, например жидкого клея или ленты. Преимущественно, для получения относительно простой системы обработки предпочтительно применять единый насос (пипетку) для приведения в движение всех жидкостей. Расположение чипа согласно предпочтительному варианту осуществления настоящего изобретения-9 011753 показано на фиг. 6. Четыре жидких резервуара (с буфером для лизиса, изопропанолом, этанолом и буфером для элюирования) последовательно заполнены с применением обычных пипеток (диаметр иглы 0,4 мм), и заполненные каналы герметично закрыты. Сначала суспензия клеток наносится на блок фильтрации с помощью насоса пипетки. Помимо суспензии пипетка наполняется воздухом в объеме приблизительно от 200 до 300 мкл, который применяется для приведения в действие жидкостей на чипе (ясно, что в зависимости от применения могут применяться другие несмешиваемые жидкости). Вторым этапом воздух закачивается в резервуар буфера для лизиса и вытесненный буфер воздействует на клетки, находящиеся на фильтре. Клеточный лизат проталкивается через фильтр и направляется к камере для гранул. В результате дополнительного этапа фильтрования вероятность засорения в камере для гранул понижается. Третьим этапом насос, приводящий в действие (пипетка), связывается с резервуаром экстракции жидкости при закрытых сообщениях с фильтровальной камерой и резервуаром буфера для лизиса. Экстракционные жидкости хранятся в едином резервуаре, разделенные воздушными пробками. Под воздействием давления на одну сторону резервуара жидкости параллельно вытесняются и последовательно перемещаются через камеру для гранул. Протокол операции, включая действия клапанов, суммированы ниже, также со ссылкой на фиг. 6. Не перечисленные клапаны находятся в закрытом состоянии, тогда как перечисленные клапаны открыты для соответствующего действия. Фильтрация. Клапаны 5, 7: введение клеточной суспензии, фильтратлевое выходное отверстие. Лизис. Клапаны 2, 3, 7: введение воздуха, вытесненная текучая средалевое выходное отверстие. Клапаны 2, 3, 6: введение воздуха, лизатконтейнер с гранулами, правое выходное отверстие. Очистка. Клапаны 1, 4, 6: введение воздуха, изопропанолконтейнер с гранулами; введение воздуха, этанолконтейнер с гранулами; введение воздуха, буфер для элюированияконтейнер с гранулами. Обратимся теперь к фиг. 7, на которой показан другой предпочтительный вариант осуществления настоящего изобретения. Вышеприведенное описание также применимо к этому варианту осуществления. Система 1 имеет входное отверстие 5 для образца текучей среды, блок лизиса/фильтрации 10, блок экстракции нуклеиновой кислоты 15, канал 20, содержащий текучую среду для лизиса, канал 25, содержащий растворители для элюирования, этанол и изопропанол, блок амплификации и детекции последовательности нуклеиновой кислоты 30 и блок для отходов 35. Канал 11 соединяет входное отверстие для образца 5 с блоком лизиса/фильтрации 10. Для контроля потока жидкости между ними имеется клапан 12. Канал 16 соединяет блок лизиса/фильтрации 10 с блоком экстракции нуклеиновой кислоты 15. Для контроля потока жидкости между ними имеется клапан 17. Канал 20, содержащий текучую среду для лизиса, связан с блоком лизиса/фильтрации 10 и входным отверстием для образца 5. Для контроля потока жидкости имеются клапаны 22 и 23. Канал 25, содержащий растворитель для элюирования, этанол и изопропанол, связан с блоком экстракции нуклеиновой кислоты 15 и входным отверстием для образца 5. Для контроля потока жидкости имеются клапаны 27 и 28. Канал 31 соединяет блок экстракции нуклеиновой кислоты 15 с блоком амплификации и детекции последовательности нуклеиновой кислоты 30. Для контроля потока жидкости между ними имеется клапан 32. Канал 36 соединяет блок лизиса/фильтрации 10 с блоком для отходов 35. Для контроля потока жидкости между ними имеется клапан 37. Канал 25 содержит растворитель для элюирования и растворители для промывки, такие как этанол и изопропанол. Растворитель для элюирования и растворители для промывки загружены в канал предварительно с применением воздушного промежутка для отделения жидкостей друг от друга. Примером подходящей текучей среды буфера для лизиса является 100 мМ Tris/HCl, 8 М GuSCN (pH 6,4). Примером подходящего раствора для элюирования является 10 мМ Tris/HCl, 1 мМ EDTA Na2(pH 8)+1 мМ YOYO-1. Квантификация нуклеиновой кислоты может быть осуществлена с применением флуоресцентного микроскопа и программы анализа интенсивности пикселя (Lispix). Блок экстракции нуклеиновой кислоты содержит гранулы кремния, например 0,3 мг гранул кремния, величиной 15-30 мкм. Непосредственно под уплотненным слоем также предоставлены платиновые электроды (не показаны) для электрокинетического накопления отрицательно заряженных, элюированных нуклеиновых кислот. Протокол операции суммирован ниже.- 10011753 Фильтрация. Все клапаны закрываются, за исключением клапанов 12 и 37. Пипетка, содержащая образец текучей среды (который содержит анализируемые клетки), связывается с входным отверстием для образца 5, и образец вводится под давлением в блок фильтрации/лизиса 10. Таким образом, клетки удерживаются в блоке 10, а оставшаяся часть текучей среды затем поступает в блок для отходов 35. Лизис. Все клапаны закрываются, за исключением клапанов 22, 23 и 37. В первом шаге (дополнительном) воздух, содержащийся в пипетке, вводится во входное отверстие для образца 5. Это вызывает перемещение текучей среды для лизиса, содержащейся в канале 20, по направлению к блоку фильтрации/лизиса 10. Однако до поступления текучей среды для лизиса в блок фильтрации/лизиса 10 воздух перед текучей средой для лизиса, то есть воздух в области канала 20 между клапаном 23 и блоком 10, вытесняет и вызывает перетекание любой оставшейся текучей среды в блоке 10 в блок для отходов 35. Затем, вторым шагом, клапан 37 закрывается, а клапан 17 открывается. Поскольку воздух, содержащийся в пипетке,продолжает вводиться во входное отверстие для образца 5, текучая среда для лизиса, содержащаяся в канале 20, перетекает под давлением в блок фильтрации/лизиса 10. Как следствие, удерживаемые там клетки лизируются и лизат перетекает в блок экстракции нуклеиновой кислоты 15. Очистка/экстракция. Все клапаны закрываются, за исключением клапанов 27, 28 и 32. Первым этапом воздух, содержащийся в пипетке, вводится во входное отверстие для образца 5. Это вызывает перемещение текучих сред(изопропанол, воздушный промежуток, этанол, воздушный промежуток, буфер для элюирования), содержащихся в канале 25, в виде столбца текучей среды по направлению к блоку экстракции нуклеиновой кислоты 15. После поступления всего изопропанола (то есть первой части столбца текучей среды) в блок экстракции нуклеиновой кислоты 15 этот процесс останавливается. После короткого промежутка времени (вместе с дополнительным нагреванием содержимого блока 15) процесс продолжается и воздушный промежуток между изопропанолом и этанолом вытесняет изопропанол. Изопропанол испаряется и/или перемещается в блок для отходов. Затем этанол перетекает под давлением в блок экстракции нуклеиновой кислоты 15. После поступления всего этанола в блок 15 процесс останавливается еще раз. После короткого промежутка времени (вместе с дополнительным нагреванием содержимого блока 15) процесс продолжается и воздушный промежуток между этанолом и буфером для элюирования вытесняет этанол. Этанол испаряется и/или перемещается в блок для отходов. Затем буфер для элюирования перетекает под давлением в блок экстракции нуклеиновой кислоты 15 и элюирует нуклеиновые кислоты, высвобождаемые с поверхности гранул кремния. Затем элюированные нуклеиновые кислоты поступают в блок амплификации и детекции последовательности нуклеиновой кислоты 30. Настоящее изобретение предоставляет прибор и способ для экстракции и анализа нуклеиновой кислоты (НК). Успешной была экстракция из биологических образцов, таких как лизаты человеческих клеток, с накоплением НК в первых 15 мл элюата. Производилась оценка амплификации в реальном времени, основанной на последовательности нуклеиновых кислот (NASBA) в пластиковых микрочипах из сополимера циклоолефина (COC) со встроенными подающими каналами и параллельными реакционными камерами. Была осуществлена успешная детекция последовательности модели папилломавируса человека 16 (HPV) в линии клеток SiHa со встроенным HPV 16 и образцах от пациента, положительных на наличие HPV 16. Образцы материалов, наносимых на чип, были разделены на одиннадцать параллельных реакционных камер, где осуществлялась их одновременная детекция в объеме 80 нл. Кроме того, теперь настоящее изобретение будет описано со ссылкой на следующие не ограничивающие примеры. Примеры Материал образца. Линии клеток карциномы шейки матки SiHa (плоскоклеточная карцинома) были получены изAmerican Type Culture Collection (USA). Линия клеток SiHa поддерживалась в модифицированной питательной среде Dulbecco's Eagles (DMEM), подкрепленной 10% эмбриональной бычьей сывороткой (FBS),2 мМ L-глутамином и 25 мкг/мл гентамицином. Клетки культивировались при температуре 37 С в атмосфере с 5% CO2. Клетки были обработаны трипсином, подсчитаны в камере Burkers и лизированы в буфере для лизиса NASBA (bioMerieux, Нидерланды, содержащем 5 М гуанидинтиоцианата). Нуклеиновые кислоты были изолированы и экстрагированы с применением способа Boom (Boom, R., Sol, J.A.,Salimans, M.M.M., Jansen, C.L., Wertheimvandillen P.M.E., Vandernoordaa, J.J. of Clinical Microbiol., 1990,28, (3), 495-503) на экстракторе NucliSense. Клетки SiHa содержат 1-2 копии интегрированной ДНК HPV 16 на клетку (Syrjanen, S., Partanen, P., Mantyjarvi, R. и Syrjanen, K. J. Virol. Methods, 1988, 19, 225-238). Проводилось тестирование десятикратных серийных разведений экстракта линии клеток SiHa. Кроме того, последовательности модели HPV типа 16 из набора HPV Proofer (NorChip AS, Norway) применялись в качестве мишени. Серии разведения были протестированы для определения предела чувствительности системы.NASBA. Реагенты в наборе PreTect HPV-Proofer были смешаны в соответствии с инструкцией изготовителей (NorChip AS, Норвегия). В наборе имелись в наличии все праймеры и зонды. Кроме того, в качестве динамического покрытия к смеси был добавлен BSA до конечной концентрации 0,05%. Раствор реагента(26 мкл) из набора и 13 мкл материала образца (образцы линии клеток SiHa и образцы последовательности HPV типа 16 из набора) были смешаны и нагревались до температуры 65 С в течение 2 мин. Затем смесь охлаждалась в течение 2 мин до температуры 41 С, после чего были добавлены энзимы(13 мкл). Одна камера приведения в действие при каждом реакционном канале была рассечена, перед тем как в полимерный микрочип была добавлена смесь. Каждый реакционный канал в чипе был заполнен смесью посредством капиллярных сил. Оставшаяся смесь была заключена в камеру для отходов в конце питающего канала. Затем держатель чипа был перемещен под оптическую систему, где были измерены каналы один за другим. Измерения проводились каждые 30 с. Только участок величиной 22 мм 2 освещался с помощью светодиода, этот участок соответствовал участку детекции 80 нл. Также для сравнения с детекцией на микрокрочипе с помощью обычного оборудования были протестированы десятикратные серийные разведения как последовательностей HPV 16, так и линий клетокSiHa. Все эксперименты продолжались в течение 2,5 ч. Расчет. Все результаты были рассчитаны с применением PreTect Data Analyzer (PDA) (NorChip AS). Микрочип был сконструирован с 12 реакционными камерами, но 2 реакционных канала на каждой стороне в расчетах не учитывались, вследствие систематической погрешности в измерениях. Расчеты были основаны на алгоритмах полиномиальной регрессии. Коэффициент определялся как разность уровня флуоресценции в конце реакции и уровня флуоресценции в начале реакции. Все образцы с коэффициентом 1,7 или больше были определены как положительные. Время до положительности или исходная точка были установлены в том месте, где кривая начинала нарастать по экспоненте. Среднее значение углового коэффициента было вычислено с применением величины 10% повышения уровня флуоресценции и величины 80% повышения уровня флуоресценции от исходной точки. Предел чувствительности для полимерных микрочипов был установлен по последней протестированной концентрации, где все 10 реакционных каналов были положительными. Результаты. Идентификация HPV 16 вирусов с помощью NASBA в реальном времени была успешно выполнена в полимерных микрочипах при объеме детекции 80 нл. На фиг. 8 и 9 показан результат одного эксперимента, выполненного, соответственно, на линиях клеток SiHa и олигонкулеотидных последовательностяхHPV 16. На фигурах показаны графики, которые очевидно являются положительными и имеют такую же кривизну, как и образцы, определение которых выполнялось с применением постоянных объемов 20 мкл и обычных считывающих устройств (не показаны). В табл. 1 показаны результаты серий разведения последовательностей модели HPV16 и линий клеток SiHa, полученные с применением полимерных микрочипов. Для характеристики реакций амплификации производилось определение нескольких различных параметров: коэффициент флуоресценции, время до положительности, среднее значение углового коэффициента линейной части кривой, число положительных амплификации и число тестируемых полимерных микрочипов. В таблице показаны средние значения и среднеквадратичное отклонение протестированных положительных образцов. Как для последовательностей HPV 16, так и для линий клеток SiHa,протестированных на микрочипах, коэффициент был более или менее постоянным. Из сравнения с обычным тестированием (табл. 2) материала того же образца видно, что коэффициент уменьшается при снижении концентрации. С другой стороны, другие параметры для микрочипов и для обычных способов значительно соответствуют. При снижении концентрации возрастает время до положительности, тогда как среднее значение коэффициента регрессии при снижении концентрации уменьшается. Десятикратные серийные разведения от 100 аМ до 100 нМ были протестированы на последовательности моделиHPV 16, тогда как линия клеток SiHa была протестирована в разведениях от 0,02 до 2000 клеток/мкл. Изготовленная на заказ система оптической детекции имела предел чувствительности 1 пМ и 20 клеток/мкл для последовательностей модели HPV 16 и материала линии клеток SiHa, соответственно. Для обычных считывающих устройств Biotek пределы чувствительности были сходными. На обеих системах была возможна детекция более низких концентраций, но отмечались противоречивые результаты. Результаты также иллюстрируют, что при снижении концентрации образца заданной мишени наблюдалось увеличение среднеквадратичного отклонения. Сравнение результатов NASBA для олигонуклеотидных последовательностей HPV 16 и для линии клеток SiHa показало, что все параметры имели сходные тенденции как для микросистем, так и для обычных способов, за исключением соотношения между уровнями флюоресценции в начале и в конце реакции амплификации. Фоновые помехи более различимы в малых реакционных камерах, чем при применении макроскопических флуоресцентных способов. Части фоновой флюоресценции удалялись из анализа с применением тонкой золотой пленки на нижней стороне полимерных микрочипов. COC сам по себе является флуоресцентентным и всегда производит некоторую фоновую флюоресценцию. Другой составляющей в детекции шума является рассеяние света вслед- 12011753 ствие недостаточно идеальных полимерных поверхностей. Время до положительности уменьшается при снижении концентрации, как ожидается вследствие того, что для обнаружения субстратов и взаимодействия с ними субстраты применяются в течение более длительного времени. В экспериментах для максимальных концентраций, в частности для модели HPV 16, время до положительности увеличивается. Очень высокие концентрации образца могут также замедлять реакцию и поэтому могут применяться в течение более длительного времени, в отличие от идеальной реакционной смеси. Подобным образом уменьшается среднее значение углового коэффициента. Чем меньшее количество мишени изначально будет находиться в реакционной смеси, тем меньше ампликонов будет произведено и угловой коэффициент будет меньше, чем для более высоких концентраций. Предел чувствительности реакции NASBA зависит от интересующей мишени, конструкции праймеров и зонда. В этих экспериментах в обеих системах детекции мы могли осуществить детекцию концентраций до 1 пМ и 20 клеток/мкл. Соответственно,этот пример показывает, что детекция последовательностей модели HPV 16 в концентрации до 1 пМ в полимерных микрочипах с применением NASBA в реальном времени является возможной. Для образцов линий клеток предел чувствительности составлял 20 клеток/мкл. Эти пределы чувствительности были сходными с полученными в экспериментах, проводимых на обычном считывающем устройстве Biotek. Таблица 1NASBA, выполненная на микрочипах,с детекцией олигонуклеотидных последовательностей HPV 16 и серий разведения линии клеток SiHa Результаты всех значений, полученных в экспериментах, приведены в средних значениях и со среднеквадратичным отклонением. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Интегрированная диагностическая система "лаборатория-на-чипе" для подготовки к анализу образца текучей среды, содержащего клетки и/или частицы, включающая следующие компоненты, расположенные на общей подложке:(a) входное отверстие для образца текучей среды;(b) блок лизиса для лизиса клеток и/или частиц, содержащихся в образце текучей среды;(c) блок экстракции нуклеиновой кислоты для экстракции нуклеиновых кислот из клеток и/или частиц, содержащихся в образце текучей среды;(d) резервуар, содержащий текучую среду для лизиса;(e) резервуар, содержащий растворитель для элюирования для перемещения нуклеиновых кислот,накапливающихся в блоке экстракции нуклеиновой кислоты; в которой входное отверстие для образца сообщается с блоком лизиса посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан;- 14011753 в которой блок лизиса сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан; в которой резервуар, содержащий текучую среду для лизиса, сообщается с блоком лизиса посредством текучей среды, а для контроля потока текучей среды между ними имеется клапан; в которой резервуар, содержащий растворитель для элюирования, сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, а для контроля потока текучей среды между ними имеется клапан; и в которой, кроме того, имеется единый насос или шприц для приведения в действие всех жидкостей. 2. Система по п.1, где резервуар, содержащий текучую среду для лизиса, сообщается с входным отверстием посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан. 3. Система по п.1 или 2, где резервуар, содержащий элюент, сообщается с входным отверстием посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан. 4. Система по любому из пп.1-3, кроме того, включающая: (g) блок взаимодействия нуклеиновой кислоты, предпочтительно блок амплификации и детекции последовательности нуклеиновой кислоты, в которой блок экстракции нуклеиновой кислоты сообщается с блоком взаимодействия нуклеиновой кислоты посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан. 5. Система по любому из пп.1-4, кроме того, включающая: (h) блок для отходов, в которой блок для отходов сообщается с блоком лизиса посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан. 6. Система по любому из пп.1-5, кроме того, включающая: (i) резервуар, содержащий растворитель для промывки, предпочтительно этанол, этот резервуар сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан. 7. Система по любому из пп.1-6, кроме того, включающая: (j) резервуар, содержащий дополнительный растворитель для промывки, предпочтительно изопропанол, этот резервуар сообщается с блоком экстракции нуклеиновой кислоты посредством текучей среды, а для контроля потока текучей среды между ними имеется необязательный клапан. 8. Система по п.6 или 7, в которой резервуар, содержащий растворитель для элюирования, сообщается посредством текучей среды с резервуаром, содержащим первый растворитель для промывки, и/или с резервуаром, содержащим второй растворитель для промывки. 9. Система по п.8, в которой растворитель для элюирования, первый растворитель для промывки и/или второй растворитель для промывки содержатся в общем резервуаре. 10. Система по п.9, в которой растворитель для элюирования, первый растворитель для промывки и/или второй растворитель для промывки отделены друг от друга в общем резервуаре при помощи текучей среды, предпочтительно воздуха. 11. Система по п.9 или 10, в которой общий резервуар включает трубку, сообщающуюся с входным отверстием и блоком лизиса посредством текучей среды. 12. Система по любому из пп.1-11, кроме того, включающая: (k) средство для введения жидкого образца и/или воздуха во входное отверстие, где указанное средство предпочтительно включает насос или шприц. 13. Система по любому из пп.1-11, кроме того, включающая блок фильтрации, причем этот блок сообщается с блоком лизиса посредством текучей среды. 14. Система по п.13, в которой блок фильтрации включает один или несколько фильтров тупиковой фильтрации, фильтров перекрестного потока, например микроструктурированных каналов, пористых полых волокон или мембран, гравитационных осадителей, центрифуг, акустических клеточных фильтров, оптических ловушек, способов, основанных на диэлектрофорезе (DEP), электрофорезе, проточной цитометрии и адсорбции. 15. Система по любому из пп.1-11, в которой блок лизиса, кроме того, включает средства фильтрации образца текучей среды. 16. Система по п.15, в которой указанные средства включают один или несколько фильтров тупиковой фильтрации, фильтров перекрестного потока, например микроструктурированных каналов, пористых полых волокон или мембран, гравитационных осадителей, центрифуг, акустических клеточных фильтров, оптических ловушек, способов, основанных на диэлектрофорезе (DEP), электрофорезе, проточной цитометрии и адсорбции. 17. Система по любому из предыдущих пунктов, причем система, кроме того, включает средства для нагревания содержимого блока лизисаи/или блока экстракции нуклеиновой кислоты. 18. Система по п.17, в которой указанное средство включает один или несколько элементов Peltier,расположенных в блоке лизиса, и/или блоке экстракции нуклеиновой кислоты, или рядом с ними. 19. Система по любому из предыдущих пунктов, в которой блок экстракции нуклеиновой кислоты,- 15011753 по крайней мере, частично заполнен гранулами или частицами кремния. 20. Система по п.19, в которой блок экстракции нуклеиновой кислоты, кроме того, включает один или несколько наборов электродов рядом с гранулами или частицами кремния для накопления и/или предварительного концентрирования элюированных нуклеиновых кислот. 21. Система по п.20, в которой указанный один или несколько комплектов электродов включают платиновые электроды. 22. Система по любому из предыдущих пунктов для экстракции нуклеиновых кислот, присутствующих в биологической текучей среде, молочном продукте, текучей среде окружающей среды или питьевой воде. 23. Прибор для анализа биологических образцов и/или образцов окружающей среды, причем прибор включает систему, определенную в любом из предыдущих пунктов. 24. Набор для анализа биологических образцов и/или образцов окружающей среды, причем набор включает систему, определенную в одном из пп.1-22, и средства для приведения в контакт образца и системы. 25. Прибор по п.23 или набор для анализа по п.24, который является одноразовым.
МПК / Метки
МПК: C12Q 1/68, G01N 1/28, G01N 27/447
Метки: проведения, детекции, нуклеиновых, система, амплификации, кислот, диагностическая, последовательностей
Код ссылки
<a href="https://eas.patents.su/20-11753-diagnosticheskaya-sistema-dlya-provedeniya-amplifikacii-i-detekcii-posledovatelnostejj-nukleinovyh-kislot.html" rel="bookmark" title="База патентов Евразийского Союза">Диагностическая система для проведения амплификации и детекции последовательностей нуклеиновых кислот</a>
Предыдущий патент: Электрод, способ его изготовления, металловоздушный топливный элемент и металлогидридный элемент
Следующий патент: Способ и элемент для термического формирования изображений
Случайный патент: Скважинная струйная установка для испытания и освоения скважин и способ работы скважинной струйной установки












