Разделение компонентов плазмы крови с помощью фильтрующих средств на основе целлюлозы
Номер патента: 757
Опубликовано: 24.04.2000
Авторы: Джонстон Анна, Дэвис Джеффри Раймонд, Уилки Брентон Джон, Турнер Петер Джеймс
Формула / Реферат
1. Способ выделения белков плазмы или смеси белков плазмы из крови, плазмы, одной из фракций плазмы или их криосупернатанта, включающий контактирование указанной крови, плазмы, одной из фракций плазмы или криосупернатанта с фильтрующим материалом на основе целлюлозы с целью создания шлама и пропускание или прокачивание с помощью насоса указанного шлама через фильтровальный сосуд или фильтровальную сетку для получения фильтрата и остатка на фильтре.
2. Способ выделения белков плазмы или смеси белков плазмы из крови, плазмы, одной из фракций плазмы или их криосупернатанта, включающий в себя следующие стадии:
(i) предварительное покрытие фильтровальной сетки фильтрующим материалом на основе целлюлозы;
(ii) пропускание или прокачивание с помощью насоса указанной крови, плазмы, одной из фракций плазмы или криосупернатанта через фильтровальную сетку с предварительно нанесенным покрытием для получения фильтрата и остатка на фильтре.
3. Способ по п.2, отличающийся тем, что к крови, плазме, одной из фракций плазмы или криосупернатанту добавляют дополнительное количество фильтровального материала на основе целлюлозы до стадии пропускания или прокачивания указанной крови, плазмы, одной из фракций плазмы или криосупернатанта через фильтровальную сетку с предварительно нанесенным покрытием.
4. Способ по любому из пп. с 1 по 3, отличающийся тем, что он включает дополнительную стадию повторного направления фильтрата один или более раз в загрузочный или фильтровальный сосуд.
5. Способ по любому из пп. с 1 по 4, отличающийся тем, что он включает дополнительную стадию промывания или отмывания остатка на фильтре подходящим растворителем или водным буферным раствором для удаления остатка маточного раствора, полученного из исходной смеси.
6. Способ по п.5, отличающийся тем, что он включает дополнительную стадию промывания или отмывания остатка на фильтре с использованием объема растворителя или водного буферного раствора, составляющего до трех объемов фильтровального сосуда.
7. Способ по любому из пп. с 1 по 6, отличающийся тем, что концентрация фильтрующего материала на основе целлюлозы составляет до 2,0% (вес на единицу объема исходной смеси или вес на единицу веса исходной смеси).
8. Способ по п.7, отличающийся тем, что концентрация фильтрующего материала на основе целлюлозы находится в диапазоне от приблизительно 0,5% до приблизительно 2,0% (вес на единицу объема исходной смеси или вес на единицу веса исходной смеси).
9. Способ по любому из пп. с 1 по 8, отличающийся тем, что плазма включает свежезамороженную плазму или несвежезамороженную плазму, а фракция плазмы включает промежуточную фракцию Кона или фракцию Онкли.
10. Способ по п.9, отличающийся тем, что белок плазмы выбран из группы, включающей альбумин, иммуноглобулин, липопротеин, эуглобулин, фактор VIII, протромбиновый комплекс и антитромбин III, в осажденной, или комплексной, или агрегированной форме, или связанный с нерастворимым носителем, например тонким кремнезёмным порошком, или отличающийся тем, что смесь белков плазмы включает указанный белок плазмы.
11. Способ по п.10, отличающийся тем, что фильтрующий материал на основе целлюлозы имеет одну или несколько из следующих характеристик:
(i) он облегчает течение исходной смеси через ячейки фильтра во время процесса фильтрации;
(iii) он не способствует образованию ПКА в продуктах, выделенных из плазмы, в количествах, превышающих допустимые значения по Британской Фармакопее, Европейской Фармакопее или Фармакопее США; и
(iv) он не выделяет алюминий в продукты, выделенные из плазмы, в количествах, превышающих допустимые значения по Британской Фармакопее, Европейской Фармакопее или Фармакопее США.
12. Способ по п.11, отличающийся тем, что фильтрующий материал на основе целлюлозы выбран из списка, содержащего DiacelT 150, DiacelT 200, ArbocelT 200 или VitacelT 200 и другие.
13. Способ выделения материала твердой фазы из крови, свежезамороженной плазмы, несвежезамороженной плазмы, криосупернатанта или полученной из них фракции плазмы, например промежуточной фракции Кона или фракции Онкли или другой фракции плазмы, включающий, по крайней мере, одну стадию фильтрации для извлечения указанного материала твердой фазы, причем эта стадия фильтрации выполняется с использованием фильтрующего материала на основе целлюлозы.
14. Способ по п.13, отличающийся тем, что материалом твердой фазы является белок плазмы, выбранный из списка, включающего среди прочих альбумин, иммуноглобулин, липопротеин, эуглобулин, фактор VIII, протромбиновый комплекс, антитромбин III или другие компоненты крови, в осажденной, или комплексной, или агрегированной форме, или связанные с нерастворимым носителем, например, тонким кремнезёмным порошком.
15. Способ по п.13 или 14, отличающийся тем, что ему предшествует, по крайней мере, одно этанольно-ацетатное осаждение или обработка тонким кремнезёмным порошком для получения материала твердой фазы.
16. Выделенный белок плазмы или выделенная смесь белков плазмы, полученные по способу из любого п. с 1 до 15.
17. Выделенный белок плазмы или выделенная смесь белков плазмы по п.16, отличающиеся тем, что они являются белком или смесью белков плазмы для терапевтического лечения или профилактики заболеваний людей или млекопитающих.
18. Выделенный белок плазмы или выделенная смесь белков плазмы, полученные по способу из любого п. с 1 до 15, отличающиеся тем, что указанный белок плазмы выбран из группы, включающей липопротеин, эуглобулин, иммуноглобулин, фактор VIII, протромбиновый комплекс, антитромбин III и альбумин, а указанная смесь включает любой или несколько из указанных белков плазмы.
19. Выделенный белок плазмы или выделенная смесь белков плазмы, полученные по способу из любого п. с 1 до 15, отличающиеся тем, что указанный белок плазмы выбран из группы, включающей альбумин, липопротеин, иммуноглобулин и эуглобулин, а указанная смесь включает любой или несколько из указанных белков плазмы.
20. Выделенная фракция альбумина, полученная по любому п. с 1 по 15.
21. Выделенная фракция альбумина, полученная по любому п. с 1 по 3 или с 13 по 14, отличающаяся тем, что уровень содержания липопротеина в препарате ниже примерно 3,0 вес.% по отношению к альбумину.
22. Выделенный белок плазмы или выделенная смесь белков плазмы, полученные по способу из любого п. с 1 по 15, отличающиеся низким уровнем содержания ПКА и/или алюминия в препарате этого белка плазмы или этой смеси белков плазмы.
23. Выделенный белок плазмы или выделенная смесь белков плазмы, полученные по способу из любого п. с 1 по 15, отличающиеся тем, что уровень содержания ПКА и/или ПКА-C1 эстеразы, и/или калликреина, и/или алюминия в препарате этого белка плазмы или этой смеси белков плазмы ниже предельно допустимого по Британской Фармакопее, Европейской Фармакопее или Фармакопее США.
24. Выделенный иммуноглобулин, полученный по любому из пп. с 1 до 15, отличающийся тем, что уровень содержания алюминия в нем составляет менее примерно 50 мкг/л.
25. Выделенный альбумин, полученный по любому из пп. с 1 до 15, отличающийся тем, что уровень содержания алюминия в нем составляет менее примерно 10 мкг/л.
26. Выделенный альбумин, полученный по любому из пп. с 1 до 15, отличающийся тем, что уровень содержания ПКА в нем составляет менее примерно 5 МЕ/мл.
27. Выделенный альбумин, полученный по любому из пп. с 1 до 15, отличающийся тем, что уровень содержания в нем ПКА-C1 эстеразы составляет менее примерно 10 МЕ/мл.
Текст
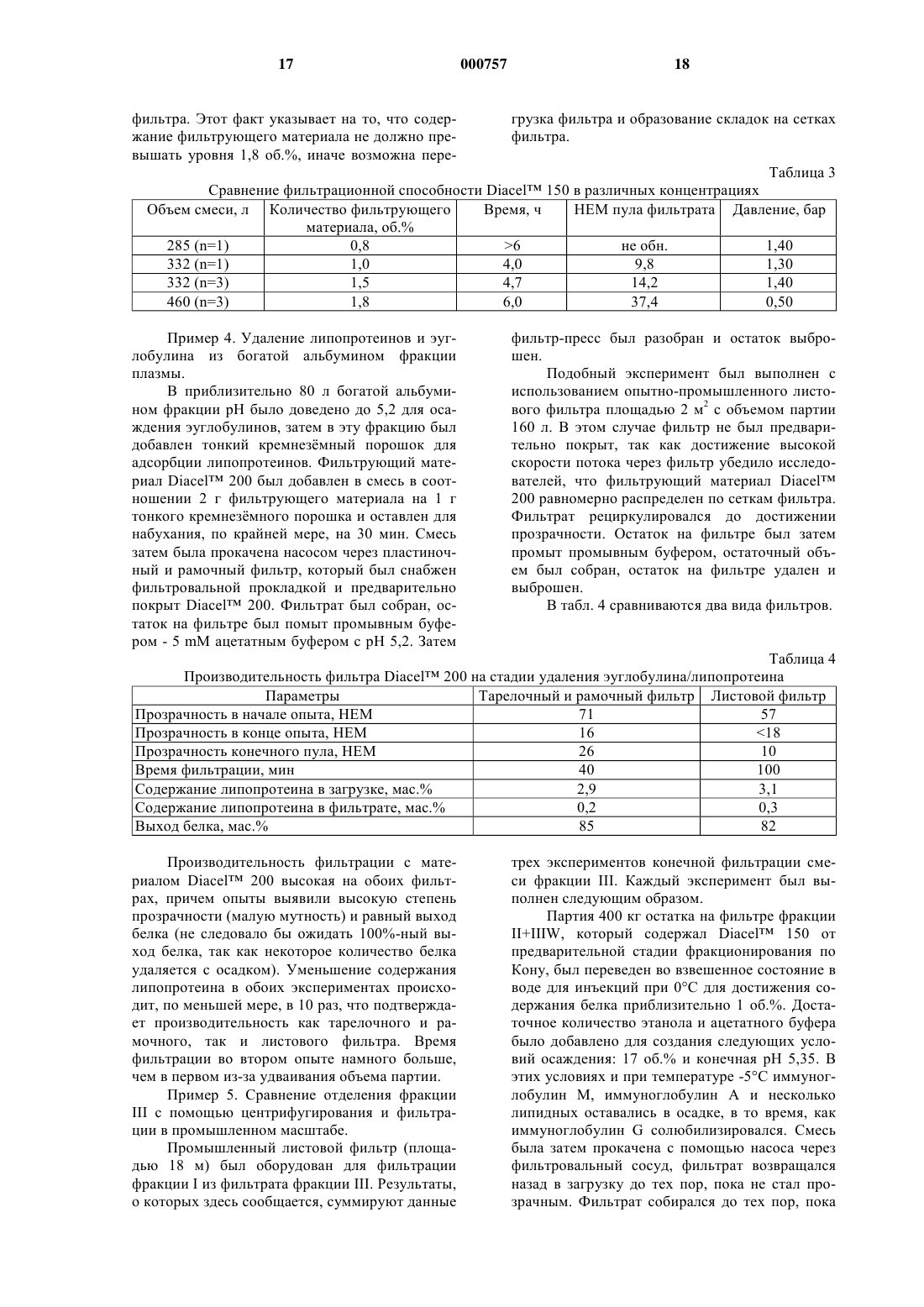
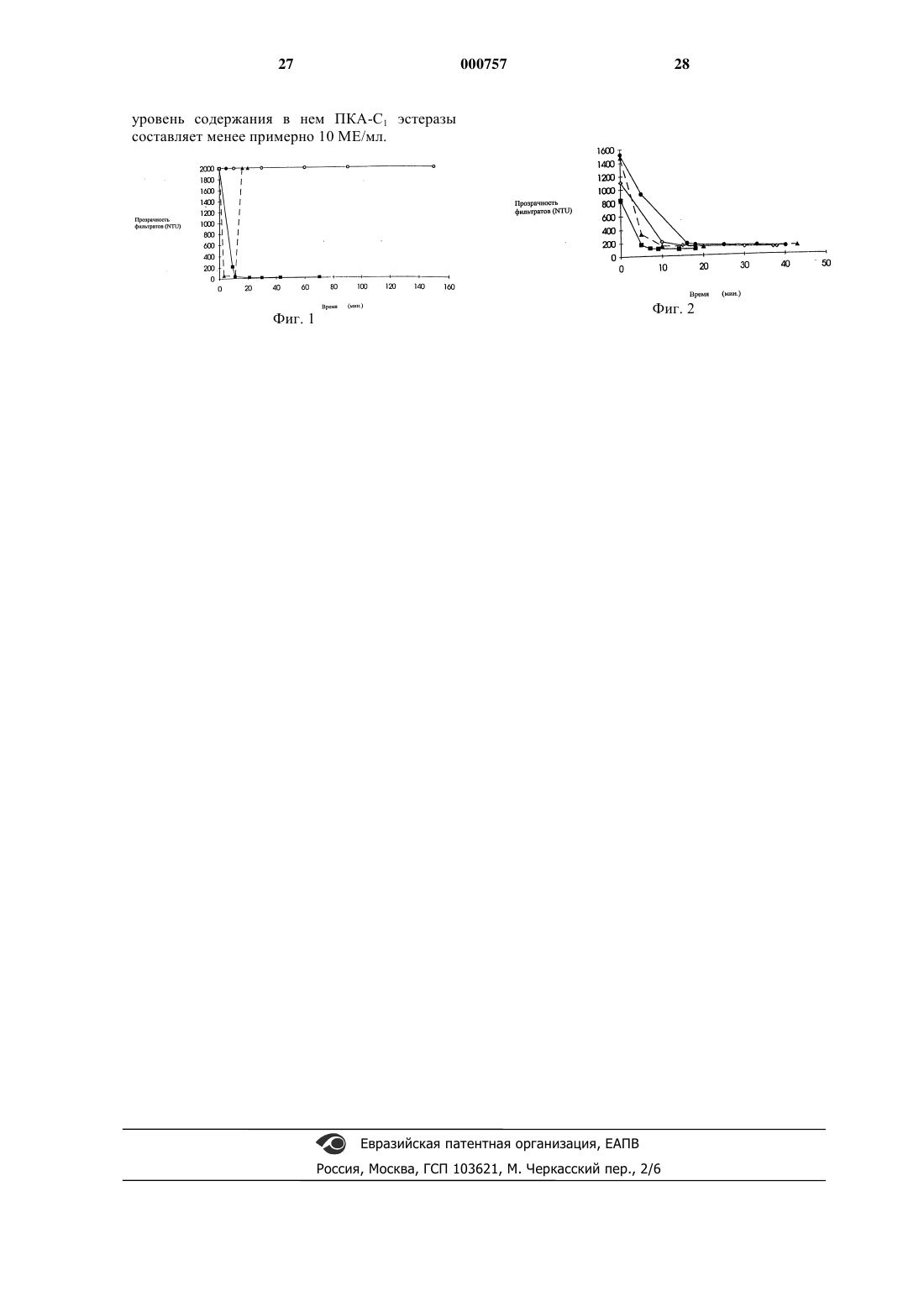
1 Настоящее изобретение относится, в общем, к способу отделения одного или более компонентов от смеси белков. Более определенно в этом изобретении указан способ отделения одного или более компонентов плазмы крови,состоящий из одной или более стадий фильтрации с использованием фильтрующих средств на основе целлюлозы. Настоящее изобретение может быть полезно в приготовлении терапевтических средств, особенно для лечения людей, с применением плазмы крови. Везде в описании изобретения, если по контексту не требуется иное толкование, под словами "состоит из" или их вариации "состоящий из" будет подразумеваться включение указанных неделимых целых (явлений, действий,веществ) или групп неделимых целых, но не исключение никаких других неделимых целых или групп неделимых целых. Сведения о публикациях, на которые ссылается автор этой заявки, приведены в конце описания. Дальнейшее развитие современных представлений о функции белков плазмы крови и заболеваниях, вызванных различными расстройствами системы кровообращения, совместно с дальнейшим усовершенствованием методов хранения наиболее важных белковых компонентов человеческой крови, привели к более полному использованию специфических подфракций человеческой крови, особенно клеточных компонентов (эритроцитов, тромбоцитов и лейкоцитов) и белковых фракций плазмы (альбумина, фибриногена и глобулинов, включая эуглобулины, псевдоглобулины, -глобулин, глобулин и -глобулин), а не цельной крови, для терапевтических целей. Белковая фракция плазмы человеческой крови имеет огромное значение в фармацевтической промышленности для производства лекарственных средств по лечению фибриногенных и фибринолитических заболеваний,нарушений коагуляции, иммунодефицитов, например, гемофилии, болезни фон Виллебрандта и фибриногенной недостаточности, и многих других. Наиболее важными терапевтическими фракциями являются: альбумин определенной степени чистоты; сывороточный иммуноглобулин, как нормальный, так и специфический; антигемофильный фактор или фактор VIII; протромбиновый комплекс, включающий факторыII, VII, IХ и X; и фибриноген или фактор I. Использование терапевтически активных фракций плазмы исключает возможность гиперволемии и уменьшает риск, связанный с использованием недостаточно очищенных белков. Для пациентов с нарушениями коагуляции является возможной только адекватная терапия по замене крови с использованием концентрата фактора коагуляции. Максимальное значение титра антител, достаточное для профилактики и лече 000757 2 ния, может быть достигнуто только через использование концентратов сывороточного иммуноглобулина. Многие компоненты плазмы крови, особенно факторы коагуляции V и VIII и сывороточный иммуноглобулин, неустойчивы и для достижения максимального терапевтического эффекта, а также для уменьшения риска, связанного с использованием продуктов крови,должны быть приготовлены быстро и с соблюдением предосторожности. Например, считается возможным, что продукты частичной денатурации сывороточного иммуноглобулина, происходящей из-за неадекватного осуществления процедуры фракционирования, являются токсичными и высокоиммуногенными для реципиента. Таким образом, производство по фракционированию плазмы нуждается в усовершенствовании способов фракционирования, которые должны быть более быстрыми, давать больший выход конечного продукта, не вызывать денатурации и вносить как можно меньше нежелательных загрязнителей во фракции плазмы, полученные с использованием этих методов. Криопреципитация (осаждение замораживанием) является первой стадией в большинстве современных способов фракционирования благодаря широкому спектру фракций плазмы. Свежезамороженная плазма объединяется, оттаивается при температуре ниже 5 С и осадок собирается в центрифуге непрерывного действия (Guthohrleen and Faike, 1977; Avery, 1972). Супернатантная фракция, известная среди специалистов под названием "криосупернатант",обычно сохраняется для использования. Криосупернатант может быть использован как источник большого количества фракций плазмы, включая фибриноген, антитромбин III,протромбиновый комплекс, включающий факторы коагуляции (II, VII, IX и X), альбумин и иммуноглобулин. Последующая обработка криосупернатанта обычно заключается в осаждении с использованием органических осадителей, таких, как сульфат аммония,этанол,ацетон и полиэтиленгликоль. Например, при определенном сочетании следующих параметров: этанола,температуры ниже 0 С, рН, ионной силы и концентрации белка - происходит селективное осаждение белковой фракции плазмы. Эти параметры являются основополагающими согласно методу фракционирования по Кону (Cohn et al,1946), который был предложен для очистки альбумина. С большинством органических растворителей, особенно с охлажденным этанолом, первыми белками плазмы, которые осаждаются,являются альбумин III и фибриноген. Альбумин, эуглобулин и липопротеин являются последними белками, которые фракционируются при использовании охлажденного этанола. 3 Вариации фракционирования Кона были усовершенствованы Oncley et al, (1949) для очистки иммуноглобулина из плазмы. По методуOncley используются фракции Кона II и III в качестве исходных продуктов и различные сочетания параметров: охлажденный этанол, рН,температура и концентрация белка аналогично описанному Коном и соавторами (1946) для того, чтобы получить функцию активного сывороточного иммуноглобулина. В последнее время метод Oncley является классическим для получения сывороточного иммуноглобулина. Фракции Кона были подвергнуты дальнейшей очистке с использованием этанола и метода осаждения в изоэлектрической точке с целью селективного отделения белков. В частности, Curling применил осаждение в изоэлектрической точке для выделения белка эуглобулина из насыщенной альбумином фракции,полученной из плазмы. С другой стороны, или вдобавок, фракции Кона могут быть подвергнуты дальнейшей очистке для удаления оставшихся в твердой фазе липопротеинов. Способы выделения липопротеинов из твердой фазы хорошо известны специалистам и состоят, например, из адсорбции липопротеинов на Аэросиле или подобном силикатном материале и др. На всех стадиях осаждения, используемого для фракционирования белков плазмы, жидкая и твердая фазы должны быть разделены. Обычно большое количество осадка собирается посредством центрифугирования. Осадок белка или паста удаляется из пробирки центрифуги, переводится во взвешенное состояние и в дальнейшем подвергается разделению на следующие фракции; или супернатант собирается и используется по назначению. Однако ассортимент подходящих для подобной работы центрифуг ограничен из-за строгих гигиенических требований к их эксплуатации и необходимости проведения процесса фракционирования плазмы при низких температурах, особенно при фракционировании лабильных белков (например,фактора VIII). К несчастью, рассеяние тепла из центрифуг значительно, и предъявляются высокие требования к охлаждающему оборудованию. Центрифуги в процессе работы нужно помещать в комнатах, где поддерживается отрицательная температура воздуха для того, чтобы снизить нагрузку на машины. В центрифугах часто происходит недостаточно полное осаждение при проведении широкомасштабных процессов, может потребоваться смена нескольких центрифужных пробирок для каждой группы белков плазмы. Опыт использования центрифуг показал, высокие требования по уходу за ними приводят к существенным потерям времени,денег и их производительности в период их срока службы. Более того, значительное количество маточного раствора, отделяемого при центрифугировании исходного материала, остается в пас 000757 4 те, что, с одной стороны, уменьшает выход ценных белков из фракции супернатанта и, с другой стороны, может привести к сильному загрязнению продуктов, получаемых из пасты, если промывание пасты не проводится. Процедурой, альтернативной центрифугированию или применяемой в сочетании с ним,является широкомасштабная фильтрация белков плазмы для удаления осадка. Известно много типов фильтров, которые могут быть использованы в фильтровании фракций плазмы. Тарелочные и рамочные фильтры являются наиболее простыми в эксплуатации, имеют наименьшее значение отношения площади к объему жидкости, так что остаточный объем минимален, и промывание остатка на фильтре очень эффективно. Трубчатые фильтры являются вертикально ориентированными и, в первую очередь, используются в тех случаях, когда содержание твердых частиц невелико, например, в очищении воды. Вращающиеся листовые фильтры создаются с вертикальным или горизонтальным положением листов в вертикальном или горизонтальном сосуде камеры. Горизонтальные листы используются в промежуточных операциях в качестве очистного фильтра, когда содержание твердых частиц мало и время циклов велико. Вертикальные листы разработаны для более эффективного удаления остатка на фильтре и когда количество твердых частиц велико. Фильтры могут быть использованы совместно со вспомогательными средствами для фильтрации с целью улучшения потока в продолжение фильтровального процесса. Вспомогательные материалы для фильтрации добавляются в твердожидкостную смесь для того, чтобы избежать залепления отверстий фильтра или закупорки пор подложки фильтра и для того,чтобы обеспечить непрерывный проход вещества через фильтр путем открытия каналов для потока. Оптимальным вспомогательным материалом для фильтрации является такой, который обеспечивает наилучшую чистоту разделения фракций и наибольшую скорость потока. Важно, чтобы этот материал был высокопроницаемым, имел узкое распределение частиц по размерам волокон, был химически инертным и физически прочным. Вспомогательные материалы для фильтрации используются повсеместно в технологических процесса для разных целей, таких, как ожижение угля (Jones et al, 1994; Shou et al,1980), очистка сточных вод (Руденко, 1981),очистка еды и продуктов (Olsen et al, 1979; Hermin and Brocheton, 1994) в масложировой промышленности (Грищенко и Ельшин, 1980; Сорока, 1975). Целлюлозные вспомогательные материалы для фильтрации - далее по тексту фильтрующие материалы - широко применяются в фильтровальных установках, в которых использование растворимого диоксида кремния из диатомовыхTechnical Bulletin, RettermaierSohn). Применимость целлюлозных фильтрующих материалов для фракционирования фармацевтических продуктов, в частности, продуктов крови, остается неопределенной. В отрасли промышленности, связанной с фракционированием плазмы, в качестве фильтрующих материалов применяется только диатомовая земля. Friedlie и соавторы из швейцарской Службы Красного Креста исследовали фильтрование с фильтрующим материалом из диатомовой земли (Perlite J-100, Celite 545 HyfloSuper-Cel) в получении альбумина и гаммаглобулина при фракционировании плазмы. Они сделали вывод, что хотя фильтрация грубых фракций дает обнадеживающие результаты, при разделении на более чистые фракции происходит недопустимая потеря белка из-за их адсорбции на фильтрующем материале из диатомовой земли (Friedli et al; 1976). Служба переливания крови Красного Креста в Германии (Wolter,1977) применила вертикальный трубчатыйZHF-S фильтр, предварительно покрытый фильтрующим материалом из диатомовой земли, Hyflo-Super-Cel, для выделения альбумина. Нао (1985) из Нью-Йоркского Центра Крови также исследовал Hyflo Super-Cel в качестве фильтрующего материала для фильтрации фракции IV-4 и обнаружил, что, действительно,потери альбумина имеют место. Dt Jonge et al(1993) сообщил о применении фильтрующего материала из диатомовой земли, Celite, для отфильтровывания осадков Кона, фракции I,фракции I+III, фракции III, фракции IV и фракции V. С применением фильтрующего материала из диатомовой земли в фармацевтической промышленности связано несколько проблем, основной из которых является необходимость высокого качества конечного продукта. В частности, фильтрующие материалы из диатомовой земли извлекаются из грунта и подвергаются незначительной обработке. Их качество сильно меняется в зависимости от месторождения, и для применения в фармацевтической промышленности они должны быть промыты кислотой из-за их способности выделять тяжелые металлы и алюминий. Они абразивны, что вредно для насосов, и способны к электризации. Более того, что касается специфических проблем отрасли промышленности, связанной с фильтрацией плазмы, где необходимы высокое качество и нерастворимость, то фильтрующие материалы из диатомовой земли активируют контактную активационную систему, вырабатывающую прекалликреиновый активатор (ПКА) и ПКА-комплекс, которые могут вызвать вредные клинические последствия. 6 В работе по подготовке данного изобретения авторы стремились разработать новый и лучший способ фракционирования смесей белков, например смесей белков плазмы, с использованием фильтрационной технологии. В частности, применение фильтрующих материалов,которые являются новыми для отрасли промышленности, связанной с фракционированием плазмы, дало возможность развить и улучшить целый ряд методик по получению фракций белков плазмы, таких, как фракции Кона, альбумин,липопротеин и эуглобулин. Соответственно, один из аспектов данного изобретения содержит способ отделения материала твердой фазы от смеси биомолекул, состоящий из контакта этой смеси с фильтрующим материалом на основе целлюлозы с образованием жидкой тестообразной массы (шламма) и прохода или прокачивания с помощью насоса этой массы через фильтровальный сосуд. Согласно другому осуществлению данное изобретение содержит способ отделения материала твердой фазы от смеси биомолекул, причем этот способ состоит из следующих стадий:(i) предварительное покрытие ячеек фильтра фильтрующим материалом на основе целлюлозы;(ii) прохождение или прокачивание с помощью насоса этой смеси биомолекул через фильтр с покрытыми ячейками. Совместно с использованием фильтрующих материалов на основе целлюлозы для предварительного покрытия отверстий фильтра дополнительное количество фильтрующего материала может быть добавлено в смесь биомолекул. Соответственно, в другом варианте изобретения дополнительное количество фильтрующего материала на основе целлюлозы добавляется в смесь биомолекул с образованием шламма, и шламм проходит или покачивается с помощью насоса через предварительно покрытые отверстия фильтра. Согласно вышеупомянутому осуществлению, полученный таким образом фильтрат может быть по желанию возвращен на дополнительную фильтрацию на подачу или в фильтровальный сосуд (рециркуляционный способ). После этого фильтрат собирается. Скорость потока, используемая в любом осуществлении вышеописанного способа, может быть легко подобрана специалистами. Желательно, чтобы было выполнено один раз или более промывание фильтра с использованием подходящего растворителя или водного буферного раствора для того, чтобы промыть полученную твердую фазу или остаток на фильтре с целью удаления остатков маточного раствора, задержанного осадком с целью дальнейшего увеличения выхода конечного продукта и улучшения процесса разделения. Каждая промывка вытесняет жидкость внутрь фильтро 7 вального сосуда, тем самым увеличивая выход желаемого продукта в фильтрате. Объем буфера, применяемый для каждой промывки фильтрата, может быть легко подобран специалистами. Раствор, подходящий для промывки, и ее условия могут значительно варьировать в зависимости от природы смеси и стабильности желаемого конечного продукта. Эти условия легко без длительных экспериментов могут быть подобраны специалистами. Данное изобретение особенно распространяется на способ отделения материала твердой фазы от смеси биомолекул, где эта смесь биомолекул включает в себя, по меньшей мере,один белок плазмы. Фильтрующим материалом на основе целлюлозы может быть любой фильтрующий материал, содержащий целлюлозу в качестве активного ингредиента, действие которого направлено на предотвращение забивания отверстий или подложки фильтра, или как альтернатива, или как дополнение, на облегчение потока во время фильтровального процесса; материал химически инертен, физически стабилен, не абразивен и,что предпочтительно, не выделяет алюминий. Авторы изобретения обнаружили, что оптимальный тип и количество целлюлозного фильтрующего материала, подходящего для конкретного процесса фильтрации, можно варьировать в зависимости от исходного материала,который подвергнется фильтрованию, и желаемого конечного продукта. В общем случае, оптимальный фильтрующий материал для конкретного фильтрования будет обеспечивать наибольшую скорость потока в продолжение фильтрации и более чистый фильтрат, чем субоптимальный фильтрующий материал. Однако для того, чтобы получить наилучшее исполнение описываемого изобретения, очень важно не перегружать фильтр, ибо перегрузка может привести к некоторым нежелательным эффектам,среди которых - повышенная мутность фильтратов, прогиб, прорыв и другие повреждения фильтра, попадание осадка фильтрования между ситами фильтра. Соответственно, особенно предпочтительное воплощение данного изобретения предполагает, что оно будет выполнено при максимальной концентрации приблизительно 2 об.% целлюлозного фильтрующего материала (т.е. 20 г целлюлозного фильтрующего материала на 1 л раствора) или 2,0 мас.% целлюлозного фильтрующего материала (т.е. 20 г целлюлозного фильтрующего материала на 1 кг плазмы). Даже более предпочтительно, чтобы целлюлозный фильтрующий материал использовался в концентрации приблизительно от 0,5 до 2,0 об.% или, по-другому, при концентрации приблизительно от 0,5 до 2 мас.%. Согласно этому предпочтительному варианту, авторы изобретения обнаружили, что до 000757 8 бавление фильтрующего материала в концентрации приблизительно от 0,5 до 2,0 мас.% в исходную смесь до фильтрования помогает получить плотный пористый слой, который облегчает поток. Более низкие концентрации фильтровального материала, чем указанные выше,имеют тенденцию быть недостаточными для того, чтобы заполнить ячейки фильтра, при этом возможно прохождение материала твердой фазы через ячейки фильтра, или, с другой стороны,это может привести к низкой пористости слоя,что ведет к резкому падению давления и снижает количество способного к фильтрации материала. Концентрация целлюлозного фильтрующего материала, более высокая по сравнению с той, которая указана выше в определенных пределах, приводит к высокопористому слою, позволяющему слишком большому количеству материала твердой фазы из исходной смеси проходить через фильтрационный слой, при этом уменьшается прозрачность фильтрата, в добавок к возникновению проблем, выявленным ранее. Желательно там, где смесь биомолекул включает, по меньшей мере, один белок плазмы,полученный от источника плазмы, и желательным конечным продуктом является богатая эуглобулином или липопротеином фракция, многие целлюлозные фильтрующие материалы могут быть подходящими, включая, например, Diacel 150, Diacel 200, Arbocel 200 или Vitacel 200 и другие. Так как эуглобулин или липопротеин могут быть изолированы внутри материала твердой фазы, будучи связанными с тонким кремнезмным порошком, например,при добавлении Aerosil в фракцию I, концентрация целлюлозного фильтрующего материала,применяемого в процессе фильтрации, выраженная как процентное отношение к весу тонкого кремнезмного порошка, находящегося в исходной смеси, должна быть оптимизирована для того, чтобы получить наилучший выход. В тех случаях, когда смесь биомолекул состоит хотя бы из одного белка плазмы, полученного из источника плазмы, и желаемым конечным продуктом является богатая иммуноглобулином фракция, предпочтительным целлюлозным фильтрующим материалом является тонкодисперсная целлюлоза, например, Diacel 150 и другие. В тех случаях, когда смесь биомолекул является фракцией плазмы, которая очень похожа на фракцию II+IIIW или на фракцию III, полученные с использованием процедуры по Cohn etal (1946) или ее модификации, предпочтительно,чтобы фильтрующим материалом была тонкодисперсная целлюлоза, например, Diacel 150 и другие. Целлюлозный фильтрующий материал может быть оставлен для предварительного набухания в подходящем буфере или среде, предпочтительно в буфере или среде, которые явля 9 ются изотоническими и с тем же рН, что и у смеси биомолекул. Другим способом целлюлозный фильтрующий материал может быть добавлен непосредственно в смесь биомолекул и выдержан по времени и в условиях, достаточных для его набухания, до стадии прохождения смеси или ее прокачивания с помощью насоса через ячейки фильтра или фильтровального сосуда. Время набухания целлюлозного фильтрующего материала и подходящие условия известны специалистам и могут варьироваться в зависимости от среднего диаметра частиц, температурозависимой гидрофильности или ионной силы раствора, в котором происходило набухание. Данное изобретение подходит для любого типа фильтровального сосуда, предназначенного для фильтрации смеси биомолекул, таких,как смесь белков плазмы, например, тарелочные или рамочные фильтры, трубчатые или вращающиеся листовые фильтры и другие. Тарелочные и рамочные фильтры наиболее просты в использовании, имеют наименьшее отношение объема жидкости к площади, так что остаточный объем минимальный, и промывание остатка на фильтре очень эффективно. Тарелочный и рамочный фильтры подходят для фильтрации,включающей в себя как предварительное покрытие ячеек фильтра, так и вышеописанный рециркуляционный метод. Трубчатые фильтры являются вертикально ориентированными и, в первую очередь, используются в тех случаях,когда содержание твердых частиц невелико,например, в очищении воды. Вращающиеся листовые фильтры создаются с вертикальным или горизонтальным положением листов в вертикальном или горизонтальном сосуде камеры. Горизонтальные листы используются в промежуточных операциях в качестве очистного фильтра, когда содержание твердых частиц мало и время циклов велико. Вертикальные листы разработаны для более эффективного удаления остатка на фильтре, и когда количество твердых частиц велико. Авторы изобретения установили,что при фильтрации смеси белков плазмы наиболее предпочтительным является рециркуляционный способ. Способ фильтрации по данному изобретению особенно полезен в разделении сложных или простых смесей биомолекул, особенно сложных и простых смесей белковых компонентов плазмы. Термин "биомолекула", используемый здесь, должен быть принят как относящийся к любой молекуле, существующей в природе или являющейся производной от природной, выключая, но не ограничиваясь ими, аминокислоты, нуклеотиды, нуклеозиды, сахара, жиры и полимеры, такие как нуклеиновые кислоты,белки, пептиды, полисахариды, липиды и липопротеины. 10 Соответственно, термин "смесь биомолекул", используемый здесь, распространяется на любую смесь, состоящую более чем из одного белка, нуклеиновой кислоты, пептида, полисахарида, липида, липопротеина, аминокислоты,нуклеотида, нуклеозида, сахара или жира, которые получены из биологических источников. В его настоящем контексте термин "смесь биомолекул" распространяется на клеточные культуры, растворы клеточных или подклеточных компонентов или клеточных экстрактов, особенно продуктов крови и их производных, таких как плазма или получаемые из нее фракции. Термин "материал твердой фазы", используемый здесь, должен быть принят как означающий любое соединение, макромолекулу,биомолекулу в их твердом состоянии, независимо от средств, применяемых для растворения этих соединений, макромолекулы или биомолекулы. Например, в контексте заявки на изобретение, имеющего отношение к отрасли промышленности, связанной с фракционированием плазмы, термин "материал твердой фазы" должен быть принят как включающий полученный осадок белков плазмы и связанные с твердой фазой липопротеины, и другие, полученные из нефракционированной или фракционированной плазмы крови. Данное изобретение не должно восприниматься как ограниченное любым способом или средством для получения материала твердой фазы так, как было описано выше, предметом оговорки является то, что этот способ или средство не разрушает целлюлозный фильтрующий материал, описанный выше. Предпочтительно, чтобы материалом твердой фазы была биомолекула, такая, как белок плазмы, выбранная из списка, включающего в себя альбумин, иммуноглобулин, липопротеин,эуглобулин, фактор VIII, протромбиновый комплекс, антитромбин III или другие компоненты крови. В контексте данного изобретения термин белок плазмы означает белковый, полипептидный или пептидный фрагмент, полученный из источника плазмы, которым (источником) может быть, но этим не ограничивается,свежезамороженная плазма, несвежезамороженная плазма или ее фракция, такая как промежуточная фракция, полученная с использованием схемы фракционирования Cohn et al (1946) или Oncley et al (1949) или какая-либо ее модификация или другая фракция плазмы. Соответственно, термин "белок плазмы" не должен восприниматься как ограниченный только понятием фракций плазмы, полученный с использованием способа осаждения с помощью этанола. Термин "полученный из" ("derived from"),использованный здесь, должен быть принят как указывающий, что конкретное вещество или группа веществ происходило из конкретного источника, как здесь определено, но не обяза 11 тельно было получено непосредственно из этого источника. Например, белок плазмы может быть получен непосредственно из нефракционированной крови, грубой плазмы или ее фракций. Другой аспект данного изобретения направлен на способ разделения смеси биомолекул, состоящей, по крайней мере, из одной стадии фильтрации с использованием целлюлозного фильтрующего материала. Другой вариант данного изобретения предусматривает способ разделения смеси биомолекул, состоящей из, по крайней мере, из одной стадии фильтрации с использованием целлюлозного фильтрующего материала, где эта смесь биомолекул содержит, по крайней мере, одну белковую молекулу. В особенно предпочтительном варианте данное изобретение предусматривает способ разделения смеси биомолекул, состоящий, по крайней мере, из одной стадии фильтрации с использованием целлюлозного фильтрующего материала, где этой смесью биомолекул является плазма крови или ее производное, такое как,но не ограничиваясь этим, супернатант, повторно суспендированный осадок белков плазмы или промежуточная фракция, полученная по схеме фракционирования Cohn или Oncley и другие. Согласно более предпочтительному варианту, этой фракцией, полученной из плазмы крови, является любая богатая иммуноглобулином, эуглобулином или липопротеином фракция. Согласно этому варианту настоящего изобретения, богатая иммуноглобулином, эуглобулином или липопротеином фракция получается из свежезамороженной плазмы или другого источника плазмы или его производного, включая супернатант или промежуточную фракцию, полученную по схеме фракционирования Cohn etal (1946), или Oncley et al (1949), или их модификации, или с использованием другого известного специалистам процесса. Специалисты должны быть знакомы со схемами фракционирования по Cohn et al (1946) и Oncley et al (1949) и существующими или доступными их модификациями, подходящими для получения источника иммуноглобулина, эуглобулина или липопротеина. Термин "криосупернатант", используемый здесь, должен быть известен специалистам как фракция супернатанта, получаемого из свежезамороженной плазмы, в дальнейшем подвергшейся оттаиванию при температуре примерно ниже 5 С и центрифугированию для удаления твердой фазы или замороженного осадка. В другом варианте настоящего изобретения предлагается способ разделения смеси биомолекул, состоящей, по крайней мере, из одной,желательно двух, более предпочтительно трех и наиболее предпочтительно четырех стадий осаждения смесью этанола и ацетатного буфера, в 12 котором твердая и жидкая фазы, полученные таким образом, фракционируются с применением, по крайней мере, одной стадии фильтрации с использованием целлюлозного фильтрующего материала. Согласно особенно предпочтительному варианту эта смесь биомолекул состоит, по крайней мере, из одного белка плазмы крови, например,липопротеин,эуглобулин,иммуноглобулин, белок фактора VIII, протромбиновый комплекс, антитромбин III или альбумин и другие. Таким образом, этот вариант изобретения применим в разделении твердой и жидкой фаз смеси этанольно-ацетатного осаждения, полученной по схеме фракционирования плазмы,например, по схемам фракционирования Кона(Cohn et al, 1946) или Онкли (Oncley et al, 1949) или их модификациям. Вышеописанный способ является особенно полезным в получении изолированных биомолекул, в частности белков, полученных из плазмы, которые подходят для использования в качестве терапевтических реагентов в лечении или профилактике заболеваний. В дальнейшем аспекте данного изобретения предлагается изолированная биомолекула,где, по крайней мере, один, лучше, по крайней мере, два и наиболее предпочтительно, по крайней мере, три стадии отделения этой биомолекулы включают использование целлюлозного фильтрующего материала для отделения этой биомолекулы от других биомолекул в простой или сложной смеси биомолекул. Желательно, чтобы эта молекула была молекулой белка, более предпочтительно лекарственного белка, еще более предпочтительно человеческий лекарственный белок и наиболее предпочтительно человеческий лекарственный белок из плазмы, например, липопротеин, эуглобулин, иммуноглобулин, фактор VIII, протромбиновый комплекс, антитромбин III или альбумин и другие. В наиболее предпочтительном варианте данное изобретение предлагает изолированный лекарственный белок из плазмы, где, по крайней мере, одна, лучше, по крайней мере, две и более предпочтительно три стадии изолирования этого белка включают использование целлюлозного фильтрующего материала и где этот белок выбран из списка, включающего в себя альбумин, липопротеин, иммуноглобулин или эуглобулин. Продукты, полученные по способу данного изобретения, являются совершенно свободными от нежелательных примесей. Например,особенно предпочтительно, чтобы белки плазмы, в частности, иммуноглобулин и альбумин,выделенные по вышеописанному способу, характеризовались малым содержанием алюминия и ПКА. Минимально допустимое содержание алюминия и ПКА определяется повсеместно в 13 мире стандартами Фармакопей, таких как Британская Фармакопея (БФ), Европейская Фармакопея (ЕФ) и/или Американская Фармакопея(СШАФ). Так как альбумин получается с использованием способа данного изобретения, особенно предпочтительно, чтобы наряду с малым содержанием алюминия и ПКА содержание липопротеина в данном изолированном белке было менее 0,3 мас.%, еще более предпочтительно менее 1,0 мас.%, еще более предпочтительно менее 0,5 мас.% и наиболее предпочтительно менее 0,3 мас.%. Данное изобретение в дальнейшем проиллюстрировано следующими чертежами и примерами, ни в коей мере не ограничивающими применение изобретения. На чертежах: фиг. 1 является графическим представлением, иллюстрирующим улучшенную прозрачность фильтратов, полученных из плазмы белковой фракции I, с использованием целлюлозного фильтрующего материала Diacel 200(темные круги), Diacel 150 (темные квадраты) и Vitacel (светлые ромбы) в сравнении с диатомитовым фильтрующим материалом Celite(темные треугольники); фиг. 2 является графическим представлением, иллюстрирующим улучшенную прозрачность фильтратов, полученной из плазмы белковой смеси фракции II+IIIW, с использованием целлюлозного фильтрующего материала Diacel 200 (темные круги), Diacel 150 (темные квадраты) и Vitacel (светлые ромбы) в сравнении с диатомитовым фильтрующим материалом Celite (темные треугольники). Пример 1. Отделение фракции I с использованием различных фильтрующих материалов. Четыре различных пула свежезамороженной плазмы или криосупернатанта, объем партии 200 л, были использованы в четырех независимых экспериментах с использованием листового фильтра опытной установки с площадью поверхности 2 м 2. Исходный материал был охлажден до менее 1 С, растворен в воде для инъекций до концентрации белка от 4 до 6 об.%. Достаточное количество этанола и ацетатного буфера было добавлено для того, чтобы получить следующие условия осаждения: 8 об.% этанола и окончательное значение рН от 6,6 до 7,4. В этих условиях при -2 С осаждается фибриноген, а иммуноглобулин и альбумин остаются в растворе. Целлюлозный фильтрующий материал (Diacel 200, Diacel 150 и Vitacel) 14 был добавлен в смесь фракции I в отношении 5 г на 1 л смеси и оставлен для набухания. Затем шламм был прокачен насосом через фильтровальный сосуд и фильтрат возвращался обратно в загрузку до тех пор, пока не становился прозрачным. Фильтрат собирался до тех пор, пока загрузка не была истощена. Остаток на фильтре затем промывался раствором, содержащим 8% этанола и 0,14 М NaCl, с целью удаления остатка маточного раствора, удержанного остатком на фильтре. Остаточный объем фильтра был в дальнейшем удален выдуванием с использованием охлажденного воздуха или азота, и в конце процесса остающаяся в фильтровальном сосуде жидкость была вылита. Остаток на фильтре был высушен обдувом охлажденным воздухом или азотом. Фильтр был открыт, остаток на фильтре был содран с сетки фильтра и выброшен. Профиль прозрачности фильтрата от различных фильтровальных материалов представлен на фиг. 1. В качестве контроля рассматривалась прозрачность фильтрата, полученного при использовании диатомитового фильтрующего материала. Более тонкодисперсный материалDiacel давал наиболее крутой профиль и наиболее быстрый проход материала. В табл. 1 сравниваются результаты нескольких опытов с различными фильтрующими материалами при фильтрации фракции I и сюда же включены результаты процессов центрифугирования, осуществлявшихся в настоящее время в Парквилле. В общем, эффективность фильтрационного отделения была более высокой по сравнению с отделением с помощью центрифуги, что подтверждается большей прозрачностью фильтрата (меньшей мутностью) и меньшим содержанием фибриногена в фильтрате. При фильтрации выход белка был меньше,чем при центрифугировании, из-за больших потерь в мертвом объеме. Все исследованные целлюлозные фильтрующие материалы, по-видимому, действовали в равной степени хорошо с прозрачностью в пределах от 82 до 196 НЕМ (нефелометрических единиц мутности). Diacel 150 требовал наименьшего времени рециркуляции, показывая, что твердые вещества быстро и эффективно удерживались на подложке фильтра, и пористость фильтра при этом уменьшалась быстро. Однако этот фильтрующий материал давал самое большое падение давления, что можно было бы ожидать при фильтрации через этот тонкий фильтрующий материал. Таблица 1 Результаты фильтрования смеси фракции I с целью получения фильтрата фракции I Содержание Фильтрующий НЕМ пула Давление,Время рецирку- Выход белка в фибриногена,материал фильтрата бар ляции, мин фракции I,мг/мл г/л плазмы 0,40,4 (n=3) 145 0,070,03 3018 не определялось не определялось этанола и 0,14 М NaCl, с целью удаления остатка маточного раствора, удержанного остатком на фильтре. Остаточный объем фильтра был в дальнейшем удален выдуванием с использованием охлажденного воздуха или азота, и в конце процесса остающаяся в фильтровальном сосуде жидкость была вылита. Остаток на фильтре был высушен обдувом охлажденным воздухом или азотом. Остаток на фильтре был содран с сетки фильтра и положен на хранение в замороженном виде до дальнейшей обработки для получения чистого иммуноглобулина. Фильтрация этой смеси получилась только при использовании фильтрующего материала тонкого помола, Celite580 и Diacel 150. Diacel 150 обеспечил замечательную фильтрацию, и прозрачность фильтрата, в общем, наступила через 5 мин. Опыт с Celite580 вначале протекал удачно, при этом фильтрат имел показания прозрачности 51 НЕМ после первых 5 мин работы. Однако когда давление возросло,тонкие волокна под нажимом были продавлены через подложку фильтра и поникли в фильтрат,при этом его мутность возросла до 988 НЕМ.VitacelLC200 Diacel 200 были неспособны обеспечить достаточно прочную подложку фильтра для фильтрации этой смеси фракцииII+IIIW. Таблица 2 Результаты фильтрования смеси фракции II+IIIW НЕМ пула фильтрата Давление, бар Время рециркуляции, мин 2000 2,0 145 988 2,0 5 3425 (n=3) 0,60,5 (n=3) 75 (n=3) 2000 0,70,9 60 55-915 не определялось не определялось Пример 2. Отделение фракции II+IIIW с использованием различных фильтрующих материалов. Опытно-промышленные испытания листового фильтра площадью 2 м 2 проводились с использованием остатка на фильтре фракции II+III с размером проб от 15 до 18 кг. Замороженный остаток на фильтре фракции III+III, содержащий фильтровальный материал от предыдущей стадии фракционирования, был переведен во взвешенное состояние в воде для инъекций с концентрацией белка 1 об.%. Достаточное количество этанола и ацетатного буфера было затем добавлено для достижения следующих условий осаждения: концентрация этанола 20 об.% и конечная рН раствора 6,65. При этих условиях и при температуре -5 С иммуноглобулин осаждается, а в осадке остаются альбумин и некоторые липопротеины. Шламм тщательно перемешивается для получения гомогенной смеси фракцииII+IIIW. Дополнительное количество фильтрующего материала не добавлялось к смеси. Шламм был прокачен с помощью насоса через фильтровальный сосуд и фильтрат возвращался обратно в загрузку до тех пор, пока не стал прозрачным. Фильтрат собирался до тех пор, пока загрузка не истощилась. Остаток на фильтре затем промывался раствором, содержащим 8% Фильтрующий материал Пример 3. Проведение фильтрации на опытной установке для различного содержания целлюлозного фильтрующего материала. Для того чтобы определить необходимое количество целлюлозного фильтрующего материала в конкретном процессе разделения, были проведены эксперименты на опытной установке по выделению альбумина из фильтрата и иммуноглобулина из осадка с использованием листового фильтра площадью 2 м 2 для фильтрации от 250 до 500 кг смеси фракции II+III в качестве исходного материала. В смесь были добавлены различные количества Diacel 150, оставлены для набухания и профильтрованы по процедуре согласно примеру 1, за исключением того, что состав промывной жидкости для фильтра был 20% этанола/NaCl и богатый иммуноглобулином осадок и богатый альбумином фильтрат были собраны вместе. Время фильтрации, прозрачность фильтратов и падение давления через фильтр представлены в табл. 3. Как видно из табл. 3, большие количества целлюлозного фильтрующего материала приводят к снижению прозрачности полученного фильтрата (т.е. к возрастанию мутности). При наибольшем процентном отношении исследуемого фильтрующего материала падение давления было наименьшим, что, кроме того,указывает на то, что слоистый фильтр является более открытым для потока в этих условиях. По-видимому, существует небольшое различие во времени фильтрации для разных количеств исследованного фильтрующего материала, однако, при наибольшем содержании исследуемого фильтрующего материала наблюдалось попадание остатка на фильтре между сетками 17 фильтра. Этот факт указывает на то, что содержание фильтрующего материала не должно превышать уровня 1,8 об.%, иначе возможна пере 000757 18 грузка фильтра и образование складок на сетках фильтра. Таблица 3 Сравнение фильтрационной способности Diacel 150 в различных концентрациях Объем смеси, л Количество фильтрующего Время, ч НЕМ пула фильтрата Давление, бар материала, об.% 285 (n=1) 0,8 6 не обн. 1,40 332 (n=1) 1,0 4,0 9,8 1,30 332 (n=3) 1,5 4,7 14,2 1,40 460 (n=3) 1,8 6,0 37,4 0,50 Пример 4. Удаление липопротеинов и эуглобулина из богатой альбумином фракции плазмы. В приблизительно 80 л богатой альбумином фракции рН было доведено до 5,2 для осаждения эуглобулинов, затем в эту фракцию был добавлен тонкий кремнезмный порошок для адсорбции липопротеинов. Фильтрующий материал Diacel 200 был добавлен в смесь в соотношении 2 г фильтрующего материала на 1 г тонкого кремнезмного порошка и оставлен для набухания, по крайней мере, на 30 мин. Смесь затем была прокачена насосом через пластиночный и рамочный фильтр, который был снабжен фильтровальной прокладкой и предварительно покрыт Diacel 200. Фильтрат был собран, остаток на фильтре был помыт промывным буфером - 5 mM ацетатным буфером с рН 5,2. Затем фильтр-пресс был разобран и остаток выброшен. Подобный эксперимент был выполнен с использованием опытно-промышленного листового фильтра площадью 2 м 2 с объемом партии 160 л. В этом случае фильтр не был предварительно покрыт, так как достижение высокой скорости потока через фильтр убедило исследователей, что фильтрующий материал Diacel 200 равномерно распределен по сеткам фильтра. Фильтрат рециркулировался до достижении прозрачности. Остаток на фильтре был затем промыт промывным буфером, остаточный объем был собран, остаток на фильтре удален и выброшен. В табл. 4 сравниваются два вида фильтров. Таблица 4 Производительность фильтра Diacel 200 на стадии удаления эуглобулина/липопротеина Параметры Тарелочный и рамочный фильтр Листовой фильтр Прозрачность в начале опыта, НЕМ 71 57 Прозрачность в конце опыта, НЕМ 16 18 Прозрачность конечного пула, НЕМ 26 10 Время фильтрации, мин 40 100 Содержание липопротеина в загрузке, мас.% 2,9 3,1 Содержание липопротеина в фильтрате, мас.% 0,2 0,3 Выход белка, мас.% 85 82 Производительность фильтрации с материалом Diacel 200 высокая на обоих фильтрах, причем опыты выявили высокую степень прозрачности (малую мутность) и равный выход белка (не следовало бы ожидать 100%-ный выход белка, так как некоторое количество белка удаляется с осадком). Уменьшение содержания липопротеина в обоих экспериментах происходит, по меньшей мере, в 10 раз, что подтверждает производительность как тарелочного и рамочного, так и листового фильтра. Время фильтрации во втором опыте намного больше,чем в первом из-за удваивания объема партии. Пример 5. Сравнение отделения фракцииIII с помощью центрифугирования и фильтрации в промышленном масштабе. Промышленный листовой фильтр (площадью 18 м) был оборудован для фильтрации фракции I из фильтрата фракции III. Результаты,о которых здесь сообщается, суммируют данные трех экспериментов конечной фильтрации смеси фракции III. Каждый эксперимент был выполнен следующим образом. Партия 400 кг остатка на фильтре фракцииII+IIIW, который содержал Diacel 150 от предварительной стадии фракционирования по Кону, был переведен во взвешенное состояние в воде для инъекций при 0 С для достижения содержания белка приблизительно 1 об.%. Достаточное количество этанола и ацетатного буфера было добавлено для создания следующих условий осаждения: 17 об.% и конечная рН 5,35. В этих условиях и при температуре -5 С иммуноглобулин М, иммуноглобулин А и несколько липидных оставались в осадке, в то время, как иммуноглобулин G солюбилизировался. Смесь была затем прокачена с помощью насоса через фильтровальный сосуд, фильтрат возвращался назад в загрузку до тех пор, пока не стал прозрачным. Фильтрат собирался до тех пор, пока 19 фильтр не истощился. Остаток на фильтре промывался промывной жидкостью, содержащей 17 об.% этанола и 0,015 М ацетата натрия для удаления остатков маточного раствора, удержанного остатком на фильтре. Остаточный объем фильтра был в дальнейшем удален выдуванием с использованием охлажденного воздуха или азота, и в конце процесса остающаяся в фильтровальном сосуде жидкость была вылита. Остаток на фильтре был высушен обдувом охлажденным воздухом или азотом. Фильтр был открыт, остаток на фильтре был содран с сетки фильтра и выброшен. Были отобраны и изучены 20 образцы фильтрата фракции III. Значение рН фильтрата было доведено до 4,0, фильтрат был сконцентрирован до концентрации белка 7 об.% и подвергнут диализу против воды для инъекций до того, как его формула была установлена с помощью мальтозы. Образцы конечного продукта были также охарактеризованы для определения следовых количеств других белков плазмы. В табл. 5 собраны характеристики фильтрата и конечного продукта из этих трех экспериментов, данные по фильтрации были сравнены с данными по центрифугированию. Таблица 5 Характеристики фильтрата фракции III и конечного продукта Центрифуга Прозрачность, НЕМ, в супернатанте/фильтрате 11,8 7,5IgA в конечном продукте, мг/мл 0,170,03 Плазминоген в конечном продукте, мкг/мл 0,520,36 Из табл. 5 видно, что фильтрат после фильтра прозрачнее, чем супернатант после центрифугирования, с меньшими значениями мутности в НЕМ. Супернатант III после центрифугирования был впоследствии очищен фильтрацией через тарелочный и рамочный фильтр для достижения такого же уровня прозрачности. Из сравнения содержания IgM, IgA и плазминогена в конечном продукте (эти белки плазмы оставались осажденными на данной стадии схемы фракционирования по Кону) следует, что фильтрация в противоположность к центрифугированию этой смеси фракции III дает продукт неплохого качества. Пример 6. Производительность фильтрации в промышленном масштабе при различном содержании целлюлозного фильтрующего материала. Два промышленных фильтра (площадью 18 м 2) были использованы для фильтрации смеси фракции II+III по процедуре, описанной в примере 1, за исключением того, что была использована промывная жидкость, содержащая 20 об.% этанола/NaCl и богатый иммуноглобулином осадок и богатый альбумином фильтрат собирались вместе. Количество фильтрующего материала (в об.%) постепенно уменьшалось для того, чтобы максимально увеличить доступное пространство внутри каждого фильтра. Результаты представлены в табл. 6. Данные для табл. 6 были получены из двух партий фракции II+III разного объема, полученных из 2500 и 5000 кг плазмы. Как видно из табл. 6, чем больше количество использованного фильтрующего материала, тем меньше время фильтрации (т.е. тем быстрее поток). В исследуемом промышленном масштабе производства прозрачность фильтрата определяется точнее, чем на опытной установке,и как следствие, прозрачность фильтрата кажется ниже. Чем больше количество фильтрующего материала, тем больше масса собранного осадка, что снижает эффективность каждого фильтра при одинаковом объеме смеси. Таблица 6 Сравнение производительности фильтрации в промышленном масштабе для различных концентраций целлюлозного фильтрующего материала(n=3) Объем смеси, л Количество фильтВремя, ч Мутность пула Масса осадка, кг трующего материала, об.% фильтрата, НЕМ 3600 1,5 4,09 6,6 254 3700 1,1 6,30 6,5 213 7100 1,5 5,24 4,9 2 х 254 7200 1,0 7,20 5,2 2 х 254 7000 1,0 8,00 7,2 2 х 202 Были использованы два фильтра, и через каждый фильтр параллельно прошло по половине общего объема. Пример 7. Выход иммуноглобулина при промышленном процессе фильтрации. Фильтры промышленного масштаба использованы для фильтрации смесей осадков 21 или 2,0 объема фильтровального сосуда (7500 кг или 10000 кг) промывной жидкости для удаления фильтрата из сосуда. Данные, представленные в табл. 7, сравнивают выход иммуноглобулина G при трех различных объемах партий, где или 1,5, или 2,0 объема фильтрационного сосуда промывной 22 жидкости были использованы. Данные показывают, что во всех случаях исследованного крупномасштабного промышленного производства выход существенно растет с увеличением объема промывной жидкости для промывки фильтра. Таблица 7 Сравнение выходов производственного процесса для различной массы партий и различных объемов жидкости для промывания фильтров Масса веществ плазмы (МВП),Объем промывной жидкости для фильтра Выход, г/кг плазмы кг(хМВП) 2500 1,5 3,60 5000 2,0 4,09 7500 2,0 4,14 фильтрующего материала, как описано выше,содержат ПКА, ПКА-комплекс и алюминий в небольших количествах. Данные табл. 9 показывают, что фильтрация с использованием целлюлозных фильтрующих материалов не оказывает отрицательного влияния на характеристики конечного продукта, что определяется малым содержанием алюминия, калликреина и ПКА в препаратах иммуноглобулина, полученных по способу данного изобретения. Таблица 8 Характеристики альбумина (промышленное производство) Нежелательная примесь Предельно допустимое значение по Фармакопее Результат (n=50) Алюминий 100 мкг/л 84 мкг/л ПКА-C1 эстераза 7 МЕ/мл 3 МЕ/мл 35 МЕ/мл ПКА 4,8 МЕ/мл 1,3 МЕ/мл 28,6 МЕ/мл Пример 8. Оценка качества продукции. Для фракций иммуноглобулина и альбумина, полученных с использованием целлюлозных фильтрующих материалов, определялся уровень содержания алюминия и ПКА. Результаты представлены в табл. 8 и 9. Данные табл. 8 показывают, что качество альбумина не ухудшается при воздействии на него целлюлозного фильтрующего материала и что продукты, полученные с использованием целлюлозного Таблица 9 Характеристики IgG, полученного путем фильтрации с использованием целлюлозных фильтрующих материалов в сравнении с IgG, полученным с использованием средств процесса центрифугирования Нежелательная примесь Центрифугирование (п=3) Фильтрация (n=3) Алюминий (мкг/л) 67 мкг/л 21 мкг/л 34 мкг/л 3 мкг/л Калликреин (% по отношению к стандарту) 453147 16733 ПКА (МЕ/мл) 1,0 МЕ/мл 1,0 МЕ/мл Специалистам следует принять во внимание, что вышеописанное изобретение допускает вариации и модификации, отличные от тех, которые специально изложены. Нужно понимать,что изобретение включает все эти модификации и вариации. Изобретение также включает все стадии, признаки, составы и соединения, которые рассматриваются в данном описании, индивидуально или коллективно, и все и любая комбинации или любые два или более указанных стадий и признаков. Литератураand Improvement of Blood Plasma Fractionation,Edt. H.E. Sandberg, Virginia Sept., pg 129, 1977. ФОРМУЛА ИЗОБРЕТЕНИЯ,1. Способ выделения белков плазмы или смеси белков плазмы из крови, плазмы, одной 24 из фракций плазмы или их криосупернатанта,включающий контактирование указанной крови,плазмы, одной из фракций плазмы или криосупернатанта с фильтрующим материалом на основе целлюлозы с целью создания шлама и пропускание или прокачивание с помощью насоса указанного шлама через фильтровальный сосуд или фильтровальную сетку для получения фильтрата и остатка на фильтре. 2. Способ выделения белков плазмы или смеси белков плазмы из крови, плазмы, одной из фракций плазмы или их криосупернатанта,включающий в себя следующие стадии:(i) предварительное покрытие фильтровальной сетки фильтрующим материалом на основе целлюлозы;(ii) пропускание или прокачивание с помощью насоса указанной крови, плазмы, одной из фракций плазмы или криосупернатанта через фильтровальную сетку с предварительно нанесенным покрытием для получения фильтрата и остатка на фильтре. 3. Способ по п.2, отличающийся тем, что к крови, плазме, одной из фракций плазмы или криосупернатанту добавляют дополнительное количество фильтровального материала на основе целлюлозы до стадии пропускания или прокачивания указанной крови, плазмы, одной из фракций плазмы или криосупернатанта через фильтровальную сетку с предварительно нанесенным покрытием. 4. Способ по любому из пп. с 1 по 3, отличающийся тем, что он включает дополнительную стадию повторного направления фильтрата один или более раз в загрузочный или фильтровальный сосуд. 5. Способ по любому из пп. с 1 по 4, отличающийся тем, что он включает дополнительную стадию промывания или отмывания остатка на фильтре подходящим растворителем или водным буферным раствором для удаления остатка маточного раствора, полученного из исходной смеси. 6. Способ по п.5, отличающийся тем, что он включает дополнительную стадию промывания или отмывания остатка на фильтре с использованием объема растворителя или водного буферного раствора, составляющего до трех объемов фильтровального сосуда. 7. Способ по любому из пп. с 1 по 6, отличающийся тем, что концентрация фильтрующего материала на основе целлюлозы составляет до 2,0% (вес на единицу объема исходной смеси или вес на единицу веса исходной смеси). 8. Способ по п.7, отличающийся тем, что концентрация фильтрующего материала на основе целлюлозы находится в диапазоне от приблизительно 0,5% до приблизительно 2,0% (вес на единицу объема исходной смеси или вес на единицу веса исходной смеси). 9. Способ по любому из пп. с 1 по 8, отличающийся тем, что плазма включает свежезамо 25 роженную плазму или несвежезамороженную плазму, а фракция плазмы включает промежуточную фракцию Кона или фракцию Онкли. 10. Способ по п.9, отличающийся тем, что белок плазмы выбран из группы, включающей альбумин, иммуноглобулин, липопротеин, эуглобулин, фактор VIII, протромбиновый комплекс и антитромбин III, в осажденной, или комплексной, или агрегированной форме, или связанный с нерастворимым носителем, например тонким кремнезмным порошком, или отличающийся тем, что смесь белков плазмы включает указанный белок плазмы. 11. Способ по п.10, отличающийся тем, что фильтрующий материал на основе целлюлозы имеет одну или несколько из следующих характеристик:(i) он облегчает течение исходной смеси через ячейки фильтра во время процесса фильтрации;(iii) он не способствует образованию ПКА в продуктах, выделенных из плазмы, в количествах, превышающих допустимые значения по Британской Фармакопее, Европейской Фармакопее или Фармакопее США; и(iv) он не выделяет алюминий в продукты,выделенные из плазмы, в количествах, превышающих допустимые значения по Британской Фармакопее, Европейской Фармакопее или Фармакопее США. 12. Способ по п.11, отличающийся тем, что фильтрующий материал на основе целлюлозы выбран из списка, содержащего Diacel 150,Diacel 200, Arbocel 200 или Vitacel 200 и другие. 13. Способ выделения материала твердой фазы из крови, свежезамороженной плазмы,несвежезамороженной плазмы, криосупернатанта или полученной из них фракции плазмы, например промежуточной фракции Кона, или фракции Онкли, или другой фракции плазмы,включающий, по крайней мере, одну стадию фильтрации для извлечения указанного материала твердой фазы, причем эта стадия фильтрации выполняется с использованием фильтрующего материала на основе целлюлозы. 14. Способ по п.13, отличающийся тем, что материалом твердой фазы является белок плазмы, выбранный из списка, включающего среди прочих альбумин, иммуноглобулин, липопротеин, эуглобулин, фактор VIII, протромбиновый комплекс, антитромбин III или другие компоненты крови, в осажденной, или комплексной,или агрегированной форме, или связанные с нерастворимым носителем, например, тонким кремнезмным порошком. 15. Способ по п.13 или 14, отличающийся тем, что ему предшествует, по крайней мере,одно этанольно-ацетатное осаждение или обработка тонким кремнезмным порошком для получения материала твердой фазы. 26 16. Выделенный белок плазмы или выделенная смесь белков плазмы, полученные по способу из любого п. с 1 до 15. 17. Выделенный белок плазмы или выделенная смесь белков плазмы по п.16, отличающиеся тем, что они являются белком или смесью белков плазмы для терапевтического лечения или профилактики заболеваний людей или млекопитающих. 18. Выделенный белок плазмы или выделенная смесь белков плазмы, полученные по способу из любого п. с 1 до 15, отличающиеся тем, что указанный белок плазмы выбран из группы, включающей липопротеин, эуглобулин,иммуноглобулин, фактор VIII, протромбиновый комплекс, антитромбин III и альбумин, а указанная смесь включает любой или несколько из указанных белков плазмы. 19. Выделенный белок плазмы или выделенная смесь белков плазмы, полученные по способу из любого п. с 1 до 15, отличающиеся тем, что указанный белок плазмы выбран из группы, включающей альбумин, липопротеин,иммуноглобулин и эуглобулин, а указанная смесь включает любой или несколько из указанных белков плазмы. 20. Выделенная фракция альбумина, полученная по любому п. с 1 по 15. 21. Выделенная фракция альбумина, полученная по любому п. с 1 по 3 или с 13 по 14,отличающаяся тем, что уровень содержания липопротеина в препарате ниже примерно 3,0 вес.% по отношению к альбумину. 22. Выделенный белок плазмы или выделенная смесь белков плазмы, полученные по способу из любого п. с 1 по 15, отличающиеся низким уровнем содержания ПКА и/или алюминия в препарате этого белка плазмы или этой смеси белков плазмы. 23. Выделенный белок плазмы или выделенная смесь белков плазмы, полученные по способу из любого п. с 1 по 15, отличающиеся тем, что уровень содержания ПКА и/или ПКАC1 эстеразы, и/или калликреина, и/или алюминия в препарате этого белка плазмы или этой смеси белков плазмы ниже предельно допустимого по Британской Фармакопее, Европейской Фармакопее или Фармакопее США. 24. Выделенный иммуноглобулин, полученный по любому из пп. с 1 до 15, отличающийся тем, что уровень содержания алюминия в нем составляет менее примерно 50 мкг/л. 25. Выделенный альбумин, полученный по любому из пп. с 1 до 15, отличающийся тем, что уровень содержания алюминия в нем составляет менее примерно 10 мкг/л. 26. Выделенный альбумин, полученный по любому из пп. с 1 до 15, отличающийся тем, что уровень содержания ПКА в нем составляет менее примерно 5 МЕ/мл. 27. Выделенный альбумин, полученный по любому из пп. с 1 до 15, отличающийся тем, что уровень содержания в нем ПКА-C1 эстеразы составляет менее примерно 10 МЕ/мл.
МПК / Метки
МПК: B01D 37/02
Метки: основе, плазмы, фильтрующих, средств, крови, целлюлозы, компонентов, разделение, помощью
Код ссылки
<a href="https://eas.patents.su/15-757-razdelenie-komponentov-plazmy-krovi-s-pomoshhyu-filtruyushhih-sredstv-na-osnove-cellyulozy.html" rel="bookmark" title="База патентов Евразийского Союза">Разделение компонентов плазмы крови с помощью фильтрующих средств на основе целлюлозы</a>
Предыдущий патент: Фунгицидная смесь
Следующий патент: Способ лечения биполярного расстройства
Случайный патент: Способ подтверждения прохождения последовательными элементами этапов переработки и применение этого способа