Способ получения антирабической вакцины путем адаптации штамма pitman moore
Номер патента: 20998
Опубликовано: 31.03.2015
Формула / Реферат
1. Способ адаптации штамма "DE 42/74 пас. 12 12.11.1974" Pitman Moore вируса бешенства, полученного пассированием штамма Wistar PM-HDCS 1503-3M, к первичным фибробластам куриных эмбрионов для производства антирабической вакцины, где способ включает следующие стадии:
культивирование штамма вируса бешенства "DE 42/74 пас. 12 12.11.1974" Pitman Moore в первичных фибробластах утиных эмбрионов в подходящей среде посредством по меньшей мере 7 пассажей;
последующее культивирование вируса бешенства "DE 42/74 пас. 12 12.11.1974" Pitman Moore в первичных фибробластах куриных эмбрионов посредством по меньшей мере 4 пассажей в подходящей среде.
2. Способ по п.1, где используемая среда является средой РСМ.
3. Способ по п.2, где среда дополнительно включает человеческий сывороточный альбумин, гидролизованный желатин, бикарбонат натрия и подходящий раствор антибиотиков.
4. Способ по любому из пп.1-3, в котором количество фибробластов поддерживают в диапазоне 1,4-2,2´106 клеток/мл.
5. Способ по любому из пп.1-4, где адаптацию проводят в ПЭТ роллер-флаконах ТС или многоярусных флаконах ТС.
6. Штамм "DE 42/74 пас. 12 12.11.1974" Pitman Moore, адаптированный к первичным фибробластам куриных эмбрионов способом по п.1 для получения антирабической вакцины.
7. Способ получения антирабической вакцины из штамма "DE 42/74 пас. 12 12.11.1974" Pitman Moore, охарактеризованного в п.6, включающий следующие стадии:
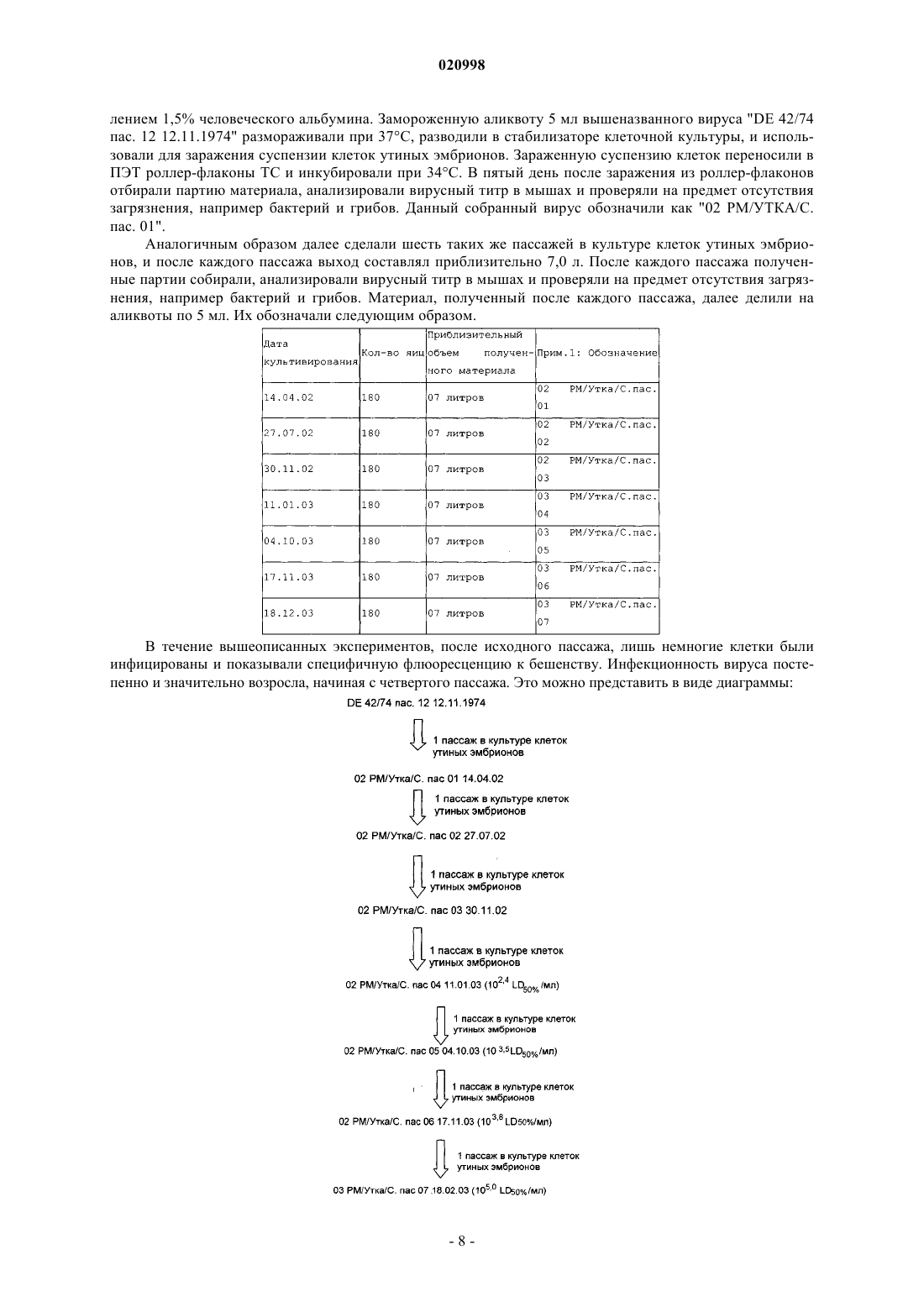
а) 1-5-кратное пассирование исходного штамма "DE 42/74 пас. 12 12.11.1974" Pitman Moore, охарактеризованного в п.6, в первичных фибробластах куриных эмбрионов;
б) наращивание вируса из указанных первичных фибробластов куриных эмбрионов;
в) выделение и очистка вируса;
г) инактивация вируса.
8. Антирабическая вакцина, полученная согласно способу по п.7.
9. Антирабическая вакцина по п.8, которая дополнительно лиофилизована.
10. Способ вакцинации млекопитающего, включающий введение вакцины по пп.8, 9.
11. Способ по п.10, где вакцину вводят до контакта с патогенным вирусом бешенства.
12. Способ по п.10, где вакцину вводят после укуса животного, который может вызвать заражение бешенством.
13. Способ по п.10, где пациентом является человек.
14. Способ по п.10, где пациентом является домашнее или дикое животное.
15. Применение вакцины по пп.8, 9 для лечения бешенства у человека и животных.
Текст
СПОСОБ ПОЛУЧЕНИЯ АНТИРАБИЧЕСКОЙ ВАКЦИНЫ ПУТМ АДАПТАЦИИ ШТАММА PITMAN MOORE Настоящее изобретение относится к способу адаптации штамма Pitman Moore вируса бешенства к первичным фибробластным клеткам куриных эмбрионов для получения антирабической вакцины,к штамму DE 42/74 пас. 12 12.11.1974 Pitman Moore, адаптированному к первичному куриному фибробласту для получения антирабической вакцины, к способу получения указанного штамма и к фармацевтической композиции, содержащей инактивированную антирабическую вакцину и подходящий эксципиент. Настоящее изобретение используется для лечения бешенства у человека и животных. Пател Прадип Маганлал, Пател Панкадж Раманбхаи (IN) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: КАДИЛА ХЕЛЗКЭР ЛИМИТЕД (IN) Область техники, к которой относится изобретение Настоящее изобретение относится к области вакцин, а именно к адаптации штамма вируса бешенства Pitman Moore (штамм РМ) в очищенной клеточной культуре фибробластов куриных эмбрионов для производства усовершенствованной и высокоочищенной вакцины. В частности, адаптированный штамм РМ вируса бешенства дает высокий вирусный титр, что, в свою очередь, обеспечивает высокий выход вакцины по количеству доз на яйцо, при этом вакцина также является высокоиммуногенной. Уровень техники Бешенство является зоонозным вирусным заболеванием, которое поражает домашних и диких животных. При развитии симптомов болезни бешенство может являться летальным и для животных, и для человека. Однако если лица получали антирабическую вакцину либо до контакта с вирусом, либо после контакта, в сочетании с тщательной очисткой раны с применением антисептика и антирабических антител, люди в большинстве случаев хорошо защищены. Человеческие антирабические вакцины получают из инактивированного или аттенуированного вируса бешенства, при этом со времен Пастера они подвергаются последовательным усовершенствованиям. Первая вакцина против бешенства, разработанная Пастером, была получена на основе нервной ткани, а вирус был инактивирован путем сушки, однако данная вакцина представляла опасность, обусловленную возможностью активации вируса и развития аллергической реакции из-за присутствия нервной ткани или миелина. Вакцины, не содержащие миелин, приготовленные на основе мозга новорожденных мышей, были предложены Fuenzalida et al. (Vaccines: Fourthedition, chapter 37, Plotkin, Rupprecht and Koprowski). Впоследствии была разработана вакцина против бешенства, выращиваемая на утиных эмбрионах(DEV). DEV против бешенства получали из вируса, выращенного в яйцах уток с эмбрионами. Она обладала меньшей иммуногенностью по сравнению с вакциной из ткани мозга. Для DEV рекомендовали от четырнадцати до двадцати трех ежедневных прививок, но иногда даже такие высокие дозы не защищали от бешенства после интенсивного контакта с источником заражения (Vaccines: Fourth edition, chapter 37,Page number 1018, Plotkin, Rupprecht and Kopwwski). Другой недостаток DEV состоял в том, что она также содержала белки миелина, которые вызывали побочные реакции, вследствие чего позже DEV была запрещена ВОЗ. Таким образом, существовала длительная потребность в высокоиммуногенной антирабической вакцине, которая могла благополучно и эффективно применяться в низких дозах как для первичной иммунизации, так и в терапии после контакта с источником заражения. Эти вакцины также могли бы снизить количество и тяжесть поствакцинальных реакций. Такая потребность была удовлетворена с развитием вакцин, получаемых в культурах тканей/клеток. Вакцина, приготовленная на культуре клеток, не только более безопасна по сравнению с прежними вакцинами на основе мозговой ткани вследствие отсутствия нейронной ткани, но и более эффективна. На основе культур клеток, с целью достичь высокой иммуногенности и безопасности, было получено несколько вакцин, таких как очищенная утиная эмбриональная вакцина (PDEV), вакцины 1-го поколения,такие как вакцина на основе диплоидных клеток человека (Wiktor et al., 1964. J. Immunol. 93:353-366), и вакцины 2-го поколения, такие как очищенная вакцина на основе клеток куриных эмбрионов (PCECV),очищенная антирабическая вакцина на основе клеток Веро, вакцина антирабическая адсорбированная(RVA) и вакцина, полученная в первичной культуре клеток почек хомяков (PHKCV), и т.д. (см. JIACM 2006; 7(1):39-46). Технологический прогресс, ведущий к разработке вышеуказанных вакцин, включал адаптацию штамма Pitman Moore вируса бешенства к стабильным клеточным линиям, таким как клетки Веро (например, очищенная антирабическая вакцина на основе клеток Веро Abhayrab и Verorab) и линия диплоидных клеток человека MRC-5 [например, вакцина на основе диплоидных клеток человека (ХДСВ), в Индии -MIRV-HDC] [См. JIACM 2006; 7(1):39-46] или в утиных эмбрионах in situ (например, очищенная утиная эмбриональная вакцина - PDEV-Lyssavac N) (см. Laboratory Techniques in Rabies; Fourth Edition,Edi. by F.X. Meslin, M.M. KaplanH. Koprowski, WHO Geneva-1996). Линии клеток Веро и MRC-5 представляют собой стабильные линии клеток и, следовательно, требуют анализа на присутствие остаточной клеточной ДНК в готовом продукте (см. европейской EuropeanPharmacopoeia, 2004), которая может представлять риск из-за переноса латентных вирусов и других агентов. Кроме того, выходы, получаемые с клетками Веро, существенно ниже, даже когда для получения вакцины используется штамм РМ. PDEV является суспензионной вакциной, и, следовательно, данная вакцина не может соответствовать требованиям для внутрикожного (ID) применения. Кроме того, данная методика не позволяет достичь высоких выходов (1,8-2,2 доз/яйцо). Продолжительность процесса также составляет 88 дней, что слишком длительно. В коммерческой вакцине PDEV используется консервант тиомерсал, который связывали с возможностью развития аутизма у маленьких детей (см.http://www.ncirs.usyd.edu.au/facts/f-thiomersal.html). Кроме того, процесс производства PDEV является длительным, тяжелым и неподходящим для крупномасштабного производства, поскольку он дает низкий выход. ХДСВ считается вакциной золотого стандарта, но она очень дорогостоящая. Таким образом, существует потребность в получении усовершенствованной и высокоиммуногенной антирабической вакцины, с более высоким выходом, а также с меньшими затратами, с применением технологии клеточных культур. В US 4115195 (Rudolph Barth et al.) описан способ получения антирабической вакцины. Описано,что культуры фибробластов куриных эмбрионов, наряду с другими культурами клеток, могут использоваться для получения антирабической вакцины с различными вирусами, такими как вирусы штамма VP 11, штамма Пастера, штамма РМ, или с гомогенизированным материалом куриных эмбрионов, содержащим вирусы штамма Flury LEP (кратковременное пассирование на куриных эмбрионах) или Flury HEP(длительное пассирование на куриных эмбрионах). В этом патенте также приведены, в частности, примеры применения вируса бешенства фиксированного штамма VP 11, Flury HEP и Flury LEP для заражения фибробластов куриных эмбрионов. Однако в этом документе не описана адаптация штамма PitmanMoore (штамм Wistar PM-HDCS, 1503-3 М) ни к первичной культуре фибробластов утиных эмбрионов,ни к первичной культуре фибробластов куриных эмбрионов. Кроме того, среды, используемые в настоящем изобретении, представляют собой уникальную комбинированную среду, которая не описана в US 4115195 и разработана исключительно для вируса бешенства РМ, для заражения первичной клеточной культуры фибробластов куриных эмбрионов. Авторы настоящего изобретения неожиданно обнаружили, что штамм Pitman Moore может быть адаптирован к первичной клеточной культуре фибробласта цыпленка. Такая адаптация обеспечивает способ получения антирабической вакцины в больших количествах с превосходным выходом, малой продолжительностью производственного цикла и легкостью масштабирования. Получаемая вакцина подходит для внутрикожного применения в дополнение к внутримышечному применению (IM), поскольку вакцина не является суспензией. Согласно настоящему изобретению антирабическая вакцина, полученная посредством адаптацииPitman Moore к первичной клеточной культуре куриных фибробластов, более выгодна, чем многие другие антирабические вакцины на основе стабильных линий клеток, и с большей легкостью адаптируется к крупномасштабному коммерческому производству вакцины. Вакцина, полученная настоящим способом,имеет очень высокий выход, эффективность, безопасность, кроме того, способ является более рентабельным по сравнению со многими другими известными способами получения антирабических вакцин,предпочтительно, когда способ осуществляют, используя ПЭТ роллер-флаконы для культур тканей (ТС). Авторы настоящего изобретения неожиданно обнаружили, что вирусом Pitman Moore можно тяжело инфицировать первичную клеточную культуру куриных фибробластов в уникальной комбинированной среде, описанной далее, при подходящих условиях процесса, как подробно описано ниже, с использованием ПЭТ роллер-флаконов ТС. Такие предпочтительные варианты осуществления обеспечивают получение вакцины с высоким выходом, большую эффективность и иммуногенность, что делает вакцину сравнительно рентабельной. Цель изобретения Первая цель настоящего изобретения состоит в адаптации штамма вируса бешенства Pitman Moore к клеточной культуре фибробластов куриных эмбрионов с целью получения антирабической вакцины. В варианте осуществления настоящее изобретение относится к способу получения иммуногенной и высокоочищенной вакцины, полученной на клетках куриных эмбрионов (далее называемой PCECVPM) с использованием штамма Pitman Moore, которая предназначена для активной иммунизации против бешенства. Другой вариант осуществления изобретения заключается в разработке высокоэффективного уникального способа получения вакцины посредством более простого процесса. В еще одном варианте осуществления настоящее изобретение относится к подходящей композиции сред, которая обеспечивает высокую инфекционность вируса бешенства штамма Pitman Moore в культуре фибробластов куриных эмбрионов. Сущность изобретения Настоящее изобретение относится к способу адаптации штамма вируса бешенства Pitman Moore к клеточной культуре фибробластов куриных эмбрионов. Исходный штамм Pitman Moore (штамм WistarPM-HDCS, 1503-3M) вначале адаптировали к мышам посредством одного интрацеребрального пассажа, а затем в яйцах утки с помощью повторных пассажей, которые авторы настоящего изобретения дополнительно адаптировали к культуре фибробластов утиных эмбрионов с помощью последовательных пассажей, с последующей адаптацией к первичной культуре фибробластов куриных эмбрионов с помощью дополнительных серийных пассажей, используя подходящую среду и другие подходящие параметры культивирования, с целью получения антирабической вакцины. Другой аспект настоящего изобретения относится к уникальной комбинированной среде, которая позволяет достичь высокой и тяжелой инфекционности штамма вируса бешенства Pitman Moore в очищенной культуре фибробластов куриных эмбрионов. В другом аспекте изобретение относится к инактивированной очищенной антирабической вакцине,полученной на клетках куриного эмбриона, с использованием штамма вируса бешенства РМ, обладающей высокой чистотой и иммуногенностью. Краткое описание фигур Фиг. 1. Показана специфичная флюоресценция к бешенству 03PM/Duck/S.Pas.07 в культуре клеток утки на 5-й день. Фиг. 2. Показана специфичная флюоресценция к бешенству 04PM/Chick/S.Pas.09 в культуре клеток куриных эмбрионов (СЕС) на 5-й день. Фиг. 3. Показана специфичная флюоресценция к бешенству 04PM/Chick/S.Pas.10 в культуре клеток куриных эмбрионов (СЕС) на 3-й день. Фиг. 4. Показана специфичная флуоресценция к бешенству 04PM/Chick/S.Pas.11 в культуре клеток куриных эмбрионов (СЕС) на 3-й день. Фиг. 5. Показана специфичная флюоресценция к бешенству 04PM/Chick/S.Pas.12 в культуре клеток куриных эмбрионов (СЕС) на 3-й день. Фиг. 6. Сравнение экспериментальной вакцины настоящего изобретения с различными коммерческими антирабическими вакцинами. Подробное описание изобретения Настоящее изобретение относится к адаптации штамма вируса бешенства Pitman Moore в первичных клеточных культурах куриных/утиных фибробластов. Используемые яйца являются куриными яйцами сорта SPF (не содержащими патогенов). Куриные яйца SPF и штамм вируса бешенства PitmanMoore являются субстратом и вирусным штаммом, одобренными ВОЗ для производства антирабической вакцины для людей. В предпочтительном варианте осуществления штамм вируса бешенства РМ адаптирован к куриным фибробластам в роллерных культурах с использованием ПЭТ роллер-флаконов ТС, что обеспечивает более высокий выход по сравнению с рядом других методик. Исходный штамм Pitman Moore (штамм Wistar PM-HDCS, 1503-3 М) вначале адаптировали к мышам посредством одного интрацеребрального пассажа, а затем в яйцах утки с помощью повторных пассажей. В дальнейшем авторы настоящего изобретения попытались разработать способ адаптации штамма вируса бешенства РМ к первичной культуре фибробластов утиных эмбрионов, и только небольшая часть клеток, как определили, была инфицирована (фиг. 1). В ходе нескольких пассажей инфекционность не повысилась до удовлетворительной степени. Например, из US 4115195 известно, что достаточно высокий вирусный титр является предпосылкой эффективной антирабической вакцины. Следовательно, авторы изобретения перевели свое внимание на пассирование вируса в клеточную культуру фибробластов куриных эмбрионов. После нескольких экспериментов на предмет инфекционности и адаптации в клетках куриных эмбрионов были получены успешные результаты титрации вируса (фиг. 2-5). Исходный штамм "Wistar PM-HDCS, 1503-3M", адаптированный к эмбриону утки, упоминается в настоящем изобретении как "Исходный посевной материал DE 42/74 Пас. 12 12.11.1974", который является посевным материалом для производства вакцины PDEV. Указанный "Исходный посевной материалDE 42/74 Пас. 12 12.11.1974" вируса бешенства первоначально адаптировали и выращивали в клетках утиных эмбрионов, а затем в первичной клеточной культуре куриных фибробластов, получив на клеточной культуре вакцину РСЕС (PCECVPM) против бешенства согласно настоящему изобретению. Первоначально авторы изобретения попытались адаптировать "исходный посевной материал DE 42/74 Пас. 12 12.11.1974" вируса к первичной клеточной культуре фибробластов утиных эмбрионов посредством повторных пассажей. Однако поскольку фибробласты утиных эмбрионов не являются "естественным" хозяином для вируса бешенства РМ, авторы изобретения не получили признаков развития инфекции в первых экспериментах, а дальнейшая оптимизация привела лишь к очень слабой инфекции в последующих экспериментах. Поэтому процесс значительно изменили и пассирование в первичной культуре фибробластов утиных эмбрионов заменили пассированием в первичной культуре фибробластов куриных эмбрионов в подходящей среде и при подходящих параметрах культивирования. Такое пассирование штамма РМ вируса бешенства в первичную культуру фибробластов куриных эмбрионов является уникальной и нестандартной заменой, которая не описана в уровне техники и не является очевидной специалисту, квалифицированному в данной области, как рутинная, поскольку эти клетки также не являются "естественным" хозяином штамма РМ вируса бешенства. В настоящем изобретении "исходный посевной материал вируса DE 42/74 Пас. 12 12.11.1974" адаптировали к первичной культуре фибробластов утиных эмбрионов, а затем первичной культуре фибробластов куриных эмбрионов посредством повторных пассажей, как описано ниже: Обозначение различных штаммов, полученных в процессе пассирования, приведено в следующем общем формате: "год получения (например, '04' для 2004)/штамм Pitman Moore (PM)/субстрат, на котором проводили пассирование (утка или курица)/номер серийного пассажа/дата приготовления культуры". Адаптированный штамм Pitman Moore, который использовали в качестве исходного или рабочего посевного материала, получали путем заражения вирусом РМ (DE 42/74 пас. 12 12.11.1974) первичной культуры фибробластов, утиного эмбриона, а затем при температуре 33-36 С проводили 7 пассажей,адаптируя штамм в первичной культуре фибробластов утиного эмбриона, с получением "03 РМ/Утка/С. пас. 07 18.12.03". Затем штаммом "03 РМ/Утка/С. пас. 07 18.12.03" инфицировали первичную культуру фибробластов куриных эмбрионов по меньшей мере за 4 пассажа, получив исходный посевной материал"04 РМ/Курица/С. пас. 11 04.08.04". Можно выполнить 1-5 пассажей от исходного посевного материала,чтобы получить рабочий посевной материал для коммерческого производства вакцины. Один из примеров партии рабочего посевного материала, полученной согласно вышеуказанному способу, обозначили как "04 РМ/Курица/С. пас. 12 25.12.04". Вирус, полученный из исходного посевного материала "04 РМ/Курица/С. пас. 11 04.08.04", имеет диковый титр по меньшей мере 106,5 TCID50% (инфекционных единиц) в мл. Титр вируса повышался логарифмически при последовательных пассажах на клетках куриного эмбриона, что позволяет предположить, что вирус имеет стабильный фенотипический признак. В каждой стадии пассажа оценивали инфекционность путем окрашивания культуры Ab ФИТЦмеченным конъюгатом, используя флуоресцентную микроскопию. После получения оптимальных и воспроизводимых условий инфекционности и культивирования, результаты подтверждали, прежде всего, с помощью флуоресцентной микроскопии, а затем с помощью нескольких тестов in vitro и in vivo, как описано в различных изданиях Pharmacopoeia. Адаптацию вируса предпочтительно выполняли, используя ПЭТ роллер-флаконы ТС или многоярусные культуральные флаконы ТС. Для надлежащей адаптации несколько сред и комбинации их компонентов применяли, как описано ниже, с помощью примера 1. Настоящее изобретение дополнительно проиллюстрировано следующими неограничивающими примерами, которые представляют один из предпочтительных способов осуществления изобретения. Следует понимать, что возможны некоторые модификации изобретения, очевидные специалисту,квалифицированному в данной области, которые, как полагают, входят в объем настоящего изобретения. Пример 1. Выбор среды для адаптации вируса и оптимизации процесса. Для адаптации вируса и оптимизации параметров процесса были выбраны следующие среды. Продукционная культуральная среда 1 (РСМ 1). Продукционная культуральная среда 2 (РСМ 2). Продукционная культуральная среда (РСМ). Вышеуказанная среда включает следующие компоненты: В вышеуказанные среды дополнительно добавляли человеческий сывороточный альбумин, гидролизованный желатин, бикарбонат натрия и раствор антибиотиков с подходящими концентрациями. Следующие эксперименты выполняли, используя различные среды, при этом сравнивали их эффективность на предмет формирования монослоя клеток и степени вирусной инфекции. Отбирали 9-11-дневные эмбрионы и трипсинизировали 10-10-20 мин. Клетки центрифугировали,чтобы удалить трипсин, и ресуспендировали в равной плотности в РСМ 1, РСМ 2 и РСМ. В различных экспериментах количество клеток доводили приблизительно до 1,7106 клеток в 1 мл во всех трех средах. Во всех экспериментах использовали вирус "03 РМ/Утка/С. пас. 07" в разведении 1:1200. Время адсорбции составляло 90 мин для каждого эксперимента. Зараженные клетки пересевали во флаконы ТС и ПЭТ роллер-флаконы ТС (Greiner). Образцы зараженных клеток из флаконов/роллер-флаконов ТС также пересевали в 24-луночные планшеты ТС. Флаконы и роллер-флаконы ТС инкубировали при 341 С в течение 5 дней. 24-луночные планшеты инкубировали в атмосфере с 3% CO2 при 341 С и окрашивали ФИТЦ-конъюгатом на 3-й день для оценки степени вирусной инфекции, которую определяли по специфичной флюоресценции к бешенству как хорошую (+), очень хорошую , превосходнуюили исключительную . На 4-й или 5-й день супернатант культуры клеток отбирали в каждом наборе экспериментов в качестве первого сбора и компенсировали свежей подходящей средой. После дальнейшего инкубирования, на 2-й, 3-й или 4-й день после первого сбора, в каждом наборе проводили второй сбор. Первый сбор и второй сбор анализировали на предмет вирусного титра и стерильности. Было установлено, что в 24-луночном планшете клетки, инокулированные в РСМ 1 и РСМ 2, показывали плохой или хороший инфекционный процесс, тогда как клетки, инокулированные в РСМ, демонстрировали превосходный или исключительный инфекционный процесс, согласно оценке посредством специфичной иммунофлюоресценции к бешенству; флаконы/роллер-флаконы ТС с культурой в РСМ демонстрировали хорошие титры по сравнению с РСМ 1 и РСМ 2. Значения титра в РСМ, РСМ 2 и "РСМ" составляли 105,6, 105,8 и 107,7 TCID50%. На основании вышеприведенных результатов в различных экспериментах среду РСМ выбрали для адаптации в первичной клеточной культуре фибробластов куриных эмбрионов и последующего получения вакцины, которое дополнительно оптимизировали по различным параметрам процесса, что находится в компетенции специалистов, квалифицированных в данной области, и путем дополнительного подбораподходящих роллер-флаконов ТС. Общая методика культивирования клеток, используемая для получения исходного посевного материала, рабочего посевного материала и производства антирабической вакцины. Куриные яйца инкубировали в течение 8-11 дней при температуре 35-37 С и 70-90%-ной относительной влажности. После инкубации яйца просвечивали на наличие живых и здоровых эмбрионов. После просвечивания эмбрионы извлекали из каждого яйца в стерильных условиях, после чего головы отделяли путем отрыва. Затем головы немедленно отбрасывали, а тела эмбрионов объединяли во флаконе,промывали три-четыре раза стерильным PBS и трипсинизировали трипсином, предварительно нагретым до 352 С в течение 10-40 мин. Суспензию трипсинизированных клеток фильтровали через нейлоновый нетканый материал с последующим центрифугированием при 1000-1500 об/мин в течение 10-15 мин в охлаждаемой центрифуге. Осадок клеток суспендировали в свежей ростовой среде, тщательно перемешивали и повторно центри-6 020998 фугировали полученную суспензию клеток аналогичным способом. Осадок клеток суспендировали в свежей ростовой среде и тщательно перемешивали. Суспензию клеток переносили в стерильный стеклянный флакон, содержащий вышеуказанную культуральную среду, и перемешивали в течение 5-10 мин при 352 С. Конечное количество клеток доводили до 1,4-2,2106/мл в 20-л стеклянных флаконах, используя культуральную среду. Суспензию клеток инокулировали заданным исходным или рабочим посевным материалом вируса с оптимальным разведением и инкубировали с медленным перемешиванием при 352 С в течение 90-120 мин для адсорбции вируса на клетках. В конце адсорбции инфицированную вирусом суспензию распределяли либо в ПЭТ роллер-флаконы ТС (300+50 мл в роллер-флакон ТС) или в многоярусные флаконы ТС, такие как клеточные фабрики или многокамерные культуральные поверхности (3000500 мл), или комбинация обоих. Затем суспензии инкубировали при 34,50,5 С в течение 4-6 дней. На 4-й или 5-й день культуральный супернатант отбирали в качестве первого сбора и добавляли свежую среду. После дальнейшей инкубации на 7-й или 8-й день проводили второй сбор. Третий сбор является необязательным. Различные сборы вируса хранили при 2-8 С. Многократный сбор делает изобретение рентабельным, поскольку обеспечивается получение большего выхода с хорошими титрами. Объединенные собранные партии вируса очищали и концентрировали с помощью ультрацентрифугирования в градиенте плотности сахарозы на зональной центрифуге при 35000 об/мин. Разделение полосы вируса бешенства наилучшим образом происходит при концентрации сахарозы приблизительно 3540% и соответствующие полосы в градиенте сахарозы, содержащие активный живой вирус бешенства,отбирают как продуктивные фракции. Концентраты вируссодержащих фракций из различных объединенных собранных партий хранили ниже -60 С до получения результатов различных тестов, таких как invitro иммуноанализ, тест на стерильность и тесты на присутствие бактериальных эндотоксинов. Настоящее изобретение также обеспечивает способ инактивации вируса РМ в целях устранения его инфекционности с сохранением его антигенных свойств. Концентраты размораживали при 37 С и охлаждали при 42 С. Концентраты разводили стабилизатором вакцины, чтобы достичь соответствующего содержания антигена 8,5 МЕ/мл, и отбирали пробы для иммуноанализа in vitro, такого как АВТ, ELISA иSRD-тест. Уровень рН смешанной массы измеряли и доводили до 8,01 10%-ным (мас./об.) стерилизованным раствором NaOH. Затем эффективное количество бета-пропиолактона, разведенного 1:100 в PBS,медленно добавляли в смешанную массу, получив конечную концентрацию 1:4000 (0,025%), после чего содержимое емкости переносили в другую предварительно стерилизованную инактивационную емкость. Инкубация с бета-пропиолактоном проводили при 2-6 С при постоянном перемешивании. По меньшей мере 48 ч потребовалось для полной инактивации вирусной инфекционности, без потери антигенных свойств вируса. Процесс инактивации вируса РМ при 2-6 С выбрали как предпочтительный благодаря его простоте при крупномасштабном культивировании. Наконец инактивированную массу хранили при 53 С до последующей обработки при непрерывном перемешивании. Инактивированную массу разводили в подходящем стабилизирующем растворе с доведением антигенного значения по меньшей мере до 5 МЕ/мл. В ходе процесса перемешивания смешанную массу поддерживали при температуре 53 С с перемешиванием. Смешанную вакцину перемешивали в течение 30 мин перед фасовкой. Лиофилизацию проводили стандартными методами, известными из уровня техники. Используемый стабилизатор вакцины содержит сахарозу, гидролизованный желатин, человеческий альбумин и соли натрия. Вакцину приготавливали в лиофилизованной форме,восстанавливаемой стерильной водой перед инъекцией. Эффективность и иммуногенность вакцины, полученной с использованием куриных фибробластов,аналогична соответствующим показателям вакцины международного стандарта (ВОЗ 5-й IRM), которую оценивали на безопасность для различных животных, эффективность и сероконверсию. Кроме того, чистоту конечного продукта подтверждали с помощью электрофореза в ДСН-ПААГ и сравнивали с другими коммерческими продуктами, выявив соответствие (фиг. 6). Продукт также высокостабилен при хранении при 2-8 С. Он также сохраняет эффективность и другие критические параметры при воздействии быстро меняющихся и экстремальных температур согласно руководству ICH (Международной конференции по гармонизации) по стабильности биотехнологических и биологических материалов. Пример 2. Адаптация штамма вируса бешенства Pitman Moore к первичной культуре фибробластов утиных эмбрионов и последующая адаптация полученного вируса к первичной культуре фибробластов куриных эмбрионов.(А) Исходный штамм вируса бешенства Pitman Moore (штамм Wistar PM-HDCS, 1503-3M) вначале адаптировали посредством 1 церебрального пассажа в швейцарских мышах-альбиносах, затем 12 пассажами в яйцах утки с эмбрионами, и обозначили полученный вирус как DE 42/74 пас. 12 12.11.1974. В настоящем изобретении данный вирус применяется для дальнейшей адаптации к первичной культуре фибробластов утиных эмбрионов, а затем к культуре фибробластов куриных эмбрионов. Эксперимент проводили с использованием беспатогенных (SPF) 11-12-дневных утиных яиц. Количество клеток установили на уровне 1,8106 клеток/мл согласно известным методам, суспензию клеток приготовили с использованием продукционной культуральной среды 1 (PCM 1, описана выше) с добав-7 020998 лением 1,5% человеческого альбумина. Замороженную аликвоту 5 мл вышеназванного вируса "DE 42/74 пас. 12 12.11.1974" размораживали при 37 С, разводили в стабилизаторе клеточной культуры, и использовали для заражения суспензии клеток утиных эмбрионов. Зараженную суспензию клеток переносили в ПЭТ роллер-флаконы ТС и инкубировали при 34 С. В пятый день после заражения из роллер-флаконов отбирали партию материала, анализировали вирусный титр в мышах и проверяли на предмет отсутствия загрязнения, например бактерий и грибов. Данный собранный вирус обозначили как "02 РМ/УТКА/С. пас. 01". Аналогичным образом далее сделали шесть таких же пассажей в культуре клеток утиных эмбрионов, и после каждого пассажа выход составлял приблизительно 7,0 л. После каждого пассажа полученные партии собирали, анализировали вирусный титр в мышах и проверяли на предмет отсутствия загрязнения, например бактерий и грибов. Материал, полученный после каждого пассажа, далее делили на аликвоты по 5 мл. Их обозначали следующим образом. В течение вышеописанных экспериментов, после исходного пассажа, лишь немногие клетки были инфицированы и показывали специфичную флюоресценцию к бешенству. Инфекционность вируса постепенно и значительно возросла, начиная с четвертого пассажа. Это можно представить в виде диаграммы: После седьмого пассажа инфекционность была почти постоянной. Несколько альтернативных методик опробовали с весьма небольшим успехом. Неожиданно, когда вирусом "03 РМ/Утка/С. пас 07 18,02.03" заразили фибробласты куриных эмбрионов, инфекционность значительно увеличилась. На основе данного наблюдения вирусный штамм далее пассировали в фибробластах куриных эмбрионов, с целью получения требуемой инфекционности и вирусного титра, следующим образом.(В) В процессе использовали приблизительно 9-11-дневные (180 эмбрионов) оплодотворенные куриные яйца SPF, опять же, головную часть отделяли от части тела, обрабатывали только часть тела, тогда как головную часть отбрасывали. Объединенные части тела несколько раз промывали фосфатносоляным буфером, а затем эмбрионы трипсинизировали с использованием раствора трипсина. Суспензию клеток готовили в РСМ, плотность клеток доводили до 1,6106 клеток/мл. Замороженную аликвоту 5 мл "03 РМ/Утка/С. пас. 07" размораживали при 37 С и разводили в стабилизаторе. Ее использовали для заражения суспензии клеток куриных эмбрионов. Полученную инфицированную суспензию клеток инкубировали при 37 С в течение 1,5 ч с медленным перемешиванием. Зараженные клетки распределяли в роллер-флаконы, а также в многоярусные флаконы ТС, и инкубировали при 34 С. В пятый день инфекции из роллер-флаконов и многоярусных флаконов ТС отбирали материал, приблизительно 7 л, и делили на подходящие аликвоты, при этом несколько из полученных аликвот 5 мл использовали для анализа вирусного титра в мышах и на предмет отсутствия загрязнений, например, бактерий и грибов. Данную партию вирусного материала обозначили как "04 РМ/Курица/С. пас. 08" Далее 3 последующих последовательных пассажа вируса проводили в куриных фибробластах, отбирали аликвоты от каждого сбора, делили на аликвоты по 5 мл и обозначали, как указано выше. Все пассажи анализировали на вирусный титр и отсутствие бактерий и грибов. На основе полученных данных вирус, полученный после 4-го пассажа и обозначенный как "04 РМ/Курица/С. пас. 11 04.08.04", который имел вирусный титр 107,7 LD50% в мл, рассматривали в настоящей заявке как исходный посевной вирусный материал. Данный вирус подвергали 1 следующему пассажу, получив рабочий посевной вирусный материал "04 РМ/Курица/С. пас. 12 25.12.04". Пример 3. Получение вакцины из рабочего посевного материала. Вирусным посевным материалом "04 РМ/Курица/С. пас. 12 25.12.04" заражали куриные фибробласты в соответствии со способом, аналогичным описанному в стадии 1(b) выше, и первую партию материала получали в 4-й или последующие дни, а вторую партию - через 2-3 дня первого отбора. Объединенный собранный вирусный материал очищали и концентрировали путем ультрацентрифугирования в градиенте плотности сахарозы на зональной центрифуге при 35000 об/мин. Разделение полосы вируса бешенства выполняли приблизительно при 35-40% концентрации сахарозы, при этом активный живой вирус бешенства отбирали в продуктивных фракциях. Вирусные концентраты из различных объединенных собранных партий хранили при температуре ниже -60 С до получения результатов различных тестов, таких как in vitro иммуноанализ, тест на стерильность и тесты на присутствие бактериальных эндотоксинов. Концентраты размораживали при 37C и охлаждали при 42 С. Концентраты разводили стабилизатором вакцины, достигая соответствующего содержания антигена 8,5 МЕ/мл, при этом отбирали пробы для in vitro иммуноанализа, такого как АВТ, ELISA и SRD тест. Показатель рН смешанной массы измеряли и доводили до 8,01 10%-ным мас./об. стерилизованным раствором NaOH. Затем смешанную массу инактивировали путем добавления бета-пропиолактона до подходящей концентрации, используя известные методы. Наконец инактивированную массу хранили при 53 С при непрерывном перемешивании и разводили подходящим стабилизирующим раствором, доводя уровень концентрации антигена до 5 МЕ/мл,после чего смешанную массу выдерживали при 53 С при перемешивании в течение 30 мин. Смешанной массой заполняли флаконы, при этом использовали подходящую стабилизирующую композицию, включающую сахарозу, гидролизованный желатин, человеческий альбумин и соли натрия. Готовую вакцину приготавливали в лиофилизованной форме, восстанавливаемой стерильной водой для инъекций перед применением. Иммуногенность и эффективность вакцины тестировали следующим образом. Пример 4. Тест для оценки эффективности (NIH) на мышах. Тест для оценки эффективности NIH (Национальный институт здравоохранения США) на мышах выполняли согласно Laboratory Techniques in Rabies, 4th ed. WHO 1996 и Фармакопеи Индии. Эффективность антирабической вакцины определяли путем сравнения дозы экспериментальной вакцины, необходимой для защиты мышей при введении смертельной внутримозговой дозы вируса бешенства, с соответствующей дозой контрольной вакцины (ВОЗ 5th IRM, 16,0 ME в ампуле), необходимой для обеспечения такой же защиты. Использовали швейцарских мышей-альбиносов весом приблизительно 12-15 г. Одну дозу контрольной вакцины международного стандарта восстанавливали в 2,0 мл воды для инъекций, и 0,5 мл полученного раствора тщательно смешивали с 12 мл фосфатно-соляного буфера(PBS), получив 25-кратное разведение. Одну дозу, по меньшей мере, с каждой полки лиофилизованных партий экспериментальной вакцины изобретения восстанавливали отдельно в 1,0 мл воды для инъекций, а затем смешивали вместе. Из полученного раствора отбирали 0,5 мл и тщательно смешивали с 12 мл PBS, получив, таким образом, 25 кратное разведение. Затем три пятикратных разведения и контрольной вакцины, и экспериментальных вакцин готовили в PBS (рН 7,4). Диапазон разведений выбирали так, чтобы среднее разведение содержало количество вакцины, достаточное для защиты 50% от общего количества мышей, взятых для исследования, при заражении дозой вируса 10-50 LD50. В диапазоне разведения 1:25, 1:125, 1:625, 1:3125 выявили хорошую эффективность и контрольной, и экспериментальной вакцины. В ходе первой иммунизации шестнадцати мышам (8 самцов + 8 самок) вводили 0,5 мл каждого разведения, внутрибрюшинным путем, а вторую иммунизацию проводили через семь дней после первой иммунизации, повторяя те же стадии, как и при первой вакцинации. Заражение вирусом (инфицирование) иммунизированных мышей. Через 14 дней после первой иммунизации всех мышей заражали мозговой суспензией стандартного вируса для контрольного заражения (CVS), дозу которого доводили до 10-50 LD50. Наблюдение за экспериментальными животными. Зараженных мышей наблюдали в течение 14 дней. Смертельные случаи у мышей отмечали через пять дней инфекции. Расчет эффективности. Эффективность вычисляли с помощью метода Рида-Менча. Было установлено, что значения ED50 тестируемой и стандартной вакцин находились между самой высокой и самой низкой дозой, которые вводили экспериментальным животным; титрация суспензии для инфицирования показала, что 0,03 мл суспензии содержали 10-50 LD50 и все животные, получившие суспензию данной концентрации, должны погибнуть. Доверительный интервал уровня значимости (р=0,95) составлял не менее 25% и не более 400% расчетной эффективности. Заключительные результаты приведены в таблице ниже. На основании вышеописанного эксперимента можно сделать вывод, что средняя эффективность экспериментальной вакцины составляет 5,43 МЕ/доза. Доверительный интервал 95% для каждого теста составляет 25-400% расчетной эффективности. Доза вируса для контрольного заражения (CVD), используемая в каждом тесте, составляла 10-50 LD50. Значение ED50 для контрольной и тестируемой вакцины в каждом тесте находилось между самым высоким и самым низким разведением. Следовательно, можно сделать вывод, что вакцина обеспечивает иммунную защиту, а уровень эффективности NIH намного выше минимального требования 2,5 МЕ/доза. Пример 5. Тест на сероконверсию и заражение на кроликах. Исходя из положительных результатов, полученных на мышах в исследовании сероконверсии/заражения, разработали комбинированное исследование для подтверждения сероконверсии и защиты у кроликов. Использовали новозеландских белых кроликов весом в пределах 1,5-2,5 кг, в группу включили 5 самцов и 5 самок.- 10020998 В качестве контрольной вакцины использовали ВОЗ 5th IRM, восстановленную в 2 мл стерильной воды для инъекций с получением концентрации 8 МЕ/мл. Экспериментальную вакцину настоящего изобретения восстанавливали в 1 мл стерильной воды для инъекций. Всем кроликам в каждой группе внутримышечно вводили 0,5 мл соответствующих вакцин в день 0 и в день 7 и наблюдали в течение 14 дней. В день 14 у каждого кролика в асептических условиях забирали 2 мл крови из краевой ушной вены, после чего кровь оставляли свертываться в термостате при 37 С в течение 1 часа. Пробы крови центрифугировали при 1500 об/мин/10 мин для отделения сыворотки и сыворотки отбирали в асептических условиях в предварительно стерилизованные пробирки/криофлаконы. Пробы инактивировали нагреванием при 56 С в течение 30 мин и хранили при температуре ниже -60 С для дальнейшего определения титра. Титр антител в каждой пробе определяли с помощью анализа быстрого ингибирования фокусов флюоресценции (RFFIT) и реакции нейтрализации на мышах (MNT). Затем всех кроликов заражали внутримозговой инъекцией 30MLD50/0,3 мл стандартного вируса для контрольного заражения (CVS-27) в условиях внутривенной анестезии (тиопентон натрия). Кроликов наблюдали в течение 14 дней на предмет развития специфических симптомов бешенства и смертности. Смертность вплоть до 5-го дня относили к случаям неспецифичной смерти. Наблюдение. Наблюдали, что ни один из кроликов в какой-либо группе не показывал развития специфических симптомов бешенства и не погиб. Тестируемая вакцина обладала аналогичной иммуногенностью по сравнению с контрольной вакциной, что можно видеть из таблицы. Сероконверсия у кроликов. Группа I: контрольная антирабическая вакцина (ВОЗ 5th IRM) Группа II: экспериментальная антирабическая вакцина (антирабическая вакцина РСЕС) Вывод. На основании титра антитела, полученного для экспериментальной тестируемой вакцины (среднее: 8,2 и 10,87 в RFFIT и MNT соответственно), а также контрольной вакцины (среднее: 8,51 и 10,06 в RFFIT и MNT соответственно), можно сделать вывод, что экспериментальная вакцина согласно настоящему изобретению обладает одинаковой иммуногенностью с контрольной вакциной. Таким образом, из результатов, полученных после контрольного заражения, можно сделать заключение, что вакцина РСЕС (экспериментальная вакцина), полученная согласно способу по настоящему изобретению, обеспечивает одинаковую защиту с контрольным стандартом в отношении иммуногенности и эффективности. Пример 6. Сравнение экспериментальной вакцины согласно настоящему изобретению с различными коммерческими антирабическими вакцинами. Анализ с помощью электрофореза в ДСН-ПААГ проводили для проверки и сравнения белкового состава экспериментальной антирабической вакцины и белкового состава других коммерческих продуктов с использованием известных маркеров. В ходе исследования наблюдали (фиг. 6), что вирусный концентрат настоящего изобретения, приготовленный в той же форме, что и другие коммерческие антирабические вакцины, показывал идентичные белковые полосы. На фиг. 6: дорожка 1: маркер молекулярного веса (низкомолекулярный); дорожка 2: АФИ согласно настоящему изобретению; дорожка 3: АФИ согласно настоящему изобретению, приготовленный в той же форме, что и другая коммерческая антирабическая вакцина РСЕС; дорожка 4: коммерческая антирабическая вакцина РСЕС; дорожка 5: коммерческая антирабическая вакцина на основе линии клеток Веро; дорожка 6: АФИ согласно настоящему изобретению, приготовленный в той же форме, что и другая коммерческая антирабическая вакцина Веро. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ адаптации штамма "DE 42/74 пас. 12 12.11.1974" Pitman Moore вируса бешенства, полученного пассированием штамма Wistar PM-HDCS 1503-3M, к первичным фибробластам куриных эмбрионов для производства антирабической вакцины, где способ включает следующие стадии: культивирование штамма вируса бешенства "DE 42/74 пас. 12 12.11.1974" Pitman Moore в первичных фибробластах утиных эмбрионов в подходящей среде посредством по меньшей мере 7 пассажей; последующее культивирование вируса бешенства "DE 42/74 пас. 12 12.11.1974" Pitman Moore в первичных фибробластах куриных эмбрионов посредством по меньшей мере 4 пассажей в подходящей среде. 2. Способ по п.1, где используемая среда является средой РСМ. 3. Способ по п.2, где среда дополнительно включает человеческий сывороточный альбумин, гидролизованный желатин, бикарбонат натрия и подходящий раствор антибиотиков. 4. Способ по любому из пп.1-3, в котором количество фибробластов поддерживают в диапазоне 1,42,2106 клеток/мл. 5. Способ по любому из пп.1-4, где адаптацию проводят в ПЭТ роллер-флаконах ТС или многоярусных флаконах ТС. 6. Штамм "DE 42/74 пас. 12 12.11.1974" Pitman Moore, адаптированный к первичным фибробластам куриных эмбрионов способом по п.1 для получения антирабической вакцины. 7. Способ получения антирабической вакцины из штамма "DE 42/74 пас. 12 12.11.1974" PitmanMoore, охарактеризованного в п.6, включающий следующие стадии: а) 1-5-кратное пассирование исходного штамма "DE 42/74 пас. 12 12.11.1974" Pitman Moore, охарактеризованного в п.6, в первичных фибробластах куриных эмбрионов; б) наращивание вируса из указанных первичных фибробластов куриных эмбрионов; в) выделение и очистка вируса; г) инактивация вируса. 8. Антирабическая вакцина, полученная согласно способу по п.7. 9. Антирабическая вакцина по п.8, которая дополнительно лиофилизована. 10. Способ вакцинации млекопитающего, включающий введение вакцины по пп.8, 9. 11. Способ по п.10, где вакцину вводят до контакта с патогенным вирусом бешенства. 12. Способ по п.10, где вакцину вводят после укуса животного, который может вызвать заражение бешенством. 13. Способ по п.10, где пациентом является человек. 14. Способ по п.10, где пациентом является домашнее или дикое животное. 15. Применение вакцины по пп.8, 9 для лечения бешенства у человека и животных.
МПК / Метки
МПК: A61K 39/205, C12N 5/07
Метки: вакцины, получения, pitman, штамма, путем, moore, способ, антирабической, адаптации
Код ссылки
<a href="https://eas.patents.su/15-20998-sposob-polucheniya-antirabicheskojj-vakciny-putem-adaptacii-shtamma-pitman-moore.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения антирабической вакцины путем адаптации штамма pitman moore</a>
Предыдущий патент: Способ получения бензола, толуола (и нафталина) из с1-с4-алканов при локальном раздельном содозировании водорода
Следующий патент: Способ гидростатического разделения потока мощности в коробке передач
Случайный патент: Система мобильной связи, устройство базовой станции, устройство мобильной станции и способ мобильной связи