Применение эритропоэтина для лечения миелобластного лейкоза
Номер патента: 13806
Опубликовано: 30.08.2010
Авторы: Кривошеев Сергей Анатольевич, Поздеев Николай Маркович, Пенькова Марина Владимировна, Назарова Елена Львовна, Рябов Николай Васильевич, Овсепян Ваник Абрамович, Зиновьев Юрий Васильевич, Михайлов Сергей Сергеевич, Бектемиров Артем Альбертович, Федоровская Надежда Станиславовна, Ковалева Лида Константиновна, Кузнецов Олег Олегович
Формула / Реферат
1. Применение эритропоэтина для лечения миелобластного лейкоза на начальной и развернутой стадиях.
2. Применение по п.1, отличающееся тем, что эритропоэтин представляет собой эритропоэтин бета.
3. Применение по п.1 или 2, отличающееся тем, что дозы эритропоэтина превышают эритропоэзстимулирующие дозы не менее чем в 3 раза.
4. Применение по любому из пп.1-3, отличающееся тем, что эритропоэтин вводится ежедневно.
Текст
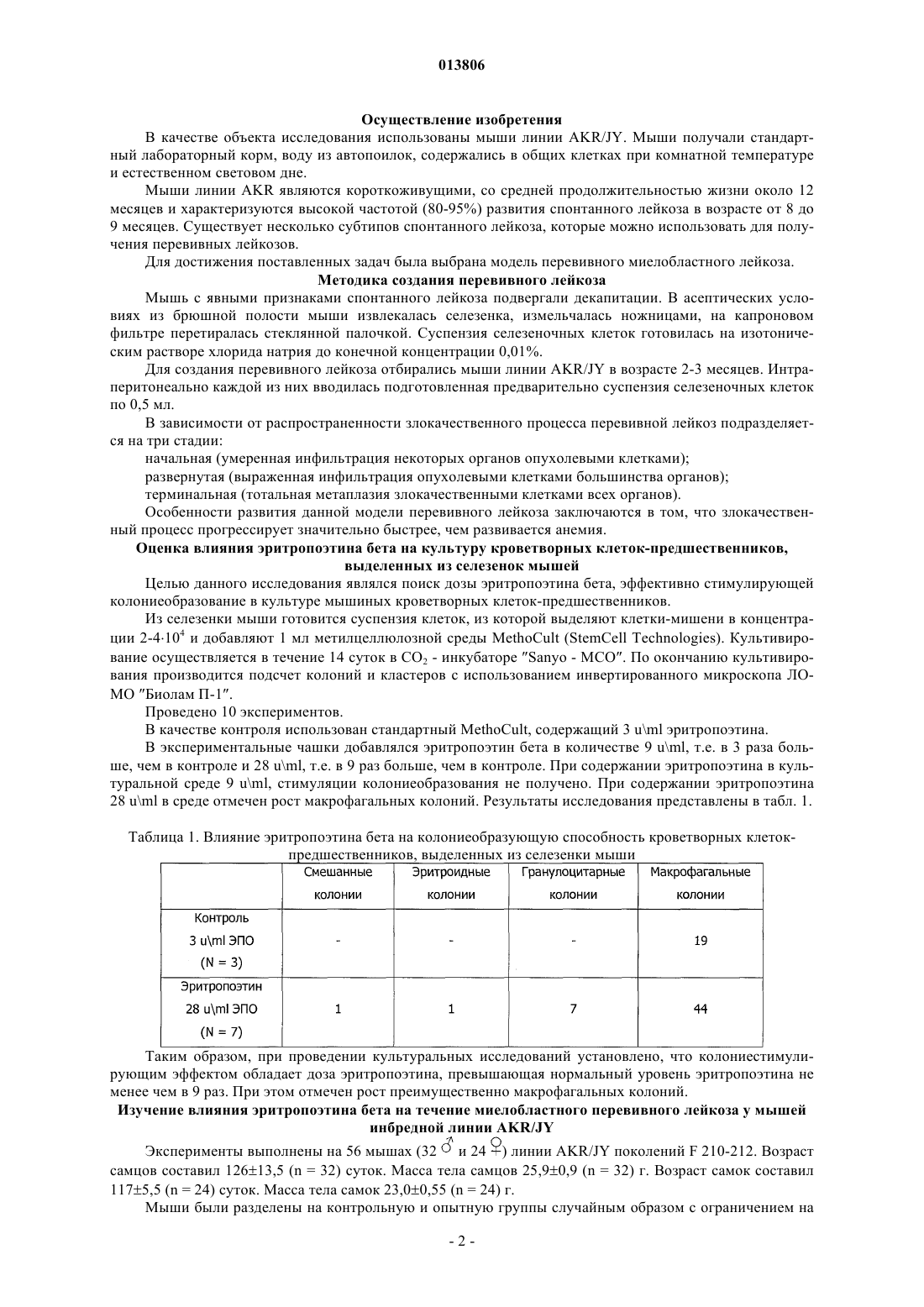
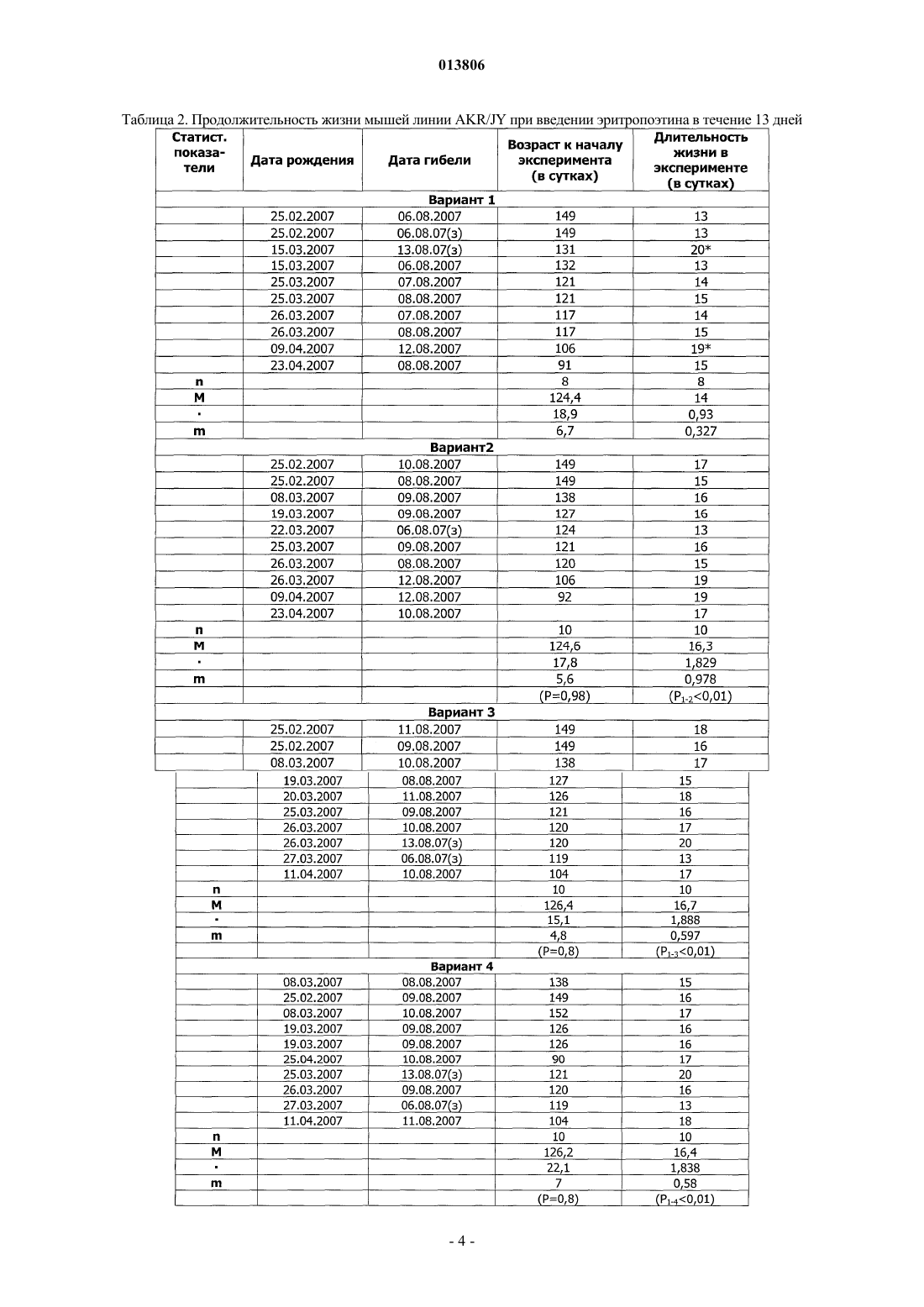
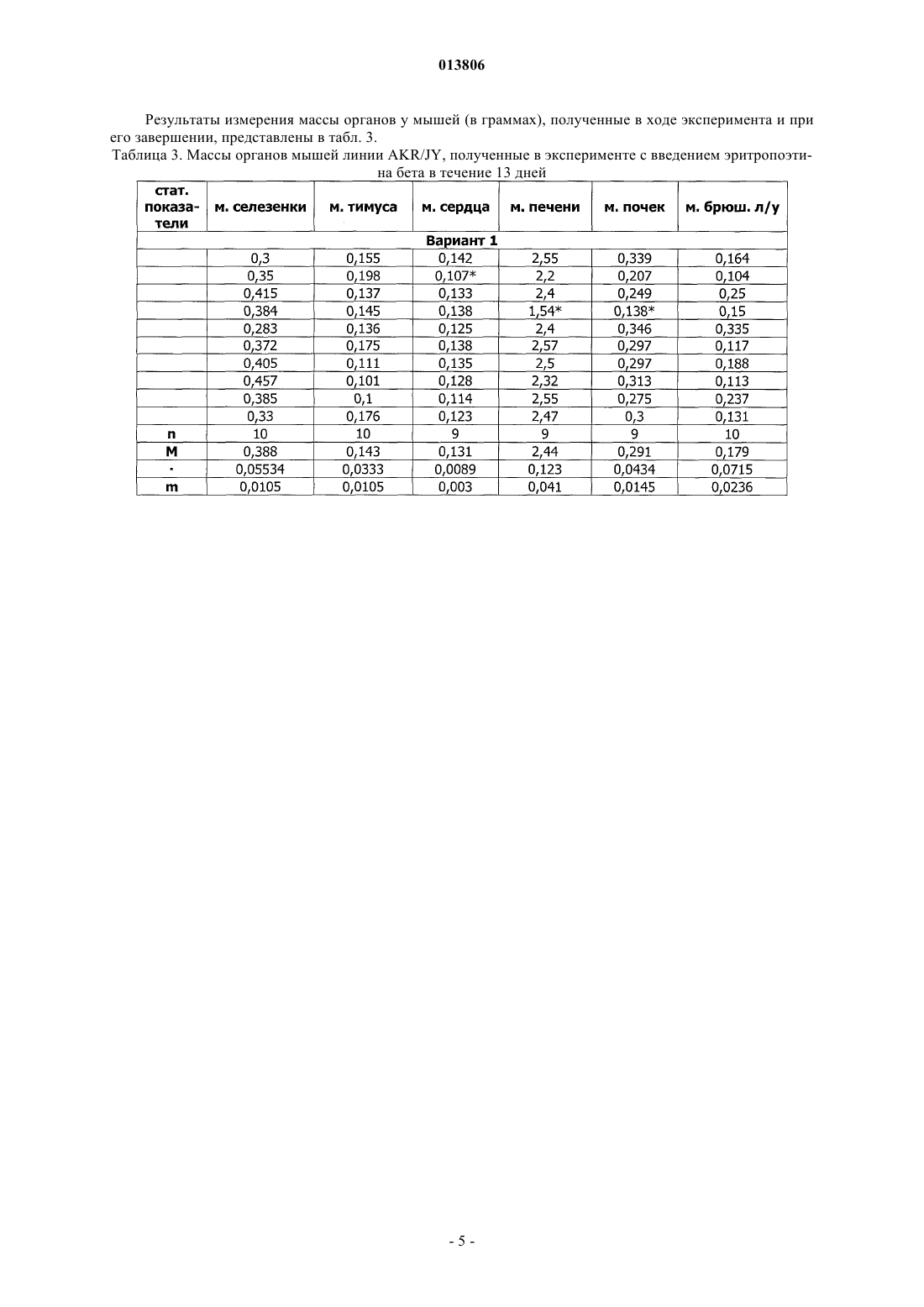
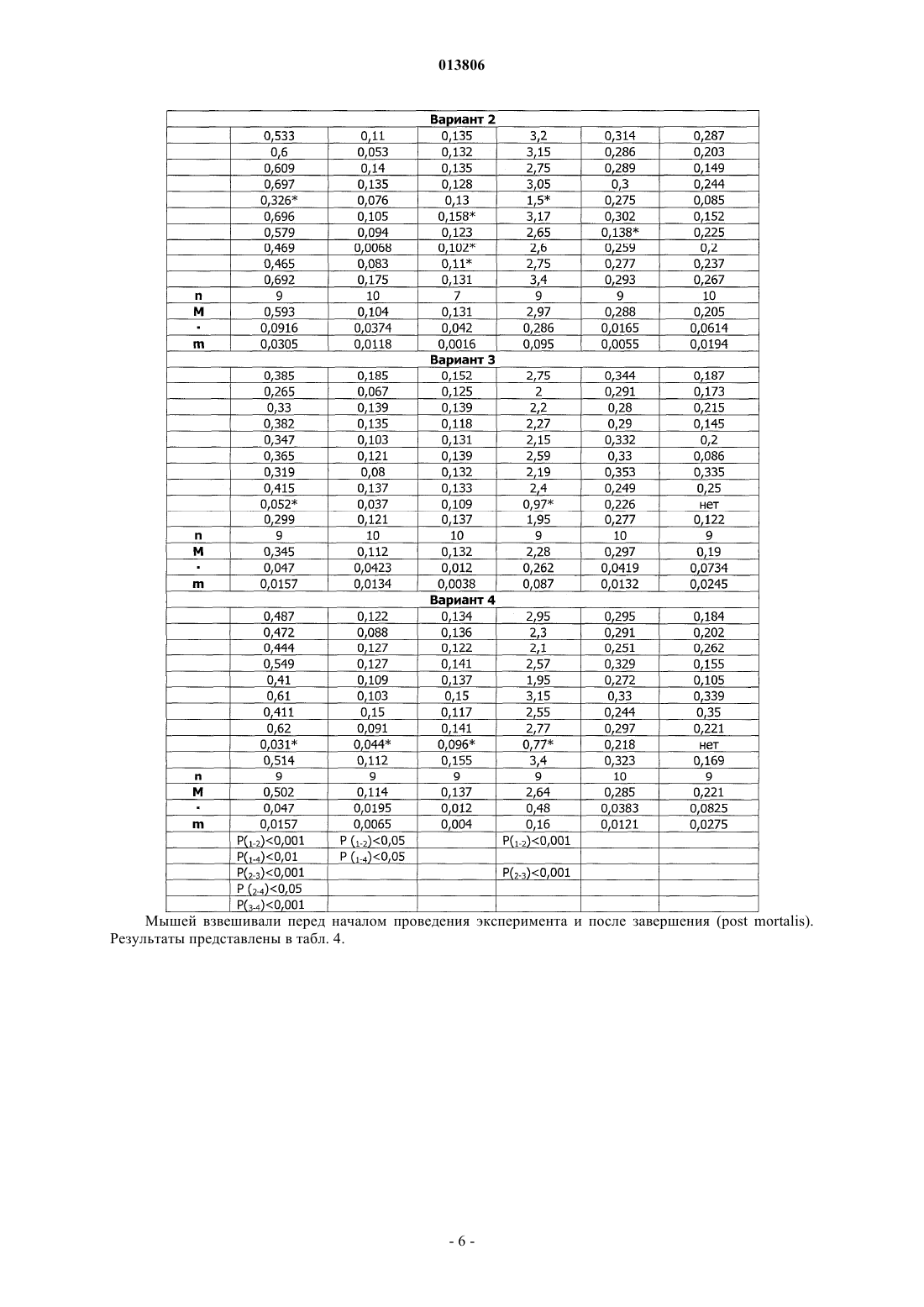
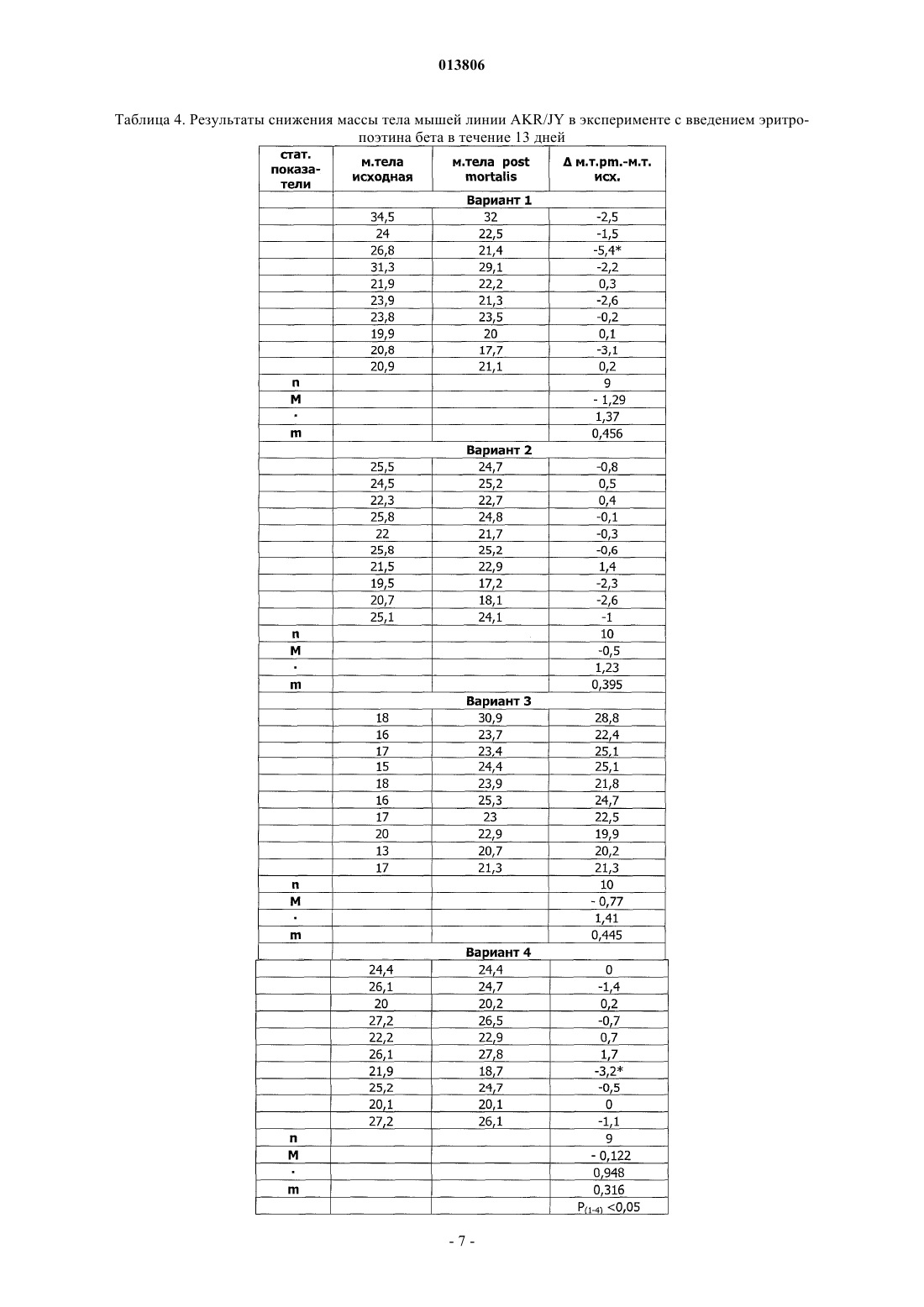
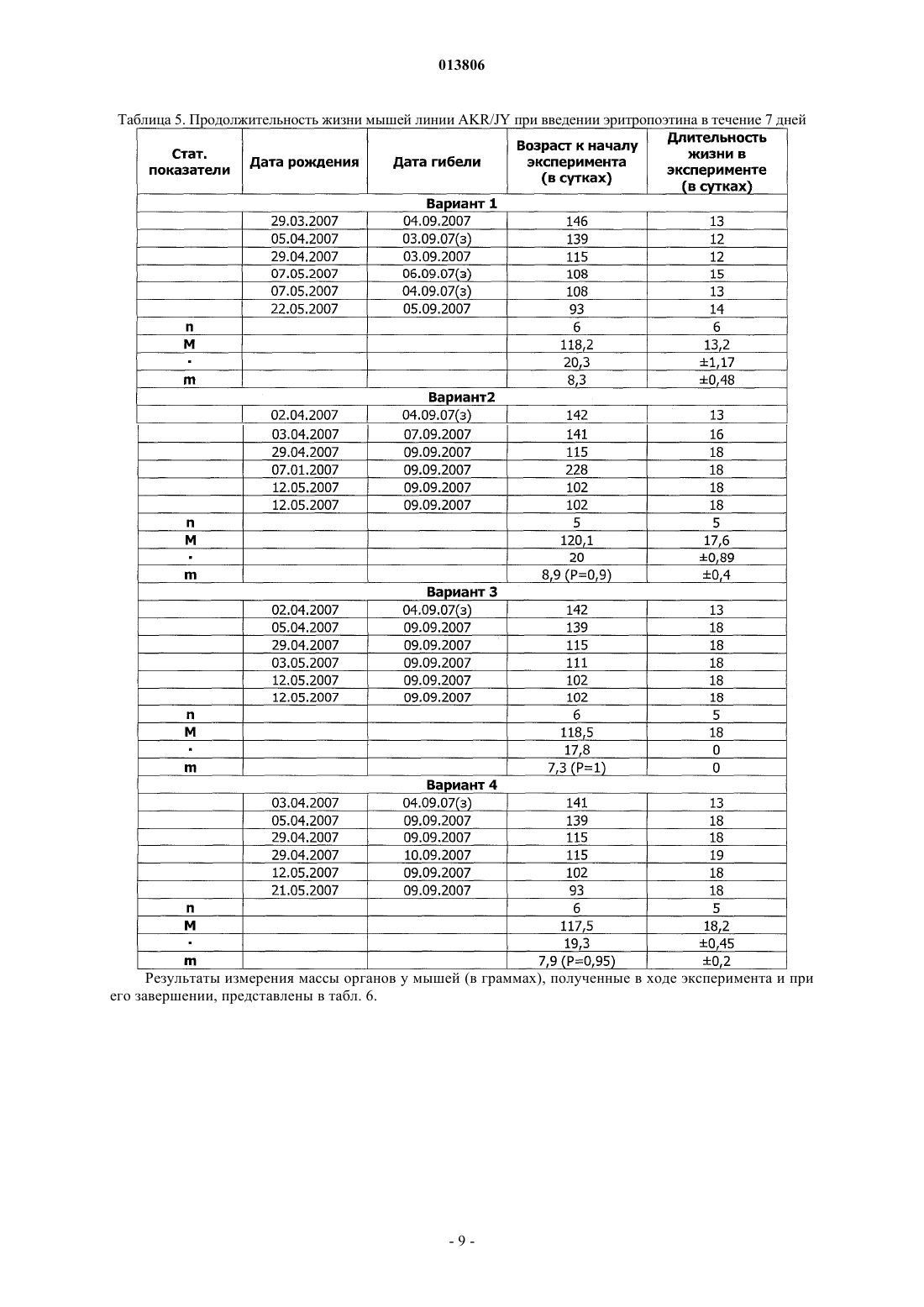
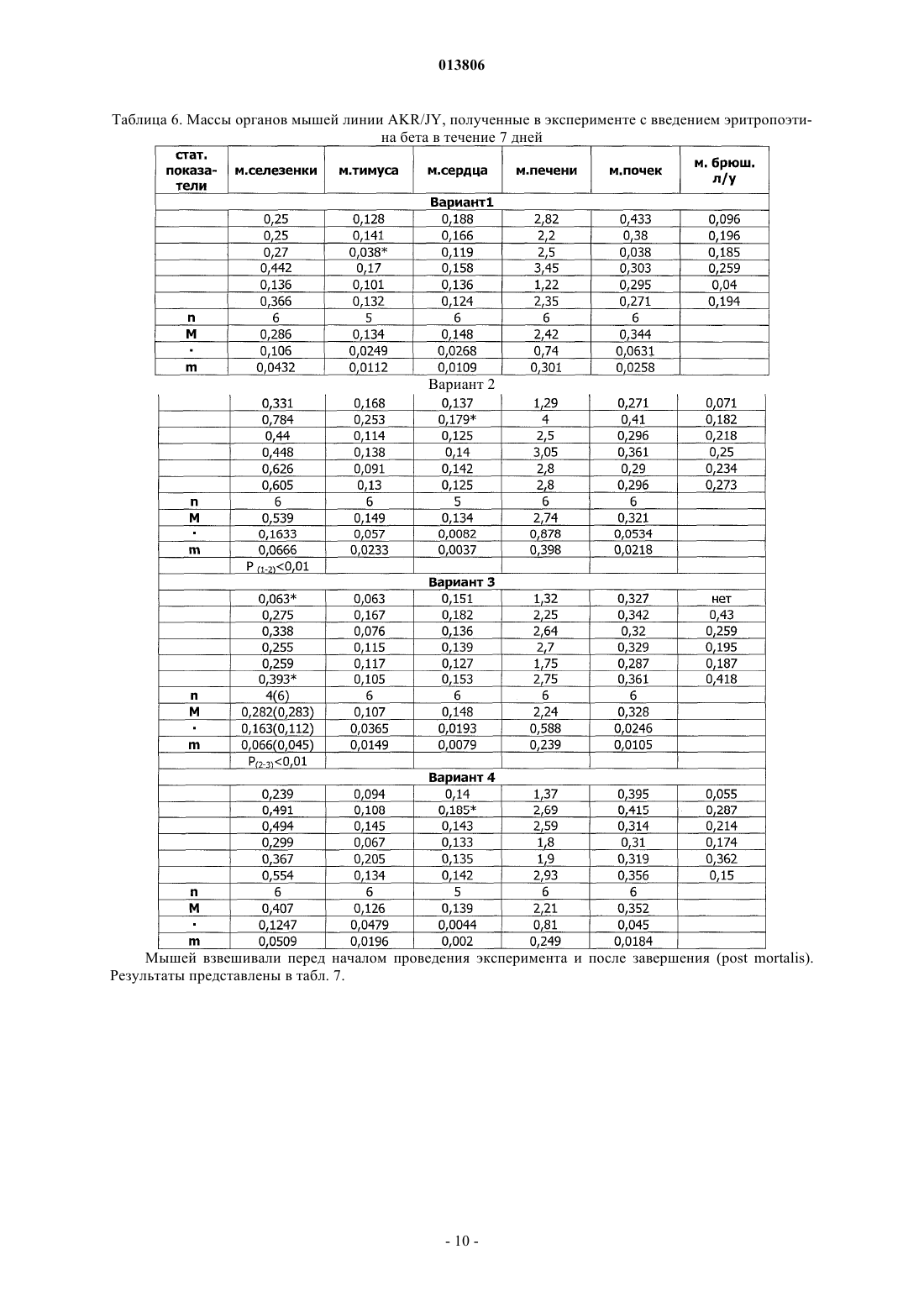
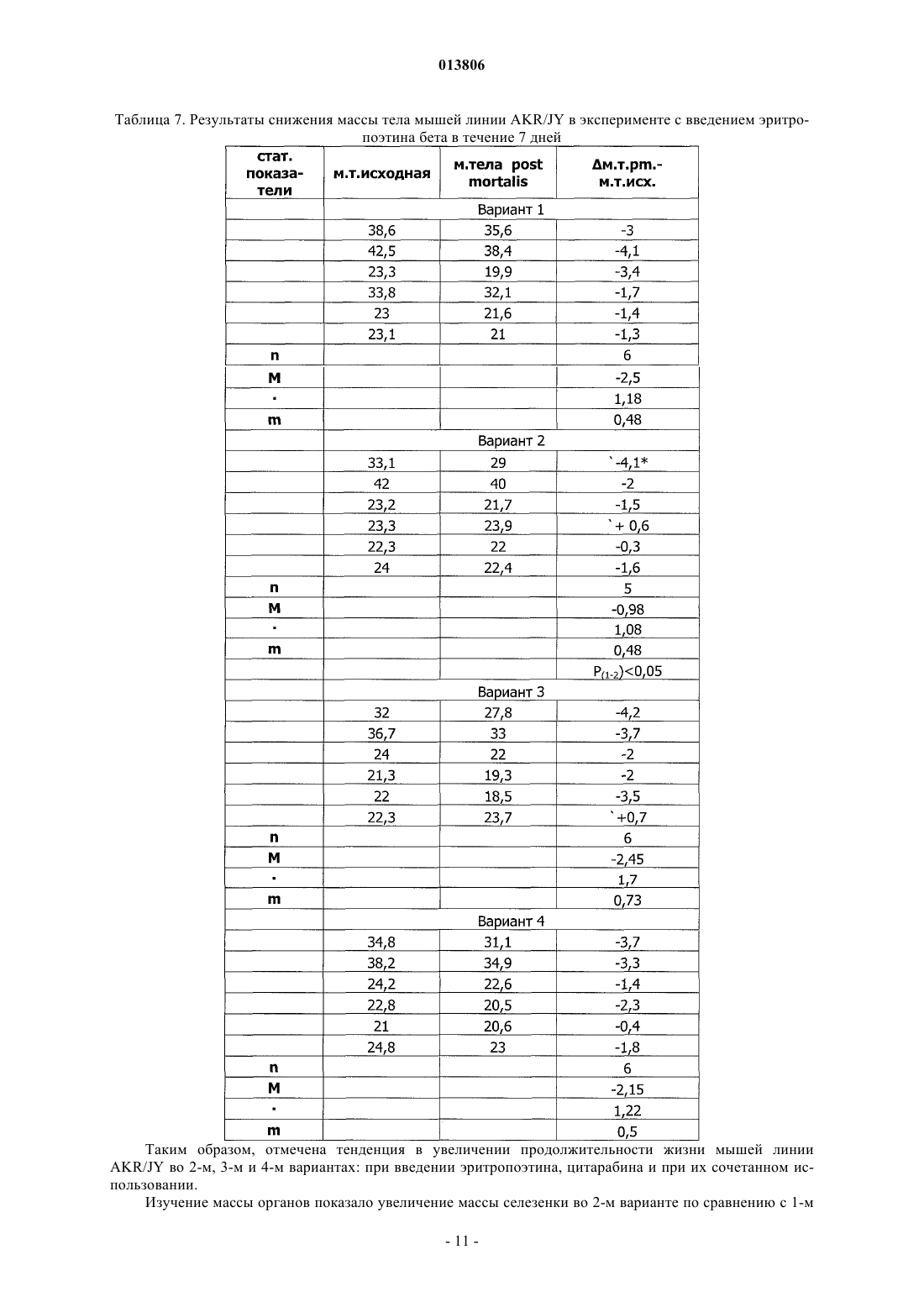
ПРИМЕНЕНИЕ ЭРИТРОПОЭТИНА ДЛЯ ЛЕЧЕНИЯ МИЕЛОБЛАСТНОГО ЛЕЙКОЗА(Budap). 2002;32(2): 169-73. [он-лайн], [найдено 2009.07.08]. Найдено из базы данных Изобретение относится к области медицины и касается применения эритропоэтина, в частности эритропоэтина-бета, для лечения миелобластного лейкоза на начальной и развернутой стадиях, а также оптимальной схемы такого применения. Эритропоэтин является эффективным средством,расширяющим возможности лечения и улучшающим результаты терапии миелобластного лейкоза. Поздеев Николай Маркович, Кузнецов Олег Олегович, Михайлов Сергей Сергеевич, Зиновьев Юрий Васильевич, Рябов Николай Васильевич, Федоровская Надежда Станиславовна, Назарова Елена Львовна, Ковалева Лида Константиновна,Овсепян Ваник Абрамович, Пенькова Марина Владимировна, Бектемиров Артем Альбертович, Кривошеев Сергей Анатольевич (RU) 013806 Уровень техники В течение 15 лет в онкогематологии широко используется рекомбинантный человеческий эритропоэтин с целью профилактики и лечения анемии, индуцированной интенсивной высокодозной химиотерапией. Наибольший эффект от применения эритропоэтина достигнут у больных с немиелоидными опухолями: неходжкинская лимфома, хронический лимфолейкоз, миеломная болезнь (1). К настоящему времени накоплены многочисленные данные, свидетельствующие о том, что кроме стимуляции эритропоэза эритропоэтин обладает выраженной плейотропной активностью. В экспериментальных исследованиях изучается влияние эритропоэтина на опухолевую прогрессию. В частности, Mittelman et al. (2), используя модели мышиной множественной миеломы MOPC-315-IgA lambda и 5 Т 33MM-IgG, показали, что ежедневное введение мышам с множественной миеломой эритропоэтина в течение нескольких недель вызвало полную регрессию опухоли у 30-60% особей, увеличивая продолжительность их жизни и сокращая смертность. Katz О. et al. (3), продолжая эксперименты по изучению влияния эритрпоэтина на течение множественной миеломы мышей, установили, что в противоопухолевых реакциях участвуют не только CD8(+) Т-лимфоциты, но и активированные В-лимфоциты. Было продемонстрировано влияние эритропоэтина на ускорение пролиферации спленоцитов, индуцированной in vitro липополисахаридом. В экспериментах in vitro и in vivo изучаются возможные механизмы влияния эритропоэтина на чувствительность злокачественных клеток к химио- и лучевой терапии (4). Рассматривая вопросы расширения использования эритропоэтина и его рецепторов, Maiese K. et al. (5) отмечают, что они играют важную роль не только в системе кроветворения. Ghezzi P. et al. (6) анализируют механизмы действия эритропоэтина, не относящиеся к стимуляции эритропоэза, в частности, тканепротективные и восстановительные эффекты. Установлено, что эритропоэтин уменьшает проявления периферической нейропатии и кардиотоксичности, вызванные химиотерапией. Обсуждается применение эритропоэтина как цитопротективного агента для нейронов и клеток сердечно-сосудистой системы. Это касается назначения эритропоэтина при церебральной ишемии, инфаркте миокарда, хронической сердечной недостаточности. Эритропоэтин является модулятором клеточных процессов, таких как развитие стволовых клеток, клеточная интеграция и ангиогенез. Эритропоэтин ингибирует механизм апоптоза при травме, включая защиту клеточной мембраны и предотвращая воспаление. Изучая негематологические эффекты эритропоэтина и ЭПО - рецепторов, расположенных на клетках некроветворных тканей, Seong S.R. et al. (7) показали возможность восстановления роста клеточных культур RAW264.7 и РС 12, из которой удалена фетальная бычья сыворотка, путем добавления эритропоэтина. Механизм восстановления роста клеток связан с экспрессией с-Fos и c-Jun, а также с активацией фактора транскрипции АР-1. Важные данные были получены Haroon Z.A. et al. (8) в эксперименте, заключавшемся в подкожной имплантации крысам камеры из полупроницаемой мембраны, где изучался процесс замещения фибрина, находящегося в камере,грануляционной тканью, содержащей новые кровеносные сосуды, макрофаги и фибробласты, т.е. компоненты репаративной реакции. Введение рекомбинантного эритропоэтина в фибриновый матрикс ускоряло образование грануляционной ткани. Для оценки роли эндогенного эритропоэтина в процессе заживления раны были использованы растворимые рецепторы эритропоэтина и анти-ЭПО моноклональные антитела, нейтрализующие эритропоэтин и вызывающие дозозависимую ингибицию образования грануляционной ткани. Показано, что способность эритропоэтина ускорять процесс заживления раны, ассоциирована с проангиогенезом, происходящем в грануляционной ткани. Была установлена выраженная экспрессия ЭПО - рецепторов на макрофагах - клетках, играющих важнейшую роль в репарации раны. Возможность модуляции процесса заживления раны путем назначения эритропоэтина демонстрирует новое направление его использования при развитии фибрин-индуцированного раневого процесса. В обзорной статье (9) приводятся подтверждения плейотропной активности эритропоэтина. Доказано, что эритропоэтин действует не только на эритроидные клетки, но и на миелоидные, на лимфоциты и мегакариоциты. Этот гормон способен активизировать фагоцитарную функцию полиморфноядерных клеток, модулируя таким образом воспалительный процесс. Рецепторы к эритропоэтину найдены на эндотелиальных и мезангиальных клетках, на миокардиоцитах, на гладкомышечных клетках и нейронах. Эти открытия стимулируют исследования негематологических эффектов эритропоэтина. В настоящее время к нерешенным проблемам онкогематологии относится ограниченное использование эритропоэтина при лечении миелоидных опухолей, в частности, миелобластного лейкоза. Миелобластный лейкоз - злокачественное заболевание, поражающее миелоидный росток кроветворения и сопровождающееся накоплением миелобластов с вытеснением всех остальных клеток из крови и костного мозга. Основным современным методом лечения миелобластного лейкоза является химиотерапия с применением миелотропного цитостатика - цитарабина, который можно рассматривать как наиболее близкий аналог заявленного изобретения. К недостаткам указанного средства относится его высокая токсичность,которая ведет к поражению жизненно важных органов и систем и развитию фатальных осложнений. Таким образом, задачей изобретения является поиск высокоэффективного средства и разработка схемы его применения для лечения миелобластного лейкоза. Задача решается за счет применения эритропоэтина бета.-1 013806 Осуществление изобретения В качестве объекта исследования использованы мыши линии AKR/JY. Мыши получали стандартный лабораторный корм, воду из автопоилок, содержались в общих клетках при комнатной температуре и естественном световом дне. Мыши линии AKR являются короткоживущими, со средней продолжительностью жизни около 12 месяцев и характеризуются высокой частотой (80-95%) развития спонтанного лейкоза в возрасте от 8 до 9 месяцев. Существует несколько субтипов спонтанного лейкоза, которые можно использовать для получения перевивных лейкозов. Для достижения поставленных задач была выбрана модель перевивного миелобластного лейкоза. Методика создания перевивного лейкоза Мышь с явными признаками спонтанного лейкоза подвергали декапитации. В асептических условиях из брюшной полости мыши извлекалась селезенка, измельчалась ножницами, на капроновом фильтре перетиралась стеклянной палочкой. Суспензия селезеночных клеток готовилась на изотоническим растворе хлорида натрия до конечной концентрации 0,01%. Для создания перевивного лейкоза отбирались мыши линии AKR/JY в возрасте 2-3 месяцев. Интраперитонеально каждой из них вводилась подготовленная предварительно суспензия селезеночных клеток по 0,5 мл. В зависимости от распространенности злокачественного процесса перевивной лейкоз подразделяется на три стадии: начальная (умеренная инфильтрация некоторых органов опухолевыми клетками); развернутая (выраженная инфильтрация опухолевыми клетками большинства органов); терминальная (тотальная метаплазия злокачественными клетками всех органов). Особенности развития данной модели перевивного лейкоза заключаются в том, что злокачественный процесс прогрессирует значительно быстрее, чем развивается анемия. Оценка влияния эритропоэтина бета на культуру кроветворных клеток-предшественников,выделенных из селезенок мышей Целью данного исследования являлся поиск дозы эритропоэтина бета, эффективно стимулирующей колониеобразование в культуре мышиных кроветворных клеток-предшественников. Из селезенки мыши готовится суспензия клеток, из которой выделяют клетки-мишени в концентрации 2-4104 и добавляют 1 мл метилцеллюлозной среды MethoCult (StemCell Technologies). Культивирование осуществляется в течение 14 суток в CO2 - инкубаторе Sanyo - МСО. По окончанию культивирования производится подсчет колоний и кластеров с использованием инвертированного микроскопа ЛОМО Биолам П-1. Проведено 10 экспериментов. В качестве контроля использован стандартный MethoCult, содержащий 3 uml эритропоэтина. В экспериментальные чашки добавлялся эритропоэтин бета в количестве 9 uml, т.е. в 3 раза больше, чем в контроле и 28 uml, т.е. в 9 раз больше, чем в контроле. При содержании эритропоэтина в культуральной среде 9 uml, стимуляции колониеобразования не получено. При содержании эритропоэтина 28 uml в среде отмечен рост макрофагальных колоний. Результаты исследования представлены в табл. 1. Таблица 1. Влияние эритропоэтина бета на колониеобразующую способность кроветворных клетокпредшественников, выделенных из селезенки мыши Таким образом, при проведении культуральных исследований установлено, что колониестимулирующим эффектом обладает доза эритропоэтина, превышающая нормальный уровень эритропоэтина не менее чем в 9 раз. При этом отмечен рост преимущественно макрофагальных колоний. Изучение влияния эритропоэтина бета на течение миелобластного перевивного лейкоза у мышей инбредной линии AKR/JY Эксперименты выполнены на 56 мышах (32 и 24 ) линии AKR/JY поколений F 210-212. Возраст самцов составил 12613,5 (n = 32) суток. Масса тела самцов 25,90,9 (n = 32) г. Возраст самок составил 1175,5 (n = 24) суток. Масса тела самок 23,00,55 (n = 24) г. Мыши были разделены на контрольную и опытную группы случайным образом с ограничением на-2 013806 рандомизацию по возрасту и массе тела. Всем животным перевит 94-й пассаж миелобластного лейкоза. В тот же день им начато внутрибрюшное введение физиологического раствора (контрольная группа) по 0,5 мл и раствора эритропоэтина бета (опытная группа) по 0,5 мл. Введение осуществлялось ежедневно,кроме выходных дней. Доза эритропоэтина составила 1000 МЕ/кг. Сравнительная оценка продолжительности жизни проведена через 20 суток. Через 20 суток после инокуляции лейкозных клеток количество оставшихся в живых мышей опытной группы составило 15, погибло 13. В контрольной группе живых мышей осталось 8, погибло 19. В целом, средняя продолжительность жизни животных опытной группы (n=27) составила 19,70,306 суток,в контрольной группе (n=25) - 18,70,29 суток (Р 0,05). Таким образом, эритропоэтин бета обеспечил продление жизни мышам линии AKR/JY с перевивным миелобластным лейкозом. С целью определения наиболее эффективной схемы лечения миелобластного перевивного лейкоза у мышей инбредной линии AKR/JY проведено сравнение результатов двух экспериментов. В первом эритропоэтин бета применялся в течение 13 дней и во втором - в течение 7 дней. Других различий между схемами лечения не было. Каждое экспериментальное исследование включало 4 варианта (в 1-м вводился физиологический раствор, во 2-м - эритропоэтин, в 3-м - цитарабин, в 4-м - эритропоэтин с цитарабином). Статистическая обработка материала Все показатели представлены в виде среднегоодно стандартное отклонение среднего значения (Мm). Результаты исследований подвергнуты статистической обработке с использованием t-критерия Стьюдента, критериев для исключения выскакивающих значений варианта и непараметрического критерия U (1), а также математического аппарата для обработки многофакторных экспериментов (10,11). Изучение эффективности лечения миелобластного перевивного лейкоза у мышей инбредной линииAKR/JY при использовании эритропоэтина бета в течение 13 дней Эксперимент выполнен на 40 самках мышей инбредной линии AKR/JY поколения F 212. Возраст мышей составил 124,42,7 дня. Масса тела - 22,60,73 г. Продолжительность опыта - 20 дней. Мыши были разделены на 4 варианта случайным образом с ограничением на рандомизацию по возрасту и массе тела. Всем животным перевит 99-й пассаж миелобластного лейкоза. В тот же день им начато внутрибрюшное введение растворов по следующее схеме. 1 вариант - в течение четырех дней однократное введение физиологического раствора, затем в течение пяти дней двукратное введение физиологического раствора, затем в течение четырех дней однократное введение физиологического раствора. 2 вариант - в течение четырех дней введение эритропоэтина бета, затем в течение пяти дней введение эритропоэтина бета и физиологического раствора, затем в течение четырех дней введение эритропоэтина бета. 3 вариант - в течение четырех дней введение физиологического раствора, затем в течение пяти дней введение цитарабина и физиологического раствора, затем в течение четырех дней введение физиологического раствора. 4 вариант - в течение четырех дней введение эритропоэтина бета, затем в течение пяти дней введение эритропоэтина бета и цитарабина, затем в течение четырех дней введение эритропоэтина бета. Доза эритропоэтина составила 1000 МЕ/кг. Доза цитарабина составила 0,003 мг на кг. Были изучены: продолжительность жизни животных, снижение массы тела в ходе исследования,масса органов после завершения эксперимента. Результаты Продолжительность жизни мышей в зависимости от варианта применения исследуемых препаратов представлена в табл. 2.-3 013806 Таблица 2. Продолжительность жизни мышей линии AKR/JY при введении эритропоэтина в течение 13 дней-4 013806 Результаты измерения массы органов у мышей (в граммах), полученные в ходе эксперимента и при его завершении, представлены в табл. 3. Таблица 3. Массы органов мышей линии AKR/JY, полученные в эксперименте с введением эритропоэтина бета в течение 13 дней Мышей взвешивали перед началом проведения эксперимента и после завершения (post mortalis). Результаты представлены в табл. 4.-6 013806 Таблица 4. Результаты снижения массы тела мышей линии AKR/JY в эксперименте с введением эритропоэтина бета в течение 13 дней-7 013806 Таким образом, продолжительность жизни мышей линии AKR/JY достоверно увеличивается во 2-м,3-м и 4-м вариантах: при введении эритропоэтина, цитарабина и при их сочетанном использовании. Изучение массы органов показало увеличение массы селезенки во 2-м и 4-м вариантах по сравнению с 1-м вариантом, при этом масса селезенки во 2-м варианте была больше, чем в 3-м и 4-м, а в 4-м больше, чем в 3-м. Масса тимуса оказалась меньше во 2-м варианте, чем в 1-м и 4-м. Масса печени во 2-м варианте превышает массу печени 1-го и 3-вариантов. Снижение массы тела отмечено во всех вариантах, однако наименее выраженным оно является во 2-м и в 4-м вариантах. Изучение эффективности лечения миелобластного перевивного лейкоза у мышей инбредной линииAKR/JY при использовании эритропоэтина бета в течение 7 дней Эксперимент выполнен на 24 самках мышей инбредной линии AKR/JY поколения F 212. Возраст мышей составил 118,63,76 дней. Масса тела 28,181,48 г. Продолжительность опыта - 20 дней. Мыши были разделены на 4 варианта случайным образом с ограничением на рандомизацию по возрасту и массе тела. Всем животным перевит 101-й пассаж миелобластного лейкоза. В тот же день им начато внутрибрюшное введение растворов по следующей схеме. 1 вариант - в течение четырех дней однократное введение физиологического раствора, затем в течение пяти дней двукратное введение физиологического раствора, далее - до конца эксперимента введение препаратов не проводилось. 2 вариант - в течение четырех дней введение эритропоэтина бета, затем в течение трех дней введение эритропоэтина бета и физиологического раствора, затем в течение двух дней физиологического раствора и далее до конца эксперимента введение препаратов не проводилось. 3 вариант - в течение четырех дней введение физиологического раствора, затем в течение пяти дней введение цитарабина и физиологического раствора, далее до конца эксперимента введение препаратов не проводилось. 4 вариант - в течение четырех дней введение эритропоэтина бета, затем в течение пяти дней введение эритропоэтина бета и цитарабина, далее до конца эксперимента введение препаратов не проводилось. Доза эритропоэтина составила 1000 МЕ/кг. Доза цитарабина составила 0,003 мг/кг. Были изучены: продолжительность жизни животных, снижение массы тела в ходе исследования,масса органов после завершения эксперимента. Результаты Продолжительность жизни мышей в зависимости от варианта применения исследуемых препаратов представлена в табл. 5.-8 013806 Таблица 5. Продолжительность жизни мышей линии AKR/JY при введении эритропоэтина в течение 7 дней Результаты измерения массы органов у мышей (в граммах), полученные в ходе эксперимента и при его завершении, представлены в табл. 6.-9 013806 Таблица 6. Массы органов мышей линии AKR/JY, полученные в эксперименте с введением эритропоэтина бета в течение 7 дней Мышей взвешивали перед началом проведения эксперимента и после завершения (post mortalis). Результаты представлены в табл. 7.- 10013806 Таблица 7. Результаты снижения массы тела мышей линии AKR/JY в эксперименте с введением эритропоэтина бета в течение 7 дней Таким образом, отмечена тенденция в увеличении продолжительности жизни мышей линииAKR/JY во 2-м, 3-м и 4-м вариантах: при введении эритропоэтина, цитарабина и при их сочетанном использовании. Изучение массы органов показало увеличение массы селезенки во 2-м варианте по сравнению с 1-м- 11013806 и 3-м вариантами. Достоверной разницы в массе органов между другими вариантами не установлено. Снижение массы тела отмечено во всех вариантах, однако наименее выраженным оно является во 2-м варианте. Сравнительный анализ двух схем лечения миелобластного перевивного лейкоза у мышей инбредной линии AKR/JY с использованием эритропоэтина бета При оценке различий в изменении массы тела мышей в ходе двух экспериментов установлено, что при 13-дневном применении эритропоэтина, меньше всего теряется масса во 2-м и 4-м вариантах, причем в 4-м варианте сохранение массы тела достоверно выше, чем в 1-м варианте (Р 0,05). При 7-дневном применении эритропоэтина масса тела достоверно сохраняется во 2-м варианте (Р 0,05). Показатели продолжительности жизни мышей, а также динамика массы селезенки и массы печени подвергнуты анализу с помощью двухфакторного эксперимента 22 [12, 10]. Каждый фактор исследовался на двух уровнях. Первый фактор - длительность применения эритропоэтина: верхний уровень - 13 дней, нижний уровень - 7 дней. Второй фактор - влияние цитарабина: верхний уровень - с введением цитарабина, нижний уровень без цитарабина. Таблица плана факторного эксперимента выглядит следующим образом: Полный двухфакторный эксперимент 22 План состоит из четырех опытов. Опыт 1 - оба фактора на нижнем уровне: эритропоэтин применялся 7 дней, цитарабин не вводился. Опыт 2 - первый фактор - на верхнем уровне, второй фактор - на нижнем уровне: эритропоэтин применялся 13 дней, цитарабин не вводился. Опыт 3 - первый фактор - на нижнем уровне, второй фактор - на верхнем уровне: эритропоэтин применялся 7 дней, вводился цитарабин. Опыт 4 - оба фактора на верхнем уровне: эритропоэтин применялся 13 дней, вводился цитарабин. По результатам эксперимента составлены уравнения регрессии типа у = b0 + b1x1 + b2x2 + b12x1x2,где у - продолжительность жизни мышей (в сутках);x1x2 - взаимодействие обоих факторов (эритропоэтина и цитарабина); b0 - первый член уравнения,среднее значение исследуемого показателя всех четырех опытов факторного эксперимента, b1, b2, b12,стоящие перед знаками факторов, - это коэффициенты, указывающие на силу влияния данного фактора. Если модуль коэффициента b равен или превышает произведение ошибки в определении коэффициента регрессии (Sb) на критерий Стьюдента (t) - bSbt, то такой коэффициент считается достоверным, и данный фактор оказывает статистически достоверное влияние на исследуемый показатель. Знак +, стоящий перед коэффициентом, указывает на то, что под влиянием данного фактора исследуемый показатель увеличивается, знак- на то, что исследуемый показатель под влиянием данного фактора уменьшается. Уравнение регрессии для оценки продолжительности жизни мышей в двух опытах имеет следующий вид: у = 16,8 - l,05x1 + 0,25 х 2 - 0,05x1x2,где у - продолжительность жизни мышей в сутках;x1x2 - взаимодействие двух факторов; b = 0,3. Коэффициенты, стоящие перед знаками факторов х 2 и x1x2, меньше критического значения 0,3, а перед фактором x1 - больше 0,3. Таким образом, у = 16,8 - l,05x1. Следовательно, под влиянием эритропоэтина, применяемого в течение 7 дней, продолжительность жизни мышей увеличивается, а применение эритропоэтина в течение 13 дней сокращает продолжительность жизни. Цитарабин не оказал влияния на- 12013806 продолжительность жизни животных. Сочетанное применение эритропоэтина и цитарабина также не привело к увеличению продолжительности жизни. Уравнение регрессии для оценки изменения массы селезенки мышей в двух опытах имеет следующий вид: у = 0,533 + 0,022x1 - 0,08 х 2 - 0,0065x1x2,где у - изменение массы селезенки в граммах;x1 - фактор эритропоэтина; х 2 - фактор цитарабина; x1x2 - взаимодействие двух факторов; b = 0,046. Таким образом, у = 0,533 - 0,08 х 2. Следовательно, масса селезенки под действием эритропоэтина достоверно не изменяется, а под влиянием цитарабина достоверно уменьшается. Уравнение регрессии для оценки изменения массы печени мышей в двух опытах имеет следующий вид: у = 2,68 - 0,0225 х 1 - 2,68 х 2 + 0,0175x1x2,где у - изменение массы печени в граммах;x1x2 - взаимодействие двух факторов; b = 0,21. Таким образом, у = 2,68 - 2,68 х 2. Следовательно, масса печени под действием эритропоэтина достоверно не изменяется, а под влиянием цитарабина достоверно уменьшается. Иммуногистохимическое исследование селезенки у мышей в ходе экспериментов При изучении механизмов влияния эритропоэтина на течение миелобластного перевивного лейкоза проведен иммуногистохимический анализ селезенки с использованием поликлона S-100 (RTU) производства Dako Cytomation, выявляющего интердигитальные дендритные клетки в лимфоидной ткани. Оценка результатов проводилась по количеству S-100 положительных (дендритных) клеток в селезенке мышей в поле зрения на 13 день эксперимента. Установлено, что независимо от длительности применения эритропоэтина, содержание S-100 положительных клеток оказалось существенно выше в селезенках мышей с перевивным лейкозом, получавших эритропоэтин и эритропоэтин с цитарабином, чем у мышей контрольной группы, получавших физиологический раствор и у мышей, получавших цитарабин. Таким образом: 1. Эритропоэтин бета эффективно сдерживает развитие перевивного миелобластного лейкоза мышей линии AKR/JY, что проявляется увеличением продолжительности жизни и сохранением массы тела животных. 2. Установлено, что обеспечение противоопухолевого действия на модели перевивного лейкоза связано с использованием высоких доз эритропоэтина бета, существенно превышающих эритропоэзстимулирующие дозы. 3. Разработана оптимальная схема применения эритропоэтина бета при лечении перевивного миелобластного лейкоза, которая заключается в назначении эритропоэтина в начальной и развернутой стадиях лейкоза. Использование эритропоэтина в терминальной стадии ведет к стимуляции лейкозного процесса. 4. В группах мышей с перевивным лейкозом, получавших эритропоэтин бета, обнаружено высокое содержание S-100 положительных (дендритных) клеток в селезенках, что можно расценивать, как стимуляцию стромальных элементов и как один из возможных механизмов противоопухолевого действия эритропоэтина бета. Список литературы 1. Зак К.П., Грыцюк С.Н. Эритропоэтины в онкологии. - Онкология.- 2001., т.3.,2-3., с.107-109. 2. Mittelman M., Neumann D, Peled A, Kanter P, Haran-Ghera N. Erythropoietin induces tumor regressionwound-healing response. Am. J. Pathol. 2003 Sep;163(3): 993-1000. 9. Buemi M., Nostro L, Romeo A. Et al. From the oxygen to the organ protection: erythropoietin as protagonist in internal medicine. Cardiovasc. Hematol. Agents Med. Chem. 2006 Oct; 4(4): 299-311. 10. Воробьев Ф.П., Голобородько H.K., Мануйлова A.M. Математическое планирование эксперимента в биохимии и медицине. Харьков. -Издательское объединение Вища школа., 1977, с. 20-27. 11. Лисенков А.Н. Математические методы планирования многофакторных медико-биологических экспериментов. М.- Медицина, 1979, с. 97-115. 12. Ашмарин И.П., Васильев Н.Н., Амбросов В.А. Быстрые методы статистической обработки и планирование экспериментов. Л., Издательство ЛГУ, 1971, 78 с. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение эритропоэтина для лечения миелобластного лейкоза на начальной и развернутой стадиях. 2. Применение по п.1, отличающееся тем, что эритропоэтин представляет собой эритропоэтин бета. 3. Применение по п.1 или 2, отличающееся тем, что дозы эритропоэтина превышают эритропоэзстимулирующие дозы не менее чем в 3 раза. 4. Применение по любому из пп.1-3, отличающееся тем, что эритропоэтин вводится ежедневно.
МПК / Метки
МПК: A61P 35/02, A61K 38/18
Метки: лейкоза, миелобластного, эритропоэтина, применение, лечения
Код ссылки
<a href="https://eas.patents.su/15-13806-primenenie-eritropoetina-dlya-lecheniya-mieloblastnogo-lejjkoza.html" rel="bookmark" title="База патентов Евразийского Союза">Применение эритропоэтина для лечения миелобластного лейкоза</a>
Предыдущий патент: Агрегат для бурения грунта и способ бурения
Следующий патент: Способ удаления газа, способного захватывать амин, из потока сырьевого газа
Случайный патент: Средство для удаления нежелательного волосяного покрова с тела человека