Радиоактивные терапевтические липосомы
Формула / Реферат
1. Система конъюгации, отличающаяся тем, что она представляет собой липосому с ионофорами и с хелатообразующим соединением, помещенными внутрь липосомы, причем в указанную липосому дополнительно инкапсулируют тяжелый(ые) радионуклид(ы), излучающий(ие) a-частицы, или 212Pb в качестве генератора для a-излучателя 212Bi.
2. Система конъюгации по п.1, отличающаяся тем, что концентрация хелатообразующего соединения внутри липосом является подходящей для удерживания дочерних нуклидов.
3. Система конъюгации по любому из пп.1 или 2, отличающаяся тем, что хелатообразующее соединение выбрано из группы, содержащей
1,4,7,10-тетраазациклододекан-1,4,7,10-N,N',N",N'"-тетрауксусную кислоту (DOTA),
1,4,7,10-тетраазациклотридекан-1,4,7,10-N,N',N",N'"-тетрауксусную кислоту (TRITA),
1,4,7,10-тетраазациклотетрадекан-1,4,7,10-N,N',N",N"'-тетрауксусную кислоту (TETA),
1,4,7,10-тетраазациклододекан-1,4,7,10-N,N',N",N"'-тетра(метилен)фосфоновую кислоту (DOTMP),
1,4,7,10-тетраазациклотридекан-1,4,7,10-N,N',N",N'"-тетра(метилен)фосфоновую кислоту,
1,4,7,10-тетраазациклотетрадекан-1,4,7,10-N,N',N",N'"-тетра(метилен)фосфоновую кислоту, диэтилентриамин-N,N',N"-пентауксусную кислоту и их изомерные производные, криптат[2,2,2], криптат[3,2,2], криптат[2,2,1] и их моно- и дибензопроизводные, соединенные мостиковой связью каликс[4]арены, содержащие богатые электронами (донорные) группы (гидроксил, карбоксил, эфир, амид, амин), 1,10-диаза-4,7,13,16-тетраоксациклооктадекан-1,10-N,N'-бис-уксусную кислоту и
1,10-диаза-4,7,13,16-тетраоксациклооктадекан-1,10-N,N'-бис-малонат.
4. Система конъюгации по любому из пп.1-3, отличающаяся тем, что липосомы содержат активированные группы в мембране, дающие возможность конъюгации белков или других рецепторных аффинных молекул с этими активированными группами.
5. Система конъюгации по п.4, где указанные активированные группы представляют собой полиэтиленгликоль.
6. Система конъюгации по любому из пп.1-5, отличающаяся тем, что липосомы являются конъюгированными с белками, связывающими рецептор.
7. Система конъюгации по п.6, где указанные белки, связывающие рецептор, представляют собой моноклональные или поликлональные антитела, либо фрагменты или конструкции антител, либо фолат.
8. Система конъюгации по п.6, отличающаяся тем, что липосомы являются конъюгированными с антителами класса IgM или IgG либо фрагментами или конструкциями из антител этих классов.
9. Система конъюгации по п.6, отличающаяся тем, что липосомы являются конъюгированными с антителами класса IgM или IgG либо фрагментами или конструкциями из антител этих классов, где эти антитела, фрагменты или конструкции являются меченными фолатом и радионуклидом или смесью различных радионуклидов.
10. Система конъюгации по любому из пп.1-9, отличающаяся тем, что антитела либо фрагменты или конструкции антител, конъюгированные с липосомами, являются мышиными, химерными или человеческими, моноклональными или поликлональными.
11. Система конъюгации по п.10, отличающаяся тем, что антитела либо фрагменты или конструкции антител являются меченными фолатом, где сайт связывания антигена направлен на белок, связывающий фолат (FBP).
12. Система конъюгации по п.10, отличающаяся тем, что антитела либо фрагменты или конструкции антител являются меченными фолатом, где сайт связывания антигена направлен на антиген, отличный от FBP.
13. Система конъюгации по любому из пп.1-12, отличающаяся тем, что радионуклид представляет собой тяжелый a -излучатель и/или 212Pb в качестве генератора для a-излучателя 212Bi, выбранный из 211At, 212Bi, 213Bi, 212Pb, 225Ac, 223Ra, 224Ra и 227Th.
14. Система конъюгации по любому из пп.1-13, отличающаяся тем, что дочерний нуклид и материнский нуклид представляют собой 212Bi и 212Pb соответственно.
15. Способ получения радиоактивно меченой системы конъюгации по пп.1-14, отличающийся тем, что липосомы с ионофорами и хелатообразующим соединением подходящей концентрации являются стабильно радиоактивно меченными тяжелыми излучателями a-частиц, при котором раствор, содержащий радионуклид или смесь радионуклидов, которые испускают излучение a-частиц, или 212Pb в качестве генератора для a-излучателя 212Bi, смешивают с раствором, содержащим липосомы, и инкубируют при повышенной температуре по сравнению с физиологической температурой для получения транспорта радионуклида(ов) в липосомы.
16. Способ по п.15, отличающийся тем, что хелатообразующее соединение выбрано из группы, содержащей
1,4,7,10-тетраазациклододекан-1,4,7,10-N,N',N",N'"-тетрауксусную кислоту (DOTA),
1,4,7,10-тетраазациклотридекан-1,4,7,10-N,N',N",N'"-тетрауксусную кислоту (TRITA),
1,4,7,10-тетраазациклотетрадекан-1,4,7,10-N,N',N",N'"-тетрауксусную кислоту (TETA),
1,4,7,10-тетраазациклододекан-1,4,7,10-N,N',N",N'"-тетра(метилен)фосфоновую кислоту (DOTMP),
1,4,7,10-тетраазациклотридекан-1,4,7,10-N,N',N",N'"-тетра(метилен)фосфоновую кислоту,
1,4,7,10-тетраазациклотетрадекан-1,4,7,10-N,N',N",N"'-тетра(метилен)фосфоновую кислоту,
диэтилентриамин-N,N',N"-пентауксусную кислоту и их изомерные производные,
криптат[2,2,2], криптат[3,2,2], криптат[2,2,1] и их моно- и дибензопроизводные, соединенные мостиковой связью каликс[4]арены, содержащие богатые электронами (донорные) группы (гидроксил, карбоксил, эфир, амид, амин),
1,10-диаза-4,7,13,16-тетраоксациклооктадекан-1,10-N,N'-бис-уксусную кислоту и
1,10-диаза-4,7,13,16-тетраоксациклооктадекан-1,10-N,N'-бис-малонат.
17. Способ по любому из пп.15-16, отличающийся тем, что липосомы содержат активированные группы в мембране, дающие возможность конъюгации белков или других рецепторных аффинных молекул.
18. Способ по п.17, отличающийся тем, что активированные группы представляют собой полиэтиленгликоль.
19. Способ по любому из пп.15-18, отличающийся тем, что липосомы являются конъюгированными с белками, связывающими рецептор.
20. Способ по п.19, где указанные белки, связывающие рецептор, представляют собой моноклональные или поликлональные антитела, либо фрагменты или конструкции антител, либо фолат.
21. Способ по п.19, отличающийся тем, что липосомы являются конъюгированными с антителами класса IgM или IgG либо фрагментами или конструкциями из антител этих классов.
22. Способ по п.19, отличающийся тем, что липосомы являются конъюгированными с антителами класса IgM или IgG либо фрагментами или конструкциями из антител этих классов, где эти антитела являются меченными фолатом и радионуклидом или смесью различных радионуклидов при использовании стандартных методик мечения антитела фолатом и радионуклидом.
23. Способ по любому из пп.15-22, отличающийся тем, что антитела либо фрагменты или конструкции антител, конъюгированные с липосомами, являются мышиными, химерными или человеческими, моноклональными или поликлональными.
24. Способ по п.23, отличающийся тем, что антитела либо фрагменты или конструкции антител являются меченными фолатом, где сайт связывания антигена направлен на FBP.
25. Способ по п.23, отличающийся тем, что антитела либо фрагменты или конструкции антител, где сайт связывания антигена направлен на антиген, отличный от FBP.
26. Способ по любому из пп.15-25, отличающийся тем, что радионуклид представляет собой тяжелый a -излучатель или 212Pb в качестве генератора для a -излучателя 212Bi, выбранный из 211At, 212Bi, 213Bi, 212Pb, 225Ac, 223Ra, 224Ra и 227Th.
27. Способ по любому из пп.15-26, отличающийся тхь, что дочерний нуклид и материнский нуклид представляют собой 212Bi и 212Pb соответственно.
28. Применение системы конъюгации по любому из пп.1-14 для изготовления фармацевтического раствора, подходящего для инъекции или инфузии млекопитающим, включая людей.
29. Применение по п.28 для изготовления фармацевтического раствора, подходящего для инъекции или инфузии млекопитающим, включая людей, посредством внутривенного, и/или регионарного, и/или внутриопухолевого пути введения.
30. Применение по п.28 в комбинации с радиоиммуноконъюгатом или несколькими радиоиммуноконъюгатами и/или другими формами радиофармацевтической терапии, химиотерапии, наружной дистанционной лучевой терапии или хирургии для лечения злокачественных опухолей.
31. Способ доставки потенциально терапевтического излучения к злокачественным клеткам-мишеням, экспрессирующим рецептор(ы), выбранные из белка, связывающего фолат, рецептора эстрогена, рецептора тестостерона и/или различных антигенов для моноклональных антител, при котором субъектам-людям посредством инъекции вводят систему конъюгации по любому из пп.1-14.
32. Способ доставки потенциально терапевтического излучения к злокачественным тканям, экспрессирующим рецептор(ы), где злокачественная ткань представляет собой рак головного мозга, легкого, шейки матки, яичника или молочной железы либо лейкемию, лимфому или злокачественную меланому, при котором субъектам-людям посредством инъекции вводят систему конъюгации по любому из пп.1-14.
33. Набор для изготовления системы конъюгации по любому из пп.1-14, отличающийся тем, что он содержит флакон, содержащий раствор липосом, и флакон, содержащий радионуклид в растворе, которые можно смешивать, чтобы способствовать радиоактивному мечению.
34. Набор для изготовления системы конъюгации по любому из пп.1-14, отличающийся тем, что он содержит флакон, содержащий раствор липосом, второй флакон, содержащий радионуклид в растворе, и третий флакон, содержащий молекулу, обладающую аффинностью к рецептору, которые можно смешивать, чтобы способствовать радиоактивному мечению и мечению молекулой, обладающей аффинностью к рецептору.
Текст
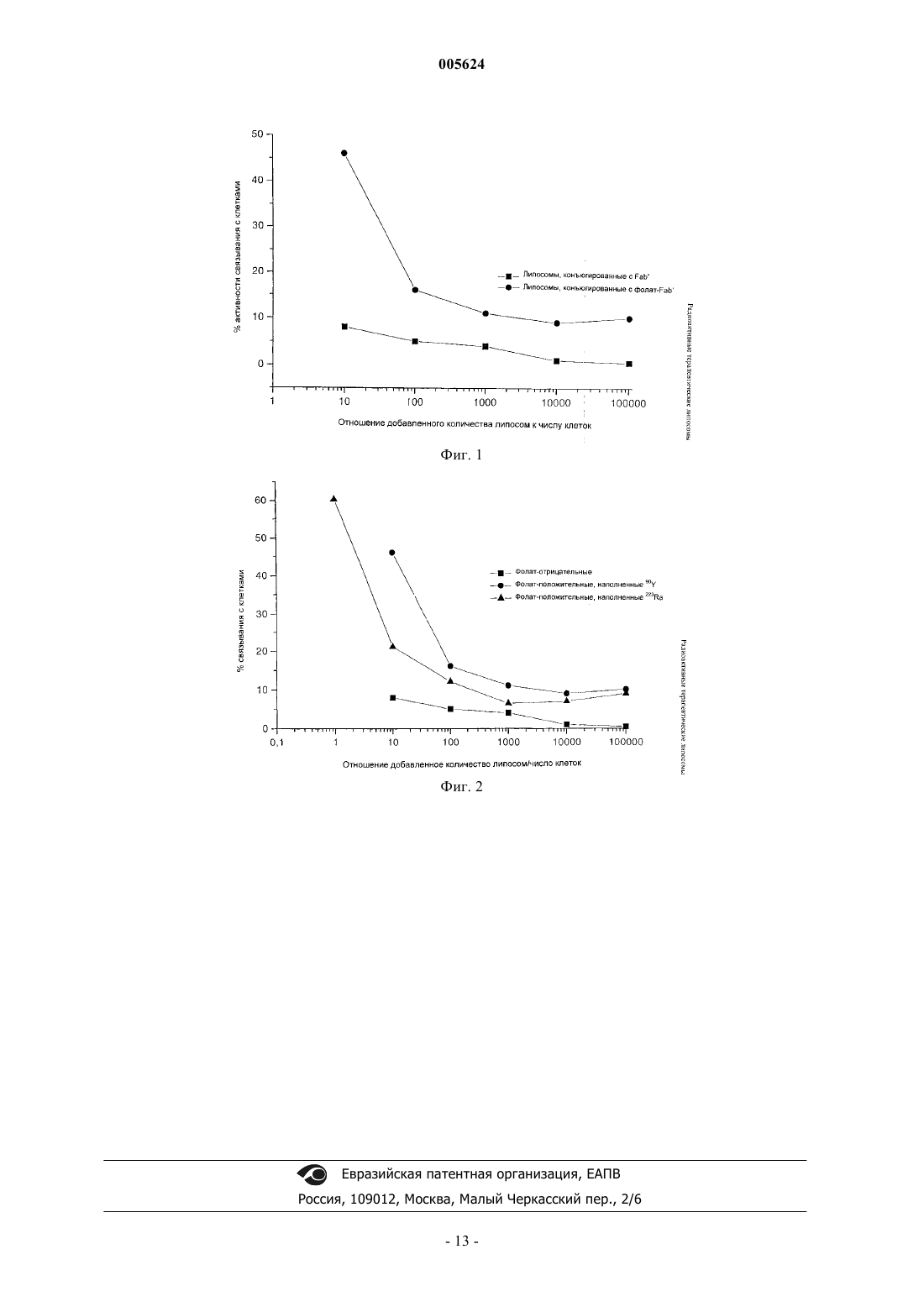
005624 Настоящее изобретение относится к системе конъюгации, содержащей липосомы с ионофорами и с хелатообразующим соединением, помещенными внутрь липосом, где эти липосомы являются стабильно меченными тяжелыми радионуклидами, излучающими -частицы. Кроме того, настоящее изобретение относится к способу приготовления данной системы конъюгации и к применению этой системы, а также к набору для приготовления этой системы. Биомедицинское применение радионуклидов в противораковой терапии до сих пор сосредоточено на применении катионных или анионных изотопов, например [131I]йодида против рака щитовидной железы и 89Sr для временного облегчения боли вследствие скелетных метастазов рака, и на применении главным образом бета-излучающих радионуклидов, связанных с моноклональными антителами (DeVita et al.,1996). Применение направленной терапии радионуклидами против рака основано на возможности поиска способов связывания радионуклидов со специфичными для опухоли соединениями-носителями (Gaze,1996). Сегодня некоторые радионуклиды с полезными радиационными характеристиками невозможно применять при направленном лечении опухоли в связи с проблемой, обеспечивающей химически стабильную связь между радионуклидом и соединением-носителем. Новые системы носителей могут, однако, расширить как применение радиоизотопов, так и арсенал радионуклидов, которые считаются полезными для терапии (Gaze, 1996). Липосомы с рецепторными аффинными группами, присоединенными к поверхности, или без таких групп, разработаны для доставки лекарств, и их в настоящее время применяют клинически для доставки химиотерапевтических агентов при некоторых формах рака. Недавние разработки при исследовании липосом привели к новым вариантам, обладающим фармакокинетикой, которая может сделать эти соединения полезными в качестве носителей для радионуклида для внутренней радиотерапии против рака(Gabizon, 1995). Эти недавние разработки в изготовлении препаратов и производстве липосом привели в результате к созданию малых везикул размером менее чем 100 нм с пролонгированным периодом циркуляции в крови, поскольку размер липосом можно лучшим образом ограничить до небольших диаметров с помощью использования экструзии через мембраны. Кроме того, введение липосом с привитым полиэтиленгликолем (ПЭГ) уменьшило взаимодействие с белками плазмы и, следовательно, уменьшило распознавание и клиренс в результате воздействия макрофагов ретикулоэндотелиальной системы (Maruyama et al., 1997). Тем самым были достигнуты повышенные уровни поглощения опухоли благодаря постоянной концентрации в крови. Даже последующее поглощение опухоли достигнуто с помощью конъюгации молекул, обладающих аффинностью к рецепторам, например моноклональных антител или фолата, с поверхностью липосом. Кроме того, некоторые исследования показали преимущество применения ПЭГ в качестве линкера между липосомой и лигандом мишени, поскольку это также может улучшить доступность рецептора (например, Maruyama et al., 1997; Gabison et al., 1999; Lee et al., 1994). Липосомы были исследованы ранее в качестве носителей для радиоизотопов (Goins et al., 1998;Turner et al., 1988). Pikul et al. (1987) сообщили об исследовании на основе 212 Рb-декстрана, включенного пассивно (то есть 212 Рb-декстран добавляли во время образования липосомы и фракцию 212 Рb-декстрана включали вместе с водной фазой, представляющей собой внутреннюю часть липосомы). Эти авторы не высказали предположения, что такие липосомы являются подходящими для терапии рака, но использовали их прежде всего для исследования внутриклеточного лизиса клетки радиоизотопом in vitro. Никаких данных о судьбе 212Bi, образованного в результате распада 212 Рb, представлено не было, а размер липосом составлял порядка 350-500 нм, что является очень большим по сравнению с размером (примерно 100 нм),который считается в настоящее время оптимальным для терапии опухоли in vivo (Forssen, 1997). Кроме того, эти липосомы не содержали ПЭГ в мембране.Ogihar-Umeda et al. (1996) использовали липосомы в качестве носителя для гамма-излучающих радионуклидов 67Ga, 111In и 99mТс и предложили применение радиоактивно меченых липосом для визуализации. В теоретическом исследовании Kostarelos et al. (1999) предложили применение липосом, меченных потенциально терапевтическими радионуклидами 131I, 67Cu, 188Re и 211At, но химические методики для получения этих радиоактивно меченых липосом не были предложены. В ЕР 386146 В 1 описана композиция и способ применения соединений, инкапсулированных в липосомы, для терапии опухоли путем захвата нейтронов. Однако, в эти липосомы вводили стабильные элементы (например бор), которые становятся радиоактивными только после активации, и эти липосомы не содержали ни ионофоры, ни хелатообразующее соединение.DTPA (диэтилентриаминпентауксусная кислота), которое представляет собой иное хелатообразующее соединение по сравнению с хелатообразующими соединениями, описанными в настоящем изобретении. Кроме того, удерживание материнского/дочернего нуклида (нуклидов) не описано и, кроме того, 90Y не является тяжелым элементом в отличие от элементов, описанных в настоящей заявке. Для достижения достаточно стабильного радиоактивного мечения носителей тяжелыми альфаизлучающими радионуклидами обычно необходимы специальные химические методики, специально приспособленные к соответствующей химии каждого элемента, и такие способы не известны. Нельзя-1 005624 ожидать, что методики, использованные для радиоактивного мечения, например, Ga, In, Тс, Сu или Re,будут совместимы с тяжелыми (атомная масса выше 150) катионными альфа-излучающими радионуклидами, подобными, например, 212/213Bi, 212Pb, 223/224Ra, 227Th или 225 Ас. Следовательно, задача настоящего изобретения заключается в том, чтобы предложить систему конъюгации радионуклид-липосома с рецепторными аффинными группами или без рецепторных аффинных групп, которая (1) инкапсулирует хелатообразующее соединение и тяжелый радионуклид (радионуклиды), который(ые) испускает(ют) альфа-частицы, (2) может удерживать дочерний нуклид (нуклиды), когда материнский нуклид (нуклиды) включен(ы) в липосому, и (3) может быть получена с помощью методики активного включения, подходящей для панели радионуклидов; а также в том, чтобы предложить применение такой системы и набор для приготовления такой системы. Эти задачи достигнуты настоящим изобретением, охарактеризованным прилагаемой формулой изобретения. Настоящее изобретение относится к системе конъюгации, содержащей липосомы с ионофорами, то есть агентом для липосом, экстрагирующим металл, и с хелатообразующим соединением и тяжелым радионуклидом (радионуклидами) (атомная масса более 150), помещенными внутрь липосом. Эти липосомы получают, используя активное включение радионуклида, то есть посредством ионофоров, и их приготавливают согласно методикам, дающим в результате липосомы, имеющие типичный размер 100 нм. Полученный в результате продукт проявляет хорошую химическую стабильность в течение нескольких суток и может также удерживать дочерний нуклид (нуклиды) внутри липосомы, например в результате превращения 212 Рb в 212Bi. Эти липосомы можно получить с модифицирующими группами, подобными полиалкиленоксидам, например ПЭГ, связанными с мембраной, либо без таких групп. В настоящем изобретении авторами также описан способ связывания таких радиоактивно меченых липосом с белками,распознающими опухоль, такими как, например, моноклональные антитела, конъюгированные с фолатом. Далее настоящее изобретение будет описано более подробно со ссылкой на фигуры и примеры. Фиг. 1 - связывание ПЭГилированных липосом, содержащих либо антитело Fab', либо меченное фолатом антитело Fab, конъюгированное с мембраной липосомы, с клетками OVCAR 3; фиг. 2 - связывание фолатированных ПЭГ-липосом с клетками OVCAR 3 по сравнению со связыванием нефолатированных ПЭГ-липосом. В целях разработки радиоактивно меченых липосом, которые являются подходящими для терапии рака, авторы настоящего изобретения исследовали получение и применение липосом, в которые включены тяжелые радионуклиды (то есть, атомная масса более 150), излучающие альфа-частицы, на основе радионуклидов 212Bi, 213Bi, 223Ra, 224Ra, 225Ac, 212Pb и 227Th. Используя липосомы (везикулы) с ионофорами, радиоактивно меченые липосомы предпочтительно с хелатообразующим соединением (то есть, липосомы, инкапсулирующие радионуклид и хелатообразующее соединение) получали путем использования активного включения радионуклида, и приготавливали их согласно методикам, дающим в результате липосомы типичного размера 100 нм. Однослойные везикулы получали путем гидратации тонкой липидной пленки и экструзии (Olson etal., 1979, Mac Donald et al., 1991) следующим образом: DSPC (дистеароилфосфатидилхолин) и холестерин в молярном отношении 2:1, типично 10 и 5 мкмоль, соответственно, растворяли в хлороформе в круглодонной колбе. Растворитель удаляли роторным выпариванием с использованием пониженного давления. Затем сухую липидную пленку подвергали гидратации в 0,5-1 мл 150 мМ лимонной кислоты,30 мМ DOTA (1,4,7,10-тетраазациклододекан-1,4,7,10,N,N',N",N'"-тетрауксусной кислоты), рН 4. Полученную в результате суспензию подвергали пяти циклам замораживания и оттаивания с последующей повторной экструзией через поликарбонатные фильтры с размером пор 100 нм 5 раз и с размером пор 50 нм 5 раз, используя ручной прибор для экструзии (Avestin, Ottawa, Canada). Концентрация липидов в продукте составляла 30 мМ. Перед включением радионуклида в липосомы внешний раствор заменяли путем элюции на колонке PD-10 на 250 мМ сахарозу, 20 мМ HEPES (N-2-гидроксиэтилпиперазин-N'-2 этансульфоновая кислота), рН 7,4. Составные части липосомы: а) Внутренняя водная среда: рН 1-14, предпочтительно 2-9, более предпочтительно 4-5. Компоненты: вода, агенты, способные к поддержанию желаемого рН во внутренней водной среде в течение желаемого временного интервала, то есть до тех пор, пока не начинается опосредованное ионофором включение радиоактивного металла (металлов). Предпочтительно, эти компоненты внутренней водной среды также приводят в результате к комплексообразующей функции радиоактивного металла (металлов). На это можно воздействовать путем 1) например, электростатических донорных функциональных групп агентов, используемых для регулирования рН, например, атома (атомов) кислорода в ацетате, цитрате и родственных соединениях; 2) дополнительного содержания комплексообразующего агента во внутренней водной среде, например, ЭДТА, DTPA, DOTA, DOTMP и родственных соединений. б) Ионофор: например, агент, способный к транспортировке, по существу необратимой, радиоактивного металла через липидный бислой из внелипосомной фазы во внутреннюю часть липосомы. При-2 005624 меры: ионофоры, для которых показано, что они функционируют желаемым способом: ионофор кальция А 23187, дициклогексил 18-С 6, бибензо-18-С 6, 2,3-димеркапто-1-пропанол, Рb-ионофор. в) Компоненты липидного бислоя: компоненты липидного бислоя предпочтительно приводят в результате к смеси, способной к образованию везикул, и для которой температура перехода жидкость твердое вещество выше физиологической температуры; например, 1) фосфолипиды. Примеры: алкилфосфатидилхолины с длинной цепью, например 1,2-дилуароил-sn-глицеро-3-фосфохолин (DLPC), 1,2 димиристоил-sn-глицеро-3-фосфохолин (DMPC), 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (DPPC),1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC), 1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC), 1 пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин (РОРС); 2) стерины или соединения, обладающие подобными свойствами, при которых они придают жесткость липидному бислою (уменьшают текучесть липидного бислоя). Примеры: Соединения класса стеринов: холестерин и холестерин-3-сульфат, и 3) (стерический) стабилизатор (стабилизаторы) in vivo для повышения свойств нацеливания этой конструкции на опухолевую клетку и увеличения времени нахождения в крови, например, полиэфиры, полиэтиленгликоли. Включение ПЭГ и/или производных ПЭГ в препараты липосом даст преимущества в отношении сниженного клиренса инъецированных липосом из системы кровообращения ретикулоэндотелиальной системой. Обычно в препарат включают от 3 до 10 мол.% по отношению к фосфолипиду. Количество стабилизатора, необходимое для получения желаемого стабилизирующего эффекта, однако, зависит от мономера (электростатических и полярных свойств) и числа повторяющихся единиц, то есть от длины цепи. Примеры (ПЭГ и/или производные ПЭГ): 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин-N[поли(этиленгликоль) 2000] (PEG2000 DJ/1 РЕ), 1,2-дипальмиоил-sn-глицеро-3-фосфоэтаноламин-N[поли(этиленгликоль) 2000] (PEG2000 DPPE), 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N[поли(этиленгликоль)2000] (PEG2000 DSPE). г) Компоненты, способствующие такой модификации конструкций, чтобы обладать свойствами нацеливания на опухолевую клетку: Выбор подходящего активированного липида будет определяться природой гаптена, а также потребностями исследования. Эффективность этого взаимодействия будет определяться уходящей группой, гидрофильной пространственной группой, свойствами материала липосомы и концентрацией реагентов. Для исследований in vivo, при которых необходимо, чтобы гаптен оставался связанным с липосомой, отдельных преимуществ можно добиться путем выбора липидных якорей с более длинной ацильной цепью, которые медленнее обмениваются между мембранами. Кроме того, ковалентная связь между гаптеном и липидным якорем должна быть устойчивой как к химическому, так и к ферментативному расщеплению. Активированные липиды могут функционировать с образованием, например, аминной, амидной, тиоэфирной или дисульфидной связей между липидом и модификатором. Если в препарат включают стерические стабилизаторы, например ПЭГ и/или производные ПЭГ, эта группа,функционирующая как связывающая, предпочтительно находится на конце соединения, идентичного или подобного стабилизатору, и имеет эффективную длину цепи, равную или большую, чем длина цепи стабилизатора. Примеры: Компоненты везикулы, способствующие такой модификации конструкций из ПЭГ и/или производных ПЭГ, чтобы обладать свойствами нацеливания на опухолевую клетку:(PDP-PEG2000-DSPE), N-[w-[4-(пара-малеимидофенил)бутаноил]аминополи(этиленгликоль)2000]-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (MpB-PEG2000-DSPE). Отделение радионуклида, связанного с липосомой, от несвязанного радионуклида было достигнуто путем использования эксклюзионной хроматографии (Mauk and Gamble 1979, Tilcock et al., 1991). Для разделения после методик наполнения липосом использовали колонки для эксклюзионной хроматографии PD-10. Из нанесенных на колонки PD-10 объемов 1 мл или менее липосомы элюировали в первых 4,5 мл. Радионуклиды, не связанные с липосомами, элюировали во фракции, соответствующей изотопам низкой молекулярной массы. Колонки PD-10 также использовали при исследовании стабильности (в отношении удерживания радионуклидов) наполненных липосом в PBS (фосфатно-солевом буферном растворе). Отделение радионуклидов, связанных с липосомой, от свободных радионуклидов в сыворотке осуществляли путем эксклюзионной хроматографии на колонке с Сефарозой CL-4B (Hwang and Mauk,1977). Посредством этого можно получить растворы, содержащие радиоактивные липосомы, диспергированные в жидком носителе, по существу свободном от несвязанных радионуклидов. ЭДТА (этилендиамин-N,N'-тетрауксусную кислоту) добавляли перед хроматографическими методиками, чтобы стабилизировать свободный радионуклид в таком состоянии, что его можно легко отделить от фракции, связанной с липосомой. Выход радионуклидного наполнения для радионуклидов, связанных с липосомой, и латентность радионуклидов, связанных с липосомой, устанавливали путем гамма-спектроскопии для 228 Ас, 223Ra,212Pb, 212Bi, 205Bi и 207Bi,228Ac и 205/207Bi использовали в качестве изотопного индикатора для потенциально терапевтически полезных радионуклидов 225 Ас, 212Bi и 213Bi, соответственно. Авторы настоящего изобретения сделали значительное и неожиданное открытие того, что 212Bi не претерпевает значительного перехода после распада 212 Рb, включенного в данный тип липосом. Текущее-3 005624 состояние применения 212 Рb в качестве молекулярно сшитого генератора для 212Bi указывает на то, что значительное высвобождение (30%) обычно происходит из хелатообразующего соединения (McClureand Feinendegen, 1998; Mirzadeh et al., 1993). Однако, посредством захвата 212Pb при высокой концентрации хелатообразующего соединения, как например внутри липосомы, высвобождения дочернего продукта можно избежать, предложив систему конъюгации, которую можно использовать для захвата дочернего нуклида после ядерного превращения. Сообщают о том, что эта система является первой наработкой системы конъюгации для 212 Рb, которая может удерживать дочерний нуклид 212Bi почти количественно. Таким образом, настоящее изобретение относится к липосомам с ионофорами, которые содержат радионуклид и хелатообразующее соединение, помещенные внутрь липосомы (система конъюгации), и причем эта система конъюгации может или не может удерживать дочерний нуклид. Хелатообразующее соединение по настоящему изобретению может быть выбрано из группы, содержащей 1,4,7,10-тетраазациклододекан-1,4,7,10-N,N',N",N"'-тетрауксусную кислоту (DOTA),1,4,7,10-тетраазациклотридекан-1,4,7,10-N,N',N",N'"-тетрауксусную кислоту (TRITA),1,4,7,10-тетраазациклотетрадекан-1,4,7,10-N,N',N",N"'-тетрауксусную кислоту (ТЕТА),1,4,7,10-тетраазациклододекан-1,4,7,10-N,N',N",N'"-тетра(метилен)фосфоновую кислоту (DOTMP),1,4,7,10-тетраазациклотридекан-1,4,7,10-N,N',N",N"'-тетра(метилен)фосфоновую кислоту,1,4,7,10-тетраазациклотетрадекан-1,4,7,10-N,N',N",N"'-тетра(метилен)фосфоновую кислоту,диэтилентриамин-N,N',N"-пентауксусную кислоту и их изомерные производные, криптат[2,2,2],криптат[3,2,2], криптат[2,2,1] и их моно- и дибензопроизводные, соединенные мостиковой связью каликс[4]арены, содержащие богатые электронами (донорные) группы (гидроксил, карбоксил, эфир, амид,амин),1,10-диаза-4,7,13,16-тетраоксациклооктадекан-1,10-N,N'-бис-уксусную кислоту и 1,10-диаза-4,7,13,16-тетраоксациклооктадекан-1,10-N,N'-бис-малонат. Другим важным и удивительным открытием было то, что липосомы по настоящему изобретению могут эффективно включать и удерживать 223Ra. Впервые описана система конъюгации, потенциально полезная для направленного лечения опухоли радием-223. Кроме того, авторами изобретения показано,что висмут и актиний также могут включаться и сильно удерживаться в описанном в настоящее время типе липосом, что указывает на то, что можно также получить системы конъюгации на основе 212Bi, 213Bi и 225 Ас. Систему конъюгации по настоящему изобретению можно приготовить либо с модифицирующими поверхностными группами, например ПЭГ, в мембране липосомы (включающие ПЭГ/ПЭГилированные липосомы), либо без таких групп. Преимущество включения ПЭГ в мембрану состоит в том, что он дает некоторые ПЭГ-реакционноспособные группы, которые дают возможность конъюгации белков, таких как, например, антитела, фрагменты антител или конструкции фолата, либо другие аффинные к рецептору (связывающие рецептор) белки/молекулы. Далее настоящее изобретение относится к новому типу липосом с белками, связывающими рецептор, присоединенными к мембране липосомы. Здесь авторами изобретения описаны радиоактивно меченые липосомы; включающие ПЭГ, конъюгированные с меченными фолатом антителами. Применение фолата и производных фолата для нацеливания на опухоли, экспрессирующие белки, связывающие фолат (FBP), гликозил-фосфатидил-инозитол-сшитый белок клеточной мембраны, вовлеченный в клеточный захват окисленных фолатов посредством эндоцитоза, привлекло внимание среди исследователей(Kranz et al., 1996; Reddy et al., 1998; Shinoda et al., 1998; Trippet et al., 1999). Поскольку показано, что некоторые типы человеческих раковых клеток обладают сверхэкспрессией FBP, этот рецептор может представлять собой возможную мишень для доставки терапевтических радиоизотопов, конъюгированных с фолатом. Таким образом может быть достигнута направленная терапия против рака радионуклидами посредством использования антител, конъюгированных с фолатом. Кроме того, если меченный фолатом сайт связывания антигена антителами направлен против антигена, ассоциированного с опухолью,отличного от FBP, достигнута двойная связывающая активность (то есть достигнута аффинность как к антителу-антигену, так и к рецептору FBP). По мнению авторов изобретения впервые описана конъюгация меченных фолатом антител. Меченные фолатом антитела, конъюгированные с липосомами, по настоящему изобретению, можно дополнительно метить радионуклидом или смесью различных радионуклидов, чтобы повысить эффективность радиотерапии. В настоящем изобретении показано, что эту новую комбинацию меченных фолатом антител, конъюгированных с липосомами, можно применять для нацеливания радионуклида (радионуклидов) на клетки, экспрессирующие рецепторы фолата. Это является особенно полезным при излучателях альфачастиц, которые представляют собой источники излучения радиации с высокой линейной передачей энергии (high-LET), которые являются крайне цитотоксичными для клеток млекопитающих (Hall, 1994;Larsen et al., 1998; Ritter et al., 1977). Однако, источник альфа-излучения может доставлять излучение в чрезвычайно малую область по сравнению с другими типами излучения. Таким образом, если источник альфа-излучения можно направлять к ткани-мишени, воздействие на нормальную ткань может быть уменьшено.-4 005624 Систему конъюгации по настоящему изобретению можно также применять для нацеливания на клетки, экспрессирующие, например, рецептор эстрогена или рецептор тестостерона, посредством конъюгации антител с эстрогеном или тестостероном. Меченые антитела, используемые согласно настоящему изобретению, предпочтительно представляют собой антитела класса IgG или IgM, и/или их фрагменты, и/или их конструкции (например, миниантитела). Кроме того, эти антитела и/или фрагменты, и/или конструкции могут быть мышиными, химерными или полностью гуманизированными, поликлональными или моноклональными. Настоящее изобретение также относится к применению системы конъюгации по настоящему изобретению для изготовления фармацевтического раствора, подходящего для инъекции или инфузии млекопитающим, включая людей, путем внутривенного и/или регионарного, и/или внутриопухолевого пути введения. Этот фармацевтический раствор можно применять в комбинации с радиоиммуноконъюгатом или несколькими радиоиммуноконъюгатами и/или другими формами радиофармацевтической терапии,химиотерапии, наружной дистанционной лучевой терапии или хирургии, для лечения злокачественных опухолей. Настоящее изобретение также относится к способу применения системы конъюгации по настоящему изобретению для лечения злокачественных опухолей, таких как, например, рак головного мозга, легкого, шейки матки, яичника или молочной железы, либо лейкемия, лимфома или злокачественная меланома. Настоящее изобретение также относится к набору для приготовления системы конъюгации по настоящему изобретению, включающему в себя флакон, содержащий раствор липосом, и второй флакон,содержащий радионуклид в растворе, которые можно смешивать, чтобы способствовать радиоактивному мечению. Кроме того, их можно смешивать с третьим флаконом, содержащим белки и/или молекулы,обладающие аффинностью к рецептору, для получения аффинной к рецептору системы конъюгации. Реагенты и оборудование Гамма-спектроскопию осуществляли с использованием германиевого детектора (Canberra, Meriden, CT,USA), соединенного с многоканальным анализатором (EGG ORTEC, Oak Ridge, TN, USA). Beckmann LS 6500(Beckmann, Fullerton, CA, USA) использовали для подсчета жидкостной сцинтилляции. DSPC и холестерин приобретали у Northern Lipids (Vancouver, Canada). Колонки PD-10 с сефадексом G-25 (Amersham Pharmacia BiotechAB, Uppsala, Sweden) использовали для очистки радиоактивно меченых липосом. Макроциклическое хелатообразующее соединение DOTA использовали в качестве внутрилипосомального хелатообразующего соединения и приобретали у Macrocyclic (Richardson, TX, USA). В данном исследовании использовали ультрачистые HNO3 (J. Т. Baker, Phillipsburg, NJ, USA), 6M HCl (Fisher Scientific, Pittsburgh, PA, USA) и бис(2-этилгексил)-фосфорную кислоту (HDEHP) от Fluka (через Sigma-Aldrich AS, Norway). Все буферы, используемые для опосредованного ионофором катионного наполнения липосом, доводили до желаемого значения рН, используя аргинин (свободное основание). Всю используемую воду получали из системы очистки воды Milli-Q (Millipore, Bedford, MA, USA). Ионообменные смолы были предоставлены BioRad (Hercules, CA, USA). Смолы предварительно готовили путем промывки водой, затем 6 М HCl, а затем ацетоном и, наконец, водой. Смолы хранили в воде перед набивкой колонок. Используемый ДМСО хранили с ситами 4 . 232Th(NO3)4, используемый в данной работе, хранили в течение более чем 20 лет. Образец был предоставлен Nuclear Chemistry Group, Department of Chemistry University of Oslo, Oslo, Norway. 3 Н-фолиевую кислоту приобретали у Amersham Pharmacia Biotech (Buckinghamshire, UK). Все остальные химические реактивы приобретали у Sigma-Aldrich, Norway. В табл. 1 показаны некоторые физические свойства радионуклидов, используемых в экспериментах с липосомами. Таблица 1 Для каждого радионуклида в списке приведено только наиболее преобладающее гаммаизлучение.-5 005624 Данные из Nuclear Data Sheets, Academic Press INC. Наилучшая методика Липосомы, полученные согласно описанным методикам, наполняли радием-55 или свинцом-212. После этого антитела подвергали взаимодействию с липосомами с получением молекул антител на поверхности липосом. Следует добиваться размера липосом примерно 100 мкм, что будет подходящим для системной доставки, но типичные размеры 200-1000 мкм можно использовать для внутриполостной доставки, например для лечения внутричерепной опухоли мозга или для лечения внутрибрюшинного рака яичника. (Больший размер липосом будет замедлять скорость клиренса из полости, в которую инъецируют препарат, поддерживая тем самым высокую концентрацию в месте опухоли). Примеры Пример 1. Включение 212Pb/212Bi в липосомы Способы: 212Pb/212Bi получали посредством эманации 220Rn из источника 228Th, как описано Hassfjelland Hoff (1994). 212Pb/212Bi без добавления носителя выщелачивали из коллектора, используя 0,1 М HNO3,и этот раствор наносили на колонку 2x20 мм с катионообменной смолой AG 50W-X4. Затем 212Pb/212Bi элюировали в 2 М HCl, и этот раствор упаривали до сухого состояния. Затем 212Pb/212Bi растворяли в 200 мкл 10 мМ раствора ацетата, рН 5. 212 Рb количественно определяли путем измерения его гаммаизлучения 238,6 кэВ (табл. 1). 212Bi количественно определяли измерением гамма-излучения 583,1 кэВ его дочернего 208Tl при радиоактивном равновесии. Результаты: Обнаружено, что менее чем 0,2% добавленной активности было связано с липосомами в течение периодов инкубации вплоть до 3 суток. Липосомы, соответствующие концентрации липидов 30-60 мМ, энергично перемешивали с пленкой ионофора А 23187 (10-13 нМ). Затем добавляли примерно 1 МБк 212Pb/212Bi, и эту смесь инкубировали при 75 С в течение 30 мин с последующей элюцией на колонке PD-10. Затем фракцию, содержащую более чем 95% наполненных везикул, элюировали на второй колонке PD-10. Латентность связанного с липосомой 212Pb/212Bi исследовали с помощью инкубации везикул при 37 С в человеческой сыворотке илиPBS. За распределением активности следили в течение периода 24 ч. Результаты: Эффективность включения 212 Рb: 34,8% (n=3). Удерживание измеряли с помощью гамма-спектроскопии, и более чем 99% 212 Рb было связано с липосомами в течение периодов инкубации вплоть до 24 ч. Пример 2. Удерживание 212Bi, образованного в результате распада связанного с липосомами 212 Рb Способы: Липосомы наполняли 212 Рb, как описано выше. Связанную с липосомами радиоактивность выделяли путем элюции реакционной смеси 10 мМ ЭДТА в PBS на колонке PD-10, предварительно уравновешенной 10 мМ ЭДТА в PBS. Через 3 ч, чтобы обеспечить, что переходное равновесие между 212 Рb и 212Bi установилось, аликвоты этого раствора наносили на колонки PD-10, предварительно уравновешенные 10 мМ ЭДТА в PBS, для отделения свободных радионуклидов от связанных с липосомами радионуклидов. За распределением активности следили в течение периода 24 ч. Отдельную аликвоту меченых липосом, которые не подвергались процедуре отделения (идентичной геометрии полученных в результате хроматографических методик), измеряли для использования в качестве стандарта. Это осуществляли для того, чтобы установить отношение активности 212Bi/212Pb при радиоактивном равновесии. Результаты: В результате сравнения отношения 212Bi/212Pb, полученного для хроматографически выделенных липосом, с отношением равновесной смеси, было установлено, что более чем 95% 212Bi показывает удерживание в липосомах после распада связанного с липосомами 212 Рb. Кроме того, сравнивали измерения активности 212Bi в двух полученных при хроматографии фракциях. Более чем 99% суммарной активности 212Bi элюировалось во фракции, соответствующие липосомам. Пример 3. Исследование возможного повторного включения Рb и Bi в липосомы Способы: Липосомы, соответствующие концентрации липидов 30-60 мМ, включающие 150 мМ лимонной кислоты, 30 мМ DOTA, и использующие внешний раствор, содержащий 10 мМ ЭДТА в PBS,добавляли к пленке ионофора А 23187 (20-26 нмоль на внутренней поверхности стеклянного сосуда). Затем добавляли 212 Рb и 212Bi в PBS с последующей инкубацией при 37 С. Аликвоты этого раствора элюировали через колонки PD-10, и полученные с помощью хроматографии фракции, соответствующие элюату с липосомами, анализировали с помощью внутреннего Ge-детектора. Результаты: Никакого обнаружимого включения ( 1%) 212 Рb и 212Bi не наблюдали в течение периода времени 24 ч. Пример 4. Включение 223Ra в липосомы 223Ra продуцировали генератором на основе 227 Ас, как описано (Larsen and Henriksen, 1999). Вкрат 227 це, Ас и его дочерний нуклид 227Th удерживались на колонке с хроматографической смолой для экстракции, способствующей элюции 223Ra при использовании минеральной кислоты. Для включения радия в липосомы этот элюированный раствор из генератора упаривали до сухого состояния, а затем 223Ra растворяли в 5 мМ цитрате, рН 7,4.-6 005624 Липосомы, соответствующие концентрации липидов 30-60 мМ, энергично перемешивали с пленкой ионофора А 23187 (10-13 нмоль на внутренней поверхности стеклянного сосуда). После этого добавляли примерно 50 кБк 223Ra, и эту смесь инкубировали при 75 С в течение 20 мин. Затем эту реакционную смесь добавляли к 100 мкл 10 мМ ЭДТА и элюировали на колонке PD-10 для выделения радиоактивности, связанной с липидными везикулами. Удерживание связанного с липосомами 223Ra исследовали с помощью инкубации везикул при 37 С в человеческой сыворотке (Sigma) или 5 мМ ЭДТА в человеческой сыворотке при концентрации липосом 0,3 мг суммарного липида/мл сыворотки. Результаты представлены в табл. 2 и демонстрируют, что 223Ra очень стабильно удерживается в липосомах. Пример 5. Определение, вносит ли повторное включение вклад в эксперимент по удерживанию 223Ra Способы: Липосомы, соответствующие концентрации липидов 30-60 мМ, образованные гидратацией липидных пленок со 150 мМ лимонной кислоты, 30 мМ DOTA, внешний раствор PBS или сыворотки,добавляли к пленке ионофора А 23187 (10-13 нмоль, распределенные на внутренней поверхности стеклянного сосуда). Затем добавляли 223Ra в 5 мМ цитрате, рН 7,4, с последующей инкубацией при 37 С. Аликвоты этого раствора наносили на колонки PD-10, и полученную с помощью хроматографии фракцию, соответствующую липосомам, анализировали с помощью внутреннего Ge-детектора. Пример 6. Включение 207Bi в липосомы Способы: 203-207Bi продуцировали с помощью реакций (р. хn) на природных свинцовых мишенях и очищали, используя хроматографическую смолу для избирательной экстракции свинца (Henriksen andHoff, 1998). Смесь изотопов Bi, состоящую главным образом из 205Bi и 207Bi, обозначенную здесь далее как 207Bi,использовали в данном исследовании. 50 мкл раствора 207Bi в 10-4 М HCl добавляли к липосомам, соответствующим концентрации липидов 30-60 мМ, которые предварительно смешивали с пленкой ионофора А 23187 (10-13 нмоль на внутренней поверхности стеклянного сосуда) и инкубировали в течение 30 мин при 75 С. Затем эту реакционную смесь добавляли к 100 мкл 10 мМ ЭДТА и элюировали на колонкеPD-10 для выделения радиоактивности, связанной с липидными везикулами. Результаты: Обнаружено, что 32% суммарного 207Bi связано с липосомами. Пример 7. Включение 228 Ас в липосомы Способы: 228 Ас выделяли из препарата 232 Тh(NО 3)4 путем комбинирования экстракции растворителем и ионного обмена. 232Th(NO3)4 (исходно 4 Н 2 О) растворяли в 20 мл 0,1 М НNО 3 и добавляли в делительную воронку объемом 500 мл и приводили в контакт с 5x100 мл 2 М раствора HDEHP в гептане. Затем водную фазу промывали три раза гептаном и после этого наносили на колонку 3x40 мм с катионообменной смолой AG50W-X12 для выделения 228 Ас, как описано (Cabell, 1959). С этой колонки 212Pb, 212Bi,224Ra и 228Ra элюировали в 3 М НNО 3, и этот раствор оставляли в течение 20 ч. Затем этот раствор упаривали до сухого состояния с последующим выщелачиванием радионуклидов из сосуда 1 мл 1 М HNO3. Этот раствор наносили на колонку 3x40 мм с AG50W-X12. Снова 212Pb, 212Bi, 224Ra и 228Ra элюировали в 3 М HNO3. 228 Ас элюировали в 6 М HNO3, и этот элюат упаривали до сухого состояния. Затем 228 Ас выщелачивали из сосуда, используя 200 мкл 5 мМ HNO3. Примерно 6 кБк 228 Ас добавляли к липосомам, содержащим ионофор А 23187, как описано выше, и инкубировали в течение 60 мин при 75 С. Затем эту реакционную смесь добавляли к 100 мкл 10 мМ ЭДТА и элюировали на колонке PD-10 для выделения радиоактивности, связанной с липидными везикулами. Фракции, соответствующие более чем 95% наполненных везикул, объединяли, а затем элюировали на второй колонке PD-10. Липосомальное удерживание 228 Ас исследовали с помощью инкубации радиоактивно меченых везикул при 37 С в человеческой сыворотке или PBS. За распределением активности следили в течение периода 24 ч. Результаты: В эксперименте по включению 90-95% добавленного 228 Ас (скорректировано с учетом распада во время мечения и очистки) было связано с липосомами после процедуры включения. В эксперименте по удерживанию обнаружено, что более чем 98% 228 Ас связано с липосомами в течение периодов инкубации вплоть до 24 ч.-7 005624 Пример 8: Включение 90Y Способы: 90Y в данном примере использовали в качестве изотопного индикатора для исследования поведения радиоактивно меченых липосом. 90Y и 90Sr в данном исследовании измеряли с помощью подсчета жидкостной сцинтилляции. 90Y выделяли из 90Sr посредством хроматографической смолы для избирательной экстракции стронция, как описано Dietz and Horwitz (1992). Здесь 90Sr (Amersham, Buckinghamshire, England) в 0,1 MHNO3 упаривали до сухого состояния, и к остатку добавляли 3 М HNO3. Этот раствор наносили на колонку 3x20 мм со Sr-смолой (EiChroM, Darien, IL, USA), и колонку отмывали 5 мл 3 М HNO3. При данной процедуре избирательно элюируется 90Y, тогда как Sr достаточно удерживается на колонке до достижения более низкого содержания 90Sr в смеси 90Sr/90Y примерно в 103 раз (Dietz and Horwitz, 1992). После этого 90Sr десорбировали с колонки, используя 0,05 М НNО 3, и этот раствор оставляли на одну неделю, чтобы дать возможность 90Y кристаллизоваться. Затем этот раствор упаривали до сухого состояния и к остатку добавляли 3 М HNO3 перед разделением радионуклидов на второй колонке со Srсмолой. Элюат, содержащий 90Y, упаривали до сухого состояния, и радионуклид выщелачивали из сосуда, используя 200 мкл 5 мМ НNО 3. Этот раствор добавляли к липосомам, содержащим ионофор А 23187(как описано ранее), и инкубировали в течение 60 мин при 75 С. Затем эту реакционную смесь добавляли к 50 мкл 10 мМ ЭДТА и элюировали на колонке PD-10 для выделения радиоактивности, связанной с липидными везикулами. Фракцию, соответствующую более чем 95% везикул, элюировали на второй колонке PD-10. Липосомальное удерживание связанного с липосомами 90Y исследовали с помощью инкубации везикул при 37 С в человеческой сыворотке или PBS. За распределением активности следили в течение периода 4 суток. Результаты: Более чем 95% добавленного 90Y было связано с липосомами после 1 ч включения и очистки на колонке для гелевой эксклюзионной хроматографии. В исследовании липосомального удерживания получены следующие результаты: через 5 ч и 1 сутки более чем 99% было связано с липосомами. После 4 суток фракцию, связанную с липосомами, определили как 981%. Как показано в этих экспериментах, липосомы можно радиоактивно метить радионуклидами, излучающими альфа-частицы и/или бета-частицы, и эти радионуклиды хорошо удерживаются при физиологической температуре. Пример 9: Получение меченных Иттрием-90/Радием-223 ПЭГилированных липосом-фолат-Fab' Для данного эксперимента использовали F(ab')2 R миелома (подкласс IgG1), 14 мг/мл в PBS(Michalsen, Norwegian Institute of Public Health, Oslo, Norway). Конъюгация фолиевой кислоты с антителами Фолиевую кислоту 2 Н 2 О сначала растворяли в диметилсульфоксиде (Fluka, содержание Н 2 О менее чем 0,05%). Затем этот раствор наносили с помощью канюли на активированные сита 4(Fluka) и хранили в атмосфере аргона в темноте в течение 6-10 ч. Меченный тритием фолат (3 Н-фолат) добавляли в виде водного раствора соли калия 3 Н-фолата (1% по отношению к лимонной кислоте). Специфичная активность 3 Н-фолата, используемая для конъюгации с белком, составляла 7-7,5 ГБк/моль. 3 Н-фолат активировали для связывания с антителом F(ab')2 миеломы путем добавления 10 мольэквивалентов 1-этил-3-(3-диметиламинопропил)-карбодиимида к раствору фолата и инкубации в течение 30 мин при температуре окружающей среды. После этого 30-40-кратный молярный избыток активированного фолата добавляли к белку, 14 мг/мл в PBS, и оставляли взаимодействовать в течение 30-60 мин. Эту реакционную смесь гасили добавлением 0,2 мл 0,3 М глицина в PBS/борате, рН 8,5. Конъюгат фолат-F(ab')2 (фолат-F(аb')2) отделяли от непрореагировавшего материала, используя колонку PD-10, предварительно уравновешенную в PBS. Чтобы образовать фолат-Fab', фолат-Р(аb')2 инкубировали в 1 мМ дитиотрейтоле (DTT) при температуре окружающей среды в течение 2 ч с последующей элюцией на колонке для эксклюзионной хроматографии NAP-5. Фракцию, содержащую фолат-Fab', подвергали дезоксигенированию путем пропускания пузырьков аргона через раствор, после чего этот раствор немедленно смешивали с раствором липосом. Степень конъюгации фолиевой кислоты определяли по содержанию 3 Н очищенного белка, которое измеряли с помощью подсчета жидкостной сцинтилляции (Beckmann LS6500) в комбинации со спектрофотометрическими записями при 280 нм. Для количественного определения связанной с липосомой фракции фолат-Fab' перед взаимодействием с DTT добавляли следовое количество йодированного F(ab')2 (белок йодировали посредством lodoGen согласно стандартным методикам). Конъюгация меченых антител с липосомамиDSPE-PEG2000-MPB (Northern Lipids, VA. Canada), натриевую соль, включали в концентрации 5 мол.% от общего фосфолипида. Иначе, липосомы составляли и также готовили для стадии опосредованного ионофором катионного наполнения способом, идентичным описанному для не ПЭГилированных липосом.-8 005624 После того, как реакционную смесь оставляли достичь комнатной температуры вслед за стадией наполнения, суспензию липосом подвергали дезоксигенированию перед добавлением фолат-Fab' с получением концентрации белка 0,3-0,5 мг/мл. Концентрация липидов составляла 1-3 мМ, как определили с помощью фосфорного количественного анализа Бартлетта (Bartlett, 1958). Фолат-Fab' и липосомы оставляли взаимодействовать в течение 2 ч при температуре окружающей среды. Затем эту реакционную смесь наносили, используя колонку PD-10, уравновешенную PBS. Конъюгированные с фолат-Fab' ПЭГлипосомы хранили при 4 С в течение 12-15 ч перед использованием в анализах на связывание с рецептором фолата. Связанную с липосомами радиоактивность измеряли детектором Nal гнездового типа с поправкой на выход за пределы в соответствующих каналах из образцов двойного мечения. Образцы одиночных нуклидов и смесей нуклидов использовали в качестве сравнения. На основании измерений радиоактивности концентрацию белка переводили в число Fab' на липосому, принимая размер липосомы 100 нм и 8104 фосфолипидов/везикулы (Kirpotin et al., 1997), а молекулярную массу антитела Fab' миеломы, равную 52000. Радиоактивность, связанную с клеткой, измеряли с помощью Nal-детектора (3 более высоких концентрации для Y-90) и подсчета жидкостной сцинтилляции после добавления Insta-Gel plus (Packard)(табл. 3). Таблица 3. Связывание 90Y-липосом, конъюгированных с антителами, с фолатом или без фолата, с клетками Обнаружение 3 Н-фолата на липосомах ПЭГ-липосомы (концентрация липидов 2,5 мМ) в 20 мМ HEPES/300 мМ сахарозе подвергали взаимодействию с конъюгированными с 3 Н-фолатом Fab' (0,5 мг/мл в PBS, отношение фолат/Fab' 20,2). После 2 ч при комнатной температуре липосомы, связанные с фолат-Fab', выделяли путем элюции на колонке с Сефарозой CL-4B. Количество 3 Н-фолат-Fаb' на липосомах определяли количественно с помощью подсчета жидкостной сцинтилляции фракций, полученных хроматографически, и отношение фолат-Fаb'/липосомы определили как примерно 110. Сокращения:- 10005624 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Система конъюгации, отличающаяся тем, что она представляет собой липосому с ионофорами и с хелатообразующим соединением, помещенными внутрь липосомы, причем в указанную липосому дополнительно инкапсулируют тяжелый(ые) радионуклид(ы), излучающий(ие) -частицы, или 212 Рb в качестве генератора для -излучателя 212Bi. 2. Система конъюгации по п.1, отличающаяся тем, что концентрация хелатообразующего соединения внутри липосом является подходящей для удерживания дочерних нуклидов. 3. Система конъюгации по любому из пп.1 или 2, отличающаяся тем, что хелатообразующее соединение выбрано из группы, содержащей 1,4,7,10-тетраазациклододекан-1,4,7,10-N,N',N",N'"-тетрауксусную кислоту (DOTA),1,4,7,10-тетраазациклотридекан-1,4,7,10-N,N',N",N'"-тетрауксусную кислоту (TRITA),1,4,7,10-тетраазациклотетрадекан-1,4,7,10-N,N',N",N"'-тетрауксусную кислоту (ТЕТА),1,4,7,10-тетраазациклододекан-1,4,7,10-N,N',N",N"'-тетра(метилен)фосфоновую кислоту (DOTMP),1,4,7,10-тетраазациклотридекан-1,4,7,10-N,N',N",N'"-тетра(метилен)фосфоновую кислоту,1,4,7,10-тетраазациклотетрадекан-1,4,7,10-N,N',N",N'"-тетра(метилен)фосфоновую кислоту, диэтилентриамин-N,N',N"-пентауксусную кислоту и их изомерные производные, криптат[2,2,2], криптат[3,2,2], криптат[2,2,1] и их моно- и дибензопроизводные, соединенные мостиковой связью каликс[4]арены, содержащие богатые электронами (донорные) группы (гидроксил, карбоксил, эфир, амид,амин), 1,10-диаза-4,7,13,16-тетраоксациклооктадекан-1,10-N,N'-бис-уксусную кислоту и 1,10-диаза-4,7,13,16-тетраоксациклооктадекан-1,10-N,N'-бис-малонат. 4. Система конъюгации по любому из пп.1-3, отличающаяся тем, что липосомы содержат активированные группы в мембране, дающие возможность конъюгации белков или других рецепторных аффинных молекул с этими активированными группами. 5. Система конъюгации по п.4, где указанные активированные группы представляют собой полиэтиленгликоль. 6. Система конъюгации по любому из пп.1-5, отличающаяся тем, что липосомы являются конъюгированными с белками, связывающими рецептор. 7. Система конъюгации по п.6, где указанные белки, связывающие рецептор, представляют собой моноклональные или поликлональные антитела, либо фрагменты или конструкции антител, либо фолат. 8. Система конъюгации по п.6, отличающаяся тем, что липосомы являются конъюгированными с антителами класса IgM или IgG либо фрагментами или конструкциями из антител этих классов. 9. Система конъюгации по п.6, отличающаяся тем, что липосомы являются конъюгированными с антителами класса IgM или IgG либо фрагментами или конструкциями из антител этих классов, где эти антитела, фрагменты или конструкции являются меченными фолатом и радионуклидом или смесью различных радионуклидов. 10. Система конъюгации по любому из пп.1-9, отличающаяся тем, что антитела либо фрагменты или конструкции антител, конъюгированные с липосомами, являются мышиными, химерными или человеческими, моноклональными или поликлональными. 11. Система конъюгации по п.10, отличающаяся тем, что антитела либо фрагменты или конструкции антител являются меченными фолатом, где сайт связывания антигена направлен на белок, связывающий фолат (FBP). 12. Система конъюгации по п.10, отличающаяся тем, что антитела либо фрагменты или конструкции антител являются меченными фолатом, где сайт связывания антигена направлен на антиген, отличный отFBP. 13. Система конъюгации по любому из пп.1-12, отличающаяся тем, что радионуклид представляет собой тяжелый -излучатель и/или 212 Рb в качестве генератора для -излучателя 212Bi, выбранный из 211At, 212Bi, 213Bi, 212Pb, 225Ac, 223Ra, 224Ra и 227Th. 14. Система конъюгации по любому из пп.1-13, отличающаяся тем, что дочерний нуклид и материнский нуклид представляют собой 212Bi и 212 Рb соответственно. 15. Способ получения радиоактивно меченой системы конъюгации по пп.1-14, отличающийся тем,что липосомы с ионофорами и хелатообразующим соединением подходящей концентрации являются стабильно радиоактивно меченными тяжелыми излучателями -частиц, при котором раствор, содержащий радионуклид или смесь радионуклидов, которые испускают излучение -частиц, или 212 Рb в качестве генератора для -излучателя 212Bi, смешивают с раствором, содержащим липосомы, и инкубируют при повышенной температуре по сравнению с физиологической температурой для получения транспорта радионуклида(ов) в липосомы. 16. Способ по п.15, отличающийся тем, что хелатообразующее соединение выбрано из группы, содержащей 1,4,7,10-тетраазациклододекан-1,4,7,10-N,N',N",N'"-тетрауксусную кислоту (DOTA),1,4,7,10-тетраазациклотридекан-1,4,7,10-N,N',N",N'"-тетрауксусную кислоту (TRITA),1,4,7,10-тетраазациклотетрадекан-1,4,7,10-N,N',N",N'"-тетрауксусную кислоту (ТЕТА),- 11005624 1,4,7,10-тетраазациклододекан-1,4,7,10-N,N',N",N'"-тетра(метилен)фосфоновую кислоту (DOTMP),1,4,7,10-тетраазациклотридекан-1,4,7,10-N,N',N",N'"-тетра(метилен)фосфоновую кислоту,1,4,7,10-тетраазациклотетрадекан-1,4,7,10-N,N',N",N"'-тетра(метилен)фосфоновую кислоту,диэтилентриамин-N,N',N"-пентауксусную кислоту и их изомерные производные,криптат[2,2,2], криптат[3,2,2], криптат[2,2,1] и их моно- и дибензопроизводные, соединенные мостиковой связью каликс[4]арены, содержащие богатые электронами (донорные) группы (гидроксил, карбоксил, эфир, амид, амин),1,10-диаза-4,7,13,16-тетраоксациклооктадекан-1,10-N,N'-бис-уксусную кислоту и 1,10-диаза-4,7,13,16-тетраоксациклооктадекан-1,10-N,N'-бис-малонат. 17. Способ по любому из пп.15, 16, отличающийся тем, что липосомы содержат активированные группы в мембране, дающие возможность конъюгации белков или других рецепторных аффинных молекул. 18. Способ по п.17, отличающийся тем, что активированные группы представляют собой полиэтиленгликоль. 19. Способ по любому из пп.15-18, отличающийся тем, что липосомы являются конъюгированными с белками, связывающими рецептор. 20. Способ по п.19, где указанные белки, связывающие рецептор, представляют собой моноклональные или поликлональные антитела, либо фрагменты или конструкции антител, либо фолат. 21. Способ по п.19, отличающийся тем, что липосомы являются конъюгированными с антителами класса IgM или IgG либо фрагментами или конструкциями из антител этих классов. 22. Способ по п.19, отличающийся тем, что липосомы являются конъюгированными с антителами класса IgM или IgG либо фрагментами или конструкциями из антител этих классов, где эти антитела являются меченными фолатом и радионуклидом или смесью различных радионуклидов при использовании стандартных методик мечения антитела фолатом и радионуклидом. 23. Способ по любому из пп.15-22, отличающийся тем, что антитела либо фрагменты или конструкции антител, конъюгированные с липосомами, являются мышиными, химерными или человеческими,моноклональными или поликлональными. 24. Способ по п.23, отличающийся тем, что антитела либо фрагменты или конструкции антител являются меченными фолатом, где сайт связывания антигена направлен на FBP. 25. Способ по п.23, отличающийся тем, что антитела либо фрагменты или конструкции антител, где сайт связывания антигена направлен на антиген, отличный от FBP. 26. Способ по любому из пп.15-25, отличающийся тем, что радионуклид представляет собой тяжелый -излучатель или 212 Рb в качестве генератора для -излучателя 212Bi, выбранный из 211At, 212Bi, 213Bi,212Pb, 225Ac, 223Ra, 224Ra и 227Th. 27. Способ по любому из пп.15-26, отличающийся тем, что дочерний нуклид и материнский нуклид представляют собой 212Bi и 212 Рb соответственно. 28. Применение системы конъюгации по любому из пп.1-14 для изготовления фармацевтического раствора, подходящего для инъекции или инфузии млекопитающим, включая людей. 29. Применение по п.28 для изготовления фармацевтического раствора, подходящего для инъекции или инфузии млекопитающим, включая людей, посредством внутривенного, и/или регионарного, и/или внутриопухолевого пути введения. 30. Применение по п.28 в комбинации с радиоиммуноконъюгатом или несколькими радиоиммуноконъюгатами и/или другими формами радиофармацевтической терапии, химиотерапии, наружной дистанционной лучевой терапии или хирургии для лечения злокачественных опухолей. 31. Способ доставки потенциально терапевтического излучения к злокачественным клеткаммишеням, экспрессирующим рецептор(ы), выбранные из белка, связывающего фолат, рецептора эстрогена, рецептора тестостерона и/или различных антигенов для моноклональных антител, при котором субъектам-людям посредством инъекции вводят систему конъюгации по любому из пп.1-14. 32. Способ доставки потенциально терапевтического излучения к злокачественным тканям, экспрессирующим рецептор(ы), где злокачественная ткань представляет собой рак головного мозга, легкого,шейки матки, яичника или молочной железы либо лейкемию, лимфому или злокачественную меланому,при котором субъектам-людям посредством инъекции вводят систему конъюгации по любому из пп.1-14. 33. Набор для изготовления системы конъюгации по любому из пп.1-14, отличающийся тем, что он содержит флакон, содержащий раствор липосом, и флакон, содержащий радионуклид в растворе, которые можно смешивать, чтобы способствовать радиоактивному мечению. 34. Набор для изготовления системы конъюгации по любому из пп.1-14, отличающийся тем, что он содержит флакон, содержащий раствор липосом, второй флакон, содержащий радионуклид в растворе, и третий флакон, содержащий молекулу, обладающую аффинностью к рецептору, которые можно смешивать, чтобы способствовать радиоактивному мечению и мечению молекулой, обладающей аффинностью к рецептору.
МПК / Метки
МПК: A61K 51/12
Метки: липосомы, радиоактивные, терапевтические
Код ссылки
<a href="https://eas.patents.su/14-5624-radioaktivnye-terapevticheskie-liposomy.html" rel="bookmark" title="База патентов Евразийского Союза">Радиоактивные терапевтические липосомы</a>
Предыдущий патент: Новые твердые формы мезопрогестина-11β-[4е-(гидроксииминометил)фенил]-17α-метоксиметил-17β-метоксиэстра-4,9-диен-3-она
Следующий патент: Система и способ обеспечения многоточечных информационных линий связи
Случайный патент: Криогенная система для удаления кислотных газов из потока газообразных углеводородов