1- или 2-замещенные производные артемизинина для повышения in vivo биологической активности биологически активных соединений
Формула / Реферат
1. Соединение, содержащее производное артемизинина общей формулы (I)

ковалентно связанное в положении 1 или 2 с соединением с биологической активностью или его фармацевтически приемлемой солью посредством сульфидной (-S-), простой эфирной (-O-), сложной эфирной (-OCO-) или аминной (-N-) связи; и в котором соединение с биологической активностью выбрано из группы, состоящей из метил-N-(1Н-бензимидазол-2-ил)карбамата, метоксиуксусной кислоты, 2,2-дихлорацетата, 5-фтор-1Н-пиримидин-2,4-диона, ацетата, изобутирата, бутирата и пропилпентаноата.
2. Соединение по п.1, в котором производное артемизинина получено из соединения, выбранного из группы, состоящей из дигидроартемизинина, ангидродигидроартемизинина и деоксоартемизинина.
3. Соединение, выбранное из группы, состоящей из соединения формулы (II)
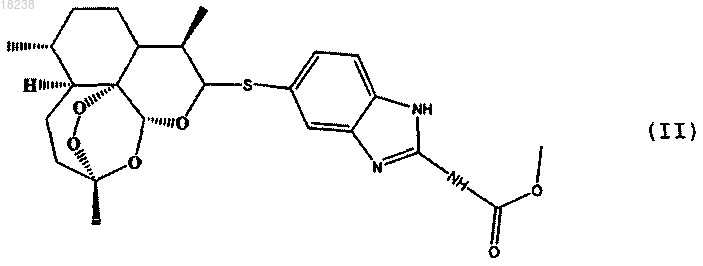
соединения формулы (III)
соединения формулы (IV)

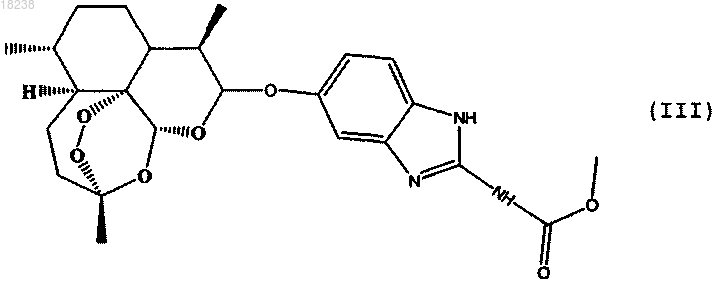
соединения формулы (V)
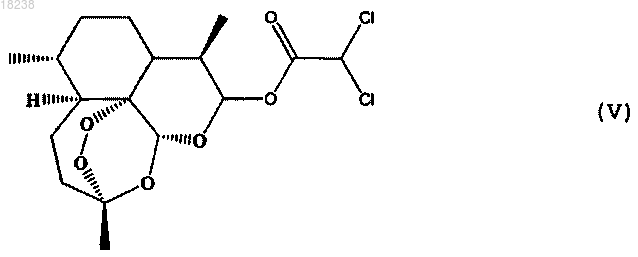
соединения формулы (VI)
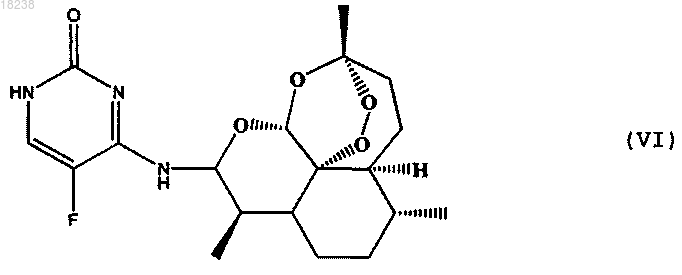
соединения формулы (VII)
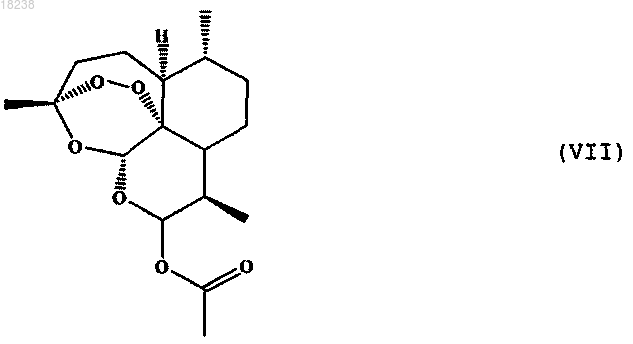
соединения формулы (VIII)
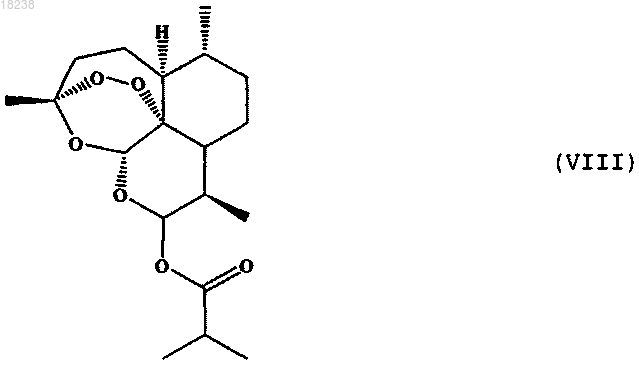
соединения формулы (IX)
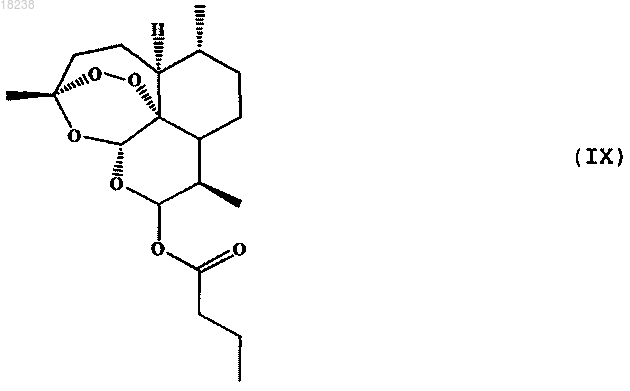
соединения формулы (X)
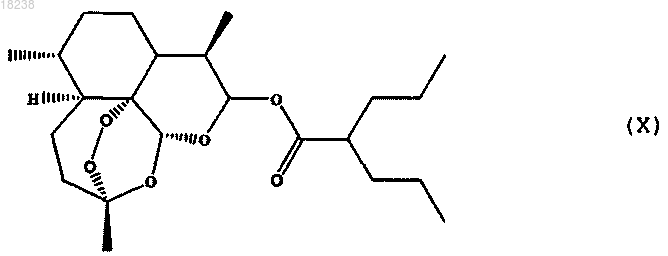
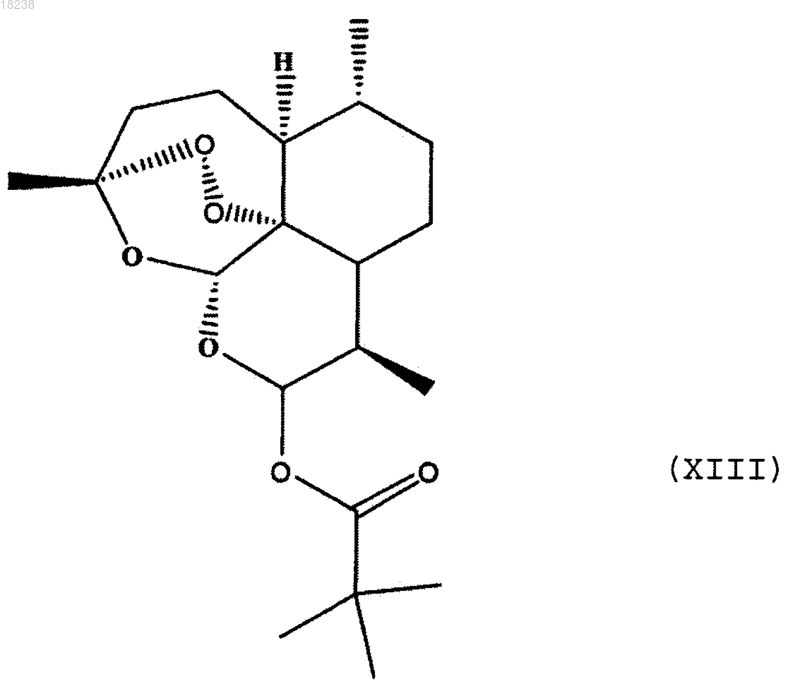
соединения формулы (XIII)
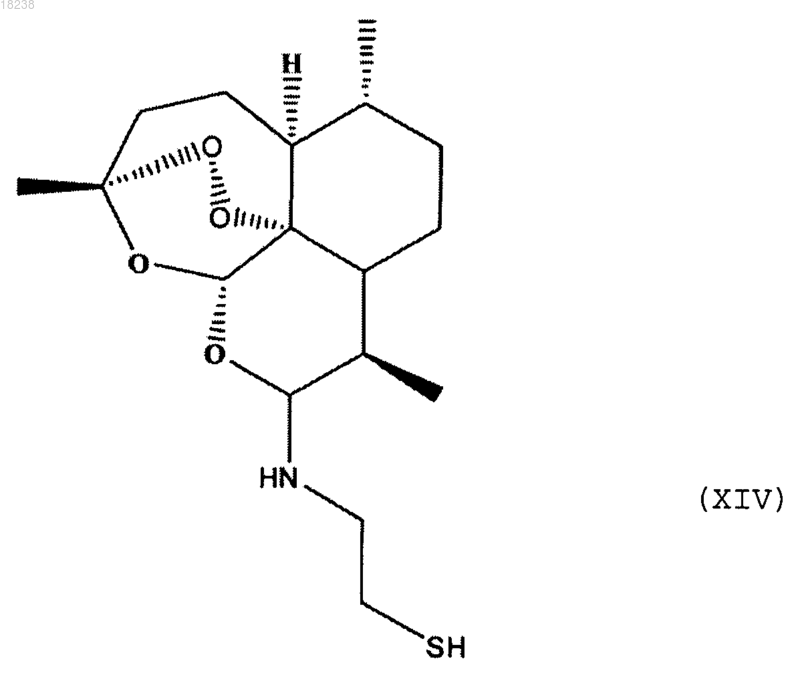
соединения формулы (XIV)
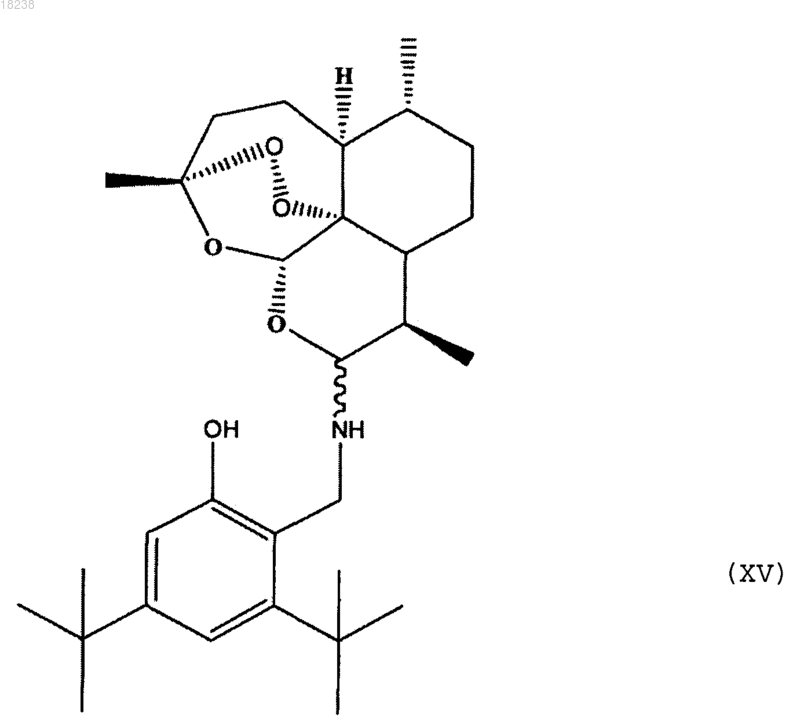
соединения формулы (XV)
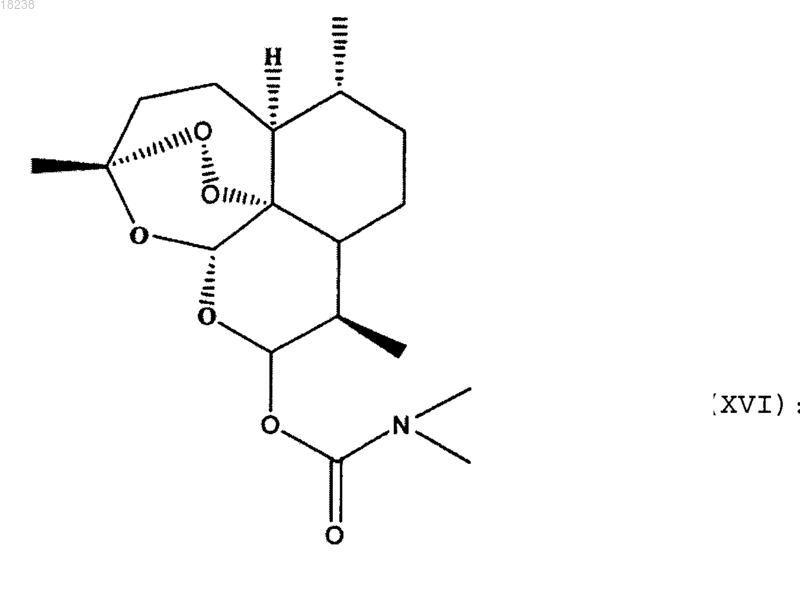
соединения формулы (XVI)
4. Способ получения соединения по любому из пп.1-3, включающий ковалентное связывание производного артемизинина по любому из пп.1-3 с соединением с биологической активностью по любому из пп.1-3 посредством сульфидной (-S-), простой эфирной (-O-), сложной эфирной (-OCO-) или аминной (-N-) связи в положении 1 или 2.
Текст
1- ИЛИ 2-ЗАМЕЩННЫЕ ПРОИЗВОДНЫЕ АРТЕМИЗИНИНА ДЛЯ ПОВЫШЕНИЯIN VIVO БИОЛОГИЧЕСКОЙ АКТИВНОСТИ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ Изобретение относится к соединениям с повышенной in vivo биологической активностью и особенно повышенной фармацевтической активностью, такой как антинематодная или противогрибковая активность, иммуносупрессивная активность, активность, влияющая на метаболизм, и/или противораковая активность. В частности, изобретение относится к соединению,содержащему производное артемизинина общей формулы (I), ковалентно связанное в положении 1 или 2 с соединением с биологической активностью, причем посредством этого увеличивается биологическая активность указанного соединения или его фармацевтически приемлемой соли. Янсен Франс Хервинг, Соомро Шахид Ахмед (BE) Медведев В.Н. (RU) 018238 Настоящее изобретение относится к соединениям с повышенной in vivo биологической активностью и особенно повышенной фармацевтической активностью, такой как антинематодная и противогрибковая активность, иммуносупрессивная активность, активность, оказывающая влияние на метаболизм, и/или противораковая активность. Настоящее изобретение далее относится к способу получения указанных соединений и применению указанных соединений для лечения млекопитающих, предпочтительно людей, нуждающихся в лечении. Биологическая активность in vivo соединения и особенно фармацевтическая активность соединения или лекарственного средства определяется, среди прочего, его фармакокинетическими параметрами. Обычно фармакокинетические параметры применяют для описания ответной реакции организма человека или животного на лекарственное средство. Примерами таких параметров являются абсорбция лекарственного средства посредством распределения лекарственного средства по всему организму и метаболическое превращение или деградация лекарственного средства в организме человека или животного. Кроме того, фармакокинетические параметры применяют для описания ответной реакции организма человека или животного на лекарственное средство. Другими словами, фармакокинетические параметры относятся к механизму действия соединения или лекарственного средства, такого как агонистическая или антагонистическая активность в отношении рецептора, разрушение мембран, подавление или активация иммунной реакции, ДНК-связывание, влияние на химические реакции, влияние на пути передачи сигналов и т.д. Сочетание, такое как ковалентное сочетание или связывание других соединений, с известным лекарственным средством может значительно влиять на его фармакокинетические параметры, такие как его абсорбция посредством его распределения по всему организму и/или его метаболическое превращение или деградация организмом человека или животного. Например, при повышении абсорбции лекарственного средства при помощи (ковалентно) связанного соединения для получения терапевтического действия могут требоваться более низкие концентрации лекарственного средства по сравнению с требуемой концентрацией лекарственного средства, не связанного (ковалентно) с соединением. Аналогичный эффект получают, когда такое (ковалентно) связанное соединение благоприятным образом улучшает распределение лекарственного средства, такое как его доставка к определенным мишеням-участкам в организме, где оно только локально проявляет свою терапевтическую активность. Дополнительным преимуществом может быть также пониженная токсичность. Кроме того, уменьшение концентрации лекарственного средства, которое вводят, или изменение схемы лечения могло бы быть обеспечено в случае, когда (ковалентно) связанные соединения уменьшают или увеличивают метаболическое превращение этого лекарственного средства в зависимости от фармацевтически активной формы лекарственного средства. Возможно также, что (ковалентно) связанное соединение влияет на один или несколько фармакодинамических параметров лекарственного средства. В этом случае действие может быть дополнительным, т.е. суммой фармацевтической активности (ковалентно) связанного соединения и лекарственного средства, или синергическим. Кроме того, возможно, что (ковалентно) связанное соединение в сочетании с лекарственным средством обеспечит ранее неидентифицированную или неизвестную полезную фармацевтическую активность. Независимо от механизма действия, т.е. улучшения или даже обеспечения фармакокинетических и/или фармакодинамических параметров или свойств (ковалентно) связанного соединения, может быть получено улучшенное и благоприятное терапевтическое действие посредством, например, уменьшения количества вводимого лекарственного средства. В качестве другого примера улучшенное полезное терапевтическое действие можно получить вследствие возможности увеличить концентрацию лекарственного средства вследствие уменьшенной токсичности, обеспеченной, например, улучшенным (локальным) распределением или увеличенным либо уменьшенным метаболическим превращением. С учетом, среди прочего, вышеуказанных возможных выгод и преимуществ (ковалентного) сочетания соединения с известным лекарственным средством в отношении его фармакокинетических и/или фармакодинамических свойств или характеристик задачей настоящего изобретения является предоставление такой комбинации (известного) лекарственного средства, (ковалентно) связанного с соединением. Согласно настоящему изобретению данная задача, среди прочего, разрешается соединением, содержащим производное артемизинина согласно формуле (I)-1 018238 ковалентно связанное в положении 1 или 2 с соединением с биологической активностью, предпочтительно фармацевтической активностью, причем посредством этого увеличивается биологическая активность, предпочтительно фармацевтическая активность, указанного соединения. Авторами настоящего изобретения неожиданно было обнаружено, что ковалентное связывание производного артемизинина согласно формуле (I) с соединением с биологической активностью, предпочтительно лекарственным средством, благотворным образом влияет на биологическую активность,предпочтительно фармацевтическую активность, указанного соединения. В большинстве случаев и предпочтительно благотворная биологическая активность, предпочтительно фармацевтическая активность, обеспечивается благоприятным влиянием одного или нескольких фармакокинетических параметров биологически активного соединения, предпочтительно лекарственного средства, таких как его абсорбция, его распределение по организму и/или его метаболическое превращение организмом человека или животного. Вышеуказанное, однако, не исключает того, что ковалентно связанное производное артемизинина согласно настоящему изобретению возможно дополнительно влияет на биологическую активность, предпочтительно фармацевтическую активность, указанного биологически активного соединения обеспечением одного или нескольких улучшенных, или даже новых, фармакодинамических свойств. Производное артемизинина согласно формуле (I) содержит в качестве исходного соединения в положении 1 и/или 2 по меньшей мере одну сочетающую группу для реакции с биологически активным соединением, такую как группа -ОН. Помимо обеспечения по меньшей мере одной сочетающей группой в положении 1 или 2, исходное соединение производного артемизинина согласно настоящему изобретению может быть дополнительно замещено в положении 1 и/или 2 C1-С 6 алкильной группой, разветвленной или неразветвленной, такой как метильная, этильная или пропильная группа, предпочтительно метильная группа, или арильной группой. Одно из производных артемизинина согласно формуле (I) по настоящему изобретению может быть получено из известного промежуточного продукта биосинтеза антималярийного лекарственного средства артемизинина, т.е. дигидроартемизинина (DHA). Согласно этому аспекту настоящего изобретения особенно подходящими для применения согласно настоящему изобретению являются также пропионатная, бутиратная и ацетатная части и группа изопропилового сложного эфира в положении 1 или 2 дигидроартемизинина (DHA). В случае дигидроартемизинина исходное производное артемизинина содержит в положении 1 группу -ОН, позволяющую ковалентно сочетать биологически активное соединение с положением 1 артемизинина, например, реакцией этерификации или реакцией получения простого эфира. Такие реакции являются обычными, известными в области органической химии, и их можно найти в большинстве учебников по органической химии, таких как, например, Organic Chemistry, JohnMcMurry, Brooks/Cole, 6th edition. Другим исходным производным артемизинина, представленным формулой (I), является деоксоартемизинин. В этом исходном соединении возможная сочетающая группа, такая как -ОН, находится в положении 2. Другим исходным производным артемизинина, представленным формулой (I), является ангидродигидроартемизинин (AHA). Это соединение содержит двойную связь между положениями 1 и 2, которая позволяет посредством реакции промежуточного продукта ковалентно сочетать биологически активное соединение с положением 1 или положением 2, например, нуклеофильной реакцией О, N или S с получением соответствующих производных в положении 1 или реакцией гидроксилирования присоединением не по правилу Марковникова в положении 2. Такие реакции являются обычными, известными реакциями в области органической химии, и их можно найти в большинстве учебников по органической химии, таких как, например, Organic Chemistry,John McMurry, Brooks/Cole, 6th edition. Согласно этому в предпочтительном варианте осуществления настоящего изобретения производное артемизинина согласно настоящему изобретению получают из соединения, выбранного из группы, состоящей из дигидроартемизинина, ангидродигидроартемизинина и деоксоартемизинина. В предпочтительном варианте осуществления настоящего изобретения биологически, предпочтительно фармацевтически активное соединение сочетают с производным артемизинина согласно настоящему изобретению, таким как ангидродигидроартемизинин, посредством сульфидной (-S-), простой эфирной (-O-), сложной эфирной (-OCO-) или аминной (-N-) связи. Особенно предпочтительными в этом варианте осуществления настоящего изобретения являются сульфидная (-S-) и простая эфирная (-O-) связи. Согласно одному предпочтительному варианту осуществления соединение с биологической активностью настоящего изобретения ковалентно связано с производным артемизинина настоящего изобретения в положении 1 соединения согласно формуле (I). Согласно еще одному предпочтительному варианту осуществления соединение с биологической активностью по настоящему изобретению ковалентно связано с производным артемизинина по настояще-2 018238 му изобретению в положении 2 соединения согласно формуле (I). В особенно предпочтительном варианте осуществления настоящего изобретения биологически активным соединением, ковалентно связанным с производным артемизинина, является метил-N-(1 Нбензимидазол-2-ил)карбамат. Метил-N-(1 Н-бензимидазол-2-ил)карбамат является антинематодным агентом и особенно фунгицидом, имеющим также ряд известных синонимов, таких как карбендазим, карбендазол, мекарзол, фунабен и т.д. Ковалентное связывание метил-N-(1 Н-бензимидазол-2-ил)карбамата с производным артемизинина согласно настоящему изобретению повышает антинематодную и особенно фунгицидную активность этого лекарственного средства. Согласно особенно предпочтительному аспекту данного варианта осуществления настоящего изобретения изобретение относится к соединению согласно формуле (II) или соединению согласно формуле (III) В другом, особенно предпочтительном варианте осуществления настоящего изобретения биологически активным соединением, ковалентно связанным с производным артемизинина согласно настоящему изобретению, является метоксиуксусная кислота. Метоксиуксусная кислота является иммуносупрессивным агентом, известным также как метоксиэтановая кислота или 2-метоксиуксусная кислота. Ковалентное связывание метоксиуксусной кислоты с производным артемизинина согласно настоящему изобретению благоприятным образом повышает иммуносупрессивную активность этого лекарственного средства. Согласно особенно предпочтительному аспекту данного варианта осуществления настоящего изобретения изобретение относится к соединению согласно формуле (IV) Еще в одном особенно предпочтительном варианте осуществления настоящего изобретения биологически активным соединением, ковалентно связанным с производным артемизинина согласно настоящему изобретению, является 2,2-дихлорацетат. 2,2-Дихлорацетат оказывает влияние на метаболизм глюкозы, снижает уровень лактата и активирует комплекс дегидрогеназы. Ковалентное связывание 2,2-дихлорацетата с производным артемизинина согласно настоящему изобретению благоприятным образом повышает, среди прочего, активность данного лекарственного средства в отношении метаболического влияния. Согласно особенно предпочтительному аспекту данного варианта осуществления настоящего изобретения изобретение относится к соединению согласно формуле (V) Еще в одном особенно предпочтительном варианте осуществления настоящего изобретения биологически активным соединением, ковалентно связанным с производным артемизинина согласно настоящему изобретению, является 5-фтор-1 Н-пиримидин-2,4-дион. 5-Фтор-1 Н-пиримидин-2,4-дион является противоопухолевым антиметаболитом. Он препятствует-3 018238 ДНК-синтезу блокированием превращения тимидилатсинтазой деоксиуридиловой кислоты в тимидиловую кислоту. 5-Фтор-1 Н-пиримидин-2,4-дион имеет также известные синонимы фторурацил, фтороплекс, адруцил, эфудекс, тимазин и т.д. Ковалентное сочетание 5-фтор-1 Н-пиримидин-2,4-диона с производным артемизинина согласно настоящему изобретению благоприятным образом особенно усиливает противораковую активность этого лекарственного средства. Согласно особенно предпочтительному аспекту данного варианта осуществления настоящего изобретения изобретение относится к соединению согласно формуле (VI) В особенно предпочтительном варианте осуществления настоящего изобретения биологически активным соединением, ковалентно связанным с производным артемизинина согласно настоящему изобретению, является также ацетат. Ацетат применяют, среди прочего, для внутреннего употребления в качестве противораздражающего средства и также в качестве реагента. Ковалентное связывание ацетата с производным артемизинина согласно настоящему изобретению благоприятным образом особенно усиливает противораздражающую активность этого лекарственного средства. Согласно особенно предпочтительному аспекту данного варианта осуществления настоящего изобретения настоящее изобретение относится к соединению согласно формуле (VII) В дополнительном другом, особенно предпочтительном варианте осуществления настоящего изобретения биологически активным соединением, ковалентно связанным с производным артемизинина согласно настоящему изобретению, является изобутират. Изобутират обладает, помимо прочего, антипролиферативным действием. Он оказывает влияние на ацетилирование и деацетилирование гистонов, тем самым оказывая влияние на регулирование роста,дифференциацию и апоптоз клеток. Ковалентное сочетание изобутирата с производным артемизинина согласно настоящему изобретению благоприятным образом особенно усиливает антипролиферативную активность этого лекарственного средства. Согласно особенно предпочтительному аспекту данного варианта осуществления настоящего изобретения настоящее изобретение относится к соединению согласно формуле (VIII) В еще одном дополнительном, особенно предпочтительном варианте осуществления настоящего изобретения биологически активным соединением, ковалентно связанным с производным артемизинина согласно настоящему изобретению, является бутират. Бутират является, среди прочего, антагонистом гистамина. Ковалентное связывание бутирата с производным артемизинина согласно настоящему изобретению благоприятным образом особенно усиливает активность в качестве антагониста гистамина этого лекарственного средства. Согласно особенно предпочтительному аспекту данного варианта осуществления настоящего изо-4 018238 бретения изобретение относится к соединению согласно формуле (IX) В еще одном особенно предпочтительном варианте осуществления настоящего изобретения биологически активным соединением, ковалентно связанным с производным артемизинина согласно настоящему изобретению, является пропилпентаноат. Пропилпентаноат является жирной кислотой с противосудорожными свойствами, применяемой при лечении эпилепсии. Пропилпентаноат имеет также известные синонимы, такие как вальпроевая кислота, эпилим, конвулекс, эурекен, лабазен, селеника, орфирил, валерин и т.д. Ковалентное сочетание пропилпентаноата с производным артемизинина согласно настоящему изобретению благоприятным образом особенно усиливает противосудорожную активность этого лекарственного средства. Согласно особенно предпочтительному аспекту данного варианта осуществления настоящего изобретения изобретение относится к соединению согласно формуле (X) Настоящее изобретение относится также к промежуточным продуктам соединений согласно настоящему изобретению согласно формуле (XI) или согласно формуле (XII) Согласно другому аспекту настоящее изобретение относится к способу получения соединения согласно настоящему изобретению, где способ содержит ковалентное связывание производного артемизинина, указанного выше, с соединением с биологической активностью, указываемым выше, посредством сульфидной (-S-), простой эфирной (-O-), сложной эфирной (-OCO-) или аминной (-N-) связи в положении 1 или 2, чтобы тем самым повысить биологическую активность указанного биологически активного соединения. С учетом терапевтических преимуществ, обеспечиваемых соединениями согласно настоящему изобретению, изобретение относится также к применению производного артемизинина, указанного выше,для повышения биологической активности указанного выше соединения. Согласно другому аспекту настоящее изобретение относится к указываемому выше соединению для применения в качестве лекарственного средства. Согласно еще одному аспекту настоящее изобретение относится к применению указанного выше соединения для получения лекарственного средства для лечения млекопитающего, предпочтительно человека, нуждающегося в таком лечении. В предпочтительном варианте осуществления указанного выше применения настоящее изобретение относится к применению указанного выше соединения для получения лекарственного средства для лече-5 018238 ния млекопитающего, предпочтительно человека, страдающего нематодной инфекцией, где соединением, обладающим биологической активностью, является метил-N-(1 Н-бензимидазол-2-ил)карбамат. В другом предпочтительном варианте осуществления указанного выше применения настоящее изобретение относится к применению указанного выше соединения для получения лекарственного средства для лечения млекопитающего, предпочтительно человека, нуждающегося в иммуносупрессии, где соединением, обладающим биологической активностью, является метоксиуксусная кислота. Еще в одном предпочтительном варианте осуществления указанного выше применения настоящее изобретение относится к применению указанного выше соединения для получения лекарственного средства для лечения млекопитающего, предпочтительно человека, страдающего метаболическим заболеванием, где соединением, обладающим биологической активностью, является 2,2-дихлорацетат. Еще в одном предпочтительном варианте осуществления указанного выше применения настоящее изобретение относится к применению указанного выше соединения для получения лекарственного средства для лечения млекопитающего, предпочтительно человека, страдающего метаболическим заболеванием и нуждающегося в иммуносупрессии или особенно раковым заболеванием, где соединением, обладающим биологической активностью, является 5-фтор-1 Н-пиримидин-2,4-дион. В дополнительном предпочтительном варианте осуществления указанного выше применения настоящее изобретение относится к применению указанного выше соединения для получения лекарственного средства для лечения млекопитающего, страдающего раздражимостью, где соединением, обладающим биологической активностью, является ацетат. В другом дополнительном предпочтительном варианте осуществления указанного выше применения настоящее изобретение относится к применению указанного выше соединения для получения лекарственного средства для лечения млекопитающего, страдающего раковым заболеванием, где соединением, обладающим биологической активностью, является изобутират. Согласно также дополнительному предпочтительному варианту осуществления указанного выше применения настоящее изобретение относится к применению указанного выше соединения для получения лекарственного средства для лечения млекопитающего, нуждающегося в иммуносупрессии, где соединением, обладающим биологической активностью, является бутират. Настоящее изобретение будет далее описано с применением нижеследующих препаративных примеров предпочтительных вариантов осуществления настоящего изобретения. Примеры Пример 1. Синтез производного тиобензимидазола: метил-5-(дигидроартемизинилтио)-1 Нбензо[d]имидазол-2-илкарбамата (1 а) Комплекс трифторид бора-диэтиловый простой эфир (1 мл) добавляли к перемешиваемому раствору дигидроартемизинина (DHA, 2,56 г, 9 ммоль) и производного бензимидазола (метил-N-1Hбензимидазол-2-ил)карбамата, 1,80 г, 8,07 ммоль) в сухом диэтиловом простом эфире (50 мл). Смесь перемешивали при комнатной температуре на протяжении ночи и затем гасили насыщенным водным NaHCO3 и сушили над MgSO4. Фильтрование и концентрирование фильтрата давали остаток, при хроматографировании которого с применением смеси этилацетат/гексан (10:90) получали продукт в виде желтого твердого вещества 3,42 г (12 ммоль) DHA подвергали реакции с метил-N-(1 Н-бензимидазол-2-ил)карбаматом (1,94 г,10 ммоль) с применением способа, описанного в примере 1, за исключением того, что элюентом для хроматографии была смесь этилацетат/гексан с градиентом (5:95-10:90). Полученный продукт далее перекристаллизовывали из дихлорметана с получением продукта (смесь эпимеров) в виде желтого твердого вещества (2,98 г, 63%), т.пл. 172-175 С. 4-(Диметиламино)пиридин (1,95 г, 16 ммоль) и дигликолевый ангидрид (3,48 г, 30 ммоль) добавляли к перемешиваемому раствору DHA (2,84 г, 10 ммоль) в дихлорметане (50 мл) и реакционную смесь непрерывно перемешивали на протяжении ночи. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией с применением смеси этилацетат/гексан (10:90) с получением продукта в виде белого твердого вещества(3,80 г, 95%). Перекристаллизация из смеси этилацетат/гексан давала белые иглы (т.пл. 168-171 С). 1 Н ЯМР: 0,86 (д, J=7,0 Гц, 3 Н, 9-Ме), 0,97 (д, J=5,95 Гц, 3 Н, 6-Ме), 1,45 (с, 3 Н, 3-Ме), 1,23-1,94 (м,9 Н), 2,04 (ддд, J=14,5, 5,0, 3,0 Гц, 1 Н), 2,39 (ддд, J=14,5, 5,0, 3,0 Гц, 1 Н), 2,55 (м, 1 Н, Н-9), 4,25 (с, 2 Н,ОСН 2 СОО), 5,40 (с, 2 Н, СОСН 2 О), 5,45 (с, 1 Н, Н-12), 5,850 (д, J=10,0 Гц, 1 Н, Н-10). Пример 4. Синтез дигидроартемизинил-2,2-дихлорацетата(2,84 г, 10 ммоль) применяли для синтеза с использованием указанного выше способа, за исключением того, что элюентом для хроматографии была смесь этилацетат/гексан (5:95). Продукт получали в виде желтого твердого вещества (3,44 г, 87%), т.пл. 160-163 С. 1 Н ЯМР: 0,86 (д, J=7,0 Гц, 3 Н, 9-Ме), 0,97 (д, J=5,95 Гц, 3 Н, 6-Ме), 1,45 (с, 3 Н, 3-Ме), 1,23-1,94 (м,9 Н), 2,04 (ддд, J=14,5, 5,0, 3,0 Гц, 1 Н), 2,39 (ддд, J=14,5, 5,0, 3,0 Гц, 1 Н), 2,55 (м, 1 Н, Н-9), 5,40 (с, 1 Н, Н 12), 5,90 (д, J=10,0 Гц, 1 Н, Н-10), 6,25 (с, 1 Н, COCHCl2). Пример 5. Синтез 5-фтор-4-(дигидроартемизиниламино)пиримидин-2(1 Н)-она Комплекс трифторид бора-диэтиловый простой эфир (1 мл) добавляли к перемешиваемому раствору DHA (2,56 г, 9 ммоль) и F-урацила (1,04 г, 8,05 ммоль) в сухом диэтиловом простом эфире (50 мл). Смесь перемешивали при комнатной температуре на протяжении ночи, затем гасили насыщенным водным NaHCO3 и сушили над MgSO4. Фильтрование и концентрирование фильтрата давали остаток, хроматографированием которого с применением смеси этилацетат/гексан (10:90) получали продукт в виде желтого твердого вещества Комплекс трифторид бора-диэтиловый простой эфир (3 мл) добавляли к перемешиваемому раствору DHA (2,56 г, 9 ммоль) при 0 С и смесь медленно нагревали до комнатной температуры, перемешивали в течение 2 ч и затем гасили насыщенным водным NaHCO3 и сушили над MgSO4.-7 018238 Фильтрование и концентрирование фильтрата давали остаток, хроматографированием которого с применением смеси этилацетат/гексан (10:90) получали продукт в виде белого твердого вещества (2,15 г,90%), т.пл. 95-98 С. 1 Н ЯМР: 0,98 (д, J=5,8 Гц, 3 Н, 6-Ме), 1,02-1,39 (м, 2 Н), 1,42 (м, 3 Н, 9-Ме), 1,44-1,75 (м, 8 Н), 1,871,96 (м, 1 Н), 2,00-2,12 (м, 2 Н), 2,35-2,46 (м, 1 Н), 5,54 (с, 1 Н, Н-12), 6,18 (с, J=1H, 10-H) м.д. Пример 7. Синтез деоксоартемизинина Раствор дигидроартемизинина (ADH, 456 мг, 1,6 ммоль) в сухом CH2Cl2 (16 мл) в 50-мл круглодонной колбе в атмосфере аргона охлаждали до -20 С. К этому раствору добавляли триэтилсилан (0,40 мл, 2,4 ммоль) и эфират трифторида бора (0,24 мл,1,92 ммоль). Раствору затем давали возможность нагреться до 5 С на протяжении 2 ч и затем добавляли 15 мл воды. Органический слой отделяли, промывали несколько раз водой и сушили над Na2SO4. Раствор концентрировали и неочищенный продукт очищали флэш-хроматографией (гексан/CH2Cl2/6:4) с получением 380 мг чистого продукта (88%), т.пл. 104-106 С. К раствору ангидродигидроартемизинина (AHA) (2,08 г, 7,8 ммоль) в ТГФ (20 мл) по каплям добавляли раствор комплекса ВН 3/ТГФ в растворителе ТГФ (1 М; 14 мл) при охлаждении льдом. После перемешивания при комнатной температуре в течение 1 ч смесь обрабатывали смесью ТГФ-вода (1:1, 4 мл) с последующей обработкой смесью водного КОН (10%; 10 мл) и водного Н 2 О 2 (50%, 4 мл). После этого реакционную смесь перемешивали в течение 5 мин, фильтровали и упаривали. Остаток промывали водой, растворяли в Et2O и эфирный раствор сушили (MgSO4) и упаривали, получая при этом белое твердое вещество смеси изомеров, которые разделяли колоночной хроматографией (гексан/этилацетат). Пример 8. Синтез дигидроартемизинилацетата 4-(Диметиламино)пиридин (0,5 г, 4,1 ммоль) и уксусный ангидрид (3,06 г, 30 ммоль) добавляли к перемешиваемому раствору DHA (7,1 г, 25 ммоль) в дихлорметане (400 мл) и реакционную смесь непрерывно перемешивали на протяжении ночи. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией с применением смеси этилацетат/гексан (10:90) с получением продукта в виде белого твердого вещества (6,80 г, 84%). Перекристаллизация из смеси этилацетат/гексан давала белые иглы (т.пл. 129-131 С). 1 Н ЯМР: 0,86 (д, J=7,0 Гц, 3 Н, 9-Me), 0,97 (д, J=5, 95 Гц, 3 Н, 6-Ме), 1,45 (с, 3 Н, 3-Ме), 1,23-1,94 (м,9 Н), 2,04 (ддд, J=14,5, 5,0, 3,0 Гц, 1 Н), 2,12 (с, 3 Н, Н-СОСН 3), 2,39 (ддд, J=14,5, 5,0, 15 3,0 Гц, 1 Н), 2,55-8 018238 4-(Диметиламино)пиридин (0,6 г, 4,9 ммоль) и изомасляный ангидрид (4,0 г, 25 ммоль) добавляли к перемешиваемому раствору DHA (5 г, 17,6 ммоль) в дихлорметане (200 мл) и реакционную смесь непрерывно перемешивали на протяжении ночи. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией с применением смеси этилацетат/гексан (10:90) с получением продукта в виде густой жидкости (6,80 г, 84%). 1 Н ЯМР: 0,86 (д, J=7,0 Гц, 3 Н, 9-Ме), 0,97 (д, J=5,95 Гц, 3 Н, 6-Ме), 1,17-1,24 (м, 6 Н), 1,45 (с, 3 Н, 3 Ме), 1,23-1,94 (м, 9 Н), 2,04 (ддд, J=14,5, 5,0, 3,0 Гц, 1 Н), 2,39 (ддд, J=14,5, 5,0, 15 3,0 Гц, 1 Н), 2,55 (м, 1 Н,Н-9), 2,68 (м, 1 Н, СОСН), 5,45 (с, 1 Н, Н-12), 5,850 (д, J=10,0 Гц, 1 Н, Н-10). Пример 10. Синтез дигидроартемизинилбутирата 4-(Диметиламино)пиридин (0,6 г, 4,9 ммоль) и масляный ангидрид (4,0 г, 25 ммоль) добавляли к перемешиваемому раствору DHA (5 г, 17,6 ммоль) в дихлорметане (300 мл) и реакционную смесь непрерывно перемешивали на протяжении ночи. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией с применением смеси этилацетат/гексан (10:90) с получением продукта в виде густой жидкости (5,9 г, 95%). 1 Н ЯМР: 0,86 (д, J=7,0 Гц, 3 Н, 9-Ме), 0,97 (д, J=5,95 Гц, 3 Н, 6-Ме), 1,17-1,24 (м, 6 Н), 1,45 (с, 3 Н, 3 Ме), 1,23-1,94 (м, 9 Н), 2,04 (ддд, J=14,5, 5,0, 3,0 Гц, 1 Н), 2,39 (ддд, J=14,5, 5,0, 15 3,0 Гц, 1 Н), 2,55 (м, 1 Н,Н-9), 2,68 (м, 1 Н, СОСН), 5,4 (с, 1 Н, Н-12), 5,850 (д, J=10,0 Гц, 1 Н, Н-10). Пример 11. Синтез дигидроартемизинил-2-пропилпентаноата 4-(Диметиламино)пиридин (0,5 г, 4,1 ммоль) и триэтиламин (3,03 г, 30 ммоль) добавляли к перемешиваемому раствору DHA (7,1 г, 2 5 ммоль) в дихлорметане (400 мл). К этому раствору добавляли 2 пропилпентаноилхлорид (4,87 г, 30 ммоль) при -30 С, реакционную смесь непрерывно перемешивали в течение 2 ч, медленно нагревали до комнатной температуры и перемешивали на протяжении ночи. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией с применением смеси этилацетат/гексан (10:90) с получением продукта в виде белого твердого вещества(10,22 г, 80%). Перекристаллизация из смеси этилацетат/гексан давала белые иглы (т.пл. 141-145 С). 1 Н ЯМР: 0,86 (д, J=7,0 Гц, 3 Н, 9-Ме), 0,90 (т, 6 Н), 0,97 (д, J=5,95 Гц, 3 Н, 6-Ме), 1,33 (м, 4 Н), 1,45 (с,3 Н, 3-Ме), 1,64 (м, 4 Н), 1,23-1,94 (м, 9 Н), 2,04 (ддд, J=14,5, 5,0, 3,0 Гц, 1 Н), 2,29 (т, 1 Н), 2,39 (ддд, J=14,5,5,0, 15 3,0 Гц, 1 Н), 2,55 (м, 1 Н, Н-9), 5,45 (с, 1 Н, Н-12), 5,850 (д, J=10,0 Гц, 1 Н, Н-10). Пример 12. Синтез дигидроартемизинил-2,2-диметилпропионата 4-(Диметиламино)пиридин (0,5 г, 4,1 ммоль) и триметилуксусный ангидрид (5,59 г, 30 ммоль) добавляли к перемешиваемому раствору DHA (7,1 г, 2 5 ммоль) в дихлорметане (400 мл) и реакционную смесь непрерывно перемешивали на протяжении ночи. Неочищенную смесь промывали водой (2100 мл), растворитель удаляли при пониженном давлении и продукт перекристаллизовывали из смеси этилацетат/гексан с получением белого твердого вещества, которое плавится при 101-104 С (6,9 г, 75%). 1 Н ЯМР: 0,86 (д, J=7,0 Гц, 3 Н, 9-Ме), 0,97 (д, J=5,95 Гц, 3 Н, 6-Ме), 1,25 (с, 9 Н, С(СН)3), 1,45 (с, 3 Н,3-Ме), 1,23-1,94 (м, 9 Н), 2,04 (ддд, J=14,5, 5,0, 3,0 Гц, 1 Н), 2,39 (ддд, J=14,5, 5,0, 15 3,0 Гц, 1 Н), 2,55 (м,-9 018238 1 Н, Н-9), 5,45 (с, 1 Н, Н-12), 5,850 (д, J=10,0 Гц, 1 Н, Н-10). Пример 13. Синтез дигидроартемизинилтиоэтиламинаDHA (7,1 г, 25 ммоль) и цистамин (2,7 г, 35 ммоль) растворяли в 300 мл дихлорметана и при 0 С медленно добавляли комплекс трифторид бора-диэтиловый простой эфир (10 мл). Реакционную смесь перемешивали в течение 3 ч при 0 С и затем 1 ч при комнатной температуре. Реакцию гасили 5% NaHCO3 и смесь экстрагировали дихлорметаном. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией с применением смеси этилацетат/гексан (10:90) с получением продукта в виде коричневого воска, выход 6,5 г. 1 Н ЯМР: 0,86 (д, J=7,0 Гц, 3 Н, 9-Ме), 0,97 (д, J=5,95 Гц, 3 Н, 6-Ме), 1,25, 1,45 (с, 3 Н, 3-Ме), 1,23-1,94DHA (7,1 г, 25 ммоль) и 3,5-ди-трет-бутил-2-(аминометил)фенол (7,06 г, 30 ммоль) растворяли в 300 мл дихлорметана и при 0 С медленно добавляли комплекс трифторид бора-диэтиловый простой эфир (10 мл). Реакционную смесь перемешивали в течение 3 ч при 0 С и затем 1 ч при комнатной температуре. Реакцию гасили 5% NaHCO3 и смесь экстрагировали дихлорметаном. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией с применением смеси этилацетат/гексан (10:80) с получением продукта в виде твердого вещества, выход 6,0 г. 1 Н ЯМР: 0,86 (д, J=7,0 Гц, 3 Н, 9-Ме), 0,97 (д, J=5, 95 Гц, 3 Н, 6-Ме), 1,34 (с, 18 Н), 1,45 (с, 3 Н, 3-Ме),1,23-1,94 (м, 9 Н), 2,04 (ддд, J=14,5, 5,0, 3,0 Гц, 1 Н), 2,39 (ддд, J=14,5, 5,0, 15 3,0 Гц, 1 Н), 2,55 (м, 1 Н, Н-9),3,91 (с, 2 Н), 5,850 (д, J=10,0 Гц, 1 Н, Н-10), 5,45 (с, 1 Н, Н-12), 6,44 (д, 1 Н), 6,76 (д, 1 Н). Пример 15. Синтез дигидроартемизинил-N,N-диметилацетамида 4-(Диметиламино)пиридин (0,5 г, 4,1 ммоль) и диметилкарбамоилхлорид (3,23 г, 30 ммоль) добавляли к перемешиваемому раствору DHA (7,1 г, 25 ммоль) в дихлорметане (400 мл) и реакционную смесь непрерывно перемешивали на протяжении ночи. Неочищенный продукт промывали водой (2100 мл),растворитель удаляли при пониженном давлении и продукт перекристаллизовывали из смеси этилацетат/гексан с получением желтого твердого вещества, выход 8,0 г (90%). 1 Н ЯМР: 0,86 (д, J=7,0 Гц, 3 Н, 9-Me), 0,97 (д, J=5,95 Гц, 3 Н, 6-Ме), 1,45 (с, 3 Н, 3-Ме), 1,23-1,94 (м,9 Н), 2,04 (ддд, J=14,5, 5,0, 3,0 Гц, 1 Н), 2,39 (ддд, J=14,5, 5,0, 15 3,0 Гц, 1 Н), 2,55 (м, 1 Н, Н-9), 2,90 (с, 6 Н,N(CH3)2, 5,45 (с, 1 Н, Н-12), 5,850 (д, J=10,0 Гц, 1 Н, Н-10).- 10018238 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, содержащее производное артемизинина общей формулы (I) ковалентно связанное в положении 1 или 2 с соединением с биологической активностью или его фармацевтически приемлемой солью посредством сульфидной (-S-), простой эфирной (-O-), сложной эфирной (-OCO-) или аминной (-N-) связи; и в котором соединение с биологической активностью выбрано из группы, состоящей из метил-N-(1 Н-бензимидазол-2-ил)карбамата, метоксиуксусной кислоты, 2,2 дихлорацетата, 5-фтор-1 Н-пиримидин-2,4-диона, ацетата, изобутирата, бутирата и пропилпентаноата. 2. Соединение по п.1, в котором производное артемизинина получено из соединения, выбранного из группы, состоящей из дигидроартемизинина, ангидродигидроартемизинина и деоксоартемизинина. 3. Соединение, выбранное из группы, состоящей из соединения формулы (II) 4. Способ получения соединения по любому из пп.1-3, включающий ковалентное связывание производного артемизинина по любому из пп.1-3 с соединением с биологической активностью по любому из пп.1-3 посредством сульфидной (-S-), простой эфирной (-O-), сложной эфирной (-OCO-) или аминной
МПК / Метки
МПК: A61P 33/06, C07D 493/20, A61K 31/365
Метки: биологически, 2-замещенные, артемизинина, повышения, соединений, активности, производные, биологической, активных
Код ссылки
<a href="https://eas.patents.su/14-18238-1-ili-2-zameshhennye-proizvodnye-artemizinina-dlya-povysheniya-in-vivo-biologicheskojj-aktivnosti-biologicheski-aktivnyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">1- или 2-замещенные производные артемизинина для повышения in vivo биологической активности биологически активных соединений</a>
Предыдущий патент: Устройство защиты иглы для медицинского устройства и внутривенный катетер
Следующий патент: Акустическое измерение толщины с использованием газа в качестве связующей среды
Случайный патент: Пептид или пептидомиметик, который связывается с рецептором тромбоэтина, фармацевтическая композиция и способ лечения.












