Определение антигенов, расположенных на эритроцитах, и антиэритроцитарных антител
Номер патента: 17380
Опубликовано: 28.12.2012
Авторы: Бюффьер Фредерик, Ривалэн Эльян, Рэзэн Ив, Санхуан Ампаро
Формула / Реферат
1. Способ in vitro для идентификации множества антигенных молекул, расположенных на эритроцитах индивидуума, и/или для идентификации множества антител против антигенных молекул, расположенных на эритроцитах, в биологическом образце,
указанные антигенные молекулы, расположенные на эритроцитах, состоящие из антигенных молекул, расположенных как на эритроцитах, так и по меньшей мере на одной другой клеточной популяции, отличаются от молекул групп крови,
причем указанный способ включает:
(а) идентификацию множества антигенных молекул, расположенных на эритроцитах индивидуума, путем
(i) приведения указанного образца, содержащего эритроциты, в контакт в единственной емкости для проведения теста или в нескольких отдельных емкостях для проведения теста с группами различимых бус, причем каждая группа различимых бус несет данное антитело, специфичное для антигенной молекулы, расположенной на эритроцитах, при этом группы бус отличаются друг от друга, при условиях, позволяющих эритроцитам связываться с антителами без агглютинации, причем указанные эритроциты метят до или после приведения их в контакт с указанными группами бус,
(ii) удаления эритроцитов, которые не связались с указанными антителами, и
(iii) идентификации группы бус, связавшихся с мечеными эритроцитами, таким образом, идентифицируя антигены, расположенные на обнаруживаемых эритроцитах;
и/или
b) идентификацию множества антител против антигенных молекул, расположенных на эритроцитах, в биологическом образце путем
(iv) приведения указанного образца в контакт в единственной емкости для проведения теста или в нескольких отдельных емкостях для проведения теста с группами различимых бус, причем каждая группа различимых бус несет (1) эритроциты или (2) фрагменты мембраны эритроцитов известного фенотипа, который отличается у каждой группы бус, при условиях, в которых антитела или активированные фракции комплемента сыворотки, присутствующие в образце, связываются с эритроцитами или фрагментами мембраны эритроцитов без агглютинации,
(v) удаления антител или активированных фракций комплемента сыворотки, которые не связались с указанными эритроцитами или указанными фрагментами мембраны эритроцитов,
(vi) мечения связавшихся антител и/или связавшихся активированных фракций комплемента сыворотки и
(vii) идентификации группы бус, связавшихся с мечеными антителами или мечеными активированными фракциями комплемента сыворотки, таким образом, идентифицируя антитела против антигенных молекул, расположенных на эритроцитах, которые присутствуют.
2. Способ по п.1, в котором идентификацию антигенов по пункту (а) и идентификацию антител по пункту (b) осуществляют одновременно в одной и той же емкости.
3. Способ по любому из предшествующих пунктов, в котором анализ смеси осуществляют с помощью проточной цитометрии.
4. Способ по любому из предшествующих пунктов, который дополнительно содержит стадию химического или ферментативного разрушения гемоглобина, такого как гемолиз.
5. Способ по любому из предшествующих пунктов, в котором различимые бусы представляют собой сверхпарамагнитные, или магнитные, или намагничивающиеся бусы.
6. Способ по любому из предшествующих пунктов, в котором различимые бусы испускают люминесцентные или флуоресцентные сигналы.
7. Способ по любому из предшествующих пунктов, в котором эритроциты, меченные детектируемым образом, метят флуоресцирующим соединением.
8. Способ по любому из предшествующих пунктов, в котором антитела (по пункту b) метят путем приведения в контакт с антителом против глобулина человека, несущим флуоресцентную, люминесцентную или радиоактивную метку.
9. Способ по любому из предшествующих пунктов, в котором активированные фракции комплемента сыворотки метят путем приведения в контакт с антителом против фракции комплемента сыворотки, несущим флуоресцентную, люминесцентную или радиоактивную метку.
10. Способ по любому из предшествующих пунктов, в котором биологический образец выбран из группы, состоящей из цельной крови, плазмы, сыворотки, осадка клеток крови или любого другого препарата крови.
11. Способ по любому из предшествующих пунктов, в котором биологический образец получают у индивидуума, эритроциты которого либо сенсибилизированы in vivo антителами, либо покрыты фракцией комплемента сыворотки.
12. Способ по любому из предшествующих пунктов, дополнительно включающий количественную оценку идентифицируемых антител.
13. Способ по любому из предшествующих пунктов, в котором антигенные молекулы представляют собой молекулы системы HLA, химические продукты или лекарственные препараты, абсорбируемые индивидуумом, или продукты их деградации.
14. Набор реагентов для осуществления способа обнаружения по любому из предшествующих пунктов, содержащий группы различимых бус, каждая из которых имеет по меньшей мере один определенный физический параметр, который может быть обнаружен и относится по меньшей мере к двум различным группам, одна из которых содержит иммобилизованное антитело, специфичное для антигенной молекулы, расположенной на эритроцитах, а другая группа несет (1) эритроциты или (2) фрагмент мембраны эритроцитов.
Текст
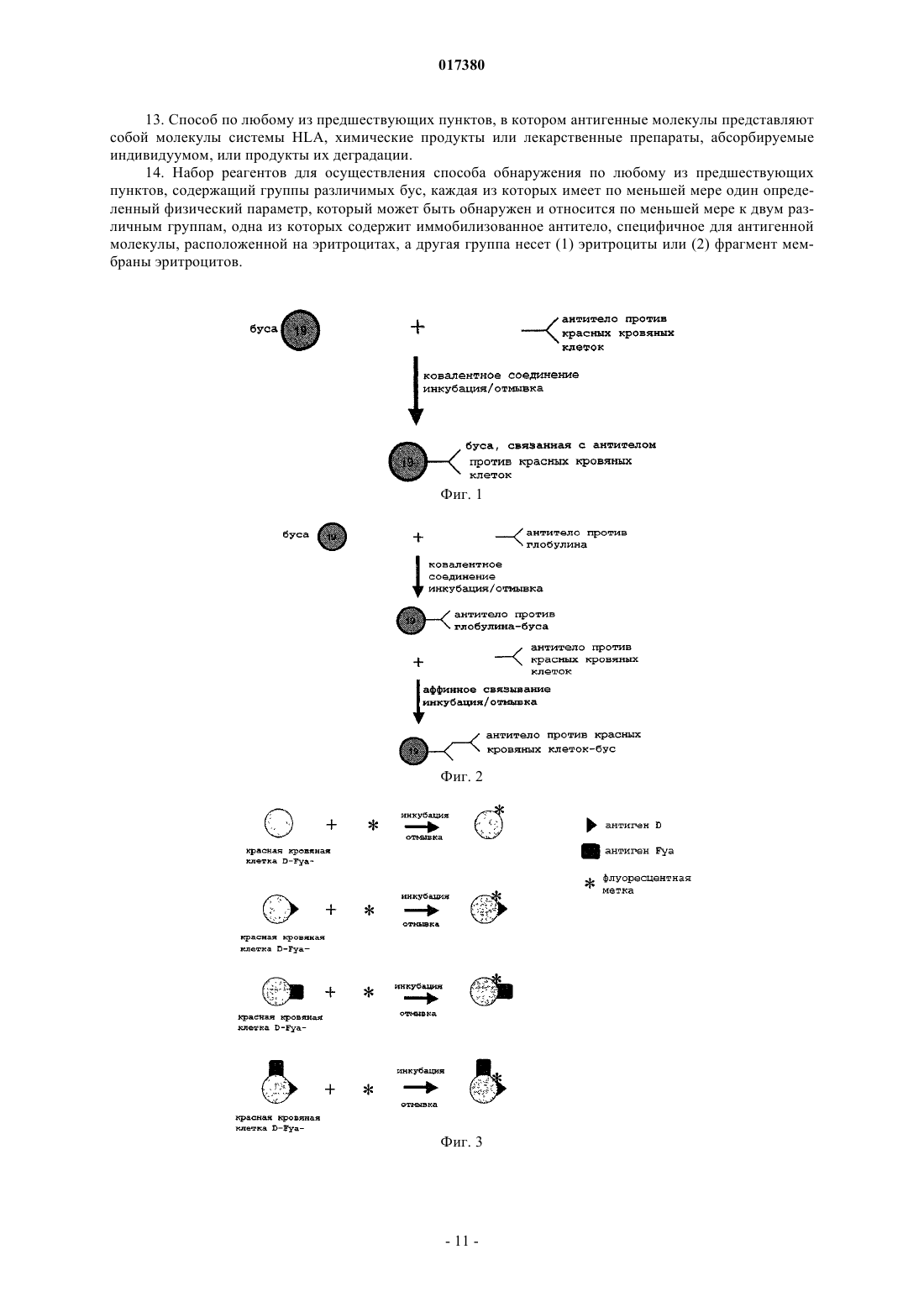
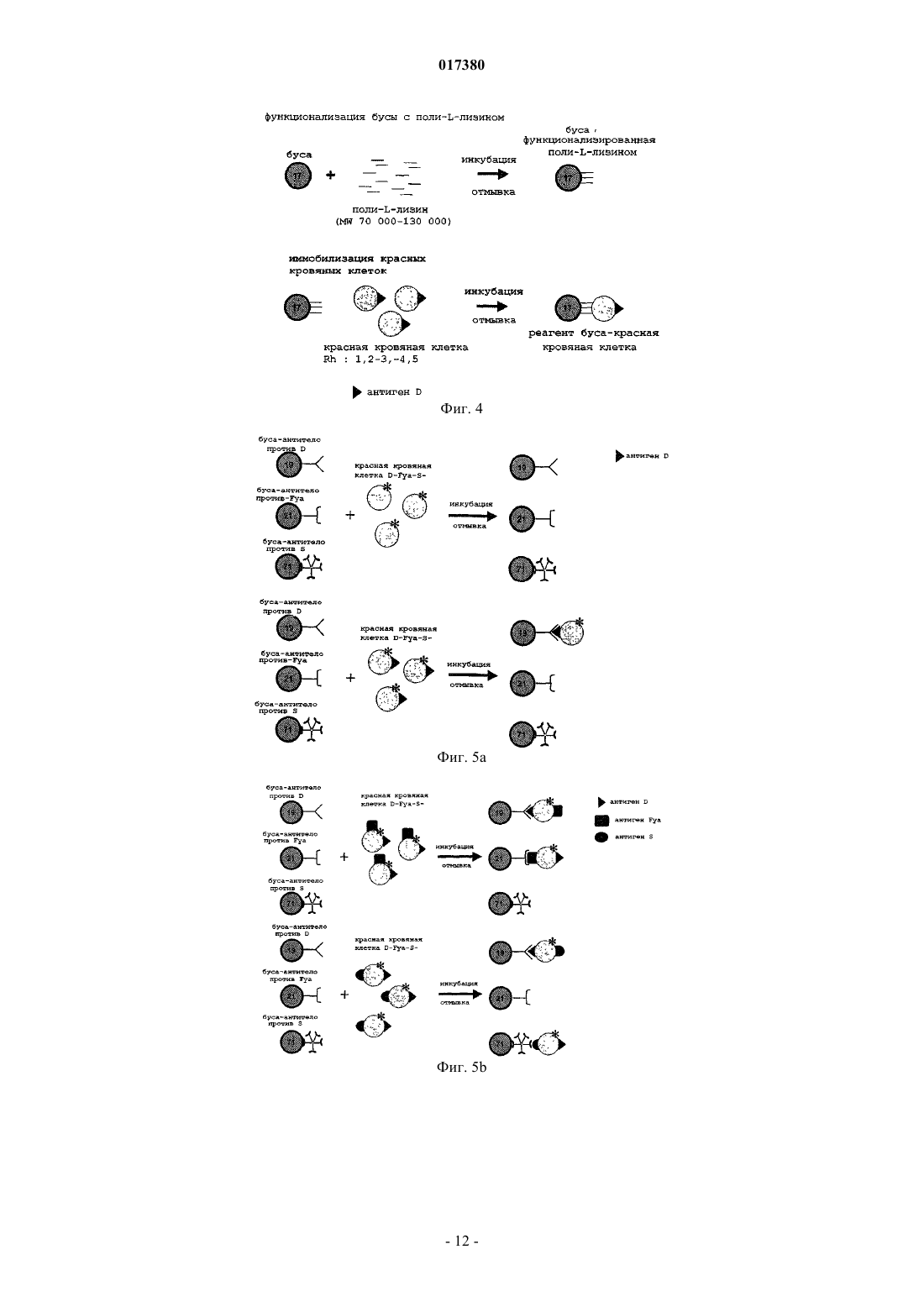
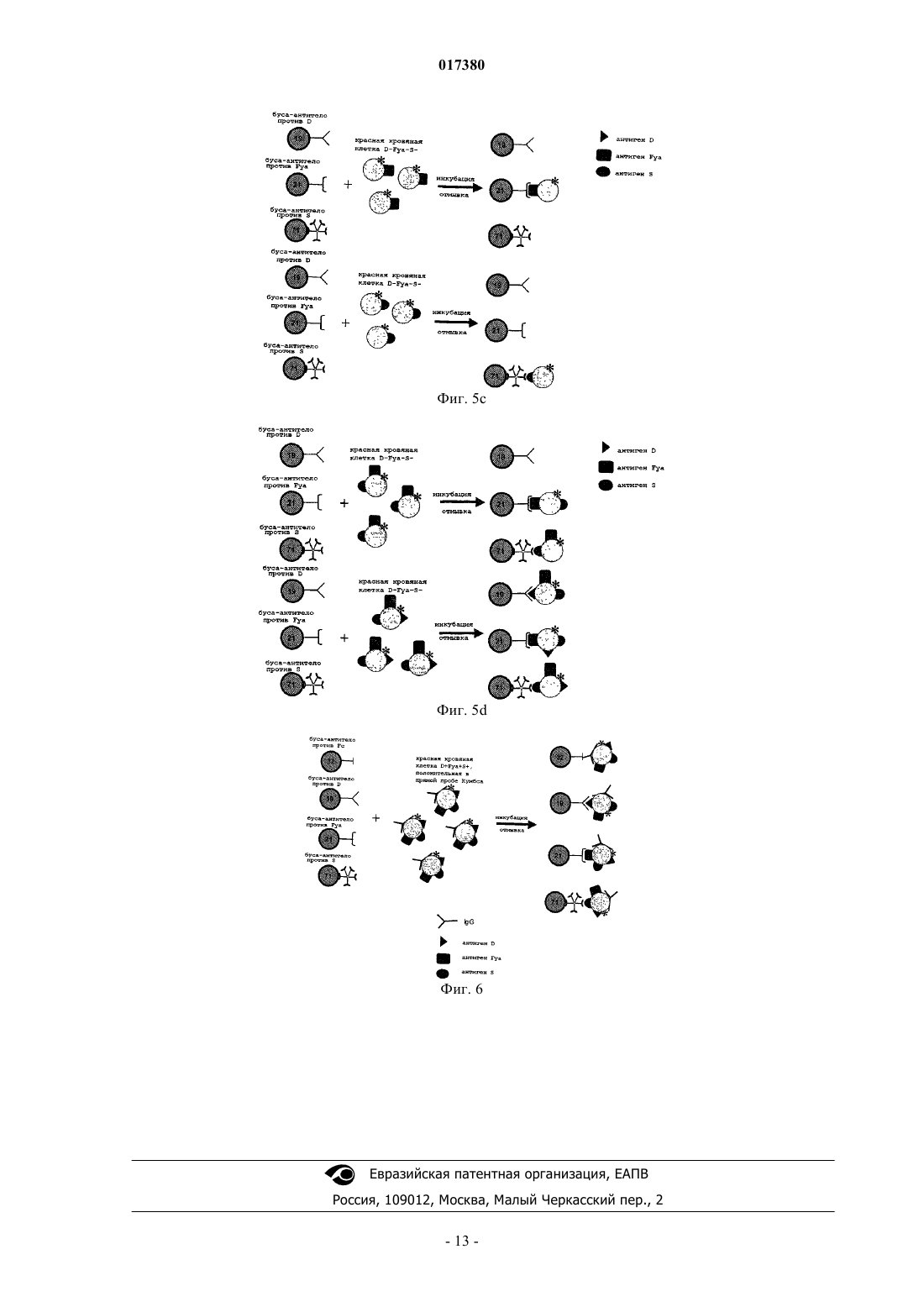
Изобретение относится к способу детекции множества антигенных молекул, расположенных на эритроцитах, и/или множества антиэритроцитарных антител, причем указанные антигенные молекулы, расположенные на эритроцитах, состоят из антигенных молекул, расположенных не только на эритроцитах, но также по меньшей мере и на одной другой клеточной популяции,отличающихся от молекул антигенов групп крови, указанный способ содержит приведение образца в контакт с различимыми бусами, на которые присоединяются: (a) антитела, специфичные для указанных антигенов, или (b) эритроциты или фрагмент мембраны эритроцитов. 017380 Настоящее изобретение основано на наличии антигенных молекул, что позволяет идентифицировать антигенные молекулы, находящиеся как на эритроцитах, так и на клетках других популяций. В настоящее время переливание крови проводят внутривенным введением препаратов концентратов эритроцитов (концентратов клеток крови), полученных у доноров крови. При переливании крови основной риск связан с возможностью антитела и его эритроцитарного антигена связываться в организме реципиента (индивидуума, которому переливают кровь). В действительности, на поверхности эритроцитов существуют мембранные антигены, в частности антигены групп крови (или систем), способные распознаваться иммунной системой и вызывать иммунный ответ с гемолизом красных кровяных клеток. Последствия такой иммунологической реакции могут различаться от неэффективной трансфузии с отсутствием клинических признаков до легкой клинической реакции (тревога, озноб), тяжелой клинической реакции (шок, гемоглобинурия, почечная недостаточность) или критической клинической реакции(шок, диссеминированный внутрисосудитый гемолиз), приводящий к летальному исходу. Полагают, что эритроциты донора совместимы с кровью реципиента, если у реципиента нет никаких циркулирующих антител, направленных против эритроцитарного антигена донора. Помимо антигенов групп крови у 15% индивидуумов в популяции, исследованной во Франции, на эритроцитах было определено наличие антигенных детерминант HLA (de Villartay et al., Tissue Antigens,1985, 26(1):12-9). Несмотря на то что это количество антигенных детерминант системы HLA на эритроцитах является низким по сравнению с другими видами клеток, оно все-таки существенно для переливания крови (Everett et al., Transplantation, 1987, vol. 44, no. 1, p. 123-129). Авторы изобретения, сфокусировавшись исходно на риске трансфузии, впоследствии поняли, что кроме молекул антигенов групп крови может без труда быть определена любая антигенная молекула,используя преимущество их характерного наличия на эритроцитах. Сущность изобретения Изобретение относится к in vitro способу идентификации множества антигенных молекул, расположенных на эритроцитах индивидуума, и/или идентификации множества антител против антигенных молекул, расположенных на эритроцитах, в биологическом образце, причем указанные антигенные молекулы, расположенные на эритроцитах, состоят из антигенных молекул, расположенных как на эритроцитах, так и, по меньшей мере, на любой другой клеточной популяции, отличной от молекул групп крови, причем указанный способ включает: а) идентификацию множества антигенных молекул, расположенных на эритроцитах индивидуума,путем(i) приведения в контакт указанного образца, содержащего эритроциты, в одном резервуаре для испытания или в нескольких отдельных резервуарах для испытания с группами различимых бус, причем каждая группа различимых бус несет данное антитело, специфичное к антигенной молекуле, расположенной на эритроцитах, при этом все группы бус отличаются друг от друга, при условиях, когда эритроциты связываются с антителами без агглютинации, причем указанные эритроциты метят до или после их приведения в контакт с указанными группами бус,(ii) удаления эритроцитов, которые не связались с указанными антителами, и(iii) идентификации группы бус, связавшихся с мечеными эритроцитами, таким образом, идентифицируя антигены, расположенных на детектируемых эритроцитах; и/или(b) идентификацию множества антител против антигенных молекул, расположенных на эритроцитах, в биологическом образце с помощью(iv) приведения в контакт указанного образца в одном резервуаре для испытания или в нескольких отдельных резервуарах для испытания с группами различимых бус, причем каждая группа различимых бус несет (1) эритроциты или (2) фрагменты мембраны эритроцитов известного фенотипа, который отличается между группами бус, в условиях, при которых антитела или активированные фракции комплемента сыворотки, присутствующие в образце, связываются с эритроцитами или фрагментами мембраны эритроцитов без агглютинации,(v) удаления антител или активированных фракций комплемента сыворотки, которые не связались с указанными эритроцитами или с указанными фрагментами мембраны эритроцитов,(vi) мечения связавшихся антител и/или связавшихся активированных фракций комплемента сыворотки и(vii) идентификации группы бус, связанных с мечеными антителами или мечеными активированными фракциями комплемента сыворотки, таким образом, идентифицируя наличие антител против антигенных молекул, расположенных на эритроцитах. Изобретение также относится к набору реагентов для осуществления указанного способа, содержащему группы различимых бус, причем каждая группа несет по меньшей мере один определенный физический параметр, который может быть обнаружен, и принадлежит по меньшей мере к двум различным группам, одна из которых несет иммобилизованное антитело, специфичное для антигенной молекулы,расположенной на эритроцитах, а другая группа несет (1) эритроциты или (2) фрагмент мембраны эритроцитов.-1 017380 Подробное описание изобретения Определения В настоящем описании термины эритроцит или красная кровяная клетка используются взаимозаменяемо для обозначения одной и той же клетки крови. Под термином мультиплексный понимают, что несколько различных реакций типа антигенантитело анализируют одновременно для одного образца в общем резервуаре и используя одну систему считывания сигнала. Под термином простой понимают, что реакции типа антиген-антитело анализируют в нескольких отдельных резервуарах. Предпочтительно анализы все равно осуществляют одновременно, и предпочтительно используя одну систему считывания сигнала. Под выражением антигенная молекула, расположенная на эритроцитах понимают любую антигенную молекулу, расположенную на эритроцитах, в том числе антигенные молекулы, которые расположены как на эритроцитах, так и по меньшей мере на любой другой клеточной популяции. К ним не относятся молекулы групп крови. Под термином антиген групп крови понимают любой антиген системы АВО с антигеном А, антигеном В и антигенами А и В, экспрессируемыми одновременно, или антигеном Н, системы резус с антигенами D, Е, е и С или с, системы Kell с антигеном K или k, системы Duffy (Fya,Fyb), системы Kidd (Jka, Jkb) или каких-либо других систем, которые менее изучены на практике, но которые также существуют, таких как MNS, Lewis и т.д. Клеточные популяции, несущие интересующие антигенные молекулы, могут представлять собой клетки крови (лимфоциты), включая тромбоциты. К примерам интересующих антигенных молекул, расположенных на эритроцитах и других клеточных популяциях, относятся молекулы системы HLA, в частности HLA B-27, CD55 и/или CD29 (Terpos etal., Medical Science Monit. 2008, 14 276-280). К другим примерам интересующих антигенных молекул относятся маркеры старения эритроцитов, например фосфатидилсерин (PS). Изобретение относится к антигенам эритроцитов, которые обнаруживают на поверхности эритроцитов и на поверхности других типов или популяций клеток в физиологическом состоянии или при патологии. Изобретение также относится к антигенам, присутствующим на поверхности эритроцитов путем иммунологических реакций, обусловленных антигенами эритроцитов. В этом случае выражение антигенная молекула, расположенная на эритроцитах включает антитела или элементы фракции комплемента сыворотки, расположенные на эритроцитах, сенсибилизированных in vivo. Изобретение относится к антигенным молекулам, не обнаруживаемым в физиологическом состоянии, например химическим продуктам или лекарственным препаратам, абсорбированным индивидуумом, или продуктам их деградации. Изобретение также относится к антигенным молекулам, адсорбируемым на эритроцитах, но происходящим из других клеточных популяций. Под термином расположенный на эритроцитах понимают экспрессию на мембране, адсорбцию или экспрессию в межклеточном пространстве, причем антигенные молекулы становятся доступны при обработке или за счет воздействия физиологического процесса эритроцита (например, в процессе старения эритроцита). Под выражением антитело против антигенных молекул, расположенных на эритроцитах или антиэритроцитарное антитело понимают любое антитело, которое специфически связывается с антигеном,расположенным на эритроцитах и, по меньшей мере, на любой другой популяции клеток. Под термином мечение связавшихся антител и/или связавшихся фракций комплемента сыворотки понимают мечение антител или (необязательно активированных) фракций комплемента сыворотки, которые обратимо связываются или непосредственно встраиваются в мембрану эритроцита. Под термином индивидуум понимают любое животное, имеющее множество антигенных молекул, расположенных на эритроцитах. В качестве животных можно упомянуть, например, собаку, у которой на сегодняшний день идентифицировано восемь различных групп крови, и кошку, которая имеет три группы крови. Конечно, под термином индивидуум также понимают человека, включая внутриутробную стадию развития. Под термином биологический образец понимают любую фракцию жидкости организма или биопсии тканей, которая может содержать эритроциты или антиэритроцитарные антитела либо в физиологическом состоянии, либо при патологии. В качестве биологического образца можно упомянуть поэтому образец крови и, в частности, образец цельной крови или образец осадка клеток крови (или контейнер для крови) или любой другой препарат крови, а также слюнную жидкость, пот, слезы, молоко или мочу,если они содержат кровь. Для скрининга антител также можно использовать образец плазмы или сыворотки. Образец, используемый в способе (а) для обнаружения антигенных молекул, может быть идентичным или отличаться от образца, используемого для детекции антител. При идентичности образца способы (а) и (b) могут быть осуществлены в одном и том же резервуаре одновременно. Биологический образец можно не подвергать предварительной обработке. Под термином антитело понимают любое целое антитело или функциональный фрагмент антите-2 017380 ла, содержащий или состоящий по меньшей мере из одного сайта взаимодействия с антигеном, который дает возможность указанному антителу связываться по меньшей мере с одной антигенной детерминантой соединения антигена. В качестве примера фрагментов антитела можно упомянуть фрагменты Fab,Fab' и F(ab')2, а также цепи scFv (одноцепочечный вариабельный фрагмент), цепи dsFv (двуцепочечный вариабельный фрагмент) и т.д. Эти функциональные фрагменты могут быть получены, в частности, посредством генной инженерии. Под термином иммобилизованное антитело понимают антитело или часть антитела, присоединенную к твердой фазе, которая способна удерживать по меньшей мере одну антигенную детерминанту антигенного соединения, присутствующего в биологическом образце, за счет аффинного связывания. Антитела, используемые в качестве средства обнаружения, могут быть поликлональными или моноклональными. Продукция моноклональных антител или поликлональных антител, которые могут быть использованы в контексте изобретения, соответствует принятым методикам. Моноклональные антитела могут быть получены согласно принятому способу слияния лимфоцитов и культивирования гибридомы, описанному Kohler и Milstein (Nature, 256, p. 495-497(1975. Известны также и другие способы получения моноклональных антител (Harlow et al. editors, Antibodies A Laboratory Manual, Cold Spring Harbor Laboratory (1988. Моноклональные антитела могут быть получены иммунизацией млекопитающего (например, мыши, крысы, кролика или даже человека и т.д.), используя технику продукции гибридом путем слияния лимфоцитов (Kohler и Milstein, 1975, выше). Кроме этой принятой методики существуют и альтернативные методики. Моноклональные антитела могут быть получены, например, за счет экспрессии нуклеиновой кислоты, клонированной из гибридомы. Антитела также могут быть получены методом фагового дисплея путем встраивания кДНК антитела в векторы, которые, как правило, представляют собой нитевидные фаги (например, fUSE5 для E.coli,Scott et al. (Science, 249, p. 386-390 (1990. Последние образуют библиотеки и несут фрагменты scFv на своей поверхности. Протоколы создания этих библиотек антител описываются в статье Marks et al. (J.Mol. Biol., 222, p. 581-597(1991. Поликлональные антитела могут быть получены из сыворотки животного, иммунизированного против антигена, предпочтительно, пептидной природы, в соответствии с принятыми методиками. Как правило, в качестве иммуногена может быть использован, например, полипептид, в частности рекомбинантный полипептид, или олигопептид. Согласно принятому протоколу кроликов иммунизируют эквивалентом 1 мг пептидного иммуногена в соответствии с процедурой, описанной Benoit et al.[PNAS USA, 79, p. 917-921 (1982)]. Бусы Бусы, как правило, состоят из полимеров, которые инертны для компонентов биологических образцов; они представляют собой твердую фазу и нерастворимы в образцах. Используемые полимеры могут представлять собой сложные полиэфиры, простые полиэфиры, полиолефины, полиамиды, полисахариды,полиуретаны или целлюлозы. Для получения целостных и структурированных частиц также могут быть использованы связующие вещества. Для облегчения присоединения или связывания интересующих биологических макромолекул (белков, липидов, углеводов, нуклеиновых кислот) с этими полимерами могут быть встроены функциональные группы. Эти функциональные группы, которые известны специалистам в данной области, могут представлять собой функции амина (-NH2) или аммония (-NH3+ или -NR3+), спиртовые функции (-ОН),карбоксильные функции (-СООН) или функции изоцианата (-NCO). Наиболее часто используемые мономеры для встраивания функциональной группы СООН в полиолефины представляют собой акриловую кислоту или метакриловую кислоту. Присоединение реагентов к поверхности бус может быть осуществлено электростатическим притяжением, аффинными взаимодействиями, гидрофобными взаимодействиями или ковалентным связыванием. Предпочтительно ковалентное связывание. Бусы, используемые в изобретении, представляют собой частицы, приблизительно сферические по форме, с размерами, которые могут составлять от 0,5 до 40 мкм, предпочтительно от 4 до 9 и более конкретно от 5 до 8 мкм. Используемые в настоящем изобретении бусы являются различимыми, то есть они обладают разными маркерами, что делает возможным их различие друг от друга с помощью подходящего детектора. Каждая группа бус поэтому обладает различными физико-химическими свойствами (размером, плотностью, размером частиц, неровностями, поглощением, флуоресценцией, парамагнитными компонентами),что дает возможность отличить их друг от друга с помощью подходящих детекторов или приборов, например проточного цитометра. В качестве отличительного параметра для различения частиц друг от друга можно использовать, в частности, размер частиц, выбирая неперекрывающиеся диапазоны размеров. В другом предпочтительном варианте осуществления различимые частицы испускают флуоресцентные сигналы. Бусы, в которые встроены различные флуоресцентные метки, фактически могут отличаться своим спектром флуоресценции. Для этого бусы могут быть импрегнированы одним или несколь-3 017380 кими красителями (например, флуоресцентными, люминесцентными и т.д.), при необходимости, в различных концентрациях, или меткой радиоизотопного типа, ферментного типа и т.д. (Venkatasubbarao S.(2004)100:252-266). Для того чтобы бусы различались, также могут быть использованы рассеяние или излучение света или их сочетание. В предпочтительном варианте осуществления различимые бусы испускают люминесцентные или флуоресцентные сигналы. Используемые бусы могут быть сверхпарамагнитными, магнитными или намагничиваемыми. В качестве бус, которые могут быть использованы по изобретению, можно указать, в частности, бусы, описанные в патенте США 6872578. В особенно предпочтительном варианте осуществления используемые бусы являются флуоресцентными и сверхпарамагнитными. Эти физико-химические свойства могут позволить во время прохождения реакции с биологическим образцом отделять фракции, удержанные этими микрочастицами, от фракций, которые не связываются. Это разделение может быть осуществлено в числе прочего с помощью центрифугирования, фильтрации или намагничивания. Предпочтительно разделение намагничиванием, и для этого могут быть использованы бусы, содержащие парамагнитные, ферромагнитные, ферримагнитные и метамагнитные компоненты. Предпочтительны парамагнитные компоненты, например железо, кобальт, никель или оксиды металлов, такие какMn2O3, Cr2O или Fe5O4. Количество магнитных компонентов может составлять от 2 до 50 мас.% и предпочтительно от 3 до 25 мас.%. Антитела могут быть присоединены к бусам посредством любой подходящей методики. Они могут быть присоединены прямой ковалетной связью или нековалентно, в частности, пассивной адсорбцией или аффинно. Прямое ковалентное присоединение может быть осуществлено путем активации карбоксильных групп, присутствующих на поверхности бус, включая связывание, например, через гидроксисукцинимид или карбодиимид. В конкретном варианте осуществления к бусам сначала ковалентно присоединяют антииммуноглобулиновые антитела, а затем бусы приводят в контакт с присоединяемыми антителами. Эритроциты или фрагменты мембраны эритроцитов могут быть присоединены к бусам путем нековалентного связывания через поли-L-лизин или посредством лиганда любого типа, такого как поликатионы красящего типа. Эритроциты или фрагменты мембраны эритроцитов также могут быть присоединены к бусам путем ковалентного связывания, в частности, используя перйодат натрия. Неожиданно было отмечено, что присоединение эритроцитов или фрагментов мембраны ковалентно или нековалентно не влияет на их различимость в способе проточной цитометрии. Бусы подвергают измерению детектором, таким как проточный цитометр, как описано, например, в патентной заявке Luminex WO 97/14028. Таким образом, подгруппы бус, несущие реагент (антитело или эритроцит или мембрану эритроцита) подвергают воздействию биологического образца, причем каждая подгруппа обладает одним или несколькими параметрами классификации, что делает возможность различить бусы одной подгруппы от бус другой подгруппы. Бусы, подвергнутые таким образом воздействию образца, затем проходят через зону оценки (например, проточный цитометр), где собираются данные, относящиеся к параметрам классификации (например, интенсивности испускания флуоресценции),и предпочтительно также данные, относящиеся к наличию или отсутствию комплекса, образованного между реактантом и интересующим аналитом (а именно между бусой и антигенной молекулой, расположенной на эритроците по пункту (а) или антителом по пункту (b) в способе по изобретению). Введение метки Меченные детектируемым образом эритроциты могут быть помечены с помощью любой техники,известной специалистам в данной области. Их можно метить, например, с помощью флуоресцирующего соединения, например флуорофора, который встраивают в мембрану этих клеток. Их можно также метить, используя лиганд, который сам является функционализированным флуоресцентной меткой, этот лиганд способен распознавать структуры на поверхности эритроцитов. Эти лиганды могут представлять собой, например, антитела или лектины животных или растений. Эти типы введения метки могут или не могут быть осуществлены до тестирования. При идентификации антитела оно представляет собой антитела, которые метят, или, альтернативно,оно представляет собой (необязательно активированные) фракции комплемента сыворотки. Возможна любая методика введения метки. Типы мечения также могут быть смешанными. В конкретном варианте осуществления антитела приводят в контакт с антителом против иммуноглобулина человека, несущим флуоресцентную, люминесцентную или радиоактивную метку. В еще одном конкретном, необязательно дополнительном варианте осуществления активированные фракции сыворотки приводят в контакт с антителом, которое специфически распознает активированные фракции комплемента сыворотки, причем указанное антитело несет, например, флуоресцентную, люминесцентную или радиоактивную метку. Такие антитела могут быть моноклональными или поликлональными и хорошо известны специалистам в данной области.-4 017380 Удаление несвязавшихся реагентов Перед осуществлением стадии анализа необходимо удалить реагенты, которые не связались в процессе приведения в контакт и инкубации реагентов. Желательно удалить как можно больше несвязавшегося реагента, чтобы уменьшить фоновый шум и таким образом получить высокую специфичность теста,но условия, которые окажутся слишком жесткими, могут снизить чувствительность указанного теста. Присутствие остаточного количества несвязавшихся реагентов поэтому, как правило, допустимо. Специалистом в данной области с помощью принятых экспериментов могут быть без труда определены условия для получения приемлемого отношения чувствительности и специфичности способа. Удаление несвязавшихся реагентов может быть осуществлено любой методикой, известной специалистам в данной области, такой как отмывка посредством повторных стадий центрифугирования или применение бус сверхпарамагнитного характера и применение магнита. Предпочтительные варианты осуществления Как определено выше, способ по изобретению можно использовать для идентификации антигенов или также для идентификации антител или фракций комплемента сыворотки, которые связываются. Также возможно использование сочетаний нескольких видов идентификации. Таким образом, идентификация антигенов и идентификация антител могут быть осуществлены одновременно, или раздельно. Идентификация антител может быть осуществлена за счет выявления, как антител, так и фракций комплемента сыворотки. Резервуар может представлять собой любой твердый контейнер, например тестируемую пробирку,лунку микропланшета или любой резервуар, который дает возможность проведения реакций в автоматической системе. Нет необходимости центрифугировать резервуары. Смешивание реагентов и интересующего исследуемого образца осуществляют в условиях (в частности, величине рН, температуре, ионной силе и т.д.), которые делают возможным специфическое связывание антигенов, расположенных на эритроцитах, с антителами без агглютинации. Отсутствие существенной агглютинации позволяет использовать, в частности, проточный цитометр. Для предотвращения какую-либо реакцию агглютинации, предпочтительно, отрегулировать количество и размер бус, а также концентрацию образца. Реакции агглютинации удовлетворяют математическим закономерностям, которые, в частности, были описаны Н.Е. Hart, Bulletin of mathematical biology, vol. 42, 17-36, K.C. Chak, Bulletin of mathematical biology, vol 42, 37-56 и С. DeLisi, Journal of Theoretical Biology, 1974, vol. 45, pages 555-575. Эти закономерности включают несколько параметров, таких как, в частности, размер реагентов,а также их количественное соотношение. Специалист в данной области поэтому должен выбрать условия проведения реакции, используя эти математические закономерности как функцию реагентов, которые в них используются, таким образом, чтобы не произошла существенная агглютинация. Например, при использовании эритроцитов и бус размера, подобного размеру эритроцитов, т.е. порядка 7 мкм, специалист в данной области должен выбрать соотношение количества эритроцитов к количеству бус в диапазоне от 30 до 150. Предпочтительно предусмотреть стадию химического или ферментативного разрушения гемоглобина, такого как гемолиз, предпочтительно после присоединения и перед идентификацией антигенов или антител. Гемолиз может быть осуществлен различными способами. Например, смесь может быть инкубирована в среде низкой осмолярности. Под терминомсреда низкой осмолярности понимают, как правило,среду, имеющую осмолярность ниже или эквивалентную 100 мосмоль/л. В качестве подходящей среды низкой осмолярности можно упомянуть растворы хлорида аммония, имеющие концентрацию 40 мМ или ниже, или дистиллированную воду. Гемолиз также может быть осуществлен обработкой ультразвуком. Применение Способ обеспечивает возможность осуществить идентификацию антигенных молекул, расположенных на эритроцитах, в мультиплексном формате. Кроме того, способ делает возможным, например, путем анализа флуоресцентных сигналов, количественно определить соотношение антигенов на поверхности эритроцитов в образце. Способ по изобретению также обеспечивает количественную оценку возможных антител. Таким образом, полученный результат может быть представлен в числовой форме и доступен для упрощенной интерпретации с помощью системы обработки электронных данных. Преимущественно, способ делает возможным получение полных достоверных результатов всего лишь за несколько минут. Конкретнее, можно получить полный результат менее чем за один час или даже менее чем за 30 мин. Способ по изобретению также обеспечивает возможность значительно снизить объем получаемого образца для проведения теста. На сегодняшний день реакции, как правило, осуществляют с тестируемым образцом 25 мкл на каждый тест. Для осуществления способа по изобретению достаточно, например,лишь от 50 до 100 мкл. Изобретение иллюстрируется следующими фигурами и примерами без ограничения его сущности. Описание фигур Фиг. 1 представляет собой схему, на которой иллюстрируется прямая иммобилизация антител на-5 017380 бусы Luminex. Фиг. 2 представляет собой схему, на которой иллюстрируется иммобилизация антител на бусы, аффинно, на бусы Luminex. Фиг. 3 представляет собой схему, на которой иллюстрируется мечение красных кровяных клеток множества фенотипов с помощью соединения, флуоресцирующего внутри мембраны. Фиг. 4 представляет собой схему, на которой иллюстрируется процедура иммобилизации красных кровяных клеток на бусы Luminex посредством поли-L-лизина. На фиг. 5A-5D показано мультиплексное фенотипирование красных кровяных клеток. Фиг. 6 представляет собой схему, на которой иллюстрируется одновременная идентификация и мультиплексное фенотипирование красных кровяных клеток от пациента с положительной прямой пробой Кумбса. Примеры Пример 1. Идентификация антигенов Целью данного анализа является идентификация с помощью специфических моноклональных антител антигенов, которые присутствуют на поверхности красных кровяных клеток доноров или пациентов. Для иммобилизации антител против красных кровяных клеток используют флуоресцирующие бусы. Антитела различных антигенных специфичностей могут таким образом связываться с множеством регионов бус, которые отличаются по цвету. В отношении красных кровяных частиц, их метят с помощью флуоресцентного соединения, совместимого с длинами волн репортерного лазера прибора, продаваемого под названием "Bioplex 200",продукция фирмы Bio-Rad. После введения метки красные кровяные клетки инкубируют с сенсибилизированными бусами. Таким образом, можно детектировать красные кровяные клетки, присоединенные к бусам, а значит, определить их антигенные специфичности. 1.1. - Материал и реагенты Бусы. Используемые бусы производятся фирмой Luminex (Luminex Corp., Austin Texas, United States). Они представляют собой сверхпарамагнитные бусы 8 мкм в диаметре, состоящие из полистирола и метакриловой кислоты (функция СООН). В этом примере используются флуоресцентные сверхпарамагнитные бусы, имеющие множество регионов бус 19, 21, 32, 34 (бусы внутреннего стандарта (ISB, 71 и 98 (контрольные бусы (ВВ. Бусы (ISB), имеющие регион бус 34, функционализованы производным родамина и используются в качестве внутреннего контроля флуоресценции. Эти бусы должны продуцировать величины флуоресценции между 5000 и 15000 RFI. Бусы ВВ с регионом 98 насыщают бычьим альбумином. Эти бусы не связываются ни с антигенами,ни с антителами, и поэтому их используют для подтверждения отсутствия неспецифического связывания. Эти бусы должны продуцировать величины флуоресценции менее чем 1000 RFI. Моноклональное антитело класса IgG против иммуноглобулина человека, клон 125 А 15 (продукция фирмы Bio-Rad). Поликлональное антитело против IgM (mu) человека (продукция фирмы Bio-Rad). Моноклональные антитела класса IgG против D (клон H2D5D2F5), класса IgG против Fya (клон 5T72A13F5A93) и класса IgM против S (MS94) (продукция фирм Bio-Rad, Millxpore). Набор для мечения клеток РКН 2 6 (продукция фирмы Sigma). Среда для разведения, торговые названия "ScanLiss" код 86442 и "Stabilise" код 86550, продукция фирмы Bio-Rad. Гелевые карты, торговое наименование "ScanGel Coombs" код 86432 для скрининга атипичных антител (продукция фирмы Bio-Rad). Гелевые карты, торговые наименования "ScanGelRhK" код 86428 и "ScanGel Neutral" код 86430(продукция фирмы Bio-Rad). Фенотипированные красные кровяные клетки, торговые названия "ScanPanel" код 86593 и "ScanCell" код 86595 для скрининга атипичных антител с помощью техники гетевых карточек (продукция фирмы Bio-Rad). Концентрированные осадки фенотипированных клеток крови, консервированные в среде SAGMAN (продукция фирмы EFS Nord de France). Красные кровяные клетки, позитивные и/или негативные в прямой пробе Кумбса, полученные из образцов пациентов. Жидкость или буфер для покрытия (10 мМ фосфат натрия, 150 мМ NaCl, 0,1 об.% проклин. Бычий сывороточный альбумин (BSA) (продукция фирмы Millipore). Буфер PBS, рН 7,4 (7 мМ фосфат натрия, 2,7 мМ KCl, 136 мМ NaCl). 1.2. - Протокол 1.2.1. Сенсибилизация бус антителами групп крови-6 017380 Иммобилизация антител на поверхности бус может быть осуществлена согласно двум различным принципам. В первом случае антитела иммобилизуют путем ковалентного связывания непосредственно на бусах (фиг. 1). Второй подход заключается в осуществлении иммобилизации антител против красных кровяных клеток нековалентно посредством аффинности. В этом случае присоединение осуществляют с помощью антииммуноглобулинового антитела, присоединенного к бусам ковалентной связью на первой стадии (фиг. 2). В представленных примерах выбирали этот подход. Для ковалентной иммобилизации антитела против иммуноглобулина человека использовали бусы,содержащие регионы 19, 21 и 32. Для ковалентной иммобилизации антитела против IgM человека использовали флуоресцентные бусы, содержащие регион 71. Карбоксильные группы, представленные на поверхности бус, активировали в соответствии с техникой, включающей гидроксисукцинимид и карбодиимид. Белки, таким образом, могли быть иммобилизованы через свои аминогруппы. Полученные таким образом бусы хранят при +4 С при концентрации 3 мг/мл в PBS, рН 7,4, содержащем 10% (мас./об.) BSA, 0,5 об.% Tween 20 и 0,09% (мас./об.) азид натрия. Бусы, несущие иммобилизованные антитела против иммуноглобулина человека, могут быть сенсибилизированы с помощью антител групп крови IgG против D или IgG против Fya. Антииммуноглобулиновое антитело фактически позволяет иммуноглобулинам класса IgG связываться через их Fc-фрагмент. Антитела групп крови, таким образом, нековалентно иммобилизуют на бусах, используя этот принцип. Каждый регион бус сенсибилизируется антителом отличающейся специфичности. Выбранное антиииммуноглобулиновое антитело обладает высоким сродством к иммуноглобулинам человека, таким образом, давая возможность этому связыванию оставаться устойчивым с течением времени. Неочищенные антитела против D и против Fya используют в соответствующих конечных концентрациях 30 и 10 мкг/мл с бусами, функционализованными антителами против Fc при 80 мкг/мг. Сенсибилизацию антителами групп крови осуществляют в PBS, рН 7,4 с встряхиванием при 37 С в течение одного часа. После сенсибилизации бусы промывают несколько раз и затем хранят при + 4 С в PBS, рН 7,4. Бусы, несущие иммобилизованные антитела против mu, могут быть сенсибилизированы с помощьюIgM против S. Антитело против mu фактически дает возможность связывания антител класса IgM. Сродства этой поликлональной сыворотки против mu достаточно для обеспечения связывания, которое остается стабильным с течением времени. Неочищенное антитело против S иммобилизуют на бусах, функционализованных антителом против mu при 40 мкг/мг. Сенсибилизацию осуществляют в PBS, рН 7,4,встряхивая при 37 С в течение одного часа. После сенсибилизации бусы промывают несколько раз и затем хранят при +4 С в PBS, рН 7,4. Перед инкубацией с красными кровяными клетками (сам по себе тест) бусы, сенсибилизированные антителами групп крови, смешивают с контрольными бусами, содержащими регион 34 (ISB), и контрольными бусами, содержащими регион 98 (ВВ). 1.2.2. Мечение красных кровяных клеток Мечение красных кровяных клеток с помощью флуоресцентного соединения может быть осуществлено с использованием множества подходов. В представленных примерах красные кровяные клетки метят, используя РКН 26, который представляет собой флуорофор, встроенный в мембрану красных кровяных клеток. Красные кровяные клетки различных фенотипов, таким образом, могут быть помечены согласно аналогичному протоколу (фиг. 3). РКН 26 представляет собой флуоресцентный зонд, продукция компании Sigma. Этот зонд имеет максимум возбуждения при 551 нм и максимум излучения при 567 нм. Набор включает флуоресцентную метку, которая имеет длинную алифатическую цепочку, позволяющую ей встраиваться в липидный слой клеточных мембран, а также изоосмотический водный разбавитель, не содержащий соли, буфера или органического растворителя. Этот разбавитель дает возможность поддерживать жизнеспособность клеток, растворимость метки и эффективность мечения на высоких уровнях. Мечение красных кровяных клеток с помощью РКН 26 осуществляют, используя протокол, рекомендуемый производителем. Меченые таким образом красные кровяные клетки разводят в буфере Stabiliss и хранят в темноте при +4 С. Качество, жизнеспособность и стабильность меченых красных кровяных клеток подтверждают с течением времени, осуществляя анализы фенотипирования в соответствии с гелевой техникой. Антигенную целостность меченых красных кровяных клеток сравнивают с целостностью немеченых красных кровяных клеток. Качество и стабильность флуоресцентного мечения при их рассмотрении изучают,осуществляя измерения флуоресценции с использованием прибора "Bioplex 200", продукция фирмы BioRad. 1.2.3. Инкубация бус с антителами и красных кровяных клеток Чтобы продемонстрировать осуществимость и подтвердить специфичность типирования согласно технологии по изобретению, авторы изобретения осуществили реакции унитарным образом. В этом случае бусы, функционализованные интересующими антителами, инкубируют по отдельности с красными-7 017380 кровяными клетками различных фенотипов. В случае мультиплексных реакций различные образцы крови приводят в контакт по отдельности с бусами, имеющими разные регионы бус и сенсибилизированными антителами различных специфичностей. Этот вид эксперимента позволял подтвердить возможность определения нескольких антигенных специфичностей в одном и том же тестируемом образце. Сенсибилизированные бусы смешивают с красными кровяными клетками так, чтобы получить соотношение красная кровяная клетка/буса примерно от 50 до 150. Смесь инкубируют в течение 15 мин,встряхивая при 37 С. После инкубации комплексы буса-красная кровяная клетка отмывают несколько раз дистиллированной водой. 1.2.4. Измерения посредством проточной цитометрии с использованием автоматизированного устройства "Bioplex 200", продукция фирмы Bio-Rad После окончательной отмывки и перед измерениями комплексы разбавляют 185 мкл среды жидкость для покрытия. Для каждого теста в прибор автоматически вносят 25 мкл суспензии. Измерения осуществляют фиксацией 250 бус на регион. Для каждого ряда типирование/фенотипирование для подтверждения специфичности исследуемых реакций осуществляют систематические контроли. 1.3. Примеры простого/мультиплексного фенотипирования/типирования Целью этой серии испытаний является демонстрация осуществимости фенотипирования/типирования красных кровяных клеток в унитарном и/или мультиплексном способе. В качестве моделей выбирают антигены D, Fya и S. Для иммобилизации антител против D, против Fya и против S используют бусы, сенсибилизированные антителом против иммуноглобулина человека или против цепиmu. 1.3.1. Унитарное фенотипирование RH D-позитивных красных кровяных клеток Бусы, сенсибилизированные антителом против D, инкубировали с RH D-позитивными и RH Dнегативными красными кровяными клетками, меченными с помощью РКН 26, используя соотношение количество красных кровяных клеток/количество бус 150. Использовали две RH D-позитивные красные кровяные клетки и две RH D-негативные красные кровяные клетки. Каждый образец помещали в прибор в двух повторах.RH D-позитивные красные кровяные клетки продуцируют сильно положительные сигналы порядка от 21000 до 25000 RFI, тогда как у RH D-негативных красных кровяных клеток наблюдаются отрицательные сигналы величиной между 40 и 400 RFI. Контрольные бусы ISB 34, которые дают сигналы порядка 6500 RFI, и контрольные бусы ВВ 98,которые дают сигналы менее 1000 RFI, подтверждают правильность результатов. У множества осуществленных отрицательных контролей наблюдаются сигналы величиной между 15 и 400 RFI, что подтверждает специфичность реакций. RH D-позитивные и RH D-негативные красные кровяные клетки посуществу не связываются с бусами в отсутствие антител против D. Эти результаты указывают на возможность очень четкого различения RH D-позитивных и RH Dнегативных красных кровяных клеток и, таким образом, идентификации антигена D на поверхности красных кровяных клеток. Унитарное фенотипирование красных кровяных клеток Fya и S может быть осуществлено в соответствии с тем же принципом, используя специфические антитела изотипа G или изотипа М. 1.3.2. Мультиплексное фенотипирование красных кровяных клеток D, Fya и S Принцип мультиплексного фенотипирования суммирован на фиг. 5A-5D. В этом случае бусы с регионом 19, сенсибилизированные антителами против D, смешивали с бусами, содержащими регион 21, сенсибилизированными антителами против Fya, а также с бусами, содержащими регион 71, сенсибилизированными антителами против S. Эту смесь бус инкубировали с красными кровяными клетками, обладающими различными фенотипами D, Fya и S: D+Fya+S+/D+Fya-S-/D-Fya+S-/D-Fya-S-/D-Fya-S+/D-Fya+S+/D+Fya-S+/D+Fya+S-. Использовали соотношение количество красных кровяных клеток/количество бус, равное 50. При связывании бус, сенсибилизированных данным антителом, с красной кровяной клеткой, обладающей соответствующей антигенной специфичностью, получают положительные сигналы величиной между 13000 и 29000 RFI. Между измеренными флуоресцентными сигналами и фенотипом красных кровяных клеток, использованных для осуществления теста, обнаруживают полное соответствие. При приведении бусы, сенсибилизированной антителом, в контакт с красной кровяной клеткой, которая не несет соответствующий антиген, получают сигнал менее 1000 RFI. Более того, контроли, осуществленные с бусами, не сенсибилизированными антителом, продуцируют негативные сигналы независимо от использованных красных кровяных клеток. Эти результаты указывают на то, что измеренные сигналы специфичны: связывание буса-красная кровяная клетка наблюдается, лишь если содержится пара антиген-антитело.-8 017380 Анализы подтверждаются результатами, полученными с контрольными бусами ISB 34 (11000 RFI) и ВВ 98 (менее 1000 RFI). Величины коэффициентов вариации в испытании находятся между 1 и 10%, что указывает на удовлетворительную воспроизводимость теста. Эти результаты демонстрируют осуществимость трехпараметрового мультиплексного фенотипирования красных кровяных клеток согласно технологии по изобретению. 1.3.3. Мультиплексное фенотипирование красных кровяных клеток, позитивных в прямой пробе Кумбса (CD+) Применение мультиплексного подхода с микрогранулами дает возможность идентифицироватьCD+характер и одновременно фенотипировать красные кровяные клетки согласно принципу, описанному на фиг. 6. Бусы с регионом 32, сенсибилизированные антителом против Fc, смешивают с бусами, содержащими регионы -19, -21 и -71, соответственно сенсибилизированными антителами против D, против Fya и против S. CD+ красные кровяные клетки, сенсибилизированные in vivo антителом, могут связываться с антителом против иммуноглобулина человека, расположенным на бусах с регионом 32, таким образом,давая возможность идентифицировать CD+характеристику. Более того, эти красные кровяные клетки также могут связываться с бусами, содержащими регионы-19, -21 и -71, несущими антитела, специфичные для антигенов D, Fya и S в соответствии со специфичностями, представленными на мембране красных кровяных клеток. Этот подход демонстрировали, используя соотношение количество красных кровяных клеток/количество бус порядка 40. Контрольные бусы ISB 34 и ВВ 98 продуцируют предполагаемые сигналы, т.е. соответственно порядка 13000 RFI и менее 1000 RFI, и подтверждают правильность результатов. Две CD+ красных кровяных клетки продуцируют положительные сигналы больше чем 30000 RFI с бусами, содержащими регион-32, сенсибилизированными антителом против иммуноглобулина человека. Две CD-негативные красные кровяные клетки с тем же регионом бус продуцируют при их рассмотрении отрицательные сигналы менее чем 500 RFI. Эти результаты указывают на возможность идентификацииCD+ красных кровяных клеток посредством их специфического связывания, используя антитело против глобулина, предварительно связанное с бусой данного региона. Кроме того, результаты также указывают на то, что мультиплексное фенотипирование эритроцитарных антигенов CD+ красных кровяных клеток может быть осуществлено одновременно с идентификацией CD+характера. Фактически, одну из CD+ красных кровяных клеток фенотипируют как D+Fya-S-,а другую D+Fya+S+. Фенотип S этих двух образцов подтверждали согласно принятой технике, используя антитела против S класса IgM. Полученные результаты полностью соответствуют результатам, полученным согласно новой технике. С другой стороны, в отношении фенотипа анти-Fya, такой же анализ осуществить нельзя. На самом деле не существует реагента типа IgM для фенотипирования красных кровяных клеток. Тем не менее, согласно проанализированным CD+ красным кровяным клеткам для фенотипа Fya наблюдается отличие, что подтверждает правильность результатов и дает возможность исключить явление неспецифического связывания. Коэффициенты вариации для большинства образцов находятся между 1 и 5%, что указывает на удовлетворительную воспроизводимость теста. Пример 2. Определение фосфатидилсерина, маркера старения эритроцитов Обнаружение маркеров старения эритроцитов имеет значение в изучении популяций красных кровяных клеток при переливании крови (Cardo L. J. et al. Transfus Apher Sci, 2008 Apr; 38(2): 141-7), а также в изучении явлений, связанных с некоторыми болезнями крови, такими как талассемия (Basu S. et al. Br J.Haematol, 2008 Apr; 141(1): 92-9). Старение эритроцитов проявляется, в частности, появлением на поверхности эритроцитов структуры, именуемой фосфатидилсерин (PS). Тест по изобретению может быть без труда применен для детекции этой молекулы на поверхности красных кровяных клеток. Для этого используют флуоресцентные бусы для иммобилизации тестируемых красных кровяных клеток через поли-L-лизин (PLL). Эти бусы затем приводят в контакт с антителом против фосфатидилсерина в фазе инкубации. После стадии отмывки связывание антитела против фосфатидилсерина с красной кровяной клеткой определяют, инкубируя комплексы буса-красная кровяная клетка с вторичным антителом против Fc(IgG), меченным фикоэритрином (РЕ). Осуществляют стадию конечной отмывки, предназначенную для устранения несвязавшихся антиFc(IgG)-РЕ. Комплексы буса-красная кровяная клетка затем считывают, используя прибор BioPlex200. В качестве стандартного диапазона используют красные кровяные клетки разного возраста, полученные из кровяных пакетов.-9 017380 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ in vitro для идентификации множества антигенных молекул, расположенных на эритроцитах индивидуума, и/или для идентификации множества антител против антигенных молекул, расположенных на эритроцитах, в биологическом образце,указанные антигенные молекулы, расположенные на эритроцитах, состоящие из антигенных молекул, расположенных как на эритроцитах, так и по меньшей мере на одной другой клеточной популяции,отличаются от молекул групп крови,причем указанный способ включает:(а) идентификацию множества антигенных молекул, расположенных на эритроцитах индивидуума,путем(i) приведения указанного образца, содержащего эритроциты, в контакт в единственной емкости для проведения теста или в нескольких отдельных емкостях для проведения теста с группами различимых бус, причем каждая группа различимых бус несет данное антитело, специфичное для антигенной молекулы, расположенной на эритроцитах, при этом группы бус отличаются друг от друга, при условиях, позволяющих эритроцитам связываться с антителами без агглютинации, причем указанные эритроциты метят до или после приведения их в контакт с указанными группами бус,(ii) удаления эритроцитов, которые не связались с указанными антителами, и(iii) идентификации группы бус, связавшихся с мечеными эритроцитами, таким образом, идентифицируя антигены, расположенные на обнаруживаемых эритроцитах; и/илиb) идентификацию множества антител против антигенных молекул, расположенных на эритроцитах, в биологическом образце путем(iv) приведения указанного образца в контакт в единственной емкости для проведения теста или в нескольких отдельных емкостях для проведения теста с группами различимых бус, причем каждая группа различимых бус несет (1) эритроциты или (2) фрагменты мембраны эритроцитов известного фенотипа, который отличается у каждой группы бус, при условиях, в которых антитела или активированные фракции комплемента сыворотки, присутствующие в образце, связываются с эритроцитами или фрагментами мембраны эритроцитов без агглютинации,(v) удаления антител или активированных фракций комплемента сыворотки, которые не связались с указанными эритроцитами или указанными фрагментами мембраны эритроцитов,(vi) мечения связавшихся антител и/или связавшихся активированных фракций комплемента сыворотки и(vii) идентификации группы бус, связавшихся с мечеными антителами или мечеными активированными фракциями комплемента сыворотки, таким образом, идентифицируя антитела против антигенных молекул, расположенных на эритроцитах, которые присутствуют. 2. Способ по п.1, в котором идентификацию антигенов по пункту (а) и идентификацию антител по пункту (b) осуществляют одновременно в одной и той же емкости. 3. Способ по любому из предшествующих пунктов, в котором анализ смеси осуществляют с помощью проточной цитометрии. 4. Способ по любому из предшествующих пунктов, который дополнительно содержит стадию химического или ферментативного разрушения гемоглобина, такого как гемолиз. 5. Способ по любому из предшествующих пунктов, в котором различимые бусы представляют собой сверхпарамагнитные, или магнитные, или намагничивающиеся бусы. 6. Способ по любому из предшествующих пунктов, в котором различимые бусы испускают люминесцентные или флуоресцентные сигналы. 7. Способ по любому из предшествующих пунктов, в котором эритроциты, меченные детектируемым образом, метят флуоресцирующим соединением. 8. Способ по любому из предшествующих пунктов, в котором антитела (по пункту b) метят путем приведения в контакт с антителом против глобулина человека, несущим флуоресцентную, люминесцентную или радиоактивную метку. 9. Способ по любому из предшествующих пунктов, в котором активированные фракции комплемента сыворотки метят путем приведения в контакт с антителом против фракции комплемента сыворотки, несущим флуоресцентную, люминесцентную или радиоактивную метку. 10. Способ по любому из предшествующих пунктов, в котором биологический образец выбран из группы, состоящей из цельной крови, плазмы, сыворотки, осадка клеток крови или любого другого препарата крови. 11. Способ по любому из предшествующих пунктов, в котором биологический образец получают у индивидуума, эритроциты которого либо сенсибилизированы in vivo антителами, либо покрыты фракцией комплемента сыворотки. 12. Способ по любому из предшествующих пунктов, дополнительно включающий количественную оценку идентифицируемых антител.- 10017380 13. Способ по любому из предшествующих пунктов, в котором антигенные молекулы представляют собой молекулы системы HLA, химические продукты или лекарственные препараты, абсорбируемые индивидуумом, или продукты их деградации. 14. Набор реагентов для осуществления способа обнаружения по любому из предшествующих пунктов, содержащий группы различимых бус, каждая из которых имеет по меньшей мере один определенный физический параметр, который может быть обнаружен и относится по меньшей мере к двум различным группам, одна из которых содержит иммобилизованное антитело, специфичное для антигенной молекулы, расположенной на эритроцитах, а другая группа несет (1) эритроциты или (2) фрагмент мембраны эритроцитов.
МПК / Метки
МПК: G01N 33/537, G01N 33/569, G01N 33/543, G01N 33/80
Метки: расположенных, определение, антител, антиэритроцитарных, антигенов, эритроцитах
Код ссылки
<a href="https://eas.patents.su/14-17380-opredelenie-antigenov-raspolozhennyh-na-eritrocitah-i-antieritrocitarnyh-antitel.html" rel="bookmark" title="База патентов Евразийского Союза">Определение антигенов, расположенных на эритроцитах, и антиэритроцитарных антител</a>
Предыдущий патент: Способ идентификации и удаления многократных отражений для построения изображения с помощью пучков
Следующий патент: Способ установления безопасной для человека и животных дозы химических средств защиты растений
Случайный патент: Способ профилактики туберкулеза молодняка крупного рогатого скота