Способ и набор для определения тимидинкиназной активности и их применение
Формула / Реферат
1. Способ определения тимидинкиназной (TK) активности в биологическом образце, включающий стадии
приведения в контакт в контейнере, содержащем одноцепочечный полинуклеотид в качестве праймера или матрицы, присоединенный к твердой поверхности, основной реакционной смеси в буфере, содержащей следующие компоненты: неприсоединенный одноцепочечный полинуклеотид в качестве матрицы и/или праймера, модифицированный дезоксинуклеозид в качестве субстрата киназного фермента, донор фосфата, нуклеотидполимеризующий фермент и источник киназного фермента, лишенный активности TK, с биологическим образцом,
инкубирования смеси,
возможной промывки инкубированной смеси для удаления неприсоединенных компонентов реакционной смеси,
определения количества модифицированного дезоксинуклеозида, встроенного в присоединенный(ую) к твердой поверхности праймер или матрицу, и
определения активности TK, присутствующей в биологическом образце, на основании количества встроенного модифицированного дезоксинуклеозида.
2. Способ по п.1, где инкубированную смесь промывают, а определение количества встроенного модифицированного дезоксинуклеозида осуществляют путем добавления к инкубированной смеси меченой аффинной молекулы с аффинностью к модифицированному дезоксинуклеозиду и определения количества встроенного модифицированного дезоксинуклеозида посредством определения с помощью метки количества присоединившейся к нему меченой аффинной молекулы.
3. Способ по п.1, где источник киназного фермента выбран из группы, состоящей из экстракта клеточной линии млекопитающего, лишенного активности TK, экстракта клеточной линии грибов, лишенного активности TK, экстракта бактериальной клеточной линии, лишенного активности TK, комбинации тимидилаткиназы (TMPK) и нуклеозиддифосфаткиназ (NdK) из очищенных экстрактов клеток млекопитающего, комбинации TMPK и NdK из очищенных экстрактов клеток грибов, комбинации TMPK и NdK из очищенных экстрактов бактериальных клеток, комбинации рекомбинантной TMPK млекопитающего и рекомбинантных NdK млекопитающего, комбинации рекомбинантной TMPK грибов и рекомбинантных NdK грибов и комбинации рекомбинантной бактериальной TMPK и рекомбинантных бактериальных NdK, и любых комбинаций TMPK и NdK из упомянутых источников.
4. Способ по п.3, где источником киназного фермента является экстракт дрожжевых клеток.
5. Способ по п.4, где указанные дрожжевые клетки представляют собой клетки Saccharomyces cerevisiae.
6. Способ по любому из пп.1-5, где модифицированный нуклеозид происходит из соответствующим образом модифицированного дезоксинуклеозида.
7. Способ по любому из пп.1-6, где модифицированный дезоксинуклеозид выбран из группы, состоящей из бромдезоксиуридина, иоддезоксиуридина, фтордезоксиуридина и винилдезокситимидина.
8. Способ по п.7, где модифицированный дезоксинуклеозид представляет собой бромдезоксиуридин.
9. Способ по любому из пп.1-8, где твердая поверхность представляет собой пластмассовую поверхность.
10. Способ по п.9, где пластмассовая поверхность представляет собой поверхность пластмассового микротитрационного планшета.
11. Способ по п.1, где присоединенный к твердой поверхности одноцепочечный полинуклеотид присоединен через свой 5'-конец или иммобилизован с использованием имидазола на активированных планшетах.
12. Способ по п.1, где биологический образец выбран из группы, состоящей из крови, сыворотки, плазмы, спинно-мозговой жидкости (CSF), плевральной жидкости, асцита, тканей, клеток и их экстрактов.
13. Набор для анализа, предназначенный для определения тимидинкиназной (TK) активности в биологическом образце, содержащий в нескольких отдельных контейнерах
присоединенный к твердой поверхности одноцепочечный полинуклеотид в качестве праймера и/или матрицы,
неприсоединенный одноцепочечный полинуклеотид в качестве матрицы и/или праймера,
модифицированный дезоксинуклеозид в качестве субстрата киназного фермента,
донор фосфата,
нуклеотидполимеризующий фермент,
источник киназного фермента, лишенный активности TK, и
буфер.
14. Набор для анализа по п.13, дополнительно содержащий TK сравнения для стандартизации анализа.
15. Набор для анализа по п.13, в котором одноцепочечный полинуклеотид присоединен к поверхности лунок одного или нескольких микротитрационных планшетов.
16. Набор для анализа по п.13, дополнительно содержащий меченую аффинную молекулу с аффинностью к модифицированному дезоксинуклеозиду.
17. Набор для анализа по п.16, где меченая аффинная молекула представляет собой меченный ферментом аффинный конъюгат.
18. Набор для анализа по п.17, где меченный ферментом аффинный конъюгат представляет собой антитело, меченное щелочной фосфатазой или пероксидазой хрена.
19. Набор для анализа по п.13, где источник киназного фермента, лишенный активности TK, выбран из группы, состоящей из экстракта клеточной линии млекопитающего, лишенного активности TK, экстракта клеточной линии грибов, лишенного активности TK, экстракта бактериальной клеточной линии, лишенного активности TK, комбинации тимидилаткиназы (TMPK) и нуклеозиддифосфаткиназ (NdK) из очищенных клеточных экстрактов млекопитающего, комбинации тимидилаткиназы и NdK из очищенных клеточных экстрактов грибов, комбинации тимидилаткиназы и NdK из очищенных бактериальных клеточных экстрактов, комбинации рекомбинантной тимидилаткиназы млекопитающего и рекомбинантных NdK млекопитающего, комбинации рекомбинантной тимидилаткиназы грибов и рекомбинантных NdK грибов млекопитающего и комбинации рекомбинантной бактериальной тимидилаткиназы и рекомбинантных бактериальных NdK.
20. Набор для анализа по п.19, где источник киназного фермента представляет собой экстракт дрожжевых клеток.
21. Применение способа по любому из пп.1-12 в диагностировании, мониторинге и/или прогнозировании расстройств или заболеваний, связанных с клеточной пролиферацией, таких как рак, у млекопитающих, в особенности людей.
22. Применение способа по любому из пп.1-12 для скрининга соединений, например новых лекарств-кандидатов, воздействующих на ферментативные пути, которые могут препятствовать образованию тимидинфосфатов или вмешиваться в синтез нуклеиновых кислот.
23. Применение набора для анализа по любому из пп.13-20 в диагностировании, мониторинге и/или прогнозировании расстройств или заболеваний, связанных с клеточной пролиферацией, таких как рак, у млекопитающих, в особенности людей.
24. Применение набора для анализа по любому из пп.13-20 для скрининга соединений, например новых лекарств-кандидатов, воздействующих на ферментативные пути, которые могут препятствовать образованию тимидинфосфатов или вмешиваться в синтез нуклеиновых кислот.
Текст
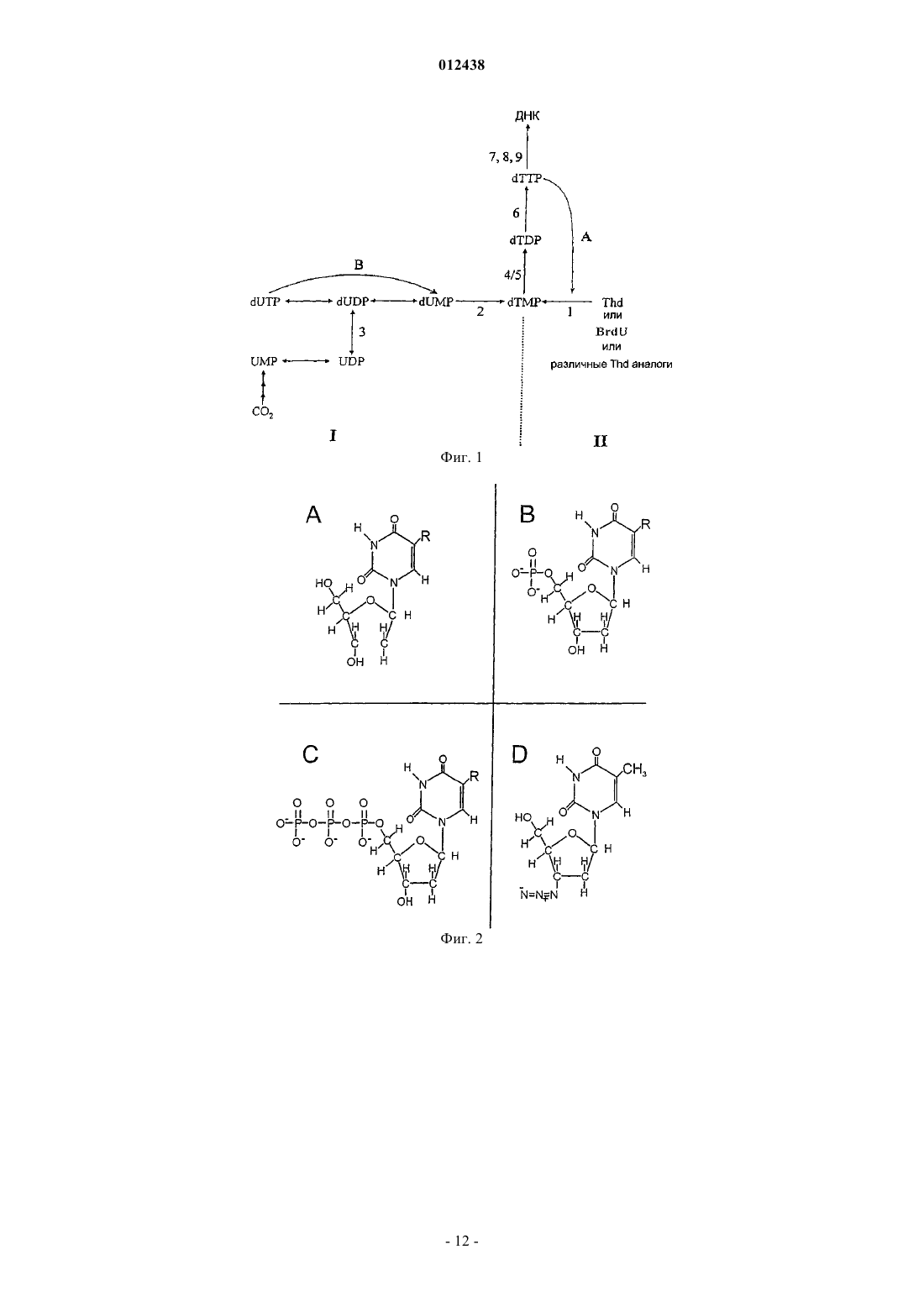
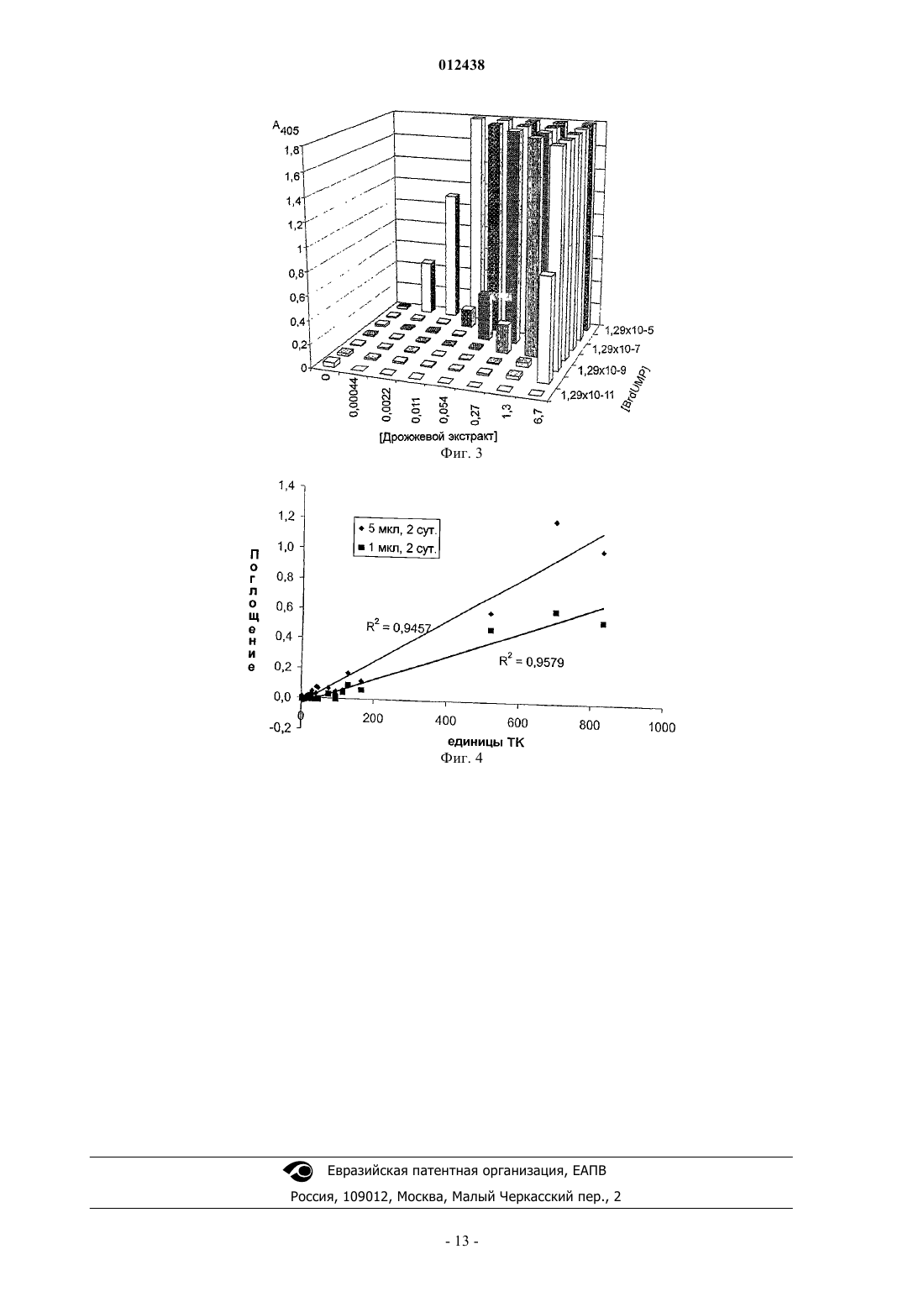
012438 Настоящее изобретение относится к нерадиоактивному способу и набору для определения тимидинкиназной (TK) активности в биологических образцах. Изобретение полезно для диагностирования,мониторинга и прогнозирования расстройств или заболеваний, связанных с клеточной пролиферацией,таких как рак и некоторые вирусные инфекции, и для скрининга соединений, например новых лекарствкандидатов, воздействующих на ферментативные пути, которые могут препятствовать образованию тимидинмонофосфата и/или вмешиваться в синтез нуклеиновых кислот после фосфорилирования. Предшествующий уровень техники Перед клеточным делением ДНК, несущая генетическую информацию, должна быть дуплицирована ДНК-полимеразой. Для этого требуется, среди других необходимых компонентов, наличие больших количеств субстратов, то есть наличие всех четырех дезоксирибонуклеотидов, например дезокситимидинтрифосфата (ТТР, фиг. 2 С). ТТР синтезируется de novo согласно пути, проиллюстрированному на фиг. 1 (Thd означает тимидин). В дополнение к этому млекопитающие и многие другие виды кодируют TK, которая экспрессируется исключительно на стадии G1-S клеточного цикла и утилизирует тимидин (Т, фиг. 2 А) для метаболизма посредством его фосфорилирования до тимидинмонофосфата (ТМР,фиг. 2 В) (фиг. 1) (1, обзор). Ввиду этого определение встроенного радиоактивного Т в ДНК клеток в культуре традиционно использовали для измерения скорости клеточного деления. В 1980-е годы активность TK была обнаружена в плазме или сыворотке крови человека у здоровых индивидуумов и пациентов, страдающих различными опухолевыми заболеваниями (2, 3). В спинно-мозговой жидкости здоровых индивидуумов активность TK отсутствовала, в то время как у пациентов с опухолями головного мозга были обнаружены различные уровни активности TK (4). С тех пор анализ TK стал общепринятым в клинической медицине, в особенности в связи с различными злокачественными новообразованиями крови(5-10). Существуют два клеточных гена, кодирующих TK, при этом TK1, являющаяся основной формой в клеточном делении, высвобождается в сыворотку в виде s-TK (сывороточная TK). Она представляет собой форму, сверхпродуцируемую в сыворотке при опухолевых заболеваниях, и ее измеряют с использованием большинства современных способов анализа, включая анализ в соответствии с данным изобретением. Форма TK2 существует в небольшом количестве в митохондрии. Кроме того, что она локализована в митохондрии, TK2 также характеризуется другим спектром субстратов и кинетических параметров по сравнению с TK1 (1). Радиоактивность, используемая в методике до настоящего времени только коммерчески доступного трудоемкого анализа сывороточной TK (s-TK), препятствовала его распространению и использованию в клинической медицине (2). Непосредственно коррелируя со степенью деления опухолевых клеток invivo, s-TK является дополнением ко многим опухолевым маркерам, которые скорее указывают на присутствие опухоли в результате сверхэкспрессии эмбриональных антигенов либо продуктов, специфически продуцируемых дифференцированной клеткой. Например, антиген предстательной железы (PSA) является ранним маркером избыточных количеств клеток предстательной железы, и повышение уровня антигена обнаруживают задолго до повышения активности TK. Однако если опухоль начинает дедифференцироваться и начинает расти быстрее, PSA-антиген (калликреин 3) пропадает, и в то же время обнаруживается повышенная активность s-TK (11). Таким образом, в дополнение к ее использованию для мониторинга репликации опухолевых клеток у пациентов, подвергающихся или не подвергающихся лечению, активность s-TK и изменение в ее кинетике также позволяет выбрать необходимое изменение в терапевтическом лечении пациента. Важность конкретного уровня s-TK для результата лечения пациента варьирует в зависимости от разных типов опухолей и естественно касается как установленного типа терапии, возраста пациента, так и других факторов, что делает s-TK важным маркером для включения в мультивариантные модели для использования в клинической медицине (12). Как отмечалось в предшествующем уровне техники, TK обнаруживали либо по ее активности, либо с использованием методики детектирования физического присутствия белка TK1 (размер, экспрессируемый геном, равен 24 кДа) (13). В последних методиках фиксируется как активный, так и неактивный фермент. Поэтому такие виды анализов, основанные на обнаружении белка, плохо коррелируют с активностью s-TK. Это не является неожиданным, поскольку TK1 активна только на стадиях от G1 до S клеточного цикла, то есть при клеточном делении, в то время как белок TK1 или продукты его деградации могут иметь разные периоды полужизни. Таким образом, дальнейшее описание будет касаться состояния уровня техники только в области измерения активности TK. В общем случае все виды анализов активности TK включают инкубацию анализируемого образца с Т или его аналогом в присутствии донора фосфата (например, аденозинтрифосфата, АТР) и Mg2+ (илиMn2+). После этого количество продукта, то есть ТМР или любого монофосфата Т-аналога, определяют следующим образом: а) В ранее описанных анализах активности TK в качестве субстрата использовали 3 Н-меченый тимидин (Т). ТМР связывали с заряженной диэтиламиноэтил(DEAE)-фильтровальной бумагой, которую затем промывали для удаления неиспользованного субстрата Т. После сушки фильтровальной бумаги 3 Нрадиоактивность измеряли на бета-счетчике. Однако тесты с использованием радиоактивности все еще разрабатываются, что указывает на устойчивый интерес к использованию s-TK в качестве маркера кле-1 012438 точной пролиферации (14). б) В коммерчески доступном анализе ProlifigenTK-REA (DiaSorin S.p.A. Saluggia, Italy) в качестве субстрата для TK используют радиоактивный иоддезоксиуридин (125IdU). Монофосфорилированный продукт, иоддезоксиуридинмонофосфат (125IdUMP), отделяют посредством его связывания с самооседающим гидроксидом алюминия (Al(OH)3), который затем промывают для удаления неиспользованного 125IdU. 125I-радиоактивность, связавшуюся с порошком Al(OH)3, затем подсчитывают на гамма-счетчике(2, 3). в) В недавно опубликованных нерадиоактивных анализах TK (15, 16) описана подобная технология количественного определения активности TK1. В этих анализах в качестве субстрата использовали либо азидотимидин (AZT, фиг. 2D), либо бромдезоксиуридин (BrdU, фиг. 2 А) и, соответственно, образованный монофосфат (AZTMP или BrdUMP) количественно измеряли, анализируя способность реакционного раствора конкурировать с мечеными ферментом AZTMP или BrdUMP по связыванию с анти-AZTMP или анти-BrdUMP антителами, иммобилизованными на дне лунок во втором 96-луночном микротитрационном планшете (то есть детектирование с использованием конкурентного твердофазного иммуноферментного анализа (ELISA. Несмотря на то, что использования радиоактивности удается избежать, известный до настоящего времени нерадиоактивный анализ не кажется достаточно эффективным для анализа биологических образцов с низкими уровнями TK, поскольку в нем измеряют уменьшение связанной метки, для чего требуется присутствие в анализируемом образце больших количеств продукта TK (15, 16). Это препятствует хорошему разрешению уровня активности TK в норме, который может отличаться более чем на три порядка у молодых и пожилых индивидуумов, и в особенности, когда данный анализ TK используют для биологических образцов в отсутствие измеряемых уровней сравнения, таких как спинно-мозговая, плевральная, асцитическая и другие жидкости организма. Недавно была раскрыта новая рекомбинантная линия клеток-хозяев, использующая дополняющую активность TMPK (тимидилаткиназа), NdK (нуклеозиддифосфаткиназа) саму по себе или в комбинации сTK, в которой ген TMPK, NdK или TK был делетирован. Это изобретение направлено на создание рекомбинантной клеточной линии и набора, включающего данную клеточную линию, для скрининга соединений, воздействующих на киназные пути (17). Описание изобретения Согласно настоящему изобретению предложен чувствительный нерадиометрический способ анализа тимидинкиназы, который при желании можно легко автоматизировать. Продукт TK непосредственно подготавливают для иммобилизации на твердой поверхности и уровень активности TK непосредственно определяют количественно, например с использованием методики ELISA (18) без переноса образцов для вторичных измерений. С использованием нового способа количественно измеряют активность тимидинкиназы (TK) (АТРтимидин-5'-фосфотрансфераза: К.Ф. 2.7.1.21) в биологическом образце, например в образце жидкости организма. Данный способ дает возможность простого, недорогого, точного и высокочувствительного определения активности TK в биологическом образце, например жидкости, или ткани организма, или в образце клеток, а также чистых рекомбинантных изоферментов TK. Таким образом, данное изобретение относится к способу определения тимидинкиназной (TK) активности в биологическом образце, включающему стадии приведения в контакт в контейнере, содержащем одноцепочечный полинуклеотид в качестве праймера или матрицы, присоединенный к твердой поверхности, основной реакционной смеси в буфере, содержащей следующие компоненты: неприсоединенный одноцепочечный полинуклеотид в качестве матрицы и/или праймера, модифицированный дезоксинуклеозид в качестве субстрата киназного фермента,донор фосфата, нуклеотидполимеризующий фермент и источник киназного фермента, лишенный активности TK, с биологическим образцом,инкубирования смеси,возможной промывки инкубированной смеси для удаления неприсоединенных компонентов реакционной смеси, определения количества модифицированного дезоксинуклеозида, встроенного в присоединенный(ую) к твердой поверхности праймер и/или матрицу, и определения активности TK, присутствующей в биологическом образце, на основании количества встроенного модифицированного дезоксинуклеозида. Выражение лишенный активности TK предназначено в настоящем описании и прилагаемой формуле изобретения для обозначения того, что имеется настолько низкая активность TK, если имеется вообще, что она не будет препятствовать осуществлению способа по изобретению. Кроме того, следует понимать, что определяемая активность TK пропорциональна количеству встроенного модифицированного нуклеозида. В представляемом предпочтительном воплощении инкубированную смесь промывают и определение количества встроенного модифицированного дезоксинуклеозида проводят, добавляя к инкубированной смеси меченую аффинную молекулу с аффинностью к модифицированному дезоксинуклеозиду и определяя количество встроенного модифицированного дезоксинуклеозида посредством определения с-2 012438 помощью метки количества присоединившейся меченой аффинной молекулы. В воплощении данного способа по изобретению источник киназного фермента выбран из группы,состоящей из экстракта клеточной линии млекопитающего, лишенного активности TK, экстракта клеточной линии грибов, лишенного активности TK, экстракта бактериальной клеточной линии, лишенного активности TK, комбинации TMPK и нуклеозиддифосфаткиназ (NdK) из очищенных экстрактов клеток млекопитающего, комбинации TMPK и NdK из очищенных экстрактов клеток грибов, комбинацииTMPK и NdK из очищенных экстрактов бактериальных клеток, комбинации рекомбинантной TMPK млекопитающего и рекомбинантных NdK млекопитающего, комбинации рекомбинантной TMPK грибов и рекомбинантных NdK грибов и комбинации рекомбинантной бактериальной TMPK и рекомбинантных бактериальных NdK. Следует понимать, что киназы в приведенных выше комбинациях могут быть из разных источников. Предпочтительным источником фермента является экстракт дрожжевых клеток, таких как Saccharomyces cerevisiae. В другом воплощении встроенный модифицированный нуклеозид происходит из соответствующим образом модифицированного дезоксинуклеозида. В еще одном дополнительном воплощении модифицированный дезоксинуклеозидный субстрат киназного фермента выбран из группы, состоящей из бромдезоксиуридина, иоддезоксиуридина, фтордезоксиуридина и винилдезокситимидина, и предпочтительно он представляет собой бромдезоксиуридин. В предпочтительном воплощении твердая поверхность представляет собой пластмассовую поверхность, например поверхность пластмассового микротитрационного планшета. Однако твердая поверхность может быть из другого материала, к которому можно присоединить аффинные молекулы, такого как материал пластмассовых гранул, магнитных гранул и агароза, или она может представлять собой поверхности из диоксида кремния в форме крошки или гранул. В еще одном дополнительном воплощении присоединенный к твердой поверхности одноцепочечный полинуклеотид присоединен через свой 5'-конец или иммобилизован с использованием имидазола на активированных планшетах. Предпочтительно, чтобы биологический образец, анализируемый способом по изобретению, был выбран из группы, состоящей из крови, сыворотки, плазмы, спинно-мозговой жидкости (CSF) (4), плевральной жидкости, асцита, тканей, клеток и их экстрактов. Образцы тканей и клеток относятся к образцам цитозольных или ядерных экстрактов. Изобретение также относится к набору для анализа, предназначенному для определения тимидинкиназной (TK) активности в биологическом образце, содержащему в нескольких отдельных контейнерах присоединенный к твердой поверхности одноцепочечный полинуклеотид в качестве праймера и/или матрицы, неприсоединенный одноцепочечный полинуклеотид в качестве матрицы и/или праймера, модифицированный дезоксинуклеозид в качестве субстрата киназного фермента, донор фосфата, нуклеотидполимеризующий фермент и источник киназного фермента, лишенный тимидинкиназы (TK), и буфер. В предпочтительном воплощении набора для анализа по изобретению, набор содержит TK сравнения для стандартизации анализа. Примерами подходящих образцов сравнения являются сыворотка млекопитающего с опухолевым заболеванием и растущие клетки, суспендированные в сыворотке животного. В другом предпочтительном воплощении набора для анализа по изобретению набор дополнительно содержит один или несколько микротитрационных планшетов, содержащих в одной или нескольких лунках присоединенный к поверхности одноцепочечный полинуклеотид (18). В другом воплощении набора по изобретению набор для анализа дополнительно содержит меченую аффинную молекулу с аффинностью к модифицированному дезоксинуклеозиду, предпочтительно меченный ферментом аффинный конъюгат, такую как антитело, меченное щелочной фосфатазой или пероксидазой хрена. Кроме того, в воплощении набора для анализа по изобретению источник киназного фермента выбран из группы, состоящей из экстракта клеточной линии млекопитающего, лишенного активности TK,экстракта клеточной линии грибов, лишенного активности TK, экстракта бактериальной клеточной линии, лишенного активности TK, комбинации тимидилаткиназы (TMPK) и нуклеозиддифосфаткиназ(NdK) из очищенных клеточных экстрактов млекопитающего, комбинации TMPK и NdK из очищенных клеточных экстрактов грибов, комбинации TMPK и NdK из очищенных бактериальных клеточных экстрактов, комбинации рекомбинантной TMPK млекопитающего и рекомбинантных NdK млекопитающего, комбинации рекомбинантной TMPK грибов и рекомбинантных NdK грибов и комбинации рекомбинантной бактериальной TMPK и рекомбинантных бактериальных NdK. Следует понимать, что киназы в приведенных выше комбинациях могут быть из разных источников. Предпочтительным источником фермента является экстракт дрожжевых клеток, таких как Saccharomyces cerevisiae. Изобретение также относится к применению способа и/или набора для анализа по изобретению в диагностировании, мониторинге и/или прогнозировании расстройств или заболеваний, связанных с клеточной пролиферацией, таких как рак и некоторые вирусные инфекции, у млекопитающих, в особенности людей.-3 012438 Изобретение дополнительно относится к применению способа и/или набора для анализа по изобретению для скрининга соединений, например новых лекарств-кандидатов, воздействующих на ферментативные пути, которые могут препятствовать образованию тимидинфосфатов. Два последних упомянутых аспекта изобретения могут быть сформулированы альтернативным образом, а именно как способ применения в диагностировании, мониторинге и прогнозировании расстройств или заболеваний, связанных с клеточной пролиферацией, таких как рак или некоторые вирусные инфекции, у млекопитающих, в особенности людей, включающий способ по изобретению и/или набор для анализа по изобретению и способ применения в скрининге соединений, например новых лекарств-кандидатов, воздействующих на ферментативные пути, которые могут препятствовать образованию тимидинфосфатов или вмешиваться в синтез нуклеиновых кислот, включающий способ по изобретению и/или набор для анализа по изобретению. Важной особенностью способа по изобретению является то, что определение активности TK в образце жидкости организма достигается в результате использования клеточного экстракта, лишенного активности TK. Это, в комбинации с предпочтительным твердофазным иммунодетектированием встраивания BrdUMP, преодолевает как проблему, связанную с применяемым в настоящее время радиоактивным способом (Prolifigen TK-REA, DiaSorin S.p.a. Saluggia, Italy) (2, 3), так и связанную с описанными нерадиоактивными способами (15, 16). Согласно настоящему изобретению не только предложен нерадиоактивный способ и набор для обнаружения активности сывороточной TK, но и этот способ, кроме того, прост в исполнении, надежен и является аналитически полезным способом для диагностических целей. Для осуществления стадий фосфорилирования в способе по изобретению безусловно требуется наличие донора фосфата в основной реакционной смеси в буфере. В качестве доноров фосфата можно использовать несколько нуклеотидтрифосфатов, в особенности АТР. Предпочтительным выбором является нуклеотид, который не будет встраиваться в растущую цепь системы праймер/матрица на твердой поверхности. Особенно предпочтительно в качестве донора фосфата использование рибонуклеотидтрифосфата. Согласно одному аспекту изобретения предложен способ определения активности TK в биологическом образце путем приведения в контакт в буфере данного образца с основной реакционной смесью,содержащей одноцепочечный полинуклеотид, присоединенный к твердой поверхности, в качестве матрицы и/или праймера, неприсоединенный одноцепочечный полинуклеотид в качестве матрицы и/или праймера и клеточный экстракт, лишенный активности TK, так что только биологический образец является единственным источником TK. Активность TK в биологическом образце затем измеряют посредством определения количества модифицированного нуклеозида, который встраивается полимеразой(ами) во вновь синтезированную двухцепочечную нуклеиновую кислоту, присоединенную к твердой поверхности, например посредством определения полимераза-зависимого твердофазного встраивания BrdUMP, который затем детектируют с использованием конъюгата фермента с антителом против встроенного BrdU. В предпочтительном воплощении экстракт, лишенный активности TK, получают из экстракта эукариотических клеток. В еще более предпочтительном воплощении экстракт получают из экстракта клеток млекопитающего. В следующем предпочтительном воплощении экстракт, лишенный активности TK,получают из очищенного экстракта клеток млекопитающего, например, используя аффинную очистку,но этим не ограничиваясь. В другом предпочтительном воплощении экстракт, лишенный активности TK,создают посредством объединения рекомбинантных ферментов TMPK (тимидилаткиназа; К.Ф. 2.7.4.9;ATP-dTMP-фосфотрансфераза) и NdK (К.Ф. 2.7.4.6; нуклеозиддифосфат(NDP)киназа) из рекомбинантных клеток, неограничивающими примерами которых являются продукты клонированных генов TMPK иcoli. В еще одном дополнительном предпочтительном воплощении экстракт получают из грибов. В особенно предпочтительном воплощении клеточный экстракт, лишенный активности TK, получают из пекарских дрожжей Saccharomyces cerevisiae. В настоящем изобретении показано, что активность TK, имеющаяся в биологическом образце, может быть детектирована и определена путем использования клеточного экстракта, лишенного активностиTK, в качестве источника киназного фермента, объединенного с полимераза-зависимым встраиванием модифицированного нуклеозида. Определение количества встроенного модифицированного нуклеозида может быть осуществлено несколькими разными путями, такими как детектирование модификации нуклеозида, например детектирование Br в BrUMP. Изобретение проиллюстрировано с использованием иммунологического способа,называемого твердофазным иммуноферментным анализом (ELISA). Так, для определения количества встроенного модифицированного нуклеозида, которое соответствует уровню клеточной пролиферации в биологическом образце, используют меченный ферментом аффинный конъюгат. Примеры аффинных молекул включают антитела, такие как моноклональные антитела или их антигенсвязывающие фрагменты. Настоящее изобретение проиллюстрировано использованием предпочтительного в настоящее время-4 012438 модифицированного нуклеозида, BrdU, и антитела против BrdU, но в данной области техники известно несколько других модифицированных нуклеозидов, которые могут фосфорилироваться под действиемTK и, таким образом, могут быть использованы в способе по настоящему изобретению. Они включают винилдезокситимидин, FdU и IdU (фиг. 2 А), но этим не ограничиваются. Фактически, в способе по изобретению были использованы два упомянутых последними модифицированных нуклеозида, и с ними были получены результаты, сравнимые с BrdU, хотя для них необходимы большие времена инкубации,возможно из-за отсутствия идеального моноклонального антитела, поскольку в этих экспериментах также использовали имеющиеся конъюгаты анти-BrdU-антител. В предпочтительном воплощении полимераза, используемая для встраивания BrdUMP в структуру твердофазной праймерной матрицы, представляет собой РНК-зависимую ДНК-полимеразу (зависимая от РНК-матрицы ДНК-полимераза = обратная транскриптаза) (RT), и присоединенная к твердой поверхности матрица нуклеиновой кислоты представляет собой поли-rA (полирибоадениловая кислота). В другом эквивалентном предпочтительном воплощении полимераза представляет собой ДНК-зависимую ДНКполимеразу, и присоединенная к твердой поверхности матрица нуклеиновой кислоты представляет собой олиго-dA, и праймер представляет собой более короткий олиго-dT, комплементарный этому праймеру. В следующем воплощении полимеразой является любая полимераза, известная в предшествующем уровне техники, и присоединенной к твердой фазе матрицей является вариабельная ДНК с гомополимерным участком или без него, а более короткий праймер комплементарен либо вариабельному участку, либо гомополимерной части матрицы. В зависимости от того, каким образом нуклеиновая кислота присоединена к поверхности, присоединенными к поверхности являются либо матрица, либо праймер. Условием является то, что система изначального(ой) праймера/матрицы не может быть образована из двух цепей рибонуклеиновой кислоты. В данной области техники известен ряд нативных и модифицированных ДНК-зависимых ДНКполимераз; примерами могут служить эукариотическая ДНК-полимераза-альфа из различных источников, ДНК-полимераза I из Escherichia coli, модифицированный фрагмент Кленова ДНК-полимеразы I изEscherichia coli, нативная или модифицированная полимераза фага Т 4, нативная или модифицированнаяPneumococcus furiousus, но этим не ограничиваются. В данной области известны несколько нативных и модифицированных РНК-зависимых ДНКполимераз (обратная транскриптаза = RT) (К.Ф.: 2.7.7.49); примерами могут служить RT вируса мозаики люцерны (AMV-RT), RT вируса Молоней (Moloney) мышиной лейкемии (M-MuLV-RT), RT вируса иммунодефицита обезьян (SIV RT) и RT вируса иммунодефицита человека (HIV), являющиеся типичными примерами полимераз этого типа, но этим не ограничиваются. Длина матрицы предпочтительно составляет 30-300 нуклеотидов, а праймера предпочтительно 1030 нуклеотидов. Способы ковалентного присоединения белков к твердой поверхности полистирольных пластмассовых 96-луночных микротитрационных планшетов хорошо известны в данной области техники. Связыванию с полистирольной поверхностью можно способствовать, используя имидазол, что тем самым включено в качестве примера, но этим данная технология не ограничивается. В области применения методов фотосочетания хорошо известно использование активированной 1-этил-3-(3 диметиламинопропил)карбодиимидом (EDCC) поверхности для сочетания с модифицированными по 5'амину олигонуклеотидными праймерами. В данной области техники хорошо известны многие разные способы применения технологий измерения присутствующих в образце биомолекул с использованием технологии твердофазного иммуноферментного анализа (ELISA). В предпочтительном воплощении моноклональное антитело против гаптенаBrdU конъюгируют с ферментом щелочной фосфатазой (АР) (щелочная фосфатаза: (орто-фосфорный моноэфир)-фосфогидролаза (оптимум в щелочной области); К.Ф. 3.1.3.1). Однако в соответствии с настоящим изобретением в качестве конъюгированного с анти-BrdU антителом фермента можно использовать любой другой применяемый в ELISA фермент, известный из предшествующего уровня техники,например пероксидазу хрена пероксид водорода)-оксидоредуктаза; К.Ф. 1.11.1.7) (HRP). Согласно другому подходу, любой хромофор, флюорофор, люминофор, известный из предшествующего уровня техники, может быть конъюгирован с меченым антителом, например анти-BrdU антителом. В данной области техники хорошо известны несколько подходящих субстратов как для АР, так и для HRP. Расщепление субстрата паранитрофенилфосфата (pNPP) под действием АР изменяет окраску от бесцветной к желтой. Оптическую плотность при длине волны 405 нм можно измерить, используя спектрофотометр. Хемилюминесцентные субстраты АР включают производные адамантил-1,2-диоксетана(например, субстраты AMPPD, CSPD, CDP и CDP-Star, все производимые Tropix (Bedford, MA, US, но этим не ограничиваются, которые являются источниками стационарного излучения при 477 нм после дефосфорилирования под действием АР и последующего разложения оставшейся молекулы. Неограничивающим примером флюоресцентных субстратов АР является 4-метилумбеллиферилфосфат (4-MUP). После дефосфорилирования MUP оставшийся метилумбеллиферил (MU) возбуждается при длине волны 370 нм. Испускаемую флюоресценцию детектируют с использованием флюориметра при 430 нм.-5 012438 Описание графических материалов Графические материалы относятся к твердофазному ELISA-анализу активности TK. Фиг. 1. Различные пути продуцирования ТТР в клетке млекопитающего. Пути: I. Путь de novo; II. Путь утилизации. Релевантные ферменты: 1. Тимидинкиназа (TK); 2. Тимидилатсинтаза (TS); 3. Рибонуклеотидредуктаза (RR); 4. Тимидилаткиназа (dTMPK); 5. Дезоксирибонуклеозидмонофосфаткиназа (dNMPK); 6. Нуклеозиддифосфаткиназа (NDPK); 7. Терминальная трансфераза (ТТ); 8. РНК-зависимая ДНКполимераза (RT); 9. ДНК-зависимая ДНК-полимераза (DNA Pol). Важные факторы регуляции: А. ингибирование по типу обратной связи; В. дефосфорилирование под действием фермента дезоксиуридинтрифосфатазы (dUTP-аза). Фиг. 2. Модификация для тимидиннуклеозидов и нуклеотидных аналогов. А. Нуклеозиды Фиг. 3. Возможность использования различных концентраций дрожжевого экстракта совместно сRT для детектирования различных концентраций BrdUMP. Фиг. 4. Возможность измерения s-TK согласно анализу по изобретению (А 405) с использованием инкубации в течение 2-х суток экстракта с двумя разными количествами сыворотки - 5 и 1 мкл, соответственно, и корреляция с Prolifigen TK-REA (единицы TK). Сокращения Пример 1. Получение киназных экстрактов из дрожжей Saccharomyces cerevisiae, которые дополняют активность TK. Дрожжевой экстракт, содержащий дополняющую/сохраняющую киназную активность, получали в сотрудничестве с Uppsala Yeast Resource competence centre (www.yeastlab.vbiol.slu.se). Краткий обзор. Получение экстракта дрожжевых клеток 200 мл Gal-среды (1% дрожжевого экстракта; BactoYeast Extract, DIFCO; 2% пептонаBactoPeptone, BD; 2% галактозы (Sigma) и 2% arapa (BactoAgar; DIFCO инокулировали свежим штаммом Saccharomyces cerevisiae G116 (генотип: МАТа ura3-52 his3 leu2pLEU-lexAop6). Дрожжевые клетки выращивали в течение ночи при 30 С и позволяли достичь плотности (ОП 600 нм) приблизительно 1,2. Клетки далее собирали центрифугированием при 230xg в течение 5 мин при 4 С, используя четыре полипропиленовые пробирки емкостью 50 мл Falcon с завинчивающимися крышками. Каждый из осадков ресуспендировали и промывали в 40 мл стерильной охлажденной во льду воды MilliQ, затем еще раз центрифугировали при 230xg в течение 5 мин при 4 С. Воду MilliQ декантировали и отбрасывали. Клетки еще раз ресуспендировали в оставшейся воде MilliQ, используя пипетку. Каждую дрожжевую суспензию в 50-мл полипропиленовых пробирках Falcon с завинчивающимися крышками (приблизительно 0,8 г на 2,2 мл) переносили в 2,2-мл микропробирки с завинчивающимися крышками (микропробирки Sarstedt;по каталогу 72.694.006), которые перед добавлением дрожжевой суспензии взвешивали, и центрифугировали при 230xg в течение 2 мин в холодной комнате (8 С). Оставшуюся воду сливали и отбрасывали. Оставшиеся осадки взвешивали (приблизительно 0,4 г на 2,2-мл микропробирку). Вес отмечали на наружной стороне этой 2,2-мл микропробирки. Клетки затем хранили при -80 С до момента получения дополняющих экстрактов. Получение дополняющих дрожжевых экстрактов Осадки дрожжевых клеток помещали на 25-28 С до полного размораживания (от 15 до 20 мин) и затем держали в ледяной бане до начала процедуры получения дрожжевого экстракта. Все последующие работы проводили в холодной комнате (8 С). В каждую 2,2-мл микропробирку, содержащую 0,4 г осадка дрожжевых клеток, добавляли 3 Х буфер для разрушения в объеме, приблизительно равном 0,5 объема осадка, подводя объем с использованием отметки объема на поверхности микропробирки (1 Х буфер для разрушения см. в табл. 1). Далее добавляли 1 мл циркониевых гранул (средний диаметр гранул 1 мм;Biospec Products, Inc., Bartlesville PO Box 788, OK 74005, USA). Затем пробирки полностью заполняли(едва не переполняя) 1 Х буфером для разрушения (3 Х буфер для разрушения = буфер для разрушения,-7 012438 разбавленный в три раза водой MilliQ) и аккуратно и плотно закрывали. Пробирки помещали в устройство Mini-BeadBeater-8 (Biospec Products, Inc., Bartlesville PO Box 788, OK 74005, USA). Разрушение суспензии дрожжевых клеток осуществляли посредством 5 Х взбиваний с гранулами по 1 мин каждое с охлаждением в ледяной бане (0 С) в течение 1-2 мин между взбиваниями. Клеточные остатки и гранулы затем удаляли центрифугированием в центрифуге для микропробирок при 10000xg в течение 2 мин. Супернатанты переносили в новые 2,2 мл микропробирки и центрифугировали при 10000xg в течение 5 мин. Содержащие ферменты супернатанты дрожжевых экстрактов разливали на аликвоты по 10 мкл в 2,2-мл микропробирки и затем хранили при -80 С до момента использования. Таблица 1. 1 Х буфер для разрушения Пример 2. Возможность использования полученного дрожжевого экстракта вместе с RT для детектирования BrdUMP посредством фосфорилирования и встраивания в твердофазный комплекс матрица/праймер. В этом эксперименте использовали основную реакционную смесь в буфере, содержащую реагенты,приведенные в табл. 2. Таблица 2. Основная реакционная смесь и буфер для анализа BrdUMP Основную реакционную смесь в буфере готовили из концентрированных растворов каждого из компонентов, после чего по 100 мкл добавляли в каждую лунку 96-луночного планшета, содержащую иммобилизованный поли-rA (готовили три планшета). Дрожжевые экстракты размораживали при 22-25 С и затем помещали в ледяную баню до момента использования. Экстракт последовательно 5-кратно разбавляли и 25 мкл раствора наибольшей концентрации добавляли в ряд А, следующей концентрации в ряд В и так далее. BrdUMP последовательно 10 кратно разбавляли, начиная с 1,310-5 М и заканчивая 1,310-11 М. Наибольшая концентрация соответствовала концентрации в 250 раз меньшей, чем в примере 1, описывающем получение. Раствор наибольшей концентрации добавляли в лунки колонки 1 96-луночных планшетов, следующей концентрации в лунки колонки 2 и так далее. Кроме этого в каждый планшет включали колонку без BrdUMP, после чего планшеты закрывали и герметизировали пластиковой липкой лентой (Fasson S695,по каталогу SH 236269, Nunc Denmark). Затем все три планшета инкубировали при 33 С. Первый планшет промывали через 3 ч инкубации и затем помещали на -20 С. Второй планшет промывали через 24 ч и помещали на 20 С, а третий планшет промывали через 48 ч инкубации и помещали на -20 С. Планшеты извлекали из места хранения при -20 С и промывали посредством четырех последовательных погружений в 4X1 л буфера для промывки, рН 8,6 (3 мМ Трис-HCl; 0,01% Твин-20; 0,5% Тритона Х-100, 0,25% EtOH CavidiTech AB, Uppsala, Sweden). Для визуализации встраивания BrdUMP в твердую фазу в каждую лунку добавляли по 100 мкл метки (АР, то есть щелочной фосфатазы, конъюгированной с анти-BrdUMP моноклональным антителом, RT product Tracer HS, CavidiTech AB, Uppsala, Sweden) и инкубировали в течение 90 мин при 33 С. Планшеты еще раз промывали посредством четырех последовательных погруже-8 012438 ний в 4X1 л буфера для промывки, рН 8,6 (3 мМ Трис-HCl; 0,01% Твин-20; 0,5% Тритона Х-100, 0,25%EtOH CavidiTech AB, Uppsala, Sweden). После промывания в каждую лунку добавляли по 125 мкл раствора, содержащего субстрат pNPP (0,5 мгмл-1), 1 мМ MgCl2 в 200 мМ Трис-HCl, рН 9,8. Планшеты инкубировали при комнатной температуре. Оптическую плотность при 405 нм регистрировали с использованием ридера Syva Micro Trak EIA, применяя фильтр с установкой двойной длины волны w1=405 иw2=630 нм, через 5 мин и через другие интервалы времени в течение до 24 ч включительно. Оптическую плотность, измеренную через 5 мин, вычитали из каждого значения оптической плотности для более поздних точек времени измерения для каждой лунки. Строили зависимость имеющихся оптических плотностей от количества использованного дрожжевого экстракта и концентрации BrdUMP. Из фиг. 3 можно видеть, что сигнал увеличивался по мере увеличения количества используемого дрожжевого экстракта. Обнаруживали концентрации BrdUMP ниже 1,310-11 М, смотри фиг. 3. Пример 4. Возможность использования имеющейся системы детектирования BrdUMP для измерения активности s-TK и ее корреляция с радиоактивным анализом TK. Для этого эксперимента были отобраны 20 различных образцов сыворотки с активностью TK, изменяющейся от нормальных значений (например 5 ед.) до очень высоких значений активности TK(800 ед.) в соответствии с Prolifigen TK-REA ( по каталогу 324250/50 таблеток, Diasorin S.p.A,Saluggia, Italy). Основную реакционную смесь в буфере готовили в соответствии с табл. 2, однако с добавлением BrdU, дающим конечную концентрацию 2,510-5 М, а дрожжевого экстракта добавляли до концентрации в 12 раз более низкой, чем наибольшая концентрация, задаваемая в примере 2. В каждую лунку 96-луночного планшета, содержащую иммобилизованный поли-rA, добавляли по 125 мкл этой основной реакционной смеси. Сыворотки последовательно 5-кратно разбавляли, начиная от 1:5 и заканчивая 1:625, в основной реакционной смеси в буфере. По 25 мкл каждого разбавления сыворотки добавляли в лунку микротитрационного планшета, содержащую основную реакционную смесь в буфере, то есть анализировали объем сыворотки каждого пациента, соответствующий 5; 1; 0,2; 0,04 мкл. Затем планшет герметизировали пластиковой липкой лентой (Fasson S695, номер по каталогу SH 236269, Nunc Denmark) и инкубировали в течение 2 суток при 33 С. Планшет промывали посредством четырех последовательных погружений в 4X1 л буфера для промывки, рН 8,6 (3 мМ Трис-HCl; 0,01% Твин-20; 0,5% Тритона Х-100, 0,25% EtOH CavidiTech AB, Uppsala, Sweden). Для визуализации встраивания BrdUMP в твердую фазу в каждую лунку добавляли по 100 мкл метки (АР, то есть щелочной фосфатазы, конъюгированной с анти-BrdUMP моноклональным антителом, RT product Tracer HS, CavidiTechAB, Uppsala, Sweden) и планшет далее инкубировали в течение 90 мин при 33 С. Планшет промывали посредством четырех последовательных погружений в 4X1 л буфера для промывки, рН 8,6 (3 мМ ТрисHCl; 0,01% Твин-20; 0,5% Тритона Х-100, 0,25% EtOH CavidiTech AB, Uppsala, Sweden). После промывания в каждую лунку добавляли по 125 мкл раствора, содержащего субстрат pNPP (0,5 мгмл-1) в 1 мМMgCl2, 200 мМ Трис-HCl, рН 9,8. Планшет инкубировали при комнатной температуре. Оптическую плотность при 405 нм регистрировали с использованием ридера Syva Micro Trak EIA, применяя фильтр с установкой двойной длины волны w1=405 и w2=630 нм, сразу через 5 мин после добавления субстратаpNPP и затем через различные интервалы времени в течение до 24 ч включительно. Оптические плотности, измеренные через 5 мин, вычитали из каждого значения каждой оптической плотности для более поздних времен измерения для каждой лунки. Величины А 405 пересчитывали к A405 в час, используя измерения внутри интервалов прочтения на ридере ELISA. Результаты для сывороток пациентов с использованием 1 и 5 мкл, соответственно, проиллюстрированы на фиг. 4, на которой оптические плотности сравниваются с активностью TK, измеренной в сыворотках согласно существующему радиоактивному способу Prolifigen TK-REA ( по каталогу 324250/50 таблеток, Diasorin S.p.A, Saluggia, Italy). Результаты показывают наличие строгой корреляции между анализом по данному изобретению и существующим радиоактивным способом Prolifigen TK-REA. Литература 1. Arnr, Elias S.J. and Eriksson Staffan. Mammalian Deoxyribonucleoside Kinases. Pharmac.Ther. 67(2): 155-186, 1995. 2. Gronowitz J.S., Kllander C.F.R. TK-REA patent. A method for determining dTK isoenzyme activitysynthase gene that have been functionally complemented by at least one functional homologue of an other organism, useful in activity testing. WO 20041162. Pr. 25.07.2002 US 2002398948. PCT filing date 24.07.2003. 18. Ekstrand D.H.L., Awad R., Kllander Clas F.R and J. Simon Gronowitz. A Sensitive Assay For Quantification of RT Activity, based on the use of Carrier Bound Template and Non Radioactive Product Detection,with Special Reference to HIV Isolation. Biotechn. Appl. Biochem. (1996) 23, 95-105. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ определения тимидинкиназной (TK) активности в биологическом образце, включающий стадии приведения в контакт в контейнере, содержащем одноцепочечный полинуклеотид в качестве праймера или матрицы, присоединенный к твердой поверхности, основной реакционной смеси в буфере, содержащей следующие компоненты: неприсоединенный одноцепочечный полинуклеотид в качестве матрицы и/или праймера, модифицированный дезоксинуклеозид в качестве субстрата киназного фермента,донор фосфата, нуклеотидполимеризующий фермент и источник киназного фермента, лишенный активности TK, с биологическим образцом,инкубирования смеси,возможной промывки инкубированной смеси для удаления неприсоединенных компонентов реакционной смеси,определения количества модифицированного дезоксинуклеозида, встроенного в присоединенный(ую) к твердой поверхности праймер или матрицу, и определения активности TK, присутствующей в биологическом образце, на основании количества встроенного модифицированного дезоксинуклеозида. 2. Способ по п.1, где инкубированную смесь промывают, а определение количества встроенного модифицированного дезоксинуклеозида осуществляют путем добавления к инкубированной смеси меченой аффинной молекулы с аффинностью к модифицированному дезоксинуклеозиду и определения количества встроенного модифицированного дезоксинуклеозида посредством определения с помощью метки количества присоединившейся к нему меченой аффинной молекулы. 3. Способ по п.1, где источник киназного фермента выбран из группы, состоящей из экстракта клеточной линии млекопитающего, лишенного активности TK, экстракта клеточной линии грибов, лишенного активности TK, экстракта бактериальной клеточной линии, лишенного активности TK, комбинации тимидилаткиназы (TMPK) и нуклеозиддифосфаткиназ (NdK) из очищенных экстрактов клеток млекопитающего, комбинации TMPK и NdK из очищенных экстрактов клеток грибов, комбинации TMPK и NdK из очищенных экстрактов бактериальных клеток, комбинации рекомбинантной TMPK млекопитающего и рекомбинантных NdK млекопитающего, комбинации рекомбинантной TMPK грибов и рекомбинантных NdK грибов и комбинации рекомбинантной бактериальной TMPK и рекомбинантных бактериальных NdK, и любых комбинаций TMPK и NdK из упомянутых источников. 4. Способ по п.3, где источником киназного фермента является экстракт дрожжевых клеток. 5. Способ по п.4, где указанные дрожжевые клетки представляют собой клетки Saccharomyces cere- 10012438visiae. 6. Способ по любому из пп.1-5, где модифицированный нуклеозид происходит из соответствующим образом модифицированного дезоксинуклеозида. 7. Способ по любому из пп.1-6, где модифицированный дезоксинуклеозид выбран из группы, состоящей из бромдезоксиуридина, иоддезоксиуридина, фтордезоксиуридина и винилдезокситимидина. 8. Способ по п.7, где модифицированный дезоксинуклеозид представляет собой бромдезоксиуридин. 9. Способ по любому из пп.1-8, где твердая поверхность представляет собой пластмассовую поверхность. 10. Способ по п.9, где пластмассовая поверхность представляет собой поверхность пластмассового микротитрационного планшета. 11. Способ по п.1, где присоединенный к твердой поверхности одноцепочечный полинуклеотид присоединен через свой 5'-конец или иммобилизован с использованием имидазола на активированных планшетах. 12. Способ по п.1, где биологический образец выбран из группы, состоящей из крови, сыворотки,плазмы, спинно-мозговой жидкости (CSF), плевральной жидкости, асцита, тканей, клеток и их экстрактов. 13. Набор для анализа, предназначенный для определения тимидинкиназной (TK) активности в биологическом образце, содержащий в нескольких отдельных контейнерах присоединенный к твердой поверхности одноцепочечный полинуклеотид в качестве праймера и/или матрицы,неприсоединенный одноцепочечный полинуклеотид в качестве матрицы и/или праймера,модифицированный дезоксинуклеозид в качестве субстрата киназного фермента,донор фосфата,нуклеотидполимеризующий фермент,источник киназного фермента, лишенный активности TK, и буфер. 14. Набор для анализа по п.13, дополнительно содержащий TK сравнения для стандартизации анализа. 15. Набор для анализа по п.13, в котором одноцепочечный полинуклеотид присоединен к поверхности лунок одного или нескольких микротитрационных планшетов. 16. Набор для анализа по п.13, дополнительно содержащий меченую аффинную молекулу с аффинностью к модифицированному дезоксинуклеозиду. 17. Набор для анализа по п.16, где меченая аффинная молекула представляет собой меченный ферментом аффинный конъюгат. 18. Набор для анализа по п.17, где меченный ферментом аффинный конъюгат представляет собой антитело, меченное щелочной фосфатазой или пероксидазой хрена. 19. Набор для анализа по п.13, где источник киназного фермента, лишенный активности TK, выбран из группы, состоящей из экстракта клеточной линии млекопитающего, лишенного активности TK,экстракта клеточной линии грибов, лишенного активности TK, экстракта бактериальной клеточной линии, лишенного активности TK, комбинации тимидилаткиназы (TMPK) и нуклеозиддифосфаткиназ(NdK) из очищенных клеточных экстрактов млекопитающего, комбинации тимидилаткиназы и NdK из очищенных клеточных экстрактов грибов, комбинации тимидилаткиназы и NdK из очищенных бактериальных клеточных экстрактов, комбинации рекомбинантной тимидилаткиназы млекопитающего и рекомбинантных NdK млекопитающего, комбинации рекомбинантной тимидилаткиназы грибов и рекомбинантных NdK грибов млекопитающего и комбинации рекомбинантной бактериальной тимидилаткиназы и рекомбинантных бактериальных NdK. 20. Набор для анализа по п.19, где источник киназного фермента представляет собой экстракт дрожжевых клеток. 21. Применение способа по любому из пп.1-12 в диагностировании, мониторинге и/или прогнозировании расстройств или заболеваний, связанных с клеточной пролиферацией, таких как рак, у млекопитающих, в особенности людей. 22. Применение способа по любому из пп.1-12 для скрининга соединений, например новых лекарств-кандидатов, воздействующих на ферментативные пути, которые могут препятствовать образованию тимидинфосфатов или вмешиваться в синтез нуклеиновых кислот. 23. Применение набора для анализа по любому из пп.13-20 в диагностировании, мониторинге и/или прогнозировании расстройств или заболеваний, связанных с клеточной пролиферацией, таких как рак, у млекопитающих, в особенности людей. 24. Применение набора для анализа по любому из пп.13-20 для скрининга соединений, например новых лекарств-кандидатов, воздействующих на ферментативные пути, которые могут препятствовать образованию тимидинфосфатов или вмешиваться в синтез нуклеиновых кислот.
МПК / Метки
МПК: C12Q 1/48
Метки: определения, активности, тимидинкиназной, применение, способ, набор
Код ссылки
<a href="https://eas.patents.su/14-12438-sposob-i-nabor-dlya-opredeleniya-timidinkinaznojj-aktivnosti-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Способ и набор для определения тимидинкиназной активности и их применение</a>
Предыдущий патент: Производные бензоконденсированных гетероциклических оксимов, способ их получения, содержащие их фармацевтическая композиция и комбинация и их применение
Следующий патент: Лекарственные средства для лечения заболеваний дыхательных путей
Случайный патент: Устройство для транспортирования и промежуточного хранения приготовленной пищи и блюд на тарелках