Капсулы для ингаляции
Номер патента: 5188
Опубликовано: 30.12.2004
Авторы: Вальц Михаэль, Трунк Михаель, Бехтольд-Петерс Каролине, Хохрайнер Дитер
Формула / Реферат
1. Капсулы для ингаляции, которые в качестве ингаляционного порошка содержат тиотропий в смеси с физиологически безвредным вспомогательным веществом, отличающиеся тем, что материал капсулы имеет пониженное влагосодержание (влажность, определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, составляет менее 15%).
2. Капсулы для ингаляции по п.1, отличающиеся тем, что материал капсулы выбран из группы, включающей желатин, производные целлюлозы, крахмал, производные крахмала, хитозан и синтетические полимерные материалы.
3. Капсулы для ингаляции по п.2, отличающиеся тем, что материалом капсулы является желатин в смеси с другими добавками, выбранными из группы, включающей полиэтиленгликоль (ПЭГ), предпочтительно ПЭГ 3350, глицерин, сорбит, пропиленгликоль, блоксополимеры полиэтиленоксида-полипропиленоксида и другие многоатомные спирты, а также простые полиэфиры.
4. Капсулы для ингаляции по п.3, отличающиеся тем, что материал капсулы наряду с желатином содержит ПЭГ в количестве от 1 до 10 мас.%, предпочтительно от 3 до 8 мас.%.
5. Капсулы для ингаляции по п.3 или 4, отличающиеся тем, что влажность материала капсулы, определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, составляет менее 12%, наиболее предпочтительно _10%.
6. Капсулы для ингаляции по п.2, отличающиеся тем, что материал капсулы выбран из группы производных целлюлозы, включающей гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, гидроксиметилцеллюлозу и гидроксиэтилцеллюлозу.
7. Капсулы для ингаляции по п.6, отличающиеся тем, что влажность материала капсулы, определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, составляет менее 8%, наиболее предпочтительно _5%.
8. Капсулы для ингаляции по п.2, отличающиеся тем, что материал капсулы выбран из группы синтетических полимерных материалов, включающей полиэтилен, поликарбонат, сложный полиэфир, полипропилен и полиэтилентерефталат.
9. Капсулы для ингаляции по п.8, отличающиеся тем, что материал капсулы выбран из группы, включающей полиэтилен, поликарбонат и полиэтилентерефталат.
10. Капсулы для ингаляции по п.8 или 9, отличающиеся тем, что влажность материала капсулы, определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, составляет менее 3%, наиболее предпочтительно _1%.
11. Капсулы для ингаляции по любому из пп.1-10, отличающиеся тем, что ингаляционный порошок содержит от 0,001 до 2% тиотропия в смеси с физиологически безвредным вспомогательным веществом.
12. Капсулы для ингаляции по п.11, отличающиеся тем, что вспомогательное вещество представляет собой смесь из вспомогательного вещества, представленного в виде более крупных частиц со средней крупностью от 15 до 80 мкм, и вспомогательного вещества, представленного в виде более мелких частиц со средней крупностью от 1 до 9 мкм, при этом на долю вспомогательного вещества, представленного в виде более мелких частиц, приходится от 1 до 20% от всего количества вспомогательного вещества.
13. Капсулы для ингаляции по п.12, отличающиеся тем, что тиотропий представлен в виде его хлорида, бромида, иодида, метансульфоната, паратолуолсульфоната или метилсульфата.
14. Применение капсул для ингаляции по любому из пп.1-13 в ингаляторе, пригодном для введения в организм ингаляционных порошков.
15. Применение по п.14 для лечения астмы или хронического обструктивного заболевания легких (ХОЗЛ).
16. Применение пустых капсул, влажность которых, определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, составляет менее 15%, для изготовления содержащих тиотропий капсул для ингаляции по любому из пп.1-13.
Текст
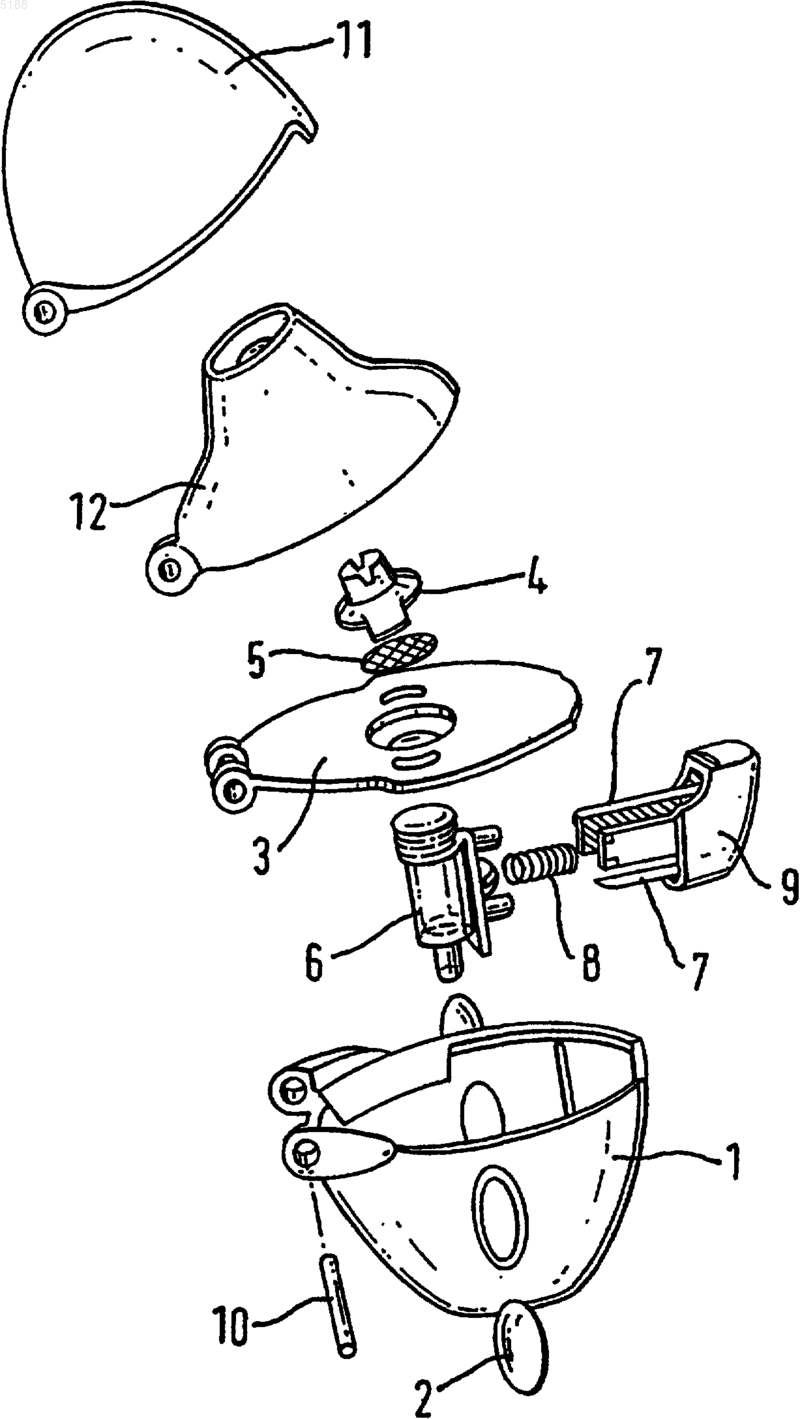
1 Настоящее изобретение относится к капсулам для ингаляции (ингалеткам) из обладающего особыми свойствами материала, содержащим действующее вещество тиотропий в виде порошковых составов и отличающимся повышенной стабильностью. Предпосылки создания изобретения Тиотропийбромид известен из заявки ЕР 418716 А 1 и имеет следующую химическую структуру: Тиотропийбромид является высокоэффективным антихолинергическим средством с длительно сохраняющимся действием, которое можно использовать для терапевтического лечения заболеваний дыхательных путей, прежде всего для лечения хронического обструктивного заболевания легких (ХОЗЛ) и астмы. Под тиотропием подразумевается свободный катион аммония. Для лечения указанных выше заболеваний действующее вещество наиболее целесообразно вводить ингаляцией. Помимо ингаляционного введения обладающих бронхолитическим действием соединений в виде дозируемых аэрозолей или растворов для ингаляции особое значение имеет также ингаляционное введение таких действующих веществ в виде содержащих их порошков для ингаляции. При применении действующих веществ,обладающих особо высокой активностью, для достижения требуемого терапевтического эффекта разовая доза должна содержать действующее вещество лишь в небольшом количестве. В подобных случаях для получения ингаляционного порошка входящее в его состав действующее вещество необходимо разбавлять пригодными для этой цели вспомогательными веществами. При этом наиболее важным условием, обеспечивающим введение в организм обладающих высокой активностью действующих веществ в постоянно воспроизводимом неизменном количестве, является получение лекарственного средства в форме, которая обладает высокой стабильностью. При отсутствии у лекарственного средства подобной высокой стабильности обеспечить введение содержащегося в нем действующего вещества в организм в постоянной дозировке невозможно. В основу настоящего изобретения была положена задача разработать заполняемую содержащим тиотропий ингаляционным порошком капсулу для ингаляции, которая обеспечивала бы достаточно высокую степень стабильности действующего вещества. Еще одна задача изобретения состояла в разработке капсулы для ингаляции, которая благодаря стабильности ее материала обеспечивала 2 бы высвобождение из нее действующего вещества в высокоточной дозировке (что относится к расфасованному в каждую капсулу для ингаляции на предприятии-изготовителе количеству действующего вещества и порошковой смеси, а также к выходящему наружу из каждой капсулы для ингаляции в процессе ингаляции и непосредственно попадающему в дыхательные пути и легкие количеству действующего вещества). Задача настоящего изобретения состояла также в разработке капсулы для ингаляции, которая обеспечивала бы введение в организм действующего вещества за счет эффективного ее опорожнения. Еще одна задача изобретения состояла в разработке капсул для ингаляции, которые при высокой стабильности и малой хрупкости ее материала обладали бы легкой прокалываемостью и тем самым не создавали бы проблем при их использовании в ингаляторах, пригодных для применения ингалеток. Подробное описание изобретения При создании изобретения неожиданно было установлено, что указанные выше задачи позволяют решить предлагаемые в изобретении капсулы для ингаляции (ингалетки), которые более подробно описаны ниже. Под предлагаемыми в изобретении капсулами для ингаляции (ингалетками) подразумеваются капсулы, которые в качестве ингаляционного порошка содержат тиотропий в смеси с физиологически безвредным вспомогательным веществом и которые отличаются тем, что материал капсулы имеет пониженное влагосодержание. Понятие "пониженное влагосодержание" в контексте настоящего изобретения трактуется как эквивалентное определяемому с помощью прибора фирмы TEWS значению влажности,равному менее 15%. Под понятием "влажность, определяемая с помощью прибора фирмы TEWS", в контексте настоящего изобретения подразумевается влажность, которую можно определить с помощью влагомера модели MW 2200 фирмы TEWS. Метод измерений, на котором основан принцип работы этого прибора, является косвенным методом определения влагосодержания. Этот метод заключается в определении действия, оказываемого присутствующей в анализируемом образце водой на измеряемый параметр (поглощение СВЧ-излучения содержащейся в анализируемом продукте водой) с последующей индикацией результата измерений в виде соответствующего значения, отражающего степень поглощения СВЧ-излучения. Для определения влагосодержания в массовых процентах необходима градуировка измерительного прибора с использованием для этой цели градуировочных образцов. При последующих измерениях полученная в результате градуировочная кривая используется измерительным прибором для пере 3 счета одной величины в другую. Измеренное значение влажности анализируемого образца,выраженное в %, выводится на индикатор и сохраняется в памяти измерительного прибора. Для градуировки прибора фирмы TEWS можно использовать, например, анализатор с галогенной сушилкой, как это имеет место согласно настоящему изобретению. Поскольку для градуировки прибора фирмы TEWS используется анализатор с галогенной сушилкой, выражение "влажность, определяемая с помощью прибора фирмы TEWS", следует рассматривать в контексте настоящего изобретения как эквивалентное выражению "влажность, определяемая с помощью анализатора с галогенной сушилкой". Так, например, равное 15% значение влажности,определяемой с помощью прибора фирмыTEWS, соответствует согласно настоящему изобретению значению определяемой с помощью анализатора с галогенной сушилкой влажности,также равному 15%. В отличие от прибора фирмы TEWS, принцип работы которого основан на относительном методе измерения влагосодержания, анализатор с галогенной сушилкой измеряет содержание влаги в материале капсулы в абсолютных значениях. Влагосодержание в анализаторе с галогенной сушилкой определяется по уменьшению массы анализируемого образца. При этом капсулы нагревают, что сопровождается удалением воды из их материала. Сушку капсул продолжают до постоянной их массы,после чего снимают полученные анализатором показания. Разность между исходным и конечным значениями массы (в граммах) соответствует содержанию влаги в материале капсул, и эту разность можно пересчитать в массовые проценты. В приборе же фирмы TEWS экспериментально снятые для фактически анализируемых капсул кривые лишь сравниваются при определении влагосодержания с внутренними эталонными кривыми. Эти эталонные кривые регистрируют путем анализа капсул с определенным влагосодержанием, абсолютное содержание влаги в материале которых уже было измерено заранее с помощью анализатора с галогенной сушилкой. Таким путем устанавливается взаимосвязь между относительным методом измерения, на основе которого работает прибор фирмы TEWS, и абсолютным методом измерения влагосодержания, который лежит в основе работы анализатора с галогенной сушилкой. Предпочтительными согласно изобретению являются капсулы для ингаляции, влажность материала которых, определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, составляет менее 12%,наиболее предпочтительно 10%. Под материалом капсулы в контексте настоящего изобретения имеется в виду материал,из которого изготовлена оболочка капсулы для ингаляции. Материалом капсулы согласно изобретению служит материал, выбранный из 4 группы, включающей желатин, производные целлюлозы, крахмал, производные крахмала,хитозан и синтетические полимеры. При применении в качестве материала капсулы желатина его можно использовать в смеси с другими добавками, выбранными из группы,включающей полиэтиленгликоль(ПЭГ), предпочтительно ПЭГ 3350, глицерин,сорбит, пропиленгликоль, блоксополимеры полиэтиленоксида-полипропиленоксида и другие многоатомные спирты, а также простые полиэфиры. В соответствии с изобретением желатин наиболее предпочтительно использовать в смеси с ПЭГ, преимущественно с ПЭГ 3350. В этом случае содержание ПЭГ в предлагаемой в изобретении желатиновой капсуле предпочтительно составляет от 1 до 10% (мас.%), наиболее предпочтительно от 3 до 8%. Особо предпочтительными являются желатиновые капсулы с содержанием ПЭГ от 4 до 6%, при этом наиболее предпочтительное содержание ПЭГ составляет согласно изобретению около 5%. При изготовлении предлагаемых в изобретении капсул из желатинсодержащих материалов их влажность, определяемая с помощью прибора фирмыTEWS или анализатора с галогенной сушилкой,предпочтительно составляет менее 12%, наиболее предпочтительно 10%. Предпочтительными производными целлюлозы при их применении в качестве материала капсулы являются гидроксипропилметилцеллюлоза,гидроксипропилцеллюлоза, метилцеллюлоза, гидроксиметилцеллюлоза и гидроксиэтилцеллюлоза. Наиболее предпочтительно в этом случае использовать в качестве материала капсулы гидроксипропилметилцеллюлозу (ГПМЦ), преимущественно ГПМЦ 2910. При изготовлении капсул из производных целлюлозы влажность таких материалов,определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, предпочтительно составляет менее 8%, наиболее предпочтительно менее 5%. Изготовленные из производных целлюлозы капсулы для ингаляции перед их заполнением содержащим тиотропий ингаляционным порошком предпочтительно подвергать сушке до остаточной влажности, определяемой с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, менее 4%, наиболее предпочтительно менее 2%. При использовании в качестве материала капсулы синтетических полимеров их согласно изобретению предпочтительно выбирать из группы, включающей полиэтилен, поликарбонат, сложные полиэфиры, полипропилен и полиэтилентерефталат. Наиболее предпочтительным синтетическим полимером в качестве материала для изготовления предлагаемых в изобретении капсул для ингаляции является полиэтилен, поликарбонат или полиэтилентерефталат. При изготовлении капсул из полиэтилена, который является одним из предпочтительных согласно изобретению материалов, предпочти 5 тельно применять полиэтилен с плотностью от 900 до 1000 кг/м 3, более предпочтительно от 940 до 980 кг/м 3, наиболее предпочтительно 960 кг/м 3 (полиэтилен высокой плотности). При изготовлении капсул из синтетических полимеров влажность таких материалов, определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, может при определенных условиях составлять менее 3%, а в некоторых случаях менее 1%. Предлагаемые в изобретении капсулы для ингаляции после их изготовления в виде пустых капсул из одного из описанных выше материалов в последующем заполняют содержащим тиотропий ингаляционным порошком. При этом для такого заполнения капсул ингаляционным порошком можно использовать любой известный из уровня техники метод. Равным образом и изготавливать пустые капсулы для ингаляции,готовые для расфасовывания в них ингаляционного порошка, можно известными из уровня техники методами. В качестве примера возможных методов изготовления капсул можно назвать такие известные из уровня техники методы, как формование окунанием, выдувное формование, литье под давлением, формование экструзией и формование глубокой вытяжкой. При изготовлении предлагаемых в изобретении капсул для ингаляции важное значение согласно изобретению имеет сушка пустых капсул, если только содержание влаги в материале капсул перед их заполнением содержащим действующее вещество ингаляционным порошком уже не снизилось за счет их хранения или выдержки в соответствующих условиях либо за счет их изготовления по соответствующей технологии до достаточно низкого уровня. Подобную сушку продолжают до снижения степени влажности материала капсул до соответствующих настоящему изобретению значений, которые при определении влажности с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой составляют максимум 15%. В контексте настоящего изобретения понятие "капсула для ингаляции" эквивалентно понятию "ингалетка". Еще одним объектом настоящего изобретения является применение капсул, влажность которых, определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, составляет менее 15% и которые могут быть выполнены из указанных выше материалов, для изготовления ингалеток (капсул для ингаляции) с содержащим тиотропий ингаляционным порошком. В контексте настоящего изобретения понятие термин "капсула" относится к пустым, т.е. еще на заполненным ингаляционным порошком, капсулам для ингаляции. Предпочтительны в соответствии с изобретением капсулы для ингаляции с ингаляционным порошком, который содержит от 0,001 до 2% тиотропия. Наиболее предпочтительны кап 005188 6 сулы для ингаляции с ингаляционным порошком, который содержит тиотропий в количестве от 0,04 до 0,8%, предпочтительно от 0,08 до 0,64%, наиболее предпочтительно от 0,16 до 0,4%. Данные о процентном содержании тиотропия в ингаляционном порошке соответствуют в контексте настоящего изобретения массовым процентам в пересчете на все количество ингаляционного порошка. Под тиотропием подразумевается свободный катион аммония. Противоионом (анионом) могут служить хлорид, бромид, иодид, метансульфонат, пара-толуолсульфонат или метилсульфат. Из числа этих анионов предпочтительным является бромид. В соответствии с этим настоящее изобретение относится предпочтительно к ингалеткам с ингаляционным порошком, содержащим от 0,0012 до 2,41% тиотропийбромида. Согласно изобретению особый интерес представляют ингаляционные порошки,содержащие от 0,048 до 0,96%, предпочтительно от 0,096 до 0,77%, наиболее предпочтительно от 0,19 до 0,48%, тиотропийбромида. Тиотропийбромид, который является согласно изобретению предпочтительным компонентом ингаляционного порошка, которым заполняют предлагаемые в изобретении ингалетки, может входить в состав таких ингаляционных порошков в виде его гидратов. Наиболее предпочтительно при этом использовать кристаллический моногидрат тиотропийбромида. В соответствии с этим настоящее изобретение относится также к ингалеткам с ингаляционным порошком, содержащим кристаллический моногидрат тиотропийбромида в количестве от 0,0012 до 2,5%. Особый интерес согласно изобретению представляют ингалетки с ингаляционным порошком, в котором содержание кристаллического моногидрата тиотропийбромида составляет от 0,05 до 1%, предпочтительно от 0,1 до 0,8%, наиболее предпочтительно от 0,2 до 0,5%. При упоминании в настоящем описании моногидрата тиотропийбромида в контексте настоящего изобретения предпочтительно подразумевается кристаллический моногидрат тиотропийбромида, получаемый по методу синтеза,который подробно рассмотрен ниже в экспериментальной части. Используемые в предлагаемых в изобретении капсулах для ингаляции (ингалетках) ингаляционные порошки наряду с действующим веществом содержат также по меньшей мере одно вспомогательное вещество. Такое вспомогательное вещество может быть представлено в виде однородной, с точки зрения средней крупности его частиц, фракции (например в виде частиц крупностью от 15 до 80 мкм) либо при определенных условиях может представлять собой смесь из вспомогательного вещества в виде частиц с большей средней крупностью,составляющей от 15 до 80 мкм, и вспомогатель 7 ного вещества в виде частиц с меньшей средней крупностью, составляющей от 1 до 9 мкм. При использовании смеси вспомогательных веществ,одно из которых представлено в виде частиц большей крупности, а другое - в виде частиц меньшей крупности, на долю вспомогательного вещества, представленного в виде частиц меньшей крупности, предпочтительно приходится от 1 до 20% от всего количества вспомогательного вещества. Если предлагаемые в изобретении капсулы для ингаляции заполняют ингаляционными порошками, которые содержат вспомогательное вещество в виде смеси фракций, одна из которых представлена в виде частиц большей крупности, а другая - в виде частиц меньшей крупности, то наиболее предпочтительны такие ингаляционные порошки, в которых средний размер частиц вспомогательного вещества,представленного в виде частиц большей крупности, составляет от 17 до 50 мкм, наиболее предпочтительно от 20 до 30 мкм, а средний размер частиц вспомогательного вещества,представленного в виде частиц меньшей крупности, составляет от 2 до 8 мкм, наиболее предпочтительно от 3 до 7 мкм. При этом под средним размером, соответственно средней крупностью частиц в контексте настоящего изобретения подразумевается размер 50% всех частиц,объемное распределение которых по крупности измеряли с помощью лазерного дифрактометра методом сухого диспергирования. При изготовлении предлагаемых в изобретении ингалеток предпочтительно использовать ингаляционные порошки, в которых на долю вспомогательного вещества, представленного в виде частиц меньшей крупности, приходится от 3 до 15%, наиболее предпочтительно от 5 до 10%, от общего количества вспомогательного вещества. В контексте настоящего изобретения указанные в процентах данные представляют собой во всех случаях массовые проценты (мас.%). Под упоминаемым в настоящем описании понятием "смесь" в контексте настоящего изобретения во всех случаях имеется в виду смесь,полученная смешением между собой заранее точно определенных компонентов. В соответствии с этим, например, под смесью вспомогательных веществ, одно из которых представлено в виде частиц большей крупности, а другое - в виде частиц меньшей крупности, подразумеваются только такие смеси, которые получают смешением вспомогательного вещества, являющегося компонентом с частицами большей крупности, со вспомогательным веществом,являющимся компонентом с частицами меньшей крупности. Служащие вспомогательными веществами компоненты могут представлять собой химически одинаковые или химически различные вещества, при этом предпочтительны ингаляционные порошки, в которых такие компоненты 8 представляют собой одно и то же химическое соединение. При использовании в качестве вспомогательного вещества смеси различных фракций вспомогательных веществ, одна из которых представлена в виде частиц большей крупности,а другая - в виде частиц меньшей крупности,такие фракции также могут представлять собой химически одинаковые или химически различные вещества, при этом предпочтительны ингаляционные порошки, в которых вспомогательное вещество, представленное в виде частиц большей крупности, и вспомогательное вещество, представленное в виде частиц меньшей крупности, являются одним и тем же химическим соединением. В качестве примера физиологически совместимых вспомогательных веществ, которые могут использоваться для получения ингаляционных порошков, применяемых в предлагаемых в изобретении ингалетках, можно назвать моносахариды (например глюкозу или арабинозу),дисахариды (например лактозу, сахарозу, мальтозу), олиго- и полисахариды (например декстраны), полиспирты (например сорбит, маннит,ксилит), соли (например хлорид натрия, карбонат кальция) или смеси этих вспомогательных веществ между собой. Предпочтительно применять моно- или дисахариды, при этом особенно предпочтительно применение лактозы или глюкозы, прежде всего, но не исключительно, в форме их гидратов. Особенно предпочтительным согласно изобретению является применение в качестве вспомогательного вещества лактозы, наиболее предпочтительно применение моногидрата лактозы. Для введения в организм содержимого предлагаемых в изобретении капсул для ингаляции можно, например, использовать ингаляторы типа тех, которые описаны в WO 94/28958. Для введения в организм ингаляционных порошков, содержащихся в предлагаемых в изобретении ингалетках, наиболее предпочтительно использовать ингалятор, который показан на прилагаемом к описанию чертеже в виде поэлементного изображения. Такой ингалятор (карманный ингалятор), предназначенный для ингаляции порошковых лекарственных средств из содержащих их капсул для ингаляции, отличается наличием корпуса 1 с двумя окошками 2,пластинчатой перегородки 3, в которой предусмотрены впускные отверстия для воздуха и которая соединена с предназначенной для размещения капсулы камерой 6, сбоку которой предусмотрена нажимная кнопка 9, снабженная двумя шлифованными иглами 7 и выполненная подвижной против усилия пружины 8, а также наличием мундштука 12, который выполнен откидным с возможностью поворота вокруг оси 10, соединяющей его с корпусом 1, пластинчатой перегородкой 3 и колпачком 11. Предназначенная для размещения капсулы камера закрыта 9 сетчатым фильтром 5. В собранном состоянии этот фильтр удерживается соответствующим держателем, жестко соединенным с мундштуком 12. Предлагаемые в изобретении капсулы для ингаляции заполняют ингаляционным порошком в количестве от 2 до 50 мг, предпочтительно от 4 до 25 мг, из расчета на одну капсулу для ингаляции. В этом случае содержание в них тиотропия составляет от 1,2 до 80 мкг. При предпочтительном содержании ингаляционного порошка в одной капсуле для ингаляции, составляющем от 4 до 6 мг, количество тиотропия в такой капсуле для ингаляции составляет от 1,6 до 48 мкг, предпочтительно от 3,2 до 38,4 мкг,наиболее предпочтительно от 6,4 до 24 мкг. При этом содержание тиотропия, составляющее, например, 18 мкг, соответствует содержанию тиотропийбромида, равному приблизительно 21,7 мкг. В соответствии с этим капсулы для ингаляции, содержащие ингаляционный порошок в количестве от 3 до 10 мг, согласно изобретению содержат предпочтительно от 1,4 до 96,3 мкг тиотропийбромида. При предпочтительном содержании ингаляционного порошка в одной капсуле для ингаляции, составляющем от 4 до 6 мг, количество тиотропийбромида в ней составляет от 1,9 до 57,8 мкг, предпочтительно от 3,9 до 46,2 мкг, наиболее предпочтительно от 7,7 до 28,9 мкг. При этом содержание тиотропийбромида, составляющее, например, 21,7 мкг, соответствует содержанию моногидрата тиотропийбромида, равному приблизительно 22,5 мкг. Следовательно, капсулы для ингаляции,содержащие ингаляционный порошок в количестве от 3 до 10 мг, содержат предпочтительно от 1,5 до 100 мкг моногидрата тиотропийбромида. При предпочтительном содержании ингаляционного порошка в одной капсуле для ингаляции,составляющем от 4 до 6 мг, количество моногидрата тиотропийбромида в ней составляет от 2 до 60 мкг, предпочтительно от 4 до 48 мкг,наиболее предпочтительно от 8 до 30 мкг. Одна из отличительных особенностей предлагаемых в изобретении капсул для ингаляции состоит в соответствии с положенной в основу настоящего изобретения задачей в том,что они обеспечивают введение в организм содержащегося в них лекарственного препарата в однократной дозировке со стабильно высокой точностью. При этом колебания вводимых за один прием количеств лекарственного препарата составляют менее 8%, предпочтительно менее 6%, наиболее предпочтительно менее 4%. Ингаляционные порошки, предпочтительно используемые для заполнения предлагаемых в изобретении капсул для ингаляции, получают описанным ниже методом. Сначала в тех случаях, когда в качестве вспомогательного вещества предполагается использовать вспомогательное вещество в виде смеси различных фракций, од 005188 10 на из которых представлена в виде частиц большей крупности, а другая - в виде частиц меньшей крупности, из исходных материалов,взятых в необходимых мерных количествах,приготавливают смесь вспомогательных веществ. Если же в качестве вспомогательного вещества используется однородная с точки зрения средней крупности его частиц фракция (например частицы крупностью от 15 до 80 мкм),то указанная первая стадия смешения отсутствует. Затем из вспомогательного вещества либо при необходимости смеси вспомогательных веществ и действующего вещества получают ингаляционный порошок. При этом предлагаемые в изобретении капсулы для ингаляции до их заполнения содержащим тиотропий ингаляционным порошком подвергают сушке до снижения их влажности, определяемой с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, до соответствующего изобретению максимально допустимого уровня. В завершение, по известным из уровня техники методам изготавливают содержащие порошок капсулы для ингаляции. В рассмотренных ниже методах получения ингаляционных порошков указанные компоненты применяют в массовых количествах, которые соответствуют количествам, указанным выше при описании составов ингаляционных порошков. При использовании в качестве вспомогательного вещества смеси, состоящей из вспомогательного вещества с частицами большей крупности и вспомогательного вещества с частицами меньшей крупности, эти вспомогательные вещества, представленные в виде частиц большей и меньшей крупности, загружают в соответствующий смеситель. Оба этих компонента предпочтительно подавать в смеситель через ситовый гранулятор с размером отверстий сита от 0,1 до 2 мм, более предпочтительно от 0,3 до 1 мм, наиболее предпочтительно от 0,3 до 0,6 мм. При этом в смеситель предпочтительно сначала загружать вспомогательное вещество с частицами большей крупности, а затем подавать в него вспомогательное вещество с частицами меньшей крупности. При такой технологии смешения оба компонента смеси предпочтительно подавать отдельными порциями, загружая в смеситель сначала часть вспомогательного вещества с частицами большей крупности, а затем попеременно добавляя в него вспомогательные вещества, представленные в виде частиц меньшей и большей крупности. При получении смеси вспомогательных веществ наиболее предпочтительным является поочередное,послойное просеивание обоих компонентов. В этом случае оба компонента предпочтительно просеивать поочередно слоями, количество которых для каждого компонента составляет по 15-45, предпочтительно по 20-40, слоев. Оба вспомогательных вещества можно смешивать 11 между собой уже в процессе подачи обоих этих компонентов в смеситель. Более предпочтительно, однако, начинать смешение обоих компонентов смеси только после их послойного просеивания. Очевидно, что при использовании вспомогательного вещества в виде однородной с точки зрения крупности его частиц фракции (например в виде частиц со средней крупностью от 15 до 80 мкм) описанная выше стадия отсутствует. На следующей стадии вспомогательное вещество либо при определенных условиях смесь вспомогательных веществ и действующее вещество загружают в соответствующий смеситель. Средняя крупность частиц используемого действующего вещества составляет от 0,5 до 10 мкм, предпочтительно от 1 до 6 мкм, наиболее предпочтительно от 2 до 5 мкм. Оба этих компонента предпочтительно подавать в смеситель через ситовый гранулятор с размером отверстий сита от 0,1 до 2 мм, более предпочтительно от 0,3 до 1 мм, наиболее предпочтительно от 0,3 до 0,6 мм. При этом в смеситель предпочтительно сначала загружать вспомогательное вещество, а затем подавать в него действующее вещество. При такой технологии смешения оба компонента смеси предпочтительно подавать отдельными порциями. При использовании смеси вспомогательных веществ наиболее предпочтительным является поочередное, послойное просеивание обоих компонентов. В этом случае оба компонента предпочтительно просеивать поочередно слоями, количество которых для каждого компонента составляет по 25-60, предпочтительно по 30-60, слоев. Смесь вспомогательных веществ можно смешивать с действующим веществом уже в процессе подачи обоих этих компонентов в смеситель. Более предпочтительно,однако, начинать смешение обоих компонентов только после их послойного просеивания. Полученную таким путем порошковую смесь при необходимости можно повторно одно- или многократно пропускать через ситовый гранулятор и затем каждый раз после очередного просеивания подвергать ее дальнейшему процессу смешения. В соответствии еще с одним вариантом осуществления изобретения капсулы для ингаляции после их заполнения содержащим тиотропийбромид ингаляционным порошком, полученным по описанной выше методике, подвергают описанному ниже процессу сушки. Заполненные ингаляционным порошком капсулы сначала на первой стадии (стадия сушки) выдерживают в течение 0,5-10 ч, предпочтительно в течение 1,5-7 ч, более предпочтительно в течение 2-5,5 ч, наиболее предпочтительно в течение примерно 2,5-4,5 ч, при температуре примерно от 10 до 50 С, предпочтительно от 20 до 40 С, наиболее предпочтительно примерно от 25 до 35 С, в атмосфере с относительной влажностью максимум 30%, предпочтительно мак 005188 12 симум 20%, наиболее предпочтительно примерно 5-15%. Под относительной влажностью (ОВ) в контексте настоящего изобретения подразумевается отношение упругости водяного пара(парциального давления водяного пара) к упругости насыщенного водяного пара при той же температуре. На второй стадии (стадия приведения в равновесное состояние), непосредственно следующей за первой стадией, капсулы выдерживают в течение 0,5-10 ч, предпочтительно в течение 1,5-7 ч, более предпочтительно в течение 2-5,5 ч, наиболее предпочтительно в течение примерно 2,5-4,5 ч, при температуре примерно от 10 до 50 С, предпочтительно от 20 до 40 С, наиболее предпочтительно примерно от 25 до 35 С, в атмосфере с относительной влажностью максимум 35%, предпочтительно максимум 25%, наиболее предпочтительно примерно 10-20%. За этим при необходимости следует стадия охлаждения, если на предыдущих стадиях температуру устанавливали на значения, превышающие комнатную температуру(т.е. 23 С). На этой стадии охлаждения капсулы выдерживают в течение 0,1-6 ч, предпочтительно в течение 0,5-4 ч, более предпочтительно в течение 0,75-2,5 ч, наиболее предпочтительно в течение примерно 1-2 ч, при температуре порядка 23 С в атмосфере с относительной влажностью максимум 35%, предпочтительно максимум 25%, наиболее предпочтительно примерно 10-20%. В одном из особо предпочтительных вариантов относительную влажность, в условиях которой осуществляют стадию приведения в равновесное состояние и стадию охлаждения,устанавливают на идентичные значения. В контексте настоящего изобретения под понятием "действующее вещество" подразумевается тиотропий. При этом каждый раз при упоминании тиотропия, представляющего собой свободный катион аммония, согласно изобретению подразумеваются и его соли (соль тиотропия), содержащие в качестве противоиона анион. Под используемыми согласно настоящему изобретению солями тиотропия имеются в виду соединения, которые помимо тиотропия содержат в качестве противоиона (аниона) хлорид,бромид,иодид,метансульфонат,паратолуолсульфонат или метилсульфат. В соответствии с изобретением из всех солей тиотропия предпочтительным является тиотропийбромид. Согласно настоящему изобретению при упоминании тиотропийбромида всегда подразумеваются и все его возможные аморфные и кристаллические модификации. При этом кристаллические структуры таких модификаций могут, например, содержать молекулы растворителя. Среди всех кристаллических модификаций тиотропийбромида предпочтительны согласно изобретению те из них, в состав которых входят молекулы воды (гидраты). Согласно настоящему изобретению наиболее предпочтительно использовать моногидрат тиотропийбромида, по 13 лучаемый в соответствии с подробно рассмотренным ниже методом. Для изготовления предлагаемых в изобретении содержащих тиотропий капсул для ингаляции тиотропий сначала необходимо перевести в форму, пригодную для фармацевтического применения. С этой целью тиотропийбромид,который можно получать по способу, описанному в ЕР 418716 А 1, предпочтительно подвергают кристаллизации на последующей стадии. При этом в зависимости от выбранных условий проведения реакции и выбранного растворителя тиотропийбромид получают в различных кристаллических модификациях. При создании изобретения было установлено, что при изготовлении предлагаемых в изобретении капсул для ингаляции наиболее целесообразно использовать кристаллический моногидрат тиотропийбромида. Ниже изобретение более подробно рассмотрено на примерах, при этом, однако, объем изобретения не ограничен рассмотренными в этих примерах конкретными вариантами его осуществления. Исходные материалы В приведенных ниже примерах в качестве вспомогательного вещества используют моногидрат лактозы (200 М). В качестве последнего можно использовать, например, продукт, выпускаемый фирмой DMV International, 5460 Вегель, Нидерланды, под торговым наименованием Pharmatose 200M. При применении смесей вспомогательных веществ указанный моногидрат лактозы (200M) используют в приведенных ниже примерах также в качестве вспомогательного вещества, представленного в виде частиц большей крупности. В качестве такого вещества равным образом можно использовать, например, продукт, выпускаемый фирмой DMV International, 5460 Вегель, Нидерланды, под торговым наименованием Pharmatose 200M. При применении смесей вспомогательных веществ в качестве вспомогательного вещества,представленного в виде частиц меньшей крупности в приведенных ниже примерах, используют моногидрат лактозы (5 мкм). Его можно получать традиционными методами (микронизацией) из моногидрата лактозы 200M. В качестве моногидрата лактозы 200M можно использовать, например, продукт, выпускаемый фирмой DMV International 5460, Вегель, Нидерланды, под торговым наименованием Pharmatose 200M. Получение кристаллического моногидрата тиотропийбромида В реактор заливают 25,7 кг воды и добавляют 15,0 кг тиотропийбромида. Смесь нагревают до 80-90 С и перемешивают при этой температуре до образования прозрачного раствора. В 4,4 кг воды суспендируют увлажненный водой активированный уголь (0,8 кг), эту смесь 14 добавляют к содержащему тиотропийбромид раствору и дополнительно промывают 4,3 кг воды. Полученную таким путем смесь перемешивают по меньшей мере в течение 15 мин при 80-90 С и затем подают через обогреваемый фильтр в аппарат с рубашкой, предварительно нагретой до температуры 70 С. Фильтр дополнительно промывают 8,6 кг воды. Затем содержимое аппарата охлаждают со скоростью 35 С/20 мин до температуры 20-25 С. Далее аппарат охлаждают до 10-15 С с помощью холодной воды и завершают кристаллизацию путем последующего перемешивания по меньшей мере в течение одного часа. Кристаллизат отделяют пропусканием через сушилку с нутчфильтром и затем отделенную суспензию кристаллов промывают 9 л холодной воды (1015 С) и холодным ацетоном (10-15 С). Полученные кристаллы сушат при 25 С в течение 2 ч в токе азота. Выход: 13,4 кг моногидрата тиотропийбромида (86% от теории). Полученный описанным выше способом кристаллический моногидрат тиотропийбромида исследовали с помощью ДСК (дифференциальная сканирующая калориметрия). На полученной ДСК-диаграмме имеются два характерных сигнала. Первый из них, сравнительно широкий эндотермический сигнал, лежащий в диапазоне от 50 до 120 С, обусловлен обезвоживанием моногидрата тиотропийбромида до безводной формы. Второй, сравнительно узкий эндотермический пик, приходящийся на температуру 2305 С, связан с расплавлением анализируемого вещества. Эти данные были получены с помощью прибора Mettler DSC 821, а для обработки использовали пакет программ STAR фирмы Mettler. Данные получали при скорости нагрева 10 К/мин. Характеристики кристаллического моногидрата тиотропийбромида определяли с помощью ИК-спектроскопии. Экспериментальные данные получали с помощью ИК-спектрометра с фурье-преобразованием (ИКФП-спектрометра) фирмы Nicolet и обрабатывали с использованием разработанного фирмой Nicolet пакета программ OMNIC, версия 3.1. Измерения проводили с использованием 2,5 мкмолей моногидрата тиотропийбромида в 300 мг KBr. Данные для некоторых из основных полос полученного ИК-спектра приведены ниже в таблице. Согласно данным рентгеноструктурного анализа монокристаллов полученный описанным выше способом кристаллический моногидрат тиотропийбромида имеет простую моноклинную ячейку следующих размеров: а=18,0774 , b=11,9711 ,с=9,9321 , =102,691, V=2096,96 3. Эти дан 15 ные были получены с помощью кругового дифрактометра типа AFC7R-4 (Rigaku) с использованием монохроматического К-излучения меди. Для уточнения структурных особенностей и детализации кристаллической структуры использовали прямые методы (программаTeXsan). Полученный таким путем кристаллический моногидрат тиотропийбромида микронизируют по известным методам для получения действующего вещества в виде частиц, средняя крупность которых соответствует предлагаемым в изобретении характеристикам. Ниже рассмотрена методика определения средней крупности частиц различных компонентов композиции, содержащейся в предлагаемых в изобретении капсулах для ингаляции. А. Определение гранулометрического состава тонкодисперсной лактозы Измерительная аппаратура и настроечные параметры С аппаратурой работают в соответствии с разработанной производителем инструкцией по эксплуатации. спектрометр типа HELOS для определения гранулометриИзмерительный прибор ческого состава по дифракции лазерного излучения(фирма SympaTec) диспергатор типа RODOS для сухого диспергирования с Диспергатор нутч-фильтром (фирма SympaTec) Масса образца начиная со 100 мг виброжелоб типа Vibri (фирПодача продукта ма SympaTec) Частота вибраций с возрастанием от 40 до 100% виброжелоба Длительность подачи 1-15 с (при массе образца 100 продукта мг) 100 мм (диапазон измерений Фокусное расстояние от 0,9 до 175 мкм) Продолжительность примерно 15 с (при массе обизмерений разца 100 мг) Продолжительность 20 мс цикла Пуск/останов при 1% на канале 28 Диспергирующий газ сжатый воздух Давление 3 бара Разрежение максимальноеHRLD (дифракция лазерного излучения высокого разрешеРежим обработки ния) Подготовка образцов/подача продукта По меньшей мере 100 мг анализируемого вещества насыпают на игральную карту. Ребром другой игральной карты измельчают все сравнительно крупные агломераты. Затем порошок равномерным тонким слоем распределяют по передней половине виброжелоба (начиная с расстояния приблизительно 1 см от переднего края). После начала измерений частоту вибра 005188 16 ций виброжелоба изменяют от приблизительно 40 до 100% (к концу процесса измерения). Продолжительность подачи всего образца составляет 10-15 с. Б. Определение гранулометрического состава микронизированного моногидрата тиотропийбромида Измерительная аппаратура и настроечные параметры С аппаратурой работают в соответствии с разработанной производителем инструкцией по эксплуатации. спектрометр типа HELOS для определения гранулоИзмерительный прибор метрического состава по дифракции лазерного излучения (фирма SympaTec) диспергатор типа RODOS для сухого диспергироваДиспергатор ния с нутч-фильтром (фирма SympaTec) Масса образца 50-400 мг виброжелоб типа Vibri Подача продукта(фирма SympaTec) Частота вибраций виб- с возрастанием от 40 до рожелоба 100% Длительность подачи 15-25 с (при массе образца продукта 200 мг) 100 мм (диапазон измереФокусное расстояние ний от 0,9 до 175 мкм) Продолжительность примерно 15 с (при массе измерений образца 200 мг) Продолжительность 20 мс цикла Пуск/останов при 1% на канале 28 Диспергирующий газ сжатый воздух Давление 3 бара Разрежение максимальное Режим обработки Подготовка образцов/подача продукта По меньшей мере 200 мг анализируемого вещества насыпают на игральную карту. Ребром другой игральной карты измельчают все сравнительно крупные агломераты. Затем порошок равномерным тонким слоем распределяют по передней половине виброжелоба (начиная с расстояния приблизительно 1 см от переднего края). После начала измерений частоту вибраций виброжелоба изменяют от приблизительно 40 до 100% (к концу процесса измерения). Подача образца должна быть по возможности непрерывной. При этом масса продукта не должна быть слишком большой для достижения требуемой степени диспергирования. Продолжительность подачи всего образца при его массе 200 мг составляет, например, приблизительно 15-25 с. В. Определение гранулометрического состава лактозы 200 М Измерительная аппаратура и настроечные параметры 17 С аппаратурой работают в соответствии с разработанной производителем инструкцией по эксплуатации. спектрометр типа HELOS для определения гранулоИзмерительный прибор метрического состава по дифракции лазерного излучения (фирма SympaTec) диспергатор типа RODOS для сухого диспергироваДиспергатор ния с нутч-фильтром(фирма SympaTec) Масса образца 500 мг виброжелоб типа Vibri Подача продукта(фирма SympaTec) Частота вибраций вибс возрастанием от 18 до рожелоба 100% 200 мм (диапазон измереФокусное расстояние (1) ний от 1,8 до 350 мкм) 500 мм (диапазон измереФокусное расстояние (2) ний от 4,5 до 875 мкм) Продолжительность измерения/ продолжитель 10 с ность интервала между операциями Продолжительность 10 мс цикла Пуск/останов при 1% на канале 19 Давление 3 бара Разрежение максимальное Режим обработки Подготовка образцов/подача продукта Приблизительно 500 мг анализируемого вещества насыпают на игральную карту. Ребром другой игральной карты измельчают все сравнительно крупные агломераты. Затем порошок переносят в нутч-фильтр виброжелоба. При этом нутч-фильтр располагают на расстоянии 1,2-1,4 мм от виброжелоба. После начала измерений амплитуду колебаний виброжелоба увеличивают с 0 до 40% до достижения непрерывности движения потока продукта. После этого амплитуду понижают приблизительно до 18%. В конце измерения амплитуду повышают до 100%. Оборудование Для получения ингаляционных порошков можно применять, например, следующее оборудование: Смеситель, соответственно смеситель для порошков: смеситель с ренским колесом объемом 200 л, тип DFW80N-4, производитель: фирма Engelsmann, D-67059 Людвигсхафен. Ситовый гранулятор: Quadro Comil, тип 197-S, производитель: фирма JoistenKettenbaum, D-51429 Бергиш-Гладбах. Прибором фирмы TEWS для определения влажности служит указанный ниже влагомер, с которым работают в соответствии с разработанной изготовителем инструкцией по эксплуатации. Прибор фирмы TEWS для определения влажности Изготовитель Тип Диапазон измерений Точность измерений ЭлектропитаниеMW 2200 от 1%-ной до 85%-ной влажности в пределах 1 % от конечного значения в выбранном диапазоне измерений от сети переменного тока напряжением 220 В 10%,50-60 Гц Анализатором с галогенной сушилкой для определения влажности, предназначенным также для проверки пригодности прибора фирмыTEWS для использования в предусмотренных настоящим изобретением целях, служит указанный ниже прибор, с которым работают в соответствии с разработанной изготовителем инструкцией по эксплуатации. Анализатор с галогенной сушилкой для определения влажности Анализатор с галогенной сушилкой MettlerHR 73, изготовитель: фирма Mettler-Toledo, D35396 Гисен. Для заполнения пустых капсул содержащим тиотропий ингаляционным порошком используют указанное ниже оборудование. Машина для заполнения капсул:MG2 S.r.l, I-40065 Пиан ди Масина ди Пианоро(Болонья) (Pian di Macina di Pianoro (ВО, Италия. Пример 1 1.1. Смесь вспомогательных веществ В качестве вспомогательного вещества,представленного в виде частиц большей крупности, используют предназначенный для использования в ингаляционных целях моногидрат лактозы (200 М) в количестве 31,82 кг. В качестве вспомогательного вещества, представленного в виде частиц меньшей крупности, используют моногидрат лактозы (5 мкм) в количестве 1,68 кг. В полученной из указанных компонентов смеси вспомогательных веществ в количестве 33,5 кг на долю вспомогательного вещества, представленного в виде частиц меньшей крупности, приходится 5%. В соответствующий смеситель вначале через соответствующий ситовый гранулятор с размером отверстий сита 0,5 мм загружают приблизительно от 0,8 до 1,2 кг предназначенного для использования в ингаляционных целях моногидрата лактозы (200 М). После этого попеременно просеиванием через сито послойно подают моногидрат лактозы (5 мкм) порциями приблизительно по 0,05-0,07 кг и предназначенный для использования в ингаляционных целях моногидрат лактозы (200 М) порциями по 0,8-1,2 кг. Количество слоев, которыми подают предназначенный для использования в ингаляционных целях моногидрат лактозы (200 М) и моногидрат лактозы (5 мкм), составляет 31 и 32 слоя, соответственно (допуск 6 слоев). Просеянные таким путем компоненты затем перемешивают в смесителе (перемешивание: 900 оборотов). 1.2: Конечная смесь Для получения конечной смеси используют 32,87 кг смеси вспомогательных веществ (со стадии 1.1) и 0,13 кг микронизированного моногидрата тиотропийбромида. В полученном из указанных компонентов ингаляционном порошке в количестве 33,0 кг на долю действующего вещества приходится 0,4%. Если в качестве вспомогательного вещества применяют однородную с точки зрения средней крупности его частиц фракцию, то соответственно используют только моногидрат лактозы(200 М) в количестве 32,87 кг. В этом случае, как очевидно, стадия 1.1 отсутствует. В соответствующий смеситель вначале через соответствующий ситовый гранулятор с размером отверстий сита 0,5 мм загружают приблизительно 1,1-1,7 кг вспомогательного вещества или смеси вспомогательных веществ (со стадии 1.1). После этого попеременно просеиванием через сито послойно подают моногидрат тиотропийбромида порциями приблизительно по 0,003 кг и вспомогательное вещество или смесь вспомогательных веществ (со стадии 1.1) порциями по 0,6-0,8 кг. Количество слоев, которыми подают вспомогательное вещество или смесь вспомогательных веществ и действующее вещество, составляет 47 и 45 слоев, соответственно (допуск 9 слоев). Просеянные таким образом компоненты ингаляционного порошка затем перемешивают в смесителе (перемешивание 900 оборотов). Полученную конечную смесь еще дважды пропускают через ситовый гранулятор и затем после каждого просеивания перемешивают (перемешивание 900 оборотов). Пример 2. С использованием смеси, приготовленной согласно примеру 1, изготавливают капсулы для ингаляции (ингалетки) следующего состава: Моногидрат тиотропийбромида Моногидрат лактозы (200 М) Моногидрат лактозы (5 мкм) Твердожелатиновая капсула (5% ПЭГ 3350, влажность, определяемая с помощью прибора фирмы TEWS, 9%) Всего Пример 3. Капсулы для ингаляции следующего состава: Моногидрат тиотропийбромида Моногидрат лактозы (200 М) Моногидрат лактозы (5 мкм) Твердожелатиновая капсула (5% ПЭГ 3350, влажность, определяемая с помощью прибора фирмы TEWS, 9%) Всего Ингаляционный порошок, необходимый для изготовления капсул для ингаляции, получали аналогично примеру 1. Пример 4. Капсулы для ингаляции следующего состава: Моногидрат тиотропийбромида Моногидрат лактозы (200 М) Моногидрат лактозы (5 мкм) ГПМЦ (влажность, определяемая с помощью прибора фирмы TEWS, 2%) Всего Ингаляционный порошок, необходимый для изготовления капсул для ингаляции, получали аналогично примеру 1. Пример 5. Капсулы для ингаляции следующего состава: Моногидрат тиотропийбромида Моногидрат лактозы (200 М) Моногидрат лактозы (5 мкм) Полиэтилен (влажность, определяемая с помощью прибора фирмы TEWS, 1%) Всего Ингаляционный порошок, необходимый для изготовления капсул для ингаляции, получали аналогично примеру 1. Пример 6. Капсулы для ингаляции следующего состава: Моногидрат тиотропийбромида Моногидрат лактозы (200 М) Полиэтилен (влажность, определяемая с помощью прибора фирмы TEWS, 1%) Всего Ингаляционный порошок, необходимый для изготовления капсул для ингаляции, получали аналогично примеру 1. Пример 7. С использованием смеси, приготовленной согласно примеру 1, изготавливают капсулы для ингаляции (ингалетки) следующего состава: Моногидрат тиотропийбромида Моногидрат лактозы (200 М) Моногидрат лактозы (5 мкм) Твердожелатиновая капсула (5% ПЭГ 3350) Всего Содержание влаги в материале этих капсул их выдержкой в соответствующих климатических условиях в камере искусственного климата доводили примерно до 8,7% (по результатам измерений с помощью СВЧ-влагомера фирмыTEWS) в соответствии со следующей методикой. Сначала проводят стадию сушки, за которой следует так называемая стадия приведения в равновесное состояние. Затем капсулы подвергают выдержке на так называемой стадии охлаждения. Сразу же после этого высушенные таким путем капсулы упаковывают в соответст 21 вующие стабильные при хранении вязки или аналогичную упаковку. Технологические параметры Настройка климатических условий на следующие заданные значения: Стадия сушки Стадия приведения в равновесное состояние Стадия охлаждения Под относительной влажностью (ОВ) в контексте настоящего изобретения подразумевается отношение упругости водяного пара(парциального давления водяного пара) к упругости насыщенного водяного пара при той же температуре. Под средней крупностью, соответственно средним размером частиц, в контексте настоящего изобретения подразумевается выраженное в мкм значение, при котором 50% частиц, крупность которых удовлетворяет некоторому объемному распределению, имеют меньший по сравнению с указанным значением или тот же размер. Суммарное распределение частиц по крупности определяют по методу дифракции лазерного излучения/сухого диспергирования. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Капсулы для ингаляции, которые в качестве ингаляционного порошка содержат тиотропий в смеси с физиологически безвредным вспомогательным веществом, отличающиеся тем, что материал капсулы имеет пониженное влагосодержание (влажность, определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, составляет менее 15%). 2. Капсулы для ингаляции по п.1, отличающиеся тем, что материал капсулы выбран из группы, включающей желатин, производные целлюлозы, крахмал, производные крахмала,хитозан и синтетические полимерные материалы. 3. Капсулы для ингаляции по п.2, отличающиеся тем, что материалом капсулы является желатин в смеси с другими добавками, выбранными из группы, включающей полиэтиленгликоль (ПЭГ), предпочтительно ПЭГ 3350,глицерин, сорбит, пропиленгликоль, блоксополимеры полиэтиленоксида-полипропиленоксида и другие многоатомные спирты, а также простые полиэфиры. 4. Капсулы для ингаляции по п.3, отличающиеся тем, что материал капсулы наряду с желатином содержит ПЭГ в количестве от 1 до 10 мас.%, предпочтительно от 3 до 8 мас.%. 22 5. Капсулы для ингаляции по п.3 или 4, отличающиеся тем, что влажность материала капсулы, определяемая с помощью прибора фирмыTEWS или анализатора с галогенной сушилкой,составляет менее 12%, наиболее предпочтительно 10%. 6. Капсулы для ингаляции по п.2, отличающиеся тем, что материал капсулы выбран из группы производных целлюлозы, включающей гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, гидроксиметилцеллюлозу и гидроксиэтилцеллюлозу. 7. Капсулы для ингаляции по п.6, отличающиеся тем, что влажность материала капсулы, определяемая с помощью прибора фирмыTEWS или анализатора с галогенной сушилкой,составляет менее 8%, наиболее предпочтительно 5%. 8. Капсулы для ингаляции по п.2, отличающиеся тем, что материал капсулы выбран из группы синтетических полимерных материалов,включающей полиэтилен, поликарбонат, сложный полиэфир, полипропилен и полиэтилентерефталат. 9. Капсулы для ингаляции по п.8, отличающиеся тем, что материал капсулы выбран из группы, включающей полиэтилен, поликарбонат и полиэтилентерефталат. 10. Капсулы для ингаляции по п.8 или 9,отличающиеся тем, что влажность материала капсулы, определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, составляет менее 3%, наиболее предпочтительно 1%. 11. Капсулы для ингаляции по любому из пп.1-10, отличающиеся тем, что ингаляционный порошок содержит от 0,001 до 2% тиотропия в смеси с физиологически безвредным вспомогательным веществом. 12. Капсулы для ингаляции по п.11, отличающиеся тем, что вспомогательное вещество представляет собой смесь из вспомогательного вещества, представленного в виде более крупных частиц со средней крупностью от 15 до 80 мкм, и вспомогательного вещества, представленного в виде более мелких частиц со средней крупностью от 1 до 9 мкм, при этом на долю вспомогательного вещества, представленного в виде более мелких частиц, приходится от 1 до 20% от всего количества вспомогательного вещества. 13. Капсулы для ингаляции по п.12, отличающиеся тем, что тиотропий представлен в виде его хлорида, бромида, иодида, метансульфоната, паратолуолсульфоната или метилсульфата. 14. Применение капсул для ингаляции по любому из пп.1-13 в ингаляторе, пригодном для введения в организм ингаляционных порошков. 15. Применение по п.14 для лечения астмы или хронического обструктивного заболевания легких (ХОЗЛ). 16. Применение пустых капсул, влажность которых, определяемая с помощью прибора фирмы TEWS или анализатора с галогенной сушилкой, составляет менее 15%, для изготов 24 ления содержащих тиотропий капсул для ингаляции по любому из пп.1-13.
МПК / Метки
МПК: A61K 9/00, C07D 451/10
Код ссылки
<a href="https://eas.patents.su/13-5188-kapsuly-dlya-ingalyacii.html" rel="bookmark" title="База патентов Евразийского Союза">Капсулы для ингаляции</a>

















