5-β производные 14-β-андростана для лечения протеинурии, гломерулосклероза и почечной недостаточности
Номер патента: 19929
Опубликовано: 30.07.2014
Авторы: Ферранди Мара, Бьянки Джузеппе, Феррари Патриция
Формула / Реферат
1. Применение соединения формулы (I)
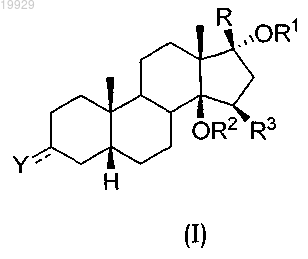 где символ
где символпредставляет собой одинарную связь;
Y представляет собой OR4 и может иметь α- или β-конфигурацию;
R представляет собой 3-фурил;
R1 представляет собой водород;
R2 представляет собой водород;
R3 представляет собой водород;
R4 представляет собой водород;
в качестве антипротеинурического средства.
2. Применение соединения формулы (I) по п.1 в качестве антигломерулосклеротического средства.
3. Применение соединения формулы (I) по п.1 в качестве средства против почечной недостаточности.
4. Применение соединения формулы (I) по п.1, которое представляет собой 17-β-(3-фурил)-5-β-андростан-3-β,14-β,17-α-триол.
5. Применение соединения формулы (I) по п.1 для изготовления лекарственного средства для предотвращения и/или лечения протеинурии, гломерулосклероза и почечной недостаточности.
6. Применение по п.5, где лекарственное средство предназначено для орального, внутривенного, внутримышечного, внутриартериального, интрамедуллярного, интратекального, интравентрикулярного, трансдермального, чрескожного, подкожного, внутрибрюшинного, интраназального, энтерального, местного, сублингвального или ректального введения.
7. Способ лечения протеинурии, гломерулосклероза и почечной недостаточности, включающий введение соединения формулы (I) в дозе от 0,05 до 20 мг/день.
8. Способ по п.7, где соединение вводится в дозе от 0,5 до 15 мг.
9. Способ по п.8, где соединение вводится в дозе от 5 до 10 мг.
10. Способ по пп.7-9, где соединение вводится по схеме введения единичной дозы.
11. Способ по пп.7-9, где соединение вводится по схеме введения множественной дозы.
Текст
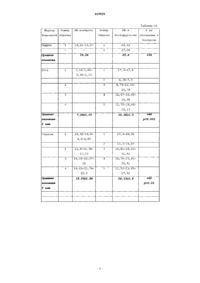
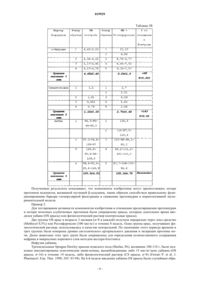
Изобретение относится к соединению формулы (I), для которой значения символов раскрыто в тексте; для изготовления лекарственного средства для предотвращения и/или лечения протеинурии,гломерулосклероза или почечной недостаточности.(71)(73) Заявитель и патентовладелец: СИГМА-ТАУ ИНДУСТРИЕ ФАРМАСЬЮТИКЕ РИУНИТЕ С.П.А. Область техники, к которой относится изобретение Данное изобретение относится к 17(3-фурил) и (4-пиридазинил)-5-, производным 14 андростана, которые являются полезными средствами для изготовления лекарственного средства для предотвращения и лечения протеинурии, гломерулосклероза и почечной недостаточности. Уровень техники Термин "протеинурия" является производным от слов "протеин" и "моча" и обозначает наличие избытка протеинов сыворотки в моче. Протеинурия может быть признаком повреждения почек, поскольку протеины сыворотки полностью реабсорбируются из мочи, а наличие избыточного протеина в ней указывает либо на недостаточность абсорбции, либо на нарушение фильтрации. Протеинурия может быть признаком следующих состояний: нефротические синдромы (например,собственная почечная недостаточность); токсические повреждения почек; коллагенозы (например, системная красная волчанка); заболевания клубочков, такие как мембранозный гломерулонефрит, фокальный сегментарный гломерулонефрит; интенсивная физическая нагрузка; стресс, сахарный диабет; лекарственные средства (например, НПВС, никотин, пенициламин, золото и другие тяжелые металлы, ингибиторы АПФ, антибиотики, опиаты, в особенности героин), инфекции (например, ВИЧ, сифилис, гепатит,постстрептококковая инфекция); аминоацидурия; гипертонический нефросклероз; интерстициальный нефрит и гломерулосклероз. Гломерулосклероз является общим термином для описания рубцевания крошечных кровеносных сосудов почек, капиллярных клубочков, являющихся функциональными единицами почек и осуществляющих фильтрацию мочи из крови. Состояние многих пациентов с гломерулосклерозом постепенно ухудшается, до тех пор пока почки полностью не перестают функционировать. Это состояние называется терминальной стадией почечной недостаточности или ESRD. Пациентам с ESRD должен проводиться диализ (гемодиализ или перитонеальный диализ) для очищения крови или пересадка новой почки с помощью трансплантации. Клубочек почки представляет собой высокоспециализированную структуру, которая контролирует ультрафильтрацию протеинов плазмы. Специфической клеточной единицей, которая обеспечивает данный контроль, является подоцит, дисфункция которого приводит к массивной потере протеинов мочи(протеинурия). Хорошо известно, что функция подоцита строго контролируется специфическими протеинами, модулирующими актиновый цитоскелет. Известно, что мутации в генах, кодирующих такие протеины подоцитов, связаны с изменением барьера гломерулярной мембраны и, следовательно, с массивной протеинурией и повреждением почек. Среди этих протеинов подоцитов нефрин является фундаментальным компонентом щелевой пористой мембраны и регулирует связи цитоскелета путем активации пути сигнальной трансдукции, регулируемой тирозинкиназой Fyn, которая принадлежит к семейству Src киназ (Trends Mol Med. 2007; 13: 396-403). Аддуцин представляет собой протеин цитоскелета, участвующий в процессе регуляции связей между актином и спектрином во всех клетках. Была установлена связь полиморфизма генов аддуцина с гипертензией и прогрессированием почечной недостаточности. Данные экспериментов показали, что - и -аддуцин экспрессируются в клубочке, и их полиморфизм вызывает изменение экспрессии некоторых протеинов подоцитов, протеинурию и прогрессирование повреждения почек у моделей животных независимо от их артериального давления (J. Hypertension,2003, 21 (Suppl. 4), abs 4C.4). Более подробно, у мышей, нокаутированных по мутантному -аддуцину и имеющих нормальное артериальное давление, была зарегистрирована повышенная экспрессия протеинов подоцитов, таких как нефрин, синаптоподин, -актинин, Fyn и ZO-1, а также снижение протеинов мочи (фиг. 1) по сравнению с контрольной группой мышей, что определяет возможную роль -аддуцина в изменении гломерулярной проницаемости независимо от контроля артериального давления. У конгенных NB крыс с нормальным уровнем артериального давления, которым мутантный-аддуцин ген от родительской гипертензивной MHS линии (Q529R) вводился в нормотензивный MNS фон (BBRC 2004; 324: 562-568), экспрессия некоторых протеинов подоцита (нефрин, -актинин, подоцин и ZO-1), измеренная в культуре подоцитов, оказалась сниженной (см. фиг. 2) и связанной с массивной протеинурией и повреждением почек, как показали данные иммунофлуоресценции (см. фиг. 3) у взрослых крыс по сравнению с нормотензивной конгенной NA линией, несущей вариант дикого типа-аддуцина вместе с мутированнымиз линии MHS. Вследствие этого, эти полученные результаты наводят на мысли о патологической роли мутантного -аддуцина в функционировании почек, что не зависит от артериального давления и регулируетсямутантным вариантом. Значимость экспериментальных данных, полученных на моделях животных, для заболеваний человека подтверждается последними клиническими исследованиями, которые показали, что у пациентов сIgA нефропатией наблюдается более быстрое прогрессирование к терминальной стадии почечной недостаточности при носительстве мутации -аддуцина (СТ+ТТ) во взаимодействии с мутантным вариантом Эндогенный Уабаин (ЕО) широко известен как новый гормон, способный контролировать артериальное давление с помощью различных механизмов, в основном через регуляцию обмена натрия в почках. Была установлена связь между высокими циркулирующими уровнями ЕО и высоким артериальным давлением. 17-(3-Фурил) и (4-пиридазинил)-5-, производные 14 андростана являются известными соединениями. ЕР 0583578 В 1 описывает производные -андростана, заявленные в данной заявке, способ их получения и их применение для лечения сердечно-сосудистых нарушений, таких как сердечная недостаточность и гипертензия. ЕР 0590271 В 1 описывает 17-арил и 17-гетероциклил-5-, производные 14 андростана, андростена и андростадиена, способ их получения и их применение для лечения кардиоваскулярных расстройств,таких как сердечная недостаточность и гипертензия. ЕР 0590272 В 1 описывает 17-арил и 17-гетероциклил-5-, производные 14 андростана и их применение для лечения кардиоваскулярных расстройств, таких как сердечная недостаточность и гипертензия.WO 2008148812 описывает 17(3-фурил) и (4-пиридазинил)-5-, производные 14 андростана и их применение для лечения рестеноза после ангиопластики или эндоартерэктомиии, а также заболеваний, обусловленных фиброзом органа. Ни одна из отмеченных выше публикаций не раскрывает применение 5-, производных 14 андростана для предотвращения и/или лечения протеинурии, гломерулосклероза и почечной недостаточности. Было обнаружено, что 17(3-фурил) и (4-пиридазинил)-5-, производные 14 андростана в соответствии с данным изобретением являются полезными средствами для предотвращения и лечения протеинурии, гломерулосклероза и почечной недостаточности. Описание изобретения Исходя из вышеизложенного, объектом данного изобретения является соединение формулы (I) где символ представляет собой одинарную или двойную связь;R4 представляет собой водород; Предпочтительным соединением в соответствии с данным изобретением является 17(3-фурил)-5-андростан-3-,14-,17 триол для применения в качестве антипротеинурического средства. Наиболее предпочтительное соединение в соответствии с данным изобретением 17(3-фурил)-5-андростан-3-,14-,17 триол, в дальнейшем именуемое как "ростафуроксин" или "PST 2238". Дополнительным объектом настоящего изобретения является применение данного соединения формулы (I) в качестве антигломерулосклеротического вещества. Дополнительным объектом является применение данного соединения формулы (I) в качестве средства против почечной недостаточности. Дополнительным объектом данного изобретения является применение компонента формулы (I) для изготовления лекарственного средства для предотвращения или лечения протеинурии, гломерулосклероза и почечной недостаточности. Дополнительным объектом данного изобретения является способ лечения млекопитающих, страдающих протеинурией, гломерулосклерозом или почечной недостаточностью, включающий введение терапевтически эффективного количества компонента формулы (I). Термин "терапевтически эффективное количество" применяется в данном документе как относящийся к количеству терапевтического средства, необходимого для лечения, улучшения конкретного заболевания или состояния или для демонстрации обнаруживаемого терапевтического эффекта. Для любого соединения терапевтически эффективная доза может быть установлена изначально как в образцах клеточной культуры, так и на модельных животных, обычно мышах, кроликах, собаках или свиньях. Животная модель также может использоваться для определения подходящего диапазона концентраций и пути введения. Такая информация может использоваться для определения подходящих доз и путей введения для людей. Точное эффективное количество для человека будет зависеть от тяжести течения заболевания, общего состояния здоровья субъекта, возраста, веса и пола, диеты, времени и частоты введения, комбинации(й) лекарственных средств, чувствительности реакции и устойчивости/восприимчивости к терапии. Это количество может быть определено путем проведения обычных экспериментов и находится в пределах компетенции клинициста. В целом эффективная ежедневная доза будет от 0,05 до 20 мг, предпочтительно от 0,5 до 15 мг, наиболее предпочтительно от 5 до 10 мг. Лечебные дозировки могут быть представлены схемой введения единичной дозы или схемой введения множественной дозы в соответствии с решением клинициста. Композиции могут вводиться пациенту отдельно или в сочетании с другими средствами, лекарственными средствами или гормонами. Лекарственное средство также может содержать фармацевтически приемлемый носитель для введения терапевтического средства. Такие носители включают в себя антитела и другие полипептиды, гены и другие терапевтические средства, такие как липосомы, при этом носитель не может индуцировать выработку антител, вредных для организма, принимающего композицию, и может вводиться без вызывания чрезмерной токсичности. Подходящие носители могут быть большими медленно метаболизируемыми макромолекулами, такими как протеины, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, полипептиды и неактивные вирусные частицы. Подробное обсуждение фармацевтически приемлемых носителей доступно в Remington'sPharmaceutical Sciences (Mack Pub. Co., N. J. 1991). Фармацевтически приемлемые носители в терапевтических композициях могут дополнительно содержать жидкости, такие как вода, физиологический раствор, глицерин и этанол. Дополнительно в таких композициях могут присутствовать вспомогательный материал, например смачивающие и эмульгирующие вещества, вещества, буферирующие рН, и им подобные. Такие носители позволяют изготавливать фармацевтические композиции в виде таблеток, пилюль, драже, желатиновых капсул, жидкостей, гелей,сиропов, вязких суспензий, суспензий и т.п. для приема внутрь пациентом. После изготовления композиция изобретения может вводиться напрямую субъекту. Такими субъектами, получающими лечение, могут быть животные; в частности, лечение могут получать люди. Лекарственное средство данного изобретения может вводиться любым способом, включая, помимо прочего, оральный, внутривенный, внутримышечный, внутриартериальный, интрамедуллярный, интратекальный, интравентрикулярный, трансдермальный путь или чрескожные аппликации, подкожный,внутрибрюшинный, интраназальный, энтеральный, местный, сублингвальный, ректальный пути или местное применение на пораженные ткани после хирургической операции. Композиция изобретения может также вводиться (в качестве покрытия) на стент даже будучи включенной в контролирующий высвобождение матрикс. Описание фигур Фиг. 1 представляет уровень экскреции протеина мочи (мг/6 ч) у мышей, нокаутированных (KO) по-аддуцину в сравнении с группой контроля дикого типа (WT). Возраст мышей мужского пола составлял 11 месяцев, а уровень экскреции протеина измерялся в моче, собранной за 6 ч от каждой мыши, содержащейся в метаболической клетке. Данные выражены как среднеестандартная ошибка средней (sem) для 15 WT и 19 KO мышей. Статистический анализ проводился с помощью t теста Стьюдента. Фигура демонстрирует существенное (приблизительно 30%) снижение экскреции протеина за 6-часовой период у KO мышей по -аддуцину по сравнению с WT контролем. Фиг. 2 представляет количество протеинов подоцитов (нефрин, -актинин, ZO-1, подоцин,-аддуцин и актин), экспрессированных в культуре подоцитов, полученных от неонатальных (возрастом менее 10 дней) крыс из конгенных NB и NA линий. Количество протеинов подоцита было измерено в выдержке подоцитов с помощью Вестерн-блоттинга с подходящими антителами (см. образцы следов над столбцами). Данные - средниеsem из нескольких экспериментов в интервале от 4 до 24 для каждой линии. Статистический анализ проводился с помощью t теста Стьюдента. На фигуре показано, что количество нефрина, -актинина, ZO-1, подоцина и -аддуцина значительно снижены в подоцитах группыNB нормотензивных крыс, имеющих мутантный -аддуцин, по сравнению с контролем NA, несущим вариант дикого типа, в то время как уровень протеина актина домашнего хозяйства примерно одинаков. Фиг. 3 представляет экспрессию некоторых протеинов подоцита (нефрин, -актинин, ZO-1, Fyn и виментин), как определяемых с помощью метода иммунофлуоресценции в гломерулах почек в группеNB нормотензивных крыс с мутантным -аддуцином, по сравнению с контролем NA, несущим вариант дикого типа. Фигура показывает существенное снижение экспрессии этих протеинов в группе NB крыс по сравнению с NA группой, в то время как виментин, микрофиламент, локализованный в теле клетки подоцита, имеет нормальный уровень экспрессии в обеих линиях. Фиг. 4 показывает прогрессирование почечной недостаточности, оцениваемой как снижение уровня гломерулярной фильтрации (GFR) с течением времени (млмин-1, год-1) у пациентов с IgA нефропатией, в 4 группах в соответствии с генотипами -аддуцина (ADD1, Gly460Tyr) и -аддуцина (ADD2, С 399 Т). Роль взаимодействия между двумя генами в резком снижении была определена как значительная. Фиг. 5 представляет количество протеинов подоцитов (нефрин, ZO-1, подоцин, -аддуцин, синаптоподин и актин), экспрессированное в культуре подоцитов, полученных от неонатальных (возраст менее 10 дней) крыс от конгенных NB линий, инкубированных в течение 5 дней в присутствии или без Ростафуроксина 10-9 М. Подсчет протеинов подоцита производился из выдержки подоцитов методом Вестернблоттинга с подходящими антителами. Данные известны как средниеsem из нескольких экспериментов. Статистический анализ проводился с помощью t теста Стьюдента. Фигуры показывают повышение в культуре подоцитов количества нефрина, ZO-1, подоцина, -аддуцина и синаптоподина, за исключением актина в присутствии 10-9 Ростафуроксина. Фиг. 6 представляет уровни систолического артериального давления (САД), экскреции протеина мочи и количество нефрина из коркового слоя почек крыс, которым длительно вводился уабаин (OS) и которые лечились с помощью носителя в сравнении с группой крыс, которым вводился физиологический раствор или с OS крысами, получавшими в течение 8 недель Ростафуроксин в дозировке 100 мкг/кг/день. Данные известны как средниеsem для 8 крыс из каждой группы. Статистический анализ проводился с помощью t теста Стьюдента. Фигура показывает, что Ростафуроксин существенно снижает САД и экскрецию протеина мочи, в то время как он увеличивает экспрессию нефрина у OS группы крыс, и таким образом наблюдаются антагонистические почечные эффекты уабаина. Следующие неограничивающие примеры раскрывают изобретение. Пример 1. Для тестирования активности компонентов изобретения в отношении предотвращения потери протеинов подоцитов были использованы конгенные NB крысы, несущие мутацию -аддуцина (Tripodi G. etal. Effect of Addl gene transfer on blood pressure in reciprocal congenic strains of Milan rats. BBRC 2004; 324; 562-568). Указанные NB крысы являлись негипертензивными и доступны в Prassis Research Institute,Sigma-tau, Italy.NB крысы в возрасте от 7 до 10 дней использовались для изоляции и культивирования подоцитов. Подоциты крыс группы NB культивировались в течение 5 дней без применения (NB контроль, n=4) и с применением 10-9 М Ростафуроксина (NB n=5). Подсчет протеинов подоцитов проводился через 5 дней культивирования путем вестерн-блоттинга. Количественная оценка вестерн-блота повторялась от двух до трех раз для каждого маркера подоцитов. Табл. 1 А и 1 В показывают окончательное число образцов подоцитов, изученных для каждого состояния, как среднее значение повторов (NB контроль, n=4;NB+Ростафуроксин, n=5). Денситометрический анализ определялся как оптическая плотность, в условных единицах. Изоляция подоцитов и количественная оценка протеинов в культивированных подоцитах. Клубочки были изолированы из почек NB путем гель-фильтрации и дальнейшей ручной очистки. Затем клубочки были помещены в колбу с культурой (Corning, Sigma-Aldrich, Milan, Italy), предварительно покрытой коллагеном IV типа (Sigma-Aldrich) при температуре 37 С в атмосфере, содержащей 5% СО 2. На 4-5 дни начался рост подоцитов, и к 8 дню клубочки были отделены с помощью трипсинEDTA. Второй пересев подоцитов, который по данным исследования световой микроскопии привел к 90% очистке, был помещен в колбу и на предметные стекла. Количественная оценка протеинов подоцитов (10 мкг протеина/ряд) производилась с помощью техники вестерн-блоттинга с применением антител к нефрину, подоцину, ZO-1, аддуцину, синаптоподину и актину. Полученные результаты показаны в табл. 1 А, 1 В и на фиг. 5. Полученные результаты показывают, что компоненты изобретения могут препятствовать потере протеинов подоцитов, вызванной мутацией -аддуцина, таким образом способствуя правильному функционированию барьера гломерулярной фильтрации и снижению протеинурии в нормотензивной экспериментальной модели. Пример 2. Для тестирования активности компонентов изобретения в отношении предотвращения протеинурии и потери почечных клубочковых протеинов были умерщвлены крысы, которым длительное время вводился уабаин (OS крысы) или физиологический раствор (контрольные крысы). Две группы OS крыс в возрасте 2 месяцев (n=8 в каждой) получали перорально через зонд средство(Methocel 0,5%) или Ростафуроксин (100 мкг/кг) в течение 8 недель. Одна группа крыс, получавших физиологический раствор, использовалась в качестве контрольной. По окончании этого периода времени в трех группах были измерены уровни систолического артериального давления и экскреция протеина мочи. Далее животные этих трех групп были умерщвлены для определения количественного содержания нефрина в микросомах коркового слоя методом вестерн-блоттинга. Инфузия уабаина. Трехнедельным Sprague-Dawley крысам мужского пола (Harlan, IN), весившим 100-110 г, были подкожно имплантированы осмотические мини-помпы, высвобождающие либо 15 мкг/кг/день уабаина (OS крысы, n=16) в течение 14 недель, либо физиологический раствор (CS крысы, n=8) (Ferrari P. et al. J.Pharmacol. Exp. Ther. 1998; 285: 83-94). На 6-й неделе введения уабаина OS крысы были случайным обра-6 019929 зом разделены на 2 группы (n=8 в каждой); первая (OS, получающая лечение) получала Ростафуроксим перорально в количестве 100 мкг/кг/день, взвешенный в 0,5% мас./об. Methocel, вторая группа (контрольная) получала только плацебо. Систолическое артериальное давление (САД) и частота сердечных сокращений (ЧСС) измерялись каждую неделю у бодрствующих крыс методом плетизмографии с помощью хвостовой манжеты (ВР recorder, U. Basile, Italy). Биохимические методы для измерения параметров мочи. Параметры мочи измерялись у бодрствующих OS и контрольных крыс на 12-й неделе лечения. Крысы были помещены в отдельные метаболические клетки и оставлены для акклиматизации на один день. 24-часовой сбор мочи начался в 9 утра. Во время сбора мочи крысы имели свободный доступ к воде и еде. После центрифугирования (4500 об/мин в течение 20 мин; Varifuge 3.2 RS, Haereus Instruments,AHSI, Milan, Italy), моча крыс была исследована на количество (мл), оценена путем взвешивания резервуара для мочи на точных весах Меттлера; на рН (рНМ 83, Radiometer, Copenhagen) и на тотальную экскрецию протеина (мг/24 ч), измеренную с помощью общего белкового набора (Sentinel Diagnostics, Milan,Italy). Животные трех групп были затем умерщвлены, микросомы коркового вещества каждой крысы были препарированы и с помощью вестерн-блоттинга была произведена количественная оценка нефрина, ключевого протеина пористой мембраны. Образцы были разделены с помощью электрофореза с SDSполиакриламидным гелем, нанесенным и культивированным в течение ночи при 4 С вместе со специфическими первыми антителами (антинефрин из Santa-Cruz; антиактин из Sigma-Aldrich), за чем последовал 1 ч инкубации с флуоресцирующими вторичными антителами (Alexa Fluor) и далее - анализ и количественная оценка с помощью системы обнаружения в инфракрасном свете Odyssey (LI-CORBiosciences). Количественная оценка нефрина выражается как оптическая плотность, в условных единицах. Полученные результаты показаны в табл. 2 А-2 С и на фиг. 6. Таблица 2 А Полученные результаты показывают, что компоненты изобретения могут противостоять патологическому действию уабаина на артериальное давление, экскрецию протеинов мочи и гломерулярную потерю протеинов и, таким образом, снижают артериальное давление, восстанавливают экспрессию нефринов клубочков и снижают протеинурию. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы (I) где символ представляет собой одинарную связь;R4 представляет собой водород; в качестве антипротеинурического средства. 2. Применение соединения формулы (I) по п.1 в качестве антигломерулосклеротического средства. 3. Применение соединения формулы (I) по п.1 в качестве средства против почечной недостаточности. 4. Применение соединения формулы (I) по п.1, которое представляет собой 17(3-фурил)-5-андростан-3-,14-,17 триол. 5. Применение соединения формулы (I) по п.1 для изготовления лекарственного средства для предотвращения и/или лечения протеинурии, гломерулосклероза и почечной недостаточности. 6. Применение по п.5, где лекарственное средство предназначено для орального, внутривенного,внутримышечного, внутриартериального, интрамедуллярного, интратекального, интравентрикулярного,трансдермального, чрескожного, подкожного, внутрибрюшинного, интраназального, энтерального, местного, сублингвального или ректального введения. 7. Способ лечения протеинурии, гломерулосклероза и почечной недостаточности, включающий введение соединения формулы (I) в дозе от 0,05 до 20 мг/день. 8. Способ по п.7, где соединение вводится в дозе от 0,5 до 15 мг. 9. Способ по п.8, где соединение вводится в дозе от 5 до 10 мг. 10. Способ по пп.7-9, где соединение вводится по схеме введения единичной дозы. 11. Способ по пп.7-9, где соединение вводится по схеме введения множественной дозы. Фиг. 1. Экскреция протеинов мочи у мышей дикого типа и нокаутированных по -аддуцину Фиг. 2. Количество протеинов подоцитов из культивированных подоцитов неонатальных NB и NA конгенных линий крыс Фиг. 3. Экскреция протеинов мочи (мг/24 ч) и количество протеинов подоцитов, определенное методом иммунофлуоресценции в участках почек нормотензивных NB и NA конгенных крыс Фиг. 4. Снижение GRF с течением времени у пациентов с IgA нефропатией, как следствие генотипа с - и -аддуцином Фиг. 5. Культивированные подоциты NB крыс: количество протеина методом вестерн-блоттинга. Эффект Ростафуроксина 10-9 М Фиг. 6. Систолическое артериальное давление, экскреция протеинов мочи и количество нефрина в корковом слое почек у крыс, получавших уабаин (OS): эффект перорального лечения 100 мкг/кг Ростафуроксина в течение 8 недель
МПК / Метки
МПК: A61K 31/58, A61P 13/12
Метки: 14-β-андростана, 5-&beta, почечной, лечения, недостаточности, производные, гломерулосклероза, протеинурии
Код ссылки
<a href="https://eas.patents.su/13-19929-5-beta-proizvodnye-14-beta-androstana-dlya-lecheniya-proteinurii-glomeruloskleroza-i-pochechnojj-nedostatochnosti.html" rel="bookmark" title="База патентов Евразийского Союза">5-β производные 14-β-андростана для лечения протеинурии, гломерулосклероза и почечной недостаточности</a>
Предыдущий патент: Способ получения аденовирусных векторов
Следующий патент: Складной самокат
Случайный патент: Способ испытания материала на трение и износ и устройство для его осуществления