Способ получения 1-галоген-2,7-нафтиридинилпроизводных
Номер патента: 14497
Опубликовано: 30.12.2010
Авторы: Тремейн Нил, Эванс Грэм Роберт, Тиррелл Николас Дейвид
Формула / Реферат
1. Способ получения соединения формулы (I)
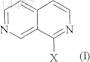
где X означает Cl или Br,
который включает следующие стадии:
(1) взаимодействие производного 3-циано-4-метилпиридина формулы (А)
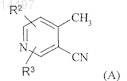
с соединением формулы (II)
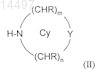
в присутствии ди(С1-С6)алкилацеталя N,N-диметилформамида с образованием енамина формулы (III)
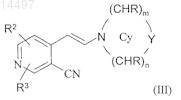
где R2и R3 независимо означают водород, Cl или Br, а Су означает N-связанный 4-6-членный гетероциклический цикл, в котором m равно 1 или 2, n равно 1 или 2, Y означает -CHR-, -NR1-, -О- или
-S(O)x-, где х равно 0, 1 или 2, каждый R независимо означает водород или C1-С6-алкил и R1 означает водород или С1-С6-алкил,
(2) циклизацию енамина формулы (III), а затем при необходимости удаление всех атомов Cl или Br с образованием соединения формулы (IV)
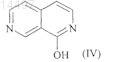
(3) реакцию соединения формулы (IV) с галогенирующим агентом с образованием соединения формулы (I).
2. Способ по п.1, где Су означает пирролидин-1-ил.
3. Способ по п.1 или 2, где на стадии (2) циклизацию проводят с использованием HBr, HCl или Н3РО4.
4. Способ по любому из пп.1-3, где на стадии (3) галогенирующий агент означает оксихлорид фосфора, оксибромид фосфора или образуется при взаимодействии хлорида тетра-н-бутиламмония и пентоксида фосфора.
5. Способ по любому из пп.1-4, где на стадии (3) используют гидробромид или гидрохлорид соединения формулы (IV).
6. Способ по п.5, где на стадии (3) используют гидрат гидробромида или гидрохлорида соединения формулы (IV).
7. Способ по п.5 или 6, где соединение формулы (IV) означает гидрат гидрохлорида 2,7-нафтиридин-1-ола.
8. Соединение формулы (III)
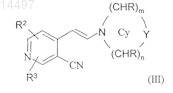
где R2и R3 независимо означают водород, Cl или Br, а Су означает N-связанный 4-6-членный гетероциклический цикл, в котором m равно 1 или 2, n равно 1 или 2, Y означает -CHR-, -NR1-, -О- или
-S(O)x-, где х равно 0, 1 или 2, каждый R независимо означает водород или C1-С6-алкил, a R1 означает водород или C1-С6-алкил.
9. Соединение, которое означает кристаллический гидрат гидробромида 2,7-нафтиридин-1-ола или кристаллический гидрат гидрохлорида 2,7-нафтиридин-1-ола.
10. Способ получения соединения формулы (I) по п.1, который включает взаимодействие соединения формулы (III) по п.1 с HBr или HCl.
Текст
В изобретении описан способ получения производных 1-галоген-2,7-нафтиридинила формулы (I) где X означает Сl или Вr, причем указанный способ включает следующие стадии: (1) взаимодействие производного 3-циано-4-метилпиридина формулы (А)(2) циклизацию енамина формулы (III) с образованием соединения формулы (IV)(3) реакцию соединения формулы (IV) с галогенирующим агентом с образованием соединения формулы (I). 014497 Настоящее изобретение относится к способу получения 1-галоген-2,7-нафтиридинилпроизводных и к классу енаминовых реагентов, которые можно использовать в указанном способе в качестве реагентов. 1-Галоген-2,7-нафтиридинилпроизводные можно использовать в качестве промежуточных продуктов при получении фармакологически активных соединений. Например, в Международной патентной заявкеWO 02/068393 описан новый класс производных енамида фенилаланина, включая производные 2,7-нафтиридин-1-иламинфенилаланина в качестве эффективных ингибиторов 4-интегринов. 1 Галоген-2,7-нафтиридины используются в качестве промежуточных соединений при получении производных таких енамидов фенилаланина. В статье Ikekawa N. (Chem. Pharm., Bull., 6, 269-272 (1958 впервые описан синтез 1-хлор-2,7 нафтиридина (кат.69042-30-4) через промежуточное получение 2,7-нафтиридин-1-ола исходя из 4-метилникотиновой кислоты. Полный синтез проходит с низким выходом и непригоден для крупномасштабного синтеза. Улучшенный синтез 1-гидрокси-2,7-нафтиридина из 3-циано-4-метилпиридина (кат.5444-01-9) описан в статье Baldwin J.J., J. Org. Chem., 43 (25), 4878-4880 (1978). В указанной методике из 3-циано-4 метилпиридина при взаимодействии с диметилацеталем N,N-диметилформамида получают N,N-диметил-2-(3-циано-4-пиридил)этенамин (транс-изомер, кат.67988-51-6). Однако реакцию проводят при высокой температуре (150 С) и в течение длительного времени (16 ч). Кроме того, продукт необходимо очищать перегонкой при высокой температуре и низком вакууме (150-160 С, 0,2 мм рт. ст., US-4176183),при этом общий выход является достаточно умеренным (63%). В связи с жесткими условиями проведения реакции и необходимостью очистки продукта перегонкой указанная методика непригодна для крупномасштабного синтеза. В указанной методике N,N-диметил-2-(3-циано-4-пиридил)этенамин (кат.67988-51-6) превращают в 2,7-нафтиридин-1-ол (кат.67988-50-5) при действии бромистого водорода в уксусной кислоте. В то время как реакция является достаточно эффективной, выделение продукта является достаточно сложным процессом. Продукт необходимо выделять из водной среды непрерывной экстракцией, поскольку он хорошо растворим в воде. После непрерывной экстракции продукт необходимо очищать экспресс-хроматографией, при этом выход является достаточно умеренным. Из 2,7-нафтиридин-1-ола (кат.67988-50-5) можно получить, например, 1-хлор-2,7-нафтиридин(кат.69042-30-4) при нагревании нафтиридона в оксихлориде фосфора в закрытом сосуде при высокой температуре в течение длительного времени (см. US 4859671), но такая реакция также идет с умеренным выходом продукта. По нашему мнению реакция, прежде всего проводимая в крупномасштабных условиях, является достаточно трудновоспроизводимой, прежде всего, если ее проводят при высокой концентрации, поскольку реакционная смесь имеет тенденцию к аггломерации, что сопровождается разложением, снижением выхода и чистоты продукта. В WO 02/068393 также описан способ получения производных 1-галоген-2,7-нафтиридина с использованием N,N-диметил-2-(3-циано-4-пиридил)этенамина. В настоящее время нами разработан новый способ синтеза производных 1-галоген-2,7-нафтиридина через циклический енамин, который, прежде всего, пригоден для крупномасштабного синтеза. Синтез проводится достаточно простым методом, позволяет получать достаточно чистые промежуточные соединения с высоким выходом в кристаллической форме и не требует продолжительного времени проведения реакции. Соответственно, в настоящем изобретении предлагается способ получения соединения формулы (I)-S(O)x-, где х равно 0, 1 или 2, каждый R независимо означает водород или C1-С 6-алкил и R1 означает водород или C1-С 6-алкил,(2) циклизацию енамина формулы (III), а затем при необходимости удаление всех атомов Cl или Br с образованием соединения формулы (IV)(3) реакцию соединения формулы (IV) с галогенирующим агентом с образованием соединения формулы (I). В одном варианте X в соединении формулы (I) означает О. В другом варианте X в соединении формулы (I) означает Br. Предпочтительно X в соединении формулы (I) означает Cl. Пригодные примеры соединения формулы (А) включают 3-циано-4-метилпиридин, 2-хлор-3-циано 4-метилпиридин, 5-хлор-3-циано-4-метилпиридин, 6-хлор-3-циано-4-метилпиридин, 3-циано-2,5-дихлор 4-метилпиридин, 3-циано-2,6-дихлор-4-метилпиридин, 3-циано-5,6-дихлор-4-метилпиридин, 2-бром-3 циано-4-метилпиридин, 5-бром-3-циано-4-метилпиридин, 6-бром-3-циано-4-метилпиридин, 3-циано-2,5 дибром-4-метилпиридин, 3-циано-2,6-дибром-4-метилпиридин, 3-циано-5,6-дибром-4-метилпиридин, 2 бром-5-хлор-3-циано-4-метилпиридин, 2-бром-6-хлор-3-циано-4-метилпиридин, 5-бром-2-хлор-3-циано 4-метилпиридин и 6-бром-2-хлор-3-циано-4-метилпиридин. Предпочтительные примеры соединения формулы (А) включают 3-циано-4-метилпиридин и 3-циано-2,6-дихлор-4-метилпиридин. В одном предпочтительном варианте R2 и R3, каждый, означают водород и, следовательно, производное формулы (А) означает 3-циано-4-метшширидин, а соединение формулы (III) означает В другом варианте R2 и R3, каждый, означают Cl. В еще одном варианте R2 означает водород, a R3 означает О. В еще одном варианте R2 и R3, каждый, означают Br. В другом варианте R2 означает водород,a R3 означает Br. В еще одном варианте R2 означает Cl, a R3 означает Br. В другом предпочтительном варианте соединение формулы (А) означает 3-циано-2,6-дихлор-4 метилпиридин. В одном варианте m равно 1. В другом варианте m равно 2. В одном варианте n равно 1. В другом варианте n равно 2. Предпочтительно m равно 1, a n равно 2. Предпочтительно R означает водород или метил. В одном варианте R означает водород. В другом варианте R означает C1-С 6-алкил, прежде всего метил. Предпочтительно R1 означает водород или метил. В другом варианте R1 означает водород. В другом варианте R1 означает C1-С 6-алкил, прежде всего метил. В одном варианте х равен 0. В другом варианте х равен 1. В еще одном варианте х равен 2. В предпочтительном варианте Y означает -CHR-, прежде всего -СН 2-. Типичные примеры группы Су включают азетидин-1-ил, пирролидин-1-ил, 2-метилпирролидин-1 ил, пиперидин-1-ил, 2-метилпиперидин-1-ил, 3-метилпиперидин-1-ил, 4-метилпиперидин-1-ил, 3,5 диметилпиперидин-1-ил, пиперазин-1-ил, 4-метилпиперазин-1-ил, морфолин-4-ил, 2,6-диметилморфолин-4-ил, тиоморфолин-4-ил и 1,1-диоксотиоморфолин-4-ил. Предпочтительные примеры Су включают пирролидин-1-ил, 2-метилпирролидин-1-ил, пиперидин-1-ил, 2-метилпиперидин-1-ил, 3-метилпиперидин-1-ил, 4-метилпиперидин-1-ил, 3,5-диметилпиперидин-1-ил и 2,6-диметилморфолин-4-ил. В одном варианте изобретения Су означает пирролидин-1-ил. Типичные примеры соединений формулы (III) включают 4-[2-(пирролидин-1-ил)винил]никотинонитрил и 2,6-дихлор-4-[2-(пирролидин-1-ил)винил]никотинонитрил. Конкретным примером соединения (III) является 4-[2-(пирролидин-1-ил)винил]никотинонитрил.-2 014497 Соединения формулы (III) являются новыми и представляют собой еще один объект изобретения. Соединения формула (III) могут существовать в виде (Е)-изомера или (Z)-изомера или в виде их смеси. Подразумевается, что изобретение включает индивидуальные изомеры и их смеси в любом соотношении. Соединения формулы (IV) могут присутствовать в виде таутомеров и подразумевается, что изобретение включает индивидуальные таутомеры и их смеси в любом соотношении. При наличии некоторых заместителей в соединениях формул (I), (II), (III) или (IV) можно использовать соли таких соединений. Пригодные соли включают кислотно-аддитивные соли, такие как гидрохлорид или гидробромид. Соединения формул (I), (II), (III) или (IV) и их соли могут существовать в форме сольвата, такого как гидрат или сольват спирта, причем все такие сольваты включены в объем настоящего изобретения. Стадия (1) описанного выше способа включает превращение производного 3-циано-4-метилпиридина формулы (А) в производное енамина формулы (III). Енамин формулы (III) предпочтительно получают в относительно мягких условиях достаточно непродолжительной реакции. Преимущественно полученный продукт кристаллизуется непосредственно из реакционной смеси с высоким выходом и в достаточно чистом состоянии, что позволяет исключить экстракцию растворителем и последующую очистку. Реакцию можно проводить в две стадии. Обычно на первой стадии соединение формулы (II), такое как пирролидин, конденсируют с ди(С 1-С 6)алкилацеталем N,N-диметилформамида, таким как диметилацеталь N,N-диметилформамида, при повышенной температуре, такой как температура кипения растворителя, в течение приблизительно от 0,5 до 5 ч, обычно от 1,0 до 1,5 ч. После выпаривания растворителя полученную смесь (продукт конденсации) можно непосредственно использовать на следующей стадии. Производное 3-циано-4-метилпиридина формулы (А) обычно перемешивают в пригодном растворителе,предпочтительно (низш.) спирте, таком как изопропиловый спирт, а затем добавляют продукт конденсации, полученный на первой стадии. Реакционную смесь обычно перемешивают при комнатной температуре или нагревают при повышенной температуре, например при температуре кипения растворителя в течение приблизительно от 0,5 до 6 ч, обычно от 1,5 до 2,0 ч. Затем добавляют вторую порцию продукта конденсации для завершения реакции. Растворитель удаляют и полученную суспензию кристаллического продукта фильтруют. Установлено, что если соединение формулы (А) означает 3-циано-4-метилпиридин,енамин формулы (III) обычно получают с выходом 87%. Стадия (2) способа включает циклизацию енамина формулы (III), а затем при необходимости удаление всех атомов Cl или Br с образованием 1-гидрокси-2,7-нафтиридина формулы (IV). Реакцию обычно проводят с использованием HBr, HCl или Н 3 РО 4, обычно HBr или HCl, обычно водного раствора HBr или HCl, необязательно в присутствии трифторуксусной кислоты. Реакцию проводят в пригодном растворителе, обычно в кислоте, такой как уксусная кислота. Например, енамин формулы (III) перемешивают в уксусной кислоте, обычно при 0-25 С, обычно при 10-15 С, а затем добавляют трифторуксусную кислоту, поддерживая в смеси указанную температуру. Полученную смесь добавляют в смесь воды и HBr или HCl, обычно HBr в уксусной кислоте, поддерживая температуру смеси 25-60 С,обычно 40-50 С. После завершения реакции растворитель упаривают в вакууме, обычно в виде азеотропной смеси с толуолом. Затем обычно добавляют второй растворитель, обычно (низш.) спирт, например этанол, после концентрирования которого происходит осаждение продукта в виде гидробромида или гидрохлорида. В другом варианте для циклизации енамина можно использовать концентрированную соляную кислоту. Например, енамин формулы (III) добавляют в соляную кислоту обычно при температуре 0-25 С. Полученную смесь нагревают при 60-100 С, обычно при 80 С. После завершения реакции растворитель выпаривают в вакууме. Затем обычно добавляют второй растворитель, обычно спирт, например н-пропанол или пропан-2-ол, после концентрирования которого происходит осаждение продукта в виде гидрата гидрохлорида. В другом варианте после завершения реакции смесь охлаждают до комнатной температуры и продукт отделяют фильтрованием. Установлено, что если в способе на стадии (1) используют 3-циано-4-метилпиридин, то соединение формулы (IV) обычно получают с выходом 96%. Выделение гидробромида или гидрохлорида преимущественно исключает необходимость экстракции другим растворителем и последующей очистки. Если производное енамина формулы (III) содержит атомы О или Br, то после циклизации такие заместители удаляют. Обычно циклическое промежуточное соединение обрабатывают (газообразным) водородом в присутствии пригодного катализатора, такого как палладий на угле в присутствии ацетата натрия, в пригодном растворителе, таком как (низш.) спирт, например метанол. Установлено, что соединение формулы (IV) обычно получают с выходом 64%. Стадия (3) способа включает превращение гидроксипроизводного формулы (IV) в галогенпроизводное формулы (I). Обычно гидроксипроизводное используют в виде гидробромида или гидрохлорида. Преимущественно применение соли в реакции галогенирования позволяет получать продукт с более высоким выходом и в более чистом состоянии, чем при использовании соответствующего свободного осно-3 014497 вания. Гидробромид 2,7-нафтиридин-1-ола является новым соединением и также представляет собой еще один объект изобретения. Обычно соль 2,7-нафтиридин-1-ола вводят в реакцию с пригодным галогенирующим агентом, например хлорирующим агентом, таким как оксихлорид фосфора (POCl3), или бромирующим агентом, таким как оксибромид фосфора (POBr3). Если в реакцию с POCl3 вводят гидробромид, то полученный продукт обычно представляет собой смесь 1-Cl- и 1-Br-2,7-нафтиридинов, обычно в соотношении приблизительно 9:1, соответственно, которую можно использовать без дополнительной очистки. В реакции можно также использовать каталитическое количество N,N-диметилформамида(ДМФА), при этом реакция идет с более высокой скоростью и конечный продукт образуется с более высоким выходом и в более чистом состоянии, причем реакцию можно проводить при более высокой концентрации реагентов. Например, POCl3 обычно добавляют в гидробромид 2,7-нафтиридин-1-ола, а затем добавляют по каплям ДМФА. Реакционную смесь нагревают, обычно при температуре кипения растворителя, в течение 1-5 ч, обычно в течение 3 ч. Реакцию обычно останавливают при добавлении в охлажденную смесь обычно до -10 С, например, аммиака в воде и пригодного органического растворителя, такого как этилацетат, поддерживая температуру менее 20 С, предпочтительно менее 15 С. После экстракции водного слоя другим органическим растворителем, например этилацетатом, органический слой промывают водой, сушат и выпаривают стандартными методами. Установлено, что соединение формулы (I) обычно получают с выходом 85-96%. В реакции галогенирования предпочтительно используют гидробромид или гидрохлорид 2,7-нафтиридин-1-ола, предпочтительно гидрат гидрохлорида и предпочтительно POCl3. Наиболее предпочтительно в реакции галогенирования, преимущественно в реакции хлорирования,используют гидрат гидробромида или гидрохлорида, обычно гидрат гидрохлорида, а при завершении реакции получают раствор, а не густую суспензию, которая образуется в присутствии безводного гидробромида или гидрохлорида, что является преимуществом способа. Полученный раствор является более пригодным для остановки реакции, прежде всего в условиях крупномасштабного синтеза. Как указано выше, гидрат означает кристаллические формы органического соединения, содержащие в кристаллической решетке молекулы воды. Для специалиста также очевидно, что гидраты образуются при длительном хранении соответствующей безводной соли на воздухе. Кристаллический гидрат гидробромида и гидрохлорида 2,7-нафтиридин-1-ола, например, охарактеризованный ниже, прежде всего гидрат гидрохлорида 2,7-нафтиридин-1-ола, является новым и представляет собой еще один объект изобретения. Например, POCl3 обычно добавляют в гидрат гидрохлорида 2,7-нафтиридин-1-ола. Реакционную смесь нагревают обычно при температуре кипения растворителя в течение 1-5 ч, обычно в течение 3 ч. Затем реакционную смесь разбавляют дихлорметаном, реакцию обычно останавливают при добавлении в охлажденную смесь, например, аммиака в воде и пригодного органического растворителя, такого как дихлорметан, строго поддерживая температуру менее 20 С, предпочтительно менее 15. После экстракции водного слоя органический слой промывают водой, сушат и выпаривают стандартными методами. Промытый водой органический слой можно частично упарить, а затем можно добавить другой растворитель, такой как ацетонитрил, и смесь частично упарить. Указанную процедуру можно повторить. Затем к полученному остатку добавляют воду, строго поддерживая температуру смеси более 50 С, а потом постепенно охлаждают предпочтительно до 5 С. После осаждения полученное твердое вещество отделяют фильтрованием, промывают водой и высушивают. Установлено, что соединение формулы (I) обычно получают с выходом 85-96%. В другом варианте галогенирующий агент можно получить из смеси хлорида тетра-н-бутиламмония и пентоксида фосфора. Можно также провести непосредственную конверсию енамина (III) в соединение (I), где X означаетBr. Таким образом, еще одним объектом настоящего изобретения является способ получения соединения формулы (I), указанного выше, где X означает Br, который включает взаимодействие соединения формулы (III) с HBr. Например, обычно получают раствор енамина (III) и в охлажденный (например, до -5 С) раствор добавляют газообразный бромистый водород. В качестве растворителя используют, например,уксусную кислоту или дихлорметан. После завершения реакции смесь обычно выливают в насыщенный раствор NaHCO3. Слои разделяют, органический слой сушат и растворитель удаляют, при этом получают неочищенный бромид (I). Аналогичным образом проводят превращение енамина (III) в соединение формулы (I), где X означает О. Таким образом, еще одним объектом настоящего изобретения является способ получения соединения формулы (I), указанного выше, где X означает О, который включает взаимодействие соединения формулы (III) с HCl. Обычно раствор енамина (III) перемешивают в пригодном растворителе, таком как уксусная кислота, а затем добавляют HCl, например, в уксусной кислоте.-4 014497 Изобретение иллюстрируется следующими примерами, не ограничивающими его объем. В описании заявки используются следующие сокращения.(программа ACD, версия 6.00). Спектры 1 Н ЯМР снимали на спектрометре Bruker AV-300 или DRX-400 при 300.13 МГц или 400.13 МГц с использованием пакета программ Bruker XWINNMR. Если не указано иное, спектры снимали при комнатной температуре. Химические сдвиги приводятся в ч./млн относительно сигнала внутреннего стандарта ТМС или сигнала остаточного растворителя. ЖХВР проводили в следующих условиях. Система 1. Колонка: Phenomenex Luna, 5 мкм, С-18 (2), 1504,6 мм; подвижная фаза: компонент А: 20 мМ KH2PO4 (рН 7); компонент В: 90% MeCN/вода для ЖХВР, 90%:10%; скорость элюирования: 2 мл/мин; длина волны детектора: 210 нм. Для характеристики соединений, описанных в примерах 2, 2 а, 3 и 4, использовали также анализ по Карлу-Фишеру, порошковую рентгенографию (ПРГ), рентгенографию на монокристалле, ИК-спектроскопию, дифференциальную сканирующую калориметрию (ДСК) и метод динамической сорбции паров. Пример 1. 4-[2-Пирролидин-1-илвинил]никотинонитрил. Стадия 1. Конденсация пирролидина и диметилацеталя диметилформамида. Диметилацеталь диметилформамида (11,21 г, 1,11 экв.) помещали в пирролидин (10,22 г, 1,70 экв.) при комнатной температуре. Смесь нагревали до 83 С и перемешивали при указанной температуре в течение 1,5 ч. Затем смесь переносили в прибор для перегонки при атмосферном давлении и перегоняли растворитель при температуре смеси 118 С. Смесь охлаждали и полученное невязкое масло непосредственно использовали на следующей стадии. Стадия 2. Получение енамина. 3-Циано-4-метилпиридин (10,00 г, 1,0 экв.) суспендировали в IPA (10 мл), при комнатной температуре добавляли полученный на первой стадии продукт конденсации и остатки продукта смывали IPA(10 мл). Смесь нагревали до температуры кипения растворителя и кипятили с обратным холодильником в течение 2 ч, после чего результаты анализа методом ЖХВР (система 1) указывали на степень превращения 98%. Реакционную смесь охлаждали и перемешивали при комнатной температуре в течение ночи. Твердое вещество отделяли фильтрованием, суспендировали на фильтре в IPA (16 мл), промывали IPA(7 мл) и высушивали в вакууме, при этом получали указанное в заголовке соединение (14,76 г, 87%). ЖХ/МС (ES+): (рН 5,8, КТ, 2,92 мин)/200 (М+Н)+. 1 Н-ЯМР (CDCl3):8,49 (1 Н, s), 8,23 (1 Н, d, J 5,9 Гц),7,56 (1 Н, d, J 13,2 Гц), 7,09 (1H, d, J 5,9 Гц), 5,21 (1 Н, d, J 13,2 Гц), 3,40 (4 Н, m), 2,00 (2 Н, t, J 6,6 Гц). В указанной реакции кроме пирролидина использовали также другие амины, указанные ниже в таблице. В типичном примере пиперидин (1,19 г, 1,65 экв.) и диметилацеталь N,N-диметилформамида(1,11 г, 1,10 экв.) растворяли в IPA (2 мл) и нагревали при температуре кипения растворителя в течение 2 ч. Затем добавляли 3-циано-4-метилпиридин (1,0 г, 1,0 экв.) и реакционную смесь кипятили с обратным холодильником в течение 2 ч. Данные ЖХ/МС (рН 5,8) для указанного и других аминов приводятся в таблице. Пример 2. Гидробромид 2,7-нафтиридин-1-ола. Метод А. Соединение, полученное как описано в примере 1, (668,6 г, 1 экв.) суспендировали в АсОН (835 мл,1,25 об.) и при перемешивании охлаждали до 10-15 С. Затем добавляли трифторуксусную кислоту(1,84 л, 2,75 об.), поддерживая температуру менее 20 С. Полученный раствор добавляли в смесь воды(135 мл, 0,2 об., 2,2 экв.) и HBr (1,35 л, 45 мас.% в АсОН, 2 об., 2,2 экв.), поддерживая температуру менее 45 С. Смесь перемешивали при температуре 40-50 С в течение 1,5-2 ч до завершения реакции по данным ЖХВР (система 1). Затем смесь помещали в прибор для перегонки в вакууме, осторожно снижали давление и перегоняли летучие компоненты (4,5-5 об., 110-70 мбар, 40-60 С). В остаток добавляли толуол(2 об.), выпаривали растворитель (2-2,5 об., 110-70 мбар, 40-60 С) и процедуру повторяли. В остаток добавляли этанол (3,5 об.) и часть растворителя удаляли перегонкой (1,3-1,6 об., 110-70 мбар, 40-60 С).-6 014497 Смесь охлаждали, перемешивали при комнатной температуре, осадок отделяли фильтрованием, промывали этанолом (1,7 об.) и высушивали в вакууме при 40-50 С, при этом получали указанное в заголовке соединение в виде твердого вещества грязно-белого цвета (745,9 г, 97,9%). ЖХ/МС (ES+): (pH 2,5, КТ,0,53 мин)/147 (М+Н)+. 1 Н-ЯМР (ДМСО):9,47 (1H, s), 8,78 (1 Н, d, J 6,3 Гц), 8,08 (1 Н, d, J 6,3 Гц), 7,83 (1H, t, J 6,8 Гц), 6,81(без ограничения перечисленным): 1653, 1633, 1247, 1223, 813, 796 и 759 см-1. Дифференциальная сканирующая калориметрия (ДСК) (Mettler Toledo ДСК 12 Е, алюминиевая кювета, скорость сканирования: 10 С/мин, 30-320 С): эндотермический пик при приблизительно 265 С. Метод В. 4-[2-Пиперидин-1-илвинил]никотинонитрил (18,79 г) циклизовали аналогично тому, как описано в методе А, при этом получали указанное в заголовке неочищенное соединение (19,64 г, 98%). ЖХ/МС:(рН 5,8, КТ, 1,38 мин)/147 (М+Н)+. Пример 2 а. Гидрат гидробромида 2,7-нафтиридин-1-ола. Анализ по Карлу-Фишеру: 7,5 мас.% воды, что соответствует содержанию 1,0 моль воды в 1 моль гидробромида 2,7-нафтиридин-1-ола. ИК-спектр (РЕ Spectrum, автоматизированный ввод пробы) характеризуется следующими пиками(без ограничения перечисленным): 3394, 1653, 1633, 1253, 1229, 837 и 781 см-1. Широкий пик при 3394 см-1 характерен для внутримолекулярной связанной водородной связью -ОН группы. ДСК (Mettler Toledo ДСК 12 Е, алюминиевая кювета, скорость сканирования: 10 С/мин, 30-320 С): широкий эндотермический пик при 65 С, а затем аналогичный эндотермический пик при приблизительно 265 С. Пример 3. Гидрохлорид 2,7-нафтиридин-1-ола. В соляную кислоту (10 мл, относительная плотность 1,18) при комнатной температуре в течение 5 мин добавляли 4-[2-пирролидин-1-илвинил]никотинонитрил (пример 1, 2,00 г). Раствор перемешивали при комнатной температуре в течение 50 мин, а затем нагревали при 80 С в течение 20 мин, при этом данные ЖХВР (система 1) указывали на завершение реакции. Реакционную смесь охлаждали, концентрировали при пониженном давлении и остаток упаривали в виде азеотропной смеси с этанолом (4). В остаток добавляли этанол (4,5 мл) и полученную суспензию перемешивали при комнатной температуре в течение 2 ч. Твердое вещество отделяли фильтрованием, промывали этанолом (21 мл) и высушивали в вакууме, при этом получали указанное в заголовке соединение (1,64 г, 90%) в виде твердого вещества зеленого цвета. ЖХ/МС (ES+): (рН 2,5, КТ, 0,53 мин)/147 (М+Н)+. 1 Н-ЯМР (MeOD):9,52 (1 Н, s), 8,75(1H, d, J 6,5 Гц), 8,15 (1H, d, J 6,5 Гц), 7,87 (1 Н, d, J 7,1 Гц), 6,88 (1 Н, d, J 7,1 Гц). Анализ по Карлу-Фишеру: (материал выделен из сухого этанола) 0,93 мас.% воды. Данные порошковой рентгенографии (XRPD) (сыпучий материал) собирали на дифрактометре Siemens D5000 с использованием излучения CuK. Данные характеризовались (без ограничения перечисленным) пиками при 9,4, 13,1, 14,0, 14,3, 15,8, 16,8, 20,5, 23,4, 23,8, 25,0, 25,3, 26,7, 27,0, 27,5, 28,0, 28,3,29,3, 30,8, 35,8, 36,5 угла 2. ИК-спектр (РЕ Spectrum, автоматизированный ввод пробы) характеризуется следующими пиками(без ограничения перечисленным): 1678, 1611, 1462, 845, 806 и 798 см-1. ДСК (Mettler Toledo ДСК 12 Е, алюминиевая кювета, скорость сканирования: 10 С/мин, 20-220 С): один широкий эндотермический пик в интервале от приблизительно 155 до 210 С. При исследовании динамической сорбции паров (Surface Measurement Systems DVS 1000) при 25 С наблюдается очень низкая потеря массы на уровне 1,2 мас.% при 0% ОВ (относительной влажности) в течение 8 ч. Указанная потеря массы быстро восстанавливается при повышении ОВ до более 10%, и,кроме того, наблюдается медленный прирост массы на уровне приблизительно 1 мас.% при 95% ОВ. Процесс изменение массы с изменением ОВ воспроизводился в течение двух циклов. Пример 4. Гидрат гидрохлорида 2,7-нафтиридин-1-ола. Метод А. В соляную кислоту (50 мл, относительная плотность 1,18) при комнатной температуре в течение 5 мин добавляли 4-[2-пирролидин-1-илвинил]никотинонитрил (пример 1, 10,01 г) и реакционную смесь нагревали при температуре 80 С в течение 35 мин, при этом данные ЖХВР (система 1) указывали на завершение реакции. Реакционную смесь охлаждали до 40 С и частично упаривали в вакууме, собирая 2,5 мл дистиллята. В реакционную смесь добавляли пропан-1-ол (40 мл) и упаривали в вакууме, собирая 30 мл дистиллята. Затем добавляли вторую порцию пропан-1-ола и упаривали в вакууме, собирая 27 мл дистиллята. Смесь охлаждали до комнатной температуры и перемешивали в течение 15 мин, твердое вещество отделяли фильтрованием, суспендировали на фильтре в пропан-1-оле (15 мл), промывали пропан-1-олом (210 мл) и высушивали в вакууме, при этом получали указанное в заголовке соединение в виде твердого вещества светло-желтого цвета (8,88 г, 88%). Данные ЯМР аналогичны указанным в-7 014497 примере 3. Анализ по Карлу-Фишеру: (продукт кристаллизовали из водного н-пропанола или изопропанола) 9,2 мас.% воды, 1,0 экв., гидрат. Рентгенография на монокристалле: кристаллы выращивали из водного н-пропанола (Instrument:Nonius Kappa CCD), C8H9ClN2O2, MM 200,62, форма моноклиническая, пространственная группа С 2/с, а 12,4267(3) , b 7,5329(2) , с 18,7840(7) ,90,00,94,0230(10),90,00, V 1754,02 кубических ,Т 120 К, Z 8, плотность (рассч.) 1,519 г/см 3,0,71073 . Конечные погрешности для 124 параметров: R1(без ограничения перечисленным) следующими пиками при: 9,4, 13,8, 14,4, 14,7, 17,0, 17,7, 20,2, 23,6,23,9, 25,3, 26,9, 27,1, 27,7, 27,9, 28,3, 28,8, 29,7, 31,0, 33,3, 35,5, 36,1, 36,8 угла 2 (данные рассчитаны с использованием системы Mercury 1.4.1 для 1,54056 ). Установлено, что экспериментальная порошковая рентгенограмма, полученная для сыпучего материала, совпадает с рассчитанной рентгенограммой,указанной выше. В указанных условиях съемки (дифрактометр Philips Xpert, немонохроматизированное излучение CuK, комнатная температура) рентгенограмма характеризуется пиками при 9,5, 13,7, 14,3,14,6, 16,8, 17,6, 20,0, 23,3, 23,8, 25,1, 26,7, 27,0, 27,5, 27,7, 28,0, 28,6, 29,4, 30,8, 33,3, 35,1, 35,6, 36,6 угла 2. ИК-спектр (РЕ Spectrum, автоматизированный ввод пробы) характеризуется следующими пиками(без ограничения перечисленным): 3383, 1678, 1635, 1462, 845, 812 и 783 см-1. Широкий пик при 3383 см-1 характерен для внутримолекулярных связанных водородными связями -ОН групп и соответствует данным рентгеноструктурного анализа на кристалле указанного материала. ДСК (Mettler Toledo ДСК 12 Е, алюминиевая кювета, скорость сканирования: 10 С/мин, 20-220 С): три эндотермических пика: начальный широкий эндотермический пик приблизительно при 125 С, острый эндотермический пик приблизительно при 165 С и последний широкий эндотермический пик приблизительно при 190 С. При исследовании динамической сорбции паров (Surface Measurement Systems DVS 1000) при 25C не наблюдается существенной потери массы или наблюдается прирост массы на уровне приблизительно 1 мас.% при 95% ОВ. Процесс изменения массы наблюдается в течение двух циклов в диапазоне 0-95% ОВ, что свидетельствует о высокой стабильности соединения. Метод В. В соляную кислоту (60 мл, относительная плотность 1,18) при комнатной температуре добавляли 4-[2-пирролидин-1-илвинил]никотинонитрил (пример 1, 20,00 г) и остатки продукта смывали из колбы второй порцией соляной кислоты (20 мл, относительная плотность 1,18). Полученный раствор нагревали до 80 С в течение 1 ч и выдерживали при указанной температуре в течение 20 мин. Затем смесь охлаждали до 40 С, в течение 30 мин добавляли пропан-2-ол (100 мл) и упаривали в вакууме, собирая 96 мл дистиллята. В остаток добавляли вторую порцию пропан-2-ола (100 мл) и упаривали в вакууме, собирая 63 мл дистиллята. Смесь охлаждали до 20 С и перемешивали в течение 2,75 ч. Твердое вещество отделяли фильтрованием, промывали 20 мл 10% водного пропан-2-ола, суспендировали на фильтре в 30 мл 10% водного пропан-2-ола, промывали 20 мл 10% водного пропан-2-ола и высушивали в вакууме, при этом получали указанное в заголовке соединение в виде твердого вещества желтого цвета (18,47 г, 92%). Данные ЯМР аналогичны указанным в примере 3. Пример 5. 2,7-Нафтиридин-1-ол. Метод А. Соединение, полученное в примере 1 (1,00 г, 1 экв.), помещали в колбу, затем добавляли 85 мас.% Н 3 РО 4 (10 мл) и смесь нагревали при 90 С в течение 35 мин. ЖХ/МС: (рН 5,8, КТ, 1,38 мин)/147 (М+Н)+. Метод В. Соединение, полученное в примере 1 (1,0 г), суспендировали/растворяли в ледяной уксусной кислоте (3,88 мл) и воде (90,5 мкл, 1 экв.), смесь перемешивали при комнатной температуре и добавляли 45% мас./об. раствор HBr в АсОН (3,62 мл, 4,0 экв.). Реакционную смесь нагревали при 40 С в течение 4 ч 49 мин, после чего данные ЖХВР указывали на завершение реакции, при этом получали раствор указанного в заголовке соединения (выход 73%). Пример 6. Получение 1-хлор-2,7-нафтиридина из гидробромида 2,7-нафтиридин-1-ола. К соединению, полученному как описано в примере 2 (0,50 кг), добавляли оксихлорид фосфора(1,645 кг, 2 об.) и смесь перемешивали, при этом через капельную воронку добавляли ДМФА 20 г(0,1 моль экв.). Затем смесь кипятили с обратным холодильником в течение 3 ч. При этом к верхней части холодильника последовательно присоединяли масляный затвор и насадку, заполненную едким натром, для поглощения выделяющегося HCl. Продукт охлаждали до 20-25 С и анализировали методом ЖХВР (система 2), при этом результаты анализа указывали на завершение реакции. Одновременно во второй реактор помещали 0,88 н. аммиак (3,65 кг, 8,3 об.) и воду (4,15 кг, 8,3 об.). Смесь охлаждали до -10 С и добавляли этилацетат (4,5 кг, 5 об.). Реакцию останавливали при добавлении смеси из первого реактора во второй реактор, поддерживая температуру 15 С. После завершения-8 014497 добавления охлаждение отключали, смесь перемешивали, а затем выдерживали до расслаивания. Органический слой отделяли, водную фазу экстрагировали этилацетатом (4,5 кг, 5 об.), который пропускали через реактор и соединительную линию. После второй стадии перемешивания/экстракции и отделения органической фазы в реактор добавляли третью порцию этилацетата (1,35 кг, 2 об.) и смесь охлаждали до 0-5 С. Затем водные растворы медленно добавляли в реактор, поддерживая температуру 15 С. После перемешивания/экстракции смесь переносили в реактор для обработки и остаток водного раствора и этилацетата (2,25 кг, 3 об.) использовали для промывки соединительной линии. Содержимое реактора для обработки перемешивали и фазы разделяли. Водную фазу экстрагировали четвертой порцией этилацетата (4,5 кг, 5 об.), которую пропускали через первый реактор. После разделения фаз объединенные экстракты фильтровали, промывали водой (1 об.), сушили над сульфатом магния (0,25 мас. экв.), суспензию фильтровали и неорганический остаток на фильтре промывали этилацетатом (0,45 кг, 21 об.). Растворитель удаляли в вакууме и неочищенный (но достаточно чистый) продукт высушивали в вакууме при 35-40 С, при этом получали указанное в заголовке соединение в виде твердого вещества грязнобелого цвета (609 г, 95,1%), которое использовали без дополнительной очистки. По данным ЖХВР (система 2) продукт представляет собой смесь 1-хлор-2,7-нафтиридина и 1-бром-2,7-нафтиридина в соотношении приблизительно 90:10. Ниже приводятся данные для 1-хлор-2,7-нафтиридина. tпл 117,6C. ЖХ/МС(1H, d, J 5,7 Гц). Пример 7. Получение 1-хлор-2,7-нафтиридина из гидрата гидрохлорида 2,7-нафтиридин-1-ола. Метод А. К соединению, полученному как описано в примере 4 (4,60 г, 9 мас.% воды), добавляли оксихлорид фосфора (108 мл, 170 г, 2 об.) и смесь кипятили с обратным холодильником в течение 3,5 ч. При этом к верхней части холодильника последовательно присоединяли масляный затвор и насадку, заполненную едким натром, для поглощения выделяющегося HCl. Продукт охлаждали до 20-25 С и анализировали методом ЖХВР (система 2), при этом результаты анализа указывали на завершение реакции. В реакционную смесь добавляли 240 мл ДХМ для промывки реактора. Затем реактор охлаждали до 5-10 С и реакционную смесь медленно и осторожно добавляли в смесь 0,88 н. аммиака (480 мл, 8 об.) и воды(480 мл, 8 об.), поддерживая температуру менее 15 С. Органический слой отделяли, водную фазу экстрагировали ДХМ (240 мл), который также использовали для промывки реактора. Затем объединенные органические слои промывали водой (180 мл), растворитель удаляли в вакууме, неочищенный продукт высушивали в вакууме при 35-40 С, при этом получали указанное в заголовке соединение в виде твердого вещества грязно-белого цвета (47,5 г, 96,7%), которое использовали без дополнительной очистки. tпл 118,1-119,8 С. ЖХ/МС (ES+): (рН 2,5, КТ, 2,10 мин)/165,2 (М+Н)+. 1 Н-ЯМР (CDCl3):9,76 (1H, s), 8,83(1 Н, d, J 5,7 Гц), 8,48 (1H, d, J 5,7 Гц), 7,67 (1 Н, d, J 5,7 Гц), 7,63 (1H, d, J 5,7 Гц). Метод В. К соединению, полученному как описано в примере 4 (750 г, 9 мас.% воды), добавляли оксихлорид фосфора (1500 мл, 2469,5 г, 2 об.) и смесь кипятили с обратным холодильником в течение 2 ч. При этом к верхней части холодильника последовательно присоединяли масляный затвор и насадку, заполненную едким натром, для поглощения выделяющегося HCl. Продукт охлаждали до 20-25 С и анализировали методом ЖХВР (система 2), при этом результаты анализа указывали на завершение реакции. В реакционную смесь добавляли 4500 мл ДХМ для промывки реактора. Затем реактор охлаждали до 5-10 С и реакционную смесь медленно и осторожно добавляли в смесь 0,88 н. раствора аммиака(6375 мл, 8 об.) и воды (6375 мл, 8 об.), поддерживая температуру менее 15 С. Органический слой отделяли, водную фазу экстрагировали ДХМ (21500 мл), который также использовали для промывки реактора. Затем объединенные органические слои промывали водой (3750 мл) и раствор в ДХМ упаривали при атмосферном давлении, собирая 6600 мл дистиллята. В остаток добавляли ацетонитрил (900 мл) и раствор упаривали, собирая еще 900 мл дистиллята. Затем добавляли вторую порцию ацетонитрила(900 мл) и раствор упаривали, собирая еще 900 мл дистиллята. К полученному остатку в течение 30 мин добавляли воду (3000 мл), поддерживая температуру смеси более 50 С. Затем суспензию постепенно охлаждали до 5 С и выдерживали при указанной температуре в течение 1 ч. Твердое вещество отделяли фильтрованием, промывали водой (1500 мл) и высушивали в вакууме при 35-40 С, при этом получали указанное в заголовке соединение в виде твердого вещества грязно-белого цвета (526,5 г, выход 85,5%,чистота 99,8% по данным ЖХВР). tпл 118,1-119,8 С. ЖХ/МС (ES+): (рН 2,5, КТ, 2,10 мин)/165,2 (М+Н)+. 1 Н-ЯМР (CDCl3):9,76 (1 Н, s), 8,83 (1 Н, d, J 5,7 Гц), 8,48 (1 Н, d, J 5,7 Гц), 7,67 (1H, d, J 5,7 Гц), 7,63(1H, d, J 5,7 Гц). Пример 8. Получение 1-хлор-2,7-нафтиридина из 2,7-нафтиридин-1-ола (с использованием другой методики хлорирования). В круглодонной колбе перемешивали смесь 2,7-нафтиридин-1-ола (пример 5, 1,0 г, 6,85 ммоль),хлорида тетрабутиламмония (2,21 г, 7,95 ммоль) и пентоксида фосфора (2,31 г, 0,016 моль) в 15 мл толуола, а затем смесь кипятили с обратным холодильником в течение 4,5 ч. Смесь охлаждали до 20-25 С и-9 014497 анализировали методом ЖХВР (система 2), при этом результаты анализа указывали, что реакция прошла приблизительно на 20%. Толуол отделяли от массы твердого вещества и остаток растворителя удаляли в вакууме, неочищенный продукт высушивали в вакууме при 35-40 С, при этом получали указанное в заголовке соединение в виде твердого вещества белого цвета (200 мг, 17,8%), которое использовали на следующей стадии без дополнительной очистки. tпл 118,1-119,8 С. ЖХ/МС (ES+): (рН 2,5, КТ,2,10 мин)/165,2 (М+Н)+. 1 Н-ЯМР (CDCl3):9,76 (1H, s), 8,83 (1H, d, J 5,7 Гц), 8,48 (1 Н, d, J 5,7 Гц), 7,67(1H, d, J 5,7 Гц), 7,63 (1H, d, J 5,7 Гц). Пример 9. Получение 1-бром-2,7-нафтиридина непосредственно из енамина. Метод А. Соединение, полученное как описано в примере 1 (100 г), растворяли в дихлорметане (1,5-2,0 л,15-20 об.) и охлаждали до -5 С . Затем в полученный раствор добавляли газообразный бромистый водород, при этом реакционную смесь нагревали до 20 С, а данные ЖХВР (система 2) указывали на завершение реакции приблизительно через 5 ч. Затем реакционную смесь выливали в насыщенный растворNaHCO3, слои разделяли и водный слой экстрагировали дихлорметаном. Объединенные органические слои сушили над MgSO4, а затем упаривали досуха. Неочищенный бромнафтиридин (97,7 г, 93%) очищали перекристаллизацией из метанола/воды, а затем высушивали в вакууме при 35-40 С, при этом получали указанное в заголовке соединение в виде твердого вещества светло-коричневого цвета (59,9 г,57%). ЖХ/МС (ES+): (рН 2,5, КТ, 2,22 мин)/211,1 (М+Н)+. 1 Н-ЯМР (CDCl3):9,70 (1 Н, s), 8,82 (1H, d, J 6,0 Гц), 8,46 (1 Н, d, J 5,7 Гц), 7,63 (2H, t, J 5,3 Гц). Метод В. Соединение, полученное как описано в примере 1 (1,0 г), суспендировали/растворяли в ледяной уксусной кислоте (3,88 мл), перемешивали при комнатной температуре, а затем добавляли 45% мас./об. раствор HBr в АсОН (3,62 мл, 4,0 экв.). Реакционную смесь нагревали при 40 С в течение 30 мин, после чего данные ЖХВР указывали на завершение потребления енамина. Указанное в заголовке соединение получали в виде раствора (выход 68%). Пример 10. Получение 1-хлор-2,7-нафтиридина непосредственно из енамина. Соединение, полученное как описано в примере 1 (1,0 г), суспендировали/растворяли в ледяной уксусной кислоте (3,65 мл), перемешивали при комнатной температуре, а затем добавляли раствор HCl в АсОН (5,3 М, 3,85 мл, 4,0 экв.). Реакционную смесь нагревали при 40 С в течение 1 ч 50 мин, после чего данные ЖХВР указывали на завершение потребления енамина. Указанное в заголовке соединение получали в виде раствора (выход 15%). Пример 11. 2,6-Дихлор-4-(2-пирролидин-1-илвинил)никотинонитрил. В колбу помещали диметилацеталь диметилформамида (7,18 г, 1,1 экв.) и пирролидин (6,39 г,1,7 экв.) и смесь нагревали при 95 С в течение 2 ч. Затем реакционную смесь концентрировали при температуре кипения 114 С и полученное масло хранили в атмосфере азота. В другую колбу помещали 2,6-дихлорникотинонитрил (10,05 г, 1,00 экв.) и пропан-2-ол (10 мл), в полученную смесь добавляли масло, полученное на первой стадии и еще 10 мл пропан-2-ола. При этом наблюдалось повышение температуры смеси до 45 С и образование осадка красного цвета. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, а затем твердое вещество отделяли фильтрованием. Остаток на фильтре суспендировали в пропан-2-оле (10 мл), промывали пропан-2-олом (10 мл) и высушивали в вакууме, при этом получали указанное в заголовке соединение (4,94 г, 34%). ЖХ/МС: (рН 5,8, КТ,4,17 мин/(268/270 [М+Н]+). Пример 12. 6,8-Дихлор-2,7-нафтиридин-1-ол. В колбу помещали концентрированную соляную кислоту (8 мл), а затем добавляли соединение, полученное как описано в примере 11 (1,00 г), и дополнительно добавляли 2 мл концентрированной соляной кислоты. Реакционную смесь нагревали при 60 С в течение 90 мин, а затем охлаждали до комнатной температуры. Твердое вещество отделяли фильтрованием, промывали водой (2 мл) и высушивали в вакууме, при этом получали указанное в заголовке соединение (0,25 г, 31%). ЖХ/МС: (рН 5,8, КТ, 2,34 мин)/(215/217 [М+Н]+). Пример 13. 2,7-Нафтиридин-1-ол. В колбу помещали соединение, полученное как описано в примере 12, (0,20 г, 1,00 экв.), 5% Pd/C(0,02 г, 10 мас.%), ацетат натрия (0,31 г, 4,1 экв.) и метанол (10 мл). Полученную смесь перемешивали при комнатной температуре при атмосферном давлении водорода в течение 22 ч 15 мин. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Остаток распределяли между ДХМ (10 мл) и водой (5 мл) и водный слой экстрагировали ДХМ (2x5 мл). Органические экстракты объединяли, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, при этом получали указанное в заголовке соединение (0,09 г, 64%). ЖХ/МС: (рН 5,8,КТ, 1,38 мин)/147 [М+Н]+. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (I)-S(O)x-, где х равно 0, 1 или 2, каждый R независимо означает водород или C1-С 6-алкил и R1 означает водород или С 1-С 6-алкил,(2) циклизацию енамина формулы (III), а затем при необходимости удаление всех атомов Cl или Br с образованием соединения формулы (IV)(3) реакцию соединения формулы (IV) с галогенирующим агентом с образованием соединения формулы (I). 2. Способ по п.1, где Су означает пирролидин-1-ил. 3. Способ по п.1 или 2, где на стадии (2) циклизацию проводят с использованием HBr, HCl или Н 3 РО 4. 4. Способ по любому из пп.1-3, где на стадии (3) галогенирующий агент означает оксихлорид фосфора, оксибромид фосфора или образуется при взаимодействии хлорида тетра-н-бутиламмония и пентоксида фосфора. 5. Способ по любому из пп.1-4, где на стадии (3) используют гидробромид или гидрохлорид соединения формулы (IV). 6. Способ по п.5, где на стадии (3) используют гидрат гидробромида или гидрохлорида соединения формулы (IV). 7. Способ по п.5 или 6, где соединение формулы (IV) означает гидрат гидрохлорида 2,7 нафтиридин-1-ола.-S(O)x-, где х равно 0, 1 или 2, каждый R независимо означает водород или C1-С 6-алкил, a R1 означает водород или C1-С 6-алкил. 9. Соединение, которое означает кристаллический гидрат гидробромида 2,7-нафтиридин-1-ола или кристаллический гидрат гидрохлорида 2,7-нафтиридин-1-ола. 10. Способ получения соединения формулы (I) по п.1, который включает взаимодействие соединения формулы (III) по п.1 с HBr или HCl.
МПК / Метки
МПК: C07D 213/24, C07D 417/04
Метки: способ, 1-галоген-2,7-нафтиридинилпроизводных, получения
Код ссылки
<a href="https://eas.patents.su/13-14497-sposob-polucheniya-1-galogen-27-naftiridinilproizvodnyh.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 1-галоген-2,7-нафтиридинилпроизводных</a>
Предыдущий патент: Применение пептидных соединений для лечения невоспалительной боли
Следующий патент: Производные бензамидов в качестве антагонистов брадикининовых рецепторов
Случайный патент: Пероральные препаративные формы кладрибина

















