Хранение и обнаружение нуклеиновой кислоты, нанесенной на твердый носитель
Формула / Реферат
1. Способ обнаружения и количественного анализа представляющей интерес нуклеиновой кислоты по меньшей мере в одном образце, включающий
нанесение указанного образца на твердый носитель, способный, по меньшей мере, частично абсорбировать указанный образец;
сушку указанного носителя;
обработку, по меньшей мере, репрезентативной части указанного носителя, содержащей по меньшей мере 100 мкл образца, раствором для выделения нуклеиновой кислоты для экстрагирования репрезентативного количества указанной нуклеиновой кислоты из указанного носителя;
количественный анализ указанного репрезентативного количества указанной нуклеиновой кислоты.
2. Способ по п.1, в котором анализируют по меньшей мере 250 мкл образца.
3. Способ по п.1 или 2, включающий идентификацию указанной нуклеиновой кислоты.
4. Способ по любому из пп.1-3, в котором указанный твердый носитель обеспечивает по меньшей мере два образца.
5. Способ по любому из пп.1-4, включающий нанесение на указанный твердый носитель известного количества контрольной нуклеиновой кислоты.
6. Способ по любому из пп.1-5, в котором указанная репрезентативная часть содержит, по существу, весь указанный по меньшей мере один образец.
7. Способ по любому из пп.1-6, в котором указанная репрезентативная часть содержит, по существу, весь указанный твердый носитель.
8. Способ по п.4 или 5, в котором указанная репрезентативная часть содержит один из указанных образцов.
9. Способ по любому из пп.1-8, в котором указанный раствор для выделения нуклеиновой кислоты содержит хаотропный буфер выделения нуклеиновой кислоты для лизиса.
10. Способ по любому из пп.1-9, в котором указанная нуклеиновая кислота содержит РНК.
11. Способ по п.10, в котором указанная РНК содержит митохондриальную РНК, вирусную РНК и/или информационную РНК.
12. Способ по любому из пп.1-11, в котором обнаруживается вирусная нуклеиновая кислота.
13. Способ по п.12, в котором указанная вирусная нуклеиновая кислота содержит ретровирусную нуклеиновую кислоту.
14. Способ по п.11 или 12, в котором указанная вирусная нуклеиновая кислота содержит ВИЧ и/или ТЛВЧ.
15. Способ по любому из пп.11-14, в котором указанная вирусная нуклеиновая кислота включает ВИЧ-1.
16. Способ по любому из пп.1-15, в котором указанный носитель содержит фильтровальную бумагу.
17. Способ по любому из пп.1-16, включающий генотипирование мутанта.
18. Способ по любому из пп.1-17, в котором указанный образец включает ценную жидкость тела.
19. Способ по любому из пп.1-18, в котором указанный образец содержит кровь, плазму, материнское молоко, мокроту, ликвор, слюну и/или мочу.
20. Способ по любому из пп.1-19, в котором указанный образец содержит каплю цельной крови, полученной путем укола пальца или пятки.
21. Способ по любому из пп.1-19, в котором указанный образец представляет собой образец плазмы.
22. Способ по любому из пп.1-21, в котором указанное обнаружение и/или количественное определение нуклеиновой кислоты содержит этап амплификации.
23. Способ по п.22, в котором указанная амплификация включает амплификацию с мониторингом в реальном времени.
24. Способ по любому из пп.1-23, в котором указанное обнаружение и/или количественное определение нуклеиновой кислоты выполняют с системой считывания конечной точки.
25. Способ по любому из пп.1-24, в котором определяют соотношение между различными нуклеиновыми кислотами.
Текст
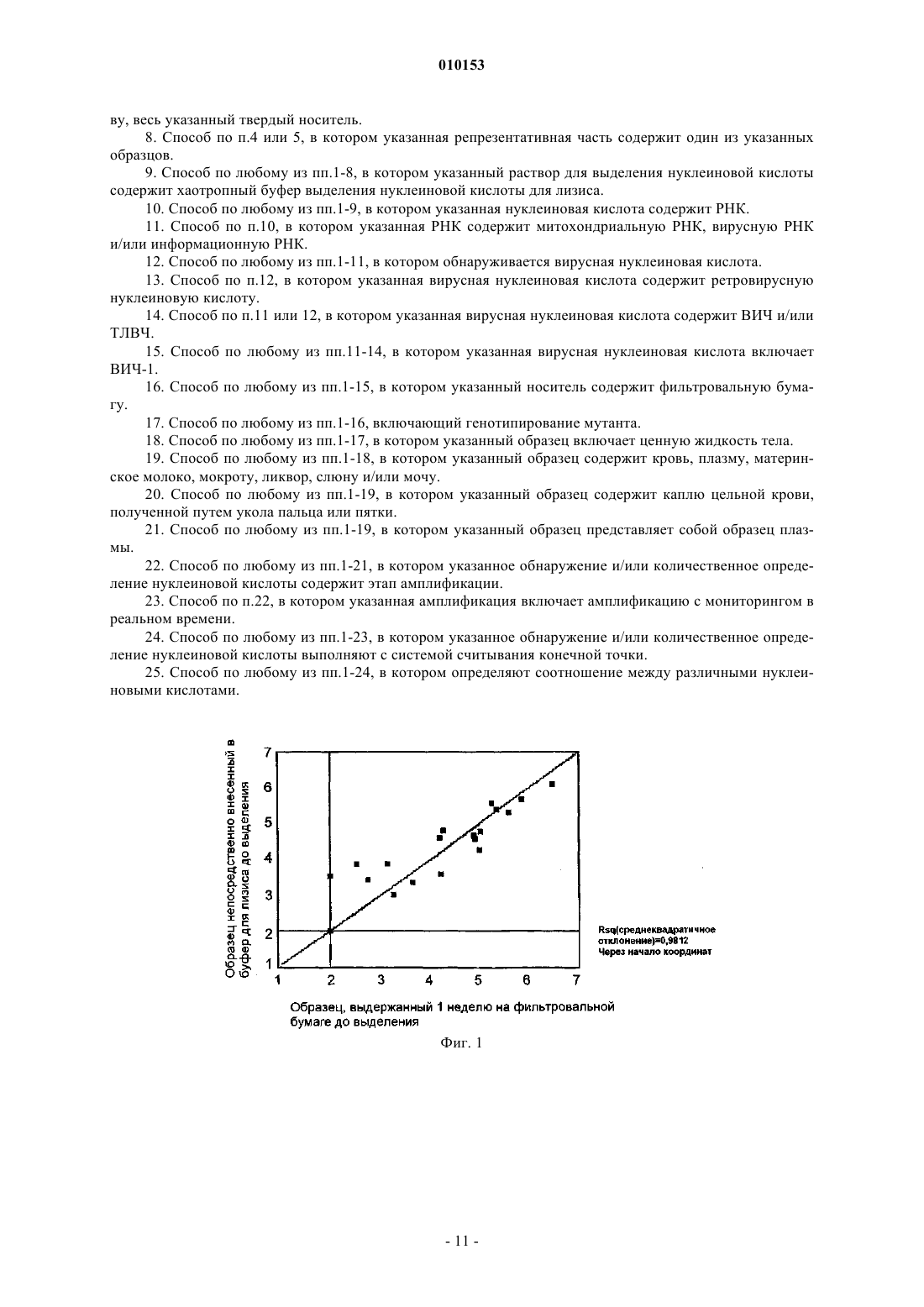
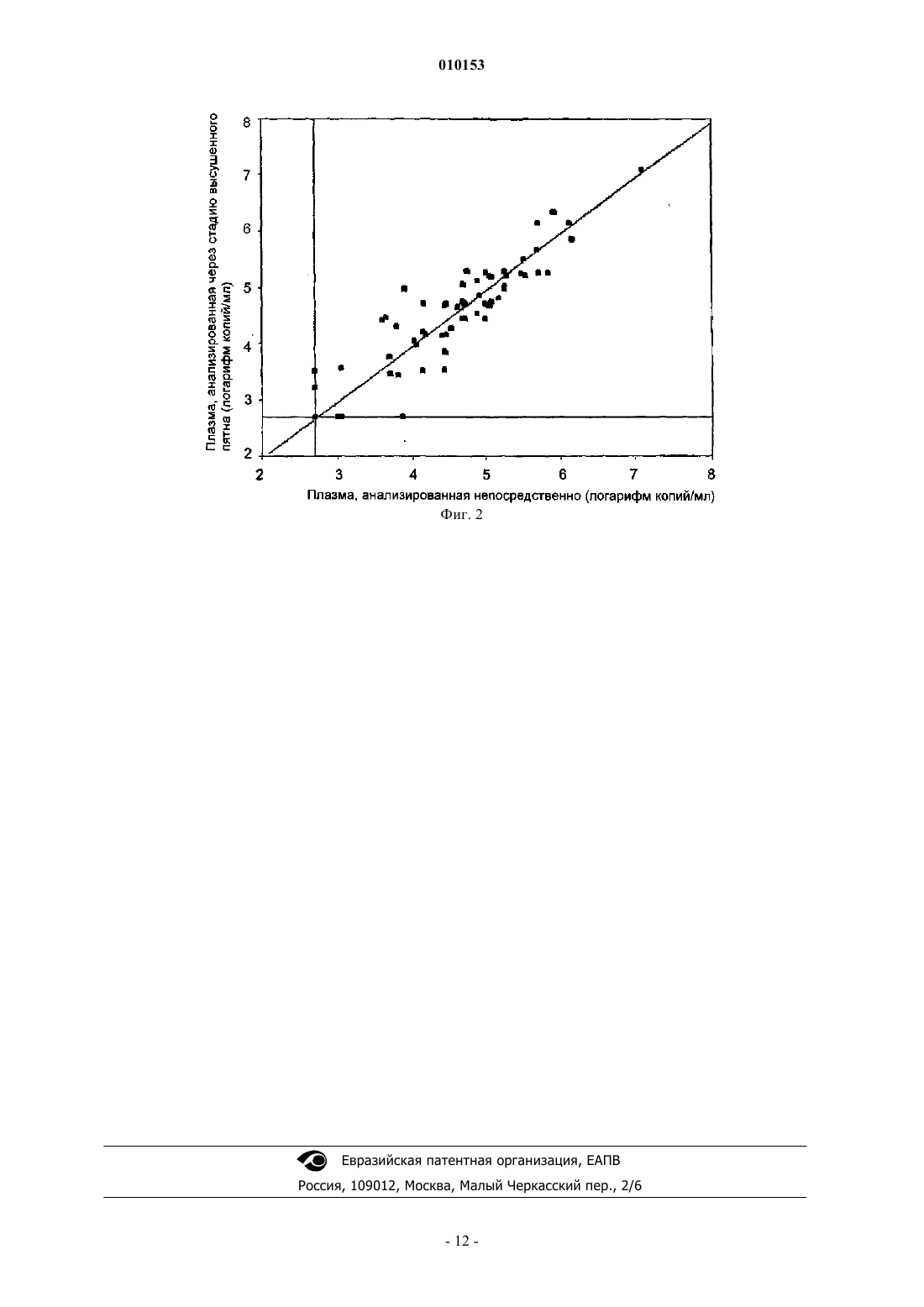
010153 Изобретение относится к области медицины. В частности, изобретение относится к диагностике. Изобретение, главным образом, относится к обнаружению и/или количественному анализу представляющей интерес нуклеиновой кислоты в образце. Инфекции с болезнетворными организмами обычно наблюдаются во всем мире. Такие инфекции,например, включают вирусные, бактериальные, грибковые и паразитические инфекции. Ранний диагноз инфекции часто предпочтителен для эффективного лечения, которое может предотвратить тяжелые патологические симптомы. Иногда ранний диагноз является необходимым условием для возможности лечения, для продления жизни и/или для улучшения качества жизни. Примеры таких инфекций включают вирус гепатита С, вирус гепатита В, туберкулез, малярию и ВИЧ, такую как ВИЧ-1. Эпидемия ВИЧ-1 быстро распространяется по миру и с распространением вируса циркуляция подтипов вируса ВИЧ-1 больше не ограничена одним географическим положением на земле. Такая ситуация требует применения диагностических тестов (нуклеиновой кислоты), которые могут обнаружить все подтипы вируса ВИЧ с равной достоверностью и точностью. Глобализация эпидемии и, в особенности, тяжесть ее протекания в странах с бедными ресурсами(Экваториальная Африка и Юго-Восточная Азия) вынуждает развитый мир принимать меры по борьбе с инфекцией с помощью программы обеспечения доступности фармацевтических препаратов. Однако для обеспечения эффективной помощи ВИЧ-1 инфицированным людям в развивающихся странах должна быть организована соответствующая диагностика на месте, например контроль эффективности лечения. К такой подходящей диагностике, главным образом, относится анализ концентрации вирусов, с помощью которого измеряют количество РНК ВИЧ-1 в жидкости тела, такой как кровь, плазма крови, материнское молоко, сперма, жидкость лимфы, мокрота, ликвор, слюна и/или моча инфицированных людей. Аналогично, соответствующие анализы концентрации нуклеиновой кислоты желательны для других связанных с инфекцией болезней. Современное состояние соответствующих анализов концентрации нуклеиновой кислоты имеет такой высокий технический стандарт, что их сложно перенести в регионы, расположенные на значительном расстоянии от технологических ресурсов, такие как Экваториальная Африка и/или Юго-Восточная Азия. Это требует значительных капиталовложений в инфраструктуру, что является невозможным с учетом обстановки в этих регионах. Альтернативное решение состоит в анализе образцов, взятых у пациентов, в лабораториях в развитых странах (например, в Европе и Северной Америке). Осуществить эту альтернативу, однако, невозможно вследствие проблем материально-технического обеспечения. Образцы жидкости тела, такой как кровь или плазма крови людей, должны быть отправлены в лабораторию в замороженном состоянии при температурах значительно ниже 0 С, обычно в коробке с сухим льдом. Этот способ пересылки клинического материала очень дорог и требует наличия сухого льда в месте отправки. Последний обычно трудно найти в развивающихся странах. Из-за затрат и отсутствия сухого льда отдаленное испытание образцов в лабораториях ("обслуживающего тестирования") не приемлемо для этих стран и для инфицированных людей в этих странах. Программы обеспечения доступности фармацевтических препаратов для развивающихся стран могут быть успешны, только если диагностика будет оптимизирована. Настоящее изобретение направлено на способ обнаружения представляющей интерес нуклеиновой кислоты по меньшей мере в одном образце, включающий нанесение указанного образца на твердый носитель, способный, по меньшей мере, частично абсорбировать указанный образец; сушку указанного носителя; обработку, по меньшей мере, репрезентативной (необходимой и достаточной для осуществления процесса) части указанного носителя раствором для выделения нуклеиновой кислоты для экстрагирования репрезентативного количества указанной нуклеиновой кислоты из указанного носителя; обнаружение указанного репрезентативного количества указанной нуклеиновой кислоты. С помощью способа в соответствии с настоящим изобретением образец, такой как образец жидкости тела, стабилизируют так, что его можно отправлять из места отбора (например, из местной больницы или лаборатории в развивающейся стране) и посылать в лабораторию обслуживающего тестирования,находящуюся в другом месте в мире, с использованием обычных средств материально-технического обеспечения, например обычной почтовой службы. Указанный способ делает возможной отправку высушенного образца по сухопутной почте в отдаленную лабораторию для обнаружения представляющей интерес нуклеиновой кислоты, присутствующей в образце. Способ в соответствии с настоящим изобретением может быть выполнен с использованием методик, известных в данной области техники. Например, определенное количество жидкого образца может наноситься на твердый носитель с использованием пипетки. Тип указанного твердого носителя не критичен и может содержать любой твердый носитель, известный в данной области техники, в случае если он обеспечивает, по меньшей мере, частичную абсорбцию указанного образца. Например, указанный твердый образец может содержать силикагель. Предпочтительно, однако, указанный твердый носитель содержит фильтровальную бумагу. Фильтровальная бумага хорошо абсорбирует жидкий образец, в то время как она обладает легким весом. Это очень важно для почтовых служб. Указанная фильтровальная бу-1 010153 мага может содержать ровную необработанную фильтровальную бумагу, такую как бумага 903, поставляемая компанией Schleicher and Schuell, или обработанную фильтровальную бумагу, которая иммобилизирует нуклеиновую кислоту для быстрой очистки. Два примера в настоящей области представляют собой бумагу IsoCode, поставляемую компанией Schleicher and Schuell, или FTA-обработанную бумагу компании Whatman, обе из которых бактерицидные, фунгицидные и вируцидные, замедляют рост бактерий и грибков и убивают вирусы, которые входят в контакт с матрицей, что обеспечивает безопасную обработку и стабильность образца. Другой пример подходящего носителя для хранения и транспортировки высушенных жидких образцов представляет собой устройство, разработанное автором Lifestock(патент США 5139742). Это устройство содержит небольшой нож с непосредственно присоединенной к нему капиллярной трубкой, оно делает возможным сбор, хранение и транспортировку крови, которая сохнет в капиллярной трубке, что, таким образом, сравнимо со способом с фильтровальной бумагой. Указанный носитель может быть высушен различными способами, известными в данной области техники. Предпочтительно указанный образец сушат на воздухе. Это недорого и эффективно. Под репрезентативной частью носителя подразумевается часть, которая отображает количество образца, нанесенного на указанный твердый носитель. Например, указанная репрезентативная часть может содержать весь указанный образец. Указанная репрезентативная часть может также содержать половину количества указанного образца. В этом случае другая половина может использоваться для проведения второго эксперимента. Указанный второй эксперимент может быть другим или подобным экспериментом. В последнем случае некоторый результат может быть получен in duplo, что более достоверно. Под репрезентативным количеством нуклеиновой кислоты подразумевается количество, которое отображает количество нуклеиновой кислоты, присутствующей в указанном образце. Указанное репрезентативное количество может содержать все количество указанной нуклеиновой кислоты, присутствующей в указанном образце. В качестве альтернативы указанное репрезентативное количество может содержать часть указанной нуклеиновой кислоты, присутствующей в указанном образце. Предпочтительно настоящее изобретение направлено на способ, в котором по меньшей мере 100 мкл образца наносят на указанный носитель. Более предпочтительно по меньшей мере 250 мкл образца наносят на указанный носитель. Наиболее предпочтительно по меньшей мере 500 мкл образца наносят на указанный носитель. При большом объеме образца все еще могут быть обнаружены малые титры представляющей интерес нуклеиновой кислоты. Главный недостаток существующих способов обнаружения заключается в том, что может быть обнаружена только нуклеиновая кислота с концентрацией выше некоторого порогового значения. Это означает, что инфицированные люди с низким содержанием в организме патогенной нуклеиновой кислоты не диагностируются как инфицируемые и, следовательно,не получают лечение на предпочтительном раннем этапе. До настоящего изобретения большие количества образцов жидкости тела, таких как кровь, или образцы плазмы не подходили для проведения тестов,поскольку наблюдались ингибиторные эффекты. Например, сообщалось, что гемоглобин и карбоангидраза, присутствующие в цельной крови, препятствуют протеканию полимеразной цепной реакции (4). Смеси ПЦР становились темно-коричневыми из-за элюции гема и продуктов его разложения из промокательных бумаг фильтра (5). С тем, чтобы улучшить амплификацию ПЦР, образцы перед реакцией ПЦР обрабатывали метанолом (6). Таким образом, включается дополнительный шаг с риском загрязнения и менее надежных результатов тестирования. Кроме того, как сообщается, хелатообразующие ионы металлов действуют как катализаторы для распада ДНК при высокой температуре с низкой ионной силой (7). Неожиданно обнаружилось, что с помощью способа в соответствии с настоящим изобретением можно хранить и впоследствии анализировать большие количества проб на высушенном твердом носителе. Ни один из вышеупомянутых ингибиторных эффектов не наблюдается, и обработка метанолом, как мера предосторожности, не является необходимой. Со способом изобретения теперь можно анализировать большие образцы на наличие представляющей интерес нуклеиновой кислоты. Следовательно, при этом в пробе могут быть обнаружены низкие концентрации представляющей интерес нуклеиновой кислоты. Способ в соответствии с изобретением подходит для обследования людей на наличие одного или более характерных болезнетворных организмов, таких как ВИЧ-1. В качестве альтернативы человек, страдающий от болезни или рискующий заболеть, может быть исследован с помощью способа в соответствии с настоящим изобретением. При обнаружении одной или более инородной нуклеиновой кислоты (нуклеиновых кислот) можно определить, какому виду микроорганизма она принадлежит. Это может, например, быть выполнено в соответствии с протоколами гибридизации, используя различные виды проб. В качестве альтернативы могут быть применены методики определения последовательности нуклеиновой кислоты и исследования этой последовательности на гомологию с любыми известными последовательностями. В одном варианте выполнения изобретения, таким образом,предложен способ в соответствии с настоящим изобретением, включающий идентификацию указанной представляющей интерес нуклеиновой кислоты. В еще одном варианте выполнения настоящее изобретение направлено на способ, в котором проводят количественный анализ указанной нуклеиновой кислоты. Неожиданно выяснилось, что с помощью способа в соответствии с настоящим изобретением можно не только обнаружить интересующую нуклеиновую кислоту, но и также определять количество указанной нуклеиновой кислоты, присутствующей в-2 010153 указанном образце. В способе изобретения в процессе хранения и/или во время процедуры обнаружения и/или выделения не теряется/разрывается существенного количества нуклеиновой кислоты. В примере показывается, что, если используется способ изобретения, измеренное количество представляющей интерес нуклеиновой кислоты из высушенного образца, хранившегося на твердом носителе, сопоставимо измеренному количеству указанной представляющей интерес нуклеиновой кислоты, когда указанный образец непосредственно подвергнут анализу. Высушенные образцы на твердом носителе теперь могут быть исследованы на количество присутствующей патогенной нуклеиновой кислоты. Следовательно, теперь может быть определено не только наличие, но также и стадия болезни. Теперь есть возможность диагностировать людей из регионов с недостатком оборудования, как, например, жителей стран с бедными ресурсами. Образец жидкости тела,такой как образец крови, может быть собран на твердый носитель, такой как фильтровальная бумага. Указанную фильтровальную бумагу можно послать в лабораторию, например в Западной Европе. Затем может быть определено количество представляющей интерес нуклеиновой кислоты и, следовательно,состояние болезни. Также путем установления, снижается ли количество указанной нуклеиновой кислоты через какое-то время, может быть определена эффективность лечения. В одном из аспектов настоящее изобретение направлено на способ в соответствии с настоящим изобретением, в котором на указанный твердый носитель наносят по меньшей мере два образца. Предпочтительно указанные образцы берут у одного человека. Более предпочтительно указанные образцы берут из одной и той же жидкости тела указанного человека. Указанные образцы могут, например, содержать две аликвоты крови. Каждый из указанных образцов крови может быть проверен независимо с применением способа в соответствии с настоящим изобретением. Таким образом, наличие и/или количество в крови представляющей интерес нуклеиновой кислоты указанного человека могут быть провереныin duplo. Это приводит к более точным результатам. Кроме того, каждый образец может быть проверен различными людьми/различными институтами. Ошибки, допущенные отдельно взятыми людьми и/или ошибки из-за ненадежного оборудования, могут быть выявлены с помощью независимого второго измерения. В альтернативном варианте выполнения указанные два образца используются для различных целей. Например, в одном образце может быть определено количество вирусной нуклеиновой кислоты, в то время как в другом образце может быть определено количество бактериальной нуклеиновой кислоты. Оба образца можно использовать для получения соотношения между вирусной нуклеиновой кислотой и хромосомной ДНК (что важно для ЦМВ), или для получения соотношения между митохондриальной и клеточной ДНК/РНК, или для определения соотношений, включающих иРНК или рибосомальные РНК. Однако многие из этих тестов также могут быть проведены с использованием только одного образца. В одном варианте выполнения указанный твердый носитель содержит группу по меньшей мере из двух образцов, взятых в различные моменты времени. Таким образом, развитие болезни может прослеживаться с течением времени. Этот вариант выполнения также особенно подходит для определения эффективности лечения. Например, образец можно наносить на указанный твердый носитель в начале лечения, а потом через равные интервалы времени. Таким образом, указанный твердый носитель не только выполняет назначение устройства для транспортировки, но также служит и для стабильного хранения при температуре окружающей среды без разложения представляющей интерес нуклеиновой кислоты. Такой твердый носитель можно послать в соответствующий институт по истечении некоторого времени. Тогда путем определения количества патогенной нуклеиновой кислоты в каждом образце с применением способа в соответствии с настоящим изобретением может быть установлено, эффективно ли лечение. Может быть установлено, уменьшается ли указанное количество с течением времени. Аналогично, образцы можно отбирать у больного человека через равные интервалы времени. Впоследствии может быть определено количество патогенной нуклеиновой кислоты в каждом образце. Это позволяет лучше изучать течение указанной болезни; например, увеличивается ли количество патогенной нуклеиновой кислоты с течением времени и т.д. При этом нет необходимости посылать в указанный институт каждый образец по отдельности. Множество образцов может быть собрано за определенное время и может быть послано одновременно. Это экономит время и деньги. Кроме того, поскольку указанные образцы посылают вместе, нет необходимости в хранении и сортировке отдельно посланных образцов. Риск потери образцов уменьшен. Чтобы еще более точно определять количество представляющей интерес нуклеиновой кислоты с применением способа в соответствии с настоящим изобретением, на указанный твердый носитель можно наносить известное количество контрольной нуклеиновой кислоты. Указанная контрольная нуклеиновая кислота может быть определена количественно, так же как интересующая нуклеиновая кислота. Точность количественного анализа представляющей интерес нуклеиновой кислоты может быть определена путем сравнения измеренного количества указанной контрольной нуклеиновой кислоты с нанесенным количеством указанной контрольной нуклеиновой кислоты. Если указанное измеренное количество не сильно отличается от нанесенного количества, то же самое, вероятно, будет верным для указанной представляющей интерес нуклеиновой кислоты. Следовательно, измеренное количество указанной представляющей интерес нуклеиновой кислоты может быть скорректировано для получения еще более точного-3 010153 результата. Кроме того, с помощью контрольной нуклеиновой кислоты может быть определена репрезентативная часть, включающая часть образца. Если репрезентативная часть, включающая часть указанного образца, нанесена на указанный буфер выделения нуклеиновой кислоты и измеренное количество контрольной нуклеиновой кислоты окажется равным одной трети нанесенного количества, это означает, что взвешенное количество представляющей интерес нуклеиновой кислоты также приблизительно равно одной трети количества, присутствующего в указанном образце. Следовательно, контрольная нуклеиновая кислота показывает, на какой коэффициент измеренное количество нуклеиновой кислоты в соответствии с изобретением должно быть умножено, если часть указанного образца внесена в указанный буфер выделения нуклеиновой кислоты. Предпочтительно использовать контрольную нуклеиновую кислоту,которая распределяется по указанному твердому носителю, по существу, таким же образом, как и указанная интересующая нуклеиновая кислота. В этом случае нет никакого существенного различия в том,какая часть указанного твердого носителя используется в способе изобретения. Другой способ точного количественного анализа представляющей интерес нуклеиновой кислоты состоит в соотнесении ее с количеством других нуклеиновых кислот. С помощью такого способа обеспечивается возможность в той же реакции или в отдельных реакциях, в том же образце или в одном из других образцов установить соотношение между любой ДНК и ДНК, любой РНК и ДНК или, напротив, любой РНК и искомой РНК. Настоящее изобретение может содержать варианты применения для определения соотношения между нуклеиновыми кислотами хозяина, например соотношение количества митохондриальной ДНК и ядерной ДНК как мера реакции на некоторые виды терапии ВИЧ, или между нуклеиновыми кислотами патогена и хозяина, например между количеством ДНК ЦМВ и ядерной ДНК хозяина. Другие варианты применения могут содержать количество иРНК на клетку в области анализа спектра экспрессии генов. Изобретение также направлено на способ в соответствии с настоящим изобретением, в котором указанная репрезентативная часть включает, по существу, весь указанный по меньшей мере один образец. Авторами настоящего изобретения показано, что надежное обнаружение и/или количественный анализ представляющей интерес нуклеиновой кислоты с применением способа в соответствии с настоящим изобретением возможно даже с большим образцом. Если используется весь большой образец, могут быть обнаружены и определены количественно даже низкие концентрации нуклеиновой кислоты. Репрезентативная часть указанного носителя может быть получена путем вырезания видимого пятна из твердого носителя, такого как фильтровальная бумага. Это вырезание может быть сделано с использованием обычных ножниц, но также может быть полностью автоматизировано, например, с использованием оборудования компании Wallack для выбивания участков равной площади из твердого носителя. В качестве другого способа упрощения этого варианта выбивания вручную можно использовать частичное выбивание указанного твердого носителя, после которого наносят и сушат образец. При поступлении в лабораторию для анализа эта частично выбитая часть может быть легко выбита полностью,в том числе и с помощью специально разработанных устройств, как пробирка Save-lock компанииEppendorf. Также можно использовать репрезентативную часть указанного пятна. Однако предпочтительно использовать целый носитель, поскольку в этом случае можно быть уверенным в том, что измерен целый образец. Согласно настоящему изобретению твердый носитель, такой как фильтровальная бумага, не существенно влияет на обнаружение и/или количественный анализ представляющей интерес нуклеиновой кислоты. Поэтому предпочтителен способ изобретения, в котором указанная репрезентативная часть включает, по существу, весь указанный твердый носитель. Если в способе изобретения указанный твердый носитель представлен по меньшей мере двумя образцами, указанная репрезентативная часть предпочтительно содержит один из указанных образцов. Указанную репрезентативную часть можно использовать для обнаружения и/или количественного анализа представляющей интерес нуклеиновой кислоты. Как было описано выше, репрезентативную часть,включающую указанный второй образец, можно использовать для измерения in duplo. В качестве альтернативы может быть проведено другое измерение. В одном аспекте настоящее изобретение направлено на способ, в котором указанный раствор для выделения нуклеиновой кислоты включает хаотропный буфер выделения нуклеиновой кислоты для лизиса. Более предпочтительно использовать буфер выделения нуклеиновой кислоты, описанный у Boom и др. Указанный твердый носитель предпочтительно содержит фильтровальную бумагу, так как фильтровальная бумага дешева, хорошо абсорбирует жидкий образец и обладает малым весом, что облегчает транспортировку. Как правило, элюция указанной нуклеиновой кислоты занимает по меньшей мере 30 мин при комнатной температуре или еще меньше при повышенных температурах, тогда как нуклеиновая кислота из жидкости тела, которая внесена непосредственно в буфер для лизиса, обычно освобождается в течение 10 мин. Повышенная температура способствует эффективной и быстрой элюции нуклеиновой кислоты из твердого носителя. Способ изобретения особенно подходит для обнаружения вирусной нуклеиновой кислоты, особенно ретровирусной нуклеиновой кислоты. Вирусная нуклеиновая кислота может присутствовать в латентной фазе, которая может длиться в течение значительного времени. Кроме того, вирус, такой как ВИЧ,ТЛВЧ и ВГЧ, часто присутствует в течение значительного времени в теле человека прежде, чем указан-4 010153 ный человек испытывает какие-либо существенные симптомы. В течение этого времени указанный вирус зачастую уже может передаваться другим людям. Кроме того, лечение на ранней стадии может увеличить шанс на излечение, продлить продолжительность жизни и/или улучшить качество жизни. Поэтому особенно важно проверить человека на наличие вирусной нуклеиновой кислоты с применением способа в соответствии с настоящим изобретением. Вирусные нуклеиновые кислоты, которые следует обнаружить, могут быть представлены последовательностями от гепатита A, B, C, парвовируса и т.д. Предпочтительно указанная вирусная нуклеиновая кислота содержит ВИЧ и/или ТЛВЧ. Более предпочтительно указанная вирусная нуклеиновая кислота содержит ВИЧ-1. В одном варианте выполнения настоящее изобретение направлено на способ, в котором указанный способ содержит генотипирование мутанта. Это особенно применимо в отношении организмов с быстро меняющимся геномом, таких как (ретро)вирусы. Генотипирование, например, применимо для определения соответствия определенного лечения для индивидуального пациента. Кроме того, если обнаружен новый мутант, существующий фармацевтический препарат может быть адаптирован или разработан новый медикамент. Способ изобретения особенно подходит для обнаружения представляющей интерес нуклеиновой кислоты в жидкости тела, такой как кровь, плазма, материнское молоко, сперма, жидкость лимфы, сыворотка, мокрота, ликвор, слюна и/или моча. Образец такой жидкости организма легко получить. Получение такого образца не доставляет большого неудобства человеку, как, например, в случае применения биопсии. Кроме того, получение образца жидкости тела не требует специального оборудования, которое часто отсутствует в развивающихся странах и в отдаленных областях. Предпочтительно настоящее изобретение направлено на способ, в котором указанный образец содержит каплю цельной крови, полученной путем укола пальца или пятки. Такой укол пальца или пятки обычно делают новорожденным, таким образом, указанный материал обычно доступен без излишнего беспокойства людей. В другом предпочтительном варианте выполнения указанный образец представляет собой образец плазмы. Образец плазмы позволяет более точно измерить количество свободных вирусных частиц, тогда как, например, образец крови также включает вирусную нуклеиновую кислоту, включенную в клетки. Измерение свободных вирусных частиц, по существу, без вирусной нуклеиновой кислоты, включенной в клетки, является особенно показательным для таких характеристик, как вирулентность вируса, распространение вируса и т.д. Следовательно, образец плазмы особенно предпочтителен,если должны быть определены такие характеристики. Чтобы удостовериться в том, что собрано, по меньшей мере, минимально необходимое количество жидкостей тела, заранее определенная поверхность может быть напечатана или нанесена на твердый носитель любым другим способом. Это означает, что поверхность будет полностью заполнена требуемой жидкостью тела. Поскольку равный объем цельной крови покрывает меньшую поверхность, чем аналогичное количество жидкости тела, например сыворотки или материнского молока, может оказаться необходимым напечатать несколько поверхностей для различных жидкостей тела на одном твердом носителе, или предусмотреть носители, предназначенные специально для некоторых определенных жидкостей тела. Таким образом, обеспечивается сбор минимального требуемого количества жидкости тела. Для обнаружения представляющей интерес нуклеиновой кислоты часто необходим этап амплификации (такой как ПЦР или NASBA). Амплифицированная нуклеиновая кислота может впоследствии быть обнаружена с использованием способов, известных в данной области техники. В связи с этим способ изобретения предпочтительно содержит этап амплификации. Предпочтительно указанная амплификация содержит амплификацию с мониторингом в реальном времени. Произведенная нуклеиновая кислота делается видимой непосредственно в ходе такой реакции амплификации. Это может, например,быть достигнуто с помощью зондов molecular beacon или других типов зондов. При гибридизации этих зондов на матрице может быть получен флуоресцентный сигнал, который можно наблюдать в течение реакции амплификации. Интенсивность флуоресценции отражает количество произведенной нуклеиновой кислоты. С использованием известных количеств нуклеиновой кислоты может быть построена калибровочная кривая. При этом можно сравнивать флуоресцентный сигнал от образца с неизвестным количеством нуклеиновой кислоты с указанной калибровочной кривой. Таким образом, может быть определено количество указанной нуклеиновой кислоты в указанном образце, поскольку интенсивность флуоресценции и количество нуклеиновой кислоты скоррелированы. В другом варианте выполнения указанное обнаружение нуклеиновой кислоты и/или количественный анализ представлены в системе считывания конечной точки. Такие системы, например, содержат колориметрическое обнаружение, ферментативный анализ, и/или индикаторную полоску. Изобретение также направлено на использование высушенного твердого носителя с образцом для обнаружения, идентификации и/или определения количества представляющей интерес нуклеиновой кислоты в указанном образце. Как было описано выше, указанный высушенный твердый носитель можно легко хранить и транспортировать, после чего могут быть проведены достоверное обнаружение нуклеиновой кислоты и количественный анализ. Предпочтительно указанный твердый носитель содержит, по меньшей мере, эквивалент 100 мкл крови или ее производного в высушенной форме. Более предпочтительно указанный носитель содержит по меньшей мере 250 мкл, наиболее предпочтительно по меньшей-5 010153 мере 500 мкл крови или ее производного в высушенной форме. С использованием изобретения может быть исследован большой объем образца, что позволяет обнаружить и/или провести количественный анализ нуклеиновой кислоты с низкой концентрацией. Под производным крови понимается по меньшей мере часть компонента крови, такого как сыворотка и/или плазма. Кровь, которая была изменена искусственно, также вписывается в понятие производного крови. Учитывая способ, которым был разработан твердый носитель, он мог бы вполне непосредственно содержать носитель, который может абсорбировать жидкость тела, прикрепленный к куску бумаги или поверхности, на которой может быть написана или напечатана информация, например информация о пациенте, дата взятия образца или несколько дат взятия образца, режим терапии, штриховые коды, идентификационные номера и т.д. Такая поверхность,определенная для данного типа информации, однозначно прикреплена к носителю с образцом, таким образом гарантируя, что информация не будет потеряна. Обычно этот тип поверхностей может содержать намного больше информации, чем на пробирке. Рассуждая логически, возможна любая вариация на эту тему. Изобретение также содержит набор компонентов для обнаружения, идентификации и/или определения количества представляющей интерес нуклеиновой кислоты в образце, содержащий твердый носитель, способный, по меньшей мере, частично абсорбировать указанный образец; раствор для выделения нуклеиновой кислоты. Предпочтительно указанный набор также содержит средство для амплификации нуклеиновой кислоты. Указанное средство, например, содержит средство для амплификации с мониторингом в реальном времени и/или средство для амплификации с обнаружением/количественным анализом в конечной точке. Набор компонентов изобретения, например, применим в странах с бедными ресурсами, в которых невелико число больниц. Такие больницы могут распространять указанные твердые носители, такие как фильтровальные бумаги, среди жителей в отдаленных областях. После сбора образцов их можно хранить и транспортировать в такие больницы. Если указанная больница должным образом оборудована, указанные образцы можно исследовать с использованием указанного раствора для выделения нуклеиновой кислоты. Конечно, больницы в развитых странах тоже могут использовать набор компонентов изобретения для сбора и тестирования образца. Набор компонентов для обнаружения, идентификации и/или количественного анализа также вполне может содержать совокупность материалов, необходимых для безопасного получения жидкости тела от пациента. Разумеется, при получении внешних жидкостей, таких как моча, материнское молоко или слюна, должны приниматься иные меры предосторожности, чем, когда в качестве образцов берут внутренние жидкости тела, такие как кровь, плазма, сыворотка или дренаж лимфы. Для внутренних жидкостей тела можно составить набор, который включает твердый носитель,способный, по меньшей мере, частично абсорбировать указанный образец, и раствор для выделения нуклеиновой кислоты, вместе с парой исследовательских перчаток, тампон с этиловым спиртом, чтобы чистить кожу, приспособление для укола пальца или пятки, бинт, конверт, например, с адресом лаборатории получателя, а также с полем для идентификационного номера или кода пациента, покрытый внутри для безопасной транспортировки по почте, и поглотителя влаги для хранения образца в сухом виде и предотвращения роста грибков или бактерий. Другие возможные варианты приспособления для сбора могут содержать специально разработанные приспособления для одноразового использования подобно описанному в патенте US 5139742: Disposable liquid testing device by Livestock Control Holding B.V. inAmersfoort, the Netherlands. Возможна любая комбинация этих предметов или можно заменить их предметами/устройствами другого типа, которые используются для хранения и/или транспортировки любых жидкостей тела, содержащих нуклеиновые кислоты. В соответствии с настоящим изобретением также предоставлен твердый носитель, содержащий, по меньшей мере, эквивалент 500 мкл крови или ее производного в высушенной форме. Предпочтительно указанный твердый носитель содержит по меньшей мере два образца. Если указанные образцы одного вида, то указанные образцы могут быть протестированы по отдельности для проведения теста in duplo. Кроме того, результат первого теста может быть проконтролирован путем независимого тестирования другого образца. В качестве альтернативы указанные образцы используют для различных целей. В соответствии с настоящим изобретением также представлен твердый носитель, содержащий ряд образцов, полученных в разные даты. Как было описано выше, такой твердый носитель подходит для отслеживания развития болезни с течением времени и/или для проверки эффективности некоторого лечения. Предпочтительно твердый носитель изобретения включает известное количество контрольной нуклеиновой кислоты. Изобретение далее объясняется на следующем примере. Пример предназначен только для пояснения изобретения. Он ни в коей мере не ограничивает объема изобретения. Альтернативные варианты выполнения также находятся в пределах объема настоящего изобретения. Примеры Пример 1. Кровь и плазму крови нанесли каплями по 50 мкл на бумагу SS 903 (Schleicher and Schull) и высушили на воздухе. Одновременно 200 мкл тех же самых образцов крови и плазмы непосредственно добавили к буферу для лизиса, как описано у Boom и др. (1990). После высыхания пятна на фильтроваль-6 010153 ной бумаге хранили при температуре окружающей среды до 3 недель и, вероятно, их можно хранить при температуре окружающей среды в течение нескольких месяцев. Пятна на фильтровальной бумаге вырезали обычными ножницами и вносили в пробирку, содержащую буфер для лизиса, как описано у Boom и др. (1990). Пятна на фильтре по 50 мкл крови или плазмы внесли в три различные пробирки: 1) пробирка на 50 мл, содержащая 9 мл буфера для лизиса; 2) пробирка на 15 мл, содержащая 15 мл буфера для лизиса, или 3) пробирка eppendorf на 1,5 мл, содержащая 1 мл буфера для лизиса. Пробирки мягко взбалтывали на колеблющейся платформе в течение 3 ч при температуре окружающей среды. В течение этой инкубации пятно крови или плазмы растворялось из фильтровальной бумаги в буфере для лизиса. Впоследствии фильтры удалили из пробирок с помощью чистого пинцета. Между пробирками пинцет последовательно очистили с помощью горячей воды - хлора - горячей воды 70% этилового спирта. В пробирки с буфером для лизиса добавили образцы 1106 копий молекулы РНК-контроля системы,чтобы позволить идентифицировать ложные отрицательные реакции на более поздней стадии. РНКконтроль системы амплифицировали с использованием тех же праймеров, что и дикий тип ВИЧ-1 и обнаружили с использованием различимого зонда в реакции. Из-за различия в длине РНК - контроль системы можно амплифицировать и обнаружить только в отсутствии (или при очень малых количествах) РНК дикого типа ВИЧ-1. Присутствующую в буфере для лизиса нуклеиновую кислоту далее очистили способом, описанным у Boom и др. (1990), или с помощью специализированных наборов для выделения, приобретенных вTeknika, Boseind 15, 5281 RM Boxtel, The Netherlands) и используемых согласно протоколам изготовителя. Выделенную нуклеиновую кислоту хранили при -80 С до дальнейшего анализа. Обычно для определения количества РНК ВИЧ-1 использовали 5 мкл как исходное количество в реакциях амплификацииNASBA, как описано у De Baar и др. (1, 2). Стандартные реакции амплификации NASBA нуклеиновой кислоты проводили в 20 мкл реакционном объеме, который содержал: 40 мМ Tris-pH 8,5,70 мМ KCl,12 мМ MgCl2,5 мМ дитиотреитола,1 мМ дНТФ (каждого),2 мМ рНТФ (каждого), 0,2 мкМ праймера (каждого), (P1: AAT TCT AAT ACG ACT CAC TAT AGGGAG AGG GGC GCC ACT GCT AGA GA и Р 2: CTC AAT AAA GCT TGC CTT GA),0,05 мкМ molecular beacon для последовательности дикого типа ВИЧ-1 (МВ 045: FAM-CGA CGTCCA GAC AAA AAA CGA GTC GG-dabcyl),0,05 мкМ molecular beacon для последовательности дикого типа ВИЧ-1,0,05 мкМ molecular beacon для РНК-контроля системы,375 мМ сорбита,0,105 мкг/мкл бычьего сывороточного альбумина,6,4 единиц AMV обратной транскриптазы,32 единицы Т 7 РНК полимеразы,0,08 единиц РНКазы Н и входную нуклеиновую кислоту. Полную смесь, кроме ферментов, до добавления ферментов разогрели до 65 С, чтобы денатурировать всю вторичную структуру в РНК и обеспечить гибридизацию праймеров. После охлаждения смеси до 41 С добавили ферменты. Амплификация происходила при 41 С в течение 90 мин в термостатированном флуориметре (CytoFluor 2000 или EasyQ Reader) и флуоресцентный сигнал зонда molecular beacon измеряли каждую минуту. Для выполнения количественного анализа ряд разбавления искомой последовательности для специфического набора праймеров амплифицировали и моменты времени, в которых реакции стали положительными (время достижения положительного результата (ТТР, отмечали на графике от значений входных количеств нуклеиновой кислоты. Таким образом, построили калибровочную кривую, которая могла быть использована для считывания значений ТТР реакций с неизвестными входными количествами и для выведения этого входного количества. Результаты определений в примере 1 приведены в таблице. В результатах для РНК-контроля системы ложные отрицательные результаты отсутствуют, и все отрицательные данные, представленные в таблице, являются истинными отрицательными данными, следующими из отсутствия или наличия последовательности ВИЧ-1 в концентрациях ниже предела обнаружения тестов. А. Результаты определяли количественно, как описано в тексте с измерениями ТТР. Результаты даются в виде логарифма числа. Отриц. указывает на отрицательный результат.LQL указывает на положительный результат, но слишком низкий для точного количественного анализа. В. Определениие для 200 мкл крови непосредственно в буфере для лизиса, 50 мкл нанесенной плазмы и 50 мкл нанесенной крови не выполняли количественно, только качественно как для положительного Данные в таблице ясно указывают на хорошую корреляцию между результатами, полученными при непосредственном внесении образца в буфер для лизиса, и результатами, полученными при первичном нанесении образца на бумагу, с сушкой и с последующим внесением в буфер для лизиса. Пример 2. Материнское молоко одной женщины, насыщенное вирусом из 6 различных штаммов в 4 концентрациях, нанесли 4 раза каплями по 50 мкл на бумагу SS 903 (Schleicher and Schull), высушили на воздухе и хранили в течение, как минимум, одной недели при температуре окружающей среды. После высыхания пятна на фильтровальной бумаге хранили при температуре окружающей среды до 3 недель и,вероятно, их можно хранить при температуре окружающей среды в течение нескольких месяцев. Одновременно 200 мкл тех же самых образцов материнского молока непосредственно добавили к буферу для лизиса, как описано у Boom и др. (1990). Пятна на фильтровальной бумаге вырезали обычными ножницами и вносили в пробирку, содержащую 4 мл буфера для лизиса, как описано у Boom и др. (1990). Пробирки мягко взбалтывали на колеблющейся платформе в течение ночи при температуре окружающей среды. В течение этой инкубации высушенное пятно растворялось из фильтровальной бумаги в буфере для лизиса. Впоследствии фильтры удалили из пробирок с помощью чистого пинцета. Между пробирками пинцет последовательно очистили с помощью горячей воды - хлора - горячей воды - 70% этилового спирта. В пробирки с буфером для лизиса добавили образцы 1000000 копий молекулы РНК-контроля системы, чтобы позволить идентифицировать ложные отрицательные реакции на более поздней стадии. РНК-контроль системы амплифицировали с использованием тех же праймеров, что и дикий тип ВИЧ-1 и обнаружили с использованием различимого зонда в реакции. Из-за различия в длине РНК контроль системы можно амплифицировать и обнаружить только в отсутствии (или при очень малых количествах) РНК дикого типа ВИЧ-1. Присутствующую в буфере для лизиса нуклеиновую кислоту далее очистили способом, описанным у Boom и др. (1990), или с помощью специализированных наборов для выделения,приобретенных в Qiagen (Qiagen GmbH, Max Volmer Strasse 4, 40724 Hilden, Germany) или Biomerieux(прежде Organon Teknika, Boseind 15, 5281 RM Boxtel, The Netherlands) и используемых согласно протоколам изготовителя. Выделенную нуклеиновую кислоту хранили при -80 С до дальнейшего анализа. Обычно для определения количества РНК ВИЧ-1 использовали 5 мкл как исходное количество в реакциях амплификации NASBA, как описано у De Baar и др. (1, 2). Стандартные реакции амплификации NASBA нуклеиновой кислоты проводили в 20 мкл реакционного объема, который содержал: 40 мМ Tris-pH 8,5,70 мМ KCl,12 мМ MgCl2,5 мМ дитиотреитола,-8 010153 1 мМ дНТФ (каждого),2 мМ рНТФ (каждого),0,2 мкМ праймера (каждого), (P1: AAT TCT AAT ACG ACT CAC TAT AGG GAG AGG GGC GCCACT GCT AGA GA и Р 2: CTC AAT AAA GCT TGC CTT GA),0,05 мкМ molecular beacon для последовательности дикого типа ВИЧ-1 (MB045: FAM-CGA CGTCCA GAC AAA AAA CGA GTC GG-dabcyl),375 мМ сорбита,0,105 мкг/мкл бычьего сывороточного альбумина,6,4 единиц AMV обратной транскриптазы,32 единицы Т 7 РНК полимеразы,0,08 единиц РНКазы Н и входную нуклеиновую кислоту. Полную смесь, кроме ферментов, до добавления ферментов разогрели до 65 С, чтобы денатурировать всю вторичную структуру в РНК и обеспечить гибридизацию праймеров. После охлаждения смеси до 41 С добавили ферменты. Амплификация происходила при 41 С в течение 60 мин в термостатированном флуориметре (CytoFluor 2000 или EasyQ Reader) и флуоресцентный сигнал зонда molecular beacon измеряли каждую минуту. Для выполнения количественного анализа ряд разбавления искомой последовательности для специфического набора праймеров амплифицировали и моменты времени, в которых реакции стали положительными (время достижения положительного результата (ТТР, отмечали, напротив, значения входных количеств нуклеиновой кислоты. Таким образом, построили калибровочную кривую, которая могла быть использована для считывания значений ТТР реакций с неизвестными входными количествами и для выведения этого входного количества. Результаты определения идентичных образцов, нанесенных и внесенных непосредственно в буфер для лизиса сравнили, и этот анализ приведен на фиг. 1. Согласно результатам для РНК-контроля системы ложных отрицательных результатов не было, и все отрицательные данные, представленные на фиг. 1,являются истинными отрицательными данными, следующие из отсутствия последовательности ВИЧ-1 или наличия ее в концентрациях ниже предела чувствительности тестов. Пример 3. Плазму 88 человек инфицированных ВИЧ-1 нанесли каплями по 200 мкл на бумагу SS 903(Schleicher and Schull), высушили на воздухе и хранили в течение, как минимум, 24 ч при температуре окружающей среды. Одновременно 200 мкл тех же самых образцов плазмы непосредственно добавили к буферу для лизиса, как описано у Boom и др. (1990). Пятна на фильтровальной бумаге выбили и поместили в пробирку, содержащую 4 мл буфера для лизиса, как описано у Boom и др. (1990). Пробирки мягко взбалтывали на колеблющейся платформе в течение 3 ч при температуре окружающей среды. В течение этой инкубации высушенное пятно растворяется из фильтровальной бумаги в буфере для лизиса. Впоследствии фильтры удалили из пробирок с помощью чистого пинцета. Между пробирками пинцет последовательно очистили с помощью горячей воды-хлора-горячей воды-70% этилового спирта. Присутствующую в буфере для лизиса нуклеиновую кислоту далее очистили способом, описанным у Boom и др. (1990), или с помощью специализированных наборов для выделения, приобретенных вTeknika, Boseind 15, 5281 RM Boxtel, The Netherlands) и используемых согласно протоколам изготовителя. Выделенную нуклеиновую кислоту хранили при -80 С до дальнейшего анализа. Обычно для определения количества РНК ВИЧ-1 использовали 5 мкл как исходное количество в реакциях амплификацииNASBA, как описано у De Baar и др. (2, 3). Стандартные реакции амплификации NASBA нуклеиновой кислоты проводили в 20 мкл реакционном объеме, который содержал: 40 мМ Tris-pH 8,5, 70 мМ KCl, 12 мМ MgCl2, 5 мМ дитиотреитола, 1 мМ дНТФ (каждого), 2 мМ рНТФ (каждого), 0,2 мкМ праймер (каждого), 0,05 мкМ molecular beacon для последовательности дикого типа ВИЧ-1, 0,05 мкМ molecular beacon для РНК-контроля системы, 375 мМ сорбита, 0,105 мкг/мкл бычьего сывороточного альбумина, 6,4 единиц AMV обратной транскриптазы,32 единицы Т 7 РНК полимеразы, 0,08 единиц РНКазы Н и входную нуклеиновую кислоту. Полную смесь, кроме ферментов, до добавления ферментов разогрели до 65 С, чтобы денатурировать всю вторичную структуру в РНК и обеспечить гибридизацию праймеров. После охлаждения смеси до 41 С добавили ферменты. Амплификация происходила при 41 С в течение 90 мин в термостатированном флуориметре (CytoFluor 2000 или EasyQ Reader) и флуоресцентный сигнал зонда molecular beacon измеряли каждую минуту. Для выполнения количественного анализа ряд разбавления искомой последовательности для специфического набора праймеров амплифицировали и моменты времени, в которых реакции стали положительными (время достижения положительного результата (ТТР отмечали напротив значений входных количеств нуклеиновой кислоты. Таким образом, построили калибровочную кривую, которая могла-9 010153 быть использована для считывания значений ТТР реакций с неизвестными входными количествами и для выведения этого входного количества. Результаты определения идентичных образцов, нанесенных и внесенных непосредственно в буфер для лизиса, сравнивали, и этот анализ приведен на фиг. 2. Данные на фиг. 2 ясно указывают на хорошую корреляцию между результатами, полученными при непосредственном внесении образца в буфер для лизиса, и результатами, полученными при нанесении образца на бумагу, с сушкой и с последующим внесением в буфер для лизиса. После проведения корреляционного анализа Пирсона были найдены коэффициенты корреляции (r) равные 0,919 непосредственно для плазмы и 0,959 для высушенной плазмы. Краткое описание чертежей Фиг. 1 представляет собой график, иллюстрирующий сравнение количественных данных для ВИЧ-1, полученных на образцах материнского молока, которые были проанализированы непосредственно или были сначала нанесены и высушены на фильтровальной бумаге. Отсечение оценки при значенииlog2, обозначено на графике сплошными линиями. Числа на оси обозначают логарифм числа копий молекулы РНК ВИЧ-1 определенных в тесте. Данные на фиг. 1 ясно указывают очень хорошую корреляцию между результатами, полученными при прямом внесении образца в буфер для лизиса, по сравнению с результатами, полученными при нанесении образца на бумагу, с сушкой и с последующим внесением в буфер для лизиса. Фиг. 2 представляет собой график, иллюстрирующий сравнение количественных данных для ВИЧ-1, полученных на образцах плазмы, которые были проанализированы непосредственно или были сначала нанесены и высушены на фильтровальной бумаге. Нижний предел оценки при значении log2,обозначен на графике сплошными линиями. Числа на оси обозначают логарифм числа копий молекулы РНК ВИЧ-1 определенных в тесте. Список литературы 1. Boom R., Sol C.J., Salimans M.M., Jansen C.L., Wertheim-van Dillen P.M., van der Noordaa J., 1990.molecular testing to screen mentally retarded individuals for fragile X syndrome. Diagnostic Molecular Pathology, 2001; 10: 34-40. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ обнаружения и количественного анализа представляющей интерес нуклеиновой кислоты по меньшей мере в одном образце, включающий нанесение указанного образца на твердый носитель, способный, по меньшей мере, частично абсорбировать указанный образец; сушку указанного носителя; обработку, по меньшей мере, репрезентативной части указанного носителя, содержащей по меньшей мере 100 мкл образца, раствором для выделения нуклеиновой кислоты для экстрагирования репрезентативного количества указанной нуклеиновой кислоты из указанного носителя; количественный анализ указанного репрезентативного количества указанной нуклеиновой кислоты. 2. Способ по п.1, в котором анализируют по меньшей мере 250 мкл образца. 3. Способ по п.1 или 2, включающий идентификацию указанной нуклеиновой кислоты. 4. Способ по любому из пп.1-3, в котором указанный твердый носитель обеспечивает по меньшей мере два образца. 5. Способ по любому из пп.1-4, включающий нанесение на указанный твердый носитель известного количества контрольной нуклеиновой кислоты. 6. Способ по любому из пп.1-5, в котором указанная репрезентативная часть содержит, по существу, весь указанный по меньшей мере один образец. 7. Способ по любому из пп.1-6, в котором указанная репрезентативная часть содержит, по сущест- 10010153 ву, весь указанный твердый носитель. 8. Способ по п.4 или 5, в котором указанная репрезентативная часть содержит один из указанных образцов. 9. Способ по любому из пп.1-8, в котором указанный раствор для выделения нуклеиновой кислоты содержит хаотропный буфер выделения нуклеиновой кислоты для лизиса. 10. Способ по любому из пп.1-9, в котором указанная нуклеиновая кислота содержит РНК. 11. Способ по п.10, в котором указанная РНК содержит митохондриальную РНК, вирусную РНК и/или информационную РНК. 12. Способ по любому из пп.1-11, в котором обнаруживается вирусная нуклеиновая кислота. 13. Способ по п.12, в котором указанная вирусная нуклеиновая кислота содержит ретровирусную нуклеиновую кислоту. 14. Способ по п.11 или 12, в котором указанная вирусная нуклеиновая кислота содержит ВИЧ и/или ТЛВЧ. 15. Способ по любому из пп.11-14, в котором указанная вирусная нуклеиновая кислота включает ВИЧ-1. 16. Способ по любому из пп.1-15, в котором указанный носитель содержит фильтровальную бумагу. 17. Способ по любому из пп.1-16, включающий генотипирование мутанта. 18. Способ по любому из пп.1-17, в котором указанный образец включает ценную жидкость тела. 19. Способ по любому из пп.1-18, в котором указанный образец содержит кровь, плазму, материнское молоко, мокроту, ликвор, слюну и/или мочу. 20. Способ по любому из пп.1-19, в котором указанный образец содержит каплю цельной крови,полученной путем укола пальца или пятки. 21. Способ по любому из пп.1-19, в котором указанный образец представляет собой образец плазмы. 22. Способ по любому из пп.1-21, в котором указанное обнаружение и/или количественное определение нуклеиновой кислоты содержит этап амплификации. 23. Способ по п.22, в котором указанная амплификация включает амплификацию с мониторингом в реальном времени. 24. Способ по любому из пп.1-23, в котором указанное обнаружение и/или количественное определение нуклеиновой кислоты выполняют с системой считывания конечной точки. 25. Способ по любому из пп.1-24, в котором определяют соотношение между различными нуклеиновыми кислотами.
МПК / Метки
МПК: G01N 33/569, C12Q 1/68, G01N 33/53, C12M 1/00
Метки: твердый, кислоты, нанесенной, хранение, нуклеиновой, обнаружение, носитель
Код ссылки
<a href="https://eas.patents.su/13-10153-hranenie-i-obnaruzhenie-nukleinovojj-kisloty-nanesennojj-na-tverdyjj-nositel.html" rel="bookmark" title="База патентов Евразийского Союза">Хранение и обнаружение нуклеиновой кислоты, нанесенной на твердый носитель</a>