Линия клеток растения сахарной свеклы и растение сахарной свеклы, устойчивые к имидазолиноновым и сульфонилмочевинным гербицидам, семена указанного растения, способы получения указанной клеточной линии и гибридных растений свеклы, устойчивых к данным гербицидам, и применение имидазолинонового гербицида для борьбы с сорняками, растущими на полях с указанными растениями сахарной свеклы
Формула / Реферат
1. Линия клеток растения сахарной свеклы с мутированным геном ацетолактатсинтазы, в котором в положении 562 цитозин замещен на тимин и в положении 337 гуанин замещен на аденин, устойчивая к имидазолиноновым и сульфонилмочевинным гербицидам, способная регенерировать в растение сахарной свеклы, причем указанная устойчивость передается при общепринятом кроссбридинге регенерированных растений с растениями, чувствительными к данным гербицидам.
2. Линия клеток по п.1, которая получена из клеток родительского растения сахарной свеклы, обозначенных как CR1-B и депонированных под номером АТСС 97961, обладающих устойчивостью к сульфонилмочевинным гербицидам и не обладающих устойчивостью к имидазолиноновым гербицидам, посредством культивирования указанных клеток в культуральной среде с имидазолиноновым гербицидом для селекции мутированных клеток, депонированная под номером АТСС 97535 (93R30B).
3. Растение сахарной свеклы, содержащее клетки с мутированным геном ацетолактатсинтазы, в котором в положении 562 цитозин замещен на тимин и в положении 337 гуанин замещен на аденин, обладающее устойчивостью как к имидазолиноновым, так и к сульфонилмочевинным гербицидам, причем указанная устойчивость передается при общепринятом кроссбридинге этого растения.
4. Растение по п.3, которое регенерировано из линии клеток по п.2.
5. Семена растения сахарной свеклы по любому из пп.3-4.
6. Способ получения линии клеток сахарной свеклы по п.1, заключающийся в том, что клетки родительского растения сахарной свеклы, обладающие устойчивостью к сульфонилмочевинным гербицидам и не обладающие устойчивостью к имидазолиноновым гербицидам, культивируют в питательной среде с имидазолиноновым гербицидом и отбирают мутированные клетки, обладающие устойчивостью как к имидазолиноновым, так и сульфонилмочевинным гербицидам.
7. Способ по п.6, при котором культивируют клетки, полученные из родительского растения сахарной свеклы, обозначенные как 93R30 (SurSur) и депонированные под номером АТСС 97961, и получают линию, депонированную по номером АТСС 97535 (93R30B).
8. Способ получения гибридного растения сахарной свеклы, устойчивого как к имидазолиноновым, так и к сульфонилмочевинным гербицидам, заключающийся в том, что регенерируют растение из линии клеток сахарной свеклы по любому из пп.1-2 формулы и осуществляют кроссбридинг регенерированного растения с растением сахарной свеклы, чувствительным к указанным гербицидам, с получением гибридного растения, которое устойчиво как к имидазолиноновым, так и к сульфонилмочевинным гербицидам.
9. Способ получения гибридного растения свеклы, за исключением сахарной свеклы, устойчивого к имидазолиноновым и сульфонилмочевинным гербицидам, заключающийся в том, что регенерируют растение из линии клеток сахарной свеклы по п.1 формулы, полученной в соответствии со способом по п.6, и осуществляют кроссбридинг регенерированного растения с растением свеклы, за исключением сахарной свеклы, чувствительным к указанным гербицидам, с получением гибридного растения, которое устойчиво к имидазолиноновому и сульфонилмочевинному гербицидам.
10. Применение имидазолинонового гербицида для борьбы с сорняками, растущими на полях с растениями сахарной свеклы по любому из пп.3-4 формулы.
Текст
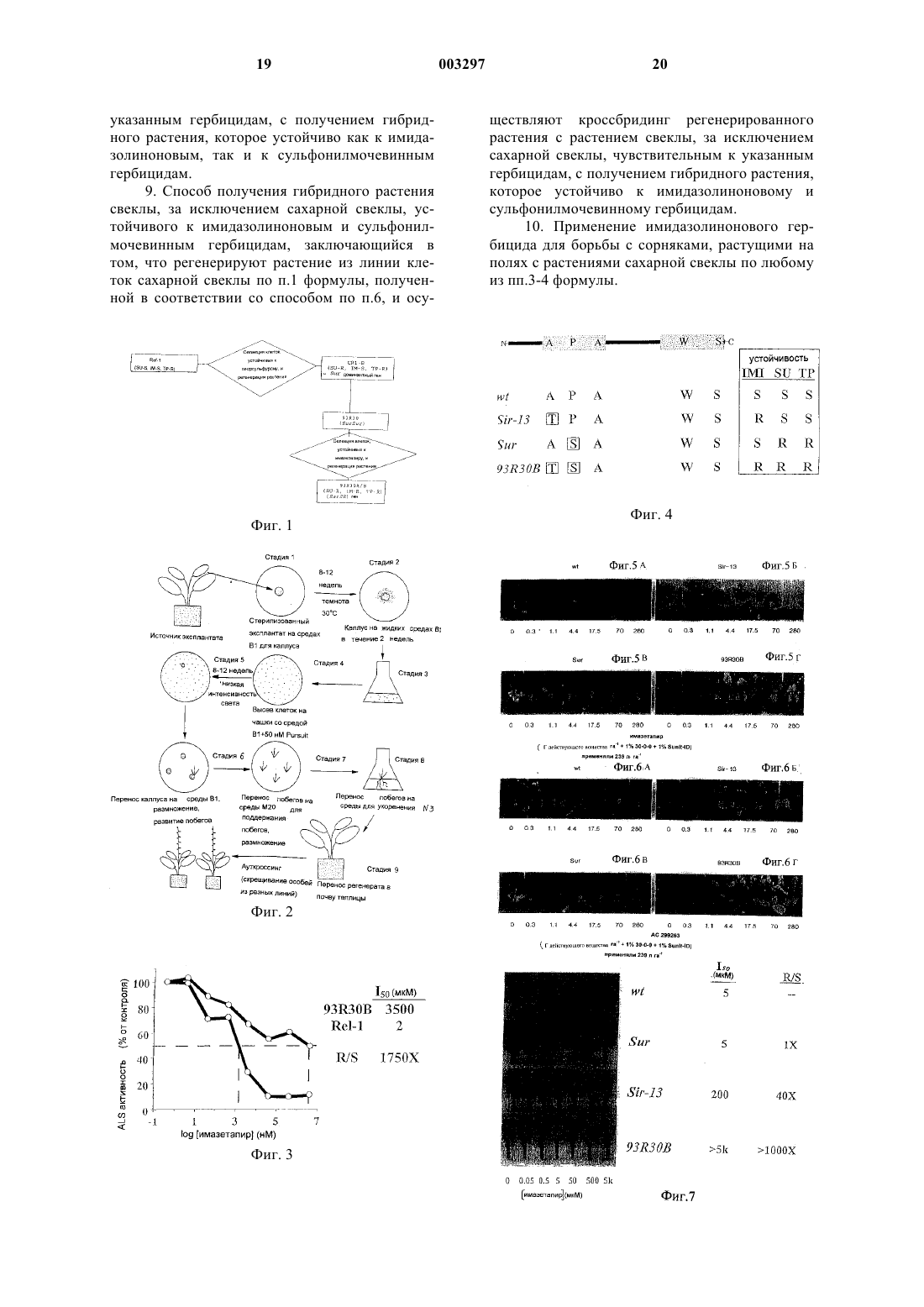
1 Область техники, к которой относится изобретение Настоящее изобретение касается получения растений сахарной свеклы (Beta vulgaris L),которые являются устойчивыми как к имидазолиноновым, так и к сульфонилмочевинным гербицидам, применяемым для борьбы с сорными растениями. В частности, настоящее изобретение относится к растениям сахарной свеклы,полученным из чувствительной сахарной свеклы посредством селекции на мутацию гена, кодирующего ацетолактатсинтазу (ALS), известную также как синтазу ацетооксикислоты(AHAS), с применением гербицидов последовательно на клетках в культуральной среде. Предшествующий уровень техники В данной области ранее описано генетическое изменение гена ацетолактатсинтазы посредством рекомбинантных методов, как показано в патентах США 5013659, 5141870 и 5378824. Данный тип модификации у растений сахарной свеклы показан на примере IV патента'824. Результаты являлись менее чем удовлетворительными при получении растений, которые давали потомство, действительно устойчивое к гербициду.Saunders et al. в (Crop Science 32: 13571360 (1992 также описывают получение растения сахарной свеклы (CR1-B), которое является устойчивым к сульфонилмочевинам, из чувствительного автофертильного клона (REL-1) посредством селекции на мутантные клетки в культуральной среде, содержащей гербицид. Различные устойчивые растения получали и подвергали кроссбридингу. Hart et al. (WeedScience 40378-383 (1992) и 41: 317-324 (1993 далее охарактеризовали устойчивую линию и определили, что устойчивость являлась следствием измененной ALS активности и не проявляла перекрестной устойчивости к другим ALSингибирующим гербицидам, и что она кодируется единственным полудоминантным геном. Не имеется публикаций, описывающих имидазолиноновую устойчивость, полученную посредством модифицирования ALS у растений сахарной свеклы. В литературе отсутствует описание растений, которые являются устойчивыми к обоим гербицидам, имидазолиноновым и сульфонилмочевинным. Различные линии зерновых культур с устойчивостью к имидазолинону разработаны, как описано Newhouse et al.,Theoretical and Applied Genetics 83: 65-70 (1991). Коммерческим путем защиты культур является применение используемых на практике"средств обеспечения безопасности", таких, как описаны в Европейском Патенте N 375875. При данном способе вводят другое химическое вещество в почву. Предпочтительный способ представляет собой создание растений сахарной свеклы, которые являются устойчивыми к имидазолиноновым и сульфонилмочевинным гербицидам. 2 Сущность изобретения Задачей настоящего изобретения, таким образом, является разработка способа сообщения растениям сахарной свеклы устойчивости как к имидазолиноновым, так и и сульфонилмочевинным гербицидам посредством селекции мутации гена ацетолактатсинтазы, которая приводит к данной устойчивости. Кроме того, задачей настоящего изобретения является получение растений сахарной свеклы, которые являются устойчивыми к данным гербицидам. Поставленная задача решается тем, что предложена линия клеток растения сахарной свеклы с мутированным геном ацетолактатсинтазы, в котором в положении 562 цитозин замещен на тимин и в положении 337 гуанин замещен на аденин, устойчивая к имидазолиноновым и сульфонилмочевинным гербицидам, способная регенерировать в растение сахарной свеклы, причем указанная устойчивость передается при общепринятом кроссбридинге регенерированных растений с растениями, чувствительными к данным гербицидам. Предпочтительным воплощением изобретения является линия указанных клеток, которая получена из клеток родительского растения сахарной свеклы, обозначенных как CR1-B и депонированных под номером АТСС 97961, обладающих устойчивостью к сульфонилмочевинным гербицидам и не обладающих устойчивостью к имидазолиноновым гербицидам, посредством культивирования указанных клеток в культуральной среде с имидазолиноновым гербицидом для селекции мутированных клеток,депонированная под номером АТСС 97535(93R30B). Поставленная задача решается также тем,что предложено растение сахарной свеклы, содержащее клетки с мутированным геном ацетолактатсинтазы, в котором в положении 562 цитозин замещен на тимин и в положении 337 гуанин замещен на аденин, обладающее устойчивостью как к имидазолиноновым, так и к сульфонилмочевинным гербицидам, причем указанная устойчивость передается при общепринятом кроссбридинге этого растения, предпочтительно растение, которое регенерировано из линии клеток, депонированной под номером АТСС 97535. Для решения указанной задачи предложены также семена растения сахарной свеклы по изобретению. Поставленная задача решается также тем,что предложен способ получения линии клеток сахарной свеклы по изобретению, заключающийся в том, что клетки родительского растения сахарной свеклы, обладающие устойчивостью к сульфонилмочевинным гербицидам и не обладающие устойчивостью к имидазолиноновым гербицидам, культивируют в питательной среде с имидазолиноновым гербицидом и отбирают мутированные клетки, обладающие устойчиво 3 стью как к имидазолиноновым, так и сульфонилмочевинным гербицидам. В предпочтительном воплощении этого способа культивируют клетки, полученные из родительского растения сахарной свеклы, обозначенные как 93R30 (SurSur) и депонированные под номером АТСС 97961, и получают линию, депонированную по номером АТСС 97535(93R30B). Предложен также способ получения гибридного растения сахарной свеклы, устойчивого как к имидазолиноновым, так и к сульфонилмочевинным гербицидам, заключающийся в том,что регенерируют растение из линии клеток сахарной свеклы по изобретению и осуществляют кроссбридинг регенерированного растения с растением сахарной свеклы, чувствительным к указанным гербицидам, с получением гибридного растения, которое устойчиво как к имидазолиноновым, так и к сульфонилмочевинным гербицидам. Предложен, кроме того, способ получения гибридного растения свеклы, за исключением сахарной свеклы, устойчивого к имидазолиноновым и сульфонилмочевинным гербицидам,заключающийся в том, что регенерируют растение из линии клеток сахарной свеклы по изобретению, полученной способом по изобретению, и осуществляют кроссбридинг регенерированного растения с растением свеклы, за исключением сахарной свеклы, чувствительным к указанным гербицидам, с получением гибридного растения, которое устойчиво к имидазолиноновому и сульфонилмочевинному гербицидам. В рамках решения поставленной задачи предложено также применение имидазолинонового гербицида для борьбы с сорняками, растущими на полях с растениями сахарной свеклы по изобретению. Растение сахарной свеклы REL-1 (Regenerating, East Lansing-1) было выделено в 1987 и может быть получено от Dr. Joseph Saunders,Research Geneticist (U.S. Department of Agriculture, East Lansing, Michigan). Его можно получить бесплатно. REL-1 является чувствительным (S) к имидазолиноновым (IM-S), сульфонилмочевинным (SU-S) и триазолпиримидинсульфонанилидным (TP-S) гербицидам, как показано на фиг. 1. С использованием каллусов и суспензионных культур была разработана линия, которая являлась гетерозиготной по имидазолиноновой и сульфонилмочевинной устойчивости (IM-R иSU-R). Данная клеточная линия была депонирована в American Type Culture Collection как АТСС 97535 6 мая 1996 под Budapest Treaty, и на нее здесь ссылаются как на 93R30B. Данную клеточную линию можно получить по запросу на название и номер. Посредством скрещивания с элитными линиями растений сахарной свеклы,в частности, Beta vulgaris L., можно получить 4 особенно коммерчески полезные устойчивые растения сахарной свеклы. Растения сахарной свеклы, устойчивые к имидазолиноновым гербицидам, конкретно к имазетапиру, и сульфонилмочевинным гербицидам (хлорсульфурону) решают проблему почвенных остатков от применения таких гербицидов в областях выращивания сахарной свеклы. В настоящее время существует 40-месячный период ожидания между применением данных гербицидов и будущим использованием данного поля для выращивания растений сахарной свеклы. Во-вторых, высокий уровень имидазолиноновой и сульфонилмочевинной устойчивости позволяет применять имидазолиноновые гербициды для борьбы с сорными растениями у сахарной свеклы. Краткое описание графических материалов Фиг. 1 представляет собой схематическое изображение способа по настоящему изобретению для получения растений сахарной свеклы,устойчивых к имидазолинону и сульфонилмочевине, 93R30A или В. R = устойчивый; IМ = имидазолинон; S = чувствительный; SU = сульфонилмочевина; Sur = ALS аллель, доминантная для SU-R, TP-R и IM-S; SB = ALS аллель, доминантная для SU-R, TP-R и IM-R; ТР = триазолпиримидин. 93R30B является SU-R и IM-R иTP-R. 93R30 (не 93R30B) является гомозиготным по Sur аллели (SU-R, IM-S). Данные материалы являлись исходными для получения имидазолиноновой устойчивости. Фиг. 2 представляет собой диаграмму технологического процесса, показывающую детализированные стадии получения мутантного растения сахарной свеклы. Фиг. 3 представляет собой график, показывающий ALS анализ на устойчивость 93R30B к имазетапиру. Фиг. 4 представляет собой схему, показывающую аминокислотные замены, обнаруженные у трех мутантов сахарной свеклы (Sir-13,Sur и SB), no сравнению с диким типом (wt) и соответствующую гербицидную устойчивость. Включены только аминокислотные остатки,которые, как сообщалось в литературе, отвечают за гербицидную устойчивость у растений. Однобуквенные аминокислотные коды обозначают следующее: А = аланин, Р = пролин, W = триптофан, S = серин, и Т = треонин. Буквы в прямоугольниках показывают изменения по отношению к последовательности дикого типа. Фиг. с 5 А по 5 Г представляют собой фотографии, показывающие ответ целого растения сахарной свеклы на имазетапир, примененный в послевсходовый период. Фиг. с 6 А по 6 Г представляют собой фотографии, показывающие ответ целого растения сахарной свеклы на АС 299263, примененный в послевсходовый период. 5 Фиг. 7 представляет собой фотографию,показывающую ответ фермента ALS на имазетапир in vitro. Фиг. 8 представляет собой фотографию,показывающую ответ фермента ALS на флуметсулам in vitro. Фиг. с 9 А по 9 Г представляют собой фотографии, показывающие ответ целого растения сахарной свеклы на хлорсульфурон, примененный в послевсходовый период. Фиг. 10 представляет собой фотографию,показывающую ответ фермента ALS на хлорсульфурон in vitro. Следующие примеры показывают выделение и размножение нового растения сахарной свеклы 93R30B, как иллюстрируется на фиг. 1. Пример 1. 1. Селекция сахарной свеклы, устойчивой к имидазолинону и сульфонилмочевине, вариант 93R30B. Описание материаловRel-1. (Regenerating East Lansing-1) представляет собой высокорегенерируемую линию сахарной свеклы с мужской фертильностью,используемую для начальной клеточной селекции на мутант, гербицидо-устойчивый к сульфонилмочевинам, и применяется в качестве чувствительного контроля для большинства экспериментов.CR1-B. Данный изолят сахарной свеклы был разработан посредством высева клеток Rel1 на хлорсульфуронсодержащую среду. Данный вариант является устойчивым к сульфонилмочевине с умеренной устойчивостью к триазолпиримидиновому гербициду, флуметсуламу, но без имидазолиноновой устойчивости. Данный вариант был описан Saunders et al. (Crop Sci. 32: 1357-1360) и Hart et al. (Weed Sci. 40: 378-383 и 41: 317-324). Ген SU устойчивости отмечен какSur. 93R30B. Данный изолят был разработан посредством высева клеток высоко регенерируемого Sur гомозиготного растения сахарной свеклы (происходящего от CR1-B) на среды,содержащую имазетапир.EL-49. East Lansing 49, выделенный USDA в 1993. Линия сахарной свеклы, гомозиготная по Sur гену, применяемая для сульфонилмочевина-устойчивого, имазетапир-чувствительного контроля. а. Растения селекционировали как исходные материалы для соматоклональной селекции,основанной на их способности образовывать каллус в условиях высокого содержания цитокининов (в средах В 1) и регенерировать побеги из каллуса. Протокол для сред В 1: 30 гл-1 сахарозы; 100 мгл-1 мио-инозитола; 1,65 гл-1 NН 4 МО 3 ; 1,90 гл-1 КNО 3 ; 6 0,44 гл-1 CaCl22H2O; 0,37 гл-1 MgSO47H2O; 0,17 гл-1 КН 2 РО 4 ; 6,2 мгл-1 Н 3 ВО 3 ; 16,8 мгл-1 MnSO4H2O; 10,6 мгл-1 ZnSО 47 Н 2 О; 0,88 мгл-1 KI; 0,25 мгл-1 Na2MoO42H2O; 0,025 мгл-1 CuSO45H2O; 0,025 мгл-1 СоСl26 Н 2 О; 37,3 мгл-1 Na2 ЭДТА; 27,8 мгл-1 FeSO47H2O; 1 мгл-1 тиамина; 0,5 мгл-1 пиридоксина; 0,5 мгл-1 никотиновой кислоты; 1 мгл-1 бензиламинопурина; рН 5,95. Твердую среду В 1 автоклавировали с 9 гл-1 растительного культурального агара и модифицировали стерилизованными фильтрованием исходными растворами для разведения,как требуется по схеме селекции. Среды с агаром заливали в одноразовые пластмассовые чашки Петри 15x100 мм. Жидкую среду В 1 добавляли 40 мл аликвотами в 125 мл колбы Эрленмейера и автоклавировали для использования для жидких суспензионных культур. Для селекции имидазолинон-устойчивого варианта 93R30B исходным материалом являлся 93R30 (Sur гомозиготный, производный от CR1B). В частности: 1. Клетки от Rel-1 (SU-S, IM-S, TP-S) помещали в культуру, где клетки селекционировали по их способности расти на хлорсульфуроне,и регенерировали растение CR1-B (описанноеSU-R, IM-S, TP-R. Растение, известное как EL49, встречающееся в данном описании, было выделено в 1993 Saunders (ген был назван Sur, и растение являлось гомозиготным по нему). 3. В последнюю очередь потомков от CR1B, гомозиготных по Sur, селекционировали по их способности регенерировать растения в культуре. Они затем служили в качестве исходного материала (например 93R30) для селекции на имазетапир в культуре. 4. В результате вышеописанной селекции получали изоляты, известные как 93R30A и 93R30B, и регенерировали растения. Они обладали характеристиками CR1-B плюс IM-R. Оказалось, что ген, ответственный за IM-R, является измененной формой Sur, и была установлена его идентичность SB. Эксплантаты листовых дисков получали из быстро растущих листьев исходного растения(стадия 1) посредством двух последовательных 20-минутных промывок 15%-ой коммерческой хлорной известью плюс 0,025%-м Тритон Х-100(Т-9280, Sigma Chem. Co., St. Louis, МО). Листья дважды ополаскивали стерильной деионизированной водой. Листовые диски вырезали с использованием стерилизованного в пламени сверла для пробок 3. Листовые диски помещали асептически на твердые среды В 1 (стадия 2). Диски инкубировали в темноте при 30 С в течение 4-8 недель до пролиферации рыхлой белой каллусной ткани из листового диска. Каллусную ткань отделяли механически с использованием пинцета и последовательно переносили в 125 мл колбы Эрленмейера (стадия 3), содержащие по 40 мл жидкой среды В 1. Колбы помещали на вращательную качалку при 50 Гц под флуоресцентным освещением низкой интенсивности (30 мкЭ/м 2 с). Жидкие культуры субкультивировали в свежих средах В 1 через 1 неделю. Через две недели после инициации жидкой культуры колонии клеток разделяли с использованием сита для диссоциации клеток (SigmaCD-1) с экраном 60 меш. Примерно две трети объема жидких сред удаляли после седиментации клеток. На стадии 4 клетки ресуспендировали в оставшихся средах, и 1 мл аликвоты равномерно распределяли на твердых средах В 1,содержащих 50 нМ гербицида имазетапира(PURSUIT, American Cyanamid, Wayne, NJ). Чашки заворачивали и инкубировали в неярком флуоресцентном свете (5-10 мкЭ/м 2 с) в течение 8-12 недель. в. При концентрации имазетапира 50 нМ все чувствительные клетки погибали. Колонии клеток, которые выжили и выросли при данной концентрации, идентифицировали как возможные устойчивые варианты. На стадии 5 эти колонии клеток (1-3 мм в диаметре) переносили на свежие твердые среды В 1 без гербицида и позволяли им расти при низкоинтенсивном свете(10-20 мкЭ/м 2 с). Каждый предполагаемый устойчивый вариант индивидуально идентифицировали и поддерживали отдельно. г. На стадии 6 белый рыхлый каллус подразделяли каждые 4-6 недель на свежие твердые среды В 1, пока из каллуса не вырастал индивидуальный побег (побеги). Эти побеги переносили на среды для поддержания побегов (М 20),такие как следующие: Протокол для М 20 сред: 30 гл-1 сахарозы; 100 мгл-1 миоинозитола; 1,65 гл-1 NН 4NО 3 ; 1,90 гл-1 КNO3 ; 0,44 гл-1 СаСl22 Н 2 О; 0,37 гл-1 MgSO47H2O; 0,17 гл-1 КН 2 РО 4 ; 6,2 мгл-1 Н 3 ВО 3 ; 16,8 мгл-1 MnSO4H2O; 8 10,6 мгл-1ZnSО 47 Н 2 О; 0,88 мгл-1 KI; 0,25 мгл-1 Na2MoO42H2O; 0,025 мгл-1 CuSO45 Н 2 О; 0,025 мгл-1 СоСl26 Н 2 О; 37,3 мгл-1 Nа 2 ЭДТА; 27,8 мгл-1 FeSO47H2O; 1 мгл-1 тиамина; 0,5 мгл-1 пиридоксина; 0,5 мгл-1 никотиновой кислоты; 0,25 мгл-1 бензиламинопурина; рН 5,95. Твердую среду М 20 автоклавировали с 9 гл-1 растительного культурального агара и модифицировали стерилизованными фильтрованием исходными растворами гербицидов для разведения, как требовалось по схеме селекции. Среды с агаром заливали в одноразовые пластмассовые чашки Петри 20x100 мм. Культуры побегов поддерживали при флуоресцентном освещении 10-20 мкЭ/м 2 с и размножали посредством разрезания культур побегов с использованием лезвия скальпеля. Кандидаты культур побегов размножали и оценивали на уровень устойчивости, как описано ниже. 2. Уровень имидазолиноновой, сульфонилмочевинной и триазолпиримидинсульфонанилидной устойчивости в культуре побегов. На стадии 7 культуры побегов оценивали на гербицидную устойчивость посредством помещения трех маленьких срезов побегов последовательных размеров на каждую из чашек со средой М 20, содержащей логарифмически возрастающие концентрации имидазолинонового гербицида, сульфонилмочевины или триазолпиримидинсульфонанилида, находящиеся в пределах от 1 нМ до 0,1 мМ. Ответы культуры 93R30 сравнивали с ответами культур побегов чувствительного контроля (Rel-1) и хлорсульфуронустойчивого,имидазолинон-чувствительного контроля (EL-49). Культуры побегов поддерживали при интенсивности света 20 мкЭ/м 2 с при 25 С в течение 3 недель. Ответ культуры побегов определяли посредством оценки повреждения побега и массы сырой ткани через 3 недели после переноса на селективные среды. Величину гербицидной устойчивости определяли как отношение величины I50 (концентрация гербицида, вызывающая 50-процентное повреждение) устойчивого варианта к величине I50 чувствительного варианта. Характеристики перекрестной устойчивости каждого варианта определяли вышеописанным способом посредством замены гербицида,используемого в средах. В культуре побегов 93R30B проявил 3600-кратный уровень устойчивости к имазетапиру, 10000-кратный уровень устойчивости к хлорсульфурону и 60-кратную перекрестную устойчивость к триазолпиримидинсульфонанилидному гербициду, флуметсу 9 ламу, как показано в табл. 1. Для сравнения EL49 проявил только 3-кратный уровень устойчи 003297 Таблица 1 Величина устойчивости и перекрестной устойчивости культуры побегов Семейство гербиRel-1 93R30B- R/S = отношение величины I50 устойчивого варианта к величине I50 чувствительного контроля для конкретного гербицида, который тестировали; 5- I50 представляет собой концентрацию гербицида, требующуюся, чтобы вызвать 50% повреждение культуры побегов; 6- классификации семейства гербицидов: IM, имидазолинон; SU, сульфонилмочевина; и ТР, триазолпиримидин сульфонанилид. 3. Регенерация растений и размножение. На стадии 8 культуры побегов 93R30B регенерировали до целых растений подобным способом. Через две недели после предшествующего субкультивирования культуры побегов побеги 93R30B переносили в 125 мл колбы Эрленмейера, содержащие 40 мл среды для укоренения N3. Протокол для среды N3: 30 гл-1 сахарозы; 100 мгл-1 мио-инозитола; 1,65 гл-1 NН 4NO3 ; 1,90 гл-1 КNО 3 ; 0,44 гл-1 CaCl22H2O; 0,37 гл-1 MgSO47H2O; 0,17 гл-1 КН 2 РО 4; 6,2 мгл-1 Н 3 ВО 3 16,8 мгл-1 MnSO4H2O; 10,6 мгл-1 ZnSO47H2O; 0,88 мгл-1 KI; 0,25 мгл-1 Na2MoO42H2O; 0,025 мгл-1 CuSO45H2O; 0,025 мгл-1 СоСl26 Н 2 О; 37,3 мгл-1 Na2 ЭДТА; 27,8 мгл-1 FeSO47H2O; 1 мгл-1 тиамина; 0,5 мгл-1 пиридоксина; 0,5 мгл-1 никотиновой кислоты; 3 мгл-1 нафталинуксусной кислоты; рН 5,95. Среду N3 добавляли 40 мл аликвотами в 125 мл колбы Эрленмейера, в каждую колбу добавляли 9 гл-1 агара и автоклавировали для использования для укоренения культур побегов. Затем культуры переносили на 24 ч на дневной свет при средней интенсивности света(40-60 мкЭ/м 2 с) при 25 С. Как правило, корни образовывались через 6-8 недель. На стадии 9 укорененные побеги (поколение R0) затем переносили в вегетационную смесь Baccto (Michigan Peat Co., Houston, TX) в теплице. На стадии 10 растения R0 регенератов 93R30B скрещивали с гладкокорневой сахарной свеклой, названной 293, или с REL-1. Из семянF1 от этих скрещиваний в результате самоопыления получали семена F2. Предполагалось, что имидазолиноновая устойчивость является доминантным или полудоминантным моногенным признаком. Растения поколения F2, полученные от самоопыления растений F1, устойчивых к имидазолинону и сульфонилмочевине, должны расщепляться в соотношении 1 гомозиготное устойчивое: 2 гетерозиготных устойчивых: 1 гомозиготное чувствительное по обеим устойчивостям, к имидазолинону и к сульфонилмочевине. Существуют основания предполагать, что имидазолиноновая устойчивость является доминантным признаком у 93R30B. Этот вывод сделан на основании анализа потомства F1 от скрещиваний между 93R30B и чувствительными к гербициду линиями сахарной свеклы с мужской фертильностью 293 или Rel-1, которые дают расщепление типа 1:1 на IM-R или IM-S. Подобным образом, во всех растениях F2 или растениях от обратного скрещивания (ВС 1), тестированных к настоящему времени, IM-R и SUR расщепляются совместно. Это позволяет предположить, что эти две устойчивости сцеплены и являются следствием разных изменений одной и той же ALS аллели. Устойчивость или чувствительность растений F1 к имазетапиру и хлорсульфурону определяли с использованием 11 недеструктивного теста на рост листовых дисков. Протокол анализа Данный протокол представляет собой недеструктивный тест, предназначенный для раннего скрининга растений свеклы, расщепляющихся по гербицидной устойчивости, чтобы определить их состояние как устойчивое или чувствительное без необходимости опрыскивания растений свеклы в послевсходовый период в теплице. 1) Вновь вырастающий лист отрезали от растения (по меньшей мере, 4-й настоящий лист). 2) Поверхность листа стерилизовали двумя 20-минутными промывками 15%-ой коммерческой хлорной известью + 0,025%-ым Тритон Х 100, затем ополаскивали дважды стерильной дистиллированной водой. 3) Эксплантаты листовых дисков вырезали с использованием стерилизованного в пламени сверла для пробок 3. 4) Листовые диски переносили на среды В 1, не содержащие гербицида, содержащие 100 нМ имазетапира или содержащие 100 нМ хлорсульфурона. Чашки делили на четыре секции,чтобы четыре образца можно было анализировать на одной чашке. На каждую чашку для каждого образца добавляли от четырех до пяти листовых дисков. 5) Чашки заворачивали и инкубировали при 25 С в течение 4-7 дней при низкой интенсивности света (примерно 10 мкЭ/м 2 с). 6) Устойчивые образцы идентифицировали по их способности жить и расти на селективной среде. Чувствительные образцы не должны расти и должны становиться от желтых до коричневых. Эффекты сравнивали с ростом листовых дисков, помещенных на среды без гербицида,чтобы гарантировать точное определение ожидаемого уровня роста дисков. 4. Ферментативный ответ ALS мишени на имазетапир Стандартные методики использовали для частичной очистки ALS из быстро растущих листьев растений сахарной свеклы, растущих в теплице (Hart et al., Weed Science 40: 378-383 (1992. Экстракты из гетерозиготных растений F1 93R30B и семена Rel-1 S1 анализировали на активность ALS в присутствии логарифмически возрастающих концентраций имазетапира. Активность ALS определяли в экстрактах из листьев линий сахарной свеклы REL1 и 93R30B. Растения выращивали в теплице,как описано выше, до стадии от четырех до шести листьев. Активность ALS из свежих экстрактов определяли в присутствии имазетапира и хлорсульфурона при логарифмически возрастающих концентрациях. Применяемые способы и методики модифицировали из описанных Ray(Plant Physiol. 76: 545-546 (1984. Десять г листьев сахарной свеклы гомогенизировали в 40 12 мл холодного буфера для гомогенизации (0,1 М К 2 НРО 4, рН 7,5, 1 мМ пируват натрия, 0,5 мМMgCl2, 0,5 мМ тиаминпирофосфат, 10 мкМ флавинадениндинуклеотида, 10% об./об. глицерина) плюс 2,5 г поливинилпирролидона. Гомогенат фильтровали через восемь слоев марли и центрифугировали при 27000 g в течение 20 мин. Супернатант отбирали и подвергали 50% насыщению (NH4)2SO4. Данный раствор хранили при 0 С в течение 1 ч, затем центрифугировали при 18000 g в течение 15 мин, остаток вновь растворяли в 1 мл буфера для ресуспендирования (0,1 М К 2 НРО 4, рН 7,5, 20 мМ пируват натрия, 0,5 мМ MgCl2) и обессоливали на колонке сSephadex G-25 PD-105. Экстракты фермента анализировали немедленно. Активность ALS измеряли посредством добавления 0,2 мл препарата фермента (разбавленного 3:1 буфером для ресуспендирования) к 1,3 мл реакционного буфера (25 мМ К 2 НРО 4, рН 7,0, 0,625 мМ MgCl2, 25 мМ пируват натрия,0,625 мМ тиаминпирофосфат, 1,25 мкМ флавинадениндинуклеотид) и инкубации при 35 С в течение 1 ч. Реакционные смеси содержали конечную концентрацию 0, 4, 40, 400, 4000, 40000,400000 или 4000000 нМ имазетапира или 0, 0,9,9, 90, 900, 9000, 90000 нМ хлорсульфурона. Реакцию останавливали посредством добавления 50 мкл 6 н. H2SO4 и инкубации при 60 С в течение 15 минут. Данная процедура, как описаноWesterfield (J. Biol. Chem. 16: 495-502 (1945 также декарбоксилирует продукт ALS фермента, ацетолактат, с образованием ацетоина. Окрашенный ацетоиновый комплекс образовывали посредством добавления 1 мл 2,5% мас./мас. нафтола и 0,25% мас./мас. креатина в 2,5 н.NaOH и инкубации при 60 С в течение 15 мин. Покупной ацетоин использовали в качестве стандарта для колориметрической реакции. Концентрации ацетоина определяли посредством измерения абсорбции реакционного раствора при 530 нм. Эксперименты с каждым гербицидом повторяли с тремя повторениями для каждого. Концентрации белка в экстрактах определяли посредством метода Брэдфорда (Anal.Biochem. 72: 248-254 (1976 с использованием бычьего сывороточного альбумина для построения стандартной кривой. Эксперименты проводили дважды, и обработки повторяли три раза. На фиг. 3 показан ответ ALS экстрактов из 93R30B и чувствительного Rel-1. 93R30B проявляет 1750-кратный уровень устойчивости к имазетапиру на уровне фермента (как определили по отношению величин I50 устойчивой и чувствительной линии). 5. Число копий ALS гена. Чтобы определить число копий ALS гена,присутствующих у чувствительной сахарной свеклы, проводили Саузерн-блот анализ. Геномную ДНК выделяли из чувствительных растений F3, происходящих от исходного мутантаSir-13, и анализировали с использованием обычно практикуемых методик (Current Protocols in Molecular Biology, J. Wiley and Sons, NewYork (1991. Подобным образом анализировали геномную ДНК из коммерческого сорта сахарной свеклы. В обоих линиях сахарной свеклы определили одну копию ALS гена. Эти данные должны указывать на то, что вся ферментативная активность ALS у гомозиготного мутанта сахарной свеклы должна состоять из устойчивой формы фермента. Это также подтверждает мнение, что SB замена, обнаруженная у изолята 93R30B, является измененной формой SUR аллели ALS. Это было подтверждено, как описано ниже. 6. Мутация ALS гена. Чтобы определить молекулярную основу устойчивости ALS фермента, использовали стандартные методики для секвенирования (определения последовательности) двух районовALS гена, где встречались все описанные ранее мутации устойчивости к гербицидам (CurrentProtocols in Molecular Biology, J. Wiley and Sons,New York (1991. Последовательность ALS гена сахарной свеклы была определена ранее (Патент США 5378824), и были сконструированы праймеры для полимеразной цепной реакции(ПЦР) для амплификации двух районов гена,ответственных за ранее описанные случаи устойчивости к гербицидам у растений. Сравнение данных последовательности из SU-R IM-S TP-R(Rel-1) сахарной свеклы указывает на то, что признаки устойчивости к гербицидам у 93R30B являлись следствием двух независимых мутаций в ALS гене. Мутация, вызывающая SU-R IM-S TP-R(Sur), является результатом одиночной замены нуклеотида цитозина на тимин в положении 562 в нуклеотидной последовательности, которая приводит к замене серина на пролин в положении 188 аминокислотной последовательностиALS сахарной свеклы. Ранее было показано, что данный сайт вовлечен в устойчивость к сульфонилмочевине у Arabidopsis thaliana (Haugh et al.,Molecular and General Genetics 211: 266-271(1988 и у дрожжей (Патент США 5378824). Других замен оснований в двух изученных районах ALS гена по сравнению с последовательностью дикого типа не наблюдалось. Мутация, вызывающая SU-R IM-R TP-R(SB), является результатом двух независимых мутаций в нуклеотидной последовательностиALS, приводящих к двум различным заменам в аминокислотной последовательности. Первая замена является идентичной Sur мутации, описанной выше. Данное наблюдение являлось ожидаемым, поскольку в качестве исходного материала для IM-R селекции служило растение сахарной свеклы (93R30). Кроме данной точечной мутации, наблюдалась дополнительная 14 одиночная замена нуклеотида гуанина на аденин в положении 337. Эта вторая мутация приводит к замене треонина на аланин в положении 113 аминокислотной последовательности ALS сахарной свеклы. Ранее было показано, что данный сайт вовлечен в устойчивость к имидазолинону у дурнишника (Bernasconi et al., J. Biol.Chem. 270: 17381-17385 (1995 и в устойчивость к сульфонилмочевине у дрожжей (Патент США 5378824). Других замен оснований в двух изученных районах ALS гена по сравнению с последовательностью дикого типа не наблюдалось. Следующая информация показывает синергизм гербицидной устойчивости возможных мутаций Ala113-Thr и Pro118-Ser. Двойная мутация в ALS гене у сахарной свеклы SB обеспечивает устойчивость к комбинации гербицидов двух химических семейств, к которым несет устойчивость каждый из одиночных мутантов сахарной свеклы индивидуально (то есть, Sur и Sir-13). На фиг. 4 показаны характеристики перекрестной устойчивости к основным семействам двух одиночных мутантов (Sur и Sir-13) и двойного мутанта (SB). Аминокислоты, изображенные на фиг. 4, представляют 5 строго консервативных остатков,которые, как сообщалось в литературе, вовлечены в ALS-ингибирующую устойчивость к гербицидам у растений. Взаимодействие независимых мутаций внутри двойного мутантного фермента (и соответствующих растений) является уникальным. Комбинация IM-специфичной устойчивости, наблюдаемой при аминокислотной замене у Sir-13 (Ala113-Thr) и SU- и ТРустойчивость, наблюдаемая при замене у Sur(Pro188-Ser) приводит в результате к сахарной свекле 93R30B (SB), устойчивой ко всем трем классам химии гербицидов. Устойчивости, однако, не являются аддитивными. Вместо этого эти мутации проявляют синергизм в отношении устойчивости к имидазолиноновым гербицидам имазетапиру и АС 299263. Данное явление можно наблюдать визуально на фиг. 5 и 6 и количественно в табл. 2. Таблица 2. Ответ целого растения сахарной свеклы в послевсходовый период на ALS-ингибирующие гербициды Линия сахарной свеклы Сахарная свекла с одиночной мутацией,Sur и Sir-13, проявляет 3 и 100-кратную устойчивость к имазетапиру, тогда как двойной мутант, SB, является 300-кратно устойчивым к гербициду при его применении в послевсходовый период на целых растениях. Подтверждение этого синергизма обеспечивается посредством 15 наблюдаемого ответа ALS фермента из каждого из мутантов на имазетапир (фиг. 7). Снова наблюдается синергизм устойчивости к гербициду у двойного мутанта, SB (1000x) по сравнению с одиночными мутантами, Sur (1x) и Sir-13 (40x) в отдельности. Подобный синергизм очевиден для ТР класса гербицидов. Устойчивость побегов для одиночных мутантов Sur и Sir-13 является 40 х и 1 х, соответственно, и 60 х для двойного мутанта,SB. Это явление синергизма подтверждается данными по ALS ферменту - 50 х и 3 х устойчивостью к флуметсуламу для одиночных мутантов, Sur и Sir-13, соответственно, и 200 х устойчивостью для двойного мутанта, SB (фиг. 8). Вторая мутация, обнаруживаемая у SB, фактически снижает устойчивость к хлорсульфурону(гербициду SU класса), наблюдаемую на уровне целого растения (фиг. 9). Для хлорсульфурона устойчивость целого растения у двойного мутанта SB (20x) снижается более чем в 50 раз посредством добавления мутации, эквивалентной Sir-13 (Ala113-Thr) (1x устойчивость) в генSU-устойчивости, Sur (Pro188-Ser) (1000x устойчивость) (табл. 2). Случай антагонизма между одиночным мутантом Sur и двойным мутантом SB еще неизвестен. На уровне ALS фермента также наблюдается синергизм устойчивости при использовании хлорсульфурона (фиг. 10). Следует принимать во внимание, что в первую очередь можно проводить селекцию на имидазолиноновую устойчивость, а затем проводить селекцию на сульфонилмочевинную устойчивость. Рекомендуется, чтобы приведенное выше описание являлось только иллюстративным для настоящего изобретения, и чтобы настоящее изобретение не было ограничено только прилагаемой ниже формулой. Аминокислотные последовательности фиг. 4 показаны в SEQ ID 18 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Линия клеток растения сахарной свеклы с мутированным геном ацетолактатсинтазы, в котором в положении 562 цитозин замещен на тимин и в положении 337 гуанин замещен на аденин, устойчивая к имидазолиноновым и сульфонилмочевинным гербицидам, способная регенерировать в растение сахарной свеклы,причем указанная устойчивость передается при общепринятом кроссбридинге регенерированных растений с растениями, чувствительными к данным гербицидам. 2. Линия клеток по п.1, которая получена из клеток родительского растения сахарной свеклы, обозначенных как CR1-B и депонированных под номером АТСС 97961, обладающих устойчивостью к сульфонилмочевинным гербицидам и не обладающих устойчивостью к имидазолиноновым гербицидам, посредством культивирования указанных клеток в культуральной среде с имидазолиноновым гербицидом для селекции мутированных клеток, депонированная под номером АТСС 97535 (93R30B). 3. Растение сахарной свеклы, содержащее клетки с мутированным геном ацетолактатсинтазы, в котором в положении 562 цитозин замещен на тимин и в положении 337 гуанин замещен на аденин, обладающее устойчивостью как к имидазолиноновым, так и к сульфонилмочевинным гербицидам, причем указанная устойчивость передается при общепринятом кроссбридинге этого растения. 4. Растение по п.3, которое регенерировано из линии клеток по п.2. 5. Семена растения сахарной свеклы по любому из пп.3-4. 6. Способ получения линии клеток сахарной свеклы по п.1, заключающийся в том, что клетки родительского растения сахарной свеклы, обладающие устойчивостью к сульфонилмочевинным гербицидам и не обладающие устойчивостью к имидазолиноновым гербицидам,культивируют в питательной среде с имидазолиноновым гербицидом и отбирают мутированные клетки, обладающие устойчивостью как к имидазолиноновым, так и сульфонилмочевинным гербицидам. 7. Способ по п.6, при котором культивируют клетки, полученные из родительского растения сахарной свеклы, обозначенные как 93R30 (SurSur) и депонированные под номером АТСС 97961, и получают линию, депонированную по номером АТСС 97535 (93R30B). 8. Способ получения гибридного растения сахарной свеклы, устойчивого как к имидазолиноновым, так и к сульфонилмочевинным гербицидам, заключающийся в том, что регенерируют растение из линии клеток сахарной свеклы по любому из пп.1-2 формулы и осуществляют кроссбридинг регенерированного растения с растением сахарной свеклы, чувствительным к 19 указанным гербицидам, с получением гибридного растения, которое устойчиво как к имидазолиноновым, так и к сульфонилмочевинным гербицидам. 9. Способ получения гибридного растения свеклы, за исключением сахарной свеклы, устойчивого к имидазолиноновым и сульфонилмочевинным гербицидам, заключающийся в том, что регенерируют растение из линии клеток сахарной свеклы по п.1 формулы, полученной в соответствии со способом по п.6, и осу Фиг. 1 20 ществляют кроссбридинг регенерированного растения с растением свеклы, за исключением сахарной свеклы, чувствительным к указанным гербицидам, с получением гибридного растения,которое устойчиво к имидазолиноновому и сульфонилмочевинному гербицидам. 10. Применение имидазолинонового гербицида для борьбы с сорняками, растущими на полях с растениями сахарной свеклы по любому из пп.3-4 формулы.
МПК / Метки
Метки: имидазолиноновым, указанными, указанной, растений, полях, сульфонилмочевинным, гербицидам, борьбы, устойчивые, имидазолинонового, линия, растениями, линии, растение, гибридных, клеток, семена, получения, применение, способы, клеточной, гербицида, устойчивых, указанного, растения, сахарной, данным, свеклы, сорняками, растущими
Код ссылки
<a href="https://eas.patents.su/12-3297-liniya-kletok-rasteniya-saharnojj-svekly-i-rastenie-saharnojj-svekly-ustojjchivye-k-imidazolinonovym-i-sulfonilmochevinnym-gerbicidam-semena-ukazannogo-rasteniya-sposoby-polucheniy.html" rel="bookmark" title="База патентов Евразийского Союза">Линия клеток растения сахарной свеклы и растение сахарной свеклы, устойчивые к имидазолиноновым и сульфонилмочевинным гербицидам, семена указанного растения, способы получения указанной клеточной линии и гибридных растений свеклы, устойчивых к данным гербицидам, и применение имидазолинонового гербицида для борьбы с сорняками, растущими на полях с указанными растениями сахарной свеклы</a>