Антагонист хемокинового рецептора и циклоспорин в комбинированной терапии
Номер патента: 3181
Опубликовано: 27.02.2003
Авторы: Нельсон Питер Дж., Веллс Тимоти Н.С., Праудфут Аманда, Гроне Херманн-Йозеф
Формула / Реферат
1. Применение антагониста хемокинового рецептора в комбинации с циклоспорином с целью получения фармацевтической композиции для лечения или профилактики отторжения трансплантированных органов, тканей или клеток.
2. Применение по п.1, отличающееся тем, что антагонист хемокинового рецептора и циклоспорин используются одновременно, раздельно или последовательно.
3. Применение по любому из предшествующих пунктов, отличающееся тем, что антагонистом хемокинового рецептора является усеченный по N-концу хемокин.
4. Применение по п.1 или 2, отличающееся тем, что антагонистом хемокинового рецептора является удлиненный по N-концу RANTES.
5. Применение по п.1 или 2, отличающееся тем, что антагонистом хемокинового рецептора является Met-RANTES.
6. Применение по любому из предшествующих пунктов, отличающееся тем, что циклоспорин выбирают из циклоспорина А, а также его метаболитов и синтетических аналогов.
7. Применение по любому из предшествующих пунктов, отличающееся тем, что циклоспорином является циклоспорин А.
8. Применение по любому из предшествующих пунктов для лечения или профилактики отторжения аллотрансплантата почки.
9. Фармацевтическая композиция, включающая антагонист хемокинового рецептора и циклоспорин в присутствии одного или более фармацевтически приемлемых наполнителей, для лечения или профилактики отторжения трансплантированных органов, тканей или клеток.
10. Фармацевтическая композиция, включающая антагонист хемокинового рецептора и циклоспорин в присутствии одного или более фармацевтически приемлемых наполнителей, для одновременного, раздельного или последовательного применения его активных ингредиентов для лечения или профилактики отторжения трансплантированных органов, тканей или клеток.
11. Фармацевтическая композиция по п.9 или 10, отличающаяся тем, что антагонистом хемокинового рецептора является усеченный по N-концу хемокин.
12. Фармацевтическая композиция по п.9 или 10, отличающаяся тем, что антагонистом хемокинового рецептора является удлиненный по N-концу RANTES.
13. Фармацевтическая композиция по п.9 или 10, отличающаяся тем, что антагонистом хемокинового рецептора является Met-RANTES.
14. Фармацевтическая композиция по любому из пп.9-13, отличающаяся тем, что циклоспорин выбирают из циклоспорина А, а также его метаболитов или синтетических аналогов.
15. Фармацевтическая композиция по любому из пп.10-14, отличающаяся тем, что циклоспорином является циклоспорин А.
16. Фармацевтическая композиция по любому из пп.9-15 для лечения или профилактики отторжения аллотрансплантата почки.
Текст
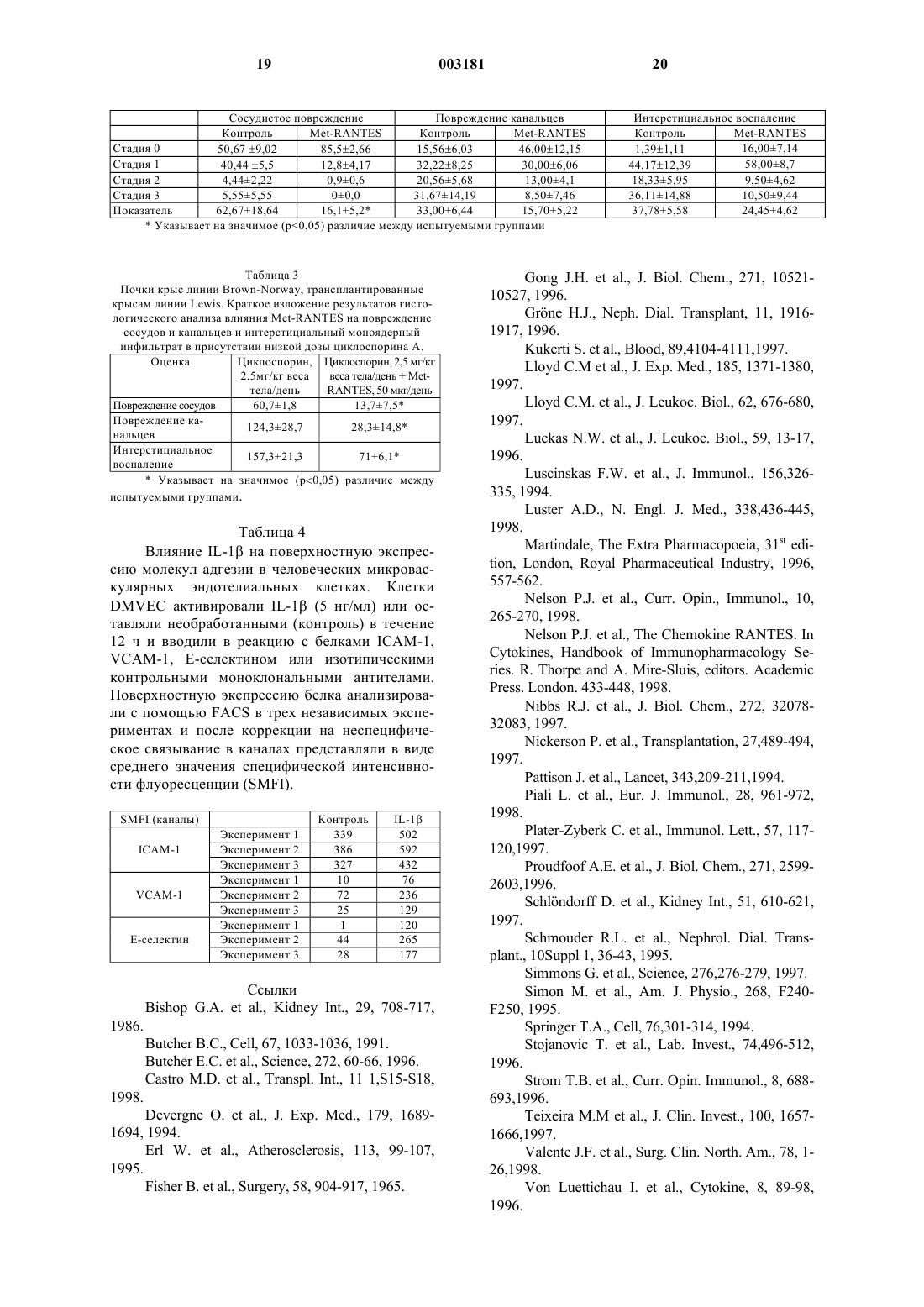
1 Область изобретения Настоящее изобретение относится к применению антагониста хемокинового рецептора совместно с циклоспорином с целью получения фармацевтической композиции для лечения или профилактики отторжения трансплантированных органов, тканей или клеток. Оно относится также к указанным фармацевтическим композициям для (далее везде) одновременного, раздельного или последовательного применения его активных ингредиентов в указанной выше терапии. В частности, оно относится к применениюMet-RANTES совместно с циклоспорином А с целью получения фармацевтического состава для лечения отторжения аллогенного трансплантата почки. Предпосылки к созданию изобретения Механизм, по которому формируется Тклеточный ответ на чужеродный (аллогенный или ксеногенный) белок или клетку, или орган,достаточно хорошо изучен. Антигенпрезентирующие клетки (АПК) притягиваются к участкам воспаления или повреждения (которые могут быть вызваны хирургической трансплантацией). Спектр Т-клеток на периферии непрерывно обследует ткани для обнаружения патогенов или наличия чужеродной (алло- или ксеногенной) ткани. Как только распознается какой-либо из этих предупреждающих сигналов,АПК поглощают белок, переваривают его и предоставляют его иммунной системе хозяина. Иммунная система хорошо приспособлена для быстрого идентифицирования чужеродной,инфицированной или воспаленной ткани и быстро ее разрушает. Это всегда было основным препятствием при трансплантации ткани, органа и клетки, а также при генной терапии. Большинство проблем обычно связаны с хронической иммуносупрессией, инкапсуляцией или иммуноизоляцией. Нежелательные побочные эффекты хронической иммуносупрессии включают повышенную чувствительность к условнопатогенной инфекции и образованию опухоли. В частности, острое отторжение аллотрансплантата почки опосредуется как аллоантиген-зависимыми, так и -независимыми факторами и характеризуется моноядерным клеточным инфильтратом, состоящим, в основном, из Т-лимфоцитов, моноцитов/макрофагов и атипичных эозинофилов (Grne H.J., 1996, ValenteJ.F. et al., 1998, Bishop G.A. et al., 1986). Рекрутинг этих лейкоцитов из периферического кровообращения в трансплантированный орган включает сложное взаимодействие между рядом молекул, экспрессированных на поверхности лейкоцитов и эндотелия (Butcher E.C., 1991,Butcher E.C. et al., 1996, Springer Т.А., 1994). Желание обеспечить долговременное восприятие трансплантированной ткани в отсутствие непрекращающейся иммуносупрессии является давней целью медицины человека. 2 Было показано, что хемокины, большое суперсемейство структурно родственных цитокинов, избирательно стимулируют быструю адгезию, хемотаксис и активацию специфических эффекторных субпопуляций лейкоцитов(Springer Т.А., 1994, Nelson P.J. et al., 1998, Luster A.D., 1998, Schlndorff D. et al., 1997). Хемокины характеризуются рядом общих структурных элементов, включающих консервативные цистеиновые остатки (С), используемые для различения хемокиновых подгрупп С, С-С,С-Х-С и С-Х 3-С (где Х означает промежуточный аминокислотный остаток, расположенный между первыми двумя N-концевыми проксимальными цистеинами). Все разнообразные биологические активности хемокинов, повидимому, контролируются их взаимодействием с большим семейством, охватывающим семь трансмембранных сопряженных с С-белком рецепторов (Nelson P.J. et al., 1998, Luster A.D.,1998, Schlndorff D. et al., 1997). Специфическая экспрессия клеточного типа этих рецепторов,по-видимому, в значительной степени контролирует лейкоцитную специфичность активности хемокинов (Nelson P.J. et al., 1998, Luster A.D.,1998, Schlndorff D. et al., 1997). Хемокин RANTES (регулируемый при активации, экспрессируемый и секретируемый нормальными Т-клетками), член подсемейства хемокинов С-С, является лигандом для ряда хемокиновых рецепторов, включая CCR1,CCR3, CCR5, CCR9 и DARC (антигеновый рецептор Даффи для хемокинов) у человека (Nelson P.J. et al., 1998, Luster A.D., 1998, SchlndorffD. et al., 1997, Nibbs R.J. et al., 1997). RANTES является сильным хемоаттрактантом для Тклеток, моноцитов, естественных клетоккиллеров, базофилов и эозинофилов (Nelson P.J.et al., 1998). Считается, что такие хемокины, как RANTES, играют основную роль в клеточных инфильтратах, которые составляют основу различных патологических процессов. Например,RANTES экспрессируется in vivo при заболеваниях, характеризующихся моноядерным клеточным инфильтратом, включая гиперчувствительность замедленного типа, некротизирующий гломерулонефрит, воспалительные заболевания легких и отторжение почечного трансплантата (Schlndorff D. et al., 1997, Nelson P.J.al., 1994, Wiedermann C.J. et al., 1993). При исследовании человеческих почек, претерпевающих острое клеточное отторжение, было найдено, что белок RANTES локализован в моноядерных инфильтрующих клетках, почечных тубулярных эпителиальных клетках и эндотелиальном слое перитубулярных капилляров (Pattison J. et al., 1994, Wiedermann C.J. et al., 1993). Поскольку острое клеточное отторжение характеризуется внутрисосудистым развившимся ин 3 терстициальным клеточным инфильтратом, состоящим из моноцитов/макрофагов,Тлимфоцитов и атипичных эозинофилов, RANTES играет потенциально ключевую роль в патогенезе острого отторжения (Schlndorff D. еt.al., 1997, Nelson P.J. et al., 1998, Pattison J. et al.,1994, Wiedermann C.J. et al., 1993). Основываясь на этих наблюдениях, была предложена модель, объясняющая роль RANTES в отторжении почечных аллотрансплантатов (Nelson P.J. et al., 1998, Pattison J. et al., 1994,Wiedermann C.J. et al., 1993). В начале отторжения микроваскулярный эндотелий воспаляется,происходит дегрануляция тромбоцитов, высвобождающая белок RANTES, который связывается с поверхностью эндотелия. Воспаленные почечные канальцы и эндотелиальные клетки продуцируют дополнительные хемокины,включая RANTES. Затем аккумулированные поверхностно-связанные хемокины подают направленные сигналы циркулирующим в крови лейкоцитам по мере того, как они проходят по поверхности эндотелия (Butcher Е.С., 1991,Butcher E.C. et al., 1996, Springer Т.А., 1994, Nelson P.J. et al., 1998, Pattison J. et al., 1994, Wiedermann C.J. et al., 1993). Лейкоциты узнают поверхностно-связанный белок, усиливают регуляцию интегринов и прочно прилипают к поверхности эндотелия, подвергаются диапедезу и транссудации. По мере того, как лейкоциты активируются, они выделяют дополнительные цитокины и хемокины, усиливая и распространяя, таким образом, воспалительную реакцию(Nelson P.J. et al., 1998, Pattison J. et al., 1994,Wiedermann C.J., 1993). Модификация N-конца белка RANTES может в существенной степени изменить его свойства (Proudfoof A.E. et al., 1996, Gong J.H. etal., 1996, Simmons G. et al., 1997). Присоединение одного остатка метионина (Met) изменяет агонистический белок в антагонист рецептора хемокина RANTES с активностью при наномолярной концентрации (Proudfoof A.E. et al.,1996). Этот антагонист, Met-RANTES, проявляет биологическую активность у мышей и крыс(Proudfoof, не опубликованные наблюдения) и,как было показано, ослабляет воспаление на мышиных моделях аллергической кожи и ревматоидного артрита и частично подавляет некротизирующий гломерулонефрит (Teixeria M.M.C.M. et al., 1997). Циклоспорины представляют собой группу неполярных циклических олигопептидов с иммунодепрессивной активностью, продуцируемых грибом Tolypocladium inflatum Gams и другими дефектными грибами. Основной компонент, циклоспорин А, был идентифицирован наряду с несколькими другими минорными метаболитами, циклоспоринами от В до N. Было также получено множество синтетических аналогов. Циклоспорин А является коммерчески 4 доступным препаратом, который получил широкое клиническое применение в качестве иммунодепрессанта при трансплантации органов. Основной проблемой применения циклоспорина А является его нефротоксичность(Martindale, 1996), характеризующаяся задержкой жидкости, повышенной концентрацией сывороточного креатинина и мочи, падением скорости гломерулофильтрации и пониженной экскрецией натрия и калия. В частности, у реципиентов почечного трансплантата бывает трудно отличить нефротоксичность от отторжения трансплантата. Раскрытие сущности изобретения В настоящее время авторы обнаружили,что комбинированная терапия антагонистом хемокинового рецептора и низкой дозой циклоспорина приводит к уменьшению случаев воспаления, связанных с оттторжением трансплантата по сравнению с лечением одним циклоспорином. В частности, авторы обнаружили, что MetRANTES уменьшает повреждение сосудов и канальцев и вызывает значительное ослабление интерстициального отторжения в почечных аллотрансплантатах. Следовательно, основным объектом настоящего изобретения является применение антагониста хемокинового рецептора в комбинации с циклоспорином с целью получения фармацевтического состава для лечения или профилактики (далее везде) отторжения трансплантированных органов, тканей или клеток. Антагонист хемокинового рецептора и циклоспорин могут вводиться одновременно, раздельно или последовательно. Поэтому другим объектом настоящего изобретения является способ лечения или предупреждения отторжения трансплантированных органов, тканей или клеток путем одновременного, раздельного или последовательного введения эффективного количества антагониста хемокинового рецептора и эффективного количества циклоспорина вместе с фармацевтически приемлемым наполнителем. Термин эффективное количество означает количество активных ингредиентов, которое является достаточным для того, чтобы воздействовать на ход и тяжесть отторжения трансплантированных органов, тканей или клеток, приводя к ослаблению или ремиссии такой патологии. Эффективное количество будет зависеть от пути введения и состояния пациента. Еще одним объектом настоящего изобретения являются фармацевтические составы, содержащие антагонист хемокинового рецептора и циклоспорин в присутствии одного или нескольких фармацевтически приемлемых наполнителей для одновременного, раздельного или последовательного введения активных ингредиентов с целью лечения или предупреждения 5 отторжения трансплантированных органов, тканей или клеток. В случае раздельного или последовательного применения двух активных ингредиентов фармацевтические составы согласно изобретению будут включать два различных состава,причем каждый включает один или два активных ингредиента наряду с одним или несколькими фармацевтически приемлемыми наполнителями. Подразумевается, что термин фармацевтически приемлемый охватывает любой носитель, который не влияет на эффективность биологической активности активного ингредиента и не является токсичным для хозяина, которому вводится. Например, для парентерального введения указанные выше активные ингредиенты могут быть смешаны в виде единичной дозы для инъекции в наполнителях, таких как физиологический раствор, раствор декстрозы, сывороточный альбумин или раствор Рингера. Помимо фармацевтически приемлемого носителя составы согласно изобретению могут также включать небольшие количества добавок,таких как стабилизаторы, наполнители, буферы и консерванты. Введение таких активных ингредиентов может быть внутривенным, внутримышечным или подкожным. Настоящее изобретение охватывает и другие пути введения, которые могут обеспечить в крови желаемые уровни соответствующих ингредиентов. Комбинированная терапия согласно настоящему изобретению применима для лечения или предупреждения отторжения любого трансплантированного органа, ткани или клетки, но она особенно целесообразна в случаях почечных трансплантатов из-за нефротоксичности циклоспорина А. Термин антагонист хемокинового рецептора означает любую молекулу, которая действует как антагонист по отношению к зрелым,полноразмерным, природным хемокинам и,предпочтительно, не обладает значительной хемоаттрактантной активностью. Для измерения указанной хемоаттрактантной активности можно сослаться, например, на Nelson P.J. et al.,1998. Антагонист хемокинового рецептора выбирают предпочтительно среди усеченных молекул хемокина RANTES, о которых сообщено в Международной патентной заявке WO 97/44462, усеченных МСР-3, RANTES и MIP1, описанных в Международной патентной заявке WO 98/06751, усеченных RANTES и МСР-2, описанных в Европейской патентной заявке 97116863.8, или удлиненного по N-концуRANTES, описанного в WO 96/17935. Особенно предпочтительным является Met-RANTES. В цитированных выше патентных заявках приведены также ссылки на способы получения упо 003181 6 мянутых антагонистов хемокиновых рецепторов. Циклоспорин выбирают из циклоспорина А, его метаболитов или синтетических аналогов. Предпочтительным является циклоспорин А. Следовательно, предпочтительное воплощение изобретения заключается в совместном применении Met-RANTES и циклоспорина А для лечения или предупреждения отторжения почечного аллотрансплантата. Заявитель нашел,что в этом случае можно снизить эффективную дозу циклоспорина, и это является огромным преимуществом, учитывая дозозависимую токсичность для почки, которая, как известно, связана с лечением циклоспорином. Указанный выше эффект показан в экспериментах на крысах in vivo. Изобретение будет теперь описываться с помощью следующих примеров, которые не должны рассматриваться как ограничивающие настоящее изобретение. В примерах будут ссылки на фигуры, описанные ниже. Описание фигур Фиг. 1. Определяли способность RANTES связываться непосредственно с микроваскулярным эндотелием до и после стимуляции с IL-1(5 нг/мл) в течение 12 ч. DMVEC выращивали в 96-ячеечных планшетах, содержание RANTES измеряли с использованием модифицированной методики ELISA. Фиг. 2 а и 2 б. Влияние Met-RANTES на устойчивую задержку, распространение или трансмиграцию клеток линии МоnоМас 6 на активированном микроваскулярном эндотелии при физиологическом токе. Клетки DMVEC,выращенные до слияния в чашках Петри, стимулировали IL-1 (5 нг/мл) или оставляли необработанными (контроль) в течение 12 ч, затем предварительно инкубировали с RANTES (10 нг/мл) или без него в течение 30 мин клетки МоnоМас 6 предварительно обрабатывали сMet-RANTES (1 мкг/мл) или без него и перфузировали при постоянной скорости тока 1,5 дин/см 2. (а) Устойчивую адгезию к DMVEC определяли путем подсчета прочно прикрепленных моноцитов в множественных полях через 5 мин и выражали как клетки/мм 2. (б) Моноциты,подвергающиеся распространению или трансмиграции, подсчитывали через 5 мин в множественных полях высокого разрешения и выражали как процент от первоначально прочно прикрепленных клеток. Данные представлены в виде среднего значениястандартное отклонение от 3 опытов. (Примечание: результаты были воспроизводимыми в интервале Met-RANTES от 0,01 мкг/мл до 1 мкг/мл). 7 Материалы и методы Используемые клетки Линию моноцитарных опухолевых клеток МоnоМас 6 культивировали в среде RPMI 1640 с добавлением 10% FCS, как описано ранее(фирмы Costar), среду и сыворотку тестировали на содержание липополисахаридов (ЛПС) низкой плотности. Первичные человеческие дермальные микроваскулярные эндотелиальные клетки (DMVEC) из человеческой неонатальной крайней плоти получены от д-ра К. Degitz (Dermatology, LMU, Munich, Germany). Клетки вносили в среду MCDB 131 (Gibco BRL, Eggenstein,Germany) с добавлением 10% эмбриональной телячьей сыворотки (Boehringer Mannheim,Germany), 1 мг/мл ацетата гидрокортизонаBRL, Eggenstein, Germany) и инкубировали при 37 С и 5% CO2. Клетки выращивали в колбах Т 75, чашках Петри диаметром 35 мм (Costar,Corning, New York) или 96-ячеечных плоскодонных планшетах (Nunc, Wiesbaden, Germany),предварительно покрытых 0,5% желатином(Sigma, Deisenhofen, Germany). Среду заменяли каждые 2-3 дня. Клетки характеризовали, чистоту культур обеспечивали посредством морфологических признаков и иммунофлуоресцентной проточной цитометрии для поверхностной экспрессии CD31. Материалы Материалы для гистологических исследований получали от фирмы Merck (Darmstadt,Germany). Материалы для химических и иммунологических измерений были поставлены фирмой Sigma (Munich, Germany). IL-1 и TNF приобретены у фирмы Sigma (Munich,Germany). Получение рекомбинантного RANTES и RANTES-специфичного моноклонального антитела VL1 описаны ранее (Von LuettichauI., 1996). Получали Met-RANTES и удаляли эндотоксин для исследований in vivo, как описано ранее (Proudfoof A.E. et аl., 1996, Teixeira M.M.C.M. et al., 1997). Животные и трансплантация почек Во всех экспериментах использовали инбредных крыс-самцов. Крысы линии Lewis(LEW, RT11) служили в качестве реципиентов почек от крыс линии Fisher 344 (F344 RT1lv1) или Brown Norway (BN RT1). Животных получали от фирмы Charles River GmbH, Sulzfeld,Germany. Крысы весили 190-250 г (Lew и F344) и 140-170 г (BN) для регулировки диаметра мочеточника. Трансплантацию проводили, используя модификацию методики, изначально опи 003181 8 санной Fisher и Lee (Fisher В. et al., 1965). Вкратце, животным давали наркоз с помощью эфирно-капельной анестезии, донорскую почку промывали 5 мл холодного (4 С) 0,9% NaCl,содержащего или не содержащего 100 мкг MetRANTES. Почку и мочеточник удаляли в блоке,включая почечную артерию вместе с 5 мм скоплением клеток вокруг аорты и почечную вену с 3 мм участком полой вены. Почки хранили в 0,9% NaCl при 4 С. Донорскую почку трансплантировали к брюшной аорте и нижней полой вене животного-реципиента ниже левой почечной артерии с помощью анастомозов конец в бок не рассасывающимся монофиламентным нейлоновым швом 8-0. Анастомоз мочеточника осуществляли конец в бок с не рассасывающимся монофиламентным нейлоновым швом 11-0. Общее ишемическое время донорской почки составляло от 30 до 40 мин. Гипонефроз оценивали как макроскопически во время гибели, так и с помощью световой микроскопии. Все животные с гипонефрозом исключались из опытных групп. Левую почку реципиента всегда удаляли во время трансплантации. При трансплантации от животного линии Fisher реципиенту линииLewis правая почка находилась на пластине слева для того, чтобы иметь внутренний контроль эффектов Met-RANTES. При трансплантации отBrown Norway к Lewis во время трансплантации проводили двустороннюю нефрэктомию. Опытные группы Опытные группы были следующие. Группа 1: почка от Fisher 344 крысе Lewis с одной эндогенной почкой. Группа 1 а: с Met-RANTES, 200 мкг/день в течение 7 дней (n=9). Группа 1 б: без Met-RANTES в течение 7 дней (n=9). Группа 2: почка от Brown Norway крысеLewis при двусторонней нефрэктомии и введении 2,5 мг/кг веса тела в день циклоспорина А. Группа 2 а: с Met-RANTES, 50 мкг/день в течение 12 дней (n=4). Группа 2 б: без Met-RANTES в течение 12 дней (n=4). Циклоспорин А (СуА) (любезно предоставленный Sandoz, Basel, Switzerland) растворяли в оливковом масле и вводили подкожно при концентрации 2,5 мг/кг веса тела ежедневно в течение 12 дней, начиная через 4 ч после трансплантации. Met-RANTES растворяли в воде и доводили до 0,9% хлоридом натрия и вводили путем внутривенной инъекции ежедневно в дозе 200 мкг/день в опыте по трансплантации отFisher к Lewis и в дозе 50 мкг/день в опыте по трансплантации от Brown Norway к Lewis. Анализ сыворотки Кровь, взятую из аорты во время умерщвления, анализировали на содержание креатинина, мочевины, глюкозы и билирубина, используя автоматический анализатор сыворотки. Это 9 не обеспечивало информацию о функции почки для модели Fisher-Lewis, поскольку у подвергшихся трансплантации животных была одна эндогенная почка, но эти измерения были уместны в случае трансплантации на модели BrownNorway-Lewis. Гистология Органы (легкое, печень, почку и селезенку) удаляли под глубоким наркозом. Органы быстро промокали от крови, взвешивали и затем подвергали обработке, необходимой для гистологии, иммуногистохимии или гибридизации insitu. Из органов готовили срезы в 1 мм и либо фиксировали погружением в 4% формальдегиде в забуференном фосфатом физиологическом растворе (PBS), рН 7,35 (PBS: 99 мМNаН 2 РO4 хН 2 О, 108 мМ NаН 2 РO4 х 2 Н 2O и 248 мМ NaCl) в течение 24 ч, либо фиксировали в метакаме в течение 8 ч и заливали парафином,или замораживали в жидком азоте и в последующем хранили при -80 С до использования в иммуногистохимическом анализе. Световую микроскопию проводили на срезах 3 мкм с помощью смеси периодная кислота-реагент Шиффа или реагента Голднер-Эластика. Иммуногистохимия Моноклональное антитело ED1 (фирмыSerotech/Camon, Wiesbaden, Germany) использовали на фиксированной метакамом и залитой парафином ткани (3 мкм) для того, чтобы продемонстрировать наличие моноцитов/макрофагов. Для обнаружения антигена CD8, экспрессированного на цитотоксических Тлимфоцитах, мышиные моноклональные антитела наносили на замороженные срезы после фиксации охлажденным льдом ацетоном в течение 5 мин (фирма Serotech/Camon, Wiesbaden,Germany). Использовали систему обнаружения щелочная фосфатаза-антищелочная фосфатаза(фирмы Dako, Hamburg, Germany). Контроли,исключающие первое или второе антитело для каждого среза, были отрицательными. Морфометрия Оценка васкулярного повреждения в баллах Прегломерулярные сосуды с поврежденным эндотелием, тромбом и эндотелиалитом были оценены, как не имеющие никакого повреждения (0), имеющие слабую (1), умеренную(2) и тяжелую (3) степень повреждения, и определялись во всем почечном срезе, включая корковый слой, внешний и внутренний мозговой слой. Степень специфического показателя васкулярного повреждения определяли как процент сосудов с соответственной степенью повреждения, встречающегося во всем почечном срезе. Оценку общего васкулярного повреждения в баллах рассчитывали как сумму всех сосудов со всеми степенями васкулярного повреждения,при том, что число сосудов с показателем 1 умножали на единицу, с показателем 2 - на коэффициент два и с показателем 3 - на коэффициент три (Stojanovic Т. et al., 1996). 10 Оценка тубулярного воспаления в баллах Тубулярное повреждение расценивали как отсутствующее (0), слабое (1), умеренное (2) и тяжелое (3) по оценке в 20 полях высокого разрешения (HPF) коркового слоя и поперечной полоски внешнего мозгового слоя. Общее тубулярное повреждение в баллах рассчитывали, как описано, для оценки общего васкулярного повреждения. Оценка интерстициального воспаления в баллах Распространенность интерстициальной инфильтрации с помощью моноядерных клеток оценивали как отсутствующую (0), слабую (1),умеренную (2) и тяжелую (3), и общее поражение в баллах рассчитывали, как описано для оценки общего васкулярного поражения. Количество моноцитов/макрофагов и Т-клеток внутри капиллярных сплетений клубочков рассчитывали как среднее значение от соответственных количеств во всех клубочках в одном почечном срезе. Гибридизация in situ Одноцепочечные РНК-зонды получали путем транскрипции in vitro клона кДНК крысиного RANTES (Dr. H. Sprenger, Marburg, Germany). Транскрипцию in vitro проводили с использованием набора Транс-зонд-Т (Pharmacia, Freiburg,Germany) и меченого дигоксигенином трифосфата уридина (Boehringer, Mannheim, Germany). Вектор (pBluescript KS(+), Stratagene, Heidelberg,Germany) разрезали рестриктазой BamH1 и транскрибировали с РНК-полимеразой Т 3, получая антисмысловой зонд; для того, чтобы получить смысловой зонд, плазмиду разрезали рестриктазой EcoRI с последующей транскрипцией с РНК-полимеразой Т 7. После удаления парафина почечные срезы расщепляли 20 мкг/мл протеиназой К (Boehringer) в буфереPBS в течение 16 мин. Срезы вторично фиксировали в 4% формальдегиде в течение 5 мин и ацетилировали (0,25% уксусный ангидрид в 0,1 М триэтаноламине, 10 мин). Для гибридизацииin situ с меченой дигоксигенином мРНК использовали следующий гибридизационный буфер: 5 х стандартный раствор хлорида и цитрата натрия (SSC), 50% формамид, 50 мкг/мл тРНК, 50 мкг/мл гепарина и 0,1% додецилсульфат натрия. После гибридизации при 56 С в течение 16 ч срезы промывали однократно буфером 4xSSC и 2xSSC в течение 10 мин при 37 С с последующим промыванием в 0,55xSSC в течение 30 мин и 0,1 SSC при 22 С в течение 15 мин. Инкубацию антидигоксигенинового антитела и реакцию со щелочной фосфатазой проводили в соответствии с руководством производителя(Boehringer, Mannheim, Germany), используя nнитротетразолий синий и 5-бром-4-хлор-3 индолилфосфат в качестве окрашивающих реагентов (Stojanovic Т. et al., 1996, Simon M. et al.,1995). Анализ на защиту от РНКазы 11 Общую РНК выделяли из всей почки крысы, как описано ранее (Simon M. et al., 1995). Опыты по защите от РНКазы проводили с использованием коммерческого набора RPA(PharMingen, San Diego, California, зонд rCK-1). Этот набор позволяет одновременно измерять в образцах мРНК крысы: IL-1, IL-1, TNF-,THF-, IL-2, IL-3, IL-4, IL-5, IL-6, IL-10 и IFNи конститутивные гены GAPDH и L32. Для каждого определения использовали 20 мкг общей РНК. Защищенные образцы прогоняли на преформированном геле (систему быстрого разделения нуклеиновых кислот Quickpoint использовали в соответствии с рекомендациями производителя, фирмы Novex, San Diego, California). Интенсивность специфических полос оценивали количественно, используя прибор Molecular Dynamics Storm 840 Phosphorimager, стандартизованный к экспрессии гена L32, и усредняли по трем анализированным животным. Анализ связывания in vitro Клетки DMVEC выращивания до слияния на 96-ячеечных плоскодонных планшетах с покрытием. Образующийся эндотелиальный монослой или оставляли необработанным, или обрабатывали различными концентрациями IL1 (от 0,1 до 5 нг/мл) в течение 12 ч. Анализ связывания RANTES являлся модификацией описанной ранее методики (Pattison J. et al.,1994, Wiedermann C.J. et al., 1993). Конъюгированное с пероксидазой хрена (HRP) моноклональное антитело против человеческого RANTES (VL1, 0,1 мкг) преинкубировали при 25 С в течение 30 мин с избытком рекомбинантного человеческого RANTES (20 мкг/мл) в ростовой среде DMVEC (без добавок). Прибавляли комплекс хемокин-антитело, затем анализировали относительную хемокин-связывающую способность микроваскулярного эндотелия. Эндотелиальный монослой осторожно промывали 1 х ростовой средой без добавок(25 С), прибавляли комплекс хемокин-антитело и инкубировали при 25 С в течение 30 мин. Затем ячейки промывали четыре раза средой без сыворотки при 25 С. Реакцию с пероксидазой хрена проводили в течение 5 мин или менее. Оптическую плотность в планшете при 406 нм определяли с использованием считывающего устройства для ELISA. Результаты демонстрируют изменения в связывающей способности воспаленного микроваскулярного эндотелия по отношению к белку RANTES после активации эндотелиальных клеток. Все эксперименты проводились четырежды, и демонстрируемые результаты представляют репрезентативную выборку от трех отдельных опытов. Анализ активируемого флуоресценцией клеточного сортинга (FACS) 12 Проточный цитометрический анализ дермальных микроваскулярных клеток (DMVEC) проводили, в основном, как описано (Weber С.DMVEC, стимулированные IL-1 (5 нг/мл) или оставленные необработанными в течение 12 ч,трипсинизировали, вводили в реакцию с интерлейкин-насыщающими концентрациями моноклонального антитела (mAb) RR1/1 (любезно предоставленного Dr. R. Rothlein) к антигенуICAM-1, моноклонального антитела к Еселектину и моноклонального антитела к антигену VCAM-1 (оба антитела от Serotec), или проводили изотипический контроль в течение 30 мин на льду, окрашенном с помощью конъюгированного с флуоресцеинизоцианатом (FITC) козьим антимышиным IgG (Boehringer Mannheim) и анализировали FACScan (Becton Dickinson). После поправки на неспецифическое связывание данные выражали в виде специфической средней логарифмической интенсивности флуоресценции (SMFI) в каналах. Модельная система рекрутинга моноцитов на микроваскулярном эндотелии in vitro при физиологических условиях тока Взаимодействие моноцитов с клеткамиL. et al., 1998). Вкратце: клетки DMVEC выращивали до слияния в чашках Петри диаметром 35 мм, стимулировали IL-1 (5 нг/мл) или оставляли необработанными в течение 12 ч. Чашки компоновали в виде нижней стенки в проточной камере с параллельными стенками и монтировали гистологические срезы на столике инвертированного микроскопа Olympus IMT-2 с 20 х и 40 х объективами фазового контраста. Монотипы (клетки МоnоМас 6) культивировали,как сообщено (Ziegler-Heitbrock H.W.L. et al.,1988, Weber С. et al., 1993) и вновь суспендировали при 106/мл в аналитическом буфере(HBSS), содержащем 10 мМ Hepes, pH 7,4 и 0,5% HSA. Незадолго до анализа добавляли 1 мМ Мg2+ и 1 мМ Са 2+. В ходе анализа клеточные суспензии выдерживали в нагревательном блоке при 37 С и перфузировали в проточную камеру при скорости 1,5 дин/см 2 в течение 5 мин. В опытах по ингибированию моноциты предварительно инкубировали с Met-RANTES при различных концентрациях (0,01-1 мкг/мл) в течение 30 мин на льду. Количество прочно прикрепленных клеток после пятого потока определяли количественно в множественных полях (по меньшей мере, пять на эксперимент) с помощью видеоанализа, записанного видеокамерой длительного накопления JVC 3CCD и с помощью видеомагнитофона JVC SR L 900E, и выражали в клетках/мм 2. Тип анализируемой адгезии был ограничен первичными, т.е. прямыми взаимодействиями моноцитов с эндотелием. В качест 13 ве взаимнообратного измерения устойчивой задержки количество клеток, движущихся при пониженной скорости по эндотелию, определяли в течение последних 30 с пятиминутных интервалов и оценивали в процентах от всех взаимодействий в данном поле. Количество распространяющихся или трансмигрирующих клеток определяли с пятиминутными интервалами в полях высокого разрешения, как описано (Luscinskas F.W. et al., 1994) и выражали в процентах от прочно прикрепленных клеток. Статистический анализ Значения SEM представляли ms roman. Статистический анализ проводили, используя критерий суммы рангов Манна-Уитни УУилкоксона. Значение р 0,05 рассматривается как значительное различие между двумя группами. Результаты Аллотрансплантация почек Fisher 344 (F344RT1lv1) в Lewis (LEW, RT11) Трансплантация почек крыс линии Fisher(344) крысам линии Lewis в отсутствие иммуносупрессии приводила к появлению характерного моноядерного клеточного инфильтрата и повреждению ткани на седьмой день после операции. Гистологическое исследование выявило местный моноядерный клеточный инфильтрат во внутренней оболочке прегломерулярных артерий и тубулярной промежуточной ткани. Основной компонент интерстициального моноядерного клеточного инфильтрата состоял из клеток моноцитов/макрофагов. Степень повреждения артерий, артериол, клубочков и распространение моноядерного клеточного инфильтрата промежуточной ткани оценивали по шкале,начиная от отсутствующего (0), слабого (1),умеренного (2) до сильного (3), используя описанную ранее методику, основанную на полуколичественной морфометрии (см. Материалы и методы). Влияние Met-RANTES на этот процесс исследовали путем обработки животных с транплантатами ежедневными внутривенными инъекциями Met-RANTES в дозе 200 мкг на животное. Первоначальную инъекцию Met-RANTES проводили через 1 ч после образования васкулярного анастомоза во время операции по трансплантации. В ходе эксперимента не давали никакого дополнительного иммуносупрессивного агента. Световая микроскопия и иммуногистология не выявили выраженного эффекта обработки Met-RANTES на эндогенную почку. В ходе отторжения органа трансплантата трансплантированный орган обычно увеличивается в весе из-за воспаления. Результаты, суммированные в табл. 1, показывают, что у животных, обработанных Met-RANTES, наблюдалось статистически значимое снижение веса трансплантированного органа по сравнению с необработанными животными. Эти результаты предполагают также уменьшение Т-клеточной и 14 моноцитной инфильтрации клубочков, однако,это уменьшение нельзя считать статистически значимым (критерий суммы рангов МаннаУитни У-Уилкоксона). Наиболее выраженные эффекты обработки Met-RANTES суммированы в табл. 2. Данные демонстрируют значительное уменьшение сосудистого повреждения и показателя тубулярного отторжения у животных,обработанных с Met-RANTES, по сравнению с тем, что наблюдается у необработанных животных. В то время, как общая тенденция, касающаяся оценки интерстициального отторжения,свидетельствует о явном снижении у обработанных Met-RANTES животных, она не может рассматриваться как статистически значимая(критерий суммы рангов Манна-Уитни УУилкоксона). Для того, чтобы оценить влияние MetRANTES на процесс отторжения, исследовали гистологические срезы и иммуногистохимическую окраску. Почки удаляли через семь дней после трансплантации и препарировали, как описано в разделе Материалы и методы. В необработанных почках наблюдали сосудистое повреждение с наличием моноядерных клеток в просвете и стенке артерий. В противоположность этому, у животных, обработанныхMet-RANTES, сосудистое отторжение не обнаруживалось. В интерстициальной области у необработанных животных наблюдалась инфильтрация большого числа темноокрашенных моноядерных клеток внутри интерстиция и канальцев. Обработанные же Met-RANTES животные,напротив, демонстрировали сниженную моноядерную инфильтрацию, меньшее повреждение канальцев при хорошо очерченной красной щеточной каемкой проксимальных канальцев. Локализация RANTES мРНК крысы путем гибридизации in situ Срезы тканей, взятые от отторгающихся почек крыс линии Fisher, использовали в исследованиях по методу гибридизации in situ для того, чтобы продемонстрировать клеточную специфическую экспрессию RANTES мРНК в отторгающейся почке. Результаты были подобны тем, которые описаны ранее для экспрессииRANTES при отторжении человеческих аллотрансплантатов почки (Pattison J. et al., 1994,Wiedermann C.J. et al., 1993, Von Luettichau I.,1996). Была отмечена выраженная экспрессия инфильтрирующими моноядерными клетками и почечными канальцами и ограниченная, но идентифицируемая экспрессия некоторыми эндотелиальными клетками. Обработанные Met-RANTES животные демонстрируют снижение экспрессии мРНК провоспалительного цитокина, как определено анализом на защиту от РНКазы Повышенная экспрессия провоспалительных цитокинов, таких, как IL-1, IL-1, IL-2, IL3, IL-6, TNF, TNF и IFN, является характер 15 ной для отторжения почечного трансплантата(Nickerson P. et al., 1997, Schmouder R.L. et al.,1995, Strom Т.В. et al., 1996, Castro M.D. et al.,1998). Экспрессия этих цитокинов является показателем протекающего воспалительного процесса. Авторы исследовали влияние MetRANTES на экспрессию ряда цитокинов в трансплантированных почках крыс линииFisher, используя количественную пробу защиты от РНКазы. Образцы РНК целиком органа выделяли из нормальных контрольных почек,необработанных трансплантированных почек и трансплантированных почек, обработанныхMet-RANTES. Уровни мРНК, представляющие цитокины: IL-1, IL-1, IL-2, IL-3, IL-4, IL-5, IL6, IL-10 TNF, TNF и IFN, определяли относительно внутренних стандартов -L32 иGAPDH. Результаты показывают, что через семь дней после трансплантации в необработанных почках усиливалась регуляция мРНК, кодирующих IL-1 (в 24 раза), TNF (в 3,2 раза) иINF (в 1,7 раза), с наиболее выраженным усилением, отмеченным в случае IL-1 (в 8,4 раза) и TNF (в 4,6 раза). В этих почках в то же самое время (7 дней после трансплантации) не отмечено экспрессии мРНК, кодирующей IL-2, IL-4 или IL-5. Для соответствующих животных, обработанных Met-RANTES, показан пониженный средний уровень экспрессии IL-1 (25%), IL1 (48%), TWF (34%), TNF (24%) и INF(24%) по сравнению с необработанными животными. Трансплантация почек крыс линии Brown Norway крысам линии Lewis: эффект Met-RANTES в сочетании с низкой дозой циклоспорина А(СуА) Далее авторы расширили эксперименты для того, чтобы определить, мог бы MetRANTES служить дополнением к лечению отторжения почечного трансплантата низкими дозами циклоспорина А. Для этой процедуры авторы выбрали модель почечного трансплантата, которая могла бы дать более сильную реакцию отторжения, а именно, трансплантацию почки крысы линии Brown Norway крысе линииLewis. Двустороннюю нефрэктомию проводили во время трансплантации. Предварительно было показано, что уровень используемого циклоспорина А 2,5 мг/кг веса тела в день, введенный подкожно, не подавляет значительно отторжение почки на этой модели (Grne, неопубликованные результаты, Stojanovic Т. et al., 1996). Наконец, для того, чтобы лучше определить любое синергистическое действие, в этих экспериментах использовали сниженную дозу MetRANTES, 50 мкг/животное/день. Результаты,суммированные в табл. 3, показывают статистически значимое уменьшение поражения сосудов и канальцев, наблюдаемое у животных, обработанных Met-RANTES и низкой дозой циклоспорина А, по сравнению с животными, которые 16 получали только низкую дозу циклоспорина А. Кроме того, наблюдалось значительное уменьшение моноядерного клеточного инфильтрата в интерстициальной области. Эти гистологические наблюдения были подтверждены функциональными измерениями, в которых сывороточный креатинин был снижен у обработанныхMet-RANTES животных по сравнению с необработанными контролями (0,980,12 к 1,420,17 мг%, n=3). Прямое связывание RANTES и экспрессия адгезионной молекулы на активированном микроваскулярном эндотелии Поскольку снижение инфильтрации моноцитов в просвете сосудов является известной особенностью обработки Met-RANTES на обеих трансплантационных моделях, авторы были намерены изучить потенциальные механизмы этого эффекта. На модели роли RANTES в отторжении почечного трансплантата было сделано предположение о том, что белок RANTES, высвобождаемый активированными тромбоцитами или секретируемый местно воспаленной тканью, аккумулируется на поверхности воспаленного эндотелия, где он может поддерживать рекрутинг моноцитов (Nelson P.J. et al., 1998,Pattison J. et al., 1994, Wiedermann C.J. et al.,1993). Для того, чтобы изучить прямое связывание RANTES с микроваскулярным эндотелием,авторы исследовали способность активированного дермального микроваскулярного эндотелия(DMVEC) секвестровать белок RANTES и воспользовались модификацией метода анализа,примененного ранее для определения связывания RANTES с поверхностью эндотелия в тканевых срезах (Pattison J. et al., 1994, WiedermannC.J. et al., 1993). Моноклональное антитело VL1,конъюгированное с пероксидазой хрена (HRP),специфичное к RANTES, инкубировали с избытком белка RANTES и полученный комплекс прибавляли к покоящемуся или активированному с помощью IL-1 микроваскулярному эндотелию, выращенному в 96-ячеечном плоскодонном культуральном планшете. С использованием разновидности ELISA определяли способность клеток DMVEC связывать комплекс антиген-моноклональное антитело (mАb) при сопоставлении со связыванием только mAb. Несмотря на то, что микроваскулярный эндотелий мог бы связать некоторое количество белка RANTES без предварительной стимуляции, связывание значительно усиливалось после предварительной стимуляции с провоспалительным цитокином IL-1 (фиг. 1). Фоновое окрашивание неконъюгированного mAb на нестимулированном или активированном эндотелии было незначительным. Для дальнейшей характеристики воспалительной активации микроваскулярного эндотелия определяли поверхностную экспрессию молекул, участвующих в адгезии моноцитов, т.е. 17 Е-селектина и членов суперсемейства иммуноглобулинов ICAM-1 и VCAM-1, на клеткахDMVEC, используя ранее приведенную методику проточной цитометрии (Weber С. et аl., 1995). Анализ показал, что покоящиеся клеткиDMVEC экспрессируют существенные поверхностные уровни белка ICAM-1, однако было обнаружено небольшое количество VCAM-1 или Е-селектина (табл. 4). Активация клетокDMVEC с IL-1 в течение 12 ч привела к усилению регуляции экспрессии ICAM-1 и заметной индукции поверхностной экспрессии VCAM-1 и Е-селектина (табл. 4).Met-RANTES блокирует устойчивую адгезию моноцитов к воспаленному микроваскулярному эндотелию, но не влияет на последующие события при диапедезе В попытке понять потенциальные механизмы действия Met-RANTES авторы изучили,могла ли блокада рецепторов хемокина RANTES ингибировать устойчивую задержку и диапедез моноцитов на микроваскулярном эндотелии. С этой целью авторы использовали моноцитные клетки линии МоnоМас 6, которые обладают адгезивными характеристиками и интегриновым спектром зрелых моноцитов и экспрессируют некоторые рецепторы хемокинов,включая CCR1 (Erl W. et al., 1995). КлеткиDMVEC выращивали на чашках Петри и либо оставляли не стимулированными, либо активировали с IL-1 (5 нг/мл) в течение 12 ч. Затем микроваскулярный эндотелий тестировали в проточных камерах с параллельными стенками,где клетки МоnоМас 6 перфузировали сквозь камеру при скорости сдвига 1,5 дин/см 2 в течение 5 мин. При таких физиологических условиях тока клетки МоnоМас 6 подвергаются коротким периодам непрерывного перемещения, и притяжение части клеток может легко превратиться в устойчивую к сдвигу задержку. Через 5 мин накопления определяли число клеток МоnоМас 6, которые подверглись устойчивой адгезии к эндотелию (фиг. 2 а). Незначительное число моноцитарных клеток, устойчиво прикрепленных к нестимулированому микроваскулярному эндотелию, и предварительное воздействие на эндотелиальные клетки белка RANTES не дали значительного эффекта. Предварительная стимуляция микроваскулярного эндотелия с IL-1 привела к повышению устойчивой к сдвигу адгезии моноцитов. Ингибирование с моноклональным антителом (mAb) подтвердило выводы о том, что этот процесс опосредуется моноцитными интегринами 4 и 2, которые взаимодействуют с белками ICAM-1 и VCAM-1, соответственно, экспрессированными на активированном эндотелии (Kukerti S. et al., 1997, Luscinskas F.W. et al.,1994). В соответствии с иммобилизацией хемокина RANTES в пробах прямого связывания предварительное воздействие белка RANTES на активированный IL-1 микроваскулярный эндотелий заметно усиливало устойчивую задержку и накопление моноцитов в течение 5 мин (фиг. 2 а). Особенно примечательно, что предварительная инкубация моноцитов Met-RANTES при различных концентрациях (0,01-1 мкг/мл) полностью блокировала опосредованную RANTES устойчивую к сдвигу адгезию моноцитов на активированных IL-1 клетках DMVEC (фиг. 2 а и непредставленные данные); параллельно фракция моноцитов, непрерывно передвигающаяся по активированному микроваскулярному эндотелию, который может использоваться в качестве обратной меры устойчивой задержки клеток,уменьшилась после предварительного воздействия хемокина RANTES, но была восстановлена с помощью Met-RANTES, свидетельствуя о том,что число начальных взаимодействий с активированным эндотелием осталось неизменным. После устойчивой задержки фракция моноцитов подверглась изменению конфигурации или распластыванию, и некоторые из них в конечном итоге мигрировали в, между или под эндотелиальные клетки. Однако RANTES или MetRANTES не изменяли распластывание или трансмиграцию (фиг. 2 б), предполагающих включение других сигналов. Таким образом, эти результаты указывают на то, что Met-RANTES может снижать рекрутинг моноцитов при отторжении трансплантата почки, блокируя задержку моноцитов в воспаленном микроваскулярном эндотелии. Таблицы Таблица 1 Почки крыс линии Fisher, трансплантированные крысам линии Lewis. Количество моноцитов/макрофагов и Т-клеток в сплетениях капилляров клубочков рассчитывали как среднее значение соответствующих количеств во всех клубочках в одном срезе почки. Контроль(n=9) Вес тела (г) 211,85,15 1955,98 Вес трансплантата почки 1,410,048 1,150,08 Вес эндогенной почки 0,910,04 0,80,04 Т-клетки в клубочках 3,980,81 2,750,45 Макрофаги в клубочках 9,161,69 5,980,87 Указывает значимое (р 0,05) различие между испытуемыми группами. Таблица 2 Почки крыс линии Fisher, трансплантированные крысам линии Lewis. Краткое изложение результатов гистологического и иммуногистологического анализа влияния Met-RANTES на повреждение сосудов и интерстициальный моноядерный инфильтрат Сосудистое повреждение Повреждение канальцев КонтрольMet-RANTES Стадия 0 50,67 9,02 85,52,66 15,566,03 46,0012,15 Стадия 1 40,44 5,5 12,84,17 32,228,25 30,006,06 Стадия 2 4,442,22 0,90,6 20,565,68 13,004,1 Стадия 3 5,555,55 00,0 31,6714,19 8,507,46 Показатель 62,6718,64 16,15,2 33,006,44 15,705,22 Указывает на значимое (р 0,05) различие между испытуемыми группами Таблица 3 Почки крыс линии Brown-Norway, трансплантированные крысам линии Lewis. Краткое изложение результатов гистологического анализа влияния Met-RANTES на повреждение сосудов и канальцев и интерстициальный моноядерный инфильтрат в присутствии низкой дозы циклоспорина А. Оценка Циклоспорин, Циклоспорин, 2,5 мг/кг 2,5 мг/кг веса веса тела/день + Metтела/деньRANTES, 50 мкг/день Повреждение сосудов 60,71,8 13,77,5 Повреждение ка 124,328,7 28,314,8 нальцев Интерстициальное 157,321,3 716,1 воспалениеУказывает на значимое (р 0,05) различие между испытуемыми группами. Таблица 4 Влияние IL-1 на поверхностную экспрессию молекул адгезии в человеческих микроваскулярных эндотелиальных клетках. КлеткиDMVEC активировали IL-1 (5 нг/мл) или оставляли необработанными (контроль) в течение 12 ч и вводили в реакцию с белками ICAM-1,VCAM-1, Е-селектином или изотипическими контрольными моноклональными антителами. Поверхностную экспрессию белка анализировали с помощью FACS в трех независимых экспериментах и после коррекции на неспецифическое связывание в каналах представляли в виде среднего значения специфической интенсивности флуоресценции (SMFI).Cancer, 41,456-461, 1988. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение антагониста хемокинового рецептора в комбинации с циклоспорином с целью получения фармацевтической композиции для лечения или профилактики отторжения трансплантированных органов, тканей или клеток. 2. Применение по п.1, отличающееся тем,что антагонист хемокинового рецептора и циклоспорин используются одновременно, раздельно или последовательно. 3. Применение по любому из предшествующих пунктов, отличающееся тем, что антагонистом хемокинового рецептора является усеченный по N-концу хемокин. 4. Применение по п.1 или 2, отличающееся тем, что антагонистом хемокинового рецептора является удлиненный по N-концу RANTES. 5. Применение по п.1 или 2, отличающееся тем, что антагонистом хемокинового рецептора является Met-RANTES. 6. Применение по любому из предшествующих пунктов, отличающееся тем, что циклоспорин выбирают из циклоспорина А, а также его метаболитов и синтетических аналогов. 7. Применение по любому из предшествующих пунктов, отличающееся тем, что циклоспорином является циклоспорин А. 22 8. Применение по любому из предшествующих пунктов для лечения или профилактики отторжения аллотрансплантата почки. 9. Фармацевтическая композиция, включающая антагонист хемокинового рецептора и циклоспорин в присутствии одного или более фармацевтически приемлемых наполнителей, для лечения или профилактики отторжения трансплантированных органов, тканей или клеток. 10. Фармацевтическая композиция, включающая антагонист хемокинового рецептора и циклоспорин в присутствии одного или более фармацевтически приемлемых наполнителей, для одновременного, раздельного или последовательного применения его активных ингредиентов для лечения или профилактики отторжения трансплантированных органов, тканей или клеток. 11. Фармацевтическая композиция по п.9 или 10, отличающаяся тем, что антагонистом хемокинового рецептора является усеченный по Nконцу хемокин. 12. Фармацевтическая композиция по п.9 или 10, отличающаяся тем, что антагонистом хемокинового рецептора является удлиненный по Nконцу RANTES. 13. Фармацевтическая композиция по п.9 или 10, отличающаяся тем, что антагонистом хемокинового рецептора является Met-RANTES. 14. Фармацевтическая композиция по любому из пп.9-13, отличающаяся тем, что циклоспорин выбирают из циклоспорина А, а также его метаболитов или синтетических аналогов. 15. Фармацевтическая композиция по любому из пп.10-14, отличающаяся тем, что циклоспорином является циклоспорин А. 16. Фармацевтическая композиция по любому из пп.9-15 для лечения или профилактики отторжения аллотрансплантата почки.
МПК / Метки
МПК: A61K 38/13, A61K 38/19
Метки: циклоспорин, терапии, рецептора, комбинированной, антагонист, хемокинового
Код ссылки
<a href="https://eas.patents.su/12-3181-antagonist-hemokinovogo-receptora-i-ciklosporin-v-kombinirovannojj-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонист хемокинового рецептора и циклоспорин в комбинированной терапии</a>
Предыдущий патент: Прокладочная шайба и композитная пленка для закрытия емкости
Следующий патент: Универсальная плазма крови
Случайный патент: Способ получения полиморфной формы i эторикоксиба