Антагонисты прогестеронового рецептора
Номер патента: 17038
Опубликовано: 28.09.2012
Авторы: Шмидт Аня, Шултце-Мосгау Маркус, Петров Орлин, Хассельманн Райнер, Роттманн Антье, Клеве Арвед, Мёллер Карстен, Брудни-Клёппель Маргарете, Прюс Штефан, Фурманн Ульрике, Гарке Гуннар
Формула / Реферат
1. Антагонист прогестеронового рецептора общей формулы I
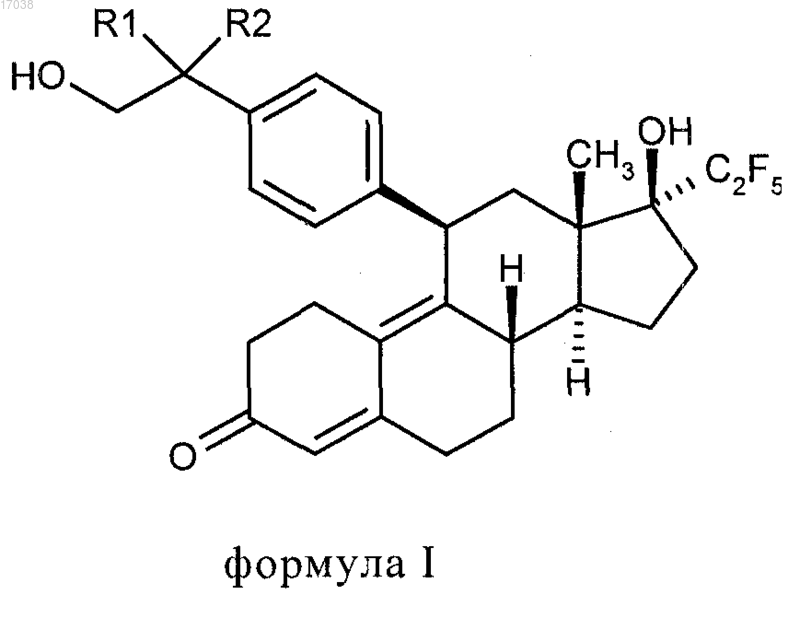
в которой R1 может быть атомом водорода и R2 гидроксильной группой или R1 и R2 вместе могут быть оксогруппой.
2. Антагонист прогестеронового рецептора общей формулы I по п.1, который представляет собой 11β-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17α-прегна-4,9-диен-3-он.
3. Антагонист прогестеронового рецептора общей формулы I по п.1, который представляет собой 11β-[4-[(1R)-1,2-дигидроксиэтил]фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17α-прегна-4,9-диен-3-он.
4. Антагонист прогестеронового рецептора общей формулы I по п.1, который представляет собой 20,20,21,21,21-пентафтор-17-гидрокси-11β-[4-(гидроксиацетил)фенил]-19-нор-17α-прегна-4,9-диен-3-он.
5. Лекарственное средство, содержащее антагонисты прогестеронового рецептора по п.1.
6. Лекарственное средство по п.5, содержащее 11β-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17α-прегна-4,9-диен-3-он.
7. Лекарственное средство по п.6, содержащее 11β-[4-[(1R)-1,2-дигидроксиэтил]фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17α-прегна-4,9-диен-3-он.
8. Лекарственное средство по п.5, содержащее 20,20,21,21,21-пентафтор-17-гидрокси-11β-[4-(гидроксиацетил)фенил]-19-нор-17α-прегна-4,9-диен-3-он.
9. Применение антагонистов прогестеронового рецептора по п.1 для получения лекарственного средства для лечения эндометриоза, миом или гормонозависимых опухолей и фармацевтических препаратов для женской контрацепции.
10. Применение антагонистов прогестеронового рецептора по п.9 для получения лекарственного средства для лечения карциномы молочной железы.
11. Применение по п.10, включающее 11β-[4-(1,2-дигидроксиэтил)фенил]-17β-гидрокси-17α-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он.
12. Применение по п.11, включающее 11β-[4-[(1R)-1,2-дигидроксиэтил]фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17α-прегна-4,9-диен-3-он.
13. Применение по п.10, включающее 20,20,21,21,21-пентафтор-17-гидрокси-11β-[4-(гидроксиацетил)фенил]-19-нор-17α-прегна-4,9-диен-3-он.
14. 11β-(4-Этенилфенил)-20,20,21,21,21-пентафтор-5,17-дигидрокси-19-нор-5α,17α-прегн-9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь в качестве интермедиата при получении антагониста прогестеронового рецептора общей формулы I.
15. 11β-[4-(1,2-Дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-5,17-дигидрокси-19-нор-5α,17α-прегн-9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь в качестве интермедиата при получении антагониста прогестеронового рецептора общей формулы I.
16. 20,20,21,21,21-Пентафтор-17-гидрокси-5,10α-эпокси-19-нор-5α,17α-прегн-9-(11)-ен-3-он 2,2-диметилпропан-1,3-диилкеталь в качестве интермедиата при получении антагониста прогестеронового рецептора общей формулы I.
17. 11β-{4-[(4R)-2,2-Диметил-1,3-диоксолан-4-ил]фенил}-20,20,21,21,21-пентафтор-5,17-дигидрокси-19-нор-5α,17α-прегн-9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь в качестве интермедиата при получении антагониста прогестеронового рецептора общей формулы I.
18. 11β-[4-[2-[[[(1,1-Диметилэтил)диметилсилил]окси]метил]-1,3-диоксолан-2-ил]фенил]-20,20,21,21,21-пентафтор-5,17-дигидрокси-19-нор-5α,17α-прегн-9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь в качестве интермедиата при получении антагониста прогестеронового рецептора 20,20,21,21,21-пентафтор-17-гидрокси-11β-[4-(гидроксиацетил)фенил]-19-нор-17α-прегна-4,9-диен-3-она.
19. 20,20,21,21,21-Пентафтор-5,17-дигидрокси-11β-[4-[2-(гидроксиметил)-1,3-диоксолан-2-ил]фенил]-19-нор-5α,17α-прегн-9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь в качестве интермедиата при получении антагониста прогестеронового рецептора 20,20,21,21,21-пентафтор-17-гидрокси-11β-[4-(гидроксиацетил)фенил]-19-нор-17α-прегна-4,9-диен-3-она.
20. Соединение по любому из пп.1-4 в изолированной форме.
21. Соединение по п.20 в твердой форме.
22. Соединение по п.3, когда оно в значительной степени свободно от 11β-[4-[(1S)-1,2-дигидроксиэтил]фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17α-прегна-4,9-диен-3-она.
23. Лекарственное средство по любому из пп.5-8, пригодное для перорального введения в виде единичной дозированной формы.
24. Лекарственное средство по п.23 в виде единичной дозированной формы.
25. Лекарственное средство по любому из пп.5-8, которое содержит от 0,01 до 100 мг соединения по п.1.
Текст
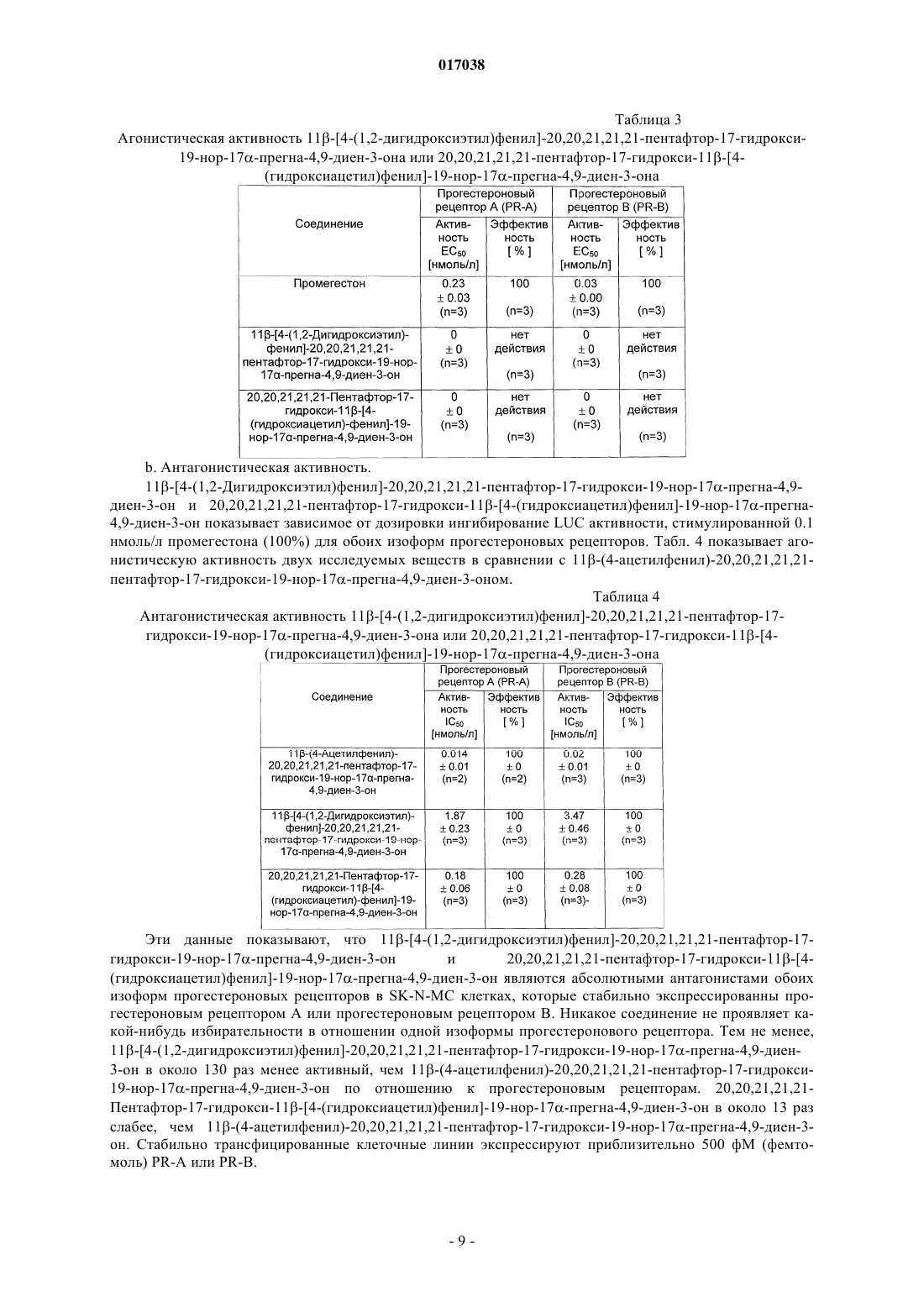
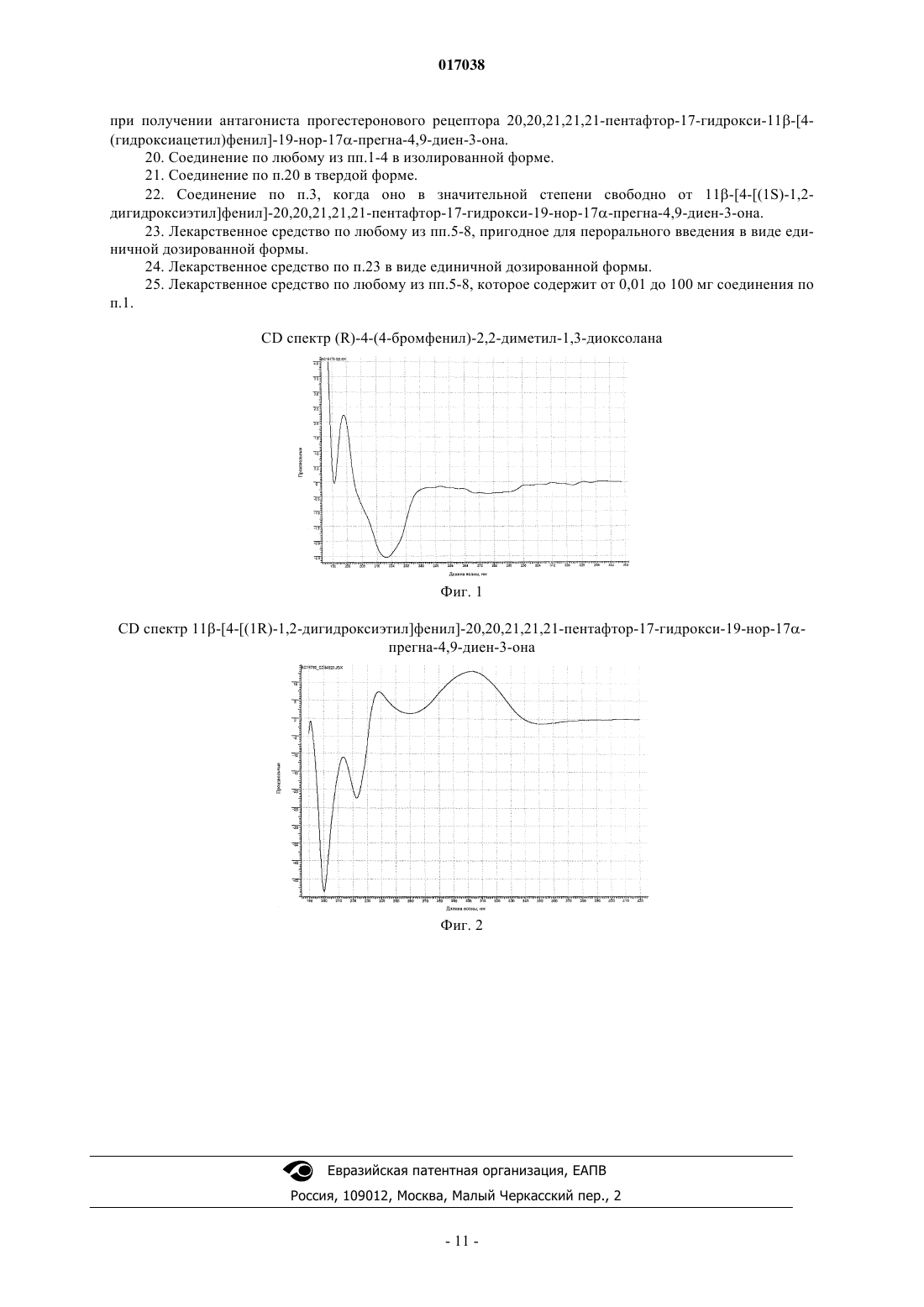
Изобретение относится к антагонистам прогестеронового рецептора общей формулы I в которой R1 может быть атомом водорода и R2 гидроксильной группой или R1 и R2 вместе могут быть оксогруппой.(71)(73) Заявитель и патентовладелец: БАЙЕР ШЕРИНГ ФАРМА АКЦИЕНГЕЗЕЛЬШАФТ (DE) 017038 Настоящее изобретение относится к антагонистам прогестеронового рецептора общей формулы I в которой R1 может быть атомом водорода и R2 гидроксильной группой или R1 и R2 вместе могут быть оксогруппой, к лекарствам (фармацевтическим композициям), содержащим их, и к их применению в производстве лекарственных средств. Изобретение относится в особенности к антагонистам прогестеронового рецептора 11-[4-(1,2 дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-ону и его отдельным эпимерам 11-[4-[(1R)-1,2-дигидроксиэтил]фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19 нор-17-прегна-4,9-диен-3-ону,11-[4-[(1S)-1,2-дигидроксиэтил]фенил]-20,20,21,21,21-пентафтор-17 гидрокси-19-нор-17-прегна-4,9-диен-3-ону, 20,20,21,21,21-пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-ону, к лекарствам, содержащим их, и к их применению в производстве лекарственных средств. Предпочтительным соединением этого изобретения является 20,20,21,21,21-пентафтор-17 гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-он. Соединения с антигестагенной активностью (конкурентные антагонисты прогестеронового рецептора) впервые стали известными в 1982 (RU 486; ЕР 57115) и с тех пор были очень хорошо описаны. Стероиды с антигестагенной активностью, которые отличаются от веществ согласно изобретению и имеют фторированную боковую цепь 17, были опубликованы в WO 98/34947 и Fuhrmann et al., J. Med. Chem. 43, 5010-5016 (2000). Класс соединений, раскрытый в WO 98/34947, допускает множество различных заместителей в положении-11 стероидного ядра, но не распространяется на дизамещенные алкилфенильные группы. ЕР 57115 предоставляет ряд заместителей в положении 11 стероидного ядра, но при этом требуется, чтобы такие заместители содержали атом азота, фосфора или кремния. Следовательно, не существует предположения, что фторсодержащие стероиды, имеющие заместитель в положении 17 и дизамещенный алкилфенильный заместитель в положении 11 стероидного ядра, могут обладать желаемыми свойствами. Вещества, заявленные здесь, представляют собой, по крайней мере частично, метаболиты вещества,заявленного в WO 98/34947. Задача настоящего изобретения состоит в том, чтобы предоставить новые конкурентные антагонисты прогестеронового рецептора и лекарства, содержащие их, и, следовательно, создать альтернативные пути лечения гинекологических заболеваний. Эта задача была достигнута при помощи синтеза 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21 пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-она и 20,20,21,21,21-пентафтор-17-гидрокси-11[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-она. Эпимеры 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-она могут быть отдельно получены или способами хроматографического разделения на Chiracel OD-H колонке со смесью гексан/этанол 90:10 (об./об.) как подвижная фаза, или исходя из хиральных исходных соединений, таких как(R)- или (S)-1-(4-бромфенил)-1,2-этандиол. Поэтому подходящими соединениями этого изобретения являются те, которые были получены химическими путями. Соответствующим образом изобретение предоставляет дигидроксисоединение этого изобретения,по большей части свободное от его изомера, то есть когда по крайней мере 90%, более точно по крайней мере 95%, предпочтительно по крайней мере 98% и наиболее предпочтительно 100% свободно от соответствующего изомера. Поскольку соединения изобретения должны применяться в фармацевтических композициях, предпочтительно обеспечить тогда изолированную форму, например, в виде порошка, точнее в виде в большой степени чистого порошка, например, в большой степени свободного от других стероидных соединений или других биологически активных агентов. Вещества общей формулы I представляют собой ценные фармацевтически активные компоненты. Они могут использоваться среди прочего для производства фармацевтических препаратов для лечения миом или эндометриоза, для женской контрацепции, для посткоитального регулирования рождаемости,для вызывания менструации, для вызывания родовой деятельности, для гормонозаместительной терапии,для лечения симптомов, связанных с дисменореей, для лечения гормональных нарушений и для лечения-1 017038 гормонозависимых опухолей, например прогестероновой рецептор-положительной карциномы молочной железы. Их эффективность в качестве антагонистов прогестеронового рецептора определяли в абортированном тесте на крысах и при помощи определения индекса McPhail на кроликах. Вещества общей формулы I показывают более высокую метаболическую стабильность в человеческих микросомах печени (HLM), чем антагонист прогестеронового рецептора 11-(4-ацетилфенил)20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-он, раскрытый в WO 98/34947. Это видно из улучшенной пероральной биологической доступности соединений этого изобретения так, что они могут применяться в фармацевтических композициях, пригодных для перорального введения. Лекарства (фармацевтические композиции) согласно изобретению могут быть пригодны для системного или местного введения. Как правило, предпочтительно приспособить лекарства для системного введения, например, путем инъекции или путем перорального введения. Если предполагается инъецируемая форма, они могут быть получены обычными способами, известными в уровне техники, для получения стероидов. Если предполагаются перорально вводимые формы, они также могут быть получены обычными способами, известными в фармацевтическом уровне техники, для получения стероидов. Предпочтительные формы лекарств будут включать соединения формулы I и фармацевтически приемлемый носитель соответственно. Фармацевтическая композиция изобретения может быть представлена в форме, подходящей для системного или местного введений, из которых системно вводимая форма в общем является самой подходящей. Системно вводимая форма может быть пригодна для введения путем инъекции, например, в виде стерильной формы, например эмульсии. Системно вводимая форма может быть пригодна для перорального введения и такие формы в общем являются самыми подходящими. Такие формы, как правило,должны быть единичной дозированной формой, содержащей заданное количество соединения изобретения. Подходящие формы включают таблетки, желатиновые капсулы, порошки, гранулят и т.п., из которых, как правило, являются предпочтительными таблетки. Такие дозированные формы могут быть произведены обычным способом, и фармацевтически приемлемым носителем может быть любой подходящий носитель, особенно носитель, известный для использования в препаратах стероидных лекарственных средств. Единичная дозированная форма может содержать 0,01-100 мг заявленных веществ. Примеры, которые следуют далее, служат иллюстрацией изобретения, ни в коей мере его не ограничивая. Пример 1. Синтез 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19 нор-17-прегна-4,9-диен-3-она. а. 11-(4-Этенилфенил)-5-гидрокси-5-эстр-9-ен-3,17-дион 3-(2,2-диметилпропан-1,3-диил)кеталь. 3.3 г магниевой стружки помещали в 14 мл абсолютного тетрагидрофурана в атмосфере инертного газа и прибавляли одну каплю 1,2-дибромэтана. После начала реакции медленно прибавляли по каплям раствор 25 г 4-бромстирола в 137 мл абсолютного тетрагидрофуран так, чтобы температура внутри сохранялась в интервале от 40 до 45 С. Реакционную смесь затем перемешивали 1 ч до тех пор, пока магний полностью не прореагирует. Затем к смеси прибавляли 2.26 г хлорида меди(I). Медленно прибавляли по каплям раствор 8.5 г 5,10-эпокси-5,10-эстр-9-(11)-ен-3,17-дион 3-(2,2-диметилпропан-1,3 диил)кеталя (для получения см. также Tetrahedron Lett. 26, 2069-2072 (1985 в 137 мл абсолютного тетрагидрофурана. Реакционную смесь перемешивали 1 ч при комнатной температуре и затем выливали в насыщенный водный раствор хлористого аммония. Водную фазу экстрагировали этилацетатом и органические фазы объединяли, промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Продукт фильтровали и концентрировали в вакууме. Колоночная хроматография на силикагеле смесью гексан/этилацетат дает 6.76 г названного соединения в виде бесцветной пены. 1 Н-ЯМР (300 МГц, CDCl3):7.30 d (J=9 Гц, 2 Н, арил); 7.18 d (J=9 Гц, 2 Н, арил); 6.66 dd (J=17 Гц + 11 Гц, 1 Н, винил); 5.70 dbr (J=17 Гц, 1 Н, винил); 5.20 dbr (J=11 Гц, 1 Н, винил); 4.44 s (1 Н, 5-ОН); 4.29 dbrb. 11-(4-Этенилфенил)-20,20,21,21,21-пентафтор-5,17-дигидрокси-19-нор-5,17-прегн-9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь. Раствор 6.76 г соединения, полученного выше в а, в 140 мл абсолютного толуола прибавляли при-78 С к 27.9 г сконденсированного пентафторйодэтана в 140 мл абсолютного толуола. Прибавляли 66.3 мл 1.5-молярного раствора комплекса метиллитий/бромид лития в диэтиловом эфире при этой температуре. Реакционную смесь затем перемешивали 1 ч при 0 С. Смесь затем выливали в насыщенный водный раствор хлористого аммония. Продукт экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали в вакууме. Хроматография полученного сырого продукта на силикагеле смесью гексан/этилацетат дает 3.73 мг названного соединения в виде белой пены. 1 Н-ЯМР (300 МГц, CDCl3):7.30 d (J=9 Гц, 2 Н, арил); 7.17 d (J=9 Гц, 2 Н, арил); 6.67 dd (J=17 Гц + 11 Гц, 1 Н, винил); 5.71 dbr (J=17 Гц, 1 Н, винил); 5.20 dbr (J=11 Гц, 1 Н, винил); 4.45 s (1 Н, 5-ОН); 4.31 dbrc. 11-[4-(1,2-Дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-5,17-дигидрокси-19-нор-5,17 прегн-9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь. 1.68 мл водного буферного раствора с рН 7.00 на основе дигидрофосфата калия и гидрофосфата дикалия и 206 мг триметиламин N-оксида прибавляли к раствору 1 г соединения, полученного согласно примеру 1b в 8.4 мл тетрагидрофурана. По каплям при 0 С прибавляли 4.3 мл раствора 250 мг тетроксида осмия в 50 мл бутанола. Реакционную смесь перемешивали 3 ч при комнатной температуре и затем выливали в насыщенный водный раствор тиосульфата натрия. Продукт экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали в вакууме. Хроматография полученного сырого продукта на силикагеле смесью гексан/этилацетат дает 860 мг названного соединения в виде белой пены. Получили смесь эпимеров бензилкарбинола. 1 Н-ЯМР (300 МГц, CDCl3):7.25 d (J=9 Гц, 2 Н, арил); 7.20 d (J=9 Гц, 2 Н, арил); 4.78 m (1 Н, СНОН); 4.44 s (1 Н, 5-ОН); 4.32 dbr (J=6.5 Гц, 1 Н, Н-11); 3.73 m (1 Н, СН 2 ОН); 3.65 m (1 Н, СН 2 ОН); 3.54 m (2 Н, 3 кеталь); 3.52 m (J=11.0 Гц, 1 Н, 3-кеталь); 3.44 m (J=11.0 Гц, 1 Н, 3-кеталь); 1.04 s (3 Н, 3-кеталь); 0.87 sd. 11-[4-(1,2-Дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна 4,9-диен-3-он. 200 мг соединения, описанного выше в примере 1 с, перемешивали в 3 мл метанола в 141 мкл полуконцентрированной водной серной кислоты в течение 1 ч при комнатной температуре. Смесь затем выливали в насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия,фильтровали и концентрировали в вакууме. Колоночная хроматография на силикагеле смесью гексан/этилацетат дает 78 мг названного соединения в виде бесцветной пены. Получили смесь эпимеров бензилкарбинола. 1 Н-ЯМР (300 МГц, CDCl3):7.25 d (J=9 Гц, 2 Н, арил); 7.15 d (J=9 Гц, 2 Н, арил); 5.77 s (1 Н, Н-4); 4.74 m (1 Н, СНОН); 4.42 dbr (J=7 Гц, 1 Н, Н-11); 3.69 m (1 Н, СН 2 ОН); 3.59 m (1H, СН 2 ОН); 0.56 s (3 Н, Н 18). Пример 2. Синтез 11-[4-[(1R)-1,2-дигидроксиэтил]фенил]-20,20,21,21,21-пентафтор-17-гидрокси 19-нор-17-прегна-4,9-диен-3-она. 17.0 г карбоната калия и 40.4 г гексацианоферрата(III) калия растворяли в смеси 190 мл н-бутанола и 190 мл воды. Затем прибавляли 30 мг осмата и 300 мг (DHQD)-2PHAL и раствор охлаждали до 0 С. Затем при 0 С прибавляли 7.5 г 4-бромстирола и смесь перемешивали всю ночь. Смесь обрабатывали прибавлением 30 г сульфита натрия. Реакционный раствор экстрагировали 300 мл этилацетата. Органическую фазу сушили над сульфатом натрия и концентрировали с получением 7.3 г белого порошка. Выход: 7.3 г = 82.1% от теории. 1 Н-ЯМР (300 МГц, CDCl3):7.50 d (J=9 Гц, 2 Н, арил); 7.25 d (J=9 Гц, 2 Н, арил); 4.80 dd (J=4.4 Гц + 3.6 Гц, 1 Н); 3.70 m (2H); 2.50 sbr (2H, ОН). Данные ЯМР продукта находятся в соответствии с данными ЯМР, описанными в литературе (Т. 3.5 г диола, описанного в примере 2 а, суспендировали в 100 мл ацетона. Прибавляли 30 мл 2,2 диметоксипропана и 0.3 мл концентрированной серной кислоты. Через 2 ч к реакционной смеси прибавляли 100 мл насыщенного раствора бикарбоната натрия и продукт экстрагировали три раза 50 мл этилацетата. Органические фазы сушили над сульфатом натрия и концентрировали в вакууме с получением 3.7 г белого порошка. Фиг. 1 показывает CD спектр (R)-4-(4-бромфенил)-2,2-диметил-1,3-диоксолана. Выход: 3.7 г=58.8% от теории. 1 Н-ЯМР (400 МГц, CDCl3):7.48 d (J=9 Гц, 2 Н, арил); 7.25 d (J=9 Гц, 2 Н, арил); 5.04 dd (J=9 Гц + 8.2 Гц, 1 Н); 4.30 dd (J=9 Гц + 8.2 Гц, 1 Н); 3.16 dd (J=9 Гц + 9 Гц, 1 Н); 1.53 s (3 Н); 1.48 s (3 Н). 2,2 50 г 5,10-эпокси-5,10-эстр-9-(11)-ен-3,17-дион 3-(2,2-диметилпропан-1,3-диил)кеталя (для получения см. также Tetrahedron Lett. 26, 2069-2072 (1985 прибавляли при -70 С к 116 г сконденсированного пентафторйодэтана в 500 мл абсолютного толуола. Прибавляли 290 мл 1.5-молярного раствора комплекса метиллитий/бромид лития в диэтиловом эфире при этой же температуре. Реакционную смесь затем перемешивали 1 ч при 0 С. Смесь затем прибавляли к насыщенному водному раствору хлористого аммония и экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали в вакууме. Сырой продукт растворяли в 200 мл ацетона и прибавляли 450 мл воды. Продукт, который выпадал, отфильтровывали и сушили в вакууме. Выход: 61.6 г (93% от теории). 1 Н-ЯМР (500 МГц, CDCl3):6.04 brd (J=2.5 Гц, 1 Н, винил); 3.60 d (J=11.3 1 Н); 3.46 d (J=11.3 Гц); 3.39 dd (J=11.3 Гц + 9.5 Гц, 1 Н); 2.51 dbr (J=10.6 Гц, 1 Н); 1.06 s (3 Н); 0.93 s (3 Н); 0.85 s (3 Н). 387 мг магниевой стружки суспендировали в 3 мл THF и при перемешивании прибавляли 50 мкл дибромэтана. Раствор 4.35 г кеталя, описанного в примере 2b, в 16 мл THF медленно прибавляли к суспензии при 65 С. Полученный раствор охлаждали до 0 С. Прибавляли 21.5 мг CuCl и 2.75 г соединения,полученного в примере 2 с, в 11 мл THF. Реакционную смесь перемешивали 2 ч при 20 С и затем прибавляли 28 мл 10-процентного раствора NH4Cl. Реакционную смесь экстрагировали 20 мл МТВ эфира. Органическую фазу концентрировали и полученный порошок (5.9 г) очищали хроматографией на 120 г силикагеля, смесью гексан/этилацетат как подвижная фаза, с получением 3.2 г продукта в виде белого порошка. Выход: 3.2 г=85% от теории. 1 Н-ЯМР (600 МГц, CDCl3):7.23 d (J=9 Гц, 2 Н, арил); 7.20 d (J=9 Гц, 2 Н, арил); 5.03 dd (J=9 Гц + 8.4 Гц, 1 Н); 4.46 s (1 Н, ОН); 4.33 dbr (J=6.5 Гц, 1 Н); 4.27 dd (J=9 Гц + 8.4 Гц, 1 Н); 3.68 dd (J=9 Гц + 9 Гц,1 Н); 1.56 s (3H); 1.49 s (3H); 1.07 s (3 Н); 0.86 s (3 Н); 0.50 s (3 Н). е. 11-[4-[(1R)-1,2-Дигидроксиэтил]фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17 прегна-4,9-диен-3-он 2.5 г соединения, описанного выше в примере 2d, растворяли в 20 мл THF, прибавляли 2.5 мл полуконцентрированной водной серной кислоты и реакционную смесь перемешивали 3 ч при 20 С. Смесь затем выливали в 60 мл насыщенного водного раствора гидрокарбоната натрия и экстрагировали этилацетатом. Очистка при помощи колоночной хроматографии на силикагеле смесью дихлорметан/ацетон дает 1.2 г названного соединения в виде бесцветной пены. Фиг. 2 показывает CD спектр 11-[4-[(1R)-1,2 дигидроксиэтил]фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-она. Выход: 1.2 г=61.2% от теории. Н-ЯМР (300 МГц, CDCl3):7.25 d (J=9 Гц, 2 Н, арил); 7.15 d (J=9 Гц, 2 Н, арил); 5.77 s (1 Н, Н-4); 4.74 m (1 Н, СНОН); 4.42 dbr (J=7 Гц, 1 Н, Н-11); 3.69 m (1 Н, СН 2 ОН); 3.59 m (1H, СН 2 ОН); 0.56 s (3 Н, Н 18). Пример 3 а. Синтез 20,20,21,21,21-пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор 17-прегна-4,9-диен-3-она. а. 20,20,21,21,21-Пентафтор-11-[4-(гидроксиацетил)фенил]-5,17-дигидрокси-19-нор-5,17-прегн 9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь. При комнатной температуре по каплям к 3.6 мг триоксида хрома в 7 мл дихлорметана прибавляли 283 мкл трет-бутил гидропероксида. Затем прибавляли по каплям раствор 450 мг соединения, полученного выше в примере 1 с, в 7 мл дихлорметана. Смесь перемешивали 3 ч при комнатной температуре. Реакцию останавливали прибавлением диметилсульфида. Смесь промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали в вакууме. Хроматография полученного сырого продукта на силикагеле смесью гексан/этилацетат дает 87 мг названного соединения в виде белой пены. 1 Н-ЯМР (300 МГц, CDCl3):7.83 d (J=9 Гц, 2 Н, арил); 7.37 d (J=9 Гц, 2 Н, арил); 4.84 m (2 Н,СН 2 ОН); 4.37 dbr (J=6.5 Гц, 1 Н, Н-11); 3.53 m (2 Н, 3-кеталь); 3.47 m (J=11.0 Гц, 1 Н, 3-кеталь); 3.42 mb. 20,20,21,21,21-Пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9 диен-3-он. Аналогично способу, описанному в примере 1d, 87 мг соединения, описанного выше в 3 а, взаимодействует в 1.4 мл метанола в 62 мкл полуконцентрированной водной серной кислоты с получением 25 мг названного соединения в виде бесцветной пены. 1 Н-ЯМР (300 МГц, CDCl3):7.86 d (J=9 Гц, 2 Н, арил); 7.34 d (J=9 Гц, 2 Н, арил); 5.81 s (1 Н, Н-4); 4.85 dbr (J=5 Гц, 2 Н, СН 2 ОН); 4.50 dbr (J=7 Гц, 1 Н, Н-11); 3.50 tbr (J=5 Гц, 1 Н, ОН); 0.57 s (3 Н, Н-18). Пример 3b. Альтернативный синтез 20,20,21,21,21-пентафтор-17-гидрокси-11-[4(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-она. а. 2-(4-Бромфенил)-1,3-диоксолан-2-ил]метокси]-(1,1-диметилэтил)диметилсилан 73.5 г 2-(4-бромфенил)-1,3-диоксолан-2-метанола растворяли в 800 мл N,N-диметилформамида. Прибавляли 38.6 г имидазола и 51.3 г трет-бутилдиметилхлорсилана. Смесь перемешивали 12 ч при 23 С. После этого реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия. Смесь перемешивали дополнительно 30 мин, затем смесь дважды экстрагировали этилацетатом. Объединенные органические слои промывали рассолом и сушили над сульфатом натрия. Сырой продукт очищали колоночной хроматографией. Получали 103.21 г продукта (97.5% от теории). 1 Н-ЯМР (300 МГц, CDCl3):7.45 d (J=9 Гц, 2H, арил); 7.37 d (J=9 Гц, 2 Н, арил); 4.08 m (2H, кеталь); 3.84 m (2H, кеталь); 0.83 s (9H, t-бутил-Si); -0.05 s (6 Н, Me-Si). 0.3 мл дибромэтана прибавили к суспензии 6.22 г магниевой стружки в 80 мл THF. После этого медленно прибавили раствор 95.5 г 3b.a в 900 мл THF. Температуру поддерживали ниже 50 С. После этого смесь перемешивали при 50 С в течение 1 ч. Затем реакционную смесь охлаждали до 0 С и прибавили 400 мг CuCl. После продолжения перемешивания в течение дополнительных 10 мин при 0 С прибавили раствор 20 г соединения, описанного выше в 2 с, в 200 мл THF. Смесь перемешивали 2 ч при 0 С и затем давали нагреться до 23 С. Перемешивание продолжили в течение дополнительных 12 ч при 23 С. Затем реакционную смесь выливали в насыщенный раствор хлористого аммония. Смесь перемешивали дополнительные 30 мин и после этого ее экстрагировали этилацетатом 3 раза. Объединенные органические слои промывали рассолом и сушили над сульфатом натрия. Сырой продукт очищали колоночной К раствору 470 мг соединения 3b.b в 5 мл THF прибавили тетрабутиламмонийфторид (0.6 мл 1 молярного раствора в THF). Смесь перемешивали 2 ч при 23 С. Затем реакционную смесь выливали в насыщенный раствор хлористого аммония. Смесь перемешивали дополнительные 30 мин и после этого ее экстрагировали этилацетатом. Органический слой промывали рассолом и сушили над сульфатом натрия. Сырой продукт очищали колоночной хроматографией. Получали 318 мг продукта (80% от теории). 1 Н-ЯМР (300 МГц, CDCl3):7.34 d (J=9 Гц, 2 Н, арил); 7.18 d (J=9 Гц, 2 Н, арил); 4.44 s (1 Н, ОН); 4.30 dbr (J=6.5 Гц, 1 Н, Н-11); 4.10 m (2H, кеталь); 3.88 m (2 Н, кеталь); 3.70 m (4H, кеталь); 3.50 m (2H); 1.02 s (3 Н); 0.88 s (3 Н); 0.50 s (3 Н). К раствору 15 г соединения, описанного выше в примере 3b.b, 150 мл THF прибавляли 15 мл полуконцентрированной водной серной кислоты. Смесь перемешивали 2.5 ч при 23 С. После этого реакционную смесь выливали в насыщенный водный раствор гидрокарбоната натрия. Смесь перемешивали дополнительные 30 мин и после этого экстрагировали этилацетатом. Органический слой промывали рассолом и сушили над сульфатом натрия. Сырой продукт очищали колоночной хроматографией. Получали 7.99 г продукта (80% от теории).d. 20,20,21,21,21-Пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9 диен-3-он из 3b.c. Взаимодействие 300 мг 3b.c с полуконцентрированной водной серной кислотой в THF аналогично способу, описанному выше в примере 3d, дает 198 мг (85% от теории) продукта. Пример 4. Абортирование на самках крыс. Антигестагенное действие антагонистов прогестеронового рецептора согласно изобретению тестировалось на беременных крысах (6 крыс в группе) на 5 и 7 дни после спаривания в стандартных жилищных и питательных условиях. После успешного спаривания беременных животных (присутствие спермы в мазке из влагалища в 1 день беременности=d1 p.с.) случайно отбирали и делили на группу обработки и контрольную группу. Каждому животному затем вводили подкожно 1.5 мг/кг исследуемого вещества (11-[4-(1,2 дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-она согласно примеру 1 или 20,20,21,21,21-пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17 прегна-4,9-диен-3-она согласно примеру 3) или 1.0 мл/кг наполнителя (бензилбензоат/касторовое масло: 1+4 [об./об.]) ежедневно с 5 по 7 день (d5-d7 p.с.). Вскрытие осуществляли на 9 день (d9 p.с.). Как характеристику антигестагенного действия, матка исследовалась на наличие имплантационных сайтов. Полное отсутствие имплантационных сайтов, также как наличие патологических, геморрагических или других анормальных имплантационных сайтов на 9 день (d9 p.с.) оценивались как аборты. Результаты абортирования показаны в табл. 1. Пример 5. Определение индекса McPhail на кроликах. Антигестагенный эффект антагонистов прогестеронового рецептора согласно изобретению тестировался на 35-дневных кроликах в стандартных жилищных и питательных условиях. В качестве подготовительных мер животным вводили подкожно 5.0 мкг/кг/день 17-эстрадиола с 1 по 4 день. Чтобы определить антигестагенный эффект, животным вводили подкожно с 7 по 10 день 0.2 мг/кг/день прогестерона и 3 мг/кг/день исследуемого вещества (11-[4-(1,2-дигидроксиэтил)фенил]20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-она согласно примеру 1 или 20,20,21,21,21-пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-она согласно примеру 3) одновременно. Как наполнитель использовали смесь бензилбензоата и касторового масла в соотношении 1+4 (об./об.). Вскрытие осуществляли на 11 день после начала исследования. Матку удаляли и определяли гистологию. Индекс McPhail (степень гландулярной дифференциации) определяли способом оптической микроскопии (оценивание: 1=нет гландулярной дифференциации; 4=максимальная гландулярная дифференциация) как характеристику антигестагенного эффекта (уменьшение гландулярной дифференциации,вызванное прогестероном). Полученный индекс McPhail показан в табл. 2. Таблица 2 Индекс McPhail Пример 6 а. Метаболическая стабильность 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21 пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-она и 20,20,21,21,21-пентафтор-17-гидрокси-11[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-она в людских микросомах печени (HLM). Людскую печеночную микросому (HLM) использовали для оценки метаболической стабильности веществ общей формулы I. Выращивание проводили в двух экземплярах с HLM и NADPH-генерирующих системах, используя встряхивающуюся баню при 37 С. Инкубационная смесь (состоящий из раствора кофермента, фосфатнокалиевого буфера и микросомного препарата) была свежеприготовлена согласно таблице ниже. Инкубационный объем составлял 0.25 мл. Инкубационную смесь преинкубировали в течение 3 мин при 37 С. Взаимодействие начинали прибавлением исследуемого вещества (конечная концентрация 50 мкМ). Взаимодействие заканчивалось после инкубирования в течение 60 мин прибавлением 250 мкл метанола и смесь затем центрифугировали для осаждения протеина. Образцы сохраняли при -18 С для последующего ОФ-ВЭЖХ анализа. Согласно ОФ-ВЭЖХ анализу около 70% использованного 11-[4-(1,2-дигидроксиэтил)фенил]20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-она и около 80% использованного-7 017038 20,20,21,21,21-пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-она были получены обратно в надосадочной жидкости. Пример 6b. Метаболическая стабильность 11-(4-ацетилфенил)-20,20,21,21,21-пентафтор-17 гидрокси-19-нор-17-прегна-4,9-диен-3-она в людских микросомах печени (HLM). Людскую печеночную микросому (HLM) использовали для оценки метаболической стабильности веществ общей формулы I. Выращивание проводили в двух экземплярах с HLM и NADPH-генерирующих системах, используя встряхивающуюся баню при 37 С. Инкубационная смесь (состоящий из раствора кофермента, фосфатнокалиевого буфера и микросомного препарата) была свежеприготовлена согласно таблице ниже. Инкубационный объем составлял 0.25 мл. Инкубационную смесь преинкубировали в течение 3 мин при 37 С. Взаимодействие начинали прибавлением исследуемого вещества (конечная концентрация 10 мкМ). Взаимодействие заканчивалось после инкубирования в течение 60 мин прибавлением 250 мкл метанола и смесь затем центрифугировали для осаждения протеина. Образцы сохраняли при -18 С для последующего ОФ-ВЭЖХ анализа. Согласно ОФ-ВЭЖХ анализу, 60% использованного 11-(4-ацетилфенил)-20,20,21,21,21 пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-она было получено обратно в надосадочной жидкости. Пример 7. Антигестагенное действие 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор 17-гидрокси-19-нор-17-прегна-4,9-диен-3-она и 20,20,21,21,21-пентафтор-17-гидрокси-11-[4(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-она на стабильную трансфикацию людских нейробластомных клеток (клетки SK-N-MC) с рецептором людского прогестерона А или прогестерона В и на MTV-LUC репортерную конструкцию.SK-N-MC клетки (людские нейробластомные клетки), стабильно трансфицированные плазмидами,которые экспрессируют людской прогестероновый рецептор В (pRChPR-B-neo) или людской прогестероновый рецептор A (pRChPR-A-neo) и репортерную конструкцию (pMMTV-LUC), инкубировали в течение 24 ч, или в отсутствие (отрицательный контроль) или в присутствии увеличивающихся количеств 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен 3-она или 20,20,21,21,21-пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9 диен-3-она (0.01, 0.1, 1, 10, 100 нмоль/л и 1 мкмоль/л), с целью определить агонистическую эффективность. Как положительный контроль стимулирования репортерного гена, клетки обрабатывали искусственным гестагенным промегестоном (0.01, 0.1, 1, 10, 100 нмоль/л и 1 мкмоль/л). Чтобы определить антагонистическую активность, клетки обрабатывали 0.1 нмоль/л промегестона и дополнительно увеличивающимися количествами 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19 нор-17-прегна-4,9-диен-3-она или 20,20,21,21,21-пентафтор-17-гидрокси-11-[4(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-она (0.01, 0.1, 1, 10, 100 нмоль/л и 1 мкмоль/л). Как положительный контроль угнетения транскрипции репортерного гена, клетки инкубировали увеличивающимися количествами антагониста прогестеронового рецептора 11-(4-ацетилфенил)20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-она (1 пмоль/л, 0.01, 0.1, 1, 10 и 100 нмоль/л). Активность LUC репортерного гена (LUC=люцифераза) определяли в клеточных лизатах и определяли как RLU (relative light units - относительная световая единица). Все измеренные величины даны как процент эффективности (относительно LUC активности как среднее плюс/минус допустимое отклонение (n=3 эксперимента и как ЕС 50 или IC50 концентрации. а. Агонистическая активность. Ни 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна 4,9-диен-3-он ни 20,20,21,21,21-пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17 прегна-4,9-диен-3-он не проявляют стимулирования LUC активности PR-A или PR-B (в отличие от промегестонового положительного контроля, который стимулирует репортерный ген в зависимости от дозы). Табл. 3 показывает агонистическую активность двух исследуемых веществ и промегестона.b. Антагонистическая активность. 11-[4-(1,2-Дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9 диен-3-он и 20,20,21,21,21-пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17-прегна 4,9-диен-3-он показывает зависимое от дозировки ингибирование LUC активности, стимулированной 0.1 нмоль/л промегестона (100%) для обоих изоформ прогестероновых рецепторов. Табл. 4 показывает агонистическую активность двух исследуемых веществ в сравнении с 11-(4-ацетилфенил)-20,20,21,21,21 пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-оном. Таблица 4 Антагонистическая активность 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17 гидрокси-19-нор-17-прегна-4,9-диен-3-она или 20,20,21,21,21-пентафтор-17-гидрокси-11-[4(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-она Эти данные показывают, что 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17 гидрокси-19-нор-17-прегна-4,9-диен-3-он и 20,20,21,21,21-пентафтор-17-гидрокси-11-[4(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-он являются абсолютными антагонистами обоих изоформ прогестероновых рецепторов в SK-N-MC клетках, которые стабильно экспрессированны прогестероновым рецептором А или прогестероновым рецептором В. Никакое соединение не проявляет какой-нибудь избирательности в отношении одной изоформы прогестеронового рецептора. Тем не менее,11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен 3-он в около 130 раз менее активный, чем 11-(4-ацетилфенил)-20,20,21,21,21-пентафтор-17-гидрокси 19-нор-17-прегна-4,9-диен-3-он по отношению к прогестероновым рецепторам. 20,20,21,21,21 Пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-он в около 13 раз слабее, чем 11-(4-ацетилфенил)-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3 он. Стабильно трансфицированные клеточные линии экспрессируют приблизительно 500 фМ (фемтомоль) PR-A или PR-B.-9 017038 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Антагонист прогестеронового рецептора общей формулы I в которой R1 может быть атомом водорода и R2 гидроксильной группой или R1 и R2 вместе могут быть оксогруппой. 2. Антагонист прогестеронового рецептора общей формулы I по п.1, который представляет собой 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен 3-он. 3. Антагонист прогестеронового рецептора общей формулы I по п.1, который представляет собой 11-[4-[(1R)-1,2-дигидроксиэтил]фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9 диен-3-он. 4. Антагонист прогестеронового рецептора общей формулы I по п.1, который представляет собой 20,20,21,21,21-пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-он. 5. Лекарственное средство, содержащее антагонисты прогестеронового рецептора по п.1. 6. Лекарственное средство по п.5, содержащее 11-[4-(1,2-дигидроксиэтил)фенил]-20,20,21,21,21 пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-он. 7. Лекарственное средство по п.6, содержащее 11-[4-[(1R)-1,2-дигидроксиэтил]фенил]20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-он. 8. Лекарственное средство по п.5, содержащее 20,20,21,21,21-пентафтор-17-гидрокси-11-[4(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-он. 9. Применение антагонистов прогестеронового рецептора по п.1 для получения лекарственного средства для лечения эндометриоза, миом или гормонозависимых опухолей и фармацевтических препаратов для женской контрацепции. 10. Применение антагонистов прогестеронового рецептора по п.9 для получения лекарственного средства для лечения карциномы молочной железы. 11. Применение по п.10, включающее 11-[4-(1,2-дигидроксиэтил)фенил]-17-гидрокси-17(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он. 12. Применение по п.11, включающее 11-[4-[(1R)-1,2-дигидроксиэтил]фенил]-20,20,21,21,21 пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-он. 13. Применение по п.10,включающее 20,20,21,21,21-пентафтор-17-гидрокси-11-[4(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-он. 14. 11-(4-Этенилфенил)-20,20,21,21,21-пентафтор-5,17-дигидрокси-19-нор-5,17-прегн-9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь в качестве интермедиата при получении антагониста прогестеронового рецептора общей формулы I. 15. 11-[4-(1,2-Дигидроксиэтил)фенил]-20,20,21,21,21-пентафтор-5,17-дигидрокси-19-нор-5,17 прегн-9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь в качестве интермедиата при получении антагониста прогестеронового рецептора общей формулы I. 16. 20,20,21,21,21-Пентафтор-17-гидрокси-5,10-эпокси-19-нор-5,17-прегн-9-(11)-ен-3-он 2,2 диметилпропан-1,3-диилкеталь в качестве интермедиата при получении антагониста прогестеронового рецептора общей формулы I. 17. 11-4-[(4R)-2,2-Диметил-1,3-диоксолан-4-ил]фенил-20,20,21,21,21-пентафтор-5,17 дигидрокси-19-нор-5,17-прегн-9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь в качестве интермедиата при получении антагониста прогестеронового рецептора общей формулы I. 18. 11-[4-[2-(1,1-Диметилэтил)диметилсилил]окси]метил]-1,3-диоксолан-2-ил]фенил]20,20,21,21,21-пентафтор-5,17-дигидрокси-19-нор-5,17-прегн-9-ен-3-он 2,2-диметилпропан-1,3 диилкеталь в качестве интермедиата при получении антагониста прогестеронового рецептора 20,20,21,21,21-пентафтор-17-гидрокси-11-[4-(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3 она. 19. 20,20,21,21,21-Пентафтор-5,17-дигидрокси-11-[4-[2-(гидроксиметил)-1,3-диоксолан-2 ил]фенил]-19-нор-5,17-прегн-9-ен-3-он 2,2-диметилпропан-1,3-диилкеталь в качестве интермедиата- 10017038 при получении антагониста прогестеронового рецептора 20,20,21,21,21-пентафтор-17-гидрокси-11-[4(гидроксиацетил)фенил]-19-нор-17-прегна-4,9-диен-3-она. 20. Соединение по любому из пп.1-4 в изолированной форме. 21. Соединение по п.20 в твердой форме. 22. Соединение по п.3, когда оно в значительной степени свободно от 11-[4-[(1S)-1,2 дигидроксиэтил]фенил]-20,20,21,21,21-пентафтор-17-гидрокси-19-нор-17-прегна-4,9-диен-3-она. 23. Лекарственное средство по любому из пп.5-8, пригодное для перорального введения в виде единичной дозированной формы. 24. Лекарственное средство по п.23 в виде единичной дозированной формы. 25. Лекарственное средство по любому из пп.5-8, которое содержит от 0,01 до 100 мг соединения по п.1.
МПК / Метки
МПК: A61K 31/567, C07J 51/00, C07J 1/00, A61P 5/36, C07J 21/00
Метки: рецептора, антагонисты, прогестеронового
Код ссылки
<a href="https://eas.patents.su/12-17038-antagonisty-progesteronovogo-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты прогестеронового рецептора</a>