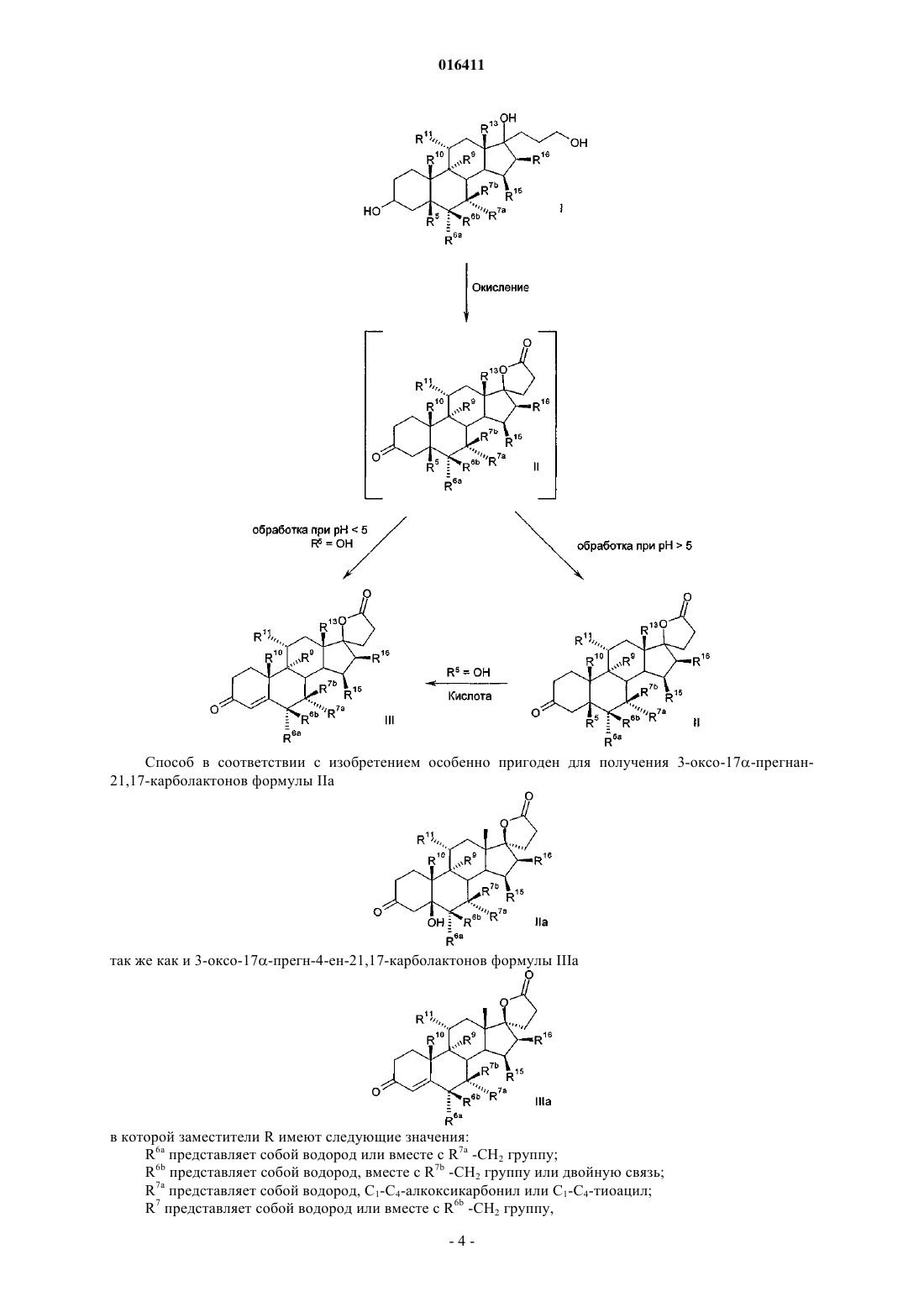
Способ получения 3-оксо-прегн-4-ен-21,17-карболактонов с помощью окисления 17-(3-гидроксипропил)-3,17-дигидроксиандростанов без использования металла
Формула / Реферат
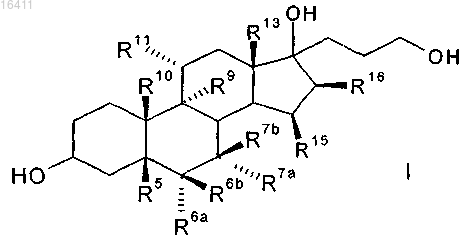
1. Способ получения 3-оксо-прегнан-21,17-карболактонов формулы II
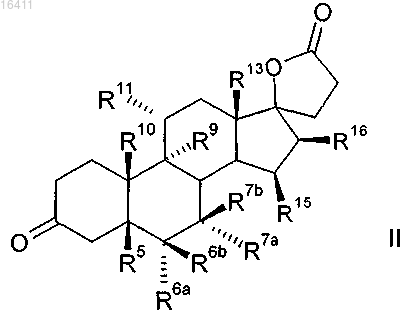
в которой R5 представляет собой водород, гидрокси;
R6a представляет собой водород или вместе с R7a -CH2 группу;
R6b представляет собой водород, вместе с R7b -CH2 группу или двойную связь;
R7a представляет собой водород, C1-C4-алкил, C1-C4-алкоксикарбонил, C1-C4-тиоацил или вместе с R6a -СН2 группу,
R7b представляет собой водород или вместе с R6b -СН2 группу или двойную связь;
R9 представляет собой водород, вместе с R11 двойную связь или вместе с R11 эпоксигруппу -О-;
R10 представляет собой водород, метил или этил;
R11 представляет собой водород, вместе с R9 двойную связь или вместе с R9 эпоксигруппу -О-;
R13 представляет собой водород, метил или этил;
R15 представляет собой водород, C1-C4-алкил, вместе с R16-СН2 группу или двойную связь;
R16 представляет собой водород, вместе с R15-CH2 группу или двойную связь;
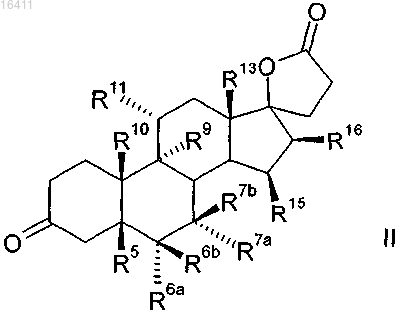
который включает реакцию соединений формулы I
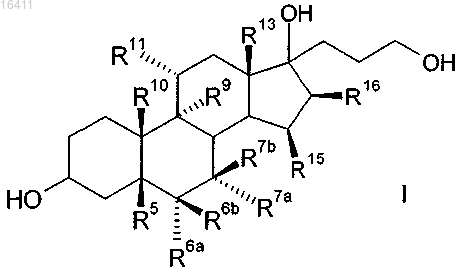
в которой R5, R6a, R6b, R7a, R7b, R9, R10, R11, R13, R15, R16 имеют те же самые значения, что и в формуле II,
по крайней мере с 3 молярными эквивалентами органического или неорганического гипохлорита в качестве окислителя, в присутствии каталитических количеств производного 2,2,6,6-тетраметилпиперидин-N-оксида при рН по крайней мере 8,0.
2. Способ по п.1 для получения 3-оксо-17α-прегнан-21,17-карболактонов формулы IIa
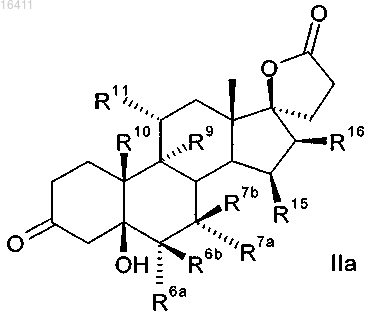
в которой R6a представляет собой водород или вместе с R7a -CH2 группу;
R6b представляет собой водород, вместе с R7b -CH2 группу или двойную связь;
R7a представляет собой водород, C1-C4-алкоксикарбонил или C1-C4-тиоацил или вместе с R6a -СН2 группу;
R7b представляет собой водород или вместе с R6b -СН2 группу или двойную связь;
R9 представляет собой водород, вместе с R11 двойную связь или вместе с R11 эпоксигруппу -О-;
R10 представляет собой водород или метил;
R11 представляет собой водород, вместе с R9 двойную связь или вместе с R9 эпоксигруппу -О-;
R15 представляет собой водород, вместе с R16 -CH2 группу или двойную связь;
R16 представляет собой водород, вместе с R15 -CH2 группу или двойную связь;
в котором взаимодействуют соединения формулы Ia

в которой R6a, R6b, R7a, R7b, R9, R10, R11, R15, R16 имеют те же самые значения, что и в формуле IIa.
3. Способ по п.1 или 2 для получения соединений формулы IIb
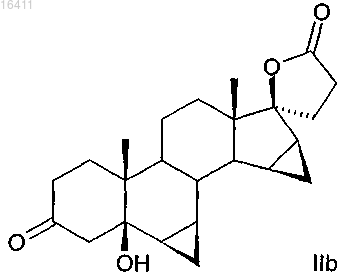
в котором соединение формулы Ib
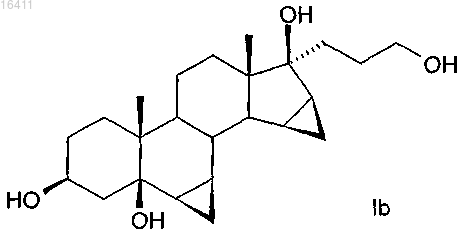
используют в качестве исходного материала.
4. Способ получения 3-оксо-прегн-4-ен-21,17-карболактонов формулы III

в которой R6a представляет собой водород или вместе с R7a -СН2 группу;
R6b представляет собой водород, вместе с R7b -СН2 группу или двойную связь;
R7a представляет собой водород, C1-C4-алкил, C1-C4-алкоксикарбонил, C1-C4-тиоацил или вместе с R6a -СН2 группу;
R7b представляет собой водород или вместе с R6b -СН2 группу или двойную связь;
R9 представляет собой водород, вместе с R11 двойную связь или вместе с R11 эпоксигруппу -О-;
R10 представляет собой водород, метил или этил;
R11 представляет собой водород, вместе с R9 двойную связь или вместе с R9 эпоксигруппу -О-;
R13 представляет собой водород, метил или этил;
R15 представляет собой водород, C1-C4-алкил, вместе с R16 -CH2 группу или двойную связь;
R16 представляет собой водород, вместе с R15 -CH2 группу или двойную связь;
включающий следующие стадии:
а) реакцию соединений общей формулы I
в которой R5 представляет собой гидрокси;
R6a, R6b, R7a, R7b, R9, R10, R11, R13, R15, R16 имеют те же самые значения, что и в формуле III,
по крайней мере с 3 молярными эквивалентами органического или неорганического гипохлорита в качестве окислителя, в присутствии каталитических количеств производного 2,2,6,6-тетраметилпиперидин-N-оксида при рН по крайней мере 8,0, в дихлорметане или в двухфазной смеси дихлорметан-вода,
с образованием соединений формулы II
в которой R5, R6a, R6b, R7a, R7b, R9, R10, R11, R13, R15, R16 имеют те же самые значения, что и в формуле I,
b) выделение соединений формулы II;
c) последующее отщепление воды при рН<5, необязательно, в присутствии кислоты.
5. Способ по п.4 для получения 3-оксо-17α-прегн-4-ен-21,17-карболактонов формулы IIIa
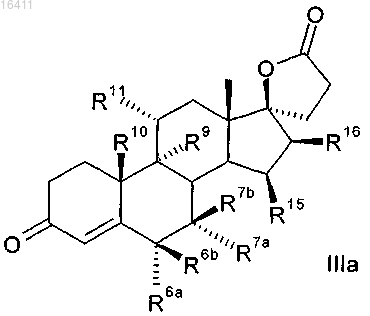
в которой R6a представляет собой водород или вместе с R7a -CH2 группу;
R6b представляет собой водород, вместе с R7b -CH2 группу или двойную связь;
R7a представляет собой водород, C1-C4-алкоксикарбонил или C1-C4-тиоацил или вместе с R6a -СН2 группу;
R7b представляет собой водород или вместе с R6b -СН2 группу или двойную связь;
R9 представляет собой водород, вместе с R11 двойную связь или вместе с R11 эпоксигруппу -О-;
R10 представляет собой водород или метил;
R11 представляет собой водород, вместе с R9 двойную связь или вместе с R9 эпоксигруппу -О-;
R15 представляет собой водород, вместе с R16 -CH2 группу или двойную связь;
R16 представляет собой водород, вместе с R15 -CH2 группу или двойную связь,
в котором взаимодействуют соединения формулы Ia
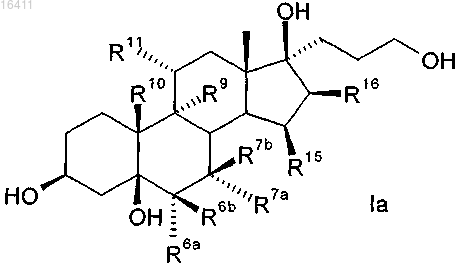
в которой R6a, R6b, R7a, R7b, R9, R10, R11, R15, R16 имеют те же самые значения, что и в формуле IIIa.
6. Способ по п.4 или 5 для получения соединения формулы IIIb
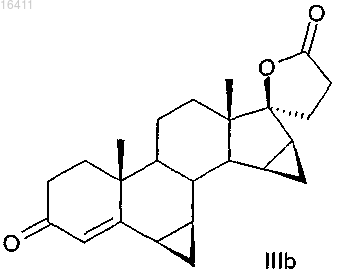
в котором соединение формулы Ib
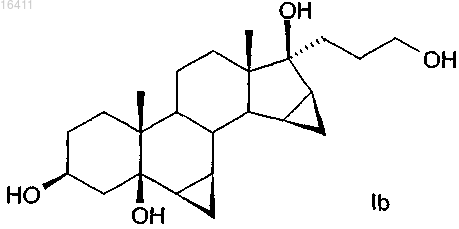
используют в качестве исходного материала.
7. Способ получения дихлорметанового гемисольвата IV
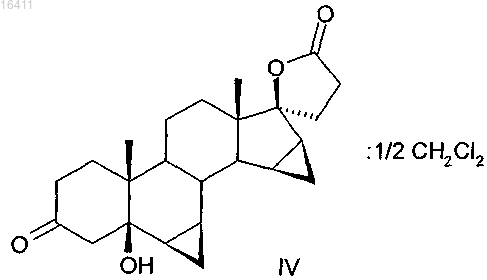
включающий следующие стадии:
а) реакцию соединений общей формулы Ib
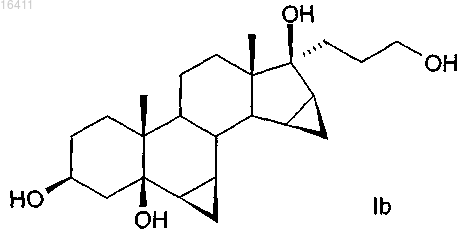
по крайней мере с 3 молярными эквивалентами органического или неорганического гипохлорита в качестве окислителя, в присутствии каталитических количеств производного 2,2,6,6-тетраметилпиперидин-N-оксида при рН по крайней мере 8,0, в дихлорметане или в двухфазной смеси дихлорметан-вода;
b) выделение соединений формулы IV.
8. Способ по любому из пп.4-7, в котором используют 1-5 мол.% производного 2,2,6,6-тетраметилпиперидин-N-оксида.
9. Способ по любому из пп.4-8, в котором используют 1-1,5 мол.% 2,2,6,6-тетраметилпиперидин-N-оксида.
10. Способ по любому из предшествующих пунктов, в котором используют 3-6 молярных эквивалентов щелочного гипохлорита.
11. Способ по любому из предшествующих пунктов, в котором используют 3-4 молярных эквивалентов гипохлорита натрия.
12. Способ по любому из предшествующих пунктов, в котором рН реакционного раствора находится в пределах от 8,5 до 10,0.
13. Способ по любому из предшествующих пунктов, в котором рН реакционного раствора устанавливают с помощью бикарбоната калия.
14. Способ по любому из предшествующих пунктов, в котором температура реакции составляет от 0 до 15°С.
15. Способ по любому из предшествующих пунктов, в котором после завершения реакции окисления к реакционной смеси прибавляют восстанавливающий агент для нейтрализации избытка гипохлоритного реагента.
16. Способ по п.15, в котором восстанавливающий агент прибавляют вместе с прибавлением основания или основного буфера при рН больше чем 5.
17. Способ по п.15 или 16, в котором в качестве восстанавливающего агента используют водный раствор щелочного гидросульфита.
18. Способ по любому из пп.15-17, в котором в качестве восстанавливающего агента используют гидросульфит натрия или гидросульфит калия в форме водного раствора дисульфита натрия или дисульфита калия.
19. Способ по любому из пп.16-18, в котором фосфат натрия (Na3PO4) используют как основание или основный буфер.
20. Гемисольват 6β,7β;15β,16β-диметилен-3-оксо-17α-прегнан-5β-ол-21,17-карболактон-дихлорметан.
21. Способ получения дроспиренона, который включает реакцию гемисольвата 6β,7β;15β,16β-диметилен-3-оксо-17α-прегнан-5β-ол-21,17-карболактон-дихлорметан с кислотой.
22. Способ по п.21, в котором в качестве кислоты используют серную кислоту, хлороводородную кислоту или паратолуолсульфоновую кислоту.
Текст
Изобретение касается способов получения 3-оксо-прегнан-21,17-карболактонов формулы (II), так же как и 3-оксо-прегн 4-ен-21,17-карболактонов формулы (III), путем безметаллического окисления 17-(3-гидроксипропил)-3,17 дигидроксиандростанов формулы (I). Кроме того, изобретение касается дихлорметанового гемисольвата 6,7;15,16 диметилен-3-оксо-17-прегнан-5-ол-21,17-карболактона (IV), так же как и способа получения дроспиренона. 016411 Изобретение касается способов получения 3-оксо-прегнан-21,17-карболактонов, так же как и 3 оксо-прегн-4-ен-21,17-карболактонов, в частности способов получения 3-оксо-17-прегнан-21,17 карболактонов, так же как и 3-оксо-17-прегн-4-ен-21,17-карболактонов. Кроме того, изобретение касается гемисольвата дихлорметана 6,7;15,16-диметилен-3-оксо-17-прегнан-5-ол-21,17 карболактона. Примерами фармакологически активных стероид-21,17-карболактонов являются эплеренон(6,7;15,16-диметилен-3-оксо-17-прегн-4-ен-21,17-карболактон), спиронолактон (7-ацилтио-3 оксо-17-прегн-4-ен-21,17-карболактон), канренон (3-оксо-17-прегна-4,6-диен-21,17-карболактон) и проренон (6,7-метилен-3-оксо-17-прегна-4,6-диен-21,17-карболактон). Создать стероид-21,17-спиролактон можно путем окисления соответствующего 17-гидрокси-17-(3 гидроксипропил)стероида используя пригодные окислительные агенты, такие как хромовая кислота (Sam et al. J. Med. Chem. 1995,38, 4518-4528), хлорхромат пиридиния (ЕР 075189), дихромат пиридиния (Bittler et al.; Angew. Chem.[Applied Chem] 1982, 94, 718-719; Nickisch et al. Liebigs Ann. Chem. 1988, 579-584) или бромат калия в присутствии рутениевого катализатора (ЕР 918791). Очевидным является образование побочных продуктов в ряде второстепенных реакций, что негативным образом влияет на процесс окисления, известный из предшествующего уровня техники, в котором используются производные хрома(VI), что препятствует выделению чистого продукта и снижает выход. Профиль побочных продуктов улучшается при использовании окисления катализируемого рутением (ЕР 918791), а также повышается выход. Однако применение переходных металлов при производстве фармацевтически активных ингредиентов обычно имеет недостаток, состоящий в удалении следов тяжелых металлов, что, в свою очередь, приводит к увеличению стоимости производства. Однако при производстве накапливаются большие количества отходов, содержащих тяжелые металлы, и упомянутые отходы можно удалить только интенсивным и дорогим путем. Поэтому цель этого изобретения состоит в разработке доступного альтернативного способа получения 3-оксо-прегнан-21,17-карболактонов, так же как и 3-оксо-прегн-4-ен-21,17-карболактонов из соответствующих 17-(3-гидроксипропил)-3,17-дигидрокси-андростанов, что сделает возможным получение целевых соединений с высоким выходом и чистотой. Эта цель в соответствии с изобретением достигается путем взаимодействия 17-(3-гидроксипропил)3,17-дигидроксиандростанов общей формулы IR6a представляет собой водород, вместе с R5 двойную связь или вместе с R7a -CH2 группу;R6b представляет собой водород, вместе с R7b -СН 2 группу или двойную связь;R7b представляет собой водород или вместе с R6b -СН 2 группу;R9 представляет собой водород, вместе с R11 двойную связь или вместе с R11 эпоксигруппу -О-;R11 представляет собой водород, вместе с R9 двойную связь или вместе с R9 эпоксигруппу -О-;R15 представляет собой водород, C1-C4-алкил, вместе с R16 -СН 2 группу или двойную связь;R16 представляет собой водород, вместе с Rb -СН 2 группу или двойную связь,с органическим или неорганическим гипохлоритом, как окислительным агентом, в присутствии каталитических количеств производного 2,2,6,6-тетраметилпиперидин-N-оксида с образованием 3-оксопрегнан-21,17-карболактонов формулы II Если R5 представляет собой гидроксигруппу, соединения формулы II можно превратить в присутствии кислоты при рН 5 после отщепления воды в соединения формулы III Безметаллическое окисление спиртов в соответствующие альдегиды, кетоны, карбоновые кислоты,лактолы и лактоны в общем описано в обзорной статье W. Adam et al., Chem. Rev. 2001, 101, 3499-3548. Безметаллическое окисление в присутствии 2,2,6,6-тетраметилпиперидин-N-оксида (TEMPO) описывается van Bekkum et al. в Synthesis 1996, 1153-1174. Первичные спирты можно окислить до альдегидов, используя бромит натрия (NaBrO2) или гипохлорит кальция [Ca(OCl2)] в присутствии производных TEMPO [S. Torii et al., J. Org. Chem. 1990, 55, 462466]. Гипохлорит натрия (NaOCl) также может быть использован как окислительный агент (Org. Synth. 69, 212). Окисление вторичных спиртов в кетоны и, в частности, окисление первичных спиртов в карбоновые кислоты (или пригодные диолы в лактоны) требует сокатализатора (P.L. Anelli et al., J. Org. Chem. 1987, 52, 2559-2562). Как сокатализатор используют бромид (в основном KBr или NaBr). Прибавление ионов брома может быть полезно даже при окислении первичных спиртов в альдегиды (P.L. Anelli et al.,J. Org. Chem. 1987, 52, 2559-2562). Неблагоприятным фактом при использовании бромидов, как сокатализаторов, является опасность образования, при условиях реакции, бромсодержащих побочных продуктов. Этот способ окисления особенно пригоден для окисления первичных спиртов в соответствующие альдегиды. Без прибавления бромида ТЕМРО-катализируемое окисление вторичных спиртов в соответствующие кетоны требует большого избытка гипохлорита [3-4 молярных эквивалентов Ca(OCl)2, таким образом 6-8 молярных эквивалентов OCl- (S. Torii et al., J. Org. Chem. 1990, 55, 462-466)]. Окислительная лактонизация 1,4-диолов происходит во множество стадий через альдегид, который сначала образует лактол на промежуточной стадии; квазивторичная гидроксигруппа упомянутого лактола должна быть в дальнейшем окислена. Поэтому окислительная лактонизация 1,4-диолов требует еще более жестких условий (по крайней мере, эквимолярных количеств производного TEMPO (J.M. Bobbitt etal., J. Org. Chem. 1991, 56, 6110-6114) или других окислительных агентов, в связи с увеличением количеств TEMPO катализатора (J. Einhorn, J. Org. Chem. 1996, 61, 7452-7454; в присутствии добавки бромида: S.D. Rychnovsky, J. Org. Chem. 1999, 64, 310-312; в присутствии ионов брома, получаемых на месте из окислительного агента - бромита натрия: S. Torii, J. Org. Chem. 1990, 55, 462-466). Принимая во внимание уровень техники, неожиданным было то, что окислительная лактонизация на D-кольце и окисление вторичной 3-гидроксигруппы 17-(3-гидроксипропил)-3,17-дигидроксиандростанов общей формулы I (в общем три стадии окисления) можно проводить, по сути, в тоже самое время при мягких условиях в присутствии каталитических количеств производных TEMPO. Кроме того, неожиданным было то, что способ в соответствии с изобретением может быть осуществлен в присутствии только 1,0-2,0 эквивалентов гипохлорита на стадии окисления, таким образом в общем достаточно 3,0-6,0 молярных эквивалентов гипохлорита без прибавления сокатализатора, такого как бромид. Способ в соответствии с изобретением проводят в общем в присутствии по крайней мере 3 молярных эквивалентов щелочного гипохлорита, органического гипохлорита или по крайней мере 1,5 молярных эквивалентов щелочно-земельного гипохлорита, как окислительного агента; предпочтительно используя 3-6 молярных эквивалентов щелочного гипохлорита или 1,5-3 молярных эквивалентов щелочноземельного гипохлорита, особенно предпочтительно 3-4 молярных эквивалентов щелочного гипохлорита или 1,5-2 молярных эквивалентов щелочно-земельного гипохлорита. Концентрацию водного раствора гипохлорита во время окисления корректируют предпочтительно так, что она составляет от 0,8 до 1,1 моль гипохлорита/кг. Как окислительный агент предпочтительно-2 016411 используют гипохлорит натрия, гипохлорит калия, гипохлорит кальция или трет-бутилгипохлорит. Производные 2,2,6,6-тетраметилпиперидин-N-оксида (производные TEMPO) используют в каталитическом количестве, где количество составляет предпочтительно 1-5 мол.%, особенно предпочтительно 1-1,5 мол.%. Пригодными производными TEMPO являются 2,2,6,6-тетраметилпиперидин-N-оксид (TEMPO), 4 метокси-2,2,6,6-тетраметилпиперидин-N-оксид (4-МеО-ТЕМРО), так же как и 4-бензилокси-2,2,6,6 тетраметилпиперидин-N-оксид (4-BnO-ТЕМРО). В соответствии с изобретением предпочтительно используется TEMPO, особенно предпочтительно в количестве 1-5 мол.%, еще особенно предпочтительно 1-1,5 мол.%. Окисление проводят в органическом растворителе или в двухфазной смеси растворительвода, где растворитель выбирают таким образом, что производное TEMPO и соединения формулы I могут хорошо растворяться в нем. Реакцию предпочтительно проводят в двухфазной системе. Способ в соответствии с изобретением еще предпочтительней проводят в смеси дихлорметан-вода. Окисление в соответствии с изобретением проводят при температуре от 0 до 20 С, предпочтительно при 10-20 С. Во время окисления рН реакционного раствора составляет по крайней мере 8,0; предпочтительно от 8,5 до 10,0; особенно предпочтительно от 9,0 до 9,5. рН можно пригодным образом корректировать, используя пригодную кислоту Бронстеда, такую как органические кислоты (например, уксусная кислота) или неорганические кислоты (HCl, H2SO4, H3PO4) или кислые соли полиосновных кислот (бикарбонаты, гидросульфаты, гидрофосфаты и т.д.). Предпочтительно используют щелочные бикарбонаты, особенно предпочтительно бикарбонат калия. Реакцию окисления прекращали, прибавляя восстанавливающий агент для того, чтобы нейтрализовать избыток гипохлоритного реагента. Для этой цели пригоден любой восстанавливающий агент с соответствующим окислительно-восстановительным потенциалом, известный специалисту в данной области техники. В соответствии с этим изобретением предпочтительно используют водный раствор щелочного гидросульфита. Особенно предпочтительно используют гидросульфит натрия или калия (NaHSO3 или KHSO3),водный раствор дисульфита натрия или калия (Na2SO2O5 или K2S2O5). Если в реакционной смеси погасить избыток гипохлоритного реагента при рН 5 без прибавления основания или основного буфера, или в присутствии дополнительной кислоты, 3-оксо-прегнан-21,17 карболактоны формулы II (если R5=ОН) взаимодействуют с водой и в реакционной смеси в эквивалентном количестве образуются 3-оксо-прегн-4-ен-21,17-карболактоны формулы III. Завершение реакции окисления при рН меньше чем 5 делает возможным получение соединений III в однореакторном процессе. Если в реакционной смеси погасить избыток гипохлоритного реагента с добавлением основания или основного буфера при рН 5, можно выделить 3-оксо-прегнан-21,17-карболактоны формулы II. Завершение реакции окисления при рН больше чем 5 делает возможным специфическое получение соединений формулы II. Так как в случае R5=ОН растворимость соединений формулы II по сравнению с соединениями формулы III в органических растворителях ниже, специфическое выделение соединений формулы II,как промежуточного соединения на пути к соединениям формулы III, обеспечивает особые преимущества состоящие в возможности более эффективной очистки (например, путем кристаллизации). Очищенные промежуточные соединения могут взаимодействовать в соответствии с методиками, известными из литературы, с пригодными кислотами (такими как, например, серная кислота, хлороводородная кислота,паратолуолсульфоновая кислота и т.д.) с образованием соединений формулы III (ЕР 0918791). Для корректировки рН может быть использовано любое пригодное неорганическое или органическое основание или любой пригодный буфер или любая пригодная буферная система. Основание или буфер предпочтительно прибавляют к реакционной смеси вместе или параллельно с восстанавливающим агентом. В соответствии с этим изобретением как основный буфер предпочтительно используют фосфат натрия (Na3PO4). Можно получить 17-(3-гидроксипропил)-3,17-дигидроксиандростаны общей формулы I, например,исходя из соответствующим образом замещенных 3-гидрокси-17-кетоандростанов, путем присоединения пропаргилового спирта по С-17 и последующего восстановления тройной связи (ЕР 918791, ЕР 51143,DE 3026783) или как описано N.W. Atwater в J. Org. Chem. 1961, 26, 3077 и в US 4069219 или в документах приведенных здесь. Соответствующие 3-гидрокси-17-кетоандростаны можно получить, в свою очередь, из соответствующим образом замещенного 3-гидроксиандрост-5-ен-17-она (ЕР 51143, DE 3026783). Способ в соответствии с изобретением особенно пригоден для получения 3-оксо-17-прегнан 21,17-карболактонов формулы IIa так же как и 3-оксо-17-прегн-4-ен-21,17-карболактонов формулы IIIaR6a представляет собой водород или вместе с R7a -СН 2 группу;R6b представляет собой водород, вместе с R7b -СН 2 группу или двойную связь;R7 представляет собой водород или вместе с R6b -СН 2 группу,-4 016411R9 представляет собой водород, вместе с R11 двойную связь или вместе с R11 эпоксигруппу -О-;R10 представляет собой водород или метил;R11 представляет собой водород, вместе с R9 двойную связь или вместе с R9 эпоксигруппу -О-;R15 представляет собой водород, вместе с R16 -СН 2 группу или двойную связь;R16 представляет собой водород, вместе с R15 -СН 2 группу или двойную связь; где как исходные материалы используются 17-(3-гидроксипропил)-3,17-дигидроксиандростаны общей формулы Ia Способ в соответствии с изобретением получения соединений формул IIa и IIIa является еще более пригодным для соединений IIb, так же как и IIIb, где соединение формулы Ib используется как исходный материал, в которыхR6b и R7 вместе представляют собой -CH2 группу;R15 и R16 вместе представляют собой -CH2 группу. Другим аспектом этого изобретения является плохая растворимость образующегося дихлорметанового гемисольвата IV, что было достаточно неожиданно, исходя из соединения IIb, когда способ в соответствии с изобретением проводится в дихлорметане и обрабатывается основанием, при рН 5. Во время окисления этот плохо растворимый продукт выпадает в осадок и таким образом можно избежать влияния окислительного агента, а также возможных дополнительных реакций, которые могут приводить к образованию побочных продуктов. Дихлорметан-гемисольват IV отличается точной и постоянной температурой плавления, которая составляет 121 С, в то время как соединение IIb плавится при 188 С. Измерения ДСК (дифференциальная сканирующая калориметрия) показали, что соединение IV стабильно до температуры плавления. После завершения реакции осаждение соединения IV из реакционного раствора завершают путем прибавления неполярного растворителя, предпочтительно эфира, особенно предпочтительно диизопро-5 016411 пилового эфира. Неполярные продукты окисления и элиминирования, образующиеся в результате остаточного окисления, хорошо растворяются в смеси эфир-дихлорметан, что делает возможным чрезвычайно легкое выделение соединения IV с высокой чистотой. В этом случае, соединение IV получают с выходом 82%. Полученный таким образом продукт содержит не больше чем 6% стероидных примесей и может легко вступать в реакции без дополнительной очистки в соответствии с известными способами с пригодными кислотами с образованием дроспиренона IIIb (ЕР 918791). Синтез вариантов протекающий через выделенное соединение IV дает дополнительные преимущество значительно больший общий выход по IIIb благодаря простоте и большей эффективности очистки на конечной стадии. Общий выход поIIIb составляет 77%, приблизительно на 7% выше, чем в соответствии со способом окисления катализируемого Ru и последующим отщеплением воды и даже приблизительно на 21% выше, чем в соответствии с однореакторным способом в соответствии с ЕР 075189 (таблица). Как альтернатива, Ib может быть окислен до IIb и превращен непосредственно в IIIb в той же самой реакционной смеси путем обработки в кислой среде при рН 5. Сравнение выходов способа в соответствии с изобретением со способами предшествующего уровня техники См. табл. на с. 7 ЕР 918791. Это изобретение объясняется более детально с использованием примеров, приведенных ниже, без желания ограничить его каким-либо образом. Способ получения. Общий технологический процесс 1 (ОТП 1): Синтез соединений формулы II. 76,9 ммоль соединения формулы I растворяют или суспендируют в 135 мл дихлорметана. Сначала к смеси при 15 С прибавляют 0,15 г (1 ммоль) TEMPO. Прибавляют раствор, содержащий 134 г 15,25% водного раствора гипохлорита натрия (230,7 ммоль) и 8,20 г (82 ммоль) бикарбоната калия в 114 мл воды, вследствие чего значение рН составляет 9,1. После завершения реакции избыток окислительного агента нейтрализуют при 15 С, прибавляя водный раствор, содержащий 12,5 г (76,5 ммоль) фосфата натрия и 10,6 г (55,8 ммоль) дисульфита натрия (Na2S2O5) и 121 мл воды. Продукт формулы II выделяют из органической фазы путем осаждения из реакционного раствора,прибавляя 240 мл диизопропилового эфира, последующего перемешивания на протяжении 3 ч при 25 С,фильтрования и высушивания. Как альтернатива, продукт, уже частично осажденный во время реакции,что зависит от растворимости в дихлорметане, можно растворить снова прибавив дихлорметан, отделить органическую фазу и отогнать диизопропиловый эфир. Продукт, выпавший в осадок, в этом случае отфильтровывают с 300 мл воды, промывают и сушат. Общий технологический процесс 2 (ОТП 1): Синтез соединений формулы III в однореакторном способе. 76,9 ммоль соединения формулы I растворяют или суспендируют в 135 мл дихлорметана. Сначала к смеси при 15 С прибавляют 0,15 г (1 ммоль) TEMPO. Прибавляют раствор, содержащий 134 г 15,25% водного раствора гипохлорита натрия (230,7 ммоль) и 8,20 г (82 ммоль) бикарбоната калия в 114 мл воды, вследствие чего значение рН составляет 9,1. После завершения реакции избыток окислительного агента нейтрализуют при 15 С, прибавляя водный раствор, содержащий 10,6 г (55,8 ммоль) дисульфита натрия (Na2S2O5) и 121 мл воды. рН реакционного раствора доводят до рН 5 с помощью прибавления разведенной водной серной кислоты и перемешивания реакционной смеси при комнатной температуре до завершения реакции. Выделение продукта формулы III проводят аналогично выделению соединений формулы II в соответствии с ОТП 1, где из нейтральной промытой органической фазы отгоняют диизопропиловый эфир. Продукт, выпавший в осадок в этом случае, отфильтровывают, промывают 300 мл воды и сушат. Общий технологический процесс 3 (ОТП 3): Синтез соединений формулы III, исходя из соединений формулы II, в которых R5=ОН: 0,1 моль соединения формулы II, в котором R5=ОН, полученного в соответствии с ОТП 1, суспендируют в 65 мл тетрагидрофурана или диоксана и подкисливают до рН 1, прибавляя 5 мл 20% серной кислоты. При комнатной температуре перемешивают реакционную смесь до завершения обезвоживания. Выделение продукта формулы III проводят путем осаждения с помощью прибавления 90 мл воды. Осажденный продукт отфильтровывают с водой, промывают до нейтральной реакции и сушат.-6 016411 Пример 1. Гемисольват 6,7;15,16-диметилен-3-оксо-17-прегнан-5-ол-21,17-карболактондихлорметан (IV). В соответствии с ОТП 1 реагируют 30 г (0,0769 моль) 17-(3-гидроксипропил)-6,7;15,16 диметилен-андростан-3,5,17-триола. Во время реакции продукт 6,7;15,16-диметилен-3-оксо-17-прегнан-5-ол-21,17-карболактон накапливают в форме его дихлорметанового гемисольвата. После разрушения избытка окислительного агента и после обработки в соответствии с ОТП 1 выделяют 27 г гемисольвата 6,7;15,16-диметилен 3-оксо-17-прегнан-5-ол-21,17-карболактон-дихлорметан (0,0630 моль)=82% от теории.=1011 см-1 (С-О) Пример 2. 6,7;15,16-Диметилен-3-оксо-17-прег-4-ен-21,17-карболактон (IIIb). В соответствии с ОТП 2 реагирует 30 г (0,0769 моль) 17-(3-гидроксипропил)-6,7;15,16 диметилен-андростан-3,5,17-триола. После разрушения избытка окислительного агента в соответствии с ОТП 2 реакционную смесь подкисляют 10% раствором серной кислоты до рН 1 и перемешивают на протяжении 30 мин при 25 С. После обработки в соответствии с ОТП 2 выделяют 21,5 г 6,7;15,16 диметилен-3-оксо-17-прегн-4-ен-21,17-карболактона (0,059 моль)=76,7% от теории.[]D22-182 (с=0,5 CHCl3); температура плавления=201,3 С; УФ (МеОН): 265=19000; наиболее важные данные 1 Н-ЯМР (CDCl3): =0,40-0,67 (м, 1 Н, циклопропил Н), 1,01 (с, 3 Н, 18-Н), 1,11 (с, 3 Н, 19-Н), 6,04 (с,1 Н, 4-Н) (D. Bittler, H. Hofmeister, H. Laurent, K. Nickisch, R. Nickolson, K. Petzoldt, R. Wiechert; Angew.R6a представляет собой водород или вместе с R7a -CH2 группу;R6b представляет собой водород, вместе с R7b -CH2 группу или двойную связь;R -СН 2 группу,R7b представляет собой водород или вместе с R6b -СН 2 группу или двойную связь;R9 представляет собой водород, вместе с R11 двойную связь или вместе с R11 эпоксигруппу -О-;R11 представляет собой водород, вместе с R9 двойную связь или вместе с R9 эпоксигруппу -О-;R15 представляет собой водород, C1-C4-алкил, вместе с R16-СН 2 группу или двойную связь;R16 представляет собой водород, вместе с R15-CH2 группу или двойную связь; который включает реакцию соединений формулы I в которой R5, R6a, R6b, R7a, R7b, R9, R10, R11, R13, R15, R16 имеют те же самые значения, что и в формуле II,по крайней мере с 3 молярными эквивалентами органического или неорганического гипохлорита в качестве окислителя, в присутствии каталитических количеств производного 2,2,6,6-тетраметилпиперидинN-оксида при рН по крайней мере 8,0. 2. Способ по п.1 для получения 3-оксо-17-прегнан-21,17-карболактонов формулы IIa в которой R6a представляет собой водород или вместе с R7a -CH2 группу;R6b представляет собой водород, вместе с R7b -CH2 группу или двойную связь;R7b представляет собой водород или вместе с R6b -СН 2 группу или двойную связь;R9 представляет собой водород, вместе с R11 двойную связь или вместе с R11 эпоксигруппу -О-;R10 представляет собой водород или метил;R11 представляет собой водород, вместе с R9 двойную связь или вместе с R9 эпоксигруппу -О-;R15 представляет собой водород, вместе с R16 -CH2 группу или двойную связь;R16 представляет собой водород, вместе с R15 -CH2 группу или двойную связь; в котором взаимодействуют соединения формулы Ia в которой R6a, R6b, R7a, R7b, R9, R10, R11, R15, R16 имеют те же самые значения, что и в формуле IIa. 3. Способ по п.1 или 2 для получения соединений формулы IIb в котором соединение формулы Ib в которой R6a представляет собой водород или вместе с R7a -СН 2 группу;R6b представляет собой водород, вместе с R7b -СН 2 группу или двойную связь;R7b представляет собой водород или вместе с R6b -СН 2 группу или двойную связь;R9 представляет собой водород, вместе с R11 двойную связь или вместе с R11 эпоксигруппу -О-;R11 представляет собой водород, вместе с R9 двойную связь или вместе с R9 эпоксигруппу -О-;R15 представляет собой водород, C1-C4-алкил, вместе с R16 -CH2 группу или двойную связь;R16 представляет собой водород, вместе с R15 -CH2 группу или двойную связь; включающий следующие стадии: а) реакцию соединений общей формулы IR6a, R6b, R7a, R7b, R9, R10, R11, R13, R15, R16 имеют те же самые значения, что и в формуле III,по крайней мере с 3 молярными эквивалентами органического или неорганического гипохлорита в качестве окислителя, в присутствии каталитических количеств производного 2,2,6,6-тетраметилпиперидинN-оксида при рН по крайней мере 8,0, в дихлорметане или в двухфазной смеси дихлорметан-вода,с образованием соединений формулы II в которой R5, R6a, R6b, R7a, R7b, R9, R10, R11, R13, R15, R16 имеют те же самые значения, что и в формуле I,b) выделение соединений формулы II;c) последующее отщепление воды при рН 5, необязательно, в присутствии кислоты. 5. Способ по п.4 для получения 3-оксо-17-прегн-4-ен-21,17-карболактонов формулы IIIa в которой R6a представляет собой водород или вместе с R7a -CH2 группу;R6b представляет собой водород, вместе с R7b -CH2 группу или двойную связь;R7b представляет собой водород или вместе с R6b -СН 2 группу или двойную связь;R9 представляет собой водород, вместе с R11 двойную связь или вместе с R11 эпоксигруппу -О-;R10 представляет собой водород или метил;R11 представляет собой водород, вместе с R9 двойную связь или вместе с R9 эпоксигруппу -О-;R15 представляет собой водород, вместе с R16 -CH2 группу или двойную связь;R16 представляет собой водород, вместе с R15 -CH2 группу или двойную связь,в котором взаимодействуют соединения формулы Ia в которой R6a, R6b, R7a, R7b, R9, R10, R11, R15, R16 имеют те же самые значения, что и в формуле IIIa. 6. Способ по п.4 или 5 для получения соединения формулы IIIb в котором соединение формулы Ib используют в качестве исходного материала. 7. Способ получения дихлорметанового гемисольвата IV включающий следующие стадии: а) реакцию соединений общей формулы Ib- 10016411 по крайней мере с 3 молярными эквивалентами органического или неорганического гипохлорита в качестве окислителя, в присутствии каталитических количеств производного 2,2,6,6-тетраметилпиперидинN-оксида при рН по крайней мере 8,0, в дихлорметане или в двухфазной смеси дихлорметан-вода;b) выделение соединений формулы IV. 8. Способ по любому из пп.4-7, в котором используют 1-5 мол.% производного 2,2,6,6 тетраметилпиперидин-N-оксида. 9. Способ по любому из пп.4-8, в котором используют 1-1,5 мол.% 2,2,6,6-тетраметилпиперидин-Nоксида. 10. Способ по любому из предшествующих пунктов, в котором используют 3-6 молярных эквивалентов щелочного гипохлорита. 11. Способ по любому из предшествующих пунктов, в котором используют 3-4 молярных эквивалентов гипохлорита натрия. 12. Способ по любому из предшествующих пунктов, в котором рН реакционного раствора находится в пределах от 8,5 до 10,0. 13. Способ по любому из предшествующих пунктов, в котором рН реакционного раствора устанавливают с помощью бикарбоната калия. 14. Способ по любому из предшествующих пунктов, в котором температура реакции составляет от 0 до 15 С. 15. Способ по любому из предшествующих пунктов, в котором после завершения реакции окисления к реакционной смеси прибавляют восстанавливающий агент для нейтрализации избытка гипохлоритного реагента. 16. Способ по п.15, в котором восстанавливающий агент прибавляют вместе с прибавлением основания или основного буфера при рН больше чем 5. 17. Способ по п.15 или 16, в котором в качестве восстанавливающего агента используют водный раствор щелочного гидросульфита. 18. Способ по любому из пп.15-17, в котором в качестве восстанавливающего агента используют гидросульфит натрия или гидросульфит калия в форме водного раствора дисульфита натрия или дисульфита калия. 19. Способ по любому из пп.16-18, в котором фосфат натрия (Na3PO4) используют как основание или основный буфер. 20. Гемисольват 6,7;15,16-диметилен-3-оксо-17-прегнан-5-ол-21,17-карболактондихлорметан. 21. Способ получения дроспиренона, который включает реакцию гемисольвата 6,7;15,16 диметилен-3-оксо-17-прегнан-5-ол-21,17-карболактон-дихлорметан с кислотой. 22. Способ по п.21, в котором в качестве кислоты используют серную кислоту, хлороводородную кислоту или паратолуолсульфоновую кислоту.
МПК / Метки
МПК: C07J 53/00
Метки: использования, получения, способ, помощью, 3-оксо-прегн-4-ен-21,17-карболактонов, 17-(3-гидроксипропил)-3,17-дигидроксиандростанов, металла, окисления
Код ссылки
<a href="https://eas.patents.su/12-16411-sposob-polucheniya-3-okso-pregn-4-en-2117-karbolaktonov-s-pomoshhyu-okisleniya-17-3-gidroksipropil-317-digidroksiandrostanov-bez-ispolzovaniya-metalla.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 3-оксо-прегн-4-ен-21,17-карболактонов с помощью окисления 17-(3-гидроксипропил)-3,17-дигидроксиандростанов без использования металла</a>