Способ получения противоопухолевой вакцины
Номер патента: 11421
Опубликовано: 27.02.2009
Формула / Реферат
1. Способ получения противоопухолевой вакцины на основе антигенпрезентирующих клеток, нагруженных антигенами, отличающийся тем, что нагрузку антигенпрезентирующих клеток проводят антигенами, полученными отщеплением протеазой с поверхности живых клеток с обеспечением представления на поверхности антигенпрезентирующих клеток совокупности антигенов, идентичной совокупности поверхностных антигенов клеток-мишеней.
2. Способ по п.1, отличающийся тем, что используют аутологичные живые клетки.
3. Способ по п.1, отличающийся тем, что используют аллогенные живые клетки.
4. Способ по п.1, отличающийся тем, что используют ксеногенные живые клетки.
5. Способ по п.1, отличающийся тем, что используют аллогенные и аутологичные живые клетки в комбинации.
6. Способ по п.1, отличающийся тем, что используют ксеногенные и аллогенные живые клетки в комбинации.
7. Способ по п.1, отличающийся тем, что используют ксеногенные и аутологичные живые клетки в комбинации.
8. Способ по п.1, отличающийся тем, что используют ксеногенные, аллогенные и аутологичные живые клетки в комбинации.
9. Способ по п.1, отличающийся тем, что используют свежевыделенные живые клетки.
10. Способ по п.1, отличающийся тем, что используют живые клетки, представляющие собой по меньшей мере одну первичную культуру.
11. Способ по п.1, отличающийся тем, что используют живые клетки по меньшей мере одной клеточной линии.
12. Способ по п.1, отличающийся тем, что используют живые клетки, являющиеся опухолевыми клетками.
13. Способ по п.1, отличающийся тем, что используют живые клетки, являющиеся эндотелиальными клетками.
14. Способ по п.1, отличающийся тем, что используют живые клетки, представляющие собой генетически модифицированные клетки.
15. Способ по п.1, отличающийся тем, что в качестве протеазы используют трипсин.
16. Способ по п.1, отличающийся тем, что к антигенпрезентирующим клеткам добавляют иммуномодуляторы и цитокины.
17. Способ по п.1, отличающийся тем, что добавляют фармацевтический носитель.
18. Способ по п.1, отличающийся тем, что используют антигенпрезентирующие клетки, полученные искусственным путем.
19. Способ по п.1, отличающийся тем, что в качестве антигенпрезентирующих клеток используют дендритные клетки.
20. Способ по пп.1, 19, отличающийся тем, что используют дендритные клетки, полученные из периферической крови.
21. Способ по пп.1, 19, отличающийся тем, что используют дендритные клетки, полученные из костного мозга.
22. Способ по пп.1, 19, отличающийся тем, что используют аллогенные дендритные клетки.
23. Способ по пп.1, 19, отличающийся тем, что используют аутологичные дендритные клетки.
24. Способ по пп.1, 19, отличающийся тем, что используют смесь аутологичных и аллогенных дендритных клеток.
25. Способ по пп.1, 19, отличающийся тем, что нагрузку проводят антигенами, полученными однократным отщеплением протеазой с количества живых клеток вдвое-впятеро большего, чем количество нагружаемых антигенпрезентирующих клеток.
26. Способ по пп.1, 19, отличающийся тем, что нагрузку проводят антигенами, полученными 2-5-кратным отщеплением протеазой с количества живых клеток, равного количеству нагружаемых антигенпрезентирующих клеток.
27. Способ по п.1, отличающийся тем, что используют зрелые антигенпрезентирующие клетки.
28. Способ по пп.1, 27, отличающийся тем, что нагрузку антигенпрезентирующих клеток проводят антигенами с молекулярным весом от 800 до 3500 Да.
29. Способ по пп.1, 19, 27, отличающийся тем, что нагрузку проводят в процессе инкубации, время которой выбирают из интервала от 12 ч до 3 суток.
30. Способ по п.1, отличающийся тем, что используют незрелые антигенпрезентирующие клетки.
31. Способ по пп.1, 30, отличающийся тем, что нагрузку антигенпрезентирующих клеток проводят антигенами с молекулярным весом не менее 600 Да.
32. Способ по пп.1, 19, 30, отличающийся тем, что нагрузку проводят в процессе инкубации, время которой выбирают из интервала от 2 до 7 суток.
33. Способ по пп.1, 29 или 32, отличающийся тем, что конечную концентрацию антигенов для нагрузки антигенпрезентирующих клеток, добавляемых в инкубационную среду, выбирают из диапазона от 10 мкг/мл до 1 мг/мл.
Текст
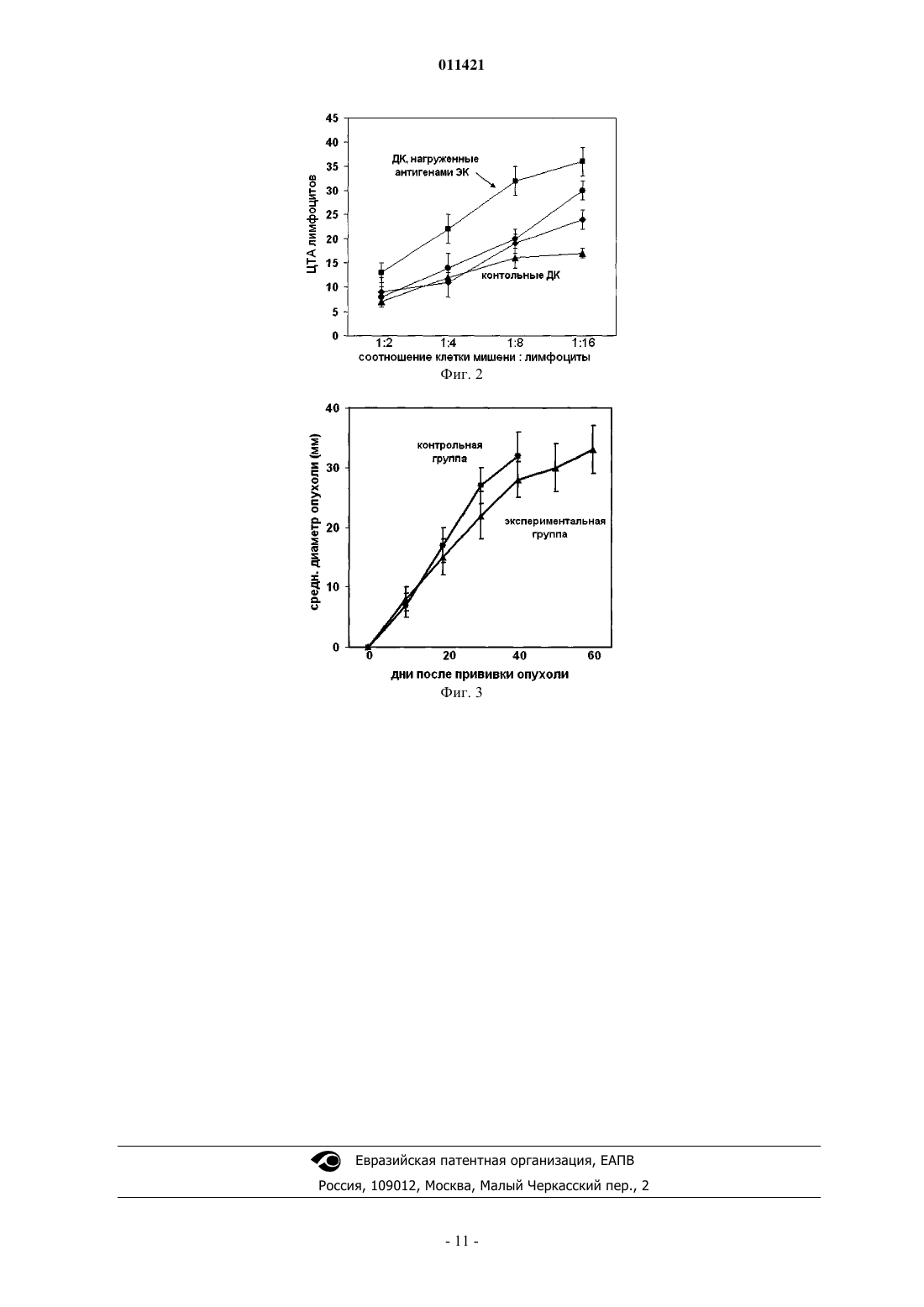
011421 Изобретение относится к биотехнологии, фармацевтике и медицине и может быть использовано для производства лекарств и осуществления медицинских технологий, в частности иммунотерапии онкологических заболеваний. Наряду с такими методами лечения опухолевых заболеваний, как оперативное лечение, химио- или лучевая терапии, в лечении онкологических больных также используют и иммунотерапию. Одним из наиболее перспективных вариантов иммунотерапии является противоопухолевая вакцинация, которая заключается в индукции у онкологического больного иммунного ответа против антигенов вакцины, которые в той или иной степени идентичны антигенам опухоли. Таким образом, вызванный вакциной иммунный ответ перекрестно повреждает опухолевые клетки (ОК), что и определяет лечебный или профилактический эффекты противоопухолевой вакцинации. Более подробно о противоопухолевых вакцинах можно прочитать в книге "Cancer Immune Therapy: Current and Future Strategies" (eds. Stuhle G. and Walden P., John WileySons, Inc, 2002). Основными факторами, определяющими эффективность вакцин, являются, во-первых, специфичность входящих в нее антигенов в отношении клеток опухоли пациента и, во-вторых, возможность вызвать к этим антигенам сильный и устойчивый иммунный ответ. Известны способы получения противоопухолевых вакцин, включающих антигены различной природы, имеющие свои преимущества и недостатки. Так, например, в качестве антигенов при получении используют синтезированные пептиды, в частности gp100(g209)-2M, MART-I27-35, MAGE-3.A1, NY-ESO-1, K-Ras/12 и т.д. (см. Rosenberg S.A. et al.M.K. et al. "Intradermal ras peptide vaccination with granulocyte-macrophage colony-stimulating factor as adjuvant: clinical and immunological responses in patients with pancreatic adenocarcinoma". Int J Cancer 2001,v. 92, p. 441-450). В других способах получения противоопухолевых вакцин в качестве антигенов используют белки,например, белки теплового шока или простат-специфический антиген (см., например, Manjili M.H. et al."Generation of Effector Cells After Vaccination With a PSA-Based Vaccine". Prostate 2000, v.43, p. 88-100). К основным преимуществам вакцин, полученных указанными способами с применением синтетических пептидов и определенных белков, можно отнести их низкую аллергенность, безопасность и относительную легкость в стандартизации производства. Основной недостаток известных способов получения вакцин - это невозможность получения вакцин, вызывающих иммунный ответ с высокой противоопухолевой эффективностью. Данное обстоятельство связано с тем, что ОК отличаются генетической нестабильностью и в организме больного постоянно мутируют, что приводит к появлению новых, имеющих измененный антигенный состав ОК. Таким образом, определенный антиген, к которому пептидный или белковый антиген вакцины вызывает иммунный ответ, может быть изменен или отсутствовать у всех или части ОК больного. Более того, для большинства видов опухолей не известны отдельные специфичные для них антигены, которые можно было бы использовать для противоопухолевой вакцинации. Известны также способы получения противоопухолевых вакцин, включающих специфические опухолевые антигены - так называемых цельноклеточных вакцин. В них в качестве антигенов применяют целые опухолевые клетки. Существует множество примеров применения целых ОК в качестве антигенов противоопухолевых вакцин, в частности, вакцин против колоректального рака, меланомы и карциномы почки (см. Armstrong А.С., Eaton D., Ewing J.C., "Cellular Immunotherapy for Cancer", Brit. Med. J., 2001,v.3323, p.1289-1293). Из патента США US 6039941 (МПК C12N15/09, A61K31/00, опубл. 21.03.2000) также известен способ получения цельноклеточной противоопухолевой вакцины, где в качестве антигенов используют целые ОК с введенными генно-инженерным способом генами, кодирующими поверхностные белки с иммуностимулирующей активностью. В других способах получения противоопухолевых вакцин, включающих специфические для опухоли антигены, в качестве антигенов используют неопухолевые клетки. Например, известно использование в качестве антигенов клеток эндотелия сосудов, вакцинация которыми вызывает иммунный ответ, направленный на повреждение сосудов солидных опухолей. Из литературных данных известен способ применения в качестве антигенов ксеногенных эндотелиальных клеток (ЭК), т.е. клеток, выделенных из эндотелия сосудов организма другого биологического вида, нежели вакцинируемый организм (см., например, Wei Y., "Immunotherapy of tumors with xenogeneic endothelial cells as a vaccine", Nature Medicine,2000, v.6, p.1160-1166). Недостатком подобных вакцин является то, что ксеногенные антигены хоть и более иммуногенны, но менее специфичны для сосудов опухоли вакцинируемого организма, что в итоге-1 011421 приводит к снижению эффективности вакцины. Из другого источника известно применение в цельноклеточной вакцине в качестве антигенов аллогенных ЭК, т.е. клеток другого организма, но того же биологического вида, что и вакцинируемый организм (см., например, Scappaticci F.A., Nolan G.P., "Induction of anti-tumor immunity in mice using a syngeneic endothelial cell vaccine", Anticancer Res., 2003, v.23, p.1165-1672; авторы научной работы также сравнивают эффективность вакцинации при использовании в качестве антигенов ЭК из различных источников). Недостатком аллогенных антигенов ЭК также является низкая их специфичность для сосудов опухоли вакцинируемого организма. Из статьи Okaji Y. и соавт. ("Vaccination with autologous endothelium inhibits angiogenesis and metastasis of colon cancer through autoimmunity", Cancer Sci., 2004, v.95, p.85-90) известно применение в качестве антигенов аутологичных ЭК, т.е. клеток, полученных из вакцинируемого или генетически идентичного (сингенного) организма. Подобные вакцины дают наиболее специфичный иммунный ответ, по сравнению с использованием ксеногенных или аллогенных ЭК. К очевидным преимуществам использования цельноклеточных противоопухолевых вакцин относят их поливалентность (т.е. содержание множества антигенов). Поливалентность вакцины позволяет вызывать иммунный ответ не к одному, а одновременно к множеству антигенов на поверхности ОК пациента,что существенно увеличивает вероятность уничтожения опухоли. Второе преимущество - это высокая специфичность антигенов, особенно в случае применения в качестве антигенов для вакцинации аутологичных ОК, т.е. ОК, выделенных из опухоли того же больного, которому проводят вакцинацию. К преимуществам использования целых ОК в качестве антигенов можно отнести возможность их использования в вакцинации больных с опухолями, для которых неизвестны отдельные опухолеспецифичные антигены и, соответственно, не созданы моновалентные вакцины. Основным недостатком всех цельноклеточных противоопухолевых вакцин является то, что вакцинация целыми клетками имеет низкую эффективность. Антигены при попадании в организм больного должны поглощаться антигенпрезентирующими клетками для дальнейшего их представления Тлимфоцитам. В случае использования в качестве антигенов целых клеток, поглощение их антигенпрезентирующими клетками затруднено. Второй существенный недостаток заключается в том, что целые клетки помимо целевых антигенов,которые представлены на их поверхности, содержат множество непригодных для вакцинации антигенов и балластных веществ, происходящих из внутриклеточного содержимого. Непригодность внутриклеточного содержимого для вакцинации объясняется тем, что внутриклеточные антигены скрыты внутри клеток и недоступны для иммунной системы организма. Таким образом, проблема поглощения ОК антигенпрезентирующими клетками и наличие в вакцине нецелевых антигенов и балластных веществ существенно ухудшают эффективность цельноклеточных вакцин. Частично проблемы цельноклеточных вакцин решаются применением в качестве антигенов не самих ОК, а их лизатов. Из международной заявки WO 02053176 (МПК А 61K39/00; C12N5/06; А 61K39/00;C12N5/06 опубл. 11.07.2002) известен способ получения противоопухолевой вакцины, включающей антигены, которые представляют собой лизат ОК, содержащий дезагрегированные антигены. Они легко поглощаются антигенпрезентирующими клетками, что в итоге приводит к более выраженному иммунному ответу при вакцинации. Недостатком использования лизатов ОК является то, что основную массу лизата также составляют нецелевые антигены, вызывающие иммунный ответ на скрытое от иммунной системы внутриклеточное содержимое ОК больного. Более того, подобные вакцины содержат множество балластных веществ, в частности, нуклеиновых кислот, углеводов, липидов и т.д. Из патента США US 5993829 (МПК А 61 Р 35/00, С 07 К 14/47, опубл. 30.11.1999) известен способ получения противоопухолевой вакцины, при котором антигены получают с поверхности клеток. ОК культивируют in vitro и получают антигены, теряемые ими в ростовую среду. Эти антигены, также описанные в патентах US 6338853 (МПК А 61 Р 35/00, С 07K14/47, опубл. 15.01.2002), US 5030621 (С 07K14/47,С 07K14/435, опубл. 09.07.1991), US 5635188 (С 07K14/47, С 07K14/435, опубл. 03.06.1997), представляют собой белки, спонтанно теряемые ОК в составе мембранных везикул, т.н. экзосом, в бессывороточную ростовую среду. Необходимо отметить, что вакцина, полученная указанным способом, отличается установленным высоким содержанием нецелевых антигенов, в частности внутриклеточных белков (см., например, "Proteomic analysis of melanoma-derived exosomes by two-dimensional polyacrylamide gel electrophoresis andmesothelioma cells". American Journal of Pathology 2004, v.164, p.1807-1815; "Exosomes: composition, biogenesis and function", Nature Reviews Immunology, 2002, v.2, p.569-579). Второй недостаток - это необходимость очистки антигенов перед их употреблением от липидов, являющихся составной частью экзосом. Общим недостатком антигенов, специфичных для опухолевых клеток или клеток сосудов опухоли,является их слабая иммуногенность. Это объясняется тем, что, в отличие от противомикробной, противовирусной или неспецифической противоопухолевой вакцинации, в которых используют чужеродные и,соответственно, иммуногенные для вакцинируемого организма антигены, в данном случае используют антигены идентичные антигенам клеток вакцинируемого организма. Как правило, нормально функцио-2 011421 нирующая иммунная система организма толерантна к собственным антигенам, в результате чего вызываемый иммунный ответ бывает слабым, кратковременным, либо вообще отсутствует. Таким образом,эффективность применения подобных опухолеспецифичных антигенов зависит от способности вызвать к ним надлежащий иммунный ответ. Известны различные способы повышения иммунного ответа на антигены, например, химическая модификация антигенов или смешивание их с адъювантами (маслами, минеральными солями, экстрактами бактерий, цитокинами и т.д.). Одним из наиболее эффективных способов добиться усиления иммунного ответа на антигены является использование антигенпрезентирующих клеток, т.е. тех клеток, с которыми обычно взаимодействуют введенные в организм антигены. В способах получения противоопухолевой вакцины на основе антигенпрезентирующих клеток, нагруженных антигенами, как правило, в качестве антигенпрезентирующих клеток используют дендритные клетки (ДК), которые способны поглощать антигены, деградировать их до маленьких фрагментов и представлять их на своей поверхности, ассоциированными с главным комплексом гистосовместимости. Клетки иммунной системы для проявления гуморального и клеточного иммунитета распознают главный комплекс гистосовместимости и ассоциированные с ним антигены. Обычно, зрелые ДК получают in vitro из CD34+ костно-мозговых предшественников или популяции моноцитов периферической крови. После получения ДК нагружают специфичными для опухоли антигенами. Пациенту вводят уже не сами антигены, а нагруженные ими ДК, т.е. применяют так называемую противоопухолевую дендритно-клеточную вакцину. Известны способы получения противоопухолевой вакцины на основе нагруженных антигенами антигенпрезентирующих клеток, при которых ДК нагружают синтезированными пептидами, опухолевыми клетками или их лизатами, живыми опухолевыми клетками (образованием гибридов ДК и опухолевых клеток) и т.д. Примеры применения ДК, нагруженных различными антигенами, описаны (см., например,Strome S.E. et al., "Strategies for Antigen Loading of Dendritic Cells to Enhance the Antitumor Immune Response", Cancer Res., 2002, v.62, p.1884-1889; Mortarini R. et al., "Autologous Dendritic Cells Derived fromLysates", Cancer Res., 2002, v.62, p.2347-2352). Недостатки применения ДК, нагруженных отдельными антигенами, целыми опухолевыми клетками или их лизатами, идентичны недостаткам, описанным выше для моновалентных и поливалентных вакцин, не содержащих ДК, а именно - низкая специфичность и наличие нецелевых антигенов. Недостатком гибридов ДК и опухолевых клеток вдобавок является возможность образования гибридных клонов со злокачественными свойствами. Наиболее близким аналогом заявленного изобретения является способ получения противоопухолевой вакцины на основе антигенпрезентирующих клеток, нагруженных антигенами, раскрытый в международной заявке WO2004012685 ("Shed antigen vaccine with dendritic cell adjuvant", МПК А 61K39/00,опубл. 12.02.2004 г.). В известном способе нагрузку антигенпрезентирующих клеток проводят антигенами, теряемыми ОК в процессе инкубации in vitro в бессывороточную инкубационную среду (способ получения самих антигенов также описан в патентах США US 5993829, МПК А 61 Р 35/00, С 07K14/47,опубл. 30.11.1999; US 6338853, МПК А 61 Р 35/00, С 07K14/47, опубл. 15.01.2002; US 5030621, С 07 К 14/47,С 07K14/435, опубл. 09.07.1991; US 5635188, С 07K14/47, С 07K14/435, опубл. 3.06.1997). Однако нагрузка ДК антигенами, спонтанно теряемыми опухолевыми клетками, имеет ряд установленных недостатков. Протеомный анализ (анализ белкового состава) выявил, что только незначительная часть теряемых клетками антигенов относится к поверхностным белкам, основная же часть относится к внутриклеточному содержимому (см., например, "Proteomic analysis of melanoma-derived exosomes bytwo-dimensional polyacrylamide gel electrophoresis and mass spectrometry", Proteomics 2004, v.4, p.40194031; "Proteomic Analysis of Exosomes Secreted by Human Mesothelioma Cells", American Journal of Pathology 2004, v.164, p.1807-1815; "Exosomes: composition, biogenesis and function", Nature Reviews Immunology, 2002, v.2, p.569-579). Таким образом, культивируемые in vitro клетки в основном теряют непригодные для вакцинации антигены. Теряемые клетками антигены представляют собой смесь белков, представление которых на поверхности антигенпрезентирующих клеток, в частности зрелых ДК, затруднено. Белковые антигены должны поглощаться ДК, деградироваться до пептидов и только потом представляться на поверхности ДК. Зрелые же ДК неспособны к поглощению антигенов. К недостаткам ближайшего аналога также можно отнести то, что клетки спонтанно теряют свои антигены в виде мембранных везикул - экзосом, содержащих,-3 011421 помимо белков, множество липидов. Поэтому выделение из них антигенов требует дополнительной стадии очистки - делипидизации. Также требуется очистка антигенов от компонентов инкубационной среды, в которую ОК теряют свои антигены и которая содержит около 40 компонентов (витамины, аминокислоты, соли, углеводы и т.д.), а также от стороннего белкового загрязнения, источником которого могут служить ростовые среды клеток, потенциально содержащие токсины, прионы и пирогенные белковые примеси. Технический результат, достигаемый при использовании изобретения, заключается в создании вакцины, способной повысить цитотоксическую активность (ЦТА) клеток иммунной системы в отношении клеток-мишеней за счет облегчения восприятия ими заданной совокупности антигенов. Данный технический результат обеспечивается при использовании способа получения противоопухолевой вакцины на основе антигенпрезентирующих клеток, нагруженных антигенами, согласно настоящему изобретению, нагрузку антигенпрезентирующих клеток проводят антигенами, полученными отщеплением протеазой с поверхности живых клеток с обеспечением представления на поверхности антигенпрезентирующих клеток совокупности антигенов, идентичной совокупности поверхностных антигенов клеток-мишеней. В предпочтительном варианте реализации изобретения используют аутологичные живые клетки,так как обеспечивают получение совокупности как специфичных внутривидовых, так и индивидуальных для вакцинируемого организма антигенов. В других вариантах реализации изобретения используют аллогенные живые клетки в случае необходимости получения совокупности общих для биологического вида внутривидовых антигенов. Также могут быть использованы ксеногенные живые клетки в случае необходимости получения совокупности общих для различных видов организмов межвидовых антигенов. В других вариантах реализации изобретения используют аллогенные и аутологичные живые клетки в комбинации. Кроме этого могут быть использованы ксеногенные и аллогенные живые клетки в комбинации. В других вариантах реализации изобретения могут быть использованы ксеногенные и аутологичные живые клетки в комбинации. В других вариантах реализации изобретения могут быть использованы ксеногенные, аллогенные и аутологичные живые клетки в комбинации. Комбинации различных типов живых клеток применяют для увеличения совокупности специфичных антигенов. В предпочтительном варианте реализации изобретения используют свежевыделенные живые клетки. Свежевыделенные клетки наиболее близки по антигенному составу к клеткам организма больного. Получение живых клеток без повреждения поверхностных антигенов, например при их получении из биологических жидкостей или неэнзиматическом способе получения из тканей (при энзиматическом способе получения клеток из тканей происходит повреждение поверхностных антигенов клеток) позволяет применять свежевыделенные клетки для получения антигенов согласно данному изобретению. В случае отсутствия достаточного количества свежевыделенных клеток для получения необходимого для нагрузки количества антигенов в других вариантах реализации изобретения могут быть использованы живые клетки, представляющие собой по меньшей мере одну первичную культуру. Также могут быть использованы живые клетки по меньшей мере одной клеточной линии. Антигены, расположенные на поверхности упомянутых клеток, также пригодны для нагрузки антигенпрезентирующих клеток. В целях создания вакцины для цитотоксического повреждения опухолевых клеток используют живые клетки, являющиеся опухолевыми клетками. В целях создания вакцины для цитотоксического повреждения клеток сосудов опухоли используют живые клетки, являющиеся эндотелиальными клетками. В других вариантах реализации изобретения для получения совокупности антигенов могут быть использованы живые клетки, представляющие собой генетически модифицированные клетки. Генетическая модификация, повышающая иммуногенность поверхностных антигенов клеток, способствует получению антигенов согласно данному изобретению с более выраженными иммуногенными свойствами. В предпочтительном варианте реализации изобретения в качестве протеазы используют трипсин. В среднем на каждые 10 аминокислот последовательности белка встречается одно место, расщепляемое трипсином. Исходя из того, что средняя масса аминокислоты составляет 110 Да и того, что неполный протеолиз белков протеазой дает пептиды как с отсутствием, так и с наличием одного или двух недорасщепленных мест, при применении трипсина получаемые антигены предположительно будет соответствовать требуемым молекулярным весам. Однако специфичность аминокислотных последовательностей пептидов и наличие углеводных модификаций влияет на средний размер получаемых антигенов, в связи с чем при подборе конкретных условий получения антигенов необходимо экспериментально контролировать размер получаемых антигенов. Наиболее простым и быстрым способом контроля размера получаемых антигенов является массспектрометрический анализ. К антигенпрезентирующим клеткам могут добавлять иммуномодуляторы и цитокины. Любые под-4 011421 ходящие комбинации цитокинов, иммуномодуляторов и неспецифических антигенов могут применяться для дифференцировки мононуклеарных лейкоцитов в незрелые ДК, а также для созревания незрелых ДК. Для создания условий, в которых антигенпрезентирующие клетки способны представлять антигены клеткам иммунной системы, могут добавлять фармацевтический носитель, который может включать одно или несколько веществ. Носитель может способствовать сохранности антигенпрезентирующих клеток при хранении, транспортировке и их введении в организм, питать клетки, обеспечивать газообмен, стабилизировать клеточные мембраны, обеспечивать локальные или системные иммунологические реакции,усиливающие действие антигенпрезентирующих клеток. В других вариантах реализации изобретения могут быть использованы антигенпрезентирующие клетки, полученные искусственным путем, так как искусственные антигенпрезентирующие клетки обладают надлежащими антигенпрезентирующими свойствами и могут быть нагружены антигенами. В предпочтительном варианте реализации изобретения в качестве антигенпрезентирующих клеток используют дендритные клетки. Могут быть использованы дендритные клетки, полученные из периферической крови. В других вариантах реализации изобретения могут быть использованы дендритные клетки, полученные из костного мозга, так как костно-мозговые ДК являются полноценными антигенпрезентирующими клетками и могут быть нагружены антигенами in vitro. В предпочтительном варианте реализации изобретения используют аутологичные дендритные клетки. В других вариантах реализации изобретения могут быть использованы аллогенные дендритные клетки, так как они способны осуществлять антигенпрезентирующую функцию в отношении аллогенных для них клеток иммунной системы. В других вариантах реализации изобретения могут использовать смесь аутологичных и аллогенных дендритных клеток. Применение смеси клеток предпочтительно при недостаточном для вакцинации количестве аутологичных дендритных клеток и возможно ввиду способности аллогенных ДК осуществлять антигенпрезентирующую функцию в отношении аллогенных для них клеток иммунной системы. В предпочтительном варианте используют зрелые антигенпрезентирующие клетки. Зрелые антигенпрезентирующие клетки могут быть получены непосредственно из тканей организма, либо получены in vitro из незрелых антигенпрезентирующих клеток. В других вариантах реализации изобретения могут быть использованы также незрелые антигенпрезентирующие клетки. Незрелые антигенпрезентирующие клетки, в частности ДК, нагружают антигенами путем их инкубации в среде, содержащей антигены. В процессе инкубации незрелые ДК поглощают антигены, деградируют их и представляют на своей поверхности. Зрелые антигенпрезентирующие клетки, в частности ДК, могут нагружать антигенами в процессе инкубации с ними путем непосредственного связывания антигенов (без предварительного их поглощения ДК) с главным комплексом гистосовместимости, расположенным на поверхности ДК. В другом варианте зрелые антигенпрезентирующие клетки получают из уже нагруженных антигенами незрелых антигенпрезентирующих клеток. В случае получения антигенов для нагрузки антигенпрезентирующих клеток, не способных поглощать антигены, например зрелых ДК, тип протеазы, ее концентрация, а также время воздействия на клетки подбирают с учетом того, что получаемые антигены должны быть с молекулярным весом от 800 до 3500 Да. Данное обстоятельство связано с тем, что именно такие пептиды способны связываться непосредственно с главным комплексом гистосовместимости, расположенным на поверхности антигенпрезентирующих клеток. Для получения антигенов нужного молекулярного веса (размера) отщепленные от поверхности клеток антигены могут дополнительно, отдельно от клеток, инкубировать с протеазой для расщепления антигенов до необходимого молекулярного веса. Достижения антигенами нужного молекулярного веса можно контролировать масс-спектрометрическим анализом. В случае получения антигенов для нагрузки антигенпрезентирующих клеток, способных их поглощать, например незрелых ДК, в предпочтительном варианте молекулярный вес антигенов должен быть не менее 600 Да. Антигены, представляющие собой пептиды меньшего молекулярного веса слабо- или неспецифичны, в связи с чем непригодны для вакцинации. Строгих ограничений на максимальный молекулярный вес антигенов нет, так как антигены после поглощения их антигенпрезентирующими клетками будут деградированы внутриклеточными протеазами до нужного размера. Время инкубации ДК с антигенами также может существенно варьировать. При нагрузке незрелых ДК время инкубации ДК с антигенами может составлять от 2 до 7 суток. При нагрузке зрелых ДК от 12 ч до 3 суток. В предпочтительном варианте реализации изобретения нагрузку дендритных клеток проводят антигенами с молекулярным весом от 800 до 3500 Да. При этом нагрузку проводят в процессе инкубации, время которой выбирают из интервала от 12 ч до 3 суток.-5 011421 В случае использования незрелых антигенпрезентирующих клеток их нагрузку могут проводить антигенами с молекулярным весом не менее 600 Да в процессе инкубации, время которой выбирают из интервала от 2 до 7 суток. В предпочтительном варианте реализации изобретения конечную концентрацию антигенов для нагрузки антигенпрезентирующих клеток, добавляемых в инкубационную среду, выбирают из диапазона от 10 мкг/мл до 1 мг/мл. Если конечная концентрация антигенов будет менее 10 мкг/мл, совокупность антигенов не будет представлена на поверхности антигенпрезентирующих клеток в количестве, необходимом для проявления специфической цитотоксической активности (ЦТА) клеток иммунной системы. При добавлении антигенов с конечной концентрацией, превышающей 1 мг/мл, количество антигенов становится большим, чем предельное их количество, которое могут воспринять антигенпрезентирующие клетки для представления на своей поверхности. Повышение цитотоксической активности (ЦТА) клеток иммунной системы достигается также в случаях, когда для нагрузки ДК используют антигены, полученные однократным отщеплением протеазой с количества живых клеток вдвое-впятеро большего, чем количество нагружаемых дендритных клеток; двухкратным-пятикратным отщеплением протеазой с количества живых клеток, равного количеству нагружаемых антигенпрезентирующих клеток. При дальнейшем увеличении числа обработок протеазой количество живых клеток уменьшают в соответствии с указанной пропорцией. Число обработок протеазой может достигать 15-20 раз. Экспериментально было установлено, что указанные соотношения живых клеток и дендритных клеток во взаимосвязи с числом обработок протеазой являются оптимальными для представления на поверхности дендритных клеток заданной совокупности антигенов и облегчения восприятия их клетками иммунной системы. Таким образом, в одном варианте реализации изобретения нагрузку могут проводить антигенами,полученными однократным отщеплением протеазой с количества живых клеток вдвое-впятеро большего,чем количество нагружаемых антигенпрезентирующих клеток. В другом варианте реализации изобретения нагрузку могут проводить антигенами, полученными двухкратным-пятикратным отщеплением протеазой с количества живых клеток, равного количеству нагружаемых антигенпрезентирующих клеток. Далее изобретение поясняется конкретными примерами реализации и прилагаемыми фигурами, на которых изображено следующее: на фиг. 1 - результаты исследования цитотоксической активности лимфоцитов в отношении опухолевых клеток MCF-7; на фиг. 2 - результаты исследования цитотоксической активности лимфоцитов в отношении ЭК; на фиг. 3 - график роста опухоли гепатомы Н 22, привитой мышам BALB/c, в экспериментальной и контрольной группах. Показаны средние значения диаметра опухоли в группе +/- стандартное отклонение. Пример 1. Ниже приведен пример реализации способа получения противоопухолевой вакцины на основе дендритных клеток, нагруженных антигенами. В данном примере нагрузку дендритных клеток проводят антигенами, полученными отщеплением трипсином с поверхности живых опухолевых клеток с представлением на поверхности дендритных клеток совокупности антигенов, идентичной совокупности поверхностных антигенов опухолевых клеток-мишеней. Для нагрузки дендритных клеток получают раствор антигенов, специфичных для опухолевых клеток-мишеней, используя культуру клеток человеческой аденокарциномы груди MCF-7. 1. Из флакона с культурой клеток MCF-7 удаляют ростовую среду и промывают монослой клеток стерильным физиологическим раствором. Промывку осуществляют не менее 3 раз до удаления остатков ростовой среды. Следующим и ключевым этапом является витальная для клеток обработка протеазой клеток MCF-7,где в качестве протеазы выбирают трипсин (активность 3000 Ед/мг). 2. Добавляют к монослою клеток 0,0001% раствор трипсина, используя 1 мл раствора на 25 см 2 поверхности культурального флакона. 3. Инкубируют флакон при 37 С. Между пятой и седьмой минутами инкубации отбирают из флакона раствор трипсина, содержащий отщепленные от клеток поверхностные антигены. 4. К клеткам добавляют свежеприготовленную ростовую среду, содержащую сыворотку (обычно 10%), и продолжают их культивирование. 5. Для наработки массы антигенов, с интервалом в сутки от 2-х до 15-ти раз повторяют пп.2-4. 6. Чтобы убрать следы трипсина и других белков, раствор антигенов фильтруют через фильтр с отсечением по белку 10-15 кДа. 7. Получают раствор антигенов, являющихся протеолитическими фрагментами поверхностных белков клеток, т.е. пептидами, которые, ввиду выраженной гликозилированности поверхностных белков-6 011421 клеток, также могут характеризоваться той или иной степенью гликозилирования. Являясь пептидами, патентуемые антигены пригодны для нагрузки антигенпрезентирующих клеток, в частности зрелых ДК, которые получают in vitro из очищенной фракции мононуклеарных лейкоцитов (моноцитов) периферической крови (Cancer Research, 2001, v.61, p.6445-6450). Кровь донора собирают в пробирки с антикоагулянтом (гепарин или цитрат натрия), разбавляют равным объемом стерильного физиологического раствора и наслаивают на раствор фиколл-пак, имеющий плотность 1,077 г/мл(2 объема разведенной крови на один объем раствора фиколла). Центрифугируют 20 мин при 800g и комнатной температуре. Собирают пипеткой фракцию клеток на границе раздела раствора фиколла и плазмы крови, разводят клетки физиологическим раствором и центрифугируют 10 мин при 250 g. Осадок ресуспендируют в среде RPMI-1640, содержащей 10% инактивированной сыворотки крупного рогатого скота и, в концентрации 50 млн кл/мл, по 10 мл вносят в чашки Петри. Чашки Петри инкубируют в условиях насыщающей влажности, 5% СО 2 и 37 С в течение 1 ч. Неприкрепившиеся клетки (в основном лимфоциты) отбирают, центрифугируют, замораживают и хранят в жидком азоте. К монослою прикрепившихся клеток (в основном моноцитов) добавляют по 10 мл свежей среды и инкубируют в стандартных условиях. На следующий день и через три дня (на четвертый день) в инкубационную среду добавляют ГМ-КСФ (гранулоцитарно-макрофагальный колониестимулирующий фактор, 800 ед./мл) и ИЛ-4(интерлейкин-4, 1000 ед./мл). Добавление данной композиции цитокинов необходимо для дифференцировки мононуклеарных лейкоцитов в незрелые ДК. На 6-й день к ДК, для созревания и нагрузки их антигенами, добавляют культуральную среду (RPMI-1640, 10% инактивированной сыворотки крупного рогатого скота), содержащую ФНО- (фактор некроза опухолей-, 10 нг/мл) и антигены, полученные отщеплением трипсином с поверхности живых опухолевых клеток, как было описано выше (конечная концентрация антигенов 100 мкг/мл), и инкубируют 2 суток при 5% СО 2 и 37 С. На 8-й день зрелые ДК собирают в отдельную емкость и используют в качестве противоопухолевой дендритоклеточной вакцины, а также проверяют их способность специфически стимулировать цитотоксические лимфоциты in vitro. Пример 2. В данном поясняющем, но не ограничивающем изобретение примере нагрузку дендритных клеток проводят антигенами, полученными отщеплением трипсином с поверхности живых эндотелиальных клеток с последующим представлением на поверхности дендритных клеток совокупности антигенов, идентичной совокупности поверхностных антигенов эндотелиальных клеток-мишеней. В качестве живых эндотелиальных клеток используют первичную культуру мышиных микроциркуляторных дермальных ЭК (ЗАО "БиоБогемия", Россия). 1. Из чашки Петри с ЭК удаляют ростовую среду и промывают чашку 3-5 раз раствором Хенкса (из расчета 2 мл на 5 см 2 поверхности чашки Петри) для удаления следов сыворотки, содержащейся в ростовой среде. После каждого добавления раствора Хенкса клетки выдерживают в нем 2 мин, после чего его удаляют. 2. Добавляют к клеткам охлажденный (+42 С) 0,0001% раствор трипсина (активность 3000 Ед/мг), приготовленный на растворе Хенкса из расчета 1 мл раствора на 5 см 2 поверхности чашки Петри и через 10-15 с его удаляют. 3. Сразу после удаления раствора трипсина чашку Петри накрывают крышкой и помещают в инкубатор на 10 мин при 37 С, 5% СО 2. Следят, чтобы в инкубаторе была не менее чем 95%-ая влажность,чтобы избежать высыхания и гибели клеток. 4. Достают из инкубатора чашку Петри и струей физиологического раствора (из расчета 250 мкл на 5 см 2 поверхности чашки Петри) смывают со дна чашки Петри клетки, с отщепленными с их поверхности фрагментами белков. 5. Отбирают физиологический раствор с открепленными от дна флакона клетками, центрифугируют 5 мин при 200g. 6. Осевшие при центрифугировании клетки ресуспендируют в свежеприготовленной ростовой среде и переносят в чашку Петри для дальнейшего культивирования и повторного использования для получения антигенов. 7. Супернатант, полученный при центрифугировании, отбирают и фильтруют через фильтр с отсечением по белку 10-15 кДа, чтобы убрать следы трипсина и других белков. 8. Полученный фильтрат, представляющий собой раствор поверхностных антигенов ЭК, используют для нагрузки зрелых ДК, полученных из крови здоровых мышей той же породы, аналогично тому, как это было описано в примере 1. Далее проводят проверку функциональной активности ДК, нагруженных антигенами. Функциональную активность ДК, нагруженных поверхностными антигенами опухолевых или ЭК,проверяют их способностью индуцировать in vitro цитотоксическую активность (ЦТА) лимфоцитов в отношении клеток-мишеней, а именно, опухолевых клеток MCF-7 и мышиных дермальных ЭК. Лимфоциты, выделенные из периферической крови человека, как было описано выше, суспендировали в культуральной среде. Для стимуляции лимфоцитов ДК отмывали фосфатно-солевым буфером и помещали в 24-луночные планшеты вместе с лимфоцитами при соотношении 1:20 (ДК:лимфоциты), в 1 мл культу-7 011421 ральной среды, содержащей 10% инактивированной эмбриональной сыворотки крупного рогатого скота. На следующий день после начала стимуляции и далее 1 раз в 3 дня к культуре добавляли по 30 ед./мл человеческого рекомбинантного ИЛ-2. Через 7 дней проводили вторичную стимуляцию культуры лимфоцитов с использованием ДК в том же количестве, как и при первой стимуляции. Через 5 дней после вторичной стимуляции проводили определение цитотоксической активности лимфоцитов в отношении опухолевых и эндотелиальных клеток. Для этого 1 млн опухолевых клеток или ЭК метили натрия хроматом с 51-ым хромом (3,7 МБк) в течение 1 ч при 37 С и отмывали 4 раза. В лунки 96-ти луночного планшета вносили суспензию стимулированных лимфоцитов в количестве 10-80 тыс. клеток на лунку, а затем добавляли меченые клетки-мишени (5 тыс. клеток на лунку). Через 18 ч отбирали из лунок по 100 мкл супернатанта и измеряли радиоактивность на гамма-счетчике. Результаты измерений использовали для определения специфического лизиса клеток-мишеней и рассчитывали ЦТА стимулированных лимфоцитов по формуле в которой Рмишень - радиоактивность проб, где инкубировали клетки-мишени; Рмишень+лимфоциты - радиоактивность проб, где инкубировали клетки-мишени вместе со стимулированными лимфоцитами. Для получения контрольных измерений также получали экзосомы клеток MCF-7. При этом использовали количество клеток MCF-7, эквивалентное количеству клеток в эксперименте. Экзосомы получали ультрацентрифугированием культуральной среды согласно способу, описанному в заявкеWO 2004012685 ("Shed antigen vaccine with dendritic cell adjuvant", МПК А 61K39/00, опубл. 12.02.2004 г.). Результаты исследования цитотоксической активности стимулированных лимфоцитов в отношении опухолевых клеток приведены на фиг. 1. В эксперименте лимфоциты стимулировали ДК-ми, нагруженными поверхностными антигенами,полученными отщеплением трипсином с поверхности живых опухолевых клеток MCF-7. В контроле или ДК, нагруженные экзосомами клеток использовали интактные (не нагруженные антигенами) ДКMCF-7 или поверхностными антигенами ЭК. Показаны средние значения +/- стандартное отклонение. Как видно из фиг. 1, цитотоксические лимфоциты, полученные после совместного культивирования с дендритными клетками, нагруженными антигенами, полученными отщеплением трипсином с поверхности живых опухолевых клеток MCF-7, обладали более высокой цитотоксической активностью против опухолевых клеток по сравнению с контрольными лимфоцитами, стимулированными интактными дендритными клетками или дендритными клетками, нагруженными иными антигенами, включая антигены,полученные согласно ближайшему прототипу изобретения. Результаты исследования цитотоксической активности стимулированных лимфоцитов в отношении ЭК приведены на фиг. 2. В эксперименте лимфоциты стимулировали ДК-ми, нагруженными антигенами, полученными отщеплением трипсином с поверхности живых эндотелиальных клеток. В контроле использовали интактные или ДК, нагруженные лизатом ЭК или поверхностными антигенами клеток MCF-7. ПоказаДК ны средние значения +/- стандартное отклонение. Лизат ЭК получали путем трехкратного резкого замораживания клеток в жидком азоте и последующего размораживания при 37 С в водяной бане. Как видно из фиг. 2, цитотоксические лимфоциты после совместного культивирования с ДК, нагруженными поверхностными антигенами ЭК, обладали более высокой цитотоксической активностью в отношении ЭК (клеток-мишеней) по сравнению с контрольными лимфоцитами, стимулированными интактными дендритными клетками или дендритными клетками, нагруженными иными поверхностными антигенами или лизатом ЭК. При нагрузке антигенпрезентирующих клеток антигенами, полученными отщеплением протеазой с поверхности живых клеток, обеспечивается представление на поверхности антигенпрезентирующих клеток ассоциированной с главным комплексом гистосовместимости совокупности антигенов, идентичной совокупности поверхностных антигенов клеток-мишеней. Т-лимфоциты распознают главный комплекс гистосовместимости и ассоциированные с ним антигены. В результате цитотоксическая активность(ЦТА) лимфоцитов проявляется не только в отношении указанных антигенов, но и в отношении клетокмишеней. Для подтверждения противоопухолевой активности вакцины, полученной патентуемым способом,был поставлен модельный эксперимент на млекопитающих, а именно 12-ти самцах мышей породыBALB/c примерно одного возраста и веса. Для получения вакцины использовали способ согласно второму примеру реализации изобретения. Антигены были получены с культуры мышиных микроциркуляторных дермальных ЭК (ЗАО "БиоБогемия", Россия). За день до получения антигенов ЭК активировали добавлением кондиционированной ростовой среды клеток Н 22 в ростовую среду ЭК в соотношении 1:3. ДК получали из крови здоровых мышей той же породы и нагружали антигенами согласно примеру 2. 0,1 мл раствора нагруженных антигенами ДК (примерно 100 тыс. ДК) вводили в хвостовую вену два раза с перерывом в 3 дня. Животным контрольной группы вводили раствор не нагруженных антиге-8 011421 нами ДК. Через 3 дня после последней иммунизации подопытным мышам была привита опухоль подкожным введением в подмышечную впадину 1 млн опухолевых клеток гепатомы Н 22. Производили запись размеров опухоли и дня смерти мышей. Средняя продолжительность жизни животных, иммунизированных вакциной, полученной патентуемым способом, увеличилась на 52%. Результаты измерений размеров опухолей представлены на фиг. 3, из которой следует замедление роста опухолей у животных из экспериментальной группы, что указывает на выраженный противоопухолевый эффект вакцины, полученной патентуемым способом. Таким образом, показана возможность применения патентуемого способа для получения противоопухолевой вакцины, содержащей антигенпрезентирующие клетки, а именно ДК, способной стимулировать цитотоксическую активность лимфоцитов, с целью селективного повреждения клеток-мишеней какin vitro, так и in vivo. Применение протеазы для отщепления антигенов дает возможность получать антигены, являющиеся пептидами, с таким молекулярным весом, который обуславливает их способность быть представленными на поверхности антигенпрезентирующих клеток в форме, пригодной для полноценного восприятия клетками иммунной системы, о чем свидетельствует повышение ЦТА лимфоцитов. Нагрузка антигенпрезентирующих клеток антигенами, полученными отщеплением протеазой с поверхности живых клеток, позволяет получать путем однократного или многократного отщепления заданную совокупность антигенов, специфичных для клеток-мишеней, в количестве, оптимальном для представления указанной совокупности клеткам иммунной системы. Кроме этого, применяемая мягкая (витальная для клеток) обработка клеток протеазой позволяет получать антигены с живых клеток, т.е. с клеток с сохраненной барьерной функцией цитоплазматической мембраны ("стенки" клетки). Данное обстоятельство позволяет воздействовать протеазой только на поверхность клеток и, соответственно, отщеплять только поверхностные антигены. Сохранность цитоплазматической мембраны также предотвращает выход из клетки внутриклеточного содержимого, способного загрязнить получаемые антигены нецелевыми внутриклеточными антигенами и другими балластными веществами (белками, липидами, нуклеиновыми кислотами и т.д.), что дает возможность представлять клеткам иммунной системы только антигены, являющиеся специфичными для клеток-мишеней, исключив присутствие на поверхности антигенпрезентирующих клеток других антигенов, не являющихся специфичными. Таким образом, при нагрузке антигенпрезентирующих клеток антигенами, полученными отщеплением протеазой с поверхности живых клеток (с сохраненной барьерной функцией цитоплазматической мембраны), с обеспечением представления на поверхности антигенпрезентирующих клеток ассоциированной с главным комплексом гистосовместимости совокупности антигенов, идентичной совокупности поверхностных антигенов клеток-мишеней, облегчается последующее полноценное представление клеткам иммунной системы, в частности Т-лимфоцитам, исключительно антигенов, являющихся специфичными для клеток-мишеней, что обеспечивает повышение цитотоксической активности (ЦТА) лимфоцитов в отношении клеток-мишеней. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения противоопухолевой вакцины на основе антигенпрезентирующих клеток, нагруженных антигенами, отличающийся тем, что нагрузку антигенпрезентирующих клеток проводят антигенами, полученными отщеплением протеазой с поверхности живых клеток с обеспечением представления на поверхности антигенпрезентирующих клеток совокупности антигенов, идентичной совокупности поверхностных антигенов клеток-мишеней. 2. Способ по п.1, отличающийся тем, что используют аутологичные живые клетки. 3. Способ по п.1, отличающийся тем, что используют аллогенные живые клетки. 4. Способ по п.1, отличающийся тем, что используют ксеногенные живые клетки. 5. Способ по п.1, отличающийся тем, что используют аллогенные и аутологичные живые клетки в комбинации. 6. Способ по п.1, отличающийся тем, что используют ксеногенные и аллогенные живые клетки в комбинации. 7. Способ по п.1, отличающийся тем, что используют ксеногенные и аутологичные живые клетки в комбинации. 8. Способ по п.1, отличающийся тем, что используют ксеногенные, аллогенные и аутологичные живые клетки в комбинации. 9. Способ по п.1, отличающийся тем, что используют свежевыделенные живые клетки. 10. Способ по п.1, отличающийся тем, что используют живые клетки, представляющие собой по меньшей мере одну первичную культуру. 11. Способ по п.1, отличающийся тем, что используют живые клетки по меньшей мере одной клеточной линии.-9 011421 12. Способ по п.1, отличающийся тем, что используют живые клетки, являющиеся опухолевыми клетками. 13. Способ по п.1, отличающийся тем, что используют живые клетки, являющиеся эндотелиальными клетками. 14. Способ по п.1, отличающийся тем, что используют живые клетки, представляющие собой генетически модифицированные клетки. 15. Способ по п.1, отличающийся тем, что в качестве протеазы используют трипсин. 16. Способ по п.1, отличающийся тем, что к антигенпрезентирующим клеткам добавляют иммуномодуляторы и цитокины. 17. Способ по п.1, отличающийся тем, что добавляют фармацевтический носитель. 18. Способ по п.1, отличающийся тем, что используют антигенпрезентирующие клетки, полученные искусственным путем. 19. Способ по п.1, отличающийся тем, что в качестве антигенпрезентирующих клеток используют дендритные клетки. 20. Способ по пп.1, 19, отличающийся тем, что используют дендритные клетки, полученные из периферической крови. 21. Способ по пп.1, 19, отличающийся тем, что используют дендритные клетки, полученные из костного мозга. 22. Способ по пп.1, 19, отличающийся тем, что используют аллогенные дендритные клетки. 23. Способ по пп.1, 19, отличающийся тем, что используют аутологичные дендритные клетки. 24. Способ по пп.1, 19, отличающийся тем, что используют смесь аутологичных и аллогенных дендритных клеток. 25. Способ по пп.1, 19, отличающийся тем, что нагрузку проводят антигенами, полученными однократным отщеплением протеазой с количества живых клеток вдвое-впятеро большего, чем количество нагружаемых антигенпрезентирующих клеток. 26. Способ по пп.1, 19, отличающийся тем, что нагрузку проводят антигенами, полученными 2-5 кратным отщеплением протеазой с количества живых клеток, равного количеству нагружаемых антигенпрезентирующих клеток. 27. Способ по п.1, отличающийся тем, что используют зрелые антигенпрезентирующие клетки. 28. Способ по пп.1, 27, отличающийся тем, что нагрузку антигенпрезентирующих клеток проводят антигенами с молекулярным весом от 800 до 3500 Да. 29. Способ по пп.1, 19, 27, отличающийся тем, что нагрузку проводят в процессе инкубации, время которой выбирают из интервала от 12 ч до 3 суток. 30. Способ по п.1, отличающийся тем, что используют незрелые антигенпрезентирующие клетки. 31. Способ по пп.1, 30, отличающийся тем, что нагрузку антигенпрезентирующих клеток проводят антигенами с молекулярным весом не менее 600 Да. 32. Способ по пп.1, 19, 30, отличающийся тем, что нагрузку проводят в процессе инкубации, время которой выбирают из интервала от 2 до 7 суток. 33. Способ по пп.1, 29 или 32, отличающийся тем, что конечную концентрацию антигенов для нагрузки антигенпрезентирующих клеток, добавляемых в инкубационную среду, выбирают из диапазона от 10 мкг/мл до 1 мг/мл.
МПК / Метки
МПК: C12N 5/08, A61P 35/00, A61K 39/00, C12N 5/22
Метки: вакцины, способ, противоопухолевой, получения
Код ссылки
<a href="https://eas.patents.su/12-11421-sposob-polucheniya-protivoopuholevojj-vakciny.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения противоопухолевой вакцины</a>
Предыдущий патент: Профилактика вич-инфекции
Следующий патент: Способ получения шоколада путем добавления в шоколадную массу диглицеридного эфира карбоновой кислоты и шоколад, полученный указанным способом
Случайный патент: Композиция водного радиопротекторного фармацевтического раствора и способ предотвращения, снижения или исключения эффектов ионизирующей радиации